Область изобретения
Данное изобретение относится к лиофилизированной протеиновой композиции. В частности, оно относится к стабильной лиофилизированной протеиновой композиции, которая может разбавляться с помощью растворителя, образуя стабильную действующую композицию, пригодную для подкожного введения.
Обзор общеизвестных технических решений
За истекшие десять лет успехи в биотехнологии сделали возможным продуцировать целый ряд протеинов для фармацевтических применений, используя генную инженерию. Поскольку протеины являются более крупными и более сложными, чем традиционные органические и неорганические лекарственные препараты (т.е. имеют многочисленные функциональные группы в дополнение к сложным трехмерным структурам), композиции таких протеинов создают особые проблемы. Чтобы протеин оставался биологически активным, композиция должна сохранять исходную конформационную целостность, по крайней мере, центральной (основной) аминокислотной последовательности протеина и в то же самое время защищать многочисленные функциональные группы белка от разрушения. Пути разрушения (деградации) белков могут включать химическую нестабильность (т.е. любой процесс, который предусматривает модификацию протеина путем образования или расщепления связи, приводящей к новой химической сущности) или физическую неустойчивость (т.е. изменения в структуре белка более высокого порядка). Химическая нестабильность может являться результатом деамидирования, рацемизации, гидропиза, окисления, β-элиминирования или дисульфидного обмена. Физическая нестабильность может являться результатом денатурации, агрегации, осаждения или, например, адсорбции. Тремя наиболее общими направлениями (путями) деградации являются агрегация, деамидирование и окисление протеина (Cleland et al. Critical Reviews in Therapeutic Drug Carrier Systems 10 (4): 307-377 (1993)).
Сушка вымораживанием является обычно применяемым способом для сохранения протеинов, который способствует удалению воды из представляющего интерес протеинового препарата. Сушка вымораживанием или лиофилизация представляет собой способ, с помощью которого вещество, которое необходимо высушить, вначале замораживается и затем лед или замерзший растворитель удаляются сублимацией в вакууме. Для увеличения стабильности во время проведения сушки вымораживанием и/или повышения стабильности лиофилизированного продукта при хранениии в композиции перед лиофилизацией может включаться наполнитель (Pikal, M., Biopharm. 3(9): 26-30 (1990) и Arakawa et al. Pharm. Res 8(3): 285-291 (1991)).
Целью настоящего изобретения является создание лиофилизированной протеиновой композиции, которая стабильна при хранении и введении. Кроме того, целью настоящего изобретения является создание действующей протеиновой композиции, которая пригодна для подкожного введения. В некоторых вариантах целью является создание композиции многократного использования, которая стабильна в течение, по крайней мере, того времени, когда она вводится пациенту.
Сущность изобретения
Данное изобретение основано на том факте, что стабильную лиофилизированную протеиновую композцию можно получать с использованием лиопротектора (предпочтительно углеводов, как например, сахарозы или трегалозы), лиофилизированная композция может разбавляться с получением стабильной действующей композиции с концентрацией протеина, которая значительно выше (например, в 2-40 раз выше, предпочтительно в 3-10 раз выше и наиболее предпочтительно 6 3-6 раз выше), чем концентрация протеина в композиции до лиофилизации. В частности, в то время как концентрация протеина в композиции до лиофилизации может составлять 5 мг/мл или меньше, концентрация протеина в действующей композиции обычно 50 мг/мл или больше. Считают, что такие высокие концентрации протеина в действующей композиции будут особенно необходимы, когда композиция предназначена для подкожного введения. Найдено, что действующая композиция стабильна, несмотря на очень высокую концентрацию протеина (т.е. не удается обнаружить значительной или незначительной химической или физической неустойчивости протеина), при 2-8°С в течение, по крайней мере, 30 дней. В некоторых вариантах действующая композиция является изотонической. В данном изобретении обнаружено, что протеин в лиофилизированной композиции практически сохраняет свою физическую и химическую стабильность и целостность при лиофилизации и хранении, несмотря на применение более низких концентраций лиопротектора для достижения таких изотонических композиций при разбавлении.
Если композиция разбавляется с помощью растворителя, содержащего консервант (например, бактериостатической водой для инъекций, BWFI - bacteriostatic water for injection), то такая действующая композиция может использоваться как композиция многократного использования. Такая композиция пригодна, когда, например, пациенту требуются частые подкожные введения протеина для лечения хронических заболеваний. Преимущество композиции многократного использования состоит в том, что она облегчает применение ее пациентом, уменьшает потери, способствуя полному использованию содержимого пузырька (флакона) и приводит к значительной экономии для производителей, так как несколько доз вмещаются в одном пузырьке (флаконе) (ниже стоимость заполнения и перевозки).
Основываясь на результатах научных наблюдений, описанных в данном изобретении, один вариант предусматривает стабильную изотоническую действующую композицию, содержащую протеин в количестве, по крайней мере, 50 мг/мл и растворитель, когда действующая композиция получена из лиофилизированной смеси протеина и лиопротектора, где концентрация протеина в разбавленной композиции в ~2-40 раз выше, чем концентрация протеина в смеси до лиофилизации.
В другом варианте изобретение предусматривает стабильную действующую композицию, содержащую антитело в количестве, по крайней мере, ~50 мг/мл и растворитель, когда действующая композиция получена из лиофилизированной смеси антитела и лиопротектора, где концентрация антитела в действующей композиции в ~2-40 раз выше, чем концентрация антитела в смеси до лиофилизации.
Отношение лиопротектора к протеину в лиофилизированной композиции, описанной в предыдущем абзаце, зависит, например, как от выбора протеина, так и лиопротектора, а также зависит и от концентрации выбранного протеина и изотоничности действующей композиции. В случае антитела полной длины (как протеин) и трегалозы или сахарозы (в качестве лиопротектора) для получения действующей изотонической композиции с высокой концентрацией протеина это соотношение может, например, составлять около 100-1500 молей трегалозы или сахарозы на 1 моль антитела.
Обычно композиция протеина и лиопротектора перед лиофилизацией дополнительно включает буфер, который обеспечивает композиции соответствующий рН в зависимости от природы протеина в композиции. Было найдено, что для этих целей желательно использовать, как будет продемонстрировано ниже, гистидиновый буфер, поскольку он, по-видимому, обладает лиопротекторными свойствами.
Как отмечено в данном изобретении, композиция может дополнительно включать поверхностно-активное вещество (например, полисорбат), которое может уменьшать агрегацию протеина и/или уменьшать образование частиц в действующей (разбавленной) композиции. Поверхностно-активное вещество по выбору может добавляться к композиции перед лиофилизацией, к лиофилизированной композиции и/или разбавленной композиции (но предпочтительно к композиции перед лиофилизацией).
Кроме того, предлагается способ получения стабильной изотонической действующей композиции, включающий разбавление лиофилизированной смеси протеина и лиопротектора растворителем, с тем, чтобы концентрация протеина в разбавленной композиции составляла бы, по крайней мере, 50 мг/мл, где концентрация протеина в разбавленной композиции в ~2-40 раз выше, чем концентрация протеина в смеси до лиофилизации.
Еще другой вариант предусматривает способ получения композиции, включающий стадии: (а) лиофилизации смеси протеина и лиопротектора; и (б) разбавление лиофилизированной смеси от стадии (а) растворителем, так чтобы разбавленная композиция являлась бы изотонической и стабильной с концентрацией протеина, по крайней мере, около 50 мг/мл. Например, концентрация протеина в разбавленной композиции может составлять от ~80 мг/мл до ~300 мг/мл. Обычно, концентрация протеина в разбавленной (действующей) композиции примерно в 2-40 раз выше, чем концентрация протеина в смеси до лиофилизации.
Производимый продукт, описанный в изобретении, также включает:
а) контейнер (флакон, пузырек), который содержит лиофилизированную смесь протеина и лиопротектора; и
б) инструкции для разбавления лиофилизированной смеси растворителем до концентрации протеина в действующей композиции, по крайней мере, ~50 мг/мл. Производимый продукт может дополнительно включать второй контейнер (флакон, пузырек), который содержит растворитель (например, бактериостатическую воду для инъекций, BWFI, содержащую ароматический спирт).
Кроме того, предусматривается способ лечения млекопитающих, включающий назначение терапевтически эффективного количества действующей композиции, описанной в данном изобретении, млекопитающим, если млекопитающие имеют расстройства, для лечения которых требуется протеинсодержащая композиция. Например, композиция (состав) может вводиться подкожно.
Было найдено, что одна полезная предварительно лиофилизированная композиция анти-HER2 антитела, как обнаружено в экспериментах, детально описанных ниже, содержит анти-HER2 в количестве от ~5 до 40 мг/мл (например, 20-30 мг/мл) и сахарозу или трегалозу в количестве от ~10 до 100 mM (например, 40-80 mM), буфер (например, гистидиновый с рН 6 или сукцинатный с рН 5) и поверхностно-активное вещество (например, полисорбат). Было установлено, что лиофилизированная композиция стабильна при 40°С, по крайней мере, в течение 3 месяцев и стабильна при 30°С, по крайней мере, в течение 6 месяцев. Эта анти-HER2 композиция может разбавляться растворителем с получением состава, пригодного для внутривенного введения, содержащего анти-HER2 в количестве от ~10 до 30 мг/мл, которая стабильна при 2-8°С в течение, по крайней мере, 30 дней. Если требуются более высокие концентрации анти-HER2 антитела (например, если подкожное введение антитела является предполагаемой формой введения пациенту), лиофилизированную композицию можно разбавить с получением стабильной действующей композиции с концентрацией протеина 50 мг/мл или больше.
Одна подходящая предварительно лиофилизированная композиция анти-IgE антитела, описанная в данном изобретении, содержит анти-IgE в количестве от ~5 до 40 мг/мл (например, 20-30 мг/мл) и сахарозу или трегалозу от -60 до 300 mM (например, 80-170 mM), буфер (предпочтительно, гистидиновый с рН 6) и поверхностно-активное вещество (например, полисорбат). Лиофилизированная анти-IgE композиция стабильна при 30°С в течение, по крайней мере, одного года. Данная композиция может разбавляться с получением композиции, содержащей анти-IgE в количестве от ~15 до ~45 мг/мл (например, 15-25 мг/мл), пригодной для внутривенного введения, которая стабильна при 2-8°С в течение, по крайней мере, одного года. Наоборот, если требуются более высокие концентрации анти-IgE в композиции, лиофилизированная композиция может разбавляться с получением стабильной композиции, концентрация анти-IgE в которой составляет ≥50 мг/мл.
Краткое описание рисунков
На фиг.1 показано влияние разбавляемого объема на стабильность лиофилизированного rhuMAв HER2. Лиофилизированную композицию получали из композиции, которая до лиофилизации содержала 25 мг/мл протеина, 60 mM трегалозы, 5 mM сукцината натрия с рН 5,0 и 0,01% твина 20™ (Tween 20™). Лиофилизированную массу выдерживали при 40°С и затем разбавляли 4,0 (о) и 20 мл (•) BWFI. Долю интактного белка в разбавленной композиции измеряли с помощью гель-хроматографии и определяли как площадь пика нативного протеина к общей площади пиков, включая агрегаты.
На фиг.2 показано влияние концентрации трегалозы на стабильность лиофилизированного rhuMAв HER2. Протеин лиофилизировали при концентрации 25 мг/мл в 5 mM сукцина натрия с рН 5,0 (кружки) или в 5 mM гистидина с рН 6,0 (квадраты) и концентрациях трегалозы в пределах от 60 mM (молярное соотношение 360) до 200 mM (молярное соотношение 1200). Лиофилизированный протеин выдерживали при 40°С в течение или 30 дней (закрашенные символы) или в течение 91 дня (незакрашенные символы). Количество интактного протеина определяли после разбавления лиофилизированного протеина 20 мл BWFI.
На фиг.3 продемонстрировано влияние концентрации трегалозы на продолжительную стабильность лиофилизированного rhuMAв HER2, поставленного на хранение при 40°С. Протеин лиофилизировали или при концентрации 25 мг/мл в 5 mM сукцината натрия с рН 5,0, 0,01% твине (Tween 20™) и 60 mM трегалозы (■) или 5 mM гистидина с рН 6,0, 0,01% твине (Tween 20™) и 60 mM трегалозы (□) или при концентрации 21 мг/мл в 10 mM сукцината натрия с рН 5,0 0,2% твине 20™ (Tween 20™) и 250 mM трегалозы (•). Лиофилизированный протеин выдерживали при 40°С и затем разбавляли 20 мл BWFI. Количество интактного протеина определяли после разбавления.
На фиг.4 показана стабильность rhuMAвHER2, лиофилизированного в 38,4 mM маннита (7 мг/мл), 20,4 mM сахарозы (7 мг/мл), 5 mM гистидина с рН 6,0, 0,01% твина 20™ (Tween 20™). Лиофилизированный протеин выдерживали при 40°С и затем разбавляли 4,0 мл (о) или 20 мл (•) BWFI. Количество интактного протеина определяли после разбавления композиции.
На фиг.5 продемонстрирована стабильность действующего rhuMAв HER2, лиофилизированного в 5 mM сукцината натрия с рН 5,0, 60 mM трегалозы, 0,01% твине (Tween 20™). Образцы разбавляли 4,0 мл (квадраты) или 20,0 мл (кружки) BWFI (20 мл: 0,9% бензиловый спирт; 4,0 мл: 1,1% бензиловый спирт) и затем хранили при 5°С (закрашенные символы) или 25°С (незакрашенные символы). Процент нативного протеина определяли как площадь пика нативного (не разрушенного) протеина к общей площади пиков, измеренных с помощью катионообменной хроматографии.
На фиг.6 показана стабильность действующей композиции, содержащей rhuMAвHER2, и лиофилизированной в 5 mM гистидина с рН 6,0, 60 mM трегалозы, 0,01% твина (Tween 20). Образцы разбавляли 4,0 мл (квадраты) или 20 мл (кружки) BWFI (20 мл: 0,9% бензиловый спирт; 4,0 мл: 1,1% бензиловый спирт) и затем хранили при 5°С (закрашенные символы) или 25°С (незакрашенные символы). Содержание нативного протеина (в %) определяли как площадь пика нативного (не разрушенного) протеина к общей площади пиков, измеренных с помощью катионообменной хроматографии.
На фиг.7 показана стабильность действующей композиции, содержащей rhuMAв HER2 и лиофилизированной в 5 mM гистидина с рН 6,0, 38,4 mM маннита, 20,4 mM сахарозы, 0,01% твина 20 (Tween 20). Образцы разбавляли 4,0 мл (квадраты) или 20 мл {кружки) BWFI (20 мл: 0,9% бензиловый спирт; 4,0 мл: 1,1% бензиловый спирт) и затем хранили при 5°С (закрашенные символы) или 25°С (незакрашенные символы). Содержание нативного протеина (в %) определяли как площадь пика нативного (не разрушенного) протеина к общей площади пиков, измеренных с помощью катионообменной хроматографии.
На фиг.8 показана стабильность действующей композиции, содержащей rhuMAв HER2 и лиофилизированной в 10 mM сукцината натрия с рН 5,0, 250 mM трегалозы, 0,2% твина 20 (Tween 20). Образцы разбавляли 20,0 мл BWFI (0,9% бензиловый спирт) и затем хранили при 5°С (•) или 25°С (о). Содержание нативного протеина (в %) определяли как площадь пика нативного (не разрушенного) протеина к общей площади пиков, измеренной с помощью катионообменной хроматографии.
На фиг.9 показана агрегация rhuМАвЕ25, имеющая место при изготовлении композиции в буферах в интервале рН от 5 до 7 при концентрации буфера 10 mM и концентрации антитела 5 мг/мл. Образцы лиофилизировали и анализировали при нулевом времени и по истечении 4 недель, 8 недель и 52 недель после хранения при 2-8°С. буферами являлись: фосфат калия с рН 7,0 (о); фосфат натрия с рН 7,0 (□); гистидин с рН 7,0 (◊); сукцинат натрия с рН 6,5 (•); сукцинат натрия с рН 6,0 (■); сукцинат натрия с рН 5,5 (♦) и сукцинат натрия с рН 5,0 (∆).
На фиг.10 изображена агрегация rhuМАвЕ25, лиофилизированного в 5 mM гистидинового буфера как при рН 6, так и при рН 7, и проанализированного после хранения следующим образом. Буфер с рН 6,0 хранили при 2-8°С (о); с рН 6 хранили при 25°С (□); с рН 6 хранили при 40°С (◊); с рН 7 хранили при 2-8°С (•); с рН 7 хранили при 25°С (■); и с рН 7 хранили при 40°С (■).
На фиг.11 показана агрегация rhuМАвЕ25 при концентрации 5 мг/мл, имеющая место при изготовлении композици в 10 mM сукцината натрия при рН 5,0 с лиопротектором, добавленным в концентрации 275 mM (изотоническим). Лиопротекторами являлись: контрольный образец без лиопротектора (о); маннит (□); лактоза (◊); мальтоза (•); трегалоза (■) и сахароза (♦). Образцы лиофилизировали и анализировали при начальном времени и после 4 недель, 8 недель и 52 недель хранения при 2-8°С.
На фиг.12 показана агрегация rhuMAв Е25 при концентрации 5 мг/мл, имеющая место при изготовлении композиции в 10 mM сукцината натрия при рН 5,0 с лиопротектором, добавленным в концентрации 275 mM (изотоническим). Лиопротекторами являлись: контрольный образец без лиопротектора (о); маннит (□); лактоза (◊); мальтоза (•); трегалоза (■) и сахароза (♦). Образцы лиофилизировали и анализировали при начальном (нулевом) времени и после 4 недель, 8 недель и 52 недель хранения при 40°C.
На фиг.13 представлена хроматография гидрофобного взаимодействия rhuMAв Е25 с концентрацией 20 мг/мл, лиофилизированного в гистидиновом буфере при рН 6 с изотонической концентрацией (т.е. 275 mM) лактозы, оставленного на хранение на 24 недели при 2-8, 25 или 40°С и разбавленного до 20 мг/мл.
На фиг.14 представлена хроматография гидрофобного взаимодействия rhuMAв Е25 с концентрацией 20 мг/мл, лиофилизированного в гистидиновом буфере с рН 6, оставленного на хранение на 24 недели при 2-8, 25 или 40°С и разбавленного до 20 мг/мл.
На фиг.15 представлена хроматография гидрофобного взаимодействия rhuMAв Е25 с концентрацией 20 мг/мл, лиофилизированного в гистидиновом буфере с рН 6 при изотонической концентрации (т.е. 275 mM) сахарозы и оставленного на хранение на 24 недели при 2-8, 25 или 40°С и разбавленного до 20 мг/мл.
На фиг.16 показано влияние концентрации углевода на rhuMAв Е25, имеющее место при концентрации 20 мг/мл в 5 mM гистидина с рН 6,0. К композиции добавляли сахарозу (•) и трегалозу (□) в молярных соотношениях, изменяющихся от 0 до 2010 (изотонические) (ниже см. табл.1). Образцы лиофилизировали и анализировали через 12 недель при хранении при 50°С.
На фиг.17 показана агрегация rhuMAв Е25, имеющая место при концентрации 25 мг/мл в 5 mM гистидина при рН 6 с 85 mM сахарозы (о); 85 mM трегалозы (□); 161 mM сахарозы (♦) или 161 mM трегалозы (∆). Образцы лиофилизировали и хранили при 2-8°С, за которым следовало разбавление 0,9% бензиловым спиртом до 100 мг/мл антитела в 20 mM гистидина при рН 6 с изотонической (340 mM) и гипертонической (644 mM) концентрацией углевода.
На фиг.18 показана агрегация rhuMAв Е25, имеющая место при концентрации 25 мг/мл в 5 mM гистидина при рН 6 с 85 mM сахарозы (о); 85 mM трегалозы (□); 161 mM сахарозы (♦) или 161 mM трегалозы (∆). Образцы лиофилизировали и хранили при 30°С, за которым следовало разбавление 0,9% бензиловым спиртом до 100 мг/мл антитела в 20 mM гистидина при рН 6 с изотонической (340 mM) и гипертонической<644 mM) концентрацией углевода.
На фиг.19 показана агрегация rhuМАвЕ25, имеющая место при 25 мг/мл в 5 mM гистидина при рН 6 с 85 mM сахарозы (о); 85 mM трегалозы (□); 161 mM сахарозы (♦) или 161 mM трегалозы (∆). Образцы лиофилизировали и хранили при 50°С, за которым следовало разбавление 0,9% бензиловым спиртом до 100 мг/мл антитела в 20 mM гистидина при рН 6 с изотонической (340 mM) и гипертонической (644 mM) концентрацией углевода.
Подробное описание предпочтительных вариантов
1. Определения
Под "протеином" подразумевают аминокислотную последовательность, длина цепи которой достаточна для продуцирования более высокого уровня третичной и/или четвертичной структуры Это отличается от "пептидов" или других низкомолекулярных препаратов, которые не имеют такой структуры. Обычно молекулярный вес протина, описанного в данном избретении, должен составлять, по крайней мере, около 15-20 kD, предпочтительно около 20 kD.
Примеры протеинов, охватываемых данным определением, содержат протеины млекопитающих, например, гормон роста, включая человеческий гормон роста и бычий гормон роста; фактор секреции гормона роста; паратиреоидный гормон; тиреостимулирующий гормон; липолротеины; α-1-антитрипсин; А-цепь инсулина; В-цепь инсулина; проинсулин; фолликулостимулирующий гормон; калцитонин; лютеинизирующий гормон; глюкагон; факторы свертывающей системы крови, такие как VIIIC фактор, IX фактор, тканевый фактор и фактор Виллебранда (Willebrands); факторы, препятствующие свертыванию крови, такие как Протеин С; предсердный натриуретический фактор; сурфактант легкого; активатор плазминогена; например, урокиназный или тканевый активатор плазминогена (t-PA); бомбазин; тромбин; α- и β-факторы, вызывающие некроз опухолевых клеток; энкефалиназа; RANTES (regulates on activation normally T-cell expressed and secreted - регулирующий активацию экспрессии и секреции нормальных Т-клеток); человеческий фагоцитарный воспалительный белок (MIP-1-α); сывороточный альбумин, например, сывороточный альбумин человека; мюллерова ингибирующая субстанция; А-цепь релаксина; В-цепь релаксина; прорелаксин; мышиный гонадотропин-связывающий пептид; ДНК-аза; ингибин; активин; васкулярный эндотелиальный фактор роста (vascular endothelial grown factor, VEGF); рецепторы гормонов или факторов роста; интегрин; А- или D-протеин; ревматоидные факторы; нейротрофический фактор, например, нейротрофический фактор костного происхождения (bone-derived neurotrophic factor, BDNF), нейротрофин-3, -4, -5 или -6 (NT-3, NT-4, NT-5 или NT-6) или нервный фактор роста, например, NGF-β; тромбоцитарный фактор роста (platelet- derived growth factor, PDGF); фактор роста фибробластов (fibroblast growth factor, FGF), например, aFGF и bFGF; эпидермальный фактор роста (epidermal growth factor, EGF); трансформирующий фактор роста (transforming growth factor, TGF), например, TGF-α и TGF-β, включая TGF-β1, TGF-β2, TGF-β3, TGF-β4 или TGF-β5; инсулиноподобный фактор роста-I и -II (insulin-like growth factor, IGF-I и IGF-II); дез(1-3)-IGF-I (мозговой IGF-1); связывающие протеины инсулиноподобного фактора роста; CD протеины, например, CD3, CD4, CD8, CD19 и CD20; эритропоэтин (ЕРО); тромбопоэтин (ТРО); остеоиндуктивные факторы; иммунотоксины; протеин, участвующий в остеогенезе (bone morphogenetic protein, BMP); интерферон, например, α-, β- и γ-интерферон; колониестимулирующие факторы (colony stimulating factors, CSFs); например, M-CSF, GM-CSF и G-CSF; интерлейкины (ILS), например, с IL-1 до IL-10; супероксиддисмутаза; Т-клеточные рецепторы; поверхностно-мембранные протеины; комплементзависимый стимулятор гемолиза (DAF-фактор, decay accelerating factor); вирусный антиген, например, часть ВИЧ-оболочки; транспортные протеины; "хоминг"-рецепторы; адрессин; регуляторные протеины; иммуноадгезины; антитела и биологически активные фрагменты или варианты любого из вышеперечисленных полипептидов.
Протеины, которые используют для получения композиции, должны, предпочтительно, быть достаточно чистыми и желательно практически гомогенными (т.е. без загрязняющих протеинов и т.д.). "Достаточно (по существу) чистый" протеин означает состав, содержащий, по крайней мере, 90% (массовых) протеина от общего веса состава, предпочтительно около 95% (массовых). "Практически гомогенный" протеин означает композицию, содержащую, по крайней мере, 99% (массовых) протеина от общего веса композиции.
В некоторых вариантах протеином является антитело. Антитело может, например, связываться с любыми из вышеперечисленных молекул. Типичными молекулярными мишенями для антител, включенными в настоящее изобретение, являются CD протеины, например, CD3, CD4, CD8, CD19, CD20 и CD34; представители семейства HER рецептора, например, EGF рецептор, HER2, HER3 или HER4 рецептор; молекулы клеточной адгезии, например, LFA-1, Мо1, р150,95, VLA-4, 1CAM-1, VCAM и αv/β3 интегрин, включая его α- или β-субъединицы (например, анти-CD11a, анти-CD18 или анти-CD11b антитела); факторы роста, например, VEGF; IgE; антигены группы крови; flk2/flt3 рецептор; рецептор ожирения (obesity, OB); С-протеин и т.д.
Термин "антитело" используют в самом широком смысле и особенно относят к моноклональным антителам (включая антитела полной длины, имеющие Fc-область иммуноглобулина), композициям антител с полиэпитопной специфичностью, биспецифическим антителам, диателам и молекулам с одной цепью, а также к фрагментам антител (например, Fab; F(ab')2 и Fv).
Термин "моноклональное антитело", используемый в данном изобретении, относится к антителу, полученному из популяции практически моноклональных антител, т.е. индивидуальных антител, включающих идентичные популяции, за исключением возможных, встречающихся в природе мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела высокоспецифичны, причем направлены к одной области детерминанты. Кроме того, в противоположность обычным составам (поликлональных) антител, которые обычно включают различные антитела, направленные к различным детерминантам (эпитопам), каждое моноклональное антитело направлено к одной детерминанте на антигене. В дополнение к специфичности, моноклональные антитела обладают тем преимуществом, что они синтезируются с помощью гибридомной культуры, незагрязненной другими иммуноглобулинами. Определение "моноклональный" указывает на характер антитела, полученного из практически гомогенной популяции антител и не должно истолковываться, как требующее продуцирования антитела любым отдельным способом. Например, моноклональные антитела, используемые в соответствии с настоящим изобретением, можно получать методом гибридом, впервые описанным Konler et al., Nature, 256: 495 (1975) или можно получать методами рекомбинантной ДНК (генной инженерией) (см., например U.S. Patent No. 4816567). "Моноклональные антитела" можно также выделить из библиотек фагов антител, используя методы, описанные, например, в публикациях Clackson et al., Nature 352: 624-628 (1991) и Marks et al., J. Mol. Biol. 222: 581-597 (1991).
Моноклональные антитела определенно включают "химерные" антитела (иммуногпобулины), в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, полученных из отдельных видов или принадлежащих отдельному классу или подклассу антитела, в то время как остаток цепи (цепей) идентичен или гомологичен соответствующим последовательностям антител, полученных из других видов или принадлежащих другому классу или подклассу антитела, а также фрагментам этих антител, до тех пор пока они проявляют нужную биологическую активность (U.S Patrent No. 4816567; Morrison et al., Proc Natl. Acad. Sci. USA, 81: 6851-6855 (1984)).
"Облагороженными" формами антител, не принадлежащих к человеческому роду (например, относящихся к мышам и крысам) являются химерные иммуноглобулины, цепи иммуноглобулина или ее фрагменты (такие как Fv, Fab, Fab', F(ab')2 или другие антигенсвязывающие последовательности антител), которые содержат минимальную последовательность, полученную из иммуноглобулина, не принадлежащего человеческому роду. Главным образом, "облагороженные" антитела являются иммуноглобулинами человека (антитело реципиента), в котором остатки гипервариабельного участка (complementarity determining region, CDR) реципиента заменены остатками CDR не принадлежащих к человеческому роду видов (донорское антитело), например, мыши, крысы или кролика, которые обладают требуемой специфичностью, сродством и емкостью. 6 некоторых случаях остатки Fv остовной области (framework region, FR) иммуноглобулина человека заменены на соответствующие остатки, не принадлежащие к человеческому роду. Кроме того, облагороженные антитела могут включать остатки, которых нет ни в реципиентном антителе, ни в вводимых (импортируемых) CDR или остовных последовательностях. Эти модификации заставляют проводить дополнительную очистку и оптимизировать характеристики антитела. Обычно, облагороженное антитело должно включать практически все или, по крайней мере, одну, как правило, две вариабельные области, в которых все или в основном все CDR участки соответствуют участкам иммуноглобулина, не принадлежащего к человеческому роду, и все или в основном все FR области являются областями последовательности иммуноглобулина человека. Оптимально, облагороженное антитело также должно включать, по крайней мере, часть константной области иммуноглобулина (Fc), обычно константной области иммуноглобулина человека. Более подробно это описано в работах Jones et at., Nature, 321: 522-525 (1986); Reichmann et al., Nature 332: 323-329 (1988) и Presta, Curr. Op. Struct. Biol., 2: 593-596 (1992). Облагороженное антитело включает антитело Primatized™, в котором антигенсвязывающую область антитела получают из антитела, продуцируемого при иммунизации обезьян (макак) нужным антигеном.
"Стабильная" композиция является такой, в которой протеин по-существу сохраняет свою физическую и химическую стабильность и целостность при хранении. Имеются различные аналитические методы для определения стабильности протеина, обзор которых приведен в Peptide and Protein Drug Delivery, 247-301, Vincent Lee Ed., Marcel Dekker, Inc., New York, Pubs. (1991) и Jones, A. Adv. Drug Delivery Rev. 10: 29-90 (1993). Стабильность можно определять при выбранной температуре в течение выбранного периода времени. Для быстрого скрининга, при котором определяется время стабильности, композицию можно выдерживать при 40°С от 2 недель до одного месяца. Если композицию следует хранить при 2-8°С, то, обычно, она должна быть стабильна при 30°С или 40°С в течение одного месяца и/или стабильна при 2-8°С в течение, по крайней мере, двух лет. Если композицию следует хранить при 30°С, то она, обычно, должна быть стабильна, по крайней мере, в течение двух лет при 30°С и/или стабильна при 40°С в течение 6 месяцев. Например, в качестве индикатора стабильности протеина (см. примеры, приведенные в изобретении), может служить степень агрегации после лиофилизации и хранения. Например, "стабильной" композицией может считаться такая, у которой менее 10% и предпочтительно менее 5% протеина присутствует в композиции в виде агрегата. В других вариантах может определяться любое увеличение образования агрегатов после лиофилизации и хранения лиофилизированной композиции. Например, "стабильной" лиофилизированной композицией может считаться такая, у которой увеличение агрегатов менее 5% и предпочтительно менее 3%, если лиофилизированную композицию хранят при 2-8°С в течение, по крайней мере, одного года. В других вариантах стабильность протеиновой композиции можно оценить, используя проверку биологической активности (см. ниже, например, пример 2).
"Действующая (разбавленная)" композиция называется такой, если ее готовят растворением лиофилизированной протеиновой композиции в растворителе с тем, чтобы протеин диспергировался в действующей композиции. Действующая (разбавленная) композиция пригодна для введения (например, парентерального введения) пациенту, которого необходимо лечить данным протеином, в некоторых вариантах композиция может быть пригодной для подкожного введения.
Под "изотонической" понимают такую композицию, которая имеет практичеки такое же осмотическое давление, что и кровь человека. Изотонические композиции обычно должны иметь осмотическое давление от 250 до 350 mOsm (миллиосмолей). Изотоничность можно измерить, например, с помощью парового или вымораживающего осмометра.
"Лиопротектор" это молекула, которая, если ее смешивают с необходимым протеином, в значительной степени предупреждает или уменьшает химическую и/или физическую нестабильность данного протеина при лиофилизации и последующем хранении. Типичные лиопротекторы включают углеводы, как например, сахарозу или трегалозу; аминокислоты, например, однозамещенный глутамат натрия или гистидин; метиламин, такой как бетаин; лиотропную соль, как например, сульфат магния; полиол, например, трехатомный или более высокоатомные спирты углеводов, например, глицерин, эритрит, арабит, ксилит, сорбит и маннит; пропиленгликоль; полиэтиленгликоль; плуроник (Pluronics) и их комбинации. Предпочтительным лиопротектором является невосстанавливающий углевод, например, трегалоза или сахароза.
Лиопротектор добавляют к композиции перед лиофилизацией в "лиопротекторном количестве", что означает, что после лиофилизации протеина в присутствии лиопротекторного количества лиопротектора, протеин, по существу, сохраняет свою физическую и химическую стабильность и идентичность при лиофилизации и хранении.
Выбранный "растворитель" является таким, если он фармацевтически приемлем (безопасен и нетоксичен при введении человеку) и пригоден для приготовления действующей (разбавленной) композиции. Типичные растворители включают стерильную воду, бактериостатическую воду для инъекций (BWFI), буферные растворы с определенным рН (например, забуференный фосфатом физиологический раствор, стерильный физиологический раствор, раствор Рингера (Ringer's solution) или раствор декстрозы.
"Консервант" означает соединение, которое может добавляться к растворителю для существенного уменьшения бактериального воздействия на разбавленную композицию, таким образом, способствуя, например, получению действующей композиции многократного использования. Примерами потенциальных консервантов являются октадецилдиметилбензиламмоний хлорид, гексаметоний хлорид, бензалконий хлорид (смесь алкилбензилдиметиламмоний хлоридов, в которых алкильные группы являются группами с длинной цепью) и бензэтоний хлорид. К другим типам консервантов относятся ароматические спирты такие, как фенол, бутиловый и бензиловый спирт, алкилпарабены, например, метил- или пропилпарабен, катехин, резорцин, циклогексанол, 3-пентанол и м-крезол. Наиболее предпочтительным консервантом в данном изобретении является бензиловый спирт.
"Наполнителем" является соединение, которое увеличивает массу лиофилизированной смеси и приводит к физической структуре лиофилизированной массы (например, способствует получению, по-существу, однородной лиофилизированной массы, которая сохраняет открытую пористую структуру). Типичными наполнителями являются маннит, глицин, попиэтиленгликоль и сорбит.
"Лечение" относится как к терапевтическому лечению, так и к профилактическим или предупреждающим мерам. Нуждающиеся в лечении включают как тех, у которых уже имеются расстройства, так и тех, у которых эти расстройства следует предупреждать.
Подвергаемыми лечению "млекопитающими" являются любые животные, классифицируемые как млекопитающие, включая людей, домашние и сельскохозяйственные животные, животные зоопарка, спортивные или комнатные животные, например, собаки, лошади, кошки, коровы и т.д.. Предпочтительным млекопитающим является человек.
"Расстройством" является любое состояние, которое будет улучшаться при лечении протеином. Оно включает хронические и острые нарушения или болезни, в том числе те патологические состояния, которые предрасполагают млекопитающего к расстройству, о котором идет речь. Неограниченными примерами расстройств, которые подвергаются лечению, являются карциномы и аллергии.
II. Способы осуществления изобретения
А. Получение протеина
Протеин, используемый в композиции, получают с применением способов, которые хорошо известны специалистам, в том числе синтетические способы (например, рекомбинантные способы (методы генной инженерии) и пептидный синтез или комбинация этих способов), или могут выделяться из эндогенного источника протеина. В некоторых вариантах изобретения протеин выбирают из антитела. Ниже следуют способы продуцирования антитела.
а) Поликлональные антитела
Поликлональные антитела обычно возникают у животных при многочисленных подкожных (sc) или внутрибрюшинных (ip) инъекциях соответствующего антигена и адъюванта. Это может быть полезно для связывания соответствующего антигена с протеином, который является иммуногенным в иммунизированных видах, например, гемоцианин лимфы улитки, сывороточный альбумин, бычий тиреоглобулин или соевый ингибитор трипсина с использованием бифункционального или дериватизирующего агента, например, эфира малеимидобензоилсульфосукцинимида (конъюгация через остатки цистеина), N-гидроксисукцинимида (через остатки лизина), глутарового альдегида, ангидрида янтарной кислоты, SOCl2 или R'N=C=NR, где R и R' являются разными алкильными группами.
Животных иммунизируют антигеном, иммуногенными конъюгатами или производными при смешивании 1 мг или 1 мкг пептида или конъюгата (для кроликов или мышей, соответственно) с тремя объемами полного адъюванта Фрейнда. Месяцем позже животных ревакцинируют от 1/5 до 1/10 части от первоначального количества пептида или конъюгата в полном адъюванте Фрейнда путем подкожной инъекции в многочисленные места. Через 7-14 дней у животных берут кровь и сыворотку анализируют на титр антитела. Животных ревакцинируют до тех пор, пока титр не перестает изменяться. Предпочтительно, животных ревакцинируют конъюгатом того же антигена, но связывают с другим протеином и/или посредством другого перекрестносшивающего реагента. Конъюгаты также можно приготовить в рекомбинантной клеточной культуре путем слияния белка. Также агенты, вызывающие агрегацию, как например, квасцы, успешно применяют для усиления иммунного ответа (реакции).
б) Моноклональные антитела
Моноклональные антитела получают из популяций в основном моноклональных антител, т.е. индивидуальных антител, включающих идентичные популяции, кроме возможных в природе встречающихся мутаций, которые могут присутствовать в незначительных количествах. Таким образом, определение "моноклональный" указывает на характер антитела, не являющегося смесью дискретных антител.
Например, Моноклональные антитела можно получить, используя метод гибридом, впервые описанный в работе Kohler et al., Nature, 256:495 (1975), или можно получить методами генной инженерии (рекомбинантной ДНК) (U.S. Patent No. 4816567).
В методе гибридом, мышь или другое подходящее животное - хозяина, например хомяка, иммунизируют, как описано выше, для выявления лимфоцитов, которые продуцируют или способны продуцировать антитела, которые будут специфически связываться с протеином, используемым для иммунизации. Или же лимфоциты могут подвергаться иммунизации in vitro. Лимфоциты затем сливаются с миеломными клетками с применением подходящего агента, вызывающего слияние клеток, как например, полиэтиленгликоля, с образованием клетки гибридомы (Coding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)).
Таким образом полученные клетки засевают и выращивают а подходящей культуральной среде, которая, предпочтительно, содержит одно или несколько веществ, которые ингибируют рост или естестенный отбор неслившихся родительских миеломных клеток. Например, если родительские миеломные клетки испытывают недостаток в ферменте гипоксантингуанинфосфорибозилтрансферазе (HGPRT или HPRT), тогда культуральная среда для гибридом должна содержать гипоксантин, аминоптерин и тимидин (ГАТ - среду), вещества которой предотвращают рост HGPRT - дефицитных клеток.
Предпочтительными миеломными клетками являются те, которые легко сливаются, поддерживают стабильно высокий уровень продуцирования антитела отобранными антитело-продуцирующими клетками и являются восприимчивыми к среде, как например, к ГАТ-среде. Среди них предпочтительными миеломными клеточными линиями являются относящиеся к мышам или крысам миеломные линии, как например, полученные из МОРС-21 и МРС-11 опухолей мышей, доступные из центра - Salk Institute Cell Distribution Center, San Diego, California USA, и SP-2 клетки, доступные из американской коллекции культур (American Type Culture Collection. Rockville, Maryland USA). Также для продуцирования моноклональных антител человека были описаны миеломные клеточные линии человека и гетеромиеломные клеточные линии мышь-человек. (Kozbor, J. Immunol. 133: 3001 (1964): Brodeur et al., Monoclonal Antibody Production Techniques and Applications pp.51-63 (Marcel Dekker, Inc., New York. 1987)).
Культуральную среду, в которой культивируются клетки гибридом, проверяли на просуцирование моноклональных антител, направленных к антигену. Предпочтительно, связывающую специфичность моноклональных антител, продуцируемых клетками гибридом, определяют с помощью иммунопреципитации или реакцией связывания in vitro, такой как радиоиммуноанализ (radioimmunoassay, RIA) или твердофазный иммуноферментный анализ (enzyme - linked immunoabsorbent assay, EL-ISA).
Связывающее сродство моноклонального антитела можно определить, например, с помощью анализа Скэтчарда (Scatchard), описанного в работе Munson et al., Anal. Biocnem. 107:220 (1980).
После того, как клетки гибридомы, которые продуцируют антитела требуемой специфичности, сродства и/или активности, идентифицируют, клоны можно субклонировать с применением техники ограниченного разбавления и культивировать стандартными способами (Coding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)). Подходящей культуральной средой для этой цели является, например, D-MEM или RPMI-1640 среда. Кроме того, клетки гибридом можно культивировать in vivo в виде асцитных опухолей у животных.
Моноклональные антитела, выделяемые (секретируемые) субклонами, легко отделяются от культуральной среды, асцитической жидкости или сыворотки обычными способами очистки иммуноглобулинов, таких как протеин А-сефароза, гидроксилапатитная хроматография, гель-электрофорез, диализ или аффинная хроматография.
ДНК, кодирующая моноклональные антитела, легко выделяется и секвенируется с использованием обычных методик (например, с использованием олигонуклеотидных зондов, которые способны специфически связываться с генами, кодирующими тяжелую и легкую цепи антител, относящихся к мышам или крысам). Клетки гибридом служат предпочтительным источником таких ДНК. Однажды выделенная, ДНК может помещаться в экспрессирующие вектора, которые затем трансфектируются в клетки хозяина, например, клетки E.coli, клетки COS обезьяны, клетки яичника китайского хомячка (Chinese hamster ovary, CHO) или миеломные клетки, которые иным способом не продуцируют протеин иммуноглобулина, применяя синтез моноклональных антител в рекомбинантных клетках хозяина. Обзорные статьи по рекомбинантной экпрессии в бактериях ДНК, кодирующей антитело, включают Skerra et at., Curr. Opinion In Immunol., 5: 256-262 (1993) и Pluckthun, Immunol. Revs., 130: 151-188 (1992).
В другом варианте антитела можно выделять из библиотек фагов антител, генерируемых с использованием методики, описанной в публикации McCafferty et al., Nature, 348: 552-554 (1990). В работах Clackson et al., Nature 352: 624-628 (1991) и Marks et al., J. Mol. Biol., 222: 581-597 (1991) описано выделение антител, относящихся к мышам или крысам и к человеку, соответственно, с использованием библиотек фагов. В последующих публикациях описано продуцирование антител человека высокого сродства (в пределах nM) путем перестановки (перемещения) цепи (Marks et al., Bio/Technology, 10: 779-783 (1992)), а также комбинаторной инфекцией и рекомбинацией in vivo как стратегии создания очень больших библиотек фагов (Waterhouse et al., Nuc. Acids. Res., 21: 2265-2266 (1993)). Таким образом, эти методы являются жизнеспособными вариантами по отношению к традиционным методам гибридом моноклональных антител для выделения моноклональных антител.
ДНК также можно модифицировать, например, замещением кодирующей последовательности на константные области тяжелой и легкой цепи вместо гомологических последовательностей, относящихся к мышам или крысам (U.S. Patent No. 4816567); Morrison, et al., Proc. Natl. Acad. Sci. USA, 81: 6851 (1984)), или ковалентным соединением кодирующей последовательности иммуноглобулина со всей кодирующей последовательностью неиммуноглобулинового полипелтида или его частью.
Обычно такие неиммуноглобулиновые полипептиды замещаются константными областями антитела, или они замещаются вариабельными областями одного антигенсвязывающего центра антитела для создания химерного двухвалентного антитела, включающего один антигенсвязывающий центр антитела, обладающий специфичностью к антигену, и другой антигенсвязывающий центр антитела, обладающий специфичностью к другому антигену.
Химерные или гибридные антитела также можно получать in vitro при использовании известных в химии синтетических протеинов способов, включая способы с участием перекрестносшивающих агентов. Например, иммунотоксины можно создать, используя реакцию дисульфидного обмена или образованием тиоэфирной связи. Примерами пригодных для этих целей реагентов являются иминотиолат и метил-4-меркаптобутиримидат.
в) Облагороженные антитела и антитела человека
Способы облагораживания антител, не принадлежащих к человеческому роду, хорошо известны. Обычно, облагороженное антитело содержит один или несколько аминокислотных остатков, введенных в антитело из источника, который не принадлежит к человеческому роду. Эти аминокислотные остатки, не принадлежащие к человеческому роду, часто называют "введенными" ("импортными") остатками, которые обычно берутся из "импортной" вариабельной области. Облагораживание можно осуществить, в основном, следуя способу Уинтера с сотр. (Winter) (Jones et al., Nature, 321: 522-525 (1986); Riechmann et al:, Nature, 332: 323-327 (1988); Verhoeyen et al., Science, 239: 1534-1536 (1988)) путем замещения CDRs или CDR последовательностей грызунов на соответствующие последовательности антитела человека. Соответственно, такие "облагороженные" антитела являются химерными антителами (U.S. Patent No. 4816567), в которых значительно меньшая часть неповрежденной (интактной) вариабельной области человека заменена на соответствующую последовательность из вида, не принадлежащего человеческому роду. На практике облагороженные антитела обычно представляют собой антитела человека, в которых некоторые CDR остатки и возможно некоторые FR остатки заменены остатками аналогичных центров в антителах грызунов.
Выбор вариабельных областей человека - как легкой, так и тяжелой, используемых для получения облагороженных антител, очень важен для уменьшения антигенности. Согласно так называемому методу "наилучшего соответствия", проводят скрининг последовательности вариабельной области антитела грызуна относительно полной (всей) библиотеки известных последовательностей вариабельных областей человека. Последовательность человека, которая ближе всего к последовательности грызуна, далее принимается в качестве остовной области (FR) человека для облагороженного антитела (Sims et al., J. Immunol., 151: 2296 (1993); Chothia et al., J. Mol. Biol., 196: 901 (1987)). Другой способ использует отдельную остовную область, полученную из обобщающей типичной последовательности всех антител человека отдельной подгруппы легкой или тяжелой цепей. Этот же остов можно использовать для некоторых других облагороженных антител (Carter et al., Proc. Natl. Acad. Sci. USA, 89: 4285 (1992); Presta et al., J. Immunol. 151: 2623 (1993)).
Кроме того, важно, что антитела облагораживаются с сохранением высокого сродства к антигену и сохранением других важных биологических свойств. В соответствии с предпочтительным вариантом для достижения этой цели облагороженные антитела получают методом анализа исходных (родительских) последовательностей и различных умозрительных облагороженных продуктов, используя трехмерные модели родительских и облагороженных последовательностей. Трехмерные модели иммуноглобулина обычно доступны и известны специалистам. Имеются компьютерные программы, которые иллюстрируют и демонстрируют вероятные трехмерные конформационные структуры выбранного варианта последовательностей иммуноглобулина. Анализ этих изображений позволяет сделать вывод о возможной роли остатков в функционировании кандидата иммуноглобулиновой последовательности, т.е. делает вывод об остатках, которые влияют на способность кандидата иммуноглобулина связывать антиген. Таким образом, FR остатки можно отобрать и отделить от реципиента и импортных последовательностей с тем, чтобы достичь требуемой характеристики антитела, как например, увеличенного сродства для антигена(нов) мишени. Обычно, CDR остатки непосредственно и наиболее сильно влияют на связывание антигена.
Наоборот, в настоящее время возможно продуцировать трансгенных животных (например, мышей), которые при иммунизации способны продуцировать полный спектр антител человека в отсутствии продуцирования эндогенного иммуноглобулина, Например, было описано, что гомозиготная делеция тяжелой цепи области соединения (jH) гена антитела в химерной и линии-эмбриона мутантных мышей приводит к полному ингибированию продуцирования эндогенного антитела. Перенос ранжированного ряда гена иммуноглобулина линии-эмбриона человека в такую линию-эмбриона мутантных мышей приведет к продуцированию антител человека при антигенном стимуле (см. например, Jakobovits et al., Proc. Natl. Acad. Sci. USA, 90: 2551 (1993); Jakobovits et al., Nature, 362: 255-258 (1993); Bruggermann et al., Year in Immune., 7: 33 (1993). Антитела человека можно получить из библиотек фагов - отображений (Hoogenboom et al., J. Mol. Biol. 227: 381 (1991); Marks et al., J. Mol. Biol., 222: 581-597 (1991)).
г) Биспецифические антитела
Биспецифическими антителами (BsAbs) являюся антитела, которые обладают связывающей специфичностью, по крайней мере, к двум различным эпитопам. Такие антитела можно получить из антитела полной длины или фрагментов антитела (например, F(ab')2 биспецифических антител).
Известны методы получения биспецифических антител. Традиционное продуцирование биспецифических антител полной длины основано на коэкспрессии двух пар тяжелой - легкой цепи иммуноглобулина, где две цепи обладают различными специфичностями (Millstein et al., Nature, 305: 537-539 (1983)). Из-за случайного выбора тяжелых и легких цепей иммуноглобулина, эти гибридомы (квадромы) продуцируют потенциальную смесь из 10 различных молекул антитела, из которых только одна обладает правильной биспецифической структурой. Очистка соответствующей молекулы, которая обычно осуществляется с помощью аффинной хроматографии, достаточно трудоемка и выход продукта при этом низок. Аналогичные методики описаны в патенте WO 93/08829 и в работе Traunecker et al., EMBO J., 10: 3655-3659 (1991).
Согласно различным подходам, происходит слияние вариабельных областей антитела, характеризующегося определенными связывающими специфичностями (антитепо-антигенсвязывающий центр) с последовательностями константной области иммуноглобулина. Преимущественно слияние происхоит с константной областью тяжелой цепи иммуноглобулина, включающей, по крайней мере, шарнирную СН2 и СН3 области. Предпочтительно, чтобы первая константная область тяжелой цепи (СН1), содержащая центр, необходимый для связывания легкой цепи, присутствовала, по крайней мере, при одном слиянии. ДНК-ты, кодирующие слияния тяжелой цепи иммуноглобулина и, если требуется, легкой цепи иммуноглобулина, вставляются в отдельные экспрессирующе вектора и котрансфектируются в подходящий организм хозяина. Это обеспечивает высокую жесткость в регулировании взаимных соотношений трех полипептидных фрагментов в случае, когда неравные соотношения трех полипептидных цепей, используемых в конструкции, дают оптимальные выходы. Однако, возможно вставить кодирующие последовательности двух или всех трех полипептидных цепей в один экспрессирующий вектор, когда экспрессия, по крайней мере, двух полипептидных цепей, взятых в равных соотношениях, приводит к высоким выходам или когда соотношения не имеют особого значения.
В предпочтительном варианте одно плечо биспецифического антитела составлено из гибридной тяжелой цепи иммуноглобулина с первоначальной связывающей специфичностью и второе плечо - из гибридной пары тяжелой - легкой цепи иммуноглобулина (обеспечивая вторичную связывающую специфичность). Найдено, что эта асимметрическая структура облегчает отделение соответствующего биспецифического соединения от ненужных комбинаций цепей иммуноглобулина, поскольку присутствие легкой цепи иммуноглобулина только в одной части бислецифической молекулы обеспечивает удобный способ отделения. Этот подход предложен в WO 94/04690 published March 3, 1994. Более детальное описание получения биспецифических антител см. например, Suresh et al., Methods in Enzymology, 121:210 (1986).
Биспецифические антитела включают перекрестносшитые или "гетероконъюгированные" антитела. Например, одно из антител в гетероконъюгате может соединяться с авидином, другое - с биотином. Такие антитела, например, были предложены для клеток-мишеней иммунной системы для ненужных (лишних) клеток (U.S. Patent No. 4676980) и для лечения ВИЧ инфекции (WO 91/00360, WO 92/200373). Гетероконъюгированные антитела можно получить с применением любых удобных перекрестносшивающих методов. Подходящие перекрестносшивающие агенты наряду с методиками перекрестного сшивания хорошо известны и описаны в US Patent No. 467980,.
Способы получения биспецифических антител из фрагментов антитела также были описаны в литературе. Следующие способы можно также использовать для продуцирования фрагментов двухвалентного антитела, которые необязательно являются биспецифическими. Например, Fab' фрагменты, полученные из E.coli, можно химически связывать in vitro с образованием двухвалентных антител, (см. Shalaby et al., J. Exp. Med., 175: 217-225 (1992)).
Были также описаны различные способы получения и выделения фрагментов двухвалентных антител непосредственно из рекомбинантной клеточной культуры. Например, двухвалентные гетеродимеры были получены с использованим связывания лейцином (Kostelny et al., J. Immunol. 148 (5): 1547-1553 (1992). Лейцинсвязанные пептиды из Fos и Jun протеинов присоединяли к Fab' частям двух различных антител при слиянии гена. Гомодимеры антитела восстанавливали в шарнирной области с образованием мономеров и затем заново окисляли с образованием гетеродимеров антитела. Технология "диатела", описанная в работе Hollinger et al., Proc. Natl. Acad. Sci. USA, 90: 6444-6448 (1993), обеспечивает альтернативный механизм получения фрагментов биспецифического/двухвалентного антитела. Фрагменты включают вариабельную область тяжелой цепи (VH), связанную с вариабельной областью легкой цепи (VL), с помощью линкера, который слишком мал, чтобы допустить соединение двух областей на одной и той же цепи. Таким образом, VH и VL области одного фрагмента принудительно соединяют с комплементарными (гипервариабельными) VH и VL областями другого фрагмента, тем самым образуя два антигенсвязывающих центра. Также сообщалось о другой стратегии получения фрагментов биспецифического/двухвалентного антитела с использованием Fv(sFv) димеров одной цепи (см. Grubere et al., J. Immunol., 152: 5368 (1994)).
Б. Получение лиофилизированной композиции
После получения нужного протеина, как описано выше, получают "прелиофилизированную композицию". Количество протеина, присутствующего в композиции до лиофилизации определяют, принимая во внимание объемы требуемой дозы, способ(ы) введения и т.д.. Если выбранный протеин является интактным (неповрежденным) антителом (как, например, анти-IgE или анти-HER2 антитело), типичной начальной концентрацией протеина является концентрация от ~2 мг/мл до ~50 мг/мл (предпочтительно от ~5 мг/мл до 40 мг/мл) и наиболее предпочтительно от ~20-30 мг/мл. Протеин обычно присутствует в растворе. Например, протеин может присутствовать в буферном растворе с определенным рН - рН~4-8, предпочтительно рН от 5 до 7. Типичными буферами являются гистидиновый, фосфатный буфер, трис, цитратный, сукцинатный буфер и буферы, содержащие другие органические кислоты. Концентрация буфера может составлять от 1 mM до ~20 mM, или от 3 mM до 15 mM, в зависимости, например, от буфера и необходимой изотоничности композиции (например, действующая (разбавленная) композиция). Предпочтительным буфером является гистидиновый буфер, поскольку, как будет показано ниже, он обладает лиопротекторными свойствами, Показано, что другим пригодным буфером является сукцинатный буфер.
Лиопротектор добавляют к композиции до лиофилизации. В предпочтительных вариантах лиопротектор представляет собой невосстанавливающий углевод, например, сахарозу или трегалозу. Количество лиопротектора в композиции до лиофилизации обычно является таким, чтобы при разбавлении полученная композиция была бы изотонической. Однако, могут быть пригодны также и гипертонические действующие композиции. Кроме того, количество лиопротектора не должно быть слишком малым, поскольку недостаточное количество его приводит к деградации/агрегации протеина при лиофилизации. Если лиопротектором является углевод (например, сахароза или трегалоза), а протеином - антитело, то типичные концентрации лиопротектора в композиции до лиофилизации составляют от ~10 mM до ~400 mM и предпочтительно от -30 mM до ~300 mM, и наиболее предпочтительно от ~50 mM до ~100 mM.
Отношение протеина к лиопротектору выбирают для каждой комбинации протеина и лиопротектора. В случае, если протеин выбирают из антитела и лиопротектор для получения изотонической действующей композиции с высокой концентрацией протеина выбирают из углевода (например, сахарозы или трегалозы), то молярное отношение лиопротектора к антителу может составлять от ~100 до ~1500 молей лиопротектора на 1 моль антитела и предпочтительно от ~200 до ~1000 молей лиопротектора на 1 моль антитела, например от ~200 до ~600 молей лиопротектора на 1 моль антитела.
В предпочтительных вариантах изобретения к композиции до лиофилизации предлагается добавлять поверхностно-активное вещество. Наоборот, или кроме того, поверхностно-активное вещество можно добавлять к лиофилизированной композиции и/или к действующей композиции. Типичными поверхностно-активными веществами являются неионные поверхностно-активные вещества, как например, полисорбаты (например, полисорбаты 20 или 80); полоксамеры (например, полоксамер 188); тритон; додецилсульфат натрия (sodium dodecyl sulfate, SDS); лаурилсульфат натрия; октилгликозид натрия; лаурил-, муристил-, линолеил- или стеарилсульфобетаин; лаурил; муристил; линолеил- или стеарилсаркозин; линолеил-, муристил- или цетилбетаин; лауроамидопропил-, кокамидопропил-, линоламидопропил-, муристамидопропил-; -палмидопропил- или изостеарамидопропилбетаин (например, лауроамидопропил); муристамидопропил-, палмидопропил- или изостеарамидопропилдиметиламин; метилкокоил натрия и двунатриевая соль метилолеилтаурата и MONAQUAT™ - серии (Mona Industries, Inc., Paterson, New Jersey), полиэтиленгликоль, полипропиленгликоль и сополимеры этилена и пропиленгликоля (например, плуроники (Pluronics, PF68 и т.д.). Количество добавленного поверхностно-активного вещества является таким, которое уменьшает агрегацию протеина в действующей композиции и доводит до минимума образование частиц после получения действующей композиции (после разбавления). Например, поверхностно-активное вещество может присутствовать в композиции до лиофилизации в количестве от ~0,001 до 0,5%. и предпочтительно от 0,005 до 0,05%.
В некоторых вариантах изобретения при получении композиции до лиофилизации используется смесь лиопротектора (например, сахарозы или трегалозы) и наполнителя (например, маннита или глицина). Наполнитель позволяет получать однородную лиофилизированную массу без излишних затрат для этого и т.д.
В композиции до лиофилизации (и/или в лиофилизированные и/или в действующие (разбавленные) композиции) могут включаться другие фармацевтически приемлемые носители, наполнители или стабилизаторы, как например, описанные в Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980), при условии, что они не оказывают вредного воздействия на требуемые характеристики композиции. Приемлемые носители, наполнители или стабилизаторы являются нетоксичными для реципиентов в применяемых дозах и концентрациях и включают: дополнительные, создающие буфер, агенты; консерванты; сорастворители; антиоксиданты, включая аскорбиновую кислоту и метионин; хелатирующе агенты, как например, EDTA; комплексы металлов (например, Zn-протеиновые комплексы); биодеградирующие полимеры, например, полиэфиры; и/или соль-образующие противоионы, например, натрий.
Композиция, описанная в настоящем изобретении, может содержать также более одного протеина, когда такая композиция требуется при особом показании при лечении, предпочтительно с дополнительными активностями, которые не воздействуют отрицательно на другой протеин. Например, может стать целесообразным использовать два или несколько антител, которые в единой композиции соединяются с HER2 рецептором или IgE. Кроме того, в одну композицию могут объединяться анти-HER2 и анти-VEGF антитела. Такие протеины соответственно присутствуют в композиции в количествах, которые эффективны для предназначенной цели.
Композиции, предусмотренные для введения in vivo, должны быть стерильны. Это легко достигается фильтрацией через стерильные фильтрационные мембраны, до или вслед за лиофилизацией и разбавлением (созданием действующей композиции). Кроме того, стерильность всей смеси может достигаться автоклавированием составных частей, за исключением протеина, например, при температуре ~120°С в течение 30 минут.
После смешивания протеина, лиопротектора и других возможных компонентов, композицию лиофилизировали. Для этих целей имеется много разных способных осуществить сушку при низких температурах агентов, например, Hull50™ (Hull, USA) или GT 20™ (Leybold-Heraeus, Germany). Лиофилизация достигается вымораживанием композиции и последующим сублимированием льда из замороженного содержимого при температуре, подходящей для первичной сушки. В этих условиях температура продукта ниже эвтектической точки или температуры разрушения композиции. Обычно температура выдерживания для первичной сушки составляет от -30 до 25°С (при условии, что продукт остается замороженным при первичной сушке) при соответствующем давлении, изменяющемся обычно от 50 до 250 млторр. Композиция, размер и тип контейнера, содержащего образец, (например, стеклянный пузырек) и объем жидкости главным образом определяют время, необходмое для высушивания, которое может варьироваться от нескольких часов до нескольких дней (например, 40-60 часов). Вторичную сушку можно проводить в температурном интервале 0-40°С, прежде всего в зависимости от типа и размера контейнера и типа применяемого протеина. Однако найдено, что вторичная сушка необязательна. Например температура выдерживания для полного удаления воды при лиофилизации может составлять 15-30°С (например, около 20°С). Время и давление, требуемые для вторичной сушки, должны быть такими, чтобы можно было получить соответствующую лиофилизированную массу, зависящую, например, от температуры и других параметров. Время вторичной сушки определяется уровнем требуемой остаточной влаги в продукте и обычно для этого требуется, по крайней мере, 5 часов (например, 10-15 часов). Давление может быть таким же как при первичной сушке. Условия лиофилизации могут изменяться в зависимости от композиции и размера пузырька.
8 некоторых случаях желательно лиофилизировать протеиновую композицию в контейнере, в котором проводят получение действующей (разбавленной) композиции для того, чтобы избежать стадию переноса. Контейнером в этом случае может быть, например, пузырек с объемом 3, 5, 10, 20, 50 или 100 см3.
Как правило, лиофилизация приведет к лиофилизированной композиции, в которой содержание влаги составляет менее 5% и предпочтительно менее 3%.
С. Разбавление лиофилизированной композиции
(получение действующей композиции)
В определенный период, обычно, когда наступает время для введения протеина пациенту, лиофилизированную композицию можно разбавить растворителем так, чтобы концентрация протеина в действующей композиции составила, по крайней мере, 50 мг/мл, например, от ~50 мг/мл до ~400 мг/мл, более предпочтительно от 80 мг/мл до 300 мг/мл и наиболее предпочтительно от 90 мг/мл до 150 мг/мл. Считают, то такие высокие концентрации протеина в действующей композиции особенно необходимы, когда действующая композиция предназначена для подкожного введения. Однако, для других путей введения, например, внутривенного введения, могут требоваться более низкие концентрации протеина в действующей композиции (например, от ~5 до 50 мг/мл, или от 10 до 40 мг/мл протеина в действующей композиции). В некоторых вариантах концентрация протеина в действующей композиции значительно выше, чем концентрация протеина в композиции до лиофилизации. Например, концентрация протеина в действующей (разбавленной) композиции может быть в 2-40 раз, предпочтительно в 3-10 раз и наиболее предпочтительно в 3-6 раз выше (например, по крайней мере, трехкратной или четырехкратной), по сравнению с композицией до лиофилизации.
Создание действующей композиции имеет место при температуре около 25°С, обеспечивая полную гидратацию, хотя могут в качестве подходящих применяться и другие температуры. Время, требуемое для создания действующей (для разбавления) композиции, будет зависеть, например, от типа растворителя, количества наполнителя(ей) и протеина. Типичными растворителями являются стерильная вода, бактериостатическая вода для инъекций (BWFI), буферный раствор с определенным рН (например, забуференный фосфатом физиологический раствор), стерильный физиологический раствор, раствор Рингера или раствор декстрозы. Растворитель обычно содержит консервант. Типичными консервантами, о которых сообщалось выше, являются ароматические спирты, из которых предпочтительными являются бензиловый спирт или фенол. Количество применяемого консерванта определяется в результате проверки различных концентраций консервантов на совместимость с протеином и проверки эффективности консервантов. Например, если консервант представляет собой ароматический спирт (например, бензиловый спирт), он может присутствовать в количестве от ~0,1 до 2,0% и предпочтительно от 0,5 до 1,5%, но наиболее предпочтительно от 1,0 до 1,2%.
Предпочтительно, чтобы действующая композиция имела менее 6000 частиц, размер которых составляет ≥10 мкм, в пузырьке.
Г. Введение действующей композиции
Действующая композиция назначается млекопитающим, которым необходимо проводить лечение протеином, предпочтительно она назначается человеку в соответствии с известными методами, например, внутривенным введением, введением в виде болюса или непрерывной инфузией в течение определенного периода времени, внутримышечно, внутрибрюшинно, внутриспинномозговым введением, подкожно, интраартикулярно внутрисуставно, подоболочечно (внутриоболочечно), оральным, локальным или ингаляционными способами.
В предпочтительных вариантах действующую композицию вводят млекопитающим подкожно (т.е. под кожу). Для этих целей композицию можно вводить, используя шприц. Однако, приемлемы и другие приспособления для введения композиции, например, инъекционные устройства (например, устройства Inject-ease™ и Genject™); инжекторные ручки (например, GenPen™); безигольчатые устройства (например, Medijector™ и Biojector™) и подкожные "очажковые" системы доставки.
Соответствующая доза ("терапевтически эффективное количество") протеина будет зависеть, например, от условий лечения, тяжести заболевания и курса лечения, назначается ли протеин для профилактических или терапевтических целей, предварительного лечения, клинического состояния человека и чувствительности к протеину, типа используемого протеина и осторожности лечащего врача. Протеин можно назначать пациентам один раз или в течение курса лечения и его можно вводить в любое время после установления диагноза. Протеин можно назначать в качестве единственного лечения или в сочетании с другими препаратами или терапиями, необходимыми для лечения рассматриваемых состояний.
Если выбранным протеином является антитело, первоначальная пробная доза для введения пациенту составляет от 0,1 до 20 мг/кг, или например, одним или несколькими отдельными введениями. Однако, могут быть пригодны и другие дозы. Прогресс этой терапии легко контролируется обычными методами.
В случае анти-HER2 антитела терапевтически эффективное количество антитела можно назначать при лечении или профилактике рака, характеризующего сверхсинтезом HER2 рецептора. Предполагают, что действующую композицию анти-HER2 антитела можно использовать при лечении рака молочной железы, яичников, желудка, внутриматочного рака, рака слюнных желез, легкого, почки, толстого кишеника и/или мочевого пузыря. Например, анти-HER2 антитело можно использовать для лечения проточной карциномы in situ (ductal carcinoma in situ, DCIS). Типичные дозы анти-HER2 антитела находятся в пределах от 1 до 10 мг/кг при одном или нескольких отдельных введений.
Назначения анти-IgE композиций используются при лечении или профилактике, например, аллергических заболеваний, вызванных IgE, паразитических инфекций, промежуточного цистита и астмы. В зависимости от заболевания или расстройства, которое подвергается лечению, пациенту назначают терапевтически эффективное количество (например, от 1 до 15 мг/кг) анти-IgE антитела.
Д. Готовый продукт
Другой вариант изобретения обеспечивает готовый продукт, который содержит лиофилизированную композицию и обеспечивается инструкциями для ее получения и/или применения. Готовый продукт включает контейнер. Подходящими контейнерами являются, например, флакон, пузырек (например, двухкамерные пузырьки), шприцы (например, двухкамерные шприцы) и пробирки. Контейнеры можно изготавливать из различных материалов, например, стекла или пластмассы. Контейнер содержит лиофилизированную композицию и этикетку (наклейку) на контейнере, или связанную с контейнером, может включать правила получения действующей композиции и/или использования. Например, на этикетке (наклейке) может указываться, что лиофилизированную композицию разбавляют до концентраций протеина, о которых сообщалось выше. Кроме того, на этикетке может указываться, что композиция пригодна или предназначена для подкожного введения. Контейнер, содержащий композицию, может быть пузырьком многократного использования, который позволяет повторные введения (например, от 2 до 6 введений) разбавленной (действующей) композиции. Готовый продукт может, кроме того, включать второй контейнер, содержащий подходящий растворитель (например, BWFI). При смешивании растворителя и лиофилизированной композиции, конечная концентрация протеина в разбавленной композиции должна обычно составлять, по крайней мере, 50 мг/мл. Готовый продукт может, кроме того, включать другие материалы, необходимые с коммерческой и точки зрения пользователя, включая другие буферные растворы, растворители, фильтры, иголки, шприцы и упаковочные вкладочные листы с инструкциями применения.
Изобретение можно более полно осмыслить с помощью ссылок на следующие примеры. Их, однако, нельзя истолковывать, как ограничивающие объем изобретения. Вся цитируемая литература включена в виде ссылок.
Пример 1
Анти-HER2 композиция
Сверхсинтез продукта (p185HER2) HER2 протоонкогена был связан с целым рядом опасных злокачествнных новообразований человека. Относящиеся к мышам или крысам моноклональные антитела, известные как muMAb4D5, направлены к внеклеточной области (extra-cellular domain, ECD) p185HER2. Молекула muMAb4D5 была облагорожена с целью улучшения ее клинической эффективности путем уменьшения иммуногенности и обеспечения поддержки эффекторных функций человека (см. WO 92/22653). Этот пример описывает создание лиофилизированной композиции, включающей облагороженное антитело huMAb4D5-8 полной длины, приведенное в WO 92/22653.
Для создания лиофилизированной композиции первоначально проводили скрининг наполнителей и буферных растворов, оценивая стабильность протеина после лиофилизации и получения действующей (разбавленной) композиции. Лиофилизированный протеин в каждой композиции также подвергают исследованиям на ускоренное старение, чтобы определить потенциальную способность протеина выдерживать его срок годности. Эти исследования по ускоренному старению обычно проводят при температурах выше предложенных для хранения, и данные затем используют для вычисления энергии активации реакций деградации (распада), используя кинетические закономерности Аррениуса (Cleland et al., Critical Reviews in Therapeutic Drug Carrier Systems 10(4): 307-377 (1993)). Энергия активации используется далее для вычисления предполагаемого срока годности протеиновой композиции для предложенных условий хранения.
В более ранних работах по скринингу изучали стабильность нескольких лиофилизированных композиций рекомбинантных облагороженных анти-HER2 антител (rhuMAbHER2) после выдерживания их при 5°С (предложенное условие хранения) и 40°С (условия ускоренного старения). Наблюдалось, что в жидком состоянии rhuMAbHER2 разрушается путем деамидирования (30 Asn легкой цепи) и образования изоспартата через циклическое имидное производное - сукцинимид (102 Asp тяжелой цепи). Деамидирование минимально при рН 5,0, приводящее к распаду, главным образом, до сукцинимида. При рН 6,0 в жидкой протеиновой композиции наблюдалось несколько более сильное диамидирование. Поэтому лиофилизированные композиции изучали в
а) 5 или 10 mM сукцинатном буферном растворе с рН 5,0 или
б) 5 или 10 mM гистидиновом буферном растворе с рН 6,0.
Оба буферных раствора содержали поверхностно-активное вещество - полисорбат 20 (твин 20™, Tween 20™), которое применяли для уменьшения возможности агрегации действующей (разбавленной) протеиновой композиции и чтобы свести к минимуму образование частиц после разбавления композиции. Эти буферные растворы использовали с различными углеводами и без них. Концентрация протеина в композиции с буферным раствором составляла 5,0; 21,0 или 25,0 мг/мл. Эти композиции далее лиофилизировали и проверяли протеин на стабильность после двух недель выдерживания при 5°С и 40°С. В установке для лиофилизации пузырьки охлаждали при температуре выдерживания -55°С в течение примерно 5 часов, за которым следовала первичная сушка при температуре выдерживания 5°С или 5 мторр в течение 30 часов; и высушивание до 1-2% содержания остаточной влаги достигалось вторичной сушкой при температуре выдерживания 20°С в течение 10 часов. Основной путь распада данного протеина при лиофилизации заключался в агрегации, и поэтому стабильность протеина проверяли с помощью гель-хроматографии, чтобы определить выход (содержание) интактного нативного протеина (% интактного протеина приведен ниже в табл.2).
Стабилизирующие влияния различных лиопротекторных углеводов на лиофилиэированный протеин определяли в 10 mM сукцината натрия с рН 5,0 (табл.2). При высоких концентрациях углеводов (250-275 mM) низкой концентрации протеина (5,0 мг/мл), трегалоза и лактоза стабилизировали протеин от агрегации при лиофилизации протеина, который хранили в течении 2 недель при 40°С. Однако, отмечали, что лактоза - восстанавливающий углевод, реагирует с протеином при более длительном сроке хранения при 40°С. Композиции при концентрации протеина 5,0 мг/мл, содержащие сорбит или маннит, давали агрегированный протеин после хранения при 40°С в течение двух недель. При более высокой концентрации протеина (21,0 мг/мл), композиции, содержащие маннит или маннит вместе с сорбитом или глицином, в обоих случаях, содержали агрегированный протеин после лиофилизации и хранения. Наоборот, в обоих случаях хранения, трегалоза и сахароза препятствовали агрегации.
Композиции с содержанием 250 mM трегалозы и 250 mM лактозы проверяли на стабильность в течение длительного срока. После хранения в течение 9 месяцев при 40°С или 12 месяцев при 5°С для композиции с трегалозой не наблюдалось изменения в % интактного протеина. Для композиции с лактозой % интактного протеина оставался постоянным (соответствовал начальному) после 3 месяцев хранения при 40°С или 6 месяцев при 25°С. Композицию, содержащую трегалозу, можно хранить при контролируемой комнатной тепературе (15-30°С) в течение 2 лет без значительного изменения % интактного протеина.
Композиция с маннитом в присутствии 10 mM гистидинового буфера с рН 6,0 содержала меньше агрегированного протеина при хранении при 40°С в течение 2 недель, чем композиция с маннитом в присутствии 10 mM сукцинатного буфера с рН 5,0. Этот результат можно объяснить некоторым стабилизирующим эффектом, обусловленным гистидином. При хранении при 40°С в течение 2 недель наблюдалась, однако, значительная агрегация композиций самого гистидина или с гистидином/маннитом. Добавка равного количества сахарозы к манниту (концентрация каждого 10 мг/мл) в гистидинобой композиции стабилизировала протеин от агрегации в обоих случаях хранения. Использование глицина с маннитом не улучшало стабильности протеина, в то время как сахароза/глициновая композиция обеспечивала ту же стабильность, что и композиция сахароза/маннит. Эти результаты, кроме того, означали, что сахароза пригодна для предупреждения агрегации лиофилизированного протеина при хранении.
ин] б) (мг/мл)
Введение высоких концентраций протеина часто требуется при подкожном введении вследствие ограничений объемов (≤1,5 мл) и требуемых доз (≥100 мг). Однако, в производственном процессе часто трудно достигнуть высоких концентраций протеина (≥50 мг/мл), так как при высоких концентрациях протеин способен агрегировать при переработке и с ним становится трудно обращаться (например, перекачивать) и проводить стерилизацию фильтрацией. Наоборот, процесс лиофилизации может обеспечить способ, позволяющий концентрирование протеина. Например, протеином заполняются пузырьки с объмом (Vf) и затем лиофилизируются. Лиофилизированный протеин затем разбавляется меньшим объемом (Vr) воды или консерванта (например, BWFI), чем первоначальный объем (например, Vr=0,25Vf), приводя к более высокой концентрации протеина в полученном (разбавленном) растворе. Этот процесс также приводит к концентрированию буферных растворов и наполнителей. Желательно, чтобы раствор для подкожного введения являлся изотоническим.
Количество трегалозы в лиофилизированном rhuMAbHER2 уменьшали для получения изотонического раствора при разбавлении с концентрацией протеина 100 мг/мл. Стабилирующее влияние трегалозы определяли как функцию концентрации для 5 mM сукцината натрия с рН 5,0 и 5 mM гистидина с рН 6,0 при концентрации протеина 25,0 мг/мл (табл.3). При концентрациях трегалозы от 60 до 200 mM не происходило значительной агрегации после выдерживания лиофилизированного протеина в течение 4 недель при 40°С. Эти композиции разбавляли 20 мл бактериостатической воды для инъекций (BWFI, USP, 0,9% бензиловый спирт). Разбавление композиции, содержащей 50 mM трегалозы (5 mM сукцината натрия), 4 мл BWFI (концентрация протеина 100 мг/мл) после выдерживания в течение 4 недель при 40°С приводило к небольшому увеличению агрегации. Законсервированная действующая (разбавленная) композиция имела преимущество в возможности многократного извлечения содержимого из одного и того же пузырька без нарушения стерильности. При использовании стерильных игл эти композиции можно применять для введения нескольких доз из одного пузырька.
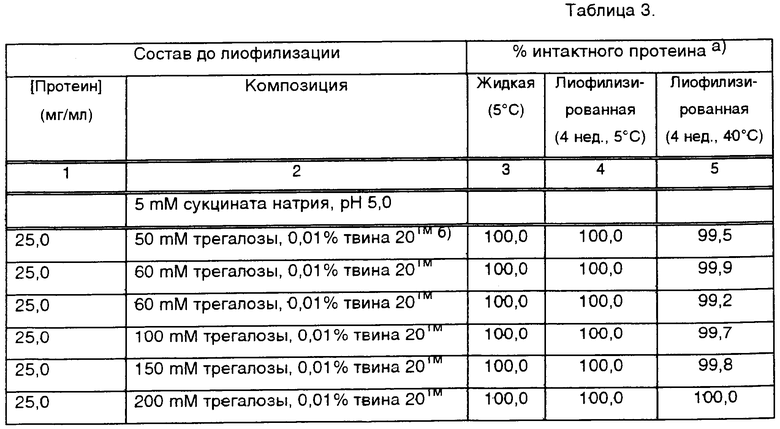
В настоящее время rhuMAв HER2 находится е процессе исследования в качестве терапевтического средства для лечения рака молочной железы. Протеин вводят пациентам еженедельно в количестве 2 мг/кг. Так как средний вес таких пациентов составляет ~65 кг, средняя недельная доза - 130 мг rhuMA в HER2. При подкожном введении хорошо переносятся инъекционные объемы в 1,5 мл или менее и поэтому концентрация протеина для еженедельного подкожного введения rhuMAв HER2 может составить приблизительно 100 мг/мл (130 мг средней дозы / 1,5 мл). Как упоминалось выше, такую высокую концентрацию протеина трудно получить и сохранить в стабильной форме. Для достижения этой высокой концентрации протеина rhuMA в HER2, содержащееся в: (а) 5 mM сукцината натрия с рН 5,0 или (б) 5 mM гистидина с рН 6,0 лиофилизировали при концентрации протеина 25 мг/мл в 60 mM трегалозы, 0,01% твина 20™. Лиофилизацию проводили путем заполнения пузырька объемом 50 см3, 18 мл протеиновой композиции. В установке для лиофилизации пузырька охлаждали при температуре выдерживания -55°С в течение примерно 5 часов, за которым следовала первичная сушка при температуре выдерживания 5°С и 150 мторр в течение 30 часов и высушивание до 1-2% остаточной влаги достигалось вторичной сушкой при температуре выдерживания 20°С в течение 10 часов. Термопары, помещенные в пузырьки, содержащие плацебо (композиция без протеина), показали, что продукт в пузырьках выдерживался при температуре ниже -10°С на протяжении всей первичной сушки. Применение уплотняющего устройства во время лиофилизации обнаружило, что остаточная влажность после первичной сушки обычно менее 10%. Лиофилизированный протеин далее разбавляли или 4 или 20 мл BWFI (0,9 или 1,1% бензиловый спирт), получая концентрированные растворы протеина:
а) 4 мл: 102 мг/мл rhuMAs HER2, 245 mM трегалозы, 21 mM сукцината натрия с рН 5,0 или 21 mM гистидина с рН 6,0, 0,04% твина 20™;
б) 20 мл: 22 мг/мл rhuMA в HER2, 52 mM трегалозы, 4 mM сукцината натрия с рН 5,0 или 4 mM гистидина с рН 6,0, 0,009% твина 20™.
При хранении лиофилизированных композиций в течение 4 недель при 40°С и разбавления до 22 мг/мл протеина количество агрегированного протеина, по-видимому, немного увеличивалось при уменьшении концентрации трегалозы. Стабильность лиофилизированного протеина не зависела от объема разбавления. Как показано на фиг.1, количество интактного протеина после выдерживания лиофилизированного протеина при 40°С было таким же, как для композиции с 60 mM трегалозы, 5 mM сукцината натрия с рН 5,0, 0,01% твина 20™, разбавленной 4 или 20 мл BWFI.
Результаты, приведенные в табл.3, наводят на мысль, что может наблюдаться зависимость между концентрацией трегалозы и стабильностью протеина. Для дальнейшей оценки этой зависимости композиции, содержащие различные концентрации трегалозы, растворенные или в сукцинате натрия, или в гистидиновом буфере, выдерживали в течение 91 дня при 40°С. Стабильность далее определяли как функцию молярного соотношения трегалозы к протеину для каждой концентрации трегалозы. Как показано на фиг.2, стабильность протеина несомненно снижается при уменьшении концентрации трегалозы для обоих композиций. Не существовало явного различия между двумя буферными растворами - сукцинатом и гистидином; в этих композициях предполагалось, что первичным стабилизатором е данных условиях является трегалоза. Кроме того, наблюдаемое уменьшение интактного протеина в двух данных композициях будет иметь место даже при низкой концентрации трегалозы для композиции, которую хранят при 2-8°С на протяжении всего срока годности. Однако, если требуется стабильность при контролируемой комнатной температуре (максимальная температура 30°С) необходимы более высокие концентрации трегалозы (отношение трегалоза : протеин ≥600:1) в зависимости от требований к стабильности продукта (т.е. требование к количеству интактного протеина, оставшегося после хранения в течение 2 лет). Обычно условия хранения при контролируемой комнатной температуре требуют стабильности в течение 6 месяцев при 40°С, что эквивалентно хранению при 30°С в течение 2 лет.
Как показано на фиг.3, композиция, содержащая 250 mM трегалозы, не изменялась после 6 месяцев хранения при 40°С, в то время как обе композиции, содержащие 60 mM трегалозы, были менее стабильными. Композиции, содержащие 60 mM трегалозы, должны храниться в холодном месте, чтобы к концу срока годности продукта содержание интактного протеина, согласно техническим уровням, составляло, например, >98% по данным гель-хроматографии.
Предварительный скрининг показал, что сахароза также препятствовала агрегации rhuMAв HER2 после лиофилизации и последующего хранения. Для достижения изотоничности растворов после разбавления, предназначенных для подкожного введения (примерно четырехкратное увеличение концентрации компонентов протеина в композиции), концентрация сахарозы в них должна быть значительно снижена. Равные весовые концентрации сахарозы и маннита (наполнитель), используемые при скрининге, препятствовали агрегации протеина. Для возможной подкожной rhuMAв HER2 композиции выбирали более низкую концентрацию сахарозы и маннита (равные весовые концентрации). Раствор протеина (25 мг/мл протеина, 5 mM гистидина с рН 6,0, 38,4 mM (7 мг/мл) маннита, 20,4 mM (7 мг/мл) сахарозы, 0,01% твина 20™) лиофилизировали таким же способом, как композицию, содержащую 60 mM трегалозы, за исключением того, что цикл первичной сушки был продлен до 54 часов. После 4 недель хранения при 40°С наблюдалось небольшое увеличение количества агрегатов после разбавления 4,0 или 20,0 мл BWFI (табл.3). Количество агрегированного протеина было таким же, как и для действующей (разбавленной) композиции с концентрацией протеина 22 или 100 мг/мл (фиг.4). Подобно композициям, содержащим 60 mM трегалозы, композиция, содержащая маннит/сахарозу, давала меньше интактного протеина во времени при 40°С. Молярное отношение сахарозы к протеину для данной композиции составляло 120:1, показывая, что комбинация маннит/сахароза может быть более эффективной, чем одна трегалоза при том же молярном соотношении стабилизирующего углевода (фиг.2 и 4).
В предыдущих примерах стабильность лиофилизированных rhuMAв HER2 композиций определяли как функцию температуры. Данные исследования показали, что композиции, содержащие трегалозу и маннит/сахарозу, препятствовали разрушению протеина в лиофилизированном состоянии при высокой температуре (40°С). Однако, эти эксперименты не относились к стабильности протеина после разбавления и хранения. Однажды разбавленные с помощью BWFI лиофилизированные rhuMAв HER2 композиции могут использоваться для нескольких введений препарата. В частности, пузырек, содержащий (450 мг rhuMAв HER2) предназначался для обеспечения трех доз для среднего пациента (130 мг rhuMAв HER2 для одной дозы). Поскольку препарат вводят еженедельно, пузырек можно хранить, по крайней мере, три недели после разбавления. Чтобы убедиться в том, что rhuМАвНЕР2 оставалось стабильным после разбавления, исследования по стабильности действующих (разбавленных) rhuMAв HER2 композиций проводили при 5°С и 25°С.
Для подкожного введения композиции разбавляли до концентрации протеина 100 мг/мл (4 мл BWFI). При этой высокой концентрации протеин может быть более чувствителен к агрегации, чем формы для внутривенного введения, которые разбавляли до концентрации протеина 22 мг/мл (20 мл BWFI). Четыре rhuMAв HER2 композиции из предыдущего примера оценивали на предмет агрегации (потеря интактного протеина). Как показано в таблицах 4-6, не наблюдалось различий в стабильности композиций, разбавленных до концентрации протеина 22 и 100 мг/мл. Кроме того, эти композиции сохраняли протеин полностью интактным вплоть до 90 дней хранения при 5°С и 30 дней при 25°С, показывая, что разбавленные протеиновые композиции можно хранить в холодном месте, по крайней мере, 90 дней. В отличие от стабильности лиофилизированного протеина, рассмотренного в предыдущем примере, концентрация трегалозы в композиции не влияла на стабильность протеина, (табл.7)
Образцы разбавляли 4,0 или 20,0 мл BWFI (содержащей 1,1% или 0,9% бензилового спирта), и далее хранили при 5°С или 25°С. Интактный протеин (в %) определяли как долю площади нативного пика, измеренной с помощью гель-хроматографии. Не опред. - не определялось.
Образцы разбавляли 4,0 или 20,0 мл BWFI (содержащей 1,1% или 0,9% бензилового спирта), и далее хранили при 5°С или 25°С. Интактный протеин (в %) определяли как долю площади нативного пика, измеренной с помощью гель-хроматографии. Не опред. - не определялось.
Образцы разбавляли 4,0 или 20,0 мл BWFI (содержащей 1,1% или 0,9% бензилового спирта), и далее хранили при 5°С или 25°С. Интактный протеин (в %) определяли как долю площади нативного пика, измеренной с помощью гель-хроматографии. Не опред. - не определялось.
Образцы разбавляли 4,0 или 20,0 мл BWFI (содержащей 1,1% или 0,9% бензилового спирта), и далее хранили при 5°С или 25°С. Интактный протеин (в %) определяли как долю площади нативного пика, измеренной с помощью гель-хроматографии. Не опред. - не определялось.
Как упоминалось выше, главным маршрутом деградации (разрушения) rhuMAв HER2 в водных растворах является деамидирование или образование сукцинимида. Потеря нативного протеина вследствие деамидирования или образования сукцинимида оценивалась для четырех действующих rhuMAв HER2 композиций.
Анализ деамидирования rhuMAв HER2 и образования суцкинимида проводили с использованием катионообменной хроматографи. Колонка Bakerbond Wide-Pore Carboxy Sulfon (CSX) (4,6×250 мм) работала при скорости потока 1 мл/мин. Буферными растворами для подвижной фазы являлись: (А) 0,02 М фосфат натрия, рН 6,9 и (Б) 0,02 М фосфат натрия, рН 6,9, 0,2 М NaCl. Хроматографию далее проводили при 40°С следующим образом:
Элюируемый пик детектировали при 214 нм, для каждого анализа брали 75 мкг протеина.
Снова не наблюдалось различий 6 стабильности композиций, разбавленных до 22 и 100 мг/мл протеина (фиг.5-7). Деградация (разрушение) протеина для каждой композиции протекала с более высокой скоростью при 25°С, чем при 5°С, и скорость деградации для всех композиций, хранящихся при 5°С, была сравнимой. Композиции, содержащие гистидин, характеризовались несколько большей скоростью деградации при 25°С, чем композиции, содержащие сукцинат. Количество трегалозы в композиции не влияло на скорость деградаци при любой температуре (фиг.5 и 8). Эти результаты показывали, что для предполагаемого периода использования (30 дней после разбавления BWFI) данные четыре композиции имеют приемлемую скорость деградации в условиях хранения в холодном месте (5°С).
Композиции многократного использования при применении их в США должны пройти проверку на консервирующую эффективность согласно фармакопеи США (US Pharmacopeia, USP). Лиофилизированную rhuMAв HER2 композицию, содержащую 25 мг/мл протеина, 5 mM гистидина, рН 6,0, 60 mM трегалозы, 0,01% тайна 20™, разбавляли 20 мл бензилового спирта, концентрации которого составляли от 0,9 до 1,5% (масс.). При концентрациях 1,3% (масс.) или выше разбавленный раствор становился мутным после выдерживания в течение ночи при комнатной температуре (~25°С). Разбавление стандартным BWFI раствором (0,9% бензиловым спиртом) приводило к раствору, который не всегда не проходил проверки на консервирующее действие. Однако, разбавление 1,0 или 1,1% бензиловым спиртом было совместимо как с композицией, так и с проверкой (тестом) на консервирующее действие. Поскольку требования производителя для растворов составляют ±10%, поэтому лиофилизированную композицию разбавляли 1,1% бензиловым спиртом (1,1±0,1%).
Разработан одностадийный цикл лиофилизации rhuMAв HER2 композиции. В одностадийном цикле лиофилизацию rhuMAв HER2 при 25 мг/мл, 60 mM трегалозы, 5 mM гистидина рН 6 и 0,01% полисорбата 20 проводили при температуре выдерживания 20°С и давлении 150 мторр. После 47 часов содержание остаточной влажности в лиофилизированной массе было менее 5%. Считают, что данный цикл лиофилизации интересен тем, что он упрощает производственный процесс, исключая стадию вторичной сушки.
Пример 2
Анти-IgE композиция
IgE антитела связываются со специфическими высокоаффинными рецепторами на тучных клетках, приводящих к дегрануляции тучной клетки и высвобождению медиаторов, например, гистамина, который продуцирует симптомы, связанные с аллергией. Следовательно, анти-IgE антитела, которые блокируют связывание IgE с высокоаффинным рецептором, имеют потенциальное терапевтическое значение при лечении аллергии. Эти антитела также не должны связываться с IgE, коль скоро они связаны с рецептором, так как это будет стимулировать выделение (секрецию) гистамина. Данный пример описывает усовершенствование лиофилизированной композиции, включающей облагороженное анти-IgE антитело МаЕ11 полной длины, описанной в работе Presta et al., J. Immunology, 151: 2623-2632 (1993).
Материалы. В композициях, описанных ниже, использовали высокоочищенное rhuMAb E25 (рекомбинантное облагороженное анти-IgE антитело МаЕ11), которое не содержало твина 20™. Мембраны для диализа - Spectra/For 7 куплены в Spectrum (Los Angeles, CA). Все другие реагенты, используемые в данном исследовании, получали от коммерческих источников и были аналитически чистые. Буферные растворы, используемые для композиции, и хроматографическую подвижную фазу готовили смешиванием соответствующего количества буфера и соли с Milli-Q водой в мерной колбе.
Композиция. E25 пул S сефарозы подвергали, как принято, диализу в буферных растворах, которые входят в состав композиции. Диализ выполняли при помощи минимум 4×2L обменов буфера в течение 48 часов при 2-8°С. После диализа к некоторым композициям, как требовалось, добавляли лиопротектор в изотонической концентрации. Концентрацию протеина после диализа определяли с помощью УФ-спектроскопии, используя молярный коэффициент поглощения, равный, 1,60. Диализированный протеин разбавляли до заранее определенной концентрации его в композиции соответствующим буфером, стерилизовали, используя 0,22 мкм Millex-GV фильтр (Millipore) и помещали в предварительно вымытые и автоклавированные стеклянные пузырьки (флаконы). Пузырьки снабжали силицированными (силиконизированными) тефлоновыми пробками для лиофилизации и лиофилизировали, используя следующие условия: Е25 композицию охлаждали до -55°С со скоростью охлаждения 80°С/час и содержимое пузырька выдерживали в замороженном состоянии в течение 4 часов. Для первичной сушки температуру выдерживания повышали до 25°С со скоростью 10°С/час. Первичную сушку проводили при 25°С, 50µ вакуумной камере в течение 39 часов так, чтобы остаточная влажность лиофилизированной массы составляла 1-2%. После лиофилизации пузырек, содержащий композицию, извлекали для анализа при t=0 и оставшиеся пузырьки выдерживали при различных температурах, которые составляли -70°С, 2-8°С, 25°С, 30°С (контролируемая комнатная температура) 40°С и 50°С.
Хроматография. Гель-хроматографию проводили на Bio-Rad Bio-Select™, SEC 250-5 колонке (300×7,8 мм). Колонку уравновешивали и пропускали PBS (забуференный фосфатом физиологический раствор) при скорости потока 0,5 мл/мин, используя Hewlett Packard 1090L HPLC хроматограф, оборудованный (снабженный) диодным матричным детектором. Для калибровки колонки использовали стандарты определенного молекулярного веса (Bio-Rad, Inc.), содержащие тироглобулин (670 kd), γ-глобулин (158 kd), овальбумин (44 kd) и цианокобаламин (1,35 kd). Образец составлял 25 мкг и протеин детектировали регистрированием УФ-абсорбции при 214 нм, используя программное обеспечение Turbochrom 3 (РЕ Nelson, Inc.).
Хроматография гидрофобного взаимодействия. F(ab')2 фрагменты Е25 антитела анализировали на колонке TosoHaas Butyl-NPR (3,5×4,6 mm) и хроматографе Hewlett Packard 1090L HPLC, оборудованном диодным матричным детектором. Буфер А для элюирования представлял собой: 20 mM трис, 2М сульфат аммония, 20% (масс.) глицерина, рН 8,0, в то время как буфер Б состоял из: 20 mM трис, 20% (объемн.) глицерина рН 8,0. Колонку уравновешивали 10% буфером Б для элюирования при скорости потока 1,0 мл/мин в течение минимум 20 минут. Нагрузка образца составляла 5 мкг и протеин детектировали контролированием УФ-абсорбции при 214 нм с применением программного обеспечения Turbochrom 3 для сбора информации (РЕ Nelson, Inc.). После введения образца колонку поддерживали 10% буфером Б в течение одной минуты, за которым следовало увеличение содержания буфера Б по линейному градиенту от 10% до 62% в течение 20 минут. Между последовательными вводами образцов колонку промывали 100% буфером Б в течение 5 минут и заново уравновешивали 10% буфером Б в течение 20 минут.
Антителосвязывающая активность: Анализ ингибирования связывания IgE рецептора (IE25:2) проводили, как описано у в Presta et al., supra на образцах, разбавленных до 20 мкг/мл и 30 мкг/мл в растворителе, в котором проводят анализ (забуференный фосфатом физиологический раствор, 0,5% BSA, 0,05% полисорбата 20, 0,01% тимерозола (Thimerosol)). Каждый разбавленный раствор далее анализировали трижды и результаты умножались на соответствующий фактор разбавления, давая активную концентрацию. Результаты 6 анализов усредняли. Анализом оценивают способность rhuМАвЕ25 конкурентно связываться с IgE и, тем самым, препятствовать связыванию IgE с его высокоаффинным рецептором, который иммобилизован на пластинке твердофазного иммуноферментного анализа (enzyme - linked immunosorbent assay, ELISA). Результаты делятся на концентрацию антитела, определяемую с помощью УФ-абсорбционной спектроскопии, и получают удельную активность. Предварительные эксперименты показали, что данный анализ является показателем стабильности.
Проверка частиц. Содержимое флаконов (пузырьков) с разбавленным лиофилизированным rhuМАвЕ25 объединяли, чтобы объем составил приблизительно 7 мл. Определяли число частиц размером от 2 до 80 мкм, присутствующих в 1 мл образца, с использованием счетчика Hiac/Royco model 1800. Счетчик вначале промывали три раза 1 мл образца, затем следовало, трижды, измерение 1 мл образца. Прибор определяет число частиц в 1 мл, которое равно или больше 10 мкм и число частиц, которое равно или больше 25 мкм.
Первая стадия в создании (усовершенствовании) композиции анти-IgE антитела состояла в нахождении подходящего буфера и рН для лиофилизации и хранения продукта. Антитела при концентрации 5,0 мг/мл использовали для создания композиции в 10 mM сукцинатном буфере при изменении рН от 5,0 до рН 6,5 и в натрийфосфатном буфере, калийфосфатном и гистидиновом буферах при рН 7,0. На фиг.9 показаны увеличенные агрегаты антитела, которые наблюдались в композициях с более высоким рН как до, так и после лиофилизации. Исключение представляла композиция, содержащая гистидиновый буфер с рН 7, в котором не наблюдалось агрегирования при хранении при 2-6°С. На фиг.10 показана rhuМАвЕ25 композиция, лиофилизированная в 5 mM гистидиновом буфере как при рН 6, так и при рН 7 и которая хранилась в течение одного года при 2-8°С, 25°С и 40°С. Анализ, отвечающий каждому моменту времени и температуре хранения композиции с рН 6 показал, что композиция содержит меньше агрегатов, чем композиция с рН 6 показал, что композиция содержит меньше агрегатов, чем композиция с антителом при рН 7,0. Эти результаты показали, что гистидин при рН 6 представляет собой особо пригодную буферную систему для предотвращения агрегации антитела.
Для облегчения скрининга лиопротекторов для получения композиции использовали анти-IgE антитело в натрий сукцинатном буфере с рН 5 с лиопротектором или без него. Потенциальные лиопротекторы, добавленные при изотонических концентрациях, разделялись на три категории:
а) невосстанавливающие моносахариды (т.е. маннит);
б) восстанавливающие дисахариды (т.е. лактоза и мальтоза); и
в) невосстанавливающие дисахариды (т.е. трегалоза и сахароза).
Агрегация композиций после хранения при 2-8°С и 40°С в течение одного года показана а фиг.11 и 12. При хранении при 2-8°С композиция, содержащая моносахарид (маннит), агрегировалась со скоростью близкой к таковой для буферного раствора (контрольного), в то время как композиции, содержащие дисахариды, были одинаково эффективны в контрольных агрегациях (фиг.11). Результаты после хранения при 40°С были аналогичными, за иключением композиции, содержащей сахарозу, которая быстро агрегирует (что коррелирует с получением темной лиофилизированной массы (фиг.12). Позже было показаю, что это является причиной разрушения (деградации) сахарозы при хранении как в растворах с кислым рН, так и при высокой температуре.
Хроматография гидрофобного взаимодействия композиции антитела е гистидиновом буфере при рН 6 с лактозой показывает, что антитело изменялось после хранения в течение 6 месяцев при 40°С (фиг.13). Хроматографические пики уширялись и время удерживания уменьшалось. Эти изменения не наблюдались с контрольным буфером и для композиций, содержащих сахарозу, при хранении в аналогичных условиях, как показано на фиг.14 и 15 соответственно. Кроме того, изоэлектрическое фокусирование показало сдвиг в кислую область pI антитела в композиции, содержащей лактозу, и при хранении при 25°С и 40°С. Это указывает на то, что восстанавливающие углеводы не пригодны в качестве лиопротекторов для антител.
Агрегация лиофилизированной композиции анти-IgE при концентрации 20 мг/мл в 5 mM гистидиновом буфере при рН 6 при различных концентрациях сахарозы и трегалозы после хранения в течение 12 недель при 50°С показана на фиг.16. Оба углевода обладают одинаковым защитным эффектом в отношении агрегации, если концентрация углевода больше 500 молей углевода на 1 моль антитела. Согласно этим результатам изотонические и гипертонические композиции, содержащие как сахарозу, так и трегалозу, предлагали для дальнейшего применения. Предполагалось, что композиции будут заполняться до лиофилизации при сравнительно низкой концентрации антитела и лиофилизированный продукт разбавляться меньшим объемом, чем при заполнении бактериостатической водой для инъекций (BWFI), содержащей 0,9% бензилового спирта. Это позволяет проводить концентрирование антитела непосредственно перед подкожным введением и включать консервант для потенциальной композиции многократного использования, избегая при этом взаимодействия между протеином и консервантом при длительном хранении.
Изотоническая композиция, Анти-IgE при концентрации 25 мг/мл использовали для создания композиции в 5 mM гистидтиновом буфере при рН 6 с 500 молями углевода на 1 моль антитела, что соответствует концентрации углевода - 85 mM. Данную композицию разбавляют BWFI (содержащей 0,9% бензилового спирта) до объема, который в четыре раза меньше объема, используемого при заполнении. Это приводит к 100 мг/мл антитела в 20 mM гистидиновом буфере с рН 6 с изотонической концентрацией углевода - 340 mM.
Гипертоническая композиция. Анти -IgE при концентрации 25 мг/мл использовали для создания композиции в 5 mM гистидиновом буфере при рН 6 с 1000 молями углевода на 1 моль антитела, что соответствует концентрации углевода в 161 mM. Данную композицию разбавляли BWFI (содержащей 0,9% бензилового спирта) до объема, который в четыре раза меньше, чем при заполнении. Это приводит к 100 мг/мл антитела в 20 mM гистидиновом буфере с рН 6 и с гипертонической концентрацией углевода - 644 mM.
Сравнения агрегации антитела после хранения изотонической или гипертоничекой композиций вплоть до 36 недель показаны на фиг.17-19. Не наблюдалось изменений в агрегации ни в гипертонической, ни в изотонической композициях при хранении при 2-8°С (Фиг.17). В гипертонической композиции не наблюдалось увеличения агрегации при хранении при контролируемой комнатной температуре (30°С), в то время как происходило увеличение агрегации от 1 до 2% в изотонических композициях (фиг.18). Наконец, после хранения при 50°С наблюдалось минимальное увеличение агрегации для гипертонических композиций, 4% увеличение в агрегации происходит с изотонической композицией, содержащей трегалозу, и 12% увеличение агрегации происходит с изотонической композицией, содержащей сахарозу (фиг.19). Эти результаты показывают, что изотоническая композиция содержит минимальное количество углевода, необходимое для сохранения стабильности антитела при хранении при температуре до 30°С.
Связывающую активность анти-IgE в изотонической или гипертонической композициях оценивали с помощью анализа ингибирования IgE рецепторов. Было обнаружено, что связывающая активность изотонических и гипертонических композиций, содержащих сахарозу и трегалозу, существенно не изменяется после хранения при -70°С, 2-8°С, 30°С и 50°С вплоть до 36 недель.
Известно, что лиофилизированные композиции протеинов содержат нерастворимые агрегаты или частицы (Cleland et al., Critical Reviews in Therapeutic Drug Carrier Systems, 10(4): 307-377 (1993)). Таким образом, проводили анализ частиц антитела, лиофилизированного при концентрации 25 мг/мл в 5 mM гистидиновом буфере с рН 6 в добавкой 85 mM и 161 mM сахарозы и трагалозы. К композиции добавляли полисорбат 20 при концентрации 0,005%, 0,01% и 0,02%. Образцы лиофилизировали. и анализировали после разбавления до 100 мг/мл антитела в 20 mM гистидиновом буфере с рН 6 с 340 mM и 644 mM углевода. Концентрация полисорбата 20 после разбавления составляла 0,02%, 0,04% и 0,08%.
Ниже в табл.9 показано число частиц размером, равным 10 мкм или больше, и равным 25 мкм или больше в изотонических и гипертонических композициях, содержащих сахарозу и трегалозу. Полисорбат 20 добавляли к композициям при концентраицях 0,005%, 0,01% и 0,02% до лиофилизации. Результаты показывают, что прибавление твина (Tween™) к композиции значительно уменьшает количество частиц для каждого проверяемого диапазона размеров частиц. По фармакопеи США (US Pharmacopeia, USP) требованием для инъекций малого объема является не более 6000 частиц, размер которых 10 мкм или не более, чем 600 частиц, размер которых 25 мкм или более, в контейнере (флаконе, пузырьке) (Cleland et al., supra). При прибавлении полисорбата 20 как гипертонические, так и изотонические композиции удовлетворяют этому требованию.
Одна композиция анти-IgE антитела (т.е. 143 мг изотонической композиции rhuMAв Е25 в пузырьке), которую, считают, можно использовать для подкожного введения этого антитела показана ниже в табл.10. Пузырек объемом 10 см3 заполняют композицией, содержащей 5,7 мл rhuМАвЕ25 при концентрации 25 мг/мл в 5 mM гистидиновом буфере с рН 6,0 с 0,01% полисорбата 20. Сахарозу добавляли в качестве лиопротектора при концентрации 85 mM, которая соответствует молярному соотношению углевода к антителу как 500:1. Пузырек лиофилизировали и разбавляли 0,9% бензиловым спиртом до 1/4 от заполненного объема или 1,2 мл. Конечную концентрацию компонентов в композиции увеличивали в четыре раза до 100 мг/мл rhuMAв Е25 в 20 mM гистидиновом буфере с рН 6 с 0,04% полисорбата 20 и 340 mM сахарозы (изотоническая композиция) и 0,9% бензиловым спиртом. Композиция содержит гистидиновый буфер с рН 6, поскольку он демонстрирует защитное действие против агрегации антитела. Сахарозу добавляли в качестве лиопротектора, поскольку и ранее ее использовали в фармацевтической промышленности. Концентрацию углевода выбирали так, чтобы при разбавлении получить изотоническую композицию. Наконец, полисорбат 20 добавляли, чтобы предотвратить образование нерастворимых агрегатов.
| название | год | авторы | номер документа |
|---|---|---|---|
| СТАБИЛЬНАЯ ИЗОТОНИЧЕСКАЯ ЛИОФИЛИЗИРОВАННАЯ ПРОТЕИНОВАЯ КОМПОЗИЦИЯ | 1996 |
|
RU2229288C2 |
| КОМПОЗИЦИИ, СОДЕРЖАЩИЕ КОНЪЮГАТЫ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО ДУОКАРМИЦИН | 2016 |
|
RU2687237C1 |
| ВЫСОКОКОНЦЕНТРИРОВАННЫЕ КОМПОЗИЦИИ АНТИТЕЛ И БЕЛКОВ | 2004 |
|
RU2332986C2 |
| СТАБИЛЬНАЯ КОМПОЗИЦИЯ АНТИТЕЛА, СПЕЦИФИЧЕСКИ СВЯЗЫВАЮЩЕГОСЯ С HER2 РЕЦЕПТОРАМИ, И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2014 |
|
RU2589691C2 |
| СТАБИЛЬНЫЕ БЕЛКОВЫЕ ПРЕПАРАТЫ, СОДЕРЖАЩИЕ МОЛЯРНЫЙ ИЗБЫТОК СОРБИТОЛА | 2015 |
|
RU2689145C2 |
| СТАБИЛЬНЫЙ ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ НА ОСНОВЕ АНТИТЕЛА К PD-1 И ЕГО ПРИМЕНЕНИЕ В МЕДИЦИНЕ | 2016 |
|
RU2731418C2 |
| КОМПОЗИЦИИ И СПОСОБЫ, ВКЛЮЧАЮЩИЕ АЛКИЛГЛИКОЗИДЫ, ДЛЯ СТАБИЛИЗАЦИИ СОДЕРЖАЩИХ БЕЛКИ СОСТАВОВ | 2011 |
|
RU2575830C2 |
| СТАБИЛЬНЫЕ КОМПОЗИЦИИ ИММУНОГЛОБУЛИНОВОГО ОДИНОЧНОГО ВАРИАБЕЛЬНОГО ДОМЕНА И ИХ ПРИМЕНЕНИЕ | 2014 |
|
RU2773172C2 |
| СТАБИЛЬНЫЕ КОМПОЗИЦИИ ИММУНОГЛОБУЛИНОВОГО ОДИНОЧНОГО ВАРИАБЕЛЬНОГО ДОМЕНА И ИХ ПРИМЕНЕНИЕ | 2014 |
|
RU2671977C2 |
| ЛИОФИЛИЗИРОВАННЫЙ ПРЕПАРАТ, СОДЕРЖАЩИЙ ИММУНОЦИТОКИНЫ | 2003 |
|
RU2316348C2 |
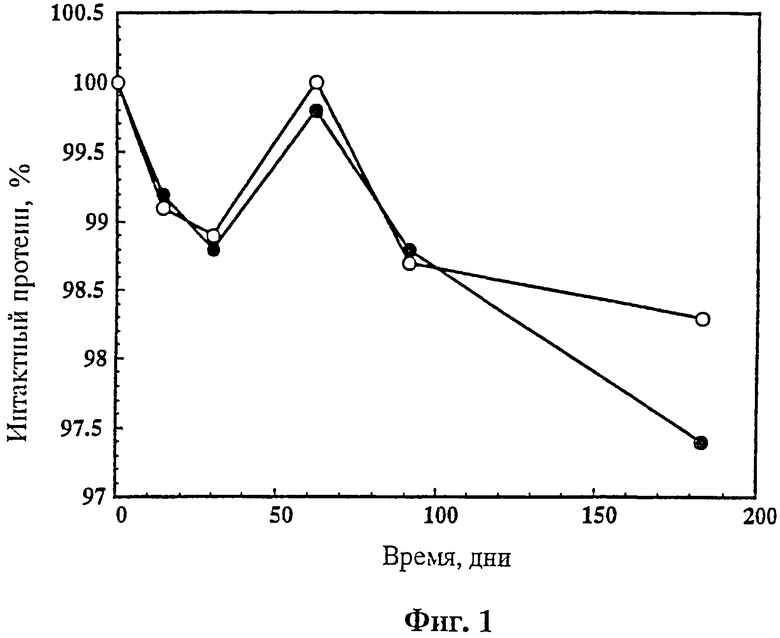
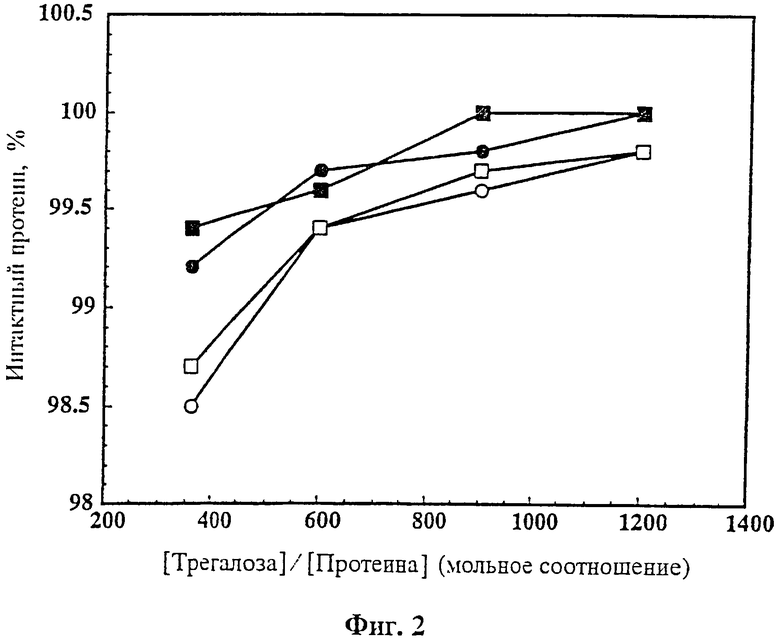
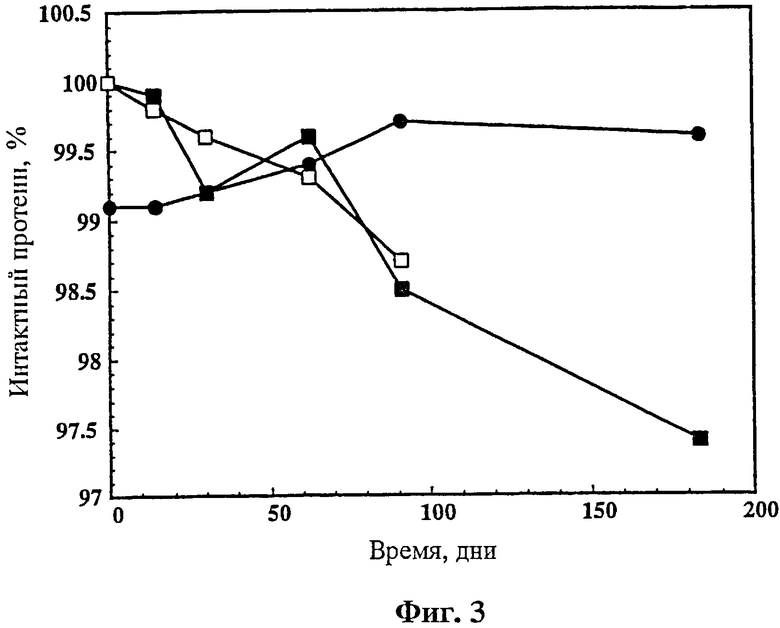
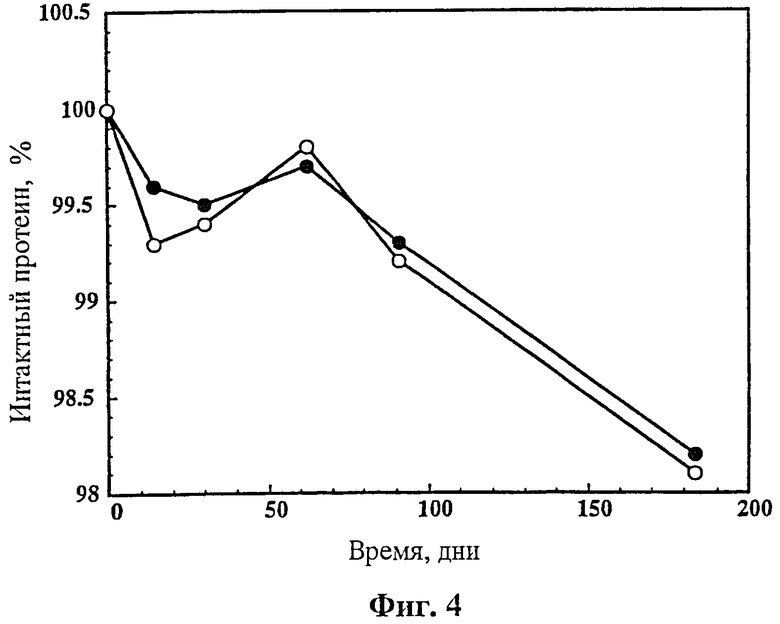
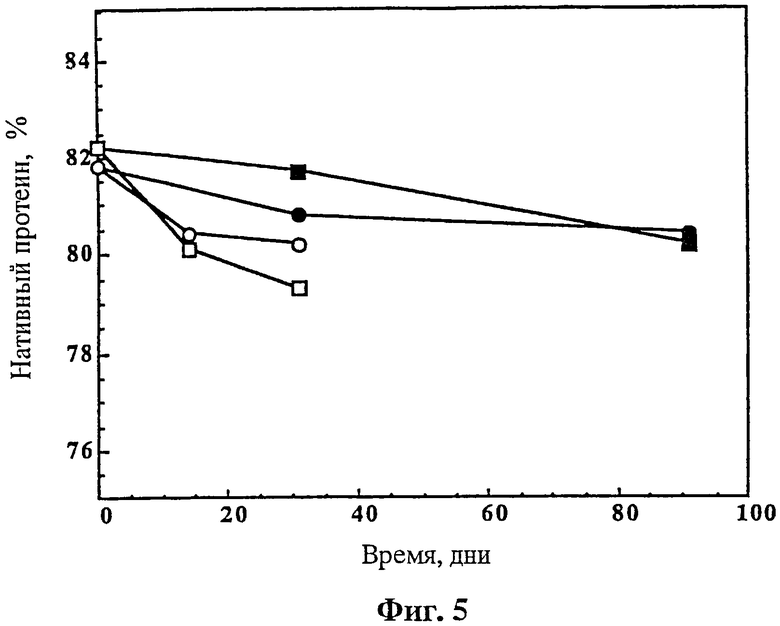
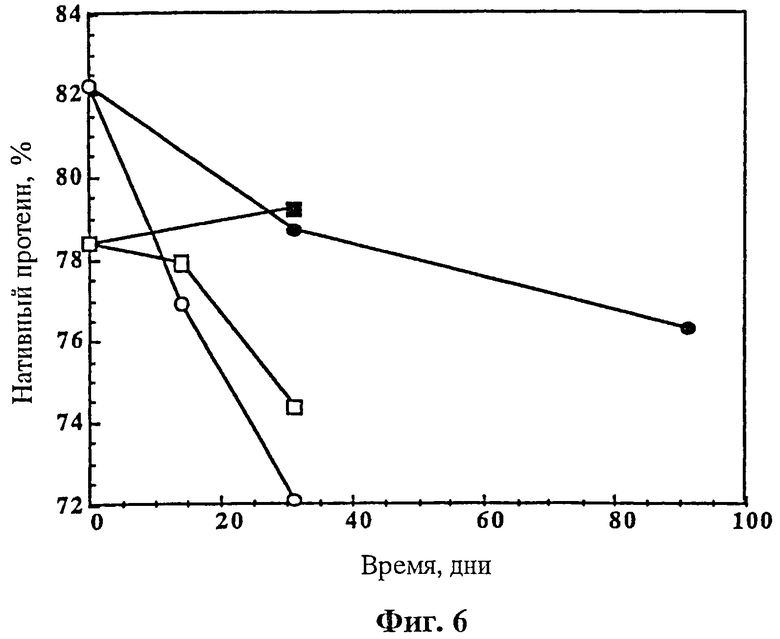
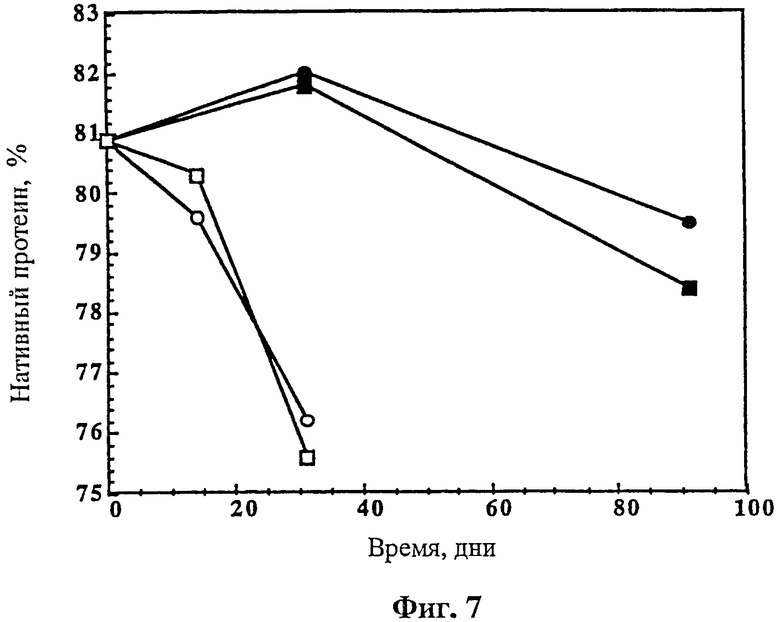
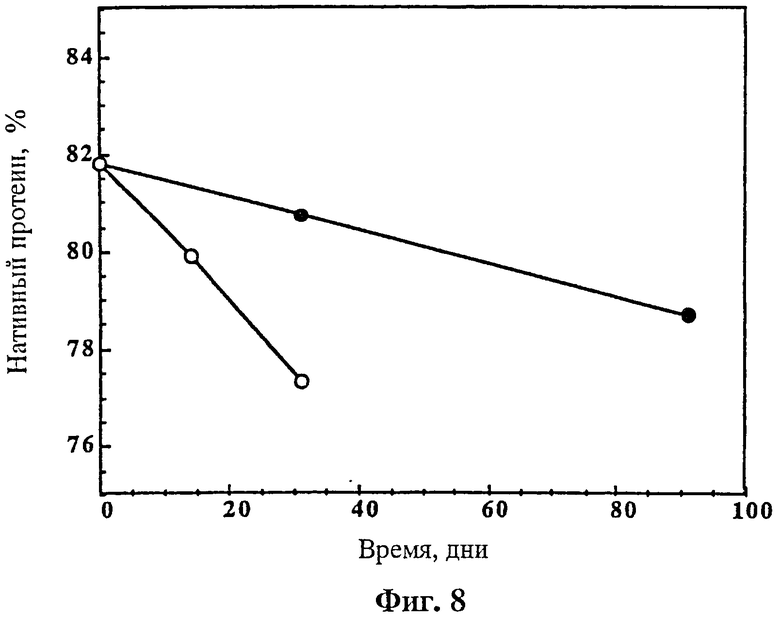

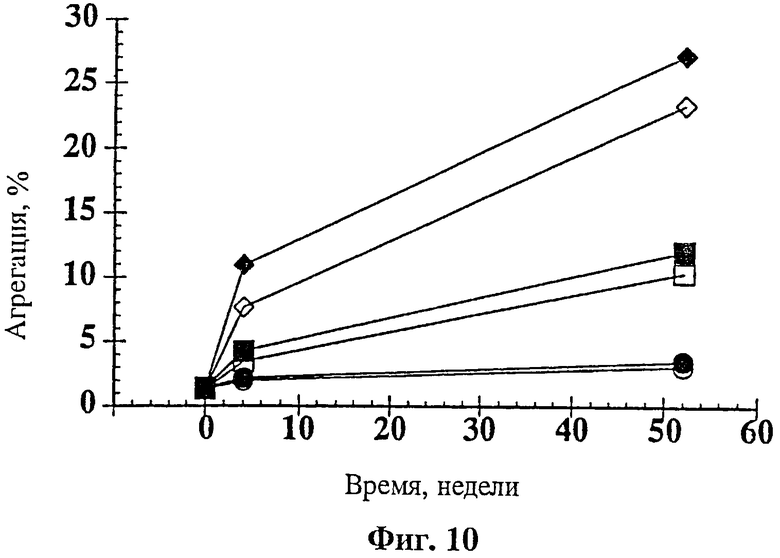
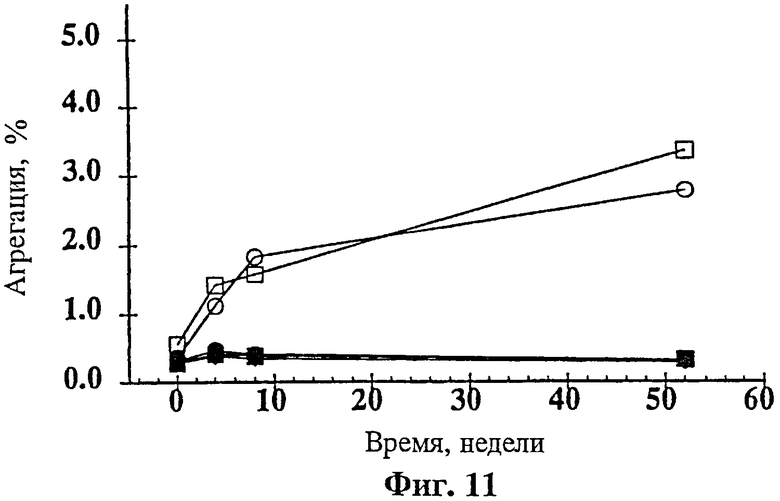
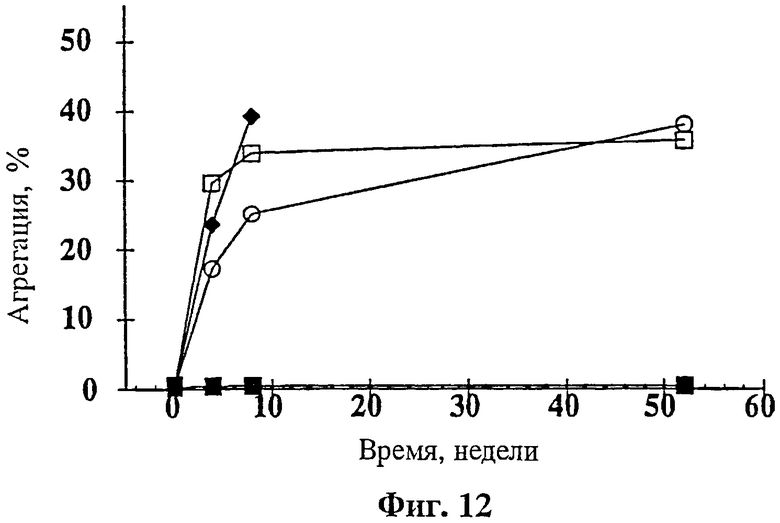
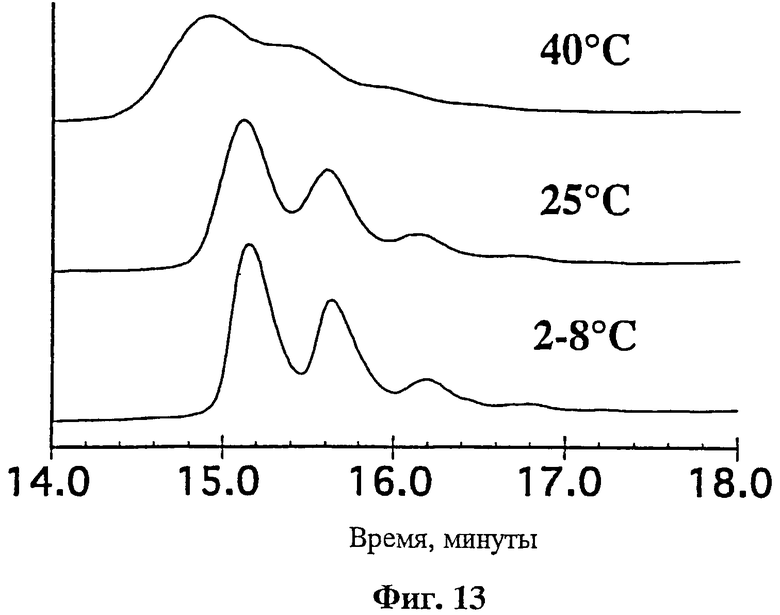
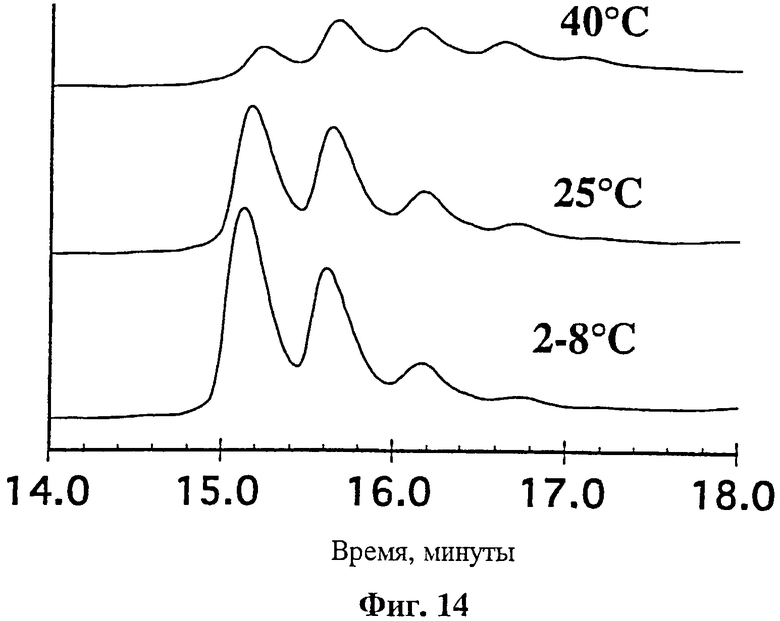
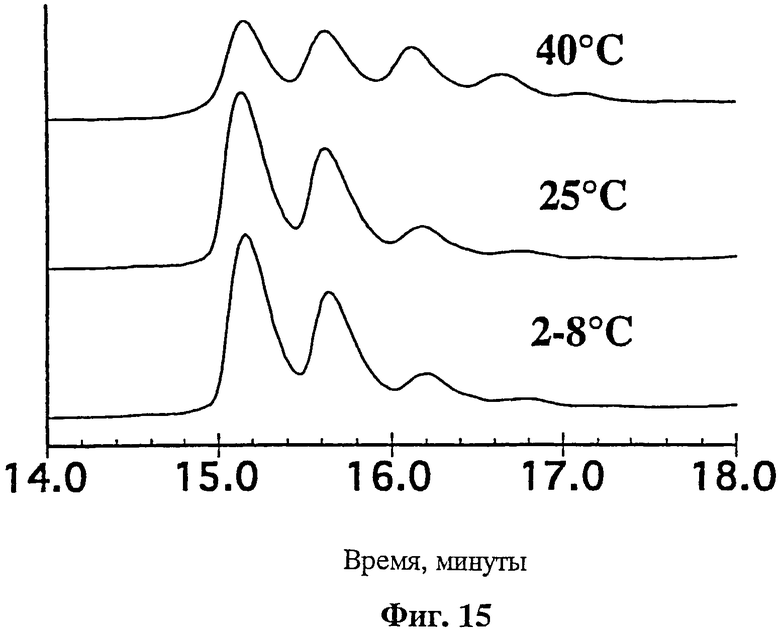
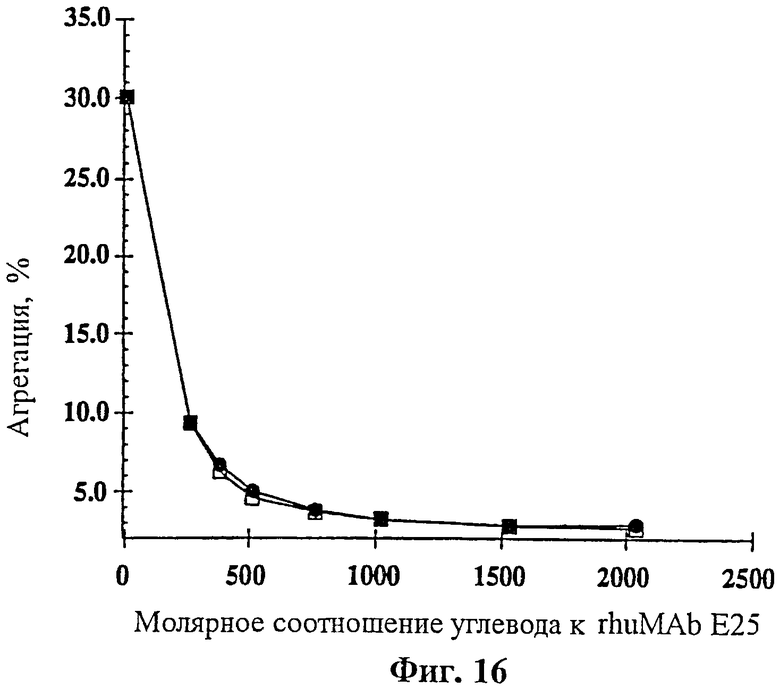
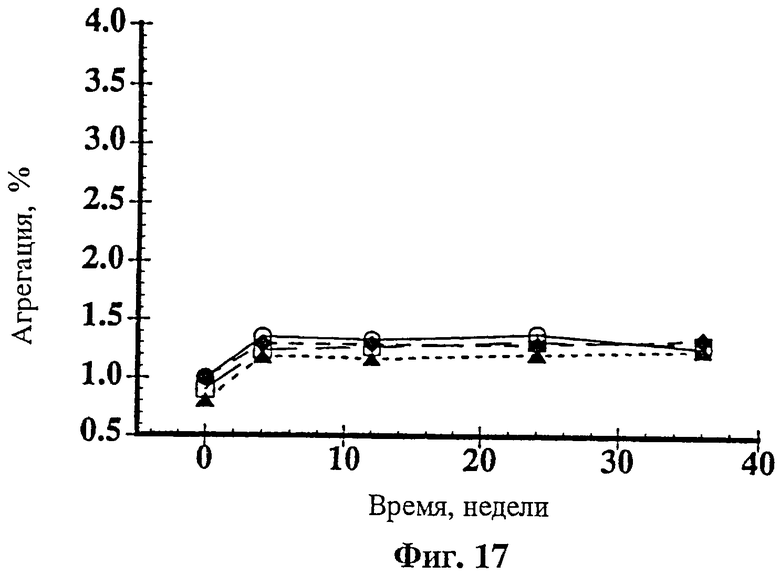
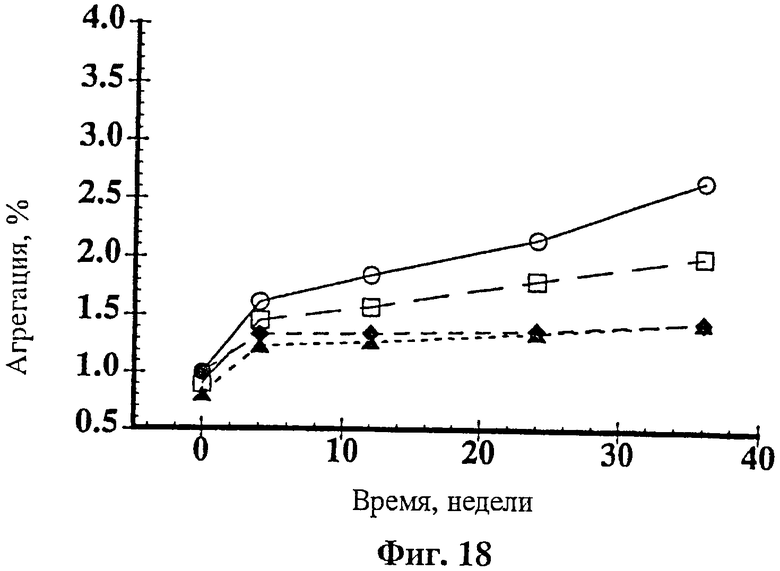
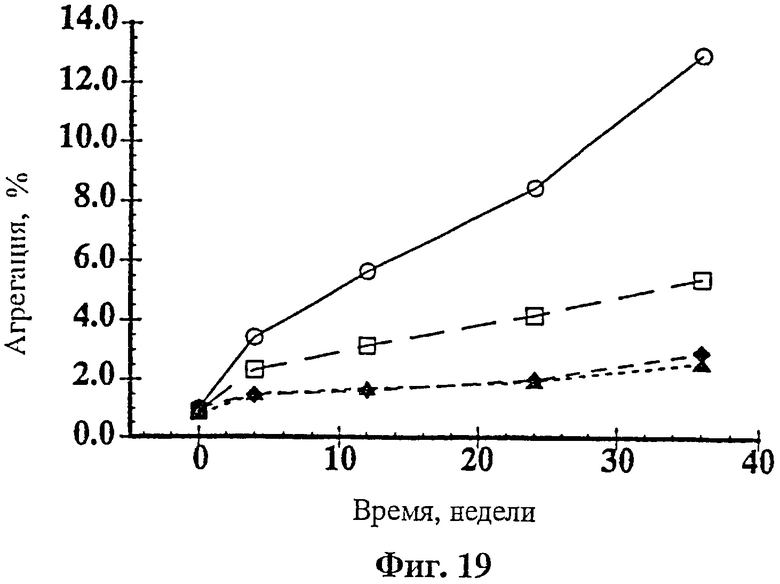
Группа изобретений относится к области медицины и фармацевтики и касается стабильной изотонической действующей композиции, содержащей протеин в количестве по крайней мере 50 мг/мл и растворитель, который разбавляет композицию, полученную из лиофилизированной смеси протеина и лиопротектора, где мольное соотношение лиопротектора и протеина в смеси составляет 100-600 моль лиопротектора на 1 моль протеина, причем концентрация протеина в разбавленной действующей композиции в 2-40 раз выше, чем концентрация протеина в смеси до лиофилизации. Заявлена также композиция, содержащая антитело, в частности анти-IgE-антитело или анти-HER2-антитело, и лекарственное средство для лечения млекопитающих, у которых имеются нарушения, характеризующиеся сверхэкспрессией HER2-рецептора, в частности для лечения рака. Способы получения композиции включают стадии лиофилизации смеси протеина и лиопротектора, которым является сахароза или трегалоза, разбавления лиофилизированной смеси растворителем до концентрации протеина по меньшей мере 50 мг/мл. Группа изобретений обеспечивает получение действующей композиции, стабильной при высоких концентрациях протеина. 8 н. и 34 з.п. ф-лы, 2 пр., 10 табл., 19 ил.
1. Стабильная изотоническая действующая композиция, содержащая протеин в количестве по крайней мере 50 мг/мл и растворитель, который разбавляет композицию, полученную из лиофилизированной смеси протеина и лиопротектора, отличающаяся тем, что мольное соотношение лиопротектора и протеина в смеси составляет 100-600 моль лиопротектора на 1 моль протеина, причем концентрация протеина в разбавленной действующей композиции в 2-40 раз выше, чем концентрация протеина в смеси до лиофилизации.
2. Композиция по п.1, отличающаяся тем, что лиопротектором является сахароза или трегалоза.
3. Композиция по п.1 или 2 дополнительно включает буферный раствор.
4. Композиция по п.3, отличающаяся тем, что буферный раствор является гистидиновым или сукцинатным буфером.
5. Композиция по любому из пп.1-4 дополнительно содержит поверхностно-активное вещество.
6. Стабильная действующая композиция, содержащая антитело в количестве по крайней мере 50 мг/мл и растворитель, который разбавляет композицию, полученную из лиофилизированной смеси антитела и лиопротектора, отличающаяся тем, что мольное соотношение лиопротектора и протеина в смеси составляет 100-600 моль лиопротектора на 1 моль антитела, причем концентрация антитела в разбавленной действующей композиции в 2-40 раз выше, чем концентрация антитела в смеси до лиофилизации.
7. Композиция по п.6, отличающаяся тем, что антитело является анти-IgE-антителом или анти-HER2-антителом.
8. Композиция по п.6 или 7, которая является изотонической.
9. Способ получения стабильной изотонической действующей композиции, включающий разбавление лиофилизированной смеси протеина и лиопротектора, отличающийся тем, что мольное соотношение лиопротектора и протеина в смеси выполняют 100-600 моль лиопротектора на 1 моль протеина в растворителе, причем концентрация протеина в разбавленной действующей композиции составляет по крайней мере 50 мг/мл, при этом концентрация протеина в разбавленной действующей композиции в 2-40 раз выше, чем концентрация протеина в смеси до лиофилизации.
10. Способ получения композиции, включающий стадии а) лиофилизации смеси протеина и лиопротектора, причем мольное соотношение лиопротектора и протеина в смеси составляет 100-600 моль лиопротектора на 1 моль протеина, и б) разбавления лиофилизированной смеси стадии а) растворителем, при этом действующую композицию выполняют изотонической и стабильной, имеющей концентрацию протеина по меньшей мере 50 мг/мл.
11. Способ по п.10, отличающийся тем, что концентрация протеина в действующей композиции от 80 до 300 мг/мл.
12. Способ по п.10 или 11, отличающийся тем, что концентрация протеина в действующей композиции в 2-40 раз выше, чем концентрация протеина в смеси до лиофилизации.
13. Способ по любому из пп.10-12, отличающийся тем, что лиофилизацию проводят при температуре выдержки, поддерживаемой на уровне 15-30°С на протяжении всего процесса лиофилизации.
14. Готовый продукт, включающий флакон, содержащий лиофилизированную смесь протеина и лиопротектора, причем мольное соотношение лиопротектора и протеина в смеси составляет 100-600 моль лиопротектора на 1 моль протеина, разбавляемую растворителем до концентрации протеина в разбавленной действующей композиции по крайней мере 50 мг/мл.
15. Готовый продукт по п.14, дополнительно включающий второй флакон, который содержит растворитель.
16. Готовый продукт по п.15, отличающийся тем, что растворителем является бактериостатическая вода для инъекций (BWFI), содержащая ароматический спирт, стерильную воду или стерильный физиологический раствор.
17. Лекарственное средство для лечения млекопитающих, у которых имеются нарушения, характеризующиеся сверхэкспрессией HER2-рецептора, содержащее композицию по п.1.
18. Лекарственное средство по п.17, отличающееся тем, что оно предназначено для подкожного введения.
19. Композиция, содержащая анти-HER2-антитело в количестве от 5 до 40 мг/мл, сахарозу или трегалозу в количестве от 10 до 100 mM, буферный раствор и поверхностно-активное вещество.
20. Композиция по п.19, дополнительно включающая наполнитель.
21. Композиция по п.19 или 20, которая лиофилизирована.
22. Композиция по любому из пп.19-21, которая разбавлена растворителем так, что концентрация анти-HER2-антитела в действующей композиции составляет от 10 до 30 мг/мл.
23. Композиция, содержащая анти-IgE-антитело в количестве от 5 до 40 мг/мл, сахарозу или трегалозу в количестве от 80 до 300 mM, буферный раствор и поверхностно-активное вещество.
24. Композиция по п.23, которая лиофилизирована.
25. Композиция по п.6, отличающаяся тем, что антитело в композиции является моноклональным антителом.
26. Композиция по п.6, отличающаяся тем, что она предназначена для лечения рака, характеризующегося сверхэкспрессией HER2-рецептора у млекопитающих, путем введения млекопитающему терапевтически эффективного количества композиции, при этом антитело в композиции связывает HER2-рецептор.
27. Композиция по п.26, отличающаяся тем, что она предназначена для введения подкожно.
28. Композиция по п.6, отличающаяся тем, что мольное соотношение лиопротектора и антитела составляет 200-600 моль лиопротектора на 1 моль антитела.
29. Композиция по п.25, отличающаяся тем, что включает моноклональное антитело в количестве от 50 до 400 мг/мл и растворитель, разбавляющий композицию, полученную из лиофилизированной смеси моноклонального антитела и сахара, выбранного из группы, состоящей из сахарозы и трегалозы, при этом мольное соотношение сахара и моноклонального антитела в смеси составляет 200-600 моль сахара на 1 моль моноклонального антитела, а концентрация моноклонального антитела в разбавленной действующей композиции в 2-40 раз выше, чем концентрация моноклонального антитела в смеси до лиофилизации.
30. Композиция по п.6, отличающаяся тем, что она содержит антитело, связывающее HER2-рецептор у людей, и предназначена для лечения рака, выбираемого из группы, состоящей из внутриматочного рака, рака легкого, толстой кишки и мочевого пузыря у людей, путем введения терапевтически эффективного количества композиции.
31. Композиция по п.6, отличающаяся тем, что содержит антитело,
связывающее HER2-рецептор у млекопитающих, и предназначена для лечения рака,
характеризующегося сверхэкспрессией HER2-рецептора у млекопитающих, путем подкожного введения терапевтически эффективного количества композиции.
32. Композиция по п.31, отличающаяся тем, что концентрация антитела в композиции составляет от 50 до 400 мг/мл.
33. Композиция по п.31 или 32, отличающаяся тем, что она получена растворением лиофилизированного антитела в растворителе.
34. Композиция по любому из пп.31-33, отличающаяся тем, что млекопитающим является человек.
35. Композиция по любому из пп.31-34, отличающаяся тем, что рак выбран из группы, состоящей из рака молочной железы, овариального рака, рака желудка, внутриматочного рака, рака слюнной железы, рака легкого, почек, толстой кишки и мочевого пузыря.
36. Композиция по п.26, отличающаяся тем, что действующая композиция содержит антитело, которое связывает HER2-рецептор, в количестве от 50 до 400 мг/мл и получена растворением лиофилизированной смеси антитела и лиопротектора в растворителе, при этом концентрация антитела в разбавленной действующей композиции в 2-40 раз выше, чем концентрация антитела в смеси до лиофилизации.
37. Композиция по п.36, отличающаяся тем, что она предназначена для введения подкожно.
38. Композиция по п.36 или 37, отличающаяся тем, что млекопитающим является человек.
39. Композиция по п.6, отличающаяся тем, что она содержит антитело, связывающее HER2-рецептор у людей, и предназначена для лечения проточной карциномы in situ у людей путем введения терапевтически эффективного количества композиции.
40. Композиция по п.6, отличающаяся тем, что применяется для лечения рака, характеризующегося сверхэкспрессией HER2-рецептора, причем антитело в указанной композиции связывает HER2-рецептор.
41. Композиция по п.40, отличающаяся тем, что она предназначена для лечения рака, выбираемого из группы, состоящей из внутриматочного рака, рака легкого, толстой кишки и мочевого пузыря.
42. Композиция по п.40, отличающаяся тем, что предназначена для введения подкожно.
| Пролетное строение колейного моста | 1977 |
|
SU661060A1 |
| US 5290764 А, 01.03.1994 | |||
| US 5011676 А, 30.04.1991 | |||
| RU 95107153, 27.11.1997. | |||
Авторы
Даты
2013-11-10—Публикация
1996-07-23—Подача