1. Область техники, к которой относится изобретение
Настоящее изобретение относится к стабильным композициям полипептидов, например, иммуноглобулиновых одиночных вариабельных доменов, в частности, иммуноглобулиновых одиночных вариабельных доменов, направленных к фактору Виллебранда (ФВ), таких как иммуноглобулиновые одиночные вариабельные домены в соответствии с SEQ ID NO: 1-19, в частности, SEQ ID NO: 1, т.е. нанотело ALX-008.
Изобретение обеспечивает композиции, устойчивые при хранении в течение длительных периодов времени и в широком диапазоне температур. Композиции из настоящего изобретения гарантируют высокую стабильность полипептида, позволяя выполнять множество циклов замораживания-оттаивания без химического или физического нарушения, и обеспечивают устойчивость к механическому стрессу, такому как встряхивание, сдвиг или перемешивание. Они пригодны для фармацевтических и диагностических препаратов и совместимы с фармацевтически пригодными растворителями, такими как солевой раствор, раствор Рингера или раствор глюкозы/декстрозы.
Настоящее изобретение также относится к способам приготовления, способам хранения и применения композиций. Изобретение также относится к лекарственным формам, наборам и медицинскому применению композиций.
2. Предшествующий уровень техники
Иммуноглобулиновые одиночные вариабельные домены, такие как верблюжьи VHH домены, камелизированные VH домены или гуманизированные VHH домены, представляют быстро увеличивающийся класс лечебных средств на основе антител. Например, иммуноглобулиновые одиночные вариабельные домены против ФВ описаны в WO2004/015425 [P02-008], WO2004/062551 [P03-001], WO2006/074947 [P05-001], WO2006/122825 [P05-003], WO2009/115614 [P08-013], и WO2011/067160.
Белки, такие как иммуноглобулиновые одиночные вариабельные домены (ИОВД), как правило, требуют хранения и транспортировки от исходного места производства до применения, например, введения пациенту. Процессы транспортировки, производства, хранения и доставки могут оказывать разнообразное стрессовое влияние на иммуноглобулиновые одиночные вариабельные домены, такое как химический и физический стресс. При хранении может происходить химическая модификация, например, такая как дезамидирование, рацемизация, гидролиз, окисление, изомеризация, бета-элиминация или дисульфидный обмен. Физический стресс может вызывать денатурацию и развертывание, агрегацию, образование частиц, осаждение, опалесценцию или адсорбцию.
Имеется потребность в обеспечении композиций иммуноглобулиновых одиночных вариабельных доменов, например, как определено в настоящей заявке, с повышенной стабильностью, защищающей активный агент от химического или механического стресса, и таким образом, обеспечивающей хранение и температурные изменения без существенного физического или химического повреждения, сохранение стабильности в течение длительного периода времени, и/или хорошую переносимость пациентом, например, когда активный агент растворен в высокой концентрации.
3. Краткое изложение сущности изобретения
Известно, что вышеупомянутый стресс может влиять на физико-химическую целостность белковых лекарственных препаратов, например, лекарственных препаратов на основе антител. Например, агрегация, дезамидирование и окисление описаны как наиболее частные причины разрушения антител (Cleland et al., 1993, Crit. Rev. Ther. Drug Carrier Systems 10, 307-377). В то же самое время важно, что обеспечиваются композиции, сохраняющие химическую и физическую целостность иммуноглобулиновых одиночных вариабельных доменов. Химическая и физическая целостность необходима для применения, например, в качестве терапевтического агента, и, как правило, также связана с биологической активностью. Хотя наши знания о стабильности белков увеличиваются, оптимизация условий композиций до полного подавления или минимизации разнообразных стрессов и обеспечения длительного срока годности остается основной проблемой.
Имеется мало данных о подходящих композициях иммуноглобулиновых одиночных вариабельных доменов. WO2010/077422 описывает композицию ФНО-связывающего нанотела, содержащую лиопротектор, сурфактант и буферный агент, выбранный из гистидинового буфера и Трис-HCl при рН от 5,0 до 7,5.
Специфические агенты, связывающие ФВ, и в частности, иммуноглобулиновые одиночные вариабельные домены с высокой аффинностью к ФВ, такие как ALX-0081 [INN: каплацизумаб], были протестированы в качестве вспомогательной терапии для пациентов с острым коронарным синдромом (ОКС), подвергающихся чрескожной коронарной ангиопластике (ЧКА), и разработаны для лечения тромботической тромбоцитопенической пурпуры (ТТП). Клинические испытания I фазы были успешно завершены, и в настоящее время проводятся испытания II фазы. До сих пор ALX-0081 представлен в виде жидкой композиции на фосфатной основе, содержащей 5 мг/мл активного фармацевтического ингредиента (АФИ) в D-PBS, 200 мМ глицина и 0,02% Твин-80 (о/о).
Хотя доказана активность этой композиции, она может быть улучшена различными способами. Во-первых, при современных концентрациях, вероятно, необходимо множество подкожных инъекций (с учетом того, что объем для подкожной инъекции ограничен примерно до 1 мл), таким образом, снижается переносимость и соблюдение режима пациентом. Во-вторых, устойчивость при хранении и срок годности имеющейся в настоящее время композиции ALX-0081 (далее обозначенной как современная композиция ALX-0081) могут быть улучшены при повышенных температурах. Стабильность в современных композициях при высоких температурах определяется главным образом химическими модификациями полипептида. Химические модификации могут быть связаны с потерей активности. Хотя практичный срок годности может быть достигнут при хранении продукта при -20°C, однако, это не считается благоприятным вариантом для большинства практических целей.
Лиофилизация является обычно применяемой методикой сохранения белков, служащей для удаления воды из препарата интересующего белка. Лиофилизация, или сублимационная сушка, является способом, при котором материал, подлежащий сушке, вначале замораживают, а затем лед или замороженный растворитель удаляют путем сублимации в вакуумной среде. Наполнитель может быть включен в композиции перед лиофилизацией для повышения стабильности во время процесса лиофилизации и/или для повышения стабильности лиофилизированного продукта при хранении (Arakawa et al. Pharm. Res. 8(3):285-291 (1991)).
Настоящее изобретение относится к композиции, включающей агент, связывающий фактор Виллебранда (ФВ) и цитратный или фосфатный буфер, предпочтительно, цитратный буфер, с рН в диапазоне от 5,0 до 7,5. В частности, настоящее изобретение относится к композиции, как описано в настоящей заявке, где указанный агент, связывающий ФВ, содержит по меньшей мере один иммуноглобулиновый одиночный вариабельный домен, связывающийся с SEQ ID NO: 20.
Указанный иммуноглобулиновый одиночный вариабельный домен включает или по существу состоит из иммуноглобулинового одиночного вариабельного домена, который является последовательностью вариабельного домена тяжелой цепи, в частности, иммуноглобулиновым одиночным вариабельным доменом, который является последовательностью вариабельного домена тяжелой цепи, полученной из обычного четырехцепочечного антитела, или последовательностью вариабельного домена тяжелой цепи, полученной из тяжелой цепи антитела, или нанотелом (включая VHH последовательность), предпочтительно нанотелом, но не ограничивается ими.
Кроме того, настоящее изобретение относится к композиции, как описано в настоящей заявке, где указанный агент, связывающий ФВ, включает по меньшей мере одну из SEQ ID NO: 1-19. Далее, настоящее изобретение относится к композиции, как описано в настоящей заявке, где указанный агент, связывающий ФВ, является одноцепочечным полипептидом, включающим один или несколько иммуноглобулиновых одиночных вариабельных доменов, предпочтительно, где указанный агент, связывающий ФВ, является одновалентным или поливалентным, где указанный агент, связывающий ФВ, является моноспецифическим или полиспецифическим, и/или один или несколько иммуноглобулиновых одиночных вариабельных доменов являются CDR-привитыми. гуманизированными, камелизированными, деиммунизированными, и/или созданными in vitro (например, выбранными посредством фагового дисплея). Настоящее изобретение также относится к композиции, как описано в настоящей заявке, где указанный агент, связывающий ФВ, включает аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 1. Настоящее изобретение также относится к композиции, как описано в настоящей заявке, где указанный агент, связывающий ФВ, имеет концентрацию в диапазоне от 0,1 до 80 мг/мл, и/или где указанный буфер имеет концентрацию в диапазоне 5-200 мМ.
Кроме того, настоящее изобретение относится к композиции, как описано в настоящей заявке, дополнительно включающей наполнитель, предпочтительно, где указанный наполнитель имеет концентрацию в диапазоне 10-500 мМ, более предпочтительно, где указанный наполнитель выбран из перечня, включающего сахарозу, глицин, маннитол, трегалозу и NaCl, еще более предпочтительно, где указанная сахароза имеет концентрацию в диапазоне 1-15%, предпочтительно 2-12%, предпочтительно 4-10%. например, 4, 5, 6, 7, 8 или 9% (м/о), наиболее предпочтительно 7%.
Настоящее изобретение также относится к композиции, как описано в настоящей заявке, выбранной из цитратного буфера, предпочтительно, где указанный цитратный буфер имеет рН от 6,0 до 7,0, более предпочтительно 6,5; и фосфатного буфера, предпочтительно, где указанный буфер имеет рН в диапазоне от 6,5 до 7,5, предпочтительно 7,1.
Кроме того, настоящее изобретение относится к композиции, как описано в настоящей заявке, дополнительно содержащей неионный детергент, такой как Твин-80, предпочтительно, в концентрации от 0,001 до 0,5% (о/о), более предпочтительно 0,01-0,02% (о/о).
Далее, настоящее изобретение относится к композиции, как описано в настоящей заявке, где указанный буфер является цитратным буфером при рН 6,5±0,5, например, 6,2; 6,3; 6,4; 6,5; 6,6; 6,7 или 6,8, в частности, 6,5, и где указанная композиция предпочтительно включает сахарозу, имеющую концентрацию в диапазоне 1-15%, предпочтительно 2-12%, предпочтительно 4-10%, например, 4, 5, 6, 7, 8 или 9% (м/о), наиболее предпочтительно 7%, и предпочтительно, включает неионный детергент, такой как Твин-80, предпочтительно в концентрации 0,01% (о/о).
Далее, настоящее изобретение относится к композиции, как описано в настоящей заявке, где указанная композиция имеет осмоляльность в диапазоне 290±60 мОсм/кг, более предпочтительно, в диапазоне 290±20 мОсм/кг.
Далее, настоящее изобретение относится к композиции, включающей:
(а) агент, связывающий ФВ, в концентрации примерно от 0,1 мг/мл до 80 мг/мл;
(b) наполнитель, выбранный из сахарозы, глицина, маннитола, трегалозы или NaCl, в концентрации примерно от 1% до 15% (м/о);
(с) Твин-80 в концентрации примерно от 0,001% до 0,5% (о/о); и
(d) буфер, выбранный из цитратного буфера в концентрации примерно от 5 мМ до 200 мМ, так что рН композиции составляет примерно от 6,0 до 7,0, и фосфатного буфера в концентрации примерно от 10 мМ до 50 мМ, так что рН композиции составляет примерно от 6,5 до 7,5, где агент, связывающий ФВ в композиции, сохраняет по меньшей мере 80% активности при хранении в течение по меньшей мере 12 месяцев при 5°С или даже 24 месяцев при 5°С.
Изобретение также относится к композиции, которая содержит меньше 5% видов с высокой молекулярной массой (ВММ) после хранения в течение по меньшей мере 12 месяцев при 5°С или даже 24 месяцев при 5°С; и/или меньше 5% видов с низкой молекулярной массой (НММ) после хранения в течение по меньшей мере 12 месяцев при 5°С или даже 24 месяцев при 5°С.
Изобретение также относится к композиции, в которой по меньшей мере 80%, предпочтительно, по меньшей мере 90%, более предпочтительно, по меньшей мере 95%, или даже по меньшей мере 99% агента, связывающего ФВ, сохраняет связывающую активность после хранения, по сравнению со связывающей активностью до хранения, где указанную связывающую активность измеряют посредством ИФА и/или Biacore.
Кроме того, изобретение относится к композиции, как описано в настоящей заявке, где указанная композиция находится в жидкой, лиофилизированной, сублимированной, восстановленной лиофилизированной или замороженной форме; в частности, изобретение относится к жидкой или восстановленной лиофилизированной композиции, включающей:
(а) агент, связывающий ФВ, в концентрации примерно от 0,1 мг/мл до 80 мг/мл;
(b) сахарозу в концентрации примерно от 15 до 15% (м/о);
(с) Твин-80 в концентрации примерно 0,001%-0,5% (о/о); и
(d) цитратный буфер в концентрации примерно от 5 мМ до 200 мМ, так что рН композиции составляет примерно от 6,0 до 7,0.
Лиофилизированную композицию можно затем восстановить, если необходимо, путем смешивания лиофилизированной формы с подходящим растворителем (например, водой) для ресолюбилизации компонентов исходной композиции до необходимой концентрации.
Настоящее изобретение также относится к композиции, как описано в настоящей заявке, являющейся композицией для хранения в большом объеме, включающей:
(а) агент, связывающий ФВ, в концентрации примерно от 0,1 мг/мл до 80 мг/мл;
(b) сахарозу в концентрации примерно от 15 до 15% (м/о);
(с) Твин-80 в концентрации примерно 0,001%-0,5% (о/о); и
(d) цитратный буфер в концентрации примерно от 5 мМ до 200 мМ, так что рН композиции составляет примерно от 6,0 до 7,0, где по меньшей мере 100 литров композиции хранят при температуре ниже точки замерзания.
Кроме того, настоящее изобретение относится к композиции, пригодной для парентерального применения у субъекта, например, у человеческого субъекта (например, пациента, имеющего ФВ-зависимое заболевание). Композицию можно применять у субъекта посредством инъекции (например, внутривенной, подкожной, внутримышечной, или интраперитонеальной).
Кроме того, настоящее изобретение обеспечивает композицию, как описано в настоящей заявке, для применения в способе лечения человеческого или животного субъекта, предпочтительно, для применения в лечении ФВ-зависимых заболеваний, например, таких как острый коронарный синдром (ОКС), преходящее нарушение мозгового кровообращения, нестабильная или стабильная стенокардия, инсульт, инфаркт миокарда или тромботическая тромбоцитопеническая пурпура (ТТП), наиболее предпочтительно, для применения в лечении ТТП или ОКС. Далее, настоящее изобретение относится к способу или процессу приготовления композиции, как описано в настоящей заявке. Способ или процесс включает экспрессию агента, связывающего ФВ, в клеточной культуре; очистку агента, связывающего ФВ, например, путем проведения агента, связывающего ФВ, по меньшей мере через один из этапа хроматографической очистки, этапов ультрафильтрации/диафильтрации; регуляцию концентрации агента, связывающего ФВ, например, примерно до 0,1-80 мг/мл в композиции, содержащей лиопротектор, сурфактант и буфер, как описано в настоящей заявке, например, сахарозу в концентрации примерно от 1% до 15%; Твин-80 в концентрации примерно от 0,001% до 0,5% (м/о); цитратный буфер в концентрации примерно от 5 мМ до 200 мМ, так чтобы рН композиции составил примерно от 6,0 до 7,0; и факультативно, включает этап получения из композиции готовой лекарственной формы.
Изобретение также относится к способу или процессу приготовления восстановленной композиции, содержащей агент, связывающий ФВ, например, ALX-0081, как описано в настоящей заявке. Способ включает: лиофилизацию смеси агента, связывающего ФВ, лиопротектора, сурфактанта и буфера, с получением лиофилизированной смеси; и восстановление лиофилизированной смеси в разбавителе, с приготовлением композиции, как описано в настоящей заявке. В частности, композиция включает: (а) агент, связывающий ФВ, например, ALX-0081 в концентрации примерно от 0,1 до 80 мг/мл; (b) сахарозу в концентрации примерно от 1% до 15% (м/о); (с) Твин-80 в концентрации примерно от 0,001% до 0,5% (о/о); и (d) цитратный буфер в концентрации примерно от 5 до 200 мМ, так чтобы рН композиции составлял примерно от 6 до 7,0; и факультативно включает этап приготовления готовой лекарственной формы из композиции.
Настоящее изобретение также относится к способу стабилизации агента, связывающего ФВ, предпочтительно, полипептида, включающего по меньшей мере одну из SEQ ID NO: 1-19, для хранения, включающему приготовление композиции, как описано в настоящей заявке.
Кроме того, изобретение относится к способу хранения агента, связывающего ФВ, предпочтительно полипептида, включающего по меньшей мере одну из SEQ ID NO: 1-19, включающему приготовление композиции, как описано в настоящей заявке.
Также обеспечиваются фармацевтические или диагностические композиции, включающие любые из композиций, описанных в настоящей заявке или полученных способами, описанными в настоящей заявке.
Далее, настоящее изобретение относится к способу анализа продукта или процесса, например, производственного процесса. Способ включает обеспечение композиции агента, связывающего ФВ, например, ALX-0081, как описано в настоящей заявке, и оценку параметра композиции, такого как цветность, прозрачность, вязкость или количество одного или нескольких видов с ВММ, НММ, как описано в настоящей заявке. Оценка может включать определение одного или нескольких параметров, такое как определение соответствия параметра предварительно выбранным критериям, например, определение наличия предварительного выбранного критерия или его соответствия предварительно установленному диапазону, таким образом, с анализом процесса. Например, оценка процесса включает определение стабильности композиции агента, связывающего ФВ. Стабильность композиции ALX-0081 можно оценить, например, по формированию агрегатов, которые количественно определяют, например, с помощью эксклюзионной высокоэффективной жидкостной хроматографией (Э-ВЭЖХ), по цветности, прозрачности, или вязкости, как описано в настоящей заявке.
Кроме того, способ может дополнительно включать сравнение двух или более образцовых композиций в способе мониторинга или контроля вариаций между сериями, сравнения препарата со стандартным образцом, классификации, селекции, принятия или браковки, выпуска или приостановки, переработки в лекарственный продукт, отгрузки, перемещения в другой участок, образования препарата, маркировки, или упаковки композиции, на основе сравнения. Кроме того, способ может дополнительно включать обеспечение протокола, включающего данные, относящиеся к оцениваемому параметру композиции, и факультативно включающие идентификатор серии композиции; передачу указанного протокола лицу, принимающему решение; факультативно, получение сообщения от указанного лица, принимающего решение; факультативно, принятие решения о выпуске или продаже серии композиции на основе сообщения от лица, принимающего решение.
Также обеспечиваются наборы или продукты производства, включающие композицию из настоящего изобретения и инструкции по их применению, например, специалистом в области здравоохранения. Наборы или продукты производства могут включать флакон или шприц, содержащий композицию из настоящего изобретения, как описано в настоящей заявке. Предпочтительно, флакон или шприц построен из стекла, пластика или полимерного материала, выбранного из циклического олефинового полимера или сополимера. Далее, композиция может также присутствовать в инъекционном устройстве (например, шприце для инъекций, например, предварительно заполненном шприце для инъекций).
Изобретение также обеспечивает фармацевтические стандартные лекарственные формы, включающие стандартные композиции из настоящего изобретения, пригодные для парентерального введения (например, интрадермально, внутримышечно, интраперитонеально, внутривенно или подкожно) композиции из изобретения пациенту-человеку.
Далее, композиции из настоящего изобретения можно применять для хранения агента, связывающего ФВ, предпочтительно, полипептида, содержащего по меньшей мере одну из SEQ ID NO: 1-19, такую как ALX-0081, как описано в настоящей заявке, где указанное хранение составляет 1-36 месяцев, такое как 1; 1,5; 3, 6, 9, 12, 18, 24, 30 или 36 месяцев, предпочтительно, по меньшей мере 12 месяцев, например, при температуре от -70°С до +40°С, такой как -70°C, -20°C, +5°C, +25°C или +40°C, предпочтительно при температуре от -70°C до +25°C.
Настоящее изобретение также относится к способу лечения или профилактики ФВ-зависимого заболевания, например, такого как острый коронарный синдром (ОКС), транзиторная церебральная ишемическая атака, нестабильная или стабильная стенокардия, инсульт, инфаркт миокарда или тромботическая тромбоцитопеническая пурпура (ТТП); где указанный способ включает применение у субъекта фармацевтической композиции, включающей композицию из изобретения, таким образом, со снижением одного или нескольких симптомов, связанных с указанным ФВ-зависимым заболеванием. В частности, указанное ФВ-зависимое заболевание является ТТП.
4. Краткое описание фигур
Фиг. 1. Поточная диаграмма, представляющая различные этапы программы стандартной 65-часовой лиофилизации, проводимой для ALX-0081.
Фиг. 2А. Релевантная часть ОФ-ВЭЖХ хроматограмм ALX-0081 спустя 1 и 2 месяца хранения при 70°C, +5°C и +25°C; mAU: милли - единицы поглощения.
Фиг. 2В. Увеличение релевантной части ОФ-ВЭЖХ хроматограмм ALX-0081 спустя 0, 4 и 8 недель инкубации при 37°C. Расщепление основного пика ОФ-ВЭЖХ наблюдается в результате пролонгированной инкубации при 37°C (0, 4, 8 недель); mAU: милли - единицы поглощения.
Фиг. 3А. Наложение профилей Э-ВЭЖХ контрольного цитратного буфера (bcb) и ALX-0081 в 20 мM цитратном буфере, pH 7,0 при 55,9 мг/мл до (a) и после 10 циклов замораживания-оттаивания (ЗО) при -20°C (c) и -70°C (b) (λ = 280 нм). Минимальный цитратный пик наблюдается для образцов, предварительно разбавленных в буфере для разделения; mAU: милли - единицы поглощения.
Фиг. 3В. Наложение профилей Э-ВЭЖХ контрольного цитратного буфера (bcb) и ALX-0081 в 20 мM цитратном буфере, pH 7,0 при 55,9 мг/мл, спустя примерно 1 неделю хранения при +4°C (λ = 280 нм). ALX-0081 давал при разделении один главный пик (97%), соответствующий интактному, немодифицированному ALX-0081, и малые предварительные пики, представляющие только 3% общей площади пика. Минорный цитратный пик наблюдается для образцов, предварительно разбавленных в буфере для разделения; mAU: милли - единицы поглощения.
Фиг. 4А. Интенсивность рассеяния перемешиваемых образцов ALX-0081 в 50 мM цитратном буфере, pH 6,0; 50 мM цитратном буфере, pH 6,0 + 0,01% Твин-80 (о/о) и 50 мM цитратном буфере, pH 6,0 + 0,02% Твин-80 (о/о) при +25°C. «+» представляет образцы в 50 мМ цитратном буфере, рН 6,0 (y=0,0044x + 3,5962, R²=0,9549); «o» представляет образцы в 50 мМ цитратном буфере, рН 6,0 + 0,02% Твин-80 (о/о) (y=0,0002x + 1,0447, R²=0,4673); «x» представляет образцы в 50 мМ цитратном буфере, рН 6,0 + 0,01% Твин-80 (о/о) (y=0,0004x + 0,5125, R²=0,6804); (ось х = время в секундах; ось у = интенсивность рассеяния).
Фиг. 4В. Интенсивность рассеяния перемешиваемых образцов ALX-0081 в 50 мM цитратном буфере, pH 6,0; 50 мM цитратном буфере, pH 6,5 + 0,01% Твин-80 (о/о) и 50 мM цитратном буфере, pH 6,5 + 0,02% Твин-80 (о/о) при +25°C. «+» представляет образцы в 50 мМ цитратном буфере, рН 6,5 (y=0,0041x + 4,7667, R²=0,9431); «o» представляет образцы в 50 мМ цитратном буфере, рН 6,5 + 0,02% Твин-80 (о/о) (y=0,0004x – 0,0208, R²=0,9391); «x» представляет образцы в 50 мМ цитратном буфере, рН 6,5 + 0,01% Твин-80 (о/о) (y=0,0001x – 1,8853, R²=0,0376); (ось х = время в секундах; ось у = интенсивность рассеяния).
Фиг. 5. Наложение профилей капиллярного изоэлектрофокусирования ALX-0081 при 5 мг/мл в D-PBS + 200 мM глицин + 0,01% Твин-80 спустя 1 месяц хранения при +40°C (a) и -70°C (b); (λ = 280 нм). AU: единицы поглощения; pxlpos: расположение пикселов.
Фиг. 6. Изображение лиофилизированных композиций ALX-0081 (форма 3 = цитрат/сахароза, рН 6,0; форма 7 = цитрат/сахароза, рН 6,5; форма 17 = D-PBS/глицин) до (панель A) и после восстановления водой Milli-Q (панель В).
Фиг. 7. Изображение лиофилизированных композиций на основе ALX-0081 цитрата/сахарозы.
Фиг. 8. Изображения жидких композиций ALX-0081, 28 мг/мл, содержащих 15, 20, 25, 30, 40 и 50 мМ цитратный буфер, рН 6,5 спустя 4 дня хранения при +25°С (панель А) или +5°С (панель В). Чистый цитратный буфер (50 мМ) включен в качестве контроля.
Фиг. 9. Изображения жидких композиций ALX-0081, 20 мг/мл, содержащих 15 мМ цитратный буфер, рН 6,5, и различные количества сахарозы и Твин-80 спустя 4 дня хранения при +25°С (панель А) или +5°С (панель В). Чистый цитратный буфер (50 мМ) включен в качестве контроля.
Фиг. 10. Прогноз содержания пироглутамата в лиофилизированном лекарственном продукте ALX-0081 в зависимости от времени при хранении при +5°С.
Фиг. 11. Прогноз содержания пироглутамата в лиофилизированном лекарственном продукте ALX-0081 в зависимости от времени при хранении при +25°С.
5. Подробное описание изобретения
Если не указано иное, все способы, этапы, методики и манипуляции, которые конкретно не описаны подробно, могут проводиться, и проводятся известным способом, как понятно для специалиста в данной области техники. Ссылки, например, можно сделать на стандартные справочники и общий уровень техники, упомянутые в настоящей заявке, и на дополнительные ссылки, приведенные в ней; а также, например, следующие обзоры: Presta, Adv. Drug Deliv. Rev. 2006, 58 (5-6): 640-56; Levin and Weiss, Mol. Biosyst. 2006, 2(1): 49-57; Irving et al., J. Immunol. Methods, 2001, 248(1-2), 31-45; Schmitz et al., Placenta, 2000, 21 Suppl. A, S106-12, Gonzales et al., Tumour Biol., 2005, 26(1), 31-43, описывающие методики белковой инженерии, такой как созревание аффинности и другие методики улучшения специфичности и других необходимых свойств белков, таких как иммуноглобулины.
Неожиданно было установлено, что агенты, связывающие ФВ, и в частности, ALX-0081 (SEQ ID NO:1), можно применять в конкретных режимах дозирования у человека. Агенты, связывающие ФВ, и в частности, ALX-0081, обеспечивают фармакодинамический эффект, с быстрым развитием эффекта немедленно в конце введения дозы и сохранением активности в течение примерно 12-24 часов. Кроме того, было установлено, что агенты, связывающие ФВ, и в частности, ALX-0081 (SEQ ID NO:1), хорошо переносятся и безопасны у здоровых мужчин-добровольцев. Эти результаты показывают, что агенты, связывающие ФВ, и в частности ALX-0081 (SEQ ID NO:1), пригодны для кратковременного лечения пациентов со стабильной стенокардией, подвергающихся чрескожной коронарной ангиопластике (далее также «ЧКА»), и лечения пациентов с тромботической тромбоцитопенической пурпурой (далее также «ТТП»)).
Тем не менее, современные композиции агентов, связывающих ФВ, и в частности, ALX-0081 (SEQ ID NO:1), которые применяли у реципиентов-людей, можно улучшить.
Изменение состава лекарственного препарата для агентов, связывающих ФВ, и в частности ALX-0081, описанного в настоящей заявке, обеспечивает новую композицию на основе цитрата/сахарозы с повышенной растворимостью (до 80 мг/мл) и значительно улучшенной стабильностью при хранении в жидком состоянии (например, происходит меньшее окисление при хранении новой композиции, по сравнению с оригинальной композицией, в жидком состоянии). Кроме того, в лиофилизированной форме по существу не происходит окисления или асп-изомеризации, которые можно было бы выявить спустя 12 месяцев хранения +40°С, или даже спустя 24 месяца хранения при +40°С. Все еще может наблюдаться остаточное формирование малых количеств пироглутамата. Дальнейшая оптимизация концентрации цитрата и сахарозы приводит к снижению содержания влаги в лиофилизированном продукте, таким образом, сводя к минимуму уровень образования остаточного пироглутамата.
Соответственно, настоящее изобретение обеспечивает стабильные жидкие или лиофилизированные композиции агентов, связывающих ФВ (например, ALX-0081), и их применение для лечения или профилактики ФВ-зависимых заболеваний.
5.1. Полипептид(ы) из изобретения
Агенты, связывающие ФВ, используемые в настоящем изобретении, как правило, являются белками или пептидами, связывающимися с человеческим фактором Виллебранда (ФВ, SEQ ID NO: 20). Предпочтительно, агентами, связывающимся с ФВ, являются белки или полипептиды, включающие или состоящие по меньшей мере из одной иммуноглобулиновой последовательности, такой как иммуноглобулиновый одиночный вариабельный домен (ИОВД). Еще более предпочтительно, агенты, связывающие ФВ из настоящего изобретения, являются белками или полипептидами, включающими или состоящими из SEQ ID NO: 1-19, и наиболее предпочтительно SEQ ID NO: 1. Агенты, связывающие ФВ, могут применяться в качестве вспомогательной терапии пациентов с ОКС, подвергающихся ЧКА, или в качестве лечения тромботической тромбоцитопенической пурпуры (ТТП). Термины «белок», «полипептид» и «аминокислотная последовательность» применяются в настоящей заявке взаимозаменяемо. Таким образом, аминокислотная последовательность из настоящего изобретения является агентом, связывающим ФВ.
Таким образом, подходящие агенты, связывающие ФВ, для применения в настоящем изобретении могут включать соединение из таблицы А-1, например, SEQ ID NO: 1-19, или соединение, имеющее 80% или больше, более предпочтительно 85% или больше, более предпочтительно 90%, 95%, 96%, 97%, 98%, 99% или больше идентичности аминокислотной последовательности с соединением из таблицы А-1 (см. «идентичность последовательности» в разделе «Определения»).
Предпочтительно, агенты, связывающие ФВ, для применения в настоящем изобретении, являются соединениями, подобными 12А02Н1. Для целей настоящего изобретения соединения, подобные 12A02H1, являются соединением, включающим 12A02H1 (т.е. SEQ ID NO: 19) или соединением, имеющим 80% или больше, более предпочтительно 85% или больше, наиболее предпочтительно 90%, 95%, 96%, 97%, 98%, 99% или больше идентичности аминокислотной последовательности (как определено в настоящей заявке) с 12A02H1 (SEQ ID NO: 19). Особо предпочтительным агентом, связывающим ФВ, является ALX-0081 (SEQ ID NO: 1).
Все агенты, связывающие ФВ, хорошо известны из литературы. Это включает их производство (см., в частности, например, WO2006/122825, а также WO2004/062551). Например, ALX-0081 готовят так, как описано в WO 2006/122825 или WO 2009/115614 [P08-013].
Если не указано иное, термин «иммуноглобулиновая последовательность», используемый для обозначения тяжелых цепей антитела или обычного четырехцепочечного антитела, применяется в качестве общего термина для включения как полноразмерного антитела, его отдельных цепей, так и всех его частей, доменов или фрагментов (включая антигенсвязывающие домены или фрагменты, такие как VHH домены или VH/VL домены, соответственно, но не ограничиваясь ими). Термины «антигенсвязывающая молекула» или «антигенсвязывающий белок» применяются взаимозаменяемо с иммуноглобулиновой последовательностью, и включают иммуноглобулиновый одиночный вариабельный домен, такой как Нанотела®.
Варианты настоящего изобретения относятся к иммуноглобулиновым последовательностям, которые являются иммуноглобулиновыми одиночными вариабельными доменами, такими как последовательности вариабельных доменов легкой цепи (например, VL-последовательность), или последовательности вариабельных доменов тяжелой цепи (например, VН-последовательность); в частности, последовательности вариабельных доменов тяжелой цепи, которые получены из обычного четырехцепочечного антитела, или последовательности вариабельных доменов тяжелой цепи, которые получены из тяжелых цепей антитела (например, VНН-последовательность).
Термин «иммуноглобулиновый одиночный вариабельный домен» определяет молекулы, в которых антигенсвязывающий участок присутствует на отдельном иммуноглобулиновом домене или его подходящих фрагментах, или образован ими. Это отделяет иммуноглобулиновые одиночные вариабельные домены от «обычных» иммуноглобулинов или их фрагментов, где два иммуноглобулиновых домена, в частности, два вариабельных домена взаимодействуют с формированием антигенсвязывающего участка. Как правило, в обычных иммуноглобулинах вариабельный домен тяжелой цепи (VH) и вариабельный домен легкой цепи (VL) взаимодействуют до формирования антигенсвязывающего участка. В этом случае гипервариабельные участки (CDR) обоих VH и VL вносят вклад в антигенсвязывающий участок, т.е. всего 6 CDR вовлечены в формирование антигенсвязывающего участка.
Напротив, антигенсвязывающий участок из иммуноглобулинового одиночного вариабельного домена формируется единичным VH или VL доменом. Таким образом, антигенсвязывающий участок иммуноглобулинового одиночного вариабельного домена формируется не более чем тремя CDR, например, одним, двумя или тремя CDR.
Таким образом, термин «иммуноглобулиновый одиночный вариабельный домен» не включает обычные иммуноглобулины или их фрагменты, которые требуют взаимодействия по меньшей мере двух вариабельных доменов для формирования антигенсвязывающего участка. Это также относится к вариантам осуществления изобретения, «включающим» или «содержащим» иммуноглобулиновый одиночный вариабельный домен. В контексте настоящего изобретения такие варианты осуществления исключают обычные иммуноглобулины или их фрагменты. Таким образом, композиция, «включающая» или «содержащая» иммуноглобулиновый одиночный вариабельный домен, может относиться, например, к конструкциям, включающим более одного иммуноглобулинового одиночного вариабельного домена. Альтернативно, они могут содержать дополнительные компоненты, иные, чем иммуноглобулиновые одиночные вариабельные домены, например, вспомогательные агенты разного рода, белковые метки, красители, пигменты, и т.д. Однако эти термины включают фрагменты обычных иммуноглобулинов, где антигенсвязывающий участок сформирован одиночным вариабельным доменом.
В соответствии с настоящим изобретением, полипептид из изобретения, в частности, иммуноглобулиновые последовательности, могут состоять, или включать одно или более из следующего: доменные антитела, или аминокислотные последовательности, пригодные для применения в качестве доменных антител, однодоменные антитела, или аминокислотные последовательности, пригодные для применения в качестве однодоменных антител, «dAb», или аминокислотные последовательности, пригодные для применения в качестве dAb, или Нанотела®, включающие VHH последовательности, такие как гуманизированные VHH последовательности или камелизированные VH последовательности, и предпочтительно являющиеся Нанотелами®, но не ограничивающиеся ими.
Настоящее изобретение охватывает подходящие фрагменты иммуноглобулиновых одиночных вариабельных доменов. «Подходящие фрагменты» иммуноглобулиновых одиночных вариабельных доменов относятся к полипептидам, содержащим меньше аминокислот, чем нативный иммуноглобулиновый одиночный вариабельный домен, но все еще демонстрирующим антигенсвязывающую активность (которые обычно содержат по меньшей мере некоторые из аминокислотных остатков, формирующих по меньшей мере один из CDR, как описано далее в настоящей заявке). Такие иммуноглобулиновые одиночные вариабельные домены и фрагменты наиболее предпочтительно содержат укладку иммуноглобулиновой цепи, или способны к формированию при подходящих условиях укладки иммуноглобулиновой цепи. В частности, иммуноглобулиновые одиночные вариабельные домены и их фрагменты способны к связыванию с целевым антигеном. Как таковой, иммуноглобулиновый одиночный вариабельный домен может, например, содержать последовательность вариабельного домена легкой цепи (например, VL-последовательность) или её подходящий фрагмент; или последовательность вариабельного домена тяжелой цепи (например, VН-последовательность или VHH-последовательность), или её подходящий фрагмент; пока он способен к формированию одиночной антигенсвязывающей единицы (т.е. функциональной антигенсвязывающей единицы, которая по существу состоит из иммуноглобулинового одиночного вариабельного домена, так чтобы не требовалось взаимодействия одиночного антигенсвязывающего домена с другим вариабельным доменом для формирования антигенсвязывающей единицы, как например, в случае вариабельных доменов, присутствующих, например, в обычных антителах, и scFv фрагментов, для которых необходимо взаимодействие с другим вариабельным доменом, например, через VH/VL взаимодействие, для формирования функционального антигенсвязывающего домена).
Иммуноглобулиновые последовательности из настоящего изобретения предпочтительно находятся по существу в изолированной форме. Иммуноглобулиновые последовательности из настоящего изобретения могут также формировать часть белка или полипептида из настоящего изобретения (как описано в настоящей заявке), которые могут включать или по существу состоять из одной или нескольких аминокислотных последовательностей из настоящего изобретения, и которые могут факультативно содержать одну или несколько дополнительных аминокислотных последовательностей (все факультативно связаны с одним или несколькими подходящими линкерами). Например, и без ограничения, одну или несколько аминокислотных последовательностей из настоящего изобретение можно применять в качестве связывающей единицы в таком белке или полипептиде, которые могут факультативно содержать одну или несколько дополнительных аминокислотных последовательностей, служащих в качестве связывающей единицы, для обеспечения одновалентного, поливалентного или полиспецифического полипептида из настоящего изобретения, соответственно, как описано в настоящей заявке. Такой белок или полипептид может также быть по существу в изолированной форме.
Настоящее изобретение относится к иммуноглобулиновым последовательностям различного происхождения, включая иммуноглобулиновые последовательности мыши, крысы, кролика, осла, человека и верблюда. Изобретение также включает полностью человеческие, гуманизированные или химерные иммуноглобулиновые последовательности. Например, изобретение включает верблюжьи иммуноглобулиновые последовательности и гуманизированные верблюжьи иммуноглобулиновые последовательности, или камелизированные доменные антитела, например, камелизированные dAb, как описано Ward et al. (см., например, WO 94/04678 и Davies and Riechmann (1994 и 1996)). Далее, изобретение включает слитые иммуноглобулиновые последовательности, например, формирующие поливалентную и/или полиспецифическую конструкцию (для поливалентных и полиспецифических полипептидов, содержащих один или несколько VHH доменов, и их препаратов можно также сделать ссылку на Conrath et al., J. Biol. Chem., Vol. 276, 7346-7350, 2001, а также, например, на WO96/34103 и WO99/23221), и иммуноглобулиновые последовательности, включающие метки или другие функциональные компоненты, например, токсины, маркеры, радиохимикаты, и т.д., которые получены из иммуноглобулиновых последовательностей из настоящего изобретения. Иммуноглобулиновые одиночные вариабельные домены также описаны у акулы (также обозначаемые как «IgNAR», как описано, например, в WO03/014161 или Streltsov, 2005).
В частном варианте осуществления иммуноглобулиновые одиночные вариабельные домены из настоящего изобретения являются Нанотелами®, в частности, верблюжьими VHH доменами, гуманизированными VHH доменами или камелизированными VH доменами. Специалисту в данной области техники хорошо знакома гуманизация VHH и/или камелизация VH доменов.
Аминокислотная последовательность и структура иммуноглобулиновой последовательности, в частности, Нанотела® могут быть рассмотрены, без какого-либо ограничения, как включающие четыре каркасных участка или «FR», которые обозначаются в данной области техники и в настоящей заявке как «Каркасный участок 1» или «FR1»; как «Каркасный участок 2» или «FR2»; как «Каркасный участок 3» или «FR3»; и как «Каркасный участок 4» или «FR4», соответственно; где каркасные участки перемежаются тремя гипервариабельными участками или «CDR», которые обозначаются в данной области техники «Гипервариабельный участок 1» или «CDR1»; как «Гипервариабельный участок 2» или «CDR2», как «Гипервариабельный участок 3» или «CDR3», соответственно.
Общее число аминокислотных остатков в Нанотеле® может составлять 110-120, предпочтительно 112-115, и наиболее предпочтительно 113. Однако необходимо отметить, что части, фрагменты, аналоги или производные (как далее описано в настоящей заявке) Нанотела® не ограничиваются конкретно их длиной и/или размером, если эти части, фрагменты, аналоги или производные соответствуют дополнительным требованиям, изложенным в настоящей заявке, и также предпочтительно являются пригодными для целей, описанных в настоящей заявке.
Таким образом, как правило, иммуноглобулиновые вариабельные домены являются аминокислотными последовательностями, состоящими, или по существу состоящими из четырех каркасных участков (FR1 - FR4, соответственно), и 3 гипервариабельных участков (CDR1 - CDR3, соответственно). «По существу состоит» в настоящем контексте означает, что могут присутствовать дополнительные элементы, например, такие как метки, используемые для очистки или маркировки, но такие дополнительные элементы являются малыми, по сравнению с иммуноглобулиновым одиночным вариабельным доменом как таковым, и не препятствуют антигенсвязывающей активности иммуноглобулинового одиночного вариабельного домена.
Как применяется в настоящей заявке, термин «иммуноглобулиновые последовательности» или «иммуноглобулиновые одиночные вариабельные домены» относится как последовательностям нуклеиновых кислот, кодирующим полипептид, так и к полипептиду как таковому. Какое-либо более ограничивающее значение станет понятным из специфического контекста.
В частности, аминокислотная последовательность из настоящего изобретения может быть Нанотелом® или его подходящим фрагментом. Для дальнейшего описания VHH и Нанотел приводится ссылка на обзорную статью Muyldermans в Reviews in Molecular Biotechnology 74(2001), 277-302; а также следующие патентные заявки, которые упомянуты в общем уровне техники: WO94/04678, WO95/04079 и WO96/34103 от Vrije Universiteit Brussel; WO94/25591, WO99/37681, WO00/40968, WO00/43507, WO00/65057, WO01/40310, WO01/44301, EP1134231 и WO02/48193 от Unilever; WO97/49805, WO01/21817, WO03/035694, WO03/054016 и WO03/055527 от Vlaams Instituut voor Biotechnologie (VIB); WO03/050531 от Algonomics N.V. и Ablynx N.V.; WO 01/90190 от National Research Council of Canada; WO03/025020 (= EP1433793) от Institute of Antibodies; а также WO04/041867, WO04/041862, WO04/041865, WO04/041863, WO04/062551, WO05/044858, WO06/40153, WO06/079372, WO06/122786, WO06/122787 и WO06/122825, от Ablynx N.V., и другие опубликованные патентные заявки от Ablynx N.V. Также приводятся ссылки на предшествующий уровень техники, упомянутый в этих заявках, и в частности, на перечень ссылок, упомянутых на страницах 41-43 Международной заявки WO06/040153, из которой перечень и ссылки включены настоящим посредством ссылки. Как описано в этих ссылках, Нанотела (в частности, VHH последовательности, и частично гуманизированные нанотела) могут, в частности, быть охарактеризованы наличием одного или нескольких «характерных остатков» в одном или нескольких из каркасных участков. Дополнительное описание нанотел, включая гуманизацию и/или камелизацию нанотел, а также другие модификации, части или фрагменты, производные или «гибриды нанотел», поливалентные конструкции (включая не ограничивающие примеры линкерных последовательностей) и различные модификации для повышения срока годности нанотел и их препаратов можно найти, например, в WO07/104529.
Иммуноглобулиновые одиночные вариабельные домены, обеспеченные настоящим изобретением, предпочтительно находятся в изолированной форме или по существу изолированной форме. Иммуноглобулиновые последовательности из настоящего изобретения могут также формировать часть белка или полипептида из настоящего изобретения, которая может включать или по существу состоять из одного или нескольких иммуноглобулиновых одиночных вариабельных доменов, и которая может факультативно дополнительно содержать одну или несколько дополнительных аминокислотных последовательностей (все факультативно связанные одним или несколькими подходящими линкерами). Например, и без ограничения, один или несколько иммуноглобулиновых одиночных вариабельных доменов можно применять в качестве связывающей единицы в таком белке или полипептиде, который может факультативно содержать одну или несколько дополнительных аминокислотных последовательностей, которые могут служить как связывающая единица, так чтобы обеспечивать одновалентный, поливалентный или полиспецифический полипептид из настоящего изобретения, соответственно, как описано в настоящей заявке. Такой белок или полипептид может также быть в изолированной или по существу изолированной форме. Таким образом, в соответствии с настоящим изобретением, иммуноглобулиновые одиночные вариабельные домены включают конструкции, содержащие две или более антигенсвязывающих единиц в форме одиночных доменов, как изложено выше. Например, два (или более) иммуноглобулиновых одиночных вариабельных домена с одной и той же или разной антигенной специфичностью могут быть сцеплены до формирования, например, двухвалентной, трехвалентной или поливалентной конструкции. Путем объединения иммуноглобулиновых одиночных вариабельных доменов из двух или более специфичностей, можно формировать биспецифические, триспецифические и т.д. конструкции. Например, полипептид в соответствии с настоящим изобретением может содержать два иммуноглобулиновых одиночных вариабельных домена, направленных против мишени А, и один иммуноглобулиновый одиночный вариабельный домен против мишени В, что делает его двухвалентным для А и одновалентным для В. Такие конструкции и их модификации, которые легко может представить специалист в данной области техники, все охватываются настоящим изобретением. В частных вариантах осуществления изобретение относится к би-паратопным конструкциям, содержащим по меньшей мере два иммуноглобулиновых одиночных вариабельных домена, направленных к различным эпитопам в пределах одного и того же целевого антигена.
Все эти молекулы также обозначаются как «полипептид из настоящего изобретения», что является синонимом «иммуноглобулиновых последовательностей» или «иммуноглобулиновых одиночных вариабельных доменов» из настоящего изобретения.
Кроме того, термин «последовательность», как применяется в настоящей заявке (например, в таких терминах, как «иммуноглобулиновая последовательность», «последовательность антитела», «последовательность вариабельного домена, «VHH-последовательность» или «белковая последовательность»), необходимо в целом понимать как включающий как релевантную аминокислотную последовательность, так и последовательность нуклеиновых кислот или нуклеотидную последовательность, кодирующую её, если в контексте не требуется более ограниченной интерпретации.
В соответствии с одним не ограничивающим вариантом осуществления настоящего изобретения, иммуноглобулиновые последовательности, Нанотело® или полипептид из настоящего изобретения являются гликозилированными. В соответствии с другим не ограничивающим вариантом осуществления изобретения, иммуноглобулиновые последовательности, Нанотело® или полипептид из настоящего изобретения являются не гликозилированными.
5.2. «Связывание» с антигеном
Настоящее изобретение относится к иммуноглобулиновым последовательностям, которые могут связываться и/или обладать аффинностью к антигену, как определено в настоящей заявке, например, к фактору Виллебранда. В контексте настоящего изобретения термин «связывающийся и/или обладающий аффинностью» к определенному антигену имеет обычное значение в данной области техники, как подразумевается, например, в контексте антител и их соответствующих антигенов.
В частных вариантах осуществления настоящего изобретения термин «связывающийся и/или обладающий аффинностью» означает, что иммуноглобулиновая последовательность специфически взаимодействует с антигеном, и применяется взаимозаменяемо с иммуноглобулиновыми последовательностями «против» указанного антигена.
Термин «специфичность» относится к числу различных типов антигенов или антигенных детерминант, с которыми может связываться конкретная иммуноглобулиновая последовательность, антигенсвязывающая молекула или антигенсвязывающий белок (такой, как иммуноглобулиновый одиночный вариабельный домен, Нанотело® или полипептид из настоящего изобретения). Специфичность антигенсвязывающего белка можно определить на основе аффинности и/или авидности. Аффинность, представленная константой равновесия для диссоциации антигена и антигенсвязывающего белка (КД), является мерой прочности связывания между антигенной детерминантой и антигенсвязывающим участком на антигенсвязывающем белке: чем меньше значение КД, тем выше прочность связывания между антигенной детерминантой и антигенсвязывающей молекулой (альтернативно, аффинность может также быть выражена в виде константы аффинности (КА), которая равна 1/КД). Как понятно для специалиста в данной области техники (например, на основе дальнейшего описания), аффинность может быть определена как таковая, в зависимости от интересующего специфического антиген. Авидность является мерой прочности связывания между антигенсвязывающей молекулой (такой, как иммуноглобулиновый одиночный вариабельный домен, Нанотело® или полипептид из настоящего изобретения) и соответствующим антигеном. Авидность относится как к аффинности между антигенной детерминантой и её антигенсвязывающим участком на антигенсвязывающей молекуле, так и к числу соответствующих участков связывания, присутствующих на антигенсвязывающей молекуле.
Как правило, иммуноглобулиновые последовательности из настоящего изобретения (такие, как аминокислотные последовательности, иммуноглобулиновые одиночные вариабельные домены, Нанотела® и/или полипептиды из настоящего изобретения) связываются с антигеном с константой диссоциации (КД) от 10-5 до 10-12 моль/литр или меньше, и предпочтительно от 10-7 до 10-12 моль/литр или меньше, и более предпочтительно от 10-8 до 10-12 моль/литр (т.е. с константой ассоциации (КА) от 105 до 1012 моль/литр или больше, и предпочтительно от 107 до 1012 моль/литр или больше, и более предпочтительно от 108 до 1012 моль/литр), и/или связывание с их антигеном определяется как Коn скоростью от 102 М-1с-1 до примерно 107 М-1с-1, предпочтительно от 103 М-1с-1 до 107 М-1с-1, более предпочтительно от 104 М-1с-1 до 107 М-1с-1, такая как от 105 М-1с-1 до 107 М-1с-1; и/или связывание с их антигеном, как определяется в настоящей заявке, Коff скоростью от 1 с-1 (t1/2=0,69 сек) до 10-6 с-1 (с обеспечением почти необратимого комплекса с t1/2 из множества суток), предпочтительно от 10-2 с-1 до 10-6 с-1, более предпочтительно от 10-3 с-1 до 10-6 с-1, такой как от 10-4 с-1 до 10-6 с-1.
Любое значение КД больше 10-4 М (или любое значение КА ниже 104 М-1) обычно считается показателем неспецифического связывания.
Предпочтительно, одновалентная иммуноглобулиновая последовательность из настоящего изобретения связывается с необходимым антигеном с аффинностью меньше 500 нМ, предпочтительно меньше 200 нМ, более предпочтительно меньше 10 нМ, такой как меньше 500 пМ.
Специфическое связывание антигенсвязывающего белка с антигеном или антигенной детерминантой можно определить любым известным подходящим способом, например, анализом Скэтчарда и/или анализами конкурентного связывания, такими как радиоиммунные анализы (РИА), ферментативные иммуноанализы (ФИА), и конкурентные сэндвич-анализы, и их различные варианты, известные в данной области техники; а также другие методики, упомянутые в настоящей заявке.
Константа диссоциации (КД) может быть истинной или кажущейся константой диссоциации, как понятно специалисту в данной области техники. Способы определения константы диссоциации известны специалисту в данной области техники, и включают, например, методики, упомянутые в настоящей заявке. В связи с этим, также должно быть понятно, что невозможно измерить константы диссоциации больше 10-4 моль/литр или 10-3 моль/литр (например, 10-2 моль/литр). Факультативно, специалисту в данной области должно быть понятно, что (истинную или кажущуюся) константу диссоциации можно рассчитать на основе (истинной или кажущейся) константы ассоциации (КА) по отношению [KД = 1/KA].
Аффинность означает прочность или стабильность молекулярного взаимодействия. Аффинность обычно определяют по КД, или константе диссоциации, которую измеряют в моль/литр (или М). Аффинность может также быть выражена константой ассоциации, КА, которая равна 1/КД и измеряется в (моль/литр)-1 (или М-1). В настоящем описании стабильность взаимодействия между двумя молекулами (такими, как аминокислотная последовательность, иммуноглобулиновая последовательность, иммуноглобулиновый одиночный вариабельный домен, Нанотело® или полипептид из настоящего изобретения, и его назначенная мишень) главным образом выражается в терминах значения КД их взаимодействия; специалисту в данной области техники понятно, что с учетом отношения КА=1/КД, выражение прочности молекулярного взаимодействия в величине КД можно также применять для расчета соответствующего значения КА. Значение КД характеризует прочность молекулярного взаимодействия также в термодинамическом смысле, поскольку она связана со свободной энергией (DG) связывания хорошо известным отношением DG=RT.ln(KD) (эквивалентно DG=-RT.ln(KA)), где R равно газовой постоянной, Т равно абсолютной температуре, а ln означает натуральный логарифм.
КД для биологических взаимодействий, таких как связывание иммуноглобулиновых последовательностей из настоящего изобретения с ФВ, как определено в настоящей заявке, которая является значимой (например, специфической), как правило, находится в диапазоне от 10-10 М (0,1 нМ) до 10-5 (10000 нМ). Чем сильнее взаимодействие, тем ниже КД.
КД можно также выразить в виде отношения константы скорости диссоциации комплекса, обозначенной как koff, к скорости ассоциации, обозначенной kon (так что KD =koff/kon, а KA = kon/koff). Скорость диссоциации koff выражается в единицах с-1 (где «с» по системе Си означает секунды). Скорость ассоциации выражается в единицах М-1с-1.
Что касается иммуноглобулиновых последовательностей из настоящего изобретения, скорость ассоциации может варьировать от 102 М-1с-1 до 107 М-1с-1, достигая ограниченной диффузией константы скорости ассоциации для бимолекулярных взаимодействий. Скорость диссоциации связана с полужизнью определенного молекулярного взаимодействия отношением t1/2=ln(2)/koff. Скорость диссоциации иммуноглобулиновых последовательностей из настоящего изобретения может варьировать от 10-6 с-1 (почти необратимый комплекс с t1/2 из множества суток) до 1 с-1 (t1/2=0,69 с).
Аффинность молекулярного взаимодействия между двумя молекулами можно измерить посредством различных известных методик, таких как хорошо известная биосенсорная методика поверхностного плазмонного резонанса (см., например, Ober et al., Intern. Immunology, 13, 1551-1559, 2001), где одну молекулу иммобилизуют на биосенсорном чипе, а другую молекулу пропускают над иммобилизованной молекулой при условиях потока, обеспечивающих измерения kon, koff, и таким образом, значений КД (или КА). Это можно осуществлять, например, с помощью хорошо известных инструментов Biacore.
Специалисту в данной области техники также понятно, что измеренная КД может соответствовать истинной КД, если процесс измерения как-либо влияет на объективную аффинность связывания предполагаемых молекул, например, посредством аномалий, связанных с нанесением на биосенсор одной молекулы. Кроме того, истинную КД можно измерить, если одна молекула содержит более одного участка распознавания для другой молекулы. В такой ситуации на измеряемую аффинность может влиять авидность взаимодействия двух молекул.
Другим подходом, который можно применять для оценки аффинности, является 2-этапная процедура ИФА (иммуноферментного анализа) Friguet et al. (J. Immunol. Methods, 77, 305-19, 1985). Этот метод обеспечивает измерение равновесия связывания в растворенной фазе и устраняет возможные аномалии, связанные с адсорбцией одной из молекул на такой подложке, как пластик.
Однако точное измерение КД может быть достаточно трудоемким, и в результате часто определяют значения кажущейся КД для оценки прочности связывания двух молекул. Необходимо отметить, что поскольку все измерения проводят последовательным образом (например, сохраняя неизменными условия анализа), определение кажущейся КД можно применять в виде приближения к истинной КД, и таким образом, в настоящем документе КД и кажущаяся КД применяются с равной значимостью или релевантностью.
Наконец, необходимо отметить, что во многих случаях опытный ученый может признать удобным определение аффинности связывания по отношению к некоторой контрольной молекуле. Например, для оценки прочности связывания между молекулами А и В, можно, например, использовать контрольную молекулу С, которая, как известно, связывается с В, и которая подходящим образом маркирована флуорофорной или хромофорной группой или другим химическим компонентом, таким как биотин, для упрощения детекции в ИФА или FACS (клеточной сортировки с активацией флуоресценции) или другом формате (флуорофором для флуоресцентной детекции, хромофором для детекции с поглощением света, биотином для стрептавидин-опосредованной ИФА детекции). Как правило, контрольную молекулу С сохраняют в фиксированной концентрации, а концентрация А варьирует для определенной концентрации или количества В. В результате получают значение IC50, соответствующее концентрации А, в которой сигнал, измеряемый для С при отсутствии А, разделен на 2. С условием, что известна KDref, КД контрольной молекулы, а также общую концентрацию cref контрольной молекулы, кажущуюся КД для взаимодействия А-В можно получить из следующей формулы: KД =IC50/(1+cref/ KDref). Отмечаем, что если cref << KDref, KD ≈ IC50. С условием, что измерения IC50 проводят последовательным образом (например, сохраняя фиксированную cref) для сравниваемых связывающих агентов, прочность или стабильность молекулярного взаимодействия можно оценить посредством IC50, и это измерение считается эквивалентом КД или кажущейся КД на протяжении данного текста.
5.3. Целевой антиген
Иммуноглобулиновые одиночные вариабельные домены из настоящего изобретения связываются и/или обладают аффинностью к ФВ. В контексте настоящего изобретения «ФВ» включает ФВ яванских макак, бабуинов, свиней, морских свинок, мышей и/или человека, но не ограничивается ими, и наиболее предпочтительно, человеческий ФВ, т.е. SEQ ID NO: 20 или GenBank entry: NP_000543.
5.4. Специфические варианты осуществления иммуноглобулиновых последовательностей
Настоящее изобретение относится к иммуноглобулиновым одиночным вариабельным доменам, описанным, или полученным посредством способов, раскрытых в WO2004/015425 [P02-008], WO2004/062551 [P03-001], WO2006/074947 [P05-001], WO2006/122825 [P05-003], WO2009/115614 [P08-013], или WO2011/067160, все от имени автора настоящей заявки.
Настоящее изобретение также охватывает оптимизированные варианты этих аминокислотных последовательностей. Как правило, «оптимизированный вариант» аминокислотной последовательности в соответствии с настоящим изобретением является вариантом, включающим одну или несколько полезных замен, таких как замены, включающие (i) степень «гуманизации»; (ii) химическую стабильность, и/или (iii) уровень экспрессии; в то время как активность (измеренная, например, посредством анализа активности, как описано в экспериментальной части WO2006/122825), остается сопоставимой (т.е. в пределах 10% отклонения) с диким типом [P05-00312A02 (как определено в WO2006/122825), или сопоставимой с вариантом 12A02H1 (SEQ ID NO: 19), также как определено в WO2006/122825. Предпочтительно, по сравнению с последовательностью дикого типа 12А02, аминокислотная последовательность из настоящего изобретения содержит по меньшей мере одну замену, и предпочтительно, по меньшей мере две таких замены, и предпочтительно, по меньшей мере три гуманизирующих замены, и предпочтительно, по меньшей мере 10 таких гуманизирующих замен.
В частном аспекте аминокислотные последовательности из настоящего изобретения содержат всего от 1 до 15, предпочтительно от 2 до 14, такое количество, как от 9 до 13, например, 10, 11 или 12 аминокислотных замен, по сравнению с последовательностью дикого типа 12А02. Как упомянуто, эти различия предпочтительно по меньшей мере включают одну и предпочтительно по меньшей мере две, такое число, как три, четыре или пять, или десять гуманизирующих замен, и могут факультативно включать одну или несколько дополнительных замен (таких как любая из указанных, или любая подходящая комбинация двух или более дополнительных замен (а)-(с), как упомянуто в настоящей заявке). Вновь, на основе настоящего описания, и факультативно после ограниченной степени проб и ошибок, специалист в данной области техники может выбрать (подходящую комбинацию) одну или несколько таких подходящих гуманизирующих и/или дополнительных замен.
Настоящее изобретение охватывает полипептидные последовательности, которые сильно схожи с любым из специфических примеров, обеспеченных в настоящей заявке, или любым из специфических примеров, определенных ссылкой выше. «Сильно схожие» означает идентичность аминокислотной последовательности по меньшей мере 90%, например, 95, 97, 98 или 99%. Сильно схожие полипептидные последовательности имеют ту же самую функцию, как последовательность, из которой они получены, т.е. они связываются с ФВ, в частности, связываются и ингибируют взаимодействие между ФВ и тромбоцитами.
В частном варианте осуществления изобретение относится к последовательностям, обладающим высоким сходством с любой из SEQ ID NO: 1-19, в частности, SEQ ID NO: 1. Однако для каждого варианта последовательности необходимо оценивать стабильность в композиции, как определено в настоящей заявке, так что настоящее изобретение, в частности, относится к вариантам последовательностей с высоким сходством, стабильным в композициях, как определено в настоящей заявке.
Способы генерации полипептидных последовательностей из настоящего изобретения широко известны и включают, например, рекомбинантную экспрессию или синтез. Специалисту в данной области техники хорошо известна подходящая технология экспрессии, например, подходящие рекомбинантные векторы и клетки-хозяева, например, бактериальные или дрожжевые клетки-хозяева. Специалисту в данной области техники также хорошо известны подходящие методики и протоколы очистки.
5,5. Композиции из настоящего изобретения
Настоящее изобретение обеспечивает композиции полипептидов, направленные против ФВ, например, иммуноглобулиновые одиночные вариабельные домены (ИОВД) или полипептиды, содержащие по меньшей мере один иммуноглобулиновый одиночный вариабельный домен, которые являются стабильными, и предпочтительно пригодными для фармацевтического применения, включая приготовление медикаментов.
Композиция агента, связывающего ФВ, например, ИОВД, включает ИОВД, соединение, служащее в качестве криопротектора и/или лиопротектора, и буфер. Значение рН композиции, как правило, составляет 5-7,5. В некоторых вариантах осуществления композицию хранят в виде жидкости. В других вариантах осуществления композицию готовят в качестве жидкости, а затем сушат, например, посредством лиофилизации или распылительной сушки, перед хранением. Сухую композицию (т.е. лиофилизат) можно применять в качестве сухого соединения, например, в виде аэрозоля или порошка, или восстанавливая до исходной или другой концентрации, например, с применением воды, буфера, или другой подходящей жидкости (разбавителя).
Способ очистки агента, связывающего ФВ, создан для обеспечения переноса агента, связывающего ФВ, в композицию, пригодную для долговременного хранения, например, в виде замороженной жидкости и/или впоследствии для лиофилизации (например, с применением цитратно/сахарозной композиции). Композицию лиофилизируют с белком, например, агентом, связывающим ФВ, в специфической концентрации. Лиофилизированная композиция может затем быть восстановлена, если необходимо, подходящим растворителем (например, водой) для повторного растворения компонентов исходной композиции до необходимой концентрации, как правило, до той же самой или более высокой концентрации, по сравнению с концентрацией перед лиофилизацией. Лиофилизированная композиция может быть восстановлена до получения композиции, имеющей концентрацию, отличающуюся от исходной концентрации (т.е. перед лиофилизацией), в зависимости от количества растворителя, добавленного к лиофилизату, относительно объема жидкости, которая была исходно лиофилизирована. Подходящие композиции можно идентифицировать путем количественного анализа одного или нескольких параметров целостности агента, связывающего ФВ. Определяемыми параметрами, как правило, является процентное содержание видов с высокой молекулярной массой (ВММ) или процентное содержание видов с низкой молекулярной массой (НММ), выявленных посредством эксклюзионной ВЭЖХ (Э-ВЭЖХ).
Соответственно, настоящее изобретение обеспечивает композиции, характеризующиеся стабильной степенью чистоты, и с подходящими концентрациями, как необходимо, например, для фармацевтических целей. Композиции обеспечивают полипептиды, например, иммуноглобулиновые одиночные вариабельные домены или полипептиды, содержащие по меньшей мере один иммуноглобулиновый одиночный вариабельный домен, как определено в настоящей заявке, в стабильной форме в широком диапазоне концентраций, и в широком диапазоне условий хранения, например, температур, включая стрессовые условия, такие как повышенные температуры (например, +25°C или выше), лиофилизация, встряхивание или другие формы физического стресса.
Композиция содержит водный носитель. Водный носитель является, в частности, буфером.
Однако настоящее изобретение также охватывает продукт, полученный путем дополнительной обработки жидкой композиции, такой как замороженный, лиофилизированный или высушенный распылением продукт. При восстановлении эти твердые продукты могут становиться жидкими композициями, как описано в настоящей заявке (но не ограничиваются ими). В самом широком смысле, термин «композиция» охватывает как жидкие, так и твердые композиции. Однако твердые композиции подразумеваются как полученные из жидких композиций (например, путем замораживания, лиофилизации или распылительной сушки), и таким образом, имеют различные характеристики, которые определяются чертами, указанными в настоящей заявке для жидких композиций. Изобретение не исключает восстановления, которое приводит к композиции, отклоняющейся от исходной композиции, например, перед лиофилизацией или распылительной сушкой.
Композиции из настоящего изобретения включают по меньшей мере один агент, связывающий ФВ, в частности, иммуноглобулиновые одиночные вариабельные домены или полипептиды, включающие по меньшей мере один иммуноглобулиновый одиночный вариабельный домен, как определено в настоящей заявке. В частных вариантах осуществления композиция содержит один или несколько полипептидов, выбранных из SEQ ID NO: 1-19, предпочтительно, SEQ ID NO: 1. У полипептидов, кроме того, может быть увеличено время полужизни, например, путем включения пептида или домена, связывающего сывороточный альбумин, который способен к повышению полужизни конструкции (по сравнению с той же самой конструкцией без пептида или домена, связывающего сывороточный альбумин), и может быть, в частности, пептидами, связывающими сывороточный альбумин, как описано в WO2008/068280 автором настоящей заявки (и в частности, WO2009/127691 и WO2011/095545, обе от автора настоящей заявки), или иммуноглобулиновым одиночным вариабельным доменом, связывающим сывороточный альбумин (таким как нанотело, связывающее сывороточный альбумин; например, Alb-1 или гуманизированная версия Alb-1, такая как Alb-8, для которой можно сделать ссылку, например, на WO06/122787). Альтернативные средства продления времени полужизни, которые также охватываются настоящим изобретением, включают, например, пэгилирование (ПЭГ), как общеизвестно в данной области техники, включая сайт-специфическое или произвольное пэгилирование, предпочтительно, сайт-специфическое пэгилирование. ПЭГ можно применять с молекулярной массой выше 5000, например, от 10,000 до 200,000, предпочтительно в диапазоне от 20,000 и 100,000. В любом аспекте повышения полужизни подразумевается, что активность полипептида, как определяется в настоящей заявке, не нарушается, например, сохраняется по меньшей мере 75%, 80%, 85%, 90% или 95% от активности того же самого полипептида без продления полужизни. Активность может быть связана, например, со связыванием с целевым антигеном, и/или активностью в биоанализе. Специалисту в данной области техники также понятно, что выбранная технология увеличения полужизни пригодна потому, что она не повышает, или даже снижает иммуногенность.
5.5.1. Буфер
Композиция из настоящего изобретения содержит буфер, выбранный по меньшей мере из цитратного или фосфатного буфера, предпочтительно, цитратный буфер. В частном варианте осуществления цитратный буфер готовят с применением моногидрата лимонной кислоты и трехзамещенного цитрата натрия безводного, например, 0,2154 г/л моногидрата лимонной кислоты и 5,5805 г/л трехзамещенного цитрата натрия безводного. Как определяли путем измерения температур плавления в не ограничивающем примере, эти буферы повышают стабильность агентов, связывающих ФВ, по сравнению с другими тестированными буферами.
Композиция в соответствии с настоящим изобретением содержит цитратный буфер в концентрации в диапазоне 5-200 мМ, например, 5; 7,5; 10, 15, 20, 25, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190 или 200 мМ, предпочтительно 5-100 мМ, более предпочтительно 7,5-80 мМ, еще более предпочтительно 10-50, например, 10, 15, 20, 25 или 30 мМ, и наиболее предпочтительно 20 мМ, где каждое значение подразумевается как факультативно охватывающее диапазон ±5 мМ. Композиция в соответствии с настоящим изобретением может содержать фосфатный буфер в концентрации в диапазоне 5-200 мМ, например, 5; 7,5; 10, 15, 20, 25, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190 или 200 мМ, предпочтительно 5-80 мМ, более предпочтительно 7,5-60 мМ, еще более предпочтительно 10-40, например, 10, 15, 20, 25 или 30 мМ, и наиболее предпочтительно 10 мМ. где каждое значение подразумевается как факультативно охватывающее диапазон ±5 мМ. Необходимо понять, что более низкие концентрации буфера оказывают влияние на итоговую осмоляльность, и соответственно, на дополнительные растворимые вещества, которые может потребоваться добавить.
Значение рН композиции из настоящего изобретения находится в диапазоне от 5,0 до 7,5, где каждое значение подразумевается как охватывающее диапазон ±0,2. Специфические примеры предпочтительных значений рН для композиций из настоящего изобретения могут быть выбраны из не ограничивающего перечня, включающего рН 5,0; 5,5; 5,8; 6,0; 6,2; 6,5; 6,7; 7,0; 7,1; 7,2 или 7,5, предпочтительно от 6,0 до 7,0, более предпочтительно 6,1; 6,2; 6,3; 6,4; 6,5; 6,6; 6,7; 6,8 или 6,9, например, 6,5, где каждое значение подразумевается как факультативно охватывающее диапазон ±0,2.
Неожиданно, цитратный и фосфатный буферы имеют перекрывающиеся диапазоны рН, например, с гистидиновым и Трис-HCl буферами, также способствуя стабильности.
Наиболее предпочтительное значение рН зависит от буфера, содержащегося в композиции. Следовательно, изобретение относится, в частности, к композиции, содержащей фосфатный буфер, который предпочтительно имеет рН в диапазоне от 6,5 до 7,5, предпочтительно, 6,9; 7,0; 7,1, например, 7,1.
Было показано, что композиция, включающая цитратный буфер, была особенно пригодной для хранения и применения. Однако в отличие от обычного опыта, жидкие композиции, содержащие цитратный буфер, были наиболее стабильными при рН около 6,0, в то время как лиофилизированные композиции, содержащие цитратный буфер, были наиболее стабильными при рН около 6,5. Следовательно, настоящее изобретение относится к композиции, содержащей цитратный буфер, предпочтительно, имеющей рН от 6,0 до 7,0, более предпочтительно, 6,1; 6,2; 6,3; 6,4; 6,5; 6,6; 6,7; 6,8 или 6,9, например, 6,5, где каждое значение подразумевается как факультативно охватывающее диапазон ±0,2.
5.5.2. Концентрация
Композиции из настоящего изобретения предпочтительно включают агенты, связывающие ФВ, как описано в настоящей заявке, в частности, иммуноглобулиновые одиночные вариабельные домены или полипептиды, включающие по меньшей мере один иммуноглобулиновый одиночный вариабельный домен в концентрации, пригодной для клинических целей, которая включает концентрации, применяемые в маточных растворах для разбавления перед введением пациенту. Помимо улучшения стабилизации, композиции из настоящего изобретения обеспечивают более высокие концентрации агентов, связывающих ФВ, например, ИОВД или полипептидов. В частности, композиции из настоящего изобретения остаются физически стабильными, т.е. отсутствует мутность и/или образование мелких частиц, как подтверждено визуальным анализом, микроскопией, Э-ВЭЖХ и ДРС (динамическим рассеянием света). Хранение при повышенных температурах в течение продолжительного времени и повторные циклы замораживания-оттаивания не оказывают явного влияния на физическую стабильность агентов, связывающих ФВ, в этих композициях.
Типичные концентрации активного агента, например, агентов, связывающих полипептиды из настоящего изобретения, в композициях из настоящего изобретения включают не ограничивающие примеры концентраций в диапазоне от 0,1 до 80 мг/мл, предпочтительно 1-70 мг/мл, 5-60 мг/мл, 7,5-50 мг/мл, или 10-40 мг/мл, такие как 5; 7,5; 10; 12,5; 15; 17,5; 20, 25, 30, 35, 40, 45, 50 или 60 мг/мл, предпочтительно 12,5 мг/мл или 10 мг/мл, где каждое значение подразумевается как факультативно охватывающее диапазон ±20% (например, значение 10 факультативно охватывает диапазон от 8 до 12 мг/мл).
5.5.3. Вспомогательные вещества
Композиции в соответствии с настоящим изобретением могут также факультативно включать одно или несколько вспомогательных веществ. Термин «вспомогательное вещество», как применяется в настоящей заявке, означает инертное вещество, которое обычно применяют в качестве разбавителя, растворителя, консерванта, лиопротектора, связующего агента или стабилизирующего агента для соединений, которое обеспечивает благоприятное физическое свойство композиции. Специалисту в данной области техники известны вспомогательные вещества, пригодные для фармацевтических целей, которые могут выполнять конкретные функции в композиции, такие как лиопротекция, стабилизация, консервация, и т.д. Обычно применяемые стабилизаторы и консерванты хорошо известны специалисту в данной области техники (см., например, WO 2010/077422). Фармацевтически пригодные носители, которые можно применять в этих композициях, включают ионообменники, окись алюминия, стеарат алюминия, лецитин, сывороточные белки, такие как человеческий сывороточный альбумин; буферные вещества, такие как фосфаты; глицин, сорбиновую кислоту, сорбат калия, частичные глицеридные смеси насыщенных растительных жирных кислот, воду, соли или электролиты, такие как протамин сульфат, гидрофосфат натрия, гидрофосфат калия, хлорид натрия, соли цинка, коллоидный диоксид кремния, трисиликат магния, поливинилпирролидон, вещества на основе целлюлозы, полиэтиленгликоль, натрия карбоксиметилцеллюлозу, полиакрилаты, воски, блок-сополимеры полиэтилена-полиоксипропилена, полиэтиленгликоль и ланолин, но не ограничиваются ими. В предпочтительных вариантах осуществления вспомогательное вещество может быть одним или несколькими, выбранными из перечня, состоящего из NaCl, трегалозы, сахарозы, маннитола или глицина.
При оценке настоящего изобретения специалист в данной области техники может легко определить подходящие концентрации вспомогательных веществ, добавляемых в композиции. В примерных вариантах осуществления NaCl имеет концентрацию в диапазоне 10-500 мМ, такую как 25, 30, 40, 50, 60, 70, 100, 150, 250 или 500 мМ, предпочтительно 50-150 мМ, например, 75 или 140 мМ, где каждое значение подразумевается как факультативно охватывающее диапазон ±5 мМ; и/или маннитол имеет концентрацию 1-10%, предпочтительно 2-4%, например, 2, 3 или 4% (м/м), где каждое значение подразумевается как факультативно охватывающее диапазон ±0,5%; и/или сахароза имеет концентрацию 1-15%, предпочтительно 2-12% или 4-10%, например, 4, 5, 6, 7, 8 или 9% (м/м) и наиболее предпочтительно 7%, где каждое значение подразумевается как факультативно охватывающее диапазон ±0,5%; и/или глицин имеет концентрацию в диапазоне 10-500 мМ, такую как 25, 30, 40, 50, 60, 70, 75, 100, 150, 250 или 500 мМ, предпочтительно 50-400 мМ, 75-300 мМ, 100-250 мМ, например, 140 или 200 мМ, где каждое значение подразумевается как факультативно охватывающее диапазон ±5 мМ; и/или трегалоза имеет концентрацию в диапазоне 10-500 мМ, такую как 25, 30, 40, 50, 60, 70, 75, 100, 150, 250 или 500 мМ, предпочтительно 100-300 мМ, 150-280 мМ, например, 160 мМ или 260 мМ, где каждое значение подразумевается как факультативно охватывающее диапазон ±5 мМ.
В предпочтительном варианте осуществления композиции в соответствии с любым аспектом настоящего изобретения являются изотоничными по отношению к крови человека. Изотоничные растворы обеспечивают то же самое осмотическое давление, что и плазма крови, и таким образом, могут быть введены внутривенно субъекту без изменения осмотического давления плазмы крови субъекта. Тоничность может быть выражена в виде осмоляльности, которая может быть теоретической осмоляльностью, или предпочтительно, экспериментально определенной осмоляльностью. Как правило, осмоляльность находится в диапазоне 290±60 мОсм/кг, предпочтительно 290±20 мОсм/кг.
Таким образом, при выборе вспомогательных веществ (если они присутствуют) специалист в данной области техники будет учитывать концентрацию буфера и концентрации одного или нескольких вспомогательных веществ, и предпочтительно, с достижением композиции с осмоляльностью в диапазонах, указанных выше. Специалисту в данной области техники знакомы расчеты для получения осмоляльности (см., например, WO2010/077422). Если необходимо, специалист в данной области техники может также дополнительно включить соединение для регуляции осмоляльности композиции. Примерные соединения включают вышеупомянутые вспомогательные вещества, и/или одно или более из сорбитола, метионина, декстрозы, инозитола, аргинина, или аргинина гидрохлорида, но не ограничиваются ими.
Была показано, что композиция, содержащая сахарозу, была особенно пригодной для сохранения физической стабильности, например, во время хранения и замораживания-оттаивания полипептидов. Соответственно, настоящее изобретение относится к композициям, содержащим примерно 5-9%, более предпочтительно 6-8%, и еще более предпочтительно 7% сахарозы, где каждое значение подразумевается как факультативно охватывающее диапазон ±0,5%.
Композиции из настоящего изобретения могут также содержать соединения, которые особенно пригодны для защиты полипептида из настоящего изобретения во время лиофилизации. Такие соединения также известны лиопротекторы, и хорошо известны специалисту в данной области техники. Специфические примеры включают сахара, такие как сахароза, сорбитол или трегалоза; аминокислоты, такие как глутамат, в частности, мононатрий глутамат или гистидин; бетаин, сульфат магния, сахароспирты, пропиленгликоль, полиэтиленгликоли, и их комбинации, но не ограничиваются ими. При оценке настоящего изобретения необходимое количество такого соединения, которое нужно добавить, может легко определить специалист в данной области техники, с учетом стабильности композиции в жидкой форме и при проведении лиофилизации. Композиции, особенно пригодные для лиофилизации, могут дополнительно содержать объемообразующие агенты. Подходящие агенты хорошо известны специалисту в данной области техники. Было показано, что композиция, содержащая сахарозу, была не только особенно пригодной для сохранения физической стабильности, например, во время хранения и замораживания-оттаивания агентов, связывающих ФВ, но также в качестве лиопротектора.
5.5.4. Детергент
В другом варианте осуществления настоящего изобретения композиция в соответствии с любым аспектом настоящего изобретения может дополнительно содержать детергент или сурфактант. Подходящие детергенты или сурфактанты для применения в настоящем изобретении включают полиоксиэтилен-сорбитановые жирнокислотные сложные эфиры, например, полисорбат -20, -40, -60, -65, -80 или -85, но не ограничиваются ими. Обычные торговые марки для полисорбатов включают Alkest, Canarcel и Tween. Специалисту в данной области техники известны другие не ограничивающие примеры детергентов, такие как те, которые перечислены, например, в WO2010/077422. В предпочтительном варианте осуществления детергент является неионным детергентом. В частности, детергент является полисорбатом-80, также обозначенным далее как Твин-80. Специалист в данной области техники может легко определить подходящую концентрацию детергента для композиции из настоящего изобретения. Как правило, концентрация является как можно более низкой, при сохранении благоприятных эффектов детергентов, например, стабилизирующих эффектов в условиях сдвигового стресса, например, перемешивания, которые снижают агрегацию составляющих композицию агентов, связывающих ФВ. В примерных, не ограничивающих вариантах осуществления концентрация детергента может быть в диапазоне от 0,001 до 0,5%, например, 0,001%, 0,002%, 0,003%, 0,004%, 0,005%, 0,01%, 0,015%, 0,02%, 0,025%, 0,03%, 0,035%, 0,04%, 0,045%, 0,05%, 0,1%, 0,2%, 0,3%, 0,4% или 0,5%, предпочтительно, в концентрации от 0,01 до 0,05%, более предпочтительно от 0,01 до 0,02%. например, 0,01% (о/о).
5,5,5. Комбинации
Различные варианты осуществления, как описано выше в разделах 5.5.1-5.5.4, можно объединить в композициях из настоящего изобретения без ограничений. Например, диапазоны значений, использующие комбинации любых из вышеприведенных значений, такие как верхний и/или нижний пределы, предназначены для включения. Однако предпочтительные не ограничивающие примеры композиций включают композиции, где буфером является цитратный буфер при рН около 6,5, предпочтительно, при концентрации 20 мМ, и композиция дополнительно включает сахарозу, предпочтительно, в концентрации около 7% (м/о), и факультативно дополнительно включает неионный детергент, такой как Твин-80, предпочтительно в концентрации 0,01% (о/о).
5.6. Дополнительная обработка
Как описано, любые из вышеуказанных композиций можно дополнительно обрабатывать, например, посредством лиофилизации, распылительной сушки или замораживания, например, замораживания в объеме. Полученный обработанный продукт имеет характеристики, полученные из жидкой исходной композиции, как определено выше. Когда необходимо, могут быть включены дополнительные агенты для дополнительной обработки, например, такие как лиопротекторы и т.д.
5.6.1. Замораживание
В некоторых случаях композиции, содержащие агенты, связывающие ФВ, замораживают для хранения. Соответственно, необходимо, чтобы композиция была относительно стабильной при таких условиях, как циклы замораживания-оттаивания (ЗО). Одним способом определения пригодности композиции является обработка образца композиции с применением по меньшей мере двух, например, трех, четырех, пяти, восьми, десяти или более циклов замораживания (например, при -20°С или -70°С) и оттаивания (например, быстрого оттаивания в водяной бане при 25°С или медленного оттаивания при температуре от +2°С до +8°С), с определением массового выхода исходного продукта и наличия и/или количества НММ видов и/или ВММ видов, накапливающихся после циклов ЗО, и сравнением их с количеством НММ видов или ВММ видов, присутствующих в образце до процедуры ЗО, например, Э-ВЭЖХ. Повышение НММ или ВММ видов указывает на снижение стабильности.
5.6.2. Лиофилизация
Композиции можно хранить после лиофилизации. Таким образом, тестирование стабильности полипептидного компонента композиции после лиофилизации применимо для определения пригодности композиции. Способ, подходящий для этого, описан выше, для замораживания, за тем исключением, что композицию образца лиофилизировали вместо замораживания, восстанавливали до исходного объема, и определяли наличие НММ видов и/или ВММ видов. Лиофилизированный образец композиции сравнивают с соответствующим образцом композиции, которая не была лиофилизирована. Повышение НММ или ВММ видов в лиофилизированном образце, по сравнению с соответствующим образцом, указывает на снижение стабильности в лиофилизированном образце. Как правило, протокол лиофилизации включает загрузку образца в лиофилизатор или сублиматор, период предварительного охлаждения, замораживания, запуск вакуума, переход к температуре первичной сушки, первичную сушку, переход к температуре вторичной сушки, вторичную сушку, закупоривание образца пробкой. Хотя способ лиофилизации хорошо известен в данной области техники, различные факторы определяют характеристики лиофилизации образца, включая температуру стеклования (Tg′) и температуру сжатия (Tc). Дополнительные параметры, которые могут быть выбраны для протокола лиофилизации, включают вакуум (например, в микронах) и температуру конденсатора.
Подходящие скорости перехода для температур составляют примерно от 0,1°C/мин до 2°C/мин, например, от 0,1°C/мин до 1,0°C/мин, от 0,1°C/мин до 0,5°C/мин, от 0,2°C/мин до 0,5°C/мин, 0,1°C/мин, 0,2°C/мин, 0,3°C/мин, 0,4°C/мин, 0,5°C/мин, 0,6°C/мин, 0,7°C/мин, 0,8°C/мин, 0,9°C/мин, и 1,0°C/мин. Подходящие температуры полок во время замораживания для цикла лиофилизации, как правило, составляют примерно от -55°C до -5°C, от -25°C до -5°C, от -20°C до -5°C, от -15°C до -5°C, от -10°C до -5°C, -10°C, -11°C, -12°C, -13°C, -14°C, -15°C, -16°C, -17°C, -18°C, -19°C, -20°C, -21°C, -22°C, -23°C, -24°C, или -25°C. Температуры полок могут быть различными для первичной сушки и вторичной сушки, например, первичную сушку можно проводить при более низкой температуре, чем вторичную сушку. В не ограничивающем примере первичную сушку можно проводить при 0°С или альтернативно, при +5°С, а вторичную сушку при +25°С. В некоторых случаях протокол закаливания применяют во время замораживания и перед запуском вакуума. В некоторых случаях время закаливания должно быть выбрано, и температура, как правило, превышает температуру стеклования композиции. Как правило, время закаливания составляет примерно от 2 до 20 часов, примерно от 3 до 19 часов, примерно от 2 до 10 часов, примерно от 3 до 5 часов, примерно от 3 до 4 часов, примерно 2 часа, примерно 3 часа, примерно 5 часов, примерно 8 часов, примерно 10 часов, примерно 12 часов, примерно 15 часов, или примерно 19 часов. Температура для закаливания, как правило, составляет примерно от -35°C до -5°C, например, примерно от -25°C до -8°C, примерно от -20°C до -10°C, примерно -25°C, примерно -20°C, примерно -15°C, примерно 0°C, или примерно -5°C. В некоторых случаях температура закалки, как правило, составляет от -35°C до +5°C, например, от -25°C до -8°C, от -20°C до -10°C, -25°C, -20°C, -15°C, 0°C, +5°C.
Стабильность композиций, описанных в настоящей заявке, можно определить с применением различных параметров лиофилизации, включая температуру полок при первичной сушке от -25°C до +30°C, и продолжительность вторичной сушки в течение от 2 часов до 33 часов от 0°С до +30°C. Температура вторичной сушки должна быть как можно более высокой, не вызывающей деградации активного фармацевтического ингредиента.
Вспомогательное вещество для применения в композиции из настоящего изобретения должно предпочтительно удовлетворять одному или нескольким из следующих параметров: быть фармакологически инертным; быть совместимым с требованиями обработки; хорошо переноситься пациентом; не повреждать активный материал; обеспечивать растворимый, абсорбируемый продукт; обеспечивать устойчивый при хранении продукт; и обеспечивать коммерчески пригодный продукт.
В одном варианте осуществления композицию из настоящего изобретения готовят путем лиофилизации, например, как показано на фигуре 1 или в таблице 14.
Было показано, что лиофилизация композиций на основе цитрата/сахарозы резко повышает стабильность агентов, связывающих ФВ. В частности, композиции на основе композиции на основе цитрата/сахарозы по существу предотвращают химические модификации, которые происходят в жидкой форме, но за исключением образования небольших количеств пироглутамата. Неожиданно, снижение концентрации цитрата, и в то же самое время повышение концентрации сахарозы повышало химическую стабильность, например, снижало формирование пироглутамата. Было показано, что агент, связывающий ФВ, был устойчивым после лиофилизации к экстремальным значениям температуры. Действительно, профиль стабильности был идентичным для материала, приготовленного с применением множества циклов замораживания-оттаивания.
Как правило, цикл лиофилизации может занимать от 10 часов до 100 часов, например, от 20 часов до 80 часов, от 30 часов до 70 часов, от 40 часов до 60 часов, от 45 часов до 50 часов, от 50 часов до 66 часов.
В не ограничивающем примере композицию из 20 мМ цитрата, 7% сахарозы, 0,01% Твин-80, рН 6,5, с концентрацией белка 12,5 мг/мл агента, связывающего ФВ, готовили в серии и лиофилизировали.
Не ограничивающими примерами температурного диапазона для хранения композиции из настоящего изобретения являются примерно от -20°C до +50°C, например, примерно от -15°C до +40°C, примерно от -15°C до +30°C, примерно от -15°C до +20°C, примерно от +5°C до +25°C, примерно от +5°C до +20°C, примерно от +5°C до +15°C, примерно от +2°C до +12°C, примерно от +2°C до +10°C, примерно от +2°C до +8°C, примерно от +2°C до +6°C, или примерно +2°C, +3°C, +4°C, +5°C, +6°C, +7°C, +8°C, +10°C, +15°C, +25°C, +30°C или +40°C. Не ограничиваясь температурами хранения, в некоторых случаях образцы являются стабильными при изменениях температуры, которые могут временно возникать при условиях хранения и транспортировки, которые предполагаются для таких композиций.
Было установлено, что при работе с композициями из настоящего изобретения, как определено в настоящей заявке, можно получить итоговый сухой порошок, имеющий размер частиц, пригодный для удобного сохранения и быстрого растворения активного материала. Сухая композиция в соответствии с настоящим изобретением включает частицы, которые остаются стабильными и однородными при обработке, заключительной отделке, хранении и распределении. Композиция является устойчивой при хранении и свободно текучей, не представляет проблем при розливе в итоговый контейнер, и проста для применения у пациента.
5.6.3. Распылительная сушка
В некоторых случаях композицию подвергают распылительной сушке, а затем хранят. Распылительную сушку проводят с применением способов, известных в данной области техники, и она может быть модифицирована для применения распылительной сушки в жидком или замороженном состоянии (например, с использованием таких способов, как от Niro Inc. (Мэдисон, Висконсин), Upperton Particle Technologies (Ноттингем, Англия), или из патентов США № 2003/0072718 и 2003/0082276), или от Buchi (Brinkman Instruments Inc., Уэстбури, Нью-Йорк).
5.6.4. Растворитель
Лиофилизированные композиции, как раскрыто в настоящей заявке, могут быть восстановлены, если необходимо, путем смешивания лиофилизированной формы со стабильным растворителем для повторного растворения компонентов оригинальной композиции до необходимой концентрации. Термин «растворитель», как применяется в настоящей заявке, относится к фармакологически пригодному (безопасному и нетоксичному для применения у человека) растворителю для изменения или достижения подходящей концентрации, как описано в настоящей заявке. Примерные растворители включают стерильную воду (например, воду для инъекций, воду Milli-Q), солевой раствор, раствор декстрозы, раствор Рингера и водные буферные растворы, но не ограничиваются ими.
5.7. Фармацевтические композиции
Композиции из настоящего изобретения предпочтительно пригодны для применения в способах лечения организма животного или человека. Таким образом, настоящее изобретение относится к фармацевтическим или диагностическим композициям, содержащим композицию полипептида в соответствии с каким-либо аспектом изобретения, или полученную посредством любого способа из настоящего изобретения.
Композиции из настоящего изобретения предпочтительно являются фармацевтическими композициями. В частности, композиции пригодны для парентерального применения у человека, например, подкожного, внутривенного, внутримышечного, интрадермального или интраперитонеального применения, предпочтительно внутривенного или подкожного применения. Применение охватывает любые способы введения жидкой композиции, в частности, инъекцию. Другие формы системного применения, например, посредством имплантируемых устройств, микро-инфузионных насосов (факультативно имплантируемых), и/или (имплантируемых) композиций пролонгированного высвобождения, например, депо-форм, гелей, биодеградируемых полимерных композиций, также находятся в пределах объема настоящего изобретения. Фармакологические композиции являются стерильными и стабильными при производстве и хранении, поскольку производные/продукты деградации агентов, связывающих ФВ, нежелательны при клиническом применении. Композиция также должна иметь высокую чистоту, например, исключено присутствие бактериальных продуктов, таких как ЛПС. Композиции могут быть стерилизованы любыми подходящими средствами, например, стерилизующей фильтрацией, облучением и их комбинациями. Предпочтительно, фармацевтические композиции приспособлены для парентерального (особенно внутривенного, интрартериального или трансдермального) введения. Внутривенное введение считается особо важным. Предпочтительно, агент, связывающий ФВ, находится в парентеральной форме, наиболее предпочтительно во внутривенной и подкожной форме.
Для обеспечения пригодности в качестве фармацевтической композиции, композиция из настоящего изобретения, как правило, содержит полипептид из настоящего изобретения (т.е. активный агент) в подходящем отношении к объему. Например, для подкожных инъекций концентрация активного агента может быть выше, для обеспечения необходимой фармацевтической дозы для применения в малом объеме, по сравнению с композицией для внутривенного введения. Однако в некоторых вариантах осуществления концентрация активного агента идентична для подкожного или внутривенного введения, и может быть в примерных диапазонах, как определено в настоящей заявке.
В некоторых вариантах осуществления композиции из настоящего изобретения могут содержать дополнительные агенты, например, дополнительные активные агенты, вспомогательные вещества, стабилизаторы, консерванты, такие как антимикробные агенты, и т.д.
Композиции из настоящего изобретения предпочтительно находятся в дозе, применяемой у пациента, нуждающегося в ней. Тем не менее, конкретный режим применения и дозировка могут быть выбраны лечащим врачом с учетом конкретных характеристик пациента, особенно возраста, массы тела, образа жизни, уровня активности, и общего состояния, как необходимо. В частности, ALX-0081 применяют внутривенно или подкожно с 24 часовым интервалом. Еще более предпочтительно, ALX-0081 применяют внутривенно или подкожно с 24-часовым интервалом с учетом активности агрегации, например, измеряемой посредством RIPA, ристоцетин-индуцированной агрегации тромбоцитов (Favaloro EJ. Clin Haematol 2001; 14: 299-319) и/или количественного анализа агглютинации тромбоцитов, индуцированной ристоцетиновым кофактором (Howard MA, Firkin BG. «Ristocetin – a new tool in the investigation of platelet aggregation». Thrombosis et Diathesis Haemorrhagica 1971; 26: 362-9 («Ристоцетин – новый инструмент в исследовании агрегации тромбоцитов»)). Например, следующую дозу не применяют, если активность агрегации остается ниже 10% при измерении RIPA или ниже 20% при измерении RICO в течение следующих 6 часов (клинически значимое ингибирование).
Однако, как правило, дозировка агентов, связывающих ФВ, может зависеть от различных факторов, таких как активность и продолжительность действия активного ингредиента, виды теплокровных животных, и/или пол, возраст, масса тела и индивидуальное состояние теплокровного животного.
Обычно дозировка является такой, что единственная доза агента, связывающего ФВ, например, устанавливается на основе результатов исследования с увеличением дозы для анализа субхронической токсичности у яванских макак. На основе такого набора доклинических исследований можно определить исходную и последующую возрастающую дозу для агента, связывающего ФВ. Например, доза может составлять 0,5-50 мг, особенно 1-30 мг, и её применяют у теплокровного животного с массой тела примерно 75 (±30) кг (но может отличаться также от этой нормы). Если необходимо, эта доза может состоять из нескольких, факультативно равных, частичных доз («мг» означает мг лекарства на млекопитающее, включая человека, получающее лечение).
Доза, упомянутая выше, применяемая в виде единственной дозы (что является одним вариантом осуществления), либо в виде нескольких частичных доз, может применяться повторно, как упоминалось выше, например, каждые шесть часов, каждые 12 часов, или каждый день. Другими словами, фармацевтические композиции могут применяться в режимах, от постоянной терапии каждые 6 часов до терапии с более продолжительными интервалами введения доз.
Предпочтительно, агенты, связывающие ФВ, применяют в дозах, которые находятся в том порядке амплитуды, как тот, который применяется во вспомогательной терапии пациентов, нуждающихся в ЧКА, как предполагается в настоящей заявке для ALX-0081. Например, для предпочтительных 12А02Н1-содержащих агентов, связывающих ФВ, например, ALX-0081 и его функциональных вариантов, можно применять дозы агентов, связывающих ФВ, в диапазоне примерно от 0,5 до 40 мг, предпочтительно примерно от 1 до 35 мг, или примерно от 2 до 30 мг, еще более предпочтительно примерно от 3 до 25 мг или примерно от 4 до 20 мг, или примерно от 5 до 17,5 мг, или даже примерно от 6 до 16 мг, или примерно от 7,5 до 15 мг, или даже примерно от 10 до 14 мг, более предпочтительно около 10, около 12,5 или около 13,8 мг, для острого лечения пациентов – людей.
Композиции в однодозовой лекарственной форме предпочтительно содержат примерно от 0,5 до 40 мг, предпочтительно, примерно от 1 до 35 мг, или примерно от 2 до 30 мг, еще более предпочтительно примерно от 3 до 25 мг или примерно от 4 до 20 мг, или примерно от 5 до 17,5 мг, или даже примерно от 6 до 16 мг, или примерно от 7,5 до 15 мг, или даже примерно от 10 до 14 мг, более предпочтительно около 10, около 12,5 или около 13,8 мг, а композиции, не находящиеся в однодозовой лекарственной форме, предпочтительно содержат примерно от 0,5 до 40 мг, предпочтительно примерно от 1 до 35 мг, или примерно от 2 до 30 мг, еще более предпочтительно примерно от 3 до 25 мг, или примерно от 4 до 20 мг, или примерно от 5 до 17,5 мг, или даже примерно от 6 до 16 мг, или от 7,5 до 15 мг, или даже примерно от 10 до 14 мг, более предпочтительно около 10, около 12,5 или около 13,8 мг активного ингредиента.
Фармацевтические препараты для парентерального применения находятся, например, в таких лекарственных формулах, как ампулы. Их готовят способом, известным как таковой, например, посредством способов обычного смешивания, растворения или лиофилизации.
Парентеральными композициями являются особенно жидкости для инъекций, вводимые различными способами, такими как в участке ЧКА, интраартериально, внутримышечно, интрапертионеально, интраназально, интрадермально, подкожно, или предпочтительно внутривенно. Такие жидкости предпочтительно являются изотоническими водными растворами или суспензиями, которые можно приготовить перед применением, например, из лиофилизированных препаратов или концентрата, которые содержат активный ингредиент, по отдельности или вместе с фармацевтически пригодным носителем. Фармацевтические препараты могут быть стерилизованы и/или содержать добавки, например, консерванты, стабилизаторы, смачивающие агенты и/или эмульгаторы, солюбилизаторы, соли для регуляции осмотического давления и/или буферы.
Подходящие композиции для трансдермального применения включают эффективное количество активного ингредиента с носителем. Предпочтительные носители включают абсорбируемые фармакологически пригодные растворители для обеспечения прохождения через кожу носителя. Характерно, что трансдермальные устройства находятся в форме бандажа, содержащего поддерживающий элемент, резервуар, содержащий соединение, факультативно с носителями, факультативно, барьер, контролирующий скорость, для доставки активного ингредиента в коже хозяина с контролируемой и предварительно заданной скоростью в течение длительного периода времени, и средства прикрепления устройства к коже.
В следующей таблице приведены некоторые не ограничивающие примеры композиций из настоящего изобретения на основе цитратного и фосфатного буфера. Во всех композициях можно регулировать осмоляльность до 290±60 мОсм/кг путем добавления подходящего наполнителя, если необходимо. Композиции могут содержать один или несколько любых полипептидов из настоящего изобретения, например, SEQ ID NO: 1-19, в частности SEQ ID NO: 1.
Концентрации буфера в этой таблице необходимо понимать как факультативно охватывающие ±5 мМ. Значение рН необходимо понимать как факультативно охватывающее ±0,2. Каждый из вышеуказанных буферов можно объединить с одним или несколькими вспомогательными веществами, выбранными, например, из NaCl в концентрации, например, 25, 30, 40, 50, 60, 70, 100, 150, 250 или 500 мМ; маннитола в концентрации, например, 2, 3 или 4% (м/о); глицина в концентрации, например, 25, 30, 40, 50, 60, 70, 100, 150, 250 или 500 мМ; трегалозы в концентрации, например, 25, 30, 40, 50, 60, 70, 100, 150, 250 или 500 мМ, и сахарозы в концентрации, например, 4, 5, 6, 7, 8 или 9% (м/о), и/или сурфактанта, например, Твин-80 в концентрации 0,001%, 0,002%, 0,003%, 0,004%, 0,005%, 0,01%, 0,015%, 0,02%, 0,025%, 0,03%, 0,035%, 0,04%, 0,045%, 0,05%, 0,1%, 0,2%, 0,3%, 0,4% или 0,5% (о/о).
5.8. Эффекты, достигаемые настоящим изобретением
Изобретение обеспечивает стабильные композиции агентов, связывающих ФВ, например, иммуноглобулиновые одиночные вариабельные домены, как описано в настоящей заявке, например, SEQ ID NO: 1-19, в частности, SEQ ID NO: 1. «Стабильный», как правило, означает, что иммуноглобулиновые одиночные вариабельные домены не испытывают значительных физических или химических изменений при хранении в течение длительных периодов времени, например, от 1 до 36 месяцев, даже при воздействии одного или нескольких химических или физических стрессов, таких как повышенные температуры (равные или превышающие +25°C), или физического стресса, такого как встряхивание или перемешивание. В частности, «стабильный» означает, что при хранении в течение длительных периодов времени (как определено) в условиях (как определено), имеется только ограниченное формирование (как определено) одного или нескольких продуктов деградации, например, например, низкомолекулярных (НММ) производных (фрагментов) полипептидов из настоящего изобретения; и/или химических производных или модификаций, например, таких как пироглутаматные варианты; и/или высокомолекулярные (ВММ) производные (олигомеры или полимеры), образованные, например, путем агрегации.
Специалистам в данной области техники хорошо знакомы методики оценки размера белков, например, эксклюзионная хроматография – ВЭЖХ, или оценки формирования химических производных, например, обращенно-фазовая ВЭЖХ. Специалисту в данной области техники также знакомы широко применяемые аппараты и средства программного обеспечения для выполнения таких анализов. Например, специалисту в данной области техники известно обычно применяемое программное обеспечение для анализа хроматограмм, например, по относительной площади пиков. Примеры включают ВЭЖХ систему Agilent 1200, оснащенную программным обеспечением ChemStation (Agilent Technologies, Пало-Альто, США, Rev B) или ВЭЖХ систему Dionex Ultimate 3000, оснащенную программным обеспечением Chromeleon (Dionex Corporation, Саннивейл, Калифорния, США, V6,8), но не ограничиваются ими.
Общие методики, которые можно применять для оценки стабильности белка, например, иммуноглобулинового одиночного вариабельного домена, включают статическое светорассеяние, тангенциальную поточную фильтрацию, инфракрасную спектроскопию с преобразованием Фурье, круговой дихроизм, индуцированное мочевиной развертывание белка, собственную флуоресценцию триптофана, и/или связывание белка с 1-анилин-8-нафталинсульфоновой кислотой. Кроме того, композиция из настоящего изобретения демонстрирует незначительную степень или отсутствие потери активности/биологической активности при хранении и/или под влиянием одного или нескольких стрессов, как определено в настоящей заявке. Биологическую активность и/или активность можно определить, например, как описано в WO2006/122825.
5.8.1. Термостабильность
Композиции из настоящего изобретения характеризуются обеспечением высокой термостабильности агентов, связывающих ФВ, например, иммуноглобулиновых одиночных вариабельных доменов, как определено в настоящей заявке. Термостабильность можно оценить, например, путем определения температуры плавления (Тп). Подходящие методики определения температуры плавления известны, и включают, например, анализ теплового сдвига (TSA), например, как описано в настоящей заявке. В частности, композиции из настоящего изобретения приводят к повышению Тп иммуноглобулиновых одиночных вариабельных доменов, как определено TSA, по сравнению с другими композициями. Этот эффект показан в таблице 1 из раздела, посвященного экспериментам.
Как видно в экспериментальном разделе, высокая термостабильность, например, высокая Тп, может быть взята в качестве показателя стабильности при хранении.
В соответствии с настоящим изобретением, композиции из изобретения оказывают положительное влияние на Тп в широком диапазоне значений рН, например, от 6,0 до 7,0 для цитратного буфера, и от 6,5 до 7,5 для фосфатного буфера. Наиболее предпочтительный эффект в отношении Тп может наблюдаться для цитратного буфера при рН 6-7, и в частности, для рН 6,5±0,2, и для фосфатного буфера для рН от 6,5 до 7,5, в частности, рН 7,1±0,2.
Добавление вспомогательных веществ может оказывать дополнительное отрицательное или положительное влияние на Тп (таблица 1). Например, трегалоза может повышать Тп (в контексте конкретного буфера), например, от 150 мМ до 300 мМ. Далее, маннитол или сахароза оказывают явное положительное влияние на Тп. Эти вспомогательные вещества могут находить применение в частных вариантах осуществления настоящего изобретения, например, в композициях, где объемообразующий агент или лиопротекторы являются предпочтительными. Эти примерные варианты осуществления не исключают применения других известных лиопротекторов или объемообразующих агентов, по отдельности или в комбинации с маннитолом или сахарозой.
Как видно из раздела, посвященного экспериментам, в настоящем описании, Тп при определении посредством TSA служит ценным индикатором стабильности агентов, связывающих ФВ, например, иммуноглобулиновых одиночных вариабельных доменов из настоящего изобретения.
5.8.2. Стабильность в отношении механического стресса
Композиции из настоящего изобретения характеризуются высокой устойчивостью к механическому стрессу, такому как перемешивание, встряхивание или сдвиговый стресс. Возможным анализом для оценки устойчивости к механическому стрессу является мониторинг 500 нм сигнала рассеяния в спектрофлуориметре, или посредством УФ спектрофотометрии, например, при 340 нм. Повышение рассеяния или УФ абсорбции отражает образование агрегатов. Когда образуются агрегаты (ВММ), повышение со временем формирует линейную кривую, для которой можно определить тангенс угла наклона (интенсивность рассеяния/время поглощения, единицы/сек). Предпочтительно, композиции из настоящего изобретения характеризуются тангенсом угла наклона меньше 0,0006, например, меньше 0,0005, например, от 0 до 0,0004 (см. фигуры 4А и 4В).
Композиции, содержащие цитратный буфер, являются особо предпочтительными, и оказывают положительное влияние на выход белков, например, после перемешивания, как определено выше. Например, массовый выход составляет по меньшей мере 90%, 95%, 98% или 100%. Выход белков определяют по сравнению с общим содержанием белка перед стрессовым воздействием на образец, например, посредством перемешивания. Композиции, содержащие фосфатные буферы, обеспечивают выход по меньшей мере 75%, 80%, 85% или еще больше после перемешивания, как определено выше.
При примерной, не ограничивающей концентрации 5 мг/мл композиции из настоящего изобретения формируют только обратимые агрегаты в ответ на перемешивание при отсутствии Твина. Таким образом, композиции из настоящего изобретения предотвращают образование необратимых агрегатов при механическом стрессе. Соответственно, в другом варианте осуществления изобретения композиции из настоящего изобретения могут содержать неионный детергент, как определено выше, например, Твин-80, например, в концентрации, как определено выше, например, от 0,01% до 0,02% (о/о). Добавление детергента может дополнительно улучшать физическую стабильность композиции. Например, при не ограничивающей примерной концентрации 5 мг/мл добавление детергента может предотвращать образование агрегатов (обратимых и необратимых), как определяют, например, путем мониторинга сигнала рассеяния при 500 нм в спектрофлуориметре, или путем УФ спектрофотометрии (340 нм) (фигуры 4А и 4В).
Физическая стабильность композиций из настоящего изобретения может также быть продемонстрирована посредством Э-ВЭЖХ. Различные не ограничивающие композиции иммуноглобулиновых одиночных вариабельных доменов из настоящего изобретения могут выдерживать механический стресс, например, стресс при перемешивании, без формирования олигомеров (ВММ) или продуктов деградации (НММ). Композиции из настоящего изобретения остаются стабильными без деградации или олигомеризации, например, спустя 1,5 часа перемешивания, по результатам Э-ВЭЖХ анализа.
Не было выявлено олигомеризации или деградации (например, по результатам ОФ-ВЭЖХ (только деградация) или определения профиля Э-ВЭЖХ) в какой-либо из композиций. Таким образом, в соответствии с предпочтительным вариантом осуществления настоящего изобретения, композиции содержат цитратный буфер, и показывают выход по меньшей мере 70%, 75%, 80%, 85%, 90%, 95%, 98%, или даже около 100%, например, в условиях, как описано выше, где выход определяют, например, посредством ОФ-ВЭЖХ или Э-ВЭЖХ, по сравнению с образцом, не подвергнутым стрессу. Предпочтительно, вспомогательным веществом в контексте цитратного буфера может быть сахароза, а выход, как определено выше, составляет по меньшей мере 80%, 85%, 90%, 95%, 98%, или даже около 100%.
5.8.3. Анализ стабильности жидких композиций
5.8.3.1. Стабильность при хранении
Жидкие композиции из настоящего изобретения обеспечивают хорошую стабильность при хранении, например, при температуре -70°C, -20°C, +5°C, +25°C или +40°C, например, в течение 1-36 месяцев, такого времени, как 1; 1,5; 3, 6, 9, 12, 18, 24, 30 или 36 месяцев. Наиболее предпочтительные результаты могут быть получены с композициями на основе цитратного буфера, как указано в примерах в таблице 5.
Специалисту в данной области техники известно, что хранение при +25°C, и тем более при +40°C представляет стрессовые условия хранения. Такие условия, как ожидается, повышают и ускоряют появление каких-либо признаков нестабильности, например, химической или физической нестабильности. Таким образом, относительно короткий период хранения, например, при +25°С или +40°С обеспечивает хороший показатель стабильности для долговременного хранения в более мягких условиях (например, при +5°С или в замороженном виде).
5.8.3.2. Стабильность при хранении с точки зрения выхода белков
Например, композиции из настоящего изобретения обеспечивают выход белков по меньшей мере 95%, например, по меньшей мере 96, 97, 98, 99 или даже около 100% после хранения при температуре от -70°С до +40°С. Выход белков можно определить любыми известными средствами количественного анализа белков, например, посредством ОФ-ВЭЖХ или Э-ВЭЖХ, как показано в таблице 5, по сравнению с контрольным образом, хранящимся при -70°С. Эти результаты можно наблюдать, например, после хранения при указанной температуре в течение 1 месяца, 1,5 месяцев, 3 месяцев, 6 месяцев, 9 месяцев, 12 месяцев, 18 месяцев, 24 месяцев, 30 месяцев, или даже 36 месяцев.
5.8.3.3. Стабильность при хранении с точки зрения химических производных/продуктов деградации
Далее, композиции из настоящего изобретения сводят к минимуму образование химических производных, например, пироглутаматных вариантов, с получением менее 5,0% по результатам измерения размера пика при определении, например, ОФ-ВЭЖХ (см. таблицу 5). В этом типе анализа площадь данного пика сравнивают с общей площадью хроматограммы, и определяют относительную площадь для каждого пика. Специалисту в данной области техники известны подходящие средства анализа, например, подходящее программное обеспечение для анализа хроматограмм (специфические не ограничивающие примеры включают ВЭЖХ систему Agilent 1200, оснащенную программным обеспечением ChemStation (Agilent Technologies, Пало-Альто, США, Rev B) или ВЭЖХ систему Dionex Ultimate 3000, оснащенную программным обеспечением Chromeleon software (Dionex Corporation, Саннивэйл. Калифорния, США V6,8). Таким образом, предпочтительно, пироглутаматные варианты имеют площадь пика меньше 5%, предпочтительно меньше 4,6%, например, 4,5%, 4,3%, 4,2%, 4,0%, или даже меньше 3,8% по результатам ОФ-ВЭЖХ, при хранении при температуре от -70°C до +40°C, например, +40°C, например, после хранения в течение времени, определенного выше, например, 1 месяца.
Композиции из настоящего изобретения также сводят к минимуму окисление, такое как образование окисленных продуктов (по результатам, например, ОФ-ВЭЖХ) на протяжении периода хранения, как определено выше, например, 1 месяца при температуре от -70°C до +40°C (см. таблица 5). Таким образом, композиции из настоящего изобретения приводят к образованию окислительных вариантов с площадью пика меньше 3%, предпочтительно меньше 2,7%, предпочтительно меньше 2,5%, например, меньше 2,3%, 2,2%, например, 2,0%, или даже меньше 1,7% или 1,5%, при хранении при температурах от 70°C до +40°C, например, +40°C, например, после хранения в течение времени, как определено выше, например, 1 месяца (по результатам, например, ОФ-ВЭЖХ).
5.8.3.4. Стабильность при хранении с точки зрения олигомеризации
Композиции из настоящего изобретения также обеспечивают стабильность при хранении, так что не образуется явного растворимого олигомерного материала (по результатам, например, Э-ВЭЖХ) при хранении при температурах от -70°C до +40°C, при продолжительности хранения, как определено выше, например, в течение 1 месяца; или образуется меньше 1%, предпочтительно меньше 0,5%, например, 0,3% растворимого олигомерного материала (по результатам, например, Э-ВЭЖХ) при температурах хранения от -70°C до +40°C, например, +40°C, при продолжительности хранения, как определено выше, например, в течение 1 месяца.
Настоящее изобретение также оказывает влияние на обеспечение индекса агрегации, как определено по значениям поглощения [(100×A340)/(A280-A340)], который остается ниже 0,15, предпочтительно ниже 0,1 после хранения при температуре от 70°C до +40°C при хранении в течение времени, как определено выше, например 1 месяца.
5.8.3.5. Стабильность при хранении, как отражается выходом основного продукта
Композиции из настоящего изобретения оказывают влияние на площадь пика основного продукта, по результатам, например, ОФ-ВЭЖХ (см. таблицу 5), составляющую примерно 90% после хранения от -70°C до +40°C при продолжительности хранения, как указано выше, например, 1 месяца; или на площадь пика основного продукта, по результатам, например, ОФ-ВЭЖХ (см. таблицу 5), составляющую по меньшей мере примерно 85% или больше, как 86%, 87% или 88%. Более предпочтительно, главный пик составляет 90%, 92% или 95%, например, по меньшей мере 97%, более предпочтительно 100%, после хранения при температуре -70°C до +40°C, например, +40°C, при продолжительности хранения, как указано выше, например, 1 месяца; или пик основного продукта по результатам, например, Э-ВЭЖХ, составляет по меньшей мере 85%, или по меньшей мере 90%, предпочтительно по меньшей мере 95%, например, по меньшей мере 98%, или даже около 100%, после хранения при температуре от -70°C до +40°C, например, +40°C, при продолжительности хранения, как указано выше, например, 1 месяц.
Композиции в соответствии с настоящим изобретением также оказывают влияние на площадь главного пика по результатам ОФ-ВЭЖХ после хранения, например, при концентрации до 20 мг/или при температуре от -70°C до +25°C в течение от 1 до 3 месяцев, остающегося неизменным, по сравнению с композицией до хранения, и представляющего по меньшей мере 90%, более предпочтительно по меньшей мере 95% от общей площади пиков, где контрольный образец имеет главный пик, например, 95%. При хранении при +40°C в течение 1 месяца композиция из настоящего изобретения сохраняет главный пик по результатам ОФ-ВЭЖХ по меньшей мере 80%, 85% или 90%; после хранения в течение 2 месяцев по меньшей мере 80% или 85%, и после хранения в течение 3 месяцев по меньшей мере 75% или 80%.
Далее, по результатам капиллярного изоэлектрофокусирования (кИЭФ), композиция из настоящего изобретения оказывает влияние на обеспечение выхода основного продукта после хранения в концентрации, например, до 20 мг/мл, в течение 1-3 месяцев при температуре от -70°C до +40°C, сопоставимого с контрольным образцом (композицией без хранения, с главным пиком по меньшей мере 98%), например, главный пик составляет по меньшей мере 85% или больше, как 86%, 87% или 88%. Более предпочтительно, главный пик составляет 90%, 92% или 95%, например, по меньшей мере 97%, более предпочтительно 100%, после хранения при температуре от -70°C до +40°C.
5.8.3.6. Стабильность в условиях замораживания-оттаивания
Помимо обеспечения стабильности композиций в условиях хранения, остающихся постоянными на протяжении времени (например, хранении при +5°C), или включающих единственный цикл ЗО (например, при хранении при -20°C или -70°C), дополнительным эффектом настоящего изобретения является стабильность в условиях повторных циклов ЗО. Каждый переход из замороженного в жидкое состояние и наоборот является особенно стрессовым состоянием для иммуноглобулиновых одиночных вариабельных доменов.
Композиции из настоящего изобретения также оказывают влияние на обеспечение хорошей стабильности в условиях ЗО. Например, композиции из настоящего изобретения можно подвергать, например, 10 ЗО циклам от -70°C до комнатной температуры (например, +25°C), или от -20°C до комнатной температуры. Иммуноглобулиновые одиночные вариабельные домены, включенные в композиции, выдерживают эти условия без существенного нарушения, по результатам, например, ОФ-ВЭЖХ или Э-ВЭЖХ. Оценивали влияние повторных циклов ЗО на различные не ограничивающие варианты осуществления композиций из настоящего изобретения, и было установлено, что во всех случаях химическая и физическая целостность агентов, связывающих ФВ, например, иммуноглобулиновых одиночных вариабельных доменов, сохранялась. Общий выход находился в диапазоне от 95 до 100%, предпочтительно, составлял по меньшей мере 95, 98 или 99%. Относительная доля различных пиков остается неизменной, по сравнению с контролем, подвергнутым только одному циклу ЗО.
В частности, при концентрации от 5 мг/или и 20 мг/мл 10 циклов ЗО приводят к выходу (как определено на основе, например, общей площади пиков, т.е. AU полипептида по результатам ОФ-ВЭЖХ или Э-ВЭЖХ составляет по меньшей мере 90%, 95%, 89% или 100%; где в частном варианте осуществления ОФ-ВЭЖХ или Э-ВЭЖХ профиль не меняется, по сравнению с контрольным образцом (1 цикл ЗО).
5.8.3.7. Стабильность с точки зрения активности
Специалисту в данной области техники известны разные способы определения активности агентов, связывающих ФВ, в частности, иммуноглобулиновых одиночных вариабельных доменов, в частности, полипептидов в соответствии с любой из SEQ ID NO: 1-19, например, SEQ ID NO: 1 (см., например, раздел, посвященный экспериментам из WO2006/122825 [P05-003], например, примеры 3-6, 18 и 19, или раздел, посвященный экспериментам из WO2009/115614 [P08-013]).
В одном варианте осуществления активность полипептида из настоящего изобретения может быть определена по связыванию с его антигена обычными методами анализа, например, ИФА, Biacore, РИА, FACS, и т.д.
Активность агентов, связывающих ФВ, остается приемлемой в композициях из настоящего изобретения, по результатам анализа в стрессовых условиях, т.е. после 4 недель хранения при +40°C.
5.8.3.8. Стабильность с точки зрения совместимости
Композиции из настоящего изобретения также являются совместимыми с широким рядом различных растворителей. Например, композиции можно смешивать/разбавлять с такими растворителями, без влияния на химическую или физическую стабильность иммуноглобулиновых одиночных вариабельных доменов.
Таким образом, композиции из настоящего изобретения также обеспечивают стабильность в широком диапазоне концентраций, как определено в настоящей заявке.
5.8.3.9. Обобщение стабилизирующих эффектов
Композиции из настоящего изобретения оказывают влияние на сохранение химической и физической целостности полипептидов из настоящего изобретения даже после продолжительного хранения, например, в течение времени, определенного выше, при температурах от -70°C до +25°C.
Хранение иммуноглобулиновых одиночных вариабельных доменов, как определено в настоящей заявке, в частности, ALX-0081 при -70°C в течение 1 месяца не влияет на их физико-химические характеристики для любой из композиций из изобретения, в частности, для не ограничивающих примеров буферов, тестированных в разделе, посвященном экспериментам. Хранение не оказывало существенного влияния на профили ОФ-ВЭЖХ, Э-ВЭЖХ или кИЭФ.
5.8.4. Анализ стабильности лиофилизированных композиций
Кроме того, изобретение обеспечивает стабильные композиции агентов, связывающих ФВ, например, иммуноглобулиновых одиночных вариабельных доменов, как определено в настоящей заявке, например, SEQ ID NO: 1-19, предпочтительно SEQ ID NO: 1, которые особенно пригодны для лиофилизации. Композиции из настоящего изобретения приводят к усовершенствованной стабильности и улучшенной стабильности при хранении после лиофилизации.
5.8.4.1. Стабильность при хранении
Композиции из настоящего изобретения позволяют обеспечить хорошую стабильность после лиофилизации при хранении, например, при температуре -70°C, -20°C, +5°C, +25°C или +40°C, например, в течение 1-36 месяцев, как 1; 1,5; 3, 6, 9, 12, 18, 24, 30 или 36 месяцев. Наиболее предпочтительные результаты могут быть получены для композиций на основе цитратного буфера, например, композиций 3 и 7, как показано в примерах в разделе, посвященном экспериментам (например, формирование хорошего осадка без визуальных признаков распада, фигура 6). Специалисту в данной области техники понятно, что в нижеприведенном обсуждении предпочтительные значения отражают композиции цитратного буфера, например, как показано в таблице 8.
Специалисту в данной области техники также понятно, что хранение при +25°C, и в частности при +40°C представляет стрессовые условия хранения. Ожидается, что такие условия повышают и ускоряют появление каких-либо признаков нестабильности, например, химической или физической нестабильности. Следовательно, относительно короткое хранение, например, при +25°C или +40°C, является хорошим показателем стабильности при длительном хранении в более мягких условиях (например, при +5°C или при замораживании).
5.8.4.2. Стабильность при хранении с точки зрения выхода белка
Например, композиции из настоящего изобретения обеспечивают выход белка после лиофилизации по меньшей мере 95%, например, по меньшей мере 96, 97, 98, 99 или даже около 100% после хранения при температуре от -70°C до +40°C. Выход белка можно определить любыми известными средствами количественного определения белков, например, по содержанию, с помощью ОФ-ВЭЖХ или Э-ВЭЖХ. Эти результаты можно наблюдать, например, после хранения при указанной температуре в течение 1-36 месяцев, как в течение 1; 1,5; 3, 6, 9, 12, 18, 24, 30 или 36 месяцев.
5.8.4.3. Стабильность при хранении с точки зрения химических производных/ продуктов деградации
Далее, композиции из настоящего изобретения могут предотвращать и сводить к минимуму образование химических производных после лиофилизации, как подтверждается, например, Э-ВЭЖХ.
5.8.4.4. Стабильность при хранении с точки зрения олигомеризации
Композиции из изобретения могут также обеспечивать стабильность при хранении после лиофилизации, так что не образуется явного растворимого олигомерного материала (как определяется, например, Э-ВЭЖХ) при температурах хранения от -70°C до +40°C, после хранения в течение периодов времени, как определено выше, например, 1 месяца; или формируется меньше 1%, предпочтительно меньше 0,5%, например, 0,3% растворимого олигомерного материала (по результатам, например, Э-ВЭЖХ) при температурах от -70°C до +40°C, например, +40°C, после хранения в течение периодов времени, как определено выше, например, 1-36 месяцев, как в течение 1; 1,5; 3, 6, 9, 12, 18, 24, 30 или 36 месяцев.
5.8.4.5. Стабильность при хранении, отражаемая выходом основного продукта
Композиции из настоящего изобретения могут также обеспечивать получение после лиофилизации главного пика продукта, по результатам, например, Э-ВЭЖХ (см. таблицу 18 и таблицы 27-29) около 100% после хранения при температуре от -70°C до +40°C при продолжительности хранения, указанной выше, например, 1, 3, 6, 9, 12, 18 или 24 месяца; или главного пика продукта, по результатам, например, Э-ВЭЖХ (см. таблицу 18 и таблицы 27-29) по меньшей мере 85% или больше, такого как 86%, 87% или 88%. Более предпочтительно, главный пик составляет 90%, 92% или 95%, например, по меньшей мере 97%, более предпочтительно 100%, после хранения от -70°C до +40°C, например, +25°C, после хранения в течение времени, указанного выше, например, 1, 3, 6, 9, 12, 18 или 24 месяцев; или главный пик продукта, по результатам, например, Э-ВЭЖХ, составляет по меньшей мере 85%, по меньшей мере 90%, предпочтительно по меньшей мере 95%, например, по меньшей мере 98%, или даже около 100% после хранения от -70°C до +40°C, например, +40°C, после хранения в течение времени, как указано выше, например, 1, 3, 6, 9, 12, 18 или 24 месяца.
Композиции в соответствии с настоящим изобретением также обеспечивают после лиофилизации отсутствие изменений главного пика по результатам ОВ-ВЭЖХ после хранения, например, в концентрации 12,5 мг/мл при температуре от -70°C до +40°C от 1 до 12 месяцев, по сравнению с композицией до хранения, и представляющего по меньшей мере 90%, более предпочтительно по меньшей мере 93% от всех пиков, где контрольный образец имеет главный пик, например, 93% (см. таблицу 15). При хранении после лиофилизации при +40°C в течение до 12 месяцев композиция из настоящего изобретения сохраняет главный пик по результатам ОФ-ВЭЖХ по меньшей мере 91%, 92% или 93%.
Далее, по результатам кИЭФ (см. таблицы 27-29), композиции из настоящего изобретения обеспечивают после лиофилизации выход основного продукта после хранения при концентрации, например, 12,7 мг/мл в течение 1-24 месяцев при температуре от -70°C до +40°C, сопоставимый с контрольным образцом (композиция без хранения, главный пик составляет по меньшей мере 96%), например, главный пик составляет по меньшей мере 85% или больше, как 86%, 875 или 88%. Более предпочтительно, главный пик составляет 90%, 92%, 93%, 94%, 95% или 96%, например, по меньшей 97%, более предпочтительно 100%, после хранения при температуре от -70°C до +40°C.
5.8.4.6. Стабильность в условиях замораживания-оттаивания
Композиции из настоящего изобретения также обеспечивают хорошую стабильность после лиофилизации в условиях ЗО. Например, композиции из настоящего изобретения можно подвергать, например, 5 циклам ЗО от -20°C до комнатной температуры (например, +25°C). Иммуноглобулиновые одиночные вариабельные домены, содержащиеся в композициях, выдерживают эти условия без существенного нарушения, по результатам, например, ОФ-ВЭЖХ или Э-ВЭЖХ. Во всех случаях сохраняется химическая и физическая целостность агентов, связывающих ФВ, например, иммуноглобулиновых одиночных вариабельных доменов. Общий выход находится в диапазоне от 95 до 100%, предпочтительно по меньшей мере 95, 98 или 99%, по сравнению с жидким контрольным образцом, хранящимся при -70°C.
В частности, при концентрации 16 мг/мл, 5 циклов ЗО приводят к выходу (по результатам определения на основе, например, общей площади, т.е. AU) полипептида, при определении ОФ-ВЭЖХ или Э-ВЭЖХ, составляющему по меньшей мере 90%, 95%, 98%, 99% или 100%; где в частном варианте осуществления профиль ОФ-ВЭЖХ или Э-ВЭЖХ не меняется, по сравнению с контрольным образцом (жидким контрольным образцом, хранившимся при -70°C) (см. таблицу 12).
5.8.4.7. Стабильность с точки зрения активности
Специалисту в данной области техники известны разные способы определения активности агентов, связывающих ФВ, в частности, иммуноглобулиновых одиночных вариабельных доменов, в частности, полипептидов в соответствии с любой из SEQ ID NO: 1-19, например, SEQ ID NO: 1 (см., например, раздел, посвященный экспериментам, из WO2006/122825 [P05-003], например, примеры 3-6, 18 и 19, или раздел, посвященный экспериментам, из WO2009/115614 [P08-013]). На активность агентов, связывающих ФВ, после лиофилизации не оказывали влияния повторные циклы ЗО композиций. В частности, активность агентов, связывающих ФВ, оставалась стабильной в композициях из изобретения, тестируемых в стрессовых условиях, т.е. до 12 месяцев хранения при +40°C (таблица 23) и даже до 24 месяцев при хранении при +40°C (таблица 29). В одном варианте осуществления активность полипептида из настоящего изобретения после лиофилизации может быть определена по связыванию с его антигеном обычными методами анализа, например, ИФА, Biacore, РИА, FACS, и т.д. В частности, в композициях из настоящего изобретения по меньшей мере 80%, предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 95%, или даже по меньшей мере 99% агентов, связывающих ФВ, сохраняют свою связывающую активность после хранения в вышеуказанных стрессовых условиях, по сравнению со связывающей активностью до хранения.
В другом аспекте композиции из настоящего изобретения по существу не демонстрируют потери биологической активности, при сравнении жидкой композиции ALX-0081 с лиофилизированной композицией, по результатам различных иммунологических анализов, включая анализ Biacore, иммуноферментный анализ (ИФА), анализ ристоцетин-индуцированной кофакторной активности (RICO) и/или анализ на основе Gyrolab (см. раздел 7.13 и таблицу 24).
5.8.4.8. Обобщение стабилизирующих эффектов
Композиции из настоящего изобретения оказывают влияние на сохранение после лиофилизации химической и физической целостности полипептидов из настоящего изобретения, ALX-0081, т.е. даже после продолжительного хранения, например, в течение времени, определенного выше, при температурах от -70°C до +40°C, чистота/профиль примесей продукта по существу не меняется. Например, пролонгированное хранение после лиофилизации не оказывало существенного влияния на профили ОФ-ВЭЖХ, Э-ВЭЖХ или кИЭФ, как подтверждено в разделе, посвященном экспериментам.
5.9. Способы из настоящего изобретения
Агенты, связывающие ФВ, из настоящего изобретения могут быть получены любым общеизвестным способом. Типичные примеры включают рекомбинантную экспрессию в системе подходящего носителя, например, бактерий или дрожжей. Агенты, связывающие ФВ, подвергают подходящему режиму очистки перед получением композиций в соответствии с настоящим изобретением.
Настоящее изобретение охватывает способы получения композиций, описанных в настоящей заявке.
Этапы очистки и получения композиций могут совпадать, например, когда агенты, связывающие ФВ, из настоящего изобретения, элюируют с колонки с применением буфера в соответствии с настоящим изобретением. Альтернативно, композиции из настоящего изобретения можно приготовить путем замены буфера любыми подходящими средствами, например, средствами, широко применяемыми в данной области техники, такими как диализ, ультрафильтрация, и т.д.
В некоторых вариантах осуществления способ получения композиции из настоящего изобретения может также относиться к восстановлению лиофилизированной или высушенной распылением композиции, например, путем добавлением воды или подходящего буфера (который может факультативно содержать дополнительные вспомогательные вещества).
Способы приготовления композиции в соответствии с настоящим изобретением могут включать дополнительные этапы, такие как розлив во флаконы, подходящие для клинического применения, такие как герметичные контейнеры, и/или заключительную обработку с получением готовой лекарственной формы. Способы могут также включать дополнительные этапы, такие как распылительная сушка, лиофилизация или замораживание, например, замораживание в объеме. Изобретение также включает контейнеры, лекарственные формы или другие продукты, полученные по любому из способов, приведенных в настоящей заявке. Композиции из настоящего изобретения можно использовать для хранения агентов, связывающих ФВ, например, ИОВД, как определено в настоящей заявке. Таким образом, изобретение охватывает способ хранения агента, связывающего ФВ, как применяется в настоящей заявке, характеризующийся применением композиции, как определено в настоящей заявке. В частности, изобретение охватывает способы стабилизации агента, связывающего ФВ, как определено в настоящей заявке, для хранения, включающие, например, приготовление композиции, как описано в настоящей заявке. Хранение может осуществляться в течение 1-36 месяцев, такого времени, как 1; 1,5; 3, 6, 9, 12, 18, 24, 30 или 36 месяцев, например, по меньшей мере 12 или даже 24 месяца, факультативно, при температуре от -70°C до +40°C, такой как -70°C, -20°C, +5°C, +25°C или +40°C, предпочтительно при температуре от -70°C до +25°C, более предпочтительно при температуре от -20°C до +5°C. Таким образом, хранение может включать замораживание, замораживание-сушку (лиофилизацию) и/или распылительную сушку. Способы хранения могут дополнительно включать оценку физической и химической целостности агентов, связывающих ФВ, как определено в настоящей заявке.
Настоящее изобретение также относится к способам анализа композиций, содержащих по меньшей мере один из агентов, связывающих ФВ, как определено в настоящей заявке. Композиции можно анализировать для определения любых признаков химической или физической нестабильности агентов, связывающих ФВ, как определено в настоящей заявке. Например, в композициях можно оценивать присутствие продуктов деградации, например, низкомолекулярных производных, таких как протеолитические фрагменты; и/или химических производных, например, пироглутаматных вариантов; и/или высокомолекулярных производных, таких как агрегаты, агломераты, и т.д. В композиции также можно оценивать общее содержание белка и/или активность. Каждый из различных способов анализа, как определено в настоящей заявке, можно применять в способе анализа из настоящего изобретения.
Таким образом, настоящее изобретение также относится к способу контроля и/или оценки качества и/или стабильности композиции, например, во время одного или более из производства, хранения и применения. Изобретение также относится к способу контроля качества композиции, например, к оценке соответствия композиции спецификациям продукта, как описано далее. Изобретение в каком-либо из этих аспектов включает одно или более, выбранное из сравнения с одним или несколькими эталонными образцами, анализа вариаций от серии к серии, и постоянного контроля производственного процесса.
Настоящее изобретение относится к любому продукту, связанному с композициями из настоящего изобретения, например, включающему их, или необходимому для их производства или получения готового продукта, без какого-либо ограничения.
Например, настоящее изобретение относится к предмету производства, например, герметичному контейнеру, содержащему одну или несколько композиций в соответствии с настоящим изобретением. Изобретение также относится к фармацевтической лекарственной форме, например, лекарственной форме, пригодной для парентерального применения у пациента, предпочтительно, пациента – человека, включающей одну или несколько из композиций в соответствии с каким-либо вариантом осуществления, описанным в настоящей заявке. Лекарственная форма может быть, например, в виде предварительно заполненного шприца, ампулы, картриджа или флакона. Шприц, ампула, картридж или флакон могут быть произведены из любого подходящего материала, такого как стекло или пластик, и могут включать резиновые материалы, такие как резиновые пробки для флаконов, и резиновые поршни и резиновые прокладки для шприцев и картриджей. Изобретение также относится к набору, содержащему одну или более из композиций в соответствии с настоящим изобретением. Набор может дополнительно содержать инструкции по применению и/или аннотацию к лекарственному средству. В любом варианте осуществления продуктов, как определено в настоящей заявке, изобретение также охватывает присутствие упаковочного материала, инструкций по применению, и/или аннотаций к лекарственному средству, например, как зависит от особенностей регулирования.
5.10. Определения
5.10.1. Идентичность
С целью сравнения двух или более аминокислотных последовательностей, процент «идентичности последовательности» между первой аминокислотной последовательностью и второй аминокислотной последовательностью (также обозначаемой в настоящей заявке как «аминокислотная идентичность») может быть рассчитан путем деления [числа аминокислотных остатков в первой аминокислотной последовательности, идентичных аминокислотным остаткам в соответствующих положениях во второй аминокислотной последовательности] на [общее число аминокислотных остатков в первой аминокислотной последовательности] и умножения на [100%], где каждая делеция, вставка, замена или добавление аминокислотного остатка во второй аминокислотной последовательности, по сравнению с первой аминокислотной последовательностью, считается отличием отдельного аминокислотного остатка (положения), т.е. «аминокислотным отличием», как определено в настоящей заявке.
Альтернативно, степень идентичности последовательности между двумя или более аминокислотными последовательностями может быть рассчитана с применением известного компьютерного алгоритма для выравнивания последовательности, такого как NCBI Blast v2.0., с применением стандартных установок.
Некоторые другие методики, компьютерные алгоритмы и установки для определения идентичности последовательности описаны, например, в WO04/037999, EP0967284, EP1085089, WO00/55318, WO00/78972, WO98/49185 и GB2357768-A.
Обычно с целью определения процента «идентичности последовательности» между двумя аминокислотными последовательностями в соответствии со способом расчета, изложенным выше, аминокислотную последовательность с наибольшим числом аминокислотных остатков принимают в качестве «первой» аминокислотной последовательности, а другую аминокислотную последовательность принимают в качестве «второй» аминокислотной последовательности.
Кроме того, при определении степени идентичности последовательности между двумя аминокислотными последовательностями специалист в данной области техники может учитывать так называемые «консервативные» аминокислотные замены, которые могут, как правило, быть описаны как аминокислотные замены, в которых аминокислотный остаток замещен другим аминокислотным остатком схожей химической структуры, и которые по существу не оказывают, или оказывают незначительное влияние на функцию, активность или другие биологические свойства полипептида. Такие консервативные аминокислотные замены хорошо известны в данной области техники, например, из WO04/037999, GB2357768-A, WO98/49185, WO00/46383 и WO01/09300; и (предпочтительные) типы и/или комбинации таких замен могут быть выбраны на основе соответствующих учений из WO04/037999, а также WO98/49185, и из других ссылок, цитированных в настоящей заявке. Такие консервативные замены предпочтительно являются заменами, в которых одна аминокислота в пределах следующих групп (а)-(е) замещена другим аминокислотным остатком в пределах той же самой группы: (а) малых алифатических, неполярных или слабо полярных остатков: Ала, Сер, Тре, Про и Гли; (b) полярных, отрицательно заряженных остатков и их (незаряженных) амидов: Асп, Асн, Глу и Глн; (с) полярных, положительно заряженных остатков: Гис, Арг и Лиз; (d) больших алифатических, неполярных остатков: Мет, Лей, Иле, Вал и Цис; и (е) ароматических остатков: Фен, Тир и Трп. Особо предпочтительными консервативными заменами являются следующие: Ала на Гли или на Сер; Арг на Лиз; Асн на Глн или на Гис; Асп на Глу; Цис на Сер; Глн на Асн; Глу на Асп; Гли на Ала или на Про; Гис на Асн или на Глн; Иле на Лей или на Вал; Лей на Иле или на Вал; Лиз на Арг, на Глн или на Глу; Мет на Лей, на Тир или на Иле; Фен на Мет, на Лей или на Тир; Сер на Тре; Тре на Сер; Трп на Тир; Тир на Трп; и/или Фен на Вал, на Иле или на Лей. Любые аминокислотные замены, применяемые к полипептидам, описанным в настоящей заявке, могут также быть основаны на анализе частот аминокислотных вариаций между гомологичными белками различных видов, разработанном Schulz et al., «Principles of Protein Structure», Springer-Verlag, 1978 («Принципы белковой структуры»), на анализах структурообразующих потенциалов, разработанных Chou and Fasman, Biochemistry 13: 211, 1974 и Adv. Enzymol., 47: 45-149, 1978, и на анализе характера гидрофобности белков, разработанном Eisenberg et al., Proc. Natl. Acad. Sci. USA 81: 140-144, 1984; Kyte & Doolittle; J Molec. Biol. 157: 105-132, 1981, и Goldman et al., Ann. Rev. Biophys. Chem. 15: 321-353, 1986, каждый из которых включен в настоящей заявке посредством ссылки во всей полноте. Информация по первичной, вторичной и третичной структуре Нанотел® приведена в описании настоящей заявки, и в целом в предшествующем уровне техники, цитированном выше. Также для этой цели, кристаллическая структура VHH домена ламы приведена, например, Desmyter et al., Nature Structural Biology, Vol. 3, 9, 803 (1996); Spinelli et al., Nature Structural Biology (1996); 3, 752-757; и Decanniere et al., Structure, Vol. 7, 4, 361 (1999). Дополнительная информация о некоторых аминокислотных остатках, которые в обычных VH доменах формируют VH/VL интерфейс, и возможные камелизирующие замены в этих положениях можно найти в предшествующем уровне техники, цитированном выше.
6. Сокращения
АФИ Активный фармацевтический ингредиент
кИЭФ Капиллярное изоэлектрофокусирование
DLS Динамическое светорассеяние
ДЭ Дизайн эксперимента
ЛП Лекарственный продукт
ЛС Лекарственная субстанция
ЗО Замораживание-оттаивание
ВММ Высокая молекулярная масса
НММ Низкая молекулярная масса
MALS Многоракурсное светорассеяние
ОВ Относительная влажность
ОФХ Обращенно-фазовая хроматография
ОФ-ВЭЖХ Обращенно-фазовая высокоэффективная хроматография
Э-ВЭЖХ Эксклюзионная высокоэффективная хроматография
СОП Стандартная операционная процедура
Тп Температура плавления (°С)
TSA Анализ теплового сдвига
ФВ Фактор Виллебранда
ВДИ Вода для инъекций
Изобретение далее описано посредством следующих не ограничивающих предпочтительных аспектов, примеров и фигур.
Полное содержание всех ссылок (включая литературные ссылки, изданные патенты, опубликованные патентные заявки, и одновременно ожидающие решения патентные заявки), цитированных в настоящей заявке, настоящим прямо включено посредством ссылки, в частности, для учения, приведенного выше.
7. Примеры
Ряд экспериментов был проведен для получения улучшенного буфера для композиции, предназначенного для удовлетворения широкого ряда различных и на первый взгляд несовместимых задач. В частности, обеспечиваются примерные композиции, способные к сохранению стабильности, биологической активности, чистоты и качества ALX-0081 на протяжении продолжительного периода времени, устойчивые к различным видам стресса, таким как замораживание, лиофилизация, нагревание и/или восстановление.
Современная лекарственная субстанция ALX-0081 представлена в виде жидкой композиции, содержащей 5 мг/мл активного фармацевтического ингредиента (АФИ) в буфере на основе фосфата (D-PBS), содержащем 200 мМ глицин и 0,02% Твин-80 (о/о), с рН 7,1 (ЛС). Хотя эту композицию применяли во время исходных клинических испытаний, она может быть улучшена различными способами. Во-первых, относительно низкая концентрация, вероятно, потребует множества подкожных инъекций (с учетом того, что объем для подкожных инъекций ограничен примерно до 1 мл), таким образом, снижая переносимость пациентом. Во-вторых, стабильность при хранении при 3-8°С или комнатной температуре современной композиции ALX-0081 ограничена. Ограниченный срок годности современной композиции главным образом определяется химической модификацией (см. раздел 7.2). Химические модификации могут быть связаны с потерей активности. Хотя достижимый срок годности может обеспечиваться при хранении продукта при -20°С, однако, это не считается благоприятным вариантом для большинства практических целей.
7.1. Методы
Образцы анализировали по существу в соответствии со стандартными операционными процедурами для оценки содержания, активности и чистоты, осаждения, концентрации, деградации, агрегации и активности. Кроме того, все образцы визуально оценивали для определения мутности или наличия белковых агрегатов, или образования осадка. Содержание остаточной влаги в специфических лиофилизированных образцах определяли посредством титрования по Карлу Фишеру.
В настоящем исследовании использовали три различных программы лиофилизации для сушки ALX-0081: стандартный 65 часовой режим (фигура 1), укороченный 37 часовой режим, и более продолжительный цикл из 66 часов, оптимизированный для снижения содержания остаточной влаги, как описано в таблице 14.
Вкратце, в начале укороченного 37 часового способа лиофилизации температура полок составила +20°С, и её доводили до -50°С за 2 часа. Затем создавали вакуум 0,04 мбар за 1 час. После достижения вакуума 0,04 мбар температуру полок в течение 4 часов поддерживали на -50°С. После этих 4 часов температуру постепенно повышали до 0°С за 15 часов (т.е. выполняя этап первичной сушки, удаляя замороженную воду). Температуру полок 0°С поддерживали в течение 7 часов при сохранении вакуума 0,04 мбар. Спустя 7 часов температуру повышали до +25°С за 3 часа, и затем поддерживали на 25°С в течение 5 часов (т.е. проводили этап вторичной сушки, удаляя размороженную воду). Флаконы укупоривали под вакуумом ±0,400 мбар, после чего восстанавливали нормальное давление.
Тот же самый способ применяли для стандартного 65 часового режима, и он только отличался вторым этапом сушки, который продляли до 28 часов при 25°С под вакуумом, приводя к достижению времени общего цикла около 65 часов. Схематический обзор различных этапов стандартного 65 часового режима лиофилизации показан на фигуре 1. Во время процесса лиофилизации контролировали температуру трех флаконов в стратегических положениях. Наконец, стандартный 65 часовой режим модифицировали во время операции, в соответствии с показаниями температурных датчиков, что приводило к пролонгированным циклам лиофилизации, как описано в таблице 14.
7.2. Химическая стабильность современной композиции ALX-0081
ОФ-ВЭЖХ является одним из наиболее информативных способов оценки химической стабильности лекарственной субстанции (ЛС).
ОФ-ВЭЖХ обеспечивала разрешение ЛС ALX-0081 на ряд различных видов. В дополнение к главному пику, можно видеть предварительные пики (вещество, элюируемое перед интактным не модифицированным материалом) и ряд последующих пиков. В сериях, полученных до сегодняшнего дня, предварительные пики и последующий пик 1, соответственно, представляют примерно 2% и 3,6% от ЛС, в то время как другие последующие пики составляют менее 1% от ЛС.
Однако при хранении в ускоренных (+5°C) или стрессовых (+25°C и +37°C/+40°C) условиях возрастает относительное присутствие определенных вариантов, связанных с продуктом, в зависимости от времени и температуры, как изображено на фигуре 2А. Кроме того, главный пик при ОФ-ВЭЖХ разделяется на несколько различных видов при пролонгированной инкубации, особенно при повышенных температурах (≥+25°C) (фигура 2В). Эти данные показывают, что некоторые элюируемые раньше новые молекулярные виды образуются при хранении.
Наиболее важными модификациями, присутствующими в ЛС ALX-0081 ко времени производства или возникающими при хранении, являются следующие: (i) предварительный пик 1 (окисление); (ii) последующий пик 1 (нор-Лей вариант); (iii) последующий пик 2 (образование пироглутамата), и (iv) расщепление главного пика (изомеризация). Модификации (i), (ii), и (iii) не оказывают существенного влияния на активность (данные не показаны). Напротив, изомеризация остатков аспарагиновой кислоты в положениях 105 и 236 SEQ ID NO: 1, которые расположены в участке CDR3, как было показано, является преобладающим молекулярным механизмом, лежащим в основе возможной потери активности ALX-0081 (см. (iv) выше).
Некоторые из вариантов, связанных с продуктом ALX-0081, которые присутствуют во время производства или возникают при хранении, можно также выявить путем кИЭФ. В этом случае пироглутаматная модификация проявляется в виде последующего пика (см. (iii) выше). Также, подобно тому, что наблюдалось при ОФ-ВЭЖХ анализе, изомеризация, происходящая в положении 105 в обоих 12А02Н1 доменах, приводит к расширению главного пика, и в итоге к расщеплению главного пика кИЭФ (см. (iv) выше).
7.3. Выбор буферов и вспомогательных веществ
Для дальнейшей разработки композиции агентов, связывающих ФВ, проводили комплексный ряд экспериментов с оценкой различных параметров, которые влияли друг на друга, включая (i) различные буферы, (ii) с различной концентрацией, (iii) с каждым буфером при различных значениях рН; и (iv) объединение каждого буфера с различными вспомогательными веществами.
Буферные системы должны иметь как можно низкую буферную ёмкость, чтобы не вызывать существенных нарушений буферной системы организма при введении. Кроме того, необходимо тщательно оценивать влияние типа и концентрации буфера на активность активного фармацевтического ингредиента (АФИ).
Как правило, повышенные уровни стабильности белков связаны с высокими температурами плавления. Соответственно, термические свойства ALX-0081 контролировали в присутствии различных композиций. В частности, эксперимент по TSA проводили с 192 различными изотоничными композициями, для которых результаты были изложены в дизайне эксперимента (ДЭ) для оценки влияния буфера, концентрации, ионной силы, рН и вспомогательных веществ на термостабильность ALX-0081. Считывали температуру плавления (Тп) ALX-0081, являющуюся показателем термостабильности белка в различных тестируемых композициях.
Вкратце, применяемый анализ теплового сдвига (TSA) использует изменения сигнала флуоресцентного красителя, такого как Sypro Orange (оранжевый), когда белок подвергается термическому развертыванию. Когда Sypro Orange добавляют к раствору соответствующим образом свернутого белка, он не может связаться с какой-либо поверхностью на белке, и его флуоресцентный сигнал гасится. Когда температура повышается, белок подвергается термическому развертыванию, и обнажает область своей гидрофобной сердцевины. Sypro Orange затем связывается с гидрофобными участками и активизируется, что приводит к повышению флуоресцентного сигнала. Анализ выполняют с растворами, содержащими различные тестируемые композиции, ALX-0081 в количестве 0,2 мг/мл и 10× Sypro Orange. Программа состоит из следующих этапов: нагревание до 37°С со скоростью изменения 4,4°С/сек и выдерживание в течение 10 сек; нагревание до 90°С при постоянной скорости изменения 0,02°С/сек (сбор данных 20 раз на °С); и охлаждение до 37°С со скоростью изменения 2,2°С/сек и выдерживание в течение 10 сек.
Применяли следующий набор буферов с различными концентрациями (10-200 мМ), значения рН и вспомогательные вещества:
- цитрат рН 6,0-6,5-7,0;
- гистидин рН 5,5-6,0-6,5;
- фосфат рН 6,5-7,0-7,5;
- Трис-НСl рН 7,4-7,7-8,0;
- NaCl 0-140 мМ диапазон концентрации;
- глицин 0-270 мМ диапазон концентрации;
- маннитол 0-270 мМ диапазон концентрации;
- сахароза 0-270 мМ диапазон концентрации;
- трегалоза 0-270 мМ диапазон концентрации.
Полученные температуры плавления (Тп) вводили в программу Design Expert для анализа эксперимента факторного скрининга для прогноза 50 композиций, обеспечивающих наивысшую термостабильность (см. таблицу 1).
Наивысшие значения Тп были прогнозированы для фосфата (рН 7,0-7,5) и цитрата (рН 6,2-7,0), содержащих трегалозу, сахарозу, маннитол или глицин. Полностью неожиданно, результаты исследования позволяют предположить, что буферы на основе Трис-НСl (рН 7,8-8,0) и гистидин-НСl (рН 6,5) возвращают значительно более низкие температуры плавления, хотя они были предварительно выбраны в качестве буферной системы выбора для контроля рН раствора иммуноглобулиновых одиночных вариабельных доменов, как описано в WO2010/077422.
Соответственно, был сделан вывод, что фосфатные и цитратные композиции, содержащие трегалозу, сахарозу, глицин или маннитол, особенно хорошо стабилизируют агенты, связывающие ФВ, например, ALX-0081.
7.4. Анализ растворимости
Чтобы определить, возможно ли дополнительное усиление растворимости ALX-0081, проводили исходный скрининг некоторых композиций. В ALX-0081 заменяли буфер на интересующую композицию (за исключением Твин-80), и дополнительно концентрировали в ячейке с перемешиванием (например, типа Amicon), оснащенной фильтром с пределом отсечения 5 кДа. Как только отмечалась видимая преципитация или мутность, образец фильтровали, и измеряли концентрацию белка. В таблице 2 обобщены полученные результаты.
Концентрация буферов на основе фосфата и гистидина приводила к мутности образца и образованию осадка при относительно низких концентрациях белка (<10 мг/мл). Напротив, ALX-0081 оставался физически стабильным в цитратном буфере, даже после достижения концентрации около 56 мг/мл. В дополнение к визуальному анализу, отсутствие частиц или ВММ видов подтверждали флуоресцентной микроскопией (с окрашиванием нильским красным, посредством Э-ВЭЖХ и DLS). Далее, когда раствор ~56 мг/мл подвергали либо 10 циклам ЗО при -20°С или -70°С, либо хранению при +4°С в течение примерно 1 недели, как кажется, это не влияло на физическую стабильность молекулы по результатам Э-ВЭЖХ анализа (см. фигуры 3А и 3В, соответственно).
Сравнительно высокая растворимость ALX-0081 в цитратном буфере была подтверждена анализом с осаждением ПЭГ (данные не показаны).
7.5. Твин-80
Чтобы определить, действительно ли неионный сурфактант полисорбат, также обозначенный как Твин (Полиоксиэтилен (N) сорбитан монолаурат; где N=20, 40, 60, 65, 80 или 85), необходим для образования ALX-0081, проводили несколько экспериментов со стрессом, вызванным перемешиванием, в 50 мМ цитратном буфере при рН 6,0 и 6,5. Влияние различных концентраций Твин-80 (без Твин-80, с 0,01% и 0,02% (о/о)) на физическую стабильность ALX-0081 оценивали при 5 мг/мл путем мониторинга рассеянного сигнала при 500 нм на спектрофлуориметре.
Твин-80 предотвращал повышение сигнала рассеивания в обоих буферах, демонстрируя защитный эффект (фигуры 4А и 4В). Не отмечалось существенных различий между образцами, содержащими 0,01% или 0,02% Твин-80 (о/о). Далее, Э-ВЭЖХ профили образцов до и после перемешивания не показывают каких-либо различий: достигается 95-100% выход, и не выявляется олигомеризации или деградации.
На основе этих результатов было решено включить 0,01% Твин-80 (о/о) в композицию агентов, связывающих ФВ, например, ALX-0081.
7.6. Твин
Чтобы определить, действительно ли другие члены полисорбатного ряда, отличающиеся по длине полиоксиэтиленовой цепи и жирнокислотно-эфирному компоненту, например, Твин-20, Твин-40, Твин-60, Твин-65 и Твин-85, необходимы в композиции агентов, связывающих ФВ, проводили несколько экспериментов по стрессу, вызванному перемешиванием, в 50 мМ цитратном буфере при рН 6,0 и 6,5, особенно как описано в разделе 7.5 выше. Оценивали влияние различных концентраций различных членов ряда Твин (без Твин, с 0,01% и с 0,025 (о/о)) на физическую стабильность агента, связывающего ФВ, при 5 мг/мл, путем мониторинга рассеивания сигнала при 500 нм на спектрофлуориметре.
Твин-20, Твин-40, Твин-60, Твин-65 и Твин-85 обеспечивали по существу один и тот же благоприятный результат, как Твин-80.
7.7. Анализ стабильности жидких композиций
Более тщательное исследование проводили для оценки стабильности ALX-0081 в различных изотоничных композициях на основе цитрата в концентрации 20 мг/мл. В таблице 3 приведен обзор различных протестированных композиций.
Основной задачей была оценка влияния рН (6,0-6,5-7,0) и типа вспомогательного вещества (NaCl, маннитола, сахарозы или глицина) на стабильность жидкого продукта. Для контроля и прямого сравнения цели исследования также включали современную композицию ALX-0081 5 мг/мл с D-PBS и глицином (идентичную современной композиции, за исключением более низких концентраций Твин-80), а также ранее упомянутые различные изотоничные растворы ALX-0081 на основе цитрата, но с концентрацией 5 мг/мл вместо 20 мг/мл. В целом, это привело к 17 различным жидким композициям (композиции NO: 1-17), которые подвергали длительному анализу стабильности. Для исключения влияния различий в концентрации Твин, все композиции содержали 0,01% Твин-80 (о/о).
7.7.1. Стабильность при замораживании-оттаивании
Оценивали влияние повторных циклов ЗО на стабильность ALX-0081 в виде жидкой композиции. Аликвоты различных композиций (0,5 мл/пробирку) подвергали воздействию до 10 циклов ЗО от -70°C или -20°C. Один цикл включал замораживание в течение ±20 мин с последующим оттаиванием в течение 5 мин на водяной бане при +25°C. После этой обработки все композиции оставались визуально прозрачными. Анализы ОФ-ВЭЖХ показали хороший выход (95-100%), и не отмечалось существенной разницы профилей, что позволяет предположить, что на качество агентов, связывающих ФВ, например, ALX-0081, не оказывает влияние повторное замораживание-оттаивание в 17 различных тестированных жидких композициях.
7.7.2. Стабильность при хранении
Стабильность 17 различных композиций также оценивали путем хранения аликвот (0,5 мл на пробирку) в стрессовых условиях, т.е. при +40°С; в качестве контроля включали условия долговременного хранения при -70°С. Анализы были сосредоточены на ОФ-ВЭЖХ, поскольку этот способ общеизвестен как особо информативный способ для выявления химических модификаций, происходящих при хранении (см. таблицу 4). В этом разделе приведен обзор данных, полученных после 1 месяца хранения; результаты подтверждают наблюдения в более ранние периоды времени, например, спустя 1 неделю и 2 недели.
(а) ОФ-ВЭЖХ
Как указано в разделе 7.2 выше, ОФ-ВЭЖХ анализ показывал разрешение современной ЛС ALX-0081 (композиция с D-PB глицином) на некоторые варианты, связанные с продуктом, и примеси. Вкратце, при стрессовых условиях (например, +40°С), чистота (% главного пика) снижалась одновременно с повышением некоторых из существующих предыдущих/последующих пиков, а также с формированием дополнительных пиков.
Данные ОФ-ВЭЖХ, полученные в настоящем исследовании, обобщены в таблице 5.
В целом, полученные результаты показывают, что по существу одни и те же модификации происходят в различных цитратных буферах, как наблюдалось в представленном буфере для композиции (т.е. D-PBS/глицине), хотя можно отметить некоторую разницу в относительной площади пика. В частности, повышение площади предыдущих пиков (окисление) было ниже в цитратных композициях (особенно при рН 6,0), по сравнению с композицией в D-PBS/глицине. Что касается образования этого предварительного пика, глицин, как кажется, является наименее благоприятным среди различных вспомогательных веществ. Профиль различных последующих пиков после хранения в течение 1 месяца при +40°С был сопоставимым для всех композиций, хотя второй последующий пик (т.е. пироглутаматный вариант) казался более выраженным при рН 7,0, чем при рН 6,0-6,5. Степень расширения/расщепления главного пика в результате Асп-изомеризации трудно оценить из-за плохого разрешения; процентная площадь плечевого пика не может быть точно установлена, и таким образом, была включена в относительную площадь пика, отмеченную в таблице 5 для главного пика. Однако соответствующие ОФ-ВЭЖХ хроматограммы (данные не показаны) обеспечили проведение количественной оценки; эти данные позволили предположить, что степень изомеризации является достаточно схожей в различных композициях.
(b) кИЭФ
Подобно ОФ-ВЭЖХ, метод кИЭФ обеспечивает детекцию определенных вариантов продукта, возникающих при хранении в стрессовых условиях (см. подробности в разделе 7.2). Примеры приведены на фигуре 5, где сравниваются электрофореграммы современного ALX-0081 после хранения в течение 1 месяца при -70°C и +40°C.
Данные кИЭФ, полученные в настоящем исследовании (данные не показаны), в основном подтверждают заключения, обеспеченные ОФ-ВЭЖХ анализом, т.е. тот же самый тип модификаций происходит примерно в той же степени в разных цитратных буферах, как наблюдалось в буфере настоящей композиции, представленном композицией 17, как изображено на фигуре 5 (т.е. D-PBS/глицин). Однако можно наблюдать некоторую разницу относительной площади пиков. В частности, последующий пик (т.е. пироглутаматный вариант) проявляется более выраженным при рН 7,0, чем при рН 6,0-6,5, что согласуется с наблюдениями ОФ-ВЭЖХ, как раньше было обобщено в таблице 5.
(с) Э-ВЭЖХ
Э-ВЭЖХ анализ проводили для оценки физической стабильности ALX-0081, т.е. для выявления ВММ видов и/или продуктов деградации, которые могут формироваться при хранении в стрессовых условиях. Для всех тестированных композиций стрессовые условия, как кажется, не оказывали существенного влияния на Э-ВЭЖХ хроматограммы.
(d) Заключение
Обобщение наиболее важных наблюдений, касающихся стабильности при хранении различных жидких композиций ALX-0081, показано в таблице 5. Перечислены только наиболее информативные данные на основе ОФ-ВЭЖХ анализа. Эти данные позволяют сделать предположение о более высокой химической стабильности в 50 мМ цитрате при рН 6,0-6,5. За исключением глицина, тип вспомогательного вещества не оказывает значительного влияния на стабильность. Что касается физической стабильности, не наблюдалось различий между различными композициями. О последнем свидетельствовал примерно 100% выход, наблюдаемый для всех образцов при различных ВЭЖХ анализах, а также Э-ВЭЖХ хроматограммы, демонстрирующие отсутствие агрегации/деградации.
На основе вышеуказанных результатов было решено далее использовать потенциал композиций из цитрата/сахарозы при рН 6,0-6,5.
7.8. Анализ стабильности лиофилизированных композиций
Влияние лиофилизации оценивали путем сравнения стабильности при хранении ALX-0081 в жидких и лиофилизированных композициях из цитрата/сахарозы (20 мг/мл АФИ при рН 6,0-6,5). Обзор тестированных композиций приведен в таблице 6. Композиции из предшествующего уровня техники на основе D-PBS/глицина (5 мг/мл АФИ) были включены для сравнения. Жидкую (т.е. до лиофилизации) и лиофилизированную композицию ALX-0081 хранили в замороженном состоянии (-70°C для жидких образцов и -20°C для лиофилизированных композиций), а также при +5°C, +25°C и +40°C, и образцы анализировали спустя 2 недели и 1,5 месяца хранения.
На Панели А с фиг. 6 показано изображение флаконов после процесса лиофилизации с применением стандартного 65 часового режима, как показано на фигуре 1. Лиофилизация композиций, содержащих цитрат/сахарозу, приводила к образованию хорошего лиофилизата, в то время как образцы, полученные в D-PBS/глицине, не обеспечивали хорошего лиофилизата. Все образцы можно было легко ресолюбилизировать в воде Milli-Q, и растворы были прозрачными и бесцветными (фигура 6, панель В).
7.8.1. Оценка продукта до или после лиофилизации
ОФ-ВЭЖХ и Э-ВЭЖХ анализ не выявил существенных различий с точки зрения физико-химических характеристик между жидким исходным продуктом (хранившимся при ≤ -70°C) и продуктом после лиофилизации и восстановления любой из тестированных композиций. Далее, полное восстановление образца было продемонстрировано для всех композиций (таблица 7).
7.8.2. Оценка лиофилизированного продукта после 1,5 месяцев хранения
(а) Визуальный анализ и содержание.
Лиофилизат из лиофилизированных образцов не показал визуальных признаков распада спустя 1,5 месяцев хранения при -20°C, +5°C, +25°C или +40°C.
Образцы были прозрачными и бесцветными после восстановления водой Milli-Q. Кроме того, хранение не оказывало значительного влияния на содержание, измеренное после восстановления (таблица 8).
(b) ОФ-ВЭЖХ.
Профили 3 различных лиофилизированных композиций (№ 3, 7 и 17) сравнивали спустя 1,5 месяца хранения при -20°C, +5°C, +25°C и +40°C, соответственно. Сравнение при наиболее активных условиях (+40°C) наилучшим образом выявляет влияние лиофилизации на химическую стабильность.
Соответствующие результаты обобщены в таблице 8. Как можно видеть, хранение в замороженной форме не влияет на ALX-0081 в какой-либо из композиций, тестированных в настоящем исследовании.
В целом, можно сделать основной вывод из полученных данных о том, что лиофилизация композиции на основе цитрата/сахарозы по существу предотвращает химические модификации, происходящие в жидкой форме, за исключением некоторых минимальных количеств пироглутаматной модификации. В этих лиофилизированных композициях не было ни повышения процентной площади предыдущих пиков, ни признаков расширения/расщепления главного пика. Напротив, лиофилизация композиции на основе D-PBS/глицина не приводит к существенному улучшению химической стабильности. Образование пироглутамата в лиофилизированной композиции на основе цитрата/сахарозы кажется слегка более выраженным при рН 6,0, чем при рН 6,5. Это обосновано данными при температуре +25°С, при которой скорость образования пироглутамата ниже, но показывает ту же самую зависимость от рН. Как ожидалось, хранение до 1,5 месяцев при -20°C или +5°C не вызывает какого-либо выявляемого нарушения лиофилизированного ALX-0081 (данные не показано).
Неожиданно, при +40°С было получено улучшение стабильности композиций на основе цитрата/сахарозы, по сравнению с композицией на основе D-PBS/глицина, в последней показана существенно более высокая восприимчивость к химическим модификациям.
Для жидких композиций хранение до 1,5 месяцев при -70°C, +5°C и +25°C не оказывало существенного влияния на ALX-0081 (данные не показаны). Нарушение наблюдалось спустя 1,5 месяца хранения при +40°С, это примерно согласуется с более ранними наблюдениями (см. раздел 7.7.2).
(с) кИЭФ
Результаты, полученные посредством кИЭФ анализа, согласуются с результатами ОФ-ВЭЖХ. Важно, что лиофилизация композиции на основе цитрата/сахарозы не позволяла полностью предотвратить пироглутаматную модификацию. Действительно, хранение лиофилизированного продукта при +40°С в течение 1,5 месяцев приводило к увеличению последующего пика. Вновь, более быстрое образование пироглутамата наблюдалось в композиции с цитратом/сахарозой при рН 6,0, по сравнению с рН 6,5.
(d) Э-ВЭЖХ/MALS/DLS.
Хранение до 1,5 месяцев при -70°C/-20°C, +5°C и +25°C не оказывало влияния на Э-ВЭЖХ профили лиофилизированных или жидких композиций ALX-0081 (данные не показаны). Однако при +40°С можно было наблюдать расширение пика и образование плечевых пиков во всех жидких композициях. MALS анализ показал, что эти плечевые пики соответствуют мономерному ALX-0081 (данные не показаны). Эти данные указывают на конформационное изменение субпопуляции ALX-0081 в результате хранения в стрессовых условиях. Неожиданно, на Э-ВЭЖХ профиль лиофилизированных композиций на основе цитрата/сахарозы не влиял стрессовый анализ при +40°C, указывая, что эти лиофилизированные композиции также улучшают физическую стабильность ALX-0081. Однако этого не отмечалось в случае лиофилизированной композиции на основе D-PBS/глицина; воздействие стресса на эту композицию при +40°С приводило не только к плечевому пику, но также к некоторым высокомолекулярным видам, наблюдаемым в качестве широкого предварительного пика (таблица 8). DLS анализ не выявил каких-либо крупных олигомерных видов в каких-либо композициях (данные не показаны).
(е) Заключение
Обобщение наиболее важных наблюдений, касающихся стабильности при хранении тестированных лиофилизированных композиций ALX-0081, показано в таблице 8. В целом, только ограниченные различия стабильности наблюдались между композициями на основе цитрата/сахарозы, хотя неожиданно ALX-0081 казался менее склонным к образованию пироглутамата при рН 6,5, по сравнению с рН 6,0. Таким образом, дальнейшие исследования по изменению композиции ALX-0081 были сфокусированы на композициях на основе цитрата/сахарозы при рН 6,5.
7.9. Дополнительная оптимизация композиции на основе цитрата/сахарозы
Данные, собранные к настоящему времени, показывают, что композиция на основе цитрата/сахарозы улучшает растворимость, и что лиофилизация этой композиции резко улучшает стабильность при хранении ALX-0081. Однако хранение лиофилизированного ALX-0081 при более высоких температурах, хотя и ограниченное, все еще приводит к образованию пироглутамата. Разумно предположить, что эта модификация может ограничивать срок годности лиофилизированного продукта (даже при хранении при +5°С). Необходимо выяснить, почему лиофилизация была неспособна предотвратить эту модификацию.
Было предположено, что вода, остающаяся в лиофилизированном продукта, играет ключевую роль.
Если эта гипотеза является правильной, то остающуюся воду можно свести к минимуму путем оптимизации физических параметров, таких как время сушки, температура, вакуум, и т.д., как перечислено выше, но в то же самые другие параметры агента, связывающего ФВ, будут оставаться постоянными. Другим подходом является модификация композиции, но вновь, в то же самое время другие параметры агента, связывающего ФВ, должны оставаться постоянными. Кроме того, можно применять регуляцию параметров физической лиофилизации в комбинации с модификацией композиции.
7.9.1. Оптимизированные параметры лиофилизации
Оптимизация физических параметров лиофилизации, включая (i) время сушки, (ii) температуры различных этапов, (iii) вакуум, и комбинацию (i) - (iii), не является удовлетворительной, т.е. отсутствует или является неадекватным влияние на остаточное содержание влаги или влияние на параметры агентов, связывающих ФВ.
7.9.2. Оптимизация композиции для лиофилизации
Влияние содержания влаги на химическую стабильность лиофилизированного продукта исследовали путем регуляции концентраций цитратного буфера и вспомогательного вещества сахарозы. Кроме того, исследовали время вторичной сушки во время программы лиофилизации.
7.10. Влияние содержания влаги на стабильность лиофилизированного продукта
Три различные изотоничные композиции ALX-0081 с различными концентрациями цитрата и сахарозы (все три при рН 6,5) подвергали двум различным программам лиофилизации: с одной стороны, стандартному 65 часовому режиму, а с другой стороны, укороченному 37 часовом режиму. Обзор тестированных композиций приведен в таблице 9. На фигуре 7 показаны флаконы, полученные после лиофилизации. Лиофилизация приводила к получению хорошего лиофилизата для всех композиций.
Лиофилизированные образцы ALX-0081 анализировали спустя 2 и 4 недели хранения при -20°С и +40°С. В данном эксперименте было решено провести исчерпывающий анализ для дальнейшего обоснования пригодности композиций.
Во-первых, при хранении при +40°С в течение 4 недель лиофилизат из лиофилизированных образцов оставался интактным, и восстановление давало прозрачные растворы. Как кажется, цикл лиофилизации не оказывал существенного влияния на содержание (измеряемое спектрофотометрически при 277 нм) или осмоляльность. В соответствии с более ранними экспериментами, 4 недели хранения при +40°С не оказывали влияния на физическую стабильность ALX-0081, на основе результатов Э-ВЭЖХ, MALS и DLS анализов (данные не показаны). Кроме того, было установлено, что на активность ALX-0081 по результатам анализа на основе Biacore не влиял процесс лиофилизации и последующее хранение (данные не показаны). Однако ОФ-ВЭЖХ анализ продемонстрировал, что хранение вновь приводило к образованию пироглутаматного варианта, хотя и в минимальном количестве. Это было слегка более выраженным для композиции, содержащим наивысшую концентрацию цитрата, и наименьшую концентрацию сахарозы (таблица 10). Кроме того, для каждой лиофилизированной композиции определяли общее содержание влаги методом титрования по Карлу Фишеру. Обобщение этих данных вместе с количеством пироглутамата, выявленного в соответствующих подвергнутых стрессу образцах, показано в таблице 10. Из данных, полученных для каждой программы лиофилизации по отдельности, видно, что более высокое содержание влаги приводит к более высокой восприимчивости к образованию пироглутамата. Это позволяет предположить, что остаточная вода, присутствующая в лиофилизированном продукте, стимулирует химические модификации. В заключение, результаты показывают, что снижение содержания влаги в лиофилизированных агентах, связывающих ФВ, например, ALX-0081, благоприятно для их химической стабильности.
7.11. Влияние снижения буферной силы и повышения содержания сахарозы
Данные, полученные в предыдущем разделе, показывают, что снижение концентрации цитрата при повышении концентрации сахарозы (с сохранением, таким образом, изотоничного раствора) благоприятно для стабильности лиофилизированного продукта. В то же самое время было получено доказательство того, что ALX-0081 требует достаточно высокой концентрации цитрата для получения усовершенствованной стабильности. Таким образом, было решено оценить влияние концентраций цитрата и сахарозы на внешний вид раствора по время хранения при +5°С и +25°С, и повторно оценить стабильность при замораживании-оттаивании в присутствии сниженных концентраций цитрата.
7.11.1. Оценка влияния концентрации цитрата/сахарозы
В первом эксперименте 12 различных композиций ALX-0081 хранили при +5°C и +25°C в течение 4 суток. В образцах на регулярной основе проверяли мутность или наличие осадка. Изображения образцов, полученные спустя 4 суток хранения, показаны на фигурах 8 и 9. Обзор различных композиций и соответствующих результатов представлен в таблице 11. Спустя 4 суток хранения при +25°C все образцы оставались прозрачными и бесцветными (фиг. 8, панель А). Видно, что степень мутности обратно пропорциональна концентрации цитрата, при этом композиция с 50 мМ цитрата остается прозрачной. Кроме того, выход для образца, содержащего 15 мМ цитрата, составил 68% (на основе А277 спустя 20 часов хранения), в то время как в других случаях выход варьировал от 90 до 100% (данные не показаны). Добавление сахарозы к композиции с 15 мМ цитратом предотвращало мутность образца, хотя при наименьшей концентрации сахарозы (т.е. 5%) выявлялась некоторая минимальная мутность при +5°С (фиг. 9, панель В).
Наблюдения подтвердили важность достаточно высокой концентрации цитрата для сохранения растворимости ALX-0081, особенно при низкой температуре. Тем не менее, повышение концентрации цитрата приводило к повышению содержания влаги. Неожиданно, снижение концентрации цитрата можно было компенсировать путем добавления сахарозы. Не наблюдалось влияния Твин-80 на растворимость.
7.11.2. Оценка устойчивости к ЗО
Следующий эксперимент был сосредоточен на устойчивости к ЗО некоторых композиций на основе цитрата/сахарозы. Девять различных композиций ALX-0081 подвергали 5 последовательным циклам ЗО при -20°С. Обзор тестируемых композиций и соответствующих результатов показан в таблице 12. Все образцы оставались прозрачными, и циклы ЗО не влияли на физическую стабильность агентов, связывающих ФВ, например, ALX-0081, по результатам анализа содержания и данных Э-ВЭЖХ.
7.11.3. Оптимизация концентрации сахарозы и цитрата с точки зрения изотоничности
На основании вышеупомянутых результатов хранения и ЗО, оптимальной концентрацией цитратного буфера было выбрано 20 мМ. Окончательный эксперимент проводили с тремя композициями, отличающимися по концентрации сахарозы. Целью этого эксперимента было установление оптимальной концентрации сахарозы для достижения изотоничной композиции и подтверждения устойчивости к ЗО ALX-0081 при 20 мг/мл. В дополнение к 5 последующим циклам, каждую композицию подвергали 1 циклу ЗО с последующим 24 часовым хранением при +25°С и дополнительному циклу ЗО для имитации этапов обработки во время производства.
Обобщение результатов приведено в таблице 13. Все тестированные композиции были прозрачными, а различные виды обработки не оказывали влияния на содержание/выход или осмоляльность. На основе значений осмоляльности кажется, что концентрация сахарозы 7% является оптимальной для получения изотоничного раствора.
7.12. Изучение стабильности лиофилизированных композиций ALX-0081, хранившихся при различных температурах в течение 12 месяцев
Готовили композицию ALX-0081 при 12,5 мг/мл в 20 мМ цитратном буфере, рН 6,5, с 7% сахарозой (м/о) и 0,01% Твин-80 (о/о); лиофилизировали её в соответствии с условиями, приведенными в таблице 14. Образцы последовательно хранили при 20°C (±5°C), +5°C (±3°C), +25°C (±2°C/60±5% ОВ) и +40°C (±2°C/75±5% ОВ).
Стабильность лиофилизированных композиций оценивали в различные моменты времени, т.е. исходно, спустя 1 месяц, 3 месяца, 6 месяцев, 9 месяцев и 12 месяцев, и определяли их чистоту, внешний вид, физико-химические свойства и активность.
Подробные данные по характеристике образца приведены в таблицах 15-23.
Чистоту образцов оценивали посредством ОФ-ВЭЖХ, при которой определяли процентную площадь главного пика, а также процентные площади предварительных и последующих пиков. Концентрацию белка определяли посредством поглощения в ультрафиолетовой области.
Далее, лиофилизированные образцы оценивали визуально, восстанавливали, и восстановленную композицию оценивали визуально. Измеряли рН образцов после восстановления, и содержание влаги в лиофилизированном порошке определяли посредством кулонометрического титрования (по Карлу Фишеру). Содержание механических примесей определяли для подсчета частиц ≥10 мкм и ≥25 мкм. В образцах дополнительно определяли биологическую функцию с применением анализа на основе Вiacore. Активность выражали в процентах относительно активности эталонного материала.
Полученные данные по стабильности показали, что на характеристики лиофилизированного ALX-0081 продукта по существу не влияло хранение в течение 12 месяцев при -20°С или +5°С. Было установлено, что данные, собранные во время исследования стабильности при этих температурах, были сопоставимыми с данными, полученными в исходный момент времени.
Некоторые минимальные изменения наблюдались для образцов, хранившихся при +25°С или +40°С, которые были связаны с ускоренными или стрессовыми условиями хранения. Главными наблюдениями было:
- при +25°С и при +40°С наблюдалось повышение последующего пика 2 на ОФ-ВЭЖХ во время 12 месячного хранения, что соответствовало образованию пироглутаматного варианта от 0,7% до 1,1% или 2,4%, соответственно;
- при +40°С отмечалось повышение содержания влаги от 0,7% до 2,15 (м/м) спустя 12 месяцев хранения. Это, возможно, было связано с поглощением влаги из окружающей среды, в которой производилось хранение (т.е. 75% ОВ) пробкой, с последующей постепенной диффузией в продукт.
Результаты, полученные в стрессовых условиях, позволяют предположить корреляцию между содержанием влаги и химической стабильностью продукта; это соответствует данным, ранее приведенным в разделе 7,10.
Таким образом, эти данные указывают важность контроля содержания влаги в лекарственном продукте во время хранения.
Учитывая, что хранение при +40°С можно рассматривать как прогностическое для долговременной стабильности при +25°С, данные по стабильности в течение 12 месяцев, включенные в настоящей заявке, обеспечивают хорошие показатели для стабильности при долговременном хранении при комнатной температуре (таком, как в течение 18, 24, 30 или 36 месяцев) и даже пролонгированную стабильность при хранении в более мягких условиях (например, при +5°С или в замороженном состоянии).
7.13. Сравнительное исследование in vitro биологической активности жидкой и лиофилизированной композиции лекарственного продукта с анти-ФВ нанотелом каплацизумабом (ALX-0081)
7.13.1. Задача
Проводили ряд анализов для оценки сопоставимости in vitro современного ЛП ALX-0081 (жидкой композиции, содержащей 5 мг/мл активного фармацевтического ингредиента (АФИ) в буфере на основе фосфата (D-PBS), содержащем 200 мМ глицина и 0,02% Твин-80 (о/о), рН 7,1), и лиофилизированной композиции ЛП ALX-0081, как представлено выше (с содержанием 12,5 мг/мл в 20 мМ цитратном буфере, рН 6,5, с 7% сахарозой (м/о) и 0,01% Твин-80 (о/о)) в отношении биологической активности и связывания с мишенью:
(а) Анализ активности на основе Biacore;
(b) Анализ активности на основе ИФА;
(с) Фармакодинамический биомаркерный анализ ристоцетин-индуцированной кофакторной активности (RICO);
(d) Определение аффинности на основе Gyrolab.
Эти анализы позволяли провести наглядное сравнение жидкого и лиофилизированного лекарственного продукта ALX-0081 (каплацизумаба). Использовали предварительно определенные критерии сопоставимости для оценки сопоставимости для каждого анализа, которые перечислены в таблице 24.
7.13.2. Методы
(а) Анализ Biacore основан на технологии поверхностного плазмонного резонанса (SPR), и измеряет авидное связывание ALX-0081 с человеческим А1-доменом ФВ, иммобилизованным на сенсорном чипе. Анализ был выбран для определения активности при выпуске и оценке стабильности.
(b) Анализ активности на основе ИФА является ортогональным методом тестирования активности ALX-0081, который был разработан для дополнительной характеристики целевой нейтрализующей способности каплацизумаба. Этот анализ измеряет ингибирование ристоцетин-индуцированного связывания фактора Виллебранда (ФВ) с тромбоцитами каплацизумабом.
(с) Анализ RICO применяют в качестве фармакодинамического маркера для фармакологической активности каплацизумаба. Анализ измеряет скорость и степень, с которой человеческие лиофилизированные тромбоциты образуют агрегаты после добавления антибиотика ристоцетина, который имитирует индуцированную сдвигом активацию ФВ.
(d) Анализ на основе Gyrolab определяет кинетические взаимодействия каплацизумаба с многомерной мишенью ФВ, и определяет константу аффинности каплацизумаба к человеческому многомерному ФВ.
Вкратце, определение аффинности на платформе Gyrolab проводили следующим образом: использовали Gyrolab Bioaffy 1000 CD. В качестве улавливающего инструмента, 3000 нМ собственный биотинилированный очищенный ФВ (очищенный HaemateP с применением эксклюзионной хроматографии) наносили на колонки, предварительно упакованный гранулами, покрытыми стрептавидином. Серии очищенного ФВ HaemateP, разбавленные 1/3, предварительно инкубировали в течение 24 при комнатной температуре (+20°С) в 96-луночном планшете на роторе при 600 об/мин с фиксированной концентрацией каплацизумаба (5 пМ) в AD1 буфере (буфер для разбавления в количественном определении для дозозависимой кривой). Спустя 24 часа планшет центрифугировали в течение 1 минуты при 200 g. 70 мкл преинкубационной смеси, содержащей свободные молекулы каплацизумаба, переносили в ПЦР-планшет с глубокими ячейками. Затем смесь пропускали через колонку так, чтобы свободный каплацизумаб мог связаться с биотинилированным ФВ, иммобилизованным на колонке. Система Gyrolab автоматически переносила смесь в трех повторностях в CD. Свободный каплацизумаб выявляли с 50 нМ AlexaFluor647-маркированным моноклональным антителом к каплацизумабу, разбавленному в Rexxip F буфере (коммерческом буфере для детекции). Три независимых эксперимента проводили для определения итоговой КД. Флуорохромы возбуждали красным лазером так, чтобы флуоресцентные сигналы получались и амплифицировались фотоумножителем (РМТ). Уровень амплификации в этом анализе составил 1% РМТ. Модель анализа неизвестного лиганда использовали для определения КД каплацизумаба. Анализ проводили с XL подогнанным программным обеспечением рабочей станции Gyrolab.
7.13.3. Результаты
(а) Относительную активность опытных образцов жидкого и лиофилизированного ALX-0081 определяли в анализе активности Biacore, относительно эталонного материала ALX-0081, использованного в анализе активности, также обозначенного как мастер-стандартный образец 2 (MRS-2). Относительная активность составила 102,8% и 102,9%, соответственно, указывая на полную сопоставимость по отношению к биологической активности, определенной посредством Biacore (см. таблицу 24).
(b) Относительную активность опытных образцов жидкого и лиофилизированного ALX-0081 определяли в анализе активности на основе ИФА, относительно MRS-2. Значения относительной активности составили 99,4% и 109,5%, соответственно, и это хорошо соответствовало критериям сопоставимости (см. таблицу 24). Таким образом, эти результаты показывают, что обе композиции сопоставимы с точки зрения активности, определенной посредством ИФА.
(с) RICO-активность опытных образцов жидкого и лиофилизированного ALX-0081 измеряли в параллельном сравнении, и определяли концентрацию, полностью блокирующую RICO активность (<20%). Концентрация, полностью блокирующая RICO активность (<20%), составила ≤0,4 мкг/мл для обеих композиций. Эти результаты хорошо соответствуют критериям сопоставимости (см. таблицу 24), и указывают на полную сопоставимость в отношении фармакодинамической активности обеих композиций.
(d) Константу аффинности (значение КД) опытных образцов жидкого и лиофилизированного ALX-0081 также определяли в параллельном сравнении посредством анализа на основе Gyrolab. Значения КД составили 6,84 пМ и 4,46 пМ, соответственно, с наложением доверительных интервалов. Таким образом, эти результаты показывают полную сопоставимость обеих композиций с точки зрения аффинности к мультимерному целевому ФВ (см. таблицу 24).
7.13.4. Заключение
Задачей настоящего исследования была оценка сопоставимости in vitro жидкого и лиофилизированного лекарственного продукта ALX-0081 (каплацизумаба) посредством четырех анализов, способных к оценке in vitro биологической активности и связывания с мишенью:
(а) Анализ активности на основе Biacore;
(b) Анализ активности на основе ИФА;
(с) Фармакодинамический биомаркерный анализ ристоцетин-индуцированной кофакторной активности (RICO);
(d) Определение аффинности на основе Gyrolab.
Все анализы in vitro удовлетворяли предварительно определенным критериям соответствия, и показали, что обе композиции ALX-0081 являются сопоставимыми с точки зрения биологической активности и связывания с мишенью (см. таблицу 24). Тестированные жидкие и лиофилизированные композиции ЛП ALX-0081 показали:
- схожую относительную активность, определенную посредством анализов Biacore и ИФА;
- сопоставимую фармакодинамическую активность in vitro (нейтрализацию мишени) при анализе RICO;
- сопоставимую целевую аффинность при анализе Gyrolab.
7.14. Ускоренный и долговременный анализ стабильности жидких и лиофилизированных композиций ALX-0081
В дополнение к примеру 7.12, проводили независимые эксперименты по изучению стабильности с применением другой серии ALX-0081 той же самой композиции (20 мМ цитратный буфер, рН 6,5; с 7% сахарозой (м/о) и 0,01% Твин-80 (о/о)).
Стабильность лиофилизированной и жидкой композиции тестировали при различных температурах:
- Жидкую композицию с 13,8 мг/мл ALX-0081 в 20 мМ цитратном буфере, рН 6,5; с 7% сахарозой (м/о) и 0,01% Твин-80 (о/о) хранили при температурах ≤-60°C и +5°C (±3°C), и анализировали стабильность в различные моменты времени, т.е. исходно, спустя 9 месяцев, 12 месяцев, 18 месяцев, и 24 месяца.
- Лиофилизированную композицию с 12,7 мг/мл ALX-0081 в 20 мМ цитратном буфере, рН 6,5; с 7% сахарозой (м/о) и 0,01% Твин-80 (о/о) хранили при температурах +5°C (±3°C), +25°C (±2°C/60±5% ОВ) и +40°C (±2°C/75±5% ОВ). Подобно жидкой композиции, определяли стабильность лиофилизированной композиции исходно и спустя 9, 12, 18 и 24 месяца.
В каждый момент времени химическую и физическую стабильность образцов контролировали с применением ряда аналитических методик, включая кИЭФ, ОФ-ВЭЖХ, Э-ВЭЖХ, визуальный анализ, определение рН и УФ поглощение.
Содержание влаги в лиофилизированном образце определяли путем кулонометрического титрования. Относительную активность жидких и лиофилизированных образцов измеряли в Biacore относительно собственного стандартного образца ALX-0081.
Подробные данные по характеристике жидких и лиофилизированных образцов приведены в таблицах 25-26 и 27-29, соответственно. Образцы, удовлетворяющие критериям, изложенным в колонке 2 каждой из вышеупомянутых таблиц, считались соответствующими спецификациям продукта.
Полученные данные показали, что композиция в соответствии с настоящим изобретением является высоко стабильной в течение по меньшей мере 24 месяцев. На физико-химические характеристики, а также биологическую активность лиофилизированного ALX-0081 не оказывало существенного влияния хранение в течение 24 месяцев при +5°C или +25°C. При стрессовом воздействии на ALX-0081 в течение 24 месяцев при +40°C наблюдалось увеличение последующего пика 2, что соответствовало образованию пироглутаматного варианта с 1,1% в исходном материале до 2,8%, 3,2%, 4,2% и 6,2% спустя 9, 12, 18 и 24 месяца, соответственно.
Хранение жидких композиций ALX-0081 в течение по меньшей мере 24 месяцев при температурах ≤ -60°C или при +5°C не оказывало существенного влияния на их физико-химическую стабильность: значения содержания были стабильными, образцы оставались прозрачными, и профили кИЭФ, ОФ-ВЭЖХ и Э-ВЭЖХ исходного материала были сопоставимыми с профилями образцов при анализе стабильности.
Изменения, отмеченные для лиофилизированных образцов, хранившихся при +40°C, могут быть связаны со стрессовыми условиями хранения, и обеспечивают хороший показатель стабильности при долговременном хранении в более мягких условиях.
Прогноз долговременной стабильности
Современные спецификации лекарственного продукта устанавливают, что допустимое содержание пироглутамата составляет ≤4%. На основе этих спецификаций и текущих данных по стабильности, применяли уравнение Аррениуса для прогноза срока годности лиофилизированного лекарственного продукта при +5°C и +25°C. Уравнение Аррениуса является точной формулой, описывающей зависимость скорости реакции от температуры, которую обычно применяют в фармацевтической промышленности. Как показано на фигурах 10 и 11, ожидалось, что лиофилизированный лекарственный продукт остается в пределах спецификаций в течение по меньшей мере 500 месяцев при хранении при +5°C и в течение по меньшей мере 60 месяцев при хранении при +25°C.
7.15. Общее заключение
Изобретение по изменению композиции агентов, связывающих ФВ, и особенно ALX-0081, описанного в настоящей заявке, обеспечивает новую композицию на основе цитрата/сахарозы с улучшенной растворимостью (до 80 мг/мл) и существенно улучшенной стабильностью при хранении в жидком виде (например, меньшим окислением, по сравнению с исходной композицией). Кроме того, в лиофилизированной форме по существу не отмечалось окисления или асп-изомеризации спустя 12 или даже 24 месяцев хранения при +40°C. Дальнейшая оптимизация концентрации цитрата и сахарозы привела к снижению содержания влаги в лиофилизированном продукте, таким образом, сводя к минимуму скорость образования пироглутамата. Было показано, что на каждую физико-химическую характеристику агента, связывающего ФВ, оказывали существенное влияние различные факторы композиции, физические и химические, такие как выбор буфера, рН, концентрация, вспомогательные вещества, и т.д. Обеспечены различные композиции, оптимизированные для устранения или предотвращения различных видов химического и/или физического стресса.
Был составлен один буфер для композиции, удовлетворяющий большинству критических критериев: 20 мМ цитрат, рН 6,5 + 7,0% сахарозы (м/о) + 0,01% Твин-80 (о/о). С применением этой композиции было показано, что ALX-0081 является стабильным в течение по меньшей мере 12 или даже 24 месяцев при -20°C, +5°C, +25°C и +40°C. Эти данные ясно указывают на значительно увеличенный срок годности при +5°C, по сравнению с современной жидкой композицией.
В дополнение, авторы настоящего изобретения всесторонне продемонстрировали, что современная композиция ALX-0081, которая была использована в клинических исследованиях к сегодняшнему дню, сопоставима с новой оптимизированной лиофилизированной ALX-0081 композицией, представленной в настоящей заявке, с точки зрения биологической активности и связывания с мишенью in vitro.
Таблица А-1. Примеры агентов, связывающихся с ФВ
(ALX-0081)
Таблица A-2
Таблица 1. Обзор 50 различных комбинаций буфера/вспомогательного вещества, прогнозируемых программой Design Expert для получения наивысших температур плавления для ALX-0081. Комбинации буфера/вспомогательного вещества упорядочены в соответствии со значением Тп. Различные типы буферов показаны различными тонами серого цвета
Таблица 2. Анализ растворимости ALX-0081 в различных буферах для композиции
(мг/мл)
(%)
Глицин
мM глицин
N.D. = не определяли
Таблица 3. Обзор жидких композиций ALX-0081 в испытаниях при хранении и ЗО, вместе с измеренными значениями рН и осмоляльности
(мг/мл)
(о/о)
мОсм/кг
Глицин
Таблица 4. Обзор исследования стабильности при хранении различных композиций ALX-0081. Указаны моменты времени, температуры и способы хранения
Таблица 5. Данные стабильности при хранении различных жидких композиций ALX-0081. Показаны относительные площади поверхности большинства соответствующих пиков ОФ-ВЭЖХ спустя 1 месяц хранения при +40°C. Пиро = пироглутамат, Главн. = главный пик (включая плечевой пик, когда он присутствует), окисл. = суммарные предварительные пики. Цветовой код указывает относительную чистоту образцов: наивысшая чистота указана белым цветом, промежуточная чистота серым цветом, и наименьшая чистота черным цветом. Выход составил около 100% для всех образцов
(мг/мл)
(о/о)
глицин
Таблица 6. Обзор лиофилизированных/жидких композиций ALX-0081, оцениваемых в испытании стабильности при хранении

Таблица 7. Выход ALX-0081 в различных композициях после лиофилизации и восстановления, на основе общей площади, по результатам ОФ-ВЭЖХ и Э-ВЭЖХ
(композиция 3)
(композиция 7)
(композиция 17)
Таблица 8. Обзор данных по стабильности при хранении различных лиофилизированных композиций ALX-0081 (1,5 месяцев хранения при -20°C, +5°C, +25°C и +40°C). Цветовой код представляет качественную оценку стабильности образца, начиная от белого (наивысшая стабильность) через серый до черного цвета (наименьшая стабильность)
N.T. = не тестировали (* по сравнению с жидким контрольным образцом, хранящимся при -70°C).
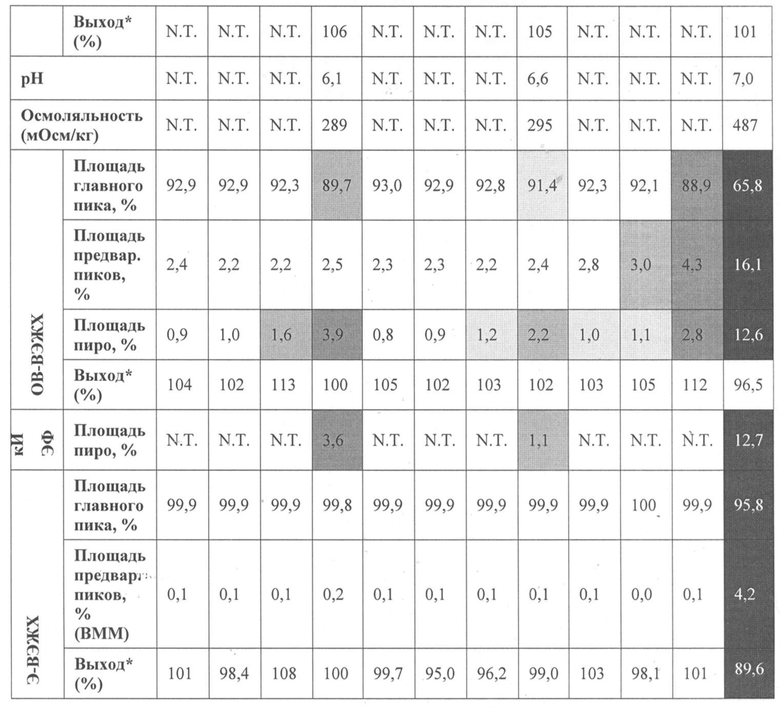
Таблица 9. Обзор композиций АLX-0081, оцениваемых в испытании стабильности при хранении
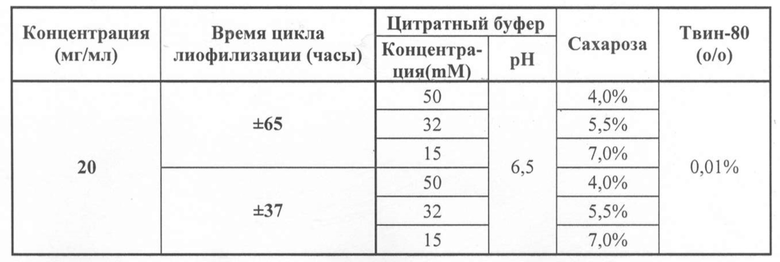
Таблица 10. Содержание влаги в лиофилизированных образцах ALX-0081, и относительное количество пироглутамата, выявленное посредством ОФ-ВЭЖХ после 4 недель хранения при +40°С
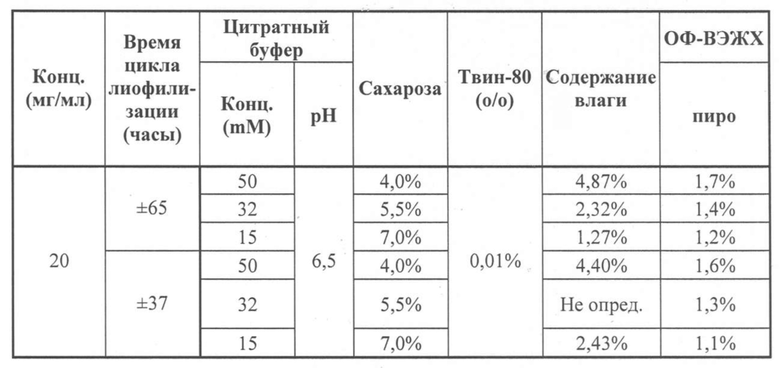
Таблица 11. Результаты визуального анализа композиции ALX-0081 при хранении при +5°С и +25°С
«+» = прозрачный; «+/-» = слегка мутный; «-» = мутный; «ч» = часы; «д» = дни.
(мг/мл)
Таблица 12. Результаты визуального анализа, определения содержания, и Э-ВЭЖХ анализа композиций ALX-0081 после последовательных 5 циклов ЗО при -20°С (*по сравнению с жидким контрольным образцом, хранившимся при ≤-70°С)
(мг/мл)
Таблица 13. Результаты визуального анализа, определения выхода и осмоляльности композиций ALX-0081 после 5 последовательных циклов ЗО при -20°С или после 1 цикла ЗО + 24 часа хранения +1 цикл ЗО (*по сравнению с жидким контрольным образцом, хранившимся при ≤-70°С)
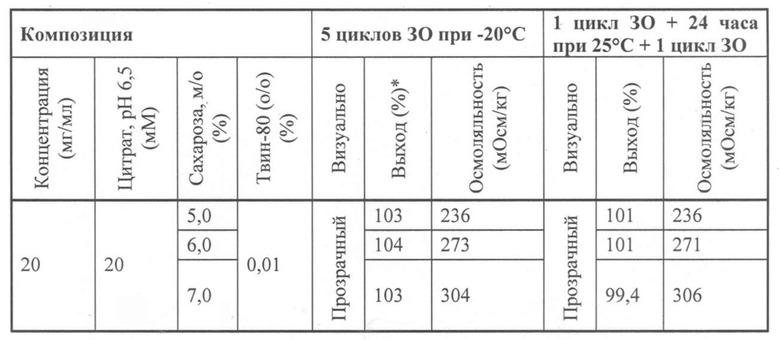
Таблица 14. Параметры лиофилизации
Таблица 15. ОФ-ВЭЖХ анализ главного пика (чистоты) композиции ALX-0081 (12,5 мг/мл АФИ, 0,01% Твин-80 (о/о) и 7% сахарозы (м/о) в 20 мМ цитратном буфере при рН 6,5)
(% площади главного пика)
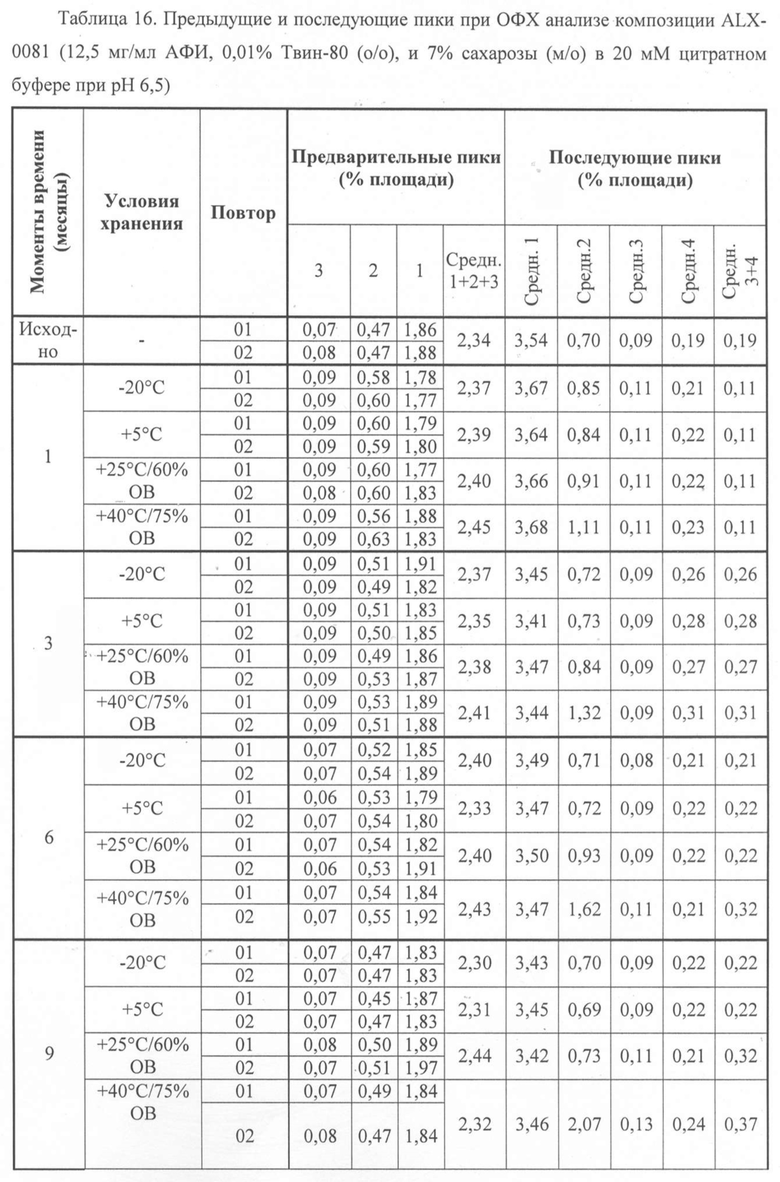

Таблица 17. Результаты определения концентрации белка посредством УФ для композиции ALX-0081 (12,5 мг/мл АФИ, 0,01% Твин-80 (о/о), и 7% сахарозы (м/о) в 20 мМ цитратном буфере при рН 6,5)
Таблица 18. Э-ВЭЖХ анализ композиции ALX-0081 (12,5 мг/мл АФИ, 0,01% Твин-80 (о/о), и 7% сахарозы (м/о) в 20 мМ цитратном буфере при рН 6,5)
(% площади)
Таблица 19. Результаты физических анализов лиофилизированного ALX-0081, хранившегося при -20°С (12,5 мг/мл АФИ, 0,01% Твин-80 (о/о), и 7% сахарозы (м/о) в 20 мМ цитратном буфере при рН 6,5)

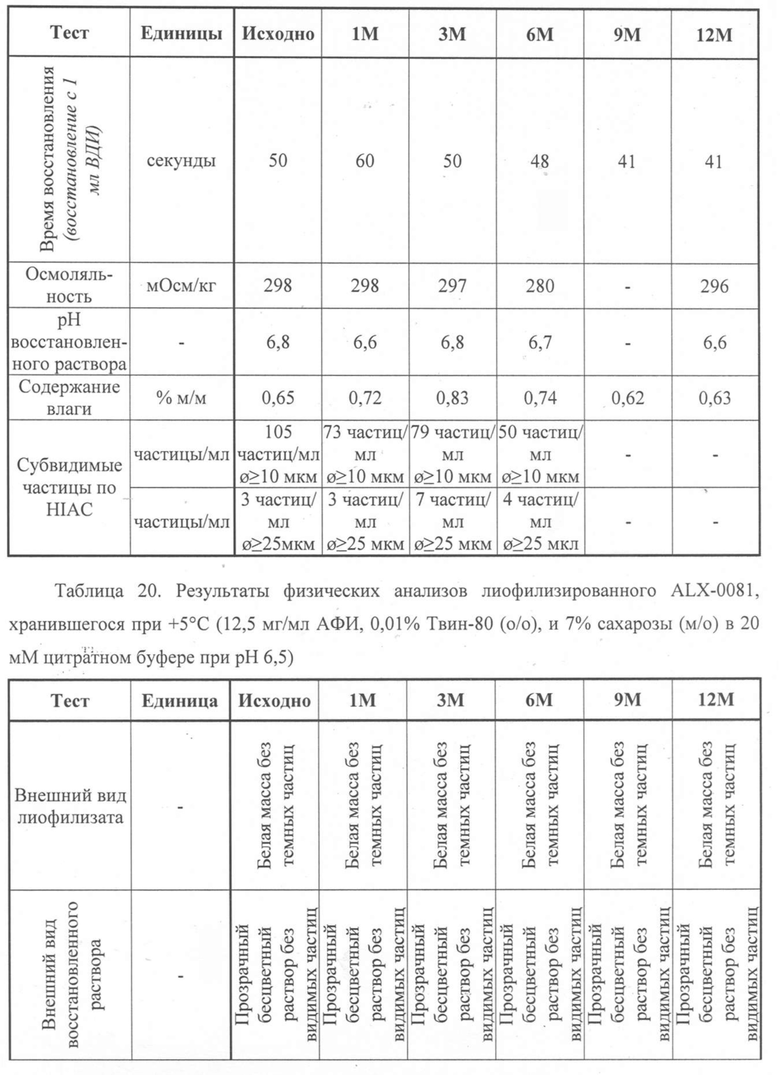

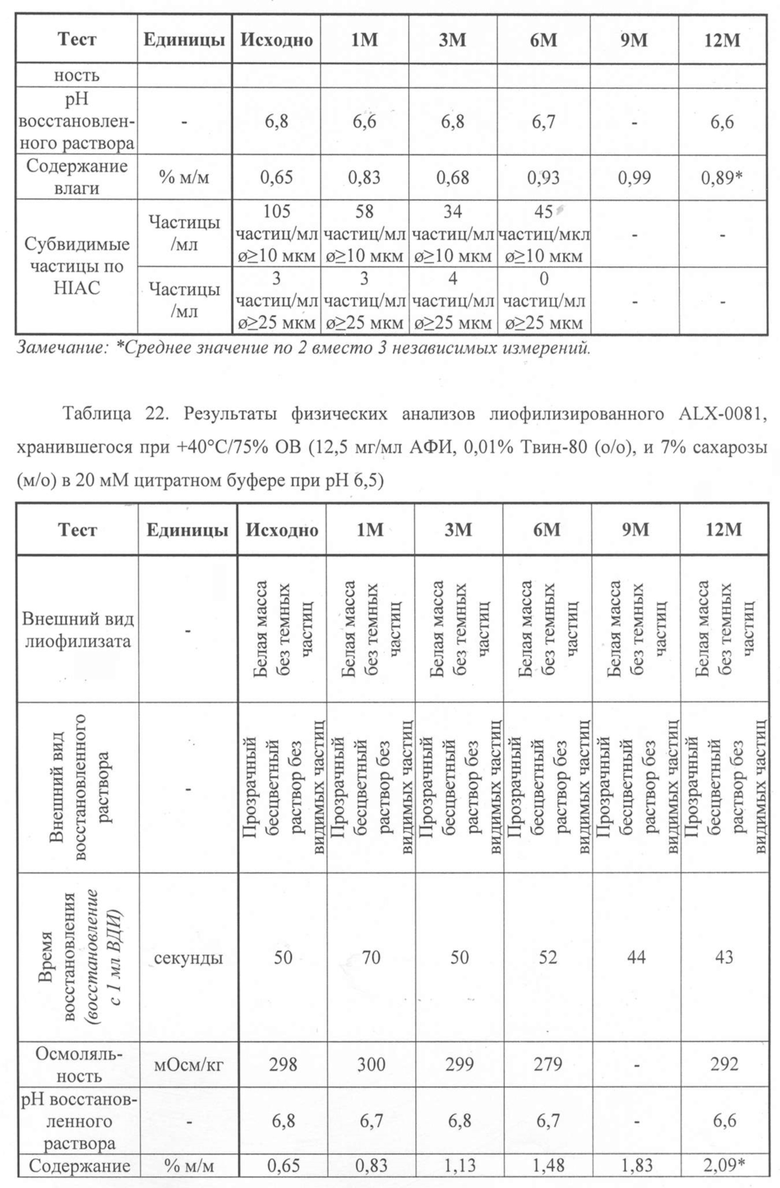
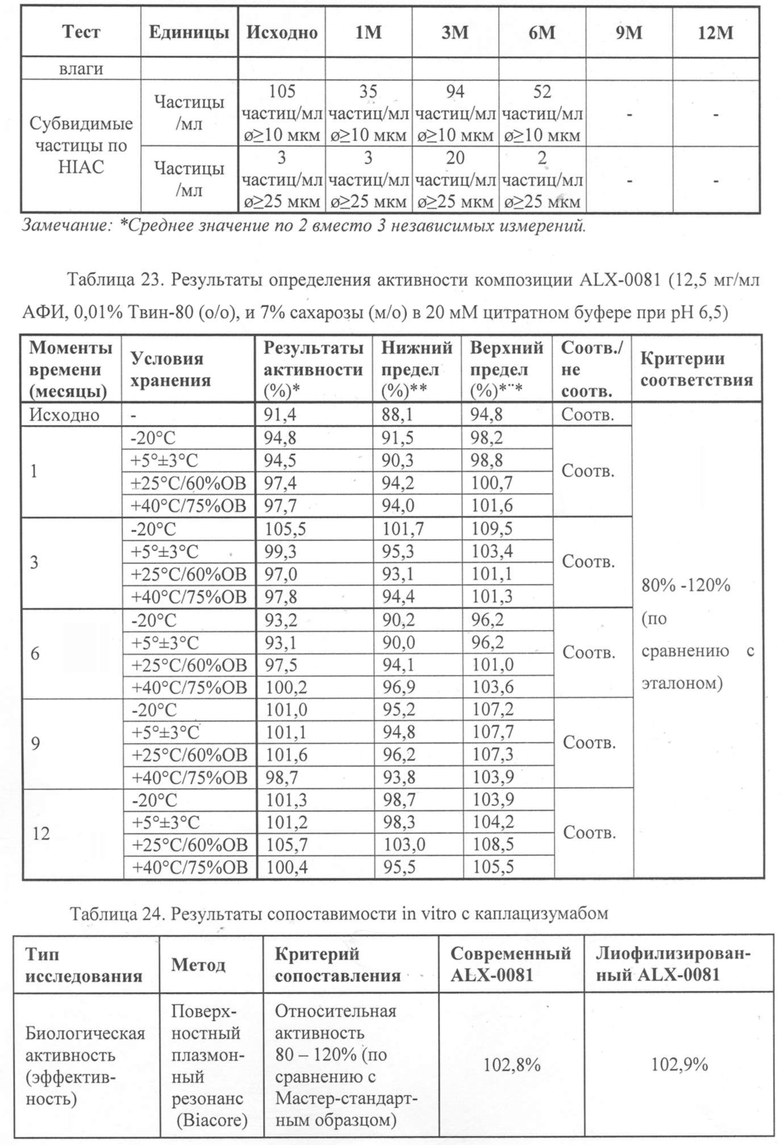
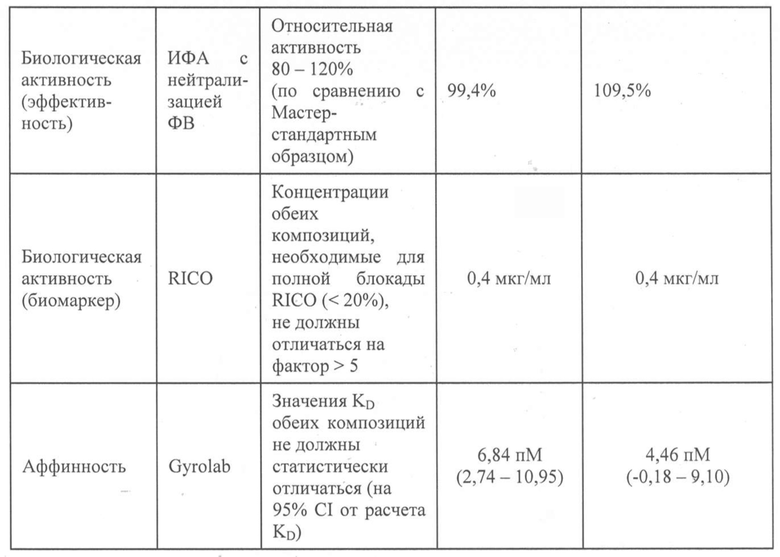
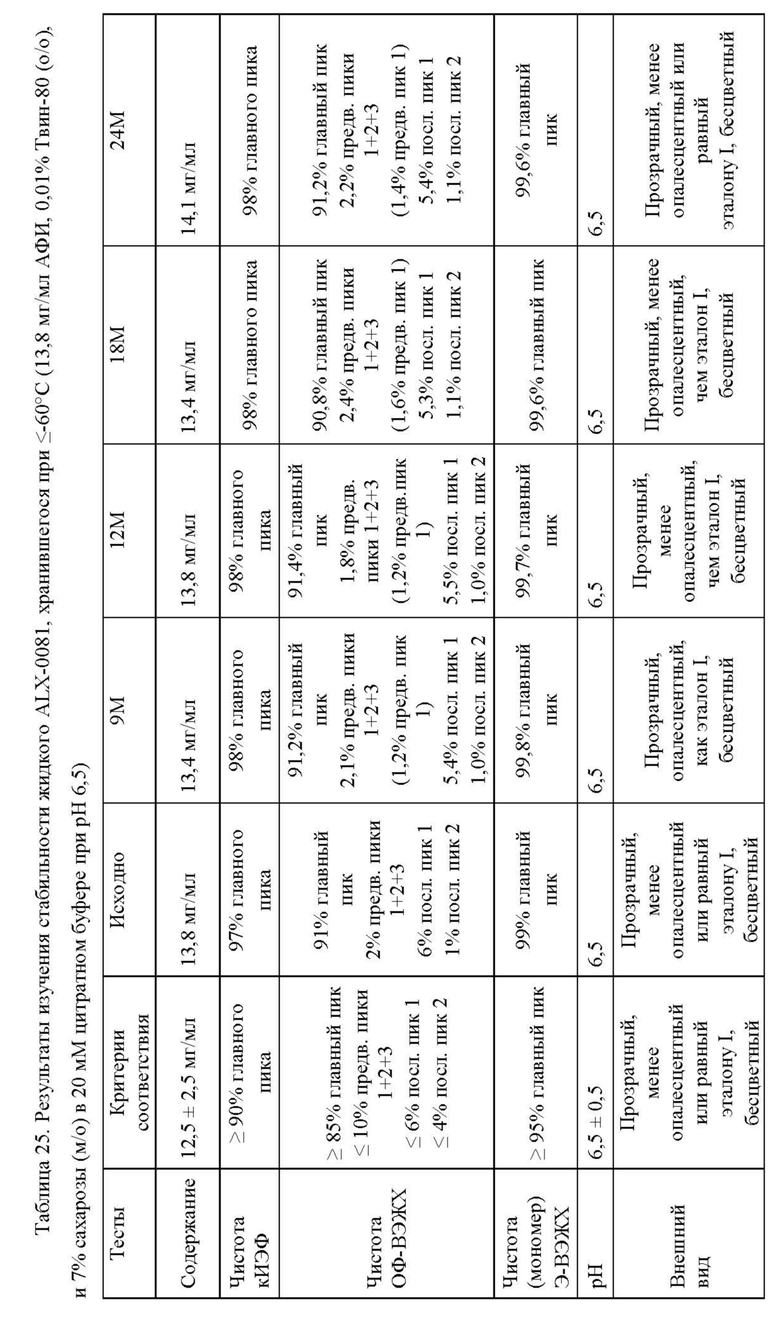
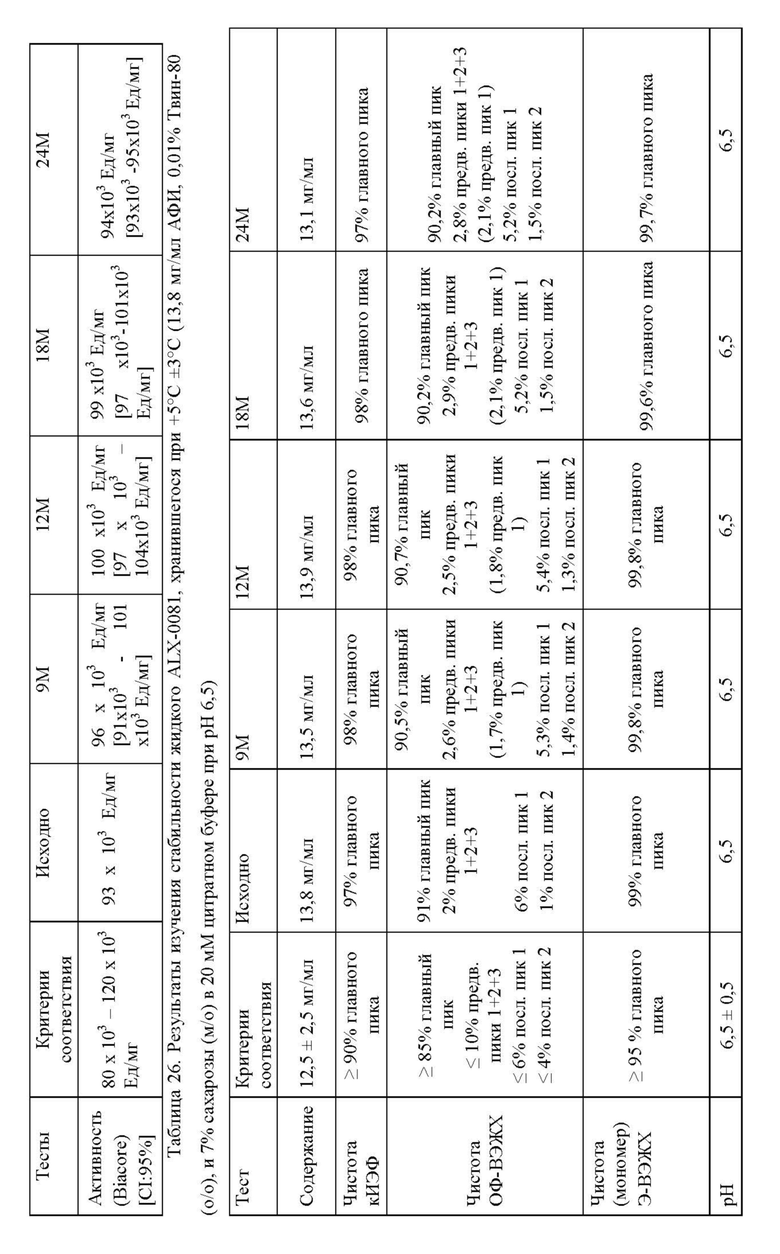
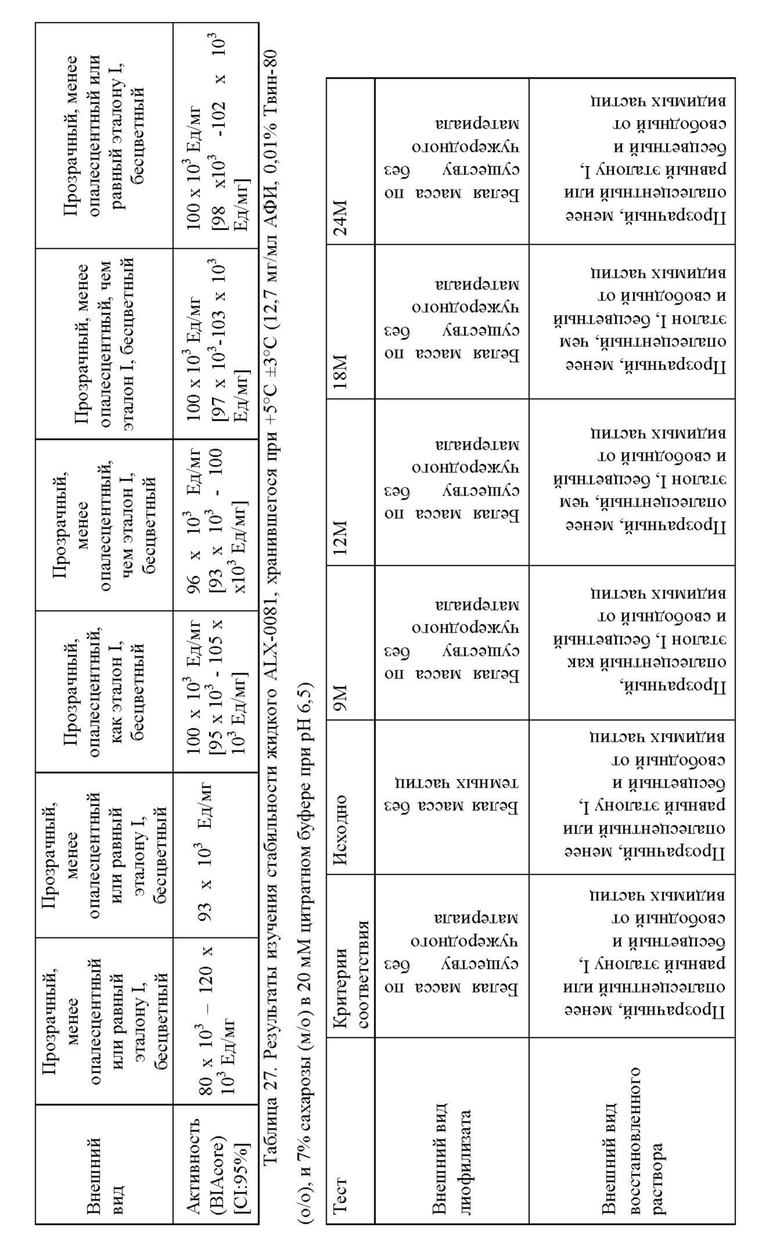
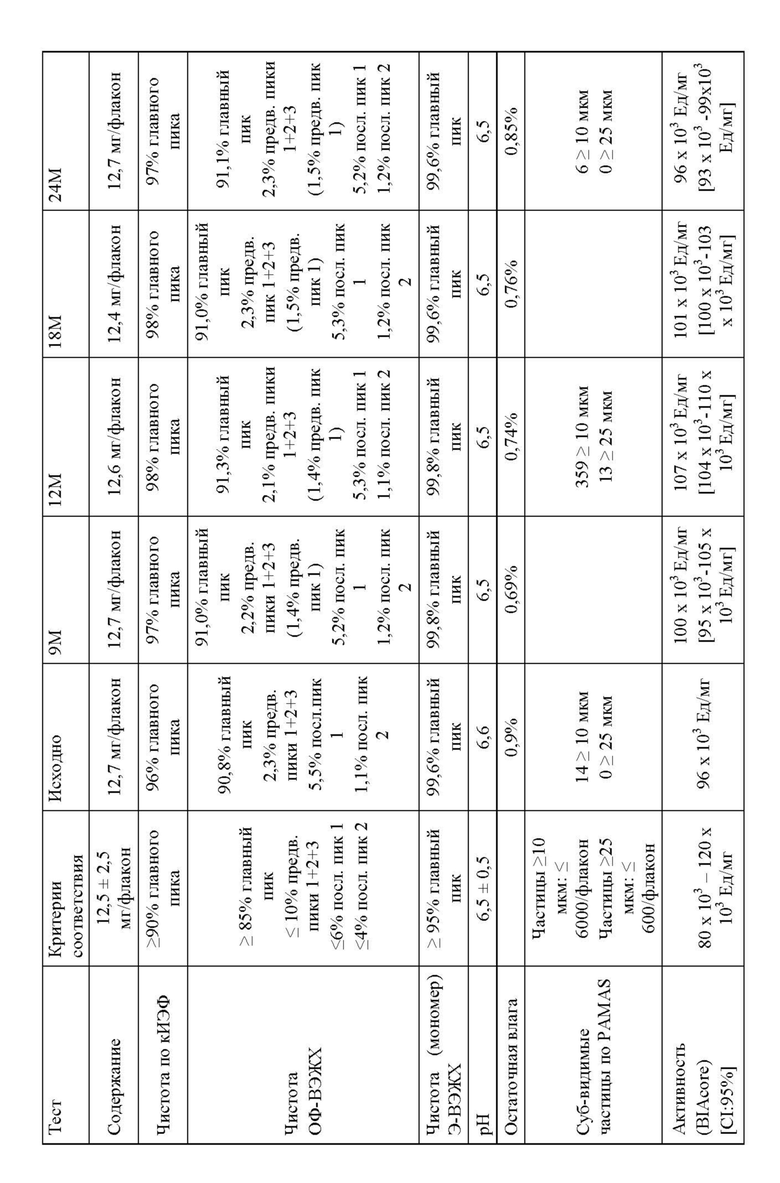
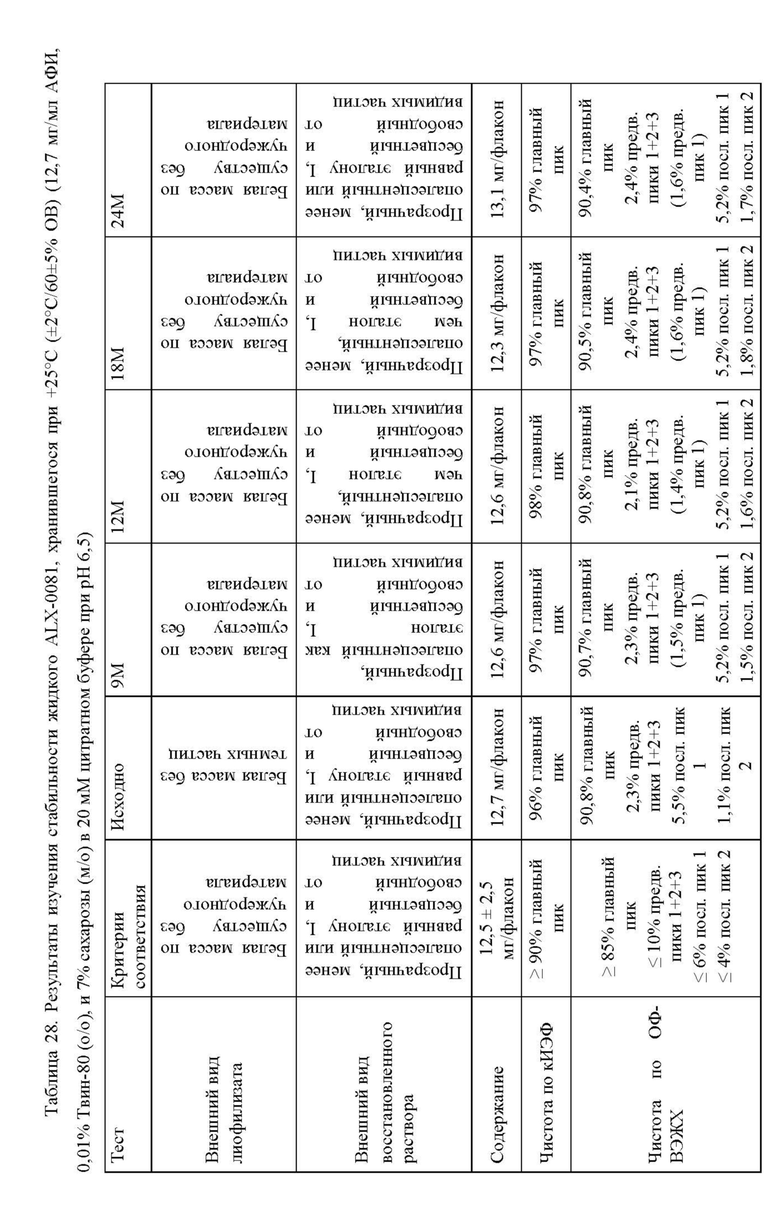
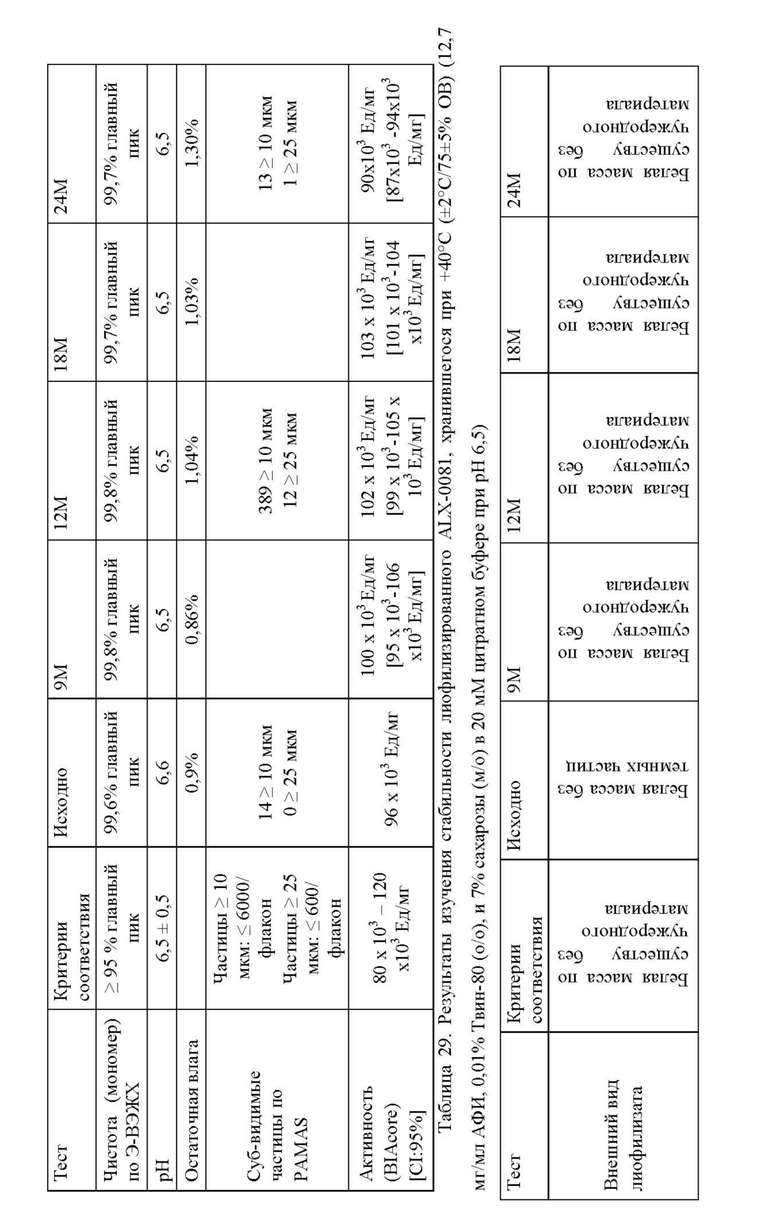
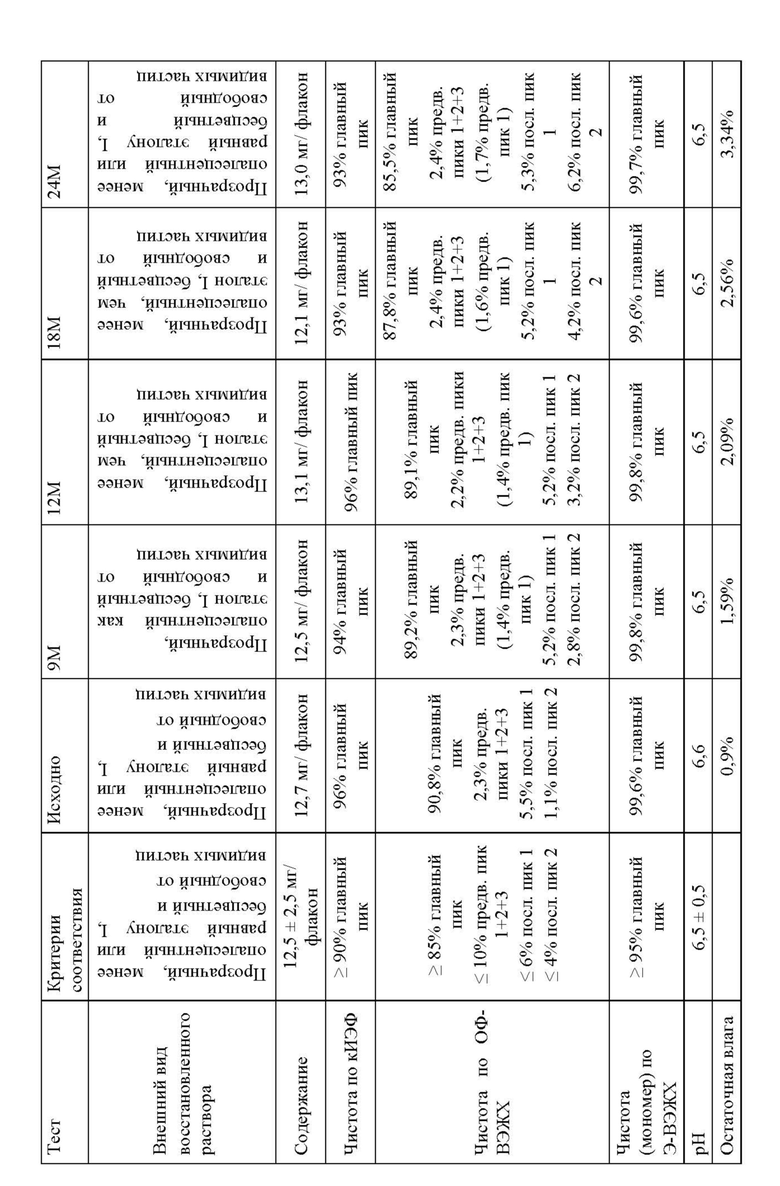
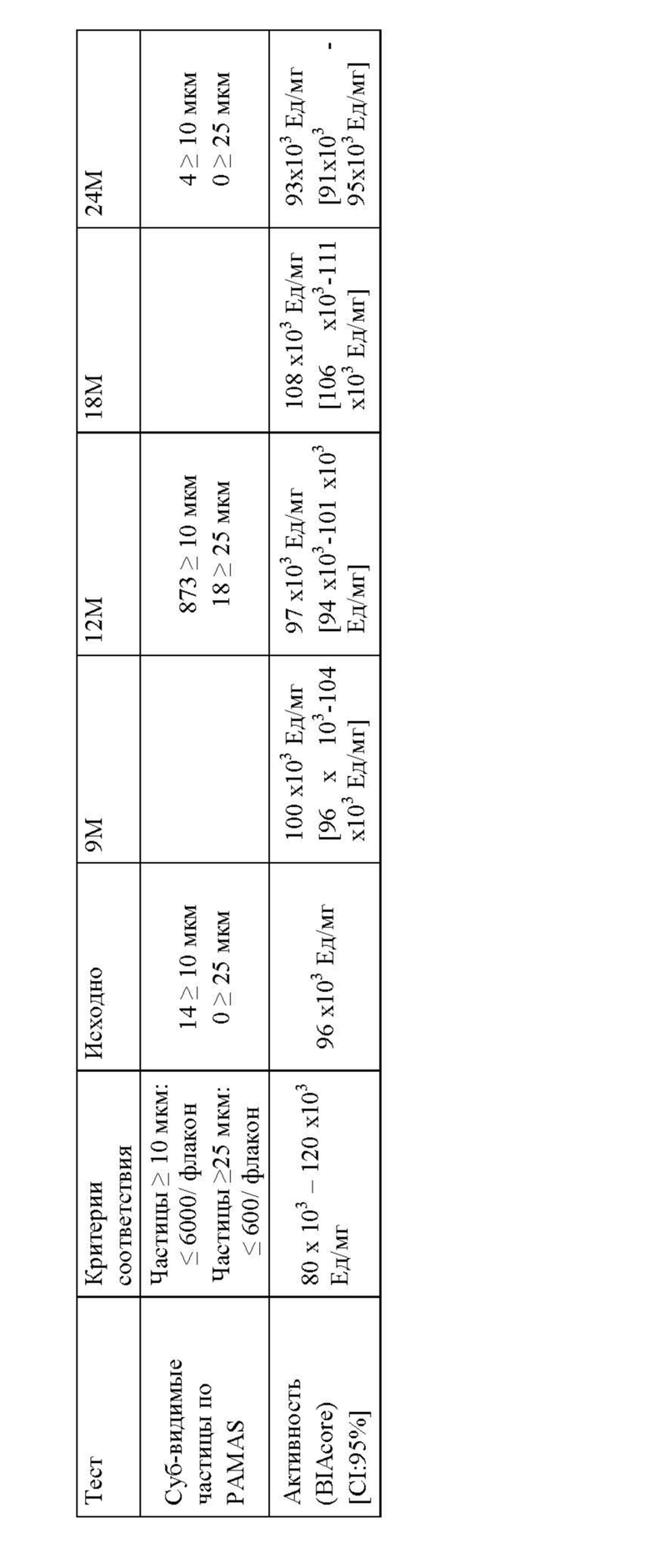
Эквиваленты
Вышеприведенное письменное описание считается достаточным для обеспечения осуществления настоящего изобретения специалистом в данной области техники. Настоящее изобретение не ограничивается объемом обеспеченных примеров, поскольку примеры предназначены только для иллюстрации одного аспекта изобретения, и другие функционально эквивалентные варианты осуществления находятся в пределах объема изобретения. Различные модификации изобретения, в дополнение к тем, которые показаны и описаны в настоящей заявке, станут понятными для специалиста в данной области техники из предыдущего описания, и относятся к объему формулы изобретения. Преимущества и объекты настоящего изобретения не обязательно охватываются каждым вариантом осуществления изобретения.
Содержание всех ссылок, патентов и опубликованных патентных заявок, цитированных на протяжении данной заявки, включено посредством ссылки во всей полноте, в частности, для применения или предмета обсуждения, упомянутых в настоящей заявке.
| название | год | авторы | номер документа |
|---|---|---|---|
| СТАБИЛЬНЫЕ КОМПОЗИЦИИ ИММУНОГЛОБУЛИНОВОГО ОДИНОЧНОГО ВАРИАБЕЛЬНОГО ДОМЕНА И ИХ ПРИМЕНЕНИЕ | 2014 |
|
RU2671977C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ТТП ИММУНОГЛОБУЛИНОВЫМИ ОДИНОЧНЫМИ ВАРИАБЕЛЬНЫМИ ДОМЕНАМИ И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2704444C2 |
| СТАБИЛЬНАЯ ИЗОТОНИЧЕСКАЯ ЛИОФИЛИЗИРОВАННАЯ ПРОТЕИНОВАЯ КОМПОЗИЦИЯ | 1996 |
|
RU2497500C2 |
| СТАБИЛЬНАЯ ИЗОТОНИЧЕСКАЯ ЛИОФИЛИЗИРОВАННАЯ ПРОТЕИНОВАЯ КОМПОЗИЦИЯ | 1996 |
|
RU2229288C2 |
| Препараты однодоменных антигенсвязывающих молекул | 2013 |
|
RU2683861C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ТТП ИММУНОГЛОБУЛИНОВЫМИ ОДИНОЧНЫМИ ВАРИАБЕЛЬНЫМИ ДОМЕНАМИ И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2807602C2 |
| СТАБИЛЬНАЯ КОМПОЗИЦИЯ РЕКОМБИНАНТНОГО МОНОКЛОНАЛЬНОГО АНТИТЕЛА ПРОТИВ PD-1 | 2021 |
|
RU2827610C1 |
| СТАБИЛЬНЫЙ ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ НА ОСНОВЕ АНТИТЕЛА К PD-1 И ЕГО ПРИМЕНЕНИЕ В МЕДИЦИНЕ | 2016 |
|
RU2731418C2 |
| КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ЭКТИНЭСАЙДИН И ДИСАХАРИД | 2005 |
|
RU2382647C2 |
| СТАБИЛИЗИРОВАННЫЕ СОСТАВЫ, СОДЕРЖАЩИЕ ФАКТОР IX И ТРЕГАЛОЗУ | 2008 |
|
RU2481823C2 |
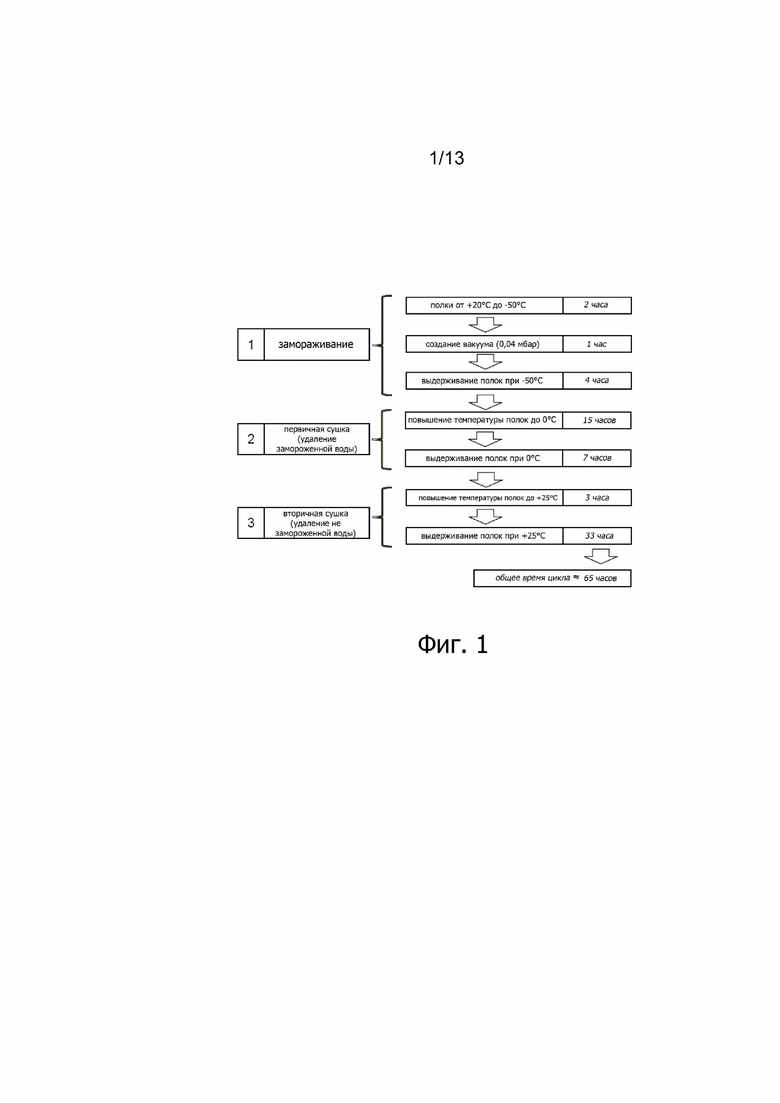
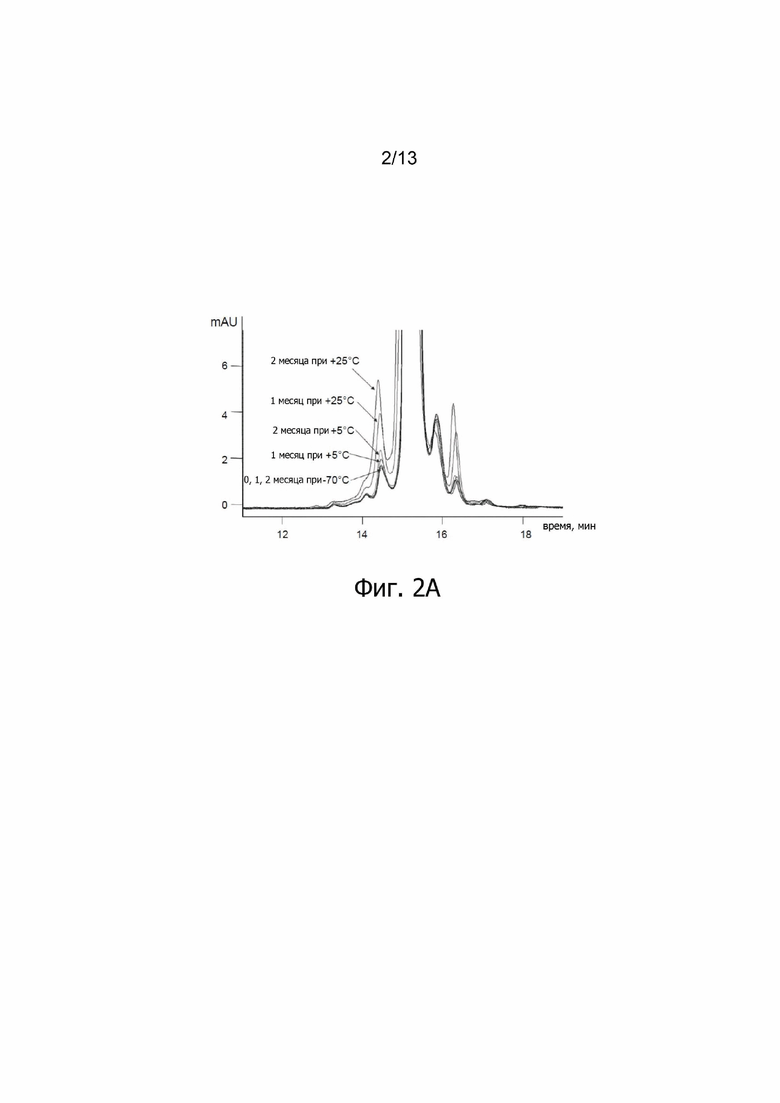
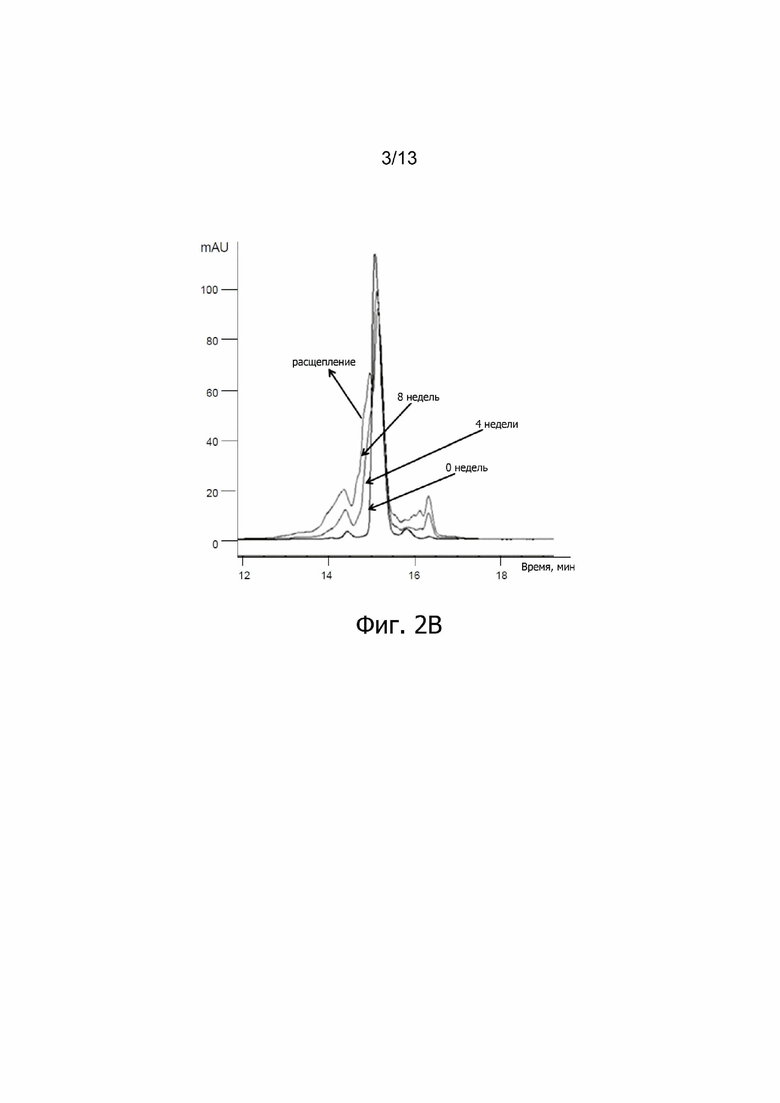
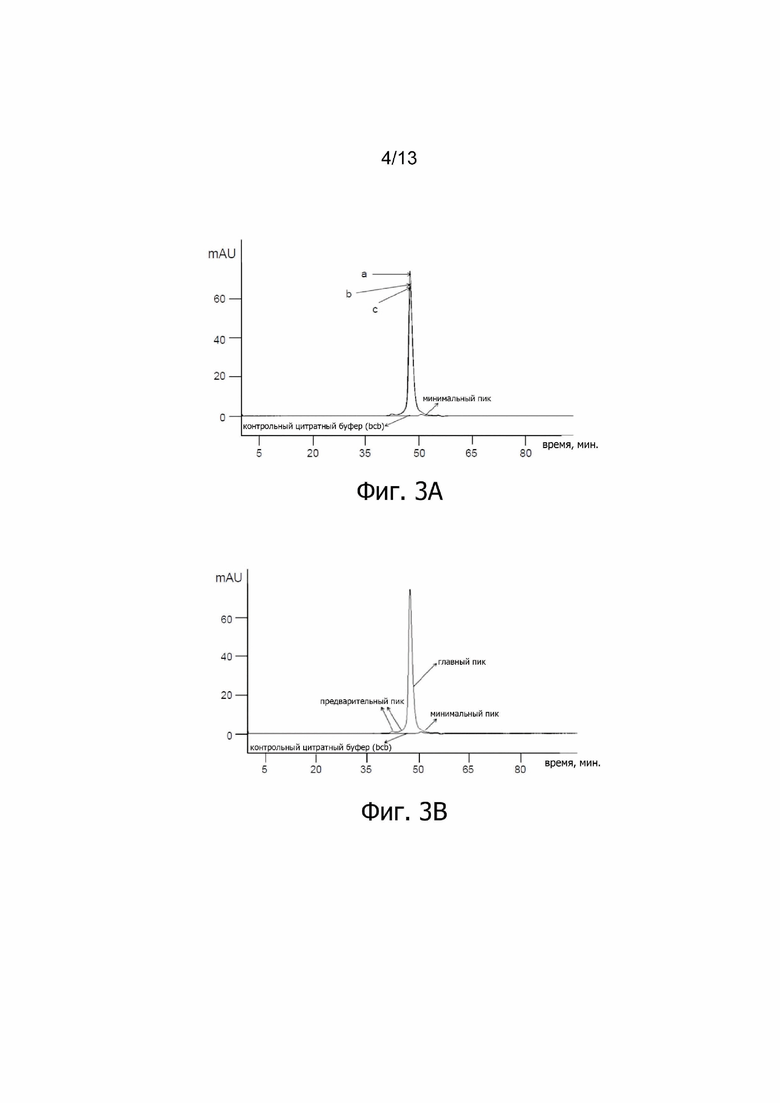
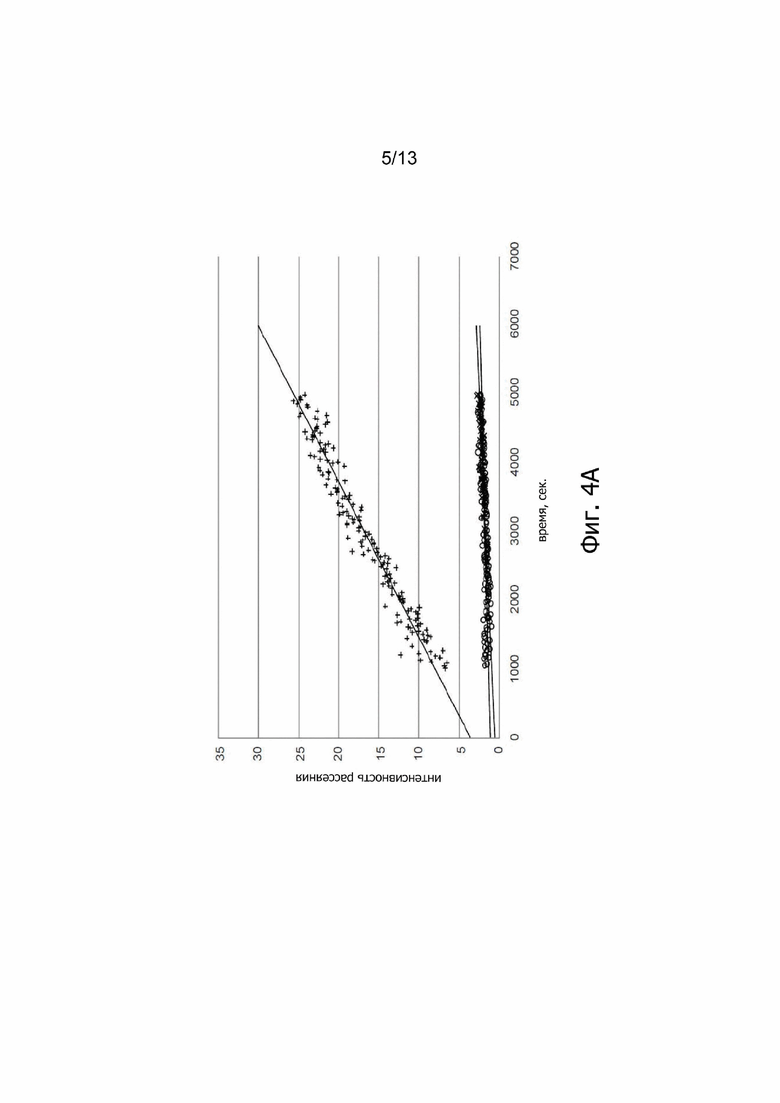
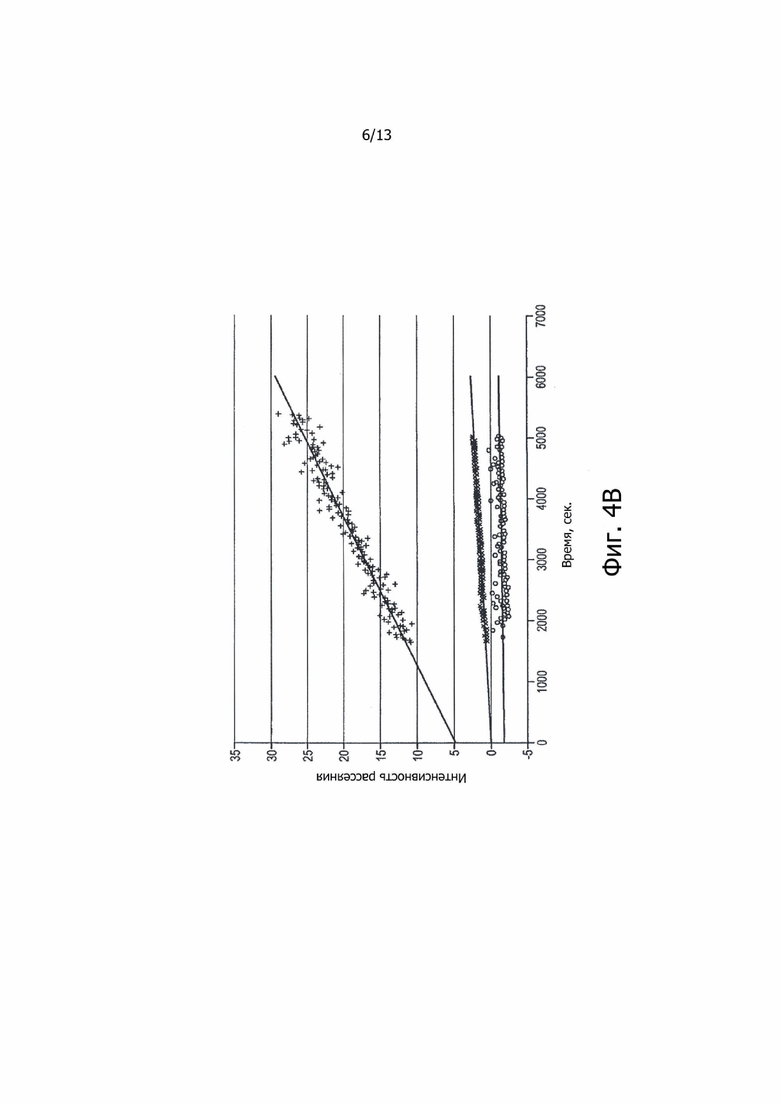
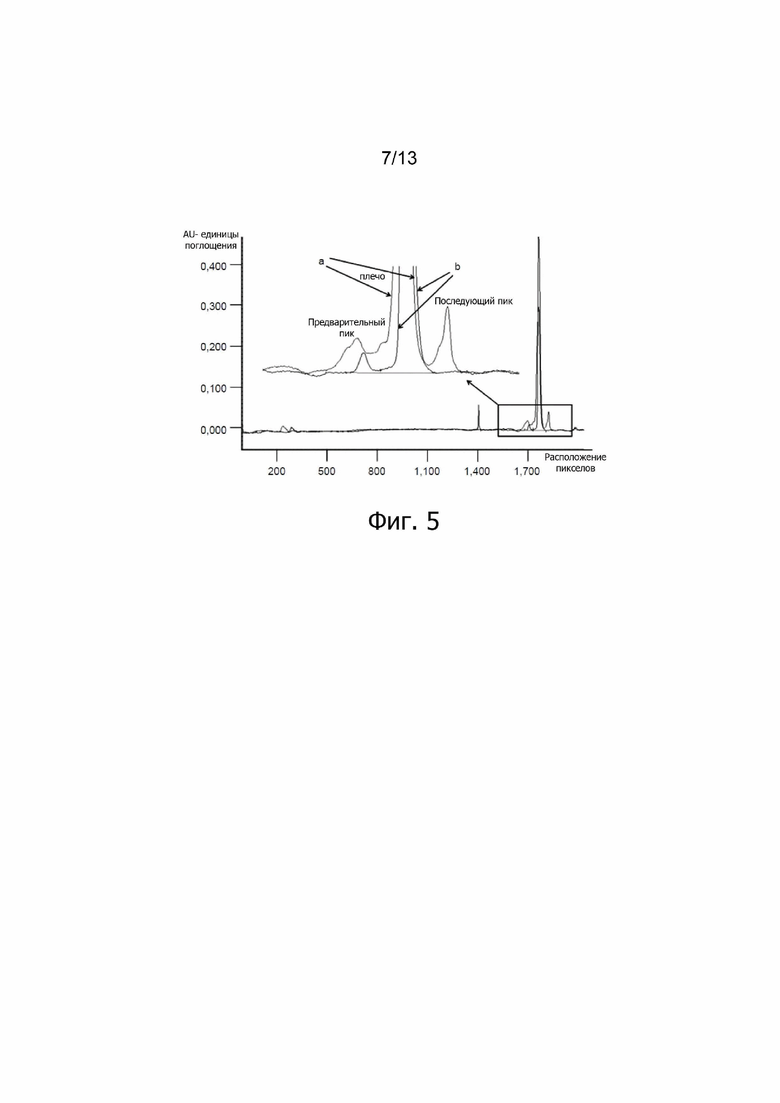




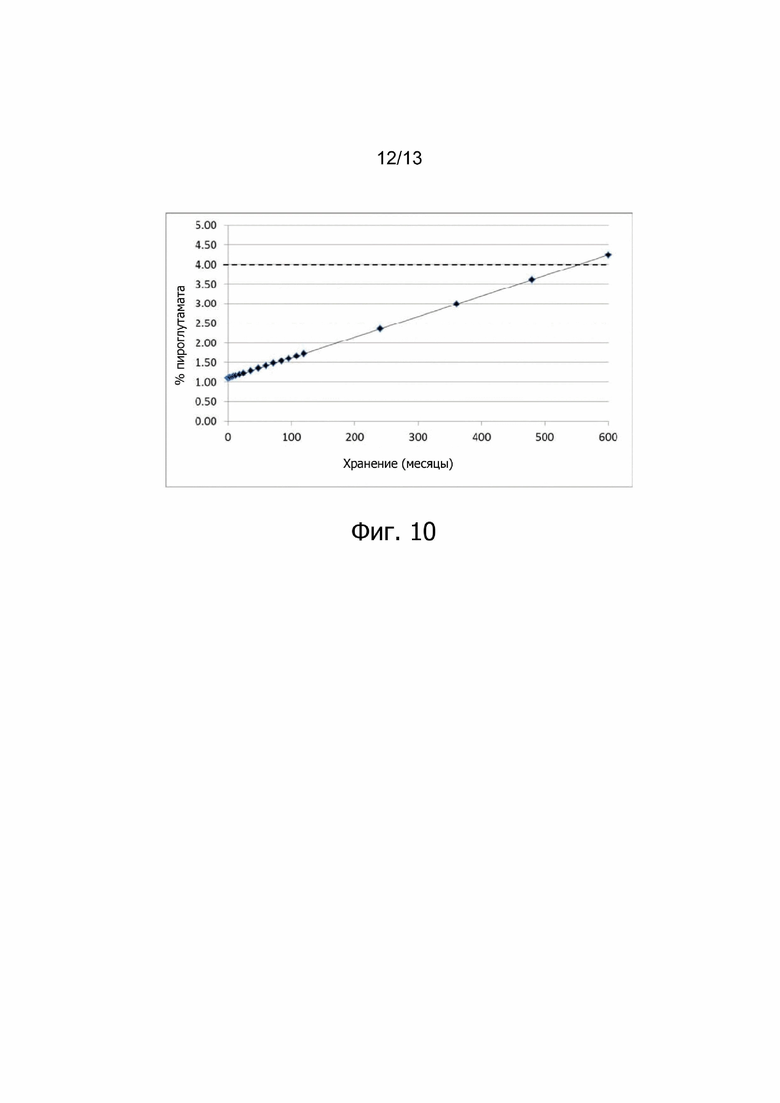
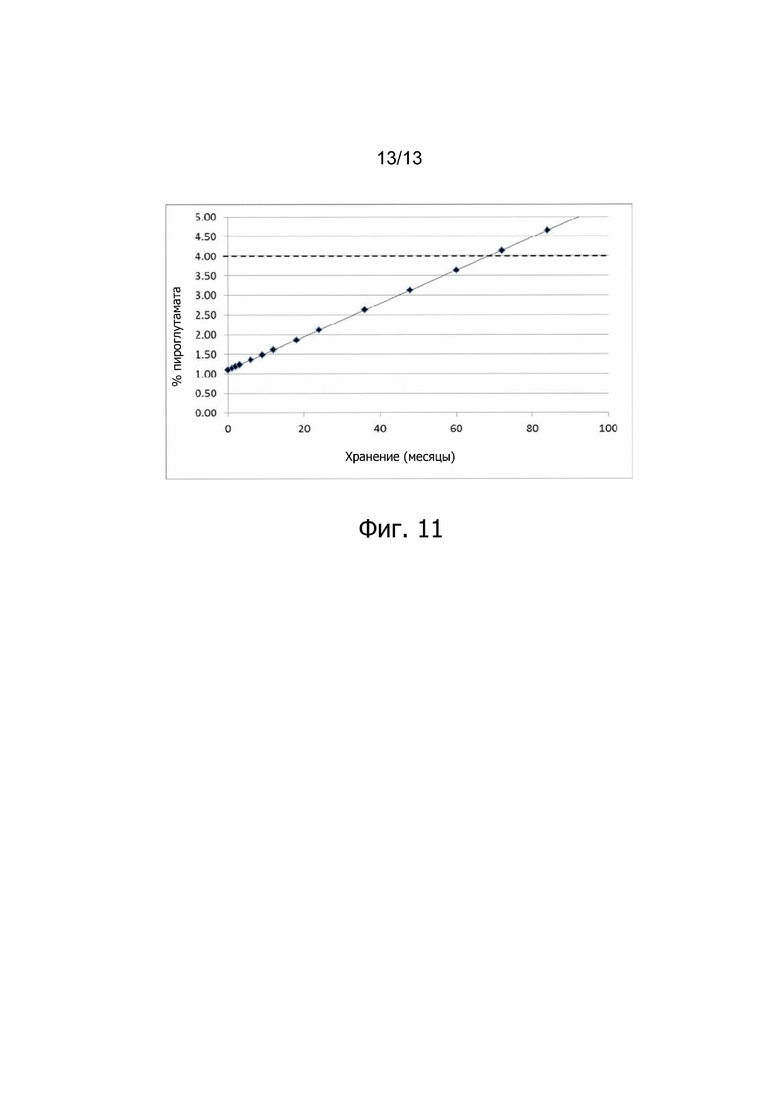
Группа изобретений относится к медицине и предназначена для лечения или профилактики фактор Виллебранда (ФВ)-связанных заболеваний. Композиция для лечения или профилактики ФВ-связанных заболеваний, содержит агент, связывающий фактор Виллебранда (ФВ), который содержит по меньшей мере одну из SEQ ID NO: 1-19, цитратный буфер, вспомогательное вещество и Твин-80. Способ приготовления данной композиции включает этапы: экспрессии агента, связывающего ФВ, в клеточной культуре; очистки агента, связывающего ФВ, при помощи хроматографической очистки и ультрафильтрации/диафильтрации; а также доведение до необходимой концентрации агента, связывающего ФВ в композиции. Также, данная группа изобретений относится к способу приготовления восстановленной композиции; и набору для лечения или профилактики ФВ-связанных заболеваний. Осуществление изобретения обеспечивает композиции, стабильные при хранении в течение продолжительных периодов времени и в широком диапазоне температур. Композиции из настоящего изобретения обеспечивают высокую стабильность полипептида, позволяя проводить множество циклов замораживания-оттаивания без химического или физического повреждения, и обеспечивают стабильность в отношении механического стресса, такого как стресс при встряхивании, сдвиге или перемешивании. 4 н. и 9 з.п. ф-лы, 32 табл., 11 ил.
1. Композиция для лечения или профилактики ФВ-зависимых заболеваний, содержащая агент, связывающий фактор Виллебранда (ФВ), цитратный буфер, вспомогательное вещество и Твин-80, где:
(а) агент, связывающий ФВ, имеет концентрацию примерно от 0,1 мг/мл до 80 мг/мл;
(b) вспомогательное вещество представляет собой сахарозу в концентрации примерно от 5% до 15% (м/о);
(с) Твин-80 имеет концентрацию примерно от 0,001% до 0,5% (о/о); и
(d) цитратный буфер имеет концентрацию примерно от 5 мМ до 200 мМ, так что рН композиции составляет примерно от 6,0 до 7,0; и
где указанный агент, связывающий ФВ, содержит по меньшей мере одну из SEQ ID NO: 1-19.
2. Композиция по п.1, где указанный агент, связывающий ФВ, содержит аминокислотную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 1, предпочтительно указанная аминокислотная последовательность идентична SEQ ID NO: 1.
3. Композиция по любому из пп.1, 2, где:
(а) агент, связывающий ФВ, имеет концентрацию 12,5 мг/мл;
(b) сахароза имеет концентрацию 7% (м/о);
(с) Твин-80 имеет концентрацию 0,01% (о/о);
(d) цитратный буфер имеет концентрацию 20 мМ; и
(е) композиция имеет рН 6,5.
4. Композиция по любому из пп.1-3, содержащая:
(i) менее 5% высокомолекулярных (ВММ) соединений, представляющих собой олигомеры, полимеры и агрегаты агента, связывающего ФВ, после хранения в течение по меньшей мере 12 месяцев при 5°С; и/или
(ii) менее 5% низкомолекулярных (НММ) соединений, представляющих собой фрагменты агента, связывающего ФВ, после хранения в течение по меньшей мере 12 месяцев при 5°С.
5. Композиция по любому из пп.1-4, где агент, связывающий ФВ, в композиции сохраняет по меньшей мере примерно 80% своей стабильности после хранения в течение по меньшей мере 12 месяцев при 5°С.
6. Композиция по любому из пп.1-5, где по меньшей мере 80%, предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 95%, наиболее предпочтительно по меньшей мере 99% агента, связывающего ФВ, сохраняет свою связывающую активность после хранения по сравнению со связывающей активностью до хранения, где указанную связывающую активность измеряют посредством ИФА и/или Biacore.
7. Композиция по любому из пп.1-6, которая является жидкой или восстановленной лиофилизированной композицией, включающей:
(а) агент, связывающий ФВ, в концентрации примерно от 0,1 мг/мл до 80 мг/мл, предпочтительно 12,5 мг/мл;
(b) сахарозу в концентрации примерно от 5% до 15% (м/о), предпочтительно 7% (м/о);
(с) Твин-80 в концентрации примерно от 0,001% до 0,5% (о/о), предпочтительно 0,01% (о/о); и
(d) цитратный буфер в концентрации примерно от 5 мМ до 200 мМ, предпочтительно 20 мМ, так что рН композиции составляет примерно от 6,0 до 7,0, предпочтительно 6,5.
8. Композиция по любому из пп.1-6,
где по меньшей мере 100 литров композиции хранят в условиях ниже температуры замерзания.
9. Композиция по любому из пп.1-8, которая находится в жидкой, лиофилизированной, высушенной распылением, восстановленной лиофилизированной, или замороженной форме.
10. Способ приготовления композиции по любому из пп.1-9, включающий этапы:
- экспрессии агента, связывающего ФВ, в клеточной культуре;
- очистки агента, связывающего ФВ, путем проведения агента, связывающего ФВ, по меньшей мере через один этап хроматографической очистки и этап ультрафильтрации/диафильтрации;
- доведения концентрации агента, связывающего ФВ, примерно до 0,1-80 мг/мл, предпочтительно 12,5 мг/мл, в композиции, содержащей:
(i) сахарозу в концентрации примерно от 5% до 15% (м/о), предпочтительно 7% (м/о);
(ii) Твин-80 в концентрации примерно 0,001%-0,5% (о/о), предпочтительно 0,01% (о/о); и
(iii) цитратный буфер в концентрации примерно от 5 мМ до 200 мМ, предпочтительно 20 мМ, так что рН композиции составляет примерно от 6,0 до 7,0, предпочтительно 6,5.
11. Способ приготовления восстановленной композиции по любому из пп.1-9, включающий этапы: (i) лиофилизации смеси агента, связывающего ФВ, лиопротектора, сурфактанта и буфера, с получением лиофилизированной смеси; и (ii) восстановления лиофилизированной смеси в растворителе, с получением композиции, где восстановленная композиция включает:
(а) агент, связывающий ФВ, в концентрации примерно от 0,1 мг/мл до 80 мг/мл, предпочтительно 12,5 мг/мл;
(b) сахарозу в концентрации примерно от 5% до 15% (м/о), предпочтительно 7% (м/о);
(с) Твин-80 в концентрации примерно от 0,001% до 0,5% (о/о), предпочтительно 0,01% (о/о); и
(d) цитратный буфер в концентрации примерно от 5 мМ до 200 мМ, предпочтительно 20 мМ, так что рН композиции составляет примерно от 6,0 до 7,0, предпочтительно 6,5.
12. Набор для лечения или профилактики ФВ-зависимых заболеваний, включающий контейнер, содержащий композицию по любому из пп.1-9, и инструкции по применению.
13. Набор по п.12, где композиция присутствует во флаконе или шприце для инъекций.
| US 2011158996 A1, 30.06.2011 | |||
| US 2010260766 A1, 14.10.2010 | |||
| US 2012225072 A1, 06.09.2012 | |||
| RU 2006100306 A, 10.06.2006 | |||
| ПЕРЕКРЫВАЮЩЕЕ КРОВОТОК ТВЕРДОФАЗНОЕ СРЕДСТВО С ПОКРЫТИЕМ ИЗ ИММОБИЛИЗОВАННОГО СВЯЗЫВАЮЩЕГО СРЕДСТВА | 2002 |
|
RU2295329C2 |
Авторы
Даты
2022-05-31—Публикация
2014-05-16—Подача