Настоящее изобретение относится к фармацевтическим композициям в форме сухого порошка для введения путем ингаляции как такового, или после дисперсии в жидкой среде посредством распылителя, и отличающимся высокой доставкой, возможностью вдыхания и устойчивостью. Ингаляционная терапия аэрозолями используется для доставки активных ингредиентов в дыхательные пути, в области слизистой оболочки, трахеи и бронхов. Термин «аэрозоль» описывает распыленную жидкую композицию, состоящую из мелких частиц, переносимых газом, обычно воздухом, к участку терапевтического действия. Когда участками терапевтического действия являются легочные альвеолы и мелкие бронхи, то лекарственное средство должно быть диспергировано в виде мелких капелек или частиц с размером, менее чем 5 мкм в качестве среднего диаметра. Когда мишень представляет собой область гортани, больше подходят более грубые частицы. Подходящими состояниями для такого лечения являются бронхоспазм, низкая податливость к лечению, отек слизистой оболочки, легочные инфекции и подобные состояния. В настоящее время, введение лекарственных средств в нижнюю легочную область достигается посредством ингаляционных устройств, таких как:
- распылители, в которых лекарственное средство растворено или диспергировано в форме суспензии и доставляется в легкие в виде мелких распыленных частиц;
- ингаляторы сухого порошка, способные доставлять лекарственное средство, загруженное в устройство в виде сухих микронизированных частиц; или
- ингаляторы в виде находящихся под избыточным давлением аэрозольных баллончиков, для которых лекарственное средство - тоже в форме мелких капелек раствора или суспензии - доставляется в нижнюю легочную область инертным газом, быстро распространяемым в воздухе из находящегося под избыточным давлением устройства.
Во всех случаях при разработке активных и эффективных продуктов обнаруживались технологические проблемы, которые еще ограничивают ингаляционную доставку лекарственных средств.
С клинической точки зрения пациент должен быть способен принимать ингаляционный продукт, используя различные способы введения, поскольку описанные ингаляторы в целом подходят для различных видов пациентов и условий введения. В целом, распылители главным образом используются пожилыми пациентами или детьми, тогда как сухие порошки или ингаляторы в виде находящихся под избыточным давлением аэрозольных баллончиков больше подходят для взрослых. Однако использование распылителей еще считается эффективным, поскольку пациент проводит ингаляцию лекарственного средства в состояниях покоя и без принуждения акта вдыхания, которое, в отличие от этого, необходимо при использовании порошка для ингаляции. Вместо этого, в случае находящегося под избыточным давлением ингалятора, вдыхание должно координироваться с активацией устройства для обеспечения того, чтобы доставленные частицы не ударяются о дно гортани вместо достижения глубоких отделов легких.
По этой причине ингаляционные композиции, загружаемые в эти 3 типа устройств, по существу отличаются друг от друга.
Композиции для распылителей представляют собой в основном растворы или суспензии, содержащие наполнители, такие как соли, поверхностно-активные вещества и консерванты, которые обеспечивают изотоничность продукта, однородность распределения размера частиц в случае суспензии и предохранение от микробного загрязнения.
Композиции для ингаляторов, находящихся под повышенным давлением, обычно содержат поверхностно-активные вещества, газы-вытеснители и совместные растворители. В композициях для ингаляторов с сухим порошком наполнители по существу состоят из лактозы с различным размером частиц, используемой в качестве разбавителя.
Поэтому такие ограничения по составлению композиций ограничили промышленную разработку ингаляционных продуктов и, кроме стероидов, которые существуют в основном во всех ингаляционных формах, для бронхолитических и антихолинергических активных ингредиентов некоторые формы не были получены в промышленном масштабе. Это ограничение по составлению композиций оказывается особенно важным, поскольку в современной респираторной терапии используется комбинация различных видов лекарственных средств в качестве наиболее эффективной методики. Однако до настоящего времени оказалось возможным создание лишь двух комбинаций кортикостероидов-бронхолитических средств, и только в форме ингаляционного порошка.
В отношении распыленных композиций, комбинация остается для получения пациентом продуктов для немедленного приема, иногда несовместимых друг с другом, непосредственно перед применением.
Поэтому, с терапевтической точки зрения ограничивающим условием со стороны пациента является его неспособность принимать одно и то же средство в различной обстановке, например дома, на работе, во время путешествий и в неотложных случаях. Для указанных различных ситуаций может случиться, что пациенту нужно применять различные продукты, содержащие различные активные ингредиенты.
Среди различных проблем, встречающихся при разработке ингаляционных продуктов, самая важная относится к химической устойчивости к атмосферным агентам, которые вызывают быстрое разрушение ингаляционной композиции, и, следовательно, короткий период хранения содержащегося продукта.
Устойчивость ингаляционного продукта особенно важна, поскольку он должен быть доставлен в глубокие отделы легких, в то же время сохраняя свои физические свойства, для достижения количественного осаждения частиц или капелек в самых глубоких отделах легких.
Нужно добавить, что количество наполнителей, утвержденных в настоящее время для ингаляционного введения, и поэтому нетоксичных для легочной ткани, крайне ограничено.
В литературных примерах сообщается о сухих ингаляционных порошках, обладающих высокой дисперсионной способностью в воздухе, благодаря их низкой плотности.
Такие порошки обычно получают с высоким содержанием фосфолипидов, в частности, дипальмитоилфосфатидилхолина (*DPPC).
Порошок такого вида описан в патентной заявке US2005/0074498 A1, относящейся к частицам низкой плотности с внутренне полой морфологией, полученным распылительной сушкой с использованием поверхностно-активных веществ, таких как фосфолипиды, в комбинации с продувочным агентом. Полая структура описана как результат точной комбинации продувочного агента и поверхностно-активного фосфолипида. Нет примеров аналогичной морфологии, полученной без фосфолипидов. Использование фосфолипидов в качестве поверхностно-активных веществ придает основные признаки полученному продукту, и, прежде всего, его чувствительность и устойчивость к атмосферным агентам, что в этом случае будет подвергаться особому влиянию влажности. В патентной литературе (US 2001/0036481 A1), кроме того, указаны величины температуры стеклования фосфолипидов в присутствии влажности, составляющие 41°C для DPPC, 55°C для дистеароилфосфатидилхолина (DSPC) и 63°C для дипальмитоилфосфатидилэтаноламина (DPPE), трех наиболее совместимых фосфолипидов для легочного введения. Эти величины Tg гораздо ниже, чем характерная величина Tg аморфной лактозы. Поэтому решение получения пористых частиц с фосфолипидами для введения путем ингаляции не представляется подтвержденным достоверными научными оценками, связанными с долгосрочной устойчивостью продукта.
В указанной патентной заявке, кроме применения частиц в виде сухого порошка для ингаляции, описывается также применение тех же частиц в ингаляторе в комбинации с газом-вытеснителем. Такое же введение нельзя было бы достичь обычным распылителем, диспергирующим частицы в воде или водном растворе ввиду несовместимости материалов и, прежде всего, из-за тенденции к плаванию на поверхности жидкости.
Концепция «высокой пористости» или «низкой плотности» использовалась практически эквивалентно в указанных патентных заявках.
В частности, термин «плотность» не использовался со ссылкой на абсолютную плотность частиц, поскольку она, измеренная гелиевым пикнометром, идентифицировал бы плотность твердых материалов, которые представляют собой часть порошка, и частицы, соответствующие уравнению
с = P/V (g/cc)
Вместо этого, термин «плотность» использовался со ссылкой на «плотность оболочки» частицы, учитывая ее создающий помехи объем, а именно, отношение массы частицы к «объему оболочки» частицы. Учитывая техническую трудность измерения плотности оболочки для каждой отдельной частицы, особенно в случае не сферических частиц, в указанных патентных заявках упомянуты параметры объема (и в последующем плотности) порошка, такие как насыпной объем и утрамбованный объем.
В WO 03/0350030 A1 описано получение набора для ингаляционного введения, в котором учитывается получение твердой сухой формы, включающей препарат, полученный лиофилизацией раствора. Способ, описанный также посредством примеров, проявляет важные промышленные сложности, и, прежде всего, не гарантирует то, что могло бы быть достигнуто существенное улучшение устойчивости препарата в течение времени. После лиофилизации, лекарственное средство, включенное в композицию, диспергируется в сети наполнителя, характеризуемого высокой пористостью, не модулируемой или изменяемой посредством способа. Указанная пористость, хотя и полезная для быстрого растворения твердой формы, гораздо больше подвергает лекарственное средство воздействию атмосферных агентов, нарушающих его устойчивость. Нет конкретных данных о пористости полученных в примерах лиофилизированных продуктов, но данные литературы, полученные при непрямых измерениях, устанавливают видимую плотность (связанную с объемной плотностью) лиофилизированных таблеток, содержащих сахара и поверхностно-активные вещества в количестве от 0,05 до 0,2 г/см3.
В свете всех приведенных выше соображений, было бы предпочтительно получение промышленным способом ингаляционной композиции, которую можно применять для различных путей ингаляции. Такое преимущество было бы существенным, если бы один из путей введения включал прием продукта или в виде порошка как такового, или диспергированного/растворенного в жидкости посредством распылителя, возможно, с другими активными ингредиентами.
Однако остается нерешенная или неудовлетворительно решенная проблема разработки ингаляционной композиции, содержащей лекарственные средства, которая является устойчивой и может вводиться или в виде сухого порошка, или в форме раствора или суспензии через распылитель при высокой доставке и способности вдыхания, и которая получается промышленно жизнеспособным способом.
Поэтому первый аспект настоящего изобретения заключается в получении ингаляционной фармацевтической композиции, включающей лекарственное средство, растворимый наполнитель и поверхностно-активное вещество, отличающийся тем, что:
- указанный растворимый наполнитель присутствует в количестве от 10% и менее чем 100% масс;
- массовое соотношение между указанным поверхностно-активным веществом и указанным средством составляет от 0,01 до 10;
- размер частиц, по меньшей мере, 50% частиц указанного порошка составляет менее 5 мкм;
- объемная плотность db указанного порошка составляет от 0,1 до 0,3 г/м3;
- плотность после уплотнения dt указанного порошка составляет от 0,15 до 0,7 г/м3;
- отношение db/ dt составляет от 0,2 до 0,65.
Другой аспект изобретения относится к способу получения указанной фармацевтической порошковой композиции с помощью распылительной сушки раствора указанного лекарственного средства с растворимым наполнителем.
Еще один аспект изобретения представляет собой раствор или суспензию непосредственно перед применением для ингаляции, полученные путем приведения в контакт указанной фармацевтической порошковой композиции с подходящим объемом жидкости.
Еще один аспект изобретения представляет собой набор для получения раствора или суспензии для ингаляционного применения непосредственно перед применением, включающих подходящее количество указанной фармацевтической композиции и подходящий объем жидкости, и который можно также использовать для прямого введения порошка без дополнительной манипуляции.
В отношении терапевтического аспекта. Некоторые преимущества можно найти в применение одного и того же продукта в виде сухого порошка или в распыленном виде, поскольку пациент применяет один и тот же продукт при любой потребности без необходимости применять другие продукты. Другие терапевтические преимущества связаны с возможностью комбинирования лекарственных средств различных видов для введения в виде жидкости и для достижения индивидуальной терапии для каждого пациента. В случае введения в виде сухого порошка препарат должен иметь соответствующие аэродинамические свойства для обеспечения возможности быстрого превращения продукта в аэрозоль при минимальном усилии при вдыхании со стороны пациента.
В случае введения в виде жидкости, один и тот же препарат должен обеспечить возможность быстрой дисперсии порошка для получения микро суспензии или раствора лекарственного средства в очень короткое время и без какого-либо усилия для пациента. Сухая композиция должна уже содержать все те наполнители, которые способны обеспечить эффективное и количественное распыление продукта, совместимого с любым видом распылителя. Патентная литература, которая относится к ингаляционным порошкам, не исключает в некоторых случаях возможность того, что определенные частицы могут диспергироваться в водной среде для распыления, но это решение в действительности указывает на то, что жидкость заранее содержит возможные наполнители, которые обеспечивают эффективное распыление продукта. Напротив, в идеальном случае фаза дисперсии не включает существенных модификаций жидкости для обеспечения возможности ее распыления различными видами распылителей. Композиция содержит в качестве наполнителей материалы, которые помогают распылению любым видом распылителя, посредством этого оптимизируя количество вводимого лекарственного средства в течение времени и аэродинамические свойства распыляемого продукта, кроме дисперсии частиц и устойчивости.
Относительно устойчивости лекарственное средство фактически захватывается в матрицу наполнителей, которые одновременно обеспечивают устойчивость продукта в сухом состоянии во время манипулирования с ним, и при его хранении, избегая необходимости хранения продукта в условиях контролируемой температуры и влажности.
Другой аспект изобретения представляет собой набор доз для введения пациенту в случае необходимости лекарственного средства в порошковой форме или, необязательно, в виде дисперсии в воде для легкого переноса в ампуле распылителя. Предпочтительно, набор включает устройство доставки, в котором требуемые компоненты в дозированных количествах содержатся раздельно, и их контакт происходит непосредственно перед их применением.
Предпочтительным способом получения порошка в сухом состоянии в соответствии с изобретением является распылительная сушка, начиная с водного раствора лактозы и поверхностно-активного вещества, в котором растворено или диспергировано лекарственное средство, с тем, чтобы образовать суспензию или эмульсию.
Предпочтительная морфология представляет собой морфологию внутренне полой частицы для получения сниженной объемной плотности.
Такое решение в действительности позволяет улучшить два фундаментальных аспекта ингаляционного введения. В случае введения в форме порошка, сниженная плотность обеспечивает возможность быстрого превращения в аэрозоль порошка ввиду уменьшенного аэродинамического диаметра таких частиц. В случае введения после растворения порошка полая морфология обеспечивает быстрое растворение матрицы порошка и последующее высвобождение активного ингредиента в растворе или микронизированной суспензии.
Поэтому предпочтительный размер частиц для такого порошка обеспечивает то, что, по меньшей мере, 50% распределения размера (Х) располагается ниже 5 мкм, также для увеличения площади поверхности, контактирующей с жидкостью, и, в случае введения в форме порошка, для оптимизации осаждения в глубоких отделах легких. Устойчивый раствор/суспензия активного ингредиента, получаемые после дисперсии твердой сухой фармацевтической композиции в соответствии с изобретением в водной среде перед применением, таковы, что доставка пневматическим распылителем стандартной дозы указанного раствора или суспензии в многоэтапном жидкостном импинжере при 30 л/мин в течение 5 мин, включает осажденную фракцию в указанном многоэтапном жидкостном импинжере, рассчитанную как активная фракция (A.F.), по меньшей мере, 25%, как будет описано далее.
В соответствии с изобретением термин «лекарственное средство» или «активный ингредиент» относится к любому веществу, которое имеет желательный терапевтический или биологический эффект.
Примеры фармакологически активных ингредиентов, которые можно вводить посредством ингаляции, включают: в2 агонисты (например, сальбутамол, тербуталин, кленбутерол, салметерол, формотерол); стероиды, такие как гликокортикостероиды, предпочтительно, противовоспалительные лекарственные средства (например, циклезонид, мометазон, флунисолид, триамсинолон, беклометазон, будезонид, флутиказон); антихолинергические лекарственные средства (например, ипратропий, тиотропий, окситропий); антагонисты лейкотриена (например, зафирлукаст, монтелукаст, пранлукаст); ксантины (например, аминофиллин, теобромин, теофиллин); стабилизаторы тучных клеток (например, кромогликат, недокромил); ингибиторы синтеза лейкотриена (например, азеластина, оксатомид, кетотифен); муколитики (например, N-ацетилцистеин, карбоцистеин); антибиотики (например, аминогликозиды, такие как амикацин, гентамицин, канамицин, неомицин, нетилмицин, стрептомицин, тобрамицин; карбацефем, такой как лоракарбеф; карбапенемы, такие как эртапенем, имипинем/циластатин, мерепенем; цефалоспорины первого поколения, такие как цефадроксил, цефаксолин, цефалексин; цефалоспорины второго поколения, такие как цефаклор, цефамандол, дефокситин, цефроксил, цефуроксим; цефалоспорины третьего поколения - цефиксим, цефдинир, цефтаксидим, дефотаксим, цефподоксим, цефтриаксон; цефалоспорины четвертого поколения, такие как максипим; гликопептиды, такие как ванкомицин, тейкопланин; макролиды, такие как азитромицин, кларитромицин, диритромицин, эритромицин, тролеандомицин; монобакта, такой как азтреонам; пенициллины, такие как амоксициллин, ампициллин, азлоциллин, карбенициллин, клоксациллин, диклоксациллин, флуклоксациллин, мезлоциллин, нафциллин, пенициллин, пиперациллин, тикарциллин; полипептиды, такие как бацитрацин, колистин, полимиксин В; хинолоны, такие какципрофлоксацин, эноксацин, гатифлоксацин, левофлоксацин, ломефлоксацин, моксифлоксацин, норфлоксацин, офлоксацин, тровафлоксацин; сульфонамиды, такие как мафенид, пронтосил, сульфацетамид, сульфаметизол, сульфаниламид, сульфаслазин, сульфисоксазол, триметоприм, триметоприм-сульфаметоксазол ко-тримазол (TMP-SMX); тетрациклины, такие как димеклоциклин, доксициклин, миноциклин, окситетрациклин, тетрациклин; другие, такие как хлорамфеникол, клиндамицин, этамбутол, фосфомицин, фуразолидон, изониазид, линезолид, метронидазол, нитрофурантоин, пиразинамид, хинупристин/далфопристин, рифампин, спектиномицин); обезболивающие средства в целом, такие как обезболивающие и противовоспалительные препараты, включая стероиды (например, гидрокортизон, кортизон ацетат, преднизон, преднизолон, метилпреднизолон, дексаметазон, бетаметазон, триамсинолон, беклометазон, флудрокортизон ацетат, деоксикортикостерон ацетат, альдостерон); и нестероидные противовоспалительные препараты (например, салицилаты, такие как аспирин, амоксиприн, бенорилат, колин, салицилат магния, дифлунизал, фаисламин, метил салицилат, салицил салицилат); арилалканоевые кислоты, такие как диклофенак, ацеклофенак, ацематицин, этодолак, индометацин, кеторолак, набуметон, сулиндак толметин; 2-арилпропаноевые кислоты (профены), такие как ибупрофен, карпрофен, фенбуфен, фенопрофен, флурбипрофен, кетопрофен, локсопрофен, напроксен, тиапрофеновая кислота; N-арилантраниловые кислоты (фенамовые кислоты), такие как мефенамовая кислота, меклофенамовая кислота, толфенамовая кислота; производные пиразолидина, такие как фенилбутазон, азапрпазон, метамизол, оксифенбутазон; оксикамы, такие как проксикам, метоксикам, теноксикам; коксиб, такой как целекоксиб, эторикоксиб, лумиракоксиб, парекоксиб (снятый с продаж), валдекоксиб (снятый с продаж); сульфонанилиды, такие как нимесулид; другие средствоы, такие как ликофелон, омега-3 жирные кислоты; сердечнососудистые препараты, такие как гликозиды (например, строфантин, дигоксин, дигитоксин, просцилларидин А); респираторные препараты; противоастматические средства; бронхолитические средства (адренергические препараты: албутерол, битолтерол, эпинефрин, фенотерол, формотерол, изоэтарин, изопротеренол, метапротеренол, пирбутерол, прокатерол, салметерол, тербуталин); противораковые средства (например, циклофосфамид, доксорубицин, винкристин, метотрексат); алкалоиды (т.е. алкалоиды спорыньи) или трипаны, такие как суматриптан, ризатриптан, наратриптан, золмитриптан, элетриптан и алмотриптан, которые можно применять против мигрени; препараты (т.е., сульфонилмочевина), применяемые против диабета и связанных с ним дисфункций (например, метформин, хлорпропамид, глибенкламид, гликлиазид, глимепирид, толазамид, акарбоза, пиоглитазон, натеглинид, ситаглиптин); седативные и снотворные препараты (например, барбитураты, такие как секобарбитал, пентобарбитал, амобарбитал; не классифицированные седативные средства, такие как эсзопиклон, рамелтеон, метаквалон, этхлорфинол, хлоралгидрат, мепробамат, глутетимид, метиприлон); психостимуляторы; ингибиторы аппетита (например, амфетамин); препараты против артрита (нестероидные противовоспалительные препараты); противомалярийные препараты (например, хинин, хинидин, мефлохин, галофантрин, примахин, клорохин, амодиахин); противоэпилептические препараты и противосудорожные препараты, такие как барбитураты (например, барбексаклон, метарбитал, метилфенобарбитал, фенобарбитал, примидон), сукцинимиды (например, этоксксимид, месуксимид, фенсуксимид), бензодиазепины, карбоксамиды (например, карбамазепин, окскарбазепин, руфинамид); производные жирных кислот (например, валпромид, валноктамид); карбоновые кислоты (например, вальпроевая кислота, тиагабин); аналоги гамма-аминомасляной кислоты (например, габапентин, прегабалин, прогабид, вигабатрин); топирамат, мочевины (например, фенацемид, фенетурид), карбаматы (например, эмилкамат, фелбамат, мепробамат); пирролидины (например, леветирацетам, нефирацетам, селетрацетам); сульфо препараты (например, ацетазоламид, этоксзоламид, султиам, зонисамид), бекламид; паральдегид, бромид калия; антитромботические препараты, такие как антагонист витамина К (например, аценокумарол, дикумарол, фенпрокумон, фениндион, варфарин); ингибиторы агрегации тромбоцитов (например, антитромбин III, бемипарин, делтапарин, данапароид, эноксапарин, гепарин, надропарин, парнапарин, ревипарин, тинзапарин); другие ингибиторы агрегации тромбоцитов (например, абциксимаб, ацетисалициловая кислота, алоксиприн, дитазол, клопидогрел, дипиридамол, эпопростенол, эптифибатид, индобуфен, прасугрел, тиклопидин, тирофибан, трепростинил, тифузал); ферменты (например, алтеплазы, анкрод, анистрплаза, фибринолизин, стрептокиназа, тенектеплаза, урокиназа); прямые ингибиторы тромбина (например, аргатробан, бивалирудин, лепирудин, мелагатран, ксимелагратан); другие антитромботические средства (например, дабигатран, дефибротид, дерматан сульфат, фондапаринукс, ривароксабан); препараты против гипертонии, такие как диуретики (например, буметанид, фуросемид, тормесид, хлорталидон, гидрохлортиазид, хлортиазид, индапамид, метолаксон, амилорид, триамтерен); антиадренергические препараты (например, атенолол, метопролол, окспренолол, пиндолол, пропранолол, доксазосин, празосин, теракосин, лабеталол); блокаторы кальциевых каналов (например, амлодипин, фелодипин, дерадипин, нифедипин, нимодипин, дилтиазем, верапамил); ингибиторы ацетилхолинэстеразы (например, каптоприл, эналаприл, фосиноприл, лисиноприл, периндоприл, хинаприл, рамиприл, бензаприл); антагонисты рецепторов ангиотензина II (например, кандесартан, ирбесартан, лосартан, телмисартан, валсартан); антагонист альдостерона, такой как спиронолактон; центрально действующие адренергические препараты (например, клонидин, гуанабенз, метилдопа); антиаритмические препараты класса I, которые блокируют натриевые каналы (например, хинидин, прокаинамид, дисодирамид, лидокаин, мексилетин, токаинид, фенитоин, энкаинид, флекаинид, морицизин, пропафенон), класса II, которые представляют собой бета-блокаторы (например, эсмолол, пропранолол, метопролол); класса III, которые воздействуют на выходящий ток калия (например, амиодарон, азимилид, бретилий, клорилий, дофетилид, тедисамил, ибутилид, сематилид, соталол); класса IV, которые воздействуют на атриовентрикулярный узел (например, верапамил, дилтиазем); класса V с неизвестными механизмами действия (например, аденоид, дигоксин); антиоксидантные препараты, такие как витамин А, витамин С, витамин Е, кофермент Q10, меланонин, каротеноидные терпеноиды, не каротеноидные терпеноиды, полифенольны флованоиды; антидепрессанты (например, миртазапин, тразодон); антипсихотические препараты (например, флуфеназин, галоперидол, тиотиксен, трифторперазин, локсапин, перфеназин, клозапин, кветиапин, рисперидон, оланзапаин); анксиолитические препараты (бензодиазепины, такие как диазепам, клоназепам, адпразолам, темазепам, хлордиазепоксид, флунитразепам, лоразепам, клоразепам,; имидаксопиридины, такие как золпидем, алпидем; пиразолопиримидины, такие как залеплон); противорвотные препараты, такие как антагонисты рецепторов серотонина (доласетрон, гранисетрон, ондансетрон), антагонисты допамина (домперидон, дроперидол, галоперидол, хлорпромазин. Прометазин, метоклопрамид); антигистаминные препараты (циклизин, дифенидрамин, дименгидринат, меклизин, прометазин, гидроксизин); противоинфекционные препараты; антигистаминные препараты (например, мепирамин, антазолин, дифенигидрамин, карбиноксамин, доксиламин, клемастин, диметидринат, циклизин, хлорциклизин, гидроксизин, меклизин, прометазин, ципротептадин, азатидин, кетотифен, акривастин, лоратадин, терфенадин, цетризидинем, азеластин, левокабастин, олопатадин, левоцетризин, деслоратадин, фексофенадин, кромогликат недокромил, типерамид, импромидин); противогрибковые препараты (например, нистатин, амфотерицин В, натамицин, римоцидин, филипин, пимарицин, миконазол, кетоконазол, клотримазол, эконазол, мебендазол, бифоназол, оксиконазол, сертаконазол, сулконазол, тиаконазол, итраконазол, посаконазол, вориконазол, тербунафин, аморолфин, бутенафин, анидулафунгин, каспофунгин, флукитосин, гризеофульвин, флуокинонид) и противовирусные препараты, такие как средства против герпесвируса (например, ацикловир, цидофовир, докозанол, фамцикловир, фомивирсен, фоскарнет, ганцикловир, идоксуридин, пенцикловир, трифлуридин, троментадин, валацикловир, валганцикловир, видарабин); средства против гриппа (амантадин, оселтамивир, перамивир, римантадин, занамивир); препараты против ретровирусов (абакавир, диданозин, эмтрицитабин, ламивудин, ставудин, тенофовир, залцитабин, адефорвир, тенофовир, эвафиренц, делавирдин, невирапин, ампренавир, атазанавир, дарунавир, фосампренавир, индинавир, лопинавир, нелфинавир, ритонавир, саквинавир, липранавир); другие противовирусные средства (энфувиртид, фомивирсен, имиквимод, инозин, интерферон, подофиллотоксин, рибавирин, вирамидин); препараты против неврологических дисфункций, такие как болезнь Паркинсона (например, агонисты допамина, L-допаб карбидопа, бензеразид, бромкриптин, перголид, прамипексол, ропинипол, апоморфин, лисурид); препараты для лечения алкоголизма (например, антабус, налтрексон, вивитрол) и других форм зависимости; сосудорасширяющие средства для лечения эректильной дисфункции (например, силфенафил, варденафил, тадалафил), мышечные релаксанты (например, бензодиазепины, метокарбамол, баклофен, каризопродол, хлорзоксазон, циклобензаприн, дантролен, метаксалон, орфенадрин, тизанидин); средства, вызывающие мышечные сокращения; опиоиды; стимулирующие препараты (например, амфетамин, кокаин, кофеин, никотин); транквилизаторы; антибиотики, такие как макролиды; аминогликозиды; фторхинолоны и в-лактамы; вакцины; цитокины; ростовые факторы; гормоны, включая контрацептивные средствоы; симпатомиметические препараты (например, амфетамин, бензилпиперазин, катинон, хлорфентермин, клобензорекс, кокаин, циклопентамин, эфедрин, фенфлурамин, метилон, метилфенидат, пемолин, фендиметразин, фентермин, фенилэфрин, пропилгекседрин, псевдоэфедрин, сибутрамин, симефрин); диуретики; средства, регулирующие уровень липидов; антиандрогенные средства (например, бикалутамид, ципротерон, флутамид, нилутамид); антипаразитарные препараты; антикоагулянты (например, варфарин); неопластические препараты; препараты против новообразований (например, хлорамбуцил, хлорметин, циклофосфамид, мелфалан, кармустин, фотемустин, ломустин, крбоплатин, бусульфан, дакарбазин, прокарбазин, тиотэф, урамустин, мехлортамин, метотрексат, кладрибин, клофарабин, флударабин, меркаптопурин, фторурацил, винбластин, винкристин, даунорубицин, эпирубицин, блеомицин, гидроксимочевина, алемтузумар, цетуксимаб, амиолевулиновая кислота, алтретамин, амсакрин, анагрелид, пентостатин, третионин); гипогликемические препараты; питательные и интегрирующие средства; ростовые интеграторы; средства против энтерита; вакцины; антитела; диагностические и рентгеноконтрастные средства; или смеси указанных выше препаратов (например, комбинации для лечения астмы, содержащие стероиды и в-агонисты).
Указанные выше активные ингредиенты являются частью одного или более структурных классов, включая без ограничения мелкие молекулы (предпочтительно, мелкие нерастворимые молекулы), пептиды, полипептиды, белки, полисахариды, стероиды, нуклеотиды, олигонуклеотиды, полинуклеотиды, жиры, электролиты и им подобные.
Определенные примеры включают в2 агонисты сальбутамол, салметерол (например, салметерол ксинафоат), форметерол и форметерол фумарат, фенотерол, кармотерол, индакатерол, кортикостероиды, такие как беклометазон дипропионат, будесонид, флутиказон (например, флутиказон дипропионат), мометазон (например, мометазон фуроат) и циклезонид. В отношении пептидов и белков, настоящее изобретение включает также синтетические, рекомбинантные, нативные, гликозилатные и не гликозилатные пептиды и белки, биологически активные фрагменты и аналоги.
Активные ингредиенты, для которых особенно предпочтительно непосредственное высвобождение в кровоток для быстрого фармакологического эффекта, включают те, которые предстоит использовать против мигрени, тошноты, бессонницы, аллергической реакции (включая анафилактические реакции), неврологических и психиатрических расстройств (в частности, панических приступах и другого психоза или невроза), эректильной дисфункции, диабета и родственных заболеваний, сердечных заболеваний, противосудорожные препараты, бронхолитики и активные средства против боли и воспаления. В соответствии с настоящим изобретением, можно также вводить вакцины, изготовленные с антителами, клетками, частицами и клеточными частями.
Активный ингредиент может включать 2 или более веществ, составленных вместе, например, одно покрытое другим, или одно, диспергированное в матрице другого вещества, или смесь двух или более активных ингредиентов. Обычные примеры таких композиций включают активные лекарственные средства, покрытые наполнителями, причем наполнитель выполняет функцию изменения скорости высвобождения или достижения точности попадания активного ингредиента.
В случае ассоциации активных ингредиентов, один из них может частично или полностью замещать растворимый наполнитель, становясь, кроме активного ингредиента, структурным компонентом твердой частицы. Такие случаи также являются частью настоящего изобретения. Примерами таких веществ являются N-ацетилцистеин и карбоцистеин, имеющие подходящую растворимость, практически низкую токсичность и, возможно, муколитическое действие.
Другими примерами активных веществ являются стероиды и их соли, такие как будезонид, тестостерон, прогестерон, флунисолид, триамсинолон, беклометазон, бетаметазон, дексаметазон, флутиказон, метилпреднизолон, преднизон, гидрокортизон и аналогичные препараты; пептиды, такие как циклоспорин и другие нерастворимые в воде пептиды; ретиноиды, такие как цис-ретиноевая кислота, 13-транс-ретиноевая кислота и другие производные витамина А и бета-каротена; витамины D, E и К и другие их предшественники и нерастворимые в воде производные; простагландины, лейкотриены и их активаторы и ингибиторы, включая простациклин, простагландины Е1 и Е2, тетрагидроканнабинол, легочные липидные поверхностно-активные вещества; растворимые в масле антиоксиданты; гидрофобные антибиотики и химиотерапевтические препараты, такие как амфотерицин В, адриамицин и им подобные.
Растворимый наполнитель или наполнители фармацевтической композиции в соответствии с изобретением обычно имеют растворимость в воде больше 5 г/л, часто больше чем 100 г/л и более. Они предпочтительно выбраны среди сахаров, солей или аминокислот и имеют двойную функцию минимизации эффектов ингаляционной композиции на выход жидкости из клетки и стабилизацию водной суспензии, полученной из сухой композиции. Относительно композиции в твердой сухой форме, наполнитель также образует твердую матрицу, в которой диспергирован препарат или активный ингредиент. Примерами растворимых наполнителей, которые можно использовать в композиции в соответствии с изобретением, являются: алитам, ацесульфам калий, аспартам, сахарин, сахарин натрия, цикламат натрия, сукралоза, трегалоза, ксилит, лимонная кислота, винная кислота, циклодекстрины, декстрины, гидроксиэтилцеллюлоза, желатин, яблочная кислота, мальтит, мальтодекстрин, мальтоза, полидекстроза, бикарбонат натрия или калия, хлорид натрия или калия, цитрат натрия или калия, фосфолипиды, лактоза, сахароза, глюкоза, фруктоза, манит, сорбит, естественные аминокислоты, аланин, глицин, серин, цистеин, фенилаланин, тирозин, триптофан, гистидин, метионин, треонин, валин, изолейцин, лейцин, аргинин, лизин, аспарагиновая кислота, глутаминовая кислота, аспарагин, глутамин, пролин, их соли и их возможные простые химические модификации, такие как N-ацетилцистеин и карбоцистеин.
Предпочтительными растворимыми наполнителями являются соли щелочных металлов, такие как хлорид натрия или хлорид калия, и сахара, такие как лактоза.
Что касается полой морфологии частиц, то композиция требует присутствия растворимого наполнителя, предпочтительно сахара, подобного лактозе, способной образовывать в начале фазы испарения растворителя, во время распылительной сушки каркаса частицы, поэтому продуцируя частицы с высокой пористостью.
Поверхностно-активное вещество фармацевтической композиции в соответствии с изобретением можно выбрать среди различных классов поверхностно-активных веществ фармацевтического применения.
Поверхностно-активные вещества, подходящие для применения в настоящем изобретении, представляют собой вещества, характеризуемые средней или низкой молекулярной массой, которые содержат гидрофобную часть, в целом легко растворимую в органическом растворителе, но слабо растворимую в воде, и гидрофильную (или полярную) часть, слабо растворимую или нерастворимую в органическом растворителе, но легко растворимую в воде. Поверхностно-активные вещества классифицируются в соответствии с их полярной частью. Поэтому поверхностно-активные вещества с отрицательно заряженной полярной частью называются анионными поверхностно-активными веществами, тогда как катионные поверхностно-активные вещества имеют положительно заряженную полярную часть. Незаряженные поверхностно-активные вещества в целом называются не ионными, тогда как поверхностно-активные вещества, заряженные и положительно, и отрицательно, называются цвиттерионными. Примеры анионных поверхностно-активных веществ представляют собой соли жирных кислот (лучше известные как мыла), сульфаты, простые эфиры сульфатов и сложные эфиры фосфатов. Катионные поверхностно-активные вещества часто основаны на полярных группах, содержащих аминогруппы. Самые обычные не ионные поверхностно-активных вещества основаны на полярных группах, содержащих олиго- (этиленоксидные) группы. Цвиттерионные поверхностно-активные вещества в целом характеризуются полярной группой, образованной четвертичным амином и серной или карбоновой группой.
Некоторые примеры этих веществ представляют собой следующие поверхностно-активные вещества: бензалконий хлорид, цетримид, докузат натрия, глицерил монолаурат, сложные эфиры сорбитана, лаурилсульфат натрия, полисорбаты, фосфолипиды, желчные соли.
Предпочтительны не ионные поверхностно-активные вещества, такие как полисорбаты и полиэтилен и блок сополимеры полиоксипропилена, известные как «Полоксамеры». Полисорбаты описаны в Международном словаре косметических ингредиентов Ассоциации производителей косметических, парфюмерных и туалетных изделий как смеси сорбита и сложных эфиров жирных кислот ангидрида сорбита, конденсированных с этиленоксидом. Особенно предпочтительными являются не ионные поверхностно-активные вещества серии, известной как “Твин”, в частности, поверхностно-активное вещество, известное как Твин 80, монолаурат полиоксиэтиленсорбитана, имеющийся в продаже.
Присутствие поверхностно-активного вещества, и, предпочтительно, Твин 80, необходимо для снижения электростатических зарядов, обнаруживаемых в композициях без него, потока порошка и поддержания твердого состояния однородным образом без первоначальной кристаллизации.
В соответствии с настоящим изобретением, фосфолипиды не включены в указанное выше определение поверхностно-активных веществ или наполнителей.
Как уже указывалось, использование сахара, подобного лактозе, дает лучшие результаты, чем фосфолипиды, которые дают с той же методикой частицы с более низкой температурой перехода и поэтому более чувствительные к влажности.
Также, что касается из морфологии, частицы, полученные с фосфолипидами, проявляют чувствительность к выбранным испарительным параметрам, имеющим примеры пористых частиц, полученных с коллапсом полой структуры первоначальной частицы.
Скорость растворения ингаляционного продукта, растворенного непосредственно перед применением, должна предоставить возможность пациенту растворить тот же продукт менее чем за 30 с, еще предпочтительнее, менее чем за 15 с, в необходимом объеме жидкости.
В этом смысле, если даже растворимость лактозы в дистиллированной воде при комнатной температуре составляет 20 г/100 мл, этот уровень растворимости достижим только через длительное время и при нагревании раствора. Лактоза, в действительности, даже если она высоко растворима, имеет низкую скорость растворения.
Предпочтительно, чтобы солюбилизация продукта в воде происходила при комнатной температуре, поэтому необходимо улучшить солюбилизацию композиции уменьшением размера частиц и содействием растворению посредством полой морфологии и поверхностно-активного вещества в композиции.
Скорость растворения дополнительно улучшается, если твердое состояние преобладающего наполнителя является аморфным.
Время растворения частиц, имеющих объемную плотность от 0,1 до 0,3 г/см3, средний размер частиц менее чем 5 мкм и внутренне полых, в соответствии с изобретением составляет менее чем 15 с при комнатной температуре в дистиллированной воде.
В отношении промышленного изготовления, фармацевтический продукт должен продуцироваться посредством регулируемого, повторяемого способа с высоким выходом и, следовательно, низкими затратами.
Ингаляционная композиция в соответствии с изобретением может включать гидрофобное вещество для снижения чувствительности к влажности. Такое гидрофобное вещество представляет собой предпочтительно лейцин, который облегчает разрушение частиц.
В случае получения твердого продукта в форме порошка, это может происходить при использовании различных методик, известных в фармацевтической промышленности.
Получение мелких частиц посредством сушки распылением представляет предпочтительный способ в соответствии с изобретением.
В случае промышленного производства, эта методика является несомненно предпочтительнее лиофилизации, которая в настоящее время является самым дорогим способом сушки, и по используемому устройству, и по выходу и времени производства. Кроме того, лиофилизация обеспечивает высоко пористые порошки, которые нежелательны в соответствии с настоящим изобретением.
Фармацевтическая композиция в соответствии с изобретением может включать другие компоненты, такие как рН буферы и консерванты, но они в целом не являются необходимыми по причине того, что композиция хранится в твердом сухом состоянии, и что родственная водная суспензия получается непосредственно перед применением.
Термин «твердая сухая композиция» относится к композиции порошкообразной, гранулированной, таблетированной формы или любой другой твердой формы с содержанием влаги, которое обеспечивает композиции химическую устойчивость во времени. Точнее, термин «сухая» относится к твердой композиции с содержанием воды ниже, чем 10% масс/масс, обычно, менее чем 5%, а предпочтительно, менее чем 3%.
Количество поверхностно-активного вещества в сухой твердой композиции по изобретению может изменяться в пределах широкого интервала. Массовое отношение поверхностно-активного вещества и активного ингредиента составляет предпочтительно от 0,01 до 10.
Размер частиц сухой твердой композиции по изобретению характеризуется средним диаметром Х50 менее чем 5 мкм, предпочтительно, менее чем 4 мкм, предпочтительнее, от 1 до 3 мкм.
Способ получения сухой твердой композиции в соответствии с изобретением включает следующие операции:
а) получения первой фазы (А), в которой активный ингредиент представляет собой соответствующую жидкую среду;
b) получения второй фазы (В), в которой растворимые наполнители растворяются и поверхностно-активные вещества растворяются в водной среде;
с) смешивания указанных фаз (А) и (В) для получения третьей фазы (С), состоящей из однородной жидкой среды;
d) сушки указанной фазы (С) в регулируемых условиях для получения сухого порошка со средним размером частиц менее чем 15 мкм;
е) сбора указанного сухого порошка и хранения его соответствующим образом для получения суспензии непосредственно перед применением.
Фаза (А) может представлять собой или суспензию активного ингредиента в водной или неводной среде, или раствор активного ингредиента в соответствующем растворителе.
Предпочтительно получить раствор и выбрать органический растворитель среди растворителей, растворимых в воде. В этом случае, фаза (С) представляет собой раствор всех компонентов желаемой композиции.
Вместо этого, когда фаза (А) представляет собой суспензию гидрофобного, активного ингредиента в водной среде, фаза (С) также представляет собой суспензию в водной среде, которая растворит растворимые компоненты, такие как наполнители и поверхностно-активные вещества.
Стадия d) состоит из устранения жидкости, растворяющей или диспергирующей среды из фазы (С) для получения сухого порошка с желаемыми размерными свойствами. Такую сушку предпочтительно получают сушкой распылением. Признаки сопла и параметры способа выбирают для высушивания жидкой среды из раствора или суспензии (С) и для получения порошка с желаемым размером частиц.
Затем полученный порошок хранят в чистом виде или включают в таблетки или другую подходящую форму. Относительно большой размер частиц сухой композиции в соответствии с изобретением имеет особое преимущество по различным причинам. Как уже говорилось ранее, грубые частицы имеют более низкую тенденцию к агрегации, чем мелкие частицы. Кроме того, выход способа распылительной сушки может быть выше, чем выход известных промышленных способов, используемых для продукции соответствующих мелких ингаляционных частиц в сухом состоянии. Наконец, легче сбор и манипуляция с порошками.
Сухая твердая фармацевтическая композиция, описанная выше, предназначена для ингаляции в чистом виде или использования для получения устойчивой суспензии или раствора препарата или активного ингредиента для получения непосредственно перед применением в соответствующем объеме диспергирующей жидкости, предпочтительно, воды или физиологического раствора.
В соответствии с одним аспектом настоящего изобретения, описанная выше твердая сухая фармацевтическая композиция используется для получения устойчивой суспензии или раствора препарата или активного ингредиента для получения непосредственно перед применением в соответствующем объеме воды или физиологического раствора.
Как известно в настоящей области, получение непосредственно перед применением представляет собой получение, завершенное непосредственно перед применением, что означает непосредственно перед введением препарата пациенту. В настоящем описании термин «получение непосредственно перед применением» также включает получение, проводимое фармацевтом, и предназначенное для применения пациентом через относительно короткий период времени от такого получения. В более общем смысле, термин «получение непосредственно перед применением» относится ко всем тем случаям, в которых раствор или суспензия полностью не изготавливается фармацевтической промышленностью и поступает в продажу в форме, готовой для применения, но готовой в тот момент, который следует за получением сухой твердой композиции, обычно в момент, близкий ко времени введения пациенту.
Концепция получения непосредственно перед применением также распространяется на получение раствора обеспечением контакта сухой композиции с жидкостью внутри устройства доставки. Введение порошка, полученного в соответствии с изобретением, можно достичь посредством:
- Ингалятора сухого порошка
- Распылителя
- Ингалятора в виде аэрозольного баллончика
- Ингалятора, отличного от аэрозольного баллончика, обеспечивающего подачу порошка типа легкого тумана.
Ингаляционный порошок в соответствии с изобретением включает частицы с объемной плотностью ниже чем 0,3 г/см3. Предпочтительно, такая объемная плотность меньше чем 0,2 г/см3, и размер его частиц таков, что средний диаметр, по меньшей мере, ниже чем 5 мкм.
В случае введения посредством распылителя, композиция (с наполнителем и поверхностно-активным веществом) не должна отрицательно влиять на качественную и количественную доставку продукта.
В случае распылителей. Обнаруживается, что они собраны в соответствии с различными функциональными механизмами.
Они включают:
- Пневматические распылители
- Ультразвуковые распылители
- Сетчатые или образующие легкий туман распылители
Изобретение предлагает более эффективное и гибкое использование этих распылителей посредством используемой композиции.
Полученные результаты показывают, что, комбинируя растворимый наполнитель и поверхностно-активное вещество, можно достичь получения лучших композиций, чем те, получаемые только буфером или только водой.
Растворы препарата в солевом буфере или аналогичных носителях обычно используются для генерирования аэрозоля в распылителе. Внутри ампулы обычного воздушного распылителя имеется небольшой элемент, который продуцирует капельки в виде аэрозоля. Стенки ампулы работают как отражатели, удаляющие крупные капли из аэрозоля. Крупные капельки движутся вдоль стенок и падают назад на колпачок, оставляя туман мелких капелек, которые могут проникать в легкие. Поток воздуха или кислорода переносит аэрозоль через мундштук распылителя.
Большинство обычных распылителей работают в соответствии с теорией Бернулли и используют поток воздуха или кислорода для генерирования распыляемых частиц. В более сложных распылителях используются ультразвуковые или вибрирующие пьезоэлектрические части для генерирования распыляемых частиц. Оба типа известны в данной области и описаны в фармацевтической литературе.
Поскольку все распылители требуют жидкой среды для создания распыляемого аэрозоля, и поскольку ингаляция распыляемого вещества должна осуществляться непосредственно в легкие, вода представляет собой наиболее подходящую среду для использования. Проблема возникает, когда сам препарат является недостаточно устойчивым в воде для обеспечения длительной устойчивости водной композиции.
Альтернативой охлаждению раствора или суспензии, которые уже были получены, является получение раствора лекарственного средства непосредственно перед применением.
Легочное введение препаратов разрабатывается посредством характеристики композиций, доставляемых из устройства в жидкий или сухой импинжер и определения FPF (фракции мелких частиц), которая представляет собой количество препарата, имеющего аэродинамический диаметр ниже, чем 5 мкм. Этот параметр не дает информацию о количестве препарата, осажденного в альвеолах или бронхах, причем хорошо известно, что бронхолитики не дают реального благоприятного эффекта при осаждении в альвеолах.
В этом смысле, если учитывать процентную долю отложения на стадиях 4 и 5 многостадийного жидкостного импинжера, работающего при 30 л/мин, то сумма стадии 4 = 40% и стадии 5 = 20% равна сумме стадии 4 = 20% и стадии 5 = 40%, но, возможно, с двумя различными фармакологическими эффектами между двумя продуктами.
Такие различия можно было бы легко обнаружить, используя другой распылитель с той же композицией. Поэтому представленное изобретение предлагает новый технологический подход, способный после манипулирования композицией оптимизировать ингаляционное введение препарата распылителем или устройством, создающим легкий туман, следующими путями:
- количественный: большие количества препарата, доставляемые в течение времени
- качественный: доставка более мелких капелек
- предварительное определение размера распыленных капелек на основании нацеливания на легкие
- улучшение длительной устойчивости продукта.
Соответствующая комбинация в соответствии с потребностями лица, составляющего композицию, может обеспечить возможность получения композиций, имеющих желаемое распределение размера, в зависимости от распылителя и лечения.
Таким образом, теоретически должно быть возможно получение ингаляционного продукта с мелким размером частиц для предпочтительного легочного осаждения и более крупного размера частиц для бронхиального или центрального осаждения без модификации устройства или без необходимости в двух различных распылителях для двух различных ингаляционных частиц.
Продукт в твердом состоянии может состоять из одной или более стандартных доз лекарственного средства и соответствующего объема диспергирующей среды.
В другой конфигурации продукта, один средство может храниться в твердом состоянии, а диспергирующее средство может включать подходящие количества полисахарида или поверхностно-активного вещества.
Композиции, осуществленные в качестве примеров, показывают, что посредством подходящего составления можно оптимизировать:
- количество препарата, доставляемое из устройства
- размер распыленных капелек
- количество, осажденное в дыхательных путях.
Композицию можно доставлять из обычного распылителя или устройства, образующего легкий туман.
В соответствии с одним аспектом изобретения, набор для введения препарата в форме порошка, в случае потребности пациента или, если возможно, его дисперсии в воде и легкого переноса в распылительной ампуле, состоит из устройства, включающего требуемые компоненты в дозированных количествах. Такое устройство сконфигурировано в виде стеклянной или пластиковой трубки, показанной на фиг.8, где перечислены различные функциональные части, отмеченные буквами от А до Е. Устройство доставки в соответствии с изобретением соответственно состоит из трубки (10), разделенной на 2 отсека (12, 14), двух резиновых или пластиковых уплотнителей (15, 17), способных скользить вдоль трубки при приложении давления через наружный поршень (18). Трубка (10) снабжена обходом, полученным увеличением (20) бокового отдела самой трубки. Верхний отсек (12) содержит ингаляционную композицию в порошковом состоянии, тогда как нижний отсек (14) содержит соответствующую дозу жидкости, достаточную для полного диспергирования порошка (22), который может быть в одной или множественных дозировках.
Трубка закрыта сверху обычным упаковочным материалом для фармакологического использования (например, алюминием) для образования прокалываемого уплотнения (26). В случае доставки порошка уплотнение (26) прокалывается мундштуком (28), обеспеченным прокалывающим штырем (30), который окружает центральную трубку для доставки порошка, как показано на фиг.8В. На фиг.9А показан мундштук (28) в вертикальном положении, где показано, что он снабжен радом небольших отверстий (32) для впуска воздуха во флакон. На фиг.9В показан сверху мундштук (28) в разрезе. В случае введения жидкости поршень (18) сдвигает нижний уплотнитель 17 в сторону верхушки, перемещая жидкость через обход в верхний отсек для смешивания с порошком и его растворения (фиг.5С). Поэтому уплотнитель прокалывается более тонким дозирующим штырем (30), включенный в мундштук (28) для тонкой дозировки, и доза доставляется при подаче дополнительного давления шприцем (фиг.8Е). На фиг.10А и 10 В показан мундштук (28) соответственно в вертикальном положении и сверху в разрезе.
Демонстрация размера частиц распыленного продукта
Для демонстрации того, что распыленный продукт, доставляемый из четырех обычных распылителей, имеющихся в продаже, различными рабочими механизмами, указанными в следующем описании соответственно как М, А, С и N:
М, А: распылитель, обеспеченный сеткой или пьезокристаллическим устройством
С: пневматический распылитель (струйный распылитель)
N: ультразвуковой распылитель,
улучшился в отношении диаметра капелек распыленного продукта и/или дозы, доставленной за стандартное время доставки для пациента, соответствующее 5 мин, заявители диспергировали в 2 мл дистиллированной воды 40 мг порошка, полученного в соответствии с примером 4, описанным ниже, что соответствует дозе 240 мкг сальбутамола, сравнивая ее с эквивалентной дозой сальбутамола сульфата, растворенной в 2 мл дистиллированной воды.
2 мл раствора двух рассматриваемых композиций загружали в 4 распылителя. И их приводили в действие в течение 5 мин для измерения доставленного количества без форсированной ингаляции.
Ту же композицию исследовали, измеряя после первой минуты непрерывной доставки распределение по размеру доставляемых капелек расположением устройства перед анализатором размера частиц, определяющим рассеивание лазерного луча света, Sympatec Helos, снабженного измерительной линзой RI (показателя преломления) для диапазоне 0,1-35 мкм.
Результаты в следующей таблице показывают улучшение одного или обоих измеренных параметров для всех исследованных распылителей, демонстрируя, что композиция практически независима от типа распыления.
(мкм)
(мкм)
Демонстрация предпочтительной точн
Если сослаться на осаждение ости попадания лекарственного средства 5 обычных ингаляционных препаратов, достигнутое солевым раствором или суспензией, то можно в данном случае указать на способность изменять легочное осаждение частиц размером менее чем 5 мкм в глубоких отделах легких.
Расчет количества частиц, которые могут достичь глубоких отделов легких
Если рассматривать дозу сухого порошка для ингаляции 100 мкг, составленных из монодисперсных сферических частиц с плотностью 1 г/см3 и с геометрическим диаметром 2 мкм, то количество (n) частиц, присутствующих в этой массе порошка, можно рассчитать по следующему уравнению:

где D = плотность насыпанного объема порошка,
m = масса порошка,
Vi = объем отдельной частицы,
n = количество частиц.
Если рассматривать частицу с геометрическим диаметром, равным 2 мкм, как описано выше, то ее отдельный объем Vi можно рассчитать по следующему уравнению:
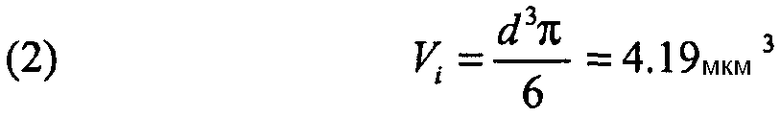
Если:
m = 100 мкг
Vi = 4,19 мкм3
D = 1 г/мм3, эквивалентная 10-6 мкг/мкм3
n было бы эквивалентно 2,38 × 107 частиц.
Уменьшение диаметра частиц с 2 мкм до 1 мкм привело бы к Vi, эквивалентному 0,52 мкм3, таким образом, увеличивая количество частиц для описанных 100 мкм до 1,92 × 108. Если допустить, что порошок с размером частиц 2 мкм, для которого полученное по оценке теоретическое количество n частиц доставляется в обеспечивающую вдыхание область человеческих легких с эффективностью, сравнимой с той, которая достигается обычными ингаляторами сухого порошка, имеющимися в продаже (приблизительно 20%), то действительная вдыхаемая доза будет равна n/5 или 4,76 × 106.
Теоретическую площадь легочной поверхности, покрываемую этой вдыхаемой дозой, можно рассчитать, начиная с количества частиц, доставленных в легкие и проецируемую площадь А на плоскость сферы с диаметром, эквивалентным диаметру частицы. В этом случае:
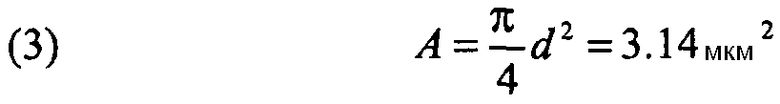
Затем эту отдельную площадь А необходимо умножить на количество частиц, доставленных в участвующую во вдыхании область n:
(4) Atot = A×n = 4,76×106×3,14 = 1,49×107 мкм2 ≈ 0,15 см2
При использовании такой же процедуры для расчета площади, покрытой частицами размером 1 мкм при такой же эффективности осаждения в легких, она была бы следующей:
= 3,84×107×0,78 = 2,99×107 мкм2 ≈ 0,30 см2
Фракционирование дозы в более мелких частицах с половинным геометрическим диаметром предыдущих частиц увеличивает приблизительно в 8 раз количество частиц, доставленных в участвующую во вдыхании область, но привело бы к покрытию площади легких, которая лишь удвоена.
Если теперь рассмотреть случай частиц сухого порошка, полученных составлением активного препарата и наполнителя обычной методикой, подобной распылительной сушке, при которой средство представляет лишь 1% всей массы частицы, то это бы означало, что была бы доставлена доза препарата 100 мкг в дозе 10 мг порошка.
Если еще учитывать монодисперсные сферические частицы с dg (геометрическим диаметром) = 2 мкм, то количество n частиц было бы рассчитано в соответствии с уравнением (1) и оно равнялось бы 2,38×109 частицам и 1,92×1010 частицам в случае dg = 1.
В обоих случаях, если эффективность отложения остается равной 20%. То такая же вдыхаемая доза покроет площадь поверхности, в 100 раз большую, чем та, которая расчитана в соответствии с уравнением (4)
или: = 4,76×108×3,14 = 1,49×109 мкм2 ≈ 15 см2
и = 3,84×109×0,78 = 2,99×109 мкм2 ≈ 30 см2
Манипуляции разведения препарата внутри матрицы наполнительа с 1% при загрузке до 0,1% или ниже и увеличение возможности вдыхания порошка с 20% до достигаемых уровней 50% или даже 70% ведут к площадям осаждения 750 см2 (dg = 1 мкм; загрузка препарата 0,1%; вдыхаемая фракция дозы 50%). Такая площадь осаждения ведет к более прогнозируемым эффектам и лучшему контролю при лечении.
При учете того, что очень трудно достичь идеального уменьшения размера частиц до уровня менее чем 1 мкм, особенно для частиц сухого порошка, дисперсия препарата в матрице наполнителя представляет целесообразный подход, который также оптимизирует осаждение в легких и взаимодействия между частицами. Активный препарат может быть диспергирован в предварительно созданной методами инженерии матрице наполнителя с желательными характеристиками, в которой активный средство не вызывает какого-либо потенциально отрицательного эффекта.
Было обнаружено, что представляющий интерес технологический подход разведения препарата внутри матрицы наполнителя с тем, чтобы образовать сухую частицу для ингаляции можно лучше использовать с определенными конкретными типами композиций для ингаляции.
Если рассматривать дозу 100 мкг препарата, то ее можно включить в композицию в соответствии с 3 различными технологическими подходами. Которые ведут к получению частиц сухого порошка с теоретическим аэродинамическим диаметром 2 мкм.
- Плотные частицы (теоретическая плотность примерно 1 г/см3).
- Низкоплотные частицы (теоретическая плотность примерно <0,1 г/см3).
- Частицы промежуточной плотности (теоретическая плотность от 0,1 до 1 г/см3).
С учетом формулы, которая коррелирует геометрический диаметр (dg) и аэродинамический диаметр (dae) по их плотности (с)
характеристики частиц, представленные в таблице ниже в настоящем документе, представляют собой иллюстративные примеры плотных, низкоплотных и промежуточных сухих частиц:
В случае композиций типов В и С, полученных распылительной сушкой, начиная при нагрузке препарата в композиции 0,4%, доставляемая доза порошка соответствует 25 мг. Если порошковая композиция состоит из монодисперсных частиц со сферической морфологией, соответствующей dg, представленному в таблице выше, то можно рассчитать количество частиц, на которые подразделяется доза порошка, используя параметр плотности, представленный в таблице.
г/см3
Допуская, что целесообразная эффективность отложения в легочном участке-мишени составляет примерно 50%, можно рассчитать теоретическое количество частиц, доставленных к мишени, и соответствующую площадь поверхности осаждения в соответствии с уравнениями (3) и (4).
Расчет показывает, что в теоретических условиях разведение препарата внутри матрицы наполнителя может иметь преимущество, поскольку оно приводит к увеличению площади осаждения, достигаемой препаратом.
Интересно также отметить, что при этом расчете имитация сухих порошков с промежуточной и низкой плотностью приводит к эквивалентной величине площади осаждения, таким образом, указывая на то, что любой из двух технологических подходов возможен с терапевтической точки зрения.
В целом, применение разбавленных ингаляционных композиций предпочтительно в случае местного и системного лечения через легкие.
В случае местного лечения, подобного лечению бронхолитиками, важно отметить, что эти препараты действительно имеют высокую активность, т.е. их терапевтическая доза иногда составляет порядка лишь нескольких микрограммов, что имеет место для формотерола (однократная доза 12 мкг) или кармотерола (однократная доза 1 мкг). Мишень для этих препаратов представлена бронхиальной областью, состоящей из гладкомышечных клеток. В литературе сообщается, что, по подсчетам, концентрация в2 рецепторов (мишени для бронхолитических препаратов) на одиночной гладкомышечной клетке составляет порядка от 30 до 40000 рецепторов на клетку. Ясно, что такое повышенное количество мишеней очень хорошо маскирует неэффективность современных ингаляционных композиций. Увеличение эффективности осаждения в легких, выраженное в переводе на количество доставленного препарата, а также покрытой площади поверхности, может привести к более эффективному использованию бронхолитиков при дозах препаратов, значительно более низких, чем дозы, используемые в настоящее время.
Ясно, что аналогичный подход с разведением можно также использовать в случае легочного введения в альвеолярную область, как в случае противовоспалительного кортикостероида или в случае системных способов лечения. В этом случае эталонная точка представлена количеством альвеол, присутствующих в легких, которое, по измерению составляет примерно 480 миллионов (в интервале от 274 до 790 миллионов), таким образом, сравнимое с введением разбавленной композиции сухого порошка.
Если считать сравнение композиций низкоплотного и промежуточного сухого порошка идеальными композициями для доставки в легкие, то очень важно принимать во внимание то, что использование сухих порошков с низкой плотностью, как в этих двух случаях, в целом требует использования ингаляторов одиночной дозы, подобных Aerolizer® или Turbospin®.
В случае Aerolizer®, в устройстве используется желатиновая капсула размера #3 с внутренним объемом 0,3 мл.
Аналогичным образом, в случае Turbospin®, используемая желатиновая капсула имеет размер #2 с внутренним объемом 0,37 мл.
В целом, рекомендуется заполнять только до 50% внутреннего имеющегося объема желатиновых капсул, предназначенного для ингаляции.
Таким образом, использование композиций с очень низкой плотностью представляет важный ограничивающий фактор, когда эти порошки, как описано Tarara et al (заявка на патент США US 2005/0074498A1), представляют наиболее предпочтительные величины объемной плотности ниже, чем 0,05 г/см3.
В случае очень низкоплотного сухого порошка с насыпной плотностью 0,04 г/см3, как описано выше для иллюстрации композиций из низкоплотных частиц, в желатиновые капсулы размера #3 и #2 можно было бы заполнить лишь 6 и 7,4 мг. Это представляет серьезный ограничивающий фактор, поскольку в случае недостаточного объема заполнения в капсулу, когда нужно доставить большое количество средствоов, нужно было бы выполнять множественные введения.
Интересно, что авторы предшествующих литературных источников никогда не оценивали и насыпную, и утрамбованную плотность их ингаляционных порошков, но игнорировали одну или другую в своей работе.
Tarara et al. (заявка на патент США US 2005/0074498A1) указали насыпную плотность как релевантный параметр для низкоплотных сухих порошков для ингаляции с предпочтительной насыпной плотностью менее, чем 0,1 г/см3.
С другой стороны, Edwards et al (патент США № 5874064) указали утрамбованную плотность как основной параметр для своих аэродинамических низкоплотных порошков и установили ее предел на 0,4 г/см3.
Pilcer et al (Pharm. Res. Vol. 23. No. 5, May 2006, pp. 931-940) получили композиции сухого порошка распылительной сушкой, начиная с жидкой суспензии микронизированного препарата, который покрыт липидами, для увеличения текучести порошка и превращения в аэрозоль.
Композиции, представленные Pilcer, проявляют величины насыпной плотности (db) и утрамбованной плотности (dt), соотношение которых (db/dt) составляет от 0,64 до 0,73, что не очень далеко от композиции чистого активного препарата, подвергнутого распылительной сушке (0,76). На основании методики получения, эти порошки привели к внутренне плотной структуре и не проявляют существенных свойств возможности уплотнения, на что указывают высокие величины db/dt.
Заявители обнаружили, что альтернативно возможно получение частиц сухого порошка с маленьким размером частиц (Х50 <5 мкм) при db, находящейся в интервале 0,1-0,3 г/см3, и dt - в интервале 0,15-0,7 г/см3, и характеризуемых соотношениями db/dt, находящимися в интервале 0,2-0,65, и со свойством способности распределяться в больших массах в небольших объемах, при этом сохраняя их аэродинамические свойства.
Объемную плотность (db) насыпного порошка можно определить в соответствии с Европейской фармакопеей (Ph. Eur) измерением объема известной массы порошка, которую пропустили через сито в градуированный цилиндр.
Аналогичным образом, в Европейской фармакопее указано, что утрамбованная плотность (dt) насыпного порошка достигается механическим постукиванием мерного цилиндра, содержащего образец порошка. После наблюдения исходного объема, цилиндр механически обстукивают, и регистрируют величину объема до тех пор, пока наблюдается дальнейшее изменение объема.
На основании объясненного выше рассуждения, в случае специфических композиций, в которых активный препарат был разведен внутри матрицы наполнителя, как в случае высушенных распылением частиц, можно рассчитать количество частиц, которые способны достичь глубоких отделов легких (диаметром <5,0 мкм).
Этот расчет возможен при знании определенных факторов:
- Диаметр частицы
- Плотность частицы
- Фракция мелких частиц
- Фактор разведения препарата в порошке, выраженный в виде отношения массы порошка, деленной на массу активного препарата в порошке
Целесообразно ожидать, что дозировки препарата в интервале, начиная менее чем с 0,1 мкг до 100 мкг, будут разведены до точки, где доза порошка находится в пределах интервала 0,5-50 мг.
Аналогичным образом, доза активного компонента в интервале 100 мкг - 1 мг будет превращена в дозу порошка в интервале 1,18-50 мг.
Доза активного компонента в интервале 1-10 мг будет превращена в дозу порошка в интервале 11,8-50 мг.
Доза активного компонента в интервале 10-100 мг будет превращена в дозу порошка в интервале 118-500 мг.
Доза активного компонента в интервале 100 мг - 1,0 г будет превращена в дозу порошка в интервале 1,18 г - 5,0 г.
Допуская, что полученные порошки будут иметь диаметр частиц в интервале 0,1 мкм - 5,0 мкм, фракцию мелких частиц (FPF<5,0 мкм) от 35% до 80% исходной дозы, и что плотность порошка после уплотнения постукиванием (dt - эквивалентная, объемная плотность частицы) находится в пределах интервала 0,15-0,70 г/см3, можно рассчитать, используя уравнения (1) и (2), количество частиц в данной дозе порошка ее умножением на FPF, интервал доз мелких частиц для каждой средствоивной формы, не в переводе на массу осажденного средствоа, как в обычном способе, но в переводе на количество частиц, как представлено в следующей таблице:
(г/см3)
Теперь изобретение будет проиллюстрировано со ссылкой на следующие не ограничивающие примеры.
ПРИМЕРЫ
Получение твердой сухой композиции
действую-щее начало
(мкм)
db
(г/см3)
dt
(г/см3)
Формотерола фумарат 0,05%
Лактоза 96,95%
Твин 80 2%
Формотерола фумарат 0,05%
Лактоза 96,95%
Твин 80 2%
Лактоза 99,0%
Твин 80 0,7%
Лактоза 98,0%
Твин 80 1,4%
Твин 80 0,07%
Лактоза 99,9%
Твин 20 1,0%
Span 20 0,2%
NaCl 11,25%
Лактоза 87,05%
Твин 80 2,0%
Лактоза 97,0%
Сальбутамола сульфат 2,5%
Твин 80 2,0%
Лактоза 94,5%
Твин 20 1,0%
Span 20 0,2%
NaCl 11,25%
Лактоза 85,85%
Твин 80 2,0%
Лактоза 95,5%
Твин 80 9,6%
Лактоза 42,3%
Твин 20 1,0%
Span 20 0,2%
NaCl 11,25%
Лактоза 87,05%
Твин 80 2,0%
Лактоза 97,0%
Твин 80 2,0%
Мальтодекстрин 97,0%
Твин 80 0,5%
L-лейцин 10%
Лактоза 87,5%
Твин 80 0,5%
L-лейцин 10%
Лактоза 88,5%
Твин 80 0,5%
L-лейцин 15%
Лактоза 84,42
Твин 80 0,5%
L-лейцин 30%
Лактоза 69,42%
Твин 80 0,5%
L-лейцин 10%
Лактоза 79,5%
Твин 80 0,5%
L-лейцин 10%
Лактоза 86%
Твин 80 0,5%
L-лейцин 15%
Лактоза 34,5%
Твин 80 0,4%
L-лейцин 15%
Лактоза 44,6%
Твин 80 0,4%
L-лейцин 30%
Лактоза 29,6%
Твин 80 0,5%
L-лейцин 15%
Лактоза 64,5%
L-лейцин 20,0%
Твин 80 0,8%
L-лейцин 15,0%
Твин 80 0,9%
Композиции примера 14, 18, 21, 22, 24, 25, 26 были охарактеризованы морфологически. Они изготовлены из частиц по существу сферической формы и эндогенной полой морфологией, как показано на фиг.1-7, которые представляют собой изображения сухого порошка при различных увеличениях.
Форметерола фумарат
Форметерола фумарат 0,0375
Лактоза 72,71
Твин 80 1,5
Концентрация твердых веществ: 5% масс/об
Температура распыления: 120°C
Поток подачи:
3 мл/мин
Диаметр сопла:
0,5 мм
Высушенный объем: 1500 мл
Форметерола фумарат
Форметерола фумарат 0,0125
Лактоза 24,24
Твин 80 0,5
Концентрация твердых веществ: 5% масс/об
Температура распыления: 120°C
Поток подачи:
3 мл/мин
Диаметр сопла:
0,5 мм
Высушенный объем: 1500 мл
Лактоза 24,75
Концентрация
Температура распыления:
130°C
Поток подачи:
3 мл/мин
Диаметр сопла:
0,5 мм
Высушенный объем: 500 мл
Лактоза 24,5
Твин 80 0,35
Концентрация твердых веществ: 5% масс/об
Температура распыления: 130°C
Поток подачи:
3 мл/мин
Диаметр сопла:
0,5 мм
Высушенный объем: 500 мл
Лактоза 49,95
Твин 80 0,035
Концентрация твердых веществ: 5% масс/об
Температура распыления: 120°C
Поток подачи:
3 мл/мин
Диаметр сопла:
0,5 мм
Высушенный объем: 1000 мл
Лактоза 8,705
NaCl 1,125
Твин 20 0,1
Span 20 0,02
Концентрация твердых веществ: 1% масс/об
Температура распыления: 130°C
Поток подачи:
5 мл/мин
Диаметр сопла:
0,5 мм
Высушенный объем: 1000 мл
Лактоза 48,5
Твин 80 1
Концентрация твердых веществ: 5% масс/об
Температура распыления: 120°C
Поток подачи:
3 мл/мин
Диаметр сопла:
0,5 мм
Высушенный объем: 1000 мл
Сальбутамол сульфат
Сальбутамол сульфат 1,25
Лактоза 47,25
Твин 80 1
Концентрация твердых
веществ: 5% масс/об
Температура распыления: 120°C
Поток подачи:
3 мл/мин
Диаметр сопла:
0,5 мм
Сальбутамол сульфат
Сальбутамол сульфат 0,12
Лактоза 8,855
NaCl 1,125
Твин 20 0,1
Span 20 0,02
30/70
Концентрация твердых веществ: 1% масс/об
Температура распыления: 130°C
Поток подачи:
5 мл/мин
Диаметр сопла:
0,5 мм
Высушенный объем: 1000 мл
Лактоза 23,875
Твин 80 0,5
Концентрация твердых веществ: 5% масс/об
Температура распыления: 130°C
Поток подачи:
3 мл/мин
Диаметр сопла:
0,5 мм
Высушенный объем: 500 мл
Лактоза 2,115
Твин 80 0,48
Концентрация твердых веществ: 1% масс/об
Температура распыления: 130°C
Поток подачи:
3 мл/мин
Диаметр сопла:
1 мм
Высушенный объем: 500 мл
Span 20 0,02
Твин 20 0,1
NaCl 1,125
Лактоза 8,705
Концентрация твердых веществ: 1% масс/об
Температура распыления: 130°C
Поток подачи:
4 мл/мин
Диаметр сопла:
0,5 мм
Высушенный объем: 1000 мл
Твин 80 0,5
Лактоза 24,25
Концентрация твердых веществ: 5%
Температура распыления: 130°C
Поток подачи:
3 мл/мин
Диаметр сопла:
0,5 мм
Высушенный объем: 500 мл
Твин 80 0,5
Лактоза 24,25
Концентрация твердых веществ: 5%
Температура распыления: 130°C
Поток подачи:
3 мл/мин
Диаметр сопла:
0,5 мм
Высушенный объем: 500 мл
Твин 80 0,075
L-лейцин 1,5
Лактоза 13,125
Концентрация твердых веществ: 5%
Температура распыления: 130°C
Поток подачи:
3 мл/мин
Диаметр сопла:
0,5 мм
Высушенный объем: 300 мл
Твин 80 0,075
L-лейцин 1,5
Лактоза 13,275
Концентрация твердых веществ: 5%
Температура распыления: 130°C
Поток подачи:
3 мл/мин
Диаметр сопла:
0,5 мм
Высушенный объем: 300 мл
Твин 80 0,075
L-лейцин 2,25
Лактоза 12,663
Концентрация твердых веществ: 3%
Температура распыления: 130°C
Поток подачи:
2 мл/мин
Диаметр сопла:
0,5 мм
Высушенный объем: 500 мл
Твин 80 0,075
L-лейцин 4,5
Лактоза 10,413
Концентрация твердых веществ: 3%
Температура распыления: 130°C
Поток подачи:
2 мл/мин
Диаметр сопла:
0,5 мм
Высушенный объем: 500 мл
Твин 80 0,075
L-лейцин 1,5
Лактоза 11,93
вода + HCl + NaOH до растворения инсулина
Концентрация твердых веществ: 3%
Температура распыления:
130°C
Поток подачи:
3 мл/мин
Диаметр сопла:
1 мм
Высушенный объем: 500 мл
Твин 80 0,075
L-лейцин 1,5
Лактоза 12,9
вода + HCl + NaOH до растворения инсулина
Концентрация твердых веществ: 3%
Температура распыления: 130°C
Поток подачи:
3 мл/мин
Диаметр сопла:
1 мм
Высушенный объем: 500 мл
Tween 80 0,075
L-лейцин 2,25
Лактоза 5,175
Концентрация твердых веществ: 3
Температура распыления: 130°C
Поток подачи:
3 мл/мин
Диаметр сопла:
0,5 мм
Высушенный объем: 500 мл
Твин 80 0,06
L-лейцин 2,25
Лактоза 6,69
Концентрация твердых веществ: 3%
Температура распыления: 130°C
Поток подачи:
3 мл/мин
Диаметр сопла:
0,5 мм
Высушенный объем: 500 мл
Твин 80 0,060
L-лейцин 4,5
Лактоза 4,44
Концентрация твердых веществ: 3%
Температура распыления: 130°C
Поток подачи:
3 мл/мин
Диаметр сопла:
0,5 мм
Высушенный объем: 500 мл
Твин 80 0,075
L-лейцин 2,25
Лактоза 9,675
Концентрация твердых веществ: 3%
Температура распыления: 130°C
Поток подачи:
3 мл/мин
Диаметр сопла:
0,5 мм
Высушенный объем: 500 мл
L-лейцин 1,8
Твин 80 0,072
Концентрация твердых веществ: 3%
Температура распыления: 130°C
Поток подачи:
3 мл/мин
Диаметр сопла:
0,5 мм
Высушенный объем: 300 мл
L-лейцин 1,35
Твин 80 0,081
Концентрация твердых веществ: 3%
Температура распыления: 130°C
Поток подачи:
3 мл/мин
Диаметр сопла:
0,5 мм
Высушенный объем: 300 мл
Демонстрация общего улучшения легочного осаждения
Для выполнения теста использовали многостадийный жидкостный импинжер, работающий при скорости потока 30 л/мин.
Порошок в количестве 100 мг растворяли/диспергировали в 2 мл дистиллированной воды, как в примерах 1, 2, 5, 7, 8, 11, 13 и 14, или количество 160 мг растворяли или диспергировали в 2 мл, как в примерах 6, 9 и 12, тогда как в примере 10, 125 мг порошка растворяли в 2 мл дистиллированной воды.
Полученный раствор/суспензию переносили в ампулу С распылителя, и распылитель подсоединяли к многостадийному жидкостному импинжеру. После запуска вакуумного насоса, подсоединенного к многостадийному жидкостному импинжеру, распылитель приводили в действие на общий период времени 5 мин. Наконец, распылитель выключали, затем выключали вакуумный насос. Через 30 мин многостадийный жидкостный импинжер разбирали, и количество активного ингредиента, растворенное в каждой стадии, измеряли посредством подходящих хроматографических условий.
Важно отметить, что по тестам, выполненным in vitro или MSLI (многостадийным жидкостным импинжером), или каскадным инерционным сепаратором Andersen, величина MMAD (среднемассового аэродинамического диаметра) не дает никакой информации о типе осаждения распыленного продукта, доставляемого из распылителя.
MMAD представляет собой медианный диаметр, который только указывает положение 50% распределения по размеру капелек, испускаемых импинжером, но не представляет действительного измерения размера подаваемых частиц, поскольку в случае распылителя можно всегда увеличить время доставки и, следовательно, доставленное количество до глубоких стадий (4 и 5), следовательно приводя к сниженной величине MMAD.
По этой причине, характеристику доставленных композиций необходимо проводить, непосредственно измеряя размер распыленных капелек.
Кроме того, необходимо отметить, что тест In vitro, посредством MMAD дает показатель признаков распыленного продукта без учета количества доставленного препарата и поэтому действительно активной дозы, которая достигает легочной мишени (в данном случае <5,0 мкм).
Поэтому можно было определить активную дозу средствоа (A.F. или активную фракцию) посредством формулы:
A.F. = (D.F. × F.P.F.)/100,
Где:
A.F. = Активная фракция или фракция в %, действительно действующая на участок-мишень
D.F. = Доставленная фракция или фракция в %, доставленная из распылителя
F.P.F. = Фракция мелких частиц или фракция в % доставленного количества, которое действует в участке-мишени.
Этот расчет позволяет найти существенные различия между количеством препарата, действительно доставляемым к участку-мишени, и количеством в распылителе, которое во всех этих случаях было одинаковым.
Видно, что доставленное количество, когда в композицию включены лактоза и поверхностно-активное вещество, часто вдвое больше количества в композиции без лактозы/поверхностно-активного вещества и с солями.
Такой эффект неизбежно вызван комбинированным воздействием увеличения подаваемого количества и уменьшением размера частиц подаваемого продукта. Результаты показаны в табл.3.
D
(мкм)
AF=(DF ×
FPF)/100
(%)
Go
Для выполнения теста использовали Многостадийный жидкостный импинжер, как описано в Европейской Фармакопее, работающий при скорости потока 60 л/мин.
Вариабельное количество порошка в интервале от 15 до 25 мг помещали в желатиновые капсулы размера #3, как в примерах 15-26.
Одну капсулу переносили в ингаляционное устройство сухого порошка Aerolizer®, и устройство подсоединяли к Многостадийному жидкостному импинжеру. Капсулу прокалывали и подавали вакуум через Многостадийный жидкостный импинжер для обеспечения воздушного потока через устройство 60 л/мин в течение 4 с. Эти операции повторяли с 5-10 капсулами для превращения в аэрозоль достаточного количества порошка в устройстве для аналитического выявления. После того как содержимое последней капсулы было превращено в аэрозоль посредством устройства, Многостадийный жидкостный импинжер выключали, по меньшей мере, на 30 мин. В последующем Многостадийный жидкостный импинжер разбирали. И количество активного ингредиента, растворенного на каждой стадии, измеряли посредством подходящих хроматографических условий.
Способом, аналогичным описанному для распыленных композиций, можно было определить активную дозу препарата (A.F. Или Активную фракцию) по формуле:
A.F. = (D.F. × F.P.F.)/100,
Где:
A.F. = Активная фракция или фракция в %, действительно действующая на участок-мишень
D.F. = Доставленная фракция или фракция в %, доставленная из распылителя
F.P.F. = Фракция мелких частиц или фракция в % доставленного количества, которое действует в участке-мишени. Результаты показаны ниже в таблице 4.
D
(мкм)
AF=(DF ×
FPF)*100
(%)
Композиция справочных примеров, не в соответствии с изобретением:
Справ. А: имеющийся в продаже продукт Clenil A (Chiesi), подлежащая распылению суспензия BDP 0,8 мг/мл, содержащая Твин 20, 1 мг/мл; Span 20, 0,2 мг/мл; NaCl 4,2 мг/мл и очищенную воду, испытан распылителем Clenny® Medel.
Справ. B: ингаляционная суспензия BDP 0,8 мг/мл, содержащая Твин 20, 1 мг/мл; Span 20, 0,2 мг/мл; Na Cl 4,2 мг/мл; Na2HPO4 7,24 мг/мл; KH2PO4 3,54 мг/мл, испытана распылителем Clenny® Medel.
Справ. С: имеющийся в продаже продукт Pulmaxan (Astra Zeneca), подлежащая распылению суспензия будезонида 1,0 мг/2 мл, содержащая Твин 80, 0,2 мг/мл; EDTA (этилендиаминтетрауксусную кислоту) 0,1 мг/мл; NaCl 8,5 мг/мл; безводную лимонную кислоту 0,28 мг/мл; цитрат натрия 0,5 мг/мл и очищенную воду, испытан распылителем Clenny® Medel.
Справ. D: не имеющаяся в продаже ингаляционная суспензия будезонида 1,0 мг/2 мл, содержащая Твин 80, 0,2 мг/мл; EDTA 0,1 мг/мл; NaCl 8,5 мг/мл; безводную лимонную кислоту 0,28 мг/мл; цитрат натрия 0,5 мг/мл; метилпарабен 1,35 мг/мл; пропилпарабен 0,15 мг/мл и очищенную воду, испытан распылителем Clenny® Medel.
Справ. E: водный раствор формотерола фумарата 24 мкг/2 мл, содержащий Твин 80, 1 мг/мл, испытанный распылителем Clenny® Medel.
Справ. F: водный раствор формотерола фумарата, лактозы и Твин 80, 1 мг/мл, имеющий такую же композицию как в примере 5, и испытанный распылителем Clenny® Medel.
Справ. G: имеющийся в продаже продукт Broncovaleas (Valeas), подлежащая распылению водный раствор с сальбутамолом сульфатом в воде с тем, чтобы иметь конечную концентрацию 200 мкг/2 мл, испытан распылителем Clenny® Medel.
Справ. H: имеющийся в продаже продукт Clenil A (Chiesi), подлежащая распылению суспензия BDP 0,8 мг/мл, содержащая Твин 20, 1 мг/мл; Span 20, 0,2 мг/мл; NaCl 4,2 мг/мл и очищенную воду, испытан распылителем MicroAir® Orion.
Справ. I: имеющийся в продаже продукт Pulmaxan (Astra Zeneca), подлежащая распылению суспензия будезонида 1,0 мг/2 мл, содержащая Твин 80, 0,2 мг/мл; EDTA 0,1 мг/мл; NaCl 8,5 мг/мл; безводную лимонную кислоту 0,28 мг/мл; цитрат натрия 0,5 мг/мл и очищенную воду, испытан распылителем MicroAir® Orion.
Справ. J: не имеющаяся в продаже ингаляционная суспензия сальбутамола 2,5 мг/2 мл, содержащая Твин 80 1 мг/мл и лактозу 4,77 мг/мл.
Справ. K: имеющийся в продаже продукт Miflonide® (Novartis), ингаляционный порошок будезонида 400 мкг/ц/с.
Справ. L: имеющийся в продаже продукт Foradil® (Novartis), ингаляционный порошок формотерола фумарата 12 мкг/ц/с.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИНГАЛЯЦИОННАЯ ПРЕПАРАТИВНАЯ ФОРМА, СОДЕРЖАЩАЯ ПРОСТОЙ СУЛЬФОАЛКИЛОВЫЙ ЭФИР ГАММА-ЦИКЛОДЕКСТРИНА И КОРТИКОСТЕРОИД | 2004 |
|
RU2390330C2 |
| НАПРАВЛЕННАЯ ДОСТАВКА ВЫСУШЕННЫХ РАСПЫЛЕНИЕМ КОМПОЗИЦИЙ В ЛЕГКИЕ | 2016 |
|
RU2731212C2 |
| РАПАМИЦИН ДЛЯ ЛЕЧЕНИЯ ЛИМФАНГИОЛЕЙОМИОМАТОЗА | 2014 |
|
RU2707285C2 |
| МИКРОЧАСТИЦЫ, СОДЕРЖАЩИЕ СЕРОСОДЕРЖАЩИЕ СОЕДИНЕНИЯ | 2017 |
|
RU2780397C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ГРИБКОВЫХ ИНФЕКЦИЙ | 2019 |
|
RU2820457C2 |
| СУХИЕ ПОРОШКОВЫЕ КОМПОЗИЦИИ В ВИДЕ ЧАСТИЦ, КОТОРЫЕ СОДЕРЖАТ ДВА ИЛИ БОЛЕЕ АКТИВНЫХ ИНГРЕДИЕНТА, ДЛЯ ЛЕЧЕНИЯ ОБСТРУКТИВНЫХ ИЛИ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ ДЫХАТЕЛЬНЫХ ПУТЕЙ | 2012 |
|
RU2629333C2 |
| АЭРОЗОЛЬНЫЕ ФТОРХИНОЛОНЫ И ИХ ПРИМЕНЕНИЯ | 2006 |
|
RU2428986C2 |
| АЭРОЗОЛЬНЫЕ ФТОРХИНОЛОНЫ И ИХ ПРИМЕНЕНИЯ | 2006 |
|
RU2603638C2 |
| РАСТВОРЫ НА ОСНОВЕ МЕЛАТОНИНА И ПОРОШКИ ДЛЯ ИХ ПОЛУЧЕНИЯ | 2012 |
|
RU2646802C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 2004 |
|
RU2363448C2 |







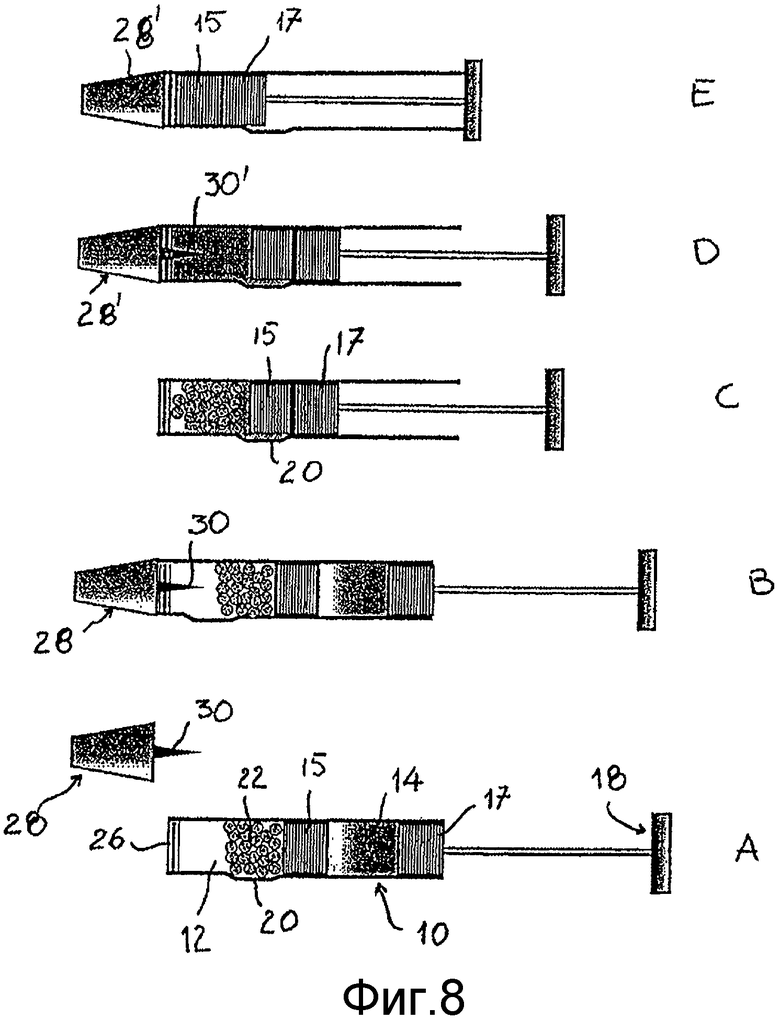
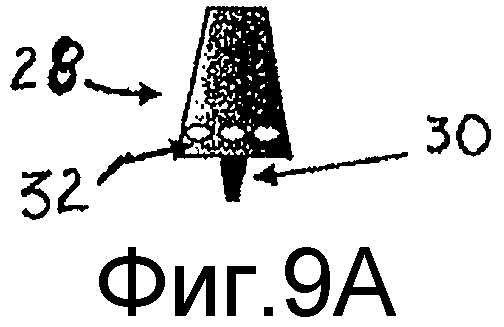
Группа изобретений относится к медицине и касается ингаляционной фармацевтической композиции, включающей лекарственное средство, растворимый наполнитель, поверхностно-активное вещество и гидрофобное вещество для снижения чувствительности к влаге, представляющее собой лейцин; способа получения указанной композиции; набора для введения лекарственного средства в виде водной дисперсии, включающего дозированное количество указанной композиции. Группа изобретений обеспечивает неожиданное увеличение обеих из активной фракции и фракции мелких частиц. 4 н. и 35 з.п. ф-лы, 1 пр., 10 ил., 5 табл.
1. Ингаляционная фармацевтическая композиция, включающая лекарственное средство, растворимый наполнитель, имеющий растворимость в воде больше 5 г/л, поверхностно-активное вещество и гидрофобное вещество для снижения чувствительности к влаге, отличающаяся тем, что:
указанный растворимый наполнитель присутствует в количестве между 10% и менее чем 100 мас.%;
массовое соотношение между указанным поверхностно-активным веществом и указанным лекарственным средством составляет от 0,01 до 10;
размер частиц, по меньшей мере, 50% частиц указанного порошка составляет менее 5 мкм;
объемная плотность db указанного порошка составляет от 0,1 до 0,3 г/см3;
плотность после уплотнения dt указанного порошка составляет от 0,15 до 0,7 г/см3;
отношение db/dt составляет от 0,2 до 0,65,
где указанное гидрофобное вещество представляет собой лейцин,
где указанные наполнитель и указанное поверхностно-активное вещество не включают фосфолипиды.
2. Ингаляционная композиция по п.1, отличающаяся тем, что указанный растворимый наполнитель присутствует в количестве от 40% до 99,9%.
3. Ингаляционная композиция по п.1, отличающаяся тем, что указанное лекарственное средство является гидрофильным.
4. Ингаляционная композиция по п.1, отличающаяся тем, что указанное лекарственное средство представляет собой ассоциацию гидрофильного лекарственного средства и гидрофобного лекарственного средства.
5. Ингаляционная композиция по п.1 или 2, отличающаяся тем, что указанный наполнитель представляет собой сахар.
6. Ингаляционная композиция по п.5, отличающаяся тем, что указанный сахар представляет собой лактозу.
7. Ингаляционная композиция по любому из пп.1 или 2, отличающаяся тем, что указанный наполнитель представляет собой аминокислоту.
8. Ингаляционная композиция по п.7, отличающаяся тем, что указанная аминокислота выбрана из группы, состоящей из N-ацетилцистеина и карбоцистеина.
9. Ингаляционная композиция по любому из пп.1 или 2, отличающаяся тем, что указанное массовое отношение между указанным поверхностно-активным веществом и указанным лекарственным средством составляет от 0,2 до 7.
10. Ингаляционная композиция по п.9, отличающаяся тем, что указанное массовое отношение между указанным поверхностно-активным веществом и указанным лекарственным средством составляет от 0,5 до 3.
11. Ингаляционная композиция по п.9, отличающаяся тем, что она включает частицы примерно сферической формы и внутренне полые.
12. Ингаляционная композиция по п.1, отличающаяся тем, что указанное лекарственное средство выбрано из класса β2 агонистов и стероидов.
13. Ингаляционная композиция по п.12, отличающаяся тем, что указанное лекарственное средство выбрано из группы, состоящей из сальбутамола, салметерола, формотерола, фенотерола, беклометазона, будезонида, флутиказона и их фармацевтически приемлемых производных.
14. Композиция лекарственного средства в жидкой среде, получаемая диспергированием ингаляционной фармацевтической композиции по п.1.
15. Композиция по п.14, отличающаяся тем, что указанное лекарственное средство суспендировано в указанной жидкой среде.
16. Композиция по п.14, отличающаяся тем, что указанное лекарственное средство растворено в указанной жидкой среде.
17. Композиция по пп.14-16 для ингаляционного введения.
18. Способ получения ингаляционной композиции лекарственного средства по п.1, в котором:
указанный растворимый наполнитель присутствует в количестве между 10% и менее чем 100 мас.%;
массовое соотношение между указанным поверхностно-активным веществом и указанным лекарственным средством составляет от 0,01 до 10;
размер частиц, по меньшей мере, 50% частиц указанного порошка составляет менее 5 мкм;
объемная плотность db указанного порошка составляет от 0,1 до 0,3 г/см3;
плотность после уплотнения dt указанного порошка составляет от 0,15 до 0,7 г/см3;
отношение db/dt составляет от 0,2 до 0,65,
где указанное гидрофобное вещество представляет собой лейцин,
отличающийся тем, что он включает стадии:
a) получения первой фазы (A), в которой активный ингредиент представляет собой соответствующую жидкую среду;
b) получения второй фазы (B), в которой растворимые наполнители растворяются, включая добавление гидрофобного вещества представляющего собой лейцин и поверхностно-активные вещества растворяются в водной среде;
c) смешивания указанных фаз (A) и (B) для получения третьей фазы (C), состоящей из однородной жидкой среды;
d) сушки указанной фазы (C) в регулируемых условиях для получения сухого порошка со средним размером частиц менее чем 15 мкм;
e) сбора указанного сухого порошка и хранения его соответствующим образом для получения суспензии непосредственно перед применением.
19. Способ получения ингаляционной композиции лекарственного средства по п.18, отличающийся тем, что указанная фаза (A) может представлять собой или суспензию, или раствор активного ингредиента в соответствующей жидкой среде.
20. Способ по п.18, отличающийся тем, что указанная фаза (A) представляет собой раствор.
21. Способ по п.20, отличающийся тем, что указанный раствор представляет собой раствор в органическом растворителе, выбранном среди растворителей, смешиваемых с водой.
22. Способ по п.18, отличающийся тем, что указанная стадия d) включает удаление жидкой среды, растворителя или диспергирующего агента из фазы (C) распылительной сушкой.
23. Способ по п.18, отличающийся тем, что общее количество лекарственного средства, наполнителя и поверхностно-активного вещества в указанной фазе (C) составляет от 1 до 5% мас./об.
24. Способ по п.23, отличающийся тем, что общее количество лекарственного средства, наполнителя и поверхностно-активного вещества в указанной фазе (C) составляет от 3 до 5% мас./об.
25. Набор для введения лекарственного средства в виде водной дисперсии, включающий дозированное количество композиции по любому из пп.1-15 и дозированное количество жидкой среды в виде растворителя или диспергирующей среды.
26. Набор, включающий устройство доставки, по п.25, отличающийся тем, что трубка (10) имеет среднюю часть с увеличенным диаметром, нижний уплотнитель (17), скользящий при наружной манипуляции, и средний уплотнитель (15), также скользящий в указанной трубке, причем указанная трубка закрыта уплотнителем (26), который можно проколоть мундштуком (28, 28'), снабженным прокалывающим штырем (30), посредством чего порошок или дисперсия, или раствор порошка в жидкой среде доставляется и вводится пациенту.
27. Набор по п.26, где указанный мундштук для доставки указанного ингаляционного порошка снабжен набором отверстий (32) для впуска воздуха.
28. Ингаляционная фармацевтическая композиция по п.1, отличающаяся тем, что указанное лекарственное средство разводится внутри указанного наполнителя в соответствии с фактором разведения, определенным как соотношение между массой порошка и массой содержащегося активного лекарственного средства, в пределах от 1,18 до 500000, где доза мелких частиц менее чем 5,0 мкм, выраженная в виде количества частиц, составляет от 3,8·106 до 5,1·1013.
29. Ингаляционная фармацевтическая композиция по п.28, отличающаяся тем, что доза активного лекарственного средства в интервале 0,1-1 мкг, разведенная в наполнителе в соответствии с фактором разведения в пределах от 5000 до 500000, где доза мелких частиц менее чем 5,0 мкм, выраженная в виде количества частиц, составляет от 3,8·106 до 5,1·1011.
30. Ингаляционная фармацевтическая композиция по п.28, отличающаяся тем, что доза активного лекарственного средства в интервале 1-10 мкг, разведенная в наполнителе в соответствии с фактором разведения в пределах от 50 до 50000, где доза мелких частиц менее чем 5,0 мкм, выраженная в виде количества частиц, составляет от 3,8·106 до 5,1·1011.
31. Ингаляционная фармацевтическая композиция по п.28, отличающаяся тем, что доза активного лекарственного средства в интервале 10-100 мкг, разведенная в наполнителе в соответствии с фактором разведения в пределах от 5 до 5000, где доза мелких частиц менее чем 5,0 мкм, выраженная в виде количества частиц, составляет от 3,8·106 до 5,1·1011.
32. Ингаляционная фармацевтическая композиция по п.28, отличающаяся тем, что доза активного лекарственного средства в интервале 100 мкг - 1 мг, разведенная в наполнителе в соответствии с фактором разведения в пределах от 1,18 до 500, где доза мелких частиц менее чем 5,0 мкм, выраженная в виде количества частиц, составляет от 9,0·106 до 5,1·1011.
33. Ингаляционная фармацевтическая композиция по п.28, отличающаяся тем, что доза активного лекарственного средства в интервале 1-10 мг, разведенная в наполнителе в соответствии с фактором разведения в пределах от 1,18 до 50, где доза мелких частиц менее чем 5,0 мкм, выраженная в виде количества частиц, составляет от 9,0·106 до 5,1·1011.
34. Ингаляционная фармацевтическая композиция по п.28, отличающаяся тем, что доза активного лекарственного средства в интервале 10-100 мг, разведенная в наполнителе в соответствии с фактором разведения в пределах от 1,18 до 50, где доза мелких частиц менее чем 5,0 мкм, выраженная в виде количества частиц, составляет от 9,0·108 до 5,1·1012.
35. Ингаляционная фармацевтическая композиция по п.28, отличающаяся тем, что доза активного лекарственного средства в интервале 100 мг - 1 г, разведенная в наполнителе в соответствии с фактором разведения в пределах от 1,18 до 50, где доза мелких частиц менее чем 5,0 мкм, выраженная в виде количества частиц, составляет от 9,0·109 до 5,1·1013.
36. Ингаляционная фармацевтическая композиция по п.5, отличающаяся тем, что она представляет собой жидкую среду для применения в распылителе.
37. Ингаляционная фармацевтическая композиция по п.36, где указанный сахар представляет собой лактозу.
38. Ингаляционная фармацевтическая композиция по п.36, где указанный сахар представляет собой мальтодекстрин.
39. Ингаляционная композиция по п.1, где указанное лекарственное средство выбрано из группы, состоящей из цефлазидима, колистина, тобрамицина и тобрамицина сульфата.
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| N-ЗАМЕЩЕННЫЕ ИНДОЛ-3-ГЛИОКСИЛАМИДЫ И ЛЕКАРСТВЕННЫЙ ПРЕПАРАТ, ОБЛАДАЮЩИЕ ПРОТИВОАСТМАТИЧЕСКИМ, ПРОТИВОАЛЛЕРГИЧЕСКИМ И ИММУНОДЕПРЕССИВНЫМ/ИММУНОМОДУЛЯТОРНЫМ ДЕЙСТВИЕМ, СПОСОБ ПОЛУЧЕНИЯ СОЕДИНЕНИЙ(ВАРИАНТЫ) И СПОСОБ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННОГО ПРЕПАРАТА | 1997 |
|
RU2237661C2 |
| Young PM., et al | |||
| The development of a novel high-dose pressurized aerosol dry-powder device (PADD) for the delivery of pumactant for inhalation therapy | |||
| J Aerosol Med | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
Авторы
Даты
2013-11-10—Публикация
2006-10-20—Подача