Данное изобретение относится к новым соединениям формулы (I), которые ингибируют фермент TAFIa (ингибитор фибринолиза, активируемого активированным тромбином), к способу их получения и к их применению в качестве лекарственных средств.
Фермент TAFIa продуцируется, например, через посредство активации тромбина из ингибитора активируемого тромбином фибринолиза, зимогена (TAFI). Фермент TAFI также относится к прокарбоксипептидазе В, прокарбоксипептидазе U или прокарбоксипептидазе R плазмы крови и представляет собой профермент, подобный карбоксипептидазе В (L. Bajzar, Arterioscler. Thromb. Vasc. Biol., 2000, сс.2511-2518).
Во время образования тромба, тромбин генерируется в виде конечного продукта каскада коагуляции и индуцирует конверсию растворимого фибриногена плазмы крови в нерастворимый фибриновый матрикс. Одновременно, тромбин активирует ингибитор эндогенного фибринолиза TAFI. Активированный TAFI (TAFIa), таким образом, продуцируется во время образования тромба и лизиса из зимогена TAFI через активацию тромбина; тромбомодулин, в комплексе с тромбином, усиливает этот эффект примерно в 1250 раз. TAFIa расщепляет основные аминокислоты на карбоксильном конце фибрина. Потеря лизинов с карбоксильным концом в качестве мест связывания плазминогена затем приводит к ингибированию фибринолиза. Эффективные ингибиторы TAFIa препятствуют потере этих высокоаффинных лизиновых мест связывания плазминогена и, таким образом, способствуют эндогенному фибринолизу плазмином: ингибиторы TAFIa обладают профибринолитическими эффектами.
Для поддержания гомеостаза в крови, выявлены механизмы, приводящие к свертыванию крови и к разрушению тромбов; они находятся в равновесии. Если нарушенное равновесие благоприятствует коагуляции, то фибрин продуцируется в больших количествах, так, что патологические процессы образования тромба могут приводить к тяжелым патологическим состояниям у людей.
Именно подобная чрезмерная коагуляция может приводить к тяжелым патологическим состояниям, вызываемым тромбозом, антитромботическое лечение влечет за собой риск нежелательного кровотечения через посредство нарушения образования необходимой гемостатической закупоривающей массы (пробки). Ингибирование TAFIa усиливает эндогенный фибринолиз, без воздействия на коагуляцию и агрегацию тромбоцитов, то есть, нарушенное равновесие смещается в сторону благоприятствования фибринолизу. Таким образом, возможно как противодействовать образованию клинически релевантных тромбов, так и усиливать лизис ранее существующего тромба. С другой стороны, образование гемостатической пробки не ухудшается, так что, вероятно, не должен ожидаться геморрагический диатез (Bouma и др., J. Thrombosis and Haemostasis, 1, 2003, сс.1566-1574).
Ингибиторы TAFIa ранее были описаны в Международной заявке WO 2005/105781.
Ингибиторы TAFIa согласно данному изобретению пригодны для профилактического и терапевтического использования в случае людей, страдающих от нарушений, связанных с тромбозами, эмболиями, гиперкоагулируемостью или фиброзными изменениями. Эти ингибиторы могут быть использованы для вторичной профилактики, и они пригодны как для неотложной терапии, так и для долговременной терапии.
Данное изобретение, следовательно, относится к применению соединения формулы (I):
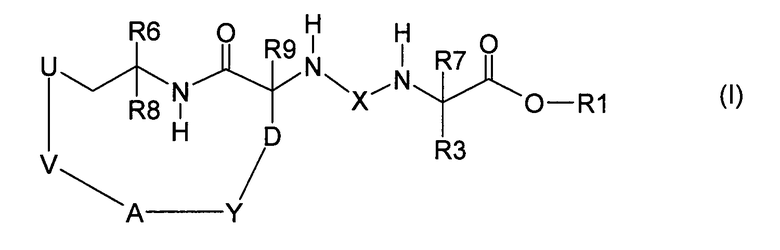
и/или стереоизомерной формы соединения формулы (I) и/или смесей этих форм в любом соотношении и/или физиологически толерантной соли соединения формулы (I), где:
Х означает -С(О)- или -SO2-,
U означает атом кислорода, атом серы, NH, -C(O)-NH- или -(С0-С4)алкилен,
А означает атом кислорода, атом серы, NH, -C(O)-NH-, -NH-C(O)-, -NR2- или -(С0-С4)алкилен,
V означает:
1) -(С2-С9)алкилен, где алкилен является незамещенным или одно-, двух- или трехкратно замещенным, независимо друг от друга, группой -ОН, NH2 или галогеном,
2) -(С1-С2)алкилен-(С3-С6)циклоалкил-(С1-С2)алкилен, где циклоалкил является одно-, двух- или трехкратно замещенным, независимо друг от друга, группой R15, или
3) -(С3-С9)алкенилен,
D означает -(С1-С2)алкилен,
Y означает:
1) ковалентную связь,
2) -(С3-С12)циклоалкил, где циклоалкил является одно-, двух- или трехкратно замещенным, независимо друг от друга, группой R15,
3) -(С6-С14)арил, где арил является незамещенным или одно-, двух- или трехкратно замещенным, независимо друг от друга, группой R15, или
4) Het, где Het означает 4-15-членную гетероциклическую систему, имеющую 4-15 атомов в цикле, которые находятся в одной, двух или трех циклических системах, объединенных вместе, и которые включают, в зависимости от размера цикла, один, два, три или четыре одинаковых или различных гетероатомов из ряда: кислород, азот или сера, и где Het является незамещенным или одно-, двух- или трехкратно замещенным, независимо друг от друга, -(С1-С3)алкилом, галогеном, -NH2, -CF3 или -О-CF3,
R1 означает:
1) атом водорода,
2) -(С1-С6)алкил,
3) -(С1-С6)алкил-ОН,
4) -(С0-С4)алкил-(С3-С6)циклоалкил,
5) -(С1-С10)алкил-О-С(О)-О-R2,
6) -(СН2)r-(С6-С14)арил, где арил является незамещенным или одно-, двух- или трехкратно замещенным, независимо друг от друга, группой R15, и r означает целое число 0, 1, 2 или 3, или
7) -(СН2)s-Het, где Het означает 4-15-членную гетероциклическую систему, имеющую 4-15 атомов в цикле, которые находятся в одной, двух или трех циклических системах, объединенных вместе, и которые включают, в зависимости от размера цикла, один, два, три или четыре одинаковых или различных гетероатомов из ряда: кислород, азот или сера, и где Het является незамещенным или одно-, двух- или трехкратно замещенным, независимо друг от друга, группой R15, и s означает целое число 0, 1, 2 или 3,
R2 означает:
1) -(С1-С6)алкил,
2) -(СН2)r-(С6-С14)арил, где арил является незамещенным или одно-, двух- или трехкратно замещенным, независимо друг от друга, группой R15, и r означает целое число 0, 1, 2 или 3, или
3) -(С0-С4)алкил-(С3-С6)циклоалкил,
R3 означает:
1) -(С2-С6)алкилен-NH2, где алкилен является незамещенным или одно-, двух-, трех- или четырехкратно замещенным галогеном,
2) -(С1-С4)алкилен-О-(С1-С4)алкилен-NH2,
3) -(С1-С4)алкилен-SO2-(С1-С4)алкилен-NH2,
4) -(С0-С4)алкилен-Het, где Het имеет значение, как указано выше, и замещен -NH2 и одно-, двух- или трехкратно группой R15,
5) -(С0-С4)алкилен-(С3-С8)циклоалкил-NH2, или
6) циклический -(С0-С6)алкиленамин,
R6 означает:
1) атом водорода,
2) -(С1-С6)алкил, где алкил является незамещенным или одно-, двух- или трехкратно замещенным, независимо друг от друга, группой R16,
3) -О-(С1-С6)алкил, где алкил является незамещенным или одно-, двух- или трехкратно замещенным, независимо друг от друга, группой R16,
4) -(С0-С4)алкилен-Het, где Het имеет значение, как указано выше, где алкилен и Het являются незамещенными или одно-, двух- или трехкратно замещенными, независимо друг от друга, группой R16,
5) -(С0-С4)алкиленарил, где алкилен и арил являются незамещенными или одно-, двух- или трехкратно замещенными, независимо друг от друга, группой R16, или
6) -(С0-С4)алкилен-(С3-С8)циклоалкил, где алкилен и циклоалкил являются незамещенными или одно-, двух- или трехкратно замещенными, независимо друг от друга, группой R16,
R7 означает атом водорода, галоген или -(С1-С6)алкил,
R8 означает атом водорода, галоген или -(С1-С6)алкил,
R9 означает атом водорода, галоген или -(С1-С6)алкил,
R15 означает атом водорода, -(С1-С4)алкил, -О-CF3, -NH2, -OH, -CF3 или галоген, и
R16 означает -О-CF3, -NH2, -OH, -CF3 или галоген.
2) Данное изобретение, далее, относится к соединению формулы (I), где:
Х означает -С(О)- или -SO2-,
U означает атом кислорода, атом серы, NH, -C(O)-NH- или -(С0-С4)алкилен,
А означает атом кислорода, атом серы, NH, -C(O)-NH- или -(С0-С4)алкилен,
V означает:
1) -(С2-С9)алкилен или
2) -(С3-С9)алкенилен,
D означает -(С1-С2)алкилен,
Y означает:
1) ковалентную связь,
2) -(С3-С12)циклоалкил, где циклоалкил является одно-, двух- или трехкратно замещенным, независимо друг от друга, группой R15,
3) -(С6-С14)арил, где арил является незамещенным или одно-, двух- или трехкратно замещенным, независимо друг от друга, группой R15, или
4) Het, где Het означает 4-15-членную гетероциклическую систему, имеющую 4-15 атомов в цикле, которые находятся в одной, двух или трех циклических системах, объединенных вместе, и которые включают, в зависимости от размера цикла, один, два, три или четыре одинаковых или различных гетероатомов из ряда: кислород, азот или сера, и где Het является незамещенным или одно-, двух- или трехкратно замещенным, независимо друг от друга, -(С1-С3)алкилом, галогеном, -NH2, -CF3 или -О-CF3,
R1 означает:
1) атом водорода,
2) -(С1-С6)алкил,
3) -(С1-С6)алкил-ОН,
4) -(С0-С4)алкил-(С3-С6)циклоалкил,
5) -(С1-С10)алкил-О-С(О)-О-R2,
6) -(СН2)r-(С6-С14)арил, где арил является незамещенным или одно-, двух- или трехкратно замещенным, независимо друг от друга, группой R15, и r означает целое число 0, 1, 2 или 3, или
7) -(СН2)s-Het, где Het означает 4-15-членную гетероциклическую систему, имеющую 4-15 атомов в цикле, которые находятся в одной, двух или трех циклических системах, объединенных вместе, и которые включают, в зависимости от размера цикла, один, два, три или четыре одинаковых или различных гетероатомов из ряда: кислород, азот или сера, и где Het является незамещенным или одно-, двух- или трехкратно замещенным, независимо друг от друга, группой R15, и s означает целое число 0, 1, 2 или 3,
R2 означает:
1) -(С1-С6)алкил,
2) -(СН2)r-(С6-С14)арил, где арил является незамещенным или одно-, двух- или трехкратно замещенным, независимо друг от друга, группой R15, и r означает целое число 0, 1, 2 или 3, или
3) -(С0-С4)алкил-(С3-С6)циклоалкил,
R3 означает:
1) -(С2-С6)алкилен-NH2, где алкилен является незамещенным или одно-, двух-, трех- или четырехкратно замещенным галогеном,
2) -(С1-С4)алкилен-О-(С1-С4)алкилен-NH2,
3) -(С1-С4)алкилен-SO2-(С1-С4)алкилен-NH2,
4) -(С0-С4)алкилен-Het, где Het имеет значение, как указано выше, и замещен -NH2 и одно-, двух- или трехкратно группой R15,
5) -(С0-С4)алкилен-(С3-С8)циклоалкил-NH2 или
6) циклический -(С0-С6)алкиленамин,
R6 означает:
1) атом водорода,
2) -(С1-С6)алкил, где алкил является незамещенным или одно-, двух- или трехкратно замещенным, независимо друг от друга, группой R16,
3) -О-(С1-С6)алкил, где алкил является незамещенным или одно-, двух- или трехкратно замещенным, независимо друг от друга, группой R16,
4) -(С0-С4)алкилен-Het, где Het имеет значение, как указано выше, где алкилен и Het являются незамещенными или одно-, двух- или трехкратно замещенными, независимо друг от друга, группой R16,
5) -(С0-С4)алкиленарил, где алкилен и арил являются незамещенными или одно-, двух- или трехкратно замещенными, независимо друг от друга, группой R16, или
6) -(С0-С4)алкилен-(С3-С8)циклоалкил, где алкилен и циклоалкил являются незамещенными или одно-, двух- или трехкратно замещенными, независимо друг от друга, группой R16,
R7 означает атом водорода, галоген или -(С1-С6)алкил,
R8 означает атом водорода, галоген или -(С1-С6)алкил,
R9 означает атом водорода, галоген или -(С1-С6)алкил,
R15 означает атом водорода, -(С1-С4)алкил, -О-CF3, -NH2, -OH, -CF3 или галоген, и
R16 означает -О-CF3, -NH2, -OH, -CF3 или галоген.
3) Данное изобретение, далее, относится к соединению формулы (I), где:
Х означает -С(О)- или -SO2-,
U означает атом кислорода, атом серы, NH, -C(O)-NH- или -(С0-С4)алкилен,
А означает атом кислорода или -(С0-С4)алкилен,
V означает -(С2-С8)алкилен или -(С3-С6)алкенилен,
D означает -(С1-С2)алкилен,
Y означает:
1) ковалентную связь,
2) -(С3-С6)циклоалкил, где циклоалкил является одно-, двух- или трехкратно замещенным, независимо друг от друга, группой R15,
3) -(С6-С14)арил, где арил выбирают из группы, состоящей из фенила, нафтила, антрила или флуоренила, и где арил является незамещенным или одно-, двух- или трехкратно замещенным, независимо друг от друга, группой R15, или
4) Het, где Het выбирают из группы, состоящей из акридинила, азепинила, азетидинила, азиридинила, бензимидазалинила, бензимидазолила, бензо[1,3]диоксолила, бензофуранила, бензотиофуранила, бензотиофенила, бензоксазолила, бензтиазолила, бензтриазолила, бензтетразолила, бензизоксазолила, бензизотиазолила, карбазолила, 4аН-карбазолила, карболинила, хиназолинила, хинолинила, 4Н-хинолизинила, хиноксалинила, хинуклидинила, хроманила, хроменила, циннолинила, декагидрохинолинила, дибензофуранила, дибензотиофенила, дигидрофуран[2,3-b]тетрагидрофуранила, дигидрофуранила, диоксолила, диоксанила, 2Н,6Н-1,5,2-дитиазинила, фуранила, фуразанила, имидазолидинила, имидазолинила, имидазолила, 1Н-индазолила, индолинила, индолизинила, индолила, 3Н-индолила, изобензофуранила, изохроманила, изоиндазолила, изоиндолинила, изоиндолила, изохинолинила (бензимидазолила), изотиазолидинила, 2-изотиазолинила, изотиазолила, изоксазолила, изоксазолидинила, 2-изоксазолинила, морфолинила, нафтиридинила, октагидроизохинолинила, оксадиазолила, 1,2,3-оксадиазолила, 1,2,4-оксадиазолила, 1,2,5-оксадиазолила, 1,3,4-оксадиазолила, оксазолидинила, оксазолила, оксотиоланила, пиримидинила, фенантридинила, фенантролинила, феназинила, фенотиазинила, феноксатиинила, феноксазинила, фталазинила, пиперазинила, пиперидинила, птеридинила, пуринила, пиранила, пиразинила, пироазолидинила, пиразолинила, пиразолила, пиридазинила, пиридооксазолила, пиридоимидазолила, пиридотиазолила, пиридотиофенила, пиридинила, пиридила, пиримидинила, пирролидинила, пирролинила, 2Н-пирролила, пирролила, тетрагидрофуранила, тетрагидроизохинолинила, тетрагидрохинолинила, тетрагидропиридинила, 6Н-1,2,5-тиадазинила, 1,2,3-тиадиазолила, 1,2,4-тиадиазолила, 1,2,5-тиадиазолила, 1,3,4-тиадиазолила, тиантренила, тиазолила, тиенила, тиеноимидазолила, тиенооксазолила, тиенопиридина, тиенотиазолила, тиоморфолинила, тиофенила, триазинила, 1,2,3-триазолила, 1,2,4-триазолила, 1,2,5-триазолила, 1,3,4-триазолила и ксантенила, и где Het является незамещенным или одно-, двух- или трехкратно замещенным, независимо друг от друга, -(С1-С3)алкилом, галогеном, -NH2, -CF3 или -О-CF3,
R1 означает:
1) атом водорода,
2) -(С1-С4)алкил,
R3 означает:
1) -(С2-С6)алкилен-NH2, где алкилен является незамещенным или одно-, двух-, трех- или четырехкратно замещенным галогеном,
2) -(С1-С4)алкилен-SO2-(С1-С4)алкилен-NH2 или
3) -(С0-С4)алкилен-Het, где Het имеет значение, как указано выше, и замещен -NH2 и одно-, двух- или трехкратно группой R15,
R6 означает:
1) атом водорода,
2) -(С1-С6)алкил, где алкил является незамещенным или замещенным, независимо друг от друга, один, два или три раза, группой R16,
3) -О-(С1-С6)алкил, где алкил является незамещенным или одно-, двух- или трехкратно замещенным, независимо друг от друга, группой R16,
4) -(С0-С4)алкилен-Het, где Het имеет значение, как указано выше, где алкилен и Het являются незамещенными или одно-, двух- или трехкратно замещенными, независимо друг от друга, группой R16,
5) -(С0-С4)алкилен-арил, где алкилен и арил являются незамещенными или одно-, двух- или трехкратно замещенными, независимо друг от друга, группой R16, или
6) -(С0-С4)алкилен-(С3-С6)циклоалкил, где алкилен и циклоалкил являются незамещенными или одно-, двух- или трехкратно замещенными, независимо друг от друга, группой R16,
R7 означает атом водорода, F или -(С1-С4)алкил,
R8 означает атом водорода, F или -(С1-С4)алкил,
R9 означает атом водорода, F или -(С1-С4)алкил,
R15 означает атом водорода, -(С1-С4)алкил, -О-CF3, -NH2, -OH, -CF3 или галоген, и
R16 означает -О-CF3, -OH, -CF3 или F.
4) Данное изобретение, далее, относится к соединению формулы (I), где:
Х означает -С(О)-,
U означает атом кислорода,
А означает атом кислорода или -(С0-С4)алкилен,
V означает:
1) -(С2-С8)алкилен, где алкилен является незамещенным или одно- или двукратно замещенным, независимо друг от друга, -ОН, F или Cl,
2) -(С1-С2)алкилен-циклопропил(С1-С2)алкилен, где циклопропил является одно- или двукратно замещенным F, или
3) -(С3-С6)алкенилен,
D означает -(С1-С2)алкилен,
Y означает:
1) ковалентную связь или
2) фенил, где фенил является незамещенным или одно-, двух- или трехкратно замещенным, независимо друг от друга, группой R15,
R1 означает:
1) атом водорода или
2) -(С1-С4)алкил,
R3 означает:
1) -(С2-С6)алкилен-NH2,
2) -(С1-С4)алкилен-SO2-(С1-С4)алкилен-NH2 или
3) -(С0-С4)алкиленпиридил, где пиридил замещен -NH2 и одно-, двух- или трехкратно группой R15,
R6 означает:
1) атом водорода,
2) -(С1-С6)алкил,
3) -CF3,
4) -(С0-С4)алкиленфенил или
5) -(С0-С4)алкилен-(С3-С6)циклоалкил,
R7, R8 и R9, каждый, означают атом водорода, и
группой R15 означает атом водорода, -(С1-С4)алкил, -CF3 или галоген.
5) Данное изобретение, далее, относится к соединению формулы (I), где:
Х означает -С(О)-,
U означает атом кислорода,
А означает атом кислорода или -(С0-С4)алкилен,
V означает -(С2-С8)алкилен или -(С3-С6)алкенилен,
D означает -(С1-С2)алкилен,
Y означает:
1) ковалентную связь, или
2) фенил, где фенил является незамещенным или одно-, двух- или трехкратно замещенным, независимо друг от друга, группой R15,
R1 означает:
1) атом водорода или
2) -(С1-С4)алкил,
R3 означает:
1) -(С2-С6)алкилен-NH2,
2) -(С1-С4)алкилен-SO2-(С1-С4)алкилен-NH2 или
3) -(С0-С4)алкиленпиридил, где пиридил замещен -NH2 и одно-, двух- или трехкратно группой R15,
R6 означает:
1) атом водорода,
2) -(С1-С6)алкил,
3) -CF3,
4) -(С0-С4)алкиленфенил или
5) -(С0-С4)алкилен-(С3-С6)циклоалкил,
R7, R8 и R9, каждый, означают атом водорода, и
R15 означает атом водорода, -(С1-С4)алкил, -CF3 или галоген.
Термин «-(С1-С6)алкил» означает углеводородные радикалы, у которых углеродная цепь является линейной или разветвленной и включает 1-6 атомов углерода, например, метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, изопентил, неопентил, гексил, 2,3-диметилбутан или неогексил.
Термин «-(С0-С4)алкилен» означает углеводородные радикалы, у которых углеродная цепь является линейной или разветвленной и включает 1-4 атома углерода, например, метилен, этилен, пропилен, изопропилен, изобутилен, бутилен или трет-бутилен. Термин «С0-алкилен» означает ковалентную связь.
Термин «-(С3-С9)алкилен» означает углеводородные радикалы, у которых углеродная цепь является линейной или разветвленной и включает 3-9 атомов углерода, например, пропилен, изопропилен, бутилен, изобутилен, пентилен, изопентилен, неопентилен, гексилен, 2,3-диметилбутанилен, неогексилен, гептилен, октанилен или нонанилен.
Термин «-(С3-С9)алкенилен» означает углеводородные радикалы, у которых углеродная цепь является линейной или разветвленной и включает 3-9 атомов углерода и которые имеют, в зависимости от длины цепи, 1, 2 или 3 двойные связи, например, этенилен, пропенилен, изопропенилен, изобутенилен или бутенилен; заместители у двойной связи, где, в принципе, возможно, могут находиться в Е- или Z-положениях.
Термин «-(С3-С12)циклоалкил» означает радикалы, такие как соединения, производимые от 3-12-членных моно-, би- или трициклов или циклов с мостиковой связью, таких как моноциклы, как циклопропан, циклобутан, циклопентан, циклогексан, циклогептан или циклооктан, производимые от бициклов, как бицикло[4.2.0]октан, октагидроинден, декагидронафталин, декагидроазулен, декагидробензоциклогептен или додекагидрогептален, или от трициклов, такие как адамантан, или производимые от циклов с мостиковой связью, такие как спиро[2.5]октан, спиро[3.4]октан, спиро[3.5]нонан, бицикло[3.1.1]гептан, бицикло[2.2.1]гептан, бицикло[2.2.2]октан или октагидро-4,7-метанинден.
Термин «-(С6-С14)арил» означает ароматические углеродные радикалы, имеющие 6-14 атомов углерода в цикле. Примерами (С6-С14)арилов являются фенил, нафтил, например, 1-нафтил, 2-нафтил, 1,2,3,4-тетрагидронафталенил, антрил или флуоренил. Нафтилы и, особенно, фенилы, являются предпочтительными арилами.
Термин «4-15-членная гетероциклическая система» или «Het» означает циклическую систему, имеющую 4-15 атомов в цикле, которые находятся в одной, двух или трех циклических системах, объединенных вместе, и которые включают, в зависимости от размера цикла, один, два, три или четыре одинаковых или различных гетероатомов из ряда: кислород, азот или сера. Примерами таких циклических систем являются акридинил, азепинил, азетидинил, азиридинил, бензимидазалинил, бензимидазолил, бензо[1,3]диоксол, бензофуранил, бензотиофуранил, бензотиофенил, бензоксазолил, бензтиазолил, бензтриазолил, бензтетразолил, бензизоксазолил, бензизотиазолил, карбазолил, 4аН-карбазолил, карболинил, хиназолинил, хинолинил, 4Н-хинолизинил, хиноксалинил, хинуклидинил, хроманил, хроменил, циннолинил, декагидрохинолинил, дибензофуранил, дибензотиофенил, дигидрофуран[2,3-b]тетрагидрофуранил, дигидрофуранил, диоксолил, диоксанил, 2Н,6Н-1,5,2-дитиазинил, фуранил, фуразанил, имидазолидинил, имидазолинил, имидазолил, 1Н-индазолил, индолинил, индолизинил, индолил, 3Н-индолил, изобензофуранил, изохроманил, изоиндазолил, изоиндолинил, изоиндолил, изохинолинил (бензимидазолил), изотиазолидинил, 2-изотиазолинил, изотиазолил, изоксазолил, изоксазолидинил, 2-изоксазолинил, морфолинил, нафтиридинил, октагидроизохинолинил, оксадиазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, оксазолидинил, оксазолил, оксазолидинил, оксотиоланил, пиримидинил, фенантридинил, фенантролинил, феназинил, фенотиазинил, феноксатиинил, феноксазинил, фталазинил, пиперазинил, пиперидинил, птеридинил, пуринил, пиранил, пиразинил, пироазолидинил, пиразолинил, пиразолил, пиридазинил, пиридооксазолил, пиридоимидазолил, пиридотиазолил, пиридотиофенил, пиридинил, пиридил, пиримидинил, пирролидинил, пирролинил, 2Н-пирролил, пирролил, тетрагидрофуранил, тетрагидроизохинолинил, тетрагидрохинолинил, тетрагидропиридинил, 6Н-1,2,5-тиадазинил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,2,5-тиадиазолил, 1,3,4-тиадиазолил, тиантренил, тиазолил, тиенил, тиеноимидазолил, тиенооксазолил, тиенопиридин, тиенотиазолил, тиоморфолинил, тиофенил, триазинил, 1,2,3-триазолил, 1,2,4-триазолил, 1,2,5-триазолил, 1,3,4-триазолил и ксантенил.
Предпочтительными циклами Het являются изоксазолил, бензо[1,3]диоксол, тиофенил, имидазол и тиазол.
Термин «галоген» означает фтор, хлор, бром или иод, предпочтительно, фтор, хлор или бром, особенно, хлор или бром.
Термин «-SO2-» означает сульфонил.
Термин «-С(О)-» означает карбонил.
Термин «циклические амины» означает циклические системы, такие как циклические амины, например, азетидинил, пирролидинил, пиперидинил, пиперазинил, азепинил, морфолинил или тиоморфолинил.
Данное изобретение, далее, относится к способу получения соединения формулы (I), включающему:
а) введение во взаимодействие соединения формулы (II):
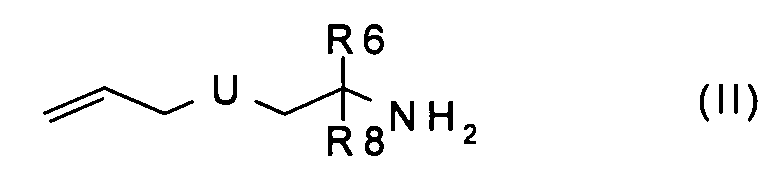
где U, R6 и R8 имеют значения, указанные в случае соединения формулы (I), с аминокислотой формулы (III):
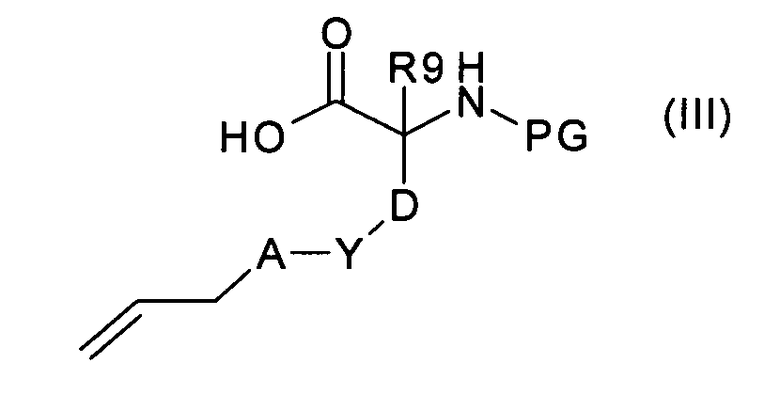
где R9, A, Y и D имеют значения, указанные в случае соединения формулы (I), с получением соединения формулы (IV):
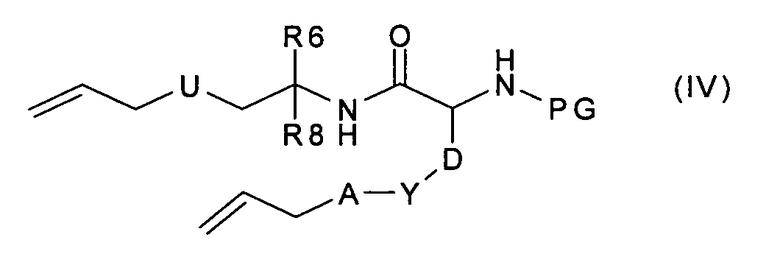
которое, в условиях метатезиса с замыканием цикла и последующем гидрировании полученной двойной связи, превращают в соединение формулы (V):
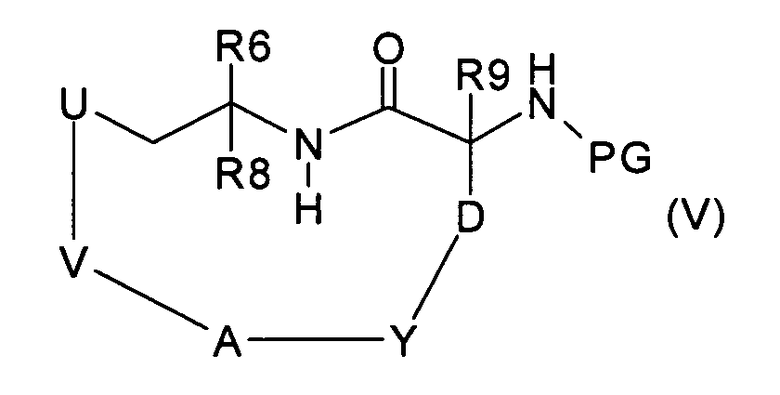
где V означает -(С2-С9)алкилен или -(С3-С9)алкенилен, затем удаляют защитную группу PG и получают соединение формулы (VI):
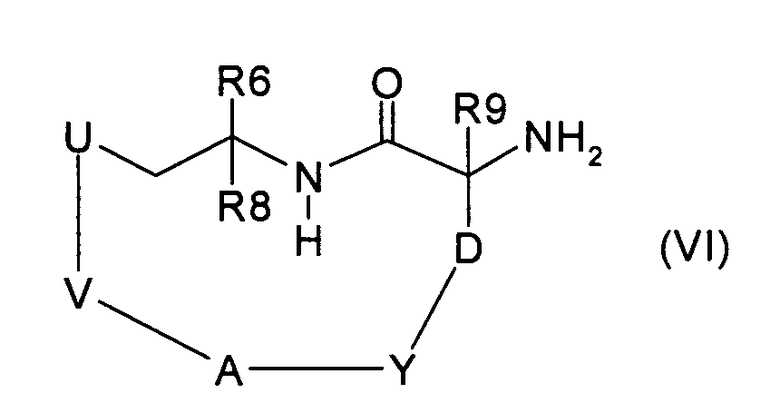
и вводят во взаимодействие с соединением формулы (VII):
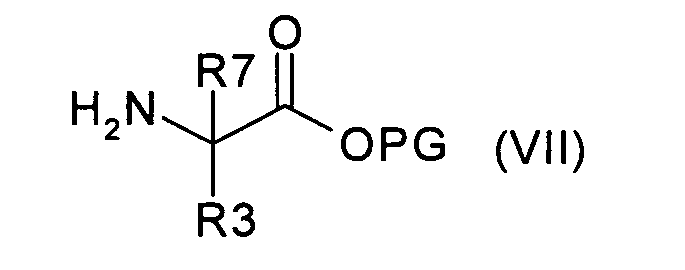
где R3 и R7 имеют значения, указанные в случае соединения формулы (I), PG представляет собой подходящую сложноэфирную защитную группу и атом азота в R3 защищен, где предназначено, подходящей защитной для аминогруппы группой, с фосгеном или эквивалентом фосгена, получая соединение формулы (VIII):
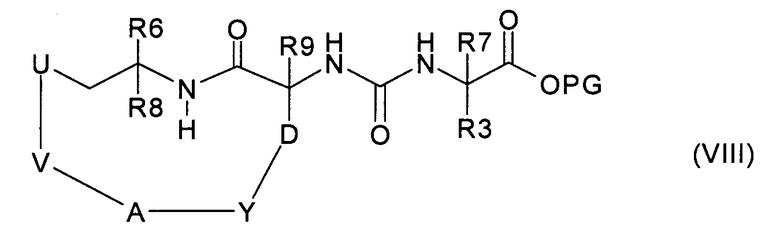
затем защитную группу PG и защитную группу, которая находится, где предназначено, у атома азота в R3, удаляют, получая в результате соединение формулы (I), или
b) введение во взаимодействие соединения формулы (IX):
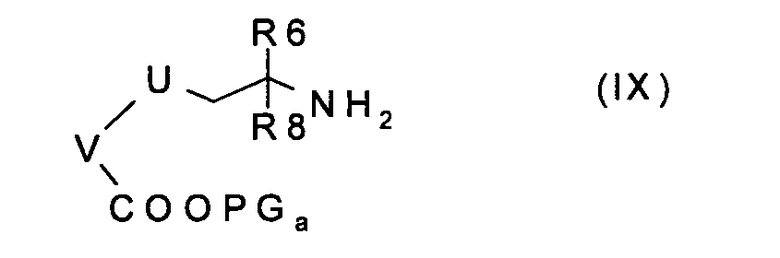
где U, V, R6 и R8 имеют значения, указанные в случае соединения формулы (I), и PGa представляет собой подходящую защитную для карбоксильной группы группу, с аминокислотой формулы (Х):
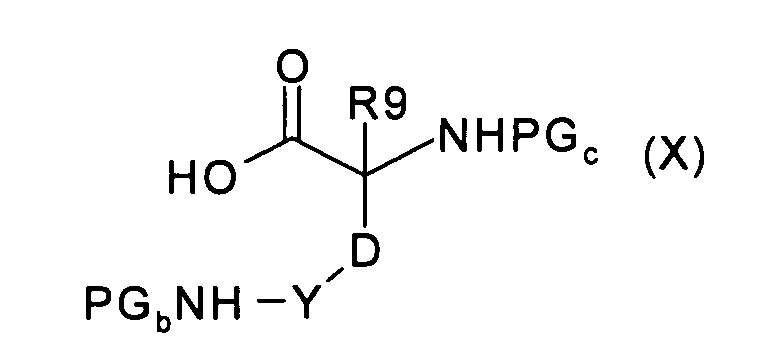
где R9, Y и D имеют значения, указанные в случае соединения формулы (I), и PGb и PGc представляют собой подходящие защитные для аминогруппы группы, с получением соединения формулы (XI):
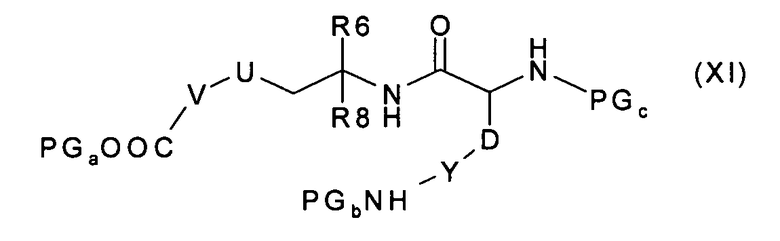
которое, после удаления защитных групп PGa и PGb, превращают в соединение формулы (XII):
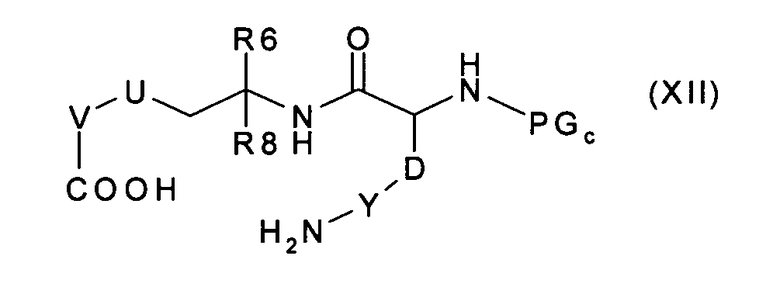
которое путем амидного связывания превращают в соединение формулы (V),
где А имеет значение, указанное в случае соединения формулы (I),
затем защитную группу удаляют и получают соединение формулы (VI),
и вводят во взаимодействие с соединением формулы (VII),
где R3 и R7 имеют значения, указанные в случае соединения формулы (I), PG представляет собой подходящую сложноэфирную защитную группу и атом азота в R3 защищен, где предназначено, подходящей защитной для аминогруппы группой, с фосгеном или эквивалентом фосгена, получая соединение формулы (VIII), затем защитную группу PG и защитную группу, которая присутствует, где предназначено, у атома азота в R3, удаляют, получая в результате соединение формулы (I), или
с) введение во взаимодействие соединения формулы (XIII):
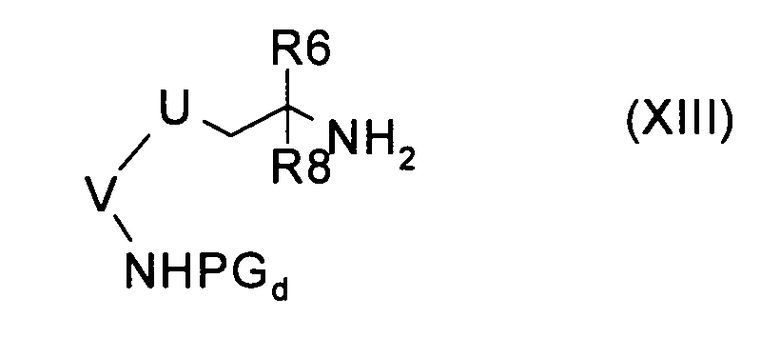
где U, V, R6 и R8 имеют значения, указанные в случае соединения формулы (I), и PGd представляет собой подходящую защитную для аминогруппы группу, с аминокислотой формулы (XIV):
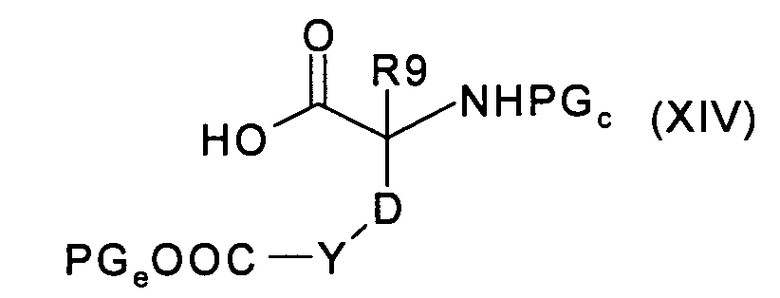
где R9, Y и D имеют значения, указанные в случае соединения формулы (I), и PGc представляют собой подходящую защитную для аминогруппы группу, а PGe представляет собой подходящую защитную для карбоксильной группы группу, с получением соединения формулы (XV):
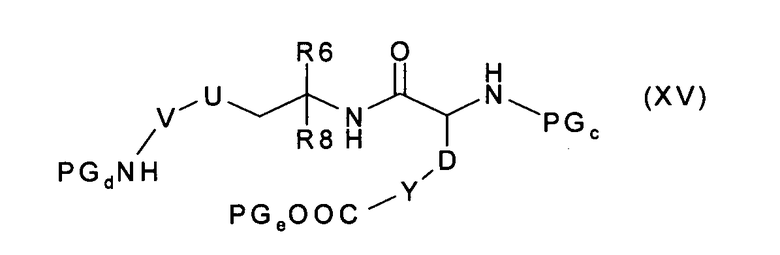
которое, после удаления защитных групп PGd и PGe, превращают в соединение формулы (XVI):
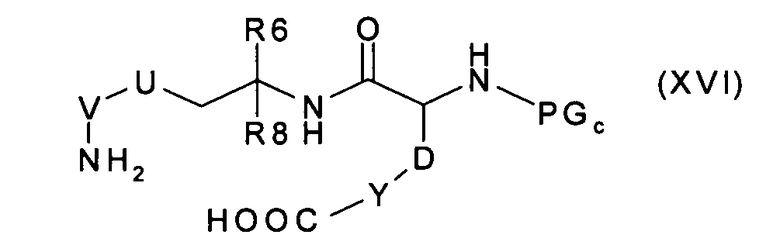
которое вводят во взаимодействие до получения соединения формулы (V),
где А имеет значение, указанное в случае соединения формулы (I),
затем защитную группу удаляют и получают соединение формулы (VI),
и вводят во взаимодействие с соединением формулы (VII),
где R3 и R7 имеют значения, указанные в случае соединения формулы (I), PG представляет собой подходящую сложноэфирную защитную группу и атом азота в R3 защищен, где предназначено, подходящей защитной для аминогруппы группой, с фосгеном или эквивалентом фосгена, получая соединение формулы (VIII), затем защитную группу PG и защитную группу, которая присутствует, где предназначено, у атома азота в R3, удаляют, получая в результате соединение формулы (I), или
d) введение во взаимодействие соединения формулы (XVII):
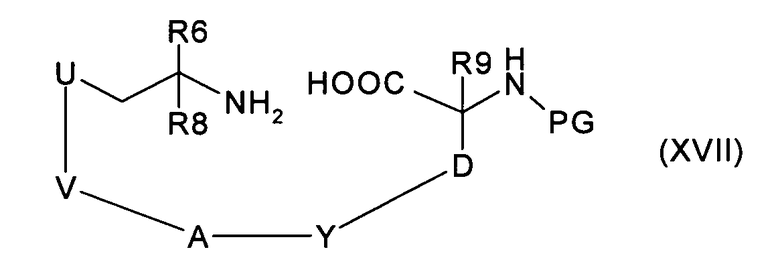
где U, V, A, Y, D, R6, R8 и R9 имеют значения, указанные в случае соединения формулы (I), с соединением формулы (V),
затем защитные группы удаляют и получают соединение формулы (VI),
и вводят во взаимодействие с соединением формулы (VII),
где R3 и R7 имеют значения, указанные в случае соединения формулы (I), PG представляет собой подходящую сложноэфирную защитную группу и атом азота в R3 защищен, где предназначено, подходящей защитной для аминогруппы группой, с фосгеном или эквивалентом фосгена, получая соединение формулы (VIII), и затем защитные группы PG и, где предназначено, защитную группу у атома азота в R3 удаляют, получая в результате соединение формулы (I), или
е) превращение соединения формулы (VIIIa):
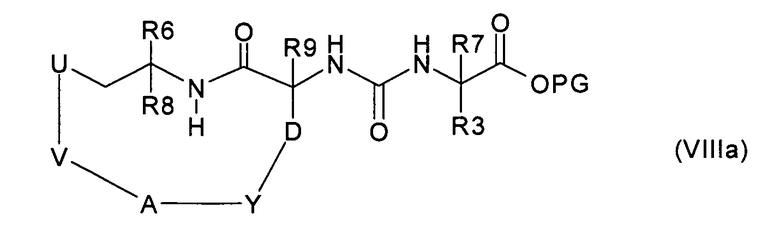
где V означает -(С3-С9)алкенилен, в соединение формулы (VIIIb):
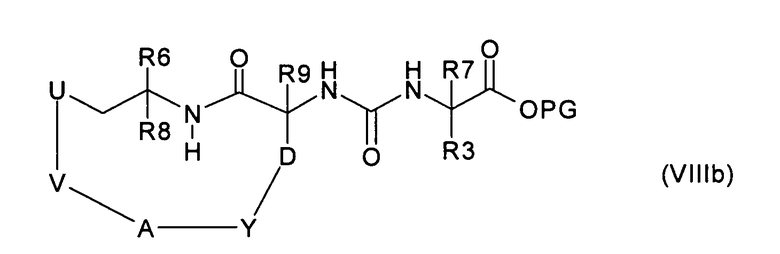
где V означает -(С3-С9)алкилен, где алкилен одно-, двух- или трехкратно замещен, независимо друг от друга, -ОН, -NH2 или галогеном, или означает -(С1-С2)алкилен-(С3-С6)циклоалкил-(С1-С2)алкилен, где циклоалкил одно-, двух- или трехкратно замещен, независимо друг от друга, группой R15,
затем соединение формулы (VIIIb) превращают, аналогично способу а), в соединение формулы (I), или
f) введение во взаимодействие соединения формулы (XVIII):
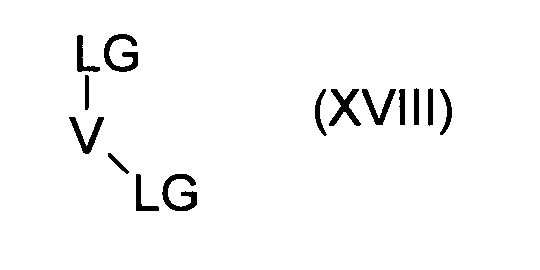
где V имеет значение, как указано в случае соединения формулы (I), последовательно, с соединениями формул (XIX) и (XX):
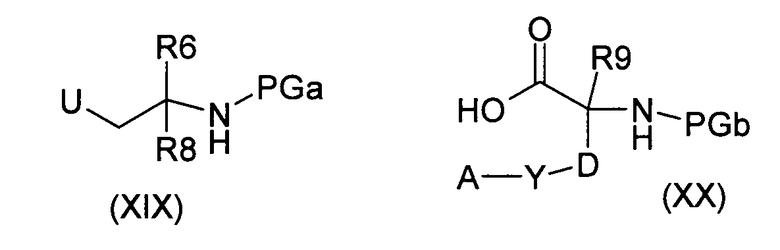
при использовании оснований, в полярных апротонных растворителях, и превращение полученных в результате соединений формулы (XXI):
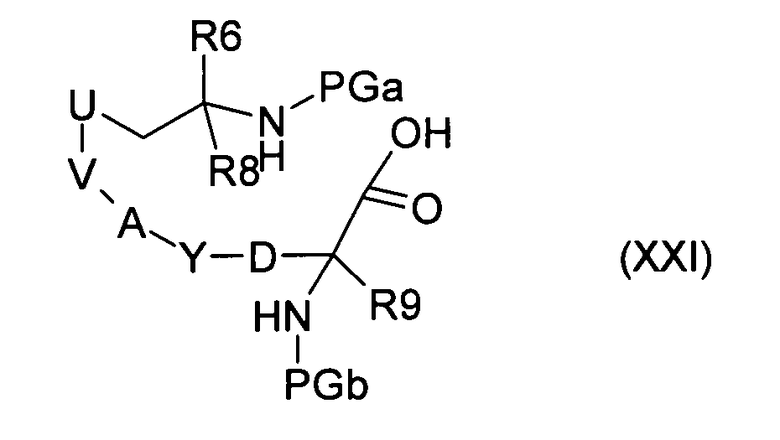
путем удаления защитной группы PGa и последующего образования пептидной связи, в соединение формулы (V), и введение во взаимодействие последнего, как в случае способа а), получая соединения формулы (I), где R6, R8, R9 и A, D, U, V и Y имеют значения, указанные в случае соединения формулы (I), и PG представляет собой подходящие защитные группы, а LG представляет собой удаляемую группу, такую как хлор, бром, иод или эфир сульфоновой кислоты, или
g) введение во взаимодействие соединения формулы (VI) с соединением формулы (XXII):
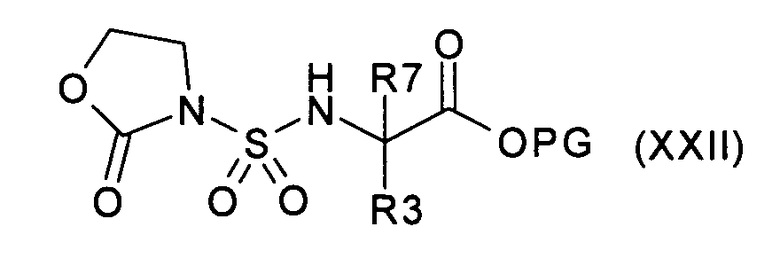
где R3 и R7 имеют значения, указанные в случае соединения формулы (I), и PG представляет собой подходящую защитную группу, с получением соединения формулы (XXIII):
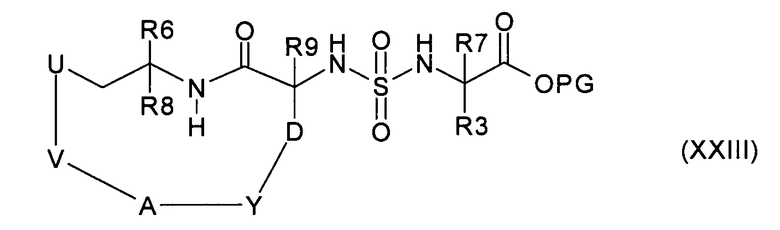
и затем превращение в соединение формулы (I), или
h) фракционирование соединения формулы (I), полученного с помощью способов а), b), c), d), e), f) или g), или подходящего предшественника соединения формулы (I), который встречается в энантиомерных формах, вследствие его химической структуры, путем солеобразования с энантиомерночистыми кислотами или основаниями, хроматографии на хиральных стационарных фазах или дериватизации посредством хиральных энантиомерночистых, соединений, таких как аминокислоты, путем разделения диастереомеров, полученных таким образом, и удаления хиральных вспомогательных групп, до чистых энантиомеров, или
i) либо выделение в свободной форме соединения формулы (I), полученного способами а), b), c), d), e), f) или g), либо превращение в физиологически толерантные соли, в случае, где присутствуют кислотные или основные группы.
Варианты получения, описанные в способах а)-f), можно варьировать в отношении последовательности стадий способа и не ограничиваются способами, описанными таким образом; так, например, сначала может быть образована карбамидная или сульфамидная связь для получения соединений типа XII (представленные в данном контексте для карбамидного типа), затем осуществляют снятие защиты и вводят во взаимодействие с соединением типа II с получением соединений типа XIV, которые затем приводят к соединениям (I) согласно данному изобретению, по аналогии через соединения (VIII) и далее:
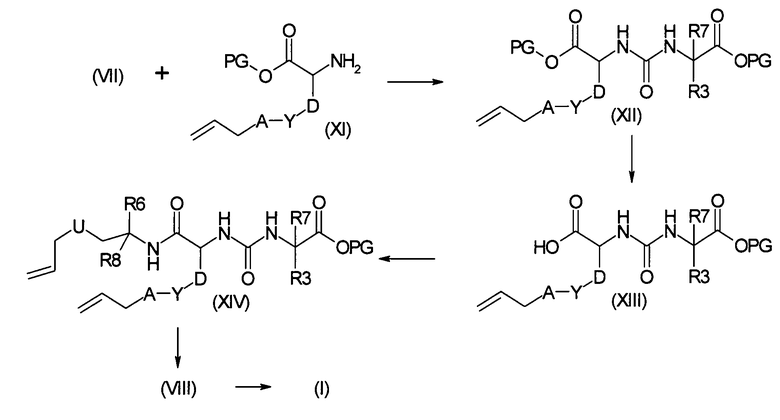
Получают соединения типа II, например, путем прямого аллилирования коммерчески доступных аминоспиртов, при использовании аллилирующих агентов, таких как аллилгалогениды или эфиры аллилсульфоновой кислоты, в полярных апротонных растворителях, таких как тетрагидрофуран (ТГФ) или диметилформамид (ДМФА), используя сильные основания, такие как гидрид натрия, литийгексаметилдисилазан или карбонаты щелочных металлов, описанные в Organic Preparations and Procedures International, 34 (5), 511-514. Альтернативно, аминогруппу можно предварительно защищать, например, путем образования оснований Шиффа, как описано в Journal of the Chemical Society, Perkin Transactions 1: Organic and Bio-Organic Chemistry, (14), 2139-2145, 1997. Удаление защитной группы может происходить в кислой среде, предпочтительно, в разбавленной хлористоводородной кислоте, в растворимых в воде органических растворителях, таких как ТГФ или метанол, или смесях множества таких растворителей. Соединения типа III являются коммерчески доступными или их можно получать из коммерчески доступных производных аминокислот, как описано выше, путем аллилирования по атому, предпочтительно, гетероатому боковой цепи. Соединения типа VII являются коммерчески доступными или их можно получать с помощью стандартных способов в химии защитных групп (см. ниже). Соединения типа IX можно получать с помощью стандартных способов органической химии, таких как присоединение по Михаэлю замещенных β-аминоспиртов к α,β-ненасыщенным сложноэфирным соединениям в присутствии каталитических количеств натрия (J. Org. Chem., том 69, № 5, 2004, 1716-1719):
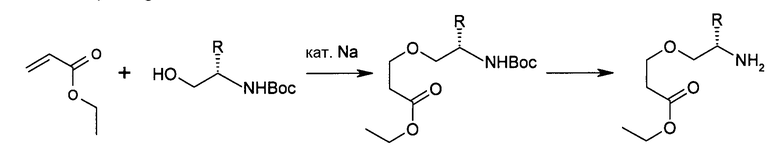
или еще путем катализируемого кислотой Льюиса присоединения соответствующим образом замещенных спиртов к защищенным азиридинам:
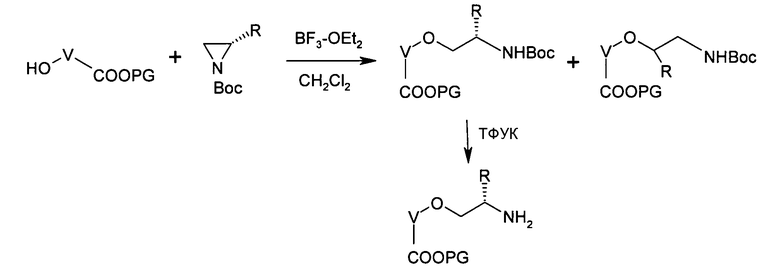
Соединения типа Х являются обычно коммерчески доступными, как например:
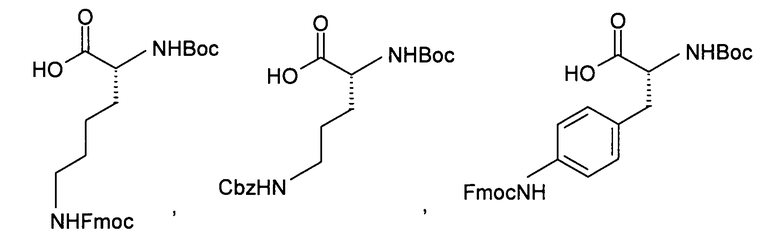
или могут быть получены из коммерчески доступных путем стандартных превращений.
Также, соединения типа XIV являются обычно коммерчески доступными, как например:
или могут быть получены из коммерчески доступных путем стандартных превращений.
Соединения типа XIII можно получать, как описано выше, путем катализируемого кислотой Льюиса присоединения соответствующих аминоспиртов к защищенным замещенным азиридинам:
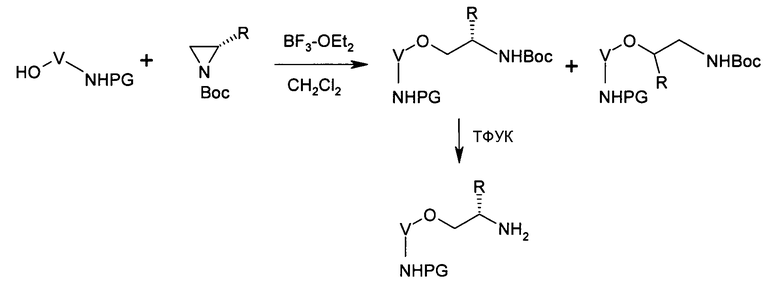
как описано в Tetrahedron Letters, том 34, № 41, 1993, 6513-6516.
Получение 2-оксооксазолидин-3-сульфонамидов типа XVIII и последующее превращение в сульфамиды описано, например, в Organic Process Research & Development (2006), 10(4), 770-775, и их можно получать, согласно данному контексту, из известных производных аминокислот.
Методы пептидного связывания описаны, например,. Bodanszky (M. Bodanszky, Principles of Peptide Synthesis, 2-ое изд., Springer, Berlin, 1993). Можно указать, например, на разнообразие известных методов активирования карбоновых кислот карбодиимидным способом (J. Am. Chem. Soc., 1955, 77, 1067) и способами образования активных сложных эфиров, таких как, например, посредством солей фосфония (Tetrahedron Lett., 1975, 14; Int, J. Peptide Protein Res., 1988, 31, 231), или солей урония (Tetrahedron Lett., 1978, 1269, Tetrahedron Lett., 1989, 30, 1927, J. Chem. Soc., Chem. Commun., 1994, 201). Защитные группы, их введение, удаление и стабильность, описаны, например, в руководстве Greene (T.W. Greene, P.G.M. Wuts, Protective Groups in Organic Synthesis, 3-ее изд., Wiley, New York, 1999). Предпочтительными защитными группами являются, например, аминозащитные группы, такие как трет-бутилоксикарбонил, флуоренилоксикарбонил, бензилоксикарбонил, бензилиденовая защитная группа или дифенилметилиденовая защитная группа; предпочтительными защитными для карбоксильных групп группами являются сложные алкиловые эфиры, такие как метиловый, этиловый, бензиловый или силиловый эфиры, такие как триметилсилиловые эфиры. Получение мочевин (карбамидов) подробно описано, например, G. Sartori; R. Maggi, Acyclic and cyclic ureas, Science of Synthesis (2005), 18, 665-758. Два аминокомпонента, в этом случае, вводят во взаимодействие, в полярных или неполярных апротонных растворителях, таких как ДМФА, дихлорметан, ацетонитрил, где предназначено, при добавлении основания, такого как карбонат щелочного металла или органические азотистые основания, предпочтительно, триэтиламин или диизопропилэтиламин, и, где предназначено, в присутствии катализатора ацилирования, такого как диметиламинопиридин, с фосгеном, трифосгеном, дифосгеном или эквивалентами фосгена, такими как 1,1'-карбонилдиимидазол или дисукцидинилкарбонат или эфиры хлормуравьиной кислоты, для образования активированных предшественников мочевины. Образование карбамидной связи также может иметь место при использовании соответствующих изоцианатов, с одним-двумя участниками связывания. Метатезис с замыканием цикла (олефиновый метатезис) означает углерод-углеродное связывание с замыканием цикла между двумя алкенильными группами при использовании металлокарбеновых катализаторов Grubbs, Hoyveda-Grubbs или Schrock, в растворителях, таких как, например, дихлорметан, бензол, пентан или ТГФ, с удалением этилена, предпочтительно, при температурах 25-50оС, и описывается, например, в Angew. Chem., Int. Ed. Engl., 1995, 34, 2039-2041; Acc. Chem. Res., 2001, 34, 18-29; Handbook of Metathesis, Grubbs, R.H. Ed., Wiley-VCH, Weinheim, Germany, 2003; Angew. Chem. Int. Ed., 2003, 42, 1900-1923; Angew. Chem., Int. Ed., 2005, 44, 4490-4527. Под гидрированием подразумевают хорошо известное присоединение водорода к ненасыщенной углерод-углеродной связи, в подходящих растворителях, таких как низшие спирты, простые и сложные эфиры, посредством воздействия атмосферы водорода и при использовании переходных металлов в качестве катализаторов. Эти и дальнейшие модификации кратной углеродной связи, как например гидроборирование, оксимеркурирование и эпоксидирование, подробно описаны, например, в Organikum, Wiley-VCH, 22-ое изд., с.228 и последующие. Дигидроксилирование двойной связи можно осуществлять, например, путем дигидроксилирования по Sharpless, с превращением кратной углеродной связи в 1,2-диолы, используя катализатор на основе осмия, стехиометрическое количество окислителя, такого как K3Fe(CN)6, в буфере, где предназначено, при добавлении хиральных лигандов или приготовленных заранее смесей, таких как AD--Mix, в подходящих растворителях.
Циклопропанирования осуществляют по кратным углеродным связям при использовании источников карбена, в инертных растворителях, таких как простые эфиры, например, с помощью метода Симмонса-Смита (дигалогенметан и пара цинк/медь) или метода Фурукава (дигалогенметан и диэтилцинк), как описано, например, в J. Am. Chem. Soc., 1958, 80, 5323-5324; дифторциклопропанирования можно осуществлять, как описано в J. Fluorine Chem., 2004, 125, 459, например, путем нагревания с триметилсилилфторсульфонилдифторацетатом и каталитическими количествами фторида, без растворителя или в инертных высококипящих растворителях.
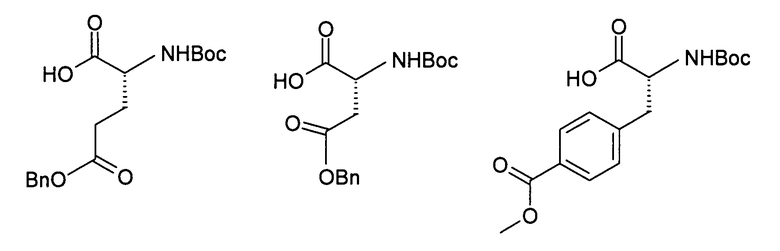
Производные аминокислот, имеющие сульфоновую группу в боковой цепи, можно получать, например, путем окисления соответствующих производных цистеина или других, содержащих серу, боковых цепей, в инертных растворителях, с помощью окислителей, таких как, например, оксон или м-хлорнадбензойная кислота.
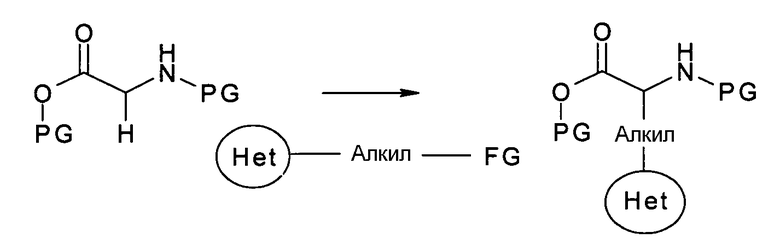
Производные аминокислот, имеющие Het-алкилиденовый радикал в боковой цепи, или коммерчески доступны или их можно получать путем алкилирования, как показано на следующей схеме, при условиях, как описано выше для аллилирования:
где FG представляет собой подходящую удаляемую группу, такую как галоген или эфир сульфоновой кислоты, и PG представляет собой подходящую защитную группу. Энантиомеры этих аминокислот можно получать, например, с помощью хиральной хроматографии. Альтернативно, производные можно получать путем конденсации гетероциклических альдегидов с аминокислотами или производными аминомалоновой кислоты, где предназначено, при добавлении минеральных кислот или органической кислоты в качестве катализаторов или дегидратирующих агентов, таких как эфиры ортомуравьиной кислоты или неорганические сульфаты, и путем последующего гидрирования, где предназначено, при использовании хиральных катализаторов гидрирования:
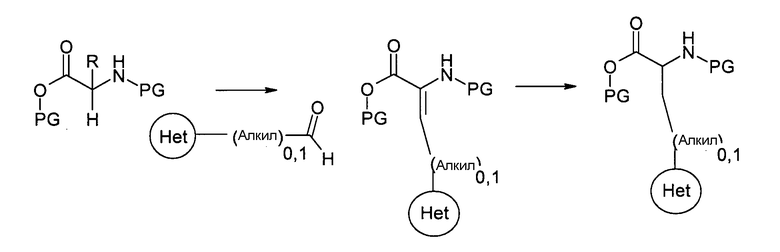
R=H или -COOPG,
где PG представляет собой подходящую защитную группу.
Соединение формулы (I), получаемые с помощью этих способов, или подходящий предшественник соединения формулы (I), который встречается в энантиомерной форме, вследствие его химической структуры, можно фракционировать путем солеобразования с энантиомерночистыми кислотами или основаниями, хроматографии на хиральных стационарных фазах или дериватизации посредством хиральных, энантиомерночистых, соединений, таких как аминокислоты, путем разделения диастереомеров, полученных таким образом, и удаления хиральных вспомогательных групп, до чистых энантиомеров (способ b), или соединение формулы (I), полученное, как представлено на схеме 1 или 3, можно или выделять в свободной форме или превращать в физиологически толерантные соли, в случае, где присутствуют кислотные или основные группы (способ d).
На стадии способа h), соединение формулы (I), если оно находится в виде смеси диастереомеров или энантиомеров, или получено в виде их смеси, согласно выбранному пути синтеза, разделяют на чистые стереоизомеры, или с помощью хроматографии на необязательном хиральном носителе, или, если рацемическое соединение формулы (I) способно образовывать соли, путем фракционной кристаллизации диастереомерных солей, образованных с оптически активным основанием или кислотой, в качестве вспомогательных агентов. Примерами подходящих хиральных стационарных фаз для тонкослойного или колоночного хроматографического разделения энантиомеров являются модифицированные носители на основе силикагеля (называемые Pirkle-фазы) и карбогидраты с высокой молекулярной массой, такие как триацетилцеллюлоза. Для аналитических целей также возможно использование методов газовой хроматографии, после соответствующей дериватизации, известной квалифицированному специалисту, на хиральных стационарных фазах. Для разделения энантиомеров рацемических карбоновых кислот, получают диастереомерные соли, различающиеся по растворимости, с оптически активным, обычно коммерчески доступным, основанием, таким как (-)-никотин, (+)- и (-)-фенилэтиламин, хинин, L-лизин или L- и D-аргинин, менее растворимый компонент выделяют в виде твердого вещества, более растворимый диастереомер осаждают из маточного раствора, и чистые энантиомеры получают из диастереомерных солей, полученных таким образом. Таким же образом, в принципе, можно превращать рацемические соединения формулы (I), включающие основную группу, такую как аминогруппа, при использовании оптически активных кислот, таких как (+)-камфор-10-сульфоновая кислота, D- и L-винная кислота, D- и L-молочная кислота и (+)- и (-)-миндальная кислота, в чистые энантиомеры. Хиральные соединения, содержащие функциональные спиртовые группы или аминогруппы, также можно превращать, при использовании соответствующим образом активированных или необязательно N-защищенных энантиомерно чистых аминокислот, в соответствующие сложные эфиры или амиды, или, наоборот, хиральные карбоновые кислоты можно превращать, при использовании энантиомерно чистых аминокислот с защищенной карбоксильной группой, в амиды, или при использовании энантиомерно чистых гидроксикарбоновых кислот, таких как молочная кислота, в соответствующие хиральные сложные эфиры. Хиральность аминокислотного или спиртового остатка, введенного в энантиомерно чистую форму, можно затем использовать для разделения изомеров путем осуществления разделения диастереомеров, имеющихся в данный момент, путем кристаллизации или хроматографии на подходящих стационарных фазах, и затем удаления введенных хиральных фрагментов снова с помощью подходящих способов.
Дальнейшей возможностью, в отношении некоторых из соединений согласно данному изобретению, является использование диастереомерно- или энантиомерночистых исходных веществ для получения каркасных структур. Таким образом, где предназначено, также можно использовать другие или упрощенные способы очистки конечных продуктов. Эти исходные вещества предварительно получают энантиомерно- или диастереомерночистыми известными из литературы способами. Под этим можно подразумевать, в частности, что или при синтезе основных структур используют энантиоселективные способы, или еще разделение энантиомеров (или диастереомеров) осуществляют на ранней стадии синтеза, а не на стадии конечных продуктов. Упрощение этих разделений может быть также достигнуто путем обработки в две или более стадии.
Кислотные или основные продукты в случае соединения формулы (I) могут быть в форме их солей или в свободной форме. Фармакологически приемлемые соли являются предпочтительными, например, соли со щелочными металлами или щелочноземельными металлами, соли с минеральными кислотами, такие как гидрохлориды, гидробромиды, сульфаты, гемисульфаты, всевозможные фосфаты, и соли аминокислот, природных оснований или карбоновых кислот.
Физиологически толерантные соли получают из соединений формулы (I), способных к образованию солей, включая их стереоизомерные формы, на стадии h) способа, самим по себе известным образом. Соединения формулы (I) образуют стабильные соли со щелочным металлом, щелочноземельным металлом или, где предназначено, стабильные замещенные аммониевые соли при использовании основных реагентов, таких как гидроксиды, карбонаты, бикарбонаты, алкоголяты и аммиак или органические основания, например, триметил- или триэтиламин, этаноламин, диэтаноламин или триэтаноламин, трометамол, или еще основные аминокислоты, например, лизин, орнитин или аргинин. Если соединения формулы (I) имеют основные группы, то также можно получать стабильные аддитивные соли кислот с сильными кислотами. Подходящими для этой цели являются как неорганические, так и органические кислоты, такие как хлористоводородная кислота, бромистоводородная кислота, серная кислота, гемисерная кислота, фосфорная кислота, метансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, 4-бромбензолсульфоновая кислота, циклогексиламидосульфоновая кислота, трифторметилсульфоновая кислота, 2-гидроксиэтансульфоновая кислота, уксусная кислота, щавелевая кислота, винная кислота, янтарная кислота, глицеринфосфорная кислота, молочная кислота, яблочная кислота, адипиновая кислота, лимонная кислота, фумаровая кислота, малеиновая кислота, глюконовая кислота, глюкуроновая кислота, пальмитиновая кислота или трифторуксусная кислота.
Данное изобретение также относится к лекарственным средствам, характеризующимся эффективным содержанием, по меньшей мере, одного соединения формулы (I) и/или физиологически толерантной соли соединения формулы (I) и/или необязательно стереоизомерной формы соединения формулы (I), вместе с фармацевтически приемлемым и физиологически толерантным носителем, добавкой и/или дополнительными активными ингредиентами и эксципиентами.
Вследствие их фармакологических свойств, соединения согласно данному изобретению пригодны для профилактики, вторичной профилактики и лечения всех нарушений, которые можно лечить путем ингибирования TAFIa. Таким образом, ингибиторы TAFIa пригодны как для профилактического, так и для терапевтического применения в случае людей. Эти ингибиторы пригодны как для неотложной терапии, так и для долговременной терапии. Ингибиторы TAFIa можно применять в случае пациентов, страдающих от ухудшения здоровья или нарушений, связанных с тромбозами, эмболиями, гиперкоагуляцией или фиброзными изменениями.
Эти заболевания включают инфаркт миокарда, стенокардию и все другие формы острого коронарного синдрома, удар, периферические сосудистые нарушения, тромбоз глубоких вен, эмболию сосудов легких, эмболические или тромботические явления, вызванные сердечной аритмией, сердечно-сосудистые явления, такие как рестеноз после реваскуляризации, ангиопластики и подобных процедур, таких как имплантации стентов и операции шунтирования. Ингибиторы TAFIa можно дополнительно использовать в случае всех процедур, приводящих к контакту крови с инородными поверхностями, такими как, например, в случае подвергаемых диализу пациентов и пациентов с постоянными катетерами. Ингибиторы TAFIa можно использовать для снижения риска тромбоза после хирургических вмешательств, таких как операции коленного и тазобедренного суставов.
Ингибиторы TAFIa пригодны для лечения пациентов с диссеминированной внутрисосудистой коагуляцией, сепсисом и другими внутрисосудистыми явлениями, связанными с воспалением. Ингибиторы TAFIa, кроме того, пригодны для профилактики и лечения пациентов с атеросклерозом, диабетом и метаболическим синдромом и их последствиями. Повреждение гемостатической системы (например, отложения фибрина) вовлечено в механизмы, приводящие к росту опухоли и метастазу опухоли, и к воспалительным и дегенеративным суставным нарушениям, таким как ревматоидный артрит и артроз. Ингибиторы TAFIa пригодны для замедления или предупреждения таких процессов.
Далее, показаниями для применения ингибиторов TAFIa являются фиброзные изменения в легких, такие как хроническое обструктивное заболевание легких, респираторный дистресс-синдром у взрослых (ARDS) и глазное заболевание, такое как отложения фибрина после глазных операций. Ингибиторы TAFIa также пригодны для предупреждения и/или лечения рубцевания.
Лекарственные средства согласно данному изобретению можно вводить пероральным путем, путем ингаляции, ректальным или трансдермальным путем введения, или подкожным, внутрисуставным, интраперитонеальным путем или в виде внутривенной инъекции. Пероральное введение является предпочтительным. Стенты и другие поверхности, которые вступают в контакт с кровью в организме, могут быть покрыты ингибиторами TAFIa.
Данное изобретение также относится к способу получения лекарственного средства, который включает получение подходящей дозированной формы, по меньшей мере, из одного соединения формулы (I) с фармацевтически приемлемым и физиологически толерантным носителем, и, где предназначено, дополнительными подходящими активными ингредиентами, добавками или эксципиентами.
Подходящими твердыми или фармацевтическими препаративными формами являются, например, гранулы, порошки, таблетки с покрытием, таблетки, (микро)капсулы, суппозитории, сиропы, растворы, суспензии, эмульсии, капли или растворы для инъекций, и продукты с пролонгированным высвобождением активного ингредиента, при получении которых используют стандартные вспомогательные агенты, такие как носители, дезинтегрирующие средства, связующие вещества, агенты для нанесения покрытия, способствующие набуханию агенты, придающие скольжение вещества или лубриканты, ароматизаторы, подслащивающие вещества и солюбилизаторы. Эксципиентами, которые часто используют и которые можно указать, являются карбонат магния, диоксид титана, лактоза, манит и другие сахара, тальк, молочный белок, желатин, крахмал, целлюлоза и ее производные, животные и растительные масла, такие как рыбий жир, подсолнечное масло, арахисовое масло или кунжутное масло, полиэтиленгликоль, и растворители, такие как, например, стерильная вода и одноатомные или многоатомные спирты, такие как глицерин.
Фармацевтические продукты предпочтительно получают и вводят в дозированных единицах, где каждая единица содержит в качестве активного ингредиента определенную дозу соединения формулы (I) согласно данному изобретению. В случае твердых дозированных единиц, таких как таблетки, капсулы, таблетки с покрытием или суппозитории, эта доза может быть равной примерно 1000 мг, однако, предпочтительно, примерно 50-300 мг, и, в случае растворов для инъекций в ампульной форме, вплоть до примерно 300 мг, однако, предпочтительно, примерно 10-100 мг.
Суточные дозы, показанные для лечения взрослого пациента массой примерно 70 кг, в зависимости от активности соединения формулы (I), составляют от примерно 2 мг до 1000 мг активного ингредиента, предпочтительно, примерно 50-500 мг. Однако, в некоторых случаях, также могут быть подходящими более высокие или более низкие суточные дозы. Суточную дозу можно вводить или путем однократного введения, в виде одной дозированной единицы, или еще в виде множества более маленьких дозированных единиц, или путем многократного введения разделенных доз в конкретные интервалы.
Ингибиторы TAFIa можно вводить как в виде монотерапии, так и в комбинации или совместно со всеми антитромботическими средствами (антикоагулянты и ингибиторы агрегации тромбоцитов), с тромболитическими средствами (активаторы плазминогена любого типа), с другими веществами, обладающими профибринолитической активностью, с антигипертензивными средствами, с регуляторами уровня глюкозы в крови, со снижающими уровень липидов агентами и с антиаритмическими средствами.
ПРИМЕРЫ
Конечные продукты обычно определяют с помощью методов масс-спектрометрии (FAB-, ESI-MS) и 1Н-ЯМР; в каждом случае указывают пик молекулярного иона или два пика молекулярного иона.
Температуры даны в градусах Цельсия, RT означает комнатную температуру (21-24оС). TFA (ТФУК) означает трифторуксусную кислоту, THF (ТГФ) означает тетрагидрофуран, DMF (ДМФА) означает диметилформамид, HATU означает 2-(7-аза-1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилуронийгексафторфосфат, HOAt означает 1-гидрокси-7-азабензотриазол. Используемые аббревиатуры являются либо поясненными, либо соответствующими обычно принятым условным обозначениям.
За исключением иначе указанного, анализы LC/MS осуществляют при следующих условиях:
Способ А: = колоночный метод: YMC Jsphere H80, размер 20×2 мм, наполнитель 4 мкм, подвижная фаза: CH3CN:H2O+0,05% трифторуксусной кислоты (ТФУК), градиент: от 4:96 (0 мин) до 95:5 (2,0 мин), до 95:5 (2,4 мин), до 4:96 (2,45 мин), объемная скорость потока: 1,0 мл/мин, температура: 30оС.
Способ В: колонка: Phenomenex LunaC18, размер 10×2,0 мм, наполнитель 3 мкм, подвижная фаза: CH3CN:H2O+0,05% ТФУК, градиент: от 7:93 (0 мин) до 95:5 (1,2 мин), до 95:5 (1,4 мин), до 7:93 (1,45 мин), объемная скорость потока: 1,1 мл/мин, температура: 30оС.
Способ С: колонка: WatersXBridgeC18, размер 4,6×50 мм, 2,5 мкм, градиент: H2O+0,05% ТФУК: CH3CN+0,05% ТФУК, от 95:5 (0 мин) до 95:5 (0,3 мин), до 5:95 (3,5 мин), до 5:95 (4 мин), объемная скорость потока: 1,3 мл/мин, температура: 40оС.
Способ D: колонка: Waters XBridgeC18, размер 4,6×50 мм, 2,5 мкм, градиент: H2O+0,1% муравьиной кислоты: CH3CN+0,08% муравьиной кислоты, от 97:3 (0 мин) до 40:60 (3,5 мин), до 2:98 (4 мин), до 2:98 (5 мин), до 97:3 (5,2 мин), до 97:3 (6,5 мин), объемная скорость потока: 1,4 мл/мин, температура: комнатная.
Способ Е: колонка: YMC Jsphere, размер 33×2 мм, 4 мкм, Н80, градиент: H2O+0,05% ТФУК: CH3CN+0,05% ТФУК, от 98:2 (1 мин) до 5:95 (5,0 мин), до 5:95 (6,25 мин), объемная скорость потока: 1 мл/мин, температура: комнатная.
Способ F: колонка: WatersXBridgeC18, размер 4,6×50 мм, 2,5 мкм, градиент: H2O+0,1% муравьиной кислоты: CH3CN+0,1% муравьиной кислоты, от 97:3 (0 мин) до 40:60 (3,5 мин), до 2:98 (4 мин), до 2:98 (5 мин), до 97:3 (5,2 мин), до 97:3 (6,5 мин), температура: комнатная.
Способ G: колонка: WatersXBridgeC18, размер 4,6×50 мм, 2,5 мкм, градиент: H2O+0,05% ТФУК: CH3CN+0,05% ТФУК, от 95:5 (0 мин) до 95:5 (0,2 мин), до 5:95 (2,4 мин), до 5:95 (3,5 мин), до 95:5 (3,6 мин), до 95:5 (4,5 мин), объемная скорость потока: 1,7 мл/мин, температура: 50°С.
Способ Н: колонка: WatersXBridgeC18, размер 4,6×50 мм, 2,5 мкм, градиент: H2O+0,05% ТФУК: CH3CN+0,05% ТФУК, от 95:5 (0 мин) до 95:5 (0,2 мин), до 5:95 (2,4 мин), до 5:95 (3,2 мин), до 95:5 (3,3 мин), до 95:5 (4,0 мин), объемная скорость потока: 1,7 мл/мин, температура: 40°С.
Способ I: колонка: Merck Chromolith FastGrad RP-18e, размер 50×2 мм, градиент: H2O+0,05% ТФУК: CH3CN+0,05% ТФУК, от 98:2 (0,2 мин) до 2:98 (2,4 мин), до 2:98 (3,2 мин), до 98:2 (3,3 мин), до 98:2 (4 мин), объемная скорость потока: 2,0 мл/мин, температура: комнатная.
Способ J: колонка: YMC Jsphere, размер 33 × 2 мм, 4 мкм, градиент: H2O+0,05% ТФУК: CH3CN+0,05% ТФУК, от 98:2 (1 мин) до 5:95 (5,0 мин), до 5:95 (6,25 мин), объемная скорость потока: 1 мл/мин, температура: комнатная.
Способ К: колонка: YMC Jsphere, размер 33×2 мм, 4 мкм, Н80, градиент: H2O+0,05% ТФУК: CH3CN+0,05% ТФУК, от 96:4 (0 мин) до 5:95 (2,0 мин), до 5:95 (2,4 мин), до 96:4 (2,45 мин).
Способ L: колонка: YMC Jsphere, размер 33×2 мм, 4 мкм, градиент: CH3OH+0,05% ТФУК: H2O+0,05% ТФУК, от 2:98 (1 мин) до 95:5 (5 мин), до 95:5 (6,25 мин), объемная скорость потока: 1 мл/мин, температура: комнатная.
За исключением иначе указанного, разделения с помощью хроматографии осуществляют на силикагеле при использовании смеси этилацетат/гептан в качестве подвижной фазы. Разделения с помощью препаративной хроматографии с обращенными фазами (RP) на силикагеле (ВЭЖХ) осуществляют, за исключением иначе указанного, при использовании фаз С18-RP в качестве стационарной фазы и при использовании смесей H2O-ТФУК-ацетонитрил в качестве подвижной фазы.
Выпаривание растворителей обычно осуществляют при пониженном давлении в роторном испарителе при температуре 35-45°С.
Пример 1-1
(S)-6-Амино-2-[3-((9S,12R)-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17),14(18),15-триен-12-ил)уреидо]гексановая кислота
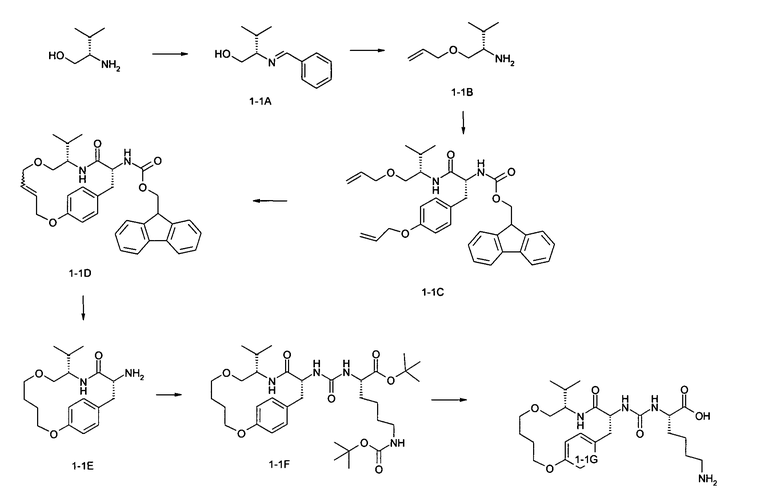
А. (S)-3-Метил-2-{[1-фенилметилиден]амино}бутан-1-ол
2,64 мл (2,78 г, 26,16 ммоль) Бензальдегида добавляют к перемешиваемому раствору 2,57 г (24,91 ммоль) L-валинола в 28 мл толуола и смесь кипятят с обратным холодильником, с водоотделителем, в течение одного часа. Охлаждают с последующим концентрированием и перекристаллизацией из гептана. Бесцветное твердое вещество отфильтровывают под вакуумом и высушивают при пониженном давлении (3,74 г).
1H-ЯМР (ДМСО-d6, 400 МГц) δ [м.д.] = 8,23 (с, 1H), 7,77 (д, 2H), 7,45-7,40 (м, 3H), 4,49 (т, 1H), 3,68-3,31 (м, 1H), 3,48-3,40 (м, 1H), 2,96 (ддд, 1H), 1,94-1,81 (м, 1H), 0,88 (с, 5H).
В. (S)-1-Аллилоксиметил-2-метилпропиламин
1,25 г (60%; 31,36 ммоль) Гидрида натрия добавляют к раствору 3,00 г (15,68 ммоль) (S)-3-метил-2-{[1-фенилметилиден]амино}-бутан-1-ола в 28 мл безводного ТГФ и смесь перемешивают при комнатной температуре в течение 45 минут. Затем добавляют 1,43 мл (16,46 ммоль) аллилбромида и смесь перемешивают далее при комнатной температуре в течение ночи. Добавляют 20 мл метанола для гашения и смесь подкисляют (рН=1) 1 н соляной кислотой и перемешивают далее. Спустя 3 часа, реакционную смесь дважды промывают дихлорметаном и объединенные дихлорметановые фазы экстрагируют 1 н соляной кислотой. Объединенные водные фазы подщелачивают 1 н раствором гидроксида натрия (рН=14), насыщают хлоридом натрия и три раза экстрагируют этилацетатом, регулируя рН после каждой стадии экстракции. Объединенные органические фазы сушат над сульфатом натрия, отфильтровывают и концентрируют, и один раз обрабатывают дихлорметаном и снова концентрируют. Получают 1,56 г указанного в заголовке соединения в виде жидкости светло-желтого цвета.
LC/MS (способ А): Rt=0,68 мин, m/z: 144,2 [МН+].
С. 9Н-Флуорен-9-илметил-[(R)-1-((S)-1-аллилоксиметил-2-метилпропилкарбамоил)-2-(4-аллилоксифенил)этил]карбамат
25,74 г (58,04 ммоль) (R)-3-(4-Аллилоксифенил)-2-(9Н-флуорен-9-илметоксикарбониламино)пропионовой кислоты вносят в 400 мл ТГФ и после последующего добавления 8,88 г (58,04 ммоль) N-гидроксибензотриазола и 11,98 г (58,04 ммоль) N,N'-дициклогексилкарбодиимида перемешивают при комнатной температуре. После выдерживания смеси в течение ночи, ее отфильтровывают и концентрируют. Остаток обрабатывают этилацетатом и последовательно промывают насыщенным раствором бикарбоната натрия и разбавленной соляной кислотой. Органическую фазу сушат над сульфатом натрия и концентрируют, и остаток разделяют с помощью хроматографии на силикагеле. Получают 13,55 г желательного соединения.
LC/MS (способ А): Rt=1,95 мин, m/z: 569,3 [МН+].
D. 9Н-Флуорен-9-илметил-((9S,12R)-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17),4,14(18),15-тетраен-12-ил)карбамат
Раствор 1,25 г (2,20 ммоль) 9Н-флуорен-9-илметил-[(R)-1-((S)-1-аллилоксиметил-2-метилпропилкарбамоил)-2-(4-аллилоксифенил)этил]карбамата и 0,40 г (0,659 ммоль) дихлор(о-изопропоксифенилметилен)(трициклогексилфосфин)рутения (катализатор Hoyveda-Grubbs) в 610 мл дихлорметана перемешивают при температуре 40°С в течение 24 часов. Реакционную смесь затем концентрируют, и остаток очищают с помощью хроматографии на силикагеле. Получают 1,03 г желательного соединения в виде бесцветного твердого вещества.
LC/MS (способ А): Rt=1,75 мин, m/z: 541,3 [МН+].
Е. (9S,12R)-12-Амино-9-изопропил-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17),14(18),15-триен-11-он
Смесь 6,82 г (12,62 ммоль) 9Н-флуорен-9-илметил-((9S,12R)-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17),4,14(18),15-тетраен-12-ил)карбамата и 4,4 г 10%-ного Pd/C, в 880 мл метанола перемешивают в атмосфере водорода при комнатной температуре. Спустя 6 часов, смесь отфильтровывают и освобождают от растворителя. Остаток разделяют с помощью препаративной ВЭЖХ. Требующиеся фракции объединяют, выпаривают ацетонитрил и полученный водный раствор слегка подщелачивают бикарбонатом натрия. Водную фазу несколько раз экстрагируют этилацетатом и объединенные органические фазы сушат над сульфатом натрия, отфильтровывают и концентрируют. Хроматографируют на силикагеле при использовании смеси этилацетат/метанол, получая указанное в заголовке соединение (2,90 г).
LC/MS (способ А): Rt=1,02 мин, m/z: 321,2 [МН+].
F. трет-Бутил-(S)-6-трет-бутоксикарбониламино-2-[3-((9S,12R)-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17),14(18),15-триен-12-ил)уреидо]гексаноат
Раствор 1,59 г (4,68 ммоль) трет-бутил-(S)-2-амино-6-трет-бутоксикарбониламиногексаноатгидрохлорида, 1,43 мл (1,04 г, 10,30 ммоль) триэтиламина и 0,76 г (4,68 ммоль) карбонилдиимидазола, в 25 мл диметилформамида (ДМФА), перемешивают при комнатной температуре в течение 1 часа и затем добавляют раствор 1,5 г в 20 мл ДМФА. Смесь перемешивают при комнатной температуре и оставляют стоять в течение ночи. Выпаривают растворитель, с последующим распределением между этилацетатом и водой, и органическую фазу сушат над сульфатом натрия, отфильтровывают и концентрируют. Остаток выделяют с помощью препаративной ВЭЖХ и требующиеся фракции объединяют и освобождают от ацетонитрила. Раствор бикарбоната натрия используют для легкого подщелачивания и смесь экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия, отфильтровывают и концентрируют. Получают 0,73 г указанного в заголовке соединения.
LC/MS (способ А): Rt=1,68 мин, m/z: 649,4 [МН+].
G. (S)-6-Амино-2-[3-((9S,12R)-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17),14(18),15-триен-12-ил)уреидо]гексановая кислота
0,71 г (1,10 ммоль) трет-Бутил-(S)-6-трет-бутоксикарбониламино-2-[3-((9S,12R)-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17),14(18),15-триен-12-ил)уреидо]гексаноата растворяют в 11 мл дихлорметана и добавляют равный объем трифторуксусной кислоты. Перемешивают при комнатной температуре в течение 4 часов, затем концентрируют и фракционируют остаток с помощью препаративной ВЭЖХ. Требующиеся фракции объединяют и, после выпаривания ацетонитрила, смешивают с разбавленной соляной кислотой, затем концентрируют и, наконец, подвергают сушке вымораживанием. Получают 0,42 г указанного в заголовке соединения в виде гидрохлорида.
1H-ЯМР (ДМСО-d6, 400 МГц) δ [м.д.] = 7,79 (3H, уш.с), 7,22 (1H, д), 6,99-6,90 (м, 3H), 6,87 (д, 1H), 6,29 (д, 1H), 5,79 (д, 1H), 4,32-4,17 (м, 3H), 4,10 (дд, 1H), 3,29-3,18 (м, 3H), 3,12 (дд, 1H), 2,96-2,87 (м, 2H), 2,83-2,72 (м, 2H), 2,65 (дд, 1H), 1,78-1,2 (м, 11H), 0,72 (д,3H), 0,67 (д, 2H).
LC/MS (способ А): Rt=0,94 мин, m/z: 493,4 [МН+].
Соединения следующих примеров получают аналогичным образом, используя подходящие аминоспирты вместо валинола.
Пример 2-1
(S)-6-Амино-2-[3-((13S,16R)-13-изопропил-15-оксо-2,11-диокса-14-азабицикло[16.2.2]докоза-1(21),18(22),19-триен-16-ил)уреидо]гексановая кислота
А. (R)-1-(2-Гепт-6-енилоксиэтил)-2-метилпропиламин
Приготовляют раствор 3,00 г (15,68 ммоль) (S)-3-метил-2-{[1-фенилметилиден]амино}бутан-1-ола (1-1А) в 28 мл безводного ТГФ, в атмосфере аргона, добавляют 1,50 г (60%; 37,51 ммоль) гидрида натрия и смесь перемешивают в течение 45 минут. Добавляют 2,83 г (15,68 ммоль) 7-бромгепт-1-ена, с последующим перемешиванием далее в течение ночи, осторожно гасят с помощью 20 мл метанола, затем добавляют 300 мл 1 н соляной кислоты (рН=1) и перемешивают при температуре 40оС в течение 2 часов. Смесь промывают дихлорметаном и водную фазу доводят до рН=14 с помощью 1 н раствора гидроксида натрия, и три раза экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия, отфильтровывают и концентрируют. Получают 0,91 г сырого продукта. Этот сырой продукт затем вводят далее в реакцию без дальнейшей очистки.
LC/MS (способ В): Rt=0,72 мин, m/z: 200,2 [МН+].
В. 9Н-Флуорен-9-илметил[(R)-2-(4-аллилоксифенил)-1-((S)-1-гепт-6-енилоксиметил-2-метилпропилкарбамоил)этил]карбамат
Раствор 2,02 г (4,57 ммоль) N-α-(9-флуоренилметилоксикарбонил)-О-аллил-D-тирозина в 46 мл ДМФА смешивают с 0,77 г (5,02 ммоль) 1-гидроксибензотриазола и 1,04 г (5,02 ммоль) N,N'-дициклогексилкарбодиимида и перемешивают при комнатной температуре в течение 2 часов. Затем, добавляют 0,91 г (4,57 ммоль) (R)-1-(2-гепт-6-енилоксиэтил)-2-метилпропиламина и смесь перемешивают далее при комнатной температуре и оставляют стоять в течение ночи. Осадок затем отфильтровывают, фильтрат концентрируют и остаток обрабатывают этилацетатом и последовательно промывают насыщенным раствором бикарбоната натрия и разбавленной соляной кислотой, и органическую фазу сушат над сульфатом натрия, отфильтровывают и концентрируют. Остаток разделяют с помощью препаративной ВЭЖХ и требующиеся фракции объединяют, освобождают от ацетонитрила и экстрагируют этилацетатом. Органическую фазу сушат над сульфатом натрия, отфильтровывают и концентрируют. Получают 1,02 г указанного в заголовке соединения (способ D): Rt=5,49 мин, m/z: 669 [М-Н+НСООН].
С. 9Н-Флуорен-9-илметил((13S,16R)-13-изопропил-15-оксо-2,11-диокса-14-азабицикло[16.2.2]докоза-1(21),4,18(22),19-тетраен-16-ил)карбамат
Раствор 1,01 г (1,61 ммоль) 9Н-флуорен-9-илметил[(R)-2-(4-аллилоксифенил)-1-((S)-1-гепт-6-енилоксиметил-2-метилпропилкарбамоил)этил]карбамата и 0,15 г (0,24 ммоль) дихлор(о-изопропоксифенилметилен)(трициклогексилфосфин)рутения (катализатор Hoyveda-Grubbs) в 460 мл дихлорметана перемешивают при температуре 40оС в течение 24 часов. Реакционную смесь затем концентрируют и остаток очищают с помощью хроматографии на силикагеле. Получают 0,87 г желательного соединения в виде бесцветного твердого вещества.
LC/MS (способ С): Rt=4,30 мин, m/z: 597,39 [МН+].
D. (13S,16R)-16-Амино-13-изопропил-2,11-диокса-14-азабицикло[16.2.2]докоза-1(21),18(22),19-триен-15-он
Смесь 0,87 г (1,46 ммоль) 9Н-флуорен-9-илметил((13S,16R)-13-изопропил-15-оксо-2,11-диокса-14-азабицикло[16.2.2]докоза-1(21),4,18(22),19-тетраен-16-ил)карбамата и 0,16 г 10%-ного Pd/C в 100 мл метанола перемешивают в атмосфере водорода, при комнатной температуре. После перемешивания в течение ночи и добавления 0,5 мл пиперидина, продолжают перемешивать в течение 2 часов и смесь отфильтровывают и освобождают от растворителя. Остаток разделяют с помощью препаративной ВЭЖХ. Требующиеся фракции объединяют и подвергают сушке вымораживанием. Получают 0,18 г указанного в заголовке соединения в виде трифторацетата.
LC/MS (способ С): Rt=3,07 мин, m/z: 377,22 [МН+].
Е. (S)-6-Амино-2-[3-((13S,16R)-13-изопропил-15-оксо-
2,11-диокса-14-азабицикло[16.2.2]докоза-1(21),18(22),
19-триен-16-ил)уреидо]гексановая кислота
Раствор 0,18 г (0,37 ммоль) (13S,16R)-16-амино-13-изопропил-2,11-диокса-14-азабицикло[16.2.2]докоза-1(21),18(22),19-триен-15-она в 3,8 мл ДМФА добавляют к 60 мг (0,37 ммоль) 1,1'-карбонилдиимидазола и, после добавления 0,2 мл (0,15 г, 1,47 ммоль) триэтиламина, перемешивают в атмосфере аргона. Спустя 10 минут, добавляют 124 мг (0,37 ммоль) трет-бутил-(S)-2-амино-6-трет-бутоксикарбониламиногексаноат-гидрохлорида и смесь перемешивают в течение 3 часов. Смесь концентрируют и распределяют между водой и этилацетатом, и органическую фазу сушат над сульфатом натрия, отфильтровывают и концентрируют. Остаток очищают с помощью препаративной ВЭЖХ. Требуемые фракции объединяют и концентрируют. Остаток обрабатывают 20 мл смеси дихлорметан/ТФУК (1:1, об./об.) и оставляют стоять в течение 2 часов. Смесь концентрируют, растворяют в 1 н соляной кислоте с небольшим количеством ацетонитрила и подвергают сушке вымораживанием. Получают аморфное твердое вещество (0,12 г) в виде гидрохлорида.
LC/MS (способ С): Rt=2,88 мин, m/z: 549,21 [МН+].
Пример 3-1
(S)-6-Амино-2-[3-((Е)-(9S,12R)-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17),4,14(18),15-тетраен-12-ил)уреидо]гексановая кислота
Указанное в заголовке соединение получают по аналогии с примером 1-1, пропуская стадию гидрирования и без конечной сушки вымораживанием, с использованием соляной кислоты, непосредственно в виде трифторацетата.
LC/MS (способ А): Rt=0,89 мин, m/z: 491,2 [МН+].
Пример 4-1
(S)-6-Амино-2-[3-((3S,6R)-3-изопропил-5-оксо-1-окса-4-азациклотетрадец-6-ил)уреидо]гексановая кислота
Указанное в заголовке соединение получают по аналогии с примером 2-1, используя Fmoc-D-аллилглицин вместо Fmoc-D-О-аллилтирозина.
LC/MS (способ С): Rt=2,35 мин, m/z: 443,34 [МН+].
Следующие соединения получают подобным образом, используя другие аминоспирты и, где предназначено, используя или вводя защитную сложноэфирную группу:
Пример 5-1
(R)-3-(2-Аминоэтансульфонил)-2-[3-((9S,12R)-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17),14(18),15-триен-12-ил)уреидо]пропионовая кислота
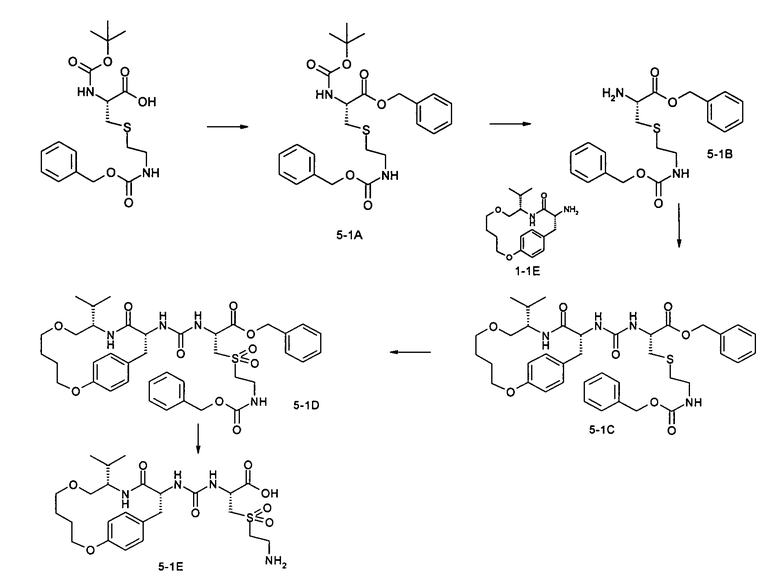
А. Бензил-(R)-3-(2-бензилоксикарбониламиноэтилсульфанил)-
2-трет-бутоксикарбониламинопропионат
Раствор 2,30 г (5,77 ммоль) (R)-3-(2-бензилоксикарбониламиноэтилсульфанил)-2-трет-бутоксикарбониламинопропионовой кислоты, 0,60 мл (0,62 г, 5,77 ммоль) бензилового спирта, 0,07 г (0,58 ммоль) 4-диметиламинопиридина и 1,33 г (6,93 ммоль) N-(3-диметиламинопропил)-N'-этилкарбодиимидгидрохлорида в 30 мл дихлорметана перемешивают при комнатной температуре в течение ночи. Реакционную смесь последовательно промывают 1 н соляной кислотой, 1 н раствором бикарбоната натрия и водой. После сушки над сульфатом натрия, отфильтровывания и концентрирования, остаток хроматографируют на силикагеле. Получают 2,09 г указанного в заголовке соединения в виде бесцветного масла.
LC/MS (способ С): Rt=3,63 мин, m/z: 389,17 [М-Вос+Н+].
В. Бензил-(R)-2-амино-3-(2-бензилоксикарбониламиноэтилсульфанил)пропионат
Раствор 0,50 г (1,023 ммоль) бензил-(R)-3-(2-бензилоксикарбониламиноэтилсульфанил)-2-трет-бутоксикарбониламинопропионата в 5 мл дихлорметана смешивают с равным объемом трифторуксусной кислоты и оставляют стоять при комнатной температуре в течение 1 часа. Затем концентрируют и непосредственно вводят во взаимодействие далее.
LC/MS (способ А): Rt=1,06 мин, m/z: 389,1 [МН+].
С. Бензил-(R)-3-(2-бензилоксикарбониламиноэтилсульфанил)-2-[3-((9S,12R)-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17),14(18),15-триен-12-ил)уреидо]пропионат
Раствор 166 мг (1,02 ммоль) 1,1'-карбонилдиимидазола в 8 мл ДМФА смешивают с 515 мг (1,02 ммоль) трифторацетата со стадии В и 0,57 мл (415 мг, 4,10 ммоль) триэтиламина. Раствор 328 мг (1,02 ммоль) (9S,12R)-12-амино-9-изопропил-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17),14(18),15-триен-11-она (1-1Е) в 8 мл ДМФА добавляют к этой смеси в атмосфере аргона и смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь затем концентрируют и разделяют с помощью препаративной ВЭЖХ. Требующиеся фракции объединяют и освобождают от ацетонитрила. Полученный водный раствор экстрагируют этилацетатом и органическую фазу сушат над сульфатом натрия, отфильтровывают и концентрируют. Получают 222 мг указанного в заголовке соединения.
LC/MS (способ А): Rt=1,72 мин, m/z: 735,3 [МН+].
D. Бензил-(R)-3-(2-бензилоксикарбониламиноэтансульфонил)-2-[3-((9S,12R)-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17),14(18),15-триен-12-ил)уреидо]пропионат
Смесь 222 мг (0,30 ммоль) бензил-(R)-3-(2-бензилоксикарбониламиноэтилсульфанил)-2-[3-((9S,12R)-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17),14(18),15-триен-12-ил)уреидо]пропионата в 5 мл метанола и 5 мл воды охлаждают до температуры 0оС и добавляют 742 мг (1,21 ммоль) оксона, в виде порций. Спустя 2 часа, смесь разбавляют этилацетатом и органическую фазу отделяют и еще дважды экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия, отфильтровывают и концентрируют. Получают 198 мг и вводят во взаимодействие далее без дальнейшей очистки.
LC/MS (способ А): Rt=1,54 мин, m/z: 767,3 [МН+].
Е. (R)-3-(2-Аминоэтансульфонил)-2-[3-((9S,12R)-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17),14(18),15-триен-12-ил)уреидо]пропионовая кислота
83 мг 5%-ного палладия-на-угле добавляют к раствору 198 мг (0,26 ммоль) бензил-(R)-3-(2-бензилоксикарбониламиноэтан-сульфонил)-2-[3-((9S,12R)-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17),14(18),15-триен-12-ил)уреидо]пропионата в 10 мл метанола и смесь гидрируют в атмосфере водорода (баллонное давление). После выдерживания в течение 2 суток, смесь отфильтровывают, концентрируют и очищают с помощью препаративной ВЭЖХ. Требующиеся фракции объединяют и, после добавления 1 н соляной кислоты, подвергают сушке вымораживанием. Получают 23 мг указанного в заголовке соединения в виде гидрохлорида.
LC/MS (способ С): Rt=2,35 мин, m/z: 543,26 [МН+].
Пример 5-2
(S)-3-(6-Аминопиридин-3-ил)-2-[3-((9S,12R)-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17),14(18),15-триен-12-ил)уреидо]пропионовая кислота
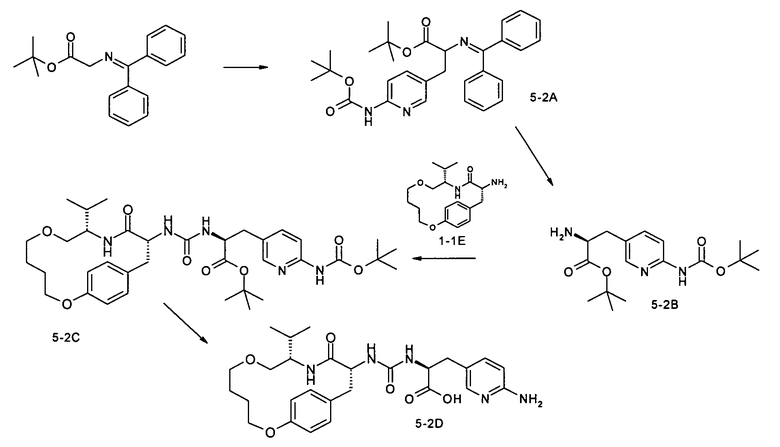
А. трет-Бутил-2-(бензгидрилиденамино)-3-(6-трет-бутоксикарбониламинопиридин-3-ил)пропионат
84,64 мл (84,64 ммоль) 1 М Раствора литийбис(триметилсилил)амида в ТГФ по каплям добавляют к раствору 25,00 г (84,64 ммоль) трет-бутилового эфира N-(дифенилметилен)глицина в 185 мл ТГФ, в атмосфере аргона и при температуре 0°С. После перемешивания при этой же температуре в течение 15 минут, добавляют 24,31 г (84,64 ммоль) трет-бутил(5-бромметилпиридин-2-ил)карбамата, в виде твердого вещества, и продолжают перемешивать в течение 1 часа. Реакционную смесь осторожно разбавляют водой и экстрагируют этилацетатом. Органическую фазу сушат над сульфатом натрия, отфильтровывают и концентрируют. Получают 44,08 г сырого продукта и вводят во взаимодействие далее без дальнейшей очистки.
LC/MS (способ А): Rt=1,68 мин, m/z: 502,2 [МН+].
В. трет-Бутил-(S)-2-амино-3-
(6-трет-бутоксикарбониламинопиридин-3-ил)пропионат
После добавления 4,14 г 10%-ного палладия-на-угле к раствору 19,50 г (38,87 ммоль) сырого продукта со стадии А, в 1,8 л метанола, его гидрируют при автогенном давлении. После завершения реакции, смесь отфильтровывают и концентрируют. Сырую смесь обрабатывают гептаном и смешивают с 45 мл 1 н соляной кислоты и 90 мл воды, и водную фазу добавляют к 90 мл 1 н раствора гидроксида натрия и четыре раза экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия, отфильтровывают и концентрируют. Рацемат разделяют с помощью хиральной хроматографии.
LC/MS (способ А): Rt=0,89 мин, m/z: 338,1 [МН+].
Хиральная хроматография (Chiralpak AD-H/44, 250×4,6 мм, этанол:метанол (1:1) + 0,1% диэтиламина, 40 минут): Rt=17,48 мин.
С. трет-Бутил-(S)-3-(6-трет-бутоксикарбониламинопиридин-
3-ил)-2-[3-((9S,12R)-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17),14(18),15-триен-12-ил)уреидо]пропионат
112 мг (0,69 ммоль) 1,1'-карбонилдиимидазола добавляют к смеси 234 мг (0,69 ммоль) трет-бутил-(S)-2-амино-3-(6-трет-бутоксикарбониламинопиридин-3-ил)пропионата и 106 мкл (77 мг, 0,76 ммоль) триэтиламина в 2,5 мл ДМФА. Раствор перемешивают при комнатной температуре в течение 1 часа, перед добавлением раствора 222 мг (0,69 ммоль) (9S,12R)-12-амино-9-изопропил-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17),14(18),15-триен-11-она (1-1Е) в 2,5 мл ДМФА. Смесь оставляют стоять в течение ночи и затем концентрируют и распределяют между водой и этилацетатом. Органическую фазу отделяют, сушат над сульфатом натрия, отфильтровывают и концентрируют. Остаток очищают с помощью препаративной ВЭЖХ. Требующиеся фракции объединяют, освобождают от ацетонитрила, слегка подщелачивают раствором бикарбоната натрия и экстрагируют этилацетатом. Органическую фазу сушат над сульфатом натрия, отфильтровывают и концентрируют.
LC/MS (способ А): Rt=1,47 мин, m/z: 684,3 [МН+].
D. (S)-3-(6-Аминопиридин-3-ил)-2-[3-((9S,12R)-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17),14(18),15-триен-12-ил)уреидо]пропионовая кислота
160 мг (0,23 ммоль) трет-бутил-(S)-3-(6-трет-бутоксикарбониламинопиридин-3-ил)-2-[3-((9S,12R)-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17),14(18),15-триен-12-ил)уреидо]пропионата растворяют в 6 мл дихлорметана и, после добавления равного объема ТГФ, перемешивают при комнатной температуре. Спустя 5 часов, смесь концентрируют и очищают с помощью препаративной ВЭЖХ. Требующиеся фракции объединяют, освобождают от ацетонитрила, смешивают с 1 н соляной кислотой, затем концентрируют и, наконец, подвергают сушке вымораживанием. Получают 108 мг указанного в заголовке соединения в виде гидрохлорида.
LC/MS (способ А): Rt=0,92 мин, m/z: 528,3 [МН+].
Пример 5-3
(S)-3-(6-Аминопиридин-3-ил)-2-[3-((9S,12R)-9-циклопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17),14(18),15-триен-12-ил)уреидо]пропионовая кислота
Указанное в заголовке соединение получают по аналогии с примером 5-2, из (S)-2-амино-2-циклопропилэтанола (патент США под номером 6191306) вместо соединения 1-1Е, используя (9S,12R)-12-амино-9-циклопропил-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17),14(18),15-триен-11-он.
LC/MS (способ J): Rt=2,39 мин, m/z: 526,41 [МН+].
Пример 5-4
(S)-6-Амино-2-[3-((9S,12R)-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17),14(18),15-триен-12-ил)уреидо]-6-метилгептановая кислота
Указанное в заголовке соединение получают по аналогии с примером 5-2, используя этил-(S)-2,6-диамино-6-метилгептаноатгидрохлорид, с добавлением триэтиламина в качестве вспомогательного основания.
LC/MS (способ С): Rt=2,34 мин, m/z: 521,26 [МН+].
Пример 5-5
Этил-(S)-3-(6-аминопиридин-3-ил)-2-[3-((9S,12R)-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17),14(18),15-триен-12-ил)уреидо]пропионат
Указанное в заголовке соединение получают по аналогии с примером 5-2, используя этиловый эфир N-(дифенилметилен)глицина вместо трет-бутилового эфира N-(дифенилметилен)глицина.
LC/MS (способ С): Rt=2,53 мин, m/z: 556,2 [МН+].
Следующие соединения получают аналогичным образом.
Пример 5-6
(S)-2-[3-((9S,12R)-9-Изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17),14(18),15-триен-12-ил)уреидо]-3-пиперидин-3-илпропионовая кислота
LC/MS (способ I): Rt=1,20 мин, m/z: 519,38 [МН+].
Пример 5-7
(S)-3-(6-Аминопиридин-3-ил)-2-[3-((9S,12R)-9-метил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17),14(18),15-триен-12-ил)уреидо]пропионовая кислота
LC/MS (способ В): Rt=0,54 мин, m/z: 500,3 [МН+].
Пример 6-1
(S)-3-(6-Аминопиридин-3-ил)-2-[3-((8S,11R)-8-изопропил-10-оксо-6-окса-1,9,14-триазабицикло[11.2.1]гексадека-13(16),14-диен-11-ил)уреидо]пропионовая кислота
А. (R)-3-(1-Аллил-1Н-имидазол-4-ил)-2-бензилоксикарбониламинопропионовая кислота
3,53 мл (4,24 г, 24,84 ммоль) Бензилхлорформиата добавляют к раствору 4,85 г (24,84 ммоль) (R)-3-(1-аллил-1Н-имидазол-4-ил)-2-аминопропионовой кислоты (как описано для (S)-энантиомера в Bioorg. Med. Chem., 2006, 14, 5981-5988) в 13 мл 2 н раствора гидроксида натрия, все время перемешивая, при температуре 0оС, и продолжают перемешивать при этой же температуре в течение 2 часов, с добавлением еще 13 мл 2 н раствора гидроксида натрия, и смесь нагревают до комнатной температуры. Реакционную смесь покрывают слоем этилацетата и значение рН доводят до 3-4 с помощью 6 н соляной кислоты. Органическую фазу отделяют, а водную фазу снова промывают этилацетатом, и затем подвергают сушке вымораживанием. Остаток смешивают с ТГФ и ДМФА до тех пор, пока смесь не станет размешиваемой и вполне перемешиваемой, и суспензию отфильтровывают. Полученный раствор концентрируют и вводят во взаимодействие, без дальнейшей очистки, на следующей стадии.
LC/MS (способ В): Rt=0,52 мин, m/z: 330,2 [МН+].
В. Бензил[(R)-2-(1-аллил-1Н-имидазол-4-ил)-1-((S)-1-аллилоксиметил-2-метилпропилкарбамоил)этил]карбамат
Раствор продукта со стадии А в 180 мл ДМФА смешивают с 4,18 г (27,32 ммоль) N-гидроксибензотриазола и 5,64 г (27,32 ммоль) N,N'-дициклогексилкарбодиимида, и перемешивают при комнатной температуре в течение 2 часов. Добавляют 3,56 г (24,84 ммоль) (S)-1-аллилоксиметил-2-метилпропиламина (1-1В), затем перемешивают при комнатной температуре в течение следующих 24 часов и затем концентрируют, и остаток распределяют между этилацетатом и насыщенным раствором NaHCO3. Органическую фазу сушат над Na2SO4, отфильтровывают и концентрируют. Остаток очищают с помощью препаративной ВЭЖХ. После промывки насыщенным раствором NaHCO3, получают 5,02 г указанного в заголовке соединения.
LC/MS (способ В): Rt=0,75 мин, m/z: 454,9 [МН+].
С. Бензил-((8S,11R)-8-изопропил-10-оксо-6-окса-1,9,14-триазабицикло[11.2.1]гексадека-3,13(16),14-триен-11-ил)карбамат
Раствор 0,735 г (1,62 ммоль) бензил[(R)-2-(1-аллил-1Н-имидазол-4-ил)-1-((S)-1-аллилоксиметил-2-метилпропилкарбамоил)этил]карбамата в 370 мл дихлорметана смешивают с 0,210 г (0,24 ммоль) бензилиден[1,3-бис(2,4,6-триметилфенил)-2-имидазолидинилиден]дихлор-(трициклогексилфосфин)рутения (катализатор II Grubbs) и перемешивают при комнатной температуре. Смесь перемешивают при комнатной температуре в течение нескольких суток с повторным добавлением катализатора II Grubbs, до тех пор, пока не будет более обнаруживаться исходное вещество (LC/MS). Смесь концентрируют и остаток хроматографируют на силикагеле (дихлорметан/метанол = 99:1→9:1). Получают 0,506 г указанного в заголовке соединения.
LC/MS (способ В): Rt=0,64 мин, m/z: 427,3 [МН+].
D. (8S,11R)-11-Амино-8-изопропил-6-окса-1,9,14-триазабицикло[11.2.1]гексадека-13(16),14-диен-10-он
Раствор 0,49 г (1,14 ммоль) бензил-((8S,11R)-8-изопропил-10-оксо-6-окса-1,9,14-триазабицикло[11.2.1]гексадека-3,13(16),14-триен-11-ил)карбамата со стадии С в 80 мл метанола гидрируют при использовании 0,12 г палладия-на-угле (10%) в атмосфере водорода, при автогенном давлении, при комнатной температуре. После завершения реагирования исходного вещества, смесь отфильтровывают и концентрируют. Остаток очищают с помощью препаративной ВЭЖХ. Получают 0,06 г указанного в заголовке соединения.
LC/MS (способ В): Rt=0,22 мин, m/z: 295 [МН+].
Е. трет-Бутил-(S)-3-(6-трет-бутоксикарбониламинопиридин-
3-ил)-2-[3-((8S,11R)-8-изопропил-10-оксо-6-окса-1,9,14-триазабицикло[11.2.1]гексадека-13(16),14-диен-11-ил)уреидо]пропионат
Раствор 56 мг (190 мкмоль) (8S,11R)-11-амино-8-изопропил-6-окса-1,9,14-триазабицикло[11.2.1]гексадека-13(16),14-диен-10-она со стадии D в 5 мл ДМФА охлаждают до температуры 0°С и, во время перемешивания, добавляют 32 мг (194 мкмоль) 1,1'-карбонилдиимидазола. Смесь перемешивают в течение 30 минут и затем добавляют 64 мг (190 мкмоль) трет-бутил-(S)-2-амино-3-(6-трет-бутоксикарбониламинопиридин-3-ил)пропионата и смесь нагревают до комнатной температуры. После выдерживания в течение ночи, снова добавляют такое же количество 1,1'-карбонилдиимидазола и смесь перемешивают в течение следующих 24 часов. Смесь затем концентрируют и очищают с помощью препаративной ВЭЖХ. Получают 27 мг желательного соединения.
LC/MS (способ В): Rt=0,58 мин, m/z: 658,9 [МН+].
F. (S)-3-(6-Аминопиридин-3-ил)-2-[3-((8S,11R)-8-изопропил-10-оксо-6-окса-1,9,14-триазабицикло[11.2.1]гексадека-13(16),14-диен-11-ил)уреидо]пропионовая кислота
Раствор 27 мг (41 мкмоль) в 6 мл смеси ТФУК/дихлорметан (1:1, об./об.) перемешивают при комнатной температуре в течение 4 часов. Затем его концентрируют и обрабатывают 1 н соляной кислотой и потом подвергают сушке вымораживанием. Получают 20 мг указанного в заголовке соединения в виде гидрохлорида.
LC/MS (способ В): Rt=0,36 мин, m/z: 502,9 [МН+].
Пример 6-2
(S)-3-(6-Аминопиридин-3-ил)-2-[3-((3R,6S)-6-изопропил-4-оксо-8-окса-5-азабицикло[11.2.2]гептадека-1(16),13(17),14-триен-3-ил)уреидо]пропионовая кислота
А. (R)-3-(4-Аллилфенил)-2-трет-
бутоксикарбониламинопропионовая кислота
Раствор 2,03 г (6,36 ммоль) метил-(R)-3-(4-аллилфенил)-2-трет-бутоксикарбониламинопропионата (получен как описывается в Synlett, 2005, 12, 1877-1880) в 20 мл смеси диоксан/вода (1:1, об./об.) и 0,30 г (12,71 ммоль) гидроксида лития перемешивают при комнатной температуре в течение 2 часов и затем нейтрализуют с помощью 1 н соляной кислоты. Реакционную смесь экстрагируют этилацетатом и органическую фазу сушат над Na2SO4, отфильтровывают и концентрируют. Получают 1,90 г указанного в заголовке соединения.
LC/MS (способ В): Rt=0,97 мин, m/z: 206,0 [МН+].
Соединение используют вместо (R)-3-(4-аллилоксифенил)-2-(9Н-флуорен-9-илметоксикарбониламино)пропионовой кислоты для того, чтобы получить соединение примера 6-2 по аналогии с примером 5-2. Защитную Вос-группу, используемую вместо защитной Fmoc-группы, удаляют известным образом, с помощью смесей дихлорметан/ТФУК.
LC/MS (способ I): Rt=1,29 мин, m/z: 512,3 [МН+].
Пример 6-3
(S)-3-(6-Аминопиридин-3-ил)-2-[3-((9S,12R)-16-фтор-9-
изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17),14(18),15-триен-12-ил)уреидо]пропионовая кислота
А. (R)-3-(4-Аллилокси-3-фторфенил)-2-трет-бутоксикарбониламинопропионовая кислота
1,18 г (60%; 29,39 ммоль) Гидрида натрия добавляют к раствору 4,0 г (13,36 ммоль) (R)-2-трет-бутоксикарбониламино-3-(3-фтор-4-гидроксифенил)пропионовой кислоты в 23 мл ДМФА, все время перемешивая, при температуре 0оС, и смесь перемешивают при этой же температуре. Спустя 15 минут, добавляют 1,27 мл (1,78 г, 14,7 ммоль) аллилбромида и продолжают перемешивать в течение 1 часа, пока температура смеси не достигнет комнатной температуры. Эту смесь гасят метанолом и, после охлаждения, удаляют избыток метанола в роторном испарителе. Разбавляют диэтиловым эфиром с последующим подкислением 1 н соляной кислотой и водную фазу еще дважды экстрагируют диэтиловым эфиром, и объединенные органические фазы промывают насыщенным раствором хлорида натрия, сушат над Na2SO4, отфильтровывают и концентрируют. Получают 4,50 г масла желтоватого цвета.
LC/MS (способ В): Rt=0,94 мин, m/z: 239,9 [МН+].
Соединение используют вместо (R)-3-(4-аллилоксифенил)-2-(9Н-флуорен-9-илметоксикарбониламино)пропионовой кислоты для того, чтобы получить соединение примера 6-3 по аналогии с примером 5-2. Защитную Вос-группу, используемую вместо защитной Fmoc-группы, удаляют известным образом, с помощью смесей дихлорметан/ТФУК.
LC/MS (способ Е): Rt=2,40 мин, m/z: 546,43 [МН+].
Следующие соединения примеров получают таким же образом, как указано выше, используя (R)-3-аллилокси-2-трет-бутоксикарбониламинопропионовую кислоту (полученную по аналогии с тем, как описано в JACS, 129 (22), 6986-6987, 2007) вместо (R)-3-(4-аллилоксифенил)-2-(9Н-флуорен-9-илметоксикарбониламино)пропионовой кислоты.
Пример 6-7
(S)-6-Амино-2-[3-((9S,12S)-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадец-12-ил)уреидо]капроновая кислота
А. (S)-2-трет-Бутоксикарбониламино-3-(4-гидроксициклогексил)пропионовая кислота
0,74 г (7,17 ммоль) Родия добавляют к раствору 7,00 г (24,88 ммоль) (S)-2-трет-бутоксикарбониламино-3-(4-гидроксифенил)пропионовой кислоты в 50 мл метанола и гидрируют при температуре 50°С и давлении водорода, составляющем 6 бар. После завершения конверсии, катализатор отфильтровывают и фильтрат концентрируют. Полученный продукт является достаточно чистым для дальнейших реакций.
LC/MS (способ К): Rt=1,00 мин, m/z: 188,2 [МН+].
В. (S)-3-(4-Аллилоксициклогексил)-2-трет-бутоксикарбониламинопропионовая кислота
Раствор 5,42 г (18,86 ммоль) (S)-2-трет-бутоксикарбониламино-3-(4-гидроксициклогексил)пропионовой кислоты в 20 мл ДМФА добавляют по каплям, в течение 30 минут, к суспензии 1,89 г (47,14 ммоль) 60%-ной дисперсии гидрида натрия в 20 мл ДМФА, при температуре 0°С. Затем добавляют 2,28 г (18,86 ммоль) аллилбромида и смесь нагревают до комнатной температуры и затем перемешивают в течение 3 часов. Смесь осторожно гасят водой и концентрируют. Остаток растворяют в воде и промывают этилацетатом. Водную фазу подкисляют до рН=2 6 М соляной кислотой и экстрагируют этилацетатом. Органическую фазу сушат над Na2SO4, отфильтровывают и концентрируют. Указанное в заголовке соединение, полученное таким образом, вводят во взаимодействие далее без дальнейшей очистки.
LC/MS (способ К): Rt=1,46 мин, m/z: 228,1 [МН+-Вос].
Дальнейшие реакции для получения соединения примера 6-7 осуществляют, как описано выше, используя вещество со стадии В. вместо D-Вос-О-аллилтирозина.
LC/MS (способ F): Rt=2,8 мин, m/z: 499,55 [МН+].
Пример 7-1
(S)-6-Амино-2-[3-((8S,11R)-8-изопропил-3,10-диоксо-6-окса-2,9-диазабицикло[11.2.2]гептадека-1(16),13(17),14-триен-11-ил)уреидо]гексановая кислота
А. Этил-3-((S)-2-трет-бутоксикарбониламино-3-метилбутокси)пропионат
Примерно 200 мг натрия добавляют к раствору 3,00 г (14,76 ммоль) Вос-L-валинола в 20 мл абсолютного ТГФ, в атмосфере аргона. Спустя 2 часа, раствор переносят посредством шприца в продутую аргоном колбу - для удаления остающегося после нерастворившегося натрия. К раствору добавляют 2,25 мл (2,22 г, 22,14 ммоль) этилакрилата и смесь перемешивают при комнатной температуре в течение 2 часов. К реакционной смеси добавляют 6 капель ледяной уксусной кислоты, после чего концентрируют при пониженном давлении. Полученный таким образом остаток (4,45 г бесцветного масла) используют сырым на следующей стадии.
В. Этил-3-((S)-2-амино-3-метилбутокси)пропионат
Сырой продукт (~4,45 г), полученный в примере 7-1, стадия А, растворяют в смеси 10 мл CH2Cl2 и 10 мл ТФУК и перемешивают при комнатной температуре в течение 2 часов. После завершения реакции, смесь концентрируют в вакууме и перегоняют несколько раз с толуолом. Полученный таким образом сырой продукт очищают с помощью препаративной ВЭЖХ (ацетонитрил/вода + добавление 0,5% ТФУК). Таким образом, получают 370 мг этил-3-((S)-2-амино-3-метилбутокси)пропионата в форме трифторацетата, в виде бесцветного масла (выход=~8%).
LC/MS (способ В): Rt=0,52 мин, m/z: 204,3 [МН+].
С. Этил-3-((S)-2-{(R)-2-трет-бутоксикарбониламино-3-[4-(9Н-флуорен-9-илметоксикарбониламино)фенил]пропиониламино}-3-метилбутокси)пропионат
158,7 мг (1,17 ммоль) HOAt, 0,6 мл (3,5 ммоль) N,N-диизопропилэтиламина и 443,3 мг (1,17 ммоль) HATU последовательно добавляют к смеси 586,0 мг (1,17 ммоль) (R)-2-трет-бутоксикарбониламино-3-[4-(9Н-флуорен-9-илметоксикарбониламино)фенил]пропионовой кислоты и 370,0 мг (1,17 ммоль) этил-3-((S)-2-амино-3-метилбутокси)пропионата в 10 мл ДМФА, и смесь перемешивают при комнатной температуре в течение 2 часов. Реакционную смесь концентрируют в вакууме. Остающийся остаток обрабатывают дихлорметаном, промывают насыщенным раствором NaHCO3, сушат и освобождают от растворителя при пониженном давлении. Полученный таким образом сырой продукт очищают с помощью флэш-хроматографии на силикагеле (гептан/этилацетат = 1:1). Таким образом, получают 355,0 мг чистого этил-3-((S)-2-{(R)-2-трет-бутоксикарбониламино-3-[4-(9Н-флуорен-9-илметоксикарбониламино)фенил]пропиониламино}-3-метилбутокси)пропионата (выход=~44%).
LC/MS (способ В): Rt=1,23 мин, m/z: 588,3 [М-Вос+Н+].
D. 3-{(S)-2-[(R)-3-(4-Аминофенил)-2-трет-бутоксикарбониламинопропиониламино]-3-
метилбутокси}пропионовая кислота
355,0 мг (0,52 ммоль) этил-3-((S)-2-{(R)-2-трет-бутоксикарбониламино-3-[4-(9Н-флуорен-9-илметоксикарбониламино)-фенил]пропиониламино}-3-метилбутокси)пропионата растворяют в смеси 9 мл ТГФ и 3 мл МеОН. Добавляют 1,29 мл (1,29 ммоль) 1 М водного раствора LiOH и полученную реакционную смесь перемешивают при комнатной температуре в течение 1 часа. После завершения реакции, смесь нейтрализуют путем добавления небольшого количества 1 н водного раствора хлороводорода, концентрируют при пониженном давлении и перегоняют с толуолом. Полученный таким образом продукт (225,0 мг) используют сырым на следующей реакционной стадии.
LC/MS (способ В): Rt=0,63 мин, m/z: 438,3 [МН+].
Е. трет-Бутил-((8S,11R)-8-изопропил-3,10-диоксо-6-окса-2,9-диазабицикло[11.2.2]гептадека-1(16),13(17),14-триен-11-ил)карбамат
3-{(S)-2-[(R)-3-(4-Аминофенил)-2-трет-бутоксикарбониламинопропиониламино]-3-метилбутокси}пропионовую кислоту (~225 мг), полученную в виде сырого продукта в примере 7-1, стадия D, растворяют в 225 мл ДМФА. К этому раствору последовательно добавляют 70,0 мг (0,51 ммоль) HOAt, 0,26 мл (1,5 ммоль) N,N-диизопропилэтиламина и 195,4 мг (0,51 ммоль) HATU и смесь перемешивают при комнатной температуре в течение 1 часа. Реакционную смесь концентрируют в вакууме. Полученный таким образом остаток обрабатывают CH2Cl2, промывают насыщенным раствором NaHCO3, сушат над MgSO4 и освобождают от растворителя, в вакууме. Полученное таким образом соединение с замкнутым циклом используют сырым на следующей стадии. Выход: 215,0 мг.
LC/MS (способ В): Rt=0,76 мин, m/z: 364,3 [М-tBu+Н+].
F. (8S,11R)-11-Амино-8-изопропил-6-окса-2,9-диазабицикло[11.2.2]гептадека-1(16),13(17),14-триен-3,10-дион
Сырой продукт (~215 мг), полученный в примере 7-1, стадия Е, перемешивают со смесью 4,75 мл ТФУК, 0,13 мл воды и 0,13 мл триизопропилсилана, при комнатной температуре, в течение 2 часов. После завершения реакции, смесь концентрируют в вакууме и перегоняют несколько раз с толуолом. Таким образом полученный сырой продукт очищают с помощью препаративной ВЭЖХ (ацетонитрил/вода + добавление 0,1% ТФУК). Таким образом, получают 80 мг (8S,11R)-11-амино-8-изопропил-6-окса-2,9-диазабицикло[11.2.2]гептадека-1(16),13(17),14-триен-3,10-диона в форме трифторацетата, в виде бесцветного аморфного вещества.
LC/MS (способ В): Rt=0,44 мин, m/z: 321,3 [МН+].
G. трет-Бутил-(S)-6-трет-бутоксикарбониламино-2-[3-((8S,11R)-8-изопропил-3,10-диоксо-6-окса-2,9-диазабицикло[11.2.2]гептадека-1(16),13(17),14-триен-11-ил)уреидо]гексаноат
81,9 мг (0,41 ммоль) 4-Нитрофенилхлорформиата растворяют в 3 мл CH2Cl2. Во время охлаждения на ледяной бане, добавляют раствор 80 мг (0,19 ммоль) (8S,11R)-11-амино-8-изопропил-6-окса-2,9-диазабицикло[11.2.2]гептадека-1(16),13(17),14-триен-3,10-диона, полученного в примере 7-1, стадия F, и 69 мкл (0,41 ммоль) N,N-диизопропилэтиламина в 3 мл CH2Cl2. Смесь затем перемешивают при комнатной температуре в течение 3 часов. Реакционную смесь промывают насыщенным раствором NaHCO3, водой и насыщенным раствором NaCl, сушат над MgSO4 и концентрируют в вакууме. Полученный таким образом остаток растворяют в 3 мл ДМФА и смешивают с раствором 68,8 мг (0,2 ммоль) Н-Lys(Boc)-OtBu-гидрохлорида и 65,9 мкл (0,39 ммоль) N,N-диизопропилэтиламина в 3 мл ДМФА. Реакционную смесь перемешивают при комнатной температуре в течение ночи и затем концентрируют в вакууме. Таким образом полученный сырой продукт очищают с помощью флэш-хроматографии на силикагеле (гептан/этилацетат = 1:1). Выход: 20 мг трет-бутил-(S)-6-трет-бутоксикарбониламино-2-[3-((8S,11R)-8-изопропил-3,10-диоксо-6-окса-2,9-диазабицикло[11.2.2]гептадека-1(16),13(17),14-триен-11-ил)уреидо]гексаноата.
LC/MS (способ В): Rt=0,91 мин, m/z: 648,5 [МН+].
Н. (S)-6-Амино-2-[3-((8S,11R)-8-изопропил-3,10-диоксо-6-окса-2,9-диазабицикло[11.2.2]гептадека-1(16),13(17),14-триен-11-ил)уреидо]гексановая кислота
20,0 мг (0,03 ммоль) трет-бутил-(S)-6-трет-бутоксикарбониламино-2-[3-((8S,11R)-8-изопропил-3,10-диоксо-6-окса-2,9-диазабицикло[11.2.2]гептадека-1(16),13(17),14-триен-11-ил)уреидо]гексаноата перемешивают со смесью 0,95 мл ТФУК, 25 мкл воды и 25 мкл триизопропилсилана, при комнатной температуре, в течение 2 часов. После завершения реакции, смесь концентрируют в вакууме и перегоняют несколько раз с толуолом. Полученный таким образом сырой продукт очищают с помощью препаративной ВЭЖХ (ацетонитрил/вода + добавление 0,1% ТФУК). Таким образом, получают 5 мг указанного в заголовке соединения в форме трифторацетата, в виде бесцветного аморфного вещества.
LC/MS (способ В): Rt=0,47 мин, m/z: 492,3 [МН+].
Следующие соединения примеров получают аналогичным образом.
Пример 7-2
(S)-3-(6-Аминопиридин-3-ил)-2-[3-((8S,11R)-8-метил-3,10-диоксо-6-окса-2,9-диазабицикло[11.2.2]гептадека-1(16),13(17),14-триен-11-ил)уреидо]пропионовая кислота
LC/MS (способ В): Rt=0,28 мин, m/z: 499,25 [МН+].
Пример 7-3
(S)-3-(6-Аминопиридин-3-ил)-2-[3-((3S,6R)-3-изопропил-5,9-диоксо-1-окса-4,10-диазациклотридец-6-ил)уреидо]пропионовая кислота
LC/MS (способ В): Rt=0,42 мин, m/z: 479,33 [МН+].
Пример 7-4
(S)-3-(6-Аминопиридин-3-ил)-2-[3-((8S,11R)-8-изопропил-2,10-диоксо-6-окса-3,9-диазабицикло[11.2.2]гептадека-1(16),13(17),14-триен-11-ил)уреидо]пропионовая кислота
LC/MS (способ А): Rt=0,82 мин, m/z: 527,20 [МН+].
Пример 8-1
(S)-6-Амино-2-[3-((9S,12R)-4,5-дигидрокси-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17),14(18),15-триен-12-ил)уреидо]гексановая кислота
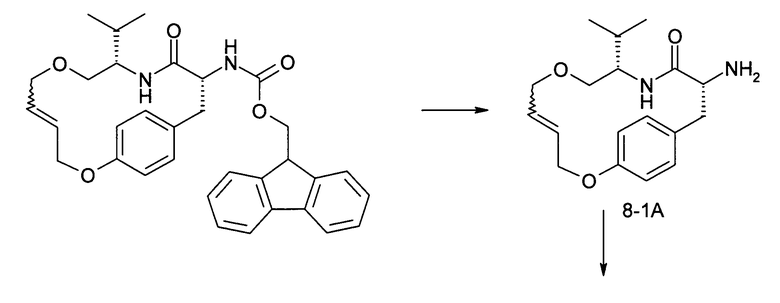
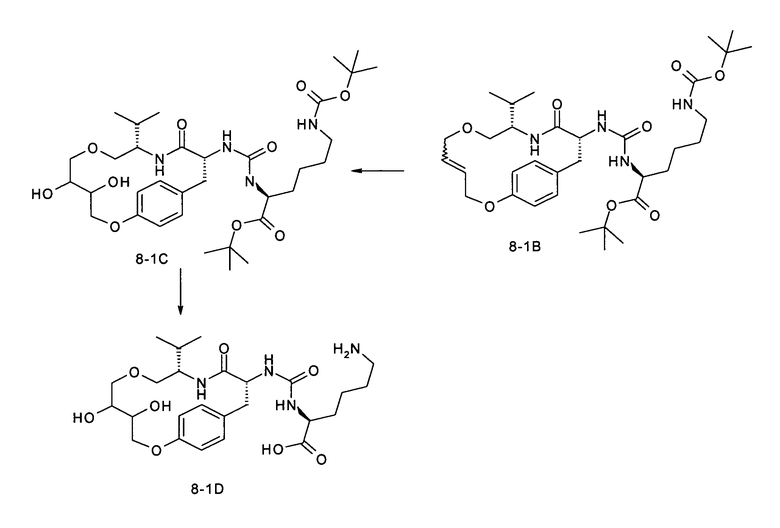
А. (9S,12R)-12-Амино-9-изопропил-2,7-диокса-10- азабицикло[12.2.2]октадека-1(17),4,14(18),15-тетраен-11-он
Раствор 3,66 г (6,78 ммоль) 9Н-флуорен-9-илметил-((9S,12R)-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17),4,14(18),15-тетраен-12-ил)карбамата (1-1D) в 300 мл дихлорметана смешивают с 75 мл диэтиламина и перемешивают при комнатной температуре в течение 5 часов. Смесь концентрируют и очищают с помощью препаративной ВЭЖХ. Ацетонитрил удаляют из объединенных фракций продукта в роторном испарителе, добавляют насыщенный раствор NaHCO3 и смесь дважды экстрагируют этилацетатом, насыщают хлоридом натрия и снова экстрагируют этилацетатом. Объединенные этилацетатные фазы сушат над Na2SO4, отфильтровывают и концентрируют. Полученное вещество является достаточно чистым для введения во взаимодействие далее.
LC/MS (способ В): Rt=0,58 мин, m/z: 319,2 [МН+].
В. трет-Бутил-(S)-6-трет-бутоксикарбониламино-2-[3-((9S,12R)-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17),4,14(18),15-тетраен-12-ил)уреидо]гексаноат
Реакцию осуществляют, как описано в 1-1F. Получают 1,13 г указанного в заголовке соединения.
LC/MS (способ В): Rt=1,00 мин, m/z: 647,3 [МН+].
С. трет-Бутил-(S)-6-трет-бутоксикарбониламино-2-[3-((9S,12R)-4,5-дигидрокси-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17),14(18),15-триен-12-ил)уреидо]гексаноат
8 мг (9,7 мкмоль) (DHQ)2PHAL (гидрохинин-1,4-фталазиндииловый диэфир) добавляют к смеси 541 мг (387 ммоль) AD-Mix-alpha и 3 мг (7,7 мкмоль) осмата калия, в смеси трет-бутанол/вода (1:1, об./об.). После образования прозрачного раствора, реакционную смесь охлаждают до температуры 0°С, добавляют 41 мг (425 мкмоль) метансульфонамида и смесь перемешивают при этой же температуре в течение 15 минут. Затем добавляют 250 мг (387 мкмоль) трет-бутил-(S)-6-трет-бутоксикарбониламино-2-[3-((9S,12R)-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17),4,14(18),15-тетраен-12-ил)уреидо]гексаноата (стадия В) и смесь нагревают до комнатной температуры и оставляют стоять в течение уикэнда. Затем добавляют 195 мг (1,55 ммоль) сульфита натрия и смесь перемешивают при комнатной температуре в течение 1 часа. Реакционную смесь экстрагируют этилацетатом и органическую фазу сушат над Na2SO4, отфильтровывают и концентрируют в роторном испарителе. Остаток очищают с помощью препаративной ВЭЖХ. Получают 164 мг указанного в заголовке соединения.
LC/MS (способ В): Rt=0,84 мин, m/z: 681,3 [МН+].
D. (S)-6-Амино-2-[3-((9S,12R)-4,5-дигидрокси-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17),14(18),15-триен-12-ил)уреидо]гексановая кислота
Защитные группы удаляют, как описано выше, при использовании смеси ТФУК/дихлорметан. Получают смесь диастереомеров.
LC/MS (способ В): Rt=0,42 мин (двойной пик), m/z: 525,3 [МН+].
Пример 8-2
(S)-6-Амино-2-[3-((9S,12R)-5-гидрокси-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17),14(18),15-триен-12-ил)уреидо]гексановая кислота
и
(S)-6-Амино-2-[3-((9S,12R)-4-гидрокси-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17),14(18),15-триен-12-ил)уреидо]гексановая кислота
А. трет-Бутил-(S)-6-трет-бутоксикарбониламино-2-[3-((9S,12R)-5-гидрокси-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17),14(18),15-триен-12-ил)уреидо]гексаноат
1,55 мл (773 мкмоль) (0,5 М раствор в ТГФ) 9-борабицикло[3.3.1]нонана добавляют к раствору 50 мг (77 мкмоль) трет-бутил-(S)-6-трет-бутоксикарбониламино-2-[3-((9S,12R)-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17),4,14(18),15-тетраен-12-ил)уреидо]гексаноата (8-1В) в 1,5 мл ТГФ и смесь перемешивают при комнатной температуре в течение ночи. Добавляют 250 мкл (1,49 ммоль) 6 н раствора гидроксида натрия и 207 мкл (1,83 ммоль) пероксида водорода с последующим экстрагированием дихлорметаном. Органическую фазу промывают насыщенным раствором хлорида натрия, сушат над Na2SO4, отфильтровывают и концентрируют. Остаток очищают с помощью препаративной ВЭЖХ.
LC/MS (способ В): Rt=0,86 мин, m/z: 665,5 [МН+].
В. (S)-6-Амино-2-[3-((9S,12R)-5-гидрокси-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17),14(18),15-триен-12-ил)уреидо]гексановая кислота и (S)-6-амино-2-[3-((9S,12R)-4-гидрокси-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17),14(18),15-триен-12-ил)уреидо]гексановая кислота
Защитные группы удаляют, как описано выше, при использовании смеси ТФУК/дихлорметан и после перемешивания с 1 н соляной кислотой.
LC/MS (способ В): Rt=0,48 мин, m/z: 509,2 [МН+].
Пример 8-3
3-(6-Аминопиридин-3-ил)-2-[3-((9S,12R)-4,5-дигидрокси-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17),14(18),15-триен-12-ил)уреидо]пропионовая кислота
Указанное в заголовке соединение получают по аналогии с предыдущими примерами.
LC/MS (способ L): Rt=2,15 мин, m/z: 560,26 [МН+].
Пример 9-1
(S)-6-Амино-2-[((9S,12R)-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17),14(18),15-триен-12-илсульфамоил)амино]гексановая кислота
А. трет-Бутил-(S)-6-трет-бутоксикарбониламино-2-[((9S,12R)-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17),14(18),15-триен-12-илсульфамоил)амино]гексаноат
Раствор 387 мг (0,858 ммоль) трет-бутил-(S)-6-трет-бутоксикарбониламино-2-(2-оксооксазолидин-3-сульфониламино)гексаноата и 250 мг (0,780 ммоль) (9S,12R)-12-амино-9-изопропил-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17),14(18),15-триен-11-она (соединение 1-1Е) в 15 мл ацетонитрила перемешивают при температуре 80°С. Спустя 1 день (d), снова добавляют такое же количество оксазолидина и смесь перемешивают в течение 1 суток. Реакционную смесь затем концентрируют и остаток очищают с помощью препаративной ВЭЖХ. Содержащие продукты фракции объединяют, ацетонитрил выпаривают, слегка подщелачивают насыщенным раствором NaHCO3 и несколько раз экстрагируют этилацетатом. Объединенные органические фазы сушат над Na2SO4, отфильтровывают и концентрируют. Получают 78 мг указанного в заголовке соединения.
LC/MS (способ В): Rt=1,16 мин, m/z: 585,9 [МН-Вос+].
В. (S)-6-Амино-2-[((9S,12R)-9-изопропил-11-оксо-2,7-диокса-
10-азабицикло[12.2.2]октадека-1(17),14(18),15-триен-12-илсульфамоил)амино]гексановая кислота
Раствор 78 мг (0,114 ммоль) трет-бутил-(S)-6-трет-бутоксикарбониламино-2-[((9S,12R)-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17),14(18),15-триен-12-илсульфамоил)амино]гексаноата в 3 мл смеси дихлорметан/ТФУК (1:1, об./об.) выдерживают при комнатной температуре в течение 2 часов и затем концентрируют. Сырой продукт очищают с помощью препаративной ВЭЖХ. Требующиеся фракции объединяют и подвергают сушке вымораживанием, после добавления 1 н соляной кислоты. Получают 34 мг указанного в заголовке соединения в виде гидрохлорида.
LC/MS (способ F): Rt=2,97 мин, m/z: 529,23 [МН+].
Пример 9-2
(S)-6-Амино-2-[((9S,12S)-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17),14(18),15-триен-12-илсульфамоил)амино]гексановая кислота
Указанное в заголовке соединение получают по аналогии с предыдущими примерами.
LC/MS (способ F): Rt=2,81 мин, m/z: 529,23 [МН+].
Фармакологические примеры
Полученные вещества тестировали в отношении ингибирования TAFIa, используя набор «Actichrome plasma TAFI Activity» фирмы American Diagnostica (Pr. No. 874). При этом добавляли 28 мкл буфера для анализа (20 мМ Hepes, 150 мМ NaCl, рН=7,4) и 10 мкл TAFIa (American Diagnostica, Pr. No. 874TAFIA; 2,5 мкг/мл) к 2 мкл 2,5 мМ раствора вещества в ДМСО и инкубировали на 96-ти луночном титрационном микропланшете при комнатной температуре в течение 15 минут. Реакцию фермента инициировали путем добавления 10 мкл TAFIa (предварительное разбавление 1:2 с помощью буфера для анализа). За протеканием во времени реакции наблюдали в течение 15 минут при длине волны 420 нм в титрационном микропланшете-ридере (SpectraMax plus 384; Molecular Devices).
Значения IC50 рассчитывали из усредненных значений (двойное определение) последовательных разведений вещества с помощью программного обеспечения Softmax Pro (версия 4,8; Molecular Devices).
В таблице 1 представлены полученные результаты.
Таблица 1
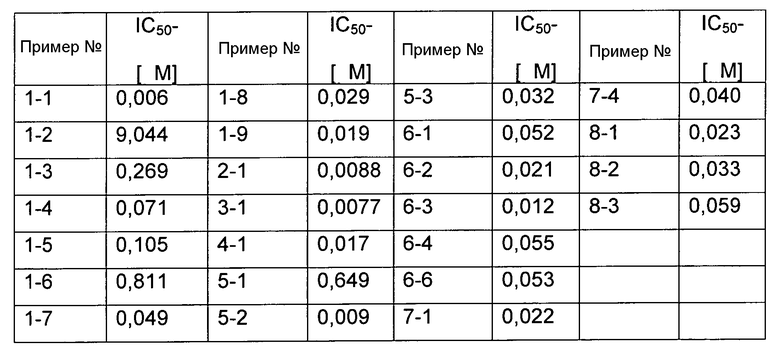
| название | год | авторы | номер документа |
|---|---|---|---|
| СПИРОЦИКЛИЧЕСКИЕ НИТРИЛЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕАЗЫ | 2007 |
|
RU2478620C2 |
| СПИРОЦИКЛИЧЕСКИЕ НИТРИЛЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕАЗЫ | 2012 |
|
RU2621695C2 |
| 2,5,7-ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ОКСАЗОЛПИРИМИДИНА | 2011 |
|
RU2557246C2 |
| МОЧЕВИНА И СУЛЬФАМИДНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ TAFIA | 2007 |
|
RU2459619C2 |
| НОВЫЕ ПИРАЗОЛПИРИМИДИНОВЫЕ ПРОИЗВОДНЫЕ | 2017 |
|
RU2769448C2 |
| НОВЫЕ АНТИГЕЛЬМИНТНЫЕ ХИНОЛИН-3-КАРБОКСАМИДНЫЕ ПРОИЗВОДНЫЕ | 2017 |
|
RU2772283C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ ИМИДАЗОЛИДИНА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТАГОНИСТОВ VLA-4 | 2002 |
|
RU2318815C2 |
| Бифункциональные цитотоксические агенты, содержащие CTI фармакофор | 2016 |
|
RU2682645C1 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТ, ИМЕЮЩИЕ 2,5-ЗАМЕЩЕННОЕ ОКСАЗОЛОПИРИМИДИНОВОЕ КОЛЬЦО | 2011 |
|
RU2559896C2 |
| НОВЫЕ АНТИГЕЛЬМИНТНЫЕ СОЕДИНЕНИЯ | 2019 |
|
RU2828007C2 |
Данное изобретение относится к соединениям формулы (I), и/или их стереоизомерным формам, и/или смесям этих форм в любом соотношении и/или физиологически толерантной соли соединения формулы (I), где: Х означает -С(O)- или -SO2-, U означает атом кислорода или -(С0-С4)алкилен, А означает атом кислорода, -С(O)-NH-, -NH-C(O)- или -(С0-С4)алкилен, V означает: 1) -(С2-С9)алкилен, где алкилен является незамещенным или одно-, двух- или трехкратно замещенным, независимо друг от друга, группой -OH, 2) -(С3-С9)алкенилен, D означает -(С1-С2)алкилен, Y означает: 1) ковалентную связь, 2) -(С6-С14)арилен-, или 3) Het, где Het означает пиридил или -имидазолил-, R1 означает: 1) атом водорода, 2) -(С1-С6)алкил, R3 означает: 1) -(С2-С6)алкилен-NH2, 2) -(С1-С4)алкилен-SO2-(С1-С4)алкилен-NH2 или 3) -(С0-С4)алкилен-Het, где Het означает пиридил или пиперидил, где Het является незамещенным или замещен -NH2, R6 означает: 1) атом водорода, 2) -(С1-С6)алкил, где алкил является незамещенным или замещенным, независимо друг от друга, группой R16, 3) -(С0-С4)алкилен-Het, где Het означает пиридил, где -(С0-С4)алкилен и Het являются незамещенными или замещенными, независимо друг от друга, группой R16, 4) -(С0-С4)алкилен-фенил, где -(С0-С4) алкилен и фенил являются незамещенными или замещенными, независимо друг от друга, группой R16, или 5) -(С0-С4) алкилен-(С3-С8)циклоалкил, R7 означает атом водорода, галоген или -(С1-С6)алкил, R8 означает атом водорода или -(С1-С6)алкил, R9 означает атом водорода, и R16 означает -NH2, которые являются ингибиторами ингибитора фибринолиза, активируемого активированным тромбином, а также к способу их получения, лекарственному средству на их основе и применению для профилактики, вторичной профилактики и лечения одного или более нарушений, связанных с тромбозами, эмболиями, гиперкоагулируемостью или фиброзными изменениями. 4 н. и 3 з.п. ф-лы, 1 табл., 9 пр.
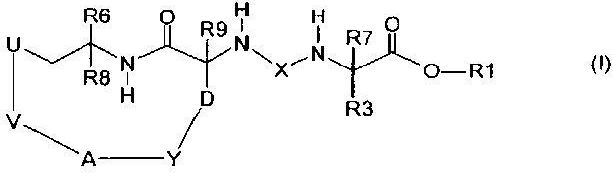
1. Соединение формулы (I):
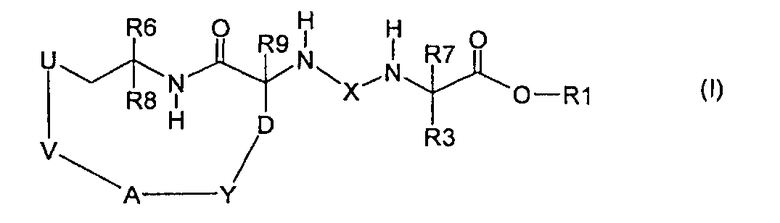
и/или стереоизомерная форма соединения формулы (I) и/или смеси этих форм в любом соотношении и/или физиологически толерантная соль соединения формулы (I),
где X означает -С(O)- или -SO2-,
U означает атом кислорода или -(С0-С4)алкилен,
А означает атом кислорода, -C(O)-NH-, -NH-C(O)- или -(С0-С4)алкилен, V означает:
1) -(С2-С9)алкилен, где алкилен является незамещенным или одно-, двух- или трехкратно замещенным, независимо друг от друга, группой -ОН,
2) -(С3-С9)алкенилен,
D означает -(С1-С2)алкилен,
Y означает:
1) ковалентную связь,
2) -(С6-С14)арилен-, или
3) Het, где Het означает пиридил или -имидазолил-,
R1 означает:
1) атом водорода,
2) -(С1-С6)алкил,
R3 означает:
1) -(С2-С6)алкилен-NH2,
2) -(С1-С4)алкилен-SO2-(С1-С4)алкилен-NH2 или
3) -(С0-С4)алкилен-Het, где Het означает пиридил или пиперидил, где Het является незамещенным или замещен -NH2,
R6 означает:
1) атом водорода,
2) -(C1-С6) алкил, где алкил является незамещенным или замещенным, независимо друг от друга, группой R16,
3) -(С0-С4) алкилен-Het, где Het означает пиридил, где -(С0-С4)алкилен и Het являются незамещенными или замещенными, независимо друг от друга, группой R16,
4) -(С0-С4)алкилен-фенил, где -(С0-С4) алкилен и фенил являются незамещенными или замещенными, независимо друг от друга, группой R16, или
5) -(C0-C4)алкилен-(С3-С8)циклоалкил,
R7 означает атом водорода, галоген или -(С1-С6)алкил,
R8 означает атом водорода или -(С1-С6)алкил,
R9 означает атом водорода, и
R16 означает -NH2.
2. Соединение формулы (I) по п.1, где:
X означает -С(O)-,
U означает атом кислорода,
А означает атом кислорода или -(С0-С4)алкилен,
V означает -(С2-С8)алкилен или -(С3-С6)алкенилен,
D означает -(С1-С2)алкилен,
Y означает:
1) ковалентную связь, или
2) фенил,
R1 означает:
1) атом водорода или
2) -(С1-С4)алкил,
R3 означает:
1) -(С2-С6)алкилен-NH2,
2) -(С1-С4)алкилен-SO2-(С1-С4)алкилен-NH2 или
3) -(С0-С4)алкиленпиридил, где пиридил замещен -NH2,
R6 означает:
1) атом водорода,
2) -(С1-С6)алкил,
3) -(С0-С4)алкиленфенил или
4) -(С0-С4)алкилен-(С3-С6)циклоалкил,
R7, R8 и R9, каждый, означает атом водорода.
3. Соединение формулы (I) по п.1, которое представляет собой соединение формулы (I):
(S)-6-амино-2-[3-((9S, 12R)-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17), 14(18), 15-триен-12-ил)уреидо]гексановая кислота,
(S)-6-амино-2-[3-((R)-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17), 14(18), 15-триен-12-ил)уреидо]гексановая кислота,
(S)-6-амино-2-[3-(R)-9,9-диметил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17), 14(18), 15-триен-12-ил)уреидо]гексановая кислота,
(S)-6-амино-2-[3-((9S, 12R)-11-оксо-9-фенил-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17), 14(18), 15-триен-12-ил)уреидо]гексановая кислота,
(S)-6-амино-2-[3-((9S, 12R)-9-бензил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17), 14(18), 15-триен-12-ил)уреидо]гексановая кислота,
(S)-6-амино-2-[3-((9S, 12R)-9-циклогексил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17), 14(18), 15-триен-12-ил)уреидо]гексановая кислота,
(S)-6-амино-2-[3-((9S, 12R)-9-этил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17), 14(18), 15-триен-12-ил)уреидо]гексановая кислота,
(S)-6-амино-2-[3-((9S, 12R)-9-метил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17), 14(18), 15-триен-12-ил)уреидо]гексановая кислота,
(S)-6-амино-2-[3-((9S, 12R)-9-трет-бутил-11 -оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17), 14(18), 15-триен-12-ил)уреидо]гексановая кислота,
(S)-6-амино-2-[3-((13S, 16R)-13-изопропил-15-оксо-2,11 -диокса-14-азабицикло[16.2.2]докоза-1(21), 18(22), 19-триен-16-ил)уреидо]гексановая кислота,
(S)-6-амино-2-[3-((E)-(9S, 12R)-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17), 4, 14(18), 15-тетраен-12-ил)уреидо]гексановая кислота,
(S)-6-амино-2-[3-((3S,6R)-3-изопропил-5-оксо-1-окса-4-азациклотетрадец-6-ил)уреидо]гексановая кислота,
(R)-3-(2-аминоэтансульфонил)-2-[3-((9S,12R)-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17), 14(18), 15-триен-12-ил)уреидо]пропионовая кислота,
(S)-3-(6-аминопиридин-3-ил)-2-[3-((9S,12R)-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17), 14(18), 15-триен-12-ил)уреидо]пропионовая кислота,
(S)-6-амино-2-{3-[(9S,12R)-9-((S)-втор-бутил)-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17), 14(18), 15-триен-12-ил]уреидо} гексановая кислота,
(S)-3-(6-аминопиридин-3-ил)-2-[3-((3S,6R)-3-изопропил-5-оксо-1-окса-4-азациклотетрадец-6-ил)уреидо]пропионовая кислота,
(S)-3-(6-аминопиридин-3-ил)-2-[3-((3S,6R)-3-метил-5-оксо-1-окса-4-азациклотетрадец-6-ил)уреидо]пропионовая кислота,
этил-(S)-3-(6-аминопиридин-3-ил)-2-[3-((3S,6R)-3-изопропил-5-оксо-1-окса-4-азациклотетрадец-6-ил)уреидо]пропионат,
этил-(S)-3-(6-аминопиридин-3-ил)-2-[3-((3S,6R)-3-метил-5-оксо-1-окса-4-азациклотетрадец-6-ил)уреидо]пропионат,
(S)-3-(6-аминопиридин-3-ил)-2-[3-((9S,12R)-9-циклопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17), 14(18), 15-триен-12-ил)уреидо]пропионовая кислота,
(S)-6-амино-2-[3-((9S,12R)-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17), 14(18), 15-триен-12-ил)уреидо]-6-метилгептановая кислота,
этил-(S)-3-(6-аминопиридин-3-ил)-2-[3-((9S,12R)-9-изопропил-11 -оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17), 14(18), 15-триен-12-ил)уреидо]пропионат,
(S)-2-[3-((9S,12R)-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17), 14(18), 15-триен-12-ил)уреидо]-3-пиперидин-3-илпропионовая кислота,
(S)-3-(6-аминопиридин-3-ил)-2-[3-((9S,12R)-9-метил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17), 14(18), 15-триен-12-ил)уреидо]пропионовая кислота,
(S)-2-[3-((9S,12R)-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1 (17), 14(18), 15-триен-12-ил)уреидо]-3-пиперидин-3-илпропионовая кислота,
(S)-3-(6-аминопиридин-3-ил)-2-[3-((8S,11R)-8-изопропил-10-оксо-6-окса-1,9,14-триазабицикло[11.2.1]гексадека-13(16), 14-диен-11 -ил)уреидо]пропионовая кислота,
(S)-3-(6-аминопиридин-3-ил)-2-[3-((3S,6R)-6-изопропил-4-оксо-8-окса-5-азабицикло[11.2.2]гептадека-1(16), 13(17), 14-триен-3-ил)уреидо]пропионовая кислота,
(S)-3-(6-аминопиридин-3-ил)-2-[3-((9S,12R)-16-фтор-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17), 14(18), 15-триен-12-ил)уреидо]пропионовая кислота,
(S)-3-(6-аминопиридин-3-ил)-2-[3-((3S,6R)-3-изопропил-5-оксо-1,8-диокса-4-азациклододец-6-ил)уреидо]пропионовая кислота,
метил-(S)-3-(6-аминопиридин-3-ил)-2-[3-((3S,6R)-3-изопропил-5-оксо-1,8-диокса-4-азациклододец-6-ил)уреидо]пропионат,
(S)-6-амино-2-[3-((3S,6R)-3-изопропил-5-оксо-1,8-диокса-4-азациклододец-6-ил)уреидо]гексановая кислота,
(S)-6-амино-2-[3-((9S,12R)-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадец-12-ил)уреидо]гексановая кислота,
(S)-6-амино-2-((8S,11R)-8-изопропил-3,10-диоксо-6-окса-2,9-диазабицикло[11.2.2]гептадека-1(16), 13(17), 14-триен-11-иламино)гексановая кислота,
(S)-3-(6-аминопиридин-3-ил)-2-[3-((8S,11R)-8-метил-3,10-диоксо-6-окса-2,9-диазабицикло[11.2.2]гептадека-1(16), 13(17), 14-триен-11 -ил)уреидо]пропионовая кислота,
(S)-3-(6-аминопиридин-3-ил)-2-[3-((3S,6R)-3-изопропил-5,9-диоксо-1-окса-4,10-диазациклотридец-6-ил)уреидо]пропионовая кислота,
(S)-3-(6-аминопиридин-3-ил)-2-[3-((8S,11R)-8-изопропил-2,10-диоксо-6-окса-3,9-диазабицикло[11.2.2]гептадека-1(16), 13(17), 14-триен-11-ил)уреидо]пропионовая кислота,
(S)-6-амино-2-[3-((9S,12R)-4,5-дигидрокси-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17), 14(18), 15-триен-12-ил)уреидо]гексановая кислота,
(S)-6-амино-2-[3-((9S,12R)-5-гидрокси-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17), 14(18), 15-триен-12-ил)уреидо]гексановая кислота,
3-(6-аминопиридин-3-ил)-2-[3-((9S,12R)-4,5-дигидрокси-9-изопропил-11 -оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17), 14(18), 15-триен-12-ил)уреидо]пропионовая кислота,
(S)-6-амино-2-[3-((9S,12R)-4-гидрокси-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17), 14(18), 15-триен-12-ил)уреидо]гексановая кислота или
(S)-6-амино-2-[((9S,12R)-9-изопропил-11-оксо-2,7-диокса-10-азабицикло[12.2.2]октадека-1(17), 14(18), 15-триен-12-илсульфамоил)амино]гексановая кислота.
4. Способ получения соединения формулы (I) по одному из п.п.1-3, включающий:
взаимодействие соединения формулы (II):
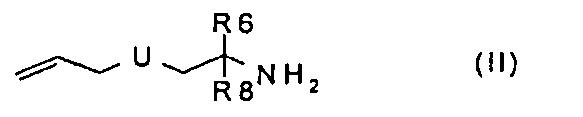
где U, R6 и R8 имеют значения, указанные в случае соединения формулы (I), с аминокислотой формулы (III):
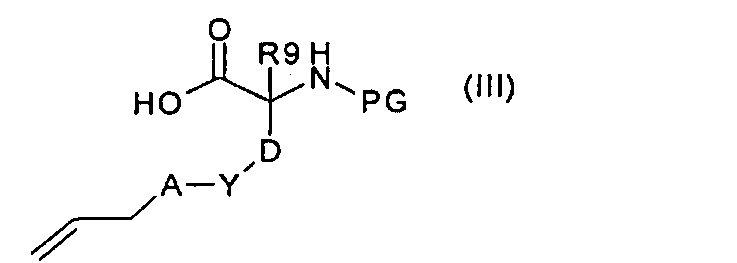
где R9, A, Y и D имеют значения, указанные в случае соединения формулы (I), с получением соединения формулы (IV):
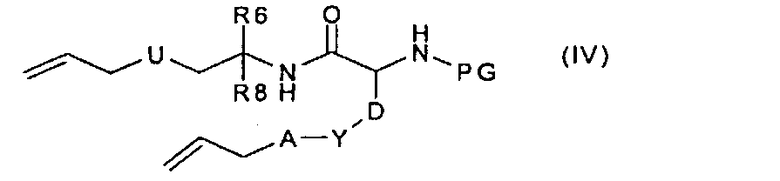
которое, в условиях метатезиса с замыканием цикла и последующем гидрировании полученной двойной связи, превращают в соединение формулы (V):
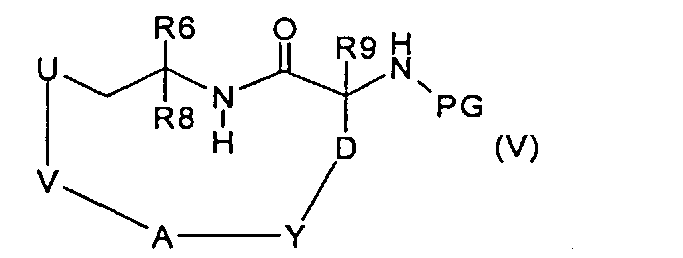
где V означает -(С2-С9)алкилен или -(С3-С9)алкенилен, затем удаляют защитную группу PG и получают соединение формулы (VI):
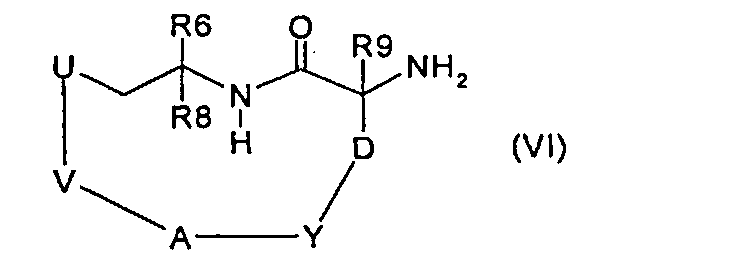
и вводят во взаимодействие с соединением формулы (VII):
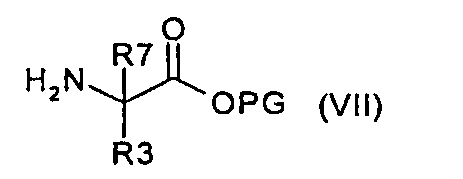
где R3 и R7 имеют значения, указанные в случае соединения формулы (I), PG представляет собой подходящую сложноэфирную защитную группу и атом азота в R3 защищен, где предназначено, подходящей защитной для аминогруппы группой, с фосгеном или эквивалентом фосгена с получением соединения формулы (VIII):
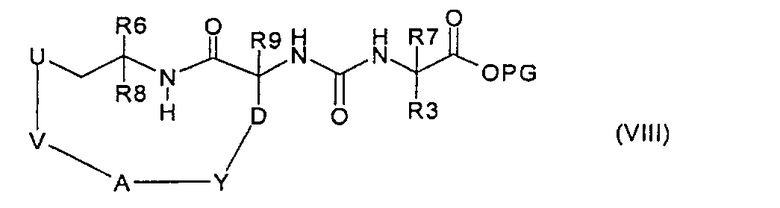
затем защитную группу PG и защитную группу, которая присутствует, где предназначено, у атома азота в R3, удаляют, получая в результате соединение формулы (I).
5. Лекарственное средство в качестве ингибитора TAFIa, включающее эффективное количество, по меньшей мере, одного соединения формулы (I), по одному из пп.1-3, вместе с фармацевтически приемлемым и физиологически толерантным носителем или добавкой.
6. Применение соединения формулы (I) по одному из пп.1-3 для профилактики, вторичной профилактики и лечения одного или более нарушений, которые связаны с тромбозами, эмболиями, гиперкоагулируемостыо или фиброзными изменениями.
7. Применение по п.6, связанное с одним или более нарушениями из ряда, включающего инфаркт миокарда, стенокардию и другие формы острого коронарного синдрома, удар, периферические сосудистые нарушения, тромбоз глубоких вен, эмболию сосудов легких, эмболические или тромботические явления, вызванные сердечной аритмией, сердечно-сосудистые явления, такие как рестеноз после реваскуляризации и ангиопластики и подобных процедур, таких как имплантации стентов и операции шунтирования, или при снижении риска тромбоза после хирургических вмешательств, таких как операции на коленном и тазобедренном суставах, или в контексте диссеминированной внутрисосудистой коагуляции, сепсиса и других внутрисосудистых явлений, связанных с воспалением, атеросклероза, диабета и метаболического синдрома, и их последствий, роста опухоли и метастаза опухоли, воспалительных и дегенеративных суставных нарушений, таких как ревматоидный артрит и артроз, повреждений гемостатической системы, таких как отложения фибрина, фиброзные изменения в легких, такие как хроническое обструктивное заболевание легких, респираторный дистресс-синдром у взрослых или отложения фибрина в глазном яблоке после глазных операций, или для предотвращения или лечения рубцевания.
| WO 2005105781 A1, 10.11.2005 | |||
| ВЕСОВОЙ РАСХОДОМЕР | 0 |
|
SU164686A1 |
| АЦИЛБЕНЗОКСАЗИНЫ ДЛЯ УСИЛЕНИЯ СИНАПТИЧЕСКОГО ОТВЕТА (ОВ) | 1999 |
|
RU2246498C2 |
Авторы
Даты
2013-12-27—Публикация
2009-05-22—Подача