ОБЛАСТЬ ИЗОБРЕТЕНИЯ
В целом изобретение относится к пептидам, которые обладают способностью связываться со скурфином и к их применению. В частности, изобретение относится к пептидам, которые ингибируют биологическую активность скурфина посредством их прямого связывания с указанным белком и которые, таким образом, позволяют регулировать или блокировать активность регуляторных T (Treg) лимфоцитов. Указанные пептиды можно использовать для лечения патологий, таких как инфекционные и неопластические заболевания, при которых уместно или необходимо регулирование или блокирование активности регуляторных T-лимфоцитов управляемым способом.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
В начале 1970-х годов впервые было описано существование T-лимфоцитов, которые способны подавлять иммунный ответ. В это время полагали, что указанное супрессорное влияние опосредовано определенной клеточной субпопуляцией, но в распоряжении не было какого-либо специфического маркера указанной субпопуляции, который удалось бы клонировать или охарактеризовать, и интерес к клеткам этого субтипа был частично утрачен. Однако в 1995 Sakaguchi et. al. (Sakaguchi et al. 1995. J Immunol 155:1151-64) обнаружили, что минорная популяция клеток CD4+ (10%), которые совместно экспрессировали α-цепь рецептора интерлейкина-2 (CD25), играла ключевую роль в контроле аутореактивных клеток и аутоиммунных реакций in vivo. После этого различные группы исследователей показали, что эта субпопуляция клеток CD4+CD25+, также известная как регуляторные T-лимфоциты или регуляторные T-клетки, обладает иммуносупрессорными свойствами (Takahashi et al. 1998. Int Immunol 10:1969-80; Thornton & Shevach. 1998. J Exp Med 188:287-96). Сначала эти клетки были идентифицированы у мышей, но позже они были тщательно описаны у людей (Dieckmann et al. 2001. J Exp Med 193:1303-10; Jonuleit et al. 2001. J Exp Med 193:1285-94; Levings et al. 2001. J Exp Med 193:1295-302). В настоящее время существование специфической иммуносупрессорной субпопуляции получило широкое признание в научном сообществе и ведется поиск способа управления ее активностью в целях клинического использования. Главным вопросом является способ управления активностью этой субпопуляции.
Регуляторные T-лимфоциты играют важную роль в защите от аутоиммунных заболеваний и в предупреждении отторжения трансплантатов; следовательно, возможность увеличения их активности обладает большим потенциалом для лечения аутоиммунных заболеваний и для трансплантации органов. Однако вследствие того, что опухоли экспрессируют аутоантигены, регуляторные T-лимфоциты могут быть способны к ингибированию активации иммунного ответа против новообразования.
Несколько групп исследователей, включая группу авторов настоящего изобретения, продемонстрировали, что простая элиминация клеток CD4+CD25+ (регуляторных T-лимфоцитов) путем введения истощающих антител in vivo способствует индуцированию противоопухолевого иммунитета и защите от развития новообразований (Casares et al. 2003. J Immunol 171:5931-9; Onizuka et al. 1999. Cancer Res 59:3128-33; Shimizu et al. 1999. J Immunol 163:5211-8; Steitz et al. 2001. Cancer Res 61:8643-6; Sutmuller et al. 2001. J Exp Med 194:823-32). Таким образом, полагают, что (регуляторные T) клетки CD4+CD25+ постоянно замедляют активацию эффекторных T-лимфоцитов для того, чтобы предотвращать аутоиммунные процессы, но, в то же время, затрудняют надлежащую активацию противоопухолевого ответа, если это необходимо.
Иммунотерапия обладает большими перспективами в лечении пациентов с новообразованиями. Осуществление многих клинических протоколов, в которых используются способы лечения, основанные на цитокинах, инфузиях эффекторных T-клеток, или схем вакцинации продемонстрировало, что иммунотерапия новообразований, как правило, безопасна. Однако, несмотря на то, что в этих клинических протоколах после лечения данными способами наблюдалось индуцирование иммунного ответа, большинство пациентов не способны развить эффективный противоопухолевый ответ. Метаанализ 37 независимых клинических схем вакцинации, в который вошло более 700 пациентов, показал, что процентная доля частичных или полных ответов против опухоли очень мала (3,8%) (Rosenberg et al. 2004. Nat Med 10:909-15). Недавние сообщения о том, что присутствие регуляторных T-лимфоцитов в ткани опухоли или в лимфатических узлах пациентов с меланомой (Wang, H. Y., J Immunol, 2005. 174:2661-2670; Viguier, M., F. J Immunol, 2004. 173:1444-1453.), раком легких (Woo, E. Y., Cancer Res 61:4766-4772), раком яичников (Woo, E. Y., Cancer Res, 2001. 61:4766-4772, Curiel, T. J., Nat Med, 2004. 10:942-949), раком поджелудочной железы и раком молочной железы (Liyanage, U. K., J Immunol, 2002. 169:2756-2761), а также в гепатокарциномах (Ormandy, L. A. Cancer Res, 2005. 65:2457-2464; Kobayashi, N., Clin Cancer Res, 2007. 13:902-911), и сообщение о том, что ткань опухоли секретирует хемокины, которые привлекают, в частности, эту субпопуляцию в ткань опухоли, указывает на то, что поступление регуляторных T-лимфоцитов в опухоль является динамическим процессом и что оказывает влияние на иммуносупрессорный эффект, облегчая развитие заболевания. Присутствие регуляторных T-клеток в опухоли, а также в периферических узлах, может объяснить низкую эффективность протоколов иммунотерапии. Таким же образом, при инфекционных заболеваниях, контроль, осуществляемый регуляторными T-лимфоцитами, может ограничивать величину ответов эффекторных T-клеток и приводить к неспособности контролировать инфекцию. Таким образом, сообщалось о том, что некоторые вирусы, такие как вирус гепатита В (Xu, D. J Immunol, 2006. 177:739-747), вирус гепатита С (Boettler, Т., J Virol, 2005. 79:7860-7867; Cabrera, R. Hepatology, 2004. 40:1062-1071; Rushbrook, J Virol, 2005. 79:7852-7859; Sugimoto, K. Hepatology, 2003. 38:1437-1448) и HIV, (Aandahl, E. M. J Virol, 2004. 78:2454-2459; Kinter, A. L. J Exp Med, 2004. 200:331-343; Oswald-Richter, K. PLoS Biol2004. 2:E198; Weiss, L. Blood, 2004. 104:3249-3256) могут использовать регуляторные T-лимфоциты для того, чтобы блокировать противовирусный иммунный ответ и, таким образом, делать возможным установление персистирующей хронической инфекции. В силу всех этих причин полагают, что модулирование деятельности регуляторных T-лимфоцитов может играть важную роль в разработке способов иммунотерапии новообразований или инфекционных заболеваний.
Существует некоторое разногласие в отношении механизма действия регуляторных T-лимфоцитов, но понимание роли цитокина TGF-β (трансформирующий фактор роста-β) в процессе ингибирования эффекторных T-клеток, по всей видимости, увеличивается (Powrie et al. 1996. J Exp Med 183:2669-74; Somasundaram et al. 2002. Cancer Res 62:5267-72).
Кроме того, недавно сообщалось о том, что фактор транскрипции скурфина (FOXP3, продукт экспрессии гена foxp3) (Yagi et al. 2004. Int Immunol 16:1643-56. 2004 Oct 04) важен для активности регуляторных T-лимфоцитов, так что его присутствие определяет супрессорную активность этих клеток. Последовательности кДНК, которые кодируют скурфин человека или мыши, являются объектом патента США 6414129, в котором, кроме того, описан способ модулирования экспрессии скурфина, который обладает терапевтическими эффектами при различных заболеваниях; в указанном патенте также упоминается об использовании синтетических пептидов, среди прочих молекул, для регулирования экспрессии гена foxp3, но ничего не говорится о возможности ингибирования активности уже экспрессированного скурфина.
Подобным образом, применение способа усиления иммунного ответа у млекопитающих основано на элиминировании регуляторных T-лимфоцитов посредством применения нейтрализующих моноклональных антител (WO 2006/044864); однако в указанной патентной заявке ничего не говорится о транзиентном регулировании активности регуляторных Т-лимфоцитов путем ингибирования активности скурфина (который важен для иммуносупрессорного действия указанных клеток). Кроме того, истощение пула регуляторных Т-лимфоцитов увеличивает риск индукции аутоиммунных реакций, а тот факт, что такие моноклональные антитела не различают регуляторные Т-лимфоциты и эффекторные Т-лимфоциты, ограничивает их применение.
В настоящее время существуют сообщения лишь о тех экспериментально подтвержденных способах ингибирования активности регуляторных Т-лимфоцитов, которые включают элиминирование этих клеток путем применения истощающих антител или путем блокирования цитокинов, которые они продуцируют и которые могут отвечать за активность этих клеток (TGF-B, IL-10), однако не существует специфического ингибитора этой клеточной субпопуляции. Способы, основанные на истощении пула регуляторных Т-клеток, имеют недостаток в виде риска развития аутоиммунных заболеваний, который обусловлен элиминированием этих клеток. Кроме того, не существует специфических антител против регуляторных Т-клеток, а те антитела, которые существуют, также элиминируют эффекторные Т-клетки.
Поэтому сохраняется необходимость в выявлении новых соединений, которые способны регулировать или блокировать активность регуляторных Т-лимфоцитов, которые потенциально можно использовать для лечения людей.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
С удивлением было обнаружено, что иммуносупрессорную активность регуляторных Т-лимфоцитов можно транзиентно или временно регулировать или блокировать путем ингибирования активности скурфина, фактора транскрипции, который важен для указанных регуляторных Т-лимфоцитов, чтобы оказывать влияние на их иммуносупрессорное действие путем применения пептидов, которые не только способны связываться со скурфином, но которые также способны ингибировать его биологическую активность. Указанные пептиды со способностью связываться со скурфином, в частности, такие пептиды со способностью ингибировать его биологическую активность, потенциально можно применять для лечения патологий, при которых необходимо временное или транзиентное регулирование или ингибирование иммуносупрессорной активности регуляторных Т-лимфоцитов, например, для лечения инфекционных заболеваний и неопластических заболеваний. Подобным образом, указанные пептиды представляют собой инструмент для изучения биологической роли скурфина и регуляторных Т-лимфоцитов.
Следовательно, один аспект данного изобретения относится к пептидам, которые обладают способностью связываться со скурфином. В конкретном и предпочтительном варианте осуществления, указанные пептиды дополнительно обладают способностью ингибировать биологическую активность скурфина.
В другом аспекте изобретение относится к слитому белку, содержащему пептид, предоставленный в этом изобретении, и пептид-носитель со способностью к интернализации пептида в клетку.
В другом аспекте изобретение относится к фармацевтической композиции, которая содержит по меньшей мере один пептид или один слитый белок, предоставленный в настоящем изобретении.
В другом аспекте изобретение относится к использованию указанных пептидов и слитых белков для получения лекарственного препарата для лечения патологии, при которой необходимо транзиентное регулирование или ингибирование иммуносупрессорной активности регуляторных Т-лимфоцитов, например, для лечения неопластического заболевания или инфекционного заболевания.
В другом аспекте изобретение относится к использованию указанных пептидов и слитых белков для лечения патологии, при которой необходимо транзиентное регулирование или ингибирование иммуносупрессорной активности регуляторных Т-лимфоцитов, например, для лечения неопластического заболевания или инфекционного заболевания.
В другом аспекте изобретение относится к нуклеиновым кислотам, которые кодируют указанные пептиды или указанные слитые белки.
В другом аспекте изобретение относится к генной конструкции, которая содержит нуклеиновую кислоту, которая кодирует пептид или слитый белок, предоставленный в настоящем изобретении.
В другом аспекте изобретение относится к вектору, который содержит указанную нуклеиновую кислоту или указанную генную конструкцию.
В другом аспекте изобретение относится к клетке-хозяину, например, к трансформированной клетке-хозяину, которая содержит указанную нуклеиновую кислоту, указанную генную конструкцию или указанный вектор.
В другом аспекте изобретение относится к способу получения пептида или слитого белка, предоставленного в настоящем изобретении, который включает культивирование указанных клеток-хозяев в условиях, которые допускают экспрессию указанного пептида и, при желании, сбор полученного пептида или слитого белка.
В другом аспекте изобретение относится к использованию указанных нуклеиновых кислот и генных конструкций для получения векторов и клеток для лечения патологии, при которой необходимо транзиентное регулирование или ингибирование иммуносупрессорной активности регуляторных Т-лимфоцитов, например, для лечения неопластического заболевания или инфекционного заболевания.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фиг. 1 представляет собой график, на котором приведены результаты анализа взаимодействия биологических молекул, которое происходит между пептидом Р60 (SEQ ID NO:1) и скурфином, способом поверхностного плазменного резонанса (SPR), как это описано в примере 1 (раздел 1.3). Как можно видеть, пептид Р60 (SEQ ID NO:1) дает положительный сигнал, что подтверждает его способность избирательно связываться со скурфином. Приведенный результат является репрезентативным для трех независимых экспериментов. О.Е.: относительные единицы.
Фиг. 2 представляет собой диаграмму, на которой приведены результаты анализа взаимодействия биологических молекул, которое происходит между пептидом Р60 (SEQ ID NO:1) или его усеченными формами T(1-13) SEQ ID NO:2, T(1-14) (SEQ ID NO:3) и Т(2-15) (SEQ ID NO:4) и скурфином, способом поверхностного плазменного резонанса (SPR) (пример 1, раздел 1.4). Как можно видеть, удаление аминокислоты в N-концевом положении подавляет способность пептида связываться со скурфином; однако, удаление остатков 14 или 15 с C-конца не подавляет способность пептида связываться со скурфином.
Фиг.3 представляет собой столбцовую диаграмму, на которой показана супрессорная активность клеточной линии человека Karpas 299 (ACC-31, DSMZ, Germany). С использованием этих клеток осуществляли реакцию смешанной культуры лимфоцитов (РСКЛ), в которой измеряли уровни IFN-γ, продуцируемого после культивирования мононуклеарных клеток периферической крови (МКПК) от 2 доноров в присутствии или в отсутствие клеточной линии Karpas 299. При культивировании МКПК от 2 различных доноров развивался иммунный ответ, известный как ответ на смешанную культуру лимфоцитов, который включает в себя активацию клеточной пролиферации и образование таких цитокинов, как IFN-γ, путем аллогенного распознавания в реакции между главным комплексом гистосовместимости (MHC) и T-клеточным рецептором (TCR). Этот ответ ингибировался при добавлении клеток Karpas 299 (с фенотипом и активностью регуляторных T-лимфоцитов). Обозначения: МКПК1 (1 × 105 клеток/лунка), лимфоциты периферической крови от здорового донора (1); МКПК2 (1 × 105 клеток/лунка), лимфоциты периферической крови от другого здорового донора (2), отличающегося от донора (1); Karpas - клеточная линия Karpas 299 (1 × 104 клеток/лунка). На тех же фигурах показано, что пептид P60 (SEQ ID NO:1) (100 мкМ) способен восстанавливать образование IFN-γ в T-лимфоцитах (его измеряли в культуральных супернатантах с помощью теста ELISA, BD Biosciences), что ингибирует супрессорное действие клеток Karpas 299.
Фиг.4 представляет собой столбцовую диаграмму, на которой показано влияние пептида P60 (SEQ ID NO:1) на действие регуляторных T-лимфоцитов человека (выделены из периферической крови здорового донора с использованием Miltenyi Biotech kit, Ref 130-091-301) в реакции смешанной культуры лимфоцитов (РСКЛ). МКПК, полученные от двух доноров крови (1 × 105 клеток/лунка от каждого донора), смешивали и инкубировали в присутствии или в отсутствие регуляторных T-лимфоцитов (2 × 104 клеток/лунка; получены от одного из них) и пептида P60 (SEQ ID NO:1) (100 мкМ). После 3 дней культивирования измеряли клеточную пролиферацию с помощью стандартного теста на поглощение тритированного тимидина. Как можно видеть, регуляторные T-лимфоциты способны ингибировать РСКЛ, а пептид P60 (SEQ ID NO:1) способен снижать иммуносупрессорное влияние регуляторных T-лимфоцитов в РСКЛ.
Фиг.5 представляет собой столбцовую диаграмму, на которой показано влияние пептида P60 (SEQ ID NO:1) на влияние природных регуляторных T-лимфоцитов человека (выделены из периферической крови здорового донора) на ответную реакцию эффекторных клеток, вызванную стимуляцией антителами против CD3/CD28, связанными с бусами (Dynabeads® CD3/CD28, Ref 111-31, Dynal). Эффекторные T-лимфоциты, полученные от здорового донора (1 × 105 клеток/лунка), культивировали в присутствии или в отсутствие стимула в виде антител против CD3/CD28, регуляторных T-лимфоцитов (2 × 104 клеток/лунка) и пептида P60 (SEQ ID NO:1) (100 мкМ). После 48 часов культивирования присутствие IFN-γ в культуральных супернатантах измеряли с помощью коммерческого ELISA. Как можно видеть, пептид P60 (SEQ ID NO:1) способен ингибировать иммуносупрессорное влияние регуляторных T-лимфоцитов человека на активацию антигеном CD3/CD28.
Фиг.6 представляет собой столбцовую диаграмму, на которой показано влияние пептида P60 (SEQ ID NO:1) на влияние природных регуляторных T-лимфоцитов мыши (выделены из спленоцитов мыши при помощи Miltenyi Biotech kit, Ref: 130-091-041) на образование IFN-γ эффекторными T-клетками в зависимости от стимуляции антителами против CD3 (BD-Biosciences). Спленоциты мышей BALB/c (1 × 105 клеток/лунка) культивировали в присутствии или в отсутствие антител против CD3 (0,5 мкг/мл), регуляторных T-лимфоцитов (2 × 104 клеток/лунка) и пептида P60 (SEQ ID NO:1) (100 мкМ). Как можно видеть, пептид P60 (SEQ ID NO: 1) способен ингибировать иммуносупрессорное влияние регуляторных T-лимфоцитов на образование IFN-γ (его измеряли с помощью коммерческого ELISA) эффекторными клетками в ответ на стимулирование антителами против CD3.
Фиг.7 представляет собой столбцовую диаграмму, на которой показано влияние пептида P60 (SEQ ID NO:1) на влияние регуляторных T-лимфоцитов мыши (выделенных из спленоцитов мыши) на ответную реакцию эффекторных клеток при стимулировании в реакции смешанной культуры лимфоцитов (РСКЛ) (измерение клеточной пролиферации осуществляли с помощью стандартного теста на поглощение тритированного тимидина). Эффекторные лимфоциты выделяли из мышей BALB/c (1 × 105 клеток/лунка) и культивировали совместно с дендритными клетками, выделенными из мышей C57BL/6, в присутствии или в отсутствие регуляторных T-лимфоцитов BALB/c (2 × 104 клеток/лунка) и в присутствии или в отсутствие пептида P60 (SEQ ID NO:1) (100 мкМ). Как можно видеть, пептид P60 (SEQ ID NO:1) способен ингибировать иммуносупрессорное влияние регуляторных T-лимфоцитов на пролиферацию эффекторных клеток.
Фиг.8 представляет собой столбцовую диаграмму, на которой показано влияние пептида P60 (SEQ ID NO:1) на влияние природных регуляторных T-лимфоцитов мыши (выделены из спленоцитов мыши) на ответную реакцию эффекторных клеток, вызванную стимуляцией антигеном (измеряли по IFN-γ в культуральном супернатанте). Эффекторные лимфоциты, выделенные из трансгенных мышей OT-1 (1 × 105 клеток/лунка) (пример 3 (раздел 3.2.3)), культивировали вместе с дендритными клетками DC из мышей C57BL/6 и пептидом SIINFEKL (SEQ ID NO:7) (10 мкг/мл), в присутствии или в отсутствие регуляторных T-лимфоцитов BALB/c (2 × 104 клеток/лунка) и в присутствии или в отсутствие пептида P60 (SEQ ID NO:1) (100 мкМ). Как можно видеть, пептид P60 (SEQ ID NO:1) способен ингибировать иммуносупрессорное влияние регуляторных T-лимфоцитов sobre на образование IFN-γ эффекторными клетками, специфичными к этому пептидному антигену.
Фиг.9 представляет собой столбцовую диаграмму, на которой показано влияние пептида P60 (SEQ ID NO:1) на ингибирование активации фактора транскрипции NF-κВ скурфином. Клетки 293 трансфицировали плазмидой pNF-κВ-Luc (Clontech, Ref 631904), экспрессирующей люциферазу под управлением промоторами, которые индуцируются фактором транскрипции NF-кВ, в присутствии или в отсутствие плазмиды pcDNA, pcDNA-Foxp3 и пептида P60 (SEQ ID NO:1) (100 мкМ). Как можно видеть, присутствие скурфина в клетках ингибирует экспрессию люциферазы, а присутствие пептида P60 (SEQ ID NO:1) восстанавливает ее экспрессию. О.Е.: относительные единицы.
На фиг.10 показано влияние введенного пептида P60 (SEQ ID NO:1) на улучшение противоопухолевой ответной реакции при вакцинации пептидом AH1 (SEQ ID NO:8). Группы мышей BALB/c иммунизировали физиологическим раствором (контрольная группа n=11) или пептидом AH1 (SEQ ID NO:8), эмульгированным в неполном адъюванте Фрейнда (НАФ) (n=22) (как описано Casares et al, 2003. J Immunol 171:5931-9). Одиннадцати мышам, иммунизированным пептидом AH1 (SEQ ID NO:8), вводили физиологический раствор через 0, 2, 4, 6, 8 и 10 дней после иммунизации, тогда как оставшимся 11 мышам в дозировке 50 нм/мышь интраперитонеально (i.p.) вводили пептид P60 (SEQ ID NO:1), растворенный в физиологическом растворе. Ввели другую контрольную группу (n=11) неиммунизрованных мышей, которым вводили только пептид P60 (SEQ ID NO:1) в фосфатно-солевом буфере (PBS), придерживаясь такой же схемы введения, как у предыдущей группы. На фиг.10A приведены средние показатели роста опухоли в различных группах мышей BALB/c, которым подкожно инокулировали 5 × 105 опухолевых клеток (CT26). Различные группы представляют средние показатели развития опухоли при отсутствии лечения (контрольная группа, белые треугольники), при лечении только вакциной с антигеном AH1 (черные треугольники), при лечении только пептидом P60 (SEQ ID NO:1) (белые круги) или при лечении вакциной с антигеном в сочетании с пептидом P60 (SEQ ID NO:1) (черные круги). На фиг.10B приведены кривые выживаемости для различных экспериментальных групп (кривые Каплана-Мейера). p<0,001 указывает на то, что результат статистического анализа получен с использованием логарифмического рангового критерия.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Пептид по изобретению
В одном из аспектов изобретение относится к пептиду, в дальнейшем в настоящем документе обозначаемому как «пептид по изобретению», со способностью связываться со скурфином, который выбран из:
a) пептида общей формулы (I), которая содержит аминокислотную последовательность:
Arg-Asp-Phe-Gln-Ser-Phe-Arg-Lys-Met-Trp-Pro-Phe-Phe-X
(I)
где X отсутствует или X присутствует и представляет собой X14 или X14-X15, где X14 и X15 независимо друг от друга обозначают аминокислоты;
b) варианта пептида, который определен в a); и
c) фрагмента пептида, который определен в a), или варианта, который определен в b); и
его фармацевтически приемлемые соли.
Термин «пептид», как применяют в настоящем документе, относится к полимеру, образованному α-аминокислотами, связанными в определенном порядке посредством пептидной связи, и включает его модификации или производные, например, гликозилированные, фосфорилированные, ацетилированные, амидированные и т.д.
Аминокислоты в пептиде по изобретению, в зависимости от положения аминогруппы при α-атоме углерода, могут принадлежать к L-ряду или к D-ряду, предпочтительно, к L-ряду.
Аминокислоты, представленные в положениях X14 и X15, могут представлять собой природные аминокислоты или модифицированные или редкие аминокислоты. Природные аминокислоты включают алифатические аминокислоты (глицин, аланин, валин, лейцин и изолейцин), гидроксилированные аминокислоты (серин и треонин), сульфитированные аминокислоты (цистеин и метионин), дикарбоксильные аминокислоты и их амиды (аспарагиновая кислота, аспарагин, глутаминовая кислота и глутамин), аминокислоты, содержащие две основных группы (лизин, аргинин и гистидин), ароматические аминокислоты (фенилаланин, тирозин и триптофан) и циклические аминокислоты (пролин). Иллюстративные неограничивающие примеры модифицированных или редких аминокислот включают 2-аминоадипиновую кислоту, 3-аминоадипиновую кислоту, β-аланин, 2-аминомасляную кислоту, 4-аминомасляную кислоту, 6-аминокапроновую кислоту, 2-аминогептановую кислоту, 2-аминоизомасляную кислоту, 3-аминоизомасляную кислоту, 2-аминопимелиновую кислоту, 2,4-диаминомасляную кислоту, десмозин, 2,2'-диаминопимелиновую кислоту, 2,3-диаминопропионовую кислоту, N-этилглицин, N-этиласпарагин, гидроксилизин, аллогидроксилизин, 3-гидроксипролин, 4-гидроксипролин, изодесмозин, аллоизолейцин, N-метилглицин, N-метилизолейцин, 6-N-метил-лизин, N-метилвалин, норвалин, норлейцин, орнитин и т.д.
Пептид по изобретению отличается способностью связываться со скурфином, и, предпочтительно, способностью ингибировать биологическую активность скурфина. Способность пептида связываться со скурфином можно определить любым подходящим способом, который позволяет определить связывание между двумя молекулами (например, с помощью теста на аффинность), указанный способ включает приведение скурфина в контакт с пептидом, подлежащим тестированию, в условиях, которые допускают связывание указанного пептида со скурфином, и оценку связывания пептида со скурфином. В конкретном варианте осуществления указанный тест на аффинность можно выполнять с использованием способа поверхностного плазмонного резонанса (SPR) (пример 1.3) или подобных способов, с использованием радиоактивно меченного скурфина, или, альтернативно, радиоактивно меченного пептида, подлежащего тестированию. Этот тип теста на аффинность, как правило, содержит приведение скурфина, например, иммобилизованного в лунках планшета, в контакт с пептидом с известной способностью связываться со скурфином, и затем инкубирование в течение соответствующего периода времени, анализ связывания пептида со скурфином. Пептиды с низкой аффинностью к скурфину удаляют промыванием, тогда как пептиды с более высокой аффинностью остаются связанными со скурфином и могут быть высвобождены путем разрушения молекулярных взаимодействий между обеими молекулами, что можно осуществить, например, путем снижения pH.
Пептид по изобретению предпочтительно отличается не только способностью связываться со скурфином, но также способностью ингибировать биологическую активность скурфина и, как следствие, опосредованно временно или транзиентно регулировать или блокировать иммуносупрессорную активность регуляторных Т-лимфоцитов. Несмотря на отсутствие намерения ограничиваться какой-либо теорией, полагают, что способность пептида ингибировать биологическую активность скурфина обусловлена прямым связыванием указанного пептида со скурфином. Способность пептида ингибировать биологическую активность скурфина можно исследовать in vitro с помощью любого подходящего способа, демонстрирующего такой эффект, например:
a) с помощью теста, основанного на измерении клеточной пролиферации в культуре эффекторных Т-лимфоцитов в присутствии антитела против CD3, регуляторных Т-лимфоцитов и тритированного тимидина и в присутствии или в отсутствие пептида, подлежащего тестированию; или
b) с помощью теста, основанного на совместном культивировании спленоцитов трансгенных мышей ОТ-1 (Т-лимфоциты этих мышей содержат Т-клеточный рецептор со специфичностью к пептиду SIINFEKL (SEQ ID NO:7) овальбумина) с регуляторными Т-лимфоцитами в присутствии антигена [пептида SIINFEKL (SEQ ID NO:7)], в присутствии или в отсутствие регуляторных Т-лимфоцитов и в присутствии или в отсутствие пептида, подлежащего тестированию; или, альтернативно
c) с помощью теста, основанного на реакции смешанной культуры лимфоцитов (РСКЛ), в которой эффекторные клетки мыши (например, мыши BALB/c) смешивают с дендритными клетками, полученными от другой линии мышей (например, C57BL/6) в присутствии или в отсутствие регуляторных Т-лимфоцитов, полученных от мыши, принадлежащей к одной из линий (например, BALB/c), и в присутствии или в отсутствие пептида, подлежащего тестированию.
Аналогично, подобные эксперименты можно осуществлять с использованием регуляторных T-лимфоцитов человека. В примере 3 подробно описаны различные тесты, предназначенные для оценки способности пептида, подлежащего тестированию (например, пептида по изобретению), ингибировать биологическую активность скурфина in vitro.
В конкретном варианте осуществления пептид по изобретению представляет собой пептид с общей формулой (I), которая содержит аминокислотную последовательность:
Arg-Asp-Phe-Gln-Ser-Phe-Arg-Lys-Met-Trp-Pro-Phe-Phe-X
где X обладает значением, указанным ранее в отношении формулы (I).
В другом конкретном варианте осуществления пептид по изобретению представляет собой пептид с общей формулой (Ia) [пептид с формулой (I), где X представляет собой X14-X15] и содержит аминокислотную последовательность или состоит из аминокислотной последовательности:
Arg-Asp-Phe-Gln-Ser-Phe-Arg-Lys-Met-Trp-Pro-Phe-Phe-X14-X15
(Ia)
где X14 и X15, независимо друг от друга, обозначают природную аминокислоту (например, Gly, Ala, Val, Leu, Ile, Ser, Thr, Cys, Met, Asp, Asn, Glu, Gln, Lys, Arg, His, Phe, Tyr, Trp или Pro) или модифицированную или редкую аминокислоту (например, Aad, bAad, bAla, Abu, 4Abu, Acp, Ahe, Aib, bAib, Apm, Dbu, Des, Dpm, Dpr, EtGly, EtAsn, Hyl, aHyl, 3Нур, 4Нур, Ide, aIle, MeGly, MeIle, MeLys, MeVal, Nva, Nle или Orn). Хотя X14 и Х15 могут быть одинаковыми или различающимися, в конкретном варианте осуществления X14 и X15 различны, например, X14 представляет собой Ala и X15 представляет собой Met.
В другом конкретном и предпочтительном варианте осуществления пептид по изобретению представляет собой пептид, который содержит аминокислотную последовательность или состоит из аминокислотной последовательности:
Arg-Asp-Phe-Gln-Ser-Phe-Arg-Lys-Met-Trp-Pro-Phe-Phe-Ala-Met
(SEQ ID NO:1)
Пептид, состоящий из SEQ ID NO:1, иногда обозначается в настоящем описании как пептид P60.
В другом конкретном варианте осуществления пептид по изобретению представляет собой пептид с общей формулой (Ib) [пептид с формулой (I), где X представляет собой X14] и содержит аминокислотную последовательность или состоит из аминокислотной последовательности:
Arg-Asp-Phe-Gln-Ser-Phe-Arg-Lys-Met-Trp-Pro-Phe-Phe-X
(Ib)
где X представляет собой X14, где X14 обозначает природную аминокислоту, такую как Gly, Ala, Val, Leu, Ile, Ser, Thr, Cys, Met, Asp, Asn, Glu, Gln, Lys, Arg, His, Phe, Tyr, Trp или Pro или модифицированную или редкую аминокислоту (например, Aad, bAad, bAla, Abu, 4Abu, Acp, Ahe, Aib, bAib, Apm, Dbu, Des, Dpm, Dpr, EtGly, EtAsn, Hyl, aHyl, 3Нур, 4Hyp, Ide, aIle, MeGly, MeIle, MeLys, MeVal, Nva, Nle или Orn), предпочтительно Ala.
В другом конкретном варианте осуществления пептид по изобретению представляет собой пептид, который содержит аминокислотную последовательность или состоит из аминокислотной последовательности:

В другом конкретном варианте осуществления пептид по изобретению представляет собой пептид с общей формулой (Ic) [пептид с формулой (I), где X отсутствует] и содержит аминокислотную последовательность или состоит из аминокислотной последовательности:

В другом конкретном варианте осуществления пептид по изобретению представляет собой пептид, который состоит из аминокислотной последовательности:

Авторы настоящего изобретения проводили тесты, которые выявили важную роль, которую играет N-конец пептида с общей формулой (I), в способности пептида связываться со скурфином, поскольку удаление аминокислоты с N-конца (Arg) резко снижает способность пептида связываться со скурфином, тогда как удаление остатков 14 или 15 с С-конца, т.е., фрагмента «X», не оказывает влияния на способность пептида связываться со скурфином (пример 1.4, фиг. 2).
В другом конкретном варианте осуществления пептид по изобретению представляет собой вариант пептида с общей формулой (I), который определен в разделе a). Термин «вариант», как применяют в настоящем документе, относится к пептиду, который по существу гомологичен и функционально эквивалентен пептиду с общей формулой (I), который определен в разделе a). Как применяют в настоящем документе, пептид «по существу гомологичен» другому пептиду, когда его аминокислотная последовательность обладает степенью идентичности по меньшей мере 50%, предпочтительно, по меньшей мере 60%, предпочтительно, по меньшей мере 70, более предпочтительно, по меньшей мере 80%, еще более предпочтительно, по меньшей мере 90% и, даже более предпочтительно, по меньшей мере 95%. Подобным образом, выражение «функционально эквивалентен», как применяют в настоящем документе, обозначает, что рассматриваемый пептид (вариант) сохраняет способность связываться со скурфином и, предпочтительно, ингибировать биологическую активность скурфина in vitro и/или in vivo. Способность пептида связываться со скурфином можно определить любым подходящим стандартным способом, как отмечалось ранее, например, с помощью теста на аффинность, такого как тест на аффинность, основанный на способе поверхностного плазмонного резонанса (SPR) (пример 1.3). Подобным образом, способность пептида ингибировать биологическую активность скурфина можно определить любым подходящим стандартным способом, как отмечалось ранее, например, с помощью любого теста, описанного в примере 3. В конкретном варианте осуществления пептид по изобретению представляет собой вариант, который содержит одну или несколько инсерций, делеций и/или модификаций одной или нескольких аминокислот в аминокислотной последовательности, приведенной в разделе a), и сохраняет способность связываться со скурфином. В конкретном варианте осуществления указанный вариант содержит одну или несколько консервативных замен аминокислот по отношению к вышеприведенной аминокислотной последовательности.
В другом конкретном варианте осуществления пептид по изобретению представляет собой фрагмент пептида с общей формулой (I), который определен в разделе a), или варианта, который определен в разделе b). Термин «фрагмент», как он используется в настоящем описании, относится к пептиду, содержащему участок по меньшей мере из 5 последовательных аминокислот из пептида с общей формулой (I), который определен в разделе a), или к варианту, который определен в разделе b), т.е. к последовательности по меньшей мере из 5 смежных аминокислот, содержащейся в аминокислотной последовательности с общей формулой (I), которая приведена в указанном разделе a), или к варианту, который определен в разделе b) и который сохраняет способность связываться со скурфином. В конкретном варианте осуществления пептид по изобретению представляет собой фрагмент пептида с общей формулой (I), который определен в a), или варианта, который определен в b), содержит 5 или более (т.е. 6, 7, 8, 9, 10, 11, 12, 13 14 или 15) смежных аминокислот из аминокислотной последовательности с общей формулой (I), приведенной в разделе a), или из варианта, который определен в разделе b), в котором одна или несколько аминокислот удалены с N-конца или с C-конца или с обоих концов, и который сохраняет способность связываться со скурфином, и, предпочтительно, способность ингибировать биологическую активность скурфина. Способность фрагмента пептида связываться со скурфином можно определить любым подходящим стандартным способом, как отмечалось ранее, например, с помощью теста на аффинность, например, теста на аффинность, который основан на способе SPR (пример 1.3). Аналогично, способность фрагмента пептида ингибировать биологическую активность скурфина можно определить любым подходящим стандартным способом, как отмечалось ранее, например, посредством любого теста, описанного в примере 3.
Подобным образом, фармацевтически приемлемые соли пептида по изобретению включены в объем настоящего изобретения. Термин «фармацевтически приемлемые соли», как применяют в настоящем документе, включает соли, которые обычно используются для получения солей металлов, или кислотно-аддитивные соли. Свойства соли не являются решающими, при условии, что она является фармацевтически приемлемой. Фармацевтически приемлемые соли пептида по изобретению можно получить из органических или неорганических кислот или оснований. Указанные соли можно получить стандартными способами, которые хорошо известны профессионалам в данной области.
В конкретном и предпочтительном варианте осуществления пептид по изобретению представляет собой пептид со способностью связываться со скурфином и ингибировать его биологическую активность, аминокислотная последовательность которого содержит или состоит из SEQ ID NO:1, ее варианта или фрагмента, и его фармацевтически приемлемые соли. В примерах, сопровождающих данное описание, показано, что указанный пептид способен связываться со скурфином и ингибировать его биологическую активность и опосредованно транзиентно регулировать или блокировать иммуносупрессорную активность регуляторных Т-лимфоцитов.
Слитый белок по изобретению
Пептид по изобретению можно слить с другим пептидом и, таким образом, получить слитый белок. Поскольку взаимодействие между пептидом по изобретению и скурфином должно происходить внутри клетки (например, в цитоплазме и/или в ядре), пептид, с которым слит пептид по изобретению, предпочтительно представляет собой пептид, который способен облегчить проникновение пептида по изобретению внутрь клетки.
Следовательно, в другом аспекте изобретение относится к слитому белку по изобретению, который содержит:
(i) пептид по изобретению, и
(ii) пептид-носитель со способностью к интернализации пептида в клетку.
Свойства пептида по изобретению уже упоминались ранее.
«Пептид-носитель со способностью к интернализации пептида в клетку», иногда называемый в настоящем описании как «пептид-носитель», представляет собой пептид, способный проходить через клеточную мембрану и проникать в клетку извне, свойства которого могут быть переданы пептиду (например, пептиду по изобретению), с которым его сливают (слитый белок по изобретению), таким образом, обеспечивая альтернативный способ транспортировки интересующих пептидов (например, пептидов по изобретению) в клетки-мишени. Этот механизм проникновения пептида в клетку известен как «белковая трансдукция или доставка»). Известны различные пептиды-носители со способностью к интернализации пептида в клетку (Schwarze S.R. et al., Science, 1999 Sep 3; 285(5433):1569-72; Niesner U. et al., Bioconjug. Chem. 2002 Jul-Aug; 13 (4):729-36; Ford K.G. et al., Gene Therapy, 2001; 8:1-4; и Gusarova G.A. et al., J. Clin. Invest. 2007 Jan; 117 (1):99-111).
Фактически, для осуществления настоящего изобретения на практике можно использовать любой пептид-носитель со способностью к интернализации пептида в клетку; однако в конкретном варианте осуществления указанный пептид-носитель является пептидом, который содержит фрагмент «PTD» («домен белковой трансдукции»). Иллюстративные неограничивающие примеры белков, содержащих домены белковой трансдукции (PTD) включают Tat-белок («трансактивирующий трансляционный белок») вируса иммунодефицита человека 1 (HIV-1), гомеозисный фактор транскрипции (Antp) Drosophila antennapedia и ДНК-связывающий белок VP22 вируса простого герпеса 1 (HSV-1), хотя также предполагается, что другие белки обладают таким свойством интернализации пептидов в клетки, например, гемагглютинин вируса гриппа, лактоферрин, фактор роста фибробластов-1, фактор роста фибробластов-2 и белки Hoxa-5, Hoxb-4 и Hoxc-8 (Ford K.G. et al., Gene Therapy, 2001; 8:1-4).
В конкретном варианте осуществления указанный пептид-носитель представляет собой пептид, который получен из Tat-белка HIV-1, содержит последовательность, отвечающую за трансдукцию пептида, и основной домен (PTD) которого содержит остатки 49-57 из указанного Tat-белка HIV-1, в частности, аминокислотную последовательность RKKRRQRRR (SEQ ID NO:9), или остатки 47-57 указанного Tat-белка HIV-1, например, пептид с аминокислотной последовательностью YGRKKRRQRRR (SEQ ID NO:10) или пептид с аминокислотной последовательностью CGISYGRKKRRQRRR (SEQ ID NO:11).
В другом конкретном варианте осуществления указанный пептид-носитель представляет собой пептид, полученный из белка Antp D. antennapedia, который содержит гомеодомен Antennapedia (AntpHD), содержащий домен, отвечающий за трансдукцию пептида (PTD) [остатки 43-58 указанного белка Antp] и содержащий аминокислотную последовательность RQIKIWFQNRRMKWKK (SEQ ID NO:12), или его функциональный фрагмент.
В другом конкретном варианте осуществления указанный пептид-носитель представляет собой пептид, полученный из белка VP22 HSV-1, содержащего домен, отвечающий за трансдукцию пептида (PTD).
В другом конкретном варианте осуществления указанный пептид-носитель представляет собой пептид, полученный из ARF («альтернативная рамка считывания») подавляющего опухоль белка, который содержит аминокислотную последовательность, отвечающую за способность пептида проникать в клетку, например, фрагмент, содержащий остатки 26-44 из указанной альтернативной рамки считывания (ARF) белка, в частности, аминокислотную последовательность KFVRSRRPRTASCALAFVN (SEQ ID NO:13), или его фрагмент, содержащий остатки 37-44 указанной альтернативной рамки считывания белка, в частности, аминокислотную последовательность SCALAFVN (SEQ ID NO:14).
Пептид по изобретению может быть связан с любым (N- или C-) концом пептида-носителя со способностью к интернализации пептида по изобретению в клетку. Следовательно, в конкретном варианте осуществления C-конец пептида по изобретению связан с N-концом указанного пептида-носителя, тогда как в другом конкретном варианте осуществления N-конец пептида по изобретению связан с C-концом указанного пептида-носителя.
Пептид по изобретению может быть связан напрямую или через линкерный или спейсерный пептид с указанным пептидом-носителем со способностью к интернализации пептида в клетку. Следовательно, в конкретном варианте осуществления пептид по изобретению [пептид (i)] непосредственно связан с указанным пептидом-носителем [пептид (ii)], тогда как в другом конкретном варианте осуществления пептид по изобретению [пептид (i)] связан с указанным пептидом-носителем [пептид (ii)] через линкерный или спейсерный пептид, расположенный между указанными пептидами (i) и (ii). В результате, при желании, слитый белок по изобретению может дополнительно содержать спейсерный пептид, расположенный между указанным пептидом по изобретению [пептид (i)] и указанным пептидом-носителем [пептид (ii)]. Указанный спейсерный пептид предпочтительно представляет собой пептид с гибкой структурой, например, пептид, который дает начало неструктурированному домену. Фактически, любой пептид с гибкой структурой можно использовать в качестве спейсерного пептида; тем не менее, иллюстративные неограничивающие примеры указанных спейсерных пептидов включают пептиды, содержащие повторяющиеся аминокислотные остатки, например, остатки Gly и/или Ser, или любые другие подходящие повторяющиеся аминокислотные остатки.
При желании, слитый белок по изобретению может необязательно содержать аминокислотную последовательность, которую можно использовать для выделения или очистки слитого белка по изобретению. Указанная последовательность будет располагаться в области слитого белка по изобретению, которая не оказывает отрицательного влияния на функциональность пептида по изобретению. Фактически любая аминокислотная последовательность, которую можно использовать для выделения или очистки слитого белка, (носит общее название «пептидная метка») может присутствовать в указанном слитом белке по изобретению. В качестве неограничивающей иллюстрации, указанная аминокислотная последовательность, которую можно использовать для выделения или очистки слитого белка, может представлять собой, например, аргининовую метку (метку Arg), гистидиновую метку (метку His), метку FLAG, метку Strep, эпитоп, который может быть распознан антителом, например, метки c-myc, SBP, S-tag, кальмодулинсвязывающий пептид, домен связывания целлюлозы, домен связывания хитина, глутатион-S-трансферазную метку, мальтозосвязывающий белок, NusA, TrxA, DsbA, Avi-tag и т.д. (Terpe K., Appl. Microbiol. Biotechnol. (2003), 60:523-525), β-галактозидазу, VSV- гликопротеин (YTDIEMNRLGK) (SEQ ID NO:15), или аминокислотную последовательность, такую как: Ala His Gly His Arg Pro (SEQ ID NO:16) (2, 4 и 8 копий), Pro Ile His Asp His Asp His Pro His Leu Val Ile His Ser (SEQ ID NO:17) и т.д.
Применение пептидов и слитых белков по изобретению
Пептид по изобретению обладает способностью связываться со скурфином и, кроме того, предпочтительно способностью ингибировать биологическую активность скурфина, следовательно, он обладает способностью к опосредованному транзиентному регулированию или блокированию иммуносупрессорной активности регуляторных Т-лимфоцитов. Следовательно, важное преимущество пептида по изобретению кроется в том факте, что с его помощью можно временно или транзиентно регулировать или блокировать иммуносупрессорную активность регуляторных Т-лимфоцитов. В отличие от других известных способов ингибирования активности регуляторных Т-лимфоцитов, которые основаны на использовании антител против маркеров поверхности, использование пептидов по изобретению, т.е. пептидов со способностью связываться со скурфином и, в частности, со способностью ингибировать биологическую активность скурфина путем их прямого связывания с указанным белком, не элиминирует регуляторные Т-лимфоциты, что делает возможным более тонкий временный контроль над их активностью. Не желая ограничиваться какой-либо теорией, полагают, что пептиды по изобретению, вследствие их небольшого размера, можно вводить в клетки для того, чтобы блокировать действие скурфина.
Вследствие того, что регуляторные Т-лимфоциты участвуют во многих биологических процессах, и вследствие того факта, что скурфин важен для их иммуносупрессорной активности, использование пептидов по изобретению предоставляет возможность для разработки нового семейства лекарственных средств, которые вероятно можно использовать для лечения неопластических заболеваний и инфекционных заболеваний. Ингибирование биологической активности скурфина позволяет пептидам по изобретению временно или транзиентно регулировать или блокировать иммуносупрессорную активность регуляторных Т-лимфоцитов, а, следовательно, можно разработать способы лечения неопластических заболеваний или инфекционных заболеваний, при которых действие указанных регуляторных Т-лимфоцитов кроме того избирательно и транзиентно контролируется, так что риск индукции аутоиммунных реакций в результате их элиминирования снижается.
Следовательно, пептиды по изобретению, а также слитые белки по изобретению можно использовать для лечения патологии, при которой уместно или необходимо транзиентное или временное регулирование или блокирование иммуносупрессорной активности регуляторных Т-лимфоцитов, как это происходит в случае неопластических заболеваний или инфекционных заболеваний, при которых регуляторные Т-лимфоциты могут выполнять иммуносупрессорную функцию, предотвращая надлежащую активацию эффективного иммунного ответа. Известно, что регуляторные Т-лимфоциты человека способны подавлять положительный эффект противоопухолевых Т-клеток в случае меланомы (Wang, H.Y., J Immunol, 2005. 174: 2661-2670; Viguier, M., F. J Immunol, 2004. 173: 1444-1453), рака легких (Woo, E.Y., Cancer Res, 2001 61: 4766-4772), рака яичников (Woo, E.Y., Cancer Res, 2001. 61: 4766-4772, Curiel, Т.J., Nat Med, 2004. 10: 942-949), рака поджелудочной железы и рака молочной железы (Liyanage, U.K., J Immunol, 2002. 169: 2756-2761), а также при гепатокарциномах (Ormandy, L.A. Cancer Res, 2005. 65: 2457-2464; Kobayashi, N., Clin Cancer Res, 2007. 13:902-911). При инфекционных заболеваниях, контроль, осуществляемый регуляторными T-клетками, может ограничивать силу ответа эффекторных T-клеток и приводить к неспособности контролировать инфекцию. Итак, было описано, что некоторые вирусы, например, вирус гепатита В (Xu, D. J Immunol, 2006. 177:739-747), вирус гепатита С (Boettler, Т., J Virol, 2005. 79:7860-7867; Cabrera, R. Hepatology, 2004. 40:1062-1071; Rushbrook, J Virol, 2005. 79:7852-7859; Sugimoto, K. Hepatology, 2003. 38:1437-1448) и вирус иммунодефицита человека (HIV) (Aandahl, E. M. J Virol, 2004. 78:2454-2459; Kinter, A. L. J Exp Med, 2004. 200:331-343; Oswald-Richter, K. PLoS Biol2004. 2:E198; Weiss, L. Blood, 2004. 104:3249-3256) могут использовать регуляторные T-клетки для того, чтобы блокировать противовирусный иммунный ответ и, таким образом, сделать возможным установление хронической персистирующей инфекции.
Иллюстративные примеры патологий, которые вероятно можно лечить с помощью пептидов и слитных белков по изобретению, включают неопластические заболевания и инфекционные заболевания. Как применяют в настоящем документе, термин «неопластические заболевания» включает как опухоли (т.е., нарушения гистогенеза, которые вызывают увеличение объема, в частности, образование припухлостей из-за увеличения числа клеток, входящих в их состав, независимо от того, являются ли они доброкачественными или злокачественными), так и раки (заболевания, которые отличаются неконтролируемой пролиферацией аномальных клеток, способных распространяться в прилегающие ткани и диссеминировать в отдаленные органы). Подобным образом, термин «инфекционные заболевания», как правило, относится к заболеваниям, вызванным инфекционными агентами, например, вирусами, бактериями, грибами, паразитами и т.д. В этом типе инфекционных или неопластических (злокачественных) заболеваний регуляторные T-лимфоциты проявляют отрицательное влияние, поскольку они способны ингибировать активацию иммунных ответов на инфекционные или неопластические процессы, что может помочь в лечении.
Иллюстративные неограничивающие примеры вирусных инфекций, которые можно лечить с помощью пептидов и слитых белков по изобретению, включают фактически любую инфекцию вирусного происхождения, например, инфекции, вызванные вирусом гепатита В, вирусом гепатита С, HIV, папилломавирусом человека, вирусами герпеса, например, таким вирусом герпеса человека, как вирус простого герпеса 1 типа (HSV-1), вирус простого герпеса 2 типа (HSV-2), вирус ветряной оспы (VZV), цитомегаловирус (CMV), вирус герпеса человека 6 типа (HHV-6), вирус герпеса человека 7 типа (HHV-7), вирус Эпштейна-Барра (EBV), вирус герпеса человека 8 типа (HHV-8) и т.д.
Иллюстративные неограничивающие примеры бактериальных инфекций, которые можно лечить с помощью пептидов и слитых белков по изобретению, включают, но без ограничений, инфекции, вызванные Mycobacterium leprae, инфекции, вызванные Mycobacterium tuberculosis, инфекции, вызванные Yersinia pestis, желудочные инфекции, вызванные Helicobacter pylori, и т.д.
Иллюстративные неограничивающие примеры грибковых инфекций, которые можно лечить с помощью пептидов и слитых белков по изобретению, включают, но без ограничений, инфекции, вызванные Candida albicans, инфекции, вызванные Trichophyton rubrum, инфекции, вызванные Aspergillus sp., и т.д.
Иллюстративные неограничивающие примеры паразитарных инфекций, которые можно лечить с помощью пептидов и слитых белков по изобретению, включают, но без ограничений, лейшманиоз, например, висцеральный лейшманиоз, такие инфекции, как малярия, вызванная паразитами Plasmodium, токсоплазмоз и т.д.
Иллюстративные неограничивающие примеры неопластических заболеваний, которые можно лечить с помощью пептидов и слитых белков по изобретению, включают, но без ограничений, папилломы, аденомы, липомы, остеомы, моиомы, ангиомы, невусы, зрелые тератомы, карциномы, саркомы или незрелые тератомы, например, меланому, миелому, лейкемию, лимфому Ходжкина, базалиому, спиналиому, рак молочной железы, рак яичников, рак матки, рак легких, рак бронхов, рак предстательной железы, рак толстого кишечника, рак поджелудочной железы, рак почки, рак пищевода, гепатокарциному, рак головы и шеи и т.д.
В целом, с помощью пептида по изобретению можно лечить любой инфекционный или неопластический процесс, в котором регуляторные T-лимфоциты играют иммуносупрессорную роль, которая может затруднить лечение патологии, от которой страдает субъект.
Подобным образом, пептиды и слитые белки по изобретению можно использовать для усиления противовирусных или противоопухолевых вакцин, поскольку их введение после вакцинации и следующее за этим блокирование регуляторных T-лимфоцитов пептидами по изобретению в процессе их введения позволит усилить ответ на компоненты вакцины.
Более того, похоже, что регуляторные T-лимфоциты могут играть роль в пищевой толерантности к антигенам (Huibregtse, I. L. Gastroenterology, 2007. 133:517-528), следовательно, пептиды по изобретению можно использовать в ситуациях, когда нужно устранить эту толерантность к перорально вводимым антигенам.
Фармацевтическая композиция
Для введения субъекту, пептид по изобретению или слитый белок по изобретению вводят в подходящую фармацевтическую композицию. Термин «субъект», как применяют в настоящем документе, относится к любому представителю млекопитающих и включает в качестве неограничивающих примеров домашних животных, приматов и людей; субъект предпочтительно представляет собой мужчину или женщину, которые принадлежат к любой возрастной группе или расе.
Следовательно, в другом аспекте изобретение относится к фармацевтической композиции, в дальнейшем в настоящем документе «фармацевтической композиции по изобретению», которая содержит терапевтически эффективное количество пептида по изобретению, или слитого белка по изобретению, по меньшей мере вместе с одним фармацевтически приемлемым эксципиентом. Указанную фармацевтическую композицию можно использовать для введения и/или применения в организме человека или животного, предпочтительно в организме человека.
Фармацевтическая композиция по изобретению может содержать один или несколько пептидов или слитых белков по изобретению необязательно вместе с одним или несколькими различными соединениями, которые регулируют или ингибируют иммуносупрессорную активность регуляторных T-лимфоцитов, отличающихся от пептидов и слитых белков по изобретению. Фактически, при желании, любое соединение, которое ингибирует или регулирует иммуносупрессорную активность регуляторных T-лимфоцитов, независимо от его механизма действия (например, посредством ингибирования скурфина или посредством других механизмов) и отличается от пептидов и слитых белков по изобретению, может присутствовать в фармацевтической композиции по изобретению. Иллюстративные неограничивающие примеры различных соединений, которые ингибируют или регулируют активность регуляторных T-лимфоцитов и отличаются от пептидов и слитых белков по изобретению и которые можно использовать вместе с пептидами и слитыми белками по изобретению, среди прочего, включают, но без ограничений, антитела против CD25, антитела против CTLA4, антитела против GITR, соединения, ингибирующие цитокины TGF-β, IL-10 или IL-9, химиотерапевтические соединения, такие как циклофосфамид флударабин, или ингибиторы хемокинов CCL17 или CCL22.
Применение пептидов по изобретению вместо антител обладает множеством преимуществ, поскольку указанные пептиды представляют собой низкомолекулярные соединения, обладают более высокой способностью к диффузии и более коротким временем полужизни. Поскольку пептиды по изобретению обладают высокой аффинностью к скурфину, но разрушаются быстрее антител, возможные неблагоприятные побочные эффекты можно контролировать посредством надлежащего дозирования пептидов по изобретению. Кроме того, большинство антител против регуляторных T-лимфоцитов вызывают элиминирование указанных клеток и, следовательно, эффект от их применения является более продолжительным, в результате чего увеличивается риск индуцирования аутоиммунных заболеваний (Stephens, L. A., Proc Natl Acad Sci USA, 2005. 102:17418-17423). Применение слитых белков по изобретению также обладает множеством преимуществ, поскольку они облегчают проникновение пептида по изобретению в клетку, в результате чего увеличивается активность ингибирования активности скурфина пептидами по изобретению, так как взаимодействие между пептидом по изобретению и скурфином должно происходить внутри клетки (например, в цитоплазме или, возможно, в ядре).
Пептиды и слитые белки по изобретению можно вводить любым способом, в результате которого возникает контакт пептида по изобретению с местом приложения его действия в организме человека или животного, для лечения патологий, для которых они показаны, например, для лечения инфекционных или неопластических заболеваний. Количество пептида, его производного или фармацевтически приемлемой соли или слитого белка по изобретению, которое может присутствовать в фармацевтической композиции, предоставленной в настоящем изобретении, может меняться в широком диапазоне.
Дозировки для лечения указанных патологий с помощью пептидов, слитых белков и/или фармацевтических композиций по изобретению будут зависеть от многих факторов, включая возраст, состояние пациента, тяжесть заболевания или патологии, путь и частоту введения, и от пептида или слитого белка по изобретению, подлежащего введению.
Фармацевтические композиции, содержащие пептид или слитый белок по изобретению, могут быть представлены в любой лекарственной форме, например, твердой или жидкой и их можно вводить через любой путь, например, перорально, парентерально, ректально или местно, для чего они должны содержать фармацевтически приемлемые эксципиенты, которые необходимы для получения желаемой лекарственной формы, например, мазей (липогелей, гидрогелей и т.д.), глазных капель, распыляемых аэрозолей, растворов для инъекций, осмотических насосов и т.д. Обзор различных фармацевтических форм лекарственных препаратов и эксципиентов, необходимых для их получения, можно найти, например, в «Tratado de Farmacia Galenica», C. Fauli i Trillo, 1993, Luzan 5, S.A. Ediciones, Madrid; и в Remington's Pharmaceutical Sciences (A.R. Gennaro, Ed.), 20th edition, Williams & Wilkins PA, USA (2000).
Использование пептидов и слитых белков по изобретению для получения фармацевтической композиции по изобретению составляет дополнительный аспект по настоящему изобретению. Следовательно, в другом аспекте изобретение относится к использованию пептида по изобретению или слитого белка по изобретению для получения лекарственного препарата для лечения патологий, при которых уместно или необходимо временное или транзиентное регулирование или блокирование иммуносупрессорной активности регуляторных Т-лимфоцитов, например, для лечения инфекционных заболеваний (например, вирусных инфекций, бактериальных инфекций, грибковых инфекций, паразитарных инфекций и т.д.) и неопластических заболеваний, например, новообразований и опухолей.
Подобным образом, в другом аспекте изобретение относится к использованию пептида по изобретению или слитого белка по изобретению для лечения патологий, при которых уместно или необходимо временное или транзиентное регулирование или блокирование иммуносупрессорной активности регуляторных Т-лимфоцитов, например, для лечения инфекционных заболеваний (например, вирусных инфекций, бактериальных инфекций, грибковых инфекций, паразитарных инфекций и т.д.) и неопластических заболеваний, например, новообразований и опухолей.
Получения пептидов по изобретению
Пептид по изобретению можно получать стандартными способами синтеза, например, с помощью способов твердофазного синтеза, и очищать стандартными способами, например, высокоэффективной жидкостной хроматографией (ВЭЖХ). Дополнительно, при желании, их можно анализировать с помощью общепринятых способов, например, посредством секвенирования и масс-спектрометрии, анализа аминокислот, ядерного магнитного резонанса и т.д. В качестве неограничивающей иллюстрации, пептид по изобретению можно получить с помощью пептидного синтеза, придерживаясь стандартных процедур (Merrifield RB. J Am Chem Soc 1963; 85: 2149-2154) с использованием способа Атертона с Fmoc (Atherton, E., Logan, J.С. and Sheppard, R. С.1989. Peptide synthesis II. Procedures for solid phase synthesis using N-fluorenyl methoxycarbonyl amino acids on polyamide supports. Synthesis of substance P and of acyl carrier protein 65-74 decapeptide. J. Chem. Soc. Perkin Trans. 1: 538). Чистоту полученного пептида можно определить, например, с помощью ВЭЖХ с обращенной фазой и/или масс-спектрометрии.
Слитый белок по изобретению можно получить с помощью реакции связывания пептида по изобретению и пептида-носителя со способностью к интернализации пептида по изобретению в клетку, при этом пептид по изобретению может быть получен с помощью стандартных способов синтеза, например, способов, которые приведены выше (например, химический синтез на твердой фазе), или с помощью рекомбинантных способов.
Альтернативно, пептид по изобретению и слитый белок по изобретению можно получить с помощью технологии рекомбинантных ДНК. Следовательно, в другом аспекте изобретение относится к последовательности ДНК, которая кодирует пептид или слитый белок по изобретению. Указанную последовательность ДНК можно легко получить, исходя из аминокислотной последовательности пептида или слитого белка по изобретению.
Указанная последовательность ДНК может содержаться в ДНК-конструкции. Следовательно, в другом аспекте изобретение относится к ДНК-конструкции, которая содержит последовательность ДНК, которая кодирует пептид или слитый белок по изобретению. Указанная ДНК-конструкция может содержать, в функциональной связи, последовательность, регулирующую экспрессию последовательности ДНК, которая кодирует пептид или слитый белок по изобретению. Управляющие последовательности представляют собой последовательности, которые контролируют и регулируют транскрипцию и, когда это уместно, трансляцию пептида или слитого белка по изобретению, и содержат промоторы, терминирующие последовательности и т.д., которые функциональны в трансформированных клетках-хозяевах, содержащих указанную последовательность ДНК или конструкцию. В конкретном варианте осуществления указанная последовательность, управляющая экспрессией, функциональна в бактериях. Указанная ДНК-конструкция предпочтительно дополнительно содержит маркер или ген, который кодирует мотив или фенотип, позволяющий проводить отбор клеток-хозяев, трансформированных указанной ДНК-конструкцией. ДНК-конструкция, предоставленная в настоящем изобретении, может быть получена с применением способов, которые широко известны в области техники на данный момент (Sambrook et al., «Molecular cloning, a Laboratory Manual», 2nd ed., Cold Spring Harbor Laboratory Press, N.Y., 1989 Vol 1-3).
Последовательность ДНК или ДНК-конструкция, предоставленная в настоящем изобретении, может быть встроена в подходящий вектор. Следовательно, в другом аспекте изобретение относится к вектору, например, к экспрессирующему вектору, который содержит указанную последовательность ДНК или ДНК-конструкцию. Выбор вектора будет зависеть от клетки-хозяина, в которую он будет впоследствии введен. В качестве примера, вектором, в который встроена указанная последовательность ДНК, может быть плазмида или вектор, который при введении в клетку-хозяина встраивается или не встраивается в геном указанной клетки. Указанный вектор можно получить стандартными способами, которые известны профессионалам в данной области (Sambrook et al., 1989, упоминалась выше).
В другом аспекте изобретение относится к клетке-хозяину, например, к трансформированной клетке-хозяину, которая содержит последовательность ДНК или ДНК-конструкцию, предоставленную в настоящем изобретении, или отмеченный ранее вектор. Указанная клетка может представлять собой прокариотическую или эукариотическую клетку.
Подобным образом, в другом аспекте изобретение относится к процессу получения пептида по изобретению или слитого белка по изобретению, который включает выращивание клетки-хозяина, которая содержит последовательность, ДНК-конструкцию или вектор, предоставленные в настоящем изобретении, в условиях, которые допускают получение указанного пептида или слитого белка по изобретению, и, при желании, сбор указанного пептида или слитого белка по изобретению. Условия оптимального культивирования указанной клетки-хозяина будут зависеть от используемой клетки-хозяина. При желании, процесс получения пептида или слитого белка по изобретению дополнительно включает выделение и очистку указанного пептида или слитого белка.
Кроме того, указанные последовательности ДНК и ДНК-конструкции, предоставленные в настоящем изобретении, можно использовать для получения векторов и клеток для лечения патологий, при которых уместно или необходимо транзиентное регулирование или блокирование иммуносупрессорной активности регуляторных Т-лимфоцитов. Следовательно, в другом аспекте изобретение относится к использованию указанных последовательностей ДНК и ДНК-конструкций для получения векторов и клеток для лечения патологий, при которых уместно или необходимо транзиентное регулирование или блокирование иммуносупрессорной активности регуляторных Т-лимфоцитов, например, для лечения вирусных, бактериальных, грибковых, паразитарных инфекций и т.д., и неопластических заболеваний. В соответствии с этим аспектом по изобретению, указанная последовательность ДНК или ДНК-конструкция может быть приведена в контакт с вектором для переноса генов, например, с вирусным или невирусным вектором. Вирусные векторы, пригодные для осуществления этого варианта осуществления изобретения на практике, включают, в качестве неограничивающих примеров, аденовирусные векторы, аденоассоциированные векторы, ретровирусные векторы, лентивирусные векторы, альфавирусные векторы, герпесвирусные векторы, векторы, полученные из коронавирусов, и т.д. Векторы невирусного типа, которые пригодны для осуществления этого варианта осуществления изобретения на практике, включают, в качестве неограничивающих примеров, депротеинированную ДНК, липосомы, полиамины, дендримеры, катионные гликополимеры, липосомально-поликатионные комплексы, белки, рецепторно-опосредованные системы для переноса генов и т.д.
Начальная идентификация пептидов по изобретению
Для начальной идентификации пептидов со способностью связываться со скурфином использовали способ, основанный на фаговых библиотеках. Этот способ позволяет идентифицировать пептиды, обладающие высокой аффинностью связывания с определенным белком (например, скурфином), и затем с помощью тестов in vitro количественно определить их способность ингибировать биологическую активность рассматриваемого белка. В этом случае, указанный белок представляет собой скурфин, и ингибирование его биологической активности позволяет опосредованно регулировать или блокировать иммуносупрессорную активность регуляторных T-лимфоцитов. Последовательность пептидов, связывающихся со скурфином и ингибирующих его биологическую активность, можно установить по соответствующей последовательности ДНК после нескольких, как правило, 3 циклов биопэннинга. Применение фаговых библиотек для идентификации ингибиторов определенных продуктов было описано, например, авторами Chirinos-Rojas C.L. et al., в Immunology, 1999, Jan. 96(1): 109-113; McConnell S.J., et al., в Gene 1994, Dec. 30, 151(1-2):115-118; или Smith G.P., Science, 1985, Jun. 14, 228(4705):1315-1317.
Следовательно, в другом аспекте изобретение относится к способу идентификации пептидов со способностью связываться со скурфином, который включает:
(i) использование фаговой библиотеки, в которой содержится множество нитевидных фагов, и геном каждого указанного фага содержит нуклеотидную последовательность, которая кодирует отличающийся пептид, присоединенный к гену оболочечного белка фага, и, тем самым, каждый фаг содержит отличающийся пептид, генетически слитый с оболочечным белком фага;
(ii) отбор фагов, содержащих пептиды, которые с высокой аффинностью связываются со скурфином, с помощью теста на аффинность; и
(iii) определение последовательностей пептидов, связывающихся со скурфином, по соответствующим последовательностям ДНК, встроенным в фаги, отобранные на стадии (ii) и кодирующие указанные пептиды, связывающиеся со скурфином.
В конкретном варианте осуществления для того, чтобы получить пептиды длиной 15 аминокислот, которые способны связываться со скурфином с высокой аффинностью и возможно обладают активностью по ингибированию его биологической активности, использовали фаговую библиотеку, которая состояла из множества нитевидных бактериофагов (M13), каждый из которых содержал отличающийся пептид из 15 аминокислот, генетически слитый с оболочечным белком фага, в данном случае, связанный с N-концом оболочечного белка pIII. Таким образом, на поверхности фага в каждой из 5 молекул поверхностного белка был представлен пептид из 15 аминокислот, тогда как внутри он содержал ДНК, кодирующую указанную пептидную последовательность. В фаговых библиотеках последовательность, кодирующая пептид, происходит из вырожденной последовательности в каждом из 15 положений, с участием 20 природных аминокислот, что делает возможным представление 1,1 × 1012 возможных последовательностей из 15 аминокислот на различных фагах. Физическое соотношение 1 к 1 между последовательностью пептида и ДНК, кодирующей его в бактериофаге, позволяет из большого числа вариантов выбрать те последовательности, которые избирательно связываются со скурфином. Этот процесс осуществляют с помощью теста на аффинность.
В конкретном варианте осуществления указанный тест на аффинность состоит из протокола отбора in vitro, который называется биопэннинг. В кратком изложении, указанный способ состоит из инкубирования набора фагов, представляющих, для практических целей, все варианты пептидов из 15 аминокислот (в данном случае), в планшете, покрытом скурфином, который правильно представлен для взаимодействия с пептидами, расположенными на фагах. После инкубирования несвязанные фаги элиминируют путем промываний, а затем избирательно связавшиеся фаги элюируют посредством понижения pH, которое разрушает молекулярные взаимодействия между скурфином и пептидами, представленными на фагах. Затем элюированные фаги амплифицируют при помощи инфицирования бактериального штамма. Процесс повторяют в течение всего 3 циклов, так что повышается содержание фагов, связывающихся со скурфином избирательно и с высокой аффинностью. Концентрация скурфина, в которой он был использован для блокирования чашек, постепенно уменьшается в каждом цикле, например, от 2,5 до 0,02 мкг/мл и, наконец, 0,002 мкг/мл. Таким образом, фаги, отобранные в каждом цикле, обладают более высокой степенью аффинности к скурфину. В конце процесса фаги, отобранные по их аффинности к скурфину, секвенировали с использованием праймеров. Это позволяет получить последовательности пептидов, представленных на фагах. После выполнения этого скрининга можно проводить тесты для подтверждения способности к взаимодействию между указанными пептидами и скурфином посредством анализа взаимодействия биологических молекул с использованием способа поверхностного плазмонного резонанса (SPR), как показано на фиг.1, который показывает избирательное связывание пептида P60 (SEQ ID NO:1), идентифицированного этим способом, со скурфином.
Следующие примеры иллюстрируют изобретение и не должны рассматриваться в качестве ограничения его объема.
ПРИМЕР 1
Отбор пептидов со способностью связываться со скурфином
Отбор пептидов со способностью связываться со скурфином и вероятной активностью, ингибирующей его биологическую активность, осуществляли с помощью способа отбора in vitro, который основан на технологии, разработанной на основе фаговых библиотек.
1.1 Получение скурфина
Чтобы получить скурфин, использовали плазмиду pDEST15-FOXP3, вектор, экспрессирующий скурфин, связанный с глутатион-S-трансферазой (GST) в виде слитого белка, любезно предоставленную доктором Ignacio Casal (Centro Nacional de Investigaciones Oncologicas, CNIO, Madrid, Espana). Указанную плазмиду клонировали в бактерии Escherichia coli BL21, компетентной для экспрессии и последующей очистки белка (скурфина). Экспрессию указанного белка осуществляли культивированием в 0,5 литра среды для культивирования LB (Sigma, St Louis). Бактериальный осадок лизировали в прессе Френча (Thermo Electron Corporation), так что скурфин оставался в супернатанте. Очистку скурфина осуществляли с помощью аффинной хроматографии с использованием колонок для аффинной хроматографии GSTrap (Ref 17513001, Amersham, Pharmacia) и платформы хроматографа для FPLC (жидкостной экспресс-хроматографии белков) (Akta FPLC, Amersham Biosciences). Для того чтобы подтвердить присутствие белка, осуществляли вестерн-блоттинг объединенных фракций с использованием антител против Foxp3 (ab10564, Abeam). После выделения и очистки скурфина, начинали циклы связывания/элюирования с фаговой библиотекой.
1.2 Отбор пептидов с помощью фаговой библиотеки и способа биопэннинга
Для того чтобы идентифицировать пептиды со способностью связываться со скурфином, использовали способ, связанный с фаговыми библиотеками. Этот способ позволяет идентифицировать пептиды, обладающие высокой аффинностью связывания с определенным белком (в данном случае, со скурфином), и затем с помощью тестов in vitro количественно определить способность различных пептидов ингибировать биологическую активность указанного белка. Последовательности пептидов, связывающихся со скурфином, можно установить по соответствующим последовательностям ДНК после нескольких (как правило, 3) циклов биопэннинга.
Для осуществления этого примера использовали предоставленную лабораторией George P. Smith (Division of Biological Sciences Tucker Hall, University of Missouri, USA) фаговую библиотеку, содержащую 2 × 108 отличающихся клонов. Перед осуществлением отбора (биопэннинга), фаги, представленные в указанной фаговой библиотеке, амплифицировали и очищали. С этой целью 10 мкл указанной фаговой библиотеки амплифицировали с использованием E. coli K91Kan (предоставил George P. Smith, Division of Biological Sciences Tucker Hall, University of Missouri) в качестве штамма-хозяина и затем очищали при помощи 2 осаждений с полиэтиленгликолем (ПЭГ)/NaCl и центрифугирования в градиенте CsCl. С помощью спектрометрии вычисляли титр фаговой суспензии, который составил 3,82 × 1014 вирионов/мл, а количество инфекционных частиц составило 1,3 × 1013 ТЕ/мл. Перед началом селекционного теста, для того, чтобы подтвердить, что амплификация не повлияла на разнообразие клонов, секвенировали фракцию указанной фаговой суспензии.
Процесс отбора пептидов со способностью связываться со скурфином, которые вероятно можно использовать в качестве ингибиторов его биологической активности, включает приведение скурфина в контакт с пептидами, представленными в фаговой библиотеке. С этой целью лунки 96-луночного планшета покрывали скурфином (добавляли скурфин в карбонатный буфер в указанных лунках и оставляли инкубироваться в течение 16 часов при 4°C), добавляли 10 мкл фаговой библиотеки в концентрации 3 × 104 вирусов/мл и оставляли инкубироваться в течение 1-2 часов при комнатной температуре (20-22°C). Затем несвязанные фаги удаляли промыванием в PBS/Tween (фосфатно-солевой буфер/полиоксиалкиленовые производные сложных эфиров сорбитана и жирной кислоты), так что только фаги со специфичностью к скурфину оставались связанными с планшетом. Эти фаги, избирательно связанные со скурфином, элюировали путем снижения pH (буфер для элюирования), что нарушает молекулярные взаимодействия между скурфином и пептидами, представленными на фагах. Элюированные фаги амплифицировали посредством инфицирования штамма бактерий (E. coli K91Kan), в этом процессе еще 3 раза повторяли цикл связывания/элюирования, каждый раз со все меньшим количеством скурфина, адгезированным в лунках (в каждом цикле количество постепенно уменьшалось с 2,5 мкг/мл до 0,02 мкг/мл и, наконец, до 0,002 мкг/мл), так что в каждом цикле происходил отбор фагов с возрастающей аффинностью связывания со скурфином. Таким образом, в последнем цикле колонии бактерий были инфицированы отдельным фагом, содержащим в вырожденной области своего генома одну последовательность, кодирующую один пептид (отбор бактериальных колоний осуществляли в присутствии тетрациклина, устойчивость к которому обеспечивал ген устойчивости к указанному антибиотику, присутствующий в геноме фагов, так что, таким образом, росли только колонии, инфицированные фагами, и каждая колония содержала геном одного фага, которому соответствовала последовательность одного пептида, представленного на его поверхности). Секвенирование этой области позволяло узнать ее ДНК-последовательность и, следовательно, последовательность пептида, способного связываться со скурфином, который вероятно являлся ингибитором активности скурфина.
Из колоний бактерий, инфицированных фагами, полученными из последнего цикла отбора биопэннингом, выделяли ДНК и секвенировали участок генома, включая область, соответствующую пептидам, представленным в белке pIII фага, с использованием специфического праймера (SEQ ID NO:5), который гибридизуется рядом с этой областью. Таким образом, было получено 47 пептидов.
Чтобы сократить число пептидов, подлежащих тестированию, осуществляли коммерческий ELISA, основанный на моноклональном антителе против M13 фага (HRP/Anti-M13 monoclonal Conjugate (Ref 27942101, Amersham Pharmacia Biotech)), только для того, чтобы отобрать фаги с более высокой аффинностью к скурфину. В кратком изложении, ELISA осуществляли с использованием планшетов Maxisorp (Nunc, Ref: 442404), покрытых скурфином. Отобранные фаги вносили в лунки планшета для ELISA и, после следующих друг за другом промываний, планшет проявляли с помощью моноклонального антитела против M13. Лунки с оптическими плотностями выше их соответствующих отрицательных контролей (лунки без скурфина) содержали пептиды с самой высокой избирательностью к скурфину. Таким образом, было отобрано 25 из 47 исходных фагов. В лаборатории авторов настоящего изобретения химически синтезировали 25 отобранных пептидов с использованием способа с Fmoc для использования в последующих тестах. После осуществления нескольких тестов для измерения способности этих пептидов ингибировать иммуносупрессорное действие регуляторных T-клеток in vitro, был выбран пептид, идентифицированный как P60 (SEQ ID NO:1), поскольку он обладал самой высокой ингибирующей активностью в этих тестах (пример 2).
1.3 Определение способности пептида P60 (SEQ ID NO:1) связываться со скурфином с помощью поверхностного плазмонного резонанса (SPR)
Способность пептида P60 (SEQ ID NO:1) связываться со скурфином подтверждали посредством анализа взаимодействия биологических молекул способом поверхностного плазмонного резонанса (SPR) с использованием Biosensor BIAcore X (BIAcore, AB, Uppsala, Sweden). Скурфин, синтезированный в E. coli и очищенный с помощью колонок для аффинной хроматографии GSTrap (Amersham, Pharmacia), ковалентно иммобилизовали на поверхности проточной кюветы 2 (FC2) чипа CM5 (Sensor Chip CM Ref 116Br-1000-14, BIAcore, General Electrics), как описано в De Crescenzo et al. (JBC 2001, Vol 276; 29632-29643). Проточную кювету 1 (FC1), на поверхности которой не был иммобилизован скурфин, использовали в качестве эталонной обратной проточной кюветы. Растворы каждого пептида (10 мкМ) впрыскивали трижды в 10 мМ буфер Hepes, 150 мМ NaCl, pH 7,4 при скорости потока 30 мкл/мин. Кривые связывания обрабатывали посредством вычитания ответа в FC1 из ответа в FC2. Сравнивали ответ в состоянии равновесия для пептида P60 (SEQ ID NO:1) и для нерелевантного контрольного пептида малого размера (длины), а именно пептида, аминокислотная последовательность которого приведена в SEQ ID NO:6 и соответствует аминокислотам 123-137 рецептора CD81 человека. Каждый ответ умножали на поправку на массу: MW(P60)/MW(P), где MW(P60) представляет собой молекулярную массу пептида P60 (SEQ ID NO:1) и MW(P) представляет собой молекулярную массу контрольного пептида. Как можно видеть на фиг.1, пептид P60 (SEQ ID NO:1) дает положительный сигнал, что подтверждает его способность избирательно связываться с белком скурфина.
1.4 Создание усеченных форм пептида P60 (SEQ ID NO:1) путем делеции аминокислот с N- или C-конца и оценка их способности связываться со скурфином
Для того чтобы оценить значение аминокислот, расположенных на N-конце и C-конце пептида P60 (SEQ ID NO:1), химически синтезировали усеченные формы указанного пептида P60 (SEQ ID NO:1), как отмечалось выше, и способность указанных усеченных форм связываться со скурфином количественно анализировали с помощью SPR в соответствии с протоколом, который был описан ранее в разделе 1.3.
Химически синтезированные усеченные формы представляли собой пептиды или усеченные формы P60, обозначенные как:
T(1-13) (SEQ ID NO:2) [аминокислоты 1-13 пептида P60],
T(1-14) (SEQ ID NO:3) [аминокислоты 1-14 пептида P60], и
T(2-15) (SEQ ID NO:4) [аминокислоты 2-15 пептида P60].
Подобным образом, способность указанных пептидов (SEQ ID NO:2, SEQ ID NO:3 и SEQ ID NO:4) связываться со скурфином определяли количественно с помощью SPR при приведенных выше условиях. Полученные результаты показывают, что удаление аминокислоты в N-концевом положении ингибирует способность пептида связываться со скурфином. Однако удаление остатков 14 или 15 с C-конца не ингибирует способность пептида связываться со скурфином (фиг.2).
ПРИМЕР 2
Влияние пептида P60 (SEQ ID NO:1) на иммуносупрессорную активность клеточной линии человека Karpas 299
После проверки и подтверждения профиля клеточной линии человека Karpas 299 (ACC-31, DSMZ, Germany), осуществляли тесты in vitro с использованием этой линии, полученной из лимфомы человека с профилем регуляторных T-клеток [регуляторных T-лимфоцитов] (Wolke et al Int J Mol Med. 2006 Feb;17(2):275-8), таким образом, устранив необходимость выделять клетки CD4+CD25+.
Для того чтобы оценить влияние пептида P60 (SEQ ID NO:1) на иммуносупрессорную активность клеточной линии Karpas 299, осуществляли тест «реакция смешанной культуры лимфоцитов» (РСКЛ) с использованием мононуклеарных клеток периферической крови (МКПК) от двух 2 доноров в присутствии или в отсутствие клеточной линии Karpas 299. Этот тест (РСКЛ) основан на совместном культивировании лимфоцитов различного происхождения и с различными гистосовместимостями, которые будут распознавать друг друга в качестве чужеродных клеток. Эта реакция заставляет лимфоциты пролиферировать, секретируя цитокины. Для этого теста по 100000 клеток от каждого донора (положительный контроль РСКЛ) культивировали в 96-луночном планшете, отдельно или в присутствии 10000 клеток клеточной линии Karpas 299.
Через 48 часов собирали супернатанты для измерения концентрации интерферона γ (IFN-γ) с помощью коммерческого ELISA (Ref 555138, Pharmingen, San Diego, CA, United States). В этом случае было невозможно измерить клеточную пролиферацию, поскольку присутствие клеточной линии Karpas 299 скрывает любое возможное влияние РСКЛ на пролиферацию. Результаты измерения концентрации IFN-γ приведены на фиг.3 и предоставляют информацию о супрессорной активности клеточной линии Karpas 299. В этом тесте на ингибирование РСКЛ, вызванное присутствием клеточной линии Karpas 299, анализировали способность пептида P60 (SEQ ID NO:1) восстанавливать образование IFN-γ, вызванное РСКЛ. На фиг.3 показано, что добавление пептида P60 (SEQ ID NO:1) (100 мкМ) в совместную культуру РСКЛ и клеточной линии Karpas 299 способно частично восстановить образование IFN-γ, которое наблюдалось в отсутствие клеток Karpas 299.
ПРИМЕР 3
Влияние пептида P60 (SEQ ID NO:1) на иммуносупрессорную активность регуляторных T-лимфоцитов человека и мыши
3.1 Влияние пептида P60 (SEQ ID NO:1) на иммуносупрессорную активность регуляторных T-лимфоцитов человека
Способность пептида P60 (SEQ ID NO:1) ингибировать иммуносупрессорную активность регуляторных T-лимфоцитов человека анализировали с помощью 2 различных тестов:
a) с помощью теста, основанного на реакции смешанной культуры лимфоцитов (РСКЛ); и
b) с помощью теста, основанного на измерении образования IFN-γ в культуре CD4 эффекторных T-лимфоцитов человека, культивируемых с микросферами, содержащими антитела против CD3 и против CD28, адгезированными на их поверхности, в присутствии или в отсутствие регуляторных T-лимфоцитов.
3.1.1 Тест, основанный на реакции смешанной культуры лимфоцитов (РСКЛ)
Для осуществления теста, основанного на реакции смешанной культуры лимфоцитов (РСКЛ), например, теста, приведенного в примере 2, мононуклеарные клетки периферической крови (МКПК) от 2 доноров смешивали вместе с CD4+CD25+ регуляторными T-клетками (регуляторными T-лимфоцитами), выделенными от одного из них с помощью коммерческого набора (Ref 130091072, Miltenyi Biotec, Bergisch Gladbach, Germany), придерживаясь инструкций производителя. После очистки клетки анализировали с помощью проточной цитометрии, во всех тестах была достигнута чистота приблизительно 90%. Этот тест РСКЛ осуществляли путем инкубирования по 105 клеток МКПК от каждого донора и 2 × 104 регуляторных T-лимфоцитов в присутствии или в отсутствие пептида P60 (SEQ ID NO:1), для того, чтобы количественно определить способность блокировать супрессорное действие регуляторных T-лимфоцитов человека. После 3 дней культивирования добавляли тритированный тимидин (Amersham, Pharmacia) в количестве 0,5 мкКи/лунка, а через 16 часов из планшетов собирали клетки с использованием сборщика клеток (сборщик клеток Filtermate 96; Packard Instrument, Meriden, CT) и радиоактивность определяли по радиоактивному тимидину, встроенному в ДНК клеток, (в качестве количественного показателя клеточной пролиферации) с помощью сцинтилляционного счетчика (Topcount; Packard Instrument). Результаты этого теста приведены на фиг.4, на которой можно видеть, что смесь МКПК от 2 доноров стимулирует клеточную пролиферацию, измеренную по встраиванию радиоактивного тимидина, и что добавление регуляторных T-лимфоцитов позволяет ингибировать указанную клеточную пролиферацию; и кроме того наблюдали, что добавление пептида P60 (SEQ ID NO:1) в эти совместные культуры позволяет частично восстановить РСКЛ, блокируя иммуносупрессорное действие регуляторных T-лимфоцитов человека.
3.1.2 Тест, основанный на измерении IFN-γ
Этот тест основан на измерении образования IFN-γ в культуре 105 CD4 эффекторных T-лимфоцитов человека, культивируемых с микросферами, содержащими антитела против CD3 и против CD28, адгезированные на их поверхности (Dynabeads® CD3/CD28; Ref 111,31, Dynal), в присутствии или в отсутствие 2 × 104 регуляторных T-лимфоцитов человека (выделенных, как указано выше). Этот тест осуществляли в присутствии или в отсутствие пептида P60 (SEQ ID NO:1) для того, чтобы оценить ингибирующее действие регуляторных T-лимфоцитов. После 48 часов культивирования, присутствие IFN-γ в культуральных супернатантах измеряли с помощью коммерческого ELISA (Ref 555138, Pharmingen). На фиг.5 показано, что микросферы, содержащие антитела против CD3 и против CD28, стимулируют образование IFN-γ T-лимфоцитами, и что добавление регуляторных T-клеток в культуру позволяет ингибировать указанное образование IFN-γ. Добавление пептида P60 (SEQ ID NO:1) в эти совместные культуры снова позволяет блокировать ингибирующее действие регуляторных T-лимфоцитов человека, частично восстанавливая образование IFN-γ в ответ на стимул.
3.2 Влияние пептида P60 (SEQ ID NO:1) на иммуносупрессорную активность регуляторных T-лимфоцитов мыши
Способность пептида P60 (SEQ ID NO:1) ингибировать иммуносупрессорную активность регуляторных T-лимфоцитов мыши анализировали с помощью трех различных тестов:
a) с помощью теста, основанного на активации спленоцитов;
b) с помощью теста, основанного на реакции смешанной культуры лимфоцитов (РСКЛ); и
с) с помощью теста, основанного на совместном культивировании спленоцитов трансгенной мыши с регуляторными T-лимфоцитами.
3.2.1 Тест, основанный на активации спленоцитов
Во-первых, осуществляли тесты на активацию спленоцитов мыши BALB/c (Charles River) в присутствии антител против CD3 (Ref 553057, BD Biosciences). С этой целью, 105 спленоцитов мыши BALB/c культивировали в присутствии или в отсутствие антител против CD3, 2 × 104 регуляторных T-лимфоцитов мыши и пептида P60 (SEQ ID NO:1), и наблюдали, что пептид P60 (SEQ ID NO:1) (100 мкМ) способен ингибировать иммуносупрессорное влияние регуляторных T-лимфоцитов на образование IFN-γ эффекторными клетками в ответ на стимулирование антителами против CD3 (фиг.6).
3.2.2 Тест, основанный на реакции смешанной культуры лимфоцитов (РСКЛ)
Во-вторых, осуществляли тесты, основанные на реакции смешанной культуры лимфоцитов (РСКЛ). Эффекторные лимфоциты, выделенные из мышей BALB/c (105 клеток/лунка), совместно культивировали с очищенными дендритными клетками от мышей C57BL/6 (Charles River), в присутствии или в отсутствие регуляторных T-лимфоцитов BALB/c и в присутствии или в отсутствие пептида P60 (SEQ ID NO:1) (100 мкМ). Измерение клеточной пролиферации осуществляли с помощью стандартного теста на встраивание тритированного тимидина, который был описан ранее. Полученные результаты показали, что пептид P60 (SEQ ID NO:1) способен ингибировать иммуносупрессорное влияние регуляторных T-лимфоцитов на пролиферацию эффекторных клеток в ответ на РСКЛ (фиг.7).
3.2.2 Тест, основанный на совместном культивировании спленоцитов трансгенных мышей с регуляторными T-лимфоцитами
В-третьих, влияние пептида P60 (SEQ ID NO:1) измеряли в тесте, основанном на совместном культивировании спленоцитов трансгенных мышей OT-1 (T-лимфоциты которых имеют специфический T-клеточный рецептор для пептида SIINFEKL (SEQ ID NO:7) из овальбумина, эти клетки любезно предоставлены доктором Melero, CIMA Pamplona) с регуляторными T-лимфоцитами в присутствии антигена (SEQ ID NO:7) и в присутствии или в отсутствие регуляторных T-лимфоцитов.
На фиг.8 показано влияние пептида P60 (SEQ ID NO:1) на влияние природных регуляторных T-клеток мыши (выделенных из спленоцитов мыши) на ответную реакцию эффекторных клеток, вызванную стимуляцией антигеном (измеряли по содержанию IFN-γ в культуральном супернатанте). Эффекторные лимфоциты, выделенные от трансгенных мышей OT-1 (105 клеток/лунка), совместно культивировали с дендритными клетками мышей C57BL/6 и пептидом SIINFEKL (SEQ ID NO:7) (10 мкг/мл), в присутствии или в отсутствие 2 × 104 регуляторных T-клеток BALB/c и в присутствии или в отсутствие пептида P60 (SEQ ID NO:1) (100 мкМ). Как можно заметить, пептид P60 (SEQ ID NO:1) способен ингибировать иммуносупрессорное влияние регуляторных T-лимфоцитов на образование IFN-γ (измеряли с помощью коммерческого ELISA (Ref: 555138, Pharmingen, San Diego, CA)) эффекторными клетками со специфичностью к этому пептидному антигену.
ПРИМЕР 4
Влияние ингибирования скурфина на активацию фактора транскрипции NF-κВ
Сообщалось, что присутствие скурфина может ингибировать активацию фактора транскрипции NF-κВ в клетках 293 (Betelli et al, Proc Natl Acad Sci USA. 2005 102:5138-43). На основании этой работы, исследовали эффект от добавления пептида P60 (SEQ ID NO:1) в культуру клеток 293, трансфицированных плазмидой, экспрессирующей ген foxp3, которая любезно предоставлена доктором Oukka и описана ранее (Betelli et al, Proc Natl Acad Sci U S A. 2005 102:5138-43), и в культуру клеток 293, трансфицированных контрольной плазмидой вместе с плазмидой, экспрессирующей люциферазу под управлением промоторов, индуцируемых фактором транскрипции NF-кВ (Ref 631904, pNF-κВ-Luc, Clontech). Клетки 293 трансфицировали с использованием липофектамина с плазмидой pNF-κВ-Luc, экспрессирующей люциферазу под управлением промоторов, индуцируемых фактором транскрипции NF-κВ, в присутствии или в отсутствие плазмиды pcDNA, pcDNA-Foxp3 и пептида P60 (SEQ ID NO:1) (100 мкМ). После 24 часов культивирования, клетки собирали и измеряли активность люциферазы в клеточных экстрактах с помощью подходящего набора (Promega, Maddison, USA) и люменометра (люменометр Orion Microplate, Berthold detection systems, Germany). Полученные результаты приведены на фиг.9, где можно видеть, что присутствие скурфина в клетках ингибирует экспрессию люциферазы и что присутствие пептида P60 (SEQ ID NO:1) восстанавливает экспрессию люциферазы.
ПРИМЕР 5
Иммунологическое усиление противоопухолевых вакцин in vivo посредством введения пептидов, ингибирующих скурфин
Принимая во внимание ранее полученные результаты, осуществляли тесты in vivo для измерения иммунологического усиления посредством введения пептидов, ингибирующих скурфин при противоопухолевой вакцинации.
Модель опухоли, использованная в данном тесте, представляет собой модель, основанную на линии клеток рака толстого кишечника CT26, которая описана в предыдущей работе лаборатории авторов настоящего изобретения (Casares et al, 2 001. Eur J Immunol 31:1780-9; Casares et al., 2003. J Immunol 171:5931-9), поскольку авторы настоящего изобретения ранее показали, что в этой модели регуляторные T-лимфоциты проявляют иммуносупрессорное действие, способствуя росту опухоли (Casares et al., 2003, упоминалась выше).
В качестве антигена для вакцины использовали синтетический пептид (SEQ ID NO:8), который содержит цитотоксический T-клеточный эпитоп для линии CT26 (Huang, A. Y. et al, Proc Natl Acad Sci USA, 1996. 93:9730-9735) и иммунизация которым в некоторой степени препятствует росту опухоли, без ее элиминации из-за присутствия регуляторных T-лимфоцитов (Casares et al., 2003, упоминалась выше).
В кратком изложении, группы мышей BALB/c в возрасте 6 недель (Charles River) иммунизировали пептидом AH1 (SEQ ID NO:8), как описано в Casares et al., 2001, которая упоминалась выше, в присутствии или в отсутствие пептида P60 (SEQ ID NO:1). Через десять дней после иммунизации мышам подкожно вводили 5 × 105 клеток CT26 и измеряли развитие опухоли.
Как показано на фиг.10, введение указанного пептида P60 (SEQ ID NO:1) в течение нескольких дней после иммунизации пептидом AH1 защищало мышей от появления опухоли. Фактически, только у 2 из 11 мышей, которых иммунизировали пептидом AH1 и лечили пептидом P60 (SEQ ID NO:1), развивалась пальпируемая опухоль (защита 82%), тогда как в остальных группах защита была значительно ниже, развивались летальные опухоли (мыши, иммунизированные только пептидом AH1 (0%), только пептидом P60 (SEQ ID NO:1) (10%) или только PBS (0%)) (n=11 во всех случаях).
На фиг.10A приведены кривые роста опухолей, а на фиг.10B приведены кривые выживаемости для различных экспериментальных групп (кривые Каплана-Мейера). p<0,001 указывает на то, что результат статистического анализа получен с использованием логарифмического рангового критерия.
| название | год | авторы | номер документа |
|---|---|---|---|
| АКТИВАТОР РЕГУЛЯТОРНЫХ T-КЛЕТОК И ЕГО ПРИМЕНЕНИЕ | 2017 |
|
RU2736650C2 |
| ПЕПТИД, СПОСОБНЫЙ СВЯЗЫВАТЬСЯ С TGF-β 1 И ИНГИБИРОВАТЬ БИОЛОГИЧЕСКУЮ АКТИВНОСТЬ TGF-β 1 IN VITRO И/ИЛИ IN VIVO, ПРИМЕНЕНИЕ ПЕПТИДА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПОСЛЕДОВАТЕЛЬНОСТЬ ДНК, КОНСТРУКЦИЯ ДНК, ВЕКТОР ЭКСПРЕССИИ, КЛЕТКА-ХОЗЯИН И СПОСОБ ПОЛУЧЕНИЯ ПЕПТИДА | 2004 |
|
RU2333917C2 |
| ПРИМЕНЕНИЕ ПОСЛЕДОВАТЕЛЬНОСТИ ДНК, КОТОРАЯ КОДИРУЕТ ПЕПТИД, СПОСОБНЫЙ СВЯЗЫВАТЬСЯ С ТРАНСФОРМИРУЮЩИМ ФАКТОРОМ РОСТА β1 (ВАРИАНТЫ) | 2008 |
|
RU2455358C2 |
| МОНОКЛОНАЛЬНОЕ АНТИТЕЛО, ПОДАВЛЯЮЩЕЕ ИММУНОСУПРЕССОРНЫЕ ФУНКЦИИ ПАТОГЕНОВ, АНТИГЕН-СВЯЗЫВАЮЩИЙ ФРАГМЕНТ УКАЗАННОГО АНТИТЕЛА И ГИБРИДОМЫ, ВЫРАБАТЫВАЮЩИЕ УКАЗАННОЕ АНТИТЕЛО | 2017 |
|
RU2751918C2 |
| СЛИТЫЙ ПОЛИПЕПТИД С ПРОТИВОРАКОВОЙ АКТИВНОСТЬЮ | 2016 |
|
RU2727165C2 |
| МУТЕИНЫ ЛИПОКАЛИНА 2 ЧЕЛОВЕКА (Lcn2, hNGAL) С АФФИННОСТЬЮ ДЛЯ ОПРЕДЕЛЕННОЙ МИШЕНИ | 2019 |
|
RU2804336C2 |
| ИММУНОСУПРЕССОРНЫЕ ПОЛИПЕПТИДЫ И НУКЛЕИНОВЫЕ КИСЛОТЫ | 2008 |
|
RU2506275C2 |
| МУТЕИНЫ ЛИПОКАЛИНА 2 ЧЕЛОВЕКА (LCN2, HNGAL) С АФФИННОСТЬЮ ДЛЯ ОПРЕДЕЛЕННОЙ МИШЕНИ | 2010 |
|
RU2564125C2 |
| МУТЕИНЫ ЛИПОКАЛИНА 2 ЧЕЛОВЕКА (Lcn2, hNGAL) С АФФИННОСТЬЮ ДЛЯ ОПРЕДЕЛЕННОЙ МИШЕНИ | 2010 |
|
RU2707126C2 |
| ГЕН НОВОЙ СЕРИНОВОЙ ПРОТЕАЗЫ, РОДСТВЕННОЙ DPPIV | 2001 |
|
RU2305133C2 |




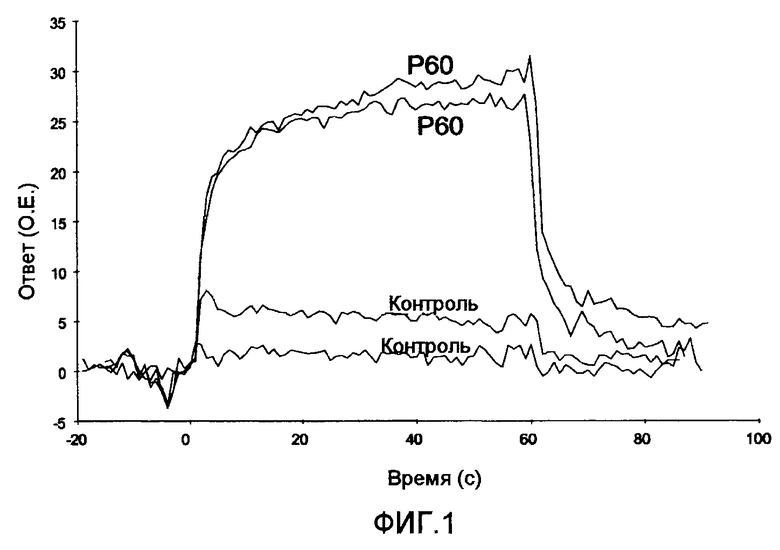
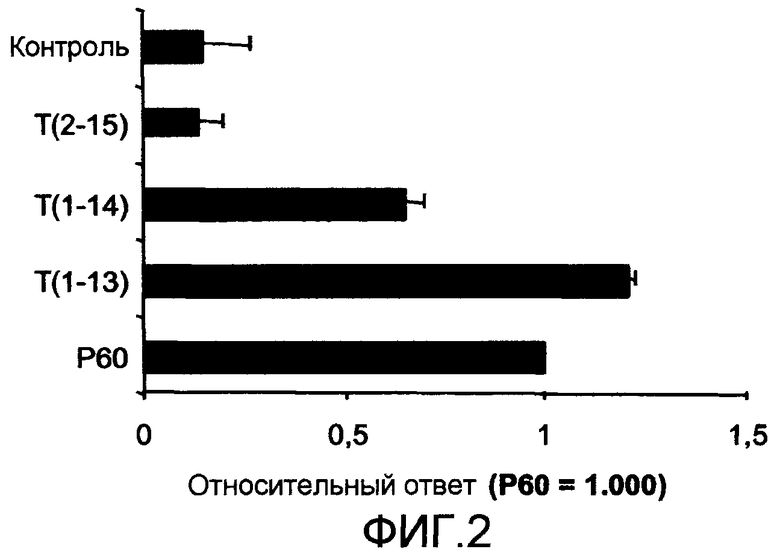
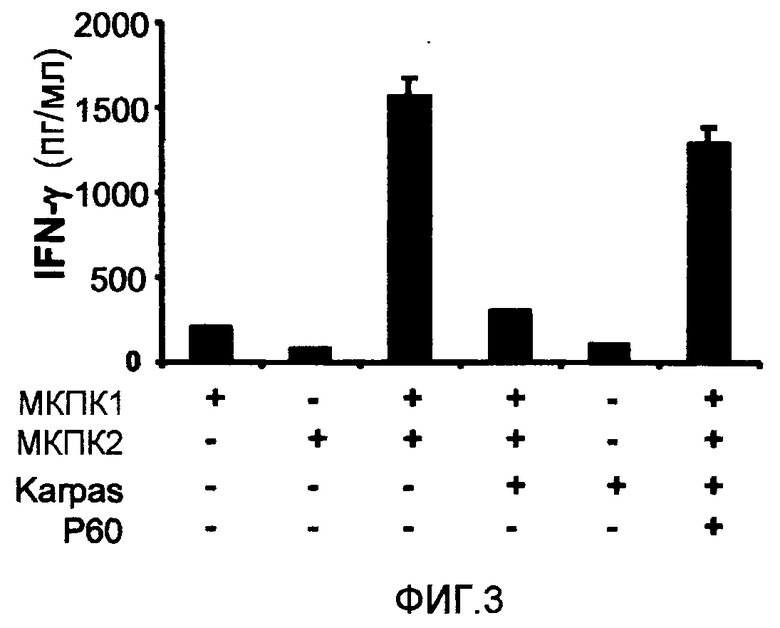
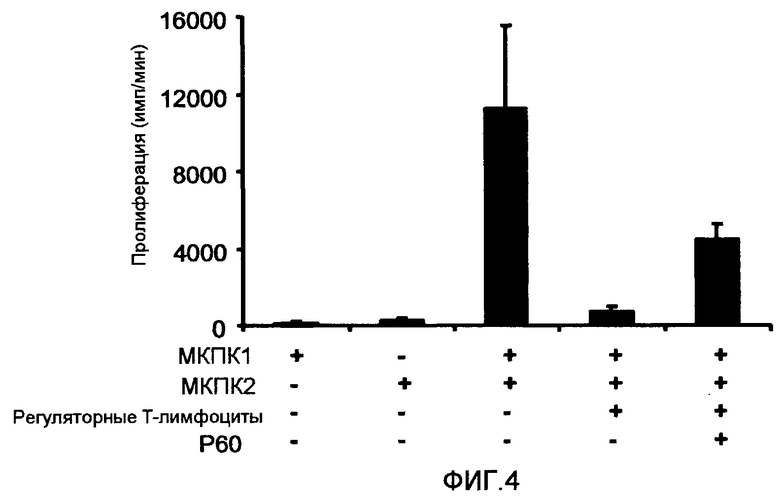
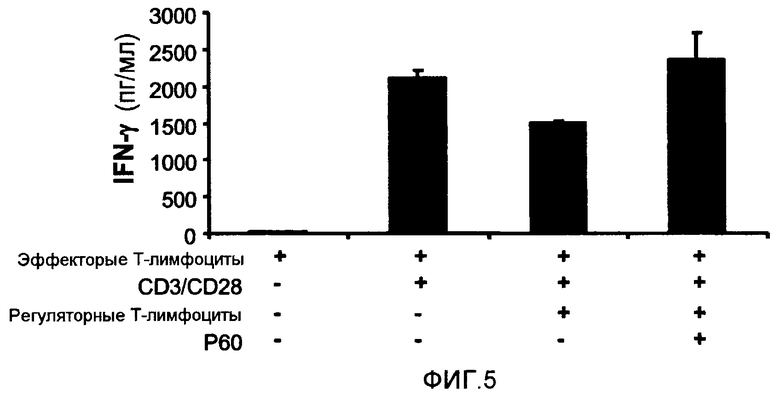
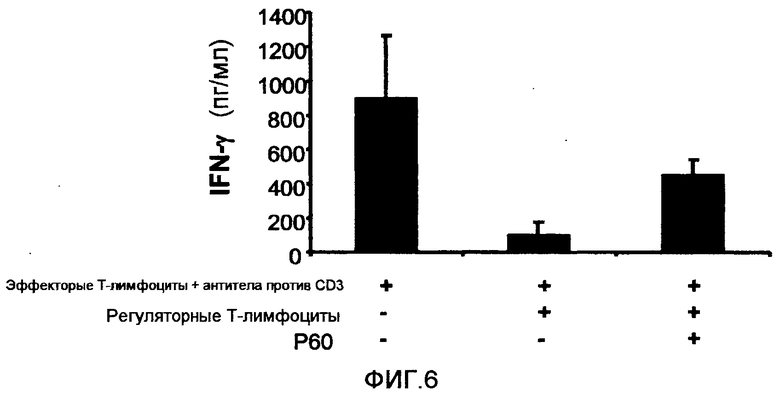
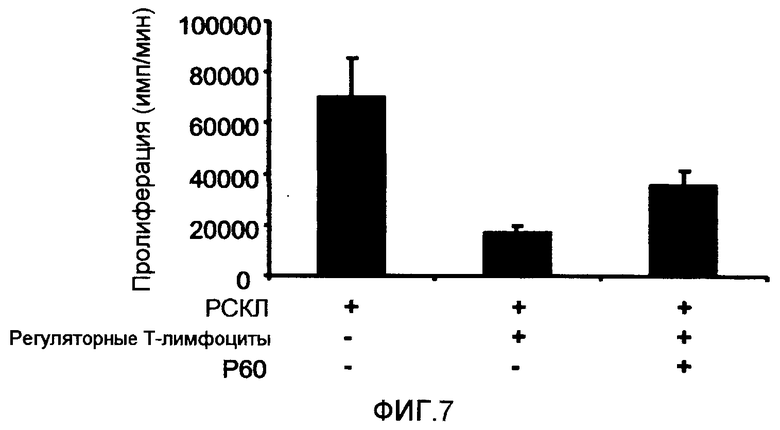
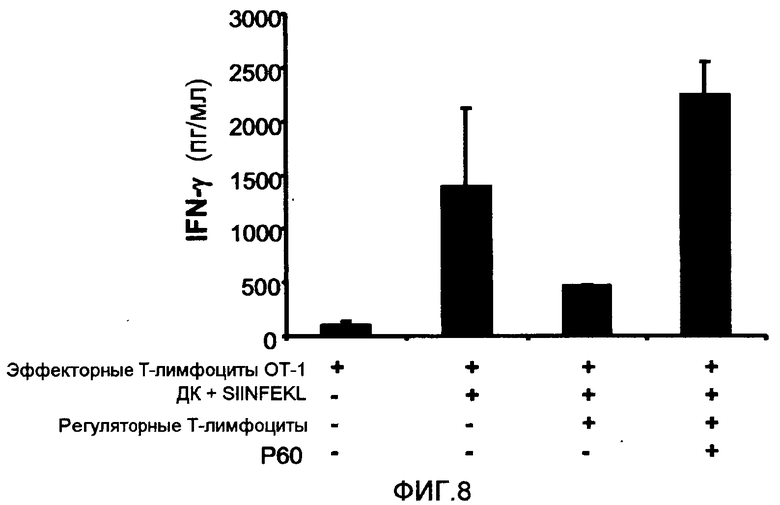
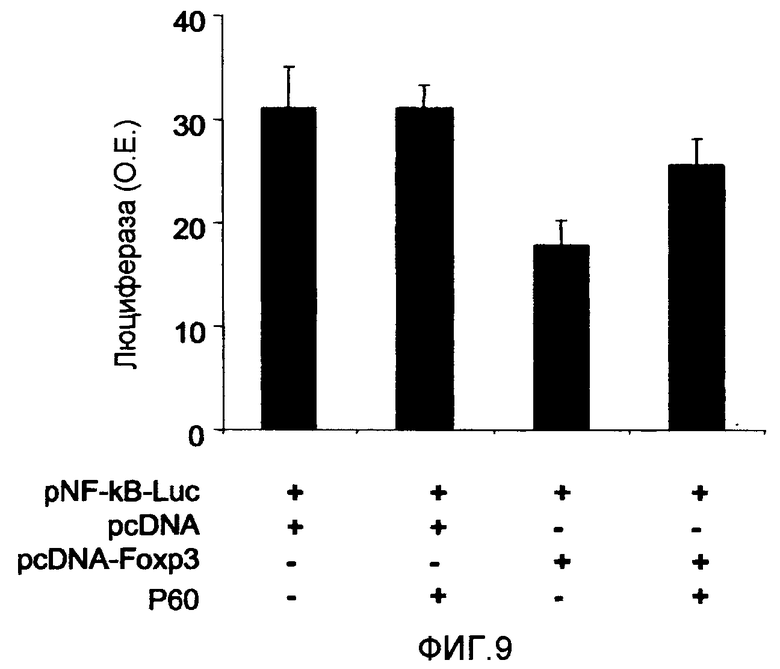
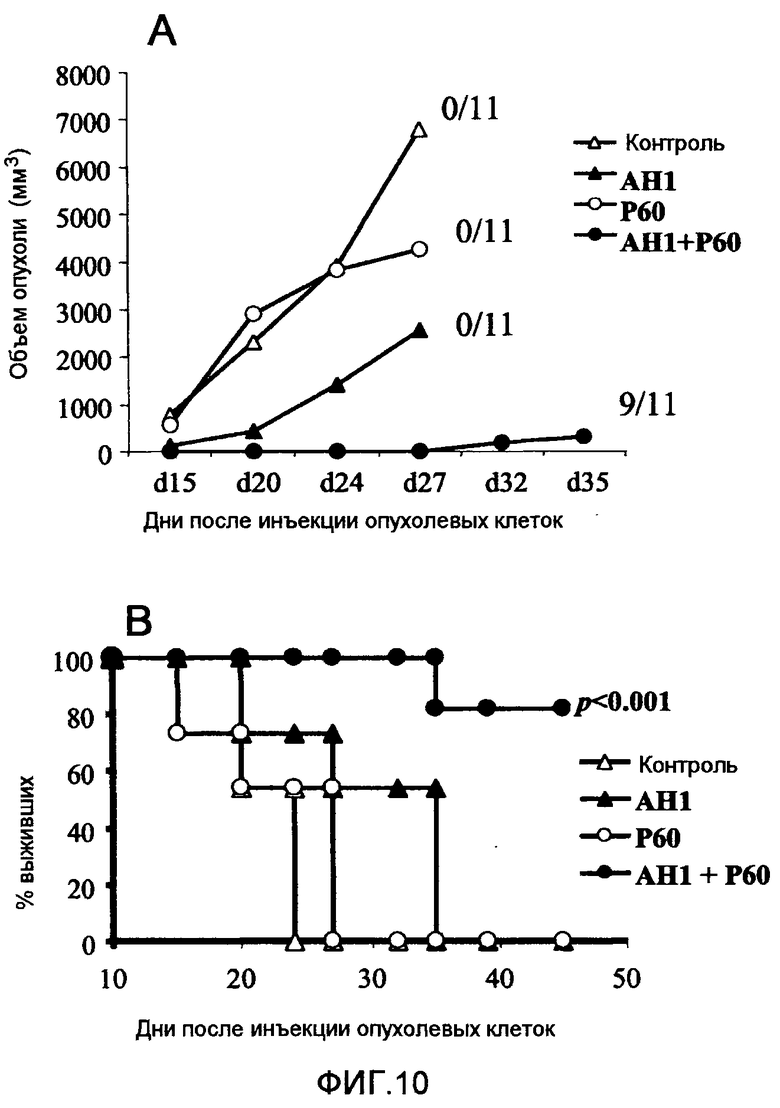
Изобретение относится к области биохимии, в частности к пептиду со способностью связываться со скурфином и ингибировать биологическую активность скурфина, который выбран из пептида, состоящего из аминокислотной последовательности Arg-Asp-Phe-Gln-Ser-Phe-Arg-Lys-Met-Trp-Pro-Phe-Phe-X, где Х отсутствует или Х присутствует и представляет собой X14 или X14-X15, где X14 и X15 независимо друг от друга обозначают аминокислоту, варианта указанного пептида и его фармацевтически приемлемой соли. Также раскрыты слитый белок и фармацевтическая композиция, предусматривающая использование указанного пептида и слитого белка, а также их применение для ее получения и лечения патологии, требующей транзиентной регуляции или ингибирования иммуносупрессорной активности регуляторных Т-лимфоцитов, такой как неопластическое заболевание или инфекционное заболевание. Кроме того, изобретение относится к способу получения указанного пептида и слитого белка, в том числе к нуклеиновой кислоте, кодирующей белок или пептид, ДНК-конструкции, экспрессирующему вектору и клетке хозяина. Изобретение позволяет эффективно лечить инфекционные и неопластические заболевания, требующие транзиентной регуляции или ингибирования иммуносупрессорной активности регуляторных Т-лимфоцитов. 11 н. и 15 з.п. ф-лы, 10 ил., 5 пр.
1. Пептид со способностью связываться со скурфином и ингибировать биологическую активность скурфина, который выбран из:
a) пептида, состоящего из аминокислотной последовательности:
Arg-Asp-Phe-Gln-Ser-Phe-Arg-Lys-Met-Trp-Pro-Phe-Phe-X,
где Х отсутствует или Х присутствует и представляет собой Х14 или Х14-Х15, где X14 и X15 независимо друг от друга обозначают аминокислоту;
b) варианта пептида, который определен в а), где указанный вариант представляет собой пептид, аминокислотная последовательность которого имеет степень идентичности по меньшей мере 80% по отношению к пептиду, определенному в а), и сохраняет способность связываться со скурфином и ингибировать биологическую активность скурфина; и его фармацевтически приемлемые соли.
2. Пептид по п.1, где указанный вариант b) представляет собой пептид, аминокислотная последовательность которого имеет степень идентичности по меньшей мере 90% по отношению к пептиду, определенному в а), и сохраняет способность связываться со скурфином и ингибировать биологическую активность скурфина.
3. Пептид по п.1, где указанный пептид представляет собой пептид, который состоит из SEQ ID NO:1, SEQ ID NO:2 или SEQ ID NO:3, или его фармацевтически приемлемую соль.
4. Пептид по п.1, который состоит из аминокислотной последовательности:
Arg-Asp-Phe-Gln-Ser-Phe-Arg-Lys-Met-Trp-Pro-Phe-Phe-X14-X15, где X14 и X15 независимо друг от друга обозначают аминокислоту.
5. Пептид по п.4, где X14 представляет собой Аlа и X15 представляет собой Met.
6. Пептид по п.1, состоящий из аминокислотной последовательности:
Arg-Asp-Phe-Gln-Ser-Phe-Arg-Lys-Met-Trp-Pro-Phe-Phe-X, где Х представляет собой X14, где X14 обозначает аминокислоту.
7. Пептид по п.6, где X14 представляет собой Аlа.
8. Пептид по п.1, где указанный пептид выбирают из пептида, состоящего из SEQ ID NO:1, SEQ ID NO:2 и SEQ ID NO:3.
9. Слитый белок, обладающий способностью связывать скурфин и ингибировать биологическую активность скурфина, который содержит:
(i) пептид по любому из пп.1-8; и
(ii) пептид-носитель со способностью к интернализации пептида в клетку.
10. Слитый белок по п.9, где указанный пептид-носитель содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13 и SEQ ID NO: 14.
11. Слитый белок по п.10, который дополнительно содержит спейсерный пептид, расположенный между указанным пептидом по любому из пп.1-8 [пептид (i)] и указанным пептид ом-носителем [пептид (ii)].
12. Слитый белок по п.10, который дополнительно содержит аминокислотную последовательность, которую можно использовать для выделения или очистки слитого белка.
13. Фармацевтическая композиция, содержащая терапевтически эффективное количество пептида по любому из пп.1-8 или слитого белка по любому из пп.9-12, вместе, по меньшей мере, с одним фармацевтически приемлемым эксципиентом, для лечения патологии, при которой является подходящим или необходимым временно или транзиентно регулировать или блокировать иммуносупрессорную активность регуляторных Т-лимфоцитов.
14. Фармацевтическая композиция по п.13, которая содержит, в дополнение, по меньшей мере, к одному пептиду по любому из пп.1-8 или слитому белку по любому из пп.9-12, одно или более соединений, ингибирующих или регулирующих иммуносупрессорную активность различных регуляторных Т-лимфоцитов.
15. Применение пептида по любому из пп.1-8 или слитого белка по любому из пп.9-12 для получения фармацевтической композиции для лечения патологии, требующей транзиентной регуляции или ингибирования иммуносупрессорной активности регуляторных Т-лимфоцитов, такой как неопластическое заболевание или инфекционное заболевание.
16. Применение по п.15, где указанное инфекционное заболевание выбрано из заболеваний, вызванных вирусной инфекцией, бактериальной инфекцией, грибковой инфекцией и паразитарной инфекцией.
17. Применение по п.16, где указанное инфекционное заболевание выбрано из заболевания, вызванного вирусом гепатита С, и заболевания, вызванного вирусом гепатита В.
18. Применение по п.15, где указанное неопластическое заболевание представляет собой папиллому, аденому, липому, остеому, миому, ангиому, невус, зрелую тератому, карциному, саркому или незрелую тератому.
19. Применение по п.18, где указанное неопластическое заболевание представляет собой меланому, миелому, лейкемию, лимфому Ходжкина, базалиому, спиналиому, рак молочной железы, рак яичника, рак матки, рак легкого, рак бронхов, рак предстательной железы, рак толстого кишечника, рак поджелудочной железы, рак почки, рак пищевода, гепатокарциному или рак головы и шеи.
20. Применение пептида по любому из пп.1-8 или слитого белка по любому из пп.9-12 для лечения патологии, требующей транзиентной регуляции или ингибирования иммуносупрессорной активности регуляторных Т-лимфоцитов, такой как неопластическое заболевание или инфекционное заболевание.
21. Нуклеиновая кислота, кодирующая пептид по любому из пп.1-8 или слитый белок по любому из пп.9-12.
22. ДНК-конструкция, кодирующая пептид по любому из пп.1-8 или слитый белок по любому из пп.9-12, содержащая нуклеиновую кислоту по п.21 и функционально связанную последовательность, регулирующую экспрессию указанной нуклеиновой кислоты.
23. Экспрессирующий вектор, который содержит нуклеиновую кислоту по п.21 или ДНК-конструкцию по п.22.
24. Клетка-хозяин для продуцирования пептида по любому из пп.1-8 или слитого белка по любому из пп.9-12, которая содержит нуклеиновую кислоту по п.21 или ДНК-конструкцию по п.22 или экспрессирующий вектор по п.23.
25. Способ получения пептида по любому из пп.1-8 или слитого белка по любому из пп.9-12, который включает выращивание клетки-хозяина по п.24 в условиях, которые делают возможным получение указанного пептида, и, при желании, сбор указанного пептида или указанного слитого белка.
26. Применение нуклеиновой кислоты по п.21 или ДНК- конструкции по п.22 при получении векторов и клеток для лечения патологии, требующей транзиентной регуляции или ингибирования иммуносупрессорной активности регуляторных Т-лимфоцитов, такой как неопластическое заболевание или инфекционное заболевание.
| US 2003170648 A1, 11.09.2003 | |||
| ZUO Т | |||
| et al., FOXP3 is an X-linked breast cancer suppressor gene and an important repressor of the HER-2/ErbB2 oncogene | |||
| Cell, 2007, Vol.129, n.7, pp.1275-1286 | |||
| HORI S | |||
| et al., Control of regulatory Т cell development by the transcription factor Foxp3, Science, 2003, Vol.299, n | |||
| РЕОСТАТ НАКАЛА ДЛЯ КАТОДНЫХ ЛАМП | 1925 |
|
SU5609A1 |
| БЫКОВСКАЯ С.Н | |||
| и | |||
Авторы
Даты
2013-12-27—Публикация
2008-11-14—Подача