Область техники, к которой относится изобретение
Изобретение в целом относится к пептидам, способным связываться с трансформирующим фактором роста β1 (ТGF-β1), и к применению таких пептидов. В частности, изобретение относится к пептидам, ингибирующим биологическую активность TGF-β1 в результате прямого связывания с TGF-β1, и к их применению при лечении заболеваний или патологических нарушений, связанных с гиперэкспрессией или разрегулированной экспрессией TGF-β1.
Уровень техники
TGF-β1 является гликопротеидом, принадлежащим к суперсемейству структурно связанных регуляторных белков (цитокинов), входящих в состав одной из трех изоформ, описанных у млекопитающих (TGF-β1, 2 и 3). Наиболее распространенной является изоформа TGF-β1, которая состоит из гомодимера в 25 кДа, составленного из двух субъединиц, соединенных дисульфидной связью. Аминокислотная последовательность человеческого TGF-β1 описана рядом авторов, например, у Derynck К. et al., в "Human transforming growth factor-beta complementary DNA sequence and expression in normal and transformed cells", Nature 316 (6030), 701-705 (1985).
TGF-β1 является молекулой с последовательностью, в высокой степени сохранившейся в процессе эволюции. Несмотря на то, что ее первоначальной характеристикой была способность к индукции адгезии независимо от пролиферации и морфологических изменений в фибробластах крыс, в последующих исследованиях выявлено, что TGF-β1 является общим ингибитором пролиферации широкого диапазона типов клеток. Данная молекула продуцируется разнообразными типами клеток и различными тканями, в течение всех фаз клеточной дифференцировки. Она обладает широким рядом биологических эффектов с генерированием потенции и часто противоположных эффектов, относящихся к развитию, физиологии и иммунному ответу. В испанской патентной заявке ES 2146552 А1 можно найти информацию относительно роли TGF-β1 в регенерации печени и дифференциации, и в развитии фиброза печени, а также о влиянии этих молекул на внеклеточный матрикс.
С целью исследования механизма действия TGF-β1 изучено (по литературным данным) взаимодействие примерно десяти белков (мембранных рецепторов и белков внеклеточного матрикса) с этим цитокином.
С другой стороны, в силу того, что существует много заболеваний или патологических нарушений, связанных с гиперэкспрессией или разрегулированной экспрессией TGF-β1, например фиброз, связанный с потерей функции органа или ткани, или хирургические или эстетические осложнения, интересно выяснить, какие продукты способны ингибировать биологическую активность TGF-β1, потому что такие продукты потенциально могут применяться при лечении человека или животного для блокирования патологических последствий гиперэкспрессии или разрегулированной экспрессии TGF-β1.
Было использовано несколько стратегий ингибирования биологической активности TGF-β1, включающих в себя применение: (1) специфических нейтрализирующих антител; (2) антисмысловых олигонуклеотидных последовательностей гена, кодирующего TGF-β1, которые блокируют его экспрессию; или (3) растворимых рецепторов для TGF-β1, которые действуют сходным с антителами образом. Использование антител предоставляет полную и специфическую блокировку этого цитокина (TGF-β1), хотя определенные побочные эффекты усиливаются как наличием в крови экзогенных иммуноглобулинов, так и влиянием последствий системной блокировки TGF-β1. Кроме того, устойчивость иммуноглобулина в динамике по времени не позволяет проводить кратковременный контроль блокирующей активности этого цитокина. Антисмысловые олигонуклеотидные последовательности ингибируют продуцирование TGF-β1 на уровне экспрессии гена - это явление способно вызывать значительную разрегуляцию всех процессов, в которых участвует этот цитокин.
Недавно была разработана другая стратегия, основанная на использовании пептидов, ингибирующих биологическую активность TGF-β1. В этой связи в испанской патентной заявке ES 2146552 А1 описаны некоторые синтетические пептиды, происходящие как из TGF-β1, так и из его рецепторов, или из белков, способных к связыванию с TGF-β1, и которые могут использоваться в качестве ингибиторов биологической активности TGF-β1.
Сущность изобретения
Настоящее изобретение в целом относится к проблеме поиска новых соединений, способных ингибировать биологическую активность TGF-β1.
Настоящее изобретение обеспечивает решение на основе того факта, что авторы настоящего изобретения идентифицировали ряд пептидов, обладающих способностью не только связываться с TGF-β1, но также и ингибировать биологическую активность TGF-β1 через прямое связывание с ним. Проведена идентификация некоторых из этих пептидов с применением технологии библиотек пептидных фаговых дисплеев, которая позволяет идентифицировать пептиды с обычным размером в диапазоне от 6 до 15 аминокислот, способные к связыванию с высокой аффинностью с TGF-β1, с последующим количественным определением в анализах in vitro и in vivo их способности ингибировать биологическую активность TGF-β1. Другие пептиды получали усечением пептидов, предварительно идентифицированных, с применением технологии фаговых библиотек.
Пептиды, способные к связыванию с TGF-β1, и в особенности пептиды, способные прямым связыванием с TGF-β1 ингибировать его биологическую активность, являются потенциально полезными для лечения заболеваний и патологических нарушений, связанных с гиперэкспрессией или разрегулированной экспрессией TGF-β1. Аналогичным образом, пептиды, способные к связыванию с TGF-β1, представляют собой инструмент для изучения биологической роли TGF-β1 (в аспекте, необходимом для объяснения регуляции различных биологических процессов во многих областях).
Таким образом, один аспект настоящего изобретения относится к пептидам, способным к связыванию с TGF-β1. В частном и предпочтительном варианте осуществления эти пептиды также способны ингибировать биологическую активность TGF-β1.
В другом аспекте настоящее изобретение относится к фармацевтической композиции, содержащей по меньшей мере один из указанных пептидов.
В другом аспекте настоящее изобретение относится к применению указанных пептидов для получения фармацевтической композиции для лечения заболеваний и патологических нарушений, связанных с гиперэкспрессией или разрегулированной экспрессией TGF-β1. Типичные примеры таких заболеваний или патологических нарушений, связанных с гиперэкспрессией или разрегулированной экспрессией TGF-β1, включают в себя фиброз, связанный с потерей функции органа или ткани, а также хирургические и/или эстетические осложнения.
В другом аспекте настоящее изобретение относится к последовательностям ДНК, которые кодируют указанные пептиды.
В другом аспекте настоящее изобретение относится к конструкции ДНК, содержащей последовательность ДНК, которая кодирует пептид, обеспечиваемый настоящим изобретением.
В другом аспекте настоящее изобретение относится к вектору, содержащему указанную последовательность ДНК или конструкцию ДНК.
В другом аспекте настоящее изобретение относится к клетке-хозяину, такой как трансформированная клетка-хозяин, которая содержит указанную конструкцию ДНК или вектор.
В другом аспекте настоящее изобретение относится к способу получения пептида, обеспечиваемого настоящим изобретением, который включает выращивание указанных клеток-хозяев в условиях, допускающих экспрессию указанного пептида, и, если желательно, выделение полученного пептида.
В другом аспекте настоящее изобретение относится к применению указанных последовательностей ДНК и конструкций ДНК в производстве векторов и клеток для лечения заболеваний и патологических нарушений, связанных с гиперэкспрессией или разрегулированной экспрессией TGF-β1, с применением технологий генной терапии.
Краткое описание чертежей
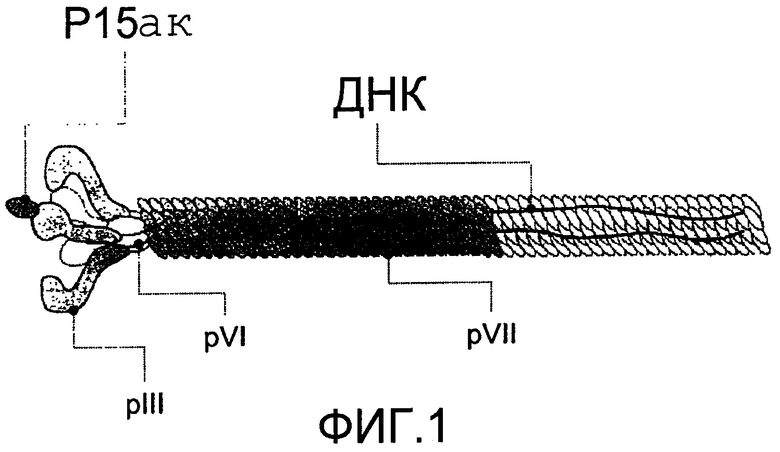
Фиг.1 схематично показывает положение 15-аминокислотного (ак) пептида, генетически слитого с белком рIII на поверхности нитевидного бактериофага М13.
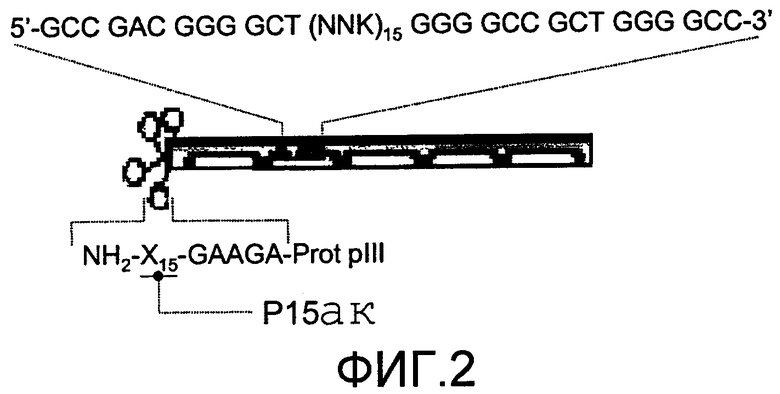
Фиг.2 схематично показывает генетическое положение вставки в геном бактериофага М13, которая кодирует 15-ак пептид, и положение пептида в последовательности белка рIII.
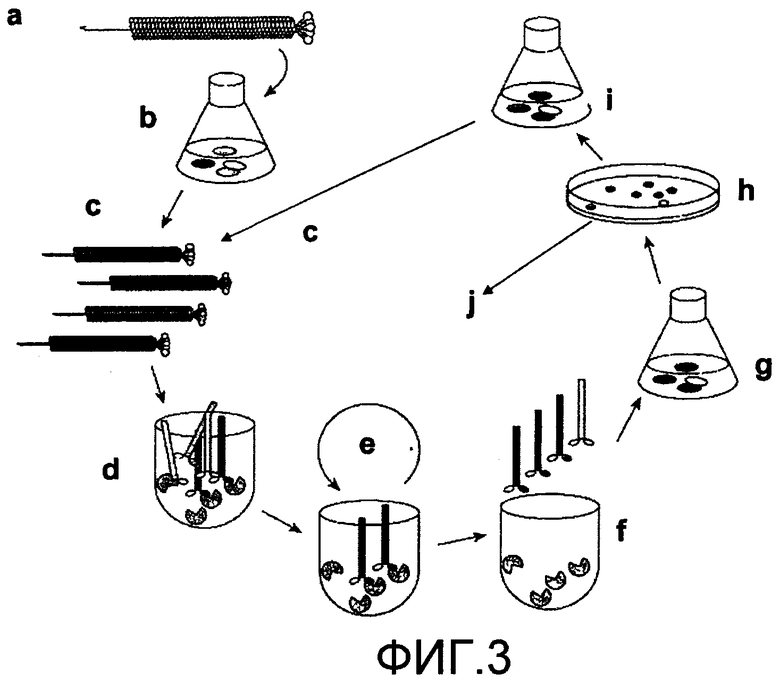
Фиг.3 схематично показывает выбор пептидов, основанный на технологии "биопэннинга". Биотинилированный TGF-β1 иммобилизировали в чашках Петри, содержащих стрептавидин (через биотин-стрептавидин связывание). Отбирали фаги из библиотеки на основе взаимодействия между TGF-β1 и пептидами, представленными фагами. Фаги с низким сродством к TGF-β1 удаляли промыванием. Фаги, остающиеся в чашке Петри, элюировали понижением уровня pH. Фаги выделяли и секвенировали после трех циклов обогащения фагами с высоким сродством к TGF-β1 (см. пример 1) [Подписи к фиг.3: "а": библиотека фагов, представляющих 15-ак пептиды; "b": инфицирование Е. coli (К19Каn) (амплификация); "c": очистка фагов; "d": инкубирование фагов с понижением концентраций TGF-β1; "e": промывание; "f": элюирование связанных фагов (↓рН); "g": инфицированный штамм E. coli; "h": отбор инфицированных колоний (тетрациклин); "i": амплификация отобранных фагов; и "j": секвенирование ДНК (соответствующей пептиду) после трех циклов "биопэннинга"].
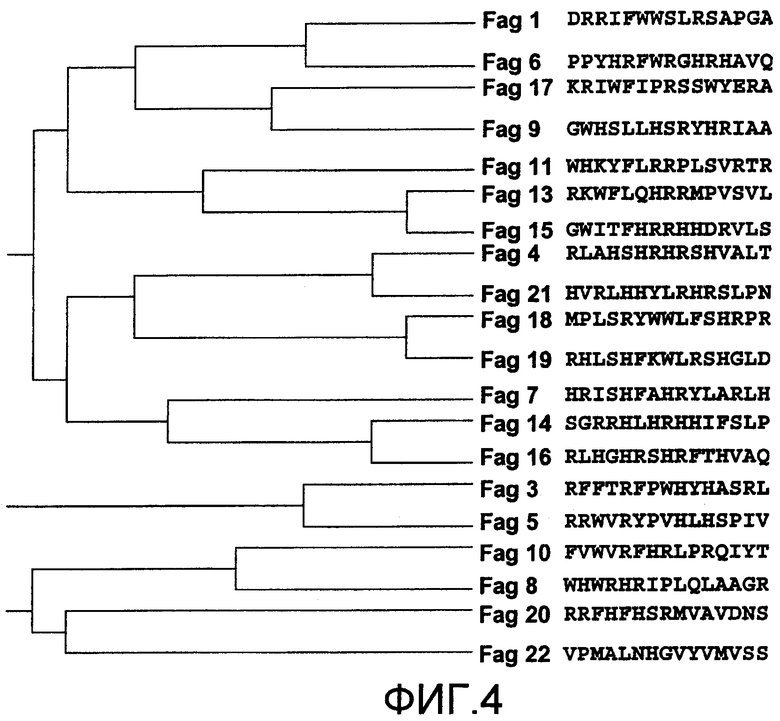
Фиг.4 представляет образец аналогового древа последовательности среди 15-ак пептидов, идентифицированных с использованием библиотеки пептидных фаговых дисплеев.
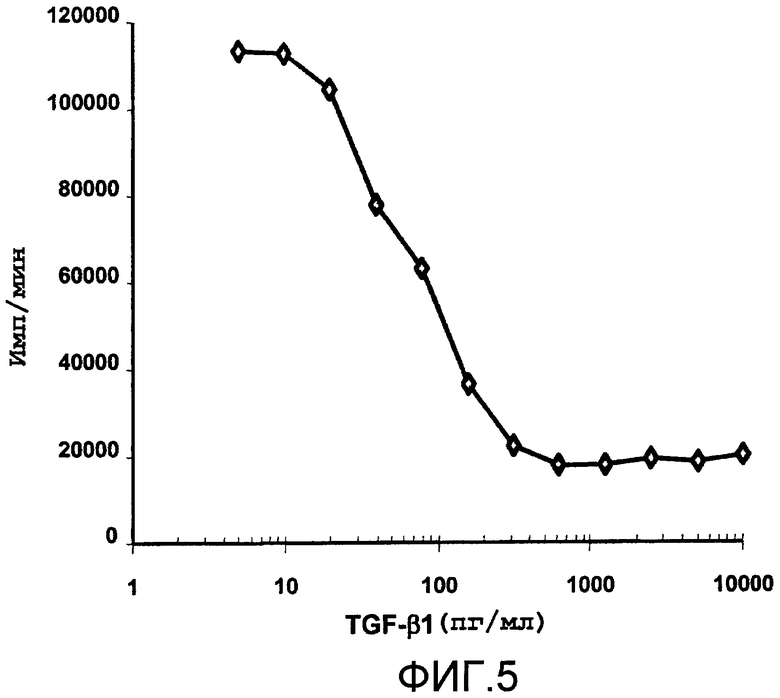
Фиг.5 в виде диаграммы показывает влияние концентрации TGF-β1 на рост клеточной линии Мv-1-Lu, выражаемой в накоплении тритиированного тимидина в числе импульсов в минуту (имп/мин).
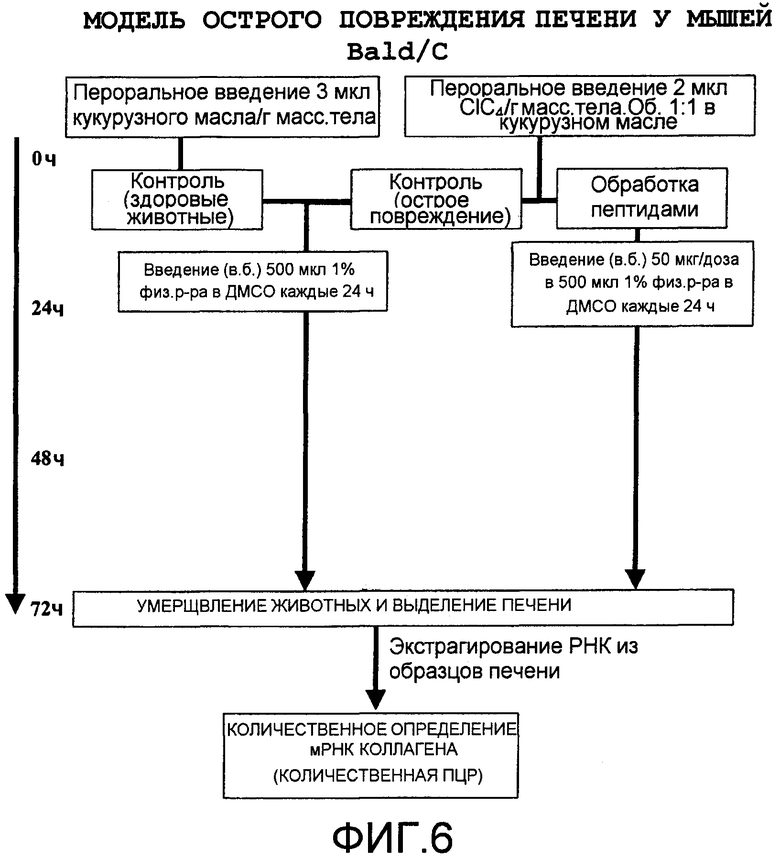
Фиг.6 представляет в виде диаграммы протокол острого индуцированного повреждения печени (см. пример 3).
Подробное описание изобретения
В одном аспекте настоящее изобретение относится к пептиду, далее называемому как пептид настоящего изобретения, последовательность аминокислот которого содержит от 3 до 15 последовательных аминокислотных остатков последовательностей аминокислот, выбираемых из SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21 и 15 SEQ ID NO:22, и их фармацевтически приемлемых солей.
Пептиды настоящего изобретения способны связываться с TGF-β1. Некоторые из этих пептидов способны ингибировать биологическую активность TGF-β1 in vitrо и/или in vivo.
Способность пептидов настоящего изобретения связываться с TGF-β1 можно определить любым подходящим способом, позволяющим установить связывание между двумя молекулами, например, посредством аффинного анализа, который включает в себя обеспечение контакта TGF-β1 с тестируемым пептидом в условиях, позволяющих связывание пептида с TGF-β1; и оценку связывания пептида и TGF-β1. В частном варианте осуществления можно проводить аффинный анализ, используя также радиоактивно меченный TGF-β1, например, человеческий 125I-TGF-β1, как описано в ES 2146552 А1. Альтернативно тестируемый пептид может быть меченым компонентом. В целом, эти разновидности аффинного анализа предусматривают обеспечение контакта TGF-β1 (например, иммобилизированного в чашке Петре, блокированной стрептавидином) с тестируемым пептидом, аффинность которого необходимо определить, и анализ связывания пептида с TGF-β1 после инкубирования в течение адекватного инкубационного периода. Пептиды с низкой аффинностью к TGF-β1 удаляли промыванием, в то время как пептиды с высокой аффинностью оставались связанными с TGF-β1 и могли быть выделены путем нарушения молекулярных связей между этими двумя молекулами (например, понижением уровня рН). Посредством тестирования пептида в различных концентрациях TGF-β1 или наоборот, можно получить представление об аффинности тестируемого пептида к TGF-β1. Можно оценивать и, если это желательно, количественно определять способность пептидов настоящего изобретения ингибировать биологическую активность TGF-β1 in vitrо, используя тест ингибирования роста клеточной линии Mv-1-Lu с получением этой клеточной линии, пролиферация которой ингибируется TGF-β1, из легочного эпителия норки (см. пример 2).
Можно оценивать и, если это желательно, количественно определять способность пептидов настоящего изобретения ингибировать биологическую активность TGF-β1 in vivo, используя тестирование на модели животных с острым повреждением печени, вызванным, например, воздействием четыреххлористого углерода (CCl4) (см. пример 3). Известно, что острое повреждение печени вызывает каскад эффектов и физиологических реакций, включающих в себя повышение уровней TGF-β1, которое, в свою очередь, отвечает (наряду с другими эффектами) за экспрессию 1 типа гена коллагена.
В объем настоящего изобретения входят фармацевтически приемлемые соли пептида настоящего изобретения. Термин "фармацевтически приемлемые соли" включают в себя соли, которые обычно образуют соли металлов или аддитивные соли кислот. Характер соли не является решающим для обеспечения фармацевтической приемлемости. Фармацевтически приемлемые соли пептида настоящего изобретения можно получать из кислот или оснований (органических или неорганических), используя общепринятые способы, хорошо известные специалистам в данной области.
В частном варианте осуществления настоящее изобретение обеспечивает пептид, содержащий 3, 4, 5, б, 7, 8, 9, 10, 11, 12, 13, 14 или 15 последовательных аминокислотных остатков аминокислотной последовательности, выбираемых из SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21 и SEQ ID NO:22, и их фармацевтически приемлемых солей.
В другом частном варианте осуществления настоящее изобретение обеспечивает пептид, выбираемый из группы, образованной пептидами, идентифицируемыми последовательностями SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21 и SEQ ID NO:22, и их фармацевтически приемлемыми солями.
В другом частном варианте осуществления настоящее изобретение обеспечивает пептид, выбираемый из группы, образованной пептидами, идентифицируемыми последовательностями SEQ ID NО:24, SEQ ID NO:25, SEQ ID NO:26, SEQ ID NО: 27, SEQ ID NO:28, SEQ ID NO:29, SEQ ID NO:30, SEQ ID NO:31, SEQ ID NO:32, SEQ ID NO:33, SEQ ID NO:34, SEQ ID NO:35 и SEQ ID NO:36, и их фармацевтически приемлемыми солями. Эти пептиды содержат от 9 до 14 последовательных аминокислотных остатков аминокислотной последовательности пептида, идентифицированной как SEQ ID No:17, и их получали усечением указанного пептида (пример 4).
В другом частном варианте осуществления настоящее изобретение обеспечивает пептид, выбираемый из группы, образованной пептидами, идентифицированными как SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:11, SEQ ID NO:14, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:33 и SEQ ID NO:34, и их фармацевтически приемлемыми солями. Пептиды, идентифицированные как SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:11, SEQ ID NO:14 и SEQ ID NO:17, проявляют способность ингибировать биологическую активность TGF-β1 как in vitro, так и in vivo; пептид, идентифицированный как SEQ ID NO:2, проявляет способность ингибировать биологическую активность TGF-β1 только in vivo; в то время как пептиды, идентифицированные как SEQ ID NO:3 и SEQ ID NO:18, проявляют способность ингибировать биологическую активность TGF-β1 только in vitro. Пептиды, идентифицированные как SEQ ID NO:33 и SEQ ID NO:34, проявляют способность ингибировать биологическую активность TGF-β1 in vitro.
Для исходной идентификации пептидов, способных связываться с TGF-β1, стало полезным использование технологии привлечения библиотек пептидных фаговых дисплеев, которые позволяют определять пептиды с высокой аффинностью связывания с TGF-β1, и дальнейшего количественного определения in vitro и in vivo их способности ингибировать биологическую активность TGF-β1. Последовательность указанных пептидов, которые связываются с TGF-β1, ингибируя биологическую активность TGF-β1 in vitro или in vivo, можно вывести из соответствующей последовательности ДНК после различных циклов биопэннинга (обычно 3 циклов). Использование библиотек пептидных фаговых дисплеев для идентификации ингибиторов некоторых продуктов описано, например, Chirinos-Rojas С.L. et al., в Immunology, 1999, Jan. 96(1): 109-113; McConnell S.J., et al., в Gene 1994, Dec. 30, 151 (1-2): 115-118; или Smith G.Р., в Science, 1985, Jun. 14, 228 (4705): 1315-1317.
Таким образом, настоящее изобретение обеспечивает способ идентификации пептидов, способных к связыванию с TGF-β1, который предусматривает:
(i) использование библиотек пептидных фаговых дисплеев, содержащих множество нитевидных фагов, геном каждого из которых содержит нуклеотидную последовательность, кодирующую отдельный пептид, связанный с геном, кодирующим оболочечный белок фага (таким образом, каждый фаг содержит отдельный пептид, генетически слитый с оболочечным белком фага);
(ii) отбор посредством проведения анализов на аффинность фагов, содержащих пептиды, которые связываются с повышенной аффинностью с TGF-β1; и
(iii) определение последовательности пептидов, связываемых с TGF-β1, на основе соответствующих последовательностей ДНК, внедренных в фаги, отбираемые на этапе (ii), и которые кодируют указанные пептиды, связывающиеся с TGF-β1.
В частном варианте осуществления для получения 15-ак пептидов, способных с высокой аффинностью связываться с TGF-β1, а также имеющих потенциальную ингибирующую активность в отношении биологической активности указанного цитокина, полезно использование технологии библиотек пептидных фаговых дисплеев, содержащих множество нитевидных фагов (М13), каждый из которых содержит различные 15-ак пептиды, генетически слитые с оболочечным белком фага, применительно к этому случаю, связанные с N-концом оболочечного белка рIII. Таким образом, фаг представляет поверхность с 15-ак пептидом в каждой из 5 поверхностных белковых молекул, в то время как ДНК, кодирующая указанную пептидную последовательность, заключена внутри фага. В библиотеках фагов последовательность, кодирующая пептид, происходит из вырожденной последовательности с 20 природными аминокислотами в каждом из указанных 15 положений, поэтому возможно представление 1,1×1012 возможных последовательностей из 15 аминокислот в различных фагах. Физическое соотношение 1:1 между пептидной последовательностью и ДНК, кодирующей ее внутри бактериофага, позволяет отобрать (из широкого диапазона вариантов) те последовательности, которые специфически связываются с TGF-β1. Этот процесс осуществляют посредством анализа аффинного связывания.
В частном варианте осуществления указанный анализ аффинного связывания состоит из протокола отбора in vitro, известного как "биопэннинг". Коротко, такая технология предусматривает инкубирование набора фагов, представляющих в плане практики все варианты 15-ак пептидов (в рассматриваемом случае), в чашке Петри, блокированной стрептавидином и в которую добавляли биотинилированный TGF-β1. Таким образом, биотинилированный TGF-β1 фиксировали на чашке Петри биотин-стрептавидин связыванием, поэтому взаимодействие TGF-β1 с пептидами, которые несут фаги, отображалось корректно. После инкубации несвязанные фаги удаляли промыванием и специфически связанные фаги затем определенным образом элюировали понижением уровня рН, процедурой, нарушающей молекулярные связи между TGF-β1 и пептидами, представленными фагами. Затем элюированные фаги амплифицировали инфицированием в бактериальном штамме. Процесс повторяли трижды (3 цикла), для достижения повышенного содержания специфически связывающихся с высокой аффинностью с TGF-β1 фагов. Постепенно в каждом цикле снижали концентрацию применяемого для блокирования в чашках Петри биотинилированного TGF-β1, например, от 2,5 до 0,01, и, наконец, до 0,001 мкг/мл. Таким образом, в конце процесса фаги, выбранные по их аффинности к TGF-β1, секвенировали с использованием праймеров. Это позволило получить последовательность пептидных фаговых дисплеев.
Пример 1 показывает отбор пептидов, связываемых с TGF-β1, через библиотеки фагов, "биопэннинг", и секвенирование пептидов, связывающихся с высокой аффинностью с TGF-β1.
Настоящее изобретение также обеспечивает способ идентификации пептидов, способных к связыванию с TGF-β1, который содержит усечение пептидов, способных к связыванию с TGF-β1, сопровождаемое анализом способности этих усеченных пептидов связываться с TGF-β1. Усеченные пептиды можно получить любым общепринятым способом, таким как, например, химический синтез вариантов пептида (по их размеру), усеченных на N-конце и С-конце. Можно определить способность этих усеченных пептидов к связыванию с TGF-β1, используя любой подходящий способ определения связывания между двумя молекулами, например, аффинный анализ, который включает в себя обеспечение контакта TGF-β1 с тестируемым пептидом в условиях, позволяющих связывание пептида с TGF-β1; и оценку связывания пептида и TGF-β1, как указано выше. Аналогичным образом, способность усеченных пептидов ингибировать биологическую активность TGF-β1 in vitro и/или in vivo может быть проанализирована любым из способов, приведенных в настоящем описании.
Благодаря роли TGF-β1 во многих биологических процессах, значение ингибирующей активности TGF-β1 пептидов настоящего изобретения имеет отношение к потенциальной разработке семейства лекарственных средств для лечения заболеваний и патологических нарушений, связанных с гиперэкспрессией или разрегулированной экспрессией TGF-β1, поскольку такие пептиды могут блокировать повреждение, индуцированное гиперэкспрессией или разрегулированной экспрессией этого цитокина.
В этой связи пептиды настоящего изобретения могут использоваться для лечения заболеваний и патологических нарушений, связанных с гиперэкспрессией или разрегулированной экспрессией TGF-β1, таких как: (1) фиброз, связанный с потерей функции органа или ткани, например легочный фиброз, фиброз печени (цирроз), почечный фиброз, фиброз роговицы и т.д.; и (2) хирургических и/или эстетических осложнений, например, фиброза, связанного с хирургическими вмешательствами на коже или в брюшной полости, фиброза, связанного с ожогами, костно-суставного фиброза, келоидов и т.д.
Таким образом, в другом аспекте настоящее изобретение относится к фармацевтической композиции, содержащей терапевтически эффективное количество пептида настоящего изобретения вместе с по меньшей мере одним фармацевтически приемлемым эксципиентом. Фармацевтическая композиция, обеспечиваемая настоящим изобретением, может содержать один или более пептидов настоящего изобретения, необязательно в комбинации с одним или более альтернативными соединениями, ингибирующими TGF-β1. Данная фармацевтическая композиция является полезной для применения и/или введения в организм человека или животного (предпочтительно человека).
Имеется много преимуществ в использовании пептидов, таких как пептиды настоящего изобретения, вместо антител или антисмысловых олигонуклеотидных последовательностей, так как они являются малыми молекулами с более высоким диффузионным потенциалом и более коротким периодом полувыведения. Пептиды могут проявлять высокую аффинность к TGF-β1, хотя распадаются они быстрее, чем антитела, при этом побочные эффекты можно регулировать дозировкой. Направленный транспорт пептидов к органам и тканям-мишеням также является более легким по сравнению с другими типами соединений.
Пептиды настоящего изобретения для лечения заболеваний и патологических нарушений, связанных с гиперэкспрессией или разрегулированной экспрессией TGF-β1, можно вводить любыми способами, которые обеспечивают контакт пептида настоящего изобретения с участком его воздействия или мишенью в организме человека или животного. Количество пептида, его производного или фармацевтически приемлемой соли, которое может присутствовать в фармацевтической композиции, обеспечиваемой настоящим изобретением, может значительно варьировать.
Дозировка, определенная для лечения заболевания или патологического нарушения, связанного с гиперэкспрессией или разрегулированной экспрессией TGF-β1, при использовании пептидов и/или фармацевтических композиций настоящего изобретения, будет зависеть от многочисленных факторов, включающих в себя возраст больного, состояние, тяжесть фонового заболевания или патологического нарушения, а также путь и частоту введения используемого пептида настоящего изобретения.
Фармацевтические композиции, содержащие пептиды настоящего изобретения, могут быть образованы в любой форме введения, например в твердой или жидкой форме, и могут вводиться любым подходящим путем, например перорально, парентерально, ректально или местно. С этой целью необходимо включение в них приемлемых фармацевтических эксципиентов, необходимых для образования желаемой формы введения, такой как, например, мази (жирные гели, гидрогели и т.д.), глазные капели, распыляемые аэрозоли, растворы для инъекций, осмотические насосные системы и т.д. Обзор различных необходимых форм лекарственных средств и эксципиентов можно найти, например, в публикации "Tratado de Farmacia Galenica", С. Fauli i Trillo, 1993, Luzan 5, S.А. Ediciones, Madrid.
Дополнительный аспект настоящего изобретения составляет использование пептидов настоящего изобретения для изготовления указанной фармацевтической композиции. Таким образом, в другом аспекте настоящее изобретение относится к применению пептида настоящего изобретения для изготовления фармацевтической композиции для лечения заболеваний или патологических нарушений, связанных с гиперэкспрессией или разрегулированной экспрессией TGF-β1, таких как фиброз, связанный с потерей функции органа или ткани, например легочный фиброз, фиброз печени (цирроз), почечный фиброз, фиброз роговицы и т.д.; и хирургических и/или эстетических осложнений, например, фиброза, связанного с хирургическими вмешательствами на коже или в брюшной полости, фиброза, связанного с ожогами, костно-суставного фиброза, келоидов и т.д.
Пептиды настоящего изобретения можно получать общепринятыми способами, такими как, например, твердофазный химический синтез, очищать высокоэффективной жидкостной хроматографией (ВЭЖХ) и, если это желательно, анализировать общепринятыми методами, такими как, например, секвенирование и масс-спектрометрия, аминокислотный анализ, методы ядерно-магнитного резонанса и т.д.
Альтернативно можно получить пептиды настоящего изобретения технологией рекомбинантной ДНК. Таким образом, в другом аспекте настоящее изобретение обеспечивает последовательность ДНК, кодирующую пептид настоящего изобретения. Указанную последовательность ДНК можно легко вывести из аминокислотной последовательности пептида.
Указанная последовательность ДНК может содержаться внутри конструкции ДНК. Таким образом, настоящее изобретение обеспечивает конструкцию ДНК, содержащую последовательность ДНК, которая кодирует пептид настоящего изобретения. Эта конструкция ДНК может функционально включать в себя регуляторную последовательность для экспрессии последовательности ДНК, кодирующей пептид настоящего изобретения. Контрольными последовательностями являются последовательности, которые контролируют и регулируют транскрипцию и, где это применимо, трансляцию пептида настоящего изобретения; они включают в себя промоторные и концевые последовательности и т.д., являющиеся в трансформированных клетках-хозяевах функциональными, содержащими указанную последовательность ДНК или конструкцию ДНК. В частном варианте осуществления указанная контрольная экспрессируемая последовательность является функциональной у бактерий. Такая конструкция ДНК предпочтительно также содержит маркер или ген, кодирующий фрагмент или фенотип, который позволяет осуществить отбор трансформированной клетки-хозяина по конструкции ДНК. Конструкцию ДНК, обеспечиваемую настоящим изобретением, можно получить способами, известными в данной области [Sambrook et al., Molecular cloning, а Laboratory Manual, 2nd ed., Cold Spring Harbor Laboratory Press, N.Y., 1989 Vol. 1-3].
Последовательность ДНК или конструкцию ДНК, обеспечиваемую настоящим изобретением, можно внедрить в подходящий вектор. Таким образом, в другом аспекте настоящее изобретение относится к вектору, такому как вектор экспрессии, который содержит указанную последовательность ДНК или конструкцию ДНК. Выбор вектора будет зависеть от клетки-хозяина, в которую впоследствии он должен быть внедрен. В качестве примера вектор, в который внедряют последовательность ДНК, может быть плазмидой или вектором, которые после внедрения в клетку могут интегрировать или не интегрировать в геном клетки. Вектор можно получить общепринятыми способами, известными специалистам в данной области [Sambrok et al., 1989, цитируемый выше].
В другом аспекте настоящее изобретение относится к клетке-хозяину, такой как трансформированная клетка-хозяин, которая содержит последовательность ДНК или конструкцию ДНК, обеспечиваемую настоящим изобретением.
В другом аспекте настоящее изобретение относится к способу получения пептида настоящего изобретения, который предусматривает выращивание клетки-хозяина с последовательностью ДНК или конструкцией ДНК, обеспечиваемой настоящим изобретением, в условиях, которые позволяют продукцию указанного пептида настоящего изобретения, и, если это желательно, выделение пептида настоящего изобретения. Условия для оптимизации культуры клетки-хозяина будут зависеть от используемого типа клетки-хозяина. Если это желательно, способ получения пептида настоящего изобретения включает в себя выделение и очистку пептида.
В другом аспекте настоящее изобретение относится к применению данных последовательностей ДНК и конструкций ДНК для получения векторов и клеток для лечении генной терапией заболеваний или патологических нарушений, связанных с гиперэкспрессией или разрегулированной экспрессией TGF-β1. В соответствии с этим аспектом настоящего изобретения указанные последовательности ДНК или конструкции ДНК приводят в контакт с генетическим вектором переноса (например, с вирусным или невирусным вектором). Подходящие вирусные векторы для осуществления данного аспекта настоящего изобретения включают в себя следующие векторы: аденовирусные, аденоассоциированные, ретровирусные, лентивирусные, альфавирусные, герпетические, короновирусные производные векторов и т.д., но не ограничены вышеперечисленным. Подходящие невирусные векторы для осуществления данного аспекта настоящего изобретения включают в себя депротеинизированную ДНК, липосомы, полиамины, дендримеры, катионные гликополимеры, липосомно-поликатионные комплексы, белки, опосредованные рецептором генетические системы переноса и т.д., но не ограничены вышеперечисленным.
Следующие примеры иллюстрируют настоящее изобретение и не должны считаться отображением ограничений настоящего изобретения.
ПРИМЕР 1
Отбор пептидов, связывающихся с TGF-β1, с использованием библиотеки пептидных фаговых дисплеев
Для получения последовательностей из 15 аминокислот, способных к высокоаффинному связыванию с TGF-β1, а также имеющих потенциальную ингибирующую активность в отношении биологической активности указанного цитокина, было полезным использование in vitrо технологии отбора, разработанной на основе технологии библиотек пептидных фаговых дисплеев. Эти библиотеки содержат множество нитевидных бактериофагов (М13), каждый из которых содержит пептид, генетически слитый с оболочечным белком фага, применительно к этому случаю, связанный на N-конце оболочечного белка рIII (фиг.1). Таким образом, фаг представляет собой 15-ак пептид на поверхности каждой из 5 копий поверхностного белка рIII, при этом последовательность ДНК, кодирующая этот пептид, заключена внутри фага. В библиотеках фагов последовательность, кодирующая пептид, получена из вырожденной последовательности с 20 природными аминокислотами в каждом из 15 положений, поэтому возможно представление 1,1×1012 возможных последовательностей из 15 аминокислот в различных фагах. Физическое соотношение 1:1 между пептидной последовательностью и ДНК, кодирующей ее внутри бактериофага, позволяет отобрать (из широкого диапазона вариантов) те последовательности, которые специфически связываются с TGF-β1. Этот процесс, известный как "биопэннинг", осуществляют in vitrо протоколом отбора.
Библиотека фаговых дисплеев, используемая в данном примере, получена из второй амплификации первичной библиотеки, описанной у Т. Nishi, Н. Tsuri и Н. Saya [Exp. 5 Med. (Japan) 11, 1759 (1993)] и предоставленной лабораторией George Р. Smith. Дополнительную информацию по этой технологии можно найти на следующем вебсайте:
http://www.biosci.missouri.edu/smithgp/PhageDisplayWebsite/PhageDisplayWebsiteIndex.html
Технология отбора ("биопэннинг")
Данная технология предусматривает инкубирование набора фагов, представляющих (по практическому эффекту) все варианты 15-ак пептидов, в чашке Петри, блокированной стрептавидином (10 мкг/мл в 0,1 моль NaНСО3, в течение 2 часов при комнатной температуре), в которую добавляли биотинилированный TGF-β1. Биотинилированный TGF-β1 фиксировали на чашке Петри взаимодействием биотин-стрептавидина, поэтому взаимодействие TGF-β1 с пептидами, переносимыми фагами, отображалось корректно. TGF-β1 контактировал с пептидами, переносимыми фагами, в концентрации 3×104 вирус/мл. После примерно 12 часов инкубации несвязанные фаги удаляли 5-кратным промыванием с PBS/Твин (забуференный фосфатом солевой раствор/сложные эфиры полиоксиалкиленовых производных сорбита и жирной кислоты). Затем связанные фаги элюировали понижением уровня рН (элюирующий буфер), что нарушает связи между TGF-β1 и пептидами фаговых дисплеев. Затем элюированные фаги амплифицировали инфицированием в бактериальном штамме (Е. coli). Процесс повторяли трижды (3 цикла) для достижения повышенного содержания специфически связывающихся с высокой аффинностью к TGF-β1 фагов (фиг.3). Постепенно в каждом цикле снижали концентрацию используемого для блокирования чашек Петри биотинилированного TGF-β1, например, от 2,5 до 0,01 и, наконец, до 0,001 мкг/мл. Таким образом, фаги, отобранные в каждом цикле, показывают возрастающую аффинность к TGF-β1. В конце процесса фаги, отобранные по их аффинности к TGF-β1, секвенировали с использованием праймеров после выделения устойчивых к тетрациклину генетически модифицированных фагов после инфицирования клеток Е.coli. Это позволяет получить последовательности пептидов в фаговых дисплеях ряда клонов, полученных из изолированных колоний. Количество повторений последовательности, соответствующей 15-аминокислотным пептидам, переносимых каждым клоном, от общего количества секвенированных колоний, является показателем степени относительной аффинности к TGF-β1 указанной 15-аминокислотной последовательности.
Последовательность пептидов
Отбор клонов, полученных "биопэннингом", проводили путем отбора бактериальных колоний, инфицированных фагами, в присутствии бактериального антибиотика; бактериальная устойчивость была приобретенной с помощью гена устойчивости к тетрациклину, кодируемого геномом фага. Таким образом, способными к росту оказались только инфицированные бактериофагами колонии. Это означает, что каждая колония содержит геном только одного бактериофага, кодирующего только один пептид, находящийся на его поверхности.
Общее количество полученных в последнем селективном цикле "биопэннинга" бактериальных колоний, инфицированных фагом, составило 108 колоний. Последовательность областей, кодирующих пептиды, которые присутствуют в белке рIII, переносили, используя праймеры, идентифицированные с SEQ ID NO:23. Это дало различные пептидные последовательности, показанные в таблице 1. В данной таблице также отражено количество колоний (клонов), переносящих указанные последовательности.
Аминокислотные последовательности фагов, связывающихся с TGF-β1
Количество клонов (колонии) каждой последовательности дает приблизительное определение степени аффинности пептида к TGF-β1, то есть чем больше колоний, тем выше аффинность связывания. Однако отсутствует корреляция между степенью аффинности и способностью пептида блокировать биологическую активность TGF-β1. Более того, наиболее активный пептид, идентифицированный как SEQ ID NO:17 (см. таблицы 2 и 3), представлен 3 клонами, в то время как пептид, идентифицированный как SEQ ID NO:3, представленный 41 клоном, является гораздо менее активным в острой пробе повреждения печени (таблица 3). В то же время, не придерживаясь твердо какой-либо конкретной теории, это наблюдение можно объяснить утверждением, что наиболее активный пептид, вероятно, блокирует связывание TGF-β1 с его рецептором.
Сравнение пептидных последовательностей
Полученные последовательности анализировали, используя программу CLUSTAL W (программа 1.81). Эта программа генерирует множественные последовательности, группируемые на основе аналогов аминокислотных последовательностей. Следовательно, пептиды группируют по различным структурным семействам на основе аналогов пептидных последовательностей (фиг.4). На основе этих аналогов можно предложить меньшие связывающиеся с TGF-β1 фрагменты или группы пептидов, которые связываются с различными областями TGF-β1.
ПРИМЕР 2
Ингибирование in vitro биологической активности TGF-β1 с использованием пептидов в анализах пролиферации клеточной линии Мv-1-Lu
Клеточную линию Мv-1-Lu (ССL-64, American Type Cell Culture, Virginia, USA) получали из легочного эпителия норки, выращивали в виде монослоя, и на присутствие TGF-β1 клетки отвечали уменьшением пролиферации (фиг.5). Таким образом, опосредованное пептидом ингибирование этого цитокина способно восстанавливать рост клеток и отражает способность различных пептидов ингибировать биологическую активность TGF-β1 in vitro. Исследуемые пептиды получали синтезом пептида, в соответствии с общепринятыми методиками Merrifield RB. J Am Chem Soc 1963; 85:2149-2154; Atherton Е et al. J Chem Soc Perkin Trans 1981; 1:538-546).
Клетки Мv-1-Lu культивировали до конфлюэнтности в полной среде [RPMI-1640 с добавлением L-глутамина, пирувата натрия, антибиотиков и 10% фетальной телячьей сыворотки (FBS)] при 37°С и в 5% СО2 в бутылях 162 см2 (Costar Corporation, СА, USA). После трипсинизации клетки выращивали в 200 мкл полной среды в 96-луночных планшетах при исходной плотности 5000 клеток/лунка при 37°С и в 5% СО2 в течение 6 часов для обеспечения адгезии. Затем добавляли тестируемые пептиды в различных концентрациях, начиная с 200 мкг/мл, и затем добавляли 200 пг/мл TGF-β1 (Roche). После 12 часов инкубации добавляли 1 мкКи метил-3Н-тимидин (Amersham Life Science, Buckinghamshire, United Kingdom) на лунку в 25 мкл чистой среды (RPMI-1640). Планшеты инкубировали в течение более 12 часов в тех же самых условиях. Наконец, клетки собирали (Filtermate 196 Harvester, Packard) в планшеты (UniFilter-96 GfiC Perkin Elmer) переносом тритиированного тимидина, включенного в цикл синтеза ДНК. Затем добавляли сцинтилляционную жидкость и количественно измеряли радиоактивность, используя сцинтилляционный счетчик (Тор Count, Microplate Scintillation Counter, Packard). В качестве положительного и отрицательного контроля полезно использовать включение тритиированного тимидина в отсутствии и в присутствии TGF-β1, соответственно. Ингибирование активности TGF-β1 в этом исследовании рассчитывали по следующей формуле:
% Ингибирования=100×[(имп/мин с пептидом-имп/мин отрицательного контроля):(имп/мин положительного контроля-имп/мин отрицательного контроля)].
Отрицательный контроль представляет включение тритиированного тимидина в присутствующий TGF-β1, но в отсутствии пептида, при этом положительный контроль относится к включению тритиированного тимидина в отсутствии TGF-β1 и пептида. Таким образом, согласно способности пептидов обращать цитокиновый репрессорный эффект на пролиферацию клеточной линии Мv-1-Lu, можно вычислить процент ингибирования пептидами биологической активности TGF-β1 (Таблица 2).
Влияние пептидов, полученных селекцией "биопэннингом" на ингибирование in vitro биологической активности TGF-β1, рассчитанное по анализу восстановления роста клеточной линии Мv-1-Lu
Пептиды, идентифицированные как SEQ ID NO:3, 11, 17 и 18, имеют процент ингибирования биологической активности TGF-β1 in vitrо выше 20%.
Дополнительно, чтобы оценить способность пептидов обращать супрессорный эффект TGF-β1 на пролиферацию клеточной линии Мv-1-Lu, как описано выше, сравнивали активность пептида, идентифицированного в испанской патентной заявке ES 2146552 А1, как Р144, с активностью пептида, идентифицированного как SEQ ID NO:17. Пептид, идентифицированный как SEQ ID NO:17, показал более высокую способность к ингибированию.
ПРИМЕР 3
Ингибирование биологической активности TGF-β1 in vivo пептидами c использованием модели острого индуцированного CCl 4 повреждения печени
Острое повреждение печени вызывает каскад эффектов и физиологических реакций, включающих в себя повышение концентрации TGF-β1. Такое повышение отвечает, среди прочего, за экспрессию гена коллагена 1 типа. На этой модели острого повреждения печени самкам мышей Balb/С массой от 25 до 30 г перорально вводили CCl4 в дозе 2 мкл CCl4 (на грамм массы тела), растворенного в эквивалентном объеме кукурузного масла (объемное соотношение 1:1). Контрольная группа получала эквивалентный объем единственного кукурузного масла, и исследуемые группы получали каждые 24 часа (после однократного перорального введения CCl4 в кукурузном масле) 50 мкг пептида в 500 мкл раствора 1% физиологического раствора в ДМСО (диметилсульфоксид). Спустя 72 часа всех животных умерщвляли и обрабатывали образцы печени. Для оценки экспрессии мРНК ткань печени замораживали в жидком азоте и сохраняли при -80°С до дальнейшего использования. Другие образцы печеночной ткани сохраняли в ОСТ® или Tissue-Теk® (Sakura Finetek ВХ.) и обрабатывали таким же образом, как и образцы, используемые для исследования мРНК. Другие образцы печени фиксировали в 10% растворе буферного формалина, погруженного в парафин, и обрабатывали для их гистологического исследования. У всех групп подсчитывали количество мРНК, кодирующей коллаген 1 типа, используя технологию количественной полимеразной цепной реакции (ПЦР). Фиг.6 показывает функциональную схему индукции, получения образцов и подсчет результатов в острой пробе повреждения печени. Способность тестируемых пептидов блокировать острое повреждение, оцениваемое измерением уровней индукции мРНК коллагена 1 типа, количественно определяли ПЦР в режиме реального времени. В таблице 3 показана степень ингибирования пептидами, производными фагов экспрессии 1 типа коллагена мРНК. Тестируемые пептиды получали в соответствии с общепринятыми методами твердофазного синтеза пептидов (Merrifield RB. J Am Chem Soc 1963; 85:2149-2154; Atherton Е et al. J Chem Soc Perkin Trans 1981; 1:538-546).
Влияние пептидов, полученных селекцией "биопэннингом" на ингибирование in vivo биологической активности TGF-β1, рассчитанное на основе ингибирования индукции мРНК коллагена 1 типа на модели острого повреждения печени
Пептиды, идентифицированные как SEQ ID NO:2, 4, 6, 11, 14 и 17, имеют процент ингибирования биологической активности TGF-β1 in vivo выше 35%.
Дополнительно, чтобы оценить способность пептидов ингибировать индукцию мРНК коллагена 1 типа на модели острого повреждения печени у мышей, как описано выше, сравнивали активность пептида, идентифицированного в испанской патентной заявке ES 2146552 А1, как Р144, с активностью пептида, идентифицированного как SEQ ID NO:17. В этом сравнительном анализе было зафиксировано, что пептид, идентифицированный как SEQ ID NO:17, показал намного более высокую способность ингибировать экспрессию мРНК коллагена 1 типа по сравнению с пептидом, идентифицированным в испанской патентной заявке ES 2146552 А1 как Р144, который в этом анализе не проявлял какой-либо активности. Результаты сравнительных тестов (примеры 2 и 3) показали, что пептид, представляющий пептиды настоящего изобретения (пептид, идентифицированный как SEQ ID NO:17), является более активным, чем пептид, представленный в испанской патентной заявке ES 2146552 А1 (пептид, идентифицированный как Р144) в тестах пролиферации клеток Мv-1-Lu и на модели острого повреждения печени.
ПРИМЕР 4
Ингибирование in vitro биологической активности TGF-β1 пептидами, усеченными от пептида SEQ ID NO:17 в анализе пролиферации клеток Мv-1-Lu.
Этот пример показывает ингибирующую активность некоторых пептидов, аминокислотные последовательности которых содержат от 3 и 15 последовательных аминокислотных остатков одной из аминокислотных последовательностей настоящего изобретения.
Сравнивали активность усеченных пептидов (полученных из пептидных последовательностей SEQ ID NO:17) с полной последовательностью, в плане способности обращать супрессорный эффект TGF-β1 на пролиферацию клеточных линий Мv-1-Lu. С этой целью и для определения минимальной последовательности пептида SEQ ID NO:17, способной ингибировать биологическую активность TGF-β1 in vitro, синтезировали усеченные версии этого пептида с усечением на N-конце, на С-конце или на обоих концах молекулы. В результате общепринятых методов синтеза получали тестируемые пептиды (Merrifield RB. J Am Chem Soc 20 1963; 85:2149-2154; Atherton Е et al. J Chem Soc Perkin Trans 1981; 1:538-546). Количественно определяли активность усеченных пептидов по сравнению с полной последовательностью пептида SEQ ID NO:17, в плане анализа пролиферации клеточной линии Мv-1-Lu, согласно методам исследования, описанным в примере 2.
Влияние усеченных пептидов, полученных из пептида SEQ ID NO:17, на ингибирование биологической активности TGF-β1
in vitro, рассчитанное по анализу восстановления роста клеточной линии Мv-1-Lu
В этом сравнительном анализе, как показано в таблице 4, удаление лизина (К) из N-конца влечет за собой потерю от 28,5% до 9,4% активности пептида SEQ ID NO:17. Напротив, удаление до трех аминокислот из С-конца не влияет на активность пептида. Также, удаление ароматических аминокислот тирозина (Y) и триптофана (W) сводит к нулю активность пептида. Это позволяет уменьшить исходный пептид SEQ ID NO:17 до 12 аминокислотных последовательностей (KRIWFIPRSSWY) [SEQ ID NO:34], не влияющих на ингибирующую активность TGF-β1 in vitro.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПЕПТИД, СПОСОБНЫЙ СВЯЗЫВАТЬСЯ С TGF-β 1 И ИНГИБИРОВАТЬ БИОЛОГИЧЕСКУЮ АКТИВНОСТЬ TGF-β 1 IN VITRO И/ИЛИ IN VIVO, ПРИМЕНЕНИЕ ПЕПТИДА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПОСЛЕДОВАТЕЛЬНОСТЬ ДНК, КОНСТРУКЦИЯ ДНК, ВЕКТОР ЭКСПРЕССИИ, КЛЕТКА-ХОЗЯИН И СПОСОБ ПОЛУЧЕНИЯ ПЕПТИДА | 2004 |
|
RU2333917C2 |
| ПЕПТИДЫ СО СПОСОБНОСТЬЮ СВЯЗЫВАТЬСЯ СО СКУРФИНОМ И ИХ ПРИМЕНЕНИЕ | 2008 |
|
RU2502741C2 |
| АНТИ-GARP-TGF-β-АНТИТЕЛА | 2018 |
|
RU2767784C2 |
| АНТИТЕЛА, НЕЙТРАЛИЗУЮЩИЕ ИНТЕГРИН ανβ8 | 2011 |
|
RU2565539C2 |
| ПРИМЕНЕНИЕ ИНГИБИРУЮЩИХ TGF-бета1 ПЕПТИДОВ ДЛЯ ПРИГОТОВЛЕНИЯ МОДУЛИРУЮЩЕГО ИММУННЫЙ ОТВЕТ АГЕНТА | 2005 |
|
RU2420307C2 |
| АНТИТЕЛА, КОТОРЫЕ СВЯЗЫВАЮТ ИНТЕГРИН АЛЬФА-V БЕТА-8 | 2012 |
|
RU2614252C2 |
| ИНГИБИТОРЫ ПЕРЕДАЧИ СИГНАЛА ТРАНСФОРМИРУЮЩИХ ФАКТОРОВ РОСТА (TGF-R) ДЛЯ ЛЕЧЕНИЯ РАССТРОЙСТВ ЦНС | 2005 |
|
RU2385933C2 |
| АНТИТЕЛО ИЛИ ЕГО ФРАГМЕНТ, ИМЕЮЩИЕ НЕЙТРАЛИЗУЮЩУЮ АКТИВНОСТЬ В ОТНОШЕНИИ ВИЧ | 2005 |
|
RU2380378C2 |
| КОНЪЮГАТЫ ДЛЯ ВВЕДЕНИЯ БИОЛОГИЧЕСКИ АКТИВНЫХ СОЕДИНЕНИЙ | 2009 |
|
RU2567667C2 |
| АНТИТЕЛА, СПЕЦИФИЧНО СВЯЗЫВАЮЩИЕСЯ С РЕЦЕПТОРАМИ ЭПИДЕРМАЛЬНОГО ФАКТОРА РОСТА | 2009 |
|
RU2518239C2 |







Изобретение относится к генной инженерии, конкретно к получению ингибиторов TGF-β1 и может быть использовано в медицине. ДНК, кодирующую пептид, способный связываться с TGF-β1, и ингибировать его биологическую активность in vitro и in vivo, применяют в качестве средства, ингибирующего биологическую активность TGF-β1. Изобретение позволяет эффективно лечить заболевания или патологические нарушения, связанные с гиперэкспрессией или разрегулированной экспрессией TGF-β1, за счет ингибирования биологической активности TGF-β1. 2 н. и 2 з.п. ф-лы, 6 ил., 4 табл., 4 пр.
1. Применение последовательности ДНК, которая кодирует пептид, способный связываться с TGF-β1 и ингибировать биологическую активность TGF-β1 in vitro и/или in vivo, аминокислотная последовательность которого выбрана из любой из SEQ ID NO:1 - SEQ ID NO:6, SEQ ID NO:9, SEQ ID NO:11 - SEQ ID NO:22, SEQ ID NO:24 - SEQ ID NO:29 и SEQ ID NO:31 - SEQ ID NO:36, или фрагменты указанных пептидов, обладающие способностью связываться с TGF-β1 и ингибировать биологическую активность TGF-β1 in vitro и/или in vivo, содержащие от 9 до 14 последовательных аминокислот для ингибирования биологической активности TGF-β1.
2. Применение последовательности ДНК, которая кодирует пептид, способный связываться с TGF-β1 и ингибировать биологическую активность TGF-β1 in vitro и/или in vivo, аминокислотная последовательность которого выбрана из любой из SEQ ID NO:1 - SEQ ID NO:6, SEQ ID NO:9, SEQ ID NO:11 - SEQ ID NO:22, SEQ ID NO:24 - SEQ ID NO:29 и SEQ ID NO:31 - SEQ ID NO:36, или фрагменты указанных пептидов, обладающие способностью связываться с TGF-β1 и ингибировать биологическую активность TGF-β1 in vitro и/или in vivo, содержащие от 9 до 14 последовательных аминокислот, в получении экспрессирующих векторов и клеток для лечения заболеваний и патологических нарушений, связанных с гиперэкспрессией и разрегулированной экспрессией TGF-β1.
3. Применение по п.2, где указанные заболевания и патологические нарушения, связанные с гиперэкспрессией и разрегулированной экспрессией TGF-β1, включают фиброз, связанный с потерей функции в органе или ткани, и хирургические и/или эстетические осложнения.
4. Применение по любому из пп.2 или 3, где указанные заболевания и патологические нарушения, связанные с гиперэкспрессией и разрегулированной экспрессией TGF-β1, выбраны из легочного фиброза, фиброза печени (цирроза), почечного фиброза, фиброза роговицы, фиброза, связанного с хирургическим вмешательством на коже или в брюшной полости, фиброза, связанного с ожогами, костно-суставного фиброза или келоидов.
| Шпарутка | 1930 |
|
SU24782A1 |
| ISHIKAWA D | |||
| et al | |||
| GDI alpha-replica peptides functionally mimic GDI alpha, an adhesion molecule of metastatic tumor cells, and suppress the tumor metastasis | |||
| FEBS Lett., 1998, v.441, n.1, p.20-24 | |||
| Способ преобразования давления в электрический сигнал | 1985 |
|
SU1320541A1 |
| RU 2001117230 A, 27.05.2003. | |||
Авторы
Даты
2012-07-10—Публикация
2008-04-21—Подача