ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка испрашивает приоритет на основании предварительных заявок на патент США №USSN 60/976,919 от 2 октября 2007 года, и USSN 61/026,460 от 5 февраля 2008 года. Содержание этих заявок включено в настоящую заявку посредством ссылки.
ПРЕДПОСЫЛКИ К СОЗДАНИЮ ИЗОБРЕТЕНИЯ
[0002] Система комплемента включает более 30 сывороточных и клеточных белков, вовлеченных в три больших сигнальных пути, известных как классический, альтернативный и пектиновый путь. Классический путь, как правило, запускается при связывании комплекса антигена и антитела IgM или IgG с С1 (хотя и другие определенные активаторы могут инициировать этот каскад). Активированный С1 расщепляет С4 и С2 с образованием С4а и C4b, а также С2а и C2b. C4b и С2а объединяются с образованием С3-конвертазы, которая расщепляет С3 с образованием С3а и C3b. Связывание С3b с С3-конвертазой приводит к образованию С5-конвертазы, которая расщепляет С5 на С5а и C5b. С3а, С4а и С5а являются анафилатоксинами и опосредуют различные реакции при остром воспалительном ответе. С3а и С5а также являются хемотаксическими факторами, которые привлекают клетки иммунной системы, такие как нейтрофилы.
[0003] Активацию альтернативного пути инициируют поверхности бактериальных клеток и различные сложные полисахариды. В этом каскаде C3b, образующийся при расщеплении С3, которое происходит самопроизвольно на низком уровне, связывается с мишенями, например, с поверхностями клеток, и формирует комплекс с фактором В, который позднее расщепляется фактором D, образуя С3-конвертазу. Расщепление С3 и связывание другой молекулы C3b с С3-конвертазой приводит к образованию С5-конвертазы. Активность С3- и С5-конвертаз этого пути регулируется белками CR1, DAF, МСР и fH. Действие этих белков связано либо с их способностью усиливать активность распада (т.е., способностью расщеплять конвертазы), либо со способностью служить кофакторами фактора I при расщеплении C3b или C4b, либо и с тем, и с другим.
[0004] С5-конвертазы, которые образуются в ходе обоих путей, расщепляют С5 с образованием С5а и C5b. C5b затем связывается с С6, С7 и С8 с образованием C5b-8, который является катализатором полимеризации С9, ведущей к образованию C5b-9 мембран-атакующего комплекса (MAC). MAC сам встраивается в мембраны клеток-мишеней и провоцирует лизис клетки. Присутствие малых количеств MAC на клеточной мембране может повлечь за собой ряд событий, отличных от гибели клетки.
[0005] Лектиновый путь комплемента инициируется связыванием манноза-связывающего лектина (MBL) и MBL-ассоциированной сериновой протеазы (MASP) с углеводами. Ген MBL-1 (у человека известный как LMAN-1) кодирует интегральный мембранный белок I типа, локализованный в промежуточной области между эндоплазматическим ретикулумом и аппаратом Гольджи. Ген MBL-2 кодирует растворимый манноза-связывающий белок, обнаруженный в сыворотке. У человека в пектиновом каскаде MASP-1 и MASP-2 вовлечены в протеолиз С4 и С2, ведущий к образованию С3-конвертазы, описанной выше.
[0006] Активность системы комплемента у млекопитающих регулируется различными белками, которые относятся к белкам контроля комплемента (ССР) или белкам-регуляторам активации комплемента (RCA) (Патент США №6,897,290). Эти белки различаются по своей специфичности к лиганду и механизмам подавления комплемента. Они могут ускорять нормальный распад конвертаз и/или действовать как кофакторы для фактора I при ферментативном расщеплении C3b и/или C4b на более мелкие фрагменты. ССР характеризуются наличием нескольких (обычно 4-56) гомологичных мотивов, которые называются короткими консенсусными повторами (SCR), модулями белка контроля комплемента (ССР) или SUSHI доменами. Для этих доменов, состоящих приблизительно из 50-70 аминокислот, как правило, приблизительно из 60 аминокислот, характерно наличие консервативного мотива, который включает четыре цистеина, связанных дисульфидными связями (две дисульфидные связи), пролин, триптофан и много гидрофобных остатков. Семейство белков ССР включает рецептор комплемента 1 типа (CR1; C3b:C4b рецептор), рецептор комплемента 2 типа (CR2), мембранный кофакторный белок (МСР; CD46), фактор, ускоряющий распад (DAF-фактор), фактор комплемента Н (fH) и C4b-связывающий белок (C4bp). CD59 - это связанный с мембраной регулятор комплемента, структурно не относящийся к ССР.
[0007] Более полную информацию относительно системы комплемента и путей ее активации можно найти в следующих ссылках: Makrides, SC, Pharm Rev., 50(1): 59-87, 1998;
Lisczewski, MK and Atkinson, JP, The Human Complement System in Health and Disease, Volanakis, JE and Frank, MM, eds., Dekker, New York, pp.149-66, 1998; Kuby Immunology, 2000; Paul, W.E., Fundamental Immunology, Lippincott Williams & Wilkins; 5th ed., 2003; and Walport MJ., Complement. First of two parts. N Engi J Med., 344(14): 1058-66, 2001.
[0008] Наряду с тем, что активация системы комплемента играет важную роль в реакциях врожденного и приобретенного иммунитета, все больше данных указывает на то, что система комплемента вовлечена в процессы повреждения тканей при различных ишемических, воспалительных и аутоиммунных заболеваниях (Makrides, SC, Pharm Rev., 50(1): 59-87, 1998; Lisczewski, MK and Atkinson, JP, in The Human Complement System in Health and Disease, Volanakis, JE and Frank, MM, eds., Dekker, New York, pp.149-66, 1998). Подавление системы комплемента было предложено в качестве терапевтической стратегии при многих подобных заболеваниях. Компстатин и его аналоги являются циклическими пептидами, которые связываются с СЗ и ингибируют его активацию. В данной области существует необходимость в создании новых составов и способов введения аналогов компстатина. Также существует необходимость в создании усовершенствованной системы доставки лекарств.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0009] Настоящее изобретение предлагает новые составы и способы введения аналогов компстатина с пролонгированным высвобождением в организм млекопитающих. В одном из аспектов изобретения предлагается жидкий состав, содержащий аналог компстатина в количестве, достаточном для формирования макроскопической гелеподобной структуры при введении его во внесосудистое пространство в теле млекопитающего. В некоторых вариантах реализации изобретения внесосудистое пространство представляет собой стекловидную камеру глазного яблока. В других вариантах реализации внесосудистое пространство представляет собой субконъюнктивальное пространство. В некоторых вариантах реализации внесосудистое пространство представляет собой ретробульбарное, субконъюнктивальное, субтеноново или субретинальное пространство. В некоторых вариантах реализации изобретения аналог компстатина имеет активность по меньшей мере в 100 раз большую активности компстатина. В некоторых вариантах осуществления изобретения аналог компстатина имеет активность по меньшей мере в 150 раз большую активности компстатина. В некоторых вариантах реализации изобретения аналог компстатина имеет активность по меньшей мере в 200 раз большую активности компстатина. В некоторых вариантах реализации изобретения аналог компстатина имеет активность по меньшей мере в 250 раз большую активности компстатина. В некоторых вариантах реализации любого способа согласно изобретению, включающего этап введения состава субъекту, субъектом является обезьяна. В некоторых вариантах реализации любого способа согласно изобретению, включающего этап введения состава субъекту, субъектом является человек.
[0010] В некоторых вариантах реализации изобретения жидкий состав включает аналог компстатина и второй активный агент в дополнение к аналогу компстатина. Второй активный агент может представялть собой полипептид, пептид, непептидное низкомолекулярное вещество, нуклеиновую кислоту и т.д. В некоторых вариантах реализации второй активный агент представляет собой ингибитор комплемента. В некоторых вариантах реализации второй активный агент представляет собой ингибитор ангиогенеза.
[0011] Изобретение дополнительно предлагает способ лечения комплемент-опосредованных заболеваний у млекопитающих, включающий введение субъекту какого-либо из вышеперечисленных жидких составов. В одном аспекте изобретения предлагается способ лечения комплемент-опосредованных заболеваний, включающий этап введения жидкого состава, который содержит эффективное количество аналога компстатина, во внесосудистое пространство в теле субъекта, где указанное эффективное количество является достаточным для формирования макроскопической гелеподобной структуры, содержащей аналог компстатина, в указанном внесосудистом пространстве. В некоторых вариантах реализации изобретения указанное эффективное количество является достаточным для формирования макроскопической гелеподобной структуры, которая со временем уменьшается в размере и становится фактически не обнаруживаемой по меньшей мере в течение 2 недель. В некоторых вариантах реализации макроскопическая гелеподобная структура со временем уменьшается в размере и высвобождает аналог компстатина в активной форме с достижением терапевтической концентрации во внесосудистом пространстве по меньшей мере в течение 2 недель, по меньшей мере в течение 4 недель, по меньшей мере в течение 2 месяцев, по меньшей мере в течение 3 месяцев, по меньшей мере в течение 6 месяцев, 9 месяцев или 12 месяцев. В некоторых вариантах макроскопические гелеподобные структуры остаются легко обнаруживаемыми, например, по меньшей мере в течение 2 недель, по меньшей мере в течение 4 недель, по меньшей мере в течение 2 месяцев, по меньшей мере в течение 3 месяцев, по меньшей мере в течение 6 месяцев, 9 месяцев или 12 месяцев, вплоть до 18 или 24 месяцев. Аналог компстатина в «активной форме» сохраняет способность связываться с С3 и ингибировать его расщепление.
[0012] В некоторых вариантах реализации изобретения состав вводится в полость стекловидного камеру глазного яблока субъекта, находящегося в группе риска или страдающего возрастной дегенерацией желтого пятна (ВДЖП). В некоторых вариантах реализации субъект находится в группе риска или страдает атрофической ВДЖП. В некоторых вариантах реализации субъект находится в группе риска или страдает диабетической ретинопатией, увеитом, глаукомой или пигментной дегенерацией сетчатки.
[0013] В некоторых вариантах реализации изобретения состав вводится в интратекальную полость в теле субъекта. Субъект может страдать от повреждения спинного мозга или хронических болей.
[0014] В некоторых вариантах реализации состав вводится в полость черепа субъекта, например, в желудочек мозга. Субъект может страдать различными склерозами, болезнью Паркинсона, болезнью Альцгеймера, или от инсульта.
[0015] В некоторых вариантах реализации состав вводится в синовиальную полость или синовиальную сумку субъекта. Субъект может страдать артритом, например, ревматоидным артритом, псориазным артритом, синдромом Рейтера, ювенильным артритом или подагрой. [0016] В одном из аспектов изобретения также предлагаются способы получения составов согласно изобретению.
[0017] Некоторые из аспектов изобретения предлагают способ лечения комплемент-опосредованных заболеваний, включающий этап введения жидкого состава, содержащего эффективное количество аналога компстатина, во внесосудистое пространство субъекта, где эффективное количество является достаточным для формирования дискретной макроскопической гелеподобной структуры, содержащей аналог компстатина в указанном внесосудистом пространстве. В некоторых вариантах реализации изобретения эффективное количество является достаточным для формирования макроскопической гелеподобной структуры, которая со временем уменьшается в размере и остается легко обнаруживаемой по меньшей мере в течение 2 недель. В некоторых вариантах реализации изобретения эффективное количество является достаточным для формирования макроскопической гелеподобной структуры, которая со временем уменьшается в размере и высвобождает аналог компстатина в активной форме по меньшей мере в течение 2 недель. В некоторых вариантах реализации изобретения эффективное количество является достаточным для формирования макроскопической гелеподобной структуры, которая со временем уменьшается в размере и остается легко обнаруживаемой по меньшей мере в течение 3 месяцев. В некоторых вариантах реализации изобретения эффективное количество является достаточным для формирования макроскопической гелеподобной структуры, которая со временем уменьшается в размере и высвобождает аналог компстатина в активной форме по меньшей мере в течение 3 месяцев. В некоторых вариантах реализации изобретения эффективное количество является достаточным для формирования макроскопической гелеподобной структуры, которая со временем уменьшается в размере и высвобождает аналог компстатина в активной форме с достижением терапевтической концентрации указанного аналога компстатина во внесосудистом пространстве или прилежащей ткани по меньшей мере в течение 2 недель. В некоторых вариантах реализации изобретения эффективное количество является достаточным для формирования макроскопической гелеподобной структуры, которая со временем уменьшается в размере и высвобождает аналог компстатина в активной форме с достижением терапевтической концентрации указанного аналога компстатина во внесосудистом пространстве или прилежащей ткани по меньшей мере в течение 3 месяцев. В некоторых вариантах реализации аналог компстатина включает пептид, последовательность которого включает последовательность, выбранную из последовательностей SEQ ID NO: 3, 4, 5, 6 и 7. В некоторых вариантах реализации аналог компстатина имеет по меньшей мере в 100 раз большую активность, чем активность последовательности SEQ ID NO: 8. В некоторых вариантах реализации аналог компстатина имеет по меньшей мере в 200 раз большую активность, чем активность последовательности SEQ ID NO: 8. В некоторых вариантах реализации аналог компстатина имеет последовательность, выбранную из SEQ ID NO: 14, 21, 28, 29, 30, 31, 32, 33, 34 и 36. В некоторых вариантах реализации аналог компстатина имеет последовательность, выбранную из SEQ ID NO: 28, 32 и 34. В некоторых вариантах реализации аналог компстатина представляет собой пептид последовательности SEQ ID NO: 14. В некоторых вариантах реализации аналог компстатина представляет собой пептид последовательности SEQ ID NO: 28. В некоторых вариантах реализации аналог компстатина представляет собой пептид последовательности SEQ ID NO: 32. В некоторых вариантах реализации аналог компстатина представляет собой пептид поеследовательности SEQ ID NO: 33. В некоторых вариантах реализации аналог компстатина представляет собой пептид последовательности SEQ ID NO: 34. В некоторых вариантах реализации концентрация указанного аналога компстатина в жидком составе находится в пределах от 1 мг/мл до 50 мг/мл. В некоторых вариантах реализации концентрация указанного аналога компстатина в жидком составе находится в пределах от 2 мг/мл до 25 мг/мл. В некоторых вариантах реализации в стекловидную камеру глазног яблока вводят от 50 мкг до 5000 мкг аналога компстатина. В некоторых вариантах реализации в стекловидную камеру глазного яблока вводят от 400 мкг до 1500 мкг аналога компстатина. В некоторых вариантах реализации в стекловидную камеру глазного яблока вводят примерно 450 мкг аналога компстатина. В некоторых вариантах реализации в стекловидную камеру глазного яблока вводят примерно 1050 мкг аналога компстатина. В некоторых вариантах реализации в стекловидную камеру глазного яблока вводят аналог компстатина в объеме от 25 мкл до 125 мкл. В некоторых вариантах реализации аналог компстатина вводят в стекловидную камеру глазного яблока в объеме примерно 50 мкл. В некоторых вариантах реализации аналог компстатина вводят в стекловидную камеру глазного яблока в объеме примерно 75 мкл. В некоторых вариантах реализации субъект страдает возрастной дегенерацией желтого пятна, и жидкий состав вводится в стекловидную камеру глазного яблока. В некоторых вариантах реализации жидкий состав содержит эффективное количество второго терапевтического агента. В некоторых вариантах реализации второй терапевтический агент представляет собой ингибитор комплемента, ингибитор ангиогенеза, стероид, противовоспалительный агент, противоинфекционный агент или анальгетик. В некоторых вариантах реализации состав вводится путем инъекции в стекловидное тело. В некоторых вариантах реализации состав содержит множество микрочастиц и наночастиц. Микрочастицы и наночастицы могут содержать терапевтический агент, который может являться, но не обязательно, аналогом компстатина; и в случае, если терапевтический агент представляет собой аналог компстатина, он может представлять собой тот же, но не обязательно, аналог компстатина, который формирует гель. В некоторых вариантах реализации по меньшей мере некоторые из микрочастиц или наночастиц включаются в гель после введения состава.
[0018] Изобретение предлагает гелеподобную структуру, содержащую аналог компстатина и по меньшей мере один эндогенный полипептид, в норме присутствующий во внесосудистом пространстве субъекта. В некоторых вариантах реализации изобретения полипептид представляет собой полипептид, присутствующий во внесосудистом пространстве, выбранном из следующей группы: стекловидная камера глазного яблока, субконъюнктивальное пространство, теноново пространство, субретинальное пространство, синовиальная полость и цереброспинальная полость.
[0019] Изобретение предлагает жидкий состав, содержащий аналог компстатина, отличающийся тем, что указанный состав характеризуется способностью формировать макроскопическую гелеподобную структуру при введении его в стекловидную камеру глазного яблока субъекта-млекопитающего. В некоторых вариантах реализации аналог компстатина присутствует в количестве, достаточном для формирования дискретной макроскопической гелеподобной структуры при введении его в стекловидную камеру глазного яблока субъекта путем инъекции, например, в стекловидное тело, в объеме примерно от 50 мкл до 100 мкл. В некоторых вариантах реализации аналог компстатина присутствует в количестве, достаточном для формирования макроскопической гелеподобной структуры, которая со временем уменьшается в размере и остается легко обнаруживаемой по меньшей мере в течение 2 недель. В некоторых вариантах реализации аналог компстатина присутствует в количестве, достаточном для формирования макроскопической гелеподобной структуры, которая со временем уменьшается в размере и высвобождает аналог компстатина в активной форме по меньшей мере в течение 2 недель. В некоторых вариантах реализации аналог компстатина присутствует в количестве, достаточном для формирования макроскопической гелеподобной структуры, которая со временем уменьшается в размере и остается легко обнаруживаемой по меньшей мере в течение 3 месяцев. В некоторых вариантах реализации аналог компстатина присутствует в количестве, достаточном для формирования макроскопической гелеподобной структуры, которая со временем уменьшается в размере и высвобождает аналог компстатина в активной форме по меньшей мере в течение 3 месяцев. В некоторых вариантах реализации аналог компстатина присутствует в количестве, достаточном для формирования макроскопической гелеподобной структуры, которая со временем уменьшается в размере и остается легко обнаруживаемой по меньшей мере в течение 6 месяцев. В некоторых вариантах реализации аналог компстатина присутствует в количестве, достаточном для формирования макроскопической гелеподобной структуры, которая со временем уменьшается в размере и высвобождает аналог компстатина в активной форме по меньшей мере в течение 6 месяцев. В некоторых вариантах реализации аналог компстатина присутствует в количестве, достаточном для формирования макроскопической гелеподобной структуры, которая со временем уменьшается в размере и высвобождает аналог компстатина в активной форме с достижением терапевтической концентрации указанного аналога компстатина в стекловидной камере глазного яблока или прилежащей ткани по меньшей мере за 2 недели. В некоторых вариантах реализации аналог компстатина присутствует в количестве, достаточном для формирования макроскопической гелеподобной структуры, которая со временем уменьшается в размере и высвобождает аналог компстатина в активной форме с достижением терапевтической концентрации указанного аналога компстатина в стекловидной камере глазного яблока или прилежащей ткани по меньшей мере за 3 месяца. В некоторых вариантах реализации аналог компстатина содержит пептид, последовательность которого включает последовательность, выбранную из следующей группы последовательностей: SEQ ID NO: 3, 4, 5, 6 и 7. В некоторых вариантах реализации активность аналога компстатина превышает активность последовательности SEQ ID NO: 8 по меньшей мере в 100 раз. В некоторых вариантах реализации активность аналога компстатина превышает активность последовательности SEQ ID NO: 8 по меньшей мере в 200 раз. В некоторых вариантах реализации последовательность аналога компстатина включает последовательность, выбранную из SEQ ID NO: 14, 21, 28, 29, 30, 31, 32, 33, 34 и 36. В некоторых вариантах реализации последовательность аналога компстатина включает последовательность, выбранную из SEQ ID NO: 28, 32 и 34. В некоторых вариантах реализации последовательность аналога компстатина включает SEQ ID NO: 28. В некоторых вариантах реализации последовательность аналога компстатина включает SEQ ID NO: 32. В некоторых вариантах реализации последовательность аналога компстатина включает SEQ ID N0: 34. В некоторых вариантах реализации количество указанного аналога компстатина в жидком составе находится в пределах от 1 мг/мл до 50 мг/мл. В некоторых вариантах реализации количество указанного аналога компстатина в жидком составе находится в пределах от 3 мг/мл до 25 мг/мл. В некоторых вариантах реализации состав содержит от 150 мкг до 5000 мкг аналога компстатина. В некоторых вариантах реализации состав содержит от 250 мкг до 2000 мкг аналога компстатина. В некоторых вариантах реализации состав содержит от 400 мкг до 1500 мкг аналога компстатина. В некоторых вариантах реализации состав имеет объем от 25 мкл до 125 мкл. В некоторых вариантах реализации состав содержит от 150 мкг до 2000 мкг аналога компстатина в объеме от 50 мкл до 100 мкл. В некоторых вариантах реализации состав состоит по существу из аналога компстатина в воде. В некоторых вариантах реализации состав по существу не содержит вспомогательных веществ. В некоторых вариантах реализации состав включает компонент, выбранный из следующей группы: сахарные спирты и аминокислоты. В некоторых вариантах реализации присутствие указанного компонента модулирует скорость исчезновения включения в условиях in vivo. В некоторых вариантах реализации состав содержит гистидин. В некоторых вариантах реализации состав содержит буфер. В некоторых вариантах реализации состав содержит ацетат натрия. В некоторых вариантах реализации состав содержит маннит. В некоторых вариантах реализации жидкий состав дополнительно содержит эффективное количество второго терапевтического агента. В некоторых вариантах реализации второй терапевтический агент представляет собой ингибитор комплемента, ингибитор ангиогенеза, стероид, противовоспалительный агент, противоинфекцйонный агент или анальгетик.
[0020] Изобретение также предлагает способ получения состава для пролонгированной доставки терапевтического агента, включающий приготовление жидкого состава, содержащего терапевтический агент и аналог компстатина, где аналог компстатина присутствует в достаточном количестве для формирования макроскопической гелеподобной структуры при введении состава во внесосудистое пространство субъекта-млекопитающего. В некоторых вариантах реализации способ дополнительно включает введение жидкого состава во внесосудистое пространство в теле млекопитающего. В некоторых вариантах реализации внесосудистое пространство представляет собой стекловидную камеру. В некоторых вариантах реализации внесосудистое пространство представляет собой стекловидную камеру, при этом субъект страдает ВДЖП.
[0021] Некоторые аспекты изобретения предлагают способ лечения субъектов, находящихся в группе риска или страдающих ВДЖП, включающий введение жидкого состава, содержащего аналог компстатина, непосредственно в стекловидную камеру глазного яблока субъекта, где жидкий состав содержит достаточное количество аналога компстатина для формирования макроскопической гелеподобной структуры после введения. В некоторых вариантах реализации аналог компстатина содержит пептид, последовательность которого включает последовательность из следующей группы: SEQ ID NO: 3, 4, 5, 6 и 7. В некоторых вариантах реализации активность аналога компстатина превышает активность последовательности SEQ ID NO: 8 по меньшей мере в 100 раз. В некоторых вариантах реализации аналог компстатина имеет активность по меньшей мере в 200 раз превышающую активность SEQ ID NO: 8. В некоторых вариантах реализации последовательность аналога компстатина включает последовательность, выбранную из SEQ ID NO: 14, 21, 28, 29, 30, 31, 32, 33, 34 и 36. В некоторых вариантах реализации последовательность аналога компстатина включает последовательность, выбранную из SEQ ID NO: 28, 32 и 34. В некоторых вариантах реализации количество аналога компстатина находится в пределах от 2 мг/мл до 20 мг/мл. В некоторых вариантах реализации от 100 мкг до 2000 мкг аналога компстатина вводится в глаз. В некоторых вариантах реализации от 250 мкг до 1500 мкг аналога компстатина вводится в глаз. В некоторых вариантах реализации от 400 мкг до 1200 мкг аналога компстатина вводится в глаз. В некоторых вариантах реализации жидкий состав дополнительно содержит ингибитор ангиогенеза.
[0022] Изобретение предлагает жидкий состав, содержащий аналог компстатина и воду, где концентрация аналога компстатина находится в пределах от 3 до 50 мг/мл. В некоторых вариантах реализации концентрация аналога компстатина находится в пределах от 5 до 30 мг/мл. В некоторых вариантах реализации концентрация аналога компстатина находится в пределах от 8 до 25 мг/мл. В некоторых вариантах реализации любого из этих составов аналог компстатина содержит пептид, выбранный из группы, включающей последовательности: SEQ ID NO: 3, 4, 5, 6 и 7. В некоторых вариантах реализации любого из этих составов активность аналога компстатина превышает активность SEQ ID NO: 8 по меньшей мере в 100 раз. В некоторых вариантах реализации любого из этих составов активность аналога компстатина превышает активность SEQ ID NO: 8 по меньшей мере в 200 раз. В некоторых вариантах реализации любого из этих составов последовательность аналога компстатина включает последовательность, выбранную из последовательностей SEQ ID NO: 14, 21, 28, 29, 30, 31, 32, 33, 34 и 36. В некоторых вариантах реализации любого из этих составов последовательность аналога компстатина включает последовательность, выбранную из последовательностей SEQ ID NO: 28, 32 и 34. В некоторых вариантах реализации любого из этих составов состав по существу состоит из аналога компстатина и воды. В некоторых вариантах реализации любого из этих составе состав дополнительно содержит вспомогательное вещество, выбранное из аминокислот и сахарных спиртов. Изобретение предлагает жидкий состав, содержащий аналог компстатина и воду, где концентрация аналога компстатина находится в пределах от 100 до 2000 мг/мл, например, от 100 мг/мл до 1000 мг/мл или от 100 до 500 мг/мл, где состав содержит компонент, который меняет свойства состава таким образом, что гель, сформированный при введении состава во внесосудистое пространство (например, стекловидную камеру глазного яблока), разлагается или распадается быстрее, чем в случае отсутствия компонента. В некоторых вариантах реализации компонент представляет собой вспомогательное вещество, выбранное из сахарного спирта и аминокислоты. В некоторых вариантах реализации аминокислота представляет собой стандартную аминокислоту, например, гистидин. В некоторых вариантах реализации сахарный спирт представляет собой маннит. В некоторых вариантах реализации компонент представляет собой буфер, например, ацетат натрия.
[0023] Если иное не указано, в настоящем изобретении применяются стандартные способы молекулярной биологии, химии, культивирования клеток, содержания животных, проведения медицинских и ветеринарных анализов и т.д., и используются принятые в соответствующей области значения терминов. Эта заявка содержит ссылки на различные патенты и публикации. Список всех научных статей, книг, патентов, заявок на патенты и других публикаций, указанных в настоящей заявке, включены в данную заявку посредством ссылок: Current Protocols in Molecular Biology, Current Protocols in Immunology, Current Protocols in Protein Science, Current Protocols in Cell Biology, John Wiley & Sons, N.Y., edition as of July 2002; Sambrook, Russell, and Sambrook, Molecular Cloning: A Laboratory Manual, 3rd ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, 2001; Kuby Immunology, 4th ed., Goldsby, R.A., Kindt, T.J., and Osbome, B. (eds.), W.H. Freeman, 2000, Goodman and Oilman's The Pharmacological Basis of Therapeutics, 10th Ed., McGraw Hill, 2001, Katzung, B. (ed.) Basic and Clinical Pharmacology, McGraw-Hill/Appleton & Lange; 9th edition (December 2003); Goldman & Ausiello, Cecil Textbook of Medicine, 22nd ed., W.B. Saunders, 2003. В случае противоречия или несоответствия между любыми включенными ссылками и настоящим изобретением, описание настоящего изобретения (включая любые дополнения) имеет преимущественную силу. В настоящей заявке используются общепринятые аббревиатуры для аминокислот, если иное особо не указано.
КРАТКОЕ ОПИСАНИЕ ФИГУР
[0024] На Фигуре 1 показана макроскопическая гелеподобная структура, выделенная из стекловидного тела кролика, которому был введен активный аналог компстатина путем инъекции в стекловидное тело.
[0025] На Фигуре 2 показаны результаты ультразвукового сканирования животных через 12 дней (слева) и 8 недель (справа) после инъекции активного аналога компстатина. Через 12 дней после инъекции наблюдается крупное включение, и намного меньшее, но все еще обнаруживаемое включение наблюдается через 8 недель.
[0026] На Фигуре 3 показаны белки, входящие в состав включения наряду с активным аналогом компстатина, выявленные при окраске геля после SDS-электрофореза. Также показаны белки, обнаруженные в стекловидном теле после введения аналога компстатина, или же без его введения.
[0027] На Фигуре 4 представлен график, показывающий, что аналог компстатина, присутствующий во включении, остается стабильным и сохраняет ингибирующую комплемент активность с течением времени. Синие области - аналог компстатина (стандарт); зеленые области - аналог компстатина, полученный из геля, извлеченного из стекловидного тела кролика через 6 недель после инъекции; коричневые пятна - аналог компстатина, полученный из геля, извлеченного из стекловидного тела кролика через 8 месяцев после инъекции; красные овалы: неактивный контрольный пептид G8A.
[0028] На Фигуре 5 представлен график, показывающий результат измерений концентрации аналога компстатина в сыворотке и стекловидных телах яванских макак через 14 дней после введения в стекловидное тело 0, 450, 1050 или 2100 мкг состава. Все оценки представлены как среднее значение ± стандартная ошибка; n=4 для каждого стекловидного тела, и n=8 для сыворотки. Следует отметить, что реальные величины для концентрации в сыворотке в 100 раз ниже, чем показано на графике, т.е. каждое значение концентрации в сыворотке примерно в 100 раз ниже, чем соответствующая концентрация в стекловидном теле при той же дозе введения.
ОПРЕДЕЛЕНИЯ
[0029] Прежде чем перейти к подробному описанию изобретения, необходимо уточнить, что настоящее изобретение не ограничивается конкретными примерами систем или параметров, которые, безусловно, могут различаться. Также необходимо понимать, что использование в данной заявке терминологии предназначено только для описания особых вариантов реализации изобретения, и никоим образом не направлено на ограничение объема изобретения. Нижеследующие определения представлены для удобства читателя, и их использование не противоречит использованию таких терминов в соответствующей области, если только иное особо не указано.
[0030] Термины «ингибитор ангиогенеза» и «антиангиогенный агент» являются взаимозаменяемыми и используются в данной заявке для описания агентов, которые способны подавлять или замедлять один или более связанных с формированием, ростом и/или развитием новых кровеносных сосудов процессов, которые включают пролиферацию эндотелиальных клеток, миграцию эндотелиальных клеток, формирование капилляров, но не ограничиваются ими. Кроме того, такие агенты могут ингибировать экссудацию жидкости из кровеносных сосудов.
[0031] Термин «антагонист» относится к соединению, которое ингибирует (противодействует, ослабляет, понижает, блокирует или отменяет) эффект конкретной молекулы. Антагонист способен действовать некоторым образом на определенную активность молекулы так, что биологическая активность молекулы снижается или блокируется по принципу антагонизма (например, противодействия, конкурентного или обратного действия) по отношению к одному или более природным действиям молекулы. Неограничивающими примерами антагонистов являются антитела или их антиген-связывающие фрагменты, белки, пептиды, нуклеиновые кислоты (такие как посредники РНКи, рибозимы, антисмысловые последовательности), или малые молекулы.
[0032] Термин «антитело» подразумевает иммуноглобулин или его производное, содержащее иммуноглобулиновый домен, способный связываться с антигеном. Антитела могут быть любого происхождения, например, человеческие, мышиные, кроличьи, козлиные, куриные и т.д. Антитело может являться представителем какого-либо класса иммуноглобулинов, включая любой из классов человеческих иммуноглобулинов: IgG, IgM, IgA, IgD и IgE, или их подклассов, таких как IgGI, IgG2 и т.д. В различных вариантах реализации изобретения антителом является фрагмент, такой как Fab', F(ab')2, scFv (вариабельный одноцепочечный) или другой фрагмент, сохраняющий сайт связывания антигена, или же scFv фрагмент, полученный путем рекомбинации, как пример полученных путем рекомбинации фрагментов. См., например, Alien, Т., Nature Reviews Cancer, Vol.2, 750-765, 2002 и включенные ссылки. Антитело может быть моновалентным, бивалентным или мультивалентным. Антитело может быть химерным или «гуманизированным» антителом, в котором, например, вариабельная область грызуна прививается к константной области человеческого происхождения, при этом сохраняется специфичность антитела грызуна. Область человеческого происхождения не обязательно должна быть получена от человека, т.е. быть впервые синтезированной в организме человека. Вместо этого, «человеческие» области могут быть синтезированы в теле грызуна, чей геном включает гены человеческих иммуноглобулинов. См., например, Vaughan, et al., (1998), Nature Biotechnology, 16: 535-539. Антитело может быть частично или полностью гуманизировано. Антитело может быть поликлональным или моноклональным, хотя для целей настоящего изобретения моноклональные антитела в целом предпочтительнее. Способы получения антител, которые специфически связываются фактически с любой интересующей молекулой, известны в данной области. Например, моноклональные или поликлональные антитела могут быть выделены из крови или асцитической жидкости животного, которое продуцирует антитело (например, после естественного воздействия или иммунизации молекулой или ее антигенным фрагментом), могут быть получены при использовании рекомбинантных технологий в культуре клеток или с помощью трансгенных организмов, или могут быть созданы хотя бы частично путем химического синтеза.
[0033] Термины «приблизительно» или «примерно» в отношении числовых значений, как правило, подразумевают числа, которые находятся в пределах ±10%, в некоторых вариантах ±5%, в некоторых вариантах ±1%, в некоторых вариантах ±0,5% от числа, если иное не указано или не следует из контекста (за исключением тех случаев, когда такое число превосходит 100% от возможной величины).
[0034] Термин «биосовместимый» используется в соответствии с его употреблением в данной области и относится к веществу, которое по существу не токсично для клеток in vitro; например, в некоторых вариантах реализации, если его добавление к клеткам в культуре в количествах, приближенных к концентрации, предусмотренной для использования in vivo, приводит к гибели не больше, чем 20% клеток. Вещество считается биосовместимым для реципиента в том случае, если оно по существу не токсично для клеток и тканей реципиента в используемых количествах и в области применения, и также не вызывает или не обуславливает значительный вредный или неблагоприятный эффект на тело реципиента, например, иммунную или воспалительную реакцию, формирование рубцовой ткани и т.д.
[0035] Термин «биодеградируемый» подразумевает, что вещество способно разрушаться физически или/и химически внутри клеток или внеклеточного компонента в теле субъекта, например, в результате гидролиза при физиологических условиях, в результате естественного биологического процесса, такого как действие ферментов, присутствующих внутри клетки или внутри тела, и т.д., с формированием более низкомолекулярных химических соединений, которые могут метаболизироваться с вероятным повторным использованием в организме, и/или выводиться или утилизироваться иначе. Вещества, которые разлагаются, расщепляются или распадаются на малые фрагменты, например, растворимые молекулы или надмолекулярные комплексы, при физиологических условиях, относятся к «биодеградируемым» веществам. Предпочтительное биодеградируемое вещество является биосовместимым.
[0036] «Биологическая макромолекула» означает большую молекулу, состоящую из меньших субъединиц, встречающихся в биологических системах. Примеры биологических макромолекул включают полипептиды, нуклеиновые кислоты и полисахариды. Обычно биологическая макромолекула содержит по меньшей мере 3 субъединицы (например, аминокислоты, нуклеозиды, моносахариды и т.д.). Биологические макромолекулы могут являться, но не обязательно, природными полипептидами, нуклеиновыми кислотами или полисахаридами. Биологическая макромолекула может быть модифицированной, например, она может быть связана с небиологической молекулой, такой как синтетический полимер, и т.д.
[0037] «Компонент комплемента» или «белок комплемента» означает молекулу, которая вовлечена в активацию системы комплемента или принимает участие в одном или более комплемент-опосредованных процессов. Компоненты классического пути комплемента включают, например, C1q, C1r, C1s, С2, С3, С4, С5, С6, С7, С8, С9 и C5b-9 комплекс, также известный как мембран-атакующий комплекс (MAC) и активные фрагменты или продукты ферментативного расщепления любых предшественников (например, С3а, C3b, С4а, C4b, С5а, и т.д.). Компоненты альтернативного пути включают, например, факторы В, D, I и пропердин. Компоненты пектинового пути включают, например, MBL2, MASP-1 и MASP-2. Компоненты комплемента также включают клеточные рецепторы растворимых компонентов комплемента. Такие рецепторы включают, например, рецептор С5а (C5aR), рецептор С3а (C3aR), рецептор комплемента 1(CR1), рецептор комплемента 2 (CR2), рецептор комплемента 3 (CR3) и т.д. Необходимо понимать, что термин «компонент комплемента» не относится к тем молекулам и молекулярным структурам, которые являются «инициаторами» для активации комплемента, например, комплексы антиген-антитело, инородные структуры на поверхностях бактериальных клеток или на искусственных поверхностях и т.д.
[0038] «Регулирующий комплемент белок» - это белок, вовлеченный в регуляцию активности комплемента, такой как фактор комплемента Н (CFH) у млекопитающих.
[0039] «Белок контроля комплемента» - это белок, регулирующий систему комплемента, содержащий множество SCR участков.
[0040] «Комплемент-подобный белок» - это белок, последовательность которого по меньшей мере на 20% от общей ее длины идентична последовательности белка комплемента или белка контроля комплемента, и/или белок, который особым образом конкурирует с белками комплемента или белками контроля комплемента за связывание с их мишенью, например, имеет по меньшей мере на 10% большую аффинность. Гены, кодирующие такие белки, могут быть обнаружены в непосредственной близости от генов, кодирующих белки комплемента или белки контроля комплемента, имеющие идентичные последовательности. Например, кластер генов CFH содержит многочисленные CFH - подобные гены (например, CFHR1, CFHR1, CFHR3, CFHR4 и CFHR5).
[0041] Термин «связанный с комплементом белок» является общим для компонентов комплемента, белков, регулирующих комплемент, и комплемент-подобных белков; однако, необходимо понимать, что изобретение охватывает варианты реализации, которые относятся конкретно к компонентам комплемента, белкам, регулирующим комплемент, комплемент-подобными белками и их комбинациям.
[0042] Термин «эффективное количество» активного агента, такого как ингибитор комплемента, относится к количеству активного агента, достаточному для того, чтобы вызвать желаемый биологический ответ (или же подавить нежелаемый биологический ответ). Специалистам в данной области ясно, что абсолютное количество определенного агента, которое является эффективным, может варьироваться в зависимости от таких факторов, как желаемый биологический ответ, применяемый агент, ткань-мишень и т.д. Специалистам в данной области также очевидно, что «эффективное количество» может достигаться при однократном введении, или же при введении нескольких доз. Например, эффективное количество может быть количеством, достаточным для того, чтобы облегчить по меньшей мере один симптом заболевания. Эффективное количество может быть количеством, достаточным для замедления развития хронического или прогрессирующего заболевания, например, для увеличения периода времени до проявления одного или более симптомов или признаков заболевания, или для увеличения периода времени до того, как заболевание приведет к определенной степени поражения организма. Эффективное количество может быть количеством, достаточным для того, чтобы обеспечить более быстрое и эффективное восстановление после заболевания, чем в отсутствии агента.
[0043] Термин «идентичный» относится к участку, в котором последовательность двух или более аминокислот или полипептидов одинакова. Процентная идентичность между интересующей последовательностью и второй последовательностью по определенным критериям, например, по длине интересующей последовательности, может быть вычислена при выравнивании последовательностей, в ходе которого определяется количество остатков (нуклеотидов или аминокислот) в пределах анализируемого участка, находящихся напротив идентичного остатка, при этом использование пробелов позволяет повысить идентичность, делится на общее число остатков интересующей последовательности или второй последовательности (той, которая больше), попадающих в анализируемый участок, и умножается на 100. Под пробелом подразумевается участок последовательности, который не занят остатком. При вычислении количества идентичных остатков для определения процентной идентичности результаты округляются до ближайшего целого числа. Процентную идентичность можно вычислить при использовании известных в данной области различных компьютерных программ. Например, такие компьютерные программы, как BLASTN, BLASTP, Gapped BLAST и т.д., выравнивают интересующую последовательность по любой из разнообразных последовательностей из общих баз данных и высчитывают процентную идентичность между ними. Алгоритм Карлина-Альтшуля (Karlin and Altschul, Proc. Natl. Acad. Sci. USA 87:22264-2268, 1990), модифицированный по Karlin and Altschul, Proc. Natl. Acad. Sci. USA 90:5873-5877, 1993, включен в программы NBLAST и XBLAST Альтшуля и др. (Altschul, et al. Nucleic Acids Res. 25: 3389-3402, 1997). При работе с программами BLAST и Gapped BLAST могут быть использованы параметры, установленные по умолчанию. Эти программы можно найти на интернет-сайте URL www.ncbi.nlm.nih.gov. В некоторых вариантах процентная идентичность между интересующей последовательностью и второй последовательностью вычисляется с помощью BLAST2 с использованием установленных по умолчанию параметров.
[0044] Термин «изолированный» означает 1) отделенный по меньшей мере от некоторых компонентов, с которыми обычно связан в природных условиях; 2) полученный или очищенный в результате процесса, который включает человеческое вмешательство и/или 3) не встречающийся в природе. Например, молекула, удаленная из клетки, которая ее продуцирует, является «изолированной». Химически синтезированная молекула является «изолированной».
[0045] Термин «связанный», при использовании в отношении двух или более соединений, значит, что эти соединения физически объединены или связаны друг с другом с образованием молекулярной структуры, которая достаточно стабильна для того, чтобы соединения оставались объединенными в условиях формирования связи и, предпочтительно, в условиях применения новой молекулярной структуры, например, физиологических условиях. В некоторых предпочтительных вариантах реализации изобретения связь является ковалентной связью. В других вариантах реализации связь является нековалентной. Соединения могут быть связаны напрямую или не напрямую. Если два соединения соединены напрямую, то они либо ковалентно связаны друг с другом, либо находятся на достаточно близком расстоянии друг от друга для того, чтобы межмолекулярные силы между ними могли поддерживать их связь. Когда два соединения связаны не напрямую, каждый из них связан либо ковалентно, либо нековалентно с третьим соединением, который поддерживает связь между двумя этими элементами. В целом, когда указывается, что два соединения связаны с помощью «линкера» или «связующей группы» или «соединительного участка», связь между двумя этими соединениями является непрямой, и, как правило, каждое из связанных соединений ковалентно связано с линкером. Линкером может быть любая подходящая группа, которая реагирует с двумя связываемыми соединениями в течение достаточного количества времени и в условиях, совместимых со стабильностью соединений (которые при необходимости могут быть защищены, в зависимости от условий), и в количестве, достаточном для получения приемлемого результата.
[0046] «Жидким составом» называется состав, содержащий по меньшей мере одно химическое вещество, которое является жидким при комнатной температуре. Жидкий состав может содержать терапевтический агент. Терапевтический агент может быть, например, растворен, суспендирован или диспергирован в нем. Терапевтический агент может присутствовать в виде отдельных молекул, перемешанных с молекулами жидкости, или в виде микроскопических или макроскопических агрегатов частиц и т.д., при условии, что такие агрегаты или частицы не препятствуют свободному перетеканию состава в соответствии с его жидким состоянием.
[0047] Термин «местное применение» или «местное введение» в отношении доставки состава или агента относится к доставке, которая не опосредована транспортом состава или агента к его намеченной ткани-мишени или намеченному участку через систему сосудов. Состав или агент может быть доставлен прямо к намеченной ткани-мишени или участку, или к прилежащей области, например, в непосредственной близости от намеченного участка или ткани-мишени. Например, состав может быть доставлен путем инъекции или инфузии состава. В результате местного введения в непосредственной близости от намеченной ткани или области-мишени, состав или один или более его компонентов могут диффундировать к намеченной ткани-мишени или области. Следует понимать, что при однократном местном введении фракция терапевтического агента (как правило, только малая фракция вводимой дозы) может попадать в кровеносную систему и транспортироваться в другую область, включая обратный транспорт к намеченной ткани-мишени или области.
[0048] «Локальная активация» относится к активации комплемента, которая происходит вне сосудистого русла.
[0049] «Множество» означает больше, чем один.
[0050] Термин «полипептид» при использовании в данной заявке относится к аминокислотному полимеру, как правило, включающему один или два аналога аминокислот. Белок - это молекула, состоящая из одного или более полипептидов. Пептид - это относительно короткий полипептид, как правило, от 2 до 60 аминокислот в длину, например, от 8 до 40 аминокислот в длину. Термины «белок», «полипептид» и «пептид» могут использоваться взаимозаменяемо. Полипептиды, использованные согласно данной заявке, могут содержать такие аминокислоты, которые встречаются в белках в природных условиях, аминокислоты, которые не встречаются в белках в природных условиях, и/или аналоги аминокислот, которые не являются аминокислотами. В данном контексте, «аналогом» аминокислоты может быть другая аминокислота, которая структурно напоминает данную аминокислоту, или вещество, не являющееся аминокислотой, которое структурно напоминает аминокислоту. Известно большое количество общепринятых аналогов 20 аминокислот, обычно встречающихся в белках («стандартных» аминокислот). Одна или более аминокислот в полипептиде могут быть модифицированы, например, с помощью присоединения к ним химической структуры, такой как углеводная группа, фосфатная группа, фарнезильная группа, изофарнезильная группа, группа жирной кислоты, линкер для конъюгации, функционализации или другой модификации и т.д. Конкретные неограничивающие примеры подходящих аналогов и модификаций описаны в международных публикациях РСТ WO 2004026328 и WO 2007062249. Полипептид может быть ацетилирован, например, на N-конце, и/или аминирован, например, на С-конце. Модификации могут происходить в любом участке полипептида, включая пептидную связь, боковые цепи аминокислот и аминный конец или карбоксильный конец. Определенный полипептид может содержать множество типов модификаций. Полипептиды могут быть разветвленные и/или циклические, разветвленные или неразветвленные. Полипептиды могут быть, например, выделены из природных источников, получены в условиях in vitro или in vivo в подходящих системах экспрессии с использованием технологии рекомбинантной ДНК (например, рекомбинантной клеткой хозяина, или в трансгенных животных или растениях), синтезированы химическими способами, такими как традиционный твердофазный пептидный синтез, и/или способами, включающими химическое лигирование синтезированных пептидов (см., например, Kent, S., J Pept Sci., 9(9):574-93, 2003), или получены с помощью комбинаций вышеперечисленных способов. Эти способы хорошо известны, и специалист в данной области может выбрать и применить подходящий способ для синтеза пептидов и полипептидов, описанных в данной заявке. Полипептид может включать один или более сайтов дотирования, как описано, например в публикации заявки США No. 20040115774. В некоторых вариантах реализации изобретения полипептид модифицирован с помощью полимера при использовании одного или более способов, описанных в данной заявке или включенных в нее посредством ссылки. Термины «полипептидная последовательность» или «аминокислотная последовательность» при использовании в данной заявке могут относиться к полипептидному материалу как таковому и не нести информацию о последовательности, характеризующей полипептид биохимически (т.е., последовательности букв или трехбуквенных кодов, выбранных из букв или кодов, представляющих собой аббревиатуры названий аминокислот). Полипептидные последовательности, используемые в данной заявке, приводятся в направлении от N-конца к С-концу, если иное не указано.
[0051] Термин «очищенный» при использовании в данной заявке означает, что соединение или вещество отделено от одного или более других соединений или веществ, с которыми оно находилось вместе до того, как было очищено. Соединение или вещество может быть частично очищенным, практически очищенным или чистым. Вещество или соединение, такое как нуклеиновая кислота или полипептид, считается чистым, если оно изолировано практически от всех других соединений и веществ, не являющихся растворителями или какими-либо ионами, содержащимися в растворе; т.е. когда оно составляет по меньшей мере около 90%, предпочтительнее по меньшей мере 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или больше,, чем 99%, сухого веса смеси. Частично или практически очищенное соединение или вещество, такое как нуклеиновая кислота или полипептид, могут быть изолированы по меньшей мере от 50% по сухому весу, по меньшей мере от 60%, по меньшей мере от 70%, или по меньшей мере от 80% материала, с которым они встречаются в природе, например, клеточного материала, такого как клеточные белки и/или нуклеиновые кислоты. В некоторых вариантах реализации изобретения количество очищенной нуклеиновой кислоты или полипептида составляет по меньшей мере 10%, 20%, 30%, 50%, 60%, 70%, 80%, 90%, 95%, 99%, или даже больше, от сухого веса общей аминокислоты или полипептида в смеси, соответственно. Способы оценки чистоты известны в данной области и включают методы хроматографии, иммунологические методы, электрофоретические методы и т.д. Любой из описанных в данной заявке полинуклеотидов или полипептидов может быть очищен.
[0052] Термин «реакционно-способоная функциональная группа» при использовании в данной заявке относится к группам, включающим, но не ограничивающимся, олефины, ацетилены, спирты, фенолы, эфиры, оксиды, галиды, альдегиды, кетоны, карбоновые кислоты, сложные эфиры, амиды, цианаты, изоцианаты, тиоцианаты, изотиоцианаты, амины, диамиды, гидразины, гидразиды, диазо-группы, диазоний, азот, нитрилы, меркаптаны, сульфиды, дисульфиды, сульфоксиды, сульфоны, сульфоновые кислоты, сульфиновые кислоты, ацетали, кетали, ангидриды, сульфаты, сульфеновые кислоты, изонитрилы, амидины, имиды, имидаты, нитроныа гидроксиламины, оксимы, гидроксамовые кислоты, тиогидроксамовые кислоты, аллены, ортоэфиры, сульфиты, енамины, инамины, карбамиды, псевдокарбамиды, семикарбазиды, карбодиимиды, карбаматы, имины, азиды, азасоединения, азоксисоединения и нитрозосоединения. Реакционно-способоные функциональные группы также включают группы, часто используемые для получения биоконъюгатов, например, N-гидроксисукцинимид, сложные эфиры, малеимиды, сульфгидрилы и т.д. (см., например, Hermanson, G., Bioconjugate Techniques, Academic press, San Diego, 1996). Способы получения каждой из этих функциональных групп хорошо известны в данной области, и их применение или модификация для конкретной цели находятся в рамках опыта специалистов (см., например, Sandier and Karo, eds. ORGANIC FUNCTIONAL GROUP PREPARATIONS, Academic Press, San Diego, 1989).
[0053] Термины «РНК-интерференция» или «РНКи» используются в данной заявке в соответствии с их применением в данной области, например, эти термины относятся к любому способу, с помощью которого может быть снижена экспрессия гена или количество генного продукта при введении внутрь, или при экспрессии внутри, клетки-мишени или организма двухцепочечных РНК (дцРНК), называемых «посредниками РНКи», последовательность которых соответствует последовательности с интересующим геном, особенно коротких двухцепочечных РНК (миРНК), содержащих последовательность, которая комплементарна матричной РНК интересующего гена.
[0054] Термин «специфическое связывание» в целом относится к физической связи между полипептидом-мишенью (или, более обобщенно, молекулой-мишенью) и связывающей молекулой, такой как антитело или лиганд. Связывание, как правило, зависит от структурных особенностей мишени, таких как антигенная детерминанта, эпитоп, связывающий карман или щель, распознаваемые связывающей молекулой. Например, если антитело специфично к эпитопу А, то присутствие полипептида, содержащего эпитоп А, или присутствие свободного немеченого эпитопа А в реакции, содержащей как свободный меченый эпитоп А, так и связующую его молекулу, будет снижать количество связанного со связывающей молекулой меченого эпитопа А. Необходимо понимать, что специфичность не является абсолютной, а обычно относится к определенным условиям, в которых происходит связывание. Например, как известно в данной области, множество антител перекрестно реагирует с другими эпитопами в дополнение к уже присутствующим эпитопам молекуле-мишени. Такая перекрестная реакционносопособность может быть приемлемой в зависимости от применения данного антитела. Средний специалист способен подобрать антитела или лиганды, имеющие достаточную степень специфичности для того, чтобы действовать должным образом при каком-либо конкретном применении (например, для определения молекулы-мишени, для терапевтических целей и т.д.). Также необходимо понимать, что специфичность можно оценивать с учетом дополнительных факторов, таких как аффинность связывающей молекулы по отношению к мишени и аффинность связывающей молекулы по отношению к другим мишеням, например, конкурентным. Если связывающая молекула проявляет высокую аффинность по отношению к интересующей молекуле-мишени и низкую аффинность по отношению к другим молекулам, то такое антитело, вероятно, будет подходящим реагентом. Если специфичность связывающей молекулы установлена в определенном условии, или условиях, такая молекула может применяться в других, предпочтительно похожих, условиях без необходимости переоценки ее специфичности. Связывание двух или более молекул может считаться специфичным, если равновесная константа диссоциации (Kd) составляет 10-3 М, или меньше, предпочтительно 10-4 М, или меньше, еще предпочтительнее 10-5 М, или меньше, например, 10-6 М, или меньше, 10-7 М, или меньше, 10-8 М, или меньше, или 10-9 М, или меньше, при экспериментальных условиях, например, физиологических условиях.
[0055] «Значительная идентичность последовательности» в отношении последовательности аминокислот означает, что последовательность по меньшей мере приблизительно на 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 95% идентична контрольной последовательности. В особых вариантах реализации термин по отношению к аминокислотной последовательности означает, что последовательность по меньшей мере приблизительно на 70%, 80%, 85%, 90%, 95%, 98% или 99% идентична контрольной последовательности. В особых вариантах по меньшей мере 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 95% неидентичных аминокислот являются консервативными заменами аминокислот контрольной последовательности. Консервативные замены могут быть определены в соответствии с Stryer, L., Biochemistry, 3rd ed., 1988, по которому нижеследующие группы аминокислот имеют сходные свойства боковых цепей, такие как заряд, гидрофобность, степень ароматизации и т.д. (1) Алифатические боковые цепи: G, А, V, L, I; (2) Ароматические боковые цепи: F, Y, W; (3) Серо-содержащие боковые цепи: С, М;
(4) Алифатические гидроксильные боковые цепи: S, Т; (5) Основные боковые цепи: K, R, Н;
(6) Кислые аминокислоты: D, Е, N, Q; (7) Циклическая алифатическая боковая цепь: Р, которую можно также рассматривать как относящуюся к группе (1). В соответствии с другой принятой классификацией консервативные замены происходят внутри следующих групп аминокислот: (1) Неполярные: А, L, I, V, G, Р, F, W, М; (2) Полярные: S, Т, С, Y, N, Q. (3) Основные: K, R, Н; (4) Кислотные: D, Е. Аминокислоты с малой боковой цепью (G, А, S, Т, М) также образуют группу, внутри которой могут происходить консервативные замены. Могут быть использованы другие способы классификации, известные в данной области. Кроме того, в соответствии с этими вариантами можно классифицировать аналоги аминокислот и не природные аминокислоты.
[0056] Термин «субъект» при использовании в данной заявке относится к индивиду, которому вводится агент, например, в экспериментальных, диагностических и/или терапевтических целях. Если иное не указано, субъектами являются млекопитающие, например, домашние животные, такие как собаки, кошки, кролики и т.д., обезьяны или люди.
[0057] Термин «системный» при использовании в данной заявке в отношении компонентов комплемента относится к белкам комплемента, которые синтезируются печеночными гепатоцитами и поступают в кровоток, или синтезируются циркулирующими макрофагами или моноцитами и секретируются в кровоток.
[0058] Термин «терапевтический агент» при использовании в данной заявке относится к какому-либо фармакологически активному агенту, применяемому для лечения заболевания. Термин включает любые фармацевтически приемлемые соли, пролекарства, соли пролекарства и их производные, известные в данной области, или же легко получаемые при использовании стандартных способов, известных в данной области. Термин «пролекарство» относится к предшественнику агента, при этом само по себе пролекарство не является фармакологически активным (или имеет ослабленное или другое действие, чем желаемое действие лекарственного агента), но после введения в организм превращается (например, метаболическим путем) в фармацевтически активный лекарственный агент. Терапевтический агент может являться, но не обязательно является, малой молекулой или биологической макромолекулой, такой как полипептид, антитело, нуклеиновая кислота, например, аптамер, агент РНКи, такой как малая интерферирующая РНК (миРНК) и т.д. В настоящей заявке терапевтический агент иногда называется «активным агентом» или «лекарственным препаратом». Малая молекула, как правило, является органическим соединением, имеющим молекулярную массу 1,500 Дальтон (Да), или меньше, например, 1,000 Да, или меньше, например, 500 Да, или меньше, и имеющим многочисленные углерод-углеродные связи.
[0059] Термин «лечение» при использовании в данной заявке относится к проведению каких-либо медицинских или хирургических процедур на субъекте. Лечение может проводиться для того, чтобы обратить, облегчить, подавить или предотвратить прогрессирование, исключить или снизить вероятность появления одного или более симптомов или проявлений болезни, нарушения или патологического состояния. «Предотвратить» означает вызвать такое действие, чтобы болезнь, нарушение, патологическое состояние или симптомы, или проявления таковых, не появлялись по меньшей мере какое-то время по меньшей мере у некоторых субъектов. Лечение может включать в себя этап введения субъекту агента после развития у него одного или более симптомов или проявлений, показательных для комплемент-опосредованных патологических состояний; например, для того, чтобы обратить, облегчить, уменьшить тяжесть патологического состояния, и/или подавить или предотвратить прогрессирование патологического состояния, и/или обратить, облегчить, уменьшить тяжесть и/или подавить один или более симптомов или проявлений патологического состояния. Состав согласно изобретению может вводиться субъекту, страдающему комплемент-опосредованным нарушением, или находящемуся в группе повышенного риска развития такого нарушения по сравнению со среднестатистическим человеком. Состав согласно данному изобретению может быть введен с целью профилактики, т.е., до момента развития каких-либо симптомов или проявлений патологического состояния (например, субъекту, имеющему по меньшей мере один фактор риска развития патологического состояния).
[0060] Термин «алкил» при использовании в данной заявке относится к насыщенному линейному разветвленному или циклическому углеводороду, который содержит приблизительно от 1 до 22 атомов углерода (включая все комбинации и подкомбинации последовательностей и специфические номера атомов углерода), предпочтительно от примерно 1 до примерно 12 или от примерно 1 до примерно 7 атомов углерода в некоторых вариантах реализации изобретения. Алкильные группы включают, но не ограничиваются, метил, этил, н-пропил, изопропил, н-бутил, изобутил, т-бутил, н-пентил, циклопентил, изопентил, неопентил, н-гексил, изогексил, циклогексил, циклооктил, адамантил, 3-метилпентил, 2,2-диметилбутил и 2,3-диметилбутил.
[0061] Термин «галоген» при использовании в данной заявке относится к F, Cl, Br или I.
[0062] Термин «алканоил» при использовании в данной заявке относится к возможно замещенному линейному или разветвленному алифатическому ациклическому остатку, имеющему приблизительно от 1 до 10 атомов углерода (включая все комбинации и подкомбинации последовательностей и специфические номера атомов углерода), например, от примерно 1 до примерно 7 атомов углерода. Алканоильные группы включают, но не ограничиваются, формил, ацетил, пропионил, бутирил, изибутирил, пентаноил, изопентаноил, 2-метил-бутирил, 2,2-диметоксипропионил, гексаноил, гептаноил, октаноил и т.д. Термин «низший алканоил» относится к возможно замещенному линейному или разветвленному алифатическому ациклическому остатку, имеющему приблизительно от 1 до 5 атомов углерода (включая все комбинации и подкомбинации последовательностей и специфические номера атомов углерода). Такие группы включают, но не ограничиваются, формил, ацетил, пропионил, бутирил, изобутирил, пентаноил, изопентаноил и т.д.
[0063] Термин «арил» при использовании в данной заявке относится к возможно замещенной моно- или бициклической системе ароматических колец, имеющей приблизительно от 5 до 14 атомов углерода (включая все комбинации и подкомбинации последовательностей и специфические номера атомов углерода), предпочтительно от примерно 6 до примерно 10 атомов углерода. К неограничивающим примерам относятся фенил и нафтил.
[0064] Термин «аралкил» при использовании в данной заявке относится к алкильным радикалам, имеющим арильные заместители и имеющим от примерно 6 до примерно 22 атомов углерода (включая все комбинации и подкомбинации последовательностей и специфические номера атомов углерода), причем в некоторых вариантах реализации изобретения предпочтительными являются радикалы с от примерно 6 до примерно 12 атомами углерода. Аралкильные группы могут быть возможно замещены. К неограничивающим примерам относятся бензил, нафтилметил, дифенилметил, трифенилметил, фенилэтил и дифенилэтил.
[0065] Термины «алкокси» и «алкоксил» при использовании в данной заявке относятся к возможно замещенной группе алкил-O-, где алкил определен ранее. Типичные алкокси и алкоксильные группы включают метокси, этокси, н-пропокси, и-пропокси, н-бутокси и гептокси группы.
[0066] Термин «карбокси» при использовании в данной заявке относится к группе -С(=O)ОН.
[0067] Термин «алкоксикарбонил» при использовании в данной заявке относится к группе -С(=O)O-алкил, где алкил определен ранее.
[0068] Термин «ароил» при использовании в данной заявке относится к группе -С(=O)-арил, где арил определен ранее. Типичные ароильные группы включают бензоил и нафтоил.
[0069] Как правило, замещенные химические группы включают один или более заместителей, которые замещают атом водорода. К типичным заместителям относятся, например, галоген, алкил, циклоалкил, аралкил, арил, сульфидрил, гидроксил (-ОН), алкоксил, цианогруппа (-CN), карбоксил (-СООН), -С(=O)O-алкил, аминокарбонил (-C(=O)NH2), -N-замещенный аминокарбонил (-C(=O)NHR”), CF3, CF2CF3 и т.д. Каждая частица R” у вышеуказанных заместителей независимо может представлять собой, например, Н, алкил, циклоалкил, арил или аралкил.
[0070] Термин «L-аминокислота» при использовании в данной заявке относится к любой встречающейся в природе левовращающей альфа-аминокислоте, присутствующей в природных условиях в белках, или к алкиловым эфирам этих альфа-аминокислот. Термин «D-аминокислота» относится к правовращающим альфа-аминокислотам. Если иное не указано, все аминокислоты, указанные в настоящей заявке, являются L-аминокислотами.
[0071] При использовании в данной заявке термин «ароматическая аминокислота» относится к аминокислоте, которая включает по меньшей мере одно ароматическое кольцо, например, арильную группу.
[0072] При использовании в данной заявке термин «аналог ароматической аминокислоты» относится к аналогу аминокислоты, который включает по меньшей мере одно ароматическое кольцо, например, арильную группу.
ПОДРОБНОЕ ОПИСАНИЕ НЕКОТОРЫХ ВАРИАНТОВ РЕАЛИЗАЦИИ ИЗОБРЕТЕНИЯ
[0073] Пролонгированное высвобождение аналога компстатина из гелеподобной структуры
[0074] Настоящее изобретение относится к пролонгированной доставке аналога компстатина с высвобождением аналога компстатина из гелеподобной структуры, которая формируется при введении жидкого состава, содержащего аналог компстатина, во внесосудистое пространство в теле млекопитающего, такое как стекловидная камера глазного яблока. Изобретение также относится к пролонгированной доставке аналога компстатина с высвобождением аналога компстатина из гелеподобной структуры, которая формируется при контакте жидкого состава, содержащего аналог компстатина, с субстанцией организма субъекта. Субстанция организма - это, как правило, жидкая или содержащая жидкость субстанция, не являющаяся кровью (или ее производными, такими как плазма или сыворотка) или мочой. Например, субстанцией может быть стекловидное тело.
[0075] Субстанции тела обычно содержат белок (белки), неорганический или органический ион (ионы) и/или гликозамингликаны. Одна или более из этих составляющих могут инициировать формирование гелеподобной структуры, или принимать в нем участие. В некоторых вариантах реализации изобретения гелеподобная структура содержит один или более эндогенных белков или гликозамингликанов, присутствующих в субстанции тела, где указанные эндогенные белки или гликозамингликаны включены в гелеподобной структуре при ее формировании in vivo.
[0076] Изобретение также относится к пролонгированной доставке терапевтического агента при введении жидкого состава, содержащего терапевтический агент и аналог компстатина, во внесосудистое пространство в теле млекопитающего с формированием гелеподобной структуры. Изобретение также относится к пролонгированной доставке терапевтического агента при высвобождении терапевтического агента из гелеподобной структуры, которая формируется при контакте жидкого состава, содержащего аналог компстатина и терапевтический агент, с субстанцией организма, например, белок-содержащей субстанцией организма. Субстанция организма, как правило, является жидкой или содержащей жидкость субстанцией, не являющаяся кровью (или ее жидкими производными, такими как плазма или сыворотка) или мочой. Например, субстанцией может быть жидкая часть стекловидного тела.
[0077] Изобретение также относится к гелеподобной структуре, формирующейся ех vivo при контакте жидкого состава, содержащего аналог компстатина, с одним или более белками, ионами или гликозамингликанами, или их комбинациями, достаточными для инициации формирования геля. Белки, ионы или гликозамингликаны, могут быть идентичными таковым, присутствующим в естественных условиях в пространствах тела, таких как стекловидная камера глазного яблока, синовиальная полость и т.д., или могут значительно совпадать с ними по структуре или последовательности. Гелеподобная структура может также содержать дополнительный терапевтический агент. Изобретение также относится к пролонгированной доставке аналога компстатина и возможно второго терапевтического агента при введении гелеподобной структуры нуждающемуся субъекту, например, путем инъекции, имплантации или нанесения на область тела, где необходимо ингибировать комплемент.
[0078] В некоторых вариантах реализации изобретения, жидкий состав характеризуется тем, что он не содержит другие гелеобразующие вещества, кроме аналога компстатина. При удалении аналога компстатина из такого состава гелеподобная структура не формируется после введения жидкого состава субъекту при условиях, в которых гелеподобная структура легко формировалась бы в присутствии аналога компстатина в достаточном количестве, например, после инъекции внутрь стекловидного тела. В некоторых вариантах реализации изобретения, жидкий состав характеризуется тем, что содержит гелеобразующие вещества, при этом такие вещества присутствуют в количествах, недостаточных для формирования геля в отсутствии аналога компстатина при условиях, в которых гелеподобная структура легко формировалась бы в присутствии аналога компстатина в достаточном количестве, например, после инъекции в стекловидное тело. В некоторых вариантах реализации изобретения жидкий состав, таким образом, отличается от составов, которые содержат гелеобразующие вещества, такие как коллаген, синтетические полимеры и т.д., которые могут быть включены в другие рецептуры аналога компстатина с целью формирования геля в достаточных количествах в отсутствии аналога компстатина.
[0079] В некоторых вариантах реализации изобретения жидкий состав состоит по существу из аналога компстатина и одного или более химических веществ, которые являются жидкими при комнатной температуре (например, воды). В некоторых вариантах реализации по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% сухого веса состава составляет аналог компстатина. В некоторых вариантах реализации жидкий состав содержит воду и органический растворитель. В некоторых вариантах реализации жидкий состав в дополнение к аналогу компстатина содержит неорганический ион, буфер, растворяющий агент или их комбинацию, где такой состав не формирует гелеподобную структуру при его введении в отсутствии аналога компстатина. Дополнительно жидкий состав может включать аналог компстатина и один или более терапевтических агентов.
[0080] Изобретение также относится к способам модулирования формирования геля из жидкого состава, содержащего аналог компстатина, и/или способам модулирования свойств геля, формирующегося из жидкого состава, содержащего аналог компстатина, и к способам исследования агентов для определения их способности модулировать желаемым образом одно или более свойств геля, и/или один или более параметров формирования геля (например, скорость, с которой гель формируется или исчезает, плотность, консистенцию, содержание аналога компстатина, скорость высвобождения аналога компстатина и т.д.). Способы включают приготовление жидкого состава, содержащего аналог компстатина, жидкую субстанцию (например, воду) и исследуемый агент; введение жидкого состава во внесосудистое пространство субъекта-млекопитающего (например, стекловидную камеру глазного яблока) и изучение одного или более свойств состава in vivo после его введения. Способ используется для выявления агентов, которые желаемым образом влияют на одно или более свойств геля и/или на его формирование. Исследуемые агенты могут содержать стандартные вспомогательные вещества, модуляторы вязкости, неорганические и органические ионы, буферы и т.д.
[0081] Одним аспектом изобретения является жидкий состав, содержащий аналог компстатина, жидкую субстанцию и модулятор одного или более свойств геля или формирования геля.
[0082] Компстатин - это циклический пептид, который связывается с компонентом комплемента СЗ и ингибирует активацию комплемента. В патенте США No. 6,319,897 описан пептид, который имеет последовательность Ile-[Cys-Val-Val-Gln-Asp-Trp-Gly-His-His-Arg-Cys]-Thr (SEQ ID NO: 44), с дисульфидной связью между двумя цистеинами, обозначенными скобками. Необходимо пояснить, что название «компстатин» не использовалось в патенте США No. 6,319,897, но позднее было принято в научной и патентной литературе (см., например, Morikis, et al.. Protein Sci., 7(3):619-27, 1998) для определения пептида, имеющего такую же последовательность, что и SEQ ID NO: 2, описанная в патенте США No. 6,319,897, но амидированную на С-конце, как показано в Таблице 1 (SEQ ID NO: 8). Термин «компстатин» употребляется в данной заявке в соответствии с его использованием (т.е., в отношении SEQ ID NO: 8). Были открыты аналоги компстатина, которые имеют более высокую ингибирующую комплемент активность, чем компстатин. См., например, международную публикацию WO 2004/026328 (PCT/US 2003/029653), Morikis, D., et al., Biochem Soc Trans. 32 (Pt 1):28-32, 2004, Mallik, В., et al., J. Med. Chem., 274-286, 2005; Katragadda, M., et al. J. Med. Chem., 49: 4616-4622, 2006; международную публикацию WO 2007062249 (PCT/US 2006/045539); WO 2007044668 (PCT/US 2006/039397), USSN 11/544,389 (Compstatin and Analogs Thereof for Eye Disorders) и описание ниже.
[0083] Настоящее изобретение появилось по меньшей мере отчасти в результате неожиданного открытия того, что введение жидкого состава, содержащего активный аналог компстатина и воду, в стекловидное тело приводит к формированию макроскопической гелеподобной структуры, также называемой «включением» или просто «гелем» (см. Фигура 1). Термин «гелеподобный» при использовании в данной заявке относится к гелю или какой-либо структуре из материала с характерными для геля физическими свойствами (например, желатина). Таким образом, термин «гелеподобный» используется для описания физической природы студенистой или желатинообразной структуры, а не для описания особой физической структуры. Конкретными физическими свойствами являются вязкость, эластичность, механическая прочность и сжимаемость. Термин «гелеподобный» относится к тем, но не только, веществам, которые имеют такую гомогенную структуру, которая обычно приписывается гелям специалистами в области коллоидной химии, где гель может быть представлен как коллоидная система, в которой пористая сеть взаимосвязанных частиц (как правило, нанометровых размеров) заполняет объем жидкого среды. Внесосудистое пространство может содержать субстанции тела, которые могут иметь различную степень вязкости. Субстанция может являться жидкостью организма. Субстанция сама по себе может хотя бы отчасти быть гелеподобной по консистенции. В некоторых вариантах реализации настоящего изобретения гелеподобная структура, формирующаяся после введения аналога компстатина, имеет большую вязкость и более плотную консистенцию, чем содержимое внесосудистого пространства, в котором она формируется.
[0084] Изобретатели предположили, что включение могло бы служить уникальной системой пролонгированной доставки аналога компстатина. Было обнаружено, что включение содержит значительную фракцию введенного аналога компстатина, и что вещество сохраняет активность и постепенно высвобождается. Включение - это дискретная структура, которую легко можно отделить от материала стекловидного тела в процессе препарирования через короткое время после того, как она была сформирована, и при использовании достаточно больших концентраций. С течением времени, и/или при использовании более низких концентраций, гели становятся мягкими и не очень «плотными» и легко распадаются при манипуляции, наряду с их разрушением с течением времени. В некоторых вариантах реализации изобретения гели являются почти сферическими и по существу прозрачными. В некоторых вариантах реализации изобретения макроскопическая гелеподобная структура со временем уменьшается в размере и/или становится менее плотной (по результатам УЗИ) и высвобождает аналог компстатина в активной форме с достижением терапевтической концентрации по меньшей мере через 2 недели, по меньшей мере через 4 недели, по меньшей мере через 2 месяца, по меньшей мере через 3 месяца, по меньшей мере через 6 месяцев, по меньшей мере через 9 месяцев, по меньшей мере через 12 месяцев (например, вплоть до примерно 3, 6, 9, 12, 18 или 24 месяцев в разных вариантах реализации). Внесосудистое пространство может представлять собой отдельную камеру, компартмент или полость, которая может содержать жидкую или полужидкую субстанцию организма. Пространством может быть стекловидная камера глазного яблока, синовиальная полость, интратекальное пространство и т.д. Камера, полость или компартмент может содержать ткань, или может быть хотя бы частично выстлан тканью, на которую комплемент оказывает нежелательное действие при комплемент-опосредованном нарушении. В некоторых вариантах реализации ткань не контактирует напрямую с содержимым пространства, но находится на достаточно близком расстоянии для того, чтобы ингибитор комплемента мог диффундировать во внеклеточную жидкость, омывающую ткань. Например, ткань может быть прилежащей, например, располагаться в пределах 10-20 мм, в некоторых вариантах в пределах 5-10 мм, в пределах 1-5 мм, в пределах 0.5-1 мм, в пределах 0.1-0.5 мм, или в пределах 0.1 мм, и меньше, от выстилки компартмента; и не быть отделенной от компартмента барьером, который мог бы помешать диффузии ингибитора комплемента в ткань. Терапевтическую концентрацию можно измерять в субстанции, находящейся внутри внесосудистого пространства (например, стекловидного тела), или в выстилающей его ткани, или в прилежащих тканях.
[0085] В некоторых вариантах реализации макроскопическая гелеподобная структура остается легко обнаруживаемой по меньшей мере в течение 2 недель, по меньшей мере в течение 4 недель, по меньшей мере в течение 2 месяцев, по меньшей мере в течение 3 месяцев, по меньшей мере в течение 6 месяцев, по меньшей мере в течение 9 месяцев или по меньшей мере 12 месяцев (например, вплоть до примерно 3, 6, 9, 12, 18 или 24 месяцев в различных вариантах реализации). Необходимо понимать, что могут наблюдаться различия между субъектами, и приведенные выше оценки могут отражать средние значения для группы изучаемых субъектов. Термин «легко обнаруживаемый» означает, что включение может быть обнаружено (i) при стандартном офтальмоскопическом исследовании; (ii) в ходе препарирования без увеличения и/или (iii) на изображениях, полученных при ультразвуковом исследовании. В некоторых вариантах реализации включение имеет начальный диаметр (или самую длинную ось измерения, или наибольшее расстояние между двумя точками поверхности) примерно 5 мм, но может быть и меньше, и больше, в зависимости, например, от объема введенного жидкого состава и концентрации аналога компстатина. В некоторых вариантах реализации макроскопическая гелеподобная структура имеет диаметр хотя бы 1 мм (или самую длинную ось измерения, или наибольшее расстояние между двумя точками поверхности) по меньшей мере в течение 2 недель, по меньшей 4 недель, по меньшей мере 2 месяцев, по меньшей мере 3 месяцев, по меньшей мере 6 месяцев, по меньшей мере 9 месяцев или по меньшей мере 12 месяцев (например, вплоть до примерно 3, 6, 9, 12, 18, или 24 месяцев в различных вариантах реализации).
[0086] Как правило, внутрь включения захватывается только часть вводимого аналога компстатина. При повышении концентрации и общего количества вводимого соединения увеличивается часть вводимой дозы, выявляемая впоследствии во включении. В некоторых вариантах реализации изобретения по меньшей мере 25% вводимой изначально дозы остается внутри включения. Например, в некоторых вариантах реализации от 25% до 50%, или от 50% до 75%, вводимого аналога компстатина остается внутри включения. В некоторых вариантах реализации изобретения от 75% до 90% изначально введенного аналога компстатина остается внутри включения. Необходимо понимать, что могут быть различия между субъектами, и вышеприведенные оценки могут являться средними значениями для группы изучаемых субъектов.
[0087] Включение, безусловно, не является токсичным в применяемых дозах, не меняет нормальную физиологию глаза и не влияет на зрение. Кроме аналога компстатина оно содержит белки, в норме присутствующие в стекловидном теле. Включение сохраняется длительный период времени, в течение которого оно высвобождает аналог компстатина. Термин «высвобождать» при использовании в данной заявке в целом означает делать активный агент (например, аналог компстатина) доступным вне включения (например, внутри тела), но не подразумевает какой-либо особенный механизм, с помощью которого происходит этот процесс. Высвобождение может, например, происходить при деградации или разрушении включения, путем диффузии агента из включения и т.д. Высвобождаемый аналог компстатина сохраняет значительную активность. В некоторых вариантах реализации высвобождаемый аналог компстатина сохраняет по меньшей мере 50% активности (в расчете на моль) вводимого соединения (например, от 50% до 75%, от 75% до 95%, от 95% до 100% начальной активности).
[0088] Таким образом, включение обеспечивает депонирование аналога компстатина и предлагает новые способы его пролонгированной доставки. Предполагается, что гелеподобные включения, сходные с включениями, формирующимися после введения состава в стекловидное тело, могут формироваться в условиях in vivo, когда жидкий состав, содержащий аналог компстатина, вводится во внесосудистые пространства, содержащие жидкости организма, такие как жидкость синовиальной полости, синовиальной сумки, полости черепа, желудочков в полости черепа, интратекального пространства и т.д. Такие включения могут содержать аналог компстатина и один или более веществ, таких как ионы, белки или гликозамингликаны, присутствующие в жидкости соответствующего пространства. Также предполагается, что гелеподобные включения могут формироваться ех vivo из жидкого состава, содержащего аналог компстатина и один или более белков, ионов или гликозамингликанов, подобных или идентичных таковым, присутствующим in vivo во внесосудистом пространстве.
[0089] Изобретение также предлагает способ лечения комплемент-опосредованных нарушений, включающий этап введения жидкого состава, содержащего эффективное количество аналога компстатина, во внесосудистое пространство субъекта, где указанное эффективное количество является достаточным для формирования дискретной макроскопической гелеподобной структуры, содержащей аналог компстатина внутри указанного внесосудистого пространства. В некоторых вариантах реализации изобретения состав вводится в стекловидную камеру глазного яблока, например, путем инъекции в стекловидное тело. В некоторых вариантах реализации используется игла 27-30 G.
[0090] Изобретение также предлагает гелеподобный материал, содержащий аналог компстатина и один или более белков, ионов и/или гликозамингликанов (ГАГ), присутствующих в природных условиях во внеклеточном пространстве млекопитающих. В одном варианте реализации белки, ионы и/или гликозамингликаны в норме присутствуют в стекловидном теле. В другом варианте реализации белки, ионы и/или гликозамингликаны в норме присутствуют в синовиальной жидкости. В другом варианте реализации белки, ионы и/или гликозамингликаны в норме присутствуют в цереброспинальной жидкости (ЦСЖ). В некоторых вариантах реализации изобретения гелеподобный материал содержит по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, или более, отдельных белков и/или ГАГ. В некоторых вариантах реализации изобретения белок или ГАГ не является веществом, которое обычно используется в данной области для приготовления составов с пролонгированным высвобождением. В некоторых вариантах реализации изобретения белок или ГАГ не является терапевтическим агентом, известным в данной области.
[0091] В некоторых вариантах реализации изобретения гелеподобный материал либо присутствует в теле субъекта, либо извлечен из него. В таких вариантах гелеподобный материал может содержать белки, ионы и/или гликозамингликаны, которые являются эндогенными для этого определенного субъекта (т.е., они в норме встречаются у конкретного субъекта). В некоторых вариантах реализации гелеподобный материал формируется ex vivo. В последнем случае включение может содержать белки, ионы или гликозамингликаны, которые подобны или идентичны белкам, ионам или гликозамингликанам субъекта, которому вводится гель, но не извлечены из этого субъекта. Например, они могут быть выделены из натуральных источников, синтезированы с помощью химических технологий или технологий рекомбинантного синтеза и т.д.
[0092] В некоторых вариантах реализации изобретения аналог компстатина вводится в условиях, подходящих для формирования гелеподобного включения, в стекловидную камеру глазного яблока для лечения субъекта, находящегося в группе риска или страдающего заболеванием глаз. В некоторых вариантах реализации изобретения заболевание представляет собой такое заболевание, при котором наблюдается повышенная активация комплемента (например, повышенное содержание продуктов активации комплемента) в глазах субъектов, страдающих заболеванием, по сравнению с активацией комплемента в глазах не страдающих заболеванием индивидов. В некоторых вариантах реализации изобретения заболевание представляет собой одно из заболеваний, при которых наблюдается повышенное образование MAC в глазах страдающих заболеванием субъектов по сравнению с количеством MAC в глазах не страдающих от заболевания индивидов.
[0093] В некоторых вариантах реализации заболевание представляет собой дегенерацию желтого пятна, например, возрастную дегенерацию желтого пятна (ВДЖП). В некоторых вариантах реализации заболевание представляет собой экссудативную ВДЖП. В некоторых вариантах реализации заболевание представляет собой атрофическую ВДЖП. В некоторых вариантах реализации субъект страдает географической атрофией (ГА). В некоторых вариантах реализации субъект страдает возрастной макулопатией, которая относится к ранней или промежуточной стадии атрофической ВДЖП, при которой ГА не развивается. В некоторых вариантах реализации заболевание представляет собой диабетическую ретинопатию. В некоторых вариантах реализации заболевание представляет собой глаукому. В некоторых вариантах реализации заболевание представляет собой задний увеит или кератит. В некоторых вариантах реализации заболевание представляет собой ретинальный пигментоз. Дополнительную информацию об этих и других заболеваниях глаз можно найти в одновременно поданных заявках на патент USSN 11/247,886, USSN 11/544,389 и USSN 11/612,751, и в Kanski, J., Clinical Ophthalmology: A Systematic Approach Butterworth-Heinemann; 6 edition (May 4, 2007). В некоторых вариантах реализации состав вводится внутрь стекловидного тела, например, путем инъекций в стекловидное тело. В некоторых вариантах реализации состав вводится в переднюю камеру глаза.
[0094] Внесосудистое пространство выбирают исходя из конкретного заболевания. Например, если патологическим состоянием является артрит, ингибитор комплемента может вводиться прямо в синовиальную полость. Примеры суставов, в которые могут вводиться жидкие составы согласно изобретению, включают бедренный, коленный, локтевой, лучезапястный, грудино-ключичный, кистевой, предплюсневый, голеностопный и любой другой сустав, подверженный артритным заболеваниям. Составы также подходят для введения в суставную сумку. Примеры суставных сумок, в которые могут вводиться составы согласно изобретению, включают акромиальную, двуглаво-лучевую, кубиторадиальную, дельтавидную, интрапателлярную, седалищную и другие суставные сумки, известные специалистам в данной области. Если патологическим состоянием является повреждение позвоночника или хронические боли в позвоночнике, состав можно вводить интратекально. Если патологическим состоянием является болезнь Альцгеймера, болезнь Паркинсона или инсульт, состав можно вводить внутрь системы желудочков (например, в третий, четвертый или боковой желудочек), которая включает ряд структур в мозге, являющихся продолжением центрального спинномозгового канала. Могут использоваться известные в данной области способы введения терапевтических агентов внутрь таких пространств тела (см. ниже).
[0095] Подходящие количества аналога компстатина могут быть выбраны по меньшей мере частично на основании уровня белков комплемента и/или активации комплемента внутри интересующего внесосудистого пространства или прилежащих тканей. Определить уровень можно по результатам измерений, проведенных на группе субъектов, или же на отдельном нуждающемся в лечении субъекте. В некоторых вариантах реализации изобретения приблизительная дозировка аналога компстатина выбирается по меньшей мере частично на основе этой информации и возможно путем оценки общего количества белков комплемента с учетом приблизительного объема пространства. Например, может быть выбрана приблизительная доза аналога компстатина для достижения средней или постоянной концентрации в пространстве, достаточной для связывания по меньшей мере 50%, 60%, 70%, 80%, 90%, 95%, или более, присутствующего С3. В некоторых вариантах реализации доза выбирается для достижения средней или постоянной концентрации, большей в 1, 2, 5, 10, 20, 50 раз, или в любое количество раз от 1 до 50, большей концентрации С3. В некоторых вариантах реализации изобретения аналог компстатина высвобождается из включения с поддержанием эффективной средней или постоянной концентрации в течение пролонгированного периода времени, например, в течение 2-4 недель, 4-6 недель, 1-3 месяцев, 3-6 месяцев, 6-12 месяцев, 12-24 месяца. В некоторых вариантах реализации выбирается доза, подходящая для достижения скорости высвобождения в стекловидной камере глазного яблока примерно от 0,01 мкг/день до примерно 3-5 мкг/день, например, примерно от 0.05 мкг/день до примерно 3 мкг/день, от примерно 0.1 мкг/день до примерно 3 мкг/день, от примерно 0.5 мкг/день до примерно 3 мкг/день, от примерно 0.5 мкг/день до примерно 2 мкг/день и т.д. в течение по меньшей мере 2 недель, например, 2-4 недель, 4-6 недель, 1-3 месяцев, 3-6 месяцев, 6-12 месяцев, 12-24 месяца. В некоторых вариантах реализации выбирается доза, подходящая для достижения скорости высвобождения в стекловидную камеру глазного яблока примерно от 0.5 мкг/день до 1 мкг/день, или от примерно 1 мкг/день до примерно 3 мкг/день, по меньшей мере в течение 2 недель, например, 2-4 недель, 4-6 недель, 1-3 месяцев, 3-6 месяцев, 6-12 месяцев, 12-24 месяца.
[0096] Изобретение предлагает единицу дозирования составов, описанных в данной заявке, содержащую, как правило в емкости, достаточное количество жидкого состава (или сухого остатка, который можно смешать с жидким фармацевтическим носителем для получения жидкого состава) для оказания желаемого терапевтического действия на субъект, т.е. достаточное количество для однократного введения нуждающемуся в лечении субъекту. В одном варианте реализации единица дозирования является стерильной и лиофилизированной. В другом варианте реализации единица дозирования является стерильной и приготовленной в виде жидкости, подходящей для введения субъекту, например, путем инъекции или инфильтрации. В другом варианте реализации единица дозирования представлена суспензией или дисперсией в жидкости, подходящей для введения субъекту, например, путем инъекции, инфильтрации и т.д. В некоторых вариантах реализации жидкий состав содержит по меньшей мере 1 мг аналога компстатина на 1 мл жидкости, например, от примерно 1 мг до примерно 300 мг аналога компстатина на 1 мл жидкости. Аналог компстатина необязательно должен быть полностью растворен в жидкости, например, по меньшей мере часть аналога компстатина может присутствовать в форме частиц. В некоторых вариантах реализации концентрация аналога компстатина в составе находится в пределах от 2 мг/мл до 20 мг/мл. В некоторых вариантах реализации концентрация аналога компстатина в составе находится в пределах от 2 мг/мл до 10 мг/мл, например, от 2 мг/мл до 5 мг/мл. В некоторых вариантах реализации концентрация аналога компстатина в составе находится в пределах от 8 мг/мл до 25 мг/мл. В некоторых вариантах реализации концентрация растворенного аналога компстатина находится в пределах от 2 мг/мл до 20 мг/мл. В некоторых вариантах реализации концентрация растворенного аналога компстатина находится в пределах от 2 мг/мл до 10 мг/мл, например, от 2 мг/мл до 5 мг/мл. В некоторых вариантах реализации концентрация растворенного аналога компстатина находится в пределах от 8 мг/мл до 25 мг/мл.
[0097] В некоторых вариантах реализации аналог компстатина вводится в стекловидную камеру глазного яблока (например, путем инъекции в стекловидное тело) в концентрации, составляющей по меньшей мере 1 мг/мл, например, от 1 мг/мл до 10 мг/мл, например, от 2 мг/мл до 5 мг/мл, в объеме по меньшей мере 25 мкл. В некоторых вариантах реализации объем составляет от 25 мкл до 150 мкл, например, от 40 мкл до 125 мкл, например, от 50 мкл до 100 мкл. В некоторых вариантах реализации объем приблизительно составляет 50 мкл, например, от 45 мкл до 55 мкл. В некоторых вариантах реализации объем приблизительно составляет 100 мкл, например, от 90 мкл до 110 мкл. В некоторых вариантах реализации вводится от 50 мкг до 2 мг аналога компстатина, например, от 100 мкг до 500 мкг. В некоторых вариантах реализации вводится от 500 мкг до 1 мкг аналога компстатина. В некоторых вариантах реализации вводится от 1 мг до 1.5 мг аналога компстатина. В некоторых вариантах реализации вводится от 1.5 мг до 2.0 мг аналога компстатина.
[0098] В некоторых вариантах реализации от примерно 150 мкг до примерно 250 мкг аналога компстатина вводится в стекловидную камеру глазного яблока. В некоторых вариантах реализации от примерно 250 мкг до примерно 350 мкг аналога компстатина вводится в стекловидную камеруглазного яблока. В некоторых вариантах реализации от примерно 350 мкг до примерно 450 мкг аналога компстатина вводится в стекловидную камеру глазного яблока. В некоторых вариантах реализации от примерно 450 мкг до примерно 550 мкг аналога компстатина вводится в стекловидную камеру глазного яблока. В некоторых вариантах реализации от примерно 550 мкг до примерно 650 мкг аналога компстатина вводится в стекловидную камеру глазного яблока. В некоторых вариантах реализации от примерно 650 мкг до примерно 750 мкг аналога компстатина вводится в стекловидную камеру глазного яблока. В некоторых вариантах реализации от примерно 750 мкг до примерно 850 мкг аналога компстатина вводится в стекловидную камеру глазного яблока. В некоторых вариантах реализации от примерно 850 мкг до примерно 950 мкг аналога компстатина вводится в стекловидную камеру глазного яблока. В некоторых вариантах реализации от примерно 950 мкг до примерно 1050 мкг аналога компстатина вводится в стекловидную камеру глазного яблока. В некоторых вариантах реализации от примерно 1050 мкг до 1150 мкг аналога компстатина вводится в стекловидную камеру глазного яблока. В некоторых вариантах реализации от примерно 1150 мкг до примерно 1250 мкг аналога компстатина вводится в стекловидную камеру глазного яблока. В некоторых вариантах реализации от примерно 1250 мкг до примерно 1350 мкг аналога компстатина вводится в стекловидную камеру глазного яблока. В некоторых вариантах реализации от примерно 1350 мкг до примерно 1450 мкг аналога компстатина вводится в стекловидную камеру глазного яблока. В некоторых вариантах реализации от примерно 1450 мкг до примерно 1550 мкг аналога компстатина вводится в стекловидную камеруглазного яблока. В некоторых вариантах реализации от примерно 1550 мкг до примерно 1650 мкг аналога компстатина вводится в стекловидную камеру глазного яблока. В некоторых вариантах реализации от примерно 1650 мкг до примерно 1750 мкг аналога компстатина вводится в стекловидную камеру глазного яблока. В некоторых вариантах реализации от примерно 1850 мкг до примерно 1950 мкг аналога компстатина вводится в стекловидную камеру глазного яблока. В некоторых вариантах реализации от примерно 1950 мкг до примерно 2050 мкг аналога компстатина вводится в стекловидную камеру глазного яблока.
[0099] Как описано в Примере 3 и представлено на Фигуре 5, эксперименты показали, что можно измерить концентрацию аналога компстатина в сыворотке крови после введения его в стековидное тело. Было обнаружено, что сывороточная концентрация хорошо коррелирует с концентрацией в стекловидном теле. Изобретение предлагает способ оценки локальной концентрации аналога компстатина после его локального введения во внесосудистое пространство, включающий измерение концентрации аналога компстатина в крови после введения аналога компстатина во внесосудистое пространство и определение его локальной концентрации в указанном пространстве на основании известной корреляции между концентрацией в крови и концентрацией в укказанном пространстве. Изобретение предлагает способ определения концентрации аналога компстатина в стекловидном теле, включающий измерение концентрации аналога компстатина в крови после введения внутрь глаза (например, в стекловидное тело) аналога компстатина и определение концентрации в стекловидном теле на основании известной корреляции между концентрацией в крови и концентрацией в стекловидном теле. Такие способы предлагают удобный способ наблюдения за локальной концентрацией (например, концентрацией в стекловидном теле) аналога компстатина и получения информации, необходимой для назначения повторного лечения. Например, когда концентрация в сыворотке (и, следовательно, местная концентрация, например, в стекловидном теле) становится ниже желаемой концентрации, субъекту назначают повторное лечение. Таким образом, этот способ позволяет специалисту-практику адаптировать временной интервал между вводимыми дозами состава для лечения конкретного субъекта.
[00100] Изобретение, таким образом, предлагает способ мониторинга субъекта после местного введения (например, введения внутрь глаза) аналога компстатина. Следует понимать, что анализ может проводиться на плазме или сыворотке крови с использованием различных способов, например, с использованием способа высокоэффективной жидкостной хроматографии (ВЭЖХ), при выявлении с помощью детекции либо в ультрафиолете, либо детекции флуоресценции, совместно, или отдельно, от масс-спектрометрического анализа (ЖХ-МС).
[00101] Кроме того, было обнаружено, что гелеподобная структура выявляется с помощью ультразвукового исследования (Фигура 2). Можно наблюдать за размером и плотностью включения с течением времени, обеспечивая тем самым второй способ мониторинга субъекта для возможного назначения повторного лечения. Например, повторное лечение можно проводить, когда диаметр или плотность включения становится меньше установленного предела. Для наблюдения за размерами включения и получения информации, существенной для решения о проведении повторного лечения, можно использовать анализ сыворотки совместно с ультразвуковым исследованием, или без ультразвукового исследования.
[00102] Необходимо понимать, что аналог компстатина может формировать гелеподобное включение у некоторых субъектов, но не обязательно у всех субъектов, при определенной дозе. Также необходимо понимать, что аналог компстатина может формировать гелеподобное включение при введении в некоторые внесосудистые пространства, но не все. Доза и специфичность аналога компстатина выбираются по обстоятельствам. Например, может быть выбран такой аналог компстатина, и в такой дозе, при которой, как было показано, включения формируются по меньшей мере у 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90% или по меньшей мере у 95% субъектов (например, обезьян или людей) при введении в конкретное внесосудистое пространство.
[00103] Компстатин и его аналоги
[00104] Как описано выше, изобретение появилось хотя бы отчасти в результате случайного и неожиданного открытия того, что жидкий состав, содержащий достаточное количество и/или концентрацию активного аналога компстатина, формирует макроскопические гелеподобные структуры при введении его в стекловидную камеру глазного яблока млекопитающих. Не желая ограничиваться какой-либо теорией, изобретатели предполагают, что такое свойство могут проявлять различные аналоги компстатина. Специалист в данной области может с легкостью проверить, проявляют ли те или иные аналоги компстатина подобные свойства при введении их в стекловидную камеру глазного яблока или в другое внесосудистое пространство, основываясь на открытии, описанном в данной заявке. Аспектами изобретения являются жидкие составы, включающие такие аналоги компстатина, и способы применения таких составов для введения аналогов компстатина и возможно дополнительного активного агента. В некоторых вариантах реализации жидкий состав содержит первый и второй аналоги компстатина, где по меньшей мере один из аналогов компстатина формирует гелеподобное включение при введении его во внесосудистое пространство. В некоторых вариантах реализации жидкий состав включает аналог компстатина и второй активный агент, который не является аналогом компстатина.
[00105] Термин «аналог компстатина» при использовании в данной заявке относится к компстатину и любому его аналогу, ингибирующему комплемент. Необходимо понимать, что при использовании в настоящей заявке термина «аналог компстатина» для описания аспекта изобретения или при ссылке на аспект изобретения, изобретение включает вариант, в котором аналогом компстатина является соединение, описанное в Примерах (SEQ ID NO: 32), если иное не указано. Термин «аналог компстатина» включает компстатин и другие соединения, созданные или выявленные на основе компстатина, и ингибирующая комплемент активность которых составляет по меньшей мере 50% активности компстатина, по результатам измерений, например, с помощью какого-либо способа оценки активации комплемента, принятого в данной области, или подобных или эквивалентных по сути анализов. Способ может быть, например, основан на оценке лизиса эритроцитов, опосредованного классическим или альтернативным путем. В некоторых вариантах реализации используется ИФА анализ. Способы оценки способности соединения ингибировать активацию комплемента, среди других ссылок, описаны в международной публикации WO 2004/026328, Morikis, выше, Mallik, выше, Katragadda 2006, выше. Конкатемеры и мультимеры компстатина или его ингибирующих комплемент аналогов (с подходящей модификацией N- и/или С-конца) также используются в настоящем изобретении.
[00106] Активность аналога компстатина может быть выражена через IC50 (концентрация соединения, при которой активация комплемента подавляется на 50%), например, через определенную концентрацию в плазме, где низкий IC50 соответствует высокой активности, как показано в данной области. Активность предпочтительного для использования в настоящем изобретение аналога компстатина является по меньшей мере такой же, как активность компстатина. Некоторые модификации, как известно, снижают или блокируют ингибирующую комплемент активность и однозначно могут быть исключены из любого варианта реализации изобретения. Необходимо понимать, что точная велинина IC50, измеренная для конкретного аналога компстатина, будет варьировать в зависимости от экспериментальных условий. Могут использоваться сравнительные величины, например, полученные экспериментально, в которых IC50 определяется для множества различных соединений при по существу одинаковых условиях. В одном варианте реализации, IC50 аналога компстатина не больше, чем IC50 компстатина. В некоторых вариантах реализации изобретения активность аналога компстатина в 2-99 раз больше активности компстатина (т.е. аналог имеет IC50 меньшую, чем IC50 компстатина, в 2-99 раз). Например, активность может быть в 10-50 раз больше активности компстатина, или в 50-99 раз больше, чем активность компстатина. В некоторых вариантах реализации изобретения активность аналога компстатина в 99-264 раза больше активности компстатина. Например, активность может быть в 100, 110, 120, 130, 140, 150, 160, 170,180, 190, 200, 210, 220, 230, 240, 250, 260 или 264 раза больше, чем активность компстатина. В некоторых вариантах реализации изобретения аналог компстатина - это активный аналог компстатина, такой как аналог, имеющий активность по меньшей мере 100 раз большую активности компстатина. В некоторых вариантах реализации изобретения активность аналога компстатина по меньшей мере в 150, по меньшей мере в 200 или по меньшей мере в 250 раз больше, чем активность компстатина. В Таблице 1 приведены последовательности ряда таких аналогов. В некоторых вариантах реализации изобретение предполагает применение аналогов, активность которых в 264-300, 300-350, 350-400 или 400-500 раз больше, чем активность компстатина. Изобретение также предполагает примененние аналогов компстатина, имеющих активность, в 500 и 1000 раз большую активности компстатина.
[00107] Для различных аналогов компстатина была измерена Кd связывания с С3 при помощи метода изотермической титрационной калориметрии (Katragadda, et al., J. Biol. Chem., 279(53), 54987-54995, 2004). Связывающая, способность различных аналогов компстатина с С3 была соотнесена с их активностью с учетом того, что более низкая Kd, как известно, свидетельствует о более высокой связывающей способности. Линейная корреляция между связывающей способностью и активностью была показана для некоторых исследованных аналогов компстатина (Katragadda, 2004, выше; Katragadda 2006, выше). В некоторых вариантах реализации изобретения Кд связывания с С3 аналога компстатина принимает значения от 0.1 мкМ до 1.0 мкМ, от 0.05 мкМ до 0.1 мкМ, от 0.025 мкм до 0.05 мкМ, от 0.015 мкМ до 0.025 мкМ, от 0.01 мкМ до 0.015 мкМ или от 0.001 мкМ до 0.01 мкМ. В некоторых вариантах реализации IC50 аналога компстатина составляет от примерно 0.1 мкМ до 0.2 мкМ. В некоторых вариантах реализации IC50 аналога компстатина составляет от примерно 0.05 мкМ до примерно 0.1 мкМ. В некоторых вариантах реализации IC50 аналога компстатина составляет от примерно 0.001 мкМ до примерно 0.05 мкМ.
[00108] Соединения, «созданные или выявленные на основе компстатина» включают, но не ограничиваются, соединения, которые содержат аминокислотную цепь, последовательность которой получена путем (i) модифицирования последовательности компстатина (например, замещения одной или более аминокислот последовательности компстатина другой аминокислотой или аналогом аминокислоты, инсерции одной или более аминокислот или аналогов аминокислот в последовательности компстатина или делеции одной или более аминокислот или аналогов аминокислот в последовательности компстатина); (ii) выбора из фагового дисплея коллекции белков последовательности, в которой одна или более аминокислот компстатина случайно распределены и дополнительно еще модифицированы в соответствии с способом (i); или (iii) выявления последовательности с помощью скрининга соединений, которые конкурируют за связывание С3 или его фрагмента с компстатином или любыми его аналогами, полученными по способам (i) или (ii). Многие используемые аналоги компстатина включают гидрофобный кластер, β-поворот и дисульфидный мостик.
[00109] В некоторых вариантах реализации изобретения последовательность аналога компстатина включает последовательность, или по существу состоит из последовательности, которая получена при помощи 1, 2, 3 или 4 замен в последовательности компстатина, т.е., когда 1, 2, 3 или 4 аминокислоты в последовательности компстатина замещены другой стандартной аминокислотой или нестандартной аминокислотой. В некоторых вариантах реализации изобретения изменена аминокислота в позиции 4. В некоторых вариантах реализации изобретения изменена аминокислота в позиции 9. В некоторых вариантах реализации изобретения изменены аминокислоты в позициях 4 и 9. В некоторых вариантах реализации изобретения изменены только аминокислоты в позициях 4 и 9. В некоторых вариантах реализации изобретения изменена аминокислота в позиции 4 или 9, или, в некоторых вариантах изменены обе аминокислоты в позициях 4 и 9, и еще до 2 аминокислот, расположенных в позициях, выбранных из 1, 7, 10, 11 или 13. В некоторых вариантах реализации изобретения изменены аминокислоты в позициях 4, 7 и 9. В некоторых вариантах реализации изобретения изменена аминокислота в позиции 2 или 12, или же изменены обе аминокислоты, при условии, что соединение при этом сохраняет способность к циклизации. Такое изменение (изменения) в позиции 2 и/или 12 может быть дополнительным к изменению (изменениям) в позиции 1, 4, 7, 9, 10, 11 и/или 13. Последовательность любого из аналогов компстатина, полученная при замещении одной или более аминокислот в последовательности компстатина, также может включать до 1, 2 или 3 дополнительных аминокислот на С-конце. В одном варианте реализации дополнительная аминокислота представляет собой Gly. Последовательность любого аналога компстатина, полученная при замещении одной или более аминокислот в последовательности компстатина также может включать до 5 или до 10 дополнительных аминокислот на С-конце. Необходимо понимать, что аналоги компстатина могут иметь любые из характеристик или свойств, присущих различным вариантам, описанным в данной заявке, и характеристики или свойства, присущие любому из вариантов, могут также относиться и к любому другому варианту, описанному в данной заявке, если иное не указано или не следует из контекста. В некоторых вариантах реализации изобретения последовательность аналога компстатина включает, или по существу состоит, из последовательности, идентичной последовательности компстатина, за исключением позиций, соответствующих позициям 4 и 9 в последовательности компстатина.
[00110] Компстатин и некоторые аналоги компстатина, имеющие немного большую активность, чем компстатин, содержат только стандартные аминокислоты (к «стандартным аминокислотам» относятся глицин, лейцин, изолейцин, валин, аланин, фенилаланин, тирозин, триптофан, аспарагиновая кислота, аспарагин, глутаминовая кислота, глутамин, цистеин, метионин, аргинин, лизин, пролин, серии, трернин и гистидин). Некоторые аналоги компстатина, имеющие повышенную активность, включают одну или более нестандартных аминокислот. Используемые нестандартные аминокислоты включают однократно и множественно галогенированные (например, фторированные) аминокислоты, D-аминокислоты, гомо-аминокислоты, N-алкилированные аминокислоты, дегидроаминокислоты, ароматические аминокислоты (не относящиеся к фенилаланину, тирозину и триптофану), орто-, мета- или пара-аминобензойные кислоты, фосфоаминокислоты, метоксилированные аминокислоты и α,α-дизамещенные аминокислоты. В некоторых вариантах реализации изобретения аналог компстатина получен при замещении одной или более L-аминокислот в аналоге компстатина, описанном ранее в данной заявке, соответствующей D-аминокислотой. Такие соединения и способы их применения являются аспектом изобретения. Типичные используемые нестандартные аминокислоты включают 2-нафтилаланин(2-NaI), 1-нафтилаланин (1-NaI), 2-инданилглицин карбоксильную кислоту (2Ig1), дигидротриптофан (Dht), 4-бензоил-L-фенилаланин (Вра), 2-α-аминомасляную кислоту (2-Abu), 3-α-аминомасляную кислоту (3-Abu), 4-α-аминомасляную кислоту (4-Abu), циклогексилаланин (Cha), гомоциклогексилаланин (hCha), 4-фтор-L-триптофан (4fW), 5-фтор-L-триптофан (5fW), 6-фтор-L-триптофан (6fW), 4-гидрокси-L-триптофан (40H-W), 5-гидрокси-L-триптофан (50H-W), 6-гидрокси-L-триптофан (60H-W), 1-метил-L-триптофан (IMeW), 4-метил-L-триптофан (4MeW), 5-метил-L-триптофан (5MeW), 7-аза-L-триптофан (7aW), α-метил-L-триптофан (αMeW), β-метил-L-триптофан (βMeW), N-метил-L-триптофан (NMeW), 5-метокси-триптофан, орнитин (от), цитруллин, норлейцин, γ-глутаминовую кислоту и т.д.
[00111] В некоторых вариантах реализации изобретения аналог компстатина включает один или более аналогов Trp (например, в позиции 4 и/или 7 относительно последовательности компстатина). Типичные аналоги Trp перечислены выше. См. также Beene, et. al. Biochemistry 41: 10262-10269, 2002 (описаны, в том числе, однократно и множественно галогенированные аналоги Trp); Babitzke & Yanofsky, J. Biol. Chem. 270: 12452-12456, 1995 (описаны, в том числе, метилированный и галогенированный Trp, и другие аналоги Trp и индола); и патенты США №№6,214,790, 6,169,057, 5,776,970, 4,870,097, 4,576,750 и 4,299,838. Другие аналоги Trp включают варианты, замещенные (например, метильной группой) по а или Р углероду, и возможно также в одном или более положении индольного кольца. В качестве аналогов Trp могут использоваться аминокислоты, включающие два или более ароматических кольца, включая замещенные, незамещенные и альтернативно замещенные варианты колец. В некоторых вариантах реализации изобретения аналогом Trp, например, в положении 4 является 5-метокси, 5-метил-, 1-метил- или 1-формил-триптофан. В некоторых вариантах реализации изобретения используется аналог Trp (например, в положении 4), включающий 1-алкильную замену, например, замену низшим алкилом (например, C1-C5). В некоторых вариантах реализации используется N(α)-метил-триптофан или 5-метил-триптофан. В некоторых вариантах реализации используется аналог, включающий заместитель 1-алканоилом, например, низшим алканоилом (например, C1-C5). Примеры включают 1-ацетил-L-триптофан и L-β-триптофан.
[00112] В некоторых вариантах реализации аналог Trp имеет повышенную гидрофобность по сравнению с Trp. Например, индольное кольцо может нести замещение одной или более алкильными (например, метальными) группами. В некоторых вариантах реализации аналог Trp принимает участие в гидрофобных взаимодействиях с С3. Такой аналог Trp может быть расположен, например, в положении 4 по последовательности компстатина. В некоторых вариантах реализации аналог Trp включает компонент замещенного или незамещенного бициклического ароматического кольца или два или более компонентов замещенного или незамещенного моноциклического ароматического кольца.
[00113] В некоторых вариантах реализации аналог Trp имеет повышенную способность к образованию водородных связей с C3 по сравнению с Trp, но не имеет повышенной гидрофобности по сравнению с Trp. Аналог Trp может иметь большую полярность по сравнению с Trp и/или повышенную способность принимать участие в электростатических взаимодействиях с донором водородной связи на С3. Конкретные типичные аналоги Trp с повышенной способностью к образованию водородных связей включают электороотрицательный заместитель в индольном кольце. Такой аналог Trp может быть расположен, например, в положении 7 по последовательности компстатина.
[00114] В некоторых вариантах реализации изобретения аналог компстатина включает один или более аналогов Ala (например, в положении9 по последовательности компстатина), например, аналоги Ala, которые идентичны Ala, за исключением того, что они включают одну или более СН2 группу в боковой цепи. В некоторых вариантах реализации аналог Ala представляет собой неразветвленную однократно метилированную аминокислоту, такую как 2-Abu. В некоторых вариантах реализации изобретения аналог компстатина включает один или более аналогов Trp (например, в положении 4 и/или 7 по последовательности компстатина) и аналог Ala (например, в положении 9 по последовательности компстатина).
[00115] В некоторых вариантах реализации изобретения аналог компстатина представляет собой соединение, которое включает пептид, имеющий последовательность (X'aa)n-Gin-Asp-Хаа-Gly-(X"aa)m, (SEQ ID NO: 2), где каждый X'aa и каждый Х”аа представляет собой независимо выбранные аминокислоты или аналоги аминокислот, где Хаа представляет собой Trp или аналог Trp, и где n>1 и m>1 и n+m принимает значения между 5 и 21. Пептид имеет коровую последовательность Gln-Asp-Хаа-Gly, где Хаа представляет собой Trp или аналог Trp, например, аналог Trp, имеющий повышенную способность к образованию водородной связи с донором водородной связи по сравнению с Trp, но в некоторых вариантах реализации не имеющий повышенной гидрофобности по сравнению с Trp. Например, аналогом может быть аналог, имеющий замещение в индольном кольце Trp электроотрицательной группой, например галогеном, таким как фтор. В одном варианте реализации Хаа представляет собой 5-фтор-триптофан. Специалисту в данной области очевидно, что поскольку не доказано обратное, то любой не встречающийся в природе пептид, последовательность которого включает эту коровую последовательность, и который подавляет активацию комплемента и/или связывает С3, должен быть получен на основании последовательности компстатина. В альтернативном варианте реализации Xaa представляет собой аминокислоту или аналог аминокислоты, отличный от аналога Trp, который позволяет пептиду Gin-Asp-Хаа-Gly формировать β-поворот.
[00116] В некоторых вариантах реализации изобретения пептид имеет коровую последовательность X'aa-GIn-Asp-Хаа-Gly (SEQ ID NO: 3), где X'aa и Хаа выбраны из Trp и аналогов Trp. В некоторых вариантах реализации изобретения пептид имеет коровую последовательность X'aa-GIn-Asp-Хаа-Gly (SEQ ID NO: 3), где X'aa и Хаа выбраны из Trp и аналогов Trp и других аминокислот или аналогов аминокислот, включающих по меньшей мере одно ароматическое кольцо. В некоторых вариантах реализации изобретения коровая последовательность формирует β-поворот в пределах пептида. β-поворот может быть гибким, позволяя пептиду принимать две или более конформаций, что показано, например, с использованием метода ядерного магнитного резонанса (ЯМР-спектроскопия). В некоторых вариантах реализации X'aa представляет собой аналог Trp, который включает замещенный или незамещенный бициклический компонент ароматического кольца или два или более замещенных или незамещенных моноциклических компонентов ароматического кольца. В некоторых вариантах реализации изобретения X'aa выбран из группы, включающей 2-нафтилаланин, 1-нафтилаланин, 2-инданилглицин, карбоксильную кислоту, дигидротриптофан и бензоилфенилаланин. В некоторых вариантах реализации изобретения X'aa представляет собой аналог Trp, который имеет повышенную гидрофобность по сравнению с Trp. Например, X'aa может представлять собой 1-метилтриптофан. В некоторых вариантах реализации изобретения Хаа представляет собой аналог Trp, который имеет повышенную способность к образованию водородных связей по сравнению с Trp, но в некоторых вариантах реализации изобретения не имеющий повышенную гидрофобность по сравнению с Trp. В некоторых вариантах реализации изобретения аналог Trp, который имеет повышенную способность к образованию водородных связей по сравнению с Trp, включает модификацию индольного кольца Trp, например в положении 5, такую как замещение атома водорода атомом галогена в положении 5. Например, Хаа может представлять собой 5-фтор-триптофан.
[00117] в некоторых вариантах реализации изобретения пептид имеет коровую последовательность X'aa-Gln-Asp-Хаа-Gly-X”aa (SEQ ID NO: 4), где X'aa и Хаа каждый независимо выбран из Trp и аналогов Trp, и Х”аа выбран из His, Ala, аналогов Ala, Phe и Trp. В некоторых вариантах реализации изобретения X'aa представляет собой аналог Trp, который имеет повышенную гидрофобность по сравнению с Trp, такой как 1-метилтриптофан или другой аналог Trp, имеющий алкильный заместитель в индольном кольце (например, в положении 1, 4, 5 или 6). В некоторых вариантах реализации X'aa представляет собой аналог Trp, который включает замещенный или незамещенный бициклический компонент ароматического кольца или два или более замещенных или незамещенных моноциклических компонентов ароматического кольца. В некоторых вариантах реализации изобретения X'aa выбран из группы, включающей 2-нафтилаланин, 1-нафтилаланин, 2-инданилглицин карбоксильную кислоту, дигидротриптофан и бензоилфенилаланин. В некоторых вариантах реализации изобретения Хаа представляет собой аналог Trp, который имеет повышенную способность к образованию водородных связей с С3 по сравнению с Trp, но в некоторых вариантах реализации не имеет повышенной гидрофобности по сравнению с Trp. В некоторых вариантах реализации изобретения аналог Trp, который имеет повышенную способность к образованию водородных связей по сравнению с Trp, включает модификацию в индольном кольце Trp, например, в положении 5, такую как замещение галогеном атома водорода в положении 5. Например, Хаа может представлять собой 5-фтор-триптофан. В некоторых вариантах реализации Х"аа представляет собой Ala или аналог Ala, такой как Abu, или другую неразветвленную однократно метилированную аминокислоту. В некоторых вариантах реализации изобретения пептид имеет коровую последовательность X'aa-Gln-Asp-Хаа-Gly-X”aa (SEQ ID NO: 4), где X'aa и Хаа каждый независимо выбран из Trp, аналогов Trp и аминокислот или аналогов аминокислот, включающих по меньшей мере одну ароматическую боковую цепь, и Х”аа выбран из His, Ala, аналогов Ala, Phe, и Trp. В некоторых вариантах Х”аа выбран из аналогов Trp, ароматических аминокислот, и аналогов ароматических аминокислот.
[00118] в некоторых предпочтительных вариантах реализации изобретения аналог компстатина является циклическим. Пептид может быть циклизован с помощью связи между любыми двумя аминокислотами, одной из которых является (Х'аа)n, а другая расположена внутри (Х”аа)m. В некоторых вариантах реализации циклическая часть пептида имеет длину в 9-15 аминокислот, например, длину в 10-12 аминокислот. В некоторых вариантах реализации циклическая часть пептида имеет длину в 11 аминокислот со связью (например, дисульфидной связью) между аминокислотами в положениях 2 и 12. Например, пептид может иметь длину в 13 аминокислот со связью между аминокислотами в положениях 2 и 12, в результате циклический участок имеет длину в 11 аминокислот.
[00119] В некоторых вариантах реализации пептид включает, или состоит из последовательности X'aa1-Х'аа2-Х'аа3-Х'аа4-Gln-Asp-Xaa-Gly-X”aa1-Х”аа2-Х”аа3-Х”аа4-Х”аа5 (SEQ ID NO: 5). В некоторых вариантах реализации Х'аа4 и Xaa выбраны из Trp и аналогов Trp, и X'aa1, Х'аа2, Х'аа3, Х”аа1, Х”аа2, Х”аа3, Х”аа4, и Х”аа5 независимо выбраны из аминокислот и аналогов аминокислот. В некоторых вариантах реализации Х'аа4 и Хаа выбраны из ароматических аминокислот и аналогов ароматических аминокислот. Любой или любые из X'aa1, Х'аа2, Х'аа3, Х”аа1, Х”аа2, Х”аа3, Х”аа4 и Х”аа5 могут быть идентичны аминокислотам в соответствующих положениях последовательности компстатина. В одном варианте Х”аа1 представляет собой Ala или однократно метилированную неразветвленную аминокислоту. Пептид может быть циклизован с помощью ковалентной связи между (i) X'aa1, Х'аа2, или Х'аа3 и (ii) Х”аа2, Х”аа3, Х”аа4 или Х”аа5. В одном варианте реализации пептид циклизован с помощью ковалентной связи между Х'аа2 и Х”аа4. В одном варианте реализации ковалентно связанные аминокислоты каждая представляют собой Cys, и ковалентная связь представляет собой дисульфидную (S-S) связь. В одном варианте реализации ковалентная связь представляеет собой С-С, С-O, C-S или C-N связь. В некоторых вариантах реализации один из ковалентно связанных остатков представляет собой аминокислоту или аналог аминокислоты, имеющий боковую цепь, которая включает первичный или вторичный амин; другой ковалентно связанный остаток представляет собой аминокислоту или аналог аминокислоты, имеющий боковую цепь, которая включает группу карбоксильной кислоты, и ковалентная связь представляет собой амидную связь. Аминокислоты или аналоги аминокислот, имеющие боковую цепь, которая содержит первичный или вторичный амин, включают лизин и диаминокарбоксильные кислоты с общей структурой NH2(CH2)nCH(NH2)COOH, такие как 2,3-диаминопропиониновая кислота (dapa), 2,4-диаминобутирильная кислота (daba) и орнитин (от), где n=1 (dapa), 2 (daba), и 3 (от), соответственно. Примеры аминокислот, имеющих боковую цепь, содержащую группу карбоксильной кислоты, включают дикарбоксильные аминокислоты, такие как глутаминовая кислота и аспарагиновая кислота. Также могут использоваться такие аналоги, как бета-гидрокси-L-глутаминовая кислота.
[00120] в некоторых вариантах реализации аналог компстатина представляет собой соединение, которое включает пептид, имеющий последовательность:
[00121] Xaa1-Cys-Va1-Xaa2-Gin-Asp-Xaa2*-Gly-Xaa3-His-Arg-Cys-Xaa4 (SEQ ID NO: 6), где:
Xaa1 представляет собой Не, Val, Leu, B1-Ile, B1-Val, B1-Leu или дипептид, включающий Gly-Ile или B1-Gly-Ile, и В1 представляет собой первую блокирующую группу;
Xaa2 и Xaa2* независимо выбраны из Trp и аналогов Trp; Xaa3 представляет собой His, Ala или аналог Ala, Phe.или аналог Phe, Trp или аналог Trp;
Xaa4 представляет собой L-Thr, D-Thr, He, Val, Gly, дипептид, выбранный из Thr-Ala и Thr-Asn, или трипептид, включающий Thr-Ala-Asn, где карбоксильный конец -ОН у любого из L-Thr, D-Thr, lie, Val, Gly, Ala, или Asn возможно замещен второй блокирующей группой В2; и два Cys остатка связаны дисульфидной связью.
[00122] В других вариантах реализации Xaa1 либо отсутствует, либо представлен какой-либо аминокислотой или аналогом аминокислоты, а Xaa2, Xaa2*, Xaa3 и Xaa4 определены выше. Если Xaa1 отсутствует, то к N-концевому остатку Cys может быть присоединена блокирующая группа В1.
[00123] в другом варианте реализации Хаа4 представляет собой какую-либо аминокислоту или аналог аминокислоты, и Xaa1, Xaa2, Хаа2* и Хаа3 определены выше. В другом варианте реализации Хаа4 представляет собой дипептид, выбранный из группы, включающей Thr-Ala и Thr-Asn, где карбоксильный конец -ОН Ala или Asn возможно замещен второй блокирующей группой В2.
[00124] В любых вариантах реализации аналога компстатина из SEQ ID NO: 6 Xaa2 может представлять собой Trp.
[00125] В любых вариантах реализации аналога компстатина из SEQ ID NO: 6, Xaa2 может представлять собой аналог Trp, включающий замещенный или незамещенный компонент бициклического ароматического кольца или два или более замещенных или незамещенных компонентов моноциклического ароматического кольца. Например, аналог Trp может быть выбран из 2-нафтилаланина (2-Nal), 1-нафтилаланина (1-Nal), 2-инданилглицин карбоксильной кислоты (Ig1), дигидротриптофана (Dht) и 4-бензоил-L-фенилаланина.
[00126] В любых вариантах реализации аналога компстатина из SEQ ID NO: 6 Xaa2 может представлять собой быть аналог Trp, имеющий повышенную гидрофобность по сравнению с Trp. Например, аналог Trp может быть выбран из 1-метилтриптофана, 4-метилтриптофана, 5-метилтриптофана и 6-метилтриптофана. В одном варианте реализации аналог Trp представляет собой 1-метилтриптофан. В одном варианте реализации Xaa2 представляет собой 1-метилтриптофан, Xaa2* представляет собой Trp, Хаа3 представляет собой Ala, а другие аминокислоты идентичны соответствующим аминокислотам в последовательности компстатина.
[00127] В любом из вариантов реализации аналогов компстатина из SEQ ID NO: 6 Xaa2* может представлять собой аналог Trp, такой как аналог Trp, имеющий повышенную способность к образованию водородной связи с СЗ по сравнению с Trp, но который в некоторых вариантах реализации не имеет повышенной гидрофобности по сравнению с Trp. В некоторых вариантах реализации аналог Trp включает электроотрицательный заместитель в индольном кольце. Например, аналог Trp может быть выбран из
5-фтортриптофана и 6-фтортриптофана.
[00128] В некоторых вариантах реализации изобретения Xaa2 представляет собой Trp, и Xaa2* представляет собой аналог Trp, имеющий повышенную способность к образованию водородных связей с С3 по сравнению Trp, но который в некоторых вариантах реализации не имеет повышенной гидрофобности по сравнению с Trp. В некоторых вариантах реализации аналога компстатина из SEQ ID NO: 6 Хаа2 представляет собой аналог Trp, имеющий повышенную гидрофобность по сравнению с Trp, такой как аналог Trp, выбранный из 1-метилтриптофана, 4-метилтриптофана, 5-метилтриптофана, и 6-метилтриптофана; и Хаа2* представляет собой аналог Trp, имеющий повышенную способность к образованию водородной связи с С3 по сравнению с Trp, но который в некоторых вариантах реализации не имеет повышенной гидрофобности по сравнению с Trp. Например, в одном варианте реализации Хаа2 представляет собой метилтриптофан, и Хаа2* представляет собой 5-фтортриптофан.
[00129] В некоторых из вышеперечисленных вариантах реализации Хаа3 представляет собой Ala. В некоторых из вышеперечисленных вариантах реализации Хаа3 представляет собой однократно метилированную неразветвленную аминокислоту, например, Abu.
[00130] в некоторых вариантах реализации изобретения Хаа3 представляет собой Phe.
[00131] в некоторых вариантах реализации изобретения используется аналог компстатина из SEQ ID NO: 6, описанной выше, где Хаа2 и Хаа2* независимо выбраны из Trp, аналогов Trp, и других аминокислот или аналогов аминокислот, которые включают по меньшей мере одно ароматическое кольцо; и Хаа3 представляет собой His, Ala или аналог Ala, Phe, Trp, аналог Trp или другую ароматическую аминокислоту или аналог ароматической аминокислоты.
[00132] В некоторых вариантах реализации изобретения блокирующей группой на N- или С-конце какого-либо аналога компстатина, описанного в настоящей заявке, является любое соединение, которое предохраняет пептид от деградации, которая происходила бы в отсутствии такой группы, в крови или стекловидном теле млекопитающего (например, человека или обезьяны). Например, блокирующей группой В1 может быть любая группа, которая меняет структуру N-конца пептида так, чтобы ингибировать расщепление пептидной связи между N-концом аминокислоты пептида и соседней аминокислотой. Блокирующей группой В2 может быть любая группа, которая меняет структуру С-конца пептида так, чтобы ингибировать расщепление пептидной связи между С-терминальной аминокислотой пептида и соседней аминокислотой. Может использоваться любая подходящая блокирующая группа, известная в данной области. В некоторых вариантах реализации изобретения блокирующая группа В' включает ацильную группу (т.е., часть карбоксильной кислоты, которая остается после удаления -ОН группы), которая в настоящей заявке также называется «алканоил». Ацильная группа, как правило, включает от 1 до 12 атомов углерода, например, от 1 до 6 атомов углерода.
Например, в некоторых вариантах реализации изобретения блокирующая группа В' выбрана из следующей группы: формил, ацетил, пропионил, бутирил, изобутирил, валерил, изовалерил и т.д. В одном варианте реализации блокирующая группа В1 представляет собой ацетильную группу, т.е. Xaal представляет собой Ac-He, Ac-Val, Ac-Leu или Ac-Gly-Ile.
[00133] В некоторых вариантах реализации изобретения блокирующая группа в2 представляет собой первичный или вторичный амин (-NH2 или -NHR1, где R представляет собой органическую группу, такую как алкильная группа).
[00134] В некоторых вариантах реализации изобретения блокирующая группа В1 представляет собой любую группу, которая нейтрализует или снижает отрицательный заряд, который в отсутствии такой группы может присутствовать на N-конце при физиологических значениях рН. В некоторых вариантах реализации изобретения блокирующая группа В2 представляет собой любую группу, которая нейтрализует или снижает отрицательный заряд, который в отсутствии такой группы может присутствовать на С-конце при физиологических значениях рН.
[00135] В некоторых вариантах реализации изобретения аналог компстатина ацетилирован или амидирован на N-конце и/или С-конце, соответственно. Аналог компстатина может быть ацетилирован на N-конце, амидирован на С-конце, или же ацетилирован на N-конце и амидирован на С-конце. В некоторых вариантах реализации изобретения аналог компстатина включает не ацетильную группу, а алкильную или арильную группу на N-конце.
[00136] В некоторых вариантах реализации аналог компстатина представляет собой соединение, которое включает пептид, имеющий последовательность:
[00137] Xaa1-Cys-Va1-Хаа2-Gin-Asp-Xaa2*-Gly-Xaa3-His-Arg-Cys-Xaa4 (SEQ ID NO: 7); где:
Xaa1 представляет собой lie, Va1, Leu, Ac-He, Ac-Va1, Ac-Leu или дипептид, включающий Gly-Ile или Ac-Gly-Ile;
Xaa2 и Xaa2* независимо выбраны из Trp и аналогов Trp;
Xaa3 представляет собой His, Ala или аналог Ala, Phe или аналог Phe, Trp, или аналог Trp;
Xaa4 представляет собой L-Thr, D-Thr, He, Val, Gly, дипептид, выбранный из Thr-Ala и Thr-Asn, или трипептид, включающий Thr-Ala-Asn, где карбоксильный конец -ОН любого из L-Thr, D-Thr, lie, Val, Gly, Ala или Asn возможно замещен -NH2 группой, и два остатка Cys связаны дисульфидной связью.
[00138] Xaa1, Xaa2, Xaa2*, Xaa3, и Xaa4 определены выше для различных вариантов реализации SEQ ID NO: 6. Например, в некоторых вариантах реализации Xaa2* представляет собой Trp.В некоторых вариантах реализации Хаа2 представляет собой аналог Trp, который имеет повышенную гидрофобность по сравнению с Trp, например, 1-метилтриптофан. В некоторых вариантах реализации Хаа3 представляет собой Ala. В некоторых вариантах реализации Хаа3 представляет собой однократно метилированную неразветвленную аминокислоту.
[00139] В некоторых вариантах реализации изобретения Xaa1 представляет собой Ile, и Хаа4 представляет собой L-Thr.
[00140] В некоторых вариантах реализации изобретения Xaa1 представляет собой Ile, Хаа2* представляет собой Trp, и Хаа4 представляет собой L-Thr.
[00141] в некоторых вариантах реализации изобретения используется аналог компстатина из SEQ ID NO: 7, как описано выше, где Хаа2 и Хаа2* независимо выбраны из Trp, аналогов Trp, других аминокислот или аналогов ароматических аминокислот; и Хаа3 представляет собой His, Ala или аналог Ala, Phe или аналог Phe, Trp, аналог Trp или другую ароматическую аминокислоту или аналог ароматической аминокислоты.
[00142] в некоторых вариантах реализации какого-либо аналога компстатина, описанного в данной заявке, Xaa3 представляет собой аналог His. В некоторых вариантах реализации какого-либо аналога компстатина, описанного в данной заявке, Xaa3 представляет собой Phe.
[00143] В Таблице 1 представлен неограничивающий список аналогов компстатина, используемых в различных вариантах настоящего изобретения. Аналоги записаны в виде аббревиатур в левой колонке с указанием специфических модификаций в обозначенных положениях (1-13) по сравнению с исходным пептидом, компстатином. В соответствии с употреблением в данной области, термин «компстатин» при использовании в настоящей заявке, и активность компстатина, с которой сравниваются активности аналогов компстатина, описанных в данной заявке, относятся к пептиду компстатина, амидированному на С-конце. Если иное не указано, пептиды амидированы на С-конце. Полужирный шрифт используется для выделения некоторых модификаций. Оценки относительной активности пептидов по сравнению с активностью компстатина основаны на опубликованных данных и описанных в них анализах, (например, WO 2004/026326, Mallik, 2005; Katragadda, 2006; WO 2007/062249). В случае, если указаны ссылки на несколько публикаций, касающихся оценки активности пептидов, представлена самая последняя опубликованная оценка, и необходимо понимать, что оценки могут быть усреднены в случае расхождений между анализами. Следует также понимать, что пептиды, перечисленные в Таблице 1, при использовании в составах и способах согласно изобретению, как правило, циклизованы с помощью дисульфидной связи между двумя остатками Cys. Однако, могут использоваться другие пути циклизации пептидов.
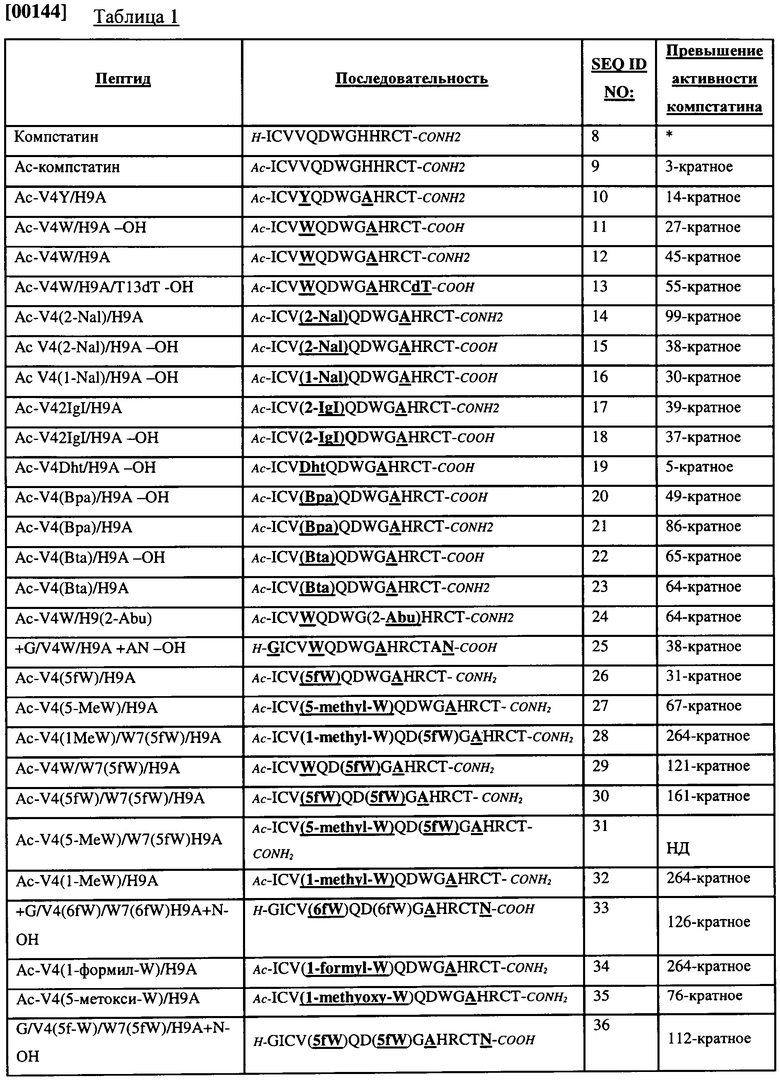
НД = нет данных
[00145] В некоторых вариантах реализации составов и способов согласно изобретению аналог компстатина имеет последовательность, выбранную из последовательностей 9-36. В некоторых вариантах реализации составов и способов согласно изобретению аналог компстатина имеет последовательность, выбранную из последовательностей SEQ ID NO: 14, 21, 28, 29, 32, 33, 34 и 36. В некоторых вариантах реализации составов и способов согласно изобретению аналог компстатина имеет последовательность SEQ ID NO: 28. В некоторых вариантах реализации составов и способов согласно изобретению аналог компстатина имеет последовательность SEQ ID NO: 29. В некоторых вариантах реализации составов и способов согласно изобретению аналог компстатина имеет последовательность, выбранную из SEQ ID NO: 30 и 31. В некоторых вариантах реализации составов и способов согласно изобретению аналог компстатина имеет последовательность SEQ ID NO: 32. В некоторых вариантах реализации составов и способов согласно изобретению аналог компстатина имеет последовательность SEQ ID NO: 33. В некоторых вариантах реализации составов и способов согласно изобретению аналог компстатина имеет последовательность SEQ ID NO: 34. В некоторых вариантах реализации составов и способов согласно изобретению аналог компстатина имеет последовательность SEQ ID NO: 36.
[00146] В других вариантах реализации используется аналог компстатина, имеющий последовательность, представленную в Таблице 1, но где Ас-группа замещена блокирующей группой В1, как описано выше. В других вариантах реализации используется аналог компстатина, имеющий последовательность, представленную в Таблице 1, но где группа - NH2 замещена блокирующей группой В2, как описано выше.
[00147] в одном варианте реализации аналог компстатина связывается по сути с тем же участком β-цепи человеческого С3, что и компстатин. В одном варианте реализации аналог компстатина представляет собой соединение, которое связывается с фрагментом С-концевого участка β-цепи человеческого С3 с молекулярным весом около 40 кДа, с которым связывается компстатин (Soulika, A.M., et al., Mol. Immunol., 35:160, 1998; Soulika, A.M., et al., Mol. Immunol. 43(12):2023-9, 2006). В некоторых вариантах реализации аналог компстатина представляет собой соединение, которое связывается с сайтом связывания компстатина, выявляемым в структуре компстатин-С3, например, кристаллической структуры, полученных с помощью методом трехмерной ЯМР-спектроскопии. В некоторых вариантах реализации аналог компстатина представляет собой соединение, способное заместить компстатин в структуре компстатин-С3 с образованием по существу таких же межмолекулярных связей с C3, какие характерны для компстатина. В некоторых вариантах реализации аналог компстатина представляет собой соединение, которое связывается с сайтом связывания пептида, имеющего последовательность, представленную в Таблице 1, например, SEQ ID NO: 14, 21, 28, 29 или 32, в структуре пептид-C3, например, кристаллической структуре. В некоторых вариантах реализации аналог компстатина представляет собой соединение, которое связывается с сайтом связывания пептида, имеющего SEQ ID NO: 30 или 31 в структуре пептид-C3, например, кристаллической структуре. В некоторых вариантах реализации аналог компстатина представляет собой соединение, которое могло бы заместить пептид с последовательностью из SEQ ID NO: 9-36, например, SEQ ID NO: 14, 21, 28, 29, 30,32, 34 или 36, в структуре пептид-C3 с образованием по существу таких же межмолекулярных связей с C3, какие характерны для пептида.
[00148] Средний специалист при использовании рутинных экспериментальных методов с легкостью определит, способен ли аналог компстатина связываться с фрагментом С-концевого участка β-цепи С3. Например, специалист в данной области может синтезировать способный к фотосшиванию вариант аналога компстатина путем включения в последовательность соединения аминокислоты, способной к фотосшиванию, такой как β-бензоил-L-фенилаланин (Вра), например, в С-концевой участок последовательности (Soulika, A.M., et al, выше). При желании можно включать возможные дополнительные аминокислоты, например, участок эпитопа, такой как FLAG или ПА, для более быстрого выявления соединения, например, с помощью метода вестерн-блоттинга. При инкубировании аналога компстатина с фрагментом активируется сшивание. Совместная локализация аналога компстатина и фрагмента С3 указывает на их связывание. Метод поверхностного плазменного резонанса также может использоваться для выявления способности связывания аналога компстатина с сайтом связывания компстатина на СЗ или его фрагменте. Для прогнозирования того, будет ли соединение образовывать по существу такие же межмолекулярные связи с C3, какие образует компстатин или пептид, имеющий последовательность одного или более пептидов из Таблицы 1, например, SEQ ID NO: 14, 21, 28, 29 или 32, или, в других вариантах реализации, SEQ Ш N0: 30 или 31, специалист в данной области может использовать программы для молекулярного моделирования.
[00149] Аналоги компстатина могут быть получены различными синтетическими способами создания пептидов, известными в данной области, путем конденсации аминокислотных остатков, например, в соответствии с способами общего синтеза пептидов, могут быть получены из соответствующих кодирующих их последовательностей нуклеиновых кислот путем экспрессии в условиях in vitro или в живых клетках с использованием способов, известных в данной области. Например, пептиды могут быть синтезированы с использованием стандартных твердофазных методов, описанных в Malik, выше, Katragadda, выше, и/или WO 2004026328. Потенциально реакционноспособные группы, такие как аминогруппы и карбоксильные группы, реакционноспособные функциональные группы и т.д., могут быть защищены с последующим снятием их защиты при помощи различных защитных групп и способов, известных в данной области. См., например, "Protective Groups in Organic Synthesis", 3rd ed. Greene, T. W. and Wuts, P.G., Eds., John Wiley & Sons, New York: 1999. Пептиды могут быть очищены с использованием стандартных методов, таких как метод обращенно-фазовой ВЭЖХ. При желании, может быть проведено разделение диастереомерных пептидов с использованием известных методов, таких как обращенно-фазовая ВЭЖХ. Составы могут быть при необходимости лиофилизированы и впоследствии растворены в подходящем растворе, например, в воде. рН конечного раствора может быть доведен, например, до физиологических значений рН с помощью основания, такого как NaOH. Пробы пептидов при необходимости могут быть проанализированы с помощью метода масс-спектрометрии, например, для подтверждения их массы и/или наличия дисульфидной связи. См., например, Mallik, 2005, and Katragadda, 2006.
[00150] Структура компстатина известна в данной области, и также известны структуры ряда аналогов компстатина, имеющих активность, большую, чем активность компстатина, которые были выявлены с помощью метода ЯМР-спектроскопии (Malik, выше). Информация о структуре может использоваться для создания миметиков компстатина. В одном варианте реализации миметиком компстатина является любое соединение, которое конкурирует с компстатином или каким-либо аналогом компстатина (например, аналогом компстатина, последовательность которого представлена в Таблице 1) за связывание с С3 или его фрагментом (таким как фрагмент β-цепи весом 40 кДа, с которым связывается компстатин), и которое имеет активность, равную или большую активности компстатина. Миметиком компстатина может быть пептид, нуклеиновая кислота или молекула с низким молекулярным весом. В некоторых вариантах реализации миметиком компстатина является соединение, которое связывается с сайтом связывания компстатина, выявляемом в структуре компстатин-C3, например, кристаллической структуре или трехмерной структуре, полученной с помощью метода ЯМР-спектроскопии. В некоторых вариантах реализации миметиком компстатина является соединение, способное заместить компстатин в структуре компстатин-C3 с образованием по существу таких же межмолекулярных связей с C3, какие образует компстатин. В некоторых вариантах реализации миметиком компстатина является соединение, которое связывается с сайтом связывания пептида, имеющего последовательность, представленную в Таблице 1, в структуре пептид-C3. В некоторых вариантах реализации миметик компстатина имеет непептидную связь, но имеет боковые цепи, представляющие собой последовательность, сконструированную на основе последовательности компстатина.
[00151] Для специалистов в данной области очевидно, что если однажды была установлена некоторая желаемая конформация короткого пептида, то можно легко подобрать способы для создания пептида или пептидомиметика с такой же конформацией. См., например, G.R.Marshall (1993), Tetrahedron, 49: 3547-3558; Hruby and Nikiforovich (1991), Molecular Conformation and Biological Interactions, P.Balaram & S.Ramasehan, eds., Indian Acad. of Sci., Bangalore, PP. 429-455), Eguchi M, Kahn M., Mini Rev Med Chem., 2(5):447-62, 2002. Конструирование аналогов пептида можно также оптимизировать при рассмотрении вклада различных боковых цепей аминокислотных остатков, например, в создание эффектов функциональных групп или стерических факторов, которые описаны в данной области для компстатина и его аналогов, наряду с другими пептидами.
[00152] Специалистам очевидно, что миметик пептида может служить так же хорошо, как и пептид, если речь о специфической каркасной конформации и функциональностях боковых цепей, необходимых для связывания с C3 и подавления активации комплемента. Таким образом подразумевается, что в рамках настоящего изобретения рассматривается получение и применение С3-связывающих ингибирующих комплемент соединений при использовании природных аминокислот, производных аминокислот и аналогов аминокислот, или молекул, не являющихся аминокислотами, способных объединяться с формированием подходящей каркасной конформации. Непептидные аналоги или аналоги, включающие пептидный и непептидный компоненты, в данной заявке иногда называются «пептидомиметиками» или «изотерическими миметиками» для описания заместителей или производных пептида, обладающих во многом такими же основными конформационными характеристиками и/или другими функциональными свойствами для того, чтобы быть достаточно похожими на типичные пептиды, подавляющие активацию комплемента. Более обобщенно, миметик компстатина является какое-либо соединение, которое имеет фармакофоры, подобные фармакофорам компстатина, даже если оно имеет другой остов.
[00153] Применение пептидомиметиков для создания высокоаффинных аналогов пептидов широко известно в данной области. Учитывая ограничения вращения, подобные таковым для остатков аминокислот в пептиде, аналоги, включающие неаминокислотные соединения, могут быть проанализированы, и их конформационные мотивы могут быть установлены, с помощью схем Рамачандры (Hruby & Nikiforovich 1991), наряду с другими известными способами. Для идентификации миметиков компстатина, которые связываются с C3, могут применяться методы виртуального скрининга. В таких методах могут использоваться подходящие алгоритмы, позволяющие соединять, сопоставлять и, если необходимо, классифицировать множество структур-кандидатов с помощью компьютера. Для проведения виртуального скрининга может использоваться любая доступная прграмма из их огромного разнообразия. Типичные программы, используемые для подвижного соединения молекул, включают DOCK 4.0, FlexX 1.8, AutoDock 3.0, GOLD 1.2, ICM 2.8 и более поздние их версии. [00154] Специалист в данной области с легкостью сможет подобрать подходящий скрининговый анализ для определения дополнительных миметиков компстатина и для отбора тех из них, которые имеют желаемые ингибиторные активности. Например, компстатин или его аналог может быть помечен (например, с помощью радиоактивной или флуоресцентной метки) и проинкубирован с C3 при различных концентрациях исследуемого соединения. Оценивается способность исследуемого соединения уменьшать связывание аналога компстатина с C3. Исследуемое соединение, которое значительно уменьшает связывание аналога компстатина с C3, является кандидатом на роль миметика компстатина. Например, исследуемое соединение, которое уменьшает равновесную концентрацию комплекса аналог компстатина-C3 по меньшей мере на 25%, или по меньшей мере на 50%, является кандидатом на роль миметика компстатина. Специалистам очевидно, что может применяться ряд вариантов этого скринингового исследования. Соединения, выбранные для скринингового анализа, могут включать природные продукты, библиотеки аптамеров, библиотеки фагового дисплея, библиотеки соединений, синтезированных при помощью комбинаторной химии и т.д. Изобретение включает создание комбинаторной библиотеки соединений на базе коровой последовательности, описанной выше, и скрининг библиотеки для выявления миметиков компстатина. Любой из этих методов также можно использовать для выявления новых аналогов компстатина, имеющих более высокую ингибиторную активность, чем ранее исследованные аналоги компстатина.
[00155] Комбинированная терапия и составы
[00156] Изобретение предлагает жидкие составы, содержащие: (а) аналог компстатина в количестве, достаточном для формирования макроскопической гелеподобной структуры после введения его во внесосудистое пространство в теле млекопитающих; и (б) дополнительный терапевтический агент, где указанный терапевтический агент не представляет собой аналог компстатина. Настоящее изобретение предполагает использование аналогов компстатина вместе с одним или более другими вторичными агентами, эффективными для лечения нарушения. Агенты могут действовать на ту же самую мишень (мишени) или путь (пути), или на другие мишени или пути. Аналог компстатина и вторичный агент могут действовать аддитивно или синергично (когда комбинированная активность агентов больше, чем сумма их активностей при раздельном введении). В некоторых вариантах реализации вторичный агент вводится для лечения нарушения, не опосредованного активацией комплемента, т.е. гелеподобная структура используется по существу как система доставки вторичного агента с его пролонгированным высвобождением. В некоторых вариантах реализации для формирования гелеподобной структуры используется пептид, включающий последовательность, выбранную из SEQ ID NO: 3, 4, 5, 6 или 7, где пептид имеет более низкую ингибирующую комплемент активность, чем компстатин. В некоторых вариантах реализации активность пептида составляет 50%, или меньше, от активности компстатина.
[00157] Вторичный агент (агенты) выбираются в соответствии с конкретным нарушением, которое необходимо лечить. Подходящие агенты включают противовоспалительные агенты, такие как кортикостероиды, нестероидные противовоспалительные агенты, лейкотриен или антагонисты рецептора лейкотриена, цитокин или антагонисты рецептора цитокина (например, анти- ФНОα агенты, такие как антитела, или растворимые рецепторы ФНОTNFα, или его фрагменты, которые связывают ФНОα), анти- IgE агенты (например, антитела или фрагменты антител, которые связываются с IgE или рецептором IgE), ингибиторы ангиогенеза, анальгетики и противоинфекционные агенты.
[00158] В некоторых вариантах реализации вторичный агент представляет собой нейропротекторный агент, или антиоксидант, или соединение, которое подавляет или замедляет цикл превращений родопсина.
[00159] В некоторых вариантах реализации изобретения дополнительный активный агент представляет собой ингибитор ангиогенеза. Используются разнообразные ингибиторы ангиогенеза. В некоторых вариантах реализации изобретения ингибитор ангиогенеза специфически связывается с одной или более изоформами или рецепторами фактора роста эндотелия сосудов (ФРЭС). Ингибитор ангиогенеза может представлять собой антитело, фрагмент антитела, полипептид, пептид, нуклеиновая кислота, аптамер или миРНК. В некоторых вариантах реализации изобретения ингибитор ангиогенеза специфически связывается с одной, несколькими или всеми изоформами или рецепторами фактора роста эндотелия сосудов (ФРЭС). В некоторых вариантах реализации вторичный терапевтический агент представляет собой гуманизированное моноклональное антитело, которое связывается с фактором роста эндотелия сосудов (ФРЭС), такое как антитело, описанное в Presta, LG, et al., Cancer Res., 57, 4593-4599 (1997), или его антиген-связывающий фрагмент, или антитело или фрагмент антитела, который связывается с тем же эпитопом. В некоторых вариантах реализации изобретения ингибитор ангиогенеза включает, или представляет собой, пептид или полипептид млекопитающих, такой как фактор, производный из пигментного эпителия (ФППЭ), ангиостатин, эндостатин и т.д., или их фрагмент, который сохраняет антиангиогенную активность. Ингибитор ангиогенеза может представлять собой ингибитор, который обычно используется для лечения ВДЖП и/или неоваскуляризации хороидеи или неоваскуляризации сетчатки, такой как Lucentis® (ранибизумаб), Avastin® (бевацизумаб) или Macugen® (натрий пегаптаниб). В некоторых вариантах реализации ранибизумаб, бевацизумаб или пегаптаниб используется в концентрации (или количестве), приблизительно в 0.5-5 раз большей, чем концентрация, некоторая для его клинического применения как единственного агента при лечении экссудативной ВДЖП. В типичных вариантах реализации количество составляет приблизительно 0.3 мг, 0.5 мг, 1.0 мг или 1.5 мг. В некоторых вариантах реализации жидкий состав, содержащий аналог компстатина и ингибитор ангиогенеза, вводится в глаз субъекта, страдающего неоваскуляризацией хороидеи и/или неоваскуляризацией сетчатки, например, субъекта, страдающего экссудативной ВДЖП. Ингибитор может быть создан, например, с помощью рекомбинантных технологий, гибридомных технологий, химического синтеза, или же выделен из природных источников.
[00160] Изобретение также предлагает способ, включающий: (а) введение субъекту-млекопитающему аналога компстатина в количестве, достаточном для формирования макроскопической гелеподобной структуры при введении его во внесосудистое пространство субъекта; и (б) введение ингибитора ангиогенеза в тело субъекта. В различных вариантах реализации изобретения ингибитор ангиогенеза может вводиться или не вводиться s в составе жидкого состава. Если ингибитор ангиогенеза вводится в составе другого состава, то он может вводиться либо в то же внесосудистое пространство, либо в другую область. При раздельном введении жидкий состав может быть введен заранее, по существу в то же время, или после введения ингибитора ангиогенеза. В некоторых вариантах реализации ингибитор ангиогенеза вводится первым, а жидкий состав согласно изобретению вводится через некоторый временной интервал. Временной интервал может быть, например, до 1, 2 или 4 недель после введения ингибитора ангиогенеза, или до 2 или 3 месяцев после введения ингибитора ангиогенеза. В некоторых вариантах реализации жидкий состав согласно изобретению вводится в глаз субъекта, страдающего ВДЖП, только после того, как у субъекта наблюдается улучшение зрения, и/или наблюдается снижение утолщения сетчатки, и/или уменьшение экссудации внутри глаза (например, при измерении с помощью оптической когерентной томографии или флуоресцентной ангиографии). Ингибитор ангиогенеза может применяться в соответствии со стандартными дозировками и способами введения для такого агента (например, способом введения в стекловидное тело).
[00161] Изобретение предлагает жидкие составы, содержащие: (а) аналог компстатина в количестве, достаточном для формирования макроскопической гелеподобной структуры при введении во внесосудистое пространство субъекта-млекопитающего; и (б) дополнительного ингибитора комплемента, где указанный дополнительный ингибитор комплемента не является аналогом компстатина. В различных вариантах реализации вторичным ингибитором комплемента является пептид, полипептид, непептидная молекула с низким молекулярным весом, аптамер, антитело или нуклеиновая кислота. В некоторых вариантах реализации изобретения вторичный агент представляет собой циклический пептид. В некоторых вариантах реализации агент представляет собой антагонист рецептора С5а (C5aR). К типичным антагонистам рецептора С5а относятся разнообразные малые циклические пептиды, такие как пептиды, описанные в патенте США No 6,821,950; USSN 11/375,587 и/или PCT/US 06/08960 (WO 2006/099330). В некоторых вариантах реализации изобретения используется циклический пептид, включающий последовательность [OPdChaWR] (SEQ ID NO: 33). В некоторых вариантах реализации изобретения используется циклический пептид, включающий последовательность [KPdChaWR] (SEQ ID NO: 37). В некоторых вариантах реализации изобретения используется пептид, включающий последовательность (Хаа)n [OPdChaWR] (SEQ ID NO: 38), где Хаа представляет собой остаток аминокислоты, и n принимает значения от 1 до 5. В некоторых вариантах реализации изобретения используется пептид, включающий (Xaa)n [KPdChaWR] (SEQ ID NO: 39), где Хаа представляет собой остаток аминокислоты, и n принимает значения от до 5. В некоторых вариантах реализации изобретения n равняется 1. В некоторых вариантах реализации изобретения n равняется 1, и Хаа представляет собой стандартную или нестандартную ароматическую аминокислоту. Например, могут использоваться пептиды F-[OPdChaWR] (SEQ ID NO: 40), F-[KPdChaWR] (SEQ ID NO: 41), Cin-[OPdChpWR] (SEQ ID NO: 42) и HCin-[OPdChaWR] (SEQ ID NO: 43). Возможно, свободный конец содержит блокирующую группу, например, терминальная аминокислота может быть ацетилирована. (Аббревиатуры: О - орнитин; Cha - циклогексилаланин; Cin - циннамоил; Hcin - гидроциннамоил; квадратные скобки обозначают внутренние пептидные связи).
[00162] Состав, содержащие частицы
[00163] В некоторых вариантах реализации жидкий состав в дополнение к достаточному для формирования гелеподобной структуры количеству аналога компстатина содержит множество частиц, которые включают терапевтический агент, при этом состав способен высвобождать терапевтический агент. Такие составы и гели, содержащие такие составы, являются аспектом изобретения. Частицы могут быть, например, микрочастицами или наночастицами. Микрочастицы или наночастицы могут представлять собой частицы, созданные на основе полимера (например, содержащие синтетические органические полимеры, полипептиды и т.д.), частицы, созданные на основе липидов, или липид-содержащие частицы, таких как липосомы, ниосомы, мицеллы и т.д. В некоторых вариантах реализации изобретения терапевтический агент представляет собой ингибитор комплемента. Частицы сохраняются в гелеподобной структуре и высвобождаются со временем в процессе разрушения или растворения гелеподобной структуры. Частицы, включенные в гель, могут хотя бы частично разрушаться или растворяться. Ингибитор комплемента может представлять собой аналог компстатина, который может являться либо таким же аналогом компстатина, который формирует гелеподобную структуру, либо другим аналогом компстатина. Другие используемые терапевтические агенты рассмотрены выше.
[00164] Наночастицы или микрочастицы могут быть созданы с использованием любого из способов, известных в данной области, включающих, но не ограничивающихся, способами распылительной сушки, фазового разделения, одинарного или двойного эмульсионного испарения растворителя, экстракции растворителя и простой или комплексной коацервации. Дисперсные полимерные составы также могут быть получены с помощью грануляции, экструзии и/или сферонизации. См., например, публикацию заявки на патент США No. 20040092470. Способы создания липосом и других основанных на липидах частиц известны в данной области. В некоторых вариантах реализации частицы состоят по существу из одного или более аналогов компстатина. В некоторых вариантах реализации частицы состоят по меньшей мере на 50% из аналога (аналогов) компстатина по сухому весу. Возможно, такие частицы могут содержать одно или более вспомогательных веществ.
[00165] Состав может содержать наночастицы или микрочастицы, имеющие различные составы и/или свойства. Условия, используемые для получения частиц, могут быть подобраны для получения частиц с необходимыми размерами или свойствами (например, гидрофобностью, гидрофильностью, внешней морфологией, плотностью, твердостью, «липкостью», формой и т.д.). Используемый способ получения частицы и используемые условия (например, растворитель, температура, концентрация, скорость потока воздуха и т.д.) могут также зависеть от терапевтического агента и/или состава полимерной матрицы. Как правило, желательно избегать крайних температур или значений рН, которые могут приводить к значительной деградации ингибитора комплемента. Очевидно, что степень деградации может зависеть и от некоторых условий,' и от времени, в течение которого ингибитор комплемента подвергается этим условиям, также как и от структуры и свойств самого агента. Например, стабильный пептид, такой как аналог компстатина, может иметь значительные преимущества. Составы можно тестировать на предмет сохранения достаточной эффективности при получении их с помощью выбранного способа. В некоторых вариантах реализации использование выбранной технологии согласно способу приводит к получению состава, который, следуя технологии, сохраняет по меньшей мере 10%, предпочтительно 20%, 50%, или более, от активности исходного соединения.
[00166] Используемый способ получения частицы и условия (например, растворитель, температура, концентрация, скорость потока воздуха и т.д.) могут также зависеть от некоторых активных агентов и других компонентов, включенных в состав. Если частицы, полученные одним из перечисленных выше способов, имеют размер, выходящий за рамки желаемых размеров, частицы могут быть откалиброваны по размеру, например, путем просеивания, перетирания и т.д. Могут применяться комбинации способов.
[00167] Микрочастицы и наночастицы, используемые в изобретении, могут иметь диапазон величин. В целом, микрочастицы имеют диаметр 500 микрон, или меньше, например, от 1 мкм до 500 мкм, от 50 мкм до 500 мкм, от 100 мкм до 250 мкм, от 20 мкм до 50 мкм, от 1 мкм до 20 мкм, от 1 мкм до 10 мкм и т.д.; а наночастицы имеют диаметр меньше 1 микрона, например, от 10 нм до 100 нм, от 100 нм до 250 нм, от 100 нм до 500 нм, от 250 нм до 500 нм, от 250 нм до 750 нм, от 500 нм до 750 нм. В некоторых вариантах реализации микрочастицы имеют диаметр в диапазоне от 5 до 750 микрометров. В некоторых вариантах реализации микрочастицы имеют диаметр в диапазоне от 10 до 500 микрометров. В некоторых вариантах реализации микрочастицы имеют диаметр в диапазоне от 20 до 200 микрометров. В некоторых вариантах реализации наночастицы имеют диаметр в диапазоне от 5 до 750 нанометров. В некоторых вариантах реализации наночастицы имеют диаметр в диапазоне от 10 до 500 нанометров. В некоторых вариантах реализации наночастицы имеют диаметр от 20 до 200 нанометров. В некоторых вариантах реализации размер частиц выбирают с целью уменьшения или предотвращения их транспорта через стенки капилляров, таким образом максимально снижая вероятность их выхода в сосудистую систему.
[00168] В некоторых вариантах реализации микрочастицы или наночастицы формируются из полимера, выбранного из группы, состоящей из гиалуроновой кислоты, хитозана, коллагена, желатина, альгината, поли(лактидов), поли(гликолидов), поли(лактид-со-гликолидов), поли(молочных кислот), поли(гликолиевых кислот), поли(молочная кислота-со-гликолиевая кислоты), поликапролактона, поликарбонатов, полиэфирамидов, полиангидридов, поли(аминокислот), поли(ортоэфиров), полиацетилов, полицианоакрилатов, полиэфирэстеров, поли(диоксанонов), поли(алкиленалкилатов), сополимеров полиэтиленгликоля и полиортоэфира, биодеградируемых полиуретанов, их смесей и сополимеров. Например, полимер может представлять собой полимолочная кислота (ПМК), полигликоевая кислота (ПГК) или поли(молочная кислота-со-гликоевая кислота). Частицы могут быть по существу одинаковыми по размеру (например, диаметру) или форме, или могут быть гетерогенными по размеру и/или форме. Они могут быть по существу сферическими, или могут иметь другие формы, в последнем случае размер частицы определяется не по диаметру, а по самому большому прямому расстоянию между двумя точками на поверхности частицы. Множество частиц может быть представлено примерно от 20% до 100% частиц, попадающих в рамки любых из перечисленных диапазонов величин, например, примерно 40%, 50%, 60%, 70%, 80%, 90% и т.д.
[00169] Жидкие составы и способы их получения
[00170] В целом, ингибиторы комплемента и другие терапевтические агенты получают при использовании стандартных способов, известных в данной области и подходящих для соединений этого класса. Пептиды, такие как аналоги компстатина, и другие пептиды, описанные в данной заявке, могут быть получены с использованием стандартных технологий твердофазного синтеза пептидов. Например, аналог компстатина может быть создан при помощи метода твердофазного синтеза защищенного пептида при использовании Fmoc-химии с выделением пептида из полимера и удалением защитных групп боковых цепей, наряду с образованием дисульфидных связей между Cys2 и Cysl2, с последующим очищением и превращением окисленных пептидов в ацетатную форму. При необходимости, основной продукт лиофилизируется. Производители пептидов включают такие компании, как Advanced Chemtech, Ambiopharm, American Peptide, Dalton Pharma Services, GenScript, Integrated Biomolecule, Lonza, New England Peptide, Peptide 2.0, Synthetech и т.д. Рекомбинантные полипептиды могут быть получены при использовании стандартных рекомбинантных технологий нуклеиновых кислот, как описано, например в USSN 11/247,886 и PCT/US 2005/36547 (WO 2006042252). Для более подробной информации относительно получения рекомбинантных полипептидов и очищения полипептидов, см., например, Hardin, С., et al., (Eds.), "Cloning, Gene Expression and Protein Purification: Experimental Procedures and Process Rationale", Oxford University Press, Oxford, 2001. Антитела, например, моноклональные антитела, могут быть получены от гибридом или созданы при помощи рекомбинантных способов, известных в данной области. Нуклеиновые кислоты, например миРНК, аптамеры и т.д., синтезируются с использованием стандартных способов. Химические модификации, такие как конъюгирование с ПЭГ, могут быть получены с использованием стандартных способов.
[00171] Жидкий состав согласно настоящему изобретению содержит аналог компстатина и фармацевтически приемлемый носитель. Термин «фармацевтически приемлемый носитель» относится к нетоксичному носителю, который не подавляет фармакологическую активность соединения, носителем которого он является. Фармацевтически приемлемые носители, или разбавители, которые могут использоваться в составах согласно изобретению, включают жидкости, такие как вода, физиологический раствор и т.д., но не ограничиваются ими. В некоторых вариантах реализации изобретения фармацевтически приемлемый носитель представляет собой воду. В некоторых вариантах реализации рН жидкого состава принимает значения от 3.5 до 6.5. В некоторых вариантах реализации рН жидкого псостава принимает значения от 4.0 до 4.5. В некоторых вариантах реализации рН жидкого состава принимает значения от 4.5 до 5.0. В некоторых вариантах реализации рН жидкого состава принимает значения от 5.0 до 5.5. В некоторых вариантах реализации рН жидкого состава принимает значения от 5.5 до 6.5.
[00172] В некоторых вариантах реализации изобретения жидкий состав может содержать различные дополнительные компоненты. Например, могут быть включены буферы, модификаторы рН, растворители, агенты, регулирующие осмолярность (например, сахара) и т.д. Могут использоваться стандартные вспомогательные вещества, известные в данной области. В некоторых вариантах реализации аналог компстатина растворен в жидкости, например, в воде, к которой были добавлены один или более буферов или вспомогательных веществ. Например, может использоваться раствор, содержащий такое вспомогательное вещество, как аминокислота, или многоатомный спирт (например, сахарный спирт), и/или буфер. Аналог компстатина добавляется в форме порошка и растворяется. При необходимости раствор фильтруется.
[00173] Могут использоваться фармацевтически приемлемые соли аналога компстатина, такие как производные фармацевтически приемлемых неорганических или органических кислот и оснований. Кроме того, необходимо понимать, что изобретение включает сольваты, гидраты, энантиомерные формы, конформации, таутомеры, полиморфные формы и т.д. активных агентов, описанных в данной заявке. В некоторых вариантах реализации аналог компстатина в качестве противоиона включает ацетат.
[00174] Количество и концентрация аналога (аналогов) компстатина в составе может варьироваться в зависимости от ряда факторов, включающих, но не ограничивающихся, степенью идентичности аналога (аналогов) компстатина, конкретным патологическим состоянием и его тяжестью и т.д., при условии, что такие количество и концентрация являются достаточными для формирования макроскопической гелеподобной структуры при введении состава. Длительность высвобождения можно регулировать с помощью выбора подходящего количества и/или концентрации вводимого аналога компстатина. Также необходимо понимать, что минимальное количество и/или концентрация аналога компстатина, необходимое для формирования макроскопического гелеподобного включения, может различаться в зависимости от таких факторов, как вид субъекта, возраст субъекта и т.д. Специалист в данной области с легкостью сможет подобрать подходящие значения. Кроме того, состав не обязательно должен формировать гелеподобное включение в теле каждого субъекта, подверженного его действию.
[00175] В некоторых вариантах реализации изобретение предлагает состав, содержащий аналог компстатина, где состав характеризуется тем, что после введения его в стекловидное тело примата он формирует гель, который остается обнаруживаемым с помощью ультразвукового и/или офтальмологического исследования по меньшей мере в течение 3 месяцев и по меньшей мере в 75% (например, по меньшей мере в 80%, по меньшей мере в 85%, по меньшей мере в 90%, по меньшей мере в 95%, или больше) глаз, в которые был введен состав. В некоторых вариантах реализации изобретение предлагает состав, содержащий аналог компстатина, где состав характеризуется тем, что после введения его в стекловидное тело примата состав формирует гель, который остается обнаруживаемым с помощью ультразвукового и/или офтальмологического исследования в течение по меньшей мере 6 месяцев по меньшей мере в 75% глаз, в которые был введен состав. В некоторых вариантах реализации изобретение предлагает состав, содержащий аналог компстатина, где состав характеризуется тем, что после введения его в стекловидное тело примата состав формирует гель, который остается обнаруживаемым. с помощью ультразвукового и/или офтальмологического исследования в течение по меньшей мере 9 месяцев по меньшей мере в 75% глаз, в которые был введен состав. В некоторых вариантах реализации приматом является обезьяна, например, яванская макака. В некоторых вариантах реализации приматом является человек. В некоторых вариантах реализации изобретения гель становиться необнаруживаемым с помощью ультразвука через 12, 15, 18 или 24 месяца после введения по меньшей мере в 75% (например, по меньшей мере в 80%, по меньшей мере в 85%, по меньшей мере в 90%, по меньшей мере в 95%, или больше) глаз. В некоторых вариантах реализации гель высвобождает от 1 мкг до 5 мкг аналога компстатина в день, например, примерно 3 мкг в день, в течение по меньшей мере 3 месяцев, например, в течение 3-6, 6-9 или 9-12 месяцев.
[00176] Изобретение предлагает жидкие составы, содержащие аналог компстатина и одно или более вспомогательных веществ или буферов. В некоторых вариантах реализации вспомогательное вещество представляет собой аминокислоту. В некоторых вариантах реализации аминокислота представляет собой аргинин, гистидин или серии. В некоторых вариантах реализации вспомогательное вещество представляет собой «сахарный спирт» (также называемый «многоатомный спирт»). В некоторых вариантах реализации вспомогательное вещество выбрано из группы, включающей гликоль, глицерин, эритрит, арабит, ксилит, рибит, маннит, сорбит, изомальт, мальтит и лактит. В некоторых вариантах реализации вспомогательное вещество присутствует в концентрации от 1 мМ до 250 мМ, например, от 10 мМ до 100 мМ, или от 10 мМ до 50 мМ, например, приблизительно 20-45 мМ. В некоторых вариантах реализации состав содержит два или более вспомогательных вещества. В некоторых вариантах реализации буфер выбран из ацетатного буфера и фосфатного буфера. В некоторых вариантах реализации буфер представляет собой ацетат натрия. В некоторых вариантах реализации концентрация буфера принимает значения от 10 мМ до 1М, например, от 20 мМ до 500 мМ, например, от 50 мМ до 200 мМ.
[00177] Как описано в Примере 4, было обнаружено, что присутствие определенных вспомогательных веществ и/или буферов в жидком составе приводит к формированию гелей, которые имеют различную и более нежную консистенцию, отличную от гелей, сформированных из состава, содержащего такое же количество аналога компстатина и только воду. Кроме того, такие гели исчезают через меньшее время после введения состава в стекловидное тело, чем гели, сформированные из состава, содержащего такое же количество аналога компстатина и только воду. Изобретатели показали, что использование таких вспомогательных веществ и буферов позволяет модулировать различные физические свойства геля и скорость, с которой аналог компстатина высвобождается из геля в условиях in vivo. Изобретение предлагает способ модулирования скорости высвобождения аналога компстатина из геля, содержащего указанный аналог компстатина, способ включает приготовление указанного аналога компстатина в составе жидкого состава, содержащего вспомогательное вещество или буфер, где присутствие вспомогательного вещества или буфера модулирует (например, увеличивает или уменьшает) скорость, с которой сформированный после введения состава в условиях in vivo гель растворяется или деградирует.
[00178] Одним из аспектов изобретения является открытие того, что применение вспомогательных веществ, которые увеличивают скорость растворения/разрушения геля в условиях in vivo, позволяет вводить повышенные количества и/или повышенные концентрации аналога компстатина без формирования при этом слишком стабильного для высвобождения желаемых количеств аналога компстатина с течением времени геля.
[00179] Оценка ингибирующей комплемент способности
[00180] Для анализа способности агента подавлять активацию системы комплемента (или какого-либо из других важных свойств) может использоваться любой подходящий метод. Ряд анализов может проводиться в условиях in vitro. Например, способность агента подавлять классический или альтернативный путь комплемента можно оценить путем измерения опосредованного комплементом гемолизиса эритроцитов (например, эритроцитов кролика или овцы, сенсибилизированных или не сенсибилизированных к антителу) при добавлении человеческой сыворотки или набора компонентов комплемента в присутствии или отсутствии агента. Агент способен подавлять комплемент, если в таком анализе он снижает гемолизис до статистически значимого уровня (p<0.05). Способность агента связываться с одним или более компонентами комплемента, такими как C3, С5, фактором В, фактором D, можно анализировать с помощью изотермической титрационной калориметрии или других методов, подходящих для их проведения в жидкой среде. В другом варианте реализации способность агента связываться с компонентом комплемента измеряется при помощи ИФА анализа. Например, лунки титрационного микропланшета покрываются агентом. Ингибитор комплемента можно функционализировать для того, чтобы ускорить связывание его с планшетом. Например, агент может быть биотинилирован в случае использования покрытого стрептавидином планшета. Компонент (компоненты) комплемента добавляются в лунки. После инкубационного периода лунки промываются, и связанные компоненты комплемента выявляются с помощью антител к интересующему компоненту комплемента. К другим методам относятся поверхностный плазменный резонанс, равновесный диализ и т.д.
[00181] Методы измерения системной или локальной активации комплемента в условиях in vitro или in vivo и методы оценки способности ингибитора комплемента подавлять такую активацию известны в данной области. Например, измерение количества продуктов активации комплемента, таких как C3a, С5а, C3bBb, C5b-9, ковалентные связи между узнаваемой молекулой классического пути (C1q) и активированным С4, и т.д., позволяет оценить степень активации комплемента. Уменьшение количества таких продуктов указывает на подавление активации комплемента в некоторых вариантах реализации изобретения. В некоторых вариантах реализации измеряется соотношение между активным продуктом расщепления и его неактивной desArg формой (например, C3a/C3adesArg). Специалист может отличить активацию классического, альтернативного и лектинового путей при измерении правильно выбранного продукта (продуктов) активации комплемента и/или выборе подходящих активаторов комплемента, таких как зимозан, липополисахарид, иммунные комплексы и т.д. Другие методы включают измерение опосредованного комплементом гемолизиса красных кровяных телец в результате формирования терминального комплекса.
[00182] Активацию комплемента в условиях in vivo и/или ее подавление ингибиторами комплемента можно измерить в соответствующей биологической пробе. Например, системную активацию комплемента и/или ее подавление ингибитором комплемента можно измерить в пробе крови или плазмы крови. Локальную активацию и/или ее подавление в стекловидном теле можно измерить в пробе стекловидного тела. Локальную активацию и/или ее подавление в дыхательных путях можно измерить в образце мокроты. Локальную активацию и/или ее подавление в ЦНС можно измерить в образце ЦСЖ. Серийные измерения, начатые до момента введения ингибитора комплемента, позволяют оценить степень подавления активации комплемента ингибитором, а также динамику и продолжительность ингибирования. Очевидно, что об уменьшении продуктов активации можно говорить только в случае наблюдаемого снижения количества продуктов активации, обнаруживаемых до введения ингибитора комплемента, или их исчезновения.
[00183] Подходящие методы описаны в ряде ссылок, приведенных в данной заявке (патент США No 5,157,110; 6,551,595; патент США. No 6,319,897; WO 2004/026328 (PCT/US 2003/029653), USSN 10/937,912; Morikis, 2004; Mallik, 2005; Katragadda, M., 2006).
[00184] Мониторинг деградации гелеподобного включения, содержащего аналог компстатина
[00185] Как отмечено выше, определенные гелеподобные включения согласно настоящему изобретению выявляются in vivo с помощью ультразвука. При необходимости, деградацию включения также можно оценивать при введении контрастного вещества в жидкий состав, приготовленный для введения. При использовании в данной заявке термин «контрастное вещество» относится к веществу, например, молекуле или надмолекулярному комплексу, которое может быть выявлено при его наличии in vivo с использованием особого метода или методов. Как правило, метод выявления является внешним и неинвазивным, т.е., метод не включает повреждения кожи или другой доступной поверхности тела, или проникновения внутрь тела. В некоторых вариантах реализации выявление контрастного вещества может быть использовано для оценки массы или объема состава для пролонгированной доставки или устройства пролонгированной доставки, которое сохраняется в течение времени «X» после введения; и/или для оценки массы или объема состава для пролонгированной доставки или устройства пролонгированной доставки, которое деградирует в течение времени «X» после введения. Если выявляется, что ранее определенная масса (или объем) состава уменьшилась или осталась в прежнем состоянии, субъекту можно провести повторное лечение в течение соответствующего периода времени. Например, проведение повторного лечения может быть назначено через 1, 2, 3 или 4 недели с того момента, когда выявляется, или ожидается, что состав для пролонгированной доставки деградировал по меньшей мере на 70%, 80%, 90%, 95%, 99% или 100%. Метод выявления контрастного вещества может альтернативно или дополнительно использоваться для оценки количества терапевтического агента, который сохраняется в составе для пролонгированной доставки или устройства пролонгированной доставки, т.е. еще не высвободился.
[00186] Способы лечения и выбор субъекта
[00187] Изобретение предлагает способы лечения субъекта, включающие введение жидкого состава, содержащего аналог компстатина, во внесосудистое пространство субъекта в количестве, достаточном для формирования макроскопического гелеподобного включения. Способы согласно изобретению могут включать выбор субъекта, которому будет вводиться состав согласно изобретению. Субъект, как правило, находится в группе риска или страдает дегенерацией желтого пятна, например, возрастной дегенерацией желтого пятна. В некоторых вариантах реализации субъект страдает по меньшей мере одним комплемент-опосредованным заболеванием, для которого характерно воспаление глаза. В некоторых вариантах субъект находится в группе риска или страдает по меньшей мере одним комплемент-опосредованным заболеванием, помимо заболевания глаза, для которого характерна дегенерация желтого пятна или воспаление глаза.
[00188] Состав, как правило, вводится субъекту с целью лечения нарушения или предупреждения развития такого нарушения. Таким образом, субъект, как правило, находится в группе риска или страдает от такого состояния. Для идентификации субъекта, находящегося в группе риска или страдающего от нарушения, представляющим интерес согласно данной заявке, могут быть использованы любые подходящие исследования и критерии. Способы диагностики заболеваний, представляющих интерес согласно данной заявке, и способы оценки ответной реакции на терапию известны в данной области.
[00189] В некоторых вариантах реализации изобретения способ лечения включает выявление у субъекта генетического полиморфизма, связанного с развитием заболевания Или повышенным риском развития заболевания. Термин «выявление» в данном случае относится к установлению того факта, что субъект обладает полиморфизмом, который увеличивает риск развития заболевания, либо путем проведения или обработки подходящего исследования, либо при использовании результатов исследования, проведенного или обработанного другими, где исследование показывает, обладает ли субъект полиморфизмом. Следует понимать, что успешно проведенное генетическое исследование не обязательно должно быть точным на 100%. Полиморфизм может быть внутри гена, который кодирует компонент комплемента.
[00190] Результаты генетических исследований показали связь между некоторыми аллелями генов, кодирующих различные связанные с комплементом белки, и предрасположенностью к развитию ВДЖП и/или повышенной вероятностью развития осложнений от ВДЖП. Аллель, которая связана с повышенной вероятностью развития заболевания или патологического состояния, и/или повышенной вероятностью развития осложнения заболевания или патологического состояния, или повышенной вероятностью неблагоприятного исхода заболевания или патологического состояния, называется в настоящей заявке «аллелью риска» данного заболевания или патологического состояния; а ген называется «модификатором риска» данного заболевания или патологического состояния. Некоторые аллели риска являются аллелями генов, которые кодируют фактор комплемента Н (CFH), где аллели обладают полиморфизмом, приводящим к появлению изоформы CFH, которая содержит His вместо Tyr в положении 402 (Tyr 402 His полиморфизм). Не желая ограничиваться какой-либо теорией, изобретатели предполагают, что Tyr402His вариант CFH может быть менее эффективным в контроле активации комплемента и/или может иметь измененную тканевую локализацию, неблагоприятно влияя на способность ткани контролировать комплемент. В результате последующих исследований было обнаружено, что другие изоформы CFH тесно связаны с риском развития ВДЖП (Klein, R.J. et al. Complement Factor H Polymorphism in Age-Related Macular Degeneratipn. Science (2005); Edwards, A.O. et al. Complement Factor H Polymorphism and Age-Related Macular Degeneration. Science (2005); Haines, J. L. et al. Complement Factor H Variant Increases the Risk of Age-Related Macular Degeneration. Science (2005). Кроме того, было показано, что варианты генов, кодирующих белки комплемента С2, С3, фактор В, С7 и MBL-2, также связаны с риском развития ВДЖП (Gold, В. et al. Variation in factor В (BF) and complement component 2 (С2) genes is associated with age-related macular degeneration. Nat. Genet. 38, 458-462 (2006); Dinu, V. et al. Evidence for Association between Multiple Complement Pathway Genes and AMD. Genet. Epidem. 31, 224-237 (2007) Yates, J.R.W., Complement СЗ Variant and the Risk of Age-Related Macular Degeneration, N. Engl. J. Med., 357: 19-27, 2007). Помимо этого, было показано, что некоторые варианты генов, кодирующих CPHR1, CFHR3 и CFI, связаны с риском развития ВДЖП. Могут использоваться способы, хотя бы отчасти основанные на выявлении таких вариантов.
[001911 Настоящее изобретение включает анализ генотипа субъекта на предмет любых вариантов генов и/или полиморфизмов, описанных в вышеуказанных ссылках, или вариантов любого другого гена (генов), кодирующего связанные с комплементом белки (см. выше); и идентификацию подходящего субъекта для введения жидкого состава, содержащего аналог компстатина, хотя бы отчасти на основании результатов указанных анализов (например, состав будет вводиться субъекту, если результаты анализа указывают на то, что субъект находится в группе повышенного риска развития или проявления комплемент-опосредованного заболевания, например, ВДЖП). Следует понимать, что полиморфизмы, например, SNP, могут быть в неравновесном сцеплении (LD) с другими полиморфизмами, например, другими SNP, расположенными на той же хромосоме. Такие SNP могут присутствовать в гаплотипах. Например, некоторые SNP могут быть связаны на протяжении до 100 т.п.н. или даже 150 т.п.н., и более (Reich, D.E., et al.. Nature, 411, 199-204, 2001). Таким образом, в некоторых вариантах способы согласно изобретению включают определение того, содержит ли гаплотип индивида по меньшей мере один полиморфный вариант, связанный с повышенным риском развития комплемент-опосредованных заболеваний, где указанный полиморфизм находится в гене, связанном с комплементом. В некоторых вариантах гаплотип включает кодирующий Tyr 402 His вариант гена CFH. В некоторых вариантах гаплотип не включает кодирующий Tyr402His вариант гена CFH (см., например, Li, et al., выше).
[00192] Генотип индивида можно определить с использованием различных методов. Применение определенного метода не является критичным для настоящего изобретения, и нет необходимости подробно его описывать в данной заявке; такие методы хорошо известны в данной области. Методы, как правило, используют биологический образец, полученный от индивида, где образец содержит нуклеиновые кислоты и/или белки. При использовании в данной заявке термин «биологический образец» относится к любому из нижеперечисленного: клетка или клетки, участок ткани, жидкость тела, такая как кровь, моча, слюна, цереброспинальная жидкость и т.д. Термин «биологический образец» также относится к любому материалу, полученному при обработке биологического материала, соответствующего предыдущему определению, например, при изолировании или очистки ДНК, РНК и/или белка из образца, при амплификации образца или его части, при переваривании рестрикционными ферментами и т.д. Как правило, используется образец крови или тканевой образец. Методы могут включать анализ ДНК индивида на предмет содержания интересующей аллели или полиморфизма. Также может использоваться РНК, если интересующий полиморфизм находится в транскрибируемом участке гена. В некоторых вариантах методы включают идентификацию особых нуклеотидов, где полиморфизм (полиморфизмы) в положении таких нуклеотидов связан с повышенным риском неблагоприятного исхода заболевания и/или с предрасположенностью к ВДЖП или другому комплемент-опосредованному заболеванию.
[00193] Методы проведения таких тестов хорошо известны в данной области и включают, например, изолирование ДНК или РНК, возможную их амплификацию (например, с помощью цепной полимеразной реакции (ПНР) или ПЦР с обратной транскрипцией) и ряд методов, таких как аллель-специфическая элонгация праймера, аллель-специфическая гибридизация, переваривание рестрикционными ферментами, секвенирование и т.д. В некоторых вариантах реализации генотипирование проводится с использованием микрочипа или «чипа». В некоторых вариантах реализации генотипирование проводится при помощи анализов, использующих гранулы, например, с помощью платформы Luminex. К другим используемым методам относятся лигирование олигонуклеотидных зондов (патенты США No. 5,185,243, 5,679,524, 5,573,907), анализ деградации, анализ меченых гетеродуплексов (АМГ) и т.д. Примеры включают анализ Taqman® assay. Applied Biosystems (патент США No. 5,723,591). Технология циклирующей гибридизационной пробы (ТЦГП), которая представляет собой систему для определения нуклеиновых кислот, основанную на амплификации сигнала или зонда, а не амплификации мишени (патенты США No. 5,011,769, 5,403,711, 5,660,988, и 4,876,187), также может использоваться. Также могут использоваться методы инвазивного расщепления, например, Invader.RTM. (Технологии третьего поколения), описанные в Eis, P.S. et al., Nat. Biotechnol. 19:673, 2001. Могут проводиться исследования, основанные на молекулярных маяках (патенты США No. 6,277,607; 6,150,097; 6,037,130) или на переносе энергии флуоресцентного сигнала (ПЭФС). Публикация заявки на патент США No. 20050069908 и ссылки в данной заявке дают представление о разнообразии других методов, которые могут использоваться для определения нуклеиновых кислот. Патенты США No. 5,854,033, 6,143,495 и 6,239,150 описывают составы и способы амплификации и множественного выявления интересующих молекул, включающих репликацию по типу «катящегося кольца». Способ используется для одновременного выявления множества специфических нуклеиновых кислот в образце. При желании, нуклеиновые кислоты секвенируются. Публикация заявки на патент США No. 20050026180 описывает способы проведения мультиплексной реакции нуклеиновых кислот, включающие амплификацию, выявление и генотипирование, которые могут быть адаптированы для определения последовательности в специфических интересующих положениях для определения того, имеет ли индивид генотип, связанный с повышенным риском неблагоприятного исхода заболевания.
[00194] К общим неограничивающим примерам подходящих способов относятся способы, основанные на гибридизации, использовании молекулярных маяков, SNP микрочипов, энзиматических способов, таких как способы, основанные на полиморфизме длины фрагментов рестрикции; способы, основанные на ПЦР, способы с использованием флэп-эндонуклеазы, элонгации праймера, 5'-нуклеазы, анализа лигирования олигонуклеотидов; другие пост-амплификационные способы, основанные на физических свойствах ДНК, полиморфизме одноцепочечной конформации, способы гель-электрофореза с использованием температурного градиента, денатурирующей высокоэффективной жидкостной хроматографии и секвенирования. Высокоэффективное секвенирование является удобным с точки зрения скорости, и секвенирование, вероятно, может стать рутинным способом для использования в генотипических целях. Могут использоваться способы, основанные на пиросеквенировании, in situ секвенировании, секвенировании на гранулах (US 2007087362) и т.д. См. также PCT/US 2006/029449 (WO 2007014338) для ознакомления с более подробной информацией и связанными с ней определениями.
[00195] В некоторых вариантах реализации раствор вводится непосредственно в глаз, например, путем интраокулярной инъекции. Могут быть использованы стандартные способы введения внутрь глаза, такие как инъекция в стекловидное тело, инъекция в переднюю камеру глаза и т.д. В некоторых вариантах реализации изобретения состав вводится путем инъекции в субтеноново пространство, инъекции в ретробульбулярное пространство или в субконъюктивальное пространство.
[00196] В некоторых вариантах реализации субъекту, страдающему глазной реваскуляризацией (например, экссудативной ВДЖП или пролиферативной диабетической ретинопатией), предварительно до введения состава согласно изобретению проводят лечение ингибитором ангиогенеза для предотвращения кровотечений и/или экссудации. В некоторых вариантах реализации субъекту проводится лечение ингибитором ангиогенеза, а состав согласно изобретению вводится через 1-6 недель после введения ингибитора ангиогенеза. [00197] В некоторых вариантах реализации изобретения раствор вводится непосредственно в сустав или в околосуставное пространство.
[00198] Доставка может производиться путем инъекции (например, с использованием иглы 25, 27 или 30 G, и др.), посредством катетера и.т.д.
[00199] В некоторых вариантах реализации изобретения состав, содержащий аналог компстатина, доставляется в одну или несколько полостей или пространств центральной нервной системы, содержащих ЦСЖ, например, в желудочки или мостомозжечковую цистерну. Доставку агента в желудочек или мостомозжечковую цистерну можно проводить с использованием инфузионной помпы при такой имплантации катетера, когда он открывается в желудочек или мостомозжечковую цистерну высвобождающим состав концом, что приводит к формированию в них гелеподобного включения. Агент, являющийся аналогом компстатина, диффундирует из желудочков и мостомозжечковой цистерны. Поэтому введение в эти полости позволяет доставлять агент в относительно широкую область мозга, не ограничивась специфическим участком. В некоторых вариантах реализации изобретения доставка состава в полости, содержащие ЦСЖ, производится при имплантации катетера хирургическим путем внутрь черепа так, чтобы один конец катетера имел доступ к полости. Другой конец катетера в таком случае соединен с резервуаром (например, сосудом Оммайя), который расположен под скальпом (подкожно).
[00200] Способы для интратекального введения хорошо известны в данной области. Если субъект страдает от повреждения позвоночника, катетер имплантируется так, что высвобождающий состав конец лежит в интратекальном пространстве, тогда как другой конец связан с резервуаром помпы. Такие способы в основном используются для лечения хронической боли и являются рутинными способами пролонгированной доставки анальгетических агентов в течение месяцев. Подобные способы используются в настоящем изобретении для доставки жидкого состава, содержащего аналог компстатина в количестве, являющемся эффективным для формирования макроскопического гелеподобного включения в интратекальном пространстве.
[00201] В одном варианте реализации настоящего изобретения субъекту, страдающему от черепно-мозговой травмы, инсульта или повреждения спинного мозга, проводится лечение путем введения аналога компстатина в условиях, приемлемых для формирования макроскопического гелеподобного включения, содержащего аналог компстатина. В некоторых вариантах реализации нейропротекторный или нейротропный агент также вводится системно и/или локально в различных вариантах реализации изобретения. В некоторых вариантах реализации нейропротекторный или нейротропный агент вводится вместе с ингибитором комплемента в одном составе.
[00202] Интервал дозирования (т.е. время между введениями субъекту состава согласно изобретению) и доза аналога компстатина, доставляемая при каждом введении, могут различаться. В некоторых вариантах реализации доставка состава осуществляется с интервалом более, чем в 6 недель, например, в 2, 3, 4, 5, 6 или 7 месяцев, или в некоторое промежуточное число недель, например, в 8, 10, 12, 14, 16 недель и т.д. В некоторых вариантах реализации состав доставляется с еще большими временными интервалами, например, с интервалом в 7, 8, 9, 10, 11 или 12 месяцев. В других вариантах реализации временной интервал составляет 6 недель, или меньше, например, 1, 3, 4, 5, или 6 недель. Например, состав может вводиться в среднем каждые 2 недели, каждые 4 недели, каждые 30 дней и т.д. Разумеется, интервал времени может меняться. Например, интервалы между введениями дозы могут меняться в пределах от 6 недель, или меньше, и до 6 недель, и больше. В некоторых вариантах реализации средний временной интервал между введениями состава согласно изобретению составляет по меньшей мере 6 недель, например, 2, 3, 4, 5 или 6 месяцев, или любое промежуточное количество недель, например, 8, 10, 12, 14, 16 недель и т.д. В некоторых вариантах реализации изобретения состав вводится несколько раз со средним временным интервалом по меньшей мере в 6, 8, 10 или 12 недель, или в 3, 4, 6, 8, 12, 15, 18 или 24 месяца разницы и т.д. Состав может вводиться по меньшей мере 1, 2, 5, 10, 15, 20, или больше, раз. Состав может вводиться неограниченное количество раз с разными временными интервалами субъекту, находящемуся в группе риска или страдающему комплемент-опосредованным нарушением, например ВДЖП. ПРИМЕРЫ
[00203] Пример 1: Формирование гелеподобного включения после введения, активного аналога компстатина в стекловидное тело обезьян [00204] Синтез аналога компстатина
[00205] Синтез активного аналога компстатина (в Примерах 1-3 также называемого «соединением») проводился в соответствии с твердофазным способом, описанным Меррифилдом (J. Amer. Chem. Soc. 85, 2149 (1963)). α-Аминогруппа каждой аминокислоты была защищена Fmoc-группой. Функциональные группы боковых цепей были также защищены различными подходящими защитными группами. Пептидную цепь образовывали путем встраивания С-терминальной аминокислоты (т.е. Thr) в амидный полимер Ринка с дальнейшим последовательным присоединением аминокислот, удалением защитных групп боковых цепей и выделением из полимера. Когда последовательность пептида была целиком сформирована, N-конец пептидного полимера ацетилировали (при использовании кэпирующего раствора, состоящего из Ac2O/CH2Cl2/DIEA в объемном соотношении 6:50:3), затем полимер последовательно промывался растворами МеОН и ДМФ. После выделения пептида из полимера с помощью стандартных способов, между остатками пептида Cys2 и Cys12 образовался дисульфидный мостик путем I2 оксидации. Сначала линейный пептид расворяли в 20% водный растворе ацетонитрила с получением раствора пептида с концентрацией 1 мг/мл. Далее к раствору пептида при его перемешивании по капле добавляли раствор I2/Nal (Nal использовали для повышения растворимости I2 в Н2О). Сначала при добавлении I2 его желтая окраска исчезала при контакте с раствором. Сохранение желтой окраски I2 свидетельствовало о том, что было добавлено достаточное количество I2, раствор в колбе перемешивали еще 30 минут для завершения окисления. Для нейтрализации избытка I2 и гашения реакции добавляли раствор аскорбиновой кислоты (0.1М). Процесс реакции контролировали с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ).
[00206] После завершения окисления готовили реакционную смесь для очистки методом препаративной ВЭЖХ путем фильтрации через стекловолоконный фильтр с порами 1 мкм. Отфильтрованный раствор пептида загружали в колонку для препаративной ВЭЖХ, наполненную C18 полимером для обратной фазы, которая управлялась с помощью системы препаративной ВЭЖХ (Varian ВЭЖХ). Колонку проэлюировали Буфером "А" [0.1% ТФУ в H2O - 1:1000 (об/об)] и линейным градиентом Буфера "В" [0.1% ТФУ в ацетонитриле -1:1000 (об/об)].
[00207] Фракции, собранные с препаративной колонки, были проанализированы с помощью аналитической системы ВЭЖХ (Varian ВЭЖХ), оснащенной аналитической колонкой ВЭЖХ (Kromasil С18 5 мкм). Фракции, которые удовлетворяли требованиям чистоты, затем были собраны для следующего этапа процесса. Фракции, которые не удовлетворяли требованиям чистоты, были повторно очищены до достижения необходимой степени чистоты, а затем собраны. Процесс повторяли до достижения по меньшей мере 95% чистоты. Собранные очищенные фракции затем были заново загружены в препаративную ВЭЖХ колонку, отмыты аммонийно-ацетатным буфером и элюированы соответствующей буферной системой для обмена соли пептида на необходимую соль, в этом случае на ацетатную соль. Фракции снова анализировали с помощью аналитической ВЭЖХ, и те фракции, которые соответствовали конечному критерию чистоты, были собраны и приготовлены для лиофилизации. Использовали лиофилизатор по типу коллектора, и в каждый контейнер лиофилизатора помещалось не более, чем 350 мл раствора очищенного пептида после замораживания. Замораживание-высушивание проводили в течение более чем 3 дней. Конечный объем пептида был проанализирован на предмет чистоты с помощью обращенно-фазовой ВЭЖХ.
[00208] Приготовление жидких составов
[00209] Были приготовлены две различные рецептуры состава при растворении его в воде для инъекций в разных концентрациях: (i) 0.299 мг/мл, обозначенная LD, и (ii) 4.51 мг/мл, обозначенная HD; и стерилизации через фильтр Millipore Durapore 47 мм, 0.22 мкм. Жидкие составы были разлиты в отдельные ампулы (250 мкл каждая). Значение рН состава LD было 5.48, тогда как значение рН состава HD было 6.0.
[00210] Введение внутрь стекловидного тела
[00211] В ходе экспериментов, включающих введение аналога компстатина, синтез которого описан выше (SEQ ID NO: 32), в воде для инъекций в стекловидное тело обезьян было обнаружено, что соединение после инъекции его в стекловидное тело способно формировать гелеподобные практически сферические включения внутри стекловидного тела примата (яванской макаки). Включения формировались в области инъекции и только при большей из двух исследуемых концентраций соединения. Высокая доза состояла из инъекции в стекловидное тело (IVT) соединения в приблизительной дозе 150 мкг соединения в объеме 50 мкл воды для инъекций, тогда как низкая доза содержала приблизительную дозу в 3 мкг соединения в объеме 50 мкл воды для инъекций. При осмотре переднего отдела глаза с помощью щелевой лампы на 2 и 15 день после введения соединения не было выявлено аномалий. При бинокулярной обратной офтальмоскопии на 2 день было выявлено диффузное помутнение стекловидного тела в правом глазу у одного животного, получившего дозу IVT в концентрации 3 мкг на глаз, и у четырех животных, получивших дозу IVT в концентрации 150 мкг на глаз. На 15 сутки помутнение стекловидного тела все еще наблюдалось у четырех из этих животных, а у других двух животных было впервые замечено помутнение стекловидного тела. Не было никаких оснований полагать, что соединение вызывало какие-либо очевидные побочные реакции внутри стекловидной камеры глазного яблока. Показатели ЭРГ были в пределах нормы, и тонометрия не выявляла изменений внутриглазного давления, обусловленных введением состава.
[00212] При некропсии у большинства животных мужского пола (10 из 12), которые получили дозу IVT соединения в 150 мкг на глаз, в ходе препарирования глаза были обнаружены гелеподобные сферические включения внутри стекловидного тела. Эти включения были изолированы и исследованы на предмет содержания соединения. Результаты показали, что содержание соединения составляло от 7 мкг до 72 мкг на включение. У одного из двух животных, усыпленных через 2 недели после инъекции разовой дозы IVT, не было обнаружено сферического включения в стекловидном теле, и следовательно, не было выявлено соединения. Сходным образом, у одного животного, получившего дозу IVT в 150 мкг на глаз, усыпленного через 4 часа после введения, не было выявлено сферических включений в стекловидном теле. Таким образом, включения впервые были обнаружены в первую контрольную точку времени - через четыре часа после введения соединения - и все еще выявлялись у одного из двух животных, усыпленных через две недели. При гистопатологическом исследовании не было обнаружено связанных с введением состава аномалий в глазах животных, получавших дозы соединения с последующим формированием или без формирования включений в стекловидном теле.
[00213] Включения были исследованы на предмет содержания состава, и количество обнаруженного состава было измерено с использованием ВЭЖХ. Было обнаружено, что включения содержат значительное количество соединения. У всех животных, в стекловидное тело которых вводили соединение в количестве 150 мкг на глаз, в любой контрольной точке времени (от 4 часов до 2 недель после введения) в стекловидном теле обнаруживалось соединение. Такие результаты дали основания полагать, что включения при формировании высвобождали соединение с течением времени.
[00214] Пример 2: Характеристика гелеподобного включения, формирующегося в стекловидном теле кролика при введении активного аналога компстатина
[00215] Исследования на новозеландских белых кроликах (NZW) были проведены с целью более подробного определения параметров формирования включения, при которых происходит формирование включения после инъекции в стекловидное тело, и также для оценки острых токсических свойств соединения после инъекции его в стекловидное тело.
[00216] Методы
[00217] Приготовление раствора соединения
[00218] Состав HD готовили так, как описано в Примере 1, и разводили водой для инъекций (WFI) в стерильных условиях для получения различных доз соединения. 50 мкл состава вводили инъекционно в стекловидное тело кролика.
[00219] Подопытные животные
[00220] Исследование проводили для оценки способности соединения формировать включения внутри глаза после инъекции его в стекловидное тело в концентрации от 0 до 200 мкг на глаз (0, 25, 50, 75, 100, 125, 150,175, 200 мкг) (Таблица 2). Инъекцию соединения в каждой из концентраций проводили в три глаза. Для определения эффекта дозы были использованы тринадцать животных. Пять дополнительных животных были использованы для гистологического анализа.
[00221] Методика проведения опытов на животных
[00222] Анестезия: Животных анестезировали с помощью внутримышечной инъекции раствора: кетамин (50 мг/кг) + ксилазин (10 мг/кг).
OE = Офтальмологические исследования
DIS = Препарирование
HISTO = Гистологический анализ
[00223] Предъинъекционные процедуры: Прямо в глаза закапывали по 2 капли местного анестетика (0.5% прокаинамида), а затем по 2 капли 5% офтальмологического раствора повидон-йода. Повышенное внимание уделялось тому, чтобы раствором повидон-йода было покрыто место планируемой инъекции. Избыток жидкости из окологлазничной области убирали насухо марлевой салфеткой. Местный анестетик и раствор повидона оставляли действовать по меньшей мере в течение 5 минут перед инъекцией в стекловидное тело.
[00224] Инъекционные процедуры: Инъекции в стекловидное тело проводили с помощью шприца для инъекций туберкулина на 0.5 мл (с неотделимой иглой 29G длиной в 1/2 дюйма); 0.2 мл раствора соединения было отобрано из ампулы. Избыток жидкости вытеснялся так, чтобы шприц содержал только необходимый объем жидкости для однократной инъекции (50 мкл). Глаз держали открытым с помощью расширителя глазного века. Иглу вводили в верхневисочный квадрант на расстоянии 3.5-4.0 мм от лимба, избегая горизонтального меридиана и направляя иглу к центру глаза. Только половина (1/4 дюйма) от общей длины иглы (1/2 дюйма) вводилась в глаз. Инъекцию проводили медленно во избежание резкого увеличения внутриглазного давления. Для того, чтобы быть уверенными в том, что весь объем раствора находится внутри глаза, и избежать его обратного вытекания через место инъекции, иглу вынимали медленно.
[00225] Постинъекционные процедуры: Сразу после инъекции глаз промывали физиологическим раствором. Избыток жидкости в окологлазничной области убирали насухо при помощи марлевой салфетки 4×4. Затем наносили по две капли антибактериального офтальмологического раствора (Vigamox®, моксифлоксацина, 0.5% офтальмологического раствора).
[00226] Офтальмологические исследования: Все животные до момента их усыпления проходили офтальмологическую проверку (с помощью непрямой офтальмоскопии) у практикующего клинического офтальмолога. Критерии оценок анализа показаны в Таблице 3.
[00227] Эвтаназия: Эвтаназию проводили на анестезированных кроликах путем инъекции в ушную вену приблизительно 2-3 мл раствора Beuthanasia-D (Schering Plough) с использованием иглы 22 G.
[00228] Энуклеация глаза для препарирования глазных яблок: Одной рукой держали широко раскрытыми глазные веки, конъюктиву сепарировали по краю роговицы с помощью лезвия скальпеля. Наружные глазные мышцы срезали по часовой стрелке, также срезали и удаляли мигательную перепонку. Глазной нерв отсекали ножницами для энуклеации при введении их в глазную камеру с назальной стороны. Глазное яблоко извлекали «монолитом» при отсечении структур из ретробульбарного отдела глаза. Каждое энуклеированное глазное яблоко очищали от связанных с ним глазных оболочек, глазной толстой мышцы и экстраокулярной мышцы с помощью маленьких изогнутых ножниц.
[00229] Сбор жидкости стекловидного тела кролика, сферических включений из стекловидного тела и слоев сетчатки из изолированных глазных яблок: Очищенное глазное яблоко кролика помещалось в стерильную чашку Петри. При захвате глаза с помощью тонкого 1х2-зубного зажима делался аккуратный надрез через склеру на расстоянии 5 мм от лимба лезвием скальпеля №11. Затем при отсечении склеры и сетчатки по всему периметру глаза отделяли верхнюю часть. Включения аккуратно собирали пинцетом, затем переносили в пробирки Эппендорфа и хранили на льду. Если включение было слишком хрупким, его выскабливали с помощью скальпеля №15. Стекловидное тело захватывали с помощью зубчатого пинцета, затем переносили в пробирку Эппендорфа и хранили на льду. Ретинальный слой от каждого глазного яблока выскабливали с задней поверхности глаза скальпелем №15 и сразу же переносили в пробирку Эппендорфа с раствором RNA Later (Ambion, Austin, TX) и хранили на льду. Все собранные материалы (жидкость стекловидного тела, включение и ретинальный слой) были заморожены и хранились на -20°С.
[00230] Критерии оценки включений: Если в процессе сбора материала было обнаружено включение, то его извлекали и проводили его оценку. Критерии оценки для включений показаны в Таблице 4.
Включение (включения) слишком
[00231] Гистопатологический анализ: После обследования проводили эвтаназию животных, глаза были энуклеированы, фиксированы в растворе Дэвидсона, были получены гистологические срезы и окрашены Г-Э. Срезы из обоих глаз животных, получавших 25, 50 или 100 мкг соединения на глаз (Таблица 2, последние трое животных), были проанализированы признанным Американским советом по патологии патологом и повторно осмотрены ветеринаром-патологом, имеющим профессиональную сертификацию и являющимся признанным экспертом. [00232] Исследование с помощью ВЭЖХ:
[00233] Приготовление образца включения
- Перед проведением анализа включение замораживали-высушивали
- Включение суспендировали в 50 мкл раствора: 80% уксусная кислота/20% вода
- Отбирали 8 мкл из раствора геля
- Добавляли 20 мкл стокового раствора внутреннего стандарта (разведение в подвижной фазе А 1:16)
- Добавляли 52 мкл подвижной фазы А
Приготовление образца стекловидного тела
Приготовление образца стекловидного тела проводилось в соответствии с SOP-D 0002v1 с модификациями. В данном случае до момента взятия образца к 50 мкл стекловидного тела добавляли 20 мкл внутреннего стандарта (значительно сходного по последовательности с соединением) (разведение в воде 1:8).
[00234] Анализ образца
[00235] Образцы как включения, так и стекловидного тела, анализировали с помощью ВЭЖХ при использовании обращенно-фазовой колонки с фазой Cig Hypersil Gold AQ, 2.1 x 150 мм, 5 мкм (Thermo Electron), при УФ-детекции на длине волны 214 нм. Были построены отдельные калибровочные кривые для анализа включения и стекловидного тела.
[00236] Анализ образцов включений в стекловидном теле кролика с помощью электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия:
- После растворения замороженного-высушенного включения в пробирке Эппедорфа в растворе: ФСБ: Уксусная кислота (1:1), образец (образцы) включения стекловидного тела кролика аликвотировали (образцы включений из животных №1341, 1310А и 1339).
- Добавляли краску для нагрузки пробы (4Х) и бета-меркаптоэтанол.
- Пробы кипятили 5 мин. на термоплитке.
- Охлаждали пробы на льду в течение нескольких минут.
- Центрифугировали пробы на 10,000 об/мин в течение 2 мин.
- В лунки для полиакриламидного геля с додецилсульфатом натрия загружали отдельно по два объема (5 мкл и 20 мкл) каждого образца, оставляя между ними по одной пустой лунке.
- Загружали маркер SeeBlue для контроля.
- Пробы прогоняли при постоянном напряжении 200V в течение 1 часа.
- Гель удаляли из устройства и окрашвали в кумаси голубом в течение 30 мин.
- Видимые белковые полосы вырезали из геля, помещали в отдельные пробирки Эппендорфа и отправляли на масс-спектрометрический анализ.
[00237] Результаты
[00238] В Таблице 5 представлен обзор результатов исследования.
ность
[00239] Результаты непрямого анализа и оценки включений показаны в Таблице 5, наряду с номерами животных и дозами. Включения были обнаружены в глазах всех животных, которые получали дозу, равную или большую, чем 125 мкг соединения на глаз. Включения не выявлялись в глазах животных, колторые получали 25 мкг соединения на глаз. При других концентрациях включения формировались с различной частотой. В этом эксперименте включения не могли быть с точностью выявлены при помощи непрямого анализа. Необходимо заметить, что офтальмолог мог наблюдать легкое замутнение даже при более низких использованных концентрациях, чем концентрации, при которых формируется включение.
[00240] Непрямое офтальмологическое исследование не выявило каких-либо патологических изменений, связанных с инъекцией соединения в стекловидное тело.
Характеристики глазного дна были нормальными, за исключением одного животного, №1339, у которого наблюдалось ретинальное кровоизлияние, по заключению офтальмолога вызванное повреждением иглой при инъекции. Помутнение стекловидного тела было обнаружено в 9 из 32 анализируемых глаз. Наличие замутнения особо не коррелировало с дозой соединения.
[00241] Гистопатологическая оценка
[00242] У пяти животных в этом эксперименте также проводили гистопатологическое исследование. Животные и лечение, которое им проводили, представлены в Таблице 6. Глаза животных были исследованы двумя патологами. Оба патолога пришли к заключению, что все исследуемые глаза нормальные. И роговица, и радужная оболочка, и цилиарное тело, и хрусталик, и склера, и сетчатка, и стекловидное тело были в норме.
[00243] Анализ включений: Включения анализировали с помощью ВЭЖХ для того, чтобы подтвердить наличие соединения и оценить его количество. Также проводили анализ с помощью электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия на предмет возможного присутствия других белков, которые не могли быть идентифицированы при использовании протокола ВЭЖХ (выявляет в основном пептиды с низкой Mr). При УФ-детекции не было выявлено других компонентов, кроме соединения. Данные подтвердили гипотезу, что содержание соединения внутри включения коррелирует с количеством соединения, инъецированного в стекловидное тело. Была измерена концентрация соединения в стекловидном теле кролика после инъекции в стекловидное тело каждой дозы соединения. Через 27 часов после инъекции не наблюдалось корреляциии между присутствующим соединением и инъецированным соединением.
[00244] На Фигуре 3 представлен результат анализа с помощью электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия включений в глазах кроликов: 1341, правый глаз (200 мкг соединения), 1310, правый глаз (150 мкг соединения) и 1339, правый глаз (175 мкг соединения). Белковые полосы из дорожки 2 были вырезаны и отправлены на идентификацию с помощью масс-спектрометрии. Все видимые белковые полосы из проб включения стекловидного тела кролика были успешно идентифицированы с помощью метода МС/МАЛДИ. Результаты показаны в таблице ниже.
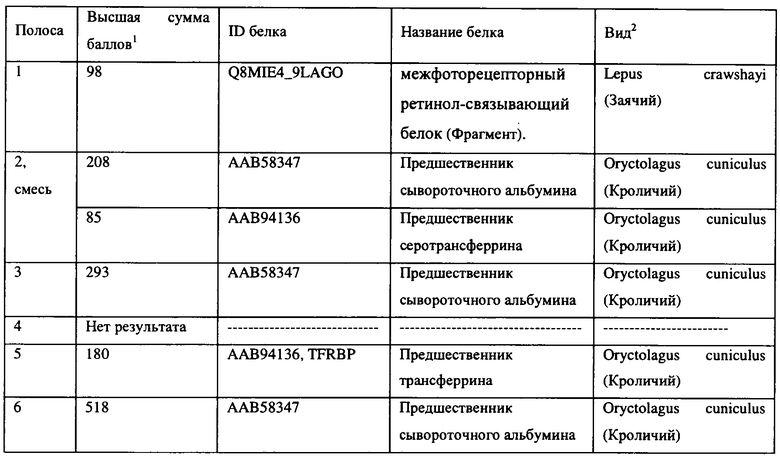
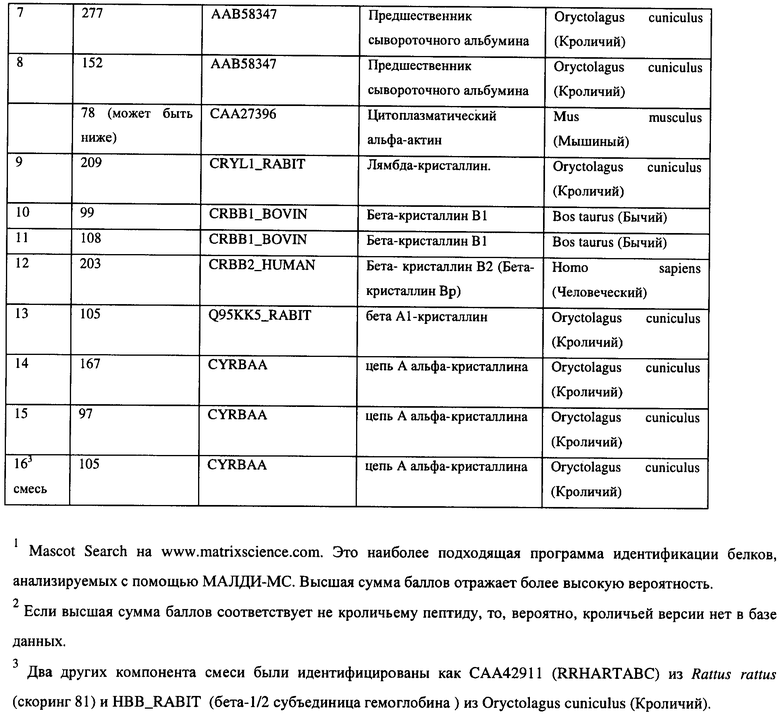
[00245] В заключение, формирование включения оказалось дозозависимым. Включения никогда не формировались при дозе введения 25 мкг на глаз, и с достоверностью формировались в глазах животных, получающих дозу 125 мкг на глаз или больше (все в объеме 50 мкл). Анализ сферических включений в стекловидных телах показал, что активное соединение является основным компонентом включения, и также что содержание белков во включениях ограничивается белками, присутствующим в стекловидном теле кроликов. Через 24 часа после инъекции было проведено гистопатологическое исследование глаз кроликов, получавших однократную инъекцию в стекловидное тело дозы соединения 25, 50 и 100 мкг на глаз. Оба патолога пришл к заключению, что все исследуемые секции глаза были нормальными.
[00246] В последующем исследовании новозеландские белые кролики содержались более 8 месяцев после введения соединения в стекловидное тело. Соединение, экстрагированное из гелей, извлеченных из стекловидного тела кролика в моменты времени в интервале от 6 недель до 8 месяцев после введения, оставалось стабильным и сохраняло существенную ингибирующую комплемент активность при стандартных анализах (Фигура 4).
[00247] В другой работе кроликам проводилось повторное лечение через 3 месяца после первичного лечения (после наблюдаемого исчезновения гелеподобного включения, сформированного в ходе первого лечения). Повторное лечение приводило к формированию нового включения, что подтвердило осуществимость повторного лечения с использованием такого состава пролонгированного высвобождения.
[00248] Пример 3: Дальнейшие исследования включений из аналога компстатина у обезьян
[00249] Были проведены дальнейшие исследования для дополнительного изучения поведения включений в глазах обезьян с течением времени. Было обнаружено, что включения можно обнаружить при помощи офтальмоскопического исследования, и наблюдать за ними с течением времени при помощи ультразвука, как и у кроликов.
[00250] В одном исследовании, яванским макакам вводили 0, 150, 450, 1050 или 2100 мкг соединения в 50 мкл воды для инъекций путем инъекции в стекловидное тело. Было обнаружено, что через 2 недели после инъекции включения выявлялись в глазах всех животных, которым вводили дозу 150 мкг, а также в глазах животных, которым вводили более высокие дозы.
[00251] Некоторых животных, которым вводили 0, 450, 1050 или 2100 мкг соединения, усыпляли через 14 дней после введения и измеряли концентрацию соединения в сыворотке и стекловидном теле. Измерение проводилось с помощью ВЭЖХ. Как показано на Фигуре 5, соединение медленно высвобождается из включений стекловидного тела обезьян по меньшей мере в течение двух недель. При введении слишком низкой для формирования включения концентрации соединение исчезает из стекловидного тела яванской макаки с T½, равным примерно 22 часам. Вследствие этого очевидно, что измеряемая в этом эксперименте концентрация соединения через 2 недели после его введения должна отражать количество высвободившегося из включения соединения, а не остаточного соединения, никогда не входившего в состав включения.
[00252] Дальнейшее исследование было направлено на изучение поведения включения с течением времени. Включения, сформированные при дозе введения 150 мкг, оставались обнаруживаемыми в течение более 2 месяцев, но уменьшались в размере. Некоторые включения полностью исчезали в течение 3 месяцев, тогда как некоторые сохранялись в течение 6 месяцев. Включения, сформированные при дозе введения 450, 1050 или 2100 мкг, оставались обнаруживаемыми более 6 месяцев. Было очевидно, что они уменьшались в размере и/или по плотности к контрольной точке времени в 6 месяцев. Включения, сформированные при дозе введения 450, 1050 и 2100 мкг, в большинстве случаев оставались видимыми в контрольную точку времени в 37 недель и до контрольной точки времени в 1 год, в которой исследование заканчивалось. Включения наблюдались как при офтальмоскопическом, так и при ультразвуковом исследовании. Как оказалось, с течением времени они продолжали уменьшаться в размере и/или распадаться на множество меньших включений. Кроме того, в течение этого времени происходило продолжительное высвобождение аналога компстатина, что было определено на основании измерения концентрации аналога компстатина в образцах сыворотки крови, полученных от этих животных.
[00253] В независимом исследовании после введения соединения в воде путем инъекции в стекловидное тело в такой низкой концентрации, как 1 мг/мл (50 мкг в 50 мкл), гелеподобные включения наблюдали и при офтальмоскопическом, и при ультразвуковом исследовании. Включения переставали обнаруживаться с помощью этих методов примерно через 1 неделю после дозирования.
[00254] Было замечено, что результаты по формированию и скорости исчезновения включений были более воспроизводимы у обезьян, чем у кроликов. В общем, было обнаружено, что включения, сформированные у кроликов, более плотные и дольше сохраняются, чем включения, сформированные при таких же дозах введения у обезьян. Ни в результате гистопаталогического исследования, ни в ходе физического исследования как на обезьянах, так и на кроликах, не было выявлено неблагоприятного воздействия включений.
[00255] Пример 4: Модуляция свойств включения
[00256] Были протестированы различные вспомогательные вещества, буферы и значения рН для оценки их способности модифицировать свойства, влияющие на образование геля аналога компстатина, используемого в Примерах 1-3, и для оценки их влияния на свойства гелей in vitro и in vivo. Были исследованы аминокислоты, включая аргинин, серии и гистидин. Было обнаружено, что составы, содержащие гистидин, обладают лучшими свойствами с точки зрения стабильности образующегося геля по сравнению с составами, содержащими аргинин или серии.
[00257] В некоторых экспериментах было изучено влияние различных концентраций ацетата натрия (NaCH3COO), гистидина и маннита in vitro и/или in vivo, либо по отдельности, либо в различных комбинациях. Концентрации гистидина и маннитола составляли от 10 до 50 мМ. В целом, наблюдалось, что использование составов, содержащих любое из этих веществ, приводило к образованию гелей, которые были более хрупкими и быстрее уменьшались в размере in vivo, чем гели, образованные при использовании составов, содержащих только аналог компстатина и воду. Было сделано заключение, что добавление этих вспомогательных веществ позволяет модулировать скорость уменьшения размера включения и в результате этого модулировать скорость высвобождения аналога компстатина из включения. Такая модуляция потенциально могла бы позволить вводить более высокие общие дозы аналога компстатина.
[00258] Типовые составы включали следующее:
[00259] А. 100 мМ раствор ацетата натрия (рН=5.10) в воде для инъекций.
[00260] Б. 100 мМ ацетат натрия + 25 мМ гистидин (р.Н=5.2)
[00261] В. 100 мМ ацетат натрия + 45 мМ маннит (рН=5.05)
[00262] Диапазон значений рН ~ (5-5.50)
[00263] Вещества:
1. Ацетат натрия:
Стоковый раствор: 3 М
Производитель: Ambion
рН=5.5
Конечная концентрация в составе: 100 мМ
Конечное значение рН состава: 5.1
2. Гистидин:
DL-Гистидин гидрохлорид, 98% min Молекулярный вес: 209.64 Производитель: Acros Organics
3. D-Маннит
Порошок согласно Фармакопее США
производитель: Fisher Scientific
[00264] Протокол приготовления состава:
Для приготовления 10 мл раствора:
1. Развести ацетат натрия в дистиллированной воде от 3 М до 100 мМ.
2. Взвесить определенное количество гистидина/маннита для достижения необходимой концентрации.
3. Определить конечное значение рН и осмолярность раствора. Для приготовления необходимого состава аналога компстатина:
1. Взвесить пустые пробирки Эппендорфа
2. Добавить необходимое количество аналога компстатина в эти пробирки
3. Добавить раствор (вода/ацетат натрия/ацетат натрия + маннит/ацетат натрия+гистидин) для достижения жнеобходимой концентрации аналога компстатина
4. Профильтровать раствор через стерильный фильтр (0.22 мкм)
5. Измерить оптическую плотность конечного раствора, чтобы проверить конечную концентрацию аналога компстатина
6. Измерить рН конечного раствора.
[00265] В некоторых экспериментах аналог компстатина добавляли к 100 мМ раствору ацетата натрия (рН=5.10) в воде для инъекций. Состав (1050 мкг аналога компстатина в 50 мкл жидкости) вводили путем инъекции в стекловидное тело 3 обезьянам. У всех троих животных со 2 по 6 неделю наблюдались включения. На 9 неделе явных включений не обнаруживалось. У одного из 3 животных наблюдался остаток включения. Напротив, у животных, которые получали такое же количество формулы аналога компстатина, состоящей из растворенного в воде для инъекций аналога компстатина, наблюдались включения на 9 неделе. Присутствие ацетата натрия, таким образом, увеличивало скорость растворения включений.
******
[00266] Специалистам в данной области очевидно, или же они могут убедиться с помощью не более чем стандартных экспериментов в том, что существует много эквивалентов специфическим вариантам реализации изобретения, описанным в данной заявке. Объем притязаний настоящего изобретения не ограничивается вышеизложенным описанием, а скорее определяется прилагаемой формулой изобретения. Следует понимать, что изобретение не ограничивается конкретными результатами, полученными в каком-либо особом примере или при каком-либо особом варианте реализации изобретения. В пунктам формулы изобретения существительные, употребляемые в единственном числе, могут означать один предмет или более, если не указано иное в противоречии к контексту или иное, очевидное из контекста. Пунктам формулы или описанию, которые включают союз «или» между одним или более членами группы, удовлетворяют варианты, когда один, более чем один, или все члены группы присутствуют, используются или как-то иначе относятся к данному продукту или способу, если иное не указано в противоречии к контексту или не следует из него. Изобретение включает варианты реализации, в которых один конкретный член группы присутствует, используется или иначе относится к данному продукту или способу. Например, и без ограничений, следует понимать, что там, где пункты формулы или описания указывают, что остаток в определенном положении может быть выбран из особой группы аминокислот или аналогов аминокислот, изобретение включает конкретные варианты реализации, в которых остаток в этом положении является любой из перечисленных аминокислот или аналогов аминокислот. Изобретение также включает варианты реализации, в которых более чем один или все члены из группы присутствуют, используются или иначе относятся к данному продукту или способу. Кроме того, необходимо понимать, что изобретение включает все вариации, комбинации и преобразования, в которых одно или более из ограничений, элементов, условий, описательных терминов и т.д. из одного или более перечисленных пунктов включены в другой пункт. В частности, любой пункт формулы, зависимый от другого пункта формулы, может быть изменен при включении одного или более элементов или ограничений, изложенных в любом другом пункте, зависимом от того же основного пункта. Кроме того, необходимо понимать, что если пункт относится к составу, то он включает введение состава согласно любому способу, изложенному в данной заявке, и получение состава согласно любому из способов получения, изложенных в данной заявке, если иное не указано, или если для специалиста не будет очевидным противоречие или несоответствие.
[00267] Необходимо понимать, что там, где элементы представлены в виде списков, например, в форме структур Маркуша, каждая подгруппа элементов также включена, и любой элемент (элементы) может быть исключен из группы. Для краткости только некоторые из этих вариантов реализации были конкретно описаны индивидуально и конкретно в данной заявке, но изобретение включает все такие варианты. Также следует понимать, что, в целом, где изобретение или аспекты изобретения относятся к включающим особенные элементы, признаки и т.д., некоторые варианты реализации изобретения или аспекты изобретения состоят или по существу состоят из таких элементов, признаков и т.д.
[00268] Включение этапа «обеспечение» в некоторые способы реализации изобретения направлено на указание того, что состав вводится для лечения нарушения, описанного в способе. Таким образом, субъект будет иметь или находиться в группе риска нарушения, и состав вводится для лечения нарушения, как правило, по рекомендации врача или хирурга-практика, который может быть или не быть тем же человеком, который вводит состав. Изобретение включает варианты реализации, в которых этап обеспечения не открыто включен и варианты реализации, в которых этап обеспечения включен. Изобретение также включает варианты реализации, в которых этап идентификации субъекта как находящегося в группе риска или страдающего от комплемент-опосредованного нарушения включен.
[00269] Там, где указаны ограничения, изобретение включает варианты реализации, в которых крайние точки включены, варианты реализации, в которых обе крайние точки исключены, и варианты реализации, в которых одна крайняя точка включена, а другая исключена. Следует исходить из того, что если иное не указано, то обе крайние точки включены. Кроме того, необходимо понимать, что если другое не указано или не следует из контекста и понимания среднего специалиста в данной области, оценки которые выражены как диапазоны, могут принимать любое специфическое значение или поддиапазон внутри установленных диапазонов в различных вариантах реализации изобретения, до десятых числа нижней границы диапазона, если из контекста не следует другое. Период времени в 1 месяц понимается как 30 дней. Период времени в 1 год как понимается как 365 дней. Для любого варианта реализации изобретения, в котором числовой оценке предшествует «примерно» или «приблизительно», изобретение включает вариант реализации, в котором конкретная оценка описана. Для любого варианта реализации изобретения, в котором числовой оценке не предшествует «примерно» или «приблизительно», изобретение включает вариант реализации, в котором оценке предшествует «примерно» или «приблизительно».
[00270] Необходимо понимать, что любой некоторый вариант реализации, признак или аспект настоящего изобретения могут быть явно исключены из любого одного или более пунктов формулы. Например, любой конкретный состав, соединение или класс соединений, участок введения, способ или способ введения, доза, рецептура или комплемент-опосредованное нарушение может быть исключено из любого одного или более пунктов формулы.
| название | год | авторы | номер документа |
|---|---|---|---|
| СХЕМЫ ВВЕДЕНИЯ | 2016 |
|
RU2770099C2 |
| СХЕМЫ ДОЗИРОВАНИЯ И СООТВЕТСТВУЮЩИЕ КОМПОЗИЦИИ И СПОСОБЫ | 2018 |
|
RU2779495C2 |
| КЛЕТОЧНО-РЕАКТИВНЫЕ АНАЛОГИ КОМПСТАТИНА, АНАЛОГИ КОМПСТАТИНА ДЛИТЕЛЬНОГО ДЕЙСТВИЯ ИЛИ АНАЛОГИ КОМПСТАТИНА НАЦЕЛЕННОГО ДЕЙСТВИЯ И СВЯЗАННЫЕ С НИМИ КОМПОЗИЦИИ И СПОСОБЫ | 2013 |
|
RU2705215C2 |
| КЛЕТОЧНО-РЕАКТИВНЫЕ АНАЛОГИ КОМПСТАТИНА, АНАЛОГИ КОМПСТАТИНА ДЛИТЕЛЬНОГО ДЕЙСТВИЯ ИЛИ АНАЛОГИ КОМПСТАТИНА НАЦЕЛЕННОГО ДЕЙСТВИЯ И ИХ ПРИМЕНЕНИЕ | 2012 |
|
RU2653439C9 |
| ЭФФЕКТИВНЫЕ АНАЛОГИ КОМПСТАТИНА | 2012 |
|
RU2656102C2 |
| ЭФФЕКТИВНЫЕ АНАЛОГИ КОМПСТАТИНА | 2006 |
|
RU2474586C2 |
| C3-СВЯЗЫВАЮЩИЕ АГЕНТЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2802307C2 |
| АНТАГОНИСТЫ ИЛ-6 И ИХ ПРИМЕНЕНИЕ | 2013 |
|
RU2670943C9 |
| ФАКТОР КОМПЛЕМЕНТА I И КОФАКТОР ФАКТОРА КОМПЛЕМЕНТА I, КОДИРУЮЩИЕ ИХ ВЕКТОРЫ И ПРИМЕНЕНИЕ В ТЕРАПЕВТИЧЕСКИХ ЦЕЛЯХ | 2019 |
|
RU2809247C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ ИНГИБИРОВАНИЯ ВОСПАЛИТЕЛЬНЫХ ЦИТОКИНОВ | 2019 |
|
RU2816868C2 |

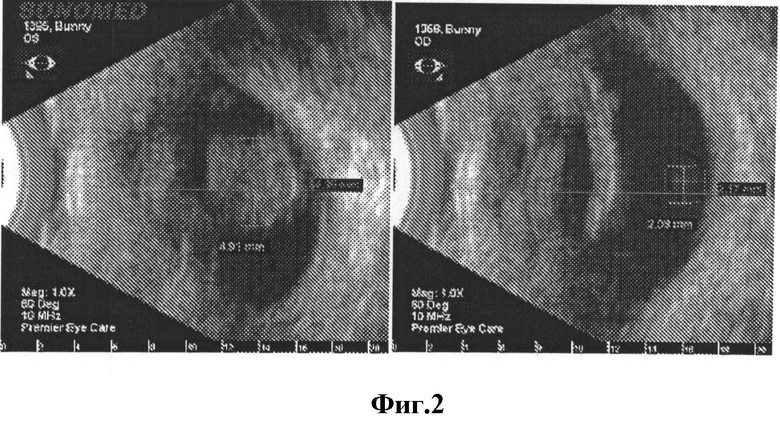
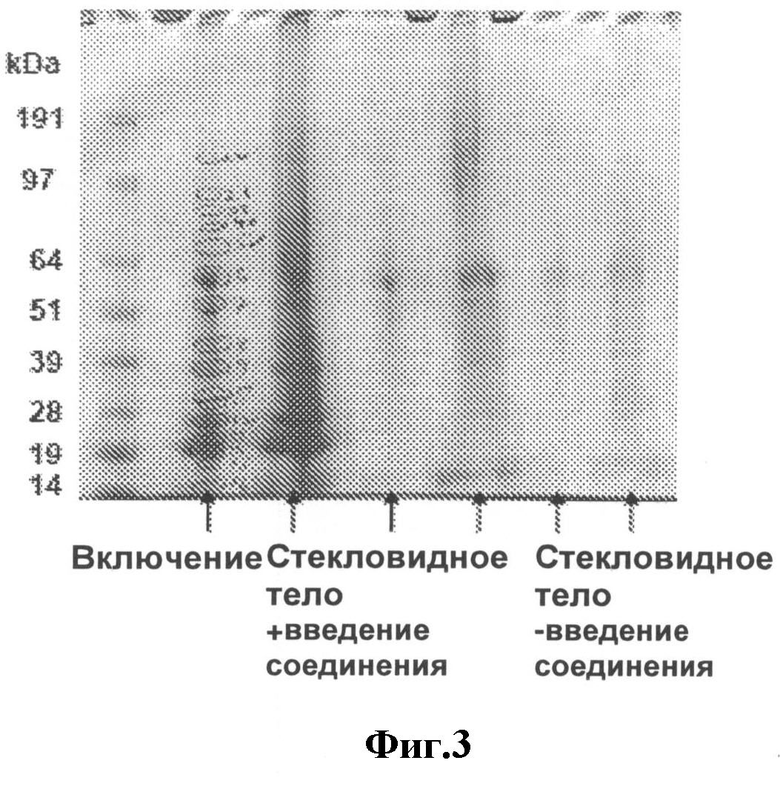
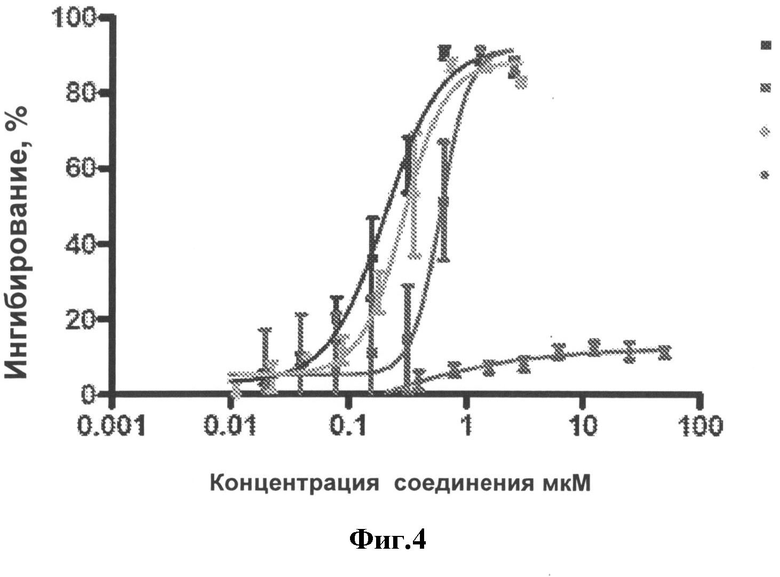
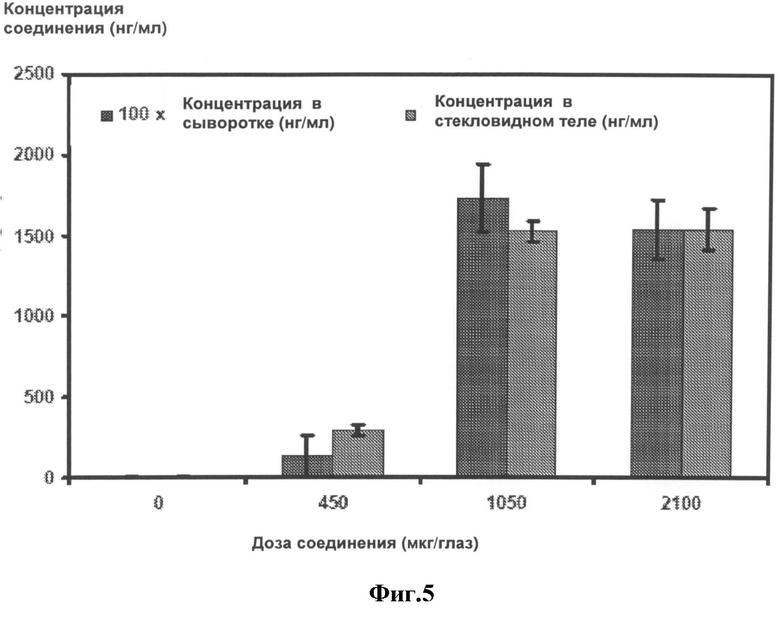
Группа изобретений относится к области фармакологии и медицины и касается пролонгированной доставки аналога компстатина, и также, возможно, дополнительного активного агента, при высвобождении его из макроскопического гелеподобного включения, формирующегося при введении жидкого состава, содержащего аналог компстатина, во внесосудистое пространство, такое как стекловидная камера глазного яблока, в теле млекопитающего. Изобретение относится также к способу лечения субъекта, страдающего возрастной дегенерацией желтого пятна (ВДЖП), включающему введение жидкого состава, содержащего аналог компстатина. Группа изобретений обеспечивает усовершенствование системы доставки компстатина для подавления системы комплемента при лечении ВДЖП. 6 н.п. и 52 з.п. ф-лы, 4 пр., 6 табл., 5 ил.
1. Способ лечения комплемент-опосредованных заболеваний, включающий этап введения жидкого состава, содержащего аналог компстатина, во внесосудистое пространство субъекта, отличающийся тем, что количество указанного аналога компстатина является достаточным для формирования дискретной макроскопической гелеподобной структуры, в указанном внесосудистом пространстве при введении в отсутствие других гелеобразующих веществ.
2. Способ по п.1, отличающийся тем, что указанное эффективное количество является достаточным для формирования макроскопической гелеподобной структуры, которая со временем уменьшается в размере и остается легко обнаруживаемой в течение по меньшей мере 2 недель, предпочтительно в течение по меньшей мере 3 месяцев.
3. Способ по п.1, отличающийся тем, что указанное эффективное количество является достаточным для формирования макроскопической гелеподобной структуры, которая со временем уменьшается в размере и высвобождает аналог компстатина в течение по меньшей мере 2 недель, предпочтительно в течение по меньшей мере 3 месяцев.
4. Способ по п.1, отличающийся тем, что указанное эффективное количество является достаточным для формирования макроскопической гелеподобной структуры, которая со временем уменьшается в размере и высвобождает аналог компстатина в активной форме с достижением терапевтической концентрации указанного аналога компстатина во внесосудистом пространстве или прилежащей ткани по меньшей мере в течение 2 недель, предпочтительно по меньшей мере в течение 3 месяцев.
5. Способ по п.1, отличающийся тем, что указанный аналог компстатина включает пептид, последовательность которого содержит последовательность, выбранную из следующей группы: SEQ ID NO: 3, 4, 5, 6 и 7.
6. Способ по п.1, отличающийся тем, что активность аналога компстатина превосходит активность последовательности SEQ ID NO: 8 по меньшей мере в 100 раз, предпочтительно по меньшей мере в 200 раз.
7. Способ по п.1, отличающийся тем, что указанный аналог компстатина имеет последовательность, выбранную из SEQ ID NO: 14, 21, 28, 29, 30, 31, 32, 33, 34 и 36, предпочтительно последовательность, выбранную из SEQ ID NO: 28, 32, и 34.
8. Способ по п.1, отличающийся тем, что количество указанного аналога компстатина в жидком составе находится в пределах от 1 мг/мл до 50 мг/мл, предпочтительно в пределах от 2 мг/мл до 25 мг/мл.
9. Способ по п.1, отличающийся тем, что в стекловидную камеру глазного яблока вводят от 50 мкг до 5000 мкг аналога компстатина, предпочтительно от 150 мкг до 2000 мкг аналога компстатина, более предпочтительно от 400 мкг до 1500 мкг аналога компстатина.
10. Способ по п.1, отличающийся тем, что указанный аналог компстатина вводят в стекловидную камеру глазного яблока в объеме от 25 мкл до 125 мкл, предпочтительно в объеме примерно 50 мкл.
11. Способ по п.1, отличающийся тем, что субъект страдает возрастной дегенерацией желтого пятна, и указанный жидкий состав вводят в стекловидную камеру глазного яблока.
12. Способ по п.1, отличающийся тем, что указанный жидкий состав дополнительно содержит эффективное количество второго терапевтического агента.
13. Способ по п.12, отличающийся тем, что второй терапевтический агент представляет собой ингибитор комплемента, ингибитор ангиогенеза, стероид, противовоспалительный агент, противоинфекционный агент или анальгетик.
14. Способ по п.1, отличающийся тем, что указанный состав вводят путем инъекции в стекловидное тело глазного яблока.
15. Способ по п.1, отличающийся тем, что указанный состав включает множество микрочастиц или наночастиц.
16. Гелеподобная структура для замедленного высвобождения аналога компстатина, отличающаяся тем, что указанная гелеподобная структура содержит аналог компстатина в количестве, достаточном для образования гелеподобной структуры в отсутствие других гелеобразующих веществ, и по меньшей мере один эндогенный полипептид, в норме присутствующий во внесосудистом пространстве субъекта.
17. Гелеподобная структура по п.16, отличающаяся тем, что внесосудистое пространство выбрано из следующей группы: стекловидная камера глазного яблока, субконъюнктивальное пространство, субтеноново пространство, субретинальное пространство, синовиальная полость и спинно-мозговая полость.
18. Жидкий состав для формирования включения аналога компстатина, содержащий указанный аналог компстатина и жидкий фармацевтически приемлемый носитель, отличающийся тем, что указанный состав характеризуется способностью формировать макроскопическую гелеподобную структуру при введении его в стекловидную камеру глазного яблока млекопитающего в отсутствие других гелеобразующих веществ.
19. Жидкий состав по п.18, отличающийся тем, что указанный аналог компстатина присутствует в количестве, достаточном для формирования дискретной макроскопической гелеподобной структуры при введении его в стекловидную камеру глазного яблока субъекта путем инъекции в стекловидное тело.
20. Жидкий состав по п.18, отличающийся тем, что указанный аналог компстатина присутствует в количестве, достаточном для формирования макроскопической гелеподобной структуры, которая со временем уменьшается в размере и остается легко обнаруживаемой в течение по меньшей мере 2 недель, предпочтительно в течение по меньшей мере 3 месяцев, более предпочтительно в течение по меньшей мере 6 месяцев.
21. Жидкий состав по п.18, отличающийся тем, что указанный аналог компстатина присутствует в количестве, достаточном для формирования макроскопической гелеподобной структуры, которая со временем уменьшается в размере и высвобождает аналог компстатина в активной форме в течение по меньшей мере 2 недель, предпочтительно в течение по меньшей мере 3 месяцев, более предпочтительно в течение по меньшей мере 6 месяцев.
22. Жидкий состав по п.18, отличающийся тем, что указанный аналог компстатина присутствует в количестве, достаточном для формирования макроскопической гелеподобной структуры, которая со временем уменьшается в размере и высвобождает аналог компстатина в активной форме с достижением терапевтической концентрации указанного аналога компстатина в стекловидной камере глазного яблока или прилежащей ткани в течение по меньшей мере 2 недель, предпочтительно в течение 3 месяцев.
23. Жидкий состав по п.18, отличающийся тем, что указанный аналог компстатина включает пептид, последовательность которого включает последовательность, выбранную из следующей группы: SEQ ID NO: 3, 4, 5, 6 и 7.
24. Жидкий состав по п.18, отличающийся тем, что активность аналога компстатина превосходит активность последовательности SEQ ID NO: 8 по меньшей мере в 100 раз, предпочтительно в 200 раз.
25. Жидкий состав по п.18, отличающийся тем, что последовательность аналога компстатина включает последовательность, выбранную из SEQ ID NO: 14, 21, 28, 29, 30, 31, 32, 33, 34 и 36, предпочтительно последовательность, выбранную из SEQ ID NO: 28, 32 и 34.
26. Жидкий состав по п.18, отличающийся тем, что количество указанного аналога компстатина в жидком составе находится в пределах от 1 мг/мл до 50 мг/мл, предпочтительно от 3 мг/мл до 25 мг/мл.
27. Жидкий состав по п.18, отличающийся тем, что указанный состав содержит от 150 мкг до 5000 мкг аналога компстатина, предпочтительно от 250 мкг до 2000 мкг аналога компстатина, более предпочтительно т 400 мкг до 1500 мкг аналога компстатина.
28. Жидкий состав по п.18, отличающийся тем, что указанный состав имеет объем от 25 мкл до 125 мкл.
29. Жидкий состав по п.18, отличающийся тем, что указанный состав содержит от 150 мкг до 2000 мкг аналога компстатина в объеме от 50 мкл до 100 мкл.
30. Жидкий состав по п.18, отличающийся тем, что указанный состав состоит, по существу, из аналога компстатина в воде.
31. Жидкий состав по п.18, отличающийся тем, что указанный состав, по существу, не содержит вспомогательных веществ.
32. Жидкий состав по п.18, отличающийся тем, что указанный состав содержит компонент, выбранный из группы, состоящей из многоатомных спиртов и аминокислот.
33. Жидкий состав по п.32, отличающийся тем, что присутствие компонента модулирует скорость, с которой включение исчезает в условиях in vivo.
34. Жидкий состав по п.32, отличающийся тем, что указанный состав содержит гистидин.
35. Жидкий состав по п.18, отличающийся тем, что указанный состав содержит буфер.
36. Жидкий состав по п.35, отличающийся тем, что указанный состав содержит ацетат натрия.
37. Жидкий состав по п.18, отличающийся тем, что указанный состав содержит маннит.
38. Жидкий состав по п.18, отличающийся тем, что указанный состав дополнительно содержит эффективное количество второго терапевтического агента.
39. Жидкий состав по п.38, отличающийся тем, что указанный второй терапевтический агент представляет собой ингибитор комплемента, ингибитор ангиогенеза, стероид, противовоспалительный агент, противоинфекционный агент или анальгетик.
40. Жидкий состав по п.38, отличающийся тем, что указанный второй терапевтический агент представляет собой антитело или фрагмент антитела.
41. Способ приготовления состава для доставки терапевтического агента в течение пролонгированного периода времени, включающий: приготовление жидкого состава, содержащего терапевтический агент и аналог компстатина, отличающийся тем, что указанный аналог компстатина присутствует в количестве, достаточном для формирования макроскопической гелеподобной структуры в отсутствие других гелеобразующих веществ, при введении состава во внесосудистое пространство в теле млекопитающего субъекта.
42. Способ по п.41, дополнительно включающий введение жидкого состава во внесосудистое пространство в теле млекопитающего.
43. Способ по п.41, отличающийся тем, что указанное внесосудистое пространство представляет собой стекловидную камеру глазного яблока.
44. Способ по п.41, отличающийся тем, что указанное внесосудистое пространство представляет собой стекловидную камеру глазного яблока, и указанный субъект страдает возрастной дегенерацией желтого пятна (ВДЖП).
45. Способ лечения субъекта, страдающего ВДЖП или находящегося в группе риска, включающий введение жидкого состава, содержащего аналог компстатина, непосредственно в стекловидную камеру глазного яблока субъекта, отличающийся тем, что указанный жидкий состав содержит количество аналога компстатина, достаточное для формирования макроскопической гелеподобной структуры в отсутствие других гелеобразующих веществ после его введения.
46. Способ по п.45, отличающийся тем, что указанный аналог компстатина содержит пептид, последовательность которого включает последовательность, выбранную из группы последовательностей SEQ ID NO: 3, 4, 5, 6 и 7.
47. Способ по п.45, отличающийся тем, что указанный аналог компстатина имеет по меньшей мере в 100 раз большую активность, чем активность SEQ ID NO: 8, предпочтительно указанный аналог компстатина имеет по меньшей мере в 200 раз большую активность, чем активность SEQ ID NO: 8.
48. Способ по п.45, отличающийся тем, что указанный аналог компстатина имеет последовательность, выбранную из SEQ ID NO: 14, 21, 28, 29, 30, 31, 32, 33, 34 и 36, или предпочтительно последовательность, выбранную из SEQ ID NO: 28, 32 и 34.
49. Способ по п.45, отличающийся тем, что указанное количество аналога компстатина находится в пределах от 2 мг/мл до 20 мг/мл.
50. Способ по п.45, отличающийся тем, что от 100 мкг до 2,000 мкг аналога компстатина, предпочтительно от 250 мкг до 1,500 мкг аналога компстатина, более предпочтительно от 400 мкг до 1,200 мкг аналога компстатина вводят в глаз.
51. Способ по п.45, отличающийся тем, что указанный жидкий состав дополнительно содержит ингибитор ангиогенеза.
52. Жидкий состав для формирования гелеподобной структуры во внесосудистом пространстве у субъекта, содержащий аналог компстатина в качестве гелеобразующего вещества и воду, отличающийся тем, что концентрация аналога компстатина находится в пределах от 3 до 50 мг/мл.
53. Жидкий состав по п.52, отличающийся тем, что концентрация аналога компстатина находится в пределах от 5 до 30 мг/мл, предпочтительно в пределах от 8 до 25 мг/мл.
54. Жидкий состав по п.52, отличающийся тем, что указанный аналог компстатина содержит пептид, выбранный из группы последовательностей SEQ ID NO: 3,4, 5, 6 и 7.
55. Жидкий состав по п.52, отличающийся тем, что указанный аналог компстатина имеет активность, по меньшей мере в 100 раз большую активности SEQ ID NO: 8, предпочтительно указанный аналог компстатина имеет активность, по меньшей мере в 200 раз большую активности SEQ ID NO: 8.
56. Жидкий состав по п.52, отличающийся тем, что указанный аналог компстатина содержит пептид, выбранный из следующей группы: SEQ ID NO: 14, 21, 28, 29, 30, 31, 32, 33, 34 и 36, или предпочтительно из следующей группы: SEQ ID NO: 28, 32 и 34.
57. Жидкий состав по п.52, отличающийся тем, что указанный состав состоит, по существу, из аналога компстатина и воды.
58. Жидкий состав по п.52, отличающийся тем, что указанный состав дополнительно содержит вспомогательное вещество, выбранное из аминокислот и сахарных спиртов.
| WO 2007044668 A2, 19.04.2007 | |||
| Onoue S et al "Structural transition of glucagon in the concentrated solution observed by electrophoretic and spectroscopic techniques", J Chromatogr A, 2006, Mar 24; 1109(2): 167-73, Epub 2005 dec 20, PMID: 16364337 , реферат | |||
| Arvind Sahu et al " Compstatin , peptide inhibitor of complement, exhibits species-specific |
Авторы
Даты
2014-01-27—Публикация
2008-10-02—Подача