Изобретение относится к области экспериментальной медицины, а именно к созданию способа моделирования стресс-индуцированного развития мелкоочаговых мозговых геморрагий в коре головного мозга у новорожденных крыс и может быть использовано с целью исследования механизмов и поиска ранних маркеров развития церебральных геморрагий в неонатальный период, а также для поиска новых подходов и лекарственных средств профилактики и лечения мозговых геморрагий у неонатальных детей.
Среди наиболее широко применяемых способов достижения острого нарушения кровоснабжения мозга с последующим развитием церебральных геморрагий являются различные методы и подходы, основанные на создании ишемии мозговой ткани и геморрагической гипотензии путем окклюзии центральных артерий, приносящих кровь к мозгу Dexmedetomidine Improves Neuroiogic Outcome from Incomplete Ischemia in the Rat, William E. Hoffman, Ph. D., Eberhard Kochs, M.D., Cristian Werner, M.D., Chinamma Thomas, M.D., Ronald F. Albrecht, M.D. Anesthesiology 75:328-332, 1991; Pulsinelli W А, Brierley J В: A new model of bilateral hemispheric ischemia in the anesthetized rat. Stroke 1979; 10: 267-272).
Известен способ моделирования острого нарушения мозгового кровообращения с повреждением ткани мозга у крыс с помощью экспериментального создания окклюзии основных артерий, питающих мозг кровью (см. патент на изобретение RU 2211672, МПК A61B 17/12, G09B 23/28). Для этого хирургическим путем перевязывают общую и наружную сонную артерии. Вводят специально приготовленный окклюдер из кетгутовой хромированной нити 5,0 в среднюю мозговую артерию через разрез общей сонной артерии. Окклюдер фиксируют перевязкой левой сонной артерии фиксируют перевязкой левой общей сонной артерии выше перфорации сосуда и перевязывают общую сонную артерию противоположной стороны. Способ позволяет создавать у 100% животных экспериментальные условия острого нарушения кровоснабжения мозга, сопровождающегося гибелью нейронов, размягчением участков мозговой ткани, тромбозами и эмболиями. Техническим результатом указанного способа является достижение удобства проведения эксперимента с минимальной травматичностью. Использование в качестве окклюдера хромированной кетгутовой нити 5,0 позволяет предупредить повреждение сосудистой стенки, т.к. кетгут при контакте с кровью размягчается, что существенно снижает механическое воздействие инородного тела в сосуде. При этом гибкая структура окклюдера легко повторяет изгибы церебральных артерий, что облегчает процесс его имплантации. Окклюзия достигается путем набухания кетгута в сосуде при контакте с кровью, что обеспечивает полное перекрытие средней мозговой артерии.
Однако указанная экспериментальная модель создания острого нарушения мозгового кровообращения позволяет лишь достичь развития острой ишемии мозга с характерными неврологическими признаками: птоз на стороне поражения, нарушение кровоснабжения тканей глазного яблока с соответствующей стороны окклюзии, нарушение рефлексов, чувствительности, тремора, атаксии, гемипареза и др., которые, однако, не всегда сопровождаются появлением разрывов церебральных сосудов в силу тех причин, что модель построена на взрослых крысах, которые значительно более устойчивы к мозговым кровотечениям, чем новорожденные животные, имеющих незрелые церебральные сосуды с тонкими стенками и наиболее подверженными стресогенному воздействию. При этом клиническая картина ишемических поражений мозга у животных наблюдается только через 72 часа после имплантации окклюдера, что не позволяет улавливать первичные маркеры нарушения ауторегуляции мозгового кровообращения. Отметим, что в клинической неврологии именно первые 24 часа являются критическими и наиболее важными с позиции ранней диагностики последствий развития острой ишемии мозга (Bryan RN, Levy LM, Whitlow WD, Killian JM, Preziosi TJ, Rosario JA. Diagnosis of acute cerebral infarction: comparison of CT and MR imaging. AJNR 1991; 12: 611-20).
Известны модели внутримозговых кровоизлияний, получаемых введением аутокрови в головной мозг подопотных животных (Поляков Н.Ф. // Ультраструктурные основы патологии сердца и сосудов. - Тбилиси, 1980 - С. 176-177) или воздействием акустического раздражителя на звукочувствительных крыс (Ничков С., Кривицкая Г. Акустический стресс и церебральные нарушения. - М., 1969). Указанные модели, однако, по особенностям патогенеза и морфологии далеки от гипертонической апоплексии у человека.
Наиболее адекватной моделью геморрагических инсультов у человека являются апоплексические кровоизлияния у крыс со спонтанной гипертензией, склонных к инсульту (КСГ-СИ) (Ганнушкина И.В., Лебедева Н.В. Гипертоническая энцефалопатия. М., 1987). Церебральные гематомы у крыс этой линии к концу жизни развиваются спонтанно, когда в органах ярко выражены сосудистые изменения (плазмопропитывание, фибриноидный некроз, гиалиноз мелких артерий и артериол), характерных для II и III стадии гипертонической болезни. Однако, эти модели не пригодны для изучения ранних этапов формирования внутримозговых кровоизлияний. К тому же частота спонтанных геморрагий у крыс этой линии не всегда одинакова (Шеллер Р. Дж., Мак Шифф Дж. С. // Артериальная гипертензия / Под. Ред. И.К. Шхвацабая, Дж. Х. Лара. - М., 1980. - С. 101-103).
Наиболее близким аналогом к заявляемому изобретению является способ моделирования внутримозговых гематом при артериальной гипертензии (Способ моделирования внутримозговых гематом при артериальной гипертензии // Патол. физиол. эксперим. тер. - 1989. - 3: 80-81). Способ заключается в том, что взрослых крыс линии КСГ-СИ со спонтанной гипертензией, склонных к инсульту, фиксируют на спине, обеспечивая полную иммобилизацию. Затем крыс подвергают воздействию сильного прерывистого звука (120 дБ) по модифицированной методике О.В. Крушинского и Л.П. Доброхотовой (Крушинский Л.В., Доброхотова Л.П. // Бюл.эксперим.биол. 1957. №8., С. 46): звук 1 мин, перерыв 1 мин, прерывистый звук 15 мин (10 с звук, 10 с перерыв), перерыв 5 мин, звук 1 мин. Этот цикл повторяется 5 раз с минутными интервалами так, чтобы общая продолжительность сочетанного действия стрессорных факторов составляла 2 часа. Воздействие звуковым стрессом осуществляется в течение 2 часов. При сочетанном воздействии иммобилизации и звукового раздражителя у 76% животных на фоне резкого полнокровия мозга развивается крупноочаговые геморрагии в разных областях мозга - в подкорковых узлах, зрительных буграх с прорывом в желудочки. В веществе мозга крупные кровоизлияния сопровождались разрушением ткани мозга на значительном протяжении до 5 мм2.
Недостатком способа, принятого за прототип, является, во-первых, тот факт, что развитие внутримозговых гематом возможно только при условии наличия у животных высоких показателей артериального давления (от 200 до 250 мм рт.ст.), используется специальная модель спонтанно-гипертензивных крыс, склонных к инсульту, т.е. требуется обеспечение генетической чистоты линии. Следствием повышенного давления у крыс линии КСГ-СИ является гипертрофия мышечной оболочки мелких артерий и артериол головного мозга, сердца и почек, что делает сосуды менее устойчивыми к разрывам. При этом, развитие интракраниальных геморрагий отмечается только у 76% крыс, таким образом, не обеспечивается 100% воспроизводимость. Важно отметить высокую травматичность данного способа, при котором отмечается гибель животных за счет развития крупных кровоизлияний, что делает его непригодным для использования новорожденных крыс.
Учитывая тот факт, что применение вышеуказанного способа сопровождается массовой гибелью новорожденных крыс до момента завершения эксперимента, перед заявляемым изобретением была поставлена задача разработать модифицированный более щадящий способ моделирования мозговых геморрагий у новорожденных животных, заключающейся в снижении силы и времени воздействия звука, а также алгоритма проведения самого эксперимента.
Технический результат заключается в повышении точности моделирования мозговых геморрагий у новорожденных животных.
Указанный технический результат достигается тем, что способ экспериментального моделирования развития мелкоочаговых мозговых геморрагий, включающий воздействие звуком, согласно решению выбирают крыс в возрасте трех дней после рождения, подвергают воздействию звука величиной 70 дБ, частотой 110 Гц непрерывно на протяжении 60 мин.
Изобретение поясняется иллюстративными материалами, на которых представлено следующее.
Фиг. 1 - Крыса перед экспериментом, скальп снят в области родничка.
Фиг. 2 - 3D изображение церебральных артерий коры головного мозга у новорожденных крыс.
Фиг. 3 - 3D изображение передней сагиттальной вены, впадающей в сагиттальный венозный синус у новорожденных крыс.
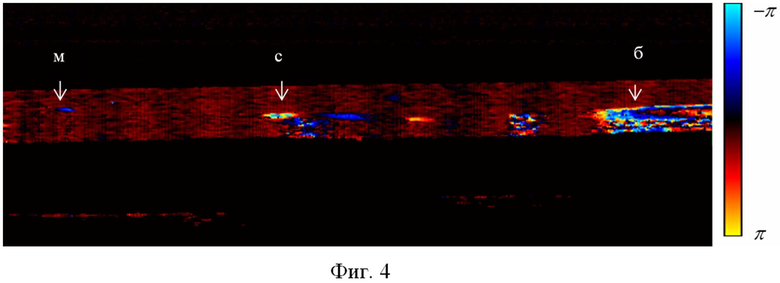
Фиг. 4 - Изображение мелких (м), среднего (с) и большого (б) диаметров артериальных сосудов мозга у новорожденных крыс с помощью оптической когерентной томографии.
Фиг. 5 - Увеличение числа функциональных капилляров в коре головного мозга крыс через 4 часа после окончания стресса. Железный гематоксилин ×400.
Фиг. 6 - Агрегация эритроцитов в расширенных венах в коре головного мозга крыс через 4 часа после окончания стресса. Железный гематоксилин ×600.
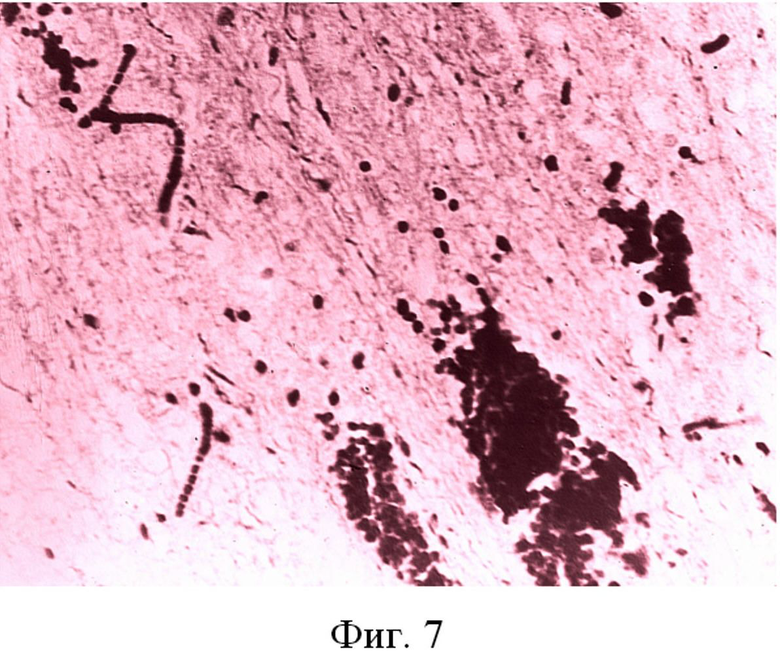
Фиг. 7 - Развитие мелкоочаговых геморрагий в мозге крыс при стрессе. Железный гематоксилин ×200.
В силу слабой подвижности новорожденных крыс (1-3 дня после рождения), животные не фиксируются, они помещаются в плексиглазовую камеру объемом 2000 см3 для звукоизоляции. Звук силой 70 дБ подается непрерывно на протяжении 60 мин.
После завершения звукового воздействия у животных (n=37) проводили исследования церебральной гемодинамики с применением когерентной оптической томографии. Измерение диаметра венозных и артериальных сосудов мозга, скорости кровотока в них и перфузии осуществляли через родничок со снятым участком скальпа (2 мм × 2 мм) под эфирной анестезией (фиг. 1-4).
Наиболее яркие изменения в мозговом кровотоке наблюдались спустя 4 часа после отмены стресса. У всех крысят отмечалось расширение передней сагиттальной вены, свидетельствуя о задержке оттока крови из полости черепа (см. таблицу). Скорость потока крови в церебральных артериях мелкого и среднего диаметра снижалась, что сопровождалось падением перфузии и развитием гипоксии.
Часть животных (n=7) умерщвлялась декапитацией с целью проведения гистологических исследований. Для световой микроскопии мозг крысы фиксировали в 96% этиловом спирте. Парафиновые срезы окрашивали метиленовым синим и гематоксилино-эозином по методу Ниссля. Исследования выявили наличие полнокровия мозга у всех животных через 4 часа после отмены стресса за счет венозного застоя (фиг. 5 и 6).
Через 24 часа после отмены стресса патологические изменения в венозном кровотоке прогрессировали. У 100% животных диаметр сагиттальной вены увеличивался в 4 раза, что сопровождалось расширением церебральных артерий и падением скорости кровотока и перфузии в них, что свидетельствует о развитии церебральной гипотензии (таблица). Гистологические исследования выявили у всех испытуемых животных (n=30) наличие мелкоочаговых геморрагий в коре и подкорковых узлах (фиг. 7).
Предлагаемый способ позволяет приблизить модель к естественным причинам происхождения мозговых геморрагий в неонатальный период, обеспечивает высокую воспроизводимость и снижение травматичности при проведении исследований, а также расширяет экспериментальные возможности изучения развития мозговых геморрагий на разных стадиях их формирования.
Преимуществом предлагаемого способа является возможность моделировать развитие церебральных кровоизлияний без дополнительной подготовки животных, не требуется наличия гипертензивного статуса, формирование мозговых гематом достигается путем воздействия сильного стресса у здоровых животных. Новым является подход, при котором моделируется развитие мозговых геморрагий у новорожденных крыс, что позволяет существенно расширить исследовательские возможности в поиске диагностических маркеров и новых методов терапии мозговых кровотечений, являющихся основной причиной инвалидизации и смертности детей в перинатальный период. Предлагаемый способ по сравнению с аналогами за счет снижения силы звука, сокращения времени и алгоритма стрессорного воздействия позволяет получить мелкоочаговые мозговые геморрагии без разрыва крупных сосудов, что наиболее близко соответствует клинической картине развития мозговых геморрагий у новорожденных детей.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ МОДЕЛИРОВАНИЯ РАЗВИТИЯ МОЗГОВЫХ ГЕМОРРАГИЙ У ГИПЕРТЕНЗИВНЫХ МЫШЕЙ | 2017 |
|
RU2678798C1 |
| Способ моделирования геморрагического инсульта у крыс | 2019 |
|
RU2721289C1 |
| Способ моделирования церебральных гематом | 1987 |
|
SU1515188A1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ФОКАЛЬНОЙ ИШЕМИИ ГОЛОВНОГО МОЗГА | 2015 |
|
RU2639787C1 |
| КОМБИНАЦИЯ КАРБОСТИРИЛА И КАРНИТИНА | 2009 |
|
RU2506950C2 |
| СПОСОБ МОДЕЛИРОВАНИЯ ИШЕМИЧЕСКОГО ПОРАЖЕНИЯ ГОЛОВНОГО МОЗГА | 2009 |
|
RU2432619C2 |
| Способ хирургического лечения структурной эпилепсии у детей | 2020 |
|
RU2743833C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ЦЕРЕБРАЛЬНОГО СОСУДИСТОГО СПАЗМА ПРИ НЕТРАВМАТИЧЕСКОМ СУБАРАХНОИДАЛЬНОМ КРОВОИЗЛИЯНИИ IN VIVO | 2014 |
|
RU2572482C1 |
| Средство для лечения ишемии сосудов головного мозга | 2016 |
|
RU2625740C1 |
| СПОСОБ КОРРЕКЦИИ НАРУШЕНИЙ МИКРОЦИРКУЛЯЦИИ ПРИ ХРОНИЧЕСКОЙ ИШЕМИИ ГОЛОВНОГО МОЗГА В ЭКСПЕРИМЕНТЕ | 2014 |
|
RU2546916C1 |





Изобретение относится к экспериментальной медицине и касается моделирования мелкоочаговых мозговых геморрагий у новорожденных крыс. Для этого новорожденных крыс в возрасте 3-х дней помещают в камеру и подвергают воздействию звука силой 70 дБ, частотой 110 Гц, на протяжении 60 минут. Способ обеспечивает развитие мелкоочаговых мозговых геморрагий в коре головного мозга у 100% новорожденных крыс, без разрыва крупных сосудов, что наиболее близко соответствует клинической картине мозговых геморрагий у новорожденных детей. 7 ил., 1 табл.
Способ экспериментального моделирования развития мелкоочаговых мозговых геморрагий, включающий воздействие звуком, отличающийся тем, что выбирают крыс в возрасте трех дней после рождения, подвергают воздействию звука величиной 70 дБ, частотой 110 Гц непрерывно на протяжении 60 мин.
| СПОСОБ МОДЕЛИРОВАНИЯ И ИССЛЕДОВАНИЯ ПОСЛЕДСТВИЙ ГЕМОРРАГИЧЕСКОГО ИНСУЛЬТА | 2007 |
|
RU2361283C1 |
| Способ моделирования геморрагического инсульта | 1990 |
|
SU1767518A1 |
| CN 101023864 А, 29.08.2007 | |||
| ТИХОНОВСКИЙ А.В | |||
| Сравнительная фармакологическая активность пикамилона и пирацетама в условиях моделирования ишемического и геморрагического повреждения головного мозга | |||
| Пикамилон - новый цереброваскулярный и ноотропный препарат | |||
| Механизм для сообщения поршню рабочего цилиндра возвратно-поступательного движения | 1918 |
|
SU1989A1 |
| MANAENKO A, | |||
Авторы
Даты
2014-01-27—Публикация
2012-10-24—Подача