Изобретение относится к области биотехнологии и может быть использовано для повышения эффективности и достоверности определения уровня токсикантов в воде, продуктах питания или физиологических жидкостях путем проведения твердофазного иммуноферментного анализа.
Из уровня техники известен способ проведения иммуноферментного анализа, включающий адсорбцию антигенов на твердой фазе физической сорбции, инкубацию тестируемых биологических образцов, инкубацию конъюгатсодержащего раствора, спектрофотометрический анализ реакции по экстинции раствора хромагента (RU 2014610 C1, G01N 33/53, 1994).
Также известен способ определения уровня токсикантов в воде, продуктах питания или физиологических жидкостях путем проводимого в колонке тест-системы иммуноферментного анализа, включающий размещение в колонке носителя в виде слоя иммуноаффинного геля с привитыми антивидовыми антителами, зафиксированного между двумя пористыми мембранами, обработку носителя блокирующим раствором для закрытия на носителе оставшихся свободными мест неспецифического связывания, иммобилизацию на носителе специфических антител, внесение тестируемых образцов, обработку носителя конъюгатсодержащим раствором и анализ обработанного носителя на изменение окраски (RU 2374649 C1, G01N 33/53, 2009). Несмотря на достаточную простоту точность визуального определения уровня токсикантов в данном способе недостаточно высокая.
Кроме того, известна тест-система для иммуноферментного определения токсикантов, включающая колонку, в которой установлен носитель в виде слоя иммуноаффинного геля с привитыми специфическими антителами, размещенного между двумя пористыми мембранами (RU 2374649 C1, G01N 33/53, 2009). Недостатком данного устройства является отсутствие средств, обеспечивающих измерение уровня токсикантов.
Технический результат, на получение которого направлено изобретение, заключается в повышении эффективности и достоверности иммуноферментного определения уровня токсикантов в воде, продуктах питания или физиологических жидкостях, проводимого в колонке тест-системы.
Решение поставленной задачи с достижением заявленного технического результата обеспечивается тем, что в способе определения уровня токсикантов в воде, продуктах питания или физиологических жидкостях путем проводимого в колонке тест-системы твердофазного иммуноферментного анализа, включающем размещение в колонке носителя с привитыми антивидовыми антителами, обработку носителя блокирующим раствором для закрытия на носителе оставшихся свободными мест неспецифического связывания, иммобилизацию на носителе специфических антител, внесение тестируемых образцов, обработку носителя конъюгатсодержащим раствором и анализ обработанного носителя, согласно изобретению, в качестве носителя используют активированную твердую фазу физической сорбции - активированную пористую подложку с привитыми антивидовыми антителами, а в качестве конъюгатсодержащего раствора используют раствор конъюгата антигена - токсиканта, химически связанного с люминесцентными квантовыми точками или с липосомами, содержащими люминесцентные квантовые точки, при этом уровень токсикантов определяют по интенсивности люминесценции, возбужденной в квантовых точках при освещении обработанного носителя возбуждающим излучением.
При этом активированную пористую подложку приготовляют путем обработки ультразвуком выполненной из полипропилена чистой пористой подложки - фритта, помещенной в этанол - 96% этиловый спирт, с последующей промывкой - последовательным пропусканием через пористую мембрану 50% этилового спирта.
Решение поставленной задачи обеспечивается также тем, что в тест-системе для способа определения уровня токсикантов в воде, продуктах питания или физиологических жидкостях, включающей колонку, в которой установлен носитель с привитыми специфичными к токсиканту антителами, отличающаяся тем, что носитель выполнен в виде активированной твердой фазы физической сорбции -активированной пористой подложки с привитыми специфичными к токсиканту антителами, колонка снабжена устройством для измерения уровня люминесценции, включающим источник возбуждающего излучения и фотоприемник, причем перед фотоприемником дополнительно установлена фокусирующая оптическая система, а выход фотоприемника электрически подключен через усилитель сигнала и аналого-цифровой преобразователь к блоку управления - контроллеру, к выходу которого подключены блок индикации и через блок стабилизации источник возбуждающего излучения, при этом боковые стенки колонки выполнены из прозрачного для возбуждающего и люминесцентного излучения материала.
Кроме того, перед фокусирующей оптической системой может быть размещен светофильтр.
Благодаря наличию в растворе конъюгата люминесцентных квантовых точек (или липосом, содержащих люминесцентные квантовые точки), химически связанных с молекулами антигена - токсиканта, которые обладают способностью связываться с сорбированными на носителе - активированной пористой подложке специфическими антителами, оставшимися свободными после связывания с находящимися в анализируемой среде молекулами токсиканта, и при освещении возбуждающим излучением люминесцируют, в заявленном изобретении, реализующим прямой конкурентный твердофазный иммуноферментный анализ, обеспечивается увеличение интенсивности полезного сигнала люминесценции, обратно пропорционального концентрации токсинов, что повышает чувствительность способа определения уровня токсикантов в воде, продуктах питания или физиологических жидкостях. Кроме того, наличие в заявленной тест-системе устройства для измерения уровня люминесценции, включающего источник возбуждающего излучения и фотоприемник, которые подключены к блоку управления - контроллеру, позволяет в автоматическом режиме просто и достоверно определять уровень токсикантов по степени интенсивности люминесценции, возбужденной в квантовых точках.
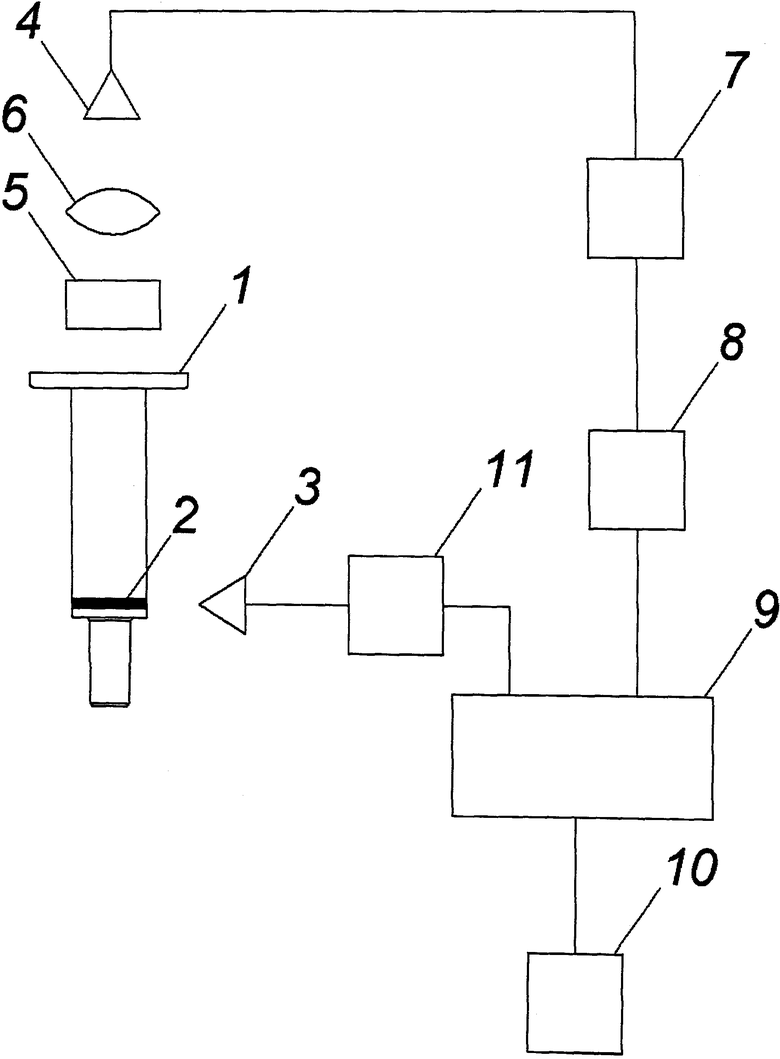
На чертеже схематично подставлен общий вид тест-системы.
Заявленная тест-система для определения уровня токсикантов в воде, продуктах питания или физиологических жидкостях включает колонку 1 с боковыми стенками, выполненными из прозрачного для возбуждающего и люминесцентного излучения материала, в которой установлен носитель в виде активированной твердой фазы физической сорбции - активированной пористой подложки 2 с привитыми специфическими антителами, и устройство для измерения уровня люминесценции. При этом устройство для измерения уровня люминесценции включает источник 3 возбуждающего излучения, выполненный, например, в виде набора светодиодов с максимумами длин волн излучения в диапазоне 395÷500 нм, и фотоприемник 4 (фотодиод), спектральный диапазон чувствительности которого лежит в диапазоне 420÷675 нм, причем перед фотоприемником 4 дополнительно установлены светофильтр 5, спектр пропускания которого соответствуют спектру люминесценции, и фокусирующая оптическая система 6 (например, собирающая линза F=5÷30 мм). Выход фотоприемника 4 электрически подключен через усилитель 7 сигнала и аналого-цифровой преобразователь 8 к блоку 9 управления - контроллеру, к выходу которого подключены блок 10 индикации и через блок 11 стабилизации источник 3 возбуждающего излучения.
Заявленный способ определения уровня токсикантов, реализуют следующим образом.
Активированную твердую фазу физической сорбции приготовляют путем обработки (активирования) в течение 15 минут выполненной из полипропилена пористой подложки 2 ультразвуком в этаноле - 96% этиловом спирте, с последующей промывкой - последовательным пропусканием через пористую подложку 2 пропускания 500 мкл водно-спиртового раствора - 50% этилового спирта, 500 мкл воды и 700 мкл карбонатного буфера (0,1 М гидрокарбоната натрия, 0,1 М хлорида натрия, pН 8,3).
После активирования на поверхность пористой подложки 2 наносят 500 мкл раствора антивидовых антител (кроличьих антимышиных антител) с концентрацией 5 мкг/мл в карбонатном буфере (0,1 М гидрокарбоната натрия, 0,1 М хлорида натрия, pН 8,3) и инкубируют в течение 20 минут при температуре 37°C. Затем пористую подложку 2 с привитыми антивидовыми антителами промывают с помощью 1 мл фосфатного буфера (pH 7.4-7.6), содержащего 0,05% Tween 20, и для ее блокирования наносят на поверхность 500 мкл 3% раствора казеина в фосфатном буфере (pH 7.4-7.6) в течение 15 минут.
После блокирования пористую подложку 2 промывают 1 мл фосфатного буфера (pH 7.4-7.6) и на ее поверхность наносят 500 мкл раствора антител, специфичных к токсину, например к зераленону, (разведение 1/10000), инкубируют в течение 15 мин при температуре 37°С и промывают 3 мл фосфатного буфера (pH 7.4-7.6).
Подготовленный таким образом носитель в виде активированной твердой фазы физической сорбции - активированной пористой подложки 2 с привитыми специфическими антителами устанавливают в пустую колонку 1 типа Bond Elut V=1 мл, предварительно промытую фосфатным буфером (pH 7.4-7.6), и хранят при 4°С.
Пример 1.
Для определения уровня токсиканта, например, концентрации зераленона, в анализируемой среде (природной воде) предварительно приготовляют - синтезируют раствор конъюгата зераленона, связанного с люминесцентными квантовыми точками - полупроводниковые наночастицы CdSe/ZnS, следующим образом.
В 1 мл диметилформамида растворяют 92 мг н-гидроксисукцинимида и 124 мг 1-этил-3-(3-диметиламинопропил)карбодиимида. Образовавшийся раствор разводят в 1000 раз в диметилформамиде (необходимая концентрация 0.8 µмоль). Затем 20 µл полученного раствора сливают с 800 µл раствора квантовых точек CdSe/ZnS (разведение 1/10 в карбонатном буфере (0,1 М гидрокарбоната натрия, 0,1 М хлорида натрия, pH 8,3), количество квантовых точек CdSe/ZnS равно 3.2×10-4 µmol), и перемешивают в течение 45 минут, после чего капельно добавляют 176 µл раствора зераленона (0,4 мг/мл), химически связанного с яичным альбумином, в фосфатном буфере (pH 7.4-7.6)). Реакционую смесь постоянно перемешивают в течение 12 часов при температуре 4°C. Избыток низкомолекулярных веществ удаляют с помощью диализа в течение 2 дней при температуре 4°С. Полученные конъюгаты хранят при температуре 4°С.
Через подготовленную выше описанным образом колонку 1, в которой установлена активированная пористая подложка 2 с привитыми специфическими антителами, пропускают 1 мл анализируемой среды и промывают колонку 1 фосфатным буфером (pH 7.4÷7.6), содержащим 0,05% Tween 20.
Затем в колонку 1 вводят 100 мкл предварительно приготовленного раствора конъюгата токсиканта - зераленона, связанного с люминесцентными квантовыми точками - полупроводниковые наночастицы CdSe/ZnS (разведение 1/30 в фосфатном буфере (pH 7.4÷7.6), содержащем 0,05% Tween 20 и 0,2% бычьего сывороточного альбумина), и инкубируют в течение 6 минут. Избыток конъюгата удаляют путем промывания колонки 1 фосфатным буфером (pH 7.4÷7.6) и осуществляют освещение обработанной пористой подложки 2, содержащей люминесцентные квантовые точки - полупроводниковые наночастицы, световым потоком, поступающим от источника 3 возбуждающего излучения устройства для измерения уровня люминесценции.
При этом, если в анализируемой среде концентрация токсиканта - зераленона превышает концентрацию сорбированных на пористой подложке 2 специфических антител, которая соответствует, например, предельно допустимой концентрации токсиканта, то происходит связывание всех специфических антител с молекулами токсиканта - зераленона, а при пропускании через пористую подложку 2 раствора конъюгата токсиканта - зераленона с флуоресцентными метками - люминесцентными квантовыми точками из-за отсутствия свободных специфических антител содержащиеся в конъюгате молекулы токсиканта - зераленона остаются несвязанными (свободными) и удаляются после промывки из колонки 1 вместе с люминесцентными квантовыми точками - полупроводниковые наночастицы CdSe/ZnS. В результате при облучении пористой подложки 2 источником 3 возбуждающего излучения люминесценция не возникает.
В том случае, если в анализируемой среде концентрация токсиканта - зераленона не превышает концентрацию сорбированных на пористой подложке 2 специфических антител, которая соответствует, например, предельно допустимой концентрации токсиканта, или токсикант - зераленон в анализируемой среде отсутствует, то происходит связывание только части специфических антител с молекулами токсиканта - зераленона, и при пропускании через пористую подложку 2 раствора конъюгата токсиканта - зераленона с флуоресцентными метками - люминесцентными квантовыми точками происходит связывания оставшихся свободными специфических антител с содержащиеся в конъюгате молекулами токсиканта - зераленона, содержащими люминесцентные квантовые точки - полупроводниковые наночастицы CdSe/ZnS. В результате при облучении пористой подложки 2 источником 3 возбуждающего излучения возникает люминесценция, уровень которой обратно пропорционален концентрации токсиканта - зераленона в анализируемой среде.
При этом поступающий из пористой подложки 2 суммарный световой фронт, состоящий из полезного сигнала люминесценции и паразитного сигнала возбуждающего излучения, проходит через светофильтр 5, который ослабляет паразитный сигнал, и отфильтрованный суммарный световой фронт с выделенным полезным сигналом фокусируется оптической системой 6 на фотоприемник 4 (фотодиод). Выработанный на выходе фотоприемника 4 электрический сигнал (значение напряжения которого соответствует уровню люминесценции) усиливается усилителем сигнала 7, оцифровывается с помощью аналого-цифрового преобразователя 8 и в цифровом представлении передается для регистрации на вход блока 9 управления - контроллера для регистрации уровня люминесценции, где обрабатывается, путем сопоставления с предварительно занесенными в память калибровочными постоянными, и количественное значение уровня люминесценции, обратно пропорциональное концентрации токсиканта - зераленона, и/или соответствующее значение уровня (концентрации) токсиканта заносится в память блока 9 управления - контроллера и отображается в блоке 10 индикации.
Кроме того, блок 9 управления - контроллер в соответствии с заложенным программным алгоритмом в автоматическом режиме осуществляет программируемое управление работой светодиодов источника 4 возбуждающего излучения, нормируя посредством блока 11 стабилизации напряжение источника 1 возбуждающего излучения, и обеспечивает сохранение в памяти параметров калибровочных постоянных (калибровочной кривой), значения которых определяются в процессе предварительных тарировочных измерений с использованием стандартных источников возбуждающего излучения и предварительной калибровки колонки 1 с использованием образцов анализируемой среды, содержащей токсиканты, например, зераленон, известной концентрации.
Пример 2.
Для определения уровня токсиканта, например, концентрации зераленона, в анализируемой среде (природной воде) предварительно приготовляют поэтапно раствор конъюгата зераленона с липосомами, содержащими водорастворимые люминесцентные квантовые точки - полупроводниковые наночастицы CdSe/ZnS, следующим образом.
На первом этапе методом гидратирования тонких пленок готовят липосомы, содержащие водорастворимые люминесцентные квантовые точки - полупроводниковые наночастицы CdSe/ZnS. Для этого 70 мг (94 µмоль) фосфолипидов (Lipoid S75) растворяют в 1 мл хлороформа в круглодонной колбе (V=10 мл). Затем хлороформ выпаривают с помощью роторного испарителя до образования пленки фосфолипидов на стенках колбы. Образовавшуюся пленку фосфолипидов обрабатывают 6 мл воды, содержащей 5 µмоль квантовых точек CdSe/ZnS, и перемешивают в течение 30 минут при температуре 45°C. Затем раствор обрабатывают ультразвуком в течение 5 минут для достижения приемлемого размера частиц липосом (порядка 100 нм). Полученный раствор, содержащий липосомы с водорастворимыми квантовыми точками CdSe/ZnS, хранят при температуре 45°C.
На втором этапе осуществляют синтез конъюгата зераленона с липосомами, содержащими квантовые точки.
Для этого к 0,4 мл раствора, содержащего липосомы с инкорпорированными квантовыми точками - полупроводниковыми наночастицами CdSe/ZnS, капельно при постоянном перемешивании добавляют 0,5 мл 2,5% раствора глутарового альдегида в воде, после чего образовавшийся раствор перемешивают в течение 3 часов при комнатной температуре. Избыток глутарового альдегида удаляют с помощью диализа в течение 2 дней при температуре 4°C. Затем капельно при постоянном перемешивании в течение 2 часов при комнатной температуре добавляют 98 µг раствора зераленона (0,4 мг/мл), химически связанного с яичным альбумином, в фосфатном буфере (pH 7.4-7.6). Затем добавляют 60 µл 3 М глицина в растворе гидроксида натрия (pH 7,2) для блокирования оставшихся свободными альдегидных групп глутарового альдегида на поверхности липосом. Полученную смесь выдерживают при температуре 4°С при постоянном перемешивании. Избыток не прореагировавших компонентов удаляют с помощью диализа в течение 3 часов. Полученные конъюгаты хранят при температуре 4°C.
Затем аналогично примеру 1 через подготовленную вышеописанным образом колонку 1, в которой установлена активированная пористая подложка 2 с привитыми специфическими антителами, пропускают 1 мл анализируемой среды и промывают колонку 1 фосфатным буфером (pH 7.4÷7.6), содержащим 0,05% Tween 20.
Потом в колонку 1 вводят 100 мкл предварительно приготовленного раствора конъюгата зераленона с липосомами, содержащими водорастворимые люминесцентные квантовые точки - полупроводниковые наночастицы CdSe/ZnS (разведение 1/20 в фосфатном буфере (pH 7.4-7.6)), и инкубируют в течение 6 минут. Избыток конъюгата удаляют путем промывания колонки 1 фосфатным буфером (pH 7.4÷7.6), и осуществляют освещение обработанной пористой перегородки 2, содержащей люминесцентные квантовые точки - полупроводниковые наночастицы, световым потоком, поступающим от источника 3 возбуждающего излучения. При этом происходит оптическое возбуждение люминесценции, уровень которой, обратно пропорциональный концентрации токсиканта, регистрируют устройством для измерения уровня люминесценции описанным выше образом.
Пример 3.
Для определения уровня токсиканта, например, концентрации зераленона, в анализируемой среде (природной воде) предварительно приготовляют поэтапно раствор конъюгата зераленона с липосомами, содержащими гидрофобные люминесцентные квантовые точки - полупроводниковые наночастицы CdSe/ZnS, следующим образом.
На первом этапе 70 мг (94 µмоль) фосфолипидов (Lipoid S75) и 30 пмоль гидрофобных квантовых точек (lem=577 nm) в толуоле (52 µл) of wisQDs растворяют в 1 мл хлороформа в круглодонной колбе (V=10 мл) при воздействии ультразвуком при температуре 45°С.
Затем в образовавшийся раствор добавляют 3 мл воды и хлороформ выпаривают с помощью роторного испарителя. После этого добавляют еще 3 мл воды и в течение 60 минут перемешивают раствор с образовавшимися липосомами при температуре 45°C.
Затем раствор обрабатывают ультразвуком в течение 5 минут для достижения приемлемого размера частиц липосом (порядка 100 нм). Полученный раствор, содержащий липосомы с гидрофобными квантовыми точками CdSe/ZnS, хранят при температуре 45°C.
На втором этапе осуществляют синтез конъюгата зераленона с липосомами, содержащими квантовые точки.
Для этого к 0,4 мл раствора, содержащего липосомы с инкорпорированными квантовыми точками - полупроводниковыми наночастицами CdSe/ZnS, капельно при постоянном перемешивании добавляют 0,5 мл 2,5% раствора глутарового альдегида в воде, после чего образовавшийся раствор перемешивают в течение 3 часов при комнатной температуре. Избыток глутарового альдегида удаляют с помощью диализа в течение 2 дней при температуре 4°С. Затем капельно при постоянном перемешивании в течение 2 часов при комнатной температуре добавляют 98 µг раствора зераленона (0,4 мг/мл), химически связанного с яичным альбумином, в фосфатном буфере (pH 7.4-7.6). Затем добавляют 60 µл 3 М глицина в растворе гидроксида натрия (pH 7,2) для блокирования оставшихся свободными альдегидных групп глутарового альдегида на поверхности липосом. Полученную смесь выдерживают при температуре 4°С при постоянном перемешивании. Избыток не прореагировавших компонентов удаляют с помощью диализа в течение 3 часов. Полученные конъюгаты хранят при температуре 4°С.
Затем аналогично примеру 1 через подготовленную вышеописанным образом колонку 1, в которой установлена активированная пористая подложка 2 с привитыми специфическими антителами, пропускают 1 мл анализируемой среды и промывают колонку 1 фосфатным буфером (pH 7.4÷7.6), содержащим 0,05% Tween 20.
Потом в колонку 1 вводят 100 мкл предварительно подготовленного раствора конъюгата зераленона с липосомами, содержащими гидрофобные люминесцентные квантовые точки - полупроводниковые наночастицы CdSe/ZnS, (разведение 1/45 в фосфатном буфере (pH 7.4-7.6)), и инкубируют в течение 6 минут. Избыток конъюгата удаляют с помощью промывания колонки 1 фосфатным буфером (pH 7.4÷7.6).
После промывания колонки 1 осуществляют освещение обработанной пористой перегородки 2, содержащей люминесцентные квантовые точки - полупроводниковые наночастицы, световым потоком, поступающим от источника 3 возбуждающего излучения, при этом происходит оптическое возбуждение люминесценции, обратно пропорциональное концентрации токсиканта, которое регистрируется устройством для измерения уровня люминесценции описанным выше образом.
Заявленное изобретение обеспечивает возможность определения уровня токсикантов в воде, продуктах питания или физиологических жидкостях путем проводимого в колонке тест-системы прямого конкурентного твердофазного иммуноферментного анализа уровня токсиканта с пределом обнаружения (чувствительностью) 1÷3 нг/мл.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ УРОВНЯ ТОКСИКАНТОВ В ВОДЕ, ПРОДУКТАХ ПИТАНИЯ ИЛИ ФИЗИОЛОГИЧЕСКИХ ЖИДКОСТЯХ И ТЕСТ-СИСТЕМА | 2013 |
|
RU2547577C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ УРОВНЯ ТОКСИКАНТОВ В ВОДЕ, ПРОДУКТАХ ПИТАНИЯ ИЛИ ФИЗИОЛОГИЧЕСКИХ ЖИДКОСТЯХ И ТЕСТ-СИСТЕМА | 2013 |
|
RU2538707C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ УРОВНЯ ТОКСИКАНТОВ В ВОДЕ, ПРОДУКТАХ ПИТАНИЯ ИЛИ ФИЗИОЛОГИЧЕСКИХ ЖИДКОСТЯХ И ТЕСТ-СИСТЕМА | 2012 |
|
RU2508553C1 |
| Способ диагностики вируса простого герпеса | 2018 |
|
RU2702000C2 |
| Способ изготовления материала люминесцентного сенсора и устройство люминесцентного сенсора для анализа кислых и основных компонентов в газовой фазе | 2017 |
|
RU2758182C2 |
| АЛКИНИЛФОСФИНОВЫЕ ЗОЛОТОМЕДНЫЕ КОМПЛЕКСЫ КАК ЛЮМИНИСЦЕНТНЫЕ МЕТКИ ДЛЯ ФЛУОРЕСЦЕНТНОЙ МИКРОСКОПИИ | 2013 |
|
RU2541794C1 |
| СПОСОБ ГИДРОФИЛИЗАЦИИ КВАНТОВЫХ ТОЧЕК | 2021 |
|
RU2786239C1 |
| ФЛУОРЕСЦЕНТНЫЙ ГИДРОГЕЛЬ ДЛЯ ДЕТЕКЦИИ БИОЛОГИЧЕСКИХ МОЛЕКУЛ | 2023 |
|
RU2814452C1 |
| ЗАЩИТНЫЙ ЭЛЕМЕНТ ДЛЯ ИДЕНТИФИКАЦИИ ПОДЛИННОСТИ ИЗДЕЛИЙ | 2013 |
|
RU2533209C1 |
| СПОСОБ МНОГОАНАЛИТНОГО ИММУНОАНАЛИЗА | 2001 |
|
RU2184970C1 |
Группа изобретений относится к области биотехнологии и может быть использована для определения уровня токсикантов в воде, продуктах питания или физиологических жидкостях. Способ осуществляют путем проведения в колонке тест-системы иммуноферментного анализа, включающего размещение в колонке носителя с привитыми антивидовыми антителами, обработку носителя блокирующим раствором, иммобилизацию на носителе специфических антител, внесение тестируемых образцов, обработку носителя конъюгатсодержащим раствором и анализ обработанного носителя. В качестве носителя используют активированную пористую подложку с привитыми антивидовыми антителами, а в качестве конъюгатсодержащего раствора - раствор конъюгата антигена - токсиканта, химически связанного с люминесцентными квантовыми точками или с липосомами, содержащими люминесцентные квантовые точки. Уровень токсикантов определяют по интенсивности люминесценции, возбужденной в квантовых точках при освещении обработанного носителя возбуждающим излучением. Тест-система для данного способа включает колонку, которая снабжена устройством для измерения уровня люминесценции, включающим источник возбуждающего излучения и фотоприемник. Перед фотоприемником дополнительно установлена фокусирующая оптическая система, а выход фотоприемника электрически подключен через усилитель сигнала и аналого-цифровой преобразователь к контроллеру, к выходу которого подключены блок индикации и источник возбуждающего излучения. Изобретение повышает эффективность и достоверность определения. 2 н. и 2 з.п. ф-лы, 3 пр., 1 ил.
1. Способ определения уровня токсикантов в воде, продуктах питания или физиологических жидкостях путем проводимого в колонке тест-системы иммуноферментного анализа, включающий размещение в колонке носителя с привитыми антивидовыми антителами, обработку носителя блокирующим раствором для закрытия на носителе оставшихся свободными мест неспецифического связывания, иммобилизацию на носителе специфических антител, внесение тестируемых образцов, обработку носителя конъюгатсодержащим раствором и анализ обработанного носителя, отличающийся тем, что в качестве носителя используют активированную твердую фазу физической сорбции - активированную пористую подложку с привитыми антивидовыми антителами, а в качестве конъюгатсодержащего раствора используют раствор конъюгата антигена - токсиканта, химически связанного с люминесцентными квантовыми точками или с липосомами, содержащими люминесцентные квантовые точки, при этом уровень токсикантов определяют по интенсивности люминесценции, возбужденной в квантовых точках при освещении обработанного носителя возбуждающим излучением.
2. Способ по п.1, отличающийся тем, что активированную пористую подложку приготовляют путем обработки ультразвуком выполненной из полипропилена чистой пористой подложки, помещенной в этанол - 96%-ный этиловый спирт, с последующей промывкой - последовательным пропусканием через пористую подложку 50%-ного этилового спирта.
3. Тест-система для способа определения уровня токсикантов в воде, продуктах питания или физиологических жидкостях по п.1, включающая колонку, в которой установлен носитель с привитыми специфичными к токсиканту антителами, отличающаяся тем, что носитель выполнен в виде активированной твердой фазы физической сорбции - активированной пористой подложки с привитыми специфичными к токсиканту антителами, колонка снабжена устройством для измерения уровня люминесценции, включающим источник возбуждающего излучения и фотоприемник, причем перед фотоприемником дополнительно установлена фокусирующая оптическая система, а выход фотоприемника электрически подключен через усилитель сигнала и аналого-цифровой преобразователь к блоку управления - контроллеру, к выходу которого подключены блок индикации и через блок стабилизации источник возбуждающего излучения, при этом боковые стенки колонки выполнены из прозрачного для возбуждающего и люминесцентного излучения материала.
4. Тест-система по п.3, отличающаяся тем, что перед фокусирующей оптической системой размещен светофильтр.
| ТЕСТ-СИСТЕМА ДЛЯ ИММУНОФЕРМЕНТНОГО ОПРЕДЕЛЕНИЯ ТОКСИКАНТОВ | 2008 |
|
RU2374649C1 |
| УСТРОЙСТВО ДЛЯ ТЕСТ-ОПРЕДЕЛЕНИЯ АНАЛИТА | 2008 |
|
RU2364870C1 |
| Леоненко И.И | |||
| и др | |||
| Методы определения нефтепродуктов в водах и других объектах окружающей среды (обзор) | |||
| Методы и объекты химического анализа, 2010, т.5, №2, с.58-72 | |||
| Карагушева М.А., Басова Е.Ю., Горячева И.Ю | |||
| Разработка иммунохимических тест-методов для определения микотоксинов в | |||
Авторы
Даты
2014-02-10—Публикация
2012-10-01—Подача