Изобретение относится к области химии металлорганических соединений, в частности к гетерометаллическим золотомедным комплексам, которые проявляют люминесцентные свойства и могут быть использованы в качестве меток для флуоресцентной микроскопии и в люминесцентном анализе. Изобретение может найти применение в аналитической химии, молекулярной биологии, биотехнологии, фармакологии и медицине для анализа in vitro.
В настоящее время известны комплексы переходных металлов (далее КПМ), которые проявляют люминесцентные свойства и используются в качестве меток в флуоресцентной микроскопии [1]. Такие комплексы обладают рядом преимуществ, по сравнению, например, с метками на основе органических люминофоров: их люминесценция характеризуется большими Стоксовыми сдвигами и большими временами жизни возбужденного состояния. Большой Стоксовый сдвиг упрощает разделение сигналов люминесценции и возбуждающего излучения и уменьшает самотушение в растворе. Большее время жизни возбужденного состояния люминесцентных КПМ позволяет, используя регистрацию времени затухания свечения образца (FLIM, fluorescence life time imaging), отсекать автофлюоресценцию биологических образцов, и тем самым повышать контрастность изображения и чувствительность детектирования.
Для практического применения наиболее интересны комплексы, способные к специфическому связыванию с определенными биомолекулами или клеточными структурами, и одним из типов меток на основе КПМ являются метки для ковалентного связывания белками [2].
К существенным недостаткам используемых в настоящий время меток на основе КПМ относится то, что люминесценция подавляющего большинства таких люминофоров подвержена тушению молекулярным кислородом и в присутствии воздуха квантовый выход люминесценции уменьшается на порядок по сравнению с дегазированным раствором.
Известны золотомедные алкинилфосфиновые комплексы, которые по решаемой технической задаче являются наиболее близкими к заявляемому изобретению и принятые в качестве прототипа [3]. Общее с заявленным изобретением является то, что комплексы-прототипы обладают интенсивной люминесценцией, микросекундными временами жизни и люминесценция комплексов незначительно снижается в присутствии кислорода.
Недостатком известных комплексов является относительно узкая область их применения за счет нерастворимости их в воде и физиологических средах, а также невозможности связывания их с белками.
Техническим результатом заявляемого изобретение является расширение области применения за счет возможности связывания с белками. Важным при этом в заявляемом изобретении является сохранение интенсивной люминесценции, в том числе и при наличии молекулярного кислорода.
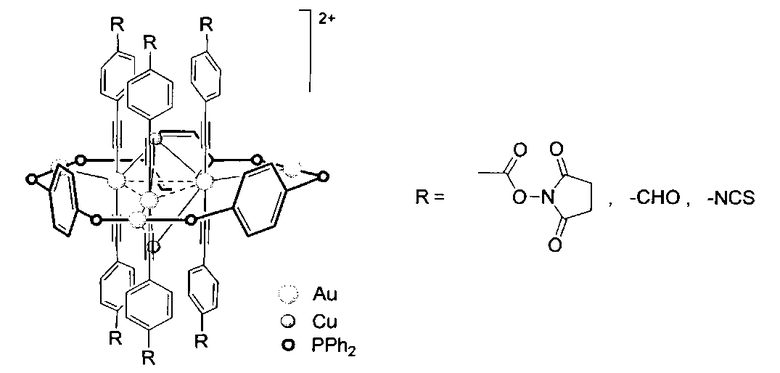
Указанный технический результат достигается тем, что алкинилфосфиновые золотомедные комплексы, диссоциирующие в растворе с образованием ионов, способны образовывать ковалентные аддукты с аминогруппами, в частности с аминогруппами белков
что позволяет использовать их в качестве люминесцентных меток для флуоресцентной микроскопии.
Сущность заявляемого изобретения поясняется примерами конкретной реализации, которые иллюстрируются Фиг. 1-5.
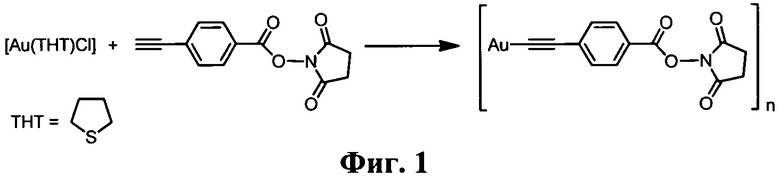
На Фиг. 1 представлена схема синтеза комплекса [AuC2C6H4-4-COONC4H4O2].
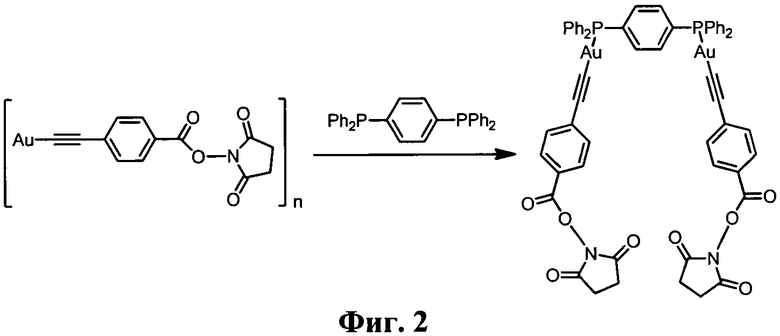
На Фиг. 2 представлена схема синтеза комплекса [Au2(С2С6Н4-4-COONC4H4O2)2 PPh2C6H4PPh2].
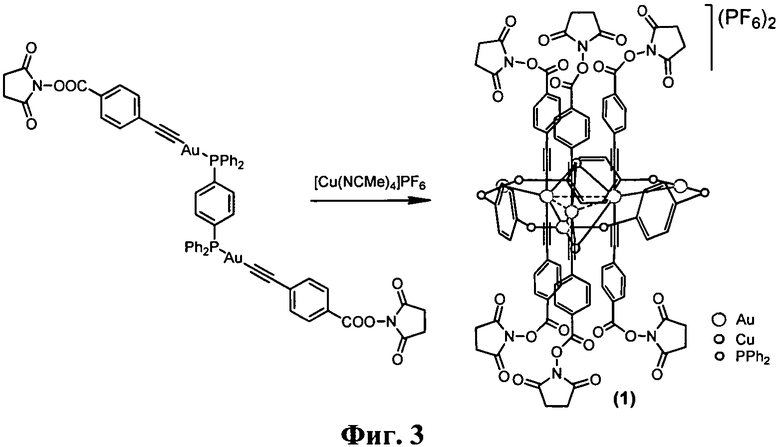
На Фиг. 3 представлена схема синтеза комплекса [Au6Cu2(С2С6Н4-4-COONC4H4O2)6(PPh2C6H4PPh2)3](PF6)2..
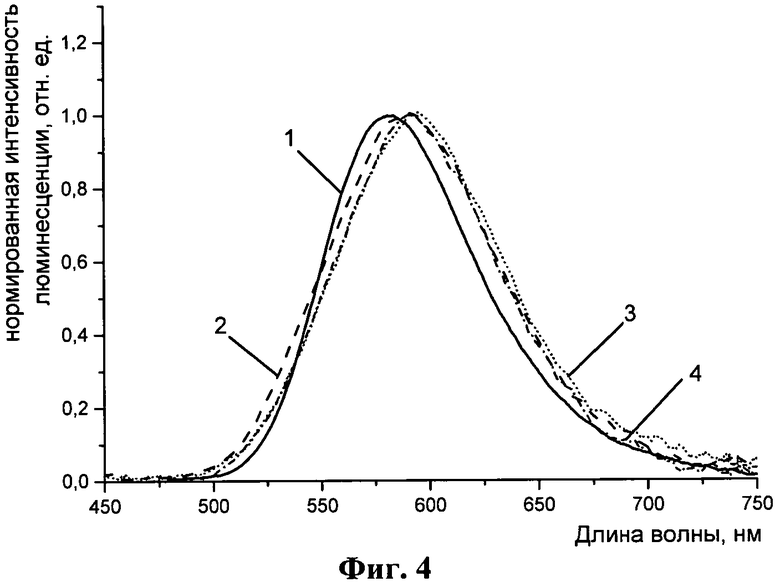
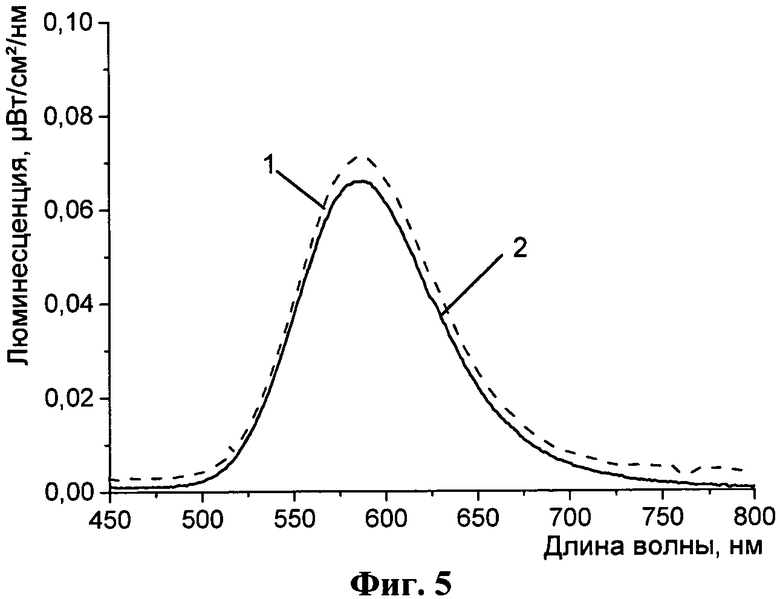
На Фиг. 4 и 5 представлены спектры люминесценции.
Заявляемое изобретение было апробировано в Санкт-Петербургском государственном университете в режиме реального времени, и результаты апробации приведены в виде конкретных примеров.
Пример 1.
Комплекс [Au6Cu2(C2C6H4-4-COONC4H4O2)6(PPh2C6H4PPh2)3](PF6)2.
Комплекс [AuC2C6H4-4-COONC4H4O2] (Фиг. 1). К суспензии 0.45 ммоль комплекса [Au(тетрагидротиофен)С1] в 2 мл ацетона добавляли раствор 0.56 ммоль 2,5-диоксопирролидин-1-ил-4-этинилбензоата в 2 мл ацетона и 10 капель триэтиламина, после чего реакционную смесь перемешивали в темноте до образования белого осадка. Осадок отделяли центрифугированием и промывали водно-этанольной смесью 1:1 по объему, этанолом и пентаном. Выход 97%.
Комплекс [Au2(C2C6H4-4-COONC4H4O2)2PPh2C6H4PPh2] (Фиг.2). В раствор 0.15 ммоль 1,4-бис(дифенилфосфино)бензола в 5 мл дихлорметана добавляли 0.32 ммоль [AuC2C6H4-4-COONC4H4O2] и перемешивали до полного растворения осадка, затем добавляли 2.5 мл толуола, после чего раствор пропускали через колонку с нейтральным алюмогелем и отгоняли растворитель. Выход 65%.
Комплекс [Au6Cu2(C2C6H4-4-COONC4H4O2)6(PPh2C6H4PPh2)3](PF6)2 (Фиг.3) (1)
К раствору 0.33 ммоль [Au2(C2C6H4-4-COONC4H4O2)2PPh2C6H4PPh2] в 3 мл дихлорметана добавили 0.22 ммоль [Cu(NCMe)4]PF6 и перемешивали реакционную смесь до образования желто-оранжевого раствора, после чего этот раствор пропустили через целиты, отогнали растворитель и перекристаллизовывали методом газофазной диффузии пентана в ацетон. Выход 81%. 31P ЯМР (D[6]-ацетон): 44.4 (с, 6Р), -144.8 (септ 2Р, PF6, JPF 712 Гц). 1Н ЯМР (D[6]-ацетон): 8.00 (дм, JHH=7.2 Гц, JPH 13 Гц, 24Н, Н-орто), 7.85 (м, 12Н, {P-C6H4-P}), 7.67 (т, JHH 7.4 Гц, 12Н, Н-пара), 7.51 (дд, JHH 7.4 Гц, 24Н, Н-мета), 7.56 (д, JHH 8.3 Гц, 12Н, C6H4), 7.05 (д, JHH 8.3 Гц, 12Н, C6H4), 2.95 (с, 24Н, CH2CH2). ESI-масс-спектр (m/z): 2060 (М2+).
Пример 2.
Комплекс  синтезированный, как описано в примере 1, с использованием 1-этинил-4-изотиоционатобензола в качестве ацетиленового лиганда.
синтезированный, как описано в примере 1, с использованием 1-этинил-4-изотиоционатобензола в качестве ацетиленового лиганда.
31Р ЯМР (D[6]-ацетон): 44.6 (с, 6Р), -144.8 (септ 2Р, PF6, JPF 712 Гц). 1Н ЯМР (D[6]-ацетон): 7.87 (дм, JHH=7 Гц, JPH=13 Гц, 24Н, орто-Н), 7.58 (м, 24Н, {P-C6H4-P}, пара-Н), 7.41 (м, 24Н, мета-Н), 6.67 (д, JHH=7.4 Гц, 12Н, С6Н4), 6.56 (с, JHH=7.4 Гц, 12Н, С6Н4).
Пример 3.
Комплекс  синтезированный, как описано в примере 1, с использованием 4-этинилбензальдегида в качестве ацетиленового лиганда.
синтезированный, как описано в примере 1, с использованием 4-этинилбензальдегида в качестве ацетиленового лиганда.
31Р ЯМР (D[6]-ацетон): 44.9 (с, 6Р), -144.8 (септ 2Р, PF6, JPF 712 Гц). 1Н ЯМР (D[6]-ацетон): 9.83 (с, 6Н, СНО), 8.02 (дм, JHH=7.2 Гц, JPH 14 Гц, 24Н, Н-орто), 7.88 (м, 12Н, {Р-С6Н4-Р}), 7.67 (т, JHH 7.4 Гц, 12Н, Н-пара), 7.49 (дд, JHH 7.4 Гц, 24Н, Н-мета), 7.35 (д, JHH 8.4 Гц, 12Н, C6H4), 7.02 (д, JHH 8.4 Гц, 12Н, С6Н4).
Для комплексов (1)-(3) были измерены фотофизические свойства, а именно: при комнатной температуре были измерены электронные спектры поглощения и спектры люминесценции, а также определены времена жизни возбужденного состояния и квантовые выходы люминесценции (таблица 1). Соединения (1)-(3) демонстрируют высокие квантовые выходы люминесценции и времена жизни люминесценции в диапазоне 2.4-3.3 мкс, аналогично свойствам прототипа.
Было продемонстрировано, что комплексы (1)-(3) способны образовывать ковалентные конъюгаты с белками. Синтез конъюгатов осуществляли в 0.01 М Na-боратном буферном растворе, pH 8.4, в течение 1 часа. Удаление несвязавшейся метки осуществляли методом гель-хроматографии с использованием в качестве стационарной фазы геля Сефадекс-G75. В таблице 2 представлены результаты получения конъюгатов белков, а именно соевого ингибитора трипсина (СИТР), сывороточного альбумина человека (ЧСА), антител к ЧСА. При этом получающиеся конъюгаты являются растворимыми в воде и буферных растворах, в отличие от исходных меток.
При образовании ковалентных конъюгатов с белками спектры люминесценции меток практически не изменяются. Для примера на Фиг.4 представлены спектры люминесценции свободного комплекса (1) и его конъюгатов с белками. На Фиг.4: 1 - комплекс (1) в ацетоне, 2 - конъюгат 1-ЧСА в боратном буфере, 3 - конъюгат 1-антиЧСА в боратном буфере и 4 - конъюгат 1-СИТР в боратном буфере.
Как для меток-прототипов, люминесценция комплексов (1)-(3) не претерпевает существенного уменьшения в присутствии кислорода. Для примера на Фиг.5 представлены спектры люминесценции конъюгата (1) с ЧСА в дегазированном (кривая 1) и аэрированном (кривая 2) растворах.
Белки при образовании конъюгатов с комплексами также сохраняют свою структуру и биологическую активность, что было продемонстрировано на примере образования специфического комплекса «трипсин-ингибитор трипсина» и модельной реакции гидролиза трипсином специфического субстрата 4-нитроаналида N-бензоил-L-тирозина в присутствии нативного СИТР и СИТР меченного комплексами (1)-(3). Константы ингибирования были определены по методу Диксона и представлены в таблице 3.
Константы Михаэлиса и удельные активности фермента реакции гидролиза представлены в таблице 4.
Полученные данные свидетельствуют о том, что ковалентное прикрепление меток (1)-(3) к белку не мешает его специфическому связыванию с аффинным партнером.
Технико-экономическая эффективность заявленного изобретения состоит, как показывают результаты приведенных примеров конкретной реализации, в существенном расширении области применения заявленных комплексов в качестве метки для флуоресцентной микроскопии за счет возможности связывания с белками. Важным при этом в заявляемом изобретении является сохранение интенсивности люминесценции при наличии молекулярного кислорода.
Заявленные комплексы проявляют люминесценцию с высоким квантовым выходом и микросекундными временами жизни. Люминесценция комплексов не подвергается существенному тушению кислородом воздуха, то есть заявленные комплексы демонстрируют люминесцентные характеристики не хуже прототипа. Существенное преимущество предлагаемых комплексов по сравнению с прототипом заключается в том, что они способны образовывать ковалентные конъюгаты с белками, переходя при этом в водорастворимую форму. При этом не наблюдается ни существенного изменения люминесценции комплекса, ни потери белком биологической активности, что позволяет использовать данные комплексы в качестве специфических меток в люминесцентном анализе и флуоресцентной микроскопии.
Список использованных источников информации
1. K.K.-W. Lo, A.W.-T. Choi, W.H.-T. Law. // Dalton Trans. 2012. V.41. P.6021-6047; Q. Zhao, C. Huang, F. Li. // Chem. Soc. ReV. 2011. V.40. P.2508-2524; V. Fernandez-Moreira, F.L. Thorp-Greenwood, M.P. Coogan. // Chem. Commun. 2010. V.46. P.186-202; K.L. Haas, K.J. Franz. // Chem. Rev. 2009. V.109. P.4921-4960; F.L. Thorp-Greenwood. // Organometallics 2012. V.31. P.5686-5692.
2. E. Ferri, D. Donghi, M. Panigati, G. Prencipe, L. D′Alfonso, I. Zanoni, C. Baldoli, S. Maiorana, G. D′Alfonso, E. Licandro. // Chem. Commun. 2010. V.46. P.6255-6257; K.W. Hubel, B.E. Henri // US 3280017 (A) 1966-10-18], иридия [D.-L. Ma, H.-J. Zhong, W.-C. Fu, D.S.-H. Chan, H.-Y. Kwan, W.-F. Fong, L.-H. Chung, C.-Y. Wong, C.-H. Leung. // PLoS ONE 2013. V.8. P.e55751], платины [D.R. McMillin, J.J. Moore. // Coordination Chemistry Reviews 2002. V.229. P.113-121; J.F. Hainfeld, F.R. Furuya, R.D. Powell // US 2005130207 (A1) 2005-06-16], а также комплексов лантаноидов [S. Mizukami, T. Yamamoto, A. Yoshimura, S. Watanabe, K. Kikuchi. // Angew. Chem. Int. Ed. 2011. V.50. P.8750-8752; K.N. Raymond, S. Petoud, S. Cohen, J. Xu // EP 1154991 (A1) 2001-11-21.
3. Koshevoy I.O. и др. Intensely luminescent alkynyl - Phosphine Gold(l)-Copper(l) complexes: Synthesis, characterization, photophysical, and computational studies // Inorg. Chem. 2009. T.48. №5. С.2094-2102 (прототип).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ГИБРИДНЫХ ПЛАЗМОННО-ЛЮМИНЕСЦЕНТНЫХ МАРКЕРОВ | 2015 |
|
RU2614245C1 |
| Способ получения противоопухолевого коньюгата на основе человеческого сывороточного альбумина, содержащего терапевтические и контрастирующий агенты | 2016 |
|
RU2644280C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ УРОВНЯ ТОКСИКАНТОВ В ВОДЕ, ПРОДУКТАХ ПИТАНИЯ ИЛИ ФИЗИОЛОГИЧЕСКИХ ЖИДКОСТЯХ И ТЕСТ-СИСТЕМА | 2013 |
|
RU2538707C1 |
| Способ получения высокоэффективной апконверсионной люминесценции комплексов оксида иттербия с наночастицами золота | 2021 |
|
RU2779620C1 |
| СПОСОБ КОМПЛЕКСНОЙ ДИАГНОСТИКИ ВИРУСНОГО ГЕПАТИТА В, ВИРУСНОГО ГЕПАТИТА С, ВИЧ-ИНФЕКЦИИ И СИФИЛИСА | 2006 |
|
RU2327170C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ УРОВНЯ ТОКСИКАНТОВ В ВОДЕ, ПРОДУКТАХ ПИТАНИЯ ИЛИ ФИЗИОЛОГИЧЕСКИХ ЖИДКОСТЯХ И ТЕСТ-СИСТЕМА | 2013 |
|
RU2547577C1 |
| Способ диагностики вируса простого герпеса | 2018 |
|
RU2702000C2 |
| КОНЪЮГАТ ФОЛИЕВОЙ КИСЛОТЫ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2012 |
|
RU2497825C1 |
| Способ получения контрастирующего препарата на основе человеческого сывороточного альбумина для визуализации опухолевых тканей | 2016 |
|
RU2629844C1 |
| СПОСОБ ТВЕРДОФАЗНОГО ЛЮМИНЕСЦЕНТНОГО ИММУНОАНАЛИЗА КОМПОНЕНТОВ БИОЛОГИЧЕСКИХ ЖИДКОСТЕЙ | 1994 |
|
RU2082982C1 |
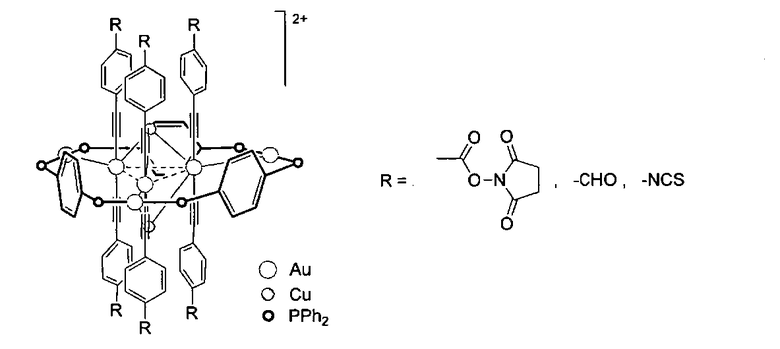
Изобретение относится к области химии металлорганических соединений, в частности к алкинилфосфиновым золотомедным комплексам, диссоциирующим в растворе с образованием ионов
 .
.
Алкинилфосфиновые золотомедные комплексы способны образовывать ковалентные конъюгаты с белками, переходя при этом в водорастворимую форму, проявляют люминесцентные свойства и могут быть использованы в качестве меток для флуоресцентной микроскопии и в люминесцентном анализе. 5 ил., 4 табл., 3 пр.
1. Алкинилфосфиновые золотомедные комплексы, диссоциирующие в растворе с образованием ионов

в качестве люминесцентной метки для флуоресцентной микроскопии.
| KOSHEVOY I.O | |||
| et al, Intensely Luminescent Alkynyl-Phosphine Gold(I)-Copper(I) Complexes: Synthesis, Characterization, Photophysical, and Computation Studies, Inorg | |||
| Chem., 2009, v | |||
| Приспособление для автоматической односторонней разгрузки железнодорожных платформ | 1921 |
|
SU48A1 |
| KOSHEVOY I.O | |||
| et al, Highly Luminescent Octanuclear AuI-CuI Clusters Adopting Two Structural Motifs: The Effect of Aliphatic Alkynyl Ligands, | |||
Авторы
Даты
2015-02-20—Публикация
2013-11-27—Подача