Изобретение относится к способам синтеза хлоридов пентаэритрита, в частности к способу получения трихлоргидрина пентаэритрита, который используют в качестве полупродукта в процессах органического синтеза. Трихлоргидрин пентаэритрита широко применяют для получения хлорированных полиэфиров, обладающих ценными механическими, диэлектрическими и химическими свойствами, а именно пониженной горючестью и способностью к самостоятельному затуханию, кроме того, они характеризуются высокой теплостойкостью.
Известен способ получения трихлоргидрина пентаэритрита путем взаимодействия пентаэритрита с тионилхлоридом в среде пиридина при мольном соотношении пентаэритрит:хлористый тионил:пиридин 1:4:4, в зависимости от целевого продукта. Способ осуществляют следующим образом.
В реакторе, снабженном мешалкой, обратным холодильником и дозирующим устройством, перемешивают заданное количество пентаэритрита и пиридина при температуре реакционной смеси 0-5°С. Через дозирующее устройство с определенной скоростью в реактор вводят 2/3 части расчетного количества хлористого тионила. Оставшуюся 1/3 часть вводят в реактор со скоростью, исключающей кристаллизацию содержимого реактора. После этого реакционную массу нагревают до прекращения выделения газов. После охлаждения в реактор добавляют равный объем воды. Водный слой декантируют и экстрагируют сначала 3 раза бензолом, а затем 3 раза эфиром. Соединяют эфирно-бензольный экстракт с водонерастворимым слоем, сушат, отгоняют эфир и бензол и фракционируют при пониженном давлении. Выход хлоргидринов пентаэритрита составляет 70% от теоретического [A.Moradien, J.B.Cloke, Am. Chem. Soc., 67, 942 (1945)].
Недостатком этого способа является сложность синтеза, обусловленная необходимостью его проведения при пониженной температуре, с последующим использованием воды для выделения продуктов синтеза и органических легколетучих растворителей для экстрагирования целевых продуктов, что требует дополнительных технологических операций, связанных с регенерацией пиридина и растворителей.
Известен способ получения трихлоргидрина пентаэритрита, по которому в реактор загружают пентаэритрит, органическую кислоту и фракцию бензина с т.кип. 60-185°С, необходимую для удаления воды, образующейся при реакции. Смесь нагревают до 120-130°С и затем через фильтр Шотта пропускают хлористый водород. При этом в течение 1-2 ч температуру поднимают до 200-220°С. Скорость пропускания хлористого водорода 110 л/ч на 1 кг пентаэритрита, расход хлористого водорода 200% от теоретического. По мере протекания реакции этерификации и гидрохлорирования образующаяся вода удаляется из реакционной зоны с бензином, который собирают в водоотделителе.
Воду, содержащую примерно 30% хлористого водорода, сливают, а бензин направляют обратно в реактор. Для удаления растворенного хлористого водорода полученный продукт промывают водой.
Молярное соотношение пентаэритрита и органической кислоты 1:1 или 1:0,75. В этих условиях выход трихлоргидрина и эфирхлоргидрина пентаэритрита составляет около 75% от теоретического в расчете на исходное количество пентаэритрита. [Д.М.Рудковский, Е.К.Ремиз, С.В.Кацман, ЖПХ, №1, 1961 г., с.16].
Недостатком этого способа является использование избыточного количества хлористого водорода, часть которого безвозвратно теряется; высокие температуры процесса; образование воды и необходимость вывода ее из реакционной зоны, что требует применения растворителя.
Наиболее близким к заявляемому изобретению является способ получения хлоргидринов пентаэритрита, где хлористый водород пропускают в смесь уксусной кислоты и воды при 0°С до тех пор, пока не будет адсорбировано расчетное количество HCl. Полученную смесь загружают в автоклав вместе с пентаэритритом. Автоклав закрывают и нагревают до 160°С в течение 8 часов. Затем автоклав охлаждают до комнатной температуры и реакционную смесь выливают в воду. Полученный ацетат трихлоргидрина пентаэритрита выделяют экстрагированием метиленхлоридом. Растворитель удаляют и оставшееся масло кипятят в течение ночи с 500 мл метанола и 50 мл концентрированной соляной кислоты. Смесь метилацетата и метанола медленно отгоняют. Трихлоргидрин пентаэритрита фракционируют или выделяют из этилацетата перекристаллизацией. Выход продукта составляет 90% от теоретического [У.Серенсон, Т.Кемпбел. «Препаративные методы химии полимеров», 1963 г., стр.306].
Недостатком известного метода является необходимость предварительного насыщения уксусной кислоты хлористым водородом, высокая коррозионная агрессивность реакционной среды, необходимость выделения продуктов синтеза промывной водой и экстракцией.
Задачей изобретения является упрощение процесса при одновременном повышении его селективности.
Технический результат от использования изобретения заключается в преимуществах предлагаемого способа, а именно в том, что в процессе синтеза и при выделении продуктов не участвует и не образуется вода, а также исключается необходимость использования растворителей для экстракции.
Вышеуказанный технический результат достигается способом получения трихлоргидрина пентаэритрита из пентаэритрита, особенность которого заключается в том, что его получают взаимодействием пентаэритрита с хлорангидридами органических кислот С2-С5 нормального и изо-строения в количестве, достаточном для замещения ОН-групп в пентаэритртите, при этом реакцию осуществляют при температуре 150-200°С, предпочтительно 170-190°С, в закрытом реакторе с получением моноэфира трихлоргидрина пентаэритрита с последующим снятием карбоксильной группы щелочным или кислотным гидролизом либо переэтерификацией со спиртами C1÷С3 в присутствии катализаторов - кислот Льюиса и (или) Бренстеда, и вакуумной перегонкой трихлогидрина пентаэритрита.
Способ иллюстрируется следующими примерами.
Пример 1. В металлический реактор загружают 120 г пентаэритрита и 276 г ацетилхлорида. Реактор закрывают и нагревают при 180°С в течение 12 ч. Затем реактор вскрывают, выгружают и отгоняют образовавшуюся уксусную кислоту. Таким образом, получают ацетат трихлоргидрина пентаэритрита, с содержанием основного вещества 98,5% масс. Далее полученный продукт подвергают переэтерификации по одному из способов снятия карбоксильной группы, для этого в колбу, снабженную ректификационной колонкой высотой 1000 мм и диаметром 25 мм, загружают ацетат трихлоргидрина пентаэритрита, 150 г этанола и 3 г п-толуолсульфокислоты. Смесь кипятят с одновременным отгоном этилацетата, об окончании реакции судят по повышению температуры дистиллята до 77-78°С. Полученный трихлоргидрин-сырец осветляют вакуумной перегонкой и получают целевой продукт с содержанием 98-99%.
Примеры 2-12 осуществляют аналогично примеру 1. Полученные результаты осуществления способа по примерам приведены в таблице 1.
Взаимодействие пентаэритрита с хлорангидридами кислот C2-C5 нормального и изо- строения, а именно хлорангидридами пропионовой, масляной, изомасляной, изомерами валериановой кислоты (н-пентановой, 3-метилбутановой, 2-метилбутановой, 2,2-диметилпропановой), включая хлорангидриды кислот по примерам 1-12, происходит по химической реакции в соответствии с нижеприведенной формулой
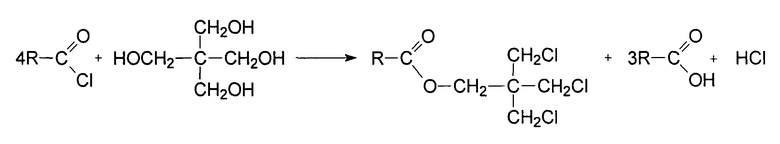
где R=CnH2n+1 - нормального и изо-строения, n=1÷4.
Условия и последовательность проведения технологических приемов при осуществлении способа взаимодействия пентаэритрита с хлорангидридами карбоновых кислот C2-C5 нормального и изо-строения находятся в рамках заявляемого технического решения, и, следовательно, указанная категория хлорангидридов в полном объеме входит в объем притязаний в соответствии с формулой изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 3,3-БИС(ХЛОРМЕТИЛ)ОКСЕТАНА | 2014 |
|
RU2576251C1 |
| Способ получения 2-аминобензофенонов | 1977 |
|
SU729192A1 |
| СПОСОБ ПОЛУЧЕНИЯ СЛОЖНЫХ ЭФИРОВ 2-АЦЕТОКСИАЛКАНОВЫХ КИСЛОТ С ИСПОЛЬЗОВАНИЕМ СЛОЖНОГО ЭФИРА АЛЬФА-ГИДРОКСИАЛКАНОВОЙ КИСЛОТЫ И СЛОЖНОГО ЭФИРА УКСУСНОЙ КИСЛОТЫ В КАЧЕСТВЕ ИСХОДНЫХ ВЕЩЕСТВ | 2015 |
|
RU2710547C2 |
| ФТОРИРОВАНИЕ ЭФИРОВ АКРИЛОВОЙ КИСЛОТЫ И ИХ ПРОИЗВОДНЫХ | 2012 |
|
RU2619108C2 |
| СПОСОБ ПОЛУЧЕНИЯ АЛКИДНЫХ ОЛИГОМЕРОВ И АЛКИДНЫЙ ЛАК, СОДЕРЖАЩИЙ АЛКИДНЫЙ ОЛИГОМЕР | 2005 |
|
RU2285705C1 |
| ФТОРИРОВАНИЕ ЭФИРОВ АКРИЛОВОЙ КИСЛОТЫ И ИХ ПРОИЗВОДНЫХ | 2012 |
|
RU2662159C1 |
| ФТОРИРОВАНИЕ ЭФИРОВ АКРИЛОВОЙ КИСЛОТЫ И ИХ ПРОИЗВОДНЫХ | 2018 |
|
RU2697581C1 |
| ПОЛИКАРБОНАТЫ С УЛУЧШЕННОЙ ХАРАКТЕРИСТИКОЙ ТЕКУЧЕСТИ, СОДЕРЖАЩИЕ ЦИКЛИЧЕСКИЕ ОЛИГОМЕРЫ | 2009 |
|
RU2491305C9 |
| СПОСОБ ПОЛУЧЕНИЯ ХЛОРАНГИДРИДОВ КАРБОНОВЫХ КИСЛОТ | 1993 |
|
RU2078759C1 |
| Способ получения метил-или этилизоцианата | 1982 |
|
SU1051065A1 |
Изобретение относится к способу получения трихлоргидрина пентаэритрита, используемого в качестве полупродукта в процессах органического синтеза. Способ заключается в том, что пентаэритрит подвергают взаимодействию с хлорангидридами органических кислот C2-C5 нормального и изо-строения. Реакцию осуществляют при температуре 150-200°C, предпочтительно 170-190°C, в закрытом реакторе с получением моноэфира трихлоргидрина пентаэритрита с последующим снятием карбоксильной группы щелочным или кислотным гидролизом либо переэтерификацией со спиртами С1÷С3 в присутствии катализаторов - кислот Льюиса и(или) Бренстеда. Полученный трихлоргидрин пентаэритрита осветляют вакуумной перегонкой. Способ позволяет упростить процесс и одновременно повысить его селективность. 1 табл., 12 пр.
Способ получения трихлоргидрина пентаэритрита из пентаэритрита, отличающийся тем, что пентаэритрит подвергают взаимодействию с хлорангидридами органических кислот C2-C5 нормального и изо-строения, при этом реакцию осуществляют при температуре 150-200°C, предпочтительно 170-190°C, в закрытом реакторе с получением моноэфира трихлоргидрина пентаэритрита с последующим снятием карбоксильной группы щелочным или кислотным гидролизом либо переэтерификацией со спиртами С1÷С3 в присутствии катализаторов - кислот Льюиса и(или) Бренстеда - и осветлением полученного трихлоргидрина пентаэритрита вакуумной перегонкой.
| US 5332790 A, 26.07.1994 | |||
| K | |||
| M | |||
| LYNCH et al., 3-Chloro-2-(chloromethyl)-1-propene, ORGANIC SYNTHESES, 1998, vol | |||
| Фальцовая черепица | 0 |
|
SU75A1 |
| Способ размножения копий рисунков, текста и т.п. | 1921 |
|
SU89A1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛЬФА,ОМЕГА-ХЛОРАЛКАНОЛОВ (ХЛОРГИДРИНОВ) | 2005 |
|
RU2287515C1 |
Авторы
Даты
2014-04-10—Публикация
2012-12-24—Подача