Настоящее изобретение относится к способу получения сложных эфиров 2-ацетоксиалкановых кислот.
Метил-2-ацетоксипропионат (MAП) представляет собой промежуточное химическое соединение, заслуживающее определенный интерес, поскольку оно может быть подвергнуто пиролизу с образованием метилакрилата и уксусной кислоты. Метилакрилат используется в качестве мономера, который может быть полимеризован с образованием полиметилакрилата, а также может быть легко превращен в акриловую кислоту или другие сложные эфиры акриловой кислоты. Поэтому большую ценность представляет экономически выгодный способ синтеза МАП.
MAП может быть получен в одну или несколько стадий исходя из молочной кислоты. Следовательно, акриловая кислота и сложные эфиры акриловой кислоты могут быть получены с использованием молочной кислоты в качестве исходного вещества. Молочная кислота производится в больших объемах с помощью процессов брожения и поэтому является одновременно недорогой и широко доступной. Акриловая кислота и ее сложные эфиры могли бы быть получены достаточно недорого, если бы существовал эффективный способ превращения молочной кислоты в MAП. Однако известные способы синтеза МАП из молочной кислоты страдают от низких конверсий и образования больших количеств нежелательных побочных продуктов.
Некоторые из известных способов синтеза начинаются с самой молочной кислоты. Например, молочная кислота, как известно, реагирует с метилацетатом с образованием MAП по следующей реакции:
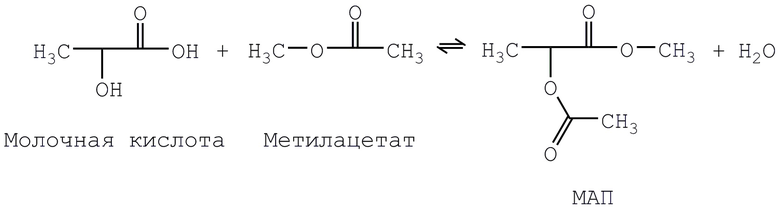
Реальная химия гораздо сложнее, чем это уравнение, по нескольким причинам. Речь идет о равновесной реакции, которая является обратимой и приводит к сложной смеси продуктов. Различные продукты и промежуточные соединения вступают в реакции переэтерификации с образованием нежелательных соединений, таких как метиллактат и 2-ацетоксипропионовая кислота. Так как молочная кислота содержит как карбоксильную группу, так и гидроксильную группу, она может вступать в реакцию сама с собой с образованием димеров и олигомеров, содержащих сложноэфирную группу. Поэтому продукт, полученный по такой реакции, представляет собой сложную смесь веществ. Конверсии в МАП удручающе низкие. Например, в публикации Rehberg et al., в Industrial and Engineering Chemistry, Vol. 36, pp. 469-472 (1944) («Rehberg 1944»), описываются конверсии в МАП менее чем 30%.
Кроме того, вода всегда присутствует в вышеупомянутом процессе, так как она является продуктом реакции. Большее количество воды почти всегда содержится в процессе с молочной кислотой, которую трудно получить в безводной форме. Вода гидролизует различные сложноэфирные соединения (включая продукт) обратно в исходные вещества или другие кислоты, такие как уксусная кислота. Эти кислоты также вызывает коррозию многих металлов, так что реакционный сосуд и сопутствующее оборудование должны быть изготовлены из специальных сплавов. Кроме того, вода образует азеотроп с метиллактатом, который является примесью, образующейся в больших количествах в этой реакции. Сложно и дорого отделять метиллактат от воды, чтобы выделять и повторно использовать молочную кислоту.
Удаление воды из молочной кислоты приводит к другим проблемам, включая олигомеризацию молочной кислоты. По этой причине коммерчески доступные концентрированные сиропы молочной кислоты содержат большие количества олигомеров. Например, в типичном коммерчески доступном 85% сиропе молочной кислоты, 20% или более молочной кислоты находится в форме димеров или олигомеров с большим количеством мономерных звеньев. Присутствие таких олигомеров с большим количеством мономерных звеньев в концентрированных сиропах молочной кислоты также приводит к уменьшенным выходам и нежелательным побочным продуктам.
В публикации Filachione et al., в Industrial and Engineering Chemistry, Vol. 36 pp. 472-475 (1944), описывается альтернативный способ, в котором молочная кислота вступает в реакцию с уксусной кислотой с образованием 2-ацетоксипропионовой кислоты, которая далее превращается в МАП путем реакции с метилацетатом или метанолом. На первой стадии выходы 2-ацетоксипропионовой кислоты составляют в лучшем случае 78%. Конверсии на второй стадии очень низкие. В результате общие выходы МАП еще ниже, чем те, которые описаны в публикации Rehberg 1944 (см. Filachione et al., страница 475).
Другие способы начинаются со сложного эфира молочной кислоты. Алкиловые эфиры молочной кислоты реагируют с уксусным ангидридом, кетеном или ацетилхлоридом с образованием соответствующего сложного эфира 2-ацетоксипропионовой кислоты. См., например, публикацию Rehberg 1944 (цитированную выше) и публикацию Rehberg et al., JACS, Vol. 67, pp. 56-56 (1945). Эти способы приводят к несколько лучшим выходам, но требуют специальных, дорогостоящих реагентов, которые могут быть трудными для регенерации и повторного использования. В патенте США №6992209 описывается способ, в котором метиллактат вступает в реакцию с уксусной кислотой с образованием MAП. В этом способе МАП реагирует с уксусной кислотой с образованием 2-ацетоксипропионовой кислоты. Вследствие этого, данный способ приводит к образованию МАП и 2-ацетоксипропионовой кислоты в примерно равных количествах наряду с метилацетатом, и поэтому представляет собой способ с низким выходом.
В данной области техники существует необходимость обеспечить недорогой способ синтеза МАП и других сложных эфиров 2-ацетоксипропионовой кислоты.
Настоящее изобретение представляет собой способ получения сложного эфира 2-ацетоксиалканоновой кислоты. Такой способ включает в себя нагревание смеси алкилового или арилового сложного эфира α-гидроксиалкановой кислоты и по меньшей мере одного моля алкилового или арилового сложного эфира уксусной кислоты на моль сложного эфира α-гидроксиалкановой кислоты до температуры по меньшей мере 150°С при избыточном давлении в присутствии катализатора переэтерификации для превращения по меньшей мере части сложного эфира α-гидроксиалкановой кислоты и сложного эфира уксусной кислоты в сложный эфир 2-ацетоксиалкановой кислоты и по меньшей мере в один алканол или фенольное соединение.
Данный способ отличается от способов предшествующего уровня техники частично тем, что как исходная молочная кислота, так и исходный ацетат представлены в виде сложных эфиров.
Этот способ неожиданно приводит к сложным эфирам 2-ацетоксиалкановой кислоты с высокими выходами из таких недорогих исходных веществ. Поскольку исходные вещества (за исключением катализаторов, которые используются в небольших количествах) не являются кислотами и могут быть представлены в практически безводной форме, а в ходе реакции образуются несколько видов кислот, наблюдается небольшая коррозия металлических реакционных сосудов. Основные побочные продукты реакции представляют собой алканол или фенольное соединение, которые легко выделяются и повторно используются (если необходимо) для образования большего количества исходных веществ.
Сложный эфир α-гидроксиалкановой кислоты представляет собой сложный эфир, соответствующий продукту реакции α-гидроксиалкановой кислоты и алканола или фенольного соединения (хотя он может быть получен различными способами, способ получения неважен по данному изобретению). Сложный эфир α-гидроксиалкановой кислоты в некоторых вариантах осуществления изображается данной структурой:

где R1 представляет собой водород или алкил (включая линейный, разветвленный и циклоалкил), а R2 представляет собой алкил (включая линейный, разветвленный и циклоалкил) или арил. R1 и/или R2 могут иметь заместители, которые инертны (т. е. не реагируют) в условиях процесса. Примеры таких заместителей включают, например, галоген, арил (если R2 представляет собой алкил), алкил (если R2 представляет собой арил), простой эфир и т. п.
R1 в некоторых вариантах осуществления представляет собой незамещенную алкильную группу. Она предпочтительно содержит до шести атомов углерода. R1 может быть метилом, этилом, н-пропилом, изо-пропилом, н-бутилом, втор-бутилом, трет-бутилом, циклогексилом и т. п. R1 предпочтительно представляет собой метил, причем в этом случае сложный эфир представляет собой сложный эфир молочной кислоты. Когда R1 отличается от водорода, атом углерода в альфа-положении к углероду карбонильной группы будет хиральным. Пригодны либо R-, либо S-энантиомер или их смесь.
R2 предпочтительно представляет собой незамещенную алкильную группу, содержащую до шести атомов углерода, или фенил. В случае алкила R2 может представлять собой метил, этил, н-пропил, изо-пропил, н-бутил, втор-бутил, трет-бутил, циклогексил и т. п. R2 предпочтительно представляет собой метил, н-бутил или фенил.
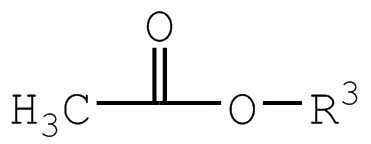
Сложный эфир уксусной кислоты соответствует сложному эфиру уксусной кислоты с алканолом или фенольным соединением (хотя это может быть сделано с использованием различных способов). Алкиловый эфир уксусной кислоты соответствует структуре:

где R3 определяется таким же образом, что и R2 выше. R3 предпочтительно представляет собой незамещенную алкильную группу, содержащую до шести атомов углерода, или фенил. В случае алкила R3 может представлять собой метил, этил, н-пропил, изо-пропил, н-бутил, втор-бутил, трет-бутил, циклогексил, арил и т. п. R3 предпочтительно представляет собой метил, н-бутил или фенил. Метил является особенно предпочтительным, особенно при получении MAП, так как полученный в результате спиртовой побочный продукт (метанол) летуч и легко удаляется из продукта, и, когда МАП в дальнейшем используется в качестве сырья для изготовления метилакрилата, отсутствие β-атомов водорода ограничивает нежелательные побочные реакции при реакции пиролиза.
Алкильная или арильная группа сложного эфира уксусной кислоты и алкильная или арильная группа сложного эфира α-гидроксиалкановой кислоты предпочтительно одинаковы, т. е. для любой реакции R2 предпочтительно является таким же, как R3. Сложный эфир уксусной кислоты наиболее предпочтительно представляет собой метилацетат, а сложный эфир α-гидроксиалкановой кислоты наиболее предпочтительно представляет собой метиловый сложный эфир. Сложный эфир α-гидроксиалкановой кислоты наиболее предпочтительно представляет собой метиллактат.
Идеализированная реакция сложного эфира уксусной кислоты и сложного эфира α-гидроксиалкановой кислоты выглядит следующим образом:

где R1, R2 и R3 аналогичны вышеуказанным. Обозначение «R2, R3» означает, что указанная молекула будет представлять собой смесь соединений, имеющих группу R2, и соединений, имеющих группу R3 (в тех случаях, где R2 и R3 различны). Так, например, побочный продукт с R2, R3OH будет представлять собой смесь алканолов и/или фенольных соединений, когда R2 и R3 различны, и будет представлять собой единственный алканол или фенольное соединение, когда R2 и R3 одинаковы (что предпочтительно). Аналогичным образом конечный сложный эфир 2-ацетоксиалкановой кислоты будет представлять собой смесь сложных эфиров, если R2 и R3 различны, и будет представлять собой единственный сложный эфир, когда R2 и R3 одинаковы. Наиболее предпочтительно, когда оба R2 и R3 представляют собой метил, алканольный побочный продукт представляет собой метанол, а полученный сложный эфир 2-ацетоксиалкановой кислоты представляет собой метиловый эфир.
Для проведения реакции, сложный эфир уксусной кислоты соединяют со сложным эфиром α-гидроксиалкановой кислоты при молярном соотношении по меньшей мере 1:1. Предпочтительно соединять сложный эфир α-гидроксиалкановой кислоты с избытком сложного эфира уксусной кислоты, так как это помогает сдвинуть равновесие в сторону целевого продукта. Предпочтительное молярное соотношение сложного эфира уксусной кислоты к сложному эфиру α-гидроксиалкановой кислоты составляет по меньшей мере 2:1, по меньшей мере 5:1, по меньшей мере 10:1 или по меньшей мере 20:1, а также молярное соотношение может быть 100:1 или даже выше.
Катализатор переэтерификации представляет собой вещество, которое катализирует реакции переэтерификации. Подходящие катализаторы переэтерификации хорошо известны в данной области техники. К ним относятся сильные кислоты Бренстеда, такие соединения, как алкил- или арилсульфокислоты, наподобие пара-толуолсульфокислоты, соляной кислоты, серной кислоты, фосфорной кислоты или олигомеров фосфорной кислоты. Подходят также и сильные кислоты Льюиса. Они включают в себя, например, хлорид олова, оксид олова, оксиды диалкилолова, алкоксиды алкилолова, карбоксилаты алкилолова, различные соединения титана или алюминия, трифторид бора и т. п.
Катализатор используют в каталитических количествах, которые, как правило, составляют от 0,001 до 0,25 моль катализатора на моль сложного эфира α-гидроксиалкановой кислоты.
Нет необходимости проводить реакцию в растворителе или разбавителе, хотя тот или иной может быть внесен, если это необходимо. Растворитель или разбавитель не должны реагировать в условиях данного процесса. Примеры подходящих растворителей или разбавителей включают в себя углеводороды, кетоны, хлорированные углеводороды, простые эфиры, простые полиэфиры и т. п.
Вода должна присутствовать по большей мере в очень небольших количествах, так как вода может участвовать в различных реакциях с исходными веществами и продуктами реакции с образованием кислот и других нежелательных соединений.
Предпочтительно вносить сложный эфир уксусной кислоты и сложный эфир α-гидроксиалкановой кислоты в практически безводной форме, т. е. каждый из них содержит менее чем 1 масс. % воды и предпочтительно каждый из них содержит менее чем 0,8 масс. % или менее чем 0,5 масс. % воды. Другие источники воды предпочтительно исключаются. Любая среда, в которой проводится реакция, предпочтительно является практически безводной. В целом предпочтительно, чтобы содержание воды в реакционном сосуде в ходе реакции поддерживалось на уровне ниже 1 масс. %, более предпочтительно ниже 0,5 масс. % и еще более предпочтительно ниже 0,15 масс. %.
Реакцию проводят при температуре по меньшей мере 150°C при избыточном давлении. Предпочтительная температура составляет по меньшей мере 175°C, а еще более предпочтительная температура составляет по меньшей мере 190°C. Подходящая максимальная температура составляет 230°C, в то время как более высокие температуры неблагоприятны, потому что молочная кислота начинает разлагаться при таких более высоких температурах.
Указанные температуры выше температуры кипения исходных веществ. В связи с этим реакция проводится при избыточном давлении, достаточном для поддержания исходных веществ в виде жидкостей в ходе реакции. В большинстве случаев подходит давление от 1010 до 6060 кПа, а предпочтительное давление составляет от 2020 до 5050 кПа.
Данная реакция может быть проведена непрерывно, полунепрерывно или периодически в оборудовании, способном выдерживать рабочую температуру и давление. Оборудование, которое вступает в контакт с горячей реакционной смесью и/или горячей смесью продукта, предпочтительно устойчиво к воздействию кислот. Реакторы периодического действия включают в себя реакторы компании Parr и другие сосуды под давлением. Реакторы непрерывного и полунепрерывного действия включают в себя трубчатый реактор, петлевой реактор, реактор с постоянным перемешиванием среды и т. п.
Реакция продолжается до тех пор, пока по меньшей мере часть исходных веществ превратится в желаемый сложный эфир 2-ацетоксипропионовой кислоты. Данная реакция является равновесной реакцией. Поэтому, если один или несколько продуктов не удаляются по мере протекания реакции, реакционная смесь достигнет равновесия до полной конверсии лимитирующего исходного вещества (как правило, сложного эфира α-гидроксиалкановой кислоты) в продукт. Без удаления продуктов реакции конверсия лимитирующего исходного вещества, как правило, достигается от 50 до 80% при поддержании условий реакции в течение достаточного количества времени. Более высокие конверсии могут быть получены, если один или несколько продуктов реакции (таких как алканол или фенольное соединение) удаляются или когда сложный эфир уксусной кислоты используется в большем избытке.
В периодическом процессе типичное время реакции составляет от 15 минут до 10 часов. Предпочтительно свести к минимуму время реакции для уменьшения образования нежелательных побочных продуктов; в предпочтительном способе реакция прерывается, когда конверсия лимитирующего исходного вещества достигает от 40 до 90%, особенно от 40 до 80% или когда реакционная смесь достигает равновесия.
Преимущество способа по настоящему изобретению состоит в том, что он высокоселективен по отношению к желаемому сложному эфиру 2-ацетоксиалканоновой кислоты. Селективность целевого продукта по меньшей мере 80% или даже 90% или выше может быть легко получена в соответствии с настоящим изобретением. Селективность вычисляется путем (а) определения количества израсходованного исходного сложного эфира α-гидроксиалкановой кислоты, (б) вычисления количества (В) сложного эфира 2-ацетоксиалканоновой кислоты, которое было бы получено, если бы весь израсходованный сложный эфир α-гидроксиалкановой кислоты был превращен в сложный эфир 2-ацетоксиалканоновой кислоты, (с) определения количества (C) полученного сложного эфира 2-ацетоксиалканоновой кислоты и (d) деления C на B и умножения на 100%. Основными побочными продуктами реакции являются алканол или фенольное соединение и небольшое количество олигомеров α-гидроксиалкановой кислоты, которые могут быть в виде сложных эфиров.
Выходы желаемого сложного эфира 2-ацетоксиалканоновой кислоты часто составляют по меньшей мере 40% в пересчете на исходный сложный эфир α-гидроксиалкановой кислоты, а также часто составляет от 50% до 75% или выше. Выходы рассчитываются как количество полученного сложного эфира 2-ацетоксиалкановой кислоты, деленное на количество, которое было бы получено, если бы весь исходный сложный эфир α-гидроксиалкановой кислоты был превращен в сложный эфир 2-ацетоксиалкановой кислоты.
Желаемый сложный эфир 2-ацетоксиалканоновой кислоты легко отделяется от остальных компонентов неочищенной смеси продуктов с использованием перегонки, кристаллизации, экстракции растворителем или других методов. Летучие компоненты реакционной смеси, такие как алканол или фенольное соединение, легко испаряются или иным образом отгоняются. Сложный эфир 2-ацетоксиалканоновой кислоты в большинстве случаев имеет более высокую температуру кипения и более высокую температуру плавления, чем исходные вещества. Эти различия в температурах кипения и плавления могут быть использованы в качестве основы для дистилляционных и кристаллизационных процессов выделения.
Непрореагировавшие исходные вещества могут быть выделены, очищены, если это необходимо, и повторно использованы в процессе. Алканол или фенольное соединение, образованные в процессе, могут быть выделены, если это необходимо, и затем вступают в реакцию с α-гидроксиалкановой кислотой и/или уксусной кислотой для регенерации любого из двух или обоих вместе исходных веществ. Олигомеры α-гидроксиалкановой кислоты (или сложные эфиры таких олигомеров) могут быть гидролизованы обратно в соответствующую α-гидроксиалкановую кислоту (или ее сложные эфиры) и повторно использованы в процессе.
Способ по настоящему изобретению особенно пригоден для образования сложных эфиров 2-ацетоксипропионовой кислоты путем реакции сложного эфира молочной кислоты (предпочтительно метиллактата) со сложным эфиром уксусной кислоты (предпочтительно метилацетатом). Конечный сложный эфир 2-ацетоксипропионовой кислоты может быть подвергнут пиролизу с образованием уксусной кислоты и сложного эфира акриловой кислоты, в котором эфирная группа соответствует группе R2 и/или R3 в исходных веществах. Пиролиз может быть проведен нагреванием сложного эфира 2-ацетоксипропионовой кислоты до температуры от 400 до 600°С в среде, не содержащей кислород. Сложный эфир акриловой кислоты представляет собой пригодный мономер, который может быть полимеризован или сополимеризован с образованием акриловых полимеров и сополимеров. Сложный эфир акриловой кислоты может быть гидролизован с образованием акриловой кислоты, которая сама является пригодным мономером, или может быть превращен в другие акриловые мономеры. Уксусная кислота может вступать в реакцию с алканолом или фенольным соединением для регенерации исходного сложного эфира уксусной кислоты, который может быть повторно использован в способе по настоящему изобретению.
Способ по настоящему изобретению также пригоден для получения бутилацетоксипропионовой кислоты. Бутилацетоксипропионовая кислота представляет собой пригодное исходное вещество для катализируемого ферментами процесса стереоселективного деацилирования, как это описано, например, в документе WO 2014/045036.
Следующие примеры приведены для иллюстрации настоящего изобретения и не предназначены для ограничения его объема. Все части и проценты являются массовыми, если не указано иное.
Примеры 1-2
Пример 1: 1 моль метиллактата (содержание воды около 0,04 масс. %), 25 моль метилацетата (содержание воды 0,5 масс. %) и 0,05 моль п-толуолсульфокислоты вносят в реактор компании Parr. В реакторе создают избыточное давление азотом до 620,5 кПа для проверки наличия утечек, а затем снижают до атмосферного давления. Реактор и его содержимое нагревают до 200°С в течение 3 часов, в ходе которых давление в реакторе увеличивается до 2757,9 кПа. Затем реакционную смесь охлаждают до комнатной температуры в закрытом реакторе. Содержимое реактора удаляют и анализируют на содержание остаточного метиллактата, целевого продукта (метил-2-ацетоксипропионовой кислоты (MAП)) и олигомеров молочной кислоты (включая их алкиловые сложные эфиры) методом газовой хроматографии с пламенно-ионизационным детектором с использованием коммерчески доступных стандартов. Конверсию метиллактата рассчитывают исходя из количества метиллактата, остающегося в реакционной смеси. Селективность по отношению к МАП рассчитывают исходя из измеренных количеств MAП и олигомеров. Выход МАП рассчитывают как конверсию, умноженную на селективность. Результаты приведены в таблице 1.
Пример 2 проводят аналогичным образом, за исключением того, что п-толуолсульфокислоту заменяют на эквивалентное количество дигидрата хлорида олова. Результаты приведены в таблице 1.
Конверсия, селективность и общий выход МАП крайне высоки в сравнении со способами предшествующего уровня техники. В данных экспериментах оловянный катализатор способствует более высокой скорости реакции, на что указывает более высокая конверсия метиллактата. Более высокая конверсия достигается в примере 1, когда реакция продолжается в течение более длительного времени.
Пример 3
1 моль н-бутиллактата (содержание воды менее чем 0,1 масс. %), 25 моль н-бутилацетата (содержание воды около 0,5 масс. % или меньше) и 0,05 моль дигидрата хлорида олова вносят в реактор компании Parr. В реакторе создают избыточное давление азотом до 620,5 кПа для проверки наличия утечек, а затем снижают до атмосферного давления. Реактор и его содержимое нагревают до 200°С в течение 3 часов, в ходе которых давление в реакторе увеличивается до 689,5 кПа. Затем реакционную смесь охлаждают до комнатной температуры в закрытом реакторе. Содержимое реактора удаляют и анализируют на содержание остаточного бутиллактата, целевого продукта (бутил-2-ацетоксипропионовой кислоты, БАП) и олигомеров молочной кислоты (включая их алкиловые сложные эфиры) методом газовой хроматографии с пламенно-ионизационным детектором с использованием коммерчески доступных стандартов. Конверсию бутиллактата рассчитывают исходя из количества бутиллактата, остающегося в реакционной смеси. Селективность по отношению к БАП рассчитывают исходя из измеренных количеств MAП и олигомеров. Выход БАП рассчитывают как конверсию, умноженную на селективность. Результаты приведены в таблице 2.
Этот эксперимент показывает, что при получении БАП вместо МАП, достигаются аналогично высокие конверсии, селективности и общие выходы целевого продукта.
Изобретение относится к способу получения сложного эфира 2-ацетоксиалкановой кислоты, включающему нагревание смеси сложного эфира α-гидроксиалкановой кислоты и по меньшей мере одного моля алкилового эфира уксусной кислоты на моль сложного эфира α-гидроксиалкановой кислоты в реакционном сосуде до температуры 190-230°C при избыточном давлении в присутствии катализатора переэтерификации для превращения по меньшей мере части сложного эфира α-гидроксиалкановой кислоты и алкилового эфира уксусной кислоты в сложный эфир 2-ацетоксиалкановой кислоты и по меньшей мере в один алканол или фенольное соединение, при котором содержание воды в реакционном сосуде в ходе реакции поддерживается на уровне ниже 0,5 мас.%. В отличие от предыдущих способов получения сложных эфиров 2-ацетоксиалкановой кислоты данный процесс протекает с высоким выходом и высокой селективностью по отношению к целевому продукту. 13 з.п. ф-лы, 2 табл., 3 пр.
1. Способ получения сложного эфира 2-ацетоксиалкановой кислоты, включающий нагревание смеси сложного эфира α-гидроксиалкановой кислоты и по меньшей мере одного моля алкилового эфира уксусной кислоты на моль сложного эфира α-гидроксиалкановой кислоты в реакционном сосуде до температуры 190-230°C при избыточном давлении в присутствии катализатора переэтерификации для превращения по меньшей мере части сложного эфира α-гидроксиалкановой кислоты и алкилового эфира уксусной кислоты в сложный эфир 2-ацетоксиалкановой кислоты и по меньшей мере в один алканол или фенольное соединение, при котором содержание воды в реакционном сосуде в ходе реакции поддерживается на уровне ниже 0,5 мас.%.
2. Способ по п.1, в котором сложный эфир α-гидроксиалкановой кислоты представлен структурой
 ,
,
где R1 представляет собой водород, линейный алкил, разветвленный алкил или циклоалкил, и R2 представляет собой линейный алкил или разветвленный алкил, при этом R1 и/или R2 могут иметь заместители, которые не реагируют в условиях данного процесса.
3. Способ по п.2, в котором сложный эфир уксусной кислоты представлен структурой
 ,
,
где R3 представляет собой линейный алкил или разветвленный алкил, при этом R3 может иметь заместители, которые не реагируют при условиях данного процесса, определенные таким же образом, как и R2 выше.
4. Способ по п.3, в котором каждый R2 и R3 независимо представляют собой метил, этил, н-пропил, изо-пропил, н-бутил, втор-бутил или трет-бутил, и R1 представляет собой метил, этил, н-пропил, изо-пропил, н-бутил, втор-бутил или трет-бутил.
5. Способ по п.3 или 4, в котором R2 и R3 одинаковы.
6. Способ по п.5, в котором каждый R2 и R3 представляют собой метил.
7. Способ по п.5, в котором каждый R2 и R3 представляют собой н-бутил.
8. Способ по любому из пп.2-4, в котором R1 представляет собой метил.
9. Способ по любому из пп.1-4, дополнительно включающий выделение сложного эфира 2-ацетоксиалканоновой кислоты.
10. Способ по п.9, в котором сложный эфир 2-ацетоксиалканоновой кислоты выделяется путем кристаллизации или перегонки.
11. Способ по любому из пп.1-4, в котором конверсия сложного эфира α-гидроксиалкановой кислоты составляет от 50 до 80%.
12. Способ по любому из пп.1-4, в котором селективность по отношению к сложному эфиру 2-ацетоксиалканоновой кислоты составляет по меньшей мере 80%.
13. Способ по любому из пп.1-4, в котором селективность по отношению к сложному эфиру 2-ацетоксиалканоновой кислоты составляет по меньшей мере 90%.
14. Способ по любому из пп.1-4, в котором выход сложного эфира 2-ацетоксиалканоновой кислоты составляет от 50 до 75% в пересчете на исходное количество сложного эфира α-гидроксиалкановой кислоты.
| C.E | |||
| REHBERG et al | |||
| "Preparation of Methyl Acetoxypropionate:Reaction of Lactic Acid with Methyl Acetate" Ind | |||
| Eng | |||
| Chem., 1944, 36 (5), pp | |||
| Прибор для раскрывания парашюта на желаемом расстоянии от места спуска | 1922 |
|
SU469A1 |
| СПОСОБ ПОЛУЧЕНИЯ (НИТРОКСИМЕТИЛ)ФЕНИЛ ЭФИРОВ ПРОИЗВОДНЫХ САЛИЦИЛОВОЙ КИСЛОТЫ | 2000 |
|
RU2235717C2 |
| СУШИЛЬНАЯ УСТАНОВКА С ИНЕРТНОЙ НАСАДКОЙ | 2007 |
|
RU2342613C1 |
Авторы
Даты
2019-12-27—Публикация
2015-02-23—Подача