Область, к которой относится изобретение
Настоящее изобретение относится к новым соединениям, которые обладают анти-ангиогенной активностью, и к способам получения и применения этих соединений. В частности, настоящее изобретение относится к пептидам, которые связываются с сосудистым эндотелиальным клеточным фактором роста (VEGF), и к макромолекулам, включающим эти пептиды, и к связанным с ними способам и применениям.
Предшествующий уровень техники
Ангиогенез представляет собой фундаментальный процесс, посредством которого образуются кровеносные сосуды, и он играет существенную роль при разнообразных видах нормальной активности организма, таких как репродукция, развитие и заживление ран. Хотя ангиогенез в нормальных условиях представляет собой высоко регулируемый процесс, многие заболевания (характеризуемые как «ангиогенные заболевания») вызываются или обостряются нерегулируемым ангиогенезом. Например, неоваскуляризация глаз считалась наиболее частой причиной слепоты. В определенных существующих состояниях, таких как артрит, вновь образованные капиллярные кровеносные сосуды внедряются в суставы и разрушают хрящ. При диабете новые капилляры, образованные в сетчатке, внедряются в стекловидное тело, кровоточат и вызывают слепоту. Рост и метастазирования солидных опухолей также зависимы от ангиогенеза (J. Folkman, Cancer Res., 46:467-473 (1986), J. Folkman, J. Natl. Cancer Inst., 82:4-6 (1989)). Было, например, показано, что опухоли, которые увеличиваются до размера более 2 мм, получают свое собственное кровоснабжение индукцией роста новых капиллярных кровеносных сосудов. После того как эти новые кровеносные сосуды становятся внедренными в опухоль, они становятся средством для поступления опухолевых клеток в кровообращение и метастазирования в отдаленные участки, такие как печень, легкие и кости (N. Weidner, et. al., N. Engl. J. Med., 324:1-8 (1991)).
Сосудистый эндотелиальный клеточный фактор роста (VEGF) был идентифицирован как крайне мощный ангиогенный фактор, и он требуется для роста и метастазирования многих опухолей человека. Много исследований были сосредоточены на попытке ингибировать путь VEGF с тем, чтобы ограничить или предотвратить ангиогенез или метастазирование. В публикации Fairbrother et al: 'Novel peptides selected to bind vascular endothelial growth factor targetthe receptor-binding site' (Biochemistry, 1998, 37, 17754-17764) описаны пептиды с различной способностью связывания с VEGF. Были идентифицированы различные пептиды, которые связываются со связанным с ангиогенезом фактором ангиопоэтином-2 ("Ang-2") (Oliner, J. et al, Cancer Cell, 204(6), 507-516 (2004)). Было показано, что пептиды, связывающие Ang-2, обладают анти-ангиогенной активностью.
Было бы желательно получить соединения, которые проявляют улучшенные характеристики по сравнению с известными соединениями, такие как, например, улучшенное связывание с VEGF. Было бы, кроме того, желательно получить соединения, демонстрирующие связывание с VEGF и Ang2.
Ссылка на любые источники информации в настоящем описании не должна восприниматься как признание любой формы предположения, что приведенная ссылка составляет часть общеизвестных положений.
Краткое описание сущности изобретения
[VEGF-пептиды] по изобретению
Изобретение относится к пептидам, соединениям и фармацевтическим композициям, способным связываться с VEGF человека (как иллюстрируется SEQ ID NO:3). Соответственно, в некоторых аспектах настоящее изобретение относится к пептиду, включающему последовательность, по существу гомологичную последовательности:
V1-E2-P3-N4-C5-D6-I7-H8-V9-M10-W11-V12-W13-X14-C15-F16-E17-R18-X19 (SEQ ID NO:122), где X14 представляет E или V, а X19 представляет натуральную или ненатуральную гидрофобную аминокислоту или ее D-изомеры.
К удивлению, было обнаружено, что этот класс пептидов и их производные (как будет детально описан ниже) демонстрируют улучшенное связывание с VEGF относительно пептидов родственной структуры. В частности, мутирование положения 12 в нейтральный гидрофобный остаток, в частности валин, обеспечивает характеристику улучшенного связывания относительно пептидов с отрицательно заряженными группами в этом положении, такими как глутамат. В некоторых вариантах осуществления настоящее изобретение относится к пептиду, включающему последовательность, по существу гомологичную SEQ ID NO:122, при условии, что V12 не замещен E. В некоторых вариантах осуществления, X19 представляет L. X19 может представлять D-Leu. X19 может представлять консервативное замещение L, такое как I, или другой гидрофобный остаток, такой как A или V, или D-изомеры любого из предыдущих остатков.
Кроме того, производные по настоящему изобретению включают добавление по меньшей мере 1-4 остатка на C-конце. Некоторые варианты осуществления включают добавление 2-4 остатков на C-конце. Некоторые варианты осуществления включают добавление 2 остатков на C-конце. Некоторые варианты осуществления включают добавление 3 остатков на C-конце. Некоторые варианты осуществления включают добавление 4 остатков на C-конце.
Соответственно, изобретение также относится к пептиду, включающему последовательность, по существу гомологичную последовательности:
V1-E2-P3-N4-C5-D6-I7-H8-V9-M10-W11-V12-W13-X14-C15-F16-E17-R18-X19-X20 (SEQ ID NO:123)
где X20 представляет любую нейтральную, гидрофобную или ароматическую аминокислоту. X20 может представлять любую ароматическую аминокислоту, такую как Y, F, W, или их D-изоформы. X20 может представлять любую нейтральную гидрофобную аминокислоту, такую как M, I, L, NIe, A, или их D-изоформы.
В некоторых аспектах изобретение относится к пептиду, включающему последовательность, по существу гомологичную последовательности:
V1-E2-P3-N4-C5-D6-I7-H8-V9-M1O-W11-V12-W13-X14-C15-F16-E17-R18-X19-X2°-X21 (SEQ ID NO:124)
где X21 представляет любую аминокислоту. В некоторых аспектах X21 может представлять любую нейтральную или положительно заряженную аминокислоту, такую как G, A, I, L, K, R, или K(ac), или их D-изоформы. Например, X21 может представлять D-Ala.
В некоторых аспектах изобретение относится к пептиду, включающему последовательность, по существу гомологичную последовательности:
V1-E2-P3-N4-C5-D6-I7-H8-V9-M10-W11-V12-W13-X14-C15-F16-E17-R18-X19-X20-X21-X22 (SEQ ID NO:125),
где X22 представляет любую алифатическую, полярную или отрицательно заряженную аминокислоту, такую как V, L, P, E, G, I, S, T, W, F, E, или их D-изомеры.
В некоторых аспектах изобретение относится к пептиду, включающему последовательность, по существу гомологичную последовательности:
V1-E2-P3-N4-C5-D6-I7-H8-V9-M10-W11-V12-W13-X14-C15-F16-E17-R18-X19-X20X21-X22-X23 (SEQ ID NO:126), где X23 представляет любую аминокислоту. X23 может быть выбран из группы, состоящей из G, A, I, L, Q, E, F, T, W, S, и Y, и их D-изомеров. X23 может быть выбран из группы, состоящей из G, A, I, L, Q, E, F, T, S, и Y, и их D-изомеров. В некоторых аспектах X23 не содержит боковую цепь с двойным кольцом. В некоторых аспектах X23 не представляет W. В некоторых аспектах X23 может представлять E, T, S, L, или F, или их D-изомеры.
В некоторых вариантах осуществления было обнаружено, что может быть предпочтительным, чтобы по меньшей мере один из 5 остатков на карбоксильном конце представлял собой D-изомер. В некоторых аспектах по меньшей мере два из пяти остатков, расположенных на С-конце, представляют собой D-изомеры. В некоторых аспектах не более чем три из пяти остатков, расположенных на С-конце, представляют собой D-изомеры. В некоторых аспектах от одного до трех из пяти остатков, расположенных на С-конце, представляют собой D-изомеры. В некоторых аспектах по меньшей мере один из четырех остатков на карбоксильном конце представляет собой D-изомер. В некоторых аспектах по меньшей мере два из четырех остатков, расположенных на С-конце, представляют собой D-изомеры. В некоторых аспектах не более чем три из четырех остатков, расположенных на С-конце, представляют собой D-изомеры. В некоторых аспектах от одного до трех из четырех остатков, расположенных на С-конце, представляют собой D-изомеры. Для каждого из них предпочтительно, чтобы было по меньшей мере два или, предпочтительно по меньшей мере три дополнительных остатка после X19. Было обнаружено, что получение оптимизированного числа D-изомеров на C-конце обеспечивает преимущество повышенной устойчивости к ферментному разрушению на C-конце, особенно ферментное разрушение между остатками E17 и R18, и ферментное разрушение между остатками R18 и X19.
В некоторых аспектах изобретения X19 может представлять L, X20 присутствует и может представлять Y, X21 присутствует и может представлять алифатическую гидрофобную аминокислоту (и может быть выбран из A, L, I, V, G), и X22 присутствует и представляет гидрофобную аминокислоту (и может быть выбран из L, P, V). В определенных вариантах осуществления два из X19, X21 и X22 представляют D-изомеры. В некоторых вариантах осуществления X23 может присутствовать или не присутствовать.
В некоторых аспектах определенные пептиды и соединения по изобретению могут включать пептидную последовательность, по существу гомологичную одной или более SEQ ID NOs:36-106.
В другом аспекте настоящее изобретение относится к пептиду, включающему последовательность, по существу гомологичную последовательности:
V1-E2-P3-N4-C5-D6-I7-H8-V9-M10-W11-E12-W13-E14-C15-F16-E17-R18-X19-X20-X21-X22-X23 (SEQ ID NO:127), где X19 представляет натуральную или ненатуральную гидрофобную аминокислоту или ее D-изомеры, и X20 представляет ароматическую аминокислоту, нейтральную аминокислоту, гидрофобную аминокислоту, или полярную аминокислоту, или ее D-изомеры, и X21 представляет гидрофобную аминокислоту, или положительно заряженную аминокислоту, или ее D-изомеры, и X22 отсутствует или представляет гидрофобную аминокислоту, ароматическую аминокислоту, отрицательно заряженную аминокислоту или ее D-изомеры, и X23 отсутствует или представляет ароматическую аминокислоту, нейтральную аминокислоту, гидрофобную аминокислоту или ее D-изомеры. X19 может представлять L. В альтернативных вариантах осуществления X19 представляет D-Leu. X19 может представлять консервативное замещение L, такое как I, или другой гидрофильный остаток, такой как A или V, или D-изомеры любого из предыдущих остатков. X20 может быть выбран из группы, состоящей из A, V, I, L, Y, W, F, M, S, и T или их D-изомера. X20 может быть выбран из группы, состоящей из A, Y, F, M, и S или их D-изомера. X21 может быть выбран из группы, состоящей из K, R, H, орнитина, Dap, Dab, G, A, V, I, и L или их D-изомеров. X21 может быть выбран из группы, состоящей из K, R, и G или их D-изомера. Когда X20 представляет гидрофобную или ароматическую аминокислоту, то X21 может представлять положительно заряженную аминокислоту. Когда X20 представляет одну из A, F или Y, то X21 может представлять одну из K или R или их D-изомер. Когда X21 представляет гидрофобную аминокислоту, то X20 может представлять полярную аминокислоту. X22 в случае его присутствия может быть выбран из группы, состоящей из E, D, G, A, L, I, V, M, W, Y, и F или их D-изомеров. X22 в случае его присутствия может быть выбран из группы, состоящей из E, G и W или их D-изомеров. Когда X21 представляет положительно заряженный остаток, то X22 в случае его присутствия может представлять отрицательно заряженный остаток. Когда X21 представляет K, то X22 может представлять E. X23 в случае присутствия может быть выбран из группы, состоящей из W, Y, F, G, A, I, L, V, и M или их D-изомеров. X в случае присутствия может быть выбран из группы, состоящей из W, F, G, A, L, и M, или их D-изомеров.
В некоторых аспектах определенные пептиды, соединения и фармацевтические композиции по изобретению могут включать пептидную последовательность, по существу гомологичную одной или более из следующих: SEQ ID NO:108, SEQ ID NO:109, SEQ ID NO:110, SEQ ID NO:111, SEQ ID NO:112, SEQ ID NO:113, SEQ ID NO:114, SEQ ID NO:115, SEQ ID NO:116, SEQ ID NO:117, SEQ ID NO:118, SEQ ID NO:119, SEQ ID NO:120, SEQ ID NO:121.
Пептиды по изобретению могут использоваться в различных применениях, включая диагностику, скрининг и лечение. Пептиды и композиции по изобретению могут использоваться непосредственно при лечении или могут найти применение при ковалентном и не ковалентном сопряженном связывании с более крупными молекулами, которые обеспечивают дополнительную терапевтическую ценность, такую как увеличенный период полувыведения (фармакокинетика, PK). Примеры молекул, которые могут обеспечить увеличенный период полувыведения, включают белки, полипептиды, антитела, фрагменты антител, в частности домен Fc антител.
Изобретение относится к соединению формулы R1-[VEGF-Пептид]-R2
где [VEGF-Пептид] представляет пептид, включающий последовательность, по существу гомологичную последовательности: X 1-X 2-P3N4-C5-X 6-X 7-X 8-V9-X 10-X 11-X 12-W13-X 14-C15-F16-E17-R18-X 19-X 20-X 21-X 22-X 23 (SEQ ID NO:131), где R1 отсутствует или представляет CH3, C(O)CH3, C(O)CH3, C(O)CH2CH3, C(O)CH2CH2CH3, C(O)CH(CH3)CH3, C(O)CH2CH2CH2CH3, C(O)CH(CH3)CH2CH3, C(O)C6H5, C(O)CH2CH2(CH2CH2O)1-5Me, амидо-2-PEG, N-ацил и N-алкил, амино-защитную группу, группу жирной кислоты липида или углеводород; и R2 отсутствует или представляет OH, NH2, NH(CH3), NHCH2CH3, NHCH2CH2CH3, NHCH(CH3)CH3, NHCH2CH2CH2CH3, NHCH(CH3)CH2CH3, NHC6H5, NHCH2CH2OCH3, NHOCH3, NHOCH2CH3, карбокси-защитную группу, группу жирной кислоты липида или углеводород, и X1 представляет остаток гидрофобной аминокислоты, X2 представляет отрицательно заряженный остаток, X6 представляет отрицательно заряженный остаток, X7 представляет остаток гидрофобной аминокислоты, X8 представляет остаток, содержащий кольцевую структуру, X10 может представлять M или любую гидрофобную аминокислоту, X11 представляет ароматическую аминокислоту, X12 выбран из группы, состоящей из V, E и Kac, X14 представляет E или V, X19 может представлять любой остаток гидрофобной аминокислоты или ее D-изомер, X20 может отсутствовать, или может представлять любую нейтральную, гидрофобную или ароматическую аминокислоту или ее D-изомер, X21 может отсутствовать или может представлять любой положительно заряженный остаток, или любой алифатический неполярный остаток, или его D-изоформу, X22 может отсутствовать или может быть выбран из группы, состоящей из G, V, L, I, P, S, T, W, F, E, Kac, или их D-изомеров, X23 может отсутствовать или выбран из группы, состоящей из G, A, I, L, Q, E, F, T, W, S, Y, и Kac и их D-изомеров.
X1 может представлять V. X2 может представлять E. X6 может представлять D. X7 может представлять I. X8 может представлять H. X11 может представлять W. [VEGF-Peptide] может представлять пептид, включающий последовательность, по существу гомологичную последовательности:
V1-E2-P3-N4-C5-D6-I7-H8-V9-X 10-W11-X 12-W13-X 14-C15-F16-E17-R18-X 19-X 20-X 21-X 22-X 23 (SEQ ID NO:132), где X10 может представлять M или любую гидрофобную аминокислоту, X12 выбран из группы, состоящей из V, E и Kac, X14 представляет E или V, X19 может представлять остаток любой гидрофобной аминокислоты или ее D-изомер, X20 может отсутствовать или может представлять любую нейтральную, гидрофобную или ароматическую аминокислоту или ее D-изомер, X21 может отсутствовать или может представлять любой положительно заряженный остаток, или любой алифатический неполярный остаток, или его D-изоформу, X22 может отсутствовать или может быть выбран из группы, состоящей из G, V, L, I, P, S, T, W, F, E, Kac, или их D-изомеров, X23 может отсутствовать или может быть выбран из группы, состоящей из G, A, I, L, Q, E, F, T, W, S, Y, Kac и их D-изомеров.
[VEGF-Пептид] включает последовательность, по существу гомологичную одной или более из следующих:
V-E-P-N-C-D-I-H-V-M-W-E-W-E-C-F-E-R-L (SEQ ID NO:34)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G-G-W (SEQ ID NO:35)
V-E-P-N-C-D-I-H-V-M-W-V-W-V-C-F-E-R-L-F-R-E-A (SEQ ID NO:36)
V-E-P-N-C-D-I-H-V-M-W-V-W-V-C-F-E-R-L-F-K-E-A (SEQ ID NO:37)
V-E-P-N-C-D-I-H-V-M-W-V-W-V-C-F-E-R-L-M-K (SEQ ID NO:38)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-R-E-L (SEQ ID NO:39)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G-I-F (SEQ ID NO:40)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y (SEQ ID NO:41)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G-W-G (SEQ ID NO:42)
V-E-P-N-C-D-I-H-V-M-W-V-W-V-C-F-E-R-L-Y-G-G-G (SEQ ID NO:43)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G-L-Y (SEQ ID NO:44)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-S-G-G-G (SEQ ID NO:45)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-M-R-L-T (SEQ ID NO:46)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G (SEQ ID NO:47)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-V-K (SEQ ID NO:48)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-M-R (SEQ ID NO:49)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G-I-L (SEQ ID NO:50)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-(Yome)-G-L-T (SEQ ID NO:51)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G-G (SEQ ID NO:52)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-F-K-E-A (SEQ ID NO:53)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-(NIe)-K (SEQ ID NO:54)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G-L-T (SEQ ID NO:55)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G-G-F (SEQ ID NO:56)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-I-K (SEQ ID NO:57)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-K (SEQ ID NO:58)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-M-G-L-T (SEQ ID NO:59)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-(D-Leu)-(Kac) (SEQ ID NO:60)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G-G-G (SEQ ID NO:61)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-M-K (SEQ ID NO:62)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-M-R-E-L (SEQ ID NO:63)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L- (SEQ ID NO:64)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-M-K-E-L (SEQ ID NO:65)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G-P-W (SEQ ID NO:66)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-L-K (SEQ ID NO:67)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-L-(Kac) (SEQ ID NO:68)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G-L-T (SEQ ID NO:69)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G-E-F (SEQ ID NO:70)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G-L-S (SEQ ID NO:71)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G-L (SEQ ID NO:72)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G-(D-Leu)-T (SEQ ID NO:73)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G-V-Q (SEQ ID NO:74)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G-L-E (SEQ ID NO:75)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G-P-L (SEQ ID NO:76)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G-P-F (SEQ ID NO:77)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-(D-Ala)-(D-Leu) (SEQ ID NO:78)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-R-(D-Leu)-(Kac) (SEQ ID NO:79)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-(D-Tyr)-G-(D-Pro)-L (SEQ ID NO:80)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-(D-Tyr)-G-(D-Fτo)-(D-Leu) (SEQ ID NO:81)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-(D-Tyr)-G-(D-Leu)-(Kac) (SEQ ID NO:82)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-(D-Leu)-Y-(Aib)-L-T (SEQ ID NO:83)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-(D-Leu)-Y-(D-Ala)-V-(D-Gln)(SEQ ID NO:84)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-(D-Leu)-Y-(D-Ala)-L-(D-Thr)(SEQ ID NO:85)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-(Cha)-G-(DLeu)-T (SEQ ID NO:86)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-(AiD)-L-(D-ThT) (SEQ ID NO:87)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-(Sar)-(D-Leu)-T (SEQ ID NO:88)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G-(D-Pro)-L(SEQ ID NO:89)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-(D-AIa)-V-(D-GIn) (SEQ ID NO:90)
V-E-P-N-C-D-I-H- V-M- W-V-W-E-C-F-E-R-L- Y-(Aib)-L-T (SEQ ID NO:91)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-(D-Tyr)-G-(D-Leu)-T (SEQ ID NO:92)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-(D-Tyr)-G-L-T (SEQ ID NO:93)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-(D-Tyr)-D-L-(D-Thr) (SEQ ID NO:94)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-(D-Leu)-(Aib) (SEQ ID NO:95)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G-(D-Leu)-(D-Thr) (SEQ ID NO:96)
V-E-P-N-C-D-I-H-V-M-W-V-W-V-C-F-E-R-L (SEQ ID NO:97)
V-E-P-N-C-D-I-H-V-M-W-V-W-V-C-F-E-R-L-Y-G-P-F (SEQ ID NO:98)
V-E-P-N-C-D-I-H-V-M-W-V-W-V-C-F-E-R-L-Y-G-P-(SEQ ID NO:99)
V-E-P-N-C-D-I-H-V-M-W-V-W-V-C-F-E-R-L-Y-G-P-E (SEQ ID NO:100)
V-E-P-N-C-D-I-H-V-M-W-V-W-V-C-F-E-R-L-Y-G-P-Q (SEQ ID NO:101)
V-E-P-N-C-D-I-H-V-M-W-V-W-V-C-F-E-R-L-Y-G-(D-Leu)-T (SEQ ID NO:102)
V-E-P-N-C-D-I-H-V-M-W-V-W-V-C-F-E-R-L-Y-G-L ((SEQ ID NO:103)
V-E-P-N-C-D-I-H-V-M-W-V-W-V-C-F-E-R-L-(D-Leu)-Kac (SEQ ID NO:104)
V-E-P-N-C-D-I-H-V-M-W-V-W-V-C-F-E-R-L-Y-G-L-T (SEQ ID NO:105)
V-E-P-N-C-D-I-H-V-M-W-V-W-V-C-F-E-R-L-Y-(D-Ala)-(D-Leu) (SEQ ID NO:106)
V-E-P-N-C-D-I-H-V-M-W-E-W-E-C-F-E-R-L-Y-A-K (SEQ ID NO:108)
V-E-P-N-C-D-I-H-V-M-W-E-W-E-C-F-E-R-L-Y-F-K-E-W (SEQ ID NO:109)
V-E-P-N-C-D-I-H-V-M-W-E-W-E-C-F-E-R-L-Y-A-R (SEQ ID NO:110)
V-E-P-N-C-D-I-H-V-M-W-E-W-E-C-F-E-R-L-Y-F-K (SEQ ID NO:111)
V-E-P-N-C-D-I-H-V-M-W-E-W-E-C-F-E-R-L-Y-A-K-E-F (SEQ ID NO:112)
V-E-P-N-C-D-I-H-V-M-W-E-W-E-C-F-E-R-L-Y-S-G-W-G (SEQ ID NO:113)
V-E-P-N-C-D-I-H-V-M-W-E-W-E-C-F-E-R-L-Y-S-G-W-F (SEQ ID NO:114)
V-E-P-N-C-D-I-H-V-M-W-E-W-E-C-F-E-R-L-Y-A-K-E-A (SEQ ID NO:115)
V-E-P-N-C-D-I-H-V-M-W-E-W-E-C-F-E-R-L-Y-A-K-E-M (SEQ ID NO:116)
V-E-P-N-C-D-I-H-V-M-W-E-W-E-C-F-E-R-L-Y-A-K-E-L (SEQ ID NO:117)
V-E-P-N-C-D-I-H-V-M-W-E-W-E-C-F-E-R-L-Y-F-K-E-L (SEQ ID NO:118)
V-E-P-N-C-D-I-H-V-M-W-E-W-E-C-F-E-R-L-Y-F-K-E-A (SEQ ID NO:119)
V-E-P-N-C-D-I-H-V-M-W-E-W-E-C-F-E-R-L-Y-Y-G-G-G (SEQ ID NO:120)
V-E-P-N-C-D-I-H-V-M-W-E-W-E-C-F-E-R-L-Y-M-K (SEQ ID NO:121)
V-E-P-N-C-D-I-H-V-(NIe)-W-V-W-E-C-F-E-R-L-Y-(Aib)-L-T (SEQ ID NO:128)
V-E-P-N-C-D-I-H-V-L-W-V-W-E-C-F-E-R-L-Y-(Aib)-L-T (SEQ ID NO:129)
V-E-P-N-C-D-I-H-V-V-W-V-W-E-C-F-E-R-L-Y-(Aib)-L-T (SEQ ID NO:130)
V-E-P-N-C-D-I-H-V-M-W-(Kac)-W-E-C-F-E-R-L-Y-(D-Ala)-V-(D-Gln) (SEQ ID NO:136)
V-E-P-N-C-D-I-H-V-K-W-V-W-E-C-F-E-R-L-(D-Leu)-(Kac) (SEQ ID NO:192)
V-E-P-N-C-D-I-H-V-K-W-V-W-E-C-F-E-R-L-Y-G-(D-Leu)-T (SEQ ID NO:193)
V-E-P-N-C-D-I-H-V-K-W-V-W-E-C-F-E-R-L-Y-G-P-L (SEQ ID NO:194)
V-E-P-N-C-D-I-H-V-K-W-V-W-E-C-F-E-R-L-Y-(D-Ala)-(D-Leu) (SEQ ID NO:195)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L(-D-Leu)-K (SEQ ID NO:196)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G-(D-Leu)-K (SEQ ID NO:197)
V-E-P-N-C-D-I-H-V-M-W-E-W-E-C-F-K-R-(D-Leu) (SEQ ID NO:198)
V-E-P-N-C-D-I-H-V-KW-E-W-E-C-F-(N-метилглутамат)-R-L (SEQ ID NO:199)
V-E-P-N-C-D-I-H-V-KW-V-E-E-C-F-(D-Glu)-R-L (SEQ ID NO:200)
V-E-P-N-C-D-I-H-V-KW-E-W-E-C-F-E-R(N-метиларгинин) (SEQ ID NO:201)
V-E-P-N-C-D-I-H-V-KW-E-W-E-C-F-E-R-(D-Asn) (SEQ ID NO:202)
V-E-P-N-C-D-I-H-V-KW-E-W-E-C-F-E-R-(Aib) (SEQ ID NO:203)
V-E-P-N-C-D-I-H-V-KW-E-W-E-C-F-(Aib)-R-L (SEQ ID NO:204)
V-E-P-N-C-D-I-H-V-KW-E-W-E-C-(нафталин)-E-R-L (SEQ ID NO:205)
V-E-P-N-C-D-I-H-V-M-W-V-E-C-F-K-R-L-Y-G-L-T (SEQ ID NO:206)
V-E-P-N-C-D-I-H-V-M-W-V-E-C-F-E-R-L-Y-K-L-E (SEQ ID NO:207)
V-E-P-N-C-D-I-H-V-M- W-E- W-E-C-F-E-R-(D-Leu) (SEQ ID NO:208)
V-E-P-N-C-D-I-H-V-E-W-E-W-E-C-F-K-R-L (SEQ ID NO:209)
V-E-P-N-C-D-I-H-V-K-W-V-W-E-C-F-E-(гомоаргинин)-L-Y-(D-Ala)-(D-Leu) (SEQ ID NO:210)
V-E-P-N-C-D-I-H-V-M-W-K-W-E-C-F-E-R-Y-G-(D-Leu)-E (SEQ ID NO:211)
V-E-P-N-C-D-I-H-V-K-W-V-W-E-C-F-E-R-L-Y-G-(D-Leu)-E (SEQ ID NO:212)
V-E-P-N-C-D-I-H-V-K-W-V-W-E-C-F-E-R-L-Y-(Aib)-L-E (SEQ ID NO:213)
V-E-P-N-C-D-I-H-V-M-W-K-W-E-C-F-E-R-L-Y-(Aib)-L-E (SEQ ID NO:214)
V-E-P-N-C-D-I-H-V-M-W-K-W-E-C-F-E-R-(D-Leu)-K (SEQ ID NO:215)
V-E-P-N-C-D-I-H-V-K-W-V-W-E-C-F-E-(Kac)-L-Y-(D-Ala)-(D-Leu) (SEQ ID NO:216)
V-E-P-N-C-D-I-H-V-K-W-V-W-E-C-F-E-(Kac)-(цикло-Leu)-Y-(D-Ala)-(D-Leu) (SEQ ID NO:217)
V-E-P-N-C-D-I-H-V-K-W-V-W-E-C-F-E-(Kac)-(Tle)-Y-(D-Ala)-(D-Leu) (SEQ ID NO:218)
В некоторых вариантах осуществления [VEGF-Пептид] по изобретению выбран из группы, состоящей из SEQ ID NOs: 60, 73, 76, 78, 192, 193, 194 или 195.
X10 может представлять M. [VEGF-Пептид] может представлять пептид, включающий последовательность, по существу гомологичную последовательности:
V1-E2-P3-N4-C5-D6-I7-H8-V9-M10-W11-X12-W13-X14-C15-F16-E17-R18-X19-X20X21-X22-X23 (SEQ ID NO:133), где X12 выбран из группы, состоящей из V, E и Kac, X14 представляет E или V, X19 может представлять любой остаток гидрофобной аминокислоты или ее D-изомер, X20 может отсутствовать или может представлять любую нейтральную, гидрофобную или ароматическую аминокислоту или ее D-изомер, X21 может отсутствовать или может представлять любой положительно заряженный остаток, или любой алифатический неполярный остаток, или его D-изоформу, X22 может отсутствовать или может быть выбран из группы, состоящей из G, V, L, I, P, S, T, W, F, E, Kac или их D-изомеров, X23 может отсутствовать или может быть выбран из группы, состоящей из G, A, I, L, Q, E, F, T, W, S, Y, Kac и их D-изомеров.
X12 может представлять E. [VEGF-Пептид] может представлять пептид, включающий последовательность, по существу гомологичную последовательности:
V1-E2-P3-N4-C5-D6-I7-H8-V9-M10-W11-E12-W13-X14-C15-F16-E17-R18-X19-X20-X21-X22-X23 (SEQ ID NO:134), где X14 представляет E или V, X19 может представлять остаток любой гидрофобной аминокислоты или ее D-изомер, X20 может отсутствовать или может представлять любую нейтральную, гидрофобную или ароматическую аминокислоту или ее D-изомер, X21 может отсутствовать или может представлять любой положительно заряженный остаток, или любой алифатический неполярный остаток, или его D-изоформу, X22 может отсутствовать или может быть выбран из группы, состоящей из G, V, L, I, P, S, T, W, F, E, Kac или их D-изомеров, X23 может отсутствовать или быть выбран из группы, состоящей из G, A, I, L, Q, E, F, T, W, S, Y, Kac и их D-изомеров.
[VEGF-Пептид] может включать последовательность, по существу гомологичную одной из следующих: SEQ ID NO:34, SEQ ID NO:108, SEQ ID NO:109, SEQ ID NO:110, SEQ ID NO:111, SEQ ID NO:112, SEQ ID NO:113, SEQ ID NO:114, SEQ ID NO:115, SEQ ID NO:116, SEQ ID NO:117, ID NO:118, SEQ ID NO:119, SEQ ID NO:120, SEQ ID NO:121.
X12 может представлять V. [VEGF-Пептид] может представлять пептид, включающий последовательность, по существу гомологичную последовательности:
V1-E2-P3-N4-C5-D6-I7-H8-V9-M10-W11-V12-W13-X14-C15-F16-E17-R18-X19-X20-X21-X22-X23 (SEQ ID NO:135), где X14 представляет E или V, X19 может представлять любой остаток гидрофобной аминокислоты или ее D-изомер, X20 может отсутствовать или может представлять любую нейтральную, гидрофобную или ароматическую аминокислоту или ее D-изомер, X21 может отсутствовать или может представлять любой положительно заряженный остаток или его D-изоформу, X22 может отсутствовать или может быть выбран из группы, состоящей из G, V, L, I, P, S, T, W, F, E, Kac или их D-изомеров, X23 может отсутствовать или может быть выбран из группы, состоящей из G, A, I, L, Q, E, F, T, W, S, Y, Kac и их D-изомеров.
[VEGF-Пептид] может включать последовательность, по существу гомологичную одной или более из следующих: SEQ ID NO:35, SEQ ID NO:36, SEQ ID NO:37, SEQ ID NO:38, SEQ ID NO:39, SEQ ID NO:40, SEQ ID NO:41, SEQ ID NO:42, SEQ ID NO:43, SEQ ID NO:44, SEQ ID NO:45, ID NO:46, SEQ ID NO:47, SEQ ID NO:48, SEQ ID NO:49, SEQ ID NO:50, SEQ ID NO:51, SEQ ID NO:52, SEQ ID NO:53, SEQ ID NO:54, SEQ ID NO:55, SEQ ID NO:56, ID NO:57, SEQ ID NO:58, SEQ ID NO:59, SEQ ID NO:60, SEQ ID NO:61, SEQ ID NO:62, SEQ ID NO:63, SEQ ID NO:64, SEQ ID NO:65, SEQ ID NO:66, SEQ ID NO:67, SEQ ID NO:68, SEQ ID NO:69, SEQ ID NO:70, ID NO:71, SEQ ID NO:72), SEQ ID NO:73, SEQ ID NO:74, SEQ ID NO:75, SEQ ID NO:76, SEQ ID NO:77, SEQ ID NO:78, SEQ ID NO:79, SEQ ID NO:80, SEQ ID NO:81, SEQ ID NO:82, ID NO:83, SEQ ID NO:84, SEQ ID NO:85, SEQ ID NO:86, SEQ ID NO:87, ID NO:88, SEQ ID NO:89, SEQ ID NO:90, SEQ ID NO:91, SEQ ID NO:92, SEQ ID NO:93, SEQ ID NO:94, SEQ ID NO:95, SEQ ID NO:96, ID NO:97, SEQ ID NO:98, SEQ ID NO:99, SEQ ID NO:100, SEQ ID NO:101, SEQ ID NO:102, SEQ ID NO:103, SEQ ID NO:104, SEQ ID NO:105, SEQ ID NO:106, SEQ ID NO:128, SEQ ID NO:129, SEQ ID NO:130.
В отношении различных вариантов осуществления [VEGF-Пептида], описанного в настоящей заявке, в некоторых аспектах изобретения R1 может представлять C(O)CH3. В некоторых аспектах изобретения R2 представляет NH2. R1 и/или R2 может отсутствовать. X19 может быть выбран из группы, состоящей из L, I, A, V, G или их D-изомеров. X19 может представлять L. X19 может представлять D-Leu. X20 может представлять Y. X20 может представлять D-Tyr. X21 может быть выбран из группы, состоящей из D-Ala, G, Aib и Kac. X21 может представлять D-Ala. X21 может представлять G. X22 может быть выбран из группы, состоящей из L, V, P, D-Leu, D-Pro. X22 может представлять D-Leu. X22 может представлять D-Pro. X22 может представлять L. X23 может отсутствовать.
В некоторых вариантах осуществления изобретения [VEGF-пептид] представляет (SEQ ID NO:78). В некоторых вариантах осуществления R1-[VEGF-пептид]-R2 представляет {C(O)CH3}-V-E-P-N-C-D-I-H-V-K-W-V-W-E-C-F-E-R-L-Y-(D-Ala)-(D-Leu)-{NH2} (SEQ ID NO:188) и K11 представляет связывающий остаток.
Связывание
Присутствие связывающего остатка (соответственно, и остатка, связывающего VEGF и остатка, связывающего Ang2) обеспечивает получение соединений по изобретению с большой гибкостью для связей с каркасами, макромолекулами и другими частями. В частности, соединения по изобретению могут быть надежно, прочно и эффективно ковалентно связаны с каркасами, такими как антитела, фрагменты антител, молекулы PEG, альбумин и т.д. К удивлению, было обнаружено, что расположение связывающего остатка в определенных ключевых положениях в соответствующем пептиде ведет к повышенной устойчивости и/или связыванию пептида. Связывающий остаток может быть выбран так, чтобы обеспечить образование боковой цепи, химические характеристики которой обеспечивают возможность специфических, надежных, направленных и эффективных химических ковалентных связей в этом положении. В некоторых аспектах изобретения, связывающий остаток ковалентно связан со связывающим участком антитела непосредственно или через промежуточный линкер. Связь может быть необратимой.
Соединения по изобретению могут быть ковалентно связаны с линкерной частью, L (или L', как описано ниже) посредством связывающего остатка. Возможны многочисленные линкеры; многие подходящие линкеры раскрыты в US2006205670, содержание которого включено в настоящее описание путем ссылки. В частности, аспекты US2006205670, относящиеся к общим формулам, описывающим линкеры, структуру определенных линкеров, синтез линкеров и комбинации различных элементов групп X, Y и Z, как конкретно и в целом описано в указанном документе, включены в настоящую заявку. Линкер может быть линейным или разветвленным и, возможно, включает одну или более карбоциклических или гетероциклических групп. Длину линкера можно рассматривать с точки зрения числа линейных атомов при подсчете циклических частей, таких как ароматические кольца и тому подобные самым коротким путем вокруг кольца. В некоторых вариантах осуществления линкер имеет линейный фрагмент секвенирования от 5 до 15 атомов, в других вариантах осуществления от 15 до 30 атомов, в еще одних вариантах осуществления - от 30 до 50 атомов, в еще одних вариантах осуществления - от 50 до 100 атомов и в еще одних вариантах осуществления - от 100 до 200 атомов. Другие учитываемые характеристики линкеров включают воздействие на физические или фармакокинетические свойства полученного соединения, такие как растворимость, липофильность, гидрофильность, гидрофобность, устойчивость (более или менее устойчив, а также планируемое разрушение), ригидность, гибкость, иммуногенность, модуляция связывания антител, способность быть включенным в мицеллу или липосому и тому подобные.
В некоторых аспектах изобретения соединение содержит линкер (L) или (L'), ковалентно связанный с боковой цепью связывающего остатка. Линкер может иметь формулу: -[Соединитель]-X-Y-Z; -[Соединитель]-X-Y-Z'; -X-Y-Z-; или -X-Y-Z'-; где: [Соединитель] присутствует, когда линкер является разветвленным, и, в случае присутствия, он ковалентно связан со связывающим остатком, и одной или более дополнительных Активных Молекул, X представляет биологически совместимую соединяющую цепь, включающую любой атом, выбранный из группы, состоящей из C, H, N, O, P, S, F, Cl, Br и I, и может содержать полимер или блок-сополимер и ковалентно связан со связывающим остатком, где линкер является линейным, Y представляет возможно присутствующую группу распознавания, содержащую по меньшей мере кольцевую структуру, и Z представляет реактивную группу, которая способна образовывать ковалентную связь с боковой цепью аминокислоты и связывающим участком антитела, и Z' представляет часть присоединения, содержащую ковалентную связь с боковой цепью аминокислоты в связывающем участке антитела.
В случае присутствия Y может иметь возможно замещенную структуру:

где a, b, c, d, и e независимо представляют углерод или азот; f представляет углерод, азот, кислород или серу; Y независимо присоединен к X и Z в любом из положений двух колец с достаточной валентностью; и не более чем четыре из a, b, c, d, e или f представляют одновременно азот, и предпочтительно каждый из a, b, c, d, и e в кольцевой структуре представляет углерод. В некоторых аспектах Y может представлять фенил. Без намерения быть связанными с какой-либо теорией, считают, что группа Y может содействовать расположению реактивной группы в связывающем участке антитела с тем, чтобы группа Z могла взаимодействовать с боковой цепью реактивной аминокислоты.
Линкер может быть сконструирован так, чтобы он содержал реактивную группу, способную ковалентно или не ковалентно образовывать связь с макромолекулой, такой как антитело, белок или его фрагмент. Реактивная группа выбирается для использования с реактивным остатком в определенном связывающем участке. Например, химическая часть для модификации антителом к альдолазе может представлять собой кетон, дикетон, бета-лактам, активный сложный эфир, галоидкетон, лактон, ангидрид, малеимид, альфа-галоидацетамид, циклогексилдикетон, эпоксид, альдегид, амидин, гуанидин, имин, энеамин, фосфат, фосфонат, эпоксид, азиридин, тиоэпоксид, маскированный или защищенный дикетон (например, кеталь), лактам, галоидкетон, альдегид и тому подобные. В вариантах осуществления настоящего изобретения связывание пептида по изобретению с линкером L или L', частями Z (или Z' при присоединении к макромолекуле) представляет собой реактивную группу.
В некоторых вариантах осуществления Z включает одну или более групп C=O, расположенных для образования азитидинона, дикетона, и ацил бета-лактама, активного сложного эфира, галоидкетона, группы циклогексил дикетона, альдегида, малеимида, активированного алкена, активированного алкина или, в целом, молекулы, содержащей уходящую группу, восприимчивую к нуклеофильному или электрофильному замещению. Другие группы могут включать лактон, ангидрид, альфа-галоидацетамид, имин, гидразид или эпоксид. Иллюстративные линкерные электрофильные реактивные группы, которые могут ковалентно связываться с реактивной нуклеофильной группой (например, боковой цепью лизина или цистеина) в связывающем участке антитела, включают ацил бета-лактам, простой дикетон, активный сложный эфир сукцинимида, малеимид, галоидацетимид с линкером, галоидкетон, циклогексилдикетон, альдегид, амидин, гуанидин, имин, энеамин, фосфат, фосфонат, эпоксид, азиридин, тиоэпоксид, маскироовный или защищенный дикетон (например, кеталь), лактам, сульфонат и тому подобные, маскированные группы C=O, такие как имины, кетали, ацетали и любую другую известную электрофильную группу. В определенных вариантах осуществления реактивная группа включает одну или более групп C=O, расположенных для образования ацил бета-лактама, простого дикетона, активного сложного эфира сукцинимида, малеимида, галоидацетамида с линкером, галоидкетона, циклогексил дикетона или альдегида. Z или Z', в случае их присутствия, могут представлять замещенный алкил, замещенный циклоалкил, замещенный арил, замещенный арилалкил, замещенный гетероциклил или замещенный гетероциклоалкил, где по меньшей мере один заместитель представляет 1,3-дикетоновую часть, ацил бета-лактам, активный сложный эфир, альфа-галоидкетон, альдегид, малеимид, лактон, ангидрид, альфа-галоидацетимид, амин, гидразид или эпоксид. В некоторых аспектах группа Z, в случае ее присутствия, ковалентно связана со связывающим участком антитела. В других аспектах группа Z ковалентно связана с каркасом макромолекулы, который может обеспечить пептидам по изобретению увеличенный период полувыведения.
В некоторых аспектах Z, в случае присутствия, имеет структуру:

где q=0-5. q может быть = 1 или 2. q может быть = 1. В других аспектах q может быть = 2.
Z', в случае присутствия, может иметь структуру:
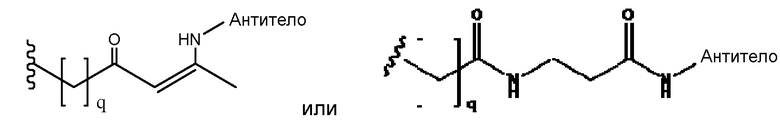
где q=0-5, и Антитело-N- представляет ковалентную связь с боковой цепью в связывающем участке антитела.
q может быть = 1 или 2. q может быть = 1. В других аспектах q может быть = 2.
X может представлять группу, содержащую три компонента; Xp-Xs-Xy, где Xp представляет группу, специфически адаптированную для возможности объединения с боковой цепью связывающего остатка, Xs представляет спейсерную область группы X, и Xy представляет группу, адаптированную связываться с группой Y. В некоторых аспектах Xy выбран из амидной связи, эинимидной связи или гуаниновой связи. Xy может быть выбран с тем, чтобы обеспечить молекулу водорода вблизи (в пределах двух атомов) к группе Y. Хотя и не желая быть связанными с теорией, считают, что атом H может содействовать распознаванию группы Y гидрофобного кармана посредством взаимодействия с H-связью, в частности, в отношении гидрофобного кармана щели связывания каталитического антитела, такого как h38C2 (например, фиг. 2A). Так, например, амидная связь может быть ориентирована так, чтобы группа NH была непосредственно связана с группой Y, обеспечивая H группы NH для связывания водорода. Альтернативно, группа C=O амида может быть связана с группой Y, при H группы NH без 2 атомов, примыкающих к группе Y, но все же доступных для связывания H. В некоторых аспектах Xs выбран так, что Xs не обеспечивает каких-либо чрезмерно реактивных групп. Xs может быть выбран так, чтобы обеспечить общую длину групп X от 2 до 15 атомов. Xs может быть выбран так, чтобы общая длина группы X составляла от 2 до 10 атомов. Xs может быть выбран так, чтобы общая длина группы X составляла от 4 до 8 атомов. Xs может быть выбран так, чтобы общая длина группы X составляла 5 атомов. Xs может быть выбран так, чтобы общая длина группы X составляла 6 атомов. Xp в идеале выбран так, чтобы обеспечить возможность стратегии специфического, направленного, ковалентного связывания с задерживающим остатком. Например, когда связывающий остаток содержит нуклеофильную группу, Xp может представлять электрофильную группу, и наоборот. Например, если боковая цепь связывающего остатка содержит аминогруппу, такую как K, H, Y, орнитин, Dap, или Dab, то Xp может представлять COOH, или другой аналогично реактивный электрофил. Если связывающий остаток представляет D или E, то Xp может содержать нуклеофильную группу, такую как аминогруппа. Любая из этих стратегий обеспечивает возможность образования ковалентной связи между группой Xp и связывающим остатком использованием стратегий образования амидной связи. Когда связывающая группа представляет C, гомологи С или другие содержащие тиольную группу остатки, то Xp может содержать малемидную группу, обеспечивающую возможность использования стратегии реакции добавления тиол-малемида для ковалентного связывания группы Xp со связывающим остатком. В некоторых аспектах Xp может также содержать тиольную группу, обеспечивающую возможность образования дисульфидной мостиковой связи между связывающим остатком и группой Xp.
Длина основной цепи X может составлять 3-15 атомов.
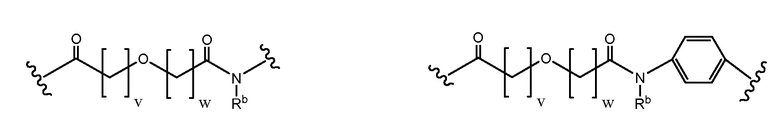

где v и w выбран так, чтобы длина основной цепи X составляла 6-12 атомов, или 3-9 атомов, или 4-7 атомов, или 6 атомов, или 7 атомов, или 8 атомов. Каждый из V и W может быть равен от 0 до 8. V может быть равен 1 или 2. W может быть равен 1 или 2. Каждый V и W может быть равен 1. Rb может представлять водород, замещенный или незамещенный C1-10 алкил, замещенный или незамещенный C3-7 циклоалкил-C0-6 алкил, или замещенный или незамещенный арил-C0-6 алкил. Rb может представлять H. В некоторых аспектах и V, и W = 1, а Rb представляет H.
Определенные варианты осуществления в соответствии с изобретением имеют структуру:
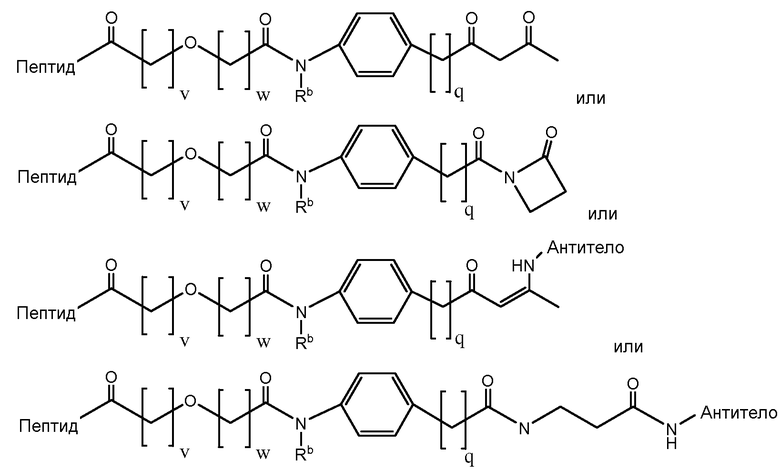
где Пептид представляет [VEGF-Пептид] по изобретению, и v = 1, 2, 3, 4 или 5; w = 1, 2, 3, 4 или 5; q = 0, 1, 2, 3, 4 или 5; и Rb представляет водород, замещенный или незамещенный C1-10 алкил, замещенный или незамещенный C3-7 циклоалкил-C0-6 алкил или замещенный или незамещенный арил-C0-6 алкил. В определенных вариантах осуществления v = 1, 2 или 3; w = 1, 2 или 3; и q = 0, 1, 2 или 3. В некоторых вариантах осуществления v = 1 или 2; w = 1 или 2; и q = 1 или 2, и Rb представляет H.
В некоторых аспектах изобретение относится к соединению, выбранному из группы, состоящей из Соединений 2001-2010, Соединений 2014-2016, Соединения 2018, Соединения 2020, Соединений 2022-2024, Соединений 2027-2033, Соединения 2036, Соединения 2038, Соединений 2041-2042, Соединений 2045-2046, Соединений 2048-2050, и Соединения 2052-2053. Эти соединения могут быть ковалентно связаны со связывающим участком каталитического антитела, например антитела к альдолазе, например, h38C2. В некоторых аспектах изобретение относится к соединению по изобретению, выбранному из группы, состоящей из Соединений 2018, 2036, 2045 и 2050. Эти соединения могут быть ковалентно связаны со связывающим участком каталитического антитела, например антитела к альдолазе, например h38C2. В некоторых аспектах изобретение относится к Соединению 2018.
Настоящее изобретение также относится к последовательностям нуклеиновых кислот (включая последовательности ДНК, последовательности РНК и последовательности ДНК-РНК), кодирующим пептиды по изобретению и их предшественников.
Бифункциональные молекулы
В некоторых аспектах изобретение относится к соединению формулы:
где [Активная молекула-1] представляет [VEGF-Пептид] по изобретению, -[Соединитель]- представляет часть, ковалентно связанную и с [VEGF-Пептидом], и с [Активной Молекулой-2]. Следует понимать, что в некоторых аспектах изобретения, [Соединитель] может быть ковалентно присоединен более чем к одной другой [Активной Молекуле], в дополнение к [VEGF-Пептиду].
R1-[VEGF-пептид]-R2 может представлять
{C(O)CH3}-V-E-P-N-C-D-I-H-V-K-W-V-W-E-C-F-E-R-L-Y-(D-Ala)-(D-Leu)-{NH2} (SEQ ID NO:188) и K11 может представлять связывающий VEGF остаток, ковалентно связанный с [Соединителем].
Активная Молекула может представлять собой любой химический, биохимический или биологический структурный элемент, способный ковалентно связываться с [Соединителем], и взаимодействовать с биологическими системами. Примеры включают терапевтические средства, лекарственные препараты, пролекарства, нацеливающие агенты, токсины, белки, пептиды, молекулы нуклеиновых кислот и липиды. В некоторых аспектах изобретения Активные Молекулы представляют собой Пептиды и могут представлять анти-ангиогенные пептиды. В некоторых аспектах Активные Молекулы в зависимости от целесообразности представляют собой [VEGF-Пептиды] по изобретению и/или [Ang2-Пептиды] по изобретению.
[VEGF-Пептид] может быть ковалентно связан с [Соединителем] через цепь нуклеиновой кислоты или N-концевую аминогруппу, или C-концевую карбоксильную группу связывающего VEGF остатка. Альтернативно, когда линкер является неразветвленным, [VEGF-пептид] может быть ковалентно связан с X-группой L или L' посредством нуклеофильной боковой цепи или N-концевой аминогруппы или C-концевой карбоксильной группы связывающего VEGF остатка. Связывающий VEGF остаток может быть выбран из группы, включающей K, R, Y, C, T, S, гомологи лизина, гомоцистеин, гомосерин, Dap, Dab, N-концевой остаток и C-концевой остаток. Связывающий VEGF остаток может быть выбран из группы, состоящей из K, Y, T, Dap и Dab. В некоторых аспектах изобретения связывающий VEGF остаток представляет K. Связывающий остаток может представлять K10. Связывающий остаток может представлять K12. В некоторых аспектах изобретения одна из группы, состоящей из V1, E2, P3, N4, V9, M10, V12, X14, E17 и C-концевого остатка [VEGF-пептида], замещена связывающим (VEGF-) остатком, содержащим нуклеофильную боковую цепь, или N-концевую аминогруппу, или C-концевую карбоксильную группу, ковалентно связанную со связывающим участком антитела, непосредственно или через промежуточный линкер, причем связывающий остаток выбран из группы, включающей K, R, Y, C, T, S, гомологи лизина, гомоцистеин, гомосерин, Dap, Dab, N-концевой остаток и C-концевой остаток. В некоторых аспектах, когда связывающий остаток расположен на N-конце или C-конце, связывание может происходить через аминогруппу N-конца или карбоксильную группу C-конца, а не через боковую цепь соответствующей аминокислоты. В некоторых аспектах изобретения, одна из V1, N4, M10, V12, X14, и E17 замещена связывающим VEGF остатком. В некоторых аспектах изобретения одна из M10 и V12 замещена связывающим остатком. В некоторых аспектах изобретения M10 замещена связывающим VEGF остатком. В некоторых аспектах изобретения V12 замещена связывающим VEGF остатком.
[Соединитель] может иметь формулу: -[AM1-Спейсер]-[Боковая цепь]-[AM2-Спейсер]-, где каждый из [AM-1-Спейсера] и [AM-2- Спейсера] представляет собой независимо биологически совместимый полимер, блок сополимер C, H, N, O, P, S, галоген (F, Cl, Br, I), или их соль, алкильную, алкенильную, алкинильную, оксоалкильную, оксоалкенильную, оксоалкинильную, аминоалкильную, аминоалкенильную, аминоалкинильную, сульфоалкильную, сульфоалкенильную, сульфоалкинильную, фосфоалкильную, фосфоалкенильную или фосфоалкинильную группу, ковалентно связанную с [Боковой Цепью], и [Боковая цепь] представляет молекулу по меньшей мере с тремя реактивными группами, и [AM-1-Спейсер] ковалентно связан с [Боковой Цепью] и с [Активной Молекулой-1], и [AM-2-Спейсер] ковалентно связан с [Боковой Цепью] и с [Активной Молекулой-2]. Каждый из [AM-1-Спейсера] и [AM-2-Спейсера] может независимо представлять нейтральную, растворимую в воде молекулу, способную образовывать ковалентные связи с их соответствующей Активной Молекулой и [Боковой Цепью]. Когда Активная Молекула содержит пептид, то [AM-1-Спейсер] и [AM-2-Спейсер] могут быть способны образовывать пептидные связи с соответствующей Активной Молекулой.
Каждый из [AM-1-Спейсера] и [AM-2- Спейсера] может быть независимо выбран из группы, состоящей из: аминокислот, модифицированных полиэтиленгликолем, двухосновных кислот полиэтиленгликоля, аминоалканоевых кислот, аминоалканоевых кислот, и полиглицина. Каждый из [AM-1-Спейсера] и [AM-2- Спейсера] может быть независимо выбран из группы, состоящей из (репрезентативных молекул, показанных ниже лишь для иллюстрации определенных подходящих видов):
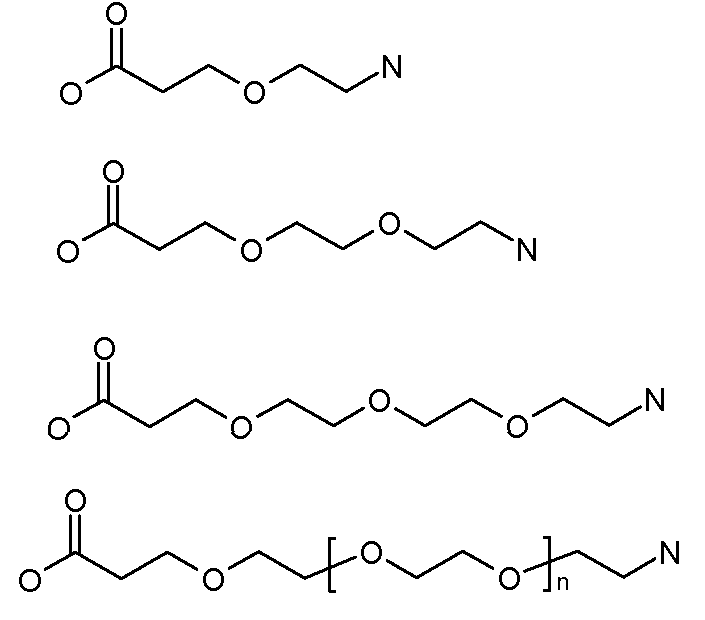
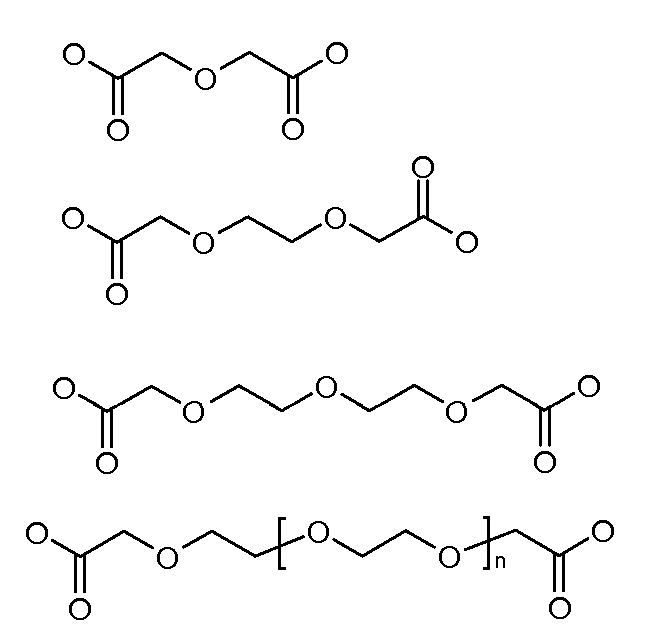
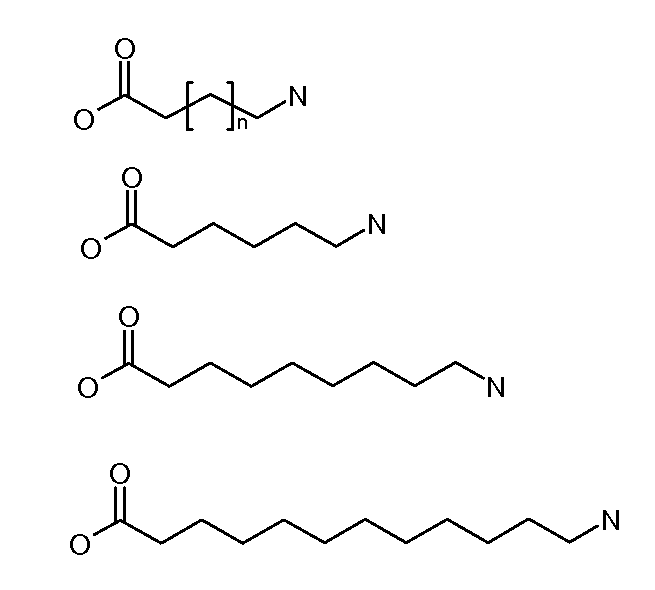
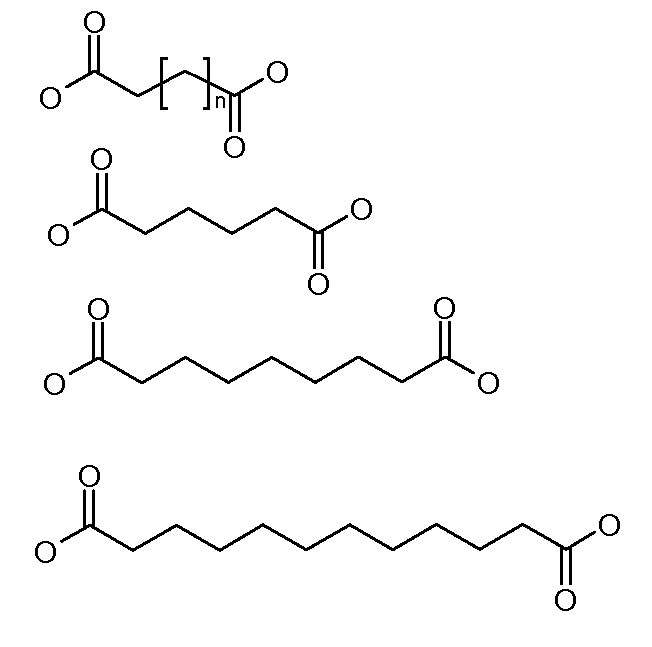
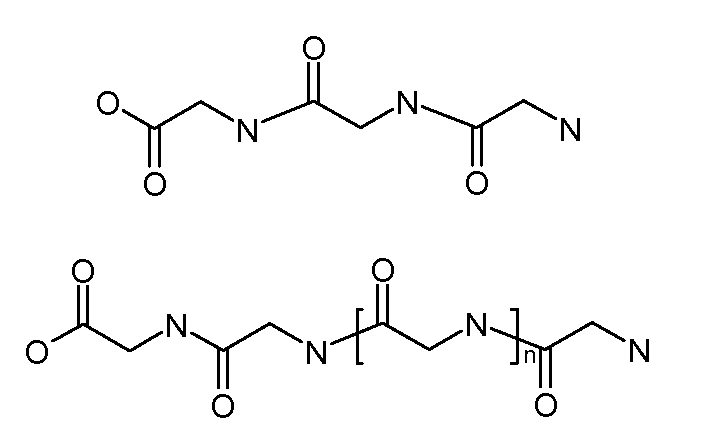
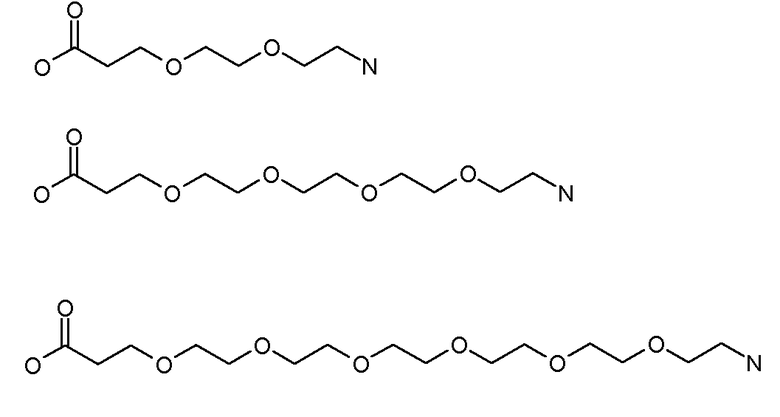
Каждый из [AM-1-Спейсера] и [AM-2-Спейсера] может быть независимо выбран из группы, состоящей из: 2-PEG, 4-PEG, и 6-PEG:
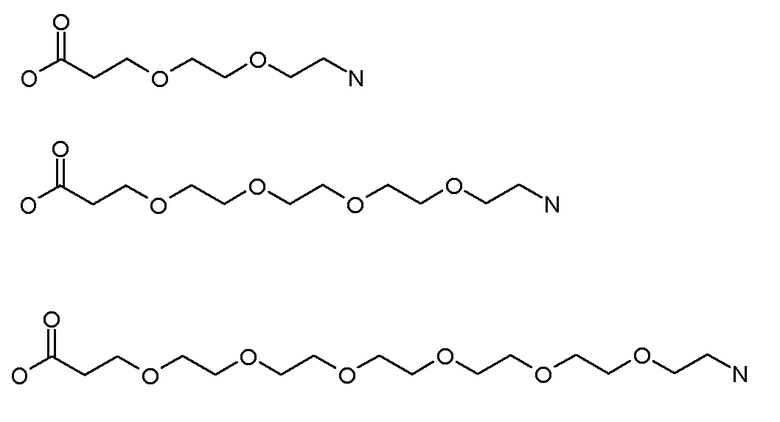
Длина каждого из [AM-1-Спейсера] и [AM-2-Спейсера] может независимо составлять от 6 атомов до 15 атомов. Каждый из [AM-1-Спейсера] и [AM-2-Спейсера] может независимо представлять спейсер 4-PEG. Каждый из [AM-1-Спейсера] и [AM-2-Спейсера] может независимо представлять спейсер 2-PEG. Каждый из [AM-1-Спейсера] и [AM-2-Спейсера] может независимо представлять спейсер 1-PEG. [AM-1-Спейсер] может иметь длину от 6 атомов до 15 атомов. [AM-1-Спейсер] может представлять 4-PEG. [AM-2-Спейсер] может иметь длину от 6 атомов до 15 атомов. [AM-2-Спейсер] может представлять 4-PEG.
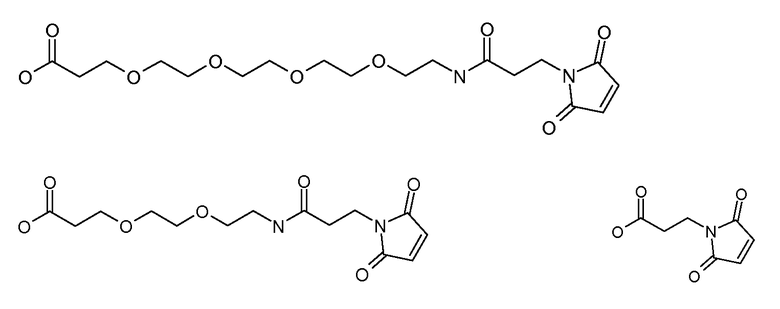
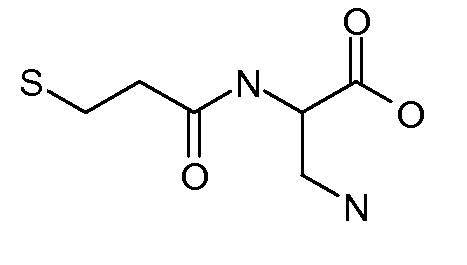
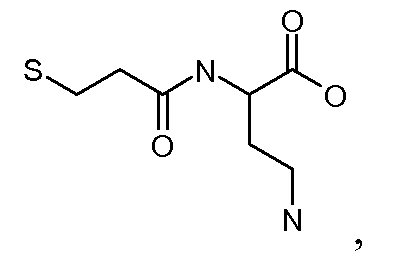
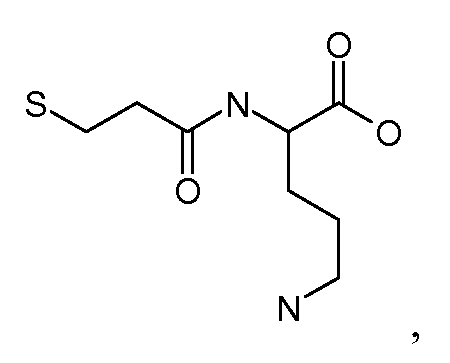
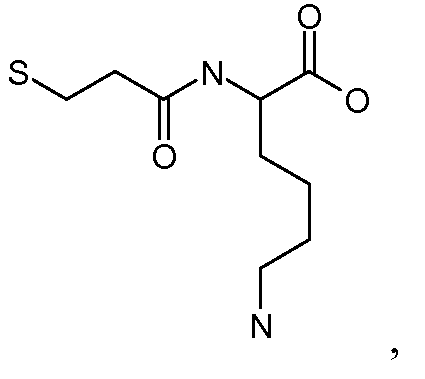
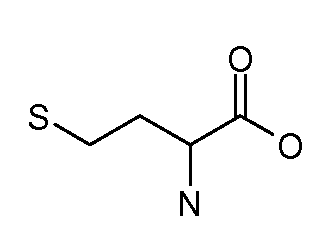
[Боковая цепь] может представлять химическую часть, содержащую три ортогональные реактивные группы. [Боковая цепь] может быть выбрана из группы, состоящей из Цистеина, Диаминопропионовой кислоты, Диаминобутаноевой кислоты, Орнитина, Лизина, Гомоцистеина, Бисмалеимида и Малеимамид-кислоты и их производных и гомологов.
[Боковая цепь] может быть выбрана из группы, состоящей из:
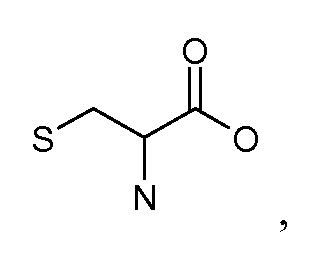
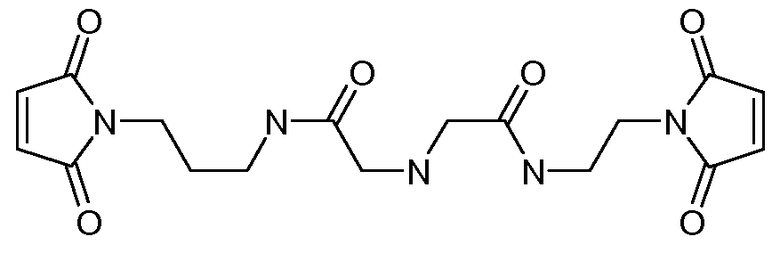 и
и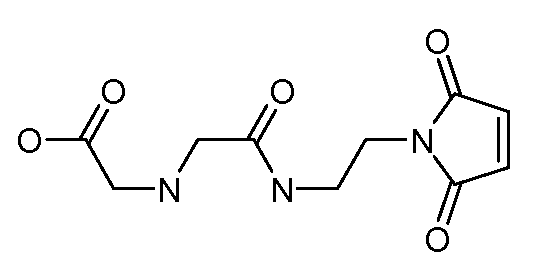
и их производные и гомологи. [Боковая цепь] может представлять цистеин:
Соединения по изобретению могут иметь формулу: [Боковая цепь]-L или [Боковая цепь]-L', где L представляет линкер, и L' представляет линкер, ковалентно присоединенный к боковой цепи аминокислоты в связывающем участке антитела, и [Боковая цепь] ковалентно присоединена к L или L'. [Боковая цепь]-L может быть выбрана из группы, состоящей из:
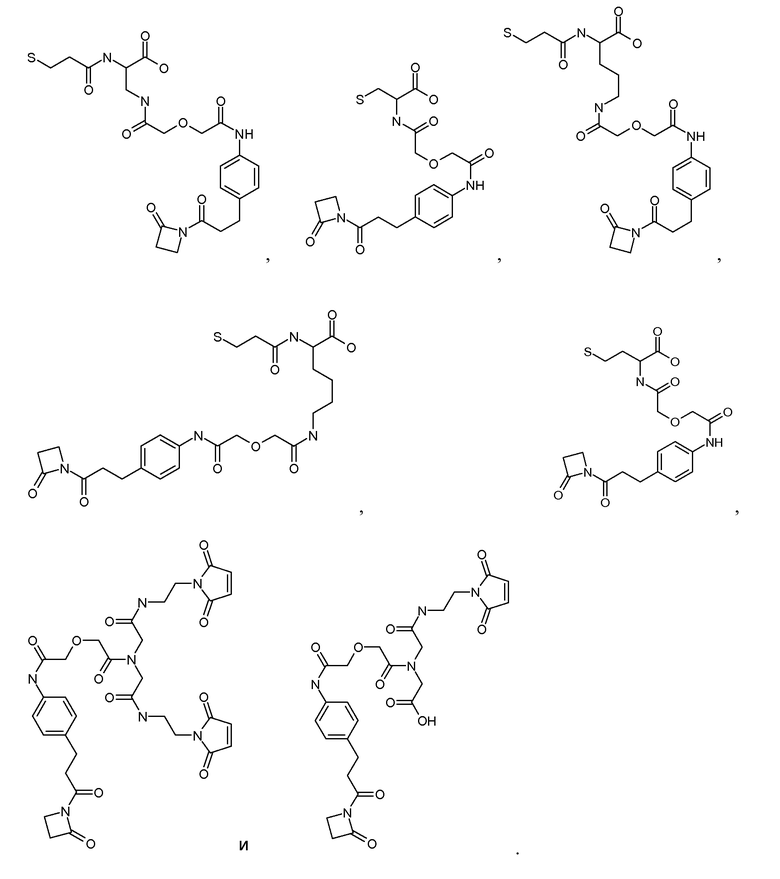
[Ang2 пептиды]
В некоторых аспектах изобретения [Активная Молекула 2] представляет собой связывающий Ang-2 пептид [Ang2-пептид]. [Ang2 -Пептид] может быть ковалентно связан с [Соединителем] посредством нуклеофильной боковой цепи или N-конца или C-конца связывающего Ang2 остатка, причем связывающий Ang2 остаток выбран из группы, включающей K, R, Y, C, T, S, гомологи лизина, гомоцистеин, Dap, Dab, N-концевой остаток и C-концевой остаток]. Когда Ang2-связывающий остаток локализуется на C-конце или N-конце, связь может осуществляться через аминогруппу N-конца или карбоксильную группу C-конца, а не боковую цепь конкретной аминокислоты в этом положении. Связывающий Ang2 остаток может быть выбран из группы, состоящей из K, Y, T, Dap, и Dab. Связывающий Ang2 остаток может представлять K.
В некоторых аспектах изобретения [Ang2-Пептид] содержит последовательность, по существу гомологичную:
Q1 X 2 Y3 Q4 X 5 L6 D7 E8 X 9 D10 X 11 X 12 X 13 X 14 D15 X 16 F17 M18 X 19 Q20 Q21 G22 (SEQ ID NO:107), где X2 выбран из группы, состоящей из K, N, R, H, Kac, Nick и CbcK, и X5 выбран из группы, состоящей из P, hP, dhP и BnHP, и X9 выбран из группы, состоящей из L, I, ThA и Kac, и Х11 выбран из группы, состоящей из Q, N, C, K, Kac, Dab и Dap, и X12 выбран из группы, состоящей из L, HL, Nva, I, HchA, HF и ThA, и X13 выбран из группы, состоящей из L, HL, Nva, I, HchA, HF и ThA, и X14 выбран из группы, состоящей из ароматических остатков, и X16 выбран из группы, состоящей из Q и N, и X19 выбран из группы, состоящей из L и I, и где один из Q1, E8, X9, X11, X12, D15, X16, M18, X19 или G22 замещен связывающим Ang2 остатком.
В некоторых аспектах X2 выбран из группы, состоящей из K, N, и Kac. X2 может представлять N. X2 может представлять Kac. В некоторых аспектах X5 выбран из группы, состоящей из P, hP и dhP. X5 может представлять P. В некоторых аспектах X9 представляет L, в некоторых аспектах X9 представляет Kac. В некоторых аспектах X11 выбран из группы, состоящей из K, Kac. В некоторых аспектах X13 выбран из группы, состоящей из L, HL, Nva, I. X13 может представлять L. В некоторых аспектах X14 выбран из группы, состоящей из F, Y, W, BPA, CF, NF. X14 может представлять Y. В некоторых аспектах X16 представляет Q. Связывающий Ang2 остаток может замещать одну группу, состоящую из X9, X11, X12, D15, X16, M18 и X19. X11 может представлять локализацию связывающего Ang2 остатка.
[Ang2-пептид] может содержать последовательность, по существу гомологичную одному или более соединениям, выбранным из группы, состоящей из: SEQ ID NO: 137-191. Ang-2 пептид может содержать соединение, выбранное из группы, состоящей из SEQ ID NOs: 137-172 и SEQ ID NO:182. [Ang2-пептид] может содержать последовательность, по существу гомологичную одному или более соединениям, выбранным из группы, состоящей из: SEQ ID NO:137, SEQ ID NO:138, SEQ ID NO:139, SEQ ID NO:140, SEQ ID NO:153, SEQ ID NO:154, SEQ ID NO:155, SEQ ID NO:157, SEQ ID NO:161, SEQ ID NO:174 и SEQ ID NO:181.
[Ang2-пептид] может содержать последовательность, по существу гомологичную Q(Kac)YQPLDE(Kac)DKTLYDQFMLQQG (SEQ ID NO:153). R1 может представлять C(O)CH3. R2 может представлять NH2. В некоторых аспектах R1-[Ang-пептид]-R2 может представлять {C(O)CH3}Q(Kac)YQPLDE(Kac)DKTLYDQFMLQQG-{NH2) (SEQ ID NO:153) и K11 представляет связывающий Ang2 остаток, ковалентно связанный с [Соединителем].
В некоторых аспектах изобретения соединение может быть выбрано из группы, состоящей из: соединений 5001-5028, и 5031-5062. В некоторых аспектах соединение выбрано из группы, состоящей из соединений 5001-5028 и соединений 5031-5074. В некоторых аспектах, соединение выбрано из группы, состоящей из соединений 5053, 5060, 5061 и 5062. В некоторых аспектах соединение представляет соединение 5053. В некоторых аспектах соединение представляет соединение 5037. В некоторых аспектах изобретения соединение выбрано из группы, состоящей из: соединений 6001-6028 и 6031-6062. В некоторых аспектах изобретения соединение выбрано из группы, состоящей из соединений 6001-6026, 6029, 6031-6069. В некоторых аспектах изобретения соединение выбрано из группы, состоящей из соединений 6001-6028 и соединений 6031-6074. В некоторых аспектах изобретения соединение выбрано из группы, состоящей из соединений 6053, 6060, 6061 и 6062. В некоторых аспектах соединение представляет соединение 6053. В некоторых аспектах соединение представляет соединение 6037.
Антитела
Содержание US2006205670 включено в настоящее описание путем ссылки - в частности, абзацы [0153]-[0233], описывающие, среди других элементов технологии антител, антитела, полезные фрагменты и варианты и их модификации, связывающие участки и CDR, получение, экспрессию, гуманизацию и модификацию, гликозилирование, ADCC, CDC, увеличение периода полувыведения, векторы экспрессии, системы млекопитающих-хозяев и укладку.
Как обсуждается в некоторых вариантах осуществления, определенные антитела, которые могут использоваться в сочетании с соединениями по изобретению, могут требовать наличия реактивной боковой цепи в связывающем участке антитела. Реактивная боковая цепь может присутствовать естественно или может быть помещена в антитело мутацией. Реактивный остаток связывающего участка антитела может быть связаны с антителом, например, когда остаток кодируется нуклеиновой кислотой, присутствующей в лимфоидной клетке, сначала идентифицированной для получения антитела. Альтернативно, аминокислотный остаток может быть получен целенаправленной мутацией ДНК с тем, чтобы кодировать определенный остаток (см., например, патент WO 01/22922, выданный Meares et al.). Реактивный остаток может представлять ненатуральный остаток, полученный, например, биосинтетическим включением с использованием необычного кодона, мРНК и аминоацил-мРНК, как обсуждается в настоящем описании. В другом подходе аминокислотный остаток или ее реактивные функциональные группы (например, нуклеофильная аминогруппа или сульфгидрильная группа) могут быть присоединены к аминокислотному остатку в связывающем участке антитела. Таким образом, ковалентная связь с антителом, происходящая «посредством аминокислотного остатка в связывающем участке антитела», которая используется в настоящем изобретении, означает, что связь может осуществляться непосредственно с аминокислотным остатком связывающего участка антитела или посредством химической части, которая связана с боковой цепью аминокислотного остатка связывающего участка антитела. В некоторых вариантах осуществления аминокислота представляет собой цистеин, а реакционная группа боковой цепи представляет собой сульфгидрильную группу. В других вариантах осуществления аминокислотный остаток представляет собой лизин, а реакционная группа боковой цепи представляет собой ε-аминогруппу.
Каталитические антитела представляют собой один источник антител с подходящими связывающими участками антитела, которые содержат одну или более боковых цепей реактивной аминокислоты. Такие антитела включают антитела к альдолазе, антитела к бета-лактамазе, антитела к эстеразе, антитела к амидазе и тому подобные.
Один вариант осуществления включает антитело к альдолазе, такое как мышиные моноклональные антитела mAb 33F12 и mAb 38C2, а также возможные химерные и гуманизированные варианты таких антител (например, h38C2, SEQ ID NOs: 1 и 2). Мышиное mAb 38C2 (andh38C2) имеет реактивный лизин около HCDR3, но снаружи от него, и представляет собой прототип нового класса каталитических антител, которые были генерированы реактивной иммунизацией и механистически имитированными натуральными ферментами альдолазами. См. CF. Barbas 3rd et al., Science 278:2085-2092 (1997)). Другие каталитические антитела к альдолазе, которые могут использоваться, включают антитела, продуцируемые гибридомой 85A2, имеющей номер доступа в ATCC (Американской Коллекции Типовых Культур) PTA-1015; гибридомой 85C7, имеющей номер доступа в ATCC PTA-1014; гибридомой 92F9, имеющей номер доступа в ATCC PTA-1017; гибридомой 93F3, имеющей номер доступа в ATCC PTA-823; гибридомой 84G3, гибридомой PTA-824; гибридомой 84Gl 1, имеющей номер доступа в ATCC PTA-1018; гибридомой 84H9, имеющей номер доступа в ATCC PTA-1019; гибридомой 85H6, имеющей номер доступа в ATCC PTA-825; гибридомой 90G8, имеющей номер доступа в ATCC PTA-1016. Посредством реактивного лизина, эти антитела катализируют реакции альдола и ретро-альдола, используя енаминовый механизм натуральных альдолаз. См., например, J. Wagner et al, Science 270:1797-1800 (1995); CF. Barbas 3rd et al, Science 278:2085-2092 (1997); G. Zhong et al, Angew. Chem. Int. Ed. Engl. 38:3738-3741 (1999); A. Karlstrom et al, Proc. Natl. Acad. Sci. U.S.A., 97:3878-3883 (2000). Антитела к альдолазе и способы генерирования антител к альдолазе описаны в патентах США № 6210938, 6368839, 6326176, 6589766, 5985626 и 573375, которые включены в настоящее описание путем ссылки.
Соединения по изобретению могут быть образованы также связыванием соединения по изобретению с реактивным цистеином, такие как соединения, обнаруживаемые в связывающих участках каталитических антител к тиоэстеразе и эстеразе. Подходящие каталитические антитела к тиоэстеразе описаны K.D. Janda et al, Proc. Natl. Acad. Sci. U.S.A. 91 :2532-2536 (1994). Подходящие антитела к эстеразе описаны P. Wirsching et al, Science 270:1775-1782 (1995). Содержащие реактивные аминокислоты антитела могут быть получены способами, хорошо известными в данной области, включая мутацию связывающего участка антитела для кодирования реактивной аминокислоты или химической дериватизации боковой цепи аминокислоты в связывающем участке антитела линкером, который содержит реактивную группу.
Антитело может представлять собой гуманизированное антитело. Когда соединения по изобретению ковалентно связаны со связывающим участком антитела, и такие антитела гуманизированы, то важно, чтобы такие антитела были гуманизированы с удержанием высокого сродства связывания с группой Z. Предусмотрены различные формы гуманизированных мышиных антител к альдолазе. В одном варианте осуществления используется гуманизированное каталитическое антитело к альдолазе h38c2 IgG1 или h38c2 Fab с человеческими константными доменами Cκ и Cγ1. C. Rader et al, J. MoI. Bio. 332:889-899 (2003) описывают генные последовательности и векторы, которые могут использоваться для получения h38c2 Fab и h38c2 IgG1. Ген DPK-9 человеческой зародышевой линии Vk и человеческий ген JK4 Jk использовались в качестве остовов для гуманизации вариабельного домена каппа легкой цепи m38c2, а ген DP-47 человеческой зародышевой линии и ген JH4 человеческой JH использовались в качестве остовов для гуманизации вариабельного домена тяжелой цепи m38c2. Фиг. 2A иллюстрирует совмещение последовательностей между вариабельной легкой и тяжелой цепями в m38c2, h38c2 и человеческими зародышевыми линиями. В h38c2 могут использоваться константные домены IgG1, IgG2, IgG3 или IgG4, включая любой из их аллотипов. Фиг. 2B иллюстрирует один вариант осуществления h38c2 IgG1 с использованием аллотипа G1m(f), где аминокислотные последовательности легкой и тяжелой цепи этого h38c2 IgG1 представлены на чертеже. В некоторых вариантах осуществления соединений по изобретению, где антитело представляет h38c2 IgG1 с аллотипом G1m(f), связями Z с боковой цепью остатка лизина в положении 99 тяжелой цепи. Этот остаток отмечен жирной печатью на фиг. 2В. В другом варианте осуществления используется химерное антитело, содержащее вариабельные домены (VL и VH) h38c2 константные домены из IgG1, IgG2, IgG3, или IgG4. Антитело может представлять собой антитело полной длины, Fab, Fab', F(ab')2, Fv, dsFv, scFv, VH, VL, диатело, или мини-антитело, содержащее домены VH и VL из h38c2. Антитело может представлять собой антитело, содержащее домены VH и VL из h38c2 и константный домен, выбранный из группы, состоящей из IgG1, IgG2, IgG3, и IgG4. Антитело может представлять собой h38C2 IgG1. Антитело может представлять собой гуманизированный вариант мышиного антитела к альдолазе, содержащего константную область и человеческого IgG, IgA, IgM, IgD, или IgE антитела. В другом варианте осуществления Антитело является химерным антителом, содержащим вариабельную область из мышиного антитела к альдолазе и константную область из человеческого IgG, IgA, IgM, IgD или IgE антитела. В еще одних вариантах осуществления Антитело представляет собой полностью человеческий вариант мышиного антитела к альдолазе, содержащего полипептидную последовательность из натурального или нативного человеческого IgG, IgA, IgM, IgD, или IgE антитела.
Предусмотрены также различные формы фрагментов гуманизированного антитела к альдолазе. В одном варианте осуществления используется h38c2 F(ab')2. h38c2 F(ab')2 может быть получен протеолитическим перевариванием h38c2 IgG1. В другом варианте осуществления используется h38c2 scFv, содержащий домены VL и VH из h38c2, которые, возможно, соединены промежуточным линкером (Gly4Ser)3. В качестве альтернативы гуманизации, могут быть генерированы человеческие антитела. Например, в настоящее время можно получить трансгенных животных (например, мышей), которые способны после иммунизации (или реактивной иммунизации в случае каталитических антител) продуцировать полный репертуар человеческих антител в отсутствие продукции эндогенного иммуноглобулина.
Альтернативно, технология представления (см., например, J. McCafferty et al, Nature 348:552-553 (1990); HJ. de Haard et al, J Biol Chem 274, 18218-18230 (1999); и A.Kanppik et al, J Mol Biol, 296, 57-86 (2000)) может использоваться для получения человеческих антител и фрагментов антител in vitro с использованием генного репертуара вариабельного (V) домена иммуноглобулина от неиммунизированных доноров. Как указано выше, человеческие антитела могут также генерироваться активацией B клеток in vitro. См., например, патенты США № 5567610 и 5229275; и C.A.K. Borrebaeck et al, Proc. Natl. Acad. Sci. U.S.A. 85:3995-3999 (1988).
Предусмотрены модификации аминокислотных последовательностей антител, описанных в настоящей заявке. Например, может быть желательным улучшение сродства связывания и/или других биологических свойств антитела. Варианты аминокислотной последовательности антител получаются введением соответствующих нуклеотидных изменений в нуклеиновую кислоту антител или пептидным синтезом. Такие модификации включают, например, делецию, инсерцию и/или замещения остатков внутри аминокислотных последовательностей антитела. Любая комбинация делеции, инсерции и замещения осуществляется для получения конечного конструкта при условии, что конечный конструкт обладает желательными характеристиками. Аминокислотные изменения также могут изменить пост-трансляционные процессы антитела, такие как изменение числа или положения сайтов гликозилирования. Способ, используемый для идентификации определенных остатков или областей антитела, которые представляют собой предпочтительные участки локализации для мутагенеза, называется «сканирующим аланином мутагенезом», как описано в публикации B.C. Cunningham and J.A. Wells, Science 244:1081-1085 (1989).
Иллюстративные применения соединений и композиций по изобретению
Изобретение относится к применению соединений по изобретению или фармацевтических композиций по изобретению в способе ингибирования или снижения ангиогенеза или для лечения или профилактики заболевания или симптома, связанного с ангиогенным расстройством. Изобретение относится к способам ингибирования или снижения ангиогенеза или лечения или профилактики заболевания или симптома, связанного с ангиогенным расстройством, включающим введение пациенту терапевтически эффективной дозы соединений и композиций по изобретению. Изобретение также относится к способам доставки или введения соединений и композиций по изобретению и способам лечения с использованием соединений и композиций по изобретению. Используемый в настоящем описании термин «состояние, опосредованное ангиогенезом», представляет собой состояние, которое вызвано патологической активностью ангиогенеза, или состояние, при котором соединения, которые модулируют активность ангиогенеза, могут применяться в качестве терапевтических средств. Один аспект изобретения относится к способам модулирования активности VEGF in vivo, включающим введение индивиду эффективного количества соединения или композиции, описанной в настоящей заявке. Другой аспект изобретения включает способы применения соединений и композиций по изобретению в диагностических целях. Заболевания и состояния, которые можно лечить и/или диагностировать соединениями и композициями по изобретению, включают рак, артрит, гипертонию, почечные заболевания, псориаз, ангиогенез глаз, связанный с глазным расстройством, инфекцией или хирургическим вмешательством, дегенерацию желтого пятна, диабетическую ретинопатию и тому подобные.
Конкретнее, примеры «рака» при использовании в связи с настоящим изобретением, включают рак, выбранный из рака легких (NSCLC, немелкоклеточного рака легких, и SCLC, мелкоклеточного рака легких), рака головы и шеи, рака яичников, рака ободочной кишки, рака прямой кишки, рака предстательной железы, рака анальной области, рака желудка, рака молочной железы, рака почек или мочеточников, почечноклеточной карциномы, карциномы почечной лоханки, неоплазии центральной нервной системы (CNS, ЦНС), первичной лимфомы CNS, не-Ходжкинской лимфомы, опухолей позвоночного столба, карцином ротоглотки, гортанной части глотки, пищевода, поджелудочной железы, печени, желчного пузыря и желчных протоков, тонкой кишки, опухолей мочевыводящих путей; или лимфомы или комбинации одного или более указанных выше форм рака. Еще конкретнее, примеры патологии, определяемой термином «рак» в связи с настоящим изобретением, включают рак, выбранный из рака легких (NSCLC и SCLC), рака молочной железы, рака яичников, рака ободочной кишки, рака прямой кишки, рака предстательной железы, рака анальной области или комбинации одного или более указанных выше форм рака.
В некоторых аспектах соединения по изобретению могут использоваться при лечении и/или профилактики глазных заболеваний, таких как возрастная дегенерация желтого пятна (и влажная, и сухая), глаукома, диабетическая ретинопатия (включая диабетический отек желтого пятна), неоваскулярная мембрана сосудистой оболочки (CNV), увеит, миопическая дегенерация, глазные опухоли, окклюзия центральной вены сетчатки, рубеоз, сосудистая неоваскуляризация, центральная серозная ретинопатия, диск глазной поверхности, такой как сухой глаз, окклюзия центральной артерии сетчатки, кистозный отек желтого пятна и другие дегенеративные заболевания сетчатки. В некоторых вариантах осуществления может иметь преимущество использование молекул с высоким сродством связывания с соответствующей мишенью (мишенями), но с более низкой фармакокинетической активностью или периодом полувыведения, поскольку будет происходить небольшое ферментативное разрушение молекулы при ее нахождении в глазу, но после того как происходит очищение глаза от молекулы, может быть желательным разрушение молекулы и как можно более быстрое выведение ее почками с тем, чтобы минимизировать возможное непосредственное действие или побочные эффекты вне глаза. В некоторых аспектах изобретения для лечения глазных заболеваний используется Соединение 6037. В некоторых аспектах изобретения для лечения глазных заболеваний используется Соединение 6044. В некоторых аспектах изобретения для лечения глазных заболеваний используется Соединение 6053.
Соединения в соответствии с изобретением могут быть сольватированными, в частности гидратированными. Гидратация может происходить во время получения соединений или композиций, содержащих соединения, или гидратация может происходить в течение времени вследствие гигроскопической природы соединений.
В другом аспекте настоящее изобретение включает способы изменения по меньшей мере одной физической или биологической характеристики соединений и композиций. Способы включают ковалентное связывание [VEGF-Пептида] по изобретению со связывающим участком антитела или непосредственно, или посредством линкера. Характеристики соединений по изобретению, которые могут быть модифицированы, включают без ограничения сродство связывания, восприимчивость к разрушению (например, протеазами), фармакокинетику, фармакодинамику, иммуногенность, растворимость, липофильность, гидрофильность, гидрофобность, устойчивость (более или менее устойчиво, а также планируемое разрушение), ригидность, гибкость, модуляцию связывания антитела и тому подобные. Биологическая активность конкретного соединения по изобретению может быть также увеличена добавлением эффекторной функции (функций), обеспечиваемых антителом. Например, антитело обеспечивает такие эффекторные функции как эффекторные функции, опосредованные комплементом. Без намерения быть связанными с какой-либо теорией, считают, что являющаяся антителом часть соединения по изобретению может в целом продлевать период полувыведения имеющего меньший размер [VEGF-Пептида] in vivo. Таким образом, в одном аспекте изобретение относится к способу увеличения эффективной циркуляции за счет удлинения периода полувыведения [VEGF-Пептида].
В другом аспекте настоящее изобретение включает способы модификации связывающего участка антитела для выработки специфичности связывания VEGF, или VEGF и одна ли более других Активных Молекул, включая Ang2. Такие способы включают ковалентное связывание боковой цепи реактивной аминокислоты в связывающем участке антитела с химической частью на линкере соединения [VEGF-Пептида]-линкера, как описано в настоящей заявке. Химическая часть линкера достаточно удалена от [VEGF-Пептида], так что [VEGF-Пептид] может связывать родственное ему соединение, когда соединение [VEGF-Пептида]-линкера ковалентно со связывающим участком антитела (аналогичные ограничения будут существовать для достижения предела других макромолекул, увеличивающих период полувыведения). Обычно, антитело не считается специфичным для молекулы-мишени. В некоторых вариантах осуществления, антитело перед ковалентным связыванием не должно иметь сродство к VEGF менее чем примерно 1×10-5 моль/литр. Однако после того как антитело ковалентно связывается с [VEGF-Пептидом], модифицированное антитело предпочтительно имеет сродство к молекуле-мишени по меньшей мере примерно 1×10-6 моль/литр, альтернативно, по меньшей мере примерно 1×10~7 моль/литр, альтернативно, по меньшей мере 1×10~8 моль/литр, альтернативно, по меньшей мере 1×10-9 моль/литр, или альтернативно, по меньшей мере 1×10-10 моль/литр.
Введение [VEGF-Пептида] по изобретению иммунокомпетентному индивиду может привести к выработке антител против конъюгата. Такие антитела могут быть направлены на вариабельную область. Включая идиотип антитела, а также на нацеливающий агент или любой линкер, используемый для сопряженного связывания нацеливающего агента с антителом. Снижение иммуногенности [VEGF-Пептида] может осуществляться способами, хорошо известными в данной области, такими как путем присоединения спейсеров на основе длинноцепочечного полиэтиленгликоля (PEG) и тому подобных полимеров к [VEGF-Пептиду]. Длинноцепочеченый PEG и другие полимеры известны их способностью маскировать инородные эпитопы, приводя к сниженной иммуногенности терапевтических белков, которые проявляют инородные эпитопы (N. V. Katre, J. Immunol. 144:209-213 (1990); G.E. Francis et al., Int. J. Hematol. 68:1-18 (1998). Альтернативно или в дополнение, индивиду, которому введен конъюгат антитела-[VEGF-Пептида], может вводиться иммуносуппрессант, такой как циклоспорин А, анти-CD3 антитело и тому подобные. Сказанное выше также относится к внесенным необходимым изменениям, когда другие Активные Молекулы, такие как Ang2, ковалентно связаны посредством разветвленного линкера с соединениями по изобретению.
Изобретение также относится к стереоизомерам, таутомерам, сольватам, пролекарствам и фармацевтически приемлемым солям соединений по изобретению.
Фармацевтические композиции, способы введения и комбинированные методы лечения
Изобретение также относится фармацевтическим композициям, содержащим терапевтически эффективное количество одного или более соединений по изобретению. Изобретение также относится к способам лечения с использованием таких композиций и к способам получения фармацевтических композиций по изобретению. Содержание US2006205670 включено в настоящее описание путем ссылки, в частности, абзацы [0497]-[0510], описывающие введение ([0498],[0499]; препаративные формы ([0499],[0500], [0501], [0502]); препараты ([0503],[504]); наборы ([0505]); стратегии дозировки ([0506], [0507], [0508], [0509]); в отношении соответствующего нацеливающего агента / нацеливающего агента AA / [Пептида] по изобретению, и способы визуализации или определения локализации мишени, на которую направлен [Пептид] изобретения.
Изобретение также включает введение одного или более соединений или композиций по изобретению в комбинации с одним или более онкологическими лекарственными средства, причем каждое вводится в соответствии со схемой, подходящей для данного лекарственного средства. Компоненты комбинированного лечения могут вводиться одновременно и не одновременно. Компоненты могут вводиться в одной и той же или в отдельных композициях, и одним и тем же или различными путями введения. Примеры подходящих онкологических лекарственных средств и комбинаций, которые могут применяться в комбинации с пептидами и соединениями по изобретению, перечислены в таблицах 4-6 US2006205670 (который включен в настоящее описание путем ссылки). Фармацевтические композиции по изобретению могут, кроме того, содержать терапевтически эффективное количество одного или более химиотерапевтического средства, причем химиотерапевтическое средство предпочтительно представляет собой соединение, выбранное из группы, состоящей из 5-Фторурацила, Иринотекана, Таксотере, Сунитиниба, Акситиниба, оксилаплатина, бевацизумаба, цетуксимаба или их химических эквивалентов. В некоторых аспектах химиотерапевтическое средство выбрано из группы, состоящей из 5-Фторурацила, Иринотекана, Таксотере, Сунитиниба и Акситиниба, или их химических эквивалентов.
Примеры синтеза соединений по изобретению
Соединения по изобретению могут быть получены с использованием методик, известных в данной области. Обычно, синтез [VEGF-Пептида] или [Ang2- Пептида] (или другой Активной Молекулы) является первой стадией и проводится, как описано в настоящей заявке. Затем Активная Молекула дериватизируется для связывания с соединяющим компонентом (линкером), который затем комбинируется с антителом. Специалист в данной области легко поймет, что определенные используемые стадии синтеза зависят от точной природы трех компонентов. Так, конъюгаты [VEGF-Пептида]-линкера и соединения по изобретению, описанные в настоящей заявке, могут быть легко синтезированы. [VEGF-Пептиды] и [Ang2- Пептиды] могут быть синтезированы многими методиками, которые известны специалистам в данной области. Для твердофазного пептидного синтеза, резюме иллюстративных методик можно найти в публикации Chemical Approaches to the Synthesis of Peptides and Proteins (Williams et al, eds.), CRC Press, Boca Raton, FL (1997).
Обычно, желательная пептидная Активная Молекула синтезируется последовательно на твердой фазе в соответствии с процедурами, хорошо известными в данной области. См., например, Заявку на патент США № 2003/0045477). Линкер может быть присоединен к пептиду частично или полностью на твердой фазе или может добавляться с использованием методик фазы растворения после удаления пептида из смолы (см. фиг. 1А и 1В). Например, N-защищенная содержащая аминокислоту или карбоновую кислоту связывающая часть может быть присоединена к смоле, такой как 4-гидроксиметил-феноксиметил-поли(стирол-1% дивинилбензол). N-защитная группа может быть удалена соответствующей кислотой (например, TFA. Трифторуксусной кислотой, для Boc) или основанием (например, пиперидином для Fmoc), и пептидная последовательность может быть получена обычным путем от C-конца к N-концу (см. фиг. IA). Альтернативно, сначала может быть синтезирована пептидная последовательность, а линкер добавлен к N-концевому аминокислотному остатку в последнюю очередь (см. фиг. IB). Еще один способ предусматривает снятие защиты соответствующей боковой цепи во время синтеза и дериватизацию подходящим образом реактивным линкером. Например, защита боковой цепи лизина может быть снята и взаимодействовать с линкером, имеющим активный сложный эфир. Альтернативно, аминокислотное производное с подходящим образом защищенной линкерной частью, уже присоединенной к боковой цепи (см. фиг. 1B), или, в некоторых случаях, альфа-амино азот может быть добавлен в качестве части растущей пептидной последовательности.
В конце твердофазного синтеза конъюгат нацеливающего агента-линкера удаляется из смолы и лишается защиты или последовательно, или одной операцией. Удаление конъюгата и снятие защиты может осуществляться одной операцией путем обработки связанного со смолой конъюгата пептида-линкера реагентом расщепления, например, акцептором, содержащим трифторуксусную кислоту, таким как тианизол, вода или этандитиол. После снятия защиты и высвобождения нацеливающего агента, может проводиться дальнейшая дериватизация пептида нацеливающего агента. Полностью лишенный защиты конъюгат Активной Молекулы пептидила-линкера очищается последовательностью хроматографических стадий с использованием любого или всех из следующих типов: ионный обмен на слабо основной смоле в форме ацетата; гидрофобная адсорбционная хроматография на недериватизированном полистироле-дивинилбензоле (например, AMBERLITE XAD); абсорбционная хроматография на силикагеле; ионообменная хроматография на карбоксиметилцеллюлозе; разделительная хроматография, например, на SEPHADEX G-25, LH-20 или противоточном распределении; высокоэффективная жидкостная хроматография (ВЭЖХ, HPLC), в частности, ВЭЖХ в обращенной фазе на связанном окстил- или октадецилсилил-диоксидом кремния фазовом колоночном заполнении.
Краткое описание чертежей
Фиг. 1А и фиг. 1В иллюстрируют твердофазный синтез конъюгатов нацеливающего агента-линкера по настоящему изобретению.
Фиг. 2А иллюстрирует совмещение аминокислотных последовательностей вариабельных доменов m38c2, h38c2, и человеческих зародышевых линий. Каркасные области (FR) и области, определяющие комплементарность (CDR), определяются в соответствии со способом Kabat et al. Звездочками отмечены различия между m38c2 и h38c2 или между h38c2 и человеческими зародышевыми линиями. Фиг. 2В иллюстрирует аминокислотную последовательность легкой и тяжелой цепей (SEQ ID NO: 1 и 2 соответственно) одного варианта осуществления гуманизированного 38c2 IgG1.
На фиг. 3 показаны различные струкры, которые могут служить в качестве линкерных реактивных групп. Структуры A-C образуют обратимые ковалентные связи с поверхностно доступными реактивными нуклеофильными группами (например, боковой цепью лизина или цистеина) связывающего участка антитела. R'1, R'2, R'3, и R4 в структурах A-C представляют заместители, которые включают, например, C, H, N, O, P, S, галоген (F, Cl, Br, I) или их соль. X представляет N, C, или любой другой гетероатом. Эти заместители могут также включать группу, такую как алкильная, алкенильная, алкинильная, оксоалкильная, оксоалкенильная, оксоалкинильная, амиоалкильная, аминоалкенильная, аминоалкинильная, сульфоалкильная, сульфоалкенильная или сульфоалкинильная группа, фосфоалкильная, фосфоалкенильная, фосфоалкинильная группа. R'2 и R'3 могут быть циклическими, как иллюстрируется в структурах B и C, тогда как X может представлять гетероатом. Например, структура A может образовывать необратимую ковалентную связь с реактивным нуклеофилом, если X представляет N, и если R'1 и R3 образуют часть циклической структуры. Структуры D-G могут образовывать необратимые ковалентные связи с реактивными нуклеофильными группами в связывающем участке антитела. В этих структурах, R"1 и R"2 представляют C, O, N, галид или уходящие группы, такие как месил иди тосил.
На фиг. 4 показаны различные электрофилы, которые подходят для реактивной модификации боковой цепью реактивной аминокислоты в связывающем участке антитела и, таким образом, могут служить в качестве линкерных реактивных групп. Ключ: (A) ацил бета-лактам; (B) простой дикетон; (C) активный сложный эфир сукцинимида; (D) малеимид; (E) галоидацетамид с линкером; (F) галоидкетон; (G) циклогексил дикетон; и (H) альдегид. Извитая линия указывает точку присоединения к остальному линкеру или нацеливающему агенту. X относится к галогену.
На фиг. 5 показано добавление нуклеофильной ("nu") боковой цепи в связывающем участке антитела к соединениям A-G на фиг. 3. Антитело-Nu- относится к ковалентной связи с боковой цепью аминокислоты, несущей нуклеофил, в связывающем участке антитела.
На фиг. 6 показано добавление нуклеофильной боковой цепи в связывающем участке антитела к соединениям A-H на фиг. 5. Антитело- Nu- относится к ковалентной связи с боковой цепью аминокислоты, несущей нуклеофил, в связывающем участке антитела.
На фиг. 7 показан синтез:
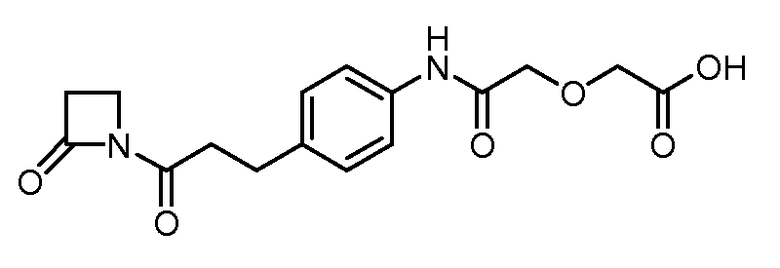
Фиг. 8: Иллюстративный синтез [Ang2-пептида]-[Ang2-Спейсера], с использованием SEQ ID NO:153 в качестве примера.
Фиг. 9: Иллюстративный синтез [VEGF-Пептида]-[VEGF-Спейсера], с использованием SEQ ID NO:188, в качестве примера.
Фиг. 10: Иллюстративный синтез соединения 5053.
Фиг. 11: Объем опухоли ксенотрансплантатов аденокарциномы ободочной кишки Colo205 после лечения носителем или Соединением 6053 (внутрибрюшинно 1 раз/нед.). Данные изображены в виде средней величины и SE (стандартной ошибки) n=20/группу в дни 0-35 (n=10 для всех групп после 35-го дня), вертикальная стрелка указывает первый день введения. *P<0,05, **P<0,01 в сравнении с носителем в 35-й день (Односторонний ANOVA (дисперсионный анализ) с использованием критерия множественного сравнения Dunnett).
Фиг. 12: Плотность опухолевых микрососудов ксенотрансплантатов аденокарциномы ободочной кишки Colo205 после лечения носителем или Соединением 6053 (внутрибрюшинно 1 раз/нед). Данные изображены в виде средней величины и SE n=9-10/группу. *P<0,05 в сравнении с носителем (Односторонний ANOVA с использованием критерия множественного сравнения Dunnett).
Фиг. 13: Объем опухоли ксенотрансплантатов аденокарциномы ободочной кишки Colo205 после лечения носителем или Соединением 6053 (внутрибрюшинно 1 раз/нед). Данные изображены в виде средней величины и SE n=10/группу, вертикальная стрелка указывает первый день введения. *P<0,05, **P<0,01 в сравнении с носителем (Односторонний ANOVA с использованием критерия множественного сравнения Dunnett).
Фиг. 14: Объем жизнеспособной опухоли ксенотрансплантатов аденокарциномы ободочной кишки Colo205 после лечения носителем или Соединением 6053 (внутрибрюшинно 1 раз/нед). Данные изображены в виде средней величины и SE n=9-10/группу. **P<0,01 в сравнении с носителем (Односторонний ANOVA с использованием критерия множественного сравнения Dunnett).
Фиг. 15: Иммунореактивность Ang2 ксенотрансплантатов аденокарциномы ободочной кишки Colo205 после лечения носителем или Соединением 6053 (внутрибрюшинно 1 раз/нед). Данные изображены в виде средней величины и SE n=9-10/группу. **P<0,01 в сравнении с носителем (Односторонний ANOVA с использованием критерия множественного сравнения Dunnett).
Фиг. 16: Иммунореактивность фосфорилированного VEGFR2 (pVEGFR2) в виде процентной доли общей иммунореактивности VEGFR2 ксенотрансплантатов аденокарциномы ободочной кишки Colo205 после лечения носителем или Соединением 6053 (внутрибрюшинно 1 раз/нед). Данные изображены в виде средней величины и SE n=9-10/группу. **P<0,01 в сравнении с носителем (Односторонний ANOVA с использованием критерия множественного сравнения Dunnett).
Фиг. 17: Объем опухоли аденокарциномы молочной железы MDA-MB-435 (A) и карциномы кожи A431 (B) после еженедельного лечения носителем или Соединением 6053 (внутрибрюшинно 1 раз/нед). Данные изображены в виде средней величины и SE n=9-10/группу, вертикальная стрелка указывает первый день введения. *P<0,05 в сравнении с носителем в 68-й день; **P<0,01 в сравнении с носителем в 35-й день (Односторонний ANOVA с использованием критерия множественного сравнения Dunnett).
Фиг. 18: Объем опухоли ксенотрансплантатов аденокарциномы ободочной кишки Colo205 после лечения один раз в неделю носителем, одним Соединением 6053 (внутрибрюшинно), одним 5-FU (внутрибрюшинно), или Соединением 6053 в комбинации с 5-FU (оба внутрибрюшинно). Данные изображены в виде средней величины и SE n=9-10/группу, вертикальная стрелка указывает первый день введения. **P<0,01 в сравнении с носителем в 29-й день (Односторонний ANOVA с использованием критерия множественного сравнения Бонферрони).
Фиг. 19: Объем опухоли ксенотрансплантатов аденокарциномы ободочной кишки Colo205 после лечения один раз в неделю носителем, одним Соединением 6053 (внутрибрюшинно), одним Иринотеканом (внутрибрюшинно), или Соединением 6053 в комбинации с Иринотеканом (оба внутрибрюшинно). Данные изображены в виде средней величины и SE n=9-10/группу, вертикальная стрелка указывает первый день введения. **P<0,01 в сравнении с носителем в 29-й день (Односторонний ANOVA с использованием критерия множественного сравнения Бонферрони).
Фиг. 20: Объем опухоли ксенотрансплантатов аденокарциномы ободочной кишки Colo205 после лечения один раз в неделю носителем, одним Соединением 6053 (внутрибрюшинно), одним Таксотере (внутрибрюшинно), или Соединением 6053 в комбинации с Таксотере (оба внутрибрюшинно). Данные изображены в виде средней величины и SE n=9-10/группу, вертикальная стрелка указывает первый день введения. **P<0,01 в сравнении с носителем, ***P<0,01 в сравнении с носителем и в сравнении с одним Соединением 6053 в 29-й день (Односторонний ANOVA с использованием критерия множественного сравнения Бонферрони).
Фиг. 21: Объем опухоли ксенотрансплантатов аденокарциномы ободочной кишки Colo205 после лечения один раз в неделю носителем, одним Соединением 6053 (внутрибрюшинно), один раз в день Сумитинибом (перорально), или Соединением 6053 (внутрибрюшинно) в комбинации с Сумитинибом (перорально). Данные изображены в виде средней величины и SE n=9-10/группу, вертикальная стрелка указывает первый день введения. *P<0,05, **P<0,01 в сравнении с носителем в 28-й день (Односторонний ANOVA с использованием критерия множественного сравнения Бонферрони).
Фиг. 22: Объем опухоли ксенотрансплантатов аденокарциномы ободочной кишки Colo205 после лечения один раз в неделю носителем, одним Соединением 6053 (внутрибрюшинно), один раз в день Акситинибом (перорально), или Соединением 6053 (внутрибрюшинно) в комбинации с Акситинибом (перорально). Данные изображены в виде средней величины и SE n=9-10/группу, вертикальная стрелка указывает первый день введения. *P<0,05, **P<0,01 в сравнении с носителем в 28-й день (Односторонний ANOVA с использованием критерия множественного сравнения Бонферрони).
Фиг. 23: Объем опухоли ксенотрансплантатов аденокарциномы ободочной кишки Colo205 после лечения один раз в неделю носителем, Соединением 2071, Соединением 2049, или Соединением 2046 (все внутрибрюшинно). Данные изображены в виде средней величины и SE n=10/группу, вертикальная стрелка указывает первый день введения.
Фиг. 24: Объем опухоли ксенотрансплантатов аденокарциномы ободочной кишки Colo205 после лечения один раз в неделю носителем, Соединением 2049, Соединением 6045, Соединением 6042 или Соединением 6053 (все внутрибрюшинно). Данные изображены в виде средней величины и SE n=10/группу, вертикальная стрелка указывает первый день введения. **P<0,01 в сравнении с носителем в 28-й день 28 (Соединения 6045, 6042 и 6053).
Фиг. 25: Объем опухоли ксенотрансплантатов аденокарциномы ободочной кишки Colo205 после лечения один раз в неделю носителем, Соединением 4043, Соединением 4043 или Соединением 6053 (все внутрибрюшинно). Данные изображены в виде средней величины и SE n=10/группу, вертикальная стрелка указывает первый день введения. **P<0,01 в сравнении с носителем в 28-й день (Соединения 4043 и 2018), ***P <0,001 в сравнении с носителем в 28-й день (Соединение 6053, еженедельные дозы 10 и 30 мг/кг).
Фиг. 26: Объем опухоли ксенотрансплантатов аденокарциномы ободочной кишки Colo205 после лечения один раз в неделю носителем, Соединением 2018, Соединением 4043, Соединением 6053, Соединением 6062, или комбинацией соединений 2018 и 4043 (все внутрибрюшинно). Данные изображены в виде средней величины и SE n=9/группу, вертикальная стрелка указывает первый день введения.
Фиг. 27: Объем опухоли ксенотрансплантатов аденокарциномы ободочной кишки Colo205 после лечения один раз в неделю носителем, Соединением 4043, Соединением 2018, Соединением 6053, или комбинацией соединений 4043 и 2018 (все внутрибрюшинно). Данные изображены в виде средней величины и SE n=10/группу, вертикальная стрелка указывает первый день введения. **P<0,01 в сравнении с носителем на 42ой день (Соединения 4043 и 6053, и комбинация соединений 4043 и 2018).
Фиг. 28: Объем опухоли ксенотрансплантатов аденокарциномы ободочной кишки Colo205 после лечения один раз в неделю носителем, Соединением 4043, Соединением 2018, Соединением 6053, или комбинацией соединений 4043 и 2018 (все внутрибрюшинно). Данные изображены в виде средней величины и SE n=10/группу, вертикальная стрелка указывает первый день введения. *P<0,05 в сравнении с носителем на 32-й день (Соединение 2018 и комбинация соединений 4043 и 2018), **P<0,01 в сравнении с носителем на 32-й день (Соединение 6053).
Фиг. 29: Градация с помощью флюоресцеиновой ангиографии вызванной VEGF сетчаточной утечки через 3 дня после IVT (инъекции в стекловидное тело) и через 48 ч после введения VEGF. Исследование зависимости реакции от дозы Соединения 6037.
Фиг. 30: Градация с помощью флюоресцеиновой ангиографии вызванной VEGF сетчаточной утечки через 7 дней после IVT инъекции и через 48 ч после введения VEGF.
Определения
Следующие аббревиатуры, термины и фразы используются в настоящем описании, как определено ниже.
Аббревиатуры ненатуральных аминокислот
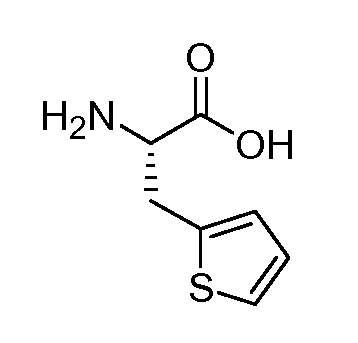
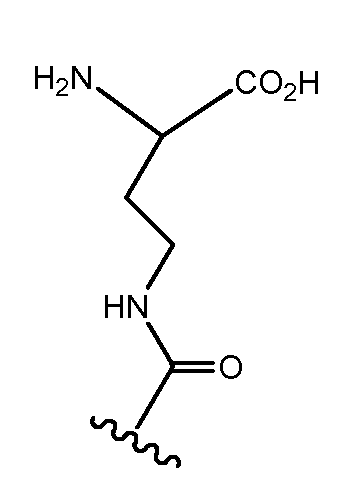
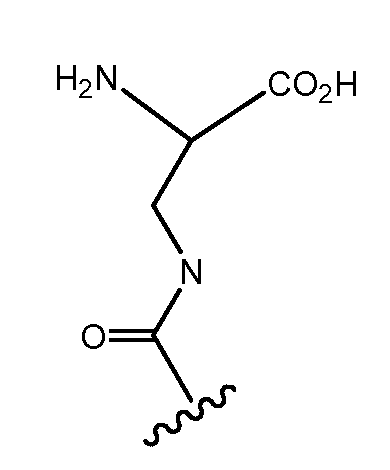
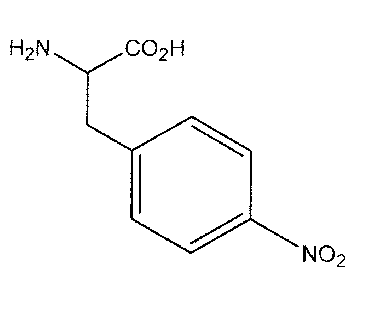
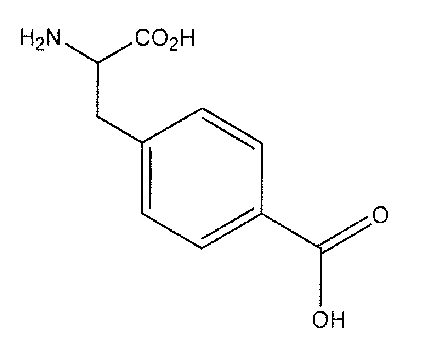
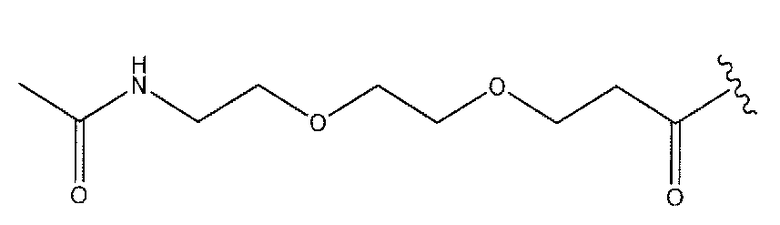
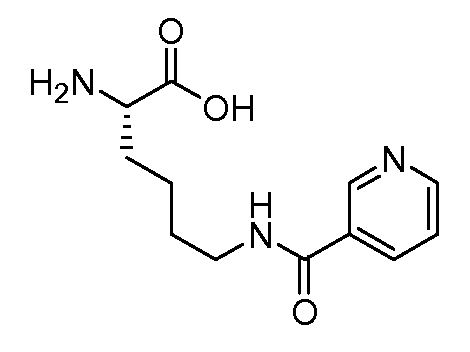
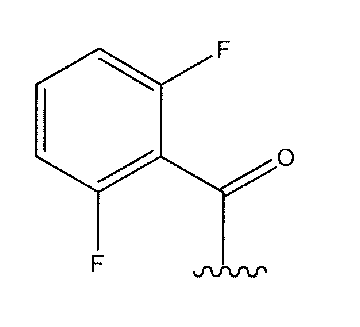
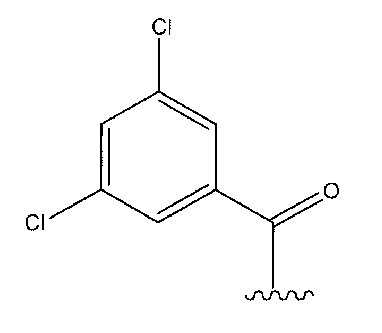
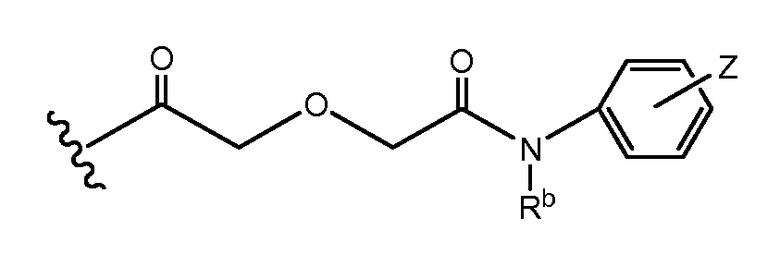
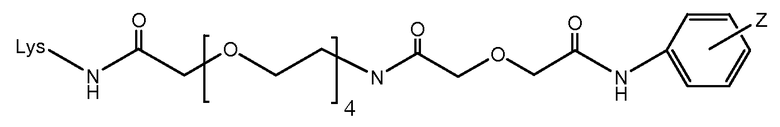
Пока нет иных указаний приставкой "D", например, D-Ala или N-Me-D-Ile, или если не написано в строчном формате, например, a, i, 1, (D варианты Ala, Ile, Leu), стереохимия альфа-углерода аминокислот и аминоацильных остатков в пептидах, описанных в настоящей заявке и в прилагаемой формуле изобретения, представляет натуральную или "L" конфигурацию. Обозначения "R" и "S" по Cahn-Ingold-Prelog используются для определения стереохимии хиральных центров в определенных ацильных замещениях на N-конце пептидов. Обозначение "R,S" предназначено для указания рацемической смеси двух энантиомерных форм. Данная номенклатура соответствует номенклатуре, описанной в публикации R. S. Cahn, et al., Angew. Chem. Int. Ed. Engl., 5:385-415 (1966).
Термины «полипептид», «пептид» и «белок» используются взаимозаменяемо для обозначения полимера или аминокислотных остатков. Эти термины, используемые в настоящем описании, относятся к аминокислотным полимерам, в которых один или более аминокислотных остатков представляет собой искусственный химический аналог соответствующей натурально встречающейся аминокислоты. Эти термины также относятся к естествено встречающимся аминокислотным полимерам. Аминокислоты могут быть в L или D форме, пока сохраняется функция связывания пептида. Пептиды могут быть циклическими, имеющими внутримолекулярную связь между двумя не соседними аминокислотами внутри пептида, например, циклизацией основной цепи с основной цепью, боковой цепи с основной цепью и боковой цепи с боковой цепью. Циклические пептиды могут быть получены способами, хорошо известными в данной области. См., например, патент США № 6013625.
Все пептидные последовательности написаны в соответствии с общепринятой конвенцией, в соответствии с которой альфа-N-концевой аминокислотный остаток находится слева, а альфа-C- концевой аминокислотный остаток находится справа. Используемый в настоящем описании термин «N-конец» относится к свободной альфа-аминогруппе аминокислоты в пептиде, а термин «С-конец» относится к свободному концу в форме α-карбоновой кислоты аминокислоты в пептиде. Пептид, N-конец которого представляет группу, относится к пептиду, несущему группу на азоте альфа-аминогруппы N-концевого аминокислотного остатка. Аминокислота, которая в качестве N-конца имеет группу, относится к аминокислоте, несущей группу на азоте альфа-аминогруппы.
В целом, термин «гидрофильные аминокислоты» или «неполярные аминокислоты» означает аминокислотные остатки, которые не содержат ионизированную группу (группы) при физиологическом pH. Примеры гидрофобных аминокислотных остатков включают без ограничения Gly, аллилглицин, циклогексилглицин (Chg), Dpg, гидроксипролин, HoLeu, аллол, Ala, Abu (аминомасляную кислоту), гомоциклолейцин, Acpc (1-аминоциклопропан-1-карбоновую кислоту), Aib, Aic, VaI, Leu, NIe, Ile, Met, Phe, Cys, Pro, Gln, Asn, Cha (бета-циклогексилаланин), циклопентилаланин, бета-циклопропилаланин, 3,3-дфенилаланин, бета-2-фурилаланин, гомоциклогексилаланин (HoCha) 3-(l-нафтилаланин, 2-фурилаланин, пиридилаланин, хинолилаланин, тиазолилаланин, тиенилаланин, Val, Nva, фенилаланин с замещением в кольце, Sar, HoSer, Tic, Tic(OH), триптофан с замещением в кольце, тирозин с замещением в кольце и их производные.
В целом, термин «алифатические аминокислоты» и «неполярные алифатические аминокислоты» означает аминокислоты с не ароматической гидрофобной боковой цепью. Примеры включают без ограничения Ala, AllylGly, Nva, Chg, Abu, Aib, Aic, Acpc, Гомоциклолейцин, Циклопентилаланин, бета-Циклопропилаланин, Cha, HoCha, Val, Ile, Leu и Met и их производные.
В целом, термин «Ароматические аминокислоты» означает аминокислоты с боковой цепью ароматического кольца. Примеры включают Phe, Tyr, Trp, His, 2-Фурилаланин, Tyr(Me) и их производные.
В целом, термин «Полярные аминокислоты» включает полярные и незаряженные аминокислоты, отрицательно заряженные аминокислоты и положительно заряженные аминокислоты. Примеры включают Arg, HoArg, Cit, Glu, Asp, Lys, Gln, Asn, Ser, Thr, His, Trp, Tyr, Lys(Ac), и их производные.
В целом, термин «Положительно заряженные аминокислоты» (или основные аминокислоты) означает аминокислоты, боковые цепи которых протонированы или могут быть протонированы в физиологических условиях. Примеры включают без ограничения Lys, Орнитин (Orn), Arg, HoArg, Dab, Dap, Trp, His и их производные.
В целом, термин «Отрицательно заряженные аминокислоты» (или кислотные аминокислоты) означает аминокислоты, боковые цепи которых могут быть депротонированы в физиологических условиях. Примеры включают без ограничения Asp, Asu, Glu, Aad и их производные.
В целом, термин «Полярные, незаряженные аминокислоты» означает аминокислоты с незаряженными боковыми цепями, способными образовывать H-связи с водой в физиологических условиях. Примеры включают без ограничения Gln, Asn, Lys(Ac), Ser, Thr, Cit, HoCit и их производные.
«По существу гомологичные» означает, что по меньшей мере примерно 75% (предпочтительно, по меньшей мере примерно 80%, а предпочтительнее, по меньшей мере примерно 95% аминокислотных остатков совпадают по определенному отрезку пептидных последовательностей. Последовательности, которые являются по существу гомологичными, могут быть идентифицированы сравнением последовательностей с использованием стандартного программного обеспечения, доступного в базе данных последовательностей, такого как программы BLAST, имеющихся в National Cancer Center for Biotechology Information (Национальном Раковом Центре Биотехнологической Информации) на сайте интернета ncbi.nlm.nih.gov.
В целом, «замещенный» относится к группе, как описано ниже, в которой одна или более связей с атомом водорода, содержащегося в ней, заменены связью с атомами, не являющимися водородом или углеродом, такими как без ограничения атом галогена, такой как F, Cl, Br, и I; атом кислорода в таких группах, как гидроксильные группы, алкокси группы, арилокси группы и сложноэфирные группы; атом серы в таких группах как тиольные группы, алкильные и арилсульфидные группы, сульфоновые группы, сульфонильные группы и сульфоксидные группы; атом азота в таких группах как амины, амиды, алкиламины, диалкиламины, ариламины, алкилариламины, диариламины, N-оксиды, имиды и енамины; атом кремния в таких группах как триалкилсилильные группы, диалкиларилсилильные группы, алкилдиарилсилильные группы и триалилсилильные группы; и другие гетероатомы в различных других группах. Замещенные алкильные группы, а также замещенные циклоалкильные группы и другие также включают группы, в которых одна или более связей с атомом (атомами) углерода или водорода заменена связью с гетероатомом, таким как кислород в карбонильной, карбоксильной и сложноэфирной группах; азот в таких группах как имины, оксимы, гидразоны и нитрилы. Используемая в настоящем изобретении группа, которая «возможно замещена», может быть замещенной или незамещенной. Так, например, «возможно замещенный алкил» относится и замещенным алкильным группам, и к незамещенным алкильным группам.
Фраза «незамещенный алкил» относится к алькильным группам, которые не содержат гетероатомы. Таким образом, фраза включает прямоцепочечные алкильные группы, такие как метил, этил, пропил, бутил, пентил, гексил, гептил, октил, нонил, децил, ундецил, додецил и тому подобные. Фраза также включает разветвленноцепочечные изомеры прямоцепочечных алкильных групп, включая без ограничения следующие, которые представлены в виде примера: -CH(CH3)2, -CH(CH3)(CH2CH3), -CH(CH2CH3)2, -C(CH3)3, -C(CH2CH3)3, -CH2CH(CH3)2, -CH2CH(CH3)(CH2CH3), -CH2CH(CH2CH3)2, -CH2C(CH3)3, -CH2C(CH2CH3)3, -CH(CH3)CH(CH3)(CH2CH3), -CH2CH2CH(CH3)2, -CH2CH2CH(CH3)(CH2CH3), -CH2CH2CH(CH2CH3)2, -CH2CH2C(CH3)3, -CH2CH2C(CH2CH3)3, -CH(CH3)CH2CH(CH3)2, -CH(CH3)CH(CH3)CH(CH3)2, -CH(CH2CH3)CH(CH3)CH(CH3)(CH2CH3), и другие. Эта фраза не включает циклоалкильные группы. Таким образом, фраза незамещенные алкильные группы включает первичные алкильные группы, вторичные алкильные группы и третичные алкильные группы. Незамещенные алкильные группы могут быть связаны с одним или более атомом (атомами) кислорода, атомом (атомами) азота и/или атомом (атомами) серы в материнском соединении. Возможные незамещенные алкильные группы включают прямо- и разветвленноцепочечные алкильные группы, имеющие от 1 до 20 атомов углерода. Альтернативно, такие незамещенные алкильные группы имеют от 1 до 10 атомов углерода или представляют собой группами низшего алкила, имеющими от 1 до примерно 6 атомов углерода. Другие незамещенные алкильные группы включают прямо- и разветвленноцепочечные алкильные группы, имеющие от 1 до 3 атомов углерода и включают метил, этил, пропил и -CH(CH3)2.
Фраза «замещенный алкил» относится к алькильной группе, в которой одна или более связей с атомом (атомами) углерода или водорода заменена связью с атомами, отличными от водорода и углерода, таким как без ограничения атом галогена в галидах, такими как F, Cl, Br, и I; атом кислорода в таких группах как гидроксильные группы, алкокси группы, арилокси группы и сложноэфирные группы; атом серы в таких группах как тиольные группы, алкильные и арилсульфидные группы, сульфоновые группы, сульфонильные группы и сульфоксидные группы; атом азота в таких группах как амины, амиды, алкиламины, диалкиламины, ариламины, алкилариламины, диариламины, N-оксиды, имиды и енамины; атом кремния в таких группах как триалкилсилильные группы, диалкиларилсилильные группы, алкилдиарилсилильные группы и триарилсилильные группы; и другие гетероатомы в различных других группах. Замещенные алкильные группы также включают группы, в которых одна или более связей с атомом (атомами) углерода или водорода заменены связью с гетероатомом, таким как кислород в карбонильной, карбоксильной и сложноэфирной группах; азот в таких группах как имины, оксимы, гидразоны и нитрилы. Замещенные алкильные группы включают, наряду с другими, алкильные группы, в которых одна или более связей с атомом углерода или водорода замещен(ы) одной или более связями с атомами фтора. Одним примером замещенной алкильной группы является трифторметильная группа и другие алкильные группы, которые содержат трифторметильную группу. Другие алкильные группы включают те, в которых одна или более связей с атомом углерода или водорода заменена связью с атомом кислорода так, что замещенная алкильная группа содержит гидроксильную, алкокси, арилокси группу или гетероциклилокси группу. Еще одни алькильные группы включают алкильные группы, которые имеют аминовую, алкиламиновую, диалкиламиновую, ариламиновую, (алкил)(арил)аминовую, диариламиновую, гетероциклиламиновую, (алкил)(гетероциклил)аминовую, (арил)(гетероциклил)аминовую или дигетероциклиламиновую группу.
Фраза «незамещенный алилен» относится к двухвалентной незамещенной алкильной группе, как определено выше. Так, каждый из метилена, этилена и пропилена является примером незамещенных алкиленов. Фраза «замещенный алкилен» относится к замещенной алкильной группе, как определено выше. Замещенные или незамещенные группы низшего алкилена имеют от 1 до 6 атомов углерода.
Фраза «незамещенный циклоалкил» относится к циклическим алкильным группам, таким как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил и такие кольца, замещенные прямо- и разветвленноцепочечными алкильными группами, как определено выше. Эта фраза также включает полициклические алкильные группы, так как без ограничения адамантил норборнил и бицикло[2.2.2]октил и тому подобные соединения, а также такие кольца, замещенные прямо- и разветвленноцепочечными алкильными группами, как определено выше. Таким образом, эта фраза включает, среди других, метилциклогексильные группы. Эта фраза не включает циклические алкильные группы, содержащие гетероатом. Незамещенные циклоалкильные группы могут быть связаны с одним или более атомом (атомами) углерода, атомом (атомами) кислорода, атомом (атомами) азота и/или атомом (атомами) серы в материнском соединении. В некоторых вариантах осуществления, незамещенные циклоалкильные группы имеют от 3 до 20 атомов углерода. В других вариантах осуществления, такие незамещенные циклоалкильные группы имеют от 3 до 8 атомов углерода, тогда как в других, такие группы имеют от 3 до 7 атомов углерода.
Фраза «замещенный циклоалкил» имеет такое же значение в отношении незамещенных циклоалкильных групп, как замещенные алкильные группы имеют в отношении незамещенных алкильных групп. Таким образом, эта фраза включает без ограничения оксоциклогексильную, хлорциклогексильную, гидроксициклопентильную и хлорметилциклогексильную группы.
Фраза «незамещенный арил» относится к арильным группам, которые не содержат гетероатомы. Таким образом, фраза включает без ограничения и в качестве примера такие группы как фенил, бифенил, антраценил и нафтенил. Хотя фраза «незамещенный арил» включает группы, содержащие конденсированные кольца, такие как нафталин, она не включает арильные группы, которые имеют другие группы, такие как алкильная или галоидная группы, связанные с одним из членов кольца, как арильные группы, такие как толил, считаются в настоящем описании замещенными арильными группами, как описано ниже. Обычно, незамещенный арил может представлять низший арил, имеющий от 6 до примерно 10 атомов углерода. Одна незамещенная арильная группа представляет фенил. Однако незамещенные арильные группы могут быть связаны с одним или более атомом (атомами) углерода, атомом (атомами) кислорода, атомом (атомами) азота и/или атомом (атомами) серы в материнском соединении.
Фраза «замещенная арильная группа» имеет такое же значение в отношении незамещенных арильных групп, которое замещенные алкильные группы имеют в отношении незамещенных алкильных групп. Однако замещенная арильная группа также включает арильные группы, в которых один из ароматических атомов углерода связан с одним из атомов, не являющихся углеродом или водородом, описанным выше, а также включает арильные группы, в которых один или более ароматических атомов углерода арильной группы связан с замещенной и/или незамещенной алкильной, алкенильной или алкинильной группой, как определено в настоящем описании. Это включает структуры связывания, в которых два атома углерода арильной группы связаны с двумя атомами алкильной, алкенильной или алкинильной групп, определяя конденсированную кольцевую систему (например, дигидронафтил или тетрагидронафтил). Таким образом, фраза «замещенный арил» включает без ограничения, среди других, толил и гидроксифенил.
Фраза «незамещенный алкенил» относится к прямо- и разветвленноцепочечным и циклическим группам, таким как группы, описанные в отношении незамещенных алкильных групп, как определено вше, за исключением того, что по меньшей мере одна двойная связь существует между двумя атомами углерода. Примеры, среди других, включают без ограничения винил, -CH=C(H)(CH3), -CH=C(CH3)2, -C(CH3)=C(H)2, -C(CH3)=C(H)(CH3), -C(CH2CH3)=CH2, циклогексенил, циклопентенил, циклогексадиенил, бутадиенил, пентадиенил и гексадиенил. Незамещенные низшие алкенильные группы имеют от 1 до примерно 6 атомов углерода.
Фраза «замещенный алкенил» имеет такое же значение в отношении незамещенных алкенильных групп, как замещенные алкильные группы имеют в отношении незамещенных алкильных групп. Замещенная алкенильная группа включает алкенильные группы, в которых не углеродный или не водородный атом связан с углеродом, связанный двойной связью с другим атомом углерода, и группы, в которых один из не углеродного или не водородного атома связан с атомом углерода, не вовлеченным в двойную связь с другим атомом углерода. Например, и -CH=CH-OCH3, и -CH=CH-CH2-OH представляют собой замещенные алкенилы. Оксоалкенилы, в которых группа CH2 замещена карбонилом, такие как -CH=CH-C(O)-CH3, также представляют собой замещенные алкенилы.
Фраза «замещенный алкенилен» относится к двухвалентной незамещенной алкенильной группе, как определено выше. Например, -CH=CH- представляет собой иллюстративный незамещенный алкенилен. Фраза «замещенный алкенилен» относится к двухвалентной замещенной адкенильной группе, как определено выше.
Фраза «незамещенный алкинил» относится к прямо- или разветвленноцепочечным группам, таким как группы, описанные в отношении незамещенных алкильных групп, как определено выше, за исключением того, что по меньшей мере одна тройная связь существует между двумя атомами углерода. Примеры, среди других, включают без ограничения -C≡C(H), -OC(CH3), -C≡C(CH2CH3), -C(H2)OC(H), -C(H)2C≡C(CH3), и -C(H)2C≡C(CH2CH3). Незамещенные низшие алкинильные группы имеют от 1 до примерно 6 атомов углерода.
Фраза «замещенный алкинил» имеет такое же значение в отношении незамещенных алкинильных групп, как замещенные алкильные группы имеют в отношении незамещенных алкильных групп. Замещенная алкинильная группа включает алкинильные группы, в которых не углеродный или не водородный атом связан с атомом углерода, связанного тройной связью с другим атомом углерода, и те, в которых не углеродный или не водородный атом связан с атомом углерода, не вовлеченным в тройную связь с другим атомом углерода. Примеры включают без ограничения оксоалкинилы, в которых группа CH2 замещена карбонилом, такие как -C(O)-CH≡CH-CH3 и -C(O)-CH2-CH≡CH.
Фраза «незамещенный алкинилен» относится к двухвалентной незамещенной алкинильной группе, как определено выше. -C≡C- является примером незамещенного алкинилена. Фраза «замещенный алкинилен» относится к двухвалентной замещенной алкинильной группе, как определено выше.
Фраза «незамещенный аралкил» относится к незамещенным аралкильным группам, как определено выше, в которых связь атома водорода или углерода незамещенной алкильной группы заменена связью с арильной группой, как определено выше. Например, метил(-CH3) представляет незамещенную алкильную группу. Если атом водорода метильной группы заменен связью с фенильной группой, например, если бы атом углерода метила был связан с атом углерода бензола, то соединение представляло бы незамещенную аралкильную группу (т.е., бензильную группу). Таким образом, эта фраза включает без ограничения такие группы как бензил, дифенилметил и 1-фенилэтил(-CH(C6H5)(CH3)).
Фраза «замещенный аралкил» имеет такое же значение в отношении незамещенных аралкильных групп, как замещенные арильные группы имеют в отношении незамещенных арильных групп. Однако замещенные аралкилы также включают группы, в которых углеродная или водородная связь алкильной части группы заменена связью с не углеродным или не водородным атомом. Примеры замещенных аралкильных групп включают без ограничения -CH2C(=O)(C6H5) и -CH2(2-метилфенил).
Фраза «незамещенный аралкенил» относится к незамещенным алкенильным группам, как определено выше, в которых водородная или углеродная связь незамещенной алкенильной группы заменена связью с арильной группой, как определено выше. Например, винил представляет собой незамещенную алкенильную группу. Если атом водорода винильной группы заменен связью с фенильной группой, например, если бы атом углерода винила был бы связан с атомом углерода бензола, то соединение представляло бы собой незамещенную аралкенильную группу (т.е., стирильную группу). Таким образом, эта фраза включает без ограничения такие группы как стирил, дифенилвинил и 1-фенилэтил(-C(C6H5)(CH2)).
Фраза «замещенный аралкенил» имеет такое же значение в отношении незамещенных аралкенильных групп, как замещенные арильные группы имеют в отношении незамещенных арильных групп. Замещенная аралкенильная группа также включает группы, в которых углеродная или водородная связь алкенильной части группы заменена связью с не углеродным или не водородным атомом. Примеры замещенных аралкенильных групп включают без ограничения -CH=C(Cl)(C6H5) и -CH=CH(2-метилфенил). Фраза «незамещенный аралкенил» относится к незамещенным алкинильным группам, как определено выше, в которых водородная или углеродная связь незамещенной алкинильной группы заменена связью с арильной группой, как определено выше. Например, ацетилен представляет собой незамещенную алкинильную группу. Если атом водорода ацетиленовой группы заменен связью с фенильной группой, например, если бы атом углерода ацетилена был бы связан с атомом углерода бензола, то соединение представляло бы собой незамещенную аралкинильную группу. Таким образом, эта фраза включает без ограничения такие группы как -C≡C-фенил и -CH2-C≡C-фенил. Фраза «замещенный аралкинил» имеет такое же значение в отношении незамещенных аралкинильных групп, как замещенные арильные группы имеют в отношении незамещенных арильных групп. Однако замещенная аралкинильная группа включает группы, в которых углеродная или водородная связь алкинильной части группы заменена связью с не углеродным или не водородным атомом. Примеры замещенных аралкинильных групп включают без ограничения -C=C-C(Br)(C6H5) и -C≡C(2-метилфенил).
Фраза «незамещенный гетероалкил» относится к незамещенным алкильным группам, как определено выше, в которых углеродная цепь прервана одним или более гетероатомами, выбранными из N, O, и S. Незамещенные гетероалкилы, содержащие N, могут иметь NH или N(незамещенный алкил) в углеродной цепи. Например, незамещенные гетероалкилы включают алкокси, алкоксиалкил, алкоксиалкокси, простой тиоэфир, алкиламиноалкил, аминоалкилокси и другие такие группы. Олбычно, незамещенные гетероалкильные группы содержат 1-5 гетероатомов, и, в частности, 1-3 гетероатома. В некоторых вариантах осуществления, незамещенные гетероалкилы включают, например, алкоксиалкоксиалкоки группы, такие как этилоксиэтилоксиэтилокси.
Фраза «замещенный гетероалкил» имеет такое же значение в отношении незамещенных гетероалкильных групп, как замещенные алкильные группы имеют в отношении незамещенных алкильных групп.
Фраза «незамещенный гетероалкилен» относится к двухвалентной незамещенной гетероалкильной группе, как определено выше. Например, и -CH2-O-CH2-, и -CH2-NH-CH2CH2- являются иллюстративными незамещенными гетероалкиленами. Фраза «замещенный гетероалкилен» относится к двухвалентной замещенной гетероалкильной группе, как определено выше.
Фраза «незамещенный гетероалкенил» относится к незамещенным алкеновым группам, как определено выше, в которых углеродная цепь прервана одним или более гетероатомов, выбранных из N, O, и S. Незамещенные гетероалкенилы, содержащие N, могут иметь NH или N(незамещенный алкил или алкен) в углеродной цепи. Фраза «замещенный гетероалкенил» имеет такое же значение в отношении незамещенных гетероалкенильных групп, как замещенные гетероалкильные группы имеют в отношении незамещенных гетероалкильных групп.
Фраза «незамещенный гетероалкенилен» относится к двухвалентной незамещенной гетероалкенильной группе, как определено выше. Так, -CH2-O-CH=CH- является примером незамещенного гетероалкенилена. Фраза «замещенный гетероалкенилен» относится к двухвалентной замещенной гетероалкенильной группе, как определено выше.
Фраза «незамещенный гетероалкинил» относится к незамещенным алкинильным группам, как определено выше, в которых углеродная цепь прервана одним или более гетероатомами, выбранными из N, O, и S. Незамещенные гетероалкинилы, содержащие N, могут иметь NH или N(незамещенный алкил, алкен или алккил) в углеродной цепи. Фраза «замещенный гетероалкинил» имеет такое же значение в отношении незамещенных гетероалкинильных групп, как замещенные гетероалкильные группы имеют в отношении незамещенных гетероалкильных групп.
Фраза «незамещенный гетероалкинилен» относится к двухвалентной незамещенной гетероалкинильной группе, как определено выше. Так, -CH2-O-CH2-C=C- является примером незамещенного гетероалкинилена. Фраза «замещенный гетероалкинилен» относится к двухвалентной замещенной гетероалкинильной группе, как определено выше.
Фраза «незамещенный гетероциклил» относится и к ароматическим, и не ароматическим кольцевым соединениям, включающим моноциклические, бициклические и полициклические кольцевые соединения, такие как без ограничения хинуклидил, содержащий 3 или более кольцевых членов, из которых один или более представляет собой гетероатом, такой как без ограничения N, O, и S. Хотя фраза «незамещенный гетероцилил» включает конденсированные гетероциклические кольца, такие как бензимидазолил, она не включает гетероциклильные группы, которые имеют другие группы, такие как алкильные или галоидные группы, связанные с одним из кольцевых членов, поскольку соединения, такие как 2-метилбензимидазолил, представляют собой замещенные гетероциклильные группы. Примеры гетероциклильных групп включают без ограничения ненасыщенные 3-8-членные кольца, содержащие 1-4 атома азота, такие как без ограничения пирролил, пирролинил, имидазолил, пиридил, дигидропиридил, пиримидил, пиразинил, пиридазинил, триазолил (например, 4H-1,2,4-триазолил, 1H-1,2,3-триазолил, 2H-1,2,3-триазолил и т.д.), тетразолил, (например, 1H-тетразолил, 2H-тетразолил, и т.д.); насыщенные 3-8-членные кольца, содержащие 1-4 атома азота, такие как без ограничения пирролидинил, имидазолидинил, пиперидинил, пиперазинил; конденсированные ненасыщенные гетероциклические группы, содержащие 1-4 атома азота, такие как без ограничения индолил, изоиндолил, индолинил, индолизинил, бензимидазолил, хинолил, изохинолил, индазолил, бензотриазолил, ненасыщенные 3-8-членные кольца, содержащие 1-2 атома кислорода, и 1-3 атома азота, такие как без ограничения оксазолил, изоксазолил, оксадиазолил (например, 1,2,4-оксадиазолил, 1,3,4-оксадиазолил, 1,2,5-оксадиазолил и т.д.); насыщенные 3-8-членные кольца, содержащие 1-3 атома кислорода и 1-3 атома азота, такие как без ограничения морфолинил; ненасыщенные конденсированные гетероциклические группы, содержащие 1-2 атома кислорода и 1-3 атома азота, например, бензоксазолил, бензоксадиазолил, бензоксазинил (например, 2H-1,4-бензоксазинил, и т.д.); ненасыщенные 3-8-членные кольца, содержащие 1-3 атома азота, такие как без ограничения тиазолил, изотиазолил, тиадиазолил (например, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,3,4-тиадиазолил, 1,2,5-тиадиазолил, и т.д.); насыщенные 3-8-членные кольца, содержащие 1-2 атома серы, и 1-3 атома азота, такие как без ограничения, тиазолодинил; насыщенные 3-8-членные кольца, содержащие 1-2 атома серы, такие как без ограничения тиенил, дигидродитиинил, дигидродитионил, тетрагидротиофен, тетрагидротиопиран; ненасыщенные конденсированные гетероциклические кольца, содержащие 1-2 атома серы, и 1-3 атома азота, такие как без ограничения бензотиазолил, бензотиадиазолил, бензотиазинил (например, 2H-1,4-бензотиазинил и т.д.), дигидробензотиазинил (например, 2H-3,4-дигидробензотиазинил и т.д.), ненасыщенные 3-8-членные кольца, содержащие атомы кислорода, такие как без ограничения фурил; ненасыщенные конденсированные гетероциклические кольца, содержащие 1-2 атома кислорода, такие как бензодиоксолил (например, 1,3-бензодиоксолил, и т.д.); ненасыщенные 3-8-членные кольца, содержащие атом кислорода, и 1-2 атома серы, такие как без ограничения дигидрооксатинил; насыщенные 3-8-членные кольца, содержащие 1-3 атома кислорода, и 1-2 атома серы, такие как 1,4-оксатиан; ненасыщенные конденсированные кольца, содержащие 1-2 атома серы, такие как бензотиенил, бензодитиинил и ненасыщенные конденсированные гетероциклические кольца, содержащие атом кислорода, и 1-3 серы, такие как бензоксатиинил. Гетероциклильная группа также включает те, которые описаны выше, в которых один или более атомов S в кольце, связана двойной связью с одним или двумя атомами кислорода (сульфоксиды и сульфоны). Например, гетероциклильные группы включают тетрагидротиофен, тетрагидротиофен оксид и тетрагидротиофен 1,1-диоксид. В некоторых вариантах осуществления, гетероциклильные группы содержат 5 или 6 кольцевых членов. В других вариантах осуществления, гетероциклильные группы включают морфолин, пиперазин, пиперидин, пирролидин, имидазол, пиразол, 1,2,3-триазол, 1,2,4-триазол, тетразол, тиоморфолин, тиоморфолин, в котором атом S тиоморфолина связан с одним или более атомов O, пиррол, гомопиперазин, оксазолидин-2-он, пирролидин-2-он, оксазол, хинуклидин, тиазол, изоксазол, фуран и тетрагидрофуран.
Фраза «замещенный гетероциклил» относится к незамещенной гетероциклильной группе, как определено выше, в которой один или более кольцевых членов связан с не водородным атомом, такой как описано выше в отношении замещенных алкильных групп и замещенных арильных групп. Примеры включают без ограничения 2-метилбензимидазолил, 5-метилбензимидазолил, 5-хлорбензтиазолил, 1-метилпиперазинил и 2-хлорпиридил.
Фраза «незамещенный гетероарил» относится к незамещенным ароматическим гетроциклильным группам, как определено выше. Так, незамещенные гетероарильные группы включают без ограничения фурил, имидазолил, оксазолил, изоксазолил, пиридинил, бензимидазолил и бензотиазолил. Фраза «замещенный гетероарил» относится к замещенным ароматическим гетероциклильным группам, как определено выше.
Фраза «незамещенный гетероциклилалкил» относится к незамещенным алкильным группам, как определено выше, в которых водородная или углеродная связь незамещенной алкильной группы заменена связью с гетероциклильной группой, как определено выше. Например, метил(-CH3) представляет собой незамещенную алкильную группу. Если атом водорода метильной группы заменен связью с гетероциклильной группой, например, если бы углерод метила был соединен с углеродом 2 пиридина (одним из атомов углерода, соединенных с N пиридина) или атомами углерода 3 или 4 пиридина, то соединение представляло бы собой незамещенную гетероциклилалкильную группу.
Фраза «замещенный гетероциклилалкил» имеет такое же значение в отношении незамещенной гетероциклилалкильной группы, как замещенные аралкильные группы имеют в отношении незамещенных аралкильных групп. Замещенные гетероциклилалкильные группы также включают группы, в которых не водородный атом связан с гетероатомом в гетероциклильной группе гетероциклилалкильной группы, такой как без ограничения атом азота в пиперидиновом кольце пиперидинилалкильной группы.
Фраза «незамещенный гетероциклилалкенил» относится к незамещенным алкенильным группам, как определено выше, в которых водородная или углеродная связь незамещенной алкенильной группы заменена связью с гетероциклильной группой, как определено выше. Например, винил представляет собой незамещенную алкенильную группу. Если атом водорода винильной группы заменен связью с гетероциклильной группой, например, если бы атом углерода винила был связан с атомом углерода 2 пиридина или атомами углерода 3 или 4 пиридина, то соединение представляло бы собой незамещенную гетероциклилалкенильную группу.
Фраза «замещенный гетероциклилалкенил» имеет такое же значение в отношении незамещенных гетероциклилалкенильных групп, как замещенные аралкенильные группы имеют в отношении незамещенных аралкенильных групп. Однако замещенная гетероциклилалкенильная группа также включает группы, в которых не водородный атом связан с гетероатомом в гетероциклильной группе гетероциклилалкенильной группы, таким как без ограничения атом азота в пиперидиновом кольце пиперидинилалкенильной группы. Фраза «незамещенный гетероциклилалкинил» относится к незамещенным алкинильным группам, как определено выше, в которых водородная или углеродная связь незамещенной алкинильной группы заменена связью с гетероциклильной группой, как определено выше. Например, ацетилен представляет собой незамещенную алкинильную группу. Если атом водорода ацетиленовой группы заменен связью с гетероциклильной группой, например, если бы атом углерода ацетилена был связан с атомом углерода 2 или атомами углерода 3 или 4 пиридина, то соединение представляло бы собой незамещенную гетероциклилалкинильную группу.
Фраза «замещенный гетероциклилалкинил» имеет такое же значение в отношении незамещенных гетероциклилалкинильных групп, как замещенные аралкинильные группы имеют в отношении незамещенных аралкинильных групп. Замещенная гетероциклилалкинильная группа также включает группы, в которых не водородный атом связан с гетероатомом в гетероциклильной группе гетероциклилалкинильной группы, таким как без ограничения атом азота в пиперидиновом кольце пиперидинилалкинильной группы. Фраза «незамещенная алкокси» относится к гидроксильной группе (-OH), в которой связь с атомом водорода заменена связью с атомом углерода иным образом незамещенной алкильной группы, как определено выше.
Фраза «замещенная алкокси» относится к гидроксильной группе (-OH), в которой связь с атомом водорода заменена связью с атомом углерода иным образом замещенной алкильной группы, как определено выше. «Фармацевтически приемлемая соль» включает соль с неорганическим основанием, органическим основанием, неорганической кислотой, органической кислотой, или основной или кислой аминокислотой. Соли неорганических оснований включают, например, щелочные металлы, такие как натрий или калий, щелочноземельные металлы, такие как кальций и магний или алюминий; и аммиак. Соли органических оснований включают, например, триметиламин, триэтиламин, пиридин, пиколин, этаноламин, диэтаноламин и триэтаноламин. Соли неорганических кислот включают, например, соли хлористоводородной кислоты, борноводородной кислоты, азотной кислоты, серной кислоты и фосфорной кислоты. Соли органических кислот включают, например, муравьиную кислоту, уксусную кислоту, трифторуксусную кислоту, фумаровую кислоту, винную кислоту, малеиновую кислоту, лимонную кислоту, янтарную кислоту, яблочную кислоту, метансульфоновую кислоту, бензолсульфоновую кислоту и п-толуолсульфоновую кислоту. Соли основных аминокислот включают, например, аргинин, лизин и орнитин. Кислые аминокислоты включают, например, аспарагиновую кислоту и глутаминовую кислоту.
Термин «таутомеры» относится к изомерным формам соединения, которые находятся в равновесии друг с другом. Концентрации изомерных форм будут зависеть от среды, в которой обнаруживается соединение, и могут быть различными, в зависимости от, например, того, является ли соединение твердым веществом или представляет собой органический или водный раствор. Например, в водном растворе кетоны обычно находятся в равновесии с их енольными формами. Таким образом, кетоны и их енолы именуются таутомерами друг друга. Как вполне понятно специалисту в данной области, широкое разнообразие функциональных групп и другие структуры могут проявить таутомеризм, и все таутомеры соединений по изобретению находятся в пределах объема настоящего изобретения.
Определенные варианты осуществления представляют собой производные, именуемые пролекарствами. Выражение «пролекарство» обозначает производное фармацевтически или терапевтически активного лекарственного препарата, например, сложные эфиры и амиды, где производное имеет усиленные характеристики, такие как, например, усиленная доставка и терапевтическая ценность, по сравнению с лекарственным препаратом, и могут трансформироваться в лекарственный препарат ферментным или химическим процессом. См., например, R.E. Notari, Methods Enzymol. 112:309-323 (1985); N. Bodor, Drugs of the Future 6:165-182 (1981); H. Bundgaard, Chapter 1 in Design of Prodrugs (H. Bundgaard, ed.), Elsevier, New York (1985); и A. G. Gilman et al., Goodman And Gilman's The Pharmacological Basis of Therapeutics, 8th ed., McGraw-Hill (1990). Таким образом, пролекарства могут быть сконструированы для изменения характеристик метаболической устойчивости или транспорта лекарственного препарата, маскировки побочных эффектов или токсичности лекарственного препарата, улучшения запаха и вкуса лекарственного препарата или для изменения других характеристик или свойств лекарственного препарата. Соединения по настоящему изобретению включают обогащенные или растворенные оптические изомеры у любого или всех асимметричных атомов, что очевидно по изображениям. Обе рацемические и диастереомерные смеси, а также отдельные оптические изомеры могут быть выделены или синтезированы с тем, чтобы по существу не содержать их энантиомерные или диастереомерные партнеры. Все такие стереоизомеры входят в объем изобретения.
Термин «карбокси-защитная группа», используемый в настоящем описании, относится к защищающей карбоновую кислоту сложноэфирной группе, используемой для блокирования или защиты функциональной группы карбоновой кислоты, в то время как реакции с участием других функциональных участков соединения проводятся. Карбокси-защитные группы описаны, например, в публикации Greene, Protective Groups in Organic Synthesis, pp. 152-186, John Wiley & Sons, New York (1981), которая включена в настоящее описание путем ссылки. Кроме того, карбокси-защитная группа может использоваться в качестве пролекарства, посредством чего, карбокси-защитная группа может легко расщепляться in vivo, например, ферментным гидролизом, для высвобождения биологически активного материнского агента. T. Higuchi и V. Stella обсуждают концепцию пролекарств в публикации "Pro-drugs as Novel Delivery Systems", Vol. 14 of the A.C.S. Symposium Series, American Chemical Society (1975), которая включена в настоящее описание путем ссылки. Такие карбокси-защитные группы хорошо известны специалистам в данной области, они широко использовались при защите карбоксильных групп в областях пенициллинов и цефалоспоринов, как описано в патентах США № 3840556 и 3719667, в публикациях S. Kukolja, J. Am. Chem. Soc. 93:6267-6269 (1971), и G.E. Gutowski, Tetrahedron Lett. 21 :1779-1782 (1970), описания которых включены в настоящую заявку путем ссылки. Примеры сложных эфиров, используемых в качестве пролекарств для соединений, содержащих карбоксильные группы, можно найти, например на стр. 14-21 в публикации Bioreversible Carriers in Drug Design: Theory and Application (E.B. Roche, ed.), Pergamon Press, New York (1987), которая включена в настоящее описание путем ссылки. Репрезентативными карбокси-защитными группами являются C1-C8 алкил (например, метил, этил или третичный бутил и тому подобные); галоидалкил; алкенил; циклоалкил и их замещенные производные, такие как циклогексил, циклопентил и тому подобные; циклоалкилалкил и его замещенные производные, такие как циклогексилметил, циклопентилметил и тому подобные; арилалкил, например, фенэтил или бензил и его замещенные производные, такие как алкоксибензильная или нитробензильная группы и тому подобные; арилалкенил, например, фенилэтенил и тому подобные; арил и его замещенные производные, например, 5-инданил и тому подобные; диалкиламиноалкил (например, диметиламиноэтил и тому подобные); алканоилоксиалкильные группы, такие как ацетоксиметил, бутирилоксиметил, валерилоксиметил, изобутирилоксиметил, изовалерилоксиметил, 1-(пропионилокси)-1-этил, 1-(пивалоилоксил)-1-этил, 1-метил-1-(пропионилокси)-1-этил, пивалоилоксиметил, пропионилоксиметил и тому подобные; циклоалканоилоксиалкильные группы, такие как циклопропилкарбонилоксиметил, циклобутилкарбонилоксиметил, циклопентилкарбонилоксиметил, циклогексилкарбонилоксиметил и тому подобные; ароилоксиалкил, такой как бензоилоксиметил, бензоилоксиэтил и тому подобные; арилалкилкарбонилоксиалкил, такой как бензилкарбонилоксиметил, 2-бензилкарбонилоксиэтил и тому подобные; алкоксикарбонилалкил, такой как метоксикарбонилметил, циклогексилоксикарбонилметил, 1-метоксикарбонил-1-этил и тому подобные; алкоксикарбонилоксиалкил, такой метоксикарбонилоксиметил, т-бутилоксикарбонилоксиметил, 1-этоксикарбонилокси-1-этил, 1-циклогексилоксикарбонилокси-1-этил и тому подобные; алкоксикарбониламиноалкил, такой как т-бутилоксикарбониламинометил и тому подобные; алкиламинокарбониламиноалкил, такой как метиламинокарбониламинометил и тому подобные; алканоиламиноалкил, такой как ацетиламинометил и тому подобные; гетероциклический карбонилоксиалкил, такой как 4-метилпиперазинилкарбонилоксиметил и тому подобные; диалкиламинокарбонилалкил, такой как диметиламинокарбонилметил, диэтиламинокарбонилметил и тому подобные; (5-(алкил)-2-оксо-1,3- диоксолен-4-ил)алкил, такой как (5-т-бутил-2-оксо-1,3-диоксолен-4-ил)метил и тому подобные; и (5-фенил-2-оксо-1,3-диоксолен-4-ил)алкил, такой как (5-фенил-2-оксо-1,3-диоксолен-4-ил)метил и тому подобные. Термин «N-защитная группа» или «N-защищенная», используемый в настоящем описании, относится к тем группам, которые предназначены для защиты N-конца аминокислоты или пептида или для защиты аминогруппы от нежелательных реакций во время синтетических процедур. Обычно используемые N-защитные группы описаны, например, в публикации Greene, Protective Groups in Organic Synthesis, John Wiley & Sons, New York (1981), которая включена в настоящее описание путем ссылки. Например, N-защитные группы могут содержать алкильные группы, такие как формил, ацетил, пропионил, пивалоил, т-бутилацетил, 2-хлорацетил, 2-бромацетил, трифторацетил, трихлорацетил, фталил, о-нитрофеноксиацетил, a-хлорбутирил, бензоил, 4-хлорбензоил, 4-бромбензоил, 4-нитробензоил и тому подобные; сульфонильные группы, такие как бензолсульфонил, п-толуолсульфонил и тому подобные; группы, образующие карбамат, такие как бензилоксикарбонил, п-хлорбензилоксикарбонил, п-метоксибензилоксикарбонил, п-нитробензилоксикарбонил, 2-нитробензилоксикарбонил, п-бромбензилоксикарбонил, 3,4-диметоксибензилоксикарбонил, 3,5-диметоксибензилоксикарбонил, 2,4-диметоксибензилоксикарбонил, 4-метоксибензилоксикарбонил, 2-нитро-4,5-диметоксибензилоксикарбонил, 3,4,5-триметоксибензилоксикарбонил, 1-(п-бифенил)-1-метилэтоксикарбонил, α,α-диметил-3,5- диметоксибензилоксикарбонил, бензгидрилоксикарбонил, т-бутилоксикарбонил, диизопропилметоксикарбонил, иопропилоксикарбонил, этоксикарбонил, метоксикарбонил, аллилоксикарбонил, 2,2,2,-трихлорэтоксикарбонил, феноксикарбонил, 4-нитрофеноксикарбонил, фторенил-9-метоксикарбонил, циклопентилоксикарбонил, адамантилоксикарбонил, циклогексилоксикарбонил, фенилтиокарбонил и тому подобные; алкильные группы, такие как бензил, трифенилметил, бензилоксиметил и тому подобные; и силильные группы, такие как триметилсилил и тому подобные. В некоторых вариантах осуществления, N-защитные группы представляют собой формил, ацетил, бензоил, пивалоил, т-бутилацетил, фенилсульфонил, бензил, 9-фторенилметилоксикарбонил (Fmoc), т-бутилоксикарбонил (Boc) и бензилоксикарбонил (Cbz).
Используемый в настоящем описании термин «галоид», «галоген» или «галид» относится к F, Cl, Br или I.
Пока нет других указаний, все используемые в настоящем описании аббревиатуры для любых защитных групп, аминокислот или других соединений соответствуют их обычному использованию, общепринятым аббревиатурам или нормативам Комиссии по биохимической номенклатуре A IUPAC-IUB Commission on Biochemical Nomenclature, Biochem. 11:942-944 (1972).
Используемый в настоящем описании термин «по существу чистый» означает достаточно однородный для определения не содержащий легко выявляемые примеси, по данным определения стандартными способами анализа, такими как тонкослойная хроматография (TLC), гель-электрофорез и высокоэффективная жидкостная хроматография (ВЭЖХ, HPLC), используемыми специалистами в данной области для оценки такой чистоты, или достаточно чистые настолько, что дальнейшая очистка выявляемо не изменила бы физические и химические свойства вещества, такие как ферментная и биологическая активность. Термин «по существу чистые» включает композиции, в которых соединение по изобретению образует основной компонент композиции, например, составляет примерно 50%, примерно 60%, примерно 70%, примерно 80%, примерно 90%, или примерно 95% или более веществ в композиции. Способы очистки соединений для получения по существу химически чистых соединений известны специалистам в данной области. Однако по существу чистое соединение может представлять собой смесь стереоизомеров. В таких случаях, дальнейшая очистка может увеличить специфическую активность соединения. Однако соединение по изобретению не всегда должно предоставляться в определенном очищенном состоянии. Частично очищенные композиции используются в определенных вариантах осуществления и в зависимости от желаемого применения. Например, способы очистки, которые могут обеспечить большее общее извлечение соединения по изобретению, могут дать более низкую степень относительной очистки.
Используемый в настоящем описании термин «биологическая активность» относится к видам активности in vivo соединения, композиции или другой смеси, или физиологические реакции, которые происходят в результате введения соединения, композиции или другой смеси in vivo. Таким образом, биологическая активность охватывает терапевтические эффекты, диагностические эффекты и фармацевтическую активность таких соединений, композиций и смесей. Термин «биологически активный» или «функциональный» при использовании в качестве модификатора композиции по изобретению, содержащей полипептиды или их композиции, относится к полипептиду, который проявляет по меньшей мере одну активность, характерную для соединения по изобретению, или подобную этой активности.
Термин «фармакокинетика», используемый в настоящем описании, относится к концентрации введенного соединения в сыворотке с течением времени. Фармакодинамика относится к концентрации с течением времени введенного соединения в тканях, являющихся и не являющихся мишенью, и к эффектам на ткани-мишени (т.е., эффективности) и на другие ткани (т.е., токсичность). Улучшения, например, фармакокинетики или фармакодинамики могут быть предназначены для конкретного нацеливающего агента, например, путем использования лабильных связей или модификацией химической природы любого линкера (например, изменение растворимости, заряда и тому подобных характеристик). Используемые в настоящем описании фразы «эффективное количество» и «терапевтически эффективное количество» относятся к количеству соединения по изобретению, которое можно применять или которое способно поддержать наблюдаемое изменение уровня одной или более характеристик биологической активности композиции по изобретению, или к дозе, достаточной для обеспечения благоприятного эффекта, например, облегчения симптома у реципиента этой дозы. Определенный терапевтически эффективный уровень дозы для любого конкретного индивида зависит от разнообразных факторов, включая подлежащий лечению симптом или заболевание, тяжесть симптома или заболевания, активность определенного соединения, путь введения, скорость выведения соединения из организма, длительность лечения, лекарственные препараты, применяемые в комбинации или одновременно с соединением, возраст, масса тела, пол, рацион питания и общее состояние здоровья индивида и тому подобные, а также другие факторы, хорошо известные в области медицины и науки. Терапевтически эффективное количество может представлять собой количество соединения по изобретению, достаточное для получения измеряемого ингибирования ангиогенеза в подвергаемой лечению ткани, т.е. количество, ингибирующее ангиогенез. Ингибирование ангиогенеза может измеряться in situ иммуногистохимическими или другими способами, известными специалисту в данной области. Различные общие соображения, принимаемые во внимание при определении «терапевтически эффективного количества» известны специалистам в данной области и описаны, например, в руководствах Gilman, A. G., et al., Goodman And Gilman's The Pharmacological Basis of Therapeutics, 8th ed., McGraw-Hill (1990); and Remington's Pharmaceutical Sciences, 17th ed., Mack Publishing Co., Easton, PA (1990).
Используемые в настоящем описании термины «одновременно вводимые» или «одновременное введение» охватывают по существу одновременное введение одного или более соединений по изобретению и одного другого применяемого в онкологии терапевтического средства.
Используемый в настоящем описании термин «не одновременное» введение охватывает введение одного или более соединений по изобретению в различные периоды времени, в любом порядке, с перекрытием указанных периодов или без него. Это включает без ограничения последовательное лечение (такое как предварительное лечение, последующее лечение или перекрывающее лечение) компонентами комбинации, а также схемы, при которых лекарственные препараты чередуются, или где один компонент вводится длительно, а другой(другие) вводятся прерывисто.
ПРИМЕРЫ
Разносторонность изобретения иллюстрируется следующими примерами, которые иллюстрируют типичные варианты осуществления изобретения и ни коим образом не ограничивают формулу изобретения или описание.
Пример 1
Синтез соединений по изобретению
Пептиды по изобретению могут быть связаны с антителом 38C2 следующей процедурой: Один мл антитела 38C2 в солевом растворе с фосфатным буфером (10 мг/мл) добавляют к 12 мкл 10 мг/мл основного раствора Пептида, и полученную смесь поддерживают при комнатной температуре в течение 2 часов перед использованием.
Пример 2
В публикации C. Rader, et al, J. MoI. Biol. 332:889-899 (2003) детально описан один способ получения h38c2. Следующие детальные описания результатов, материалы и методы в этой ссылке. Гуманизацию человеческого VK гена DPK-9 и человеческого гена JK4, использовали в качестве остова для гуманизации вариабельного домена каппа легкой цепи, и человеческий ген DP-47 VH (человеческого вариабельного тяжелого домена) и JH4 человеческого гена JH используются в качестве остовов для гуманизации вариабельного домена тяжелой цепи m38C2. Все остатки определяющей комплементарность области (CDR), как определено Kabat et al., а также как определенные остатки остова в вариабельном домене и легкой цепи, и тяжелой цепи были трансплантированы из m38C2 в человеческий остов. Выбор трансплантированных остатков остова может основываться на кристаллической структуре мышиного mAb 33F12 Fab (PDB IAXT). mAb 33F12 Fab разделяет 92% гомологию последовательности с m38c2 в вариабельных доменах и идентичные длины CDR. Кроме того, и 33F12, и m38C2 имеют одинаковую каталитическую активность. Остатки остова состояли из пяти остатков в легкой цепи и семи остатков в тяжелой цепи (фиг. 7A) и охватывали остатки, которые, вероятно, непосредственно или опосредованно участвуют в каталитической активности m38C2. Они включают реактивный лизин m38C2, LysH93, который расположен в области 3 (FR3) тяжелой цепи. Шесть остатков, SerH35, ValH37, TrpH47, TrpH103 и PheL98, которые сохраняются между 33F12 и 38C2 мышиных mAbs, находятся в пределах радиуса 5-Å ε аминогруппы LysH93. Эти остатки также учитывались при гуманизации. LysH93 лежит на дне сайтов связывания высоко гидрофобного субстрата 33F12 и 38C2 мышиных mAbs. В дополнение к остаткам CDR, ряд остатков остова выстилают этот карман. Среди них, LeuL37, GlnL42, SerL43, ValL85, PheL87, ValH5, SerH40, GluH42, GlyH88, IleH89 и ThrH94 трансплантировали на человеческий остов.
Экспрессия
Путем слияния гуманизированных вариабельных доменов с человеческими константными доменами Cκ и Cγ11, h38C2 был первоначально генерирован в качестве Fab экспрессируемого в E. coli. Затем, h38c2 IgG образовывался из h38c2 Fab с использованием вектора PIGG, созданного методами генной инженерии для экспрессии человеческого IgG1 в клетках млекопитающих, подвергали аффинной хроматографии на рекомбинантном белке A, получая приблизительно 1 мг/л h38C2 IgG1. Чистоту устанавливали SDS-PAGE (электрофорезом на полиакриламидном геле с додецилсульфатом натрия) с последующим окрашиванием бриллиантовым голубым Кумасси.
Соединения β-Дикетона-
Енаминон, образованный ковалентным добавлением β-дикетона с m38c2 имеет характерную спектральную поглощательную способность УФ при λmax = 318 нм. Как и m38C2 IgG, h38C2 IgG проявил характерную спектральную поглощательную способность енаминона после инкубации с β-дикетоном. В качестве отрицательного контроля, рекомбинантный человеческий анти-ВИЧ-1 gp120 mAb b12 с таким же изотипом IgG1, как h38C2, но без реактивного лизина, не выявил спектральной поглощательной способности енаминона после инкубации с β-дикетоном 2. Для количественного сравнения связывания β-дикетонов с m38C2 и h38C2, авторы использовали конкурентный ELISA (иммуноферментный анализ). Антитела инкубировали с увеличивающимися концентрациями β-дикетонов 2 и 3 и анализировали против иммобилизованного сопряженно связанного с BSA (бычьим сывороточным альбумином) β-дикетоном 1. Видимые равновесные константы диссоциации составляли 38 мкМ (m38C2) и 7,6 мкМ (h38C2) для β-диктона 2 и 0,43 мкМ (m38C2) и 1,0 мкМ (h38C2) для β-дикетона 3, выявляя одинаковые свойства связывания β-дикетона для мышиного и гуманизированного антитела (фиг. 6).
Молекулярное моделирование - Молекулярную модель h38C2 Fab конструировали гомологическим моделированием с использованием кристаллической структуры родственного антитела к альдолазе, мышиного 33F12 Fab (Protein Data Bank ID: IAXT), в качестве матрицы. Кристаллическую структуру мышиного 33F12 Fab предварительно определяли при разрешении 2,15 Å4. Совмещение мышиных аминокислотных последовательностей 33F12 и 38C2 с использованием модуля HOMOLOGY в пределах программного обеспечения INSIGHT II (Accelrys) подтвердило, что обе последовательности высоко гомологичны. Они отличаются друг от друга 19 из 226 аминокислот в двух вариабельных доменах, и их CDR разделяют одни и те же отрезки. В дополнение к высокой гомологии последовательностей, обе структуры проявляют значительную структурную аналогию, как наблюдается определением с низким разрешением кристаллической структуры 38C2. Остатки в модели были мутированы для соответствия аминокислотной последовательности h38C2, и боковые цепи размещали на основании стандартных ротамеров. Эта модель была затем минимизирована модулем DISCOVER в программном обеспечении INSIGHT II с использованием 100 стадий, причем за каждой наиболее круто нисходящей минимизацией следовала градиентная минимизация конъюгата.
Конструкция h38C2 Fab-
Последовательности вариабельных доменов легкой и тяжелой цепи m38C2 (соответственно SEQ ID NO:4 и 5), а также последовательности человеческой зародышевой линии DPK-9 (SEQ ID NO:6), JK4 (SEQ ID NO:7), DP-47 (SEQ ID NO:8) и JH4 (SEQ ID NO:9, 10 и 11) (V BASE; http://vbase.mrc-cpe.cam.ac.uk/) использовали для конструирования перекрывающихся олигонуклеотидов для синтетической сборки соответственно гуманизированной Vκ и VH. Избегали сайты N-гликозилирования с последовательностью NXS/T, а также внутренние сайты рестрикции HindIII, XbaI, SacI, ApaI и SfiI. PCR (полимеразную цепную реакцию) проводили использованием системы Expand High Fidelity PCR System (Roche Molecular Systems). Гуманизированные олигонуклеотиды Vκ представляли собой: фланкирующую смысловую последовательность L (Rader, C, Ritter, G., Nathan, S., Elia, M., Gout, L, Junbluth, A.A., J. Biol. Chem. 275: 13668-13676 (2000)) (смысловая последовательность 5'-GAGGAGGAGGAGGAGGGCCCAGGCGGCCGAGCTCCAGATGACCCAGTCTCTCCA-3' SEQ ID NO:12); h38C2Ll (смысловая последовательность; 5'-GAGCT CCAGATGACCCAGTCTCCATCCTCCCTGTCTGCATCTGTAGGTGACCGCGTCACCATCACTTG-3') (SEQ ID NO:13); h38C2L2 (антисмысловая последовательность; 5'-ATTCAGATATGGGCTGCCATAAGTGTGCAGGAGGCTCTGACTGGAGCGGCAAGTGATGGTGACGCGGTC-3') (SEQ ID NO:14); h38C2L3 (смысловая последовательность; 5'-TATGGCAGCCCATATCTGAATTGGTATCTCCAGAAACCAGGCCAGTCTCCTAAGCTCCTGATCT AT-3') (SEQ ID NO:15); h38C2L4 (антисмысловая последовательность; 5'-CTGAAACGTGATGGGACACCACTGAAACGATTGGACACTTTATAGATCAGGAGCTTAGGAGACTG-3') (SEQ ID NO:16); h38C2L5 (смысловая последовательность; 5'-AGTGGTGTCCCATCACGTTTCAGTGGCAGTGGTTCTGGCACAGATTTCACTCTCACCATCAGCAGTCTGCAACCTGAAGATTTTGCAGTG-3') (SEQ ID NO:17); h38C2L6 (антисмысловая последовательность; 5'-GATCTCCACCTTGGTCCCTCCGCCGAAAGTATAAGGGAGGTGGGTGCCCTGACTACAGAAGTACACTGCAAAATCTTCAGGTTGCAG-3') (SEQ ID NO:18); фланкирующая антисмысловая последовательность L (C. Rader et al, J. Biol. Chem. 275:13668-13676 (2000)) (антисмысловая последовательность 5'-GACAGATGGTGCAGCCACAGTTCGTTTGATCTCCACCTTGGTCCTCC-3' SEQ ID NO:19). Гуманизированные олигонуклеотиды VH представляли собой: фланкирующую антисмысловую последовательность H (C. Rader et al, J. Biol. Chem. 275:13668-13676 (2000)) (смысловая последовательность 5'-GCTGCCCAACCAGCCATGGCCGAGGTGCAGCTGGTGGAGTCTGGGGGA-3' SEQ ID NO:20); h38C2Hl (смысловая последовательность; 5'-GAGGTGCAGCTGGTGGAGTCTGGCGGTGGCTTGGTACAGCCTGGCGGTTCCCTGCGCCTCTCCTGTGCAGCCTCTGGCT-3') (SEQ ID NO:21); h38C2H2 (антисмысловая последовательность; 5'-CTCCAGGCCCTTCTCTGGAGACTGGCGGACCCAGCTCATCCAATAGTTGCTAAAGGTGAAGCCAGAGGCTGCACAGGAGAG-3') (SEQ ID NO:22); h38C2H3 (смысловая последовательность; 5'-TCTCC AGAGAAGGGCCTGGAGTGGGTCTCAGAGATTCGTCTGCGCAGTGACAACTACGCCACGCACTATGCAGAGTCTGTC-3') (SEQ ID NO:23); h38C2H4 (антисмысловая последовательность; 5'-CAGATACAGCGTGTTCTTGGAATTGTCACGGGAGATGGTGAAGCGGCCCTTGACAGACTCTGCATAGTGCGTG-3') (SEQ ID NO:24); h38C2H5 (смысловая последовательность; 5'-CAATTCCAAGAACACGCTGTATCTGCAAATGAACAGCCTGCGCGCCGAGGACACGGGCATTTATTACTGTAAAACG-3') (SEQ ID NO:25); h38C2H6 (антисмысловая последовательность; 5'-TGAGGAGACGGTGACCAGGGTGCCCTGGCCCCAGTAGCTGAAACTGTAGAAGTACGTTTTACAGTAATAAATGCCCGTG-3') (SEQ ID NO:26); фланкирующая антисмысловая последовательность H (C. Rader et al, J. Biol. Chem. 275:13668-13676 (2000)) (антисмысловая последовательность 5'-GACCGATGGGCCCTTGGTGGAGGCTGAGGAGACGGTGACCAGGGTGCC-3' SEQ ID NO:27). После сборки, проводили слияние гуманизированных Vκ и VH соответственно с человеческими Cκ и Cγ11, и проводили слияние полученных фрагментов легкой цепи и тяжелой цепи и SfiI-клонирование в фагемидный вектор pComb3X, как описано в публикации (C. Rader et al, J. Biol. Chem. 275:13668-13676 (2000); CF. Barbas 3rd et al, Phage Display: A laboratory manual, Cold Spring Harbor Laboratory, Cold Spring Harbor N. Y. (2001)). Для обогащения клонов с правильной последовательностью h38C2, Fab представляли на фаге и проводили отбор одним циклом пэннинга против иммобилизованного β-дикетона 1 (JW), сопряженно связанного с BSA. Растворимые Fab получали из одних клонов и тестировали ELISA на наличие связывания с иммобилизованным JW-BSA путем использования ослиных анти-человеческих поликлональных антител F(ab')2, сопряженно связанных с пероксидазой хрена (Jackson ImmunoResearch Laboratories) в качестве вторичного антитела. Последовательности, кодирующие легкую цепь и тяжелую цепь, анализировали секвенированием ДНК с использованием соответственно затравок OMPSEQ (5'-AAGACAGCTATCGCGATTGCAG3' SEQ ID NO:28) и PELSEQ (5'-CTATTGCCTACGGCAGCCGCTG-3' SEQ ID NO:29) (CF. Barbas 3rd et al., Phage Display: A laboratory manual, Cold Spring Harbor Laboratory, Cold Spring Harbor N. Y., (2001)), для подтверждения собранных последовательностей Vκ и VH h38C2.
Конструкция, получение и очистка h38C2 IgG1 - Недавно описанный вектор PIGG (C. Rader et al, FASEB J., 16:2000-2002 (2002)) использовали для экспрессии h38C2 IgG1 у млекопитающих. Вектор экспрессии млекопитающих PIGG-h38c2 иллюстрируется на фиг. 23. Вектор 9kb содержит кассеты γ1 тяжелой цепи и κ легкой цепи, приводимые в действие конструктом двунаправленного промотера. С использованием затравок PIGG-h38C2H (смысловая последовательность; 5'-GAGGAGGAGGAGGAGGAGCTCACTCCGAGGTGCAGCTGGTGGAGTCTG-3') (SEQ ID NO:30) и GBACK (5'-GCCCCCTTATTAGCGTTTGCCATC-3' SEQ ID NO:31) (CF. Barbas 3rd et al, Phage Display: A laboratory manual, Cold Spring Harbor Laboratory, Cold Spring Harbor N. Y. (2001)), кодирующую последовательность VH из h38C2 Fab в фагемидном векторе pComb3X амплифицировали, переваривали SacI и ApaI и клонировали в соответствующим образом переваренный вектор PIGG. С использованием затравок PIGG-h38C2L (смысловая последовательность: 5'-GAGGAGGAGGAGGAGAAGCTTGTTGCTCTGGATCTCTGGTGCCTACGGGGAGCTCCAGATGACCCAGTC TCC-3') (SEQ ID NO:32) и LEADB (5'-GCCATGGCTGGTTGGGCAGC-3' SEQ ID NO:33) ((CF. Barbas 3rd et al, Phage Display: A laboratory manual, Cold Spring Harbor Laboratory, Cold Spring Harbor N. Y. (2001)) кодирующую последовательность легкой цепи из h38C2 Fab в фагемидном векторе pComb3X амплифицировали, переваривали HindIII и XbaI и клонировали в соответствующим образом переваренный вектор PIGG, который уже содержал тяжелую цепь h38C2. Промежуточный и конечный конструкторы вектора PIGG амплифицировали в штамме SURE E. coli (Stratagene) и получали плазмидным набором QIAGEN Plasmid Maxi Kit. h38C2 IgG1 производили из полученного конечного конструкта вектора PIGG транзиторной трансфекцией человеческих клеток 293T с использованием Lipofectamine 2000 (Invitrogen). Трансфецированные клетки поддерживали в 10% GIBCO со сверхнизким содержанием IgG (<0,1 %) FCS (Invitrogen) в среде RPMI 1640 (Hyclone) в течение 2 недель. В течение этого времени, среду собирали и заменяли три раза. Собранную среду подвергали аффинной хроматографии на колонке с рекомбинантным белком А HiTrap (Amersham Biosciences). Эта стадия очистки давала 2,45 мг h38C2 IgG1 из 2,300 мл собранной среды, по данным определения измерением оптической плотности при 280 нм с использованием биофотометра Eppendorf BioPhotometer. После анализа в сравнении с PBS в диализной кассете Slide-A-Lyzer 1OK (Pierce), антитело концентрировали до 760 мкг/мл с использованием центрифужного фильтрующего устройства Ultrafree-15 (UFV2BTK40; Millipore), и подвергали стерилизационной фильтрации через шприцевый фильтр с размером пор 0,2 мкм Acrodisc 13MM S-200 (Pall). Конечный выход составил 2,13 мг (87%). Очищенный h38C2 IgG1 подтверждали не восстанавливающим SDS-PAGE с последующим окрашиванием бриллиантовым голубым Кумасси.
Образование енаминона - Антитело (h38C2 IgG1 или b12 IgG1) добавляли к β-дикетону 2 до конечной концентрации 25 мкМ сайта связывания антитела и 125 мкМ β-дикетона. Эту смесь инкубировали при комнатной температуре в течение 10 минут перед получением УФ спектра на считывающем устройстве планшет SpectraMax Plus 384 UV (Molecular Devices) с использованием программного обеспечения SOFTmax Pro (версия 3.1.2).
Анализы связывания - Пока нет других указаний, все растворы представляли собой солевой раствор с фосфатным буфером (pH 7,4). Раствор 2 x или β-дикетона 2, или 3 (50 мкл) добавляли к 50 мкл антитела (или h38C2, или m38C2) и давали возможность инкубироваться при 37°C в течение 1 ч. Растворы смешивали пипетированием. Конечные концентрации антитела составляли от 0,4 до 8 нМ сайта связывания антитела, и конечные концентрации β-дикетонов 2 и 3 составляли соответственно от 10-9 до 10-2 M и от 10-10 до 10-4 M. Каждую лунку 96-луночного планшета Costar 3690 (Corning) покрывали 100 нг конъюгата BSA β-дикетона 1 в TBS (солевом растворе, забуференном Tris). Затем лунки блокировали 3% (масс./об.) BSA в TBS. Затем, добавляли 50 мкл смеси антитела/β-дикетона, с последующим добавлением 50 мкл или козьих анти-человеческих Fc IgG поликлональных антител (Pierce), или кроличьих анти-мышиных Fc IgG поликлональных антител (Jackson ImmunoResearch Laboratories) в разведении 1:1000, сопряженно связанных с пероксидазой хрена. За этим следовало добавлением 50 мкл раствора субстрата ABTS (диаммониевая соль 2,2'-азинобис[3-этилбензотиазолин-6-сульфоновой кислоты]). Между каждым добавлением, планшет покрывали, инкубировали при 37°C в течение 1 ч и затем промывали пять раз деионизированной H2O. Спектральную поглощательную способность при 405 нм контролировали, как описано выше, до тех пор, пока реакция с отсутствующим β-дикетоном не достигала соответствующей величины (0,5 < A405 < 1,0). Для каждой лунки рассчитывали фракционное ингибирование сигнала ELISA (Vi) с использованием уравнения i:

где A0 представляет спектральную поглощательную способность ELISA, полученную в отсутствие β-дикетона, а Ai представляет спектральную поглощательную способность ELISA, полученную в присутствие β-дикетона. Для одновалентных связывающих белков, фракция антитела, связанная с растворимым β-дикетоном (ƒ) равна νi. Однако IgG антитело является бивалентным, и сигнал ELISA ингибируется только присутствием антитела, подвергнутого двойному лигандированию, а не одновалентным связыванием. Поэтому, использовали коррекцию Stevens для бивалентного антитела:

Следующее отношение использовали для определения видимой равновесной константы диссоциации (модифицированное [ссылка 37]):
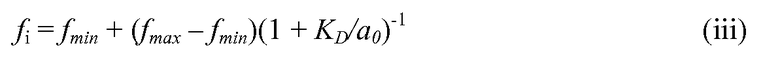
где α0 соответствует общей концентрации β-дикетона, KD представляет равновесную константу диссоциации, и ƒmin и ƒmax представляют экспериментально определенные величины, когда связывающие антитела сайты соответственно не заняты или насыщены. Ввиду того, что данное уравнение действительно только когда величины KD по меньшей мере в 10 раз выше, чем концентрация антител, было подтверждено, что величины KD, определенные по уравнению iii, соответствуют этому критерию. Подгонку данных осуществляли с использованием процедуры подгонки теоретических и экспериментальных данных при минимальной сумме квадратов отклонений нелинейных функций KaleidaGraph (версия 3.0.5, программное обеспечение Abelbeck) при использовании KD, ƒmax, и ƒmin в качестве подгоняемых параметров и нормализовали с использованием уравнения iv:

Пример 3
Связывающие пептиды по изобретению с линкерами по изобретению.
Соединения по изобретению могут быть получены несколькими подходами. При одном подходе, соединение [Пептида]-линкера синтезируется с линкером, который включает одну или более реактивных групп, предназначенных для ковалентного взаимодействия с боковой цепью аминокислоты в связывающем участке антитела. Соединение нацеливающего агента-линкера и антитело объединяются в условиях, при которых линкерная реактивная группа образует ковалентную связь с боковой цепью аминокислоты.
При другом подходе, связывание может быть достигнуто синтезом соединения антитела-линкера, содержащего антитело и линкер, где линкер включает одну или более реактивных групп, предназначенных для ковалентного взаимодействия с соответствующей химической частью [Пептид]. Может потребоваться модификация [Пептида] для обеспечения соответствующей части для взаимодействия с линкерной реактивной группой. Антитело-линкер и [Пептид] объединяются в условиях, при которых линкерная реактивная группа ковалентно связывается с нацеливающим и/или биологическим агентом.
В еще одном подходе для образования конъюгата антитела-[Пептида] используется двойная линкерная конструкция. В некоторых вариантах осуществления, синтезируется соединение [Пептида]-линкера, которое содержит [Пептид]-линкер и линкер с реактивной группой. Синтезируется соединение антитела-линкера, которое содержит антитело и линкер с химической группой, восприимчивой к взаимодействию с реактивной группой [Пептида]-линкера первой стадии. Эти два содержащих линкер соединения затем объединяются в условиях, в которых линкеры ковалентно связываются, образуя соединение антитела-[Пептида]. В таблице 9 показаны иллюстративные соединения по изобретению, содержащие [VEGF-Пептиды], ковалентно связанные с линкерами: D-аминокислоты обозначены использованием букв в строчном формате: например, Соединение 2018 (содержащие SEQ ID NO:78, замещенную K10 в качестве соединяющего остатка, также равного SEQ ID NO:195) включает остатки «R-L-Y-(D-Ala)-(D-Leu)», которые написаны в виде «R-L-Y-a-1». Дисульфидные связи изображены в виде соединяющих линий между цистеиновыми остатками.
Z может представлять группу, которая образует обратимую или необратимую ковалентную связь. В некоторых вариантах осуществления, обратимые ковалентные связи могут быть образованы с использованием дикетоновых групп Z, таких как группы, показанные на фиг. 3. Таким образом, структуры A-C могут образовывать обратимые ковалентные связи с реактивными нуклеофильными группами (например, боковая цепь лизина или цистеина) в связывающем участке антитела. R'1, R'2, R'3 и R4 в структурах A-C на фиг. 3 представляют заместители, которые могут представлять C, H, N, O, P, S, галоген (F, Cl, Br, I) или их соль. Эти заместители могут также включать группу, такую как алкильная, алкенильная, алкинильная, оксоалкильная, оксоалкенильная, оксоалкинильная, аминоалкильная, аминоалкенильная, аминоалкинильная, сульфоалкильная, сульфоалкенильная или сульфалкинильная группа, фосфоалкильная, фосфоалкенильная, фосфоалкинильная группа. R'2 и R'3 также могут образовывать кольцевую структуру, как иллюстрируется в структурах B и C. X на фиг. 3, может представлять гетероатом. Другие группы Z, которые образуют обратимые ковалентные связи, включают амидин, имин и другие реактивные группы, охватываемые структурой G на фиг. 3. Фиг. 4 включает структуры других линкерных реактивных групп, которые образуют обратимые ковалентные связи, например, структуры B, G, H, и, где X не представляет уходящую группу, E и F.
Реактивные группы Z, которые образуют необратимую ковалентную связь со связывающим участком антитела, включают структуры D-G на фиг. 3 (например, когда G представляет имидат) и структуры A, C и D на фиг. 4. Когда X представляет уходящую группу, структуры E и F на фиг. 4 могут также образовывать необратимые ковалентные связи. Такие структуры могут использоваться для необратимого присоединения нацеливающего агента-линкера к реактивной нуклеофильной группе к связывающему участку антитела. Используемое в настоящем описании обозначение L' представляет линкерную часть, соединяющую антитела с нацеливающим агентом, и имеющую формулу -X-Y-Z'-. Фиг. 5 и 6, соответственно, иллюстрируют механизм добавления реактивной, нуклеофильй боковой цепи в связывающем участке антитела к частям Z, иллюстрируемым на фиг. 3 и 4.
Это показано ниже для случая, когда линкер имеет дикетоновую часть в качестве реактивной группы, и связь возникает с аминогруппой боковой цепи остатка лизина в связывающем участке антитела. Антитело схематически показано как бивалентное с боковой цепью реактивной аминокислоты для каждого указанного связывающего участка.
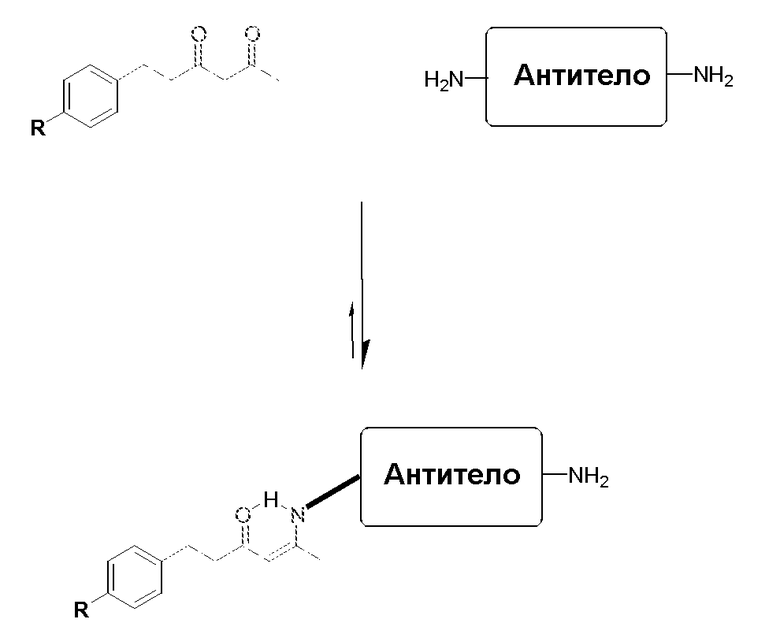
Другой вариант осуществления, показанный ниже, предназначен для случая, где линкер имеет бета-лактамовую часть в качестве реактивной группы, и связь возникает с аминогруппой боковой цепи остатка лизина в связывающем участке антитела. Антитело показано схематически как бивалентное с боковой цепью реактивной аминокислоты для каждого указанного связывающего участка.
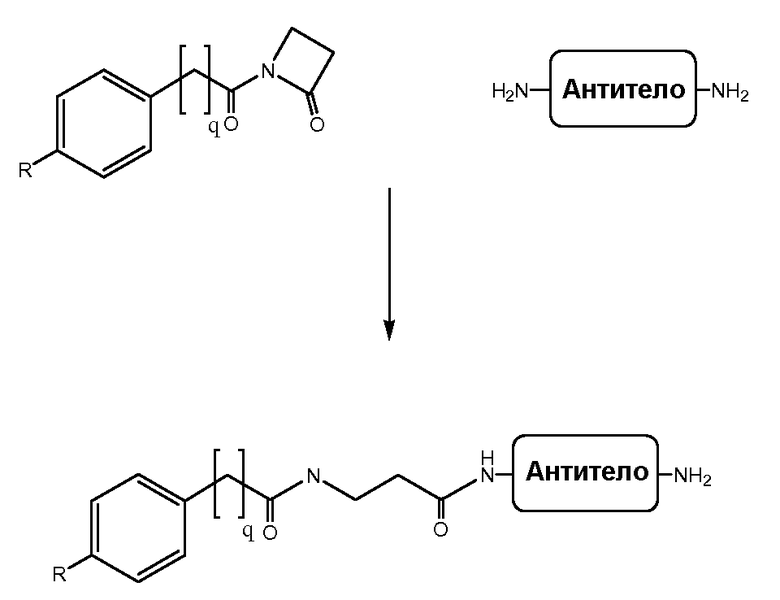
Соединения по изобретению могут быть также легко синтезированы ковалентным связыванием соединения [Пептида]-линкера, как описано в настоящей заявке, с связывающим участком мультивалентного антитела. Например, конъюгат [Пептида]-линкера, где линкер включает дикетоновую реактивную часть, может инкубироваться с 0,5 эквивалентами антитела к альдолазе, такого как h38C2 IgG1, для получения соединения по изобретению.
Еще один пример механизма реакции, объединяющего [Линкер]-[Антитело] с пептидом, показан ниже, в котором используется принцип «click chemistry» (подход для быстрого и надежного получения веществ соединением вместе мелких единиц) для объединения алкина и азида (где R может быть прикреплен к [Пептиду] изобретения.
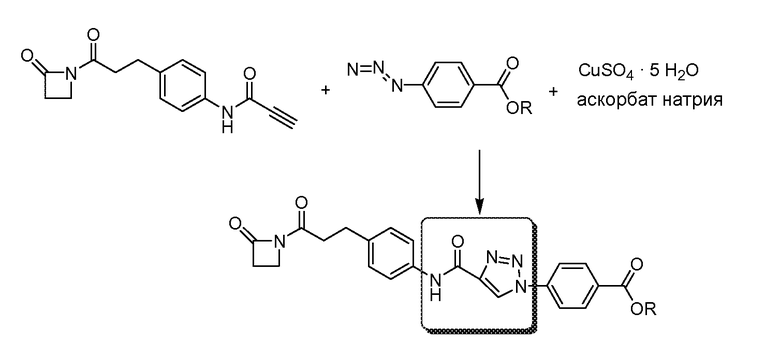
Пример 4
Синтез соединения:
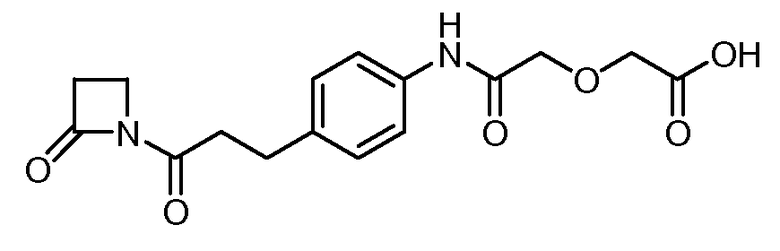
представлен на фиг. 7.
Пример 5
Способность соединений, связывающих Ang2, взаимодействовать с Ang2, измеряли конкуренцией с Tie-2. Эти тесты были описаны в US2008166364 (а также в PCT/IE2007/000110), содержания которых полностью включены в настоящее описание путем ссылки. В частности, те части PCT/IE2007/000110 и US2008166364, в которых детально описаны преимущества и недостатки различных пептидов, связывающих Ang2, и преимущества и недостатки ковалентного связывания определенных связывающих Ang2 пептидов с каталитическими антителами (и те части, которые конкретно относятся к связыванию с h38C2), а также преимущества и недостатки использования определенных остатков соответствующего специфичного для Ang2 пептида в качестве связывающего остатка (в данном контексте, связывающий остаток означает остаток, ковалентно связанный с линкером (например, используемым в настоящем описании в примере 4). Для конкурентного ELISA, белок человеческого ангиопоэтина-2 и Tie-2-Fc (R&D Systems) восстанавливали без белка-носителя. Мышиное антитело против человеческого Tie-2 (Pharmingen) использовали в качестве первичного антитела, а козий анти-мышиный-IgG1-HRP (Pierce) использовали в качестве вторичного антитела. Использовали субстрат TMB от компании Pierce.
Высоко связывающие полулуночные планшеты покрывали Ang-2 (100 нг/лунку) в 50 мкл PBS и инкубировали при 4°C в течение ночи. Планшеты промывали три раза промывным буфером (0,1% Tween 20, PBS, pH 7,4) и блокировали Superblock (Scytek), 100 мкл/лунку при комнатной температуре («КT») в течение 1 часа. После удаления блокирующего раствора, добавляли 50 мкл связывающего Ang-2 пептидного соединения (1 мМ и серийное разведение 5x) в присутствии 0,25 нМ hTie-2-Fc с использованием Superblock в качестве разбавителя и инкубировали при КT в течение 2 часов. Планшеты промывали 3 раза промывным буфером. Затем, добавляли 50 мл 0,1 мг/мл мышиного античеловеческого Tie-2, разбавленного в Superblock, и инкубировали при КT в течение 1 часа. После инкубации, затем добавляли 50 мкл козьего антимышиного IgG-HRP в Superblock в разведении 1:5000 и инкубировали при КT в течение одного часа. После промывания 3 раза, добавляли 50 мкл (25 мкл TMB + 25 мкл H2O2) и инкубировали в течение 3-5 минут. Развитие цвета контролировали и останавливали 25 мкл 2M H2SO4. Измеряли OD450 нм (оптическую плотность при 450 нм) при длине коррекционных волн 540 нм. Величины IC50 (ингибирование связывания Ang-2-Tie-2 на 50%) рассчитывали с использованием функции подгонки нелинейной сигмоидальной кривой зависимости реакции от дозы в программном обеспечении Prism 4 (GraphPad).
Для конкурентного ELISA в обращенной фазе, использовали человеческий Tie-2-Fc, белок ангиопоэтина-2, биотинилированное антитело против человеческого Ang-2 и стрептавидин HRP (R&D Systems) и субстрат TMB от компании Pierce. Высоко связывающие полулуночные планшеты покрывали Tie-2-Fc (50 нг/лунку) в 50 мкл PBS и инкубировали при 4°C в течение ночи. Планшеты промывали три раза промывным буфером (0,1% Tween 20, PBS, pH 7,4) и блокировали Superblock, 150 мкл/лунку при КT в течение 1 часа. Планшеты промывали три раза. После промывания добавляли 50 мкл связывающего Ang-2 пептидного соединения (50 нМ, серийное разведение 5x) в присутствии 50 нг/мл (0,83 нМ) Ang-2 в Superblock и инкубировали при КT в течение 1 часа. Планшеты промывали 3 раза. После промывания добавляли 50 мкл 1 мкг/мл биотинилированного детекционного антитела против Ang-2 в Superblock и инкубировали при КT в течение 2 часов. Планшеты промывали 3 раза и добавляли 50 мкл стрептавидина HRP (разведение 1:200 в Superblock) при КT в течение 20 минут. Планшеты промывали 3 раза и добавляли 50 мкл (25 мкл TMB + 25 мкл H2O2) раствора субстрата и инкубировали в течение 20-30 минут. Развитие цвета останавливали 25 мкл 2 M H2SO4. Измеряли OD450 нм при длине коррекционных волн 540 нм. Величины IC50 (ингибирование связывания Ang-2-Tie-2 на 50%) рассчитывали с использованием функции подгонки нелинейной сигмоидальной кривой зависимости реакции от дозы в программном обеспечении Prism 4.
Величины IC50 для иллюстративных связывающих Ang-2 пептидных соединений, по данным определения конкурентным ELISA, представлены в таблице 5. Величины IC50 представлены для связывающего Ang2 пептида, ковалентно связанного с Линкером, как показано в примере 4, через боковую цепь связывающего Ang2 остатка (T), и связывающего Ang2 пептида, ковалентно связанного с линкером примера 4 через боковую цепь связывающего Ang2 остатка, где группа Z линкера ковалентно связана со связывающим участком h38C2 (P).
В таблице 5, соединения 4021, 4022 и 4023 представляют одни связывающие Ang-2 пептиды, не имеющие сопряженной связи или с линкером, или с линкером-антителом; соединения 4024 и 4025 представляют собой связывающие Ang-2 пептиды, сопряженно связанные с линкером-антителом, где линкер представляет собой 4P («4» PEG); а соединения 4026-4063 представляют собой связывающие Ang-2 пептиды, сопряженно связанные с линкером-антителом, где линкер представляет собой OP («O» PEG) и имеет структуру линкера, показанного в примере 4. Соединения 4024-4063 были сопряженно связаны с гуманизированным антителом к альдолазе при получении данных, показанных ниже, за исключением иных указаний. Все соединения по изобретению, показанные в таблицах, были кэппированы ацильной группой на N-конце и аминогруппой на C-кнце, за исключением иных указаний (например, соединения 4026, 4049, 4050, 4051 и 4052). В таблице 5 аминокислотные последовательности пептидных соединений показаны с положением линкера OP или 4P, указанным в скобках, после внутреннего аминокислотного остатка, к которому присоединен линкер. Для соединения 4026, N-концевой линкер «OP» указан в начале пептидной последовательности.
Например, соединение 4024 в таблице 5 имеет следующую последовательность: Q(Kac)Y QPL DEL DK(4P)T LYD QFM LQQ G (материнская SEQ ID представляет собой SEQ ID NO:138). В этом примере, второй аминокислотный остаток представляет собой эпсилон-ацил-лизин, за ним следует тирозин, а положение связывания (в данном случае линкер 4P) представляет собой остаток лизина 11, за которым следует треонин. Также, соединение 4052 имеет следующую последовательность: (Амидо 2-PEG)QKacY QPL DEL DK(OP)T LYD QFMLQQ G (SEQ ID NO:162). В этом случае, N-концевой остаток глутамина кэппирован группой амидо-2-PEG, второй аминокислотный остаток представляет собой эпсилон-ацил-лизин, а линкер OP присоединен к остатку лизина 11.
В таблицах 5 и 6 показан период полувыведения (T1/2) и полупериод «скрининга» (результаты в скобках), альтернативный способ определения T1/2 на основании более короткого периода тестирования. Для T1/2 «скрининга», тестируемые соединения вводили внутривенно самцам мышей линии Swiss Webster. Образцы крови брали у 4 мышей на точку времени взятием крови из ретроорбитального синуса в следующие точки времени: 0,08, 5 и 32 часа. Содержание тестируемых соединений в крови определяли ELISA. Данные представляли в виде процентных долей тестируемых соединений через 32 часа в сравнении с 5 мин. Нормальный T1/2 рассчитывали аналогичным образом после дополнительного анализа данных с использованием программного обеспечения WinNonlin в версии 4.1 (Pharsight Corporation). Подгонку данных осуществляли к модели на основании формы кривой (т.е., би-экспоненциальное снижение подгоняется к двухкомпартментальной модели и т.д.). Критерии для наилучшей подгонки (т.е., самый низкий %CV, коэффициент вариации) основывались на повторяющихся, повторно взвешенных минимальных квадратических отклонениях.
Величины IC50 для иллюстративных связывающих Ang-2 пептидных соединений, по данным определения конкурентной ELISA в обращенной фазе, представлены в таблице 5. Величины IC50 представлены для нацеливающего пептида плюс линкера и нацеливающего пептида, связанного с антителом (P), через линкер примера 4, пока нет других указаний. В таблице 5, соединения сопряженно связаны с гуманизированным антителом к альдолазе h38c2 и линкерными структурами, показанными в 4 (OP).
Исследования с использованием ксенотрансплантатов
Клетки Colo205 культивировали в среде 10% FBS RPMI, и 3 x l06 клеток в 0,1 мл сбалансированного солевого раствора Хэнка (Hank) (HBSS) инъецировали подкожно в верхнюю часть правого бока голых мышей. Через 7-9 дней, животных методом рандомизации включали в соответствующее число групп со средним размером опухоли 200-300 мм3. Затем мышей лечили требуемым количеством соединения по изобретению, и объемы опухолей измеряли дважды в неделю. Животных умерщвляли, после того как средний объем опухоли достигал у них 2000 мм3. После умерщвления, опухоли взвешивали и сохраняли для дальнейших гистологических исследований. Эффективность лечения оценивали измерением разности объемов опухолей у группы, получавшей лечение, в сравнении с контрольной группой. Результаты представлены в виде %T/C, где %T/C рассчитывали как: %T/C = (Vt-V0)/(Ct-C0)×l00, где V0 и Vt представляли собой средние объемы опухолей групп лечения в начале и при умерщвлении мышей группы. C0 и Ct представляли собой средние объемы опухолей контрольной группы в начале и при умерщвлении мышей группы (таблица 7).
Пример 6
Иллюстративные соединения [VEGF-Пептида]-[Линкера] показаны в таблице 9, а иллюстративные соединения [VEGF-Пептида]-[Линкера]-Антитела показаны в таблице 10.
Пример 7
Анализ связывания VEGF с пептидом
Высоко связывающие полулуночные 96-луночные планшеты (Costar #3690) покрывали рекомбинантным человеческим VEGFR2/Fc (50 нг/лунку) в 50 мкл PBS, и инкубировали при 4°C в течение ночи. После промывания планшета три раза IX промывным буфером (KPL Cat#50-65-00) и блокирования Superblock (Scytek #AAA500) при комнатной температуре (КT) в течение 1 часа, VEGF-пептиды по изобретению серийно разбавляли (концентрации: 0,128-10000 нМ) в присутствии 25 нг/мл рекомбинантного человеческого VEGF-165 в 50 мкл Superblock, и затем добавляли в 96-луночные планшеты и инкубировали при КT в течение 1 часа. Все пептиды по изобретению, тестированные таким образом, были кэппированы на амино конце соединением C(O)CH3, а на карбоксильном конце - группой NH2. Затем планшеты промывали три раза промывным буфером и добавляли разведенное (1:500) биотинилированное антитело против человеческого VEGF (R&D systems, Cat# BAF293) и инкубировали при КT в течение 2 часов. После промывания планшета, добавляли конъюгат стрептавидина-HRP (1:200 в Superblock) (R&D systems, Cat# DY998) для выявления связанного антитела против VEGF с последующим добавлением субстрата тетраметилбензидина (TMB) (Pierce, Cat# 34021) для развития цвета. Реакцию останавливали 2M H2SO4. OD450 измеряли с использованием SpectraMax (Molecular Device) с коррекцией длины волн 540 нМ. Данные анализировали с использованием программного обеспечения Prism. Величины OD450 наносили на график как функцию концентраций VEGF-пептидов. Величины IC50, указывающие на активность VEGF-пептидов в отношении ингибирования взаимодействия VEGF-VEGFR2, получали с использованием подгонки к сигмовидной кривой зависимости реакции от дозы в программном обеспечении Prism. Результаты анализов связывания VEGF показаны в таблицах 1 и 2 (в таблице 1 представлены VEGF-Пептиды с V12 (за исключением, SEQ ID NO:34), в таблице 2 представлены VEGF-пептиды с E12). В таблицах 1 и 2 указаны соединения по изобретению, тестированные материнской SEQ ID NO, хотя N' и C' концы тестированных соединений были кэппированы, как описано выше. Не все соединения были тестированы в одном и том же случае: величины IC50, указанные в скобках, были нормализованы.
Пример 8
Связывание пептидов
Раствор линкера (как показано в примере 4) (0,1 г, 0,3 ммоль), HBTU (O-Бензотриазол-N,N,N',N'-тетраметилуроний-гексафторфосфат) (0,11 г, 0,3 ммоль) в безводном DMF (Диметилформамиде) (2 мл) охлаждали до 2-5°C в ледяной бане в атмосфере аргона. NMM (N-метилморфолин) (0,12 г, 0,9 ммоль) вводили через шприц и перемешивали в течение 5 минут. Холодный раствор другого Пептида (SEQ ID NO:64) (0,24 г, 0,1 ммоль) в безводном DMF (2 мл) добавляли в первый реакционный сосуд и перемешивали в течение 30 минут. После завершения реакции по данным мониторинга LCMS (жидкостной хроматографией/масс спектрометрией), добавляли воду (1 мл) и реакционную смесь очищали, используя HPLC (ВЭЖХ, высокоэффективную жидкостную хроматографию) для получения чистого продукта (145 мг) с массой 2785. На чертеже ниже, изображены полные структуры ненатуральных аминокислот и остатков, включающие любое связывание, отличное от связывания пептидов. Так, показан N обоих цистеинов. Другие Соединения по изобретению были образованы ковалентной связью.
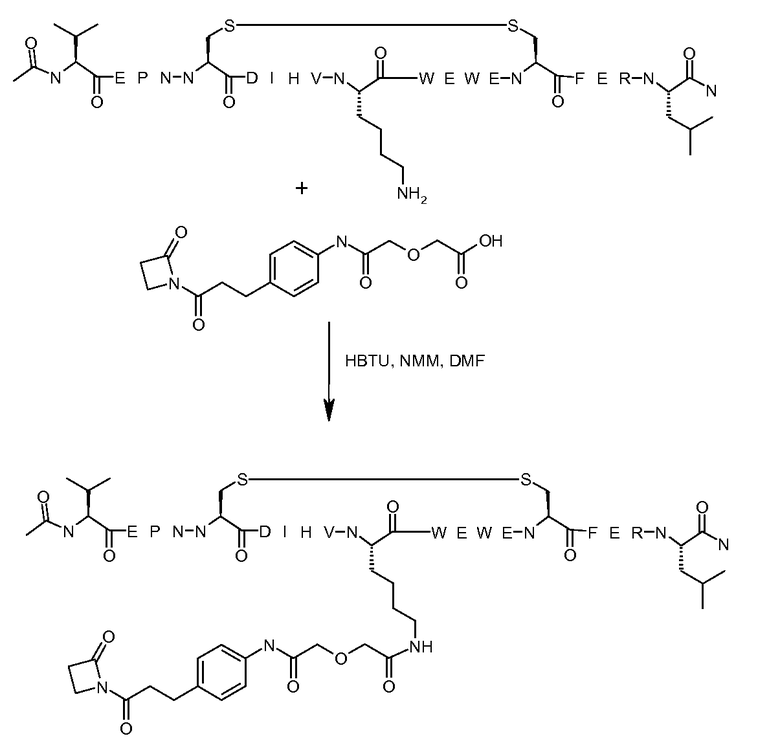
Пример 9
Ковалентное связывание части, включающей [Пептид]-[Линкер], с [Антителом]
Программирование и очистка комплексов [Пептид]-[Линкер]-[Антитело]
Связанные пептиды программировали в отношении 3:1 с h38C2 при комнатной температуре в течение ночи. Полученные макромолекулы [Пептида]-[Линкера]-[Антитела] очищали обессоливающими колонками PD-10. Конфигурации белка измеряли УФ A280. Макромолекулы [Пептида]-[Линкера]-[Антитела] характеризовали анализом LCMS для определения эффективности программирования.
Пример 10
Анализы фармакокинетики у мышей (ELISA в обращенном формате)
Фармакокинетические исследования проводили с использованием самцов мышей Swiss Webster (CFW, Charles Rivers Hollister, CA) с массой тела приблизительно 20-22 грамм в начале введения. Комплексы [VEGF-Пептид]-[Линкер]-[Антитело] вводили внутривенно через хвостовую вену, образцы крови брали у 3 мышей на точку времени забором из ретроорбитального синуса в следующие точки времени: 0,08, 0,5, 1, 3, 5, 7 и 24 часа. Для точек времени до 32 часов, мышей наркотизировали изофлюраном и объемы взятой крови не превышали 0,1 мл/забор крови. Для остальных точек времени (32-120 ч), мышей умерщвляли ингаляцией CO2 и конечные образцы крови отсасывали из сердца. Смесь ингибиторов протеазы добавляли во все пробирки для крови перед взятием образцов. Крови давали возможность свернуться на льду в течение 30 минут и затем центрифугировали при 12000 об/мин в течение 5-10 минут при 4°C для сбора сыворотки и сразу хранили при -80°C до анализа посредством ELISA. Вводимые растворы использовали для установления стандартных кривых для анализа образцов сыворотки анализом VEGF с использованием ELISA в обращенной фазе. Аликвотные количества каждого образца сыворотки анализировали или анализом VEGF с использованием ELISA в обращенной фазе (также описанным в настоящей заявке как ELISA с покрытием IgG), или анализом VEGF с использованием ELISA (ELISA с покрытием VEGF).
Анализ VEGF с использованием ELISA в обращенной фазе
Высоко связывающие полулуночные 96-луночные планшеты (Costar #3690) покрывали козьим античеловеческим IgG в разведении 1:100 в покрывающем буфере (набор ELISA Bethyl Laboratories, Cat# E80-104) при 4°C в течение ночи. После промывания планшет три раза промывным буфером IX (KPL Cat#50-65-00) и блокирования Superblock (Scytek #AAA500) при комнатной температуре (КT) в течение 1 часа, полученные стандарты раствора для введения (диапазон: 3,91-500 нг/мл) и образцы сыворотки добавляли в планшет и инкубировали в течение 1 часа на планшетном вибростенде для обеспечения возможности связывания комплексов [VEGF-Пептид]-[Линкер]-[Антитело] с планшетами. Затем добавляли фиксированную концентрацию VEGF (3 нМ) и инкубировали в течение 1 часа на планшетном вибростенде. Затем планшеты промывали три раза промывным буфером, и добавляли разведенное (1:500) биотинилированное антитело против человеческого VEGF (R&D systems, Cat# BAF293) и инкубировали при КT в течение 2 часов. После промывания планшетов, добавляли конъюгат стрептавидина HRP (1:200 в Superblock) (R&D systems, Cat# DY998) для выявления связанного антитела против VEGF, с последующим добавлением субстрата тетраметилбензидина (TMB) (Pierce, Cat# 34021) для развития цвета. Реакцию останавливали 2M H2SO4. OD450 измеряли с использованием SpectraMax (Molecular Device) при длине коррекционных волн 540 нм. Сывороточные концентрации комплексов [VEGF-Пептид]-[Линкер]-[Антитело] рассчитывали с использованием стандартных кривых. Сывороточные концентрации соединения, по данным определения с использованием ELISA, наносили на график как функцию времени. Дальнейший анализ данных предпринимали с использованием программного обеспечения WinNonlin в версии 4.1 (Pharsight Corporation) для определения периода полувыведения β (T1/2) и площади под кривой (AUC) для комплексов [Пептид]-[Линкер]-[Антитело].
Анализ VEGF с использованием ELISA
Высоко связывающие полулуночные 96-луночные планшеты (Costar #3690) покрывали rhVEGF165 (6,25 нг/лунку) в 50 мкл PBS/лунку и инкубировали при 4°C в течение ночи. После промывания планшет три раза промывным буфером IX (KPL Cat#50-65-00) и блокирования Superblock (Scytek #AAA500) при комнатной температуре (КT) в течение 1 часа, полученные стандарты раствора для введенияp (диапазон: 3,91-500 нг/мл) и образцы сыворотки добавляли в планшет и инкубировали в течение 1 часа для обеспечения возможности связывания комплексов [VEGF-Пептид]-[Линкер]-[Антитело] с покрытым VEGF на планшетах. Затем планшеты промывали три раза промывным буфером, добавляли разведенный козий античеловеческий IgG-HRP (1:5000) (Bethyl A80-104P-52) и инкубировали при КT в течение 1 часа с последующим добавлением субстрата тетраметилбензидина (TMB) (Pierce, Cat# 34021) для развития цвета. Реакцию останавливали 2M H2SO4. OD450 измеряли с использованием SpectraMax (Molecular Device) при длине коррекционных волн 540 нм. Сывороточные концентрации комплексов [VEGF-Пептид]-[Линкер]-[Антитело] рассчитывали с использованием стандартных кривых. Сывороточные концентрации комплексов [VEGF-Пептид]-[Линкер]-[Антитело], по данным определения с использованием ELISA, наносили на график как функцию времени. Дальнейший анализ данных предпринимали с использованием программного обеспечения WinNonlin в версии 4.1 (Pharsight Corporation) для определения периода полувыведения β (T1/2) и площади под кривой (AUC) для комплексов [VEGF-Пептид]-[Линкер]-[Антитело].
В таблице 3 показано связывание серии комплексов [VEGF-Пептид]-[Линкер]-[Антитело]. Часть, содержащая [VEGF-Пептид] каждого комплекса была основана на SEQ ID NO:34, и с одним из остатков из X1 до X19, замещенных K в качестве связывающего остатка, за исключением C5 и C15. В каждом случае, [VEGF-Пептид] кэппировали на амино конце группой C(O)CH3 и на карбокси конце = группой NH2. Часть [Линкер] каждого комплекса представляла собой часть, изображенную в примере 4. Часть [Антитело] каждого комплекса представляла собой h38C2, содержащее SEQ ID NO:1 и SEQ ID NO:2. В таблице 6 также показаны данные периода полувыведения для определенных комплексов [VEGF-Пептид]-[Линкер]-[Антитело], а также данные, представляющие площадь под кривой (AUC). Данные AUC представляют общую площадь под кривой с учетом и α-периода полувыведения и β-периода полувыведения.
В таблице 4 показано связывание серии комплексов [VEGF-Пептид]-[Линкер]-[Антитело]. Часть, содержащая [VEGF-Пептид] каждого комплекса была основана на указанной SEQ ID NO, и при указанном остатке, замещенном K, в качестве связывающего остатка. В каждом случае, [VEGF-Пептид] кэппировали на аминоконце группой C(O)CH3 и на карбокси конце = группой NH2. Остатки 1-18 пептидов не изображены в таблице 4, но представляли собой, как описано в других местах, за исключением соответствующего замещения связывающего остатка (в каждом случае этих вариантов осуществления, связывающий остаток представляет K). Часть [Линкер] каждого комплекса представляла собой ту, которая изображена в примере 4. Часть [Антитело] каждого комплекса представляла собой h38C2, содержащая SEQ ID NO:1 и SEQ ID NO:2. В таблице 4 также показаны некоторые данные периодов полувыведения для определенных комплексов [VEGF-Пептид]-[Линкер]-[Антитело]. Результаты были получены и по ELISA VEGF, и по ELISA VEGF в обращенной фазе (результаты показаны в скобках).
Пример 11
Синтез соединений по изобретению формулы: [Ang2-Пептид]-[Соединитель]-[VEGF- Пептид] показан фиг. 8-10.
Пример 12
Иллюстративные соединения по изобретению формулы: [Ang2-Пептид]-[Соединитель]-[VEGF- Пептид] показаны в таблице 11.
Пример 13
В таблице 12 показаны иллюстративные соединения по изобретению формулы:
([Ang2-Пептид]-[Соединитель]-[VEGF- Пептид]) 1 или 2
│
[Антитело]
Пример 14
Соединения примера 13 тестировали на связывание VEGF (IC50), T1/2 VEGF, связывание Ang2 (IC50) и T1/2 Ang2. Способы тестирования представляли собой, как описано выше. Результаты показаны в таблице 8. Соединения по изобретению, иллюстрируемые в примере 13, содержат фиксированное соотношение [Ang-2-Пептида] и [VEGF-Пептида]. Отмечено, что уровни циркулирующего Ang-2 примерно в 10 раз выше, чем уровни циркулирующего VEGF у пациентов при раке предстательной железы (2,5 нг/мл Ang-2 и 0,2 нг/мл VEGF) и молочной железы (2 нг/мл Ang-2 и 0,3 нг/мл VEGF) (См. European Journal of Clinical Investigation (2003) 33, 883-890). Очевидно, что некоторые соединения изобретения (например, см. пример 14) демонстрируют большое разнообразие IC50 связывания и периодов полувыведения in vivo и Ang2, и VEGF относительно друг друга внутри одной и той же молекулы, а также относительно других молекул. Таким образом, для определенных видов применения, может быть желательным использование соединения, чье сродство к Ang2 примерно в 3-15 раз выше, чем сродство связывания с VEGF, с тем, чтобы обеспечить возможность достижения больших циркулирующих количеств соответствующих мишеней. Естественно, различные виды терапевтического применения могут потребовать или обеспечить возможность применения или благоприятствовать применению различных соединений по изобретению.
Например, Соединение 6053 проявило KD 3E-10 в отношении связывания VEGF и KD 9E-11 в отношении связывания Ang-2 в анализе Biacore. Более высокое сродство связывания с Ang-2 может иметь преимущества, поскольку сообщалось, что концентрация Ang-2 в плазме выше у определенных пациентов, страдающих раком. Соединение 6053 проявляет одинаковую IC50 ингибирования VEGF (0,7 нМ) и IC50 ингибирования Ang-2 (0,6 нМ). Кроме того, устойчивость (T1/2) у мышей компонентов и [Ang2-Пептид], и [VEGF- Пептид] Соединения 6053 очень похожа. Проводили последующий сравнительный анализ Соединения 2018, Соединения 4043 и Соединения 6053 (таблица 8).
Фармакология in vivo
Противоопухолевую активность Соединения 6053 оценивали на моделях ксенотрансплантации человеческих опухолей. Ксенотрансплантаты индуцировали подкожной (SC) имплантацией опухолевых клеток 5-7-недельным самкам мышей nu/nu и давали возможность осуществить рост до объема 200~400 мм3 перед началом лечения. После завершения начального роста опухолей, мышей методом рандомизации распределяли по группам лечения с идентичными объемами опухолей (n=9-10/группу), и лечение Соединением 6053 проводили 1 раз в неделю внутрибрюшинной (IP) инъекцией. При исследованиях комбинации, дополнительные противораковые средства вводили или еженедельно IP инъекцией, или ежедневно пероральным введением (PO), при лечении, начинающемся одновременно с Соединением 6053. Объемы опухолей измеряли один или два раза в неделю с использованием штангенциркуля, и массу тела измеряли еженедельно в течение периода лечения. В некоторых исследованиях, всех мышей умерщвляли асфиксией CO2, и опухоли иссекали после достижения опухолью объема 2000 мм3 в контрольной группе, получавшей лечение носителем. В исследованиях псевдо-выживания, мышей умерщвляли асфиксией CO2, и опухоли иссекали, взвешивали и обрабатывали для дальнейшего гистологической и/или иммуногистохимической оценки, после того как средний объем опухоли в каждой группе лечения превышал 2000 мм3.
Пример 15
Исследования одного средства
Эксперимент, проведенный на модели ксенотрансплантата Colo205 (аденокарциномы ободочной кишки человека) иллюстрируется на фиг. 11. Введение Соединения 6053 один раз в неделю зависимо от дозы ингибировало рост опухоли Colo205. В 35-й день, Соединение 6053 в дозе 3 мг/кг (IP, 1 раз/нед) привело к значительному снижению роста опухоли (-30%), тогда как в дозе 10 или 30 мг/кг (IP, 1 раз/нед) наблюдалось значительное снижение роста опухоли (-50%) по сравнению с контролями, получавшими лечение носителем. Лечение Соединением 6053 в дозе 10 или 30 мг/кг также привело к стойкому ингибированию опухоли, по сравнению с контрольной группой. Лечение Соединением 6053 не воздействовало на прибавку массы тела (данные не показаны), и в течение всего исследования представлялось, что мыши находятся в хорошем состоянии здоровья.
В 35-й день мышей, получавших лечение носителем, и половину мышей из каждой группы, получавшей лечение Соединением 6053, умерщвляли, и опухоли иссекали и моментально замораживали. Для оценки анти-ангиогенного эффекта Соединения 6053, плотность опухолевых микрососудов оценивали иммуногистохимически на замороженных срезах ксенотрансплантатов аденокарциономы ободочной кишки человека Colo205 после лечения носителем или Соединением 6053. Опухоли окрашивали специфичным мышиным моноклональным антителом к CD31, и иммунореактивность количественно определяли по пяти зонам 3 срезов из каждой опухоли. Плотность опухолевых микрососудов была значительно снижена (~44%) лечением Соединением 6053 (30 мг/кг, 1 раз/нед), в сравнении с группой, получавшей лечение носителем (фиг. 12), подтверждая анти-ангиогенную активность молекулы.
В независимом исследовании ксенотрансплантатов Colo205, введение 1 раз/нед Соединения 6053 снова зависимо от дозы ингибировало рост опухоли Colo205. В дозе 30 мг/кг в неделю, Соединение 6053 привело к значительному снижению (~70%) роста опухоли в 28-й день, по сравнению с контролями, получавшими лечение носителем (умерщвленными асфиксией CO2 (фиг. 13). Получали срезы иссеченных опухолей и окрашивали гематоксилином и эозином (H&E), и жизнеспособную зону опухоли оценивали, используя стандартные компьютерные способы и программное обеспечение анализа изображения. Жизнеспособную зону опухоли определяли для 4 срезов из каждой опухоли, и среднюю величину этих измерений затем умножали на объем опухоли в конце исследования для получения показателя объема жизнеспособной ткани каждой опухоли. Данные об объеме жизнеспособной ткани опухоли из эксперимента с использованием ксенотрансплантатов аденокарциномы ободочной кишки Colo205 показаны на фиг. 14. У мышей, получавших лечение Соединением 6053 в дозе 10 мг/кг и 30 мг/кг, объем жизнеспособной ткани опухоли значительно уменьшился соответственно на ~60% и ~76%, по сравнению с группой, получавшей лечение носителем.
Для исследования того, нацеливается ли Соединение 6053 и на Ang2, и на VEGF in vivo, воздействия Соединения 6053 на экспрессию Ang2 и уровни фосфорилированного VEGFR2 (pVEGFR2) оценивали с использованием иммунофлюоресценции в ксенотрансплантатах опухолей Colo205 после лечения носителем или Соединением 6053. Замороженные срезы этих опухолей окрашивали меченым FITC (флюоресцеин-изотиоцианатом) моноклональным антителом против Ang2, и количественное определение иммунореактивности Ang2 осуществляли по 3 изображениям 1 среза из каждой опухоли. Иммунореактивность Ang2 была значительно снижена на ~70% в группах, леченных Соединением 6053 (10 и 30 мг/кг), в сравнении с группой, леченной носителем (фиг. 15). Замороженные срезы этих опухолей также подвергали двойному окрашиванию меченым FITC антителом против VEGFR и меченым родамином антителом против pVEGFR2, и иммунореактивность pVEGFR2 количественно определяли по 3 изображениям 1 среза из каждой опухоли и выражали в виде процентной доли общей иммунореактивности VEGFR2 (pVEGFR2/VEGFR2). pVEGFR2/VEGFR2 была значительно снижена лечением Соединением 6053 зависимым от дозы образом, в сравнении с группой, леченной носителем, причем снижение составило соответственно ~43% и ~70% в дозе 10 и 30 мг/кг (фиг. 16). Эти данные демонстрируют, что Соединение 6053 воздействует на пути и Ang2, и VEGF на модели ксенотрансплантата Colo205.
Противоопухолевую активность Соединения 6053 также оценивали на модели ксенотрансплантата карциномы молочной железы MDA-MB-435 и на модели ксенотранспланта карциномы кожи A431. Введение Соединения 6053 1 раз в неделю (30 мг/кг IP) привело к значительному снижению на 45% (68-й день) роста опухоли на модели MDA-MB-435 (фиг. 17A), и значительное снижение на 54% (35-й день) роста опухоли модели A431 (фиг. 17B). Таким образом, Соединение 6053 демонстрирует значимую противоопухолевую активность на трех различных моделях ксенотрансплантатов опухолей человека.
Дальнейшие исследования одного средства проводили с Соединениями 2018, 2036, 2049, 2071, 4043 и 6053, и они показаны на фиг. 23-28.
Пример 16
Исследования комбинаций
Противоопухолевую активность Соединения 6053 далее оценивали в исследованиях комбинированного лечения, проводимых на модели ксенотрансплантата Colo205, включающих противоопухолевую эффективность Соединения 6053 (10 мг/кг IP, 1 раз в неделю) отдельно и в комбинации с 5-фторурацило (5-FU, фиг. 18), Иринотеканом (фиг. 19), Таксотере (фиг. 20), Сунитинибом (фиг. 21) и Акситинибом (фиг. 22). Комбинация Соединения 6053 с этими химиотерапевтическими средствами (5-FU, Иринотеканом, Таксотере) или множественными испытанными ингибиторами тирозин-киназы (Сунитинибом, Акситинибом) привела к значительно большему ингибированию скорости роста опухоли, чем любая из монотерапий отдельно (p<0,05 двусторонним ANOVA с множественным критерием сравнения Бонферрони). В комбинированном исследовании Соединения 6053 + Таксофере (фиг. 17), одна опухоль вышла за пределы очерченного объема (достигнутый объем опухоли > 2000 мм3 в 57-й день, требующий эвтаназии), и поэтому была исключена из анализа. В заключение, эти данные обеспечивают превосходное преклиническое обоснование широкого применения Соединения 6053 в комбинации с множественными противораковыми терапевтическими средствами, нацеленными на механизмы действия и на опухоль, и на ангиогенез.
Резюме преклинической эффективности
Соединение 6053 ингибировало связывание человеческого Ang2 и человеческого VEGF с их родственными рецепторами с активностью в суб-наномолярных количествах и демонстрировало длительный и сбалансированный фармакокинетический профиль у преклинических видов. Соединение 6053 было эффективно в отношении множества моделей ксенотрансплантатов человеческих опухолей и обеспечило дополнительное преимущество в комбинации с множественными стандартными терапевтическими средствами, включая терапевтические средства против ангиогенеза и против опухоли, о чем свидетельствует задержка опухолевого роста и удлинение периода времени до прогрессирования. Взятые вместе, эти данные свидетельствуют о том, что высокая активность Соединения 6053 в отношении Ang2 и VEGF оказывает значительные воздействия на рост и жизнеспособность опухоли отдельно и в комбинации со стандартными химиотерапевтическими средствами.
Пример 17
Анти-ангиогенная активность при вызванной VEGF сетчаточной утечки в глазу кролика
Анти-ангиогенную активность соединений 6054, 6037 и 6044 оценивали в анализе сетчаточной утечки, вызванной VEGF, в глазу кролика. Этот анализ выполняли в трехдневном или семидневном формате. В формате 3-дневого анализа, в правый глаз каждого кролика (3 кролика/группу) инъецировали (IVT) соединение (l мг/глаз) или носитель в 0 день с последующей инъекцией (IVT) VEGF (1 мкг/глаз) в тот же глаз в следующий день или 1-ый день. В 3-ий день, флюоресцеин инъецировали IV (внутривенно) и проводили ангиографию глаза. В формате 7-дневого анализа, соединения (1 мг/глаз) инъецировали в 0 день, VEGF (1 мкг/глаз) инъецировали на 5-й, а флюоресцеин инъецировали IV на 7-й день. Кроме того, связывание и период полувыведения анализировали, как описано выше, и показано в таблице 14. В качестве ссылки, период полувыведения VEGF Соединения 6037, как указано в таблице 14, составляет приблизительно 36 часов, причем эта цифра представляет период полувыведения VEGF аналогичной молекулы, Соединения 2053 (см. таблицу 4).
После проведения флюоресцеиновой ангиографии, каждому глазу присваивали степень от 0 до 4 на основании интенсивности флюоресценции между сетчаточными сосудами, по сравнению с фоном. Степень 0 указывает на интенсивность флюоресценции между сетчаточными сосудами, эквивалентную фону, не вызванному VEGF, и представляет минимальную или отсутствующую сетчаточную утечку. Степень 4 указывает на интенсивность флюоресценции, эквивалентную вызванному VEGF фону сетчаточной утечки и указывает на обильную сетчаточную утечку флюоресцеина. При 3-дневном анализе вызванной VEGF сетчаточной утечки Соединение 6037 проявило эффективность при определении степени сетчаточной утечки 1 при дозе 1 мг/глаз (фиг. 29). Дозы 0,1 мг и 0,01 мг не проявили эффективность.
Соединения 6037, 6044 и 6054 оценивали в 7-дневном анализе утечки у кроликов. Соединение 6037 проявило эффективность в дозе 1 мг при степени 2 (фиг. 30).
Таким образом, изобретение было детально описано и проиллюстрировано со ссылкой на описанные выше репрезентативные варианты осуществления. Специалистам в данной области будет понятно, что различные модификации могут быть внесены в настоящее изобретение без отхода от его сущности и объема. Все публикации, патентные заявки и выданные патенты включены в настоящее описание путем ссылки в такой же степени как если бы каждая отдельная публикация, патентная заявка или выданный патент были определенно и отдельно указаны как полностью включенные путем ссылки. Определения, которые содержатся в тексте, включенные путем ссылки, исключаются в той степени, в которой они противоречат определениям в настоящем описании.
Понятно, что определенные признаки изобретения, которые для ясности описаны в контексте отдельных вариантов осуществления, могут быть также представлены в комбинации в одном варианте осуществления. Напротив, различные признаки изобретения, которые для краткости описаны в контексте одного варианта осуществления, могут быть также представлены отдельно или в любой подходящей субкомбинации.
В частности, предусматривается, что любое ограничение, обсужденное в отношении одного варианта осуществления изобретения, может относиться к любому другому варианту осуществления изобретения. Кроме того, любая композиция по изобретению могут применяться в любом способе по изобретению, и любой способ по изобретению может применяться для получения или для использования композиции по изобретению. В частности, любой аспект изобретения, описанный в формуле изобретения, отдельно или в комбинации с одним или более дополнительными пунктами формулы и/или аспектами описания, следует понимать как являющиеся комбинируемыми с другими аспектами изобретения, изложенными в других местах в формуле изобретения и/или описания.
Использование термина «или» в формуле изобретения предназначено для обозначения «и/или», пока нет точного указания, что он относится только к альтернативам, или альтернативы являются взаимно исключающими, хотя описание подтверждает определение, которое относится только к альтернативам и «и/или».
Пока нет иных указаний, используемый в описании неопределенный артикль может означать один или более. Используемые в описании и в формуле изобретения неопределенные артикли при применении в сочетании со словом «содержащий(ая)(ее)(ие)», могут значить один или более. Используемый в настоящей заявке термин «другой(ая)(ое)(ие)» может значить по меньшей мере второй или более.
Слова «содержит/содержащий» и слова «имеющий/включающий» при использовании в настоящем описании со ссылкой на настоящее изобретение, используются для определения присутствия указанных признаков, целых чисел, стадий или компонентов, но не предотвращает присутствие или добавление одного или боле других признаков, целых чисел, стадий, компонентов или их групп.
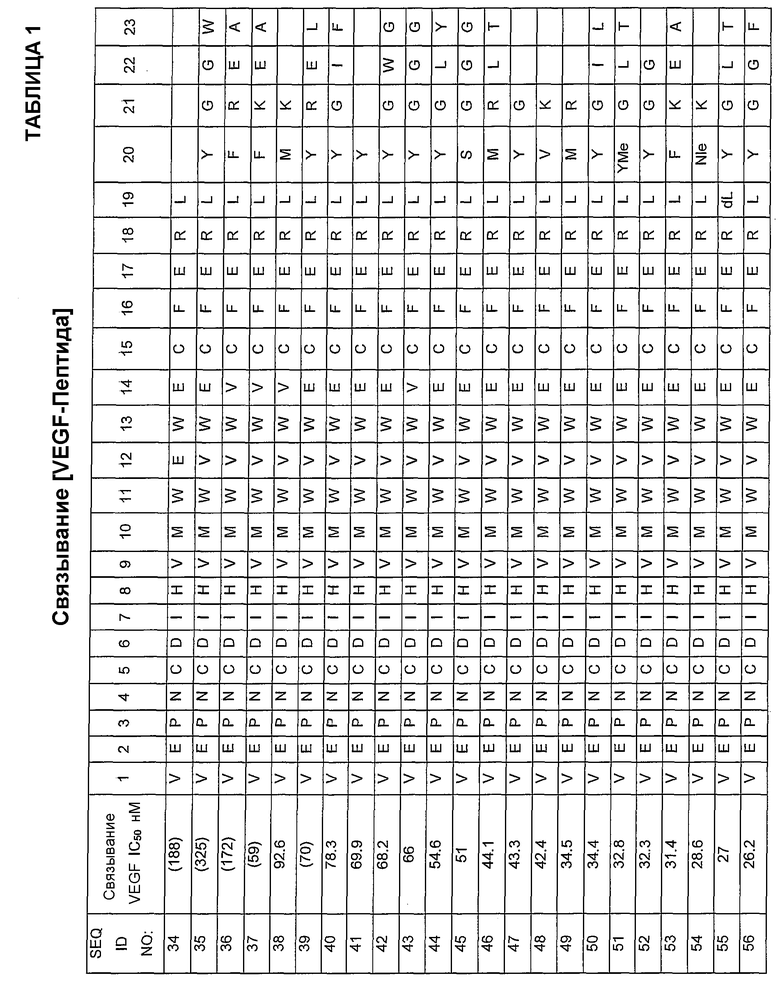
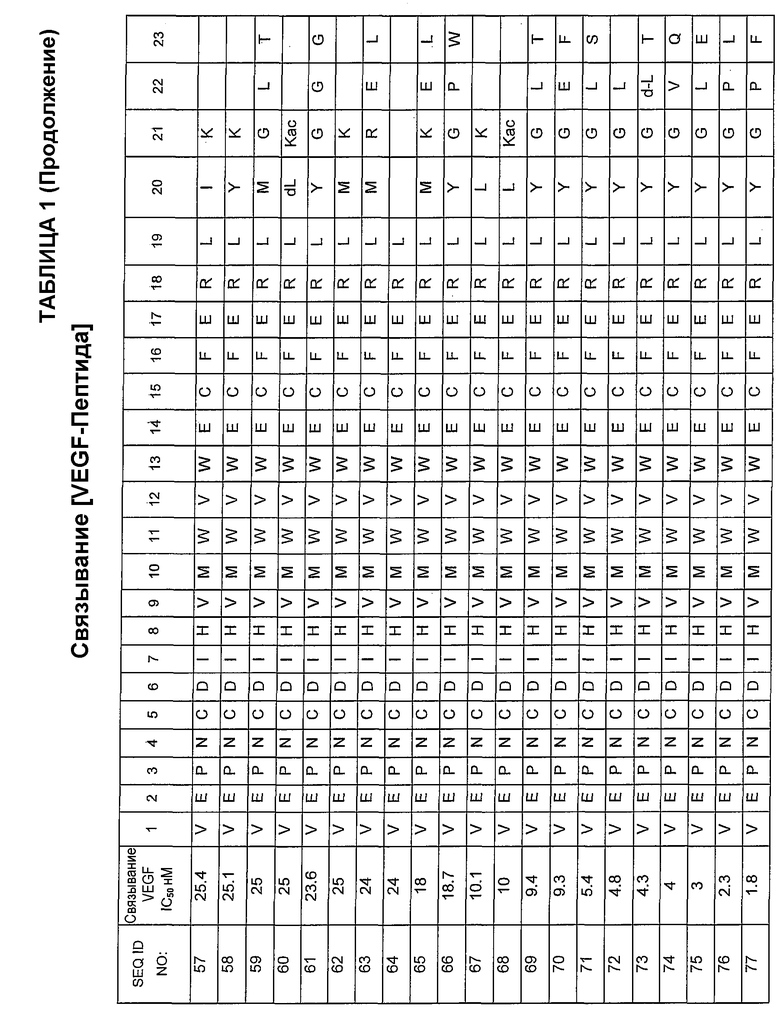
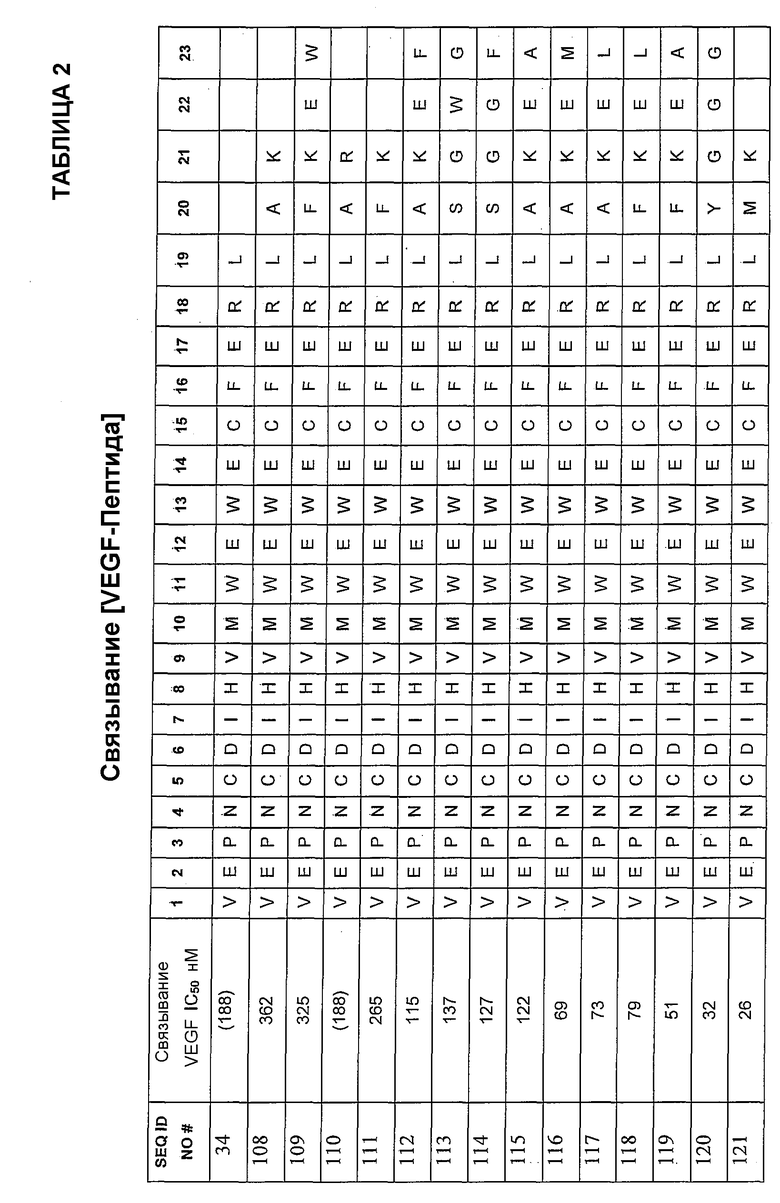
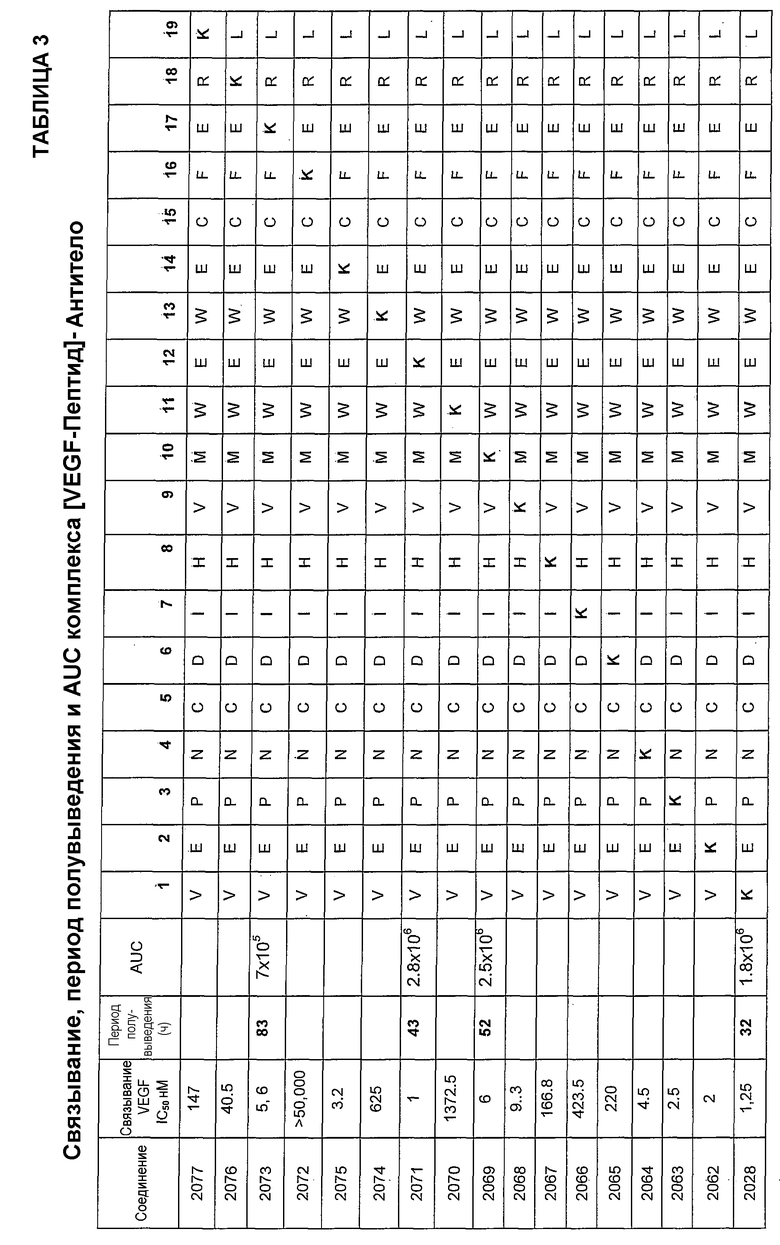
Комплекс [VEGF-Пептид]-Антитело: Связывание и период полувыведения - Связывающий остаток и модификации x
19
-X
23
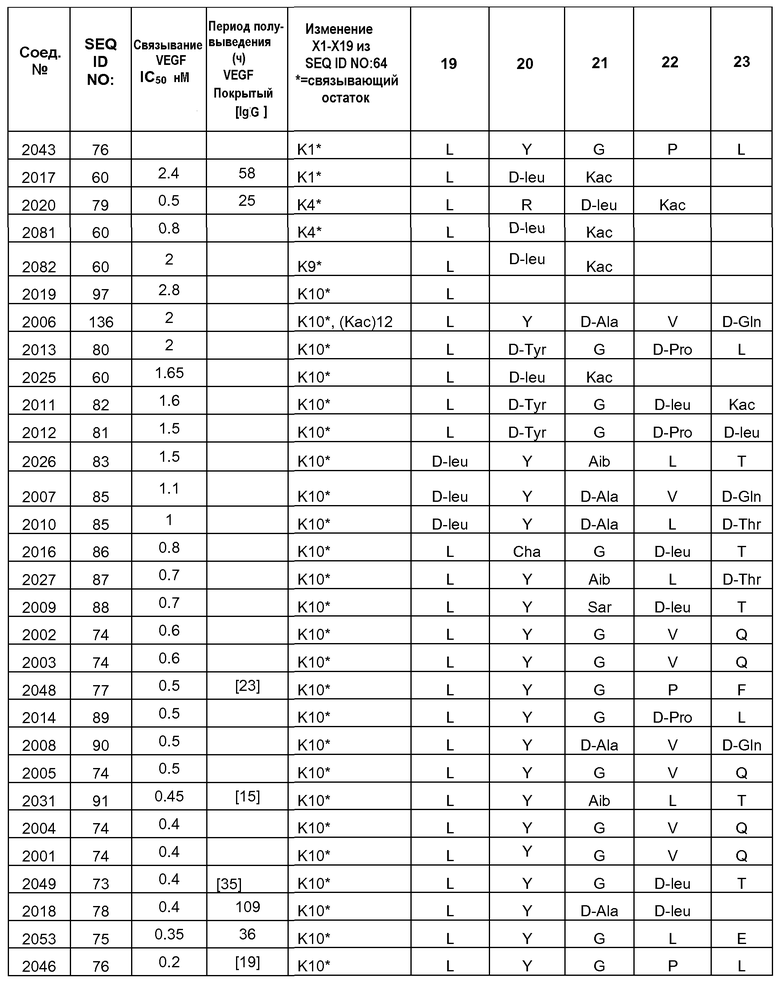
Комплекс [VEGF-Пептид]-Антитело: Связывание и период полувыведения - Связывающий остаток и модификации x
19
-X
23
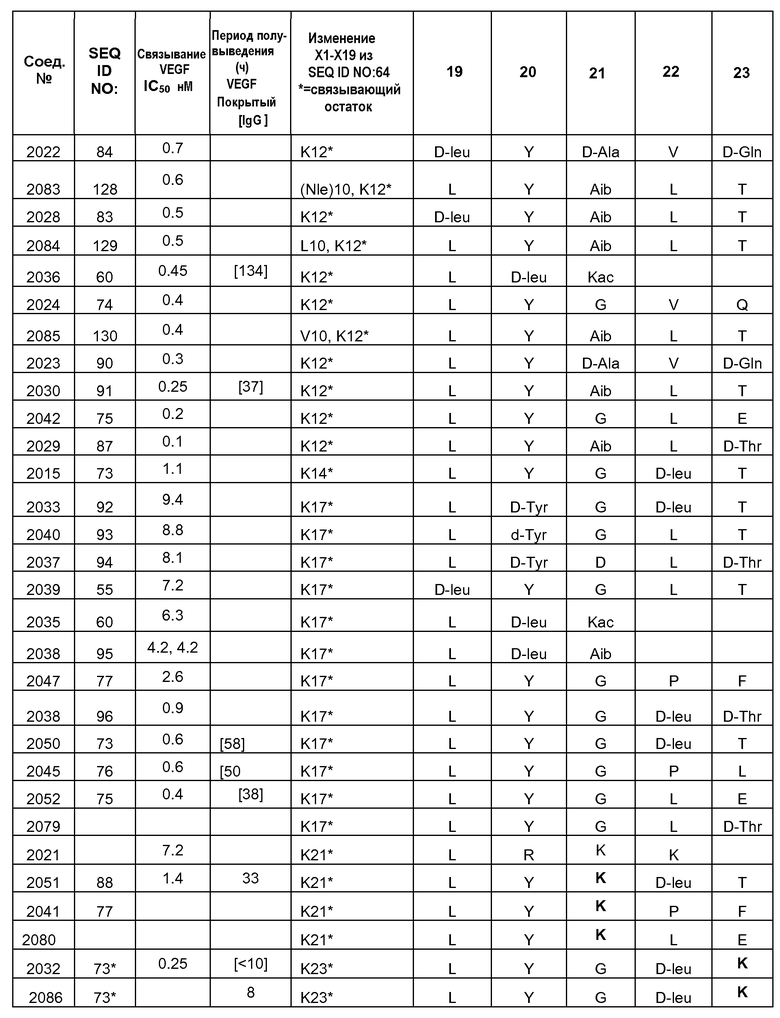
[Ang2-Петид] и Комплекс [Ang2-Петид]-Антитело: Связывание и период полувыведения
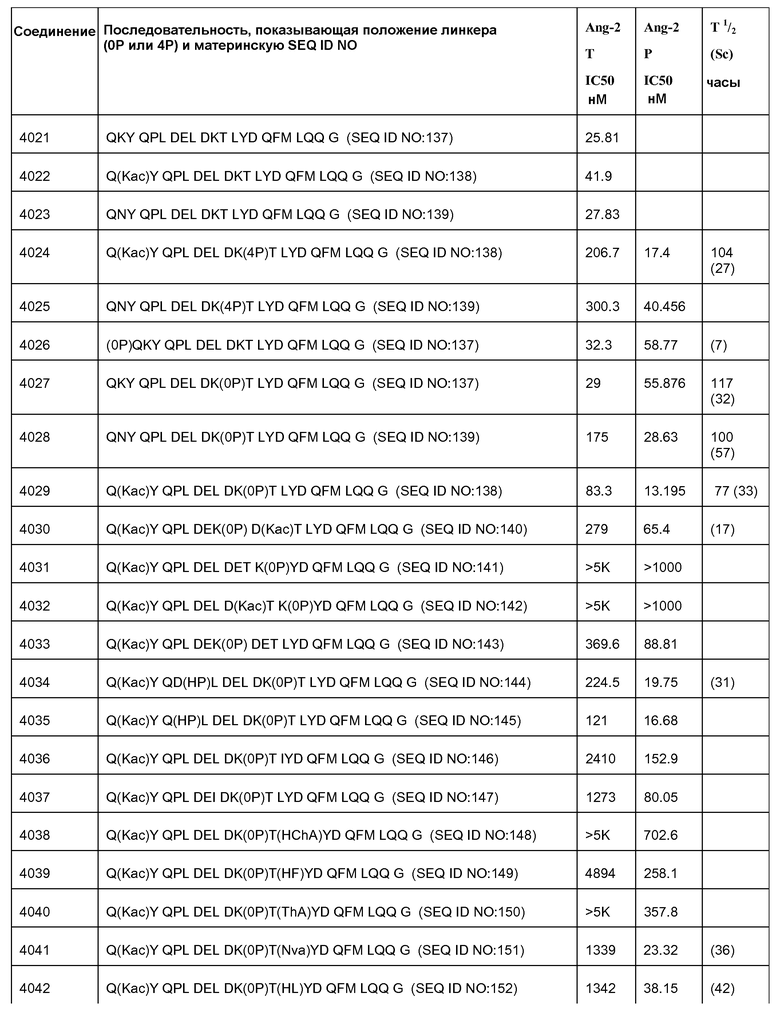
[Ang2-Петид] и Комплекс [Ang2-Петид]-Антитело: Связывание и период полувыведения
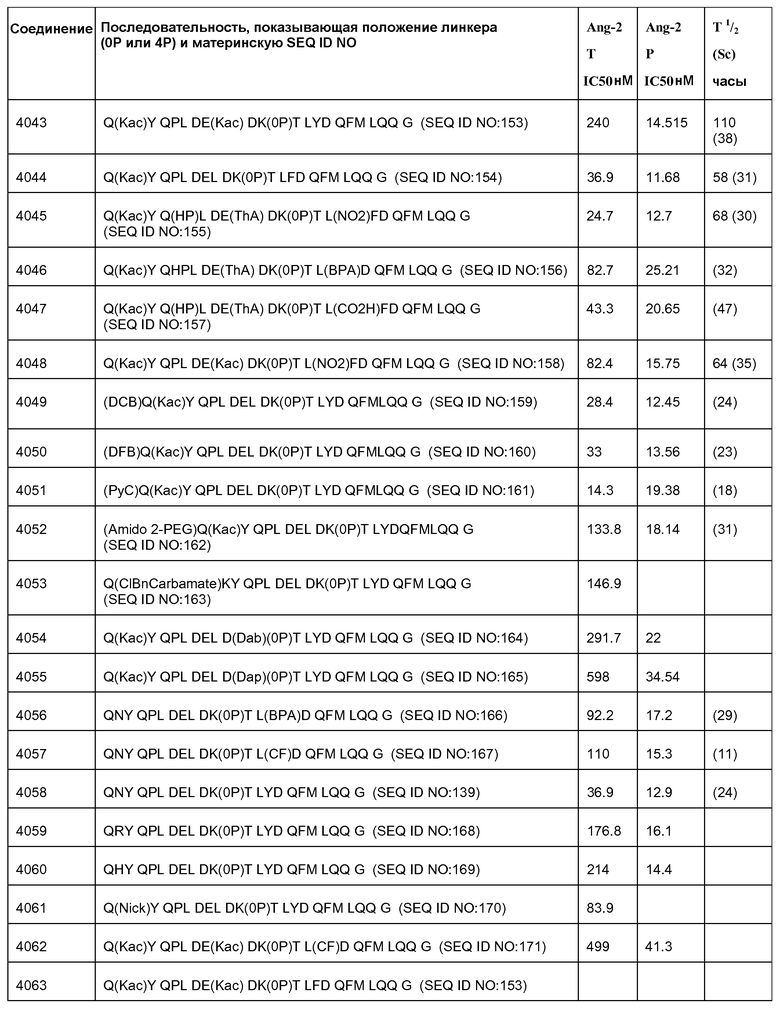
Комплекс [Ang2-Петид]-Антитело: Связывание и период полувыведения
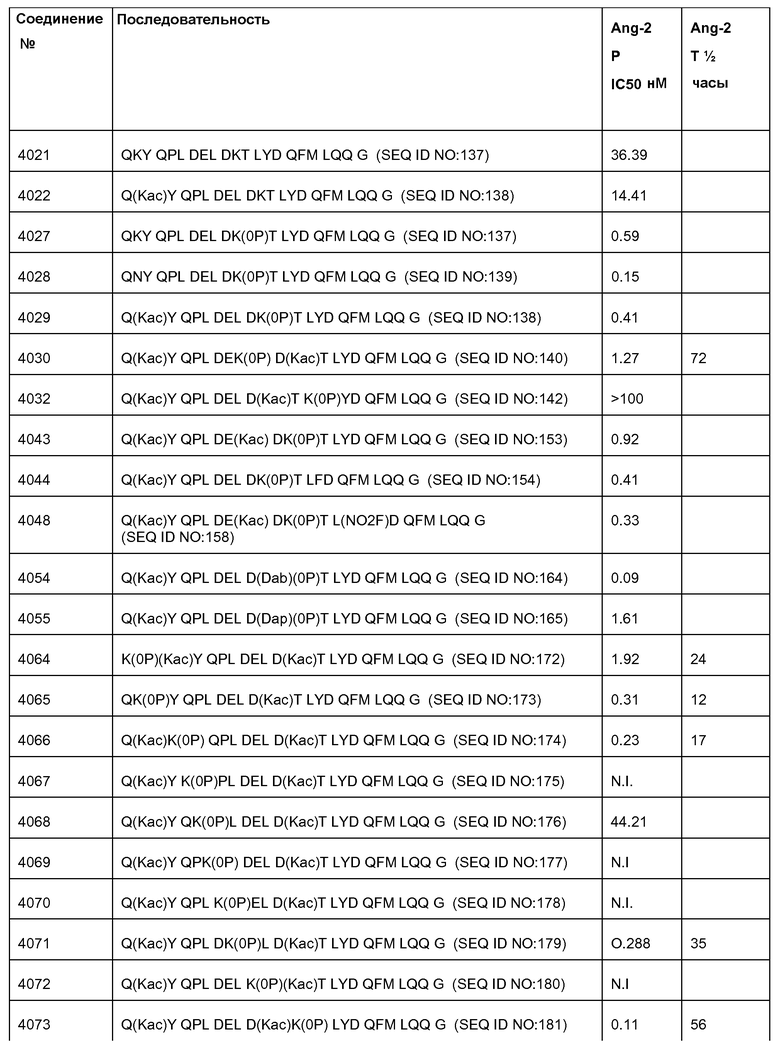
Комплекс [Ang2-Петид]-Антитело: Связывание и период полувыведения

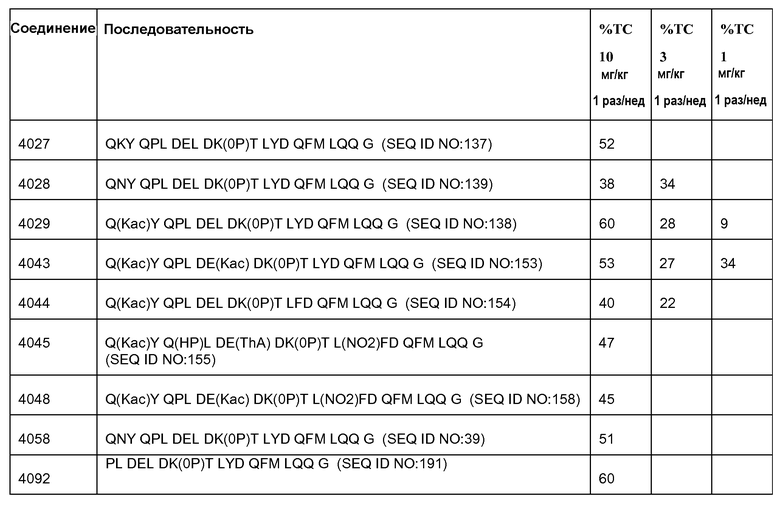
Период полувыведения (ч)
Период полувыведения (ч)
Соединения[VEGF-Пептид]-Линкер
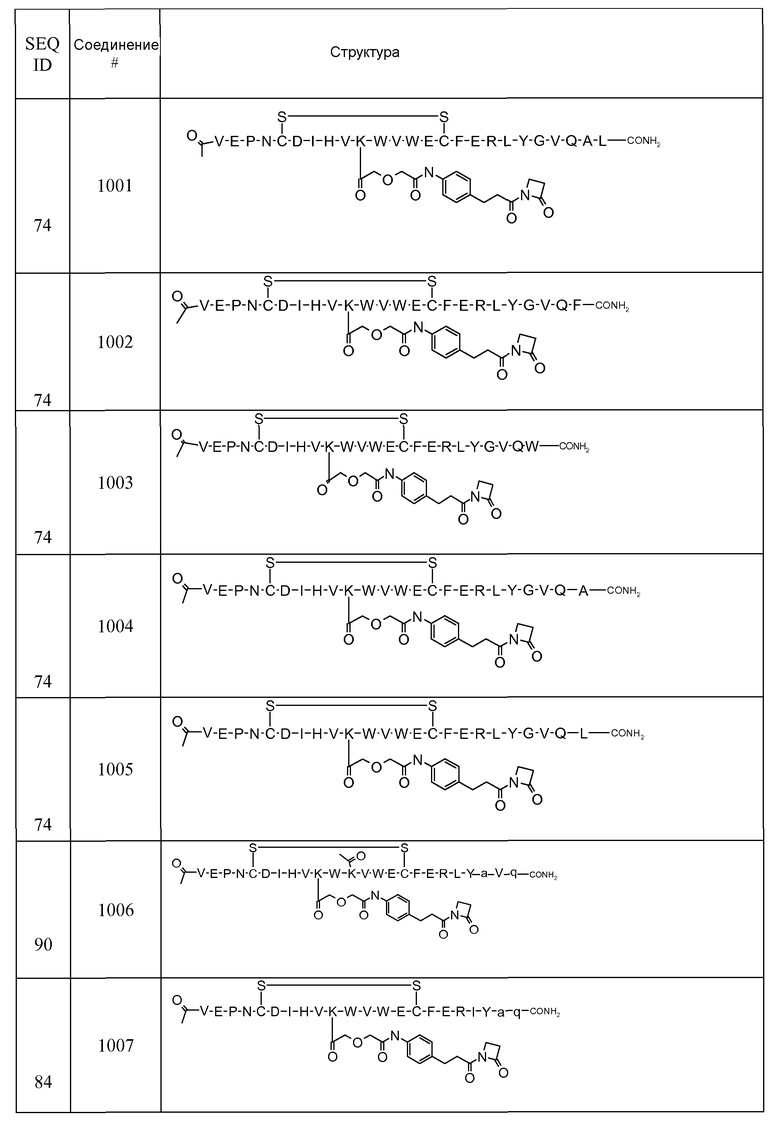
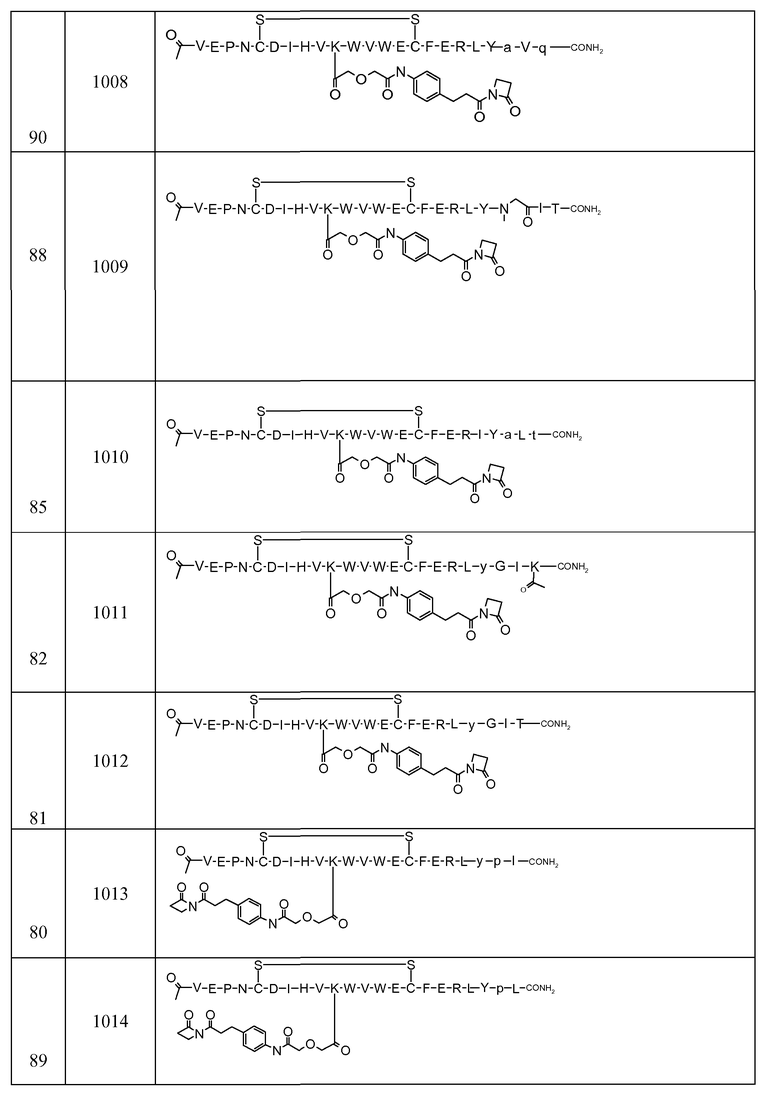
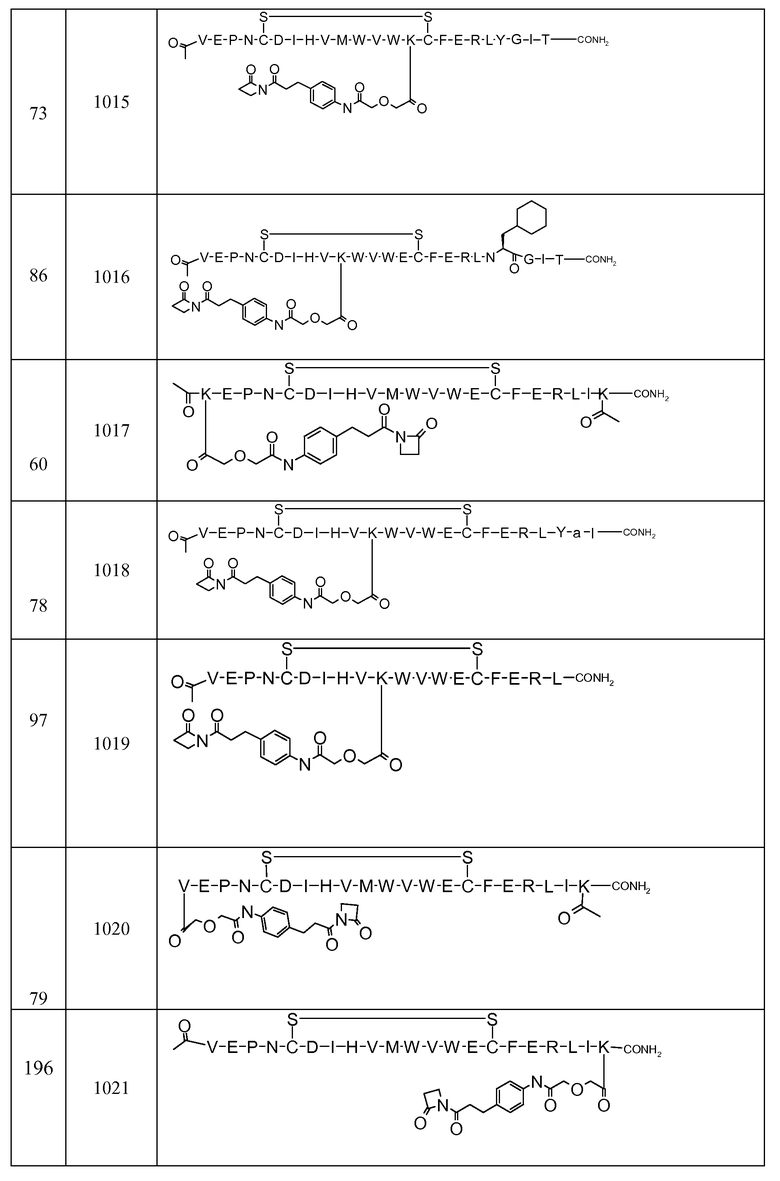
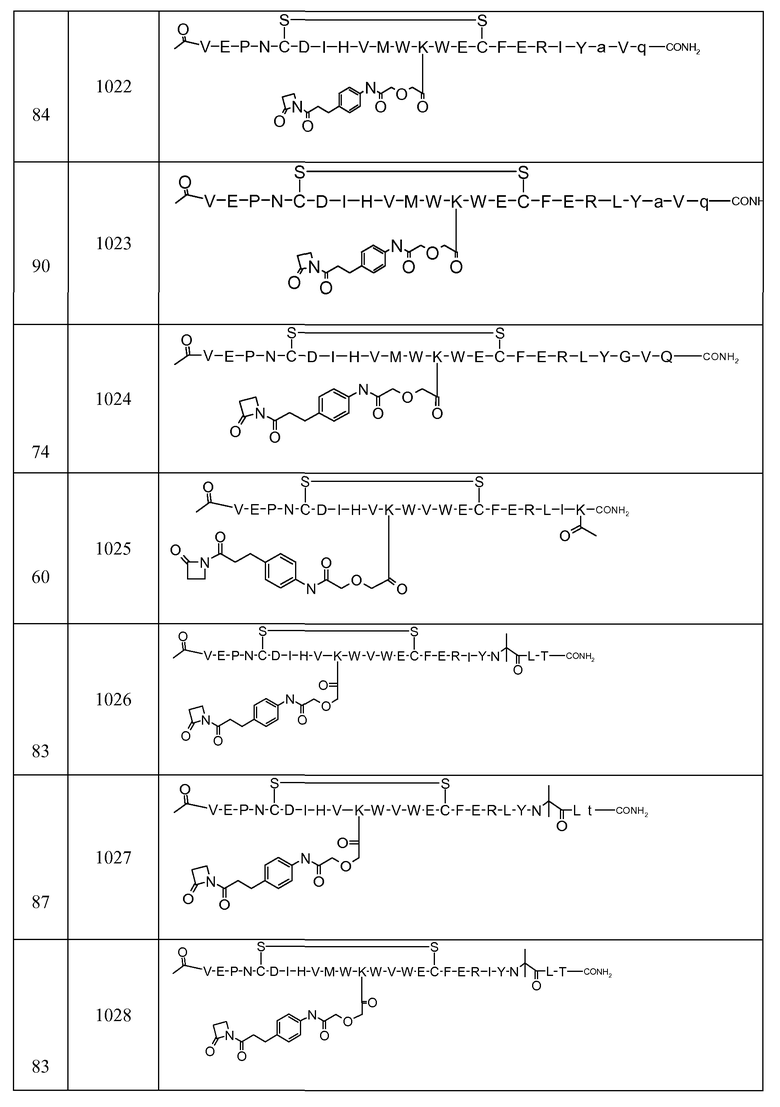
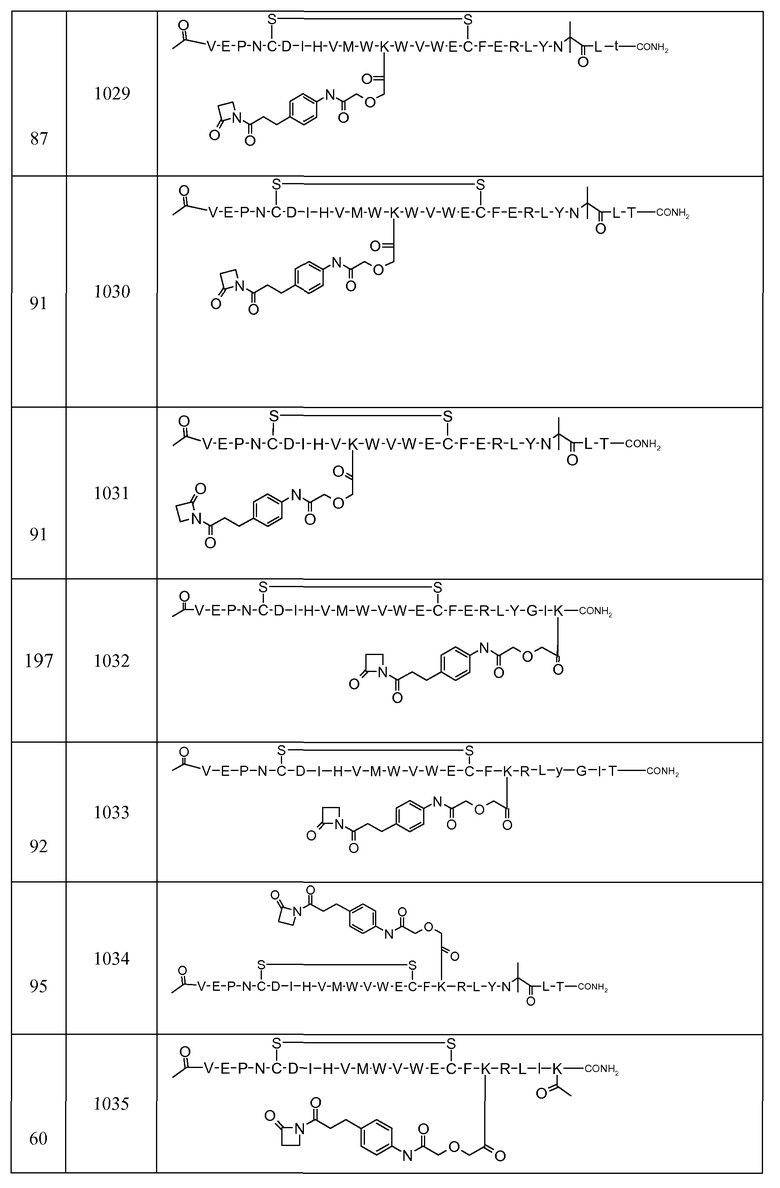
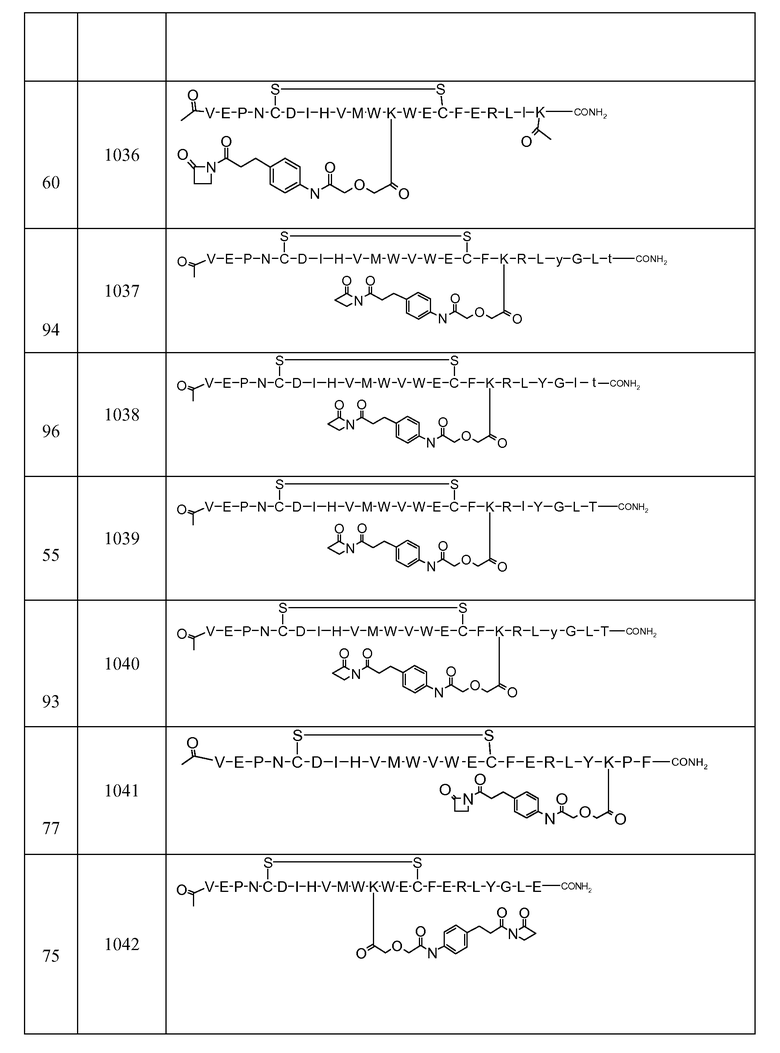
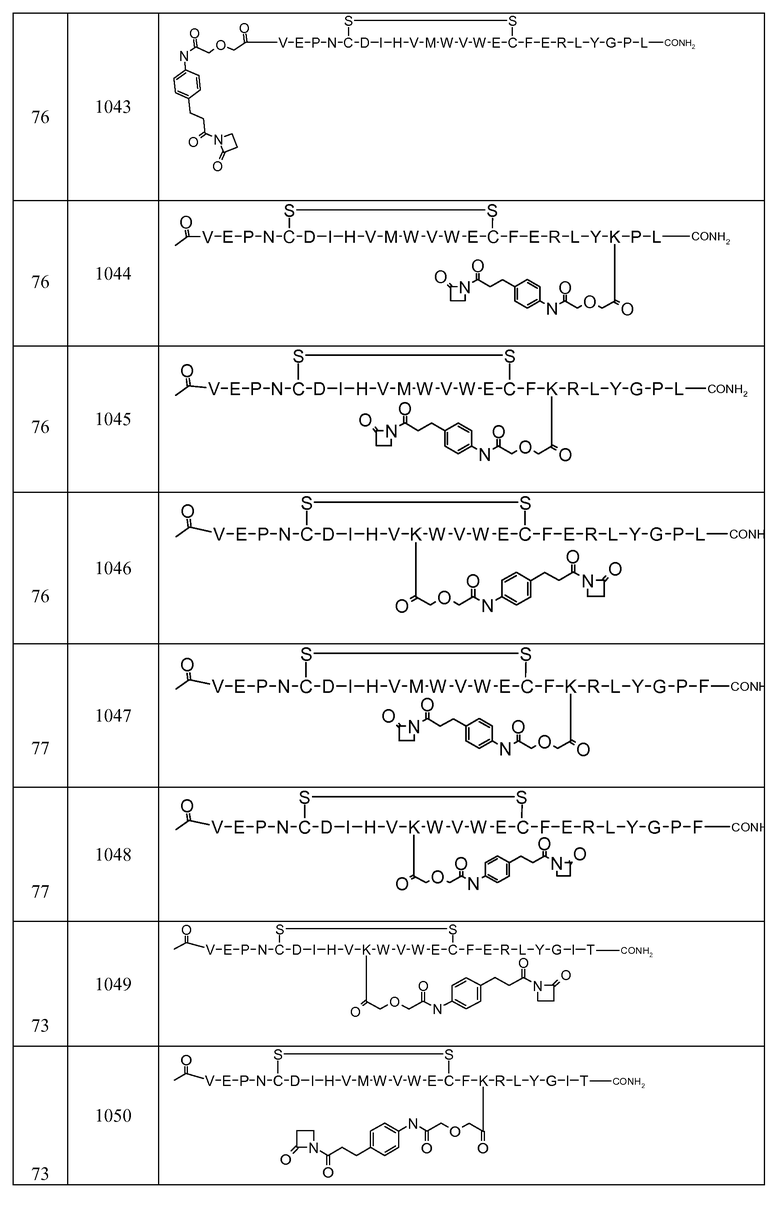
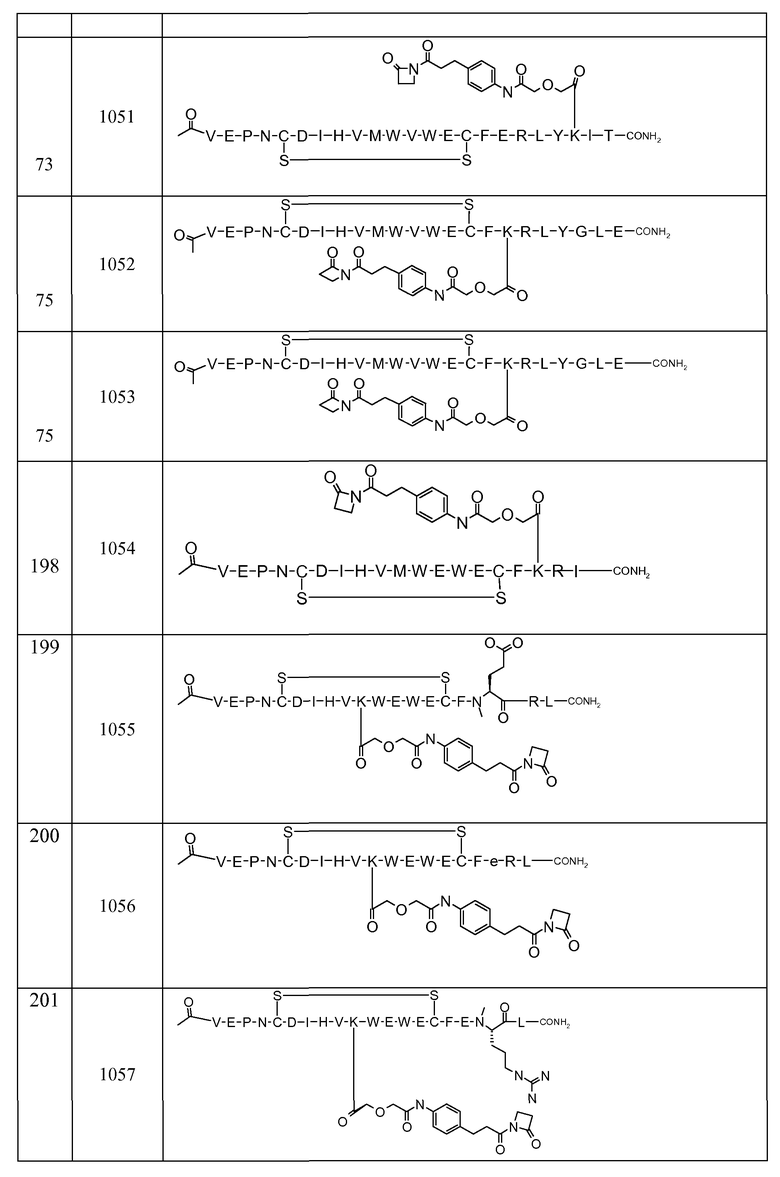
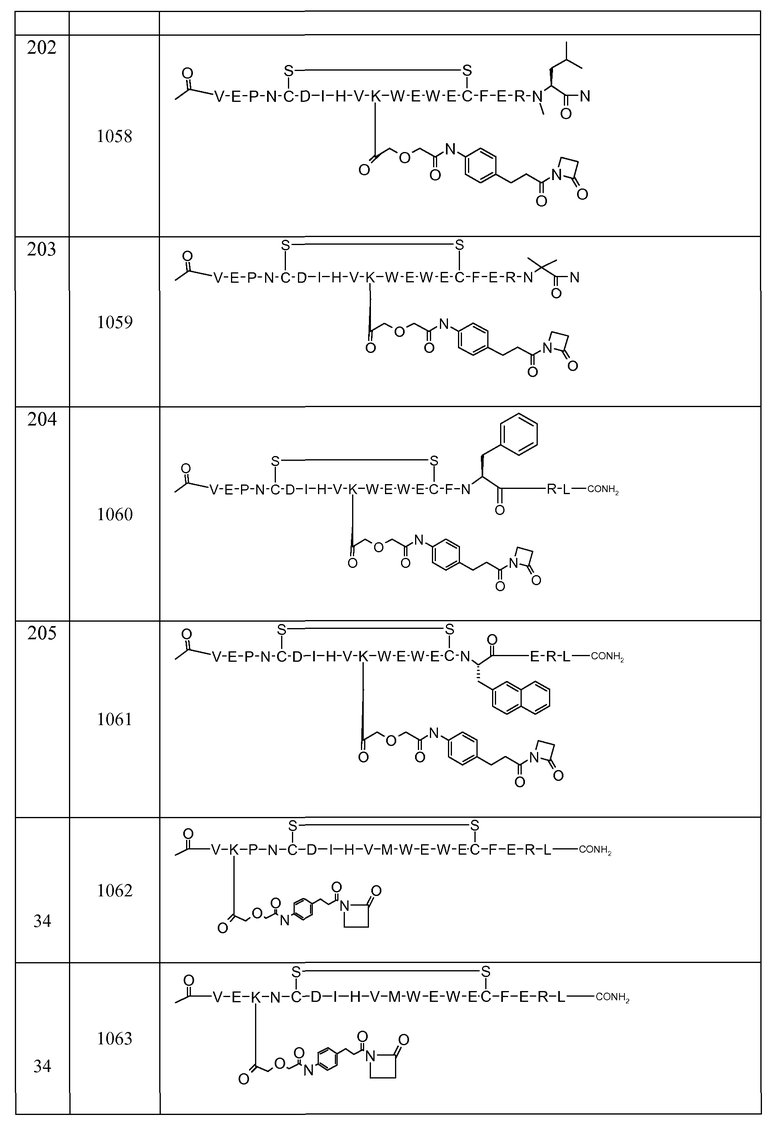
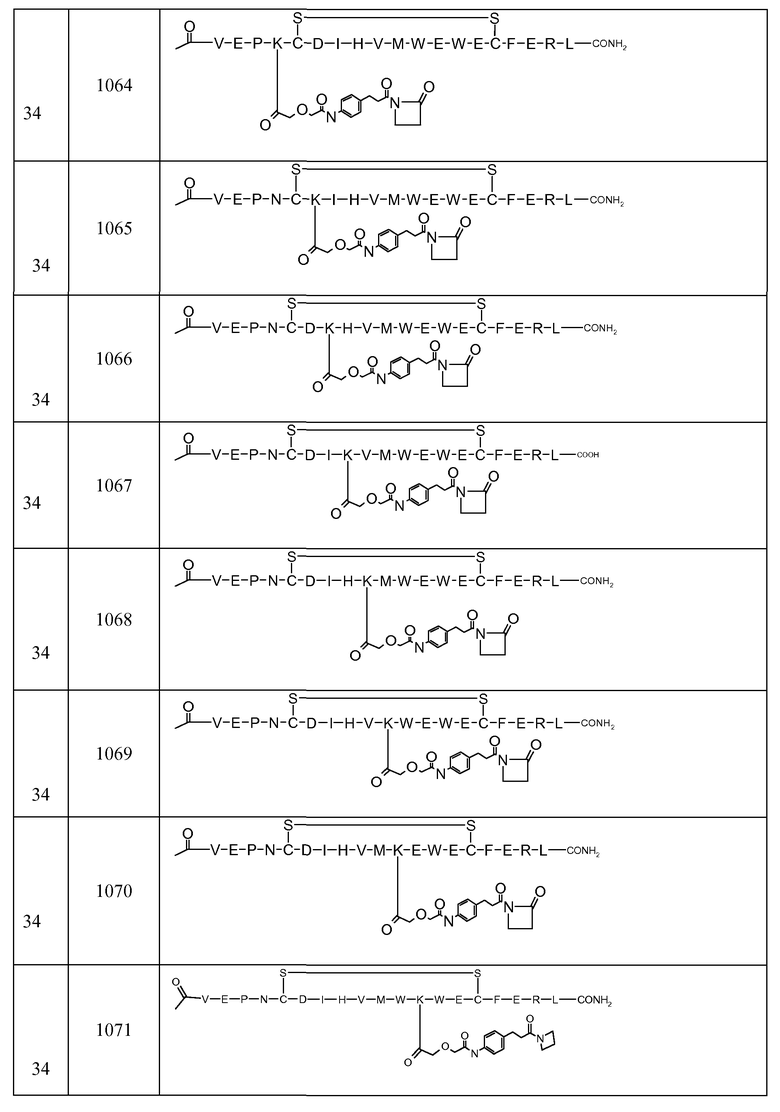
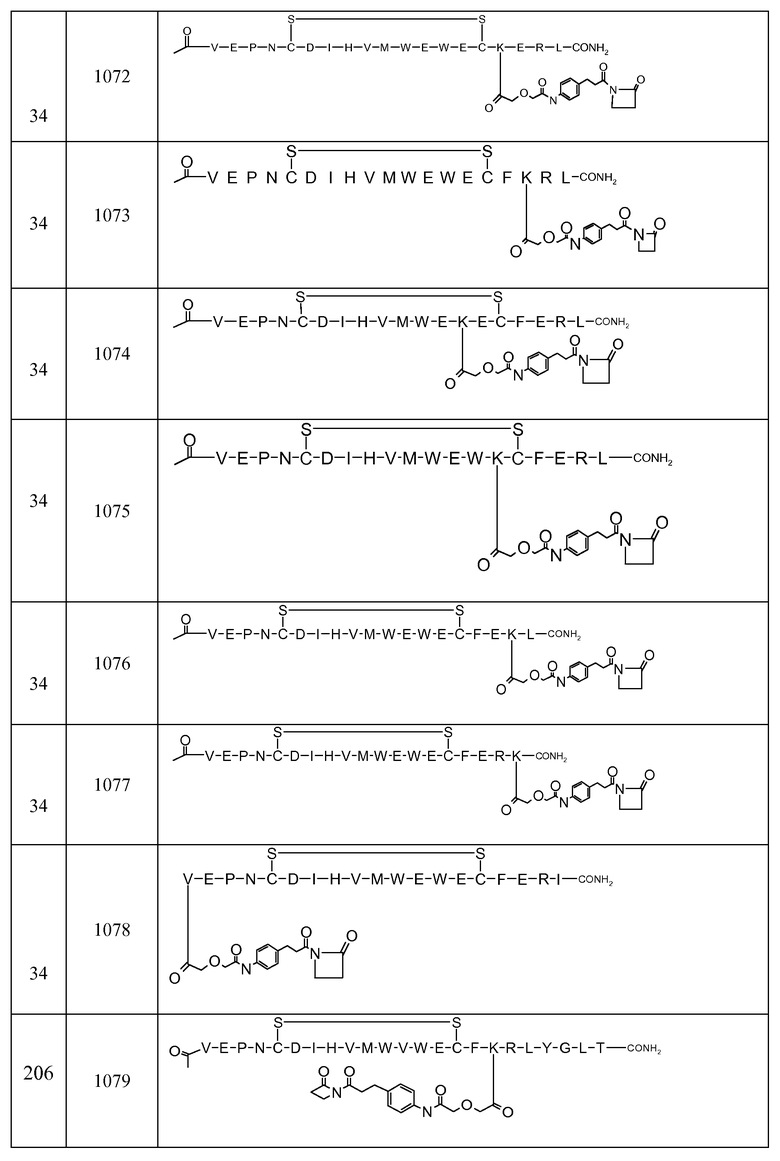
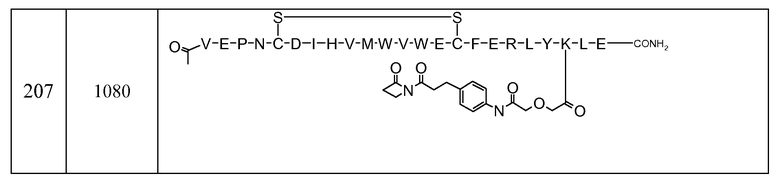
Соединения[VEGF-Пептид]-[Линкер]-Антитело
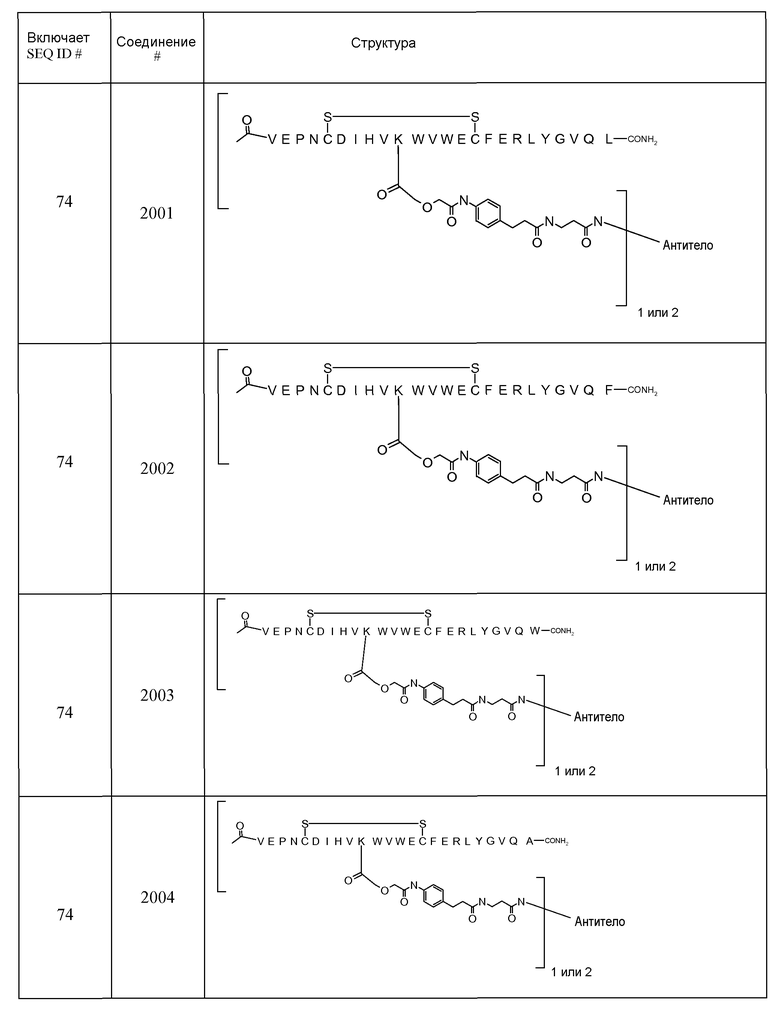
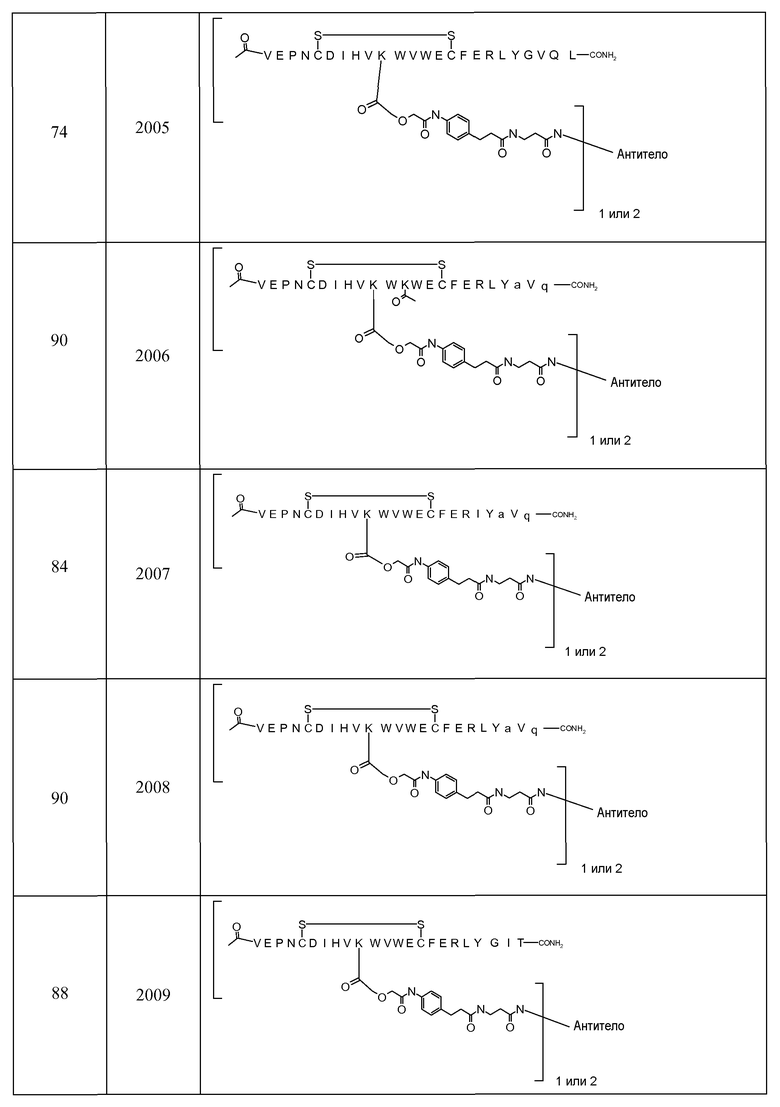
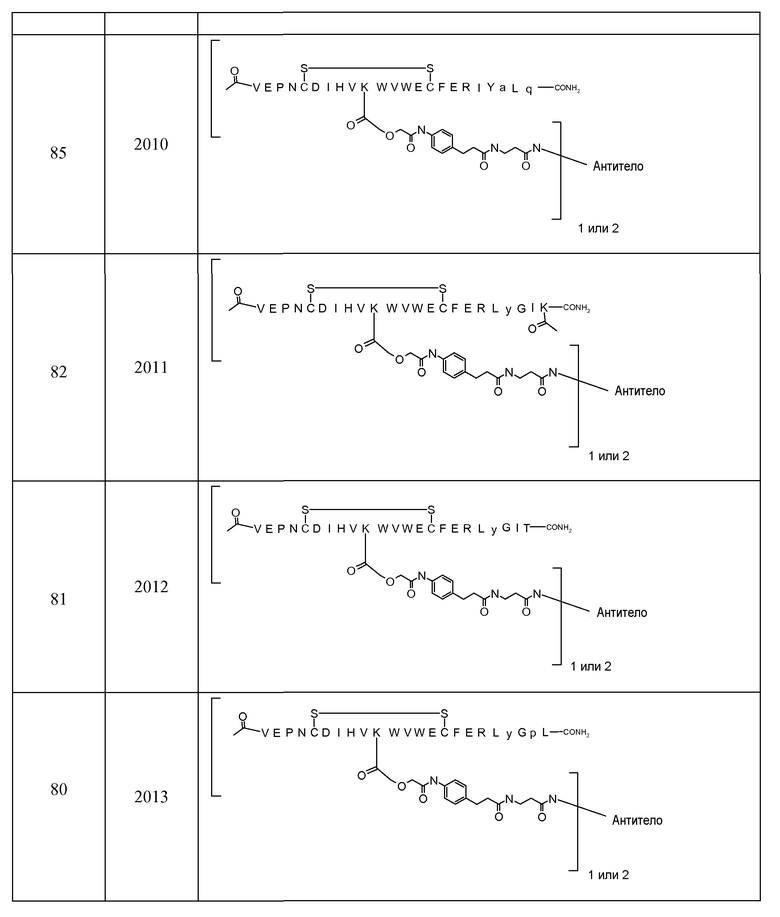
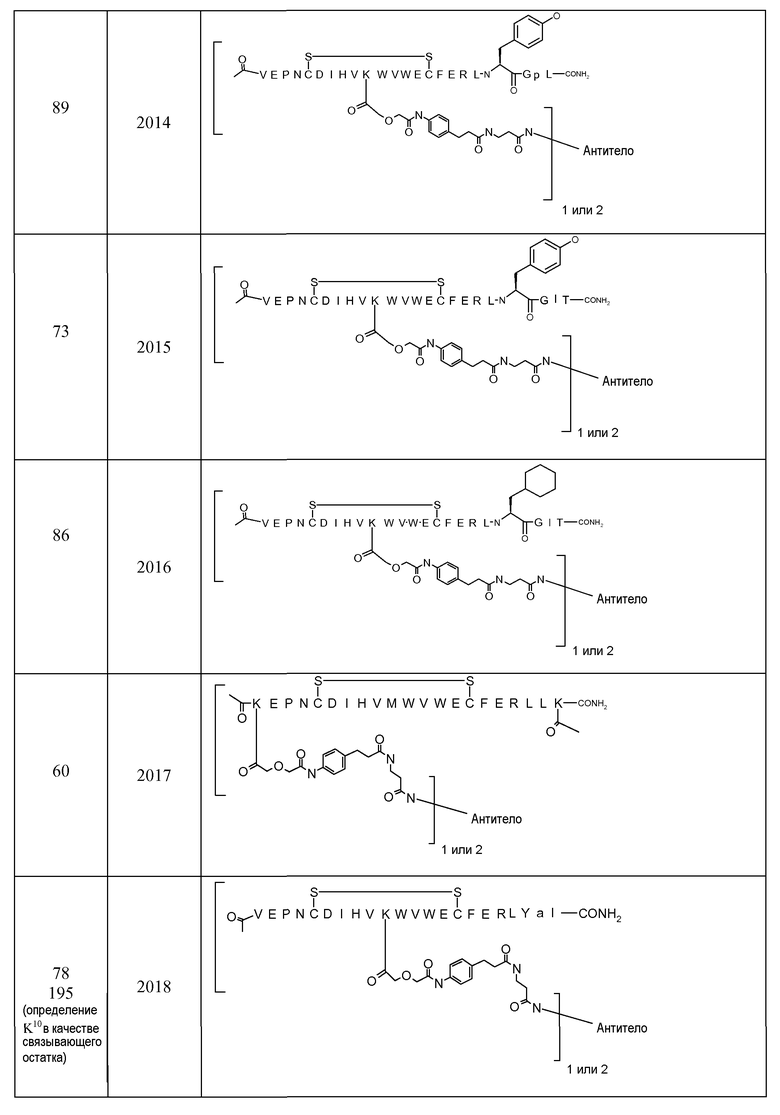
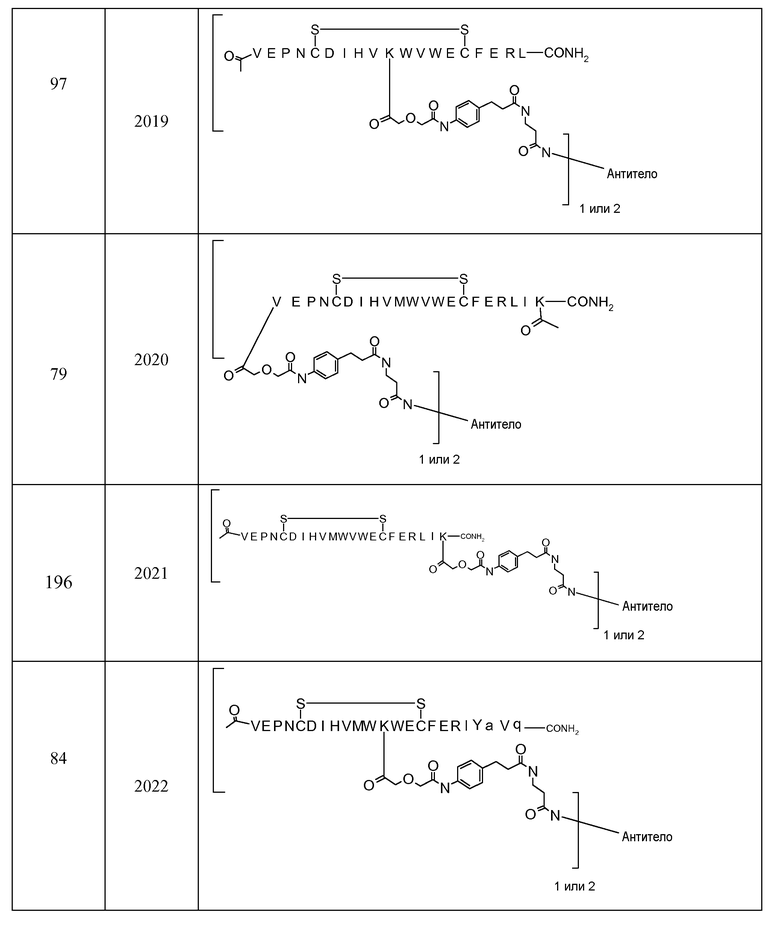
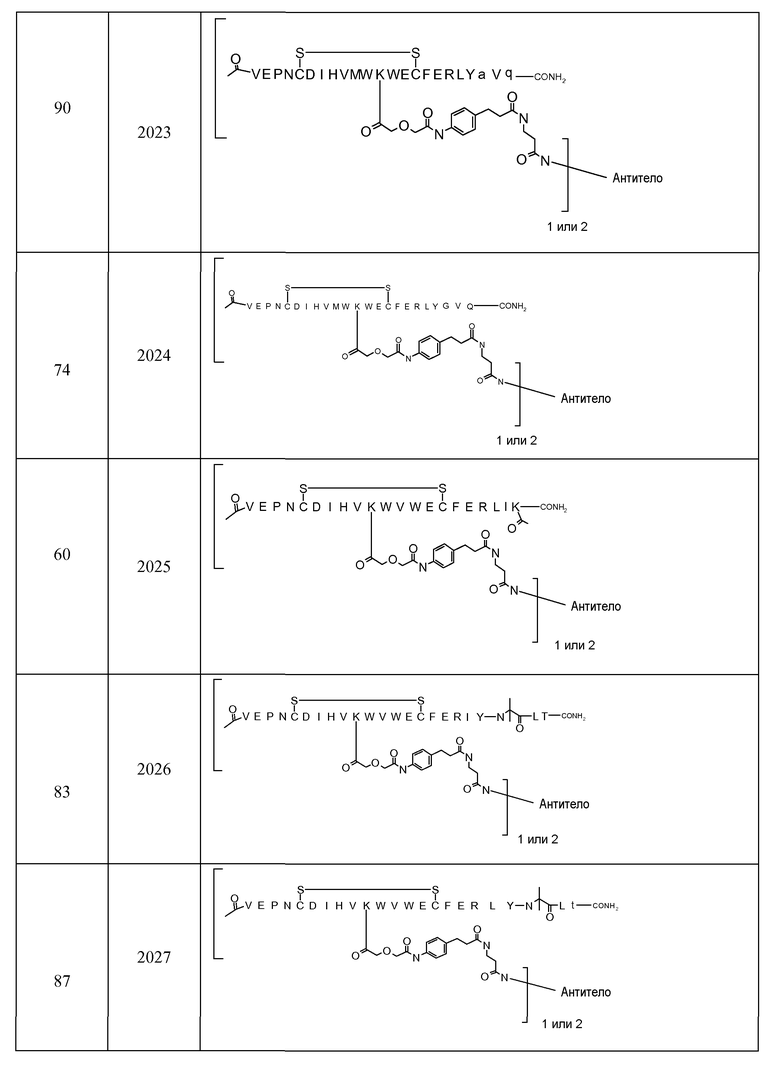
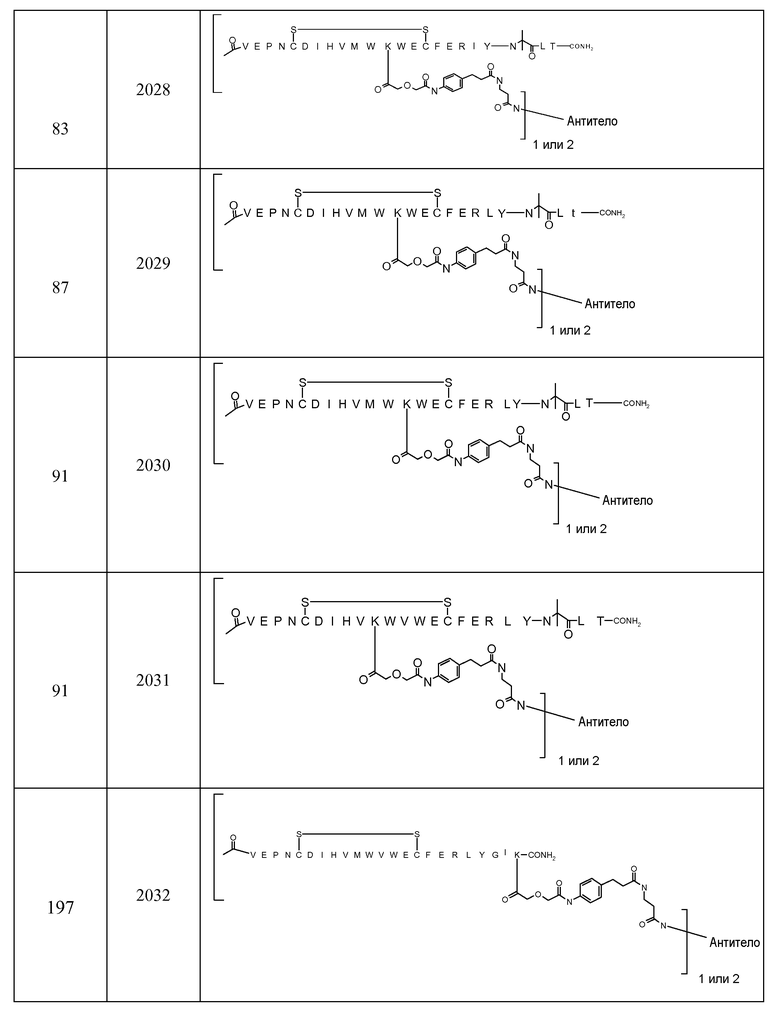
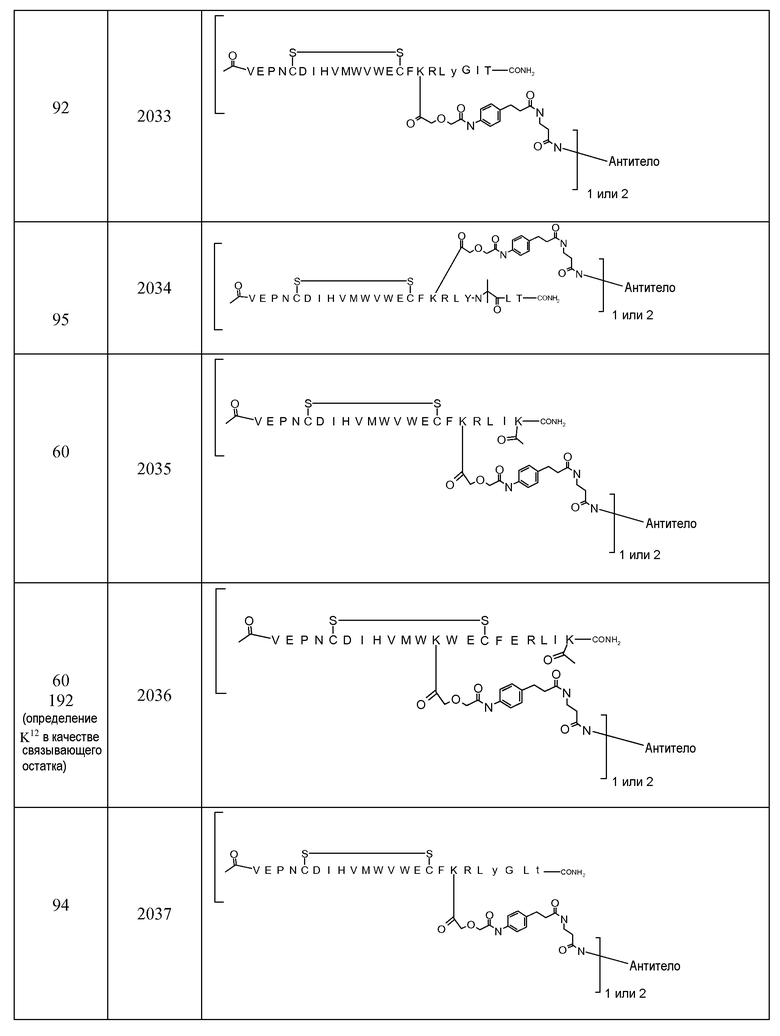
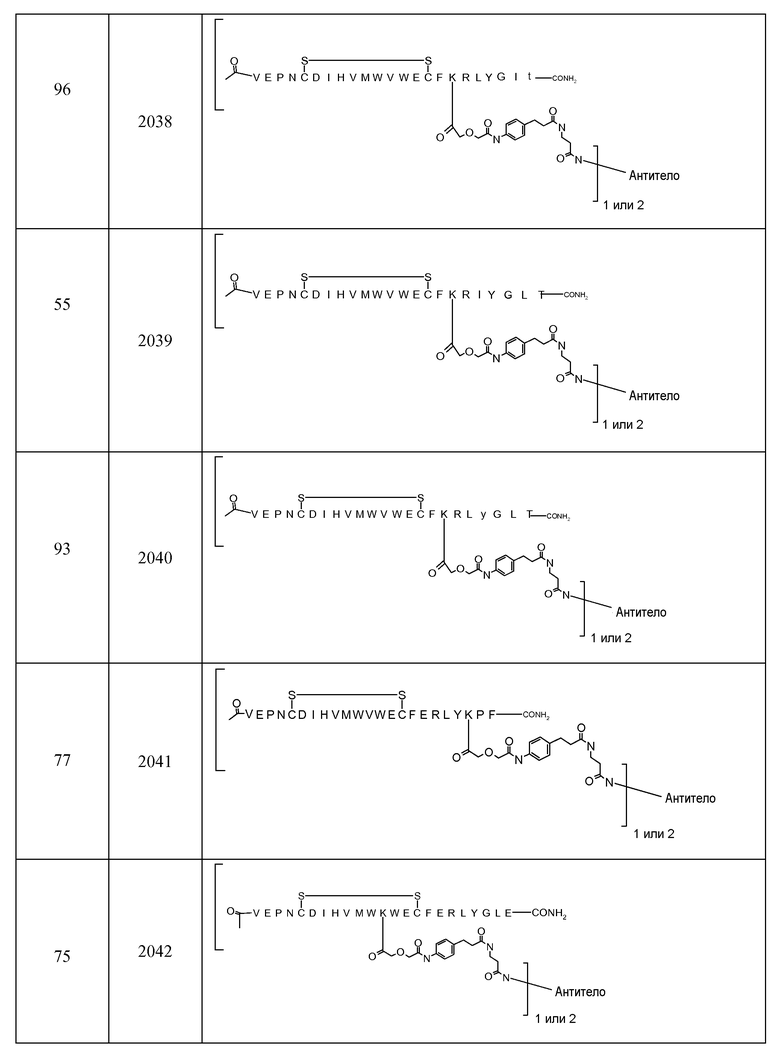
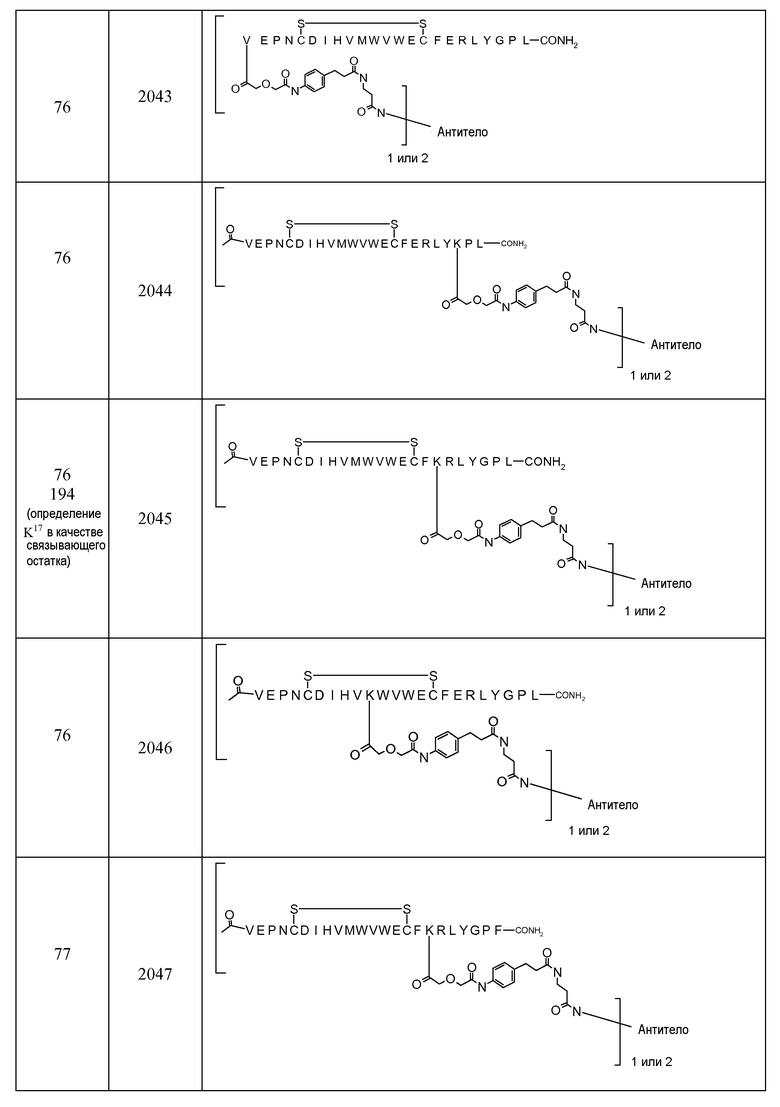
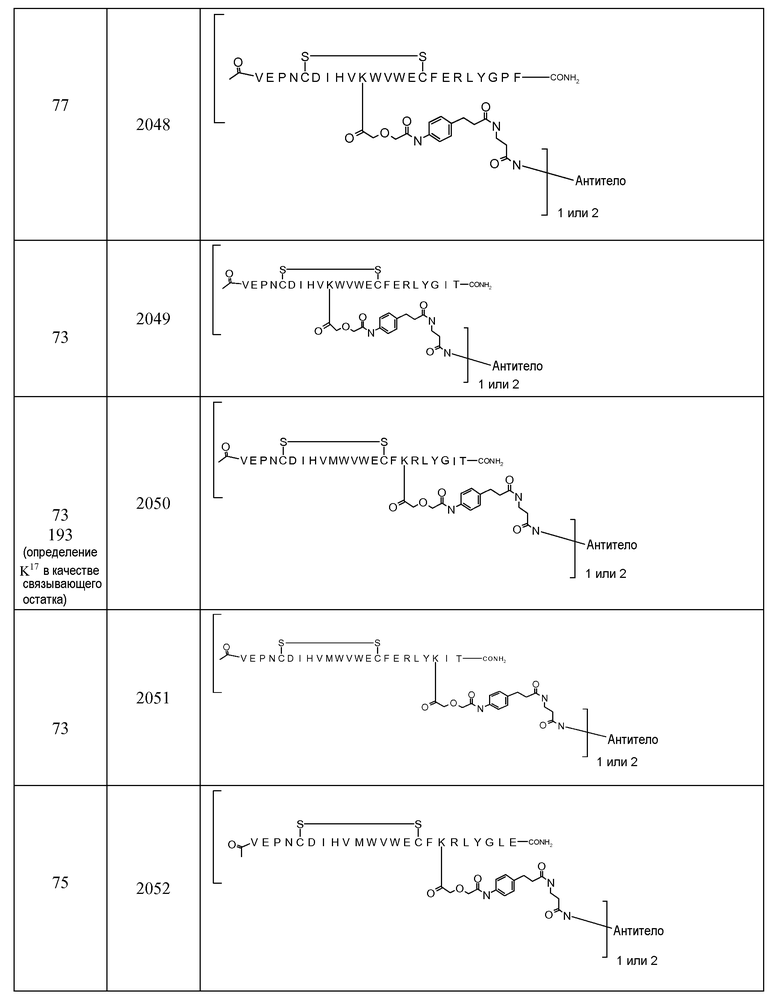
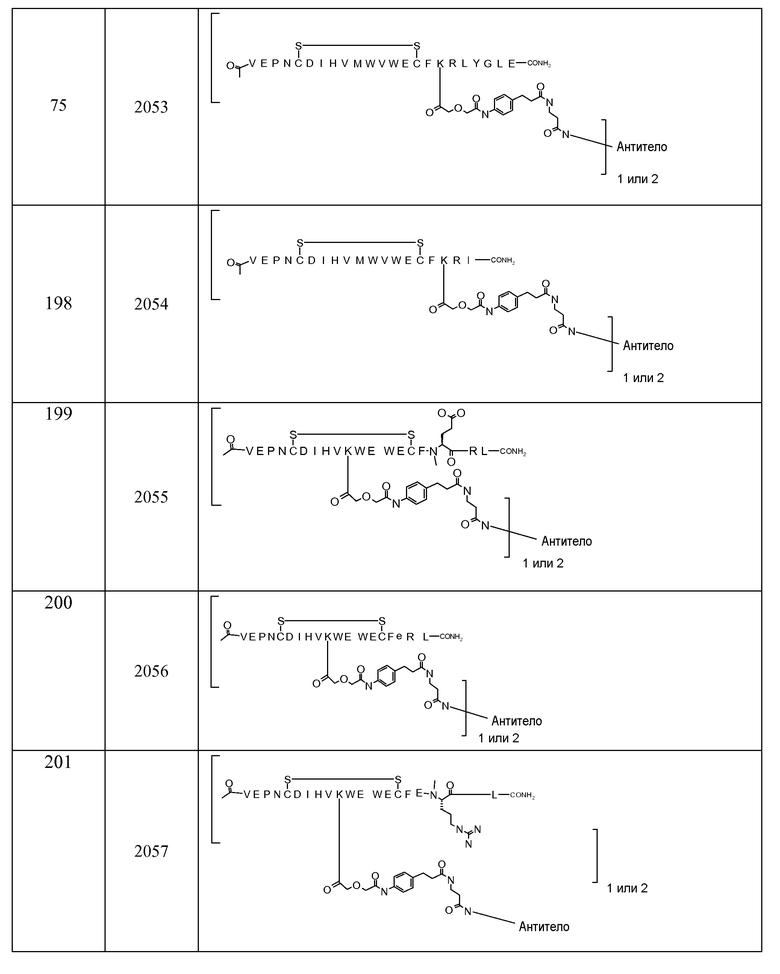
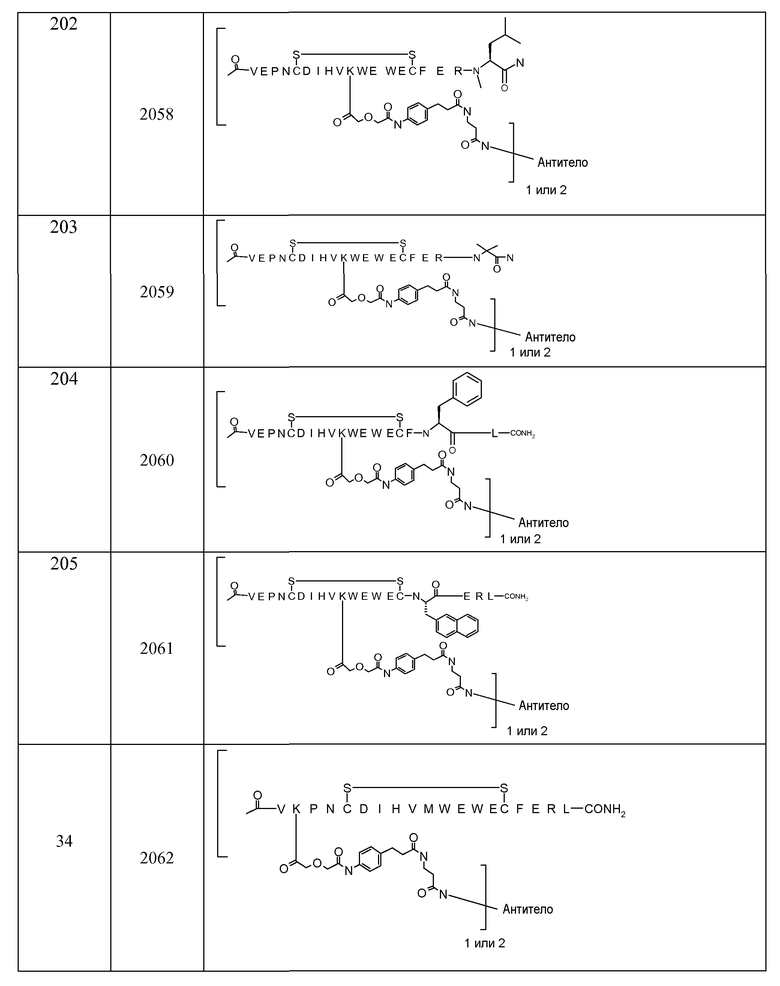
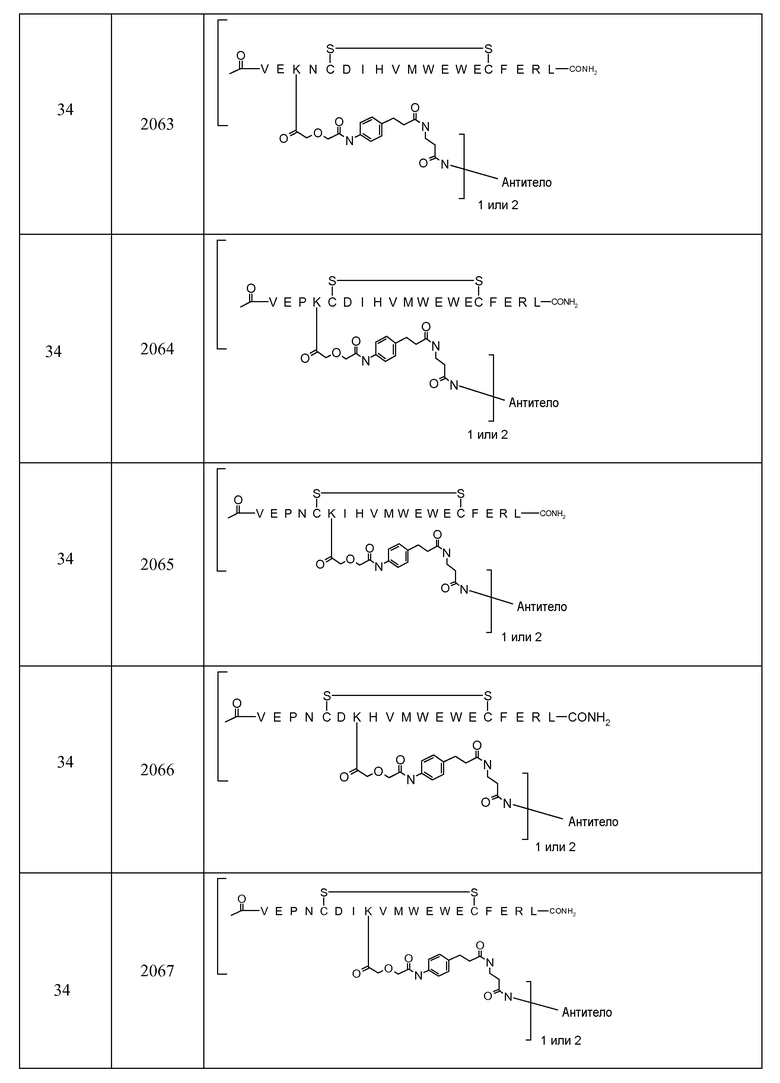
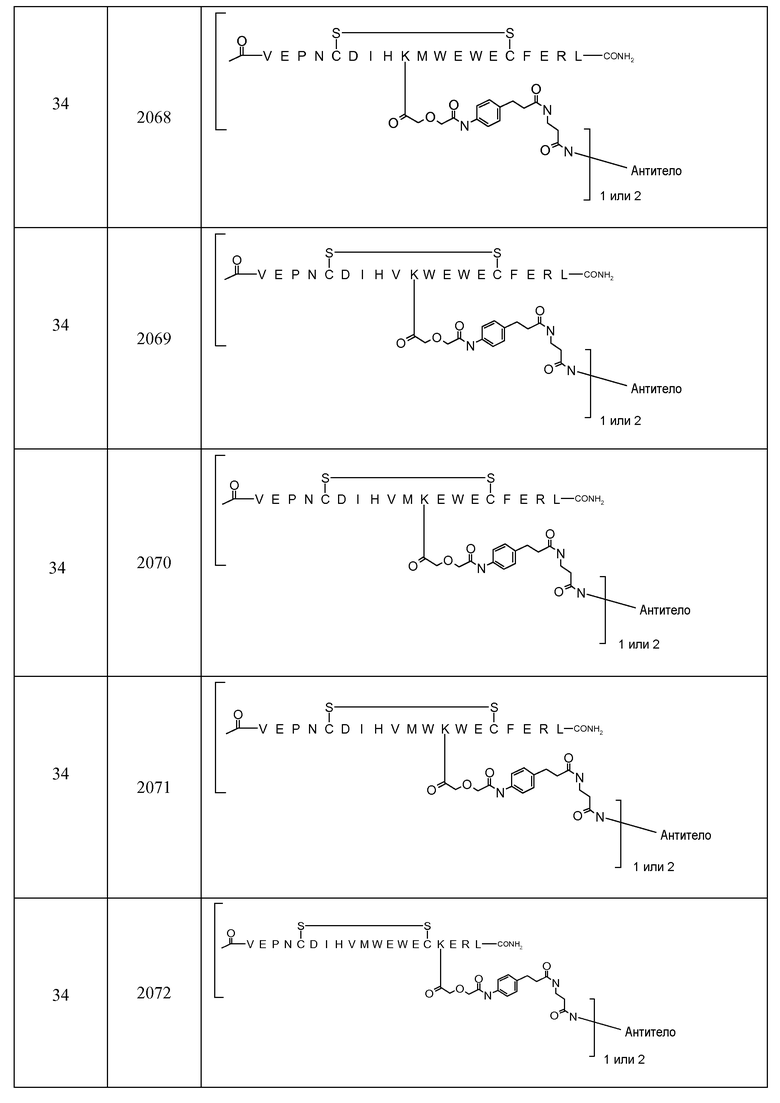
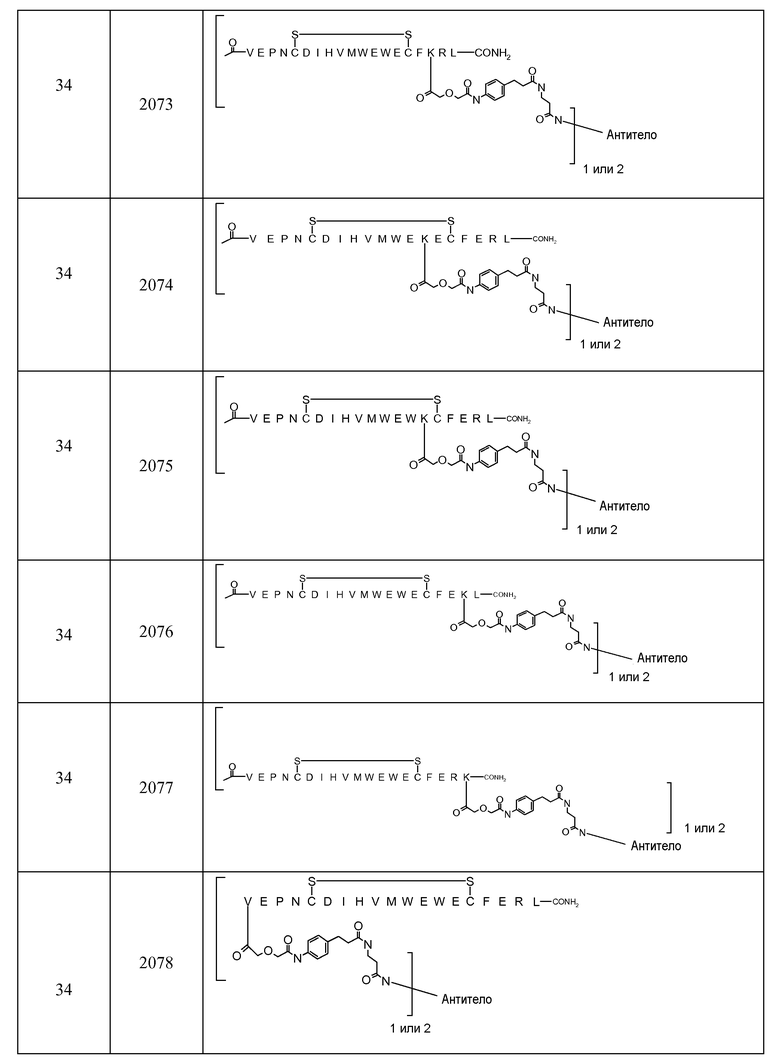
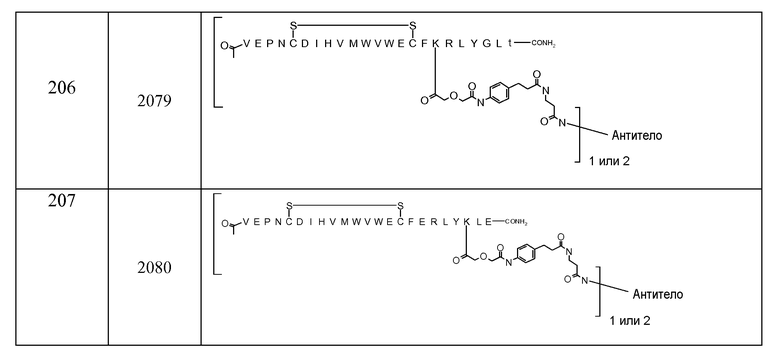
Соединения по изобретению формулы: [Ang2-Пептид] [Соединитель]-[VEGF-Пептид]
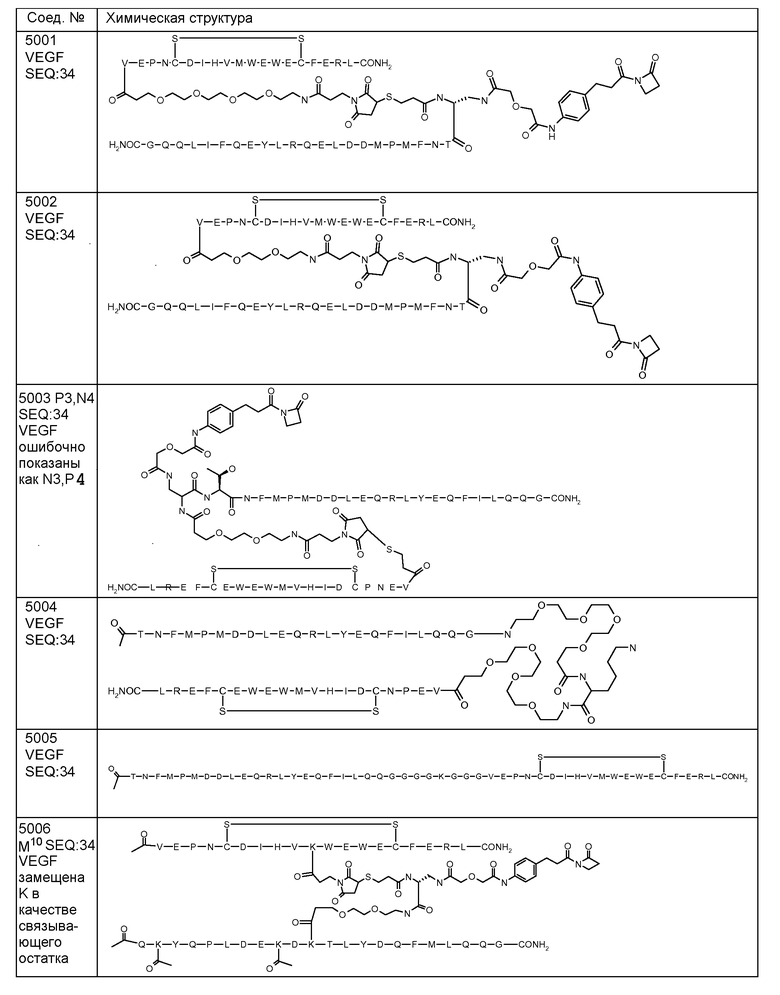
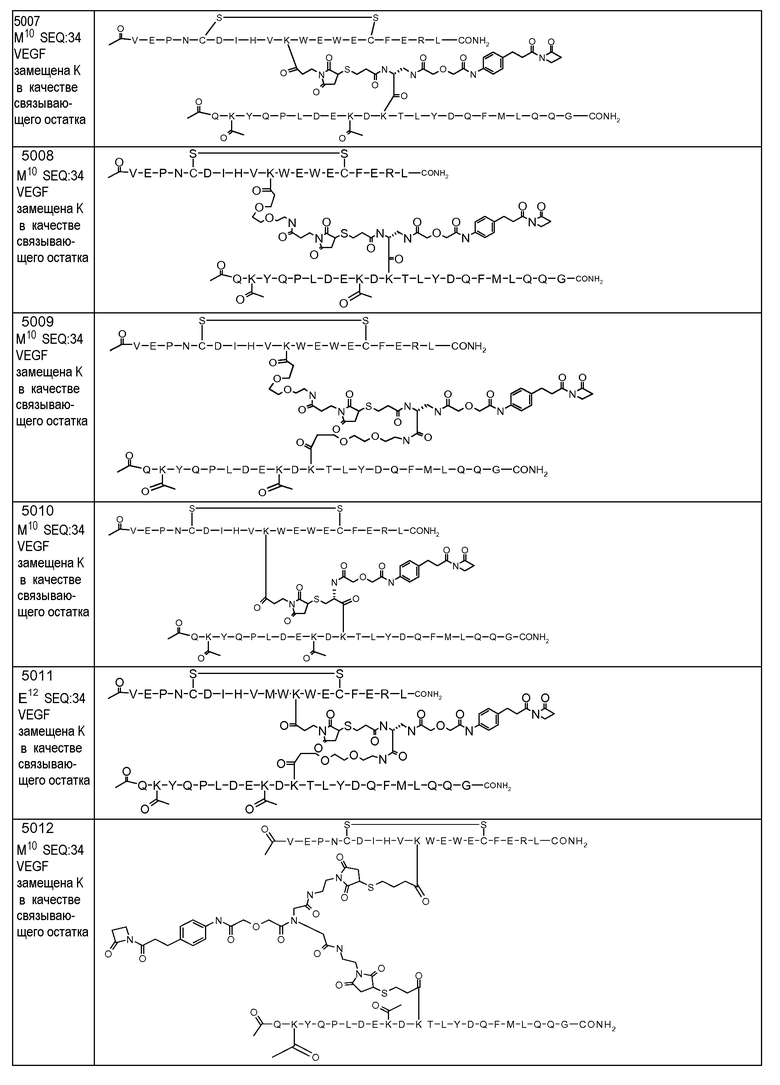
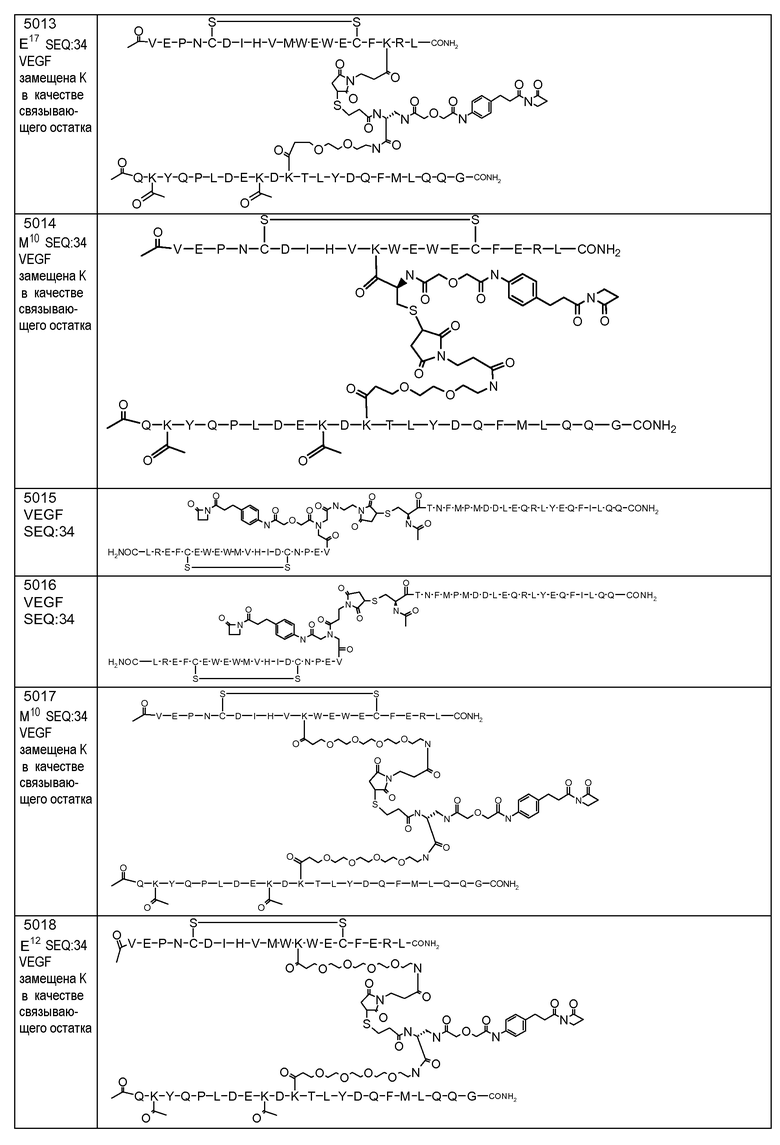
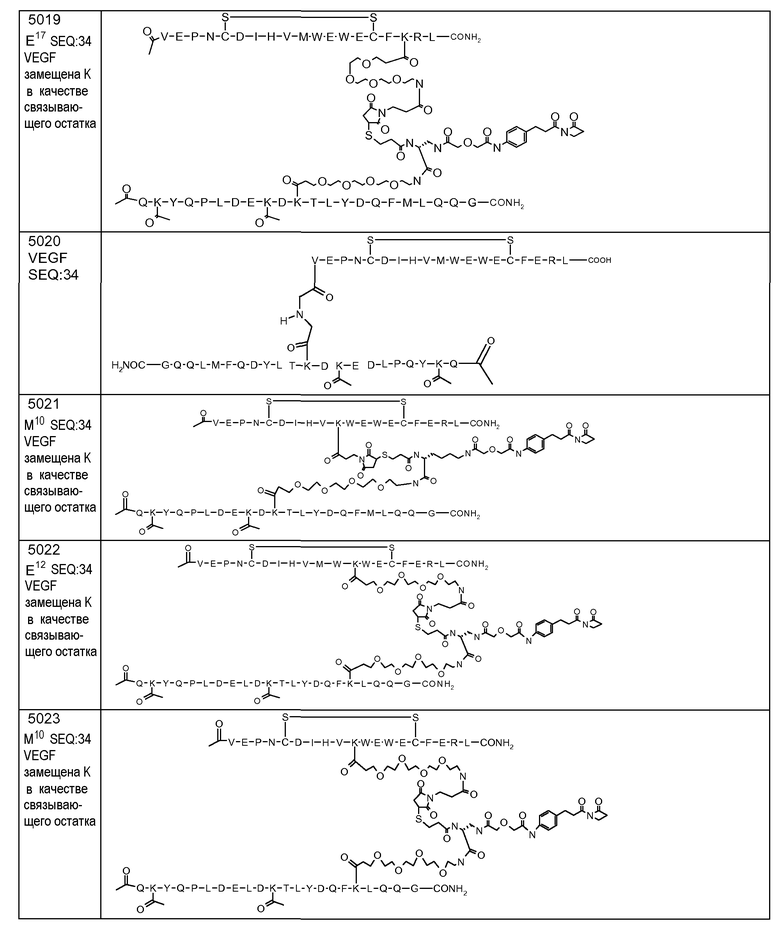
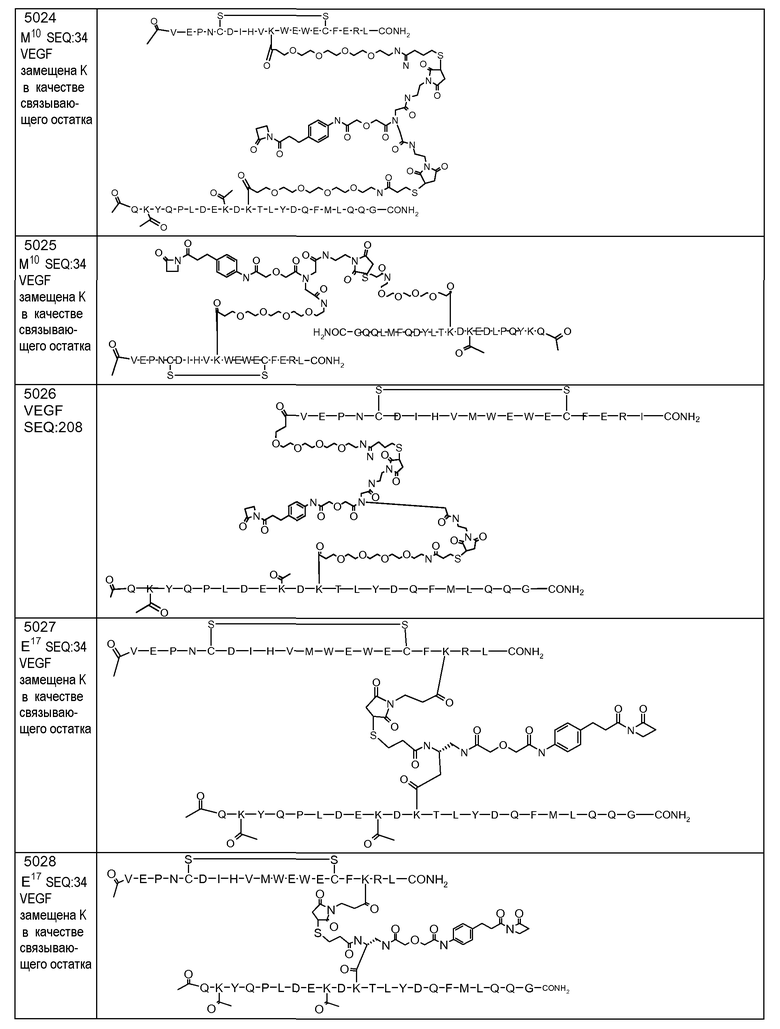
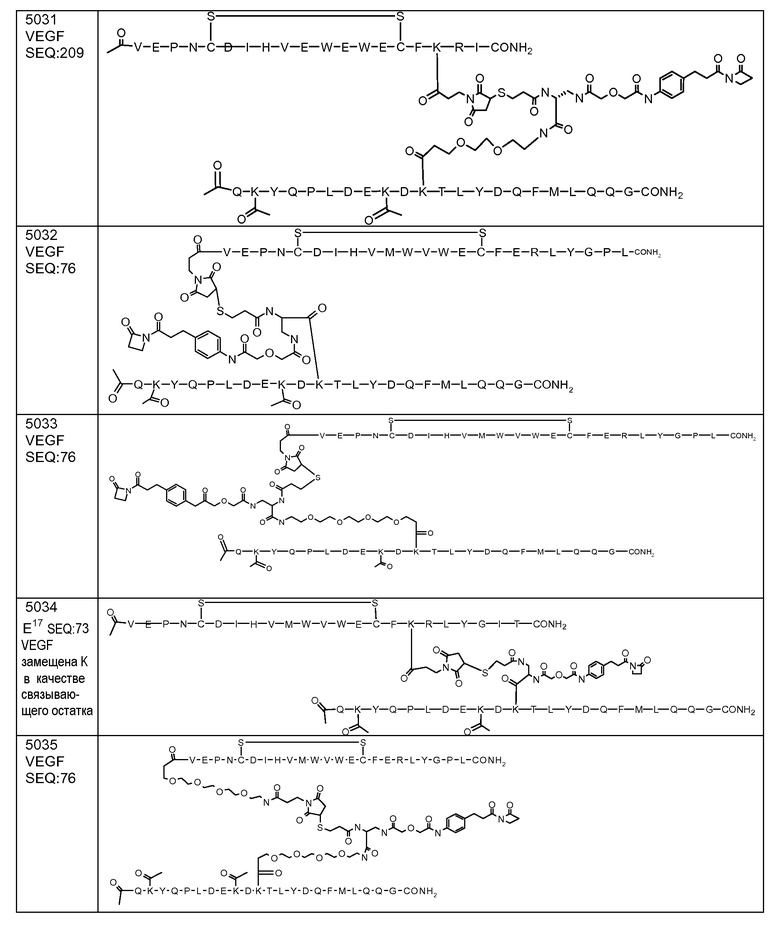
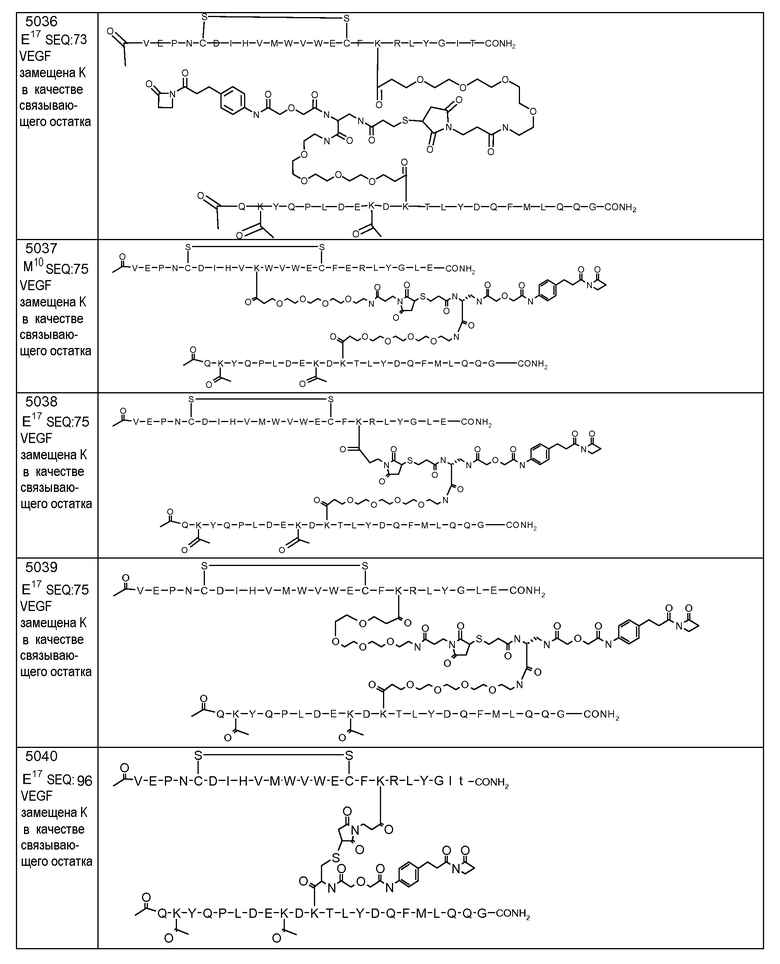
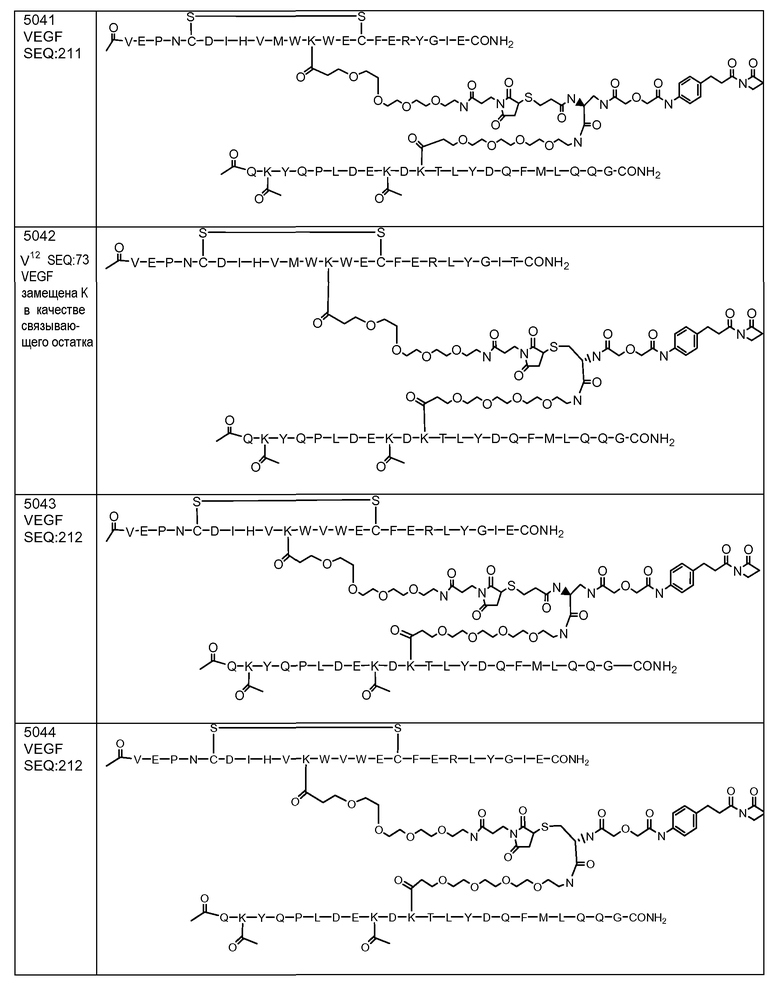
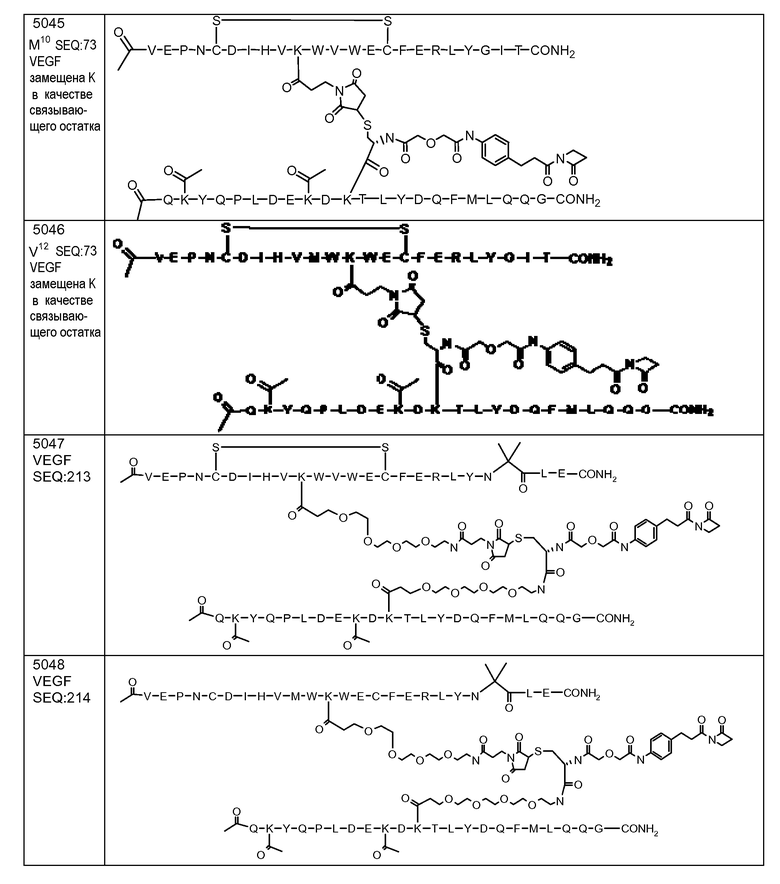
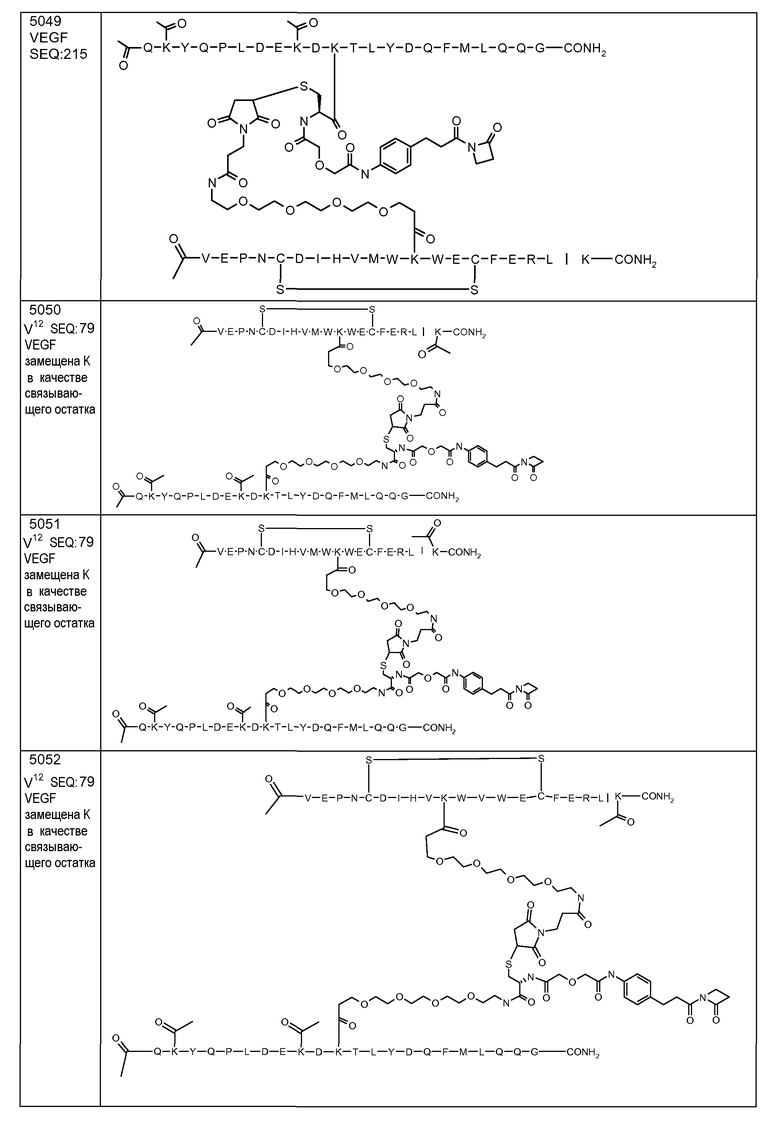
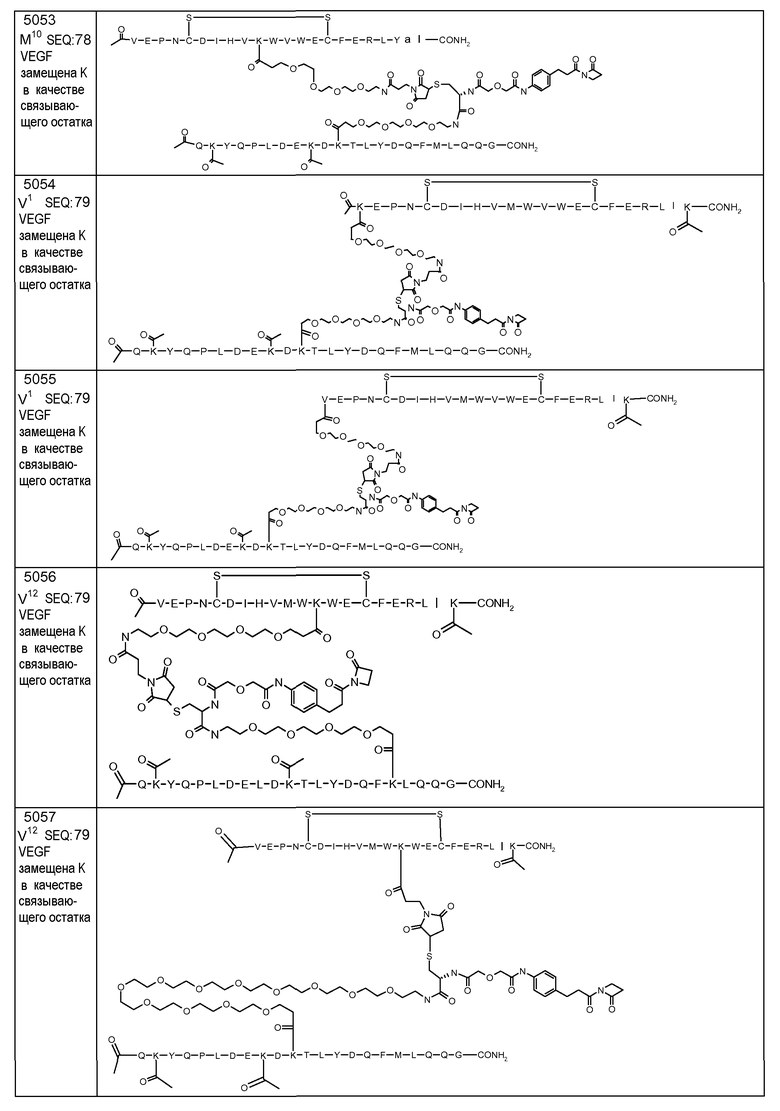
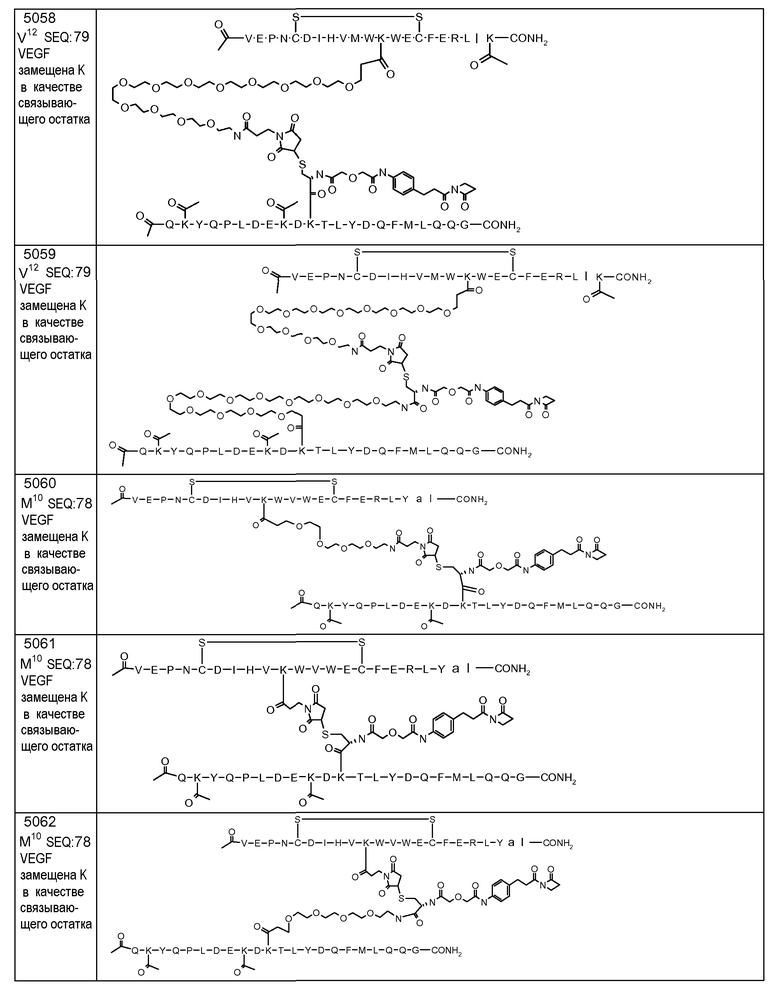
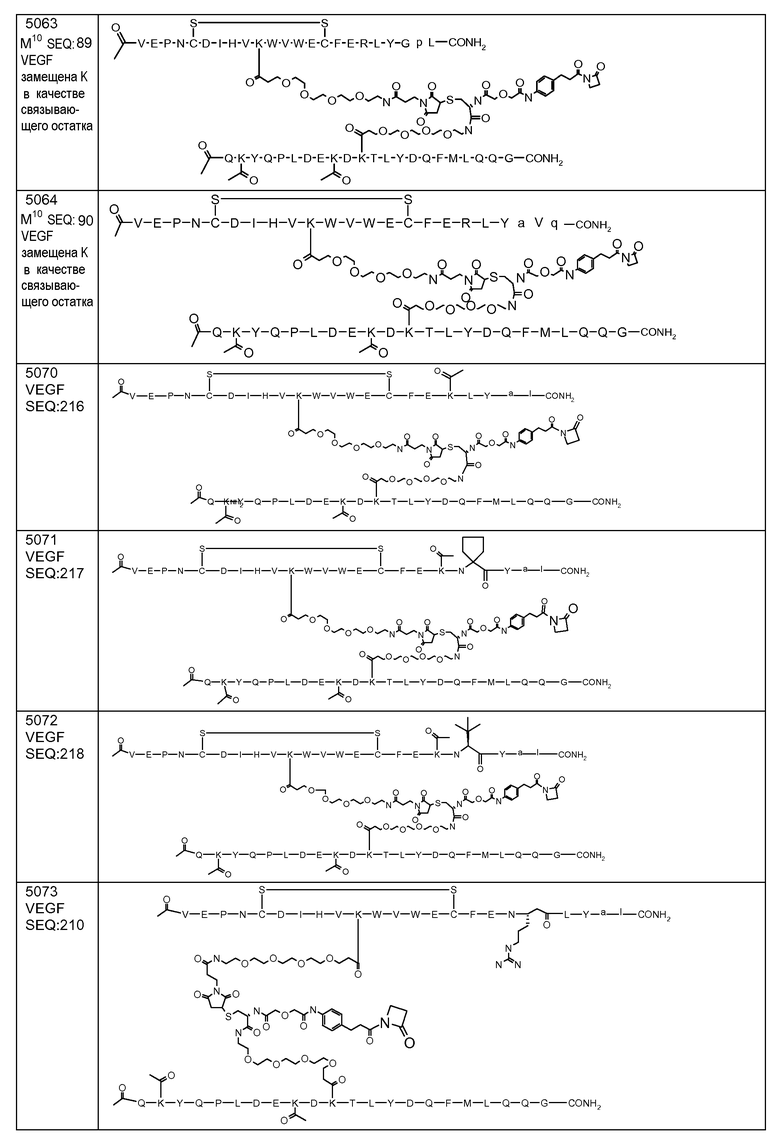
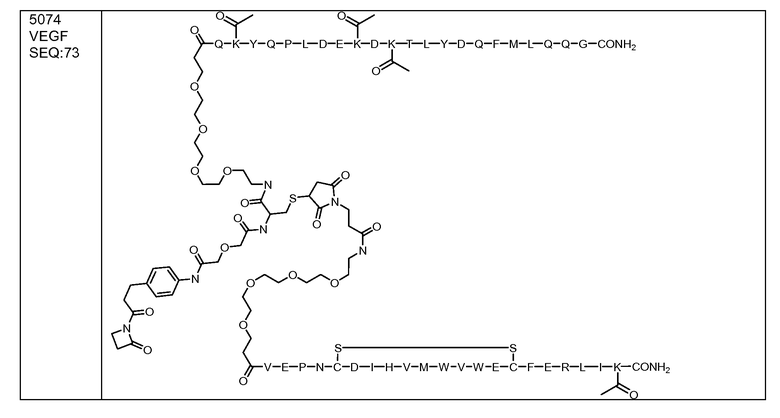
{([Ang2-Пептид]-[Соединитель]-[VEGF-Пептид])
1 или 2
}-[Антитело]
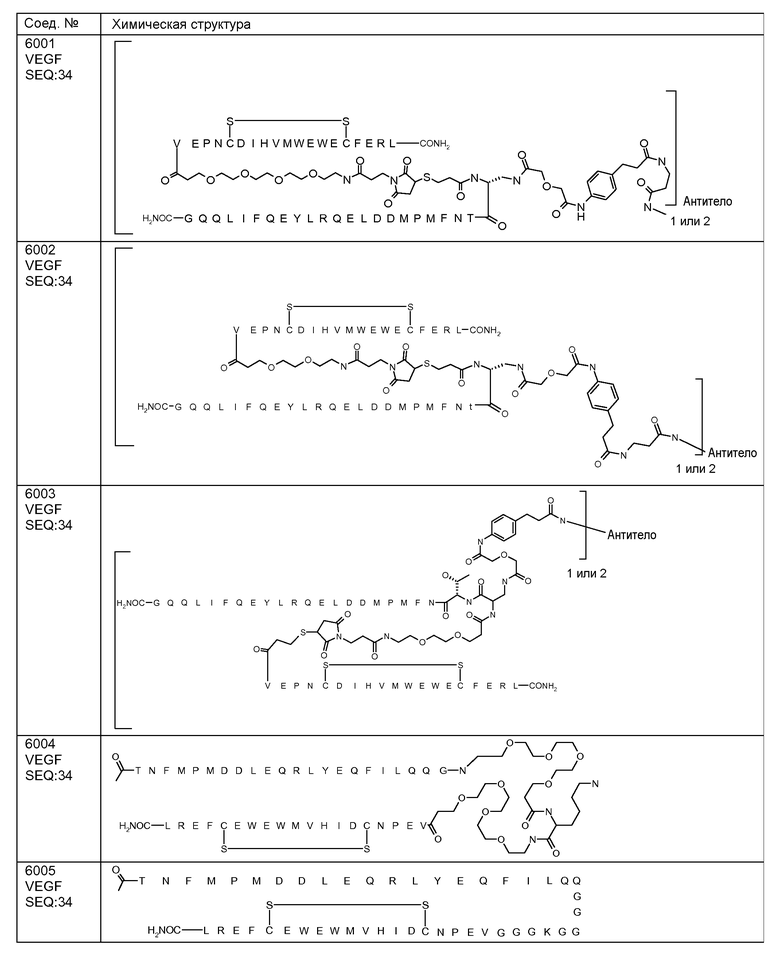
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИАНГИОГЕННЫЕ СОЕДИНЕНИЯ | 2007 |
|
RU2418003C2 |
| Субстраты матриксной металлопротеиназы и другие расщипляемые фрагменты и способы их использования | 2014 |
|
RU2715232C2 |
| КОНЪЮГАТЫ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО (ADC), КОТОРЫЕ СВЯЗЫВАЮТСЯ С БЕЛКАМИ FLT3 | 2016 |
|
RU2739617C2 |
| ИНГИБИТОРЫ РЕЦЕПТОРОВ ФАКТОРА РОСТА ЭНДОТЕЛИЯ СОСУДОВ ТИПА 2 | 2004 |
|
RU2402567C2 |
| ПРОЛЕКАРСТВЕННЫЕ КОМПОЗИЦИИ НА ОСНОВЕ ГИДРОГЕЛЯ ПОПЕРЕЧНО-СШИТОЙ ГИАЛУРОНОВОЙ КИСЛОТЫ И СПОСОБЫ | 2018 |
|
RU2812787C2 |
| АНТИ-FcRH5 АНТИТЕЛА | 2014 |
|
RU2687132C2 |
| СТАБИЛЬНЫЕ И РАСТВОРИМЫЕ АНТИТЕЛА, ИНГИБИРУЮЩИЕ VEGF | 2016 |
|
RU2648152C2 |
| СТАБИЛЬНЫЕ И РАСТВОРИМЫЕ АНТИТЕЛА, ИНГИБИРУЮЩИЕ VEGF | 2009 |
|
RU2531523C9 |
| ТЕРАПЕВТИЧЕСКИЕ DLL4-СВЯЗЫВАЮЩИЕ БЕЛКИ | 2010 |
|
RU2570639C2 |
| СТАБИЛЬНЫЕ И РАСТВОРИМЫЕ АНТИТЕЛА, ИНГИБИРУЮЩИЕ VEGF | 2009 |
|
RU2588467C2 |





















































































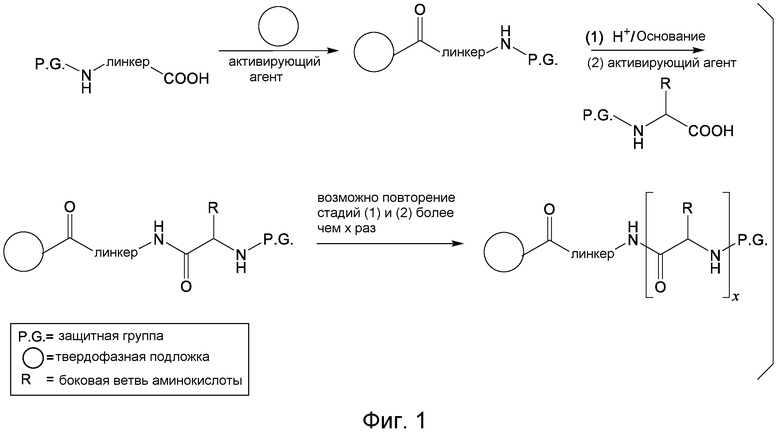
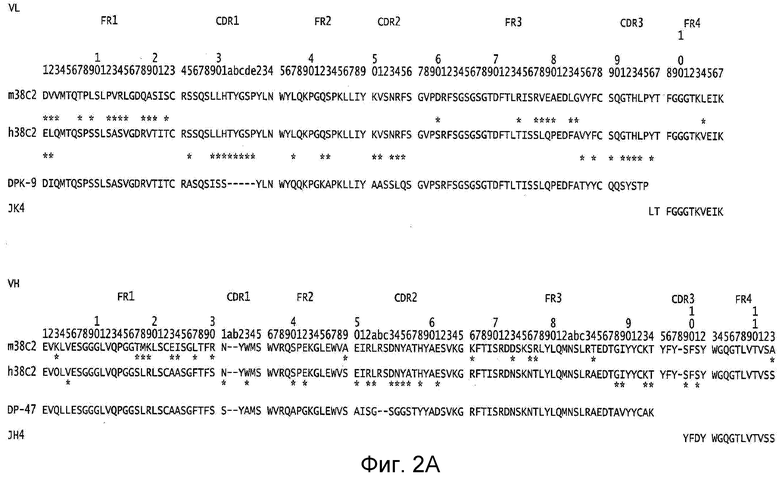

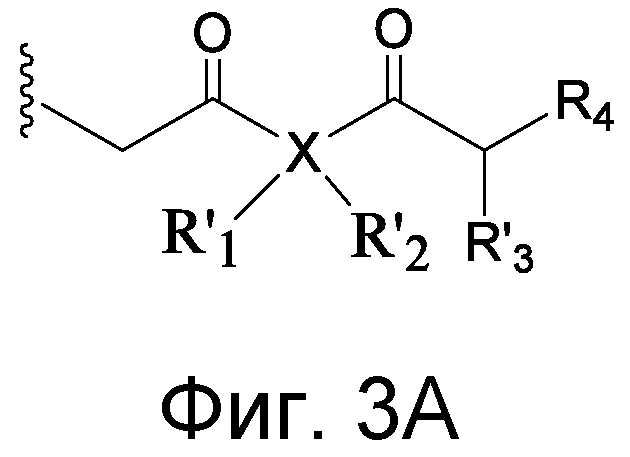
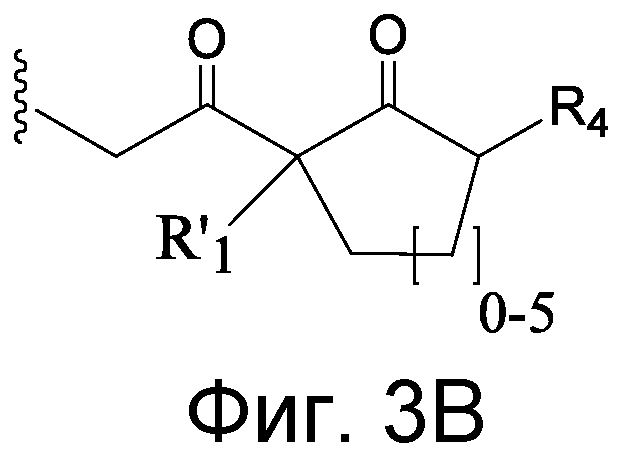
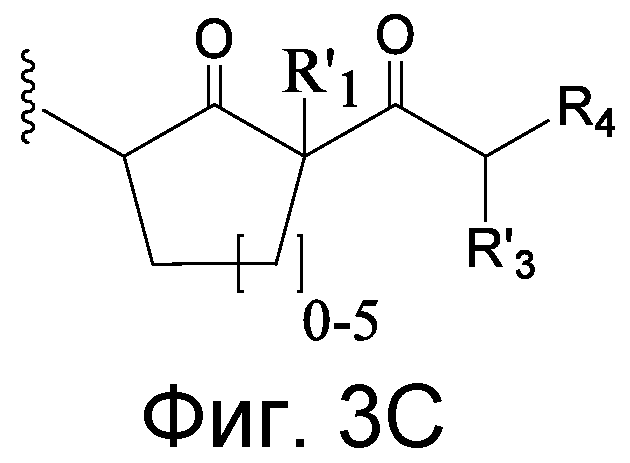
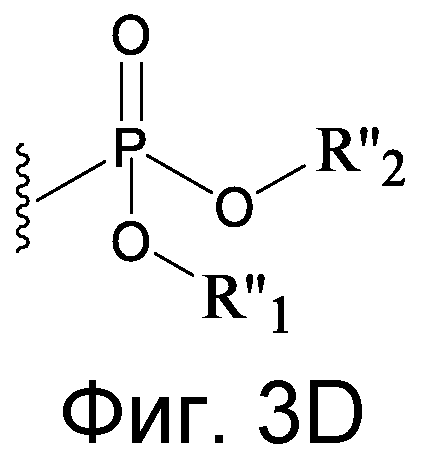
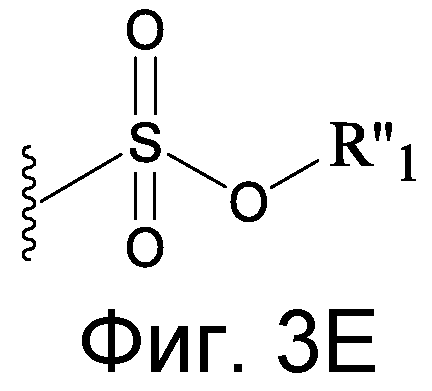
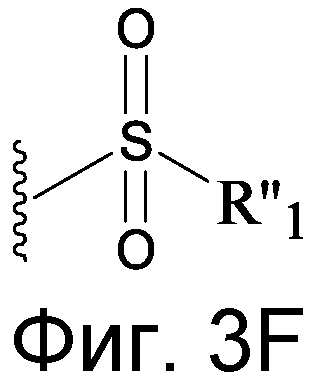
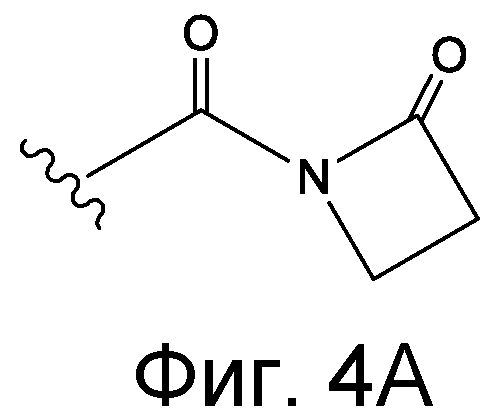
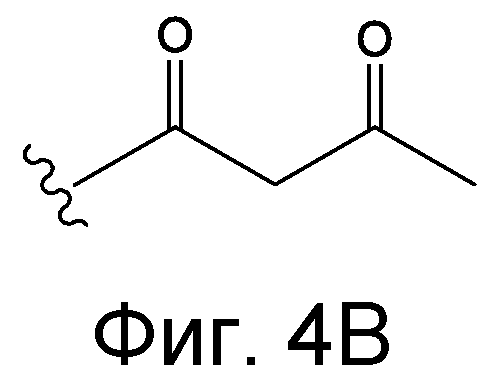
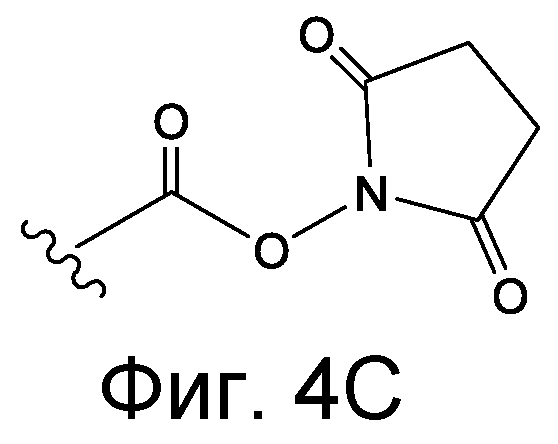
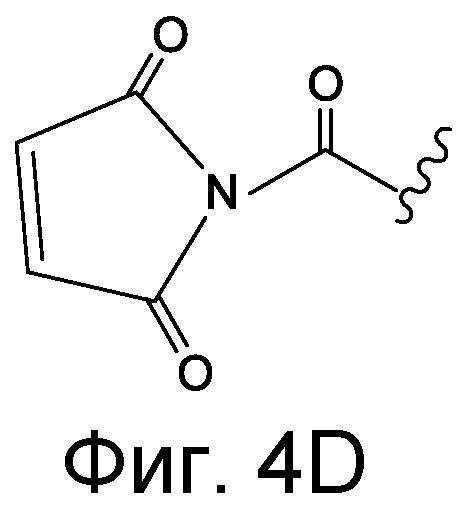
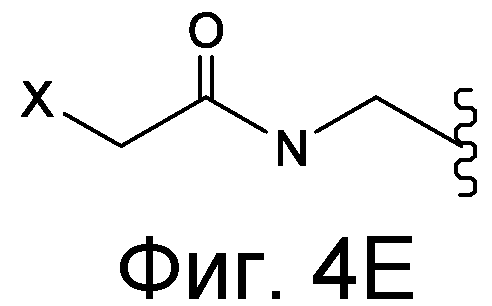
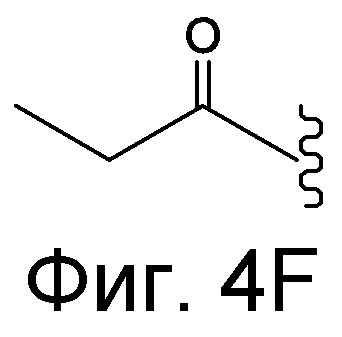
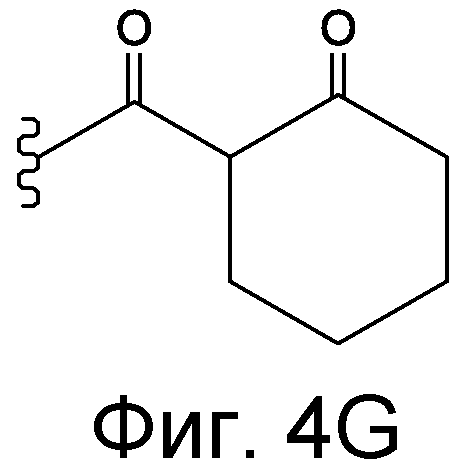
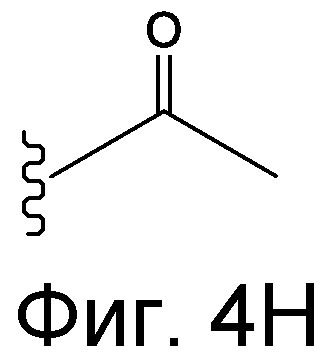
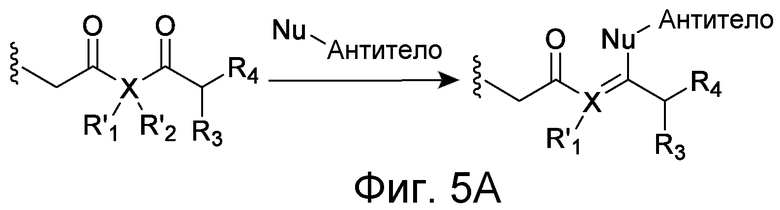
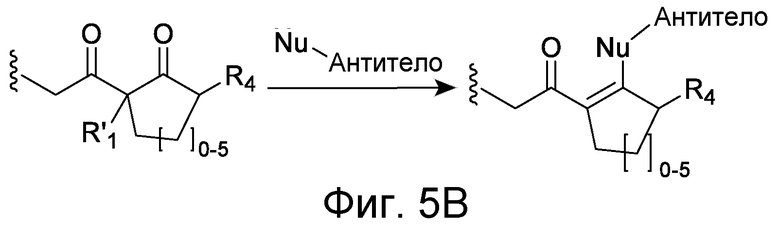
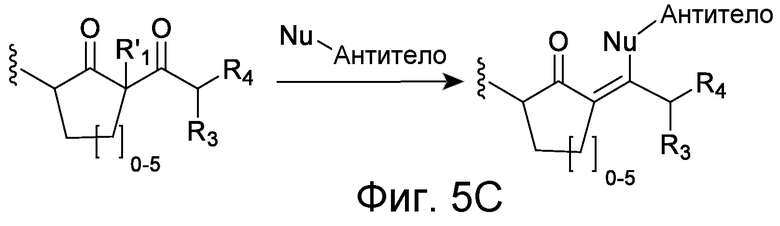
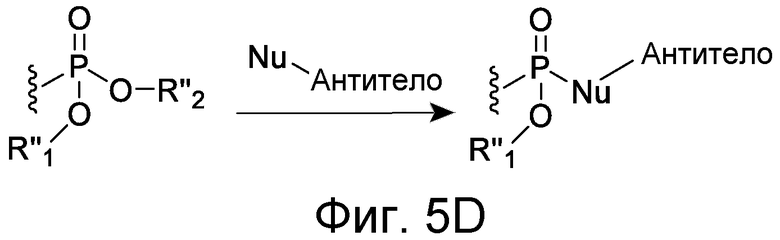
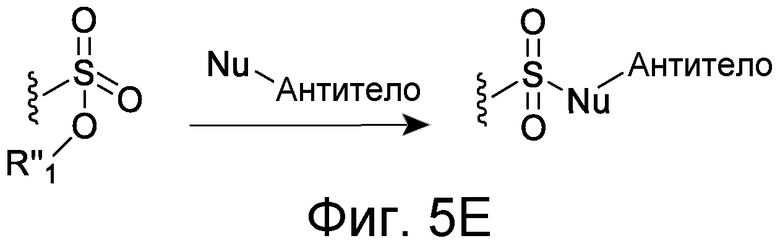
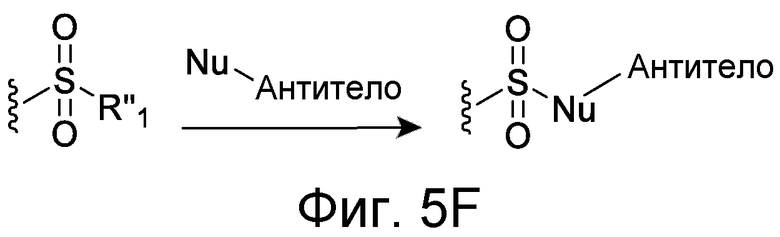
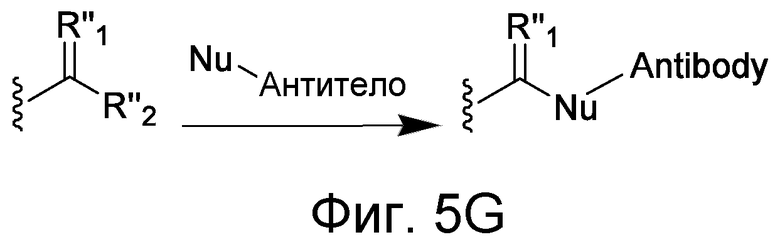
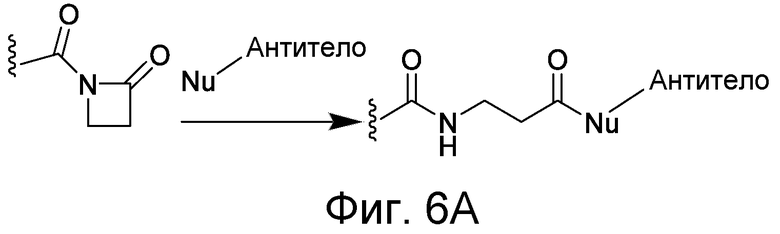
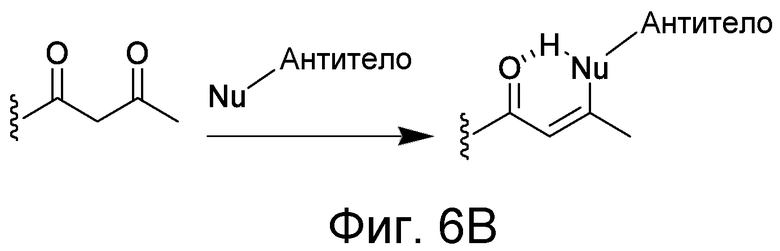
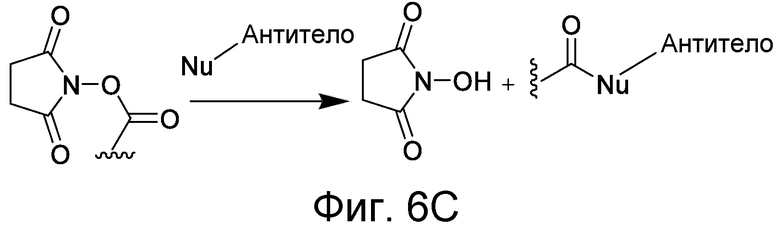
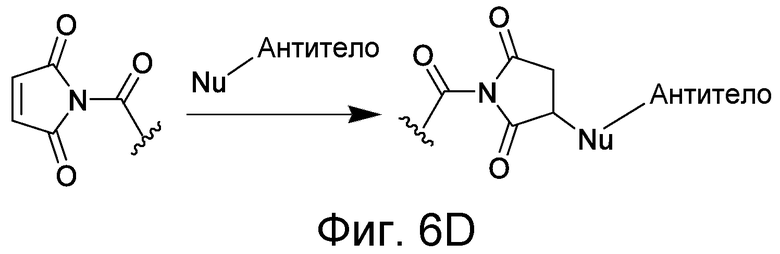
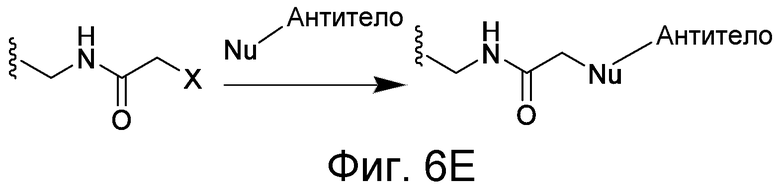
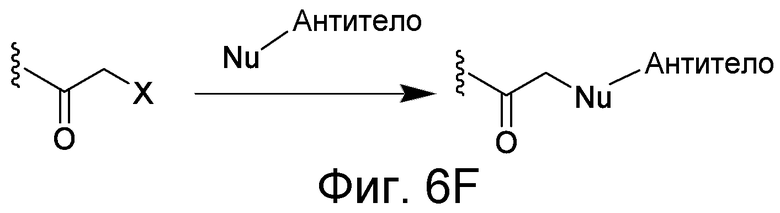
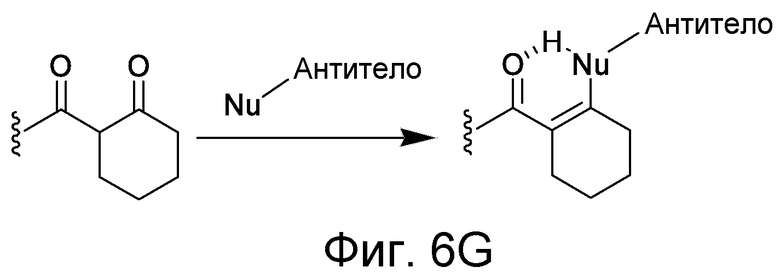
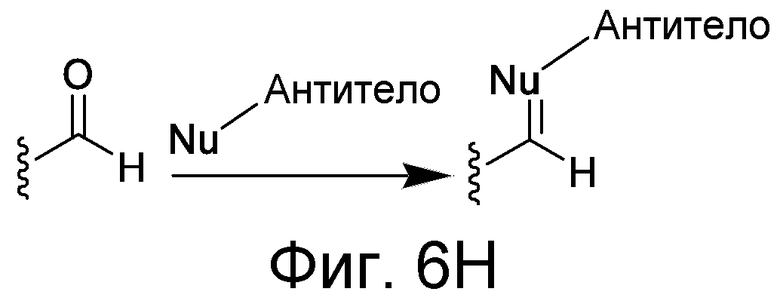
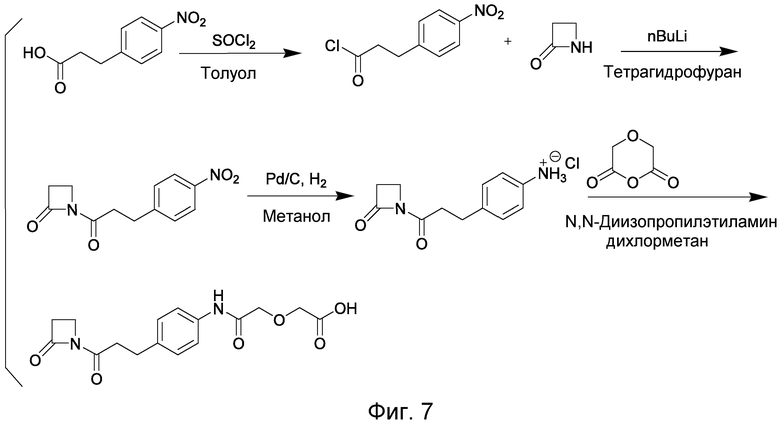
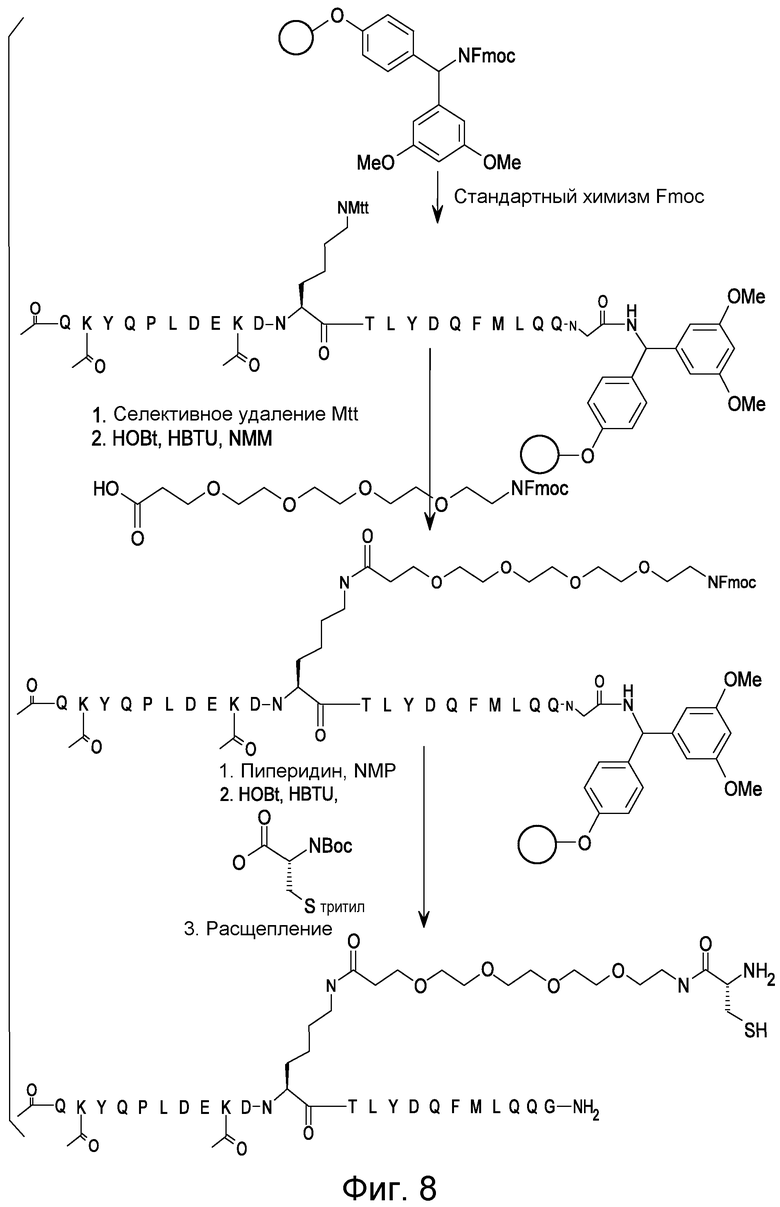
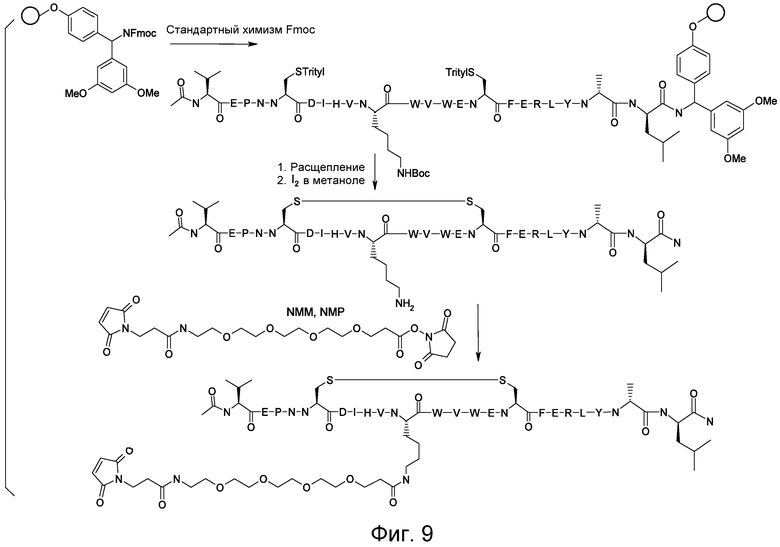
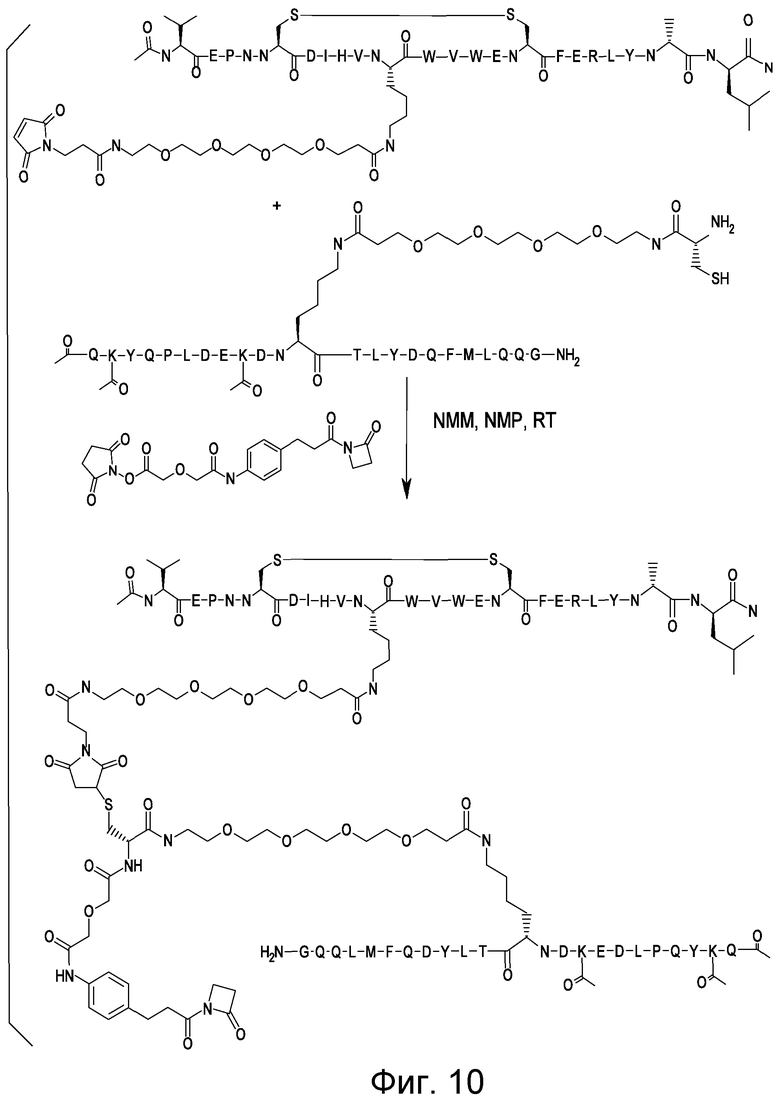
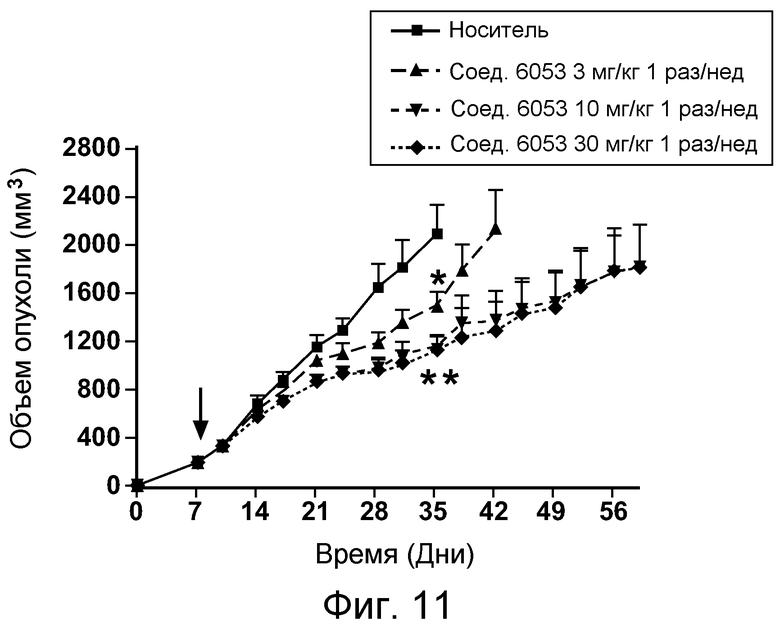
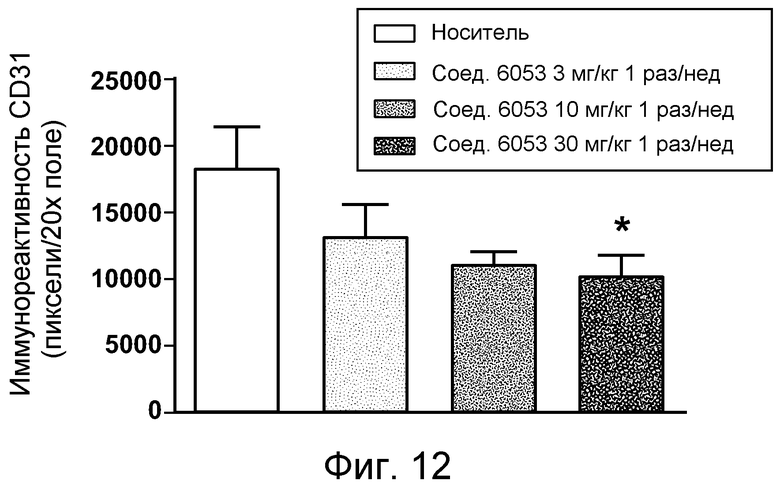
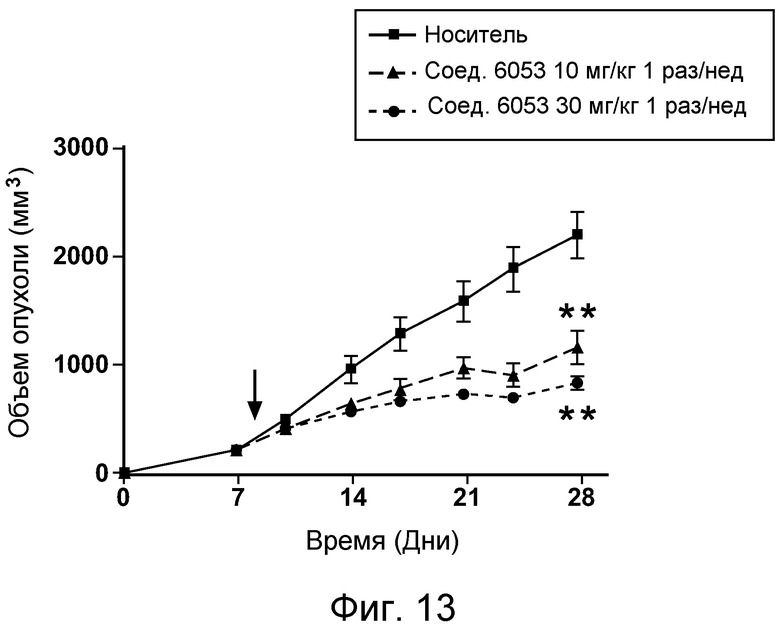
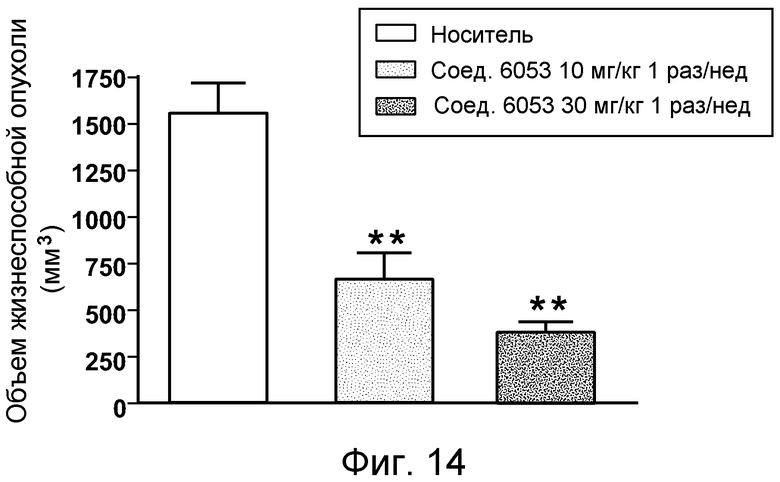
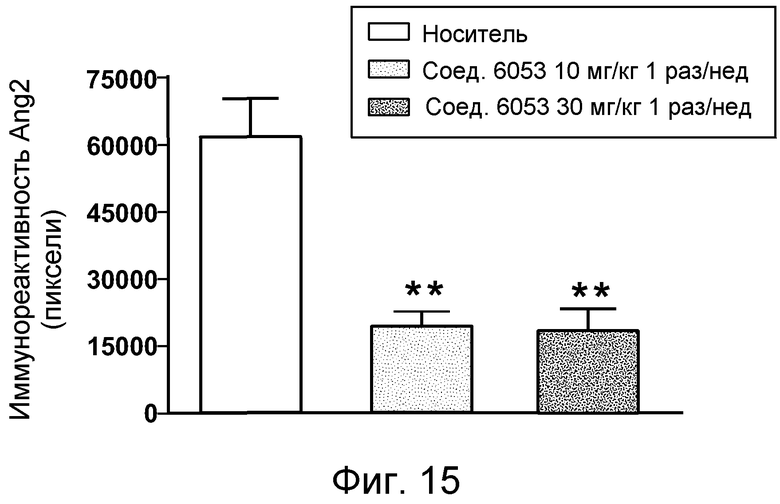
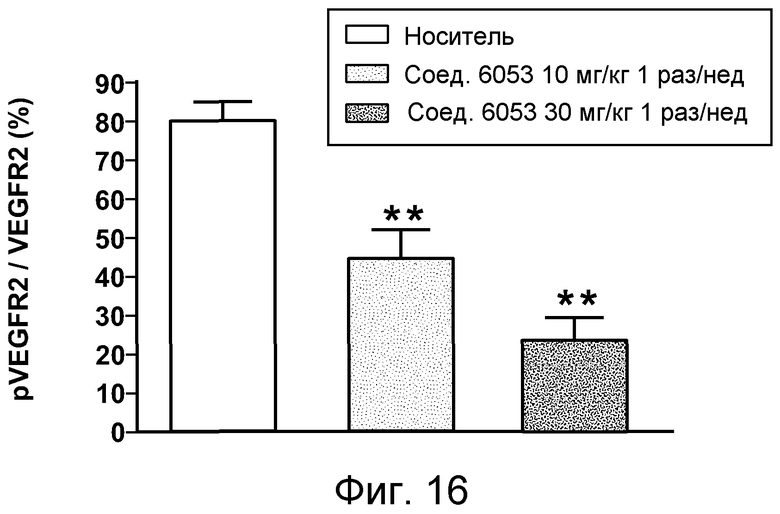
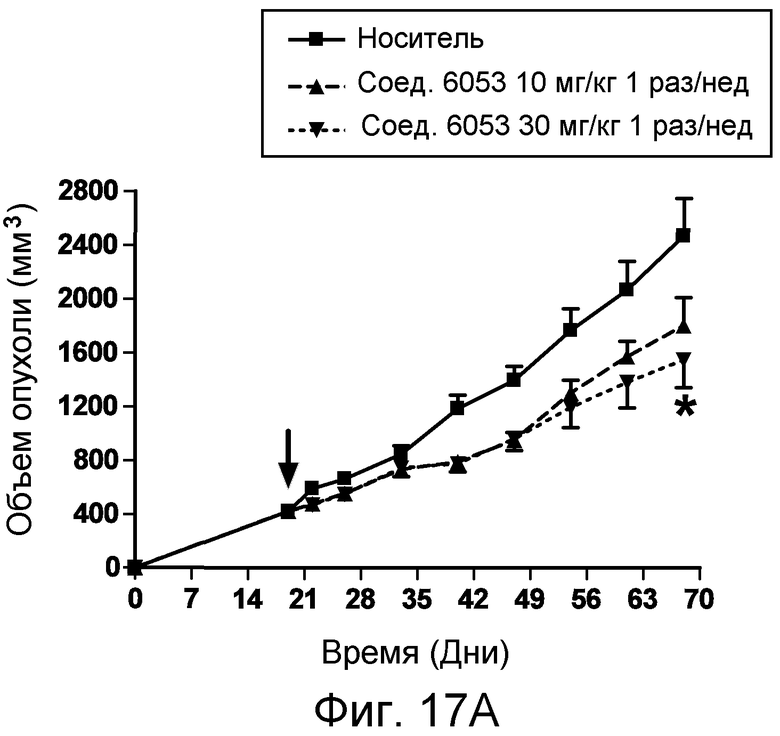
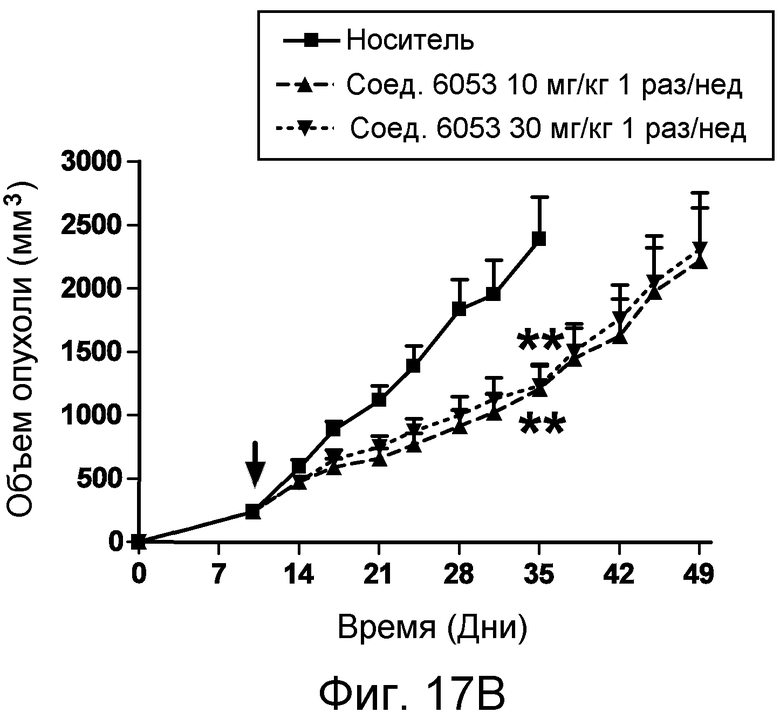
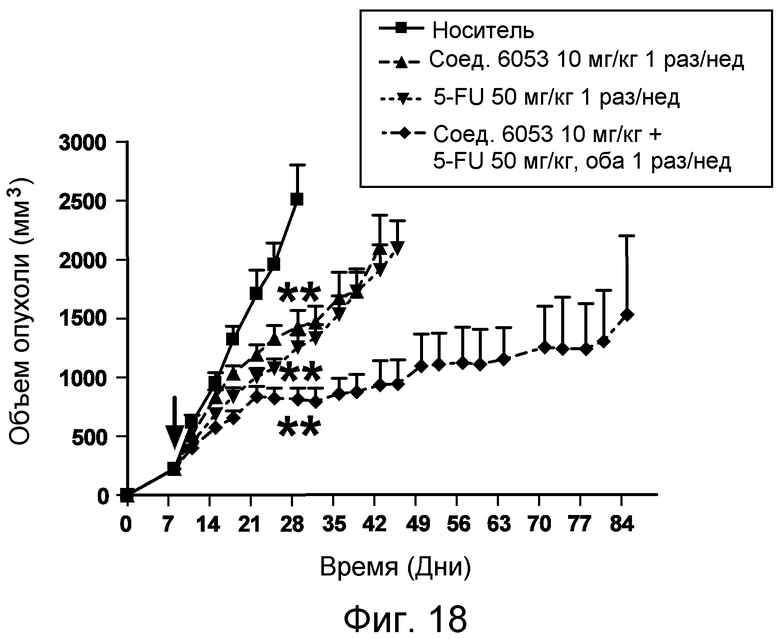
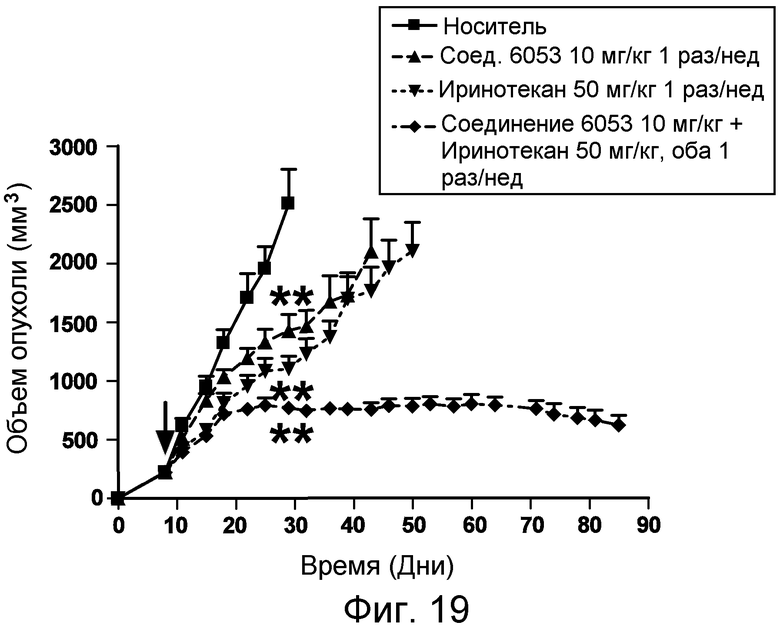
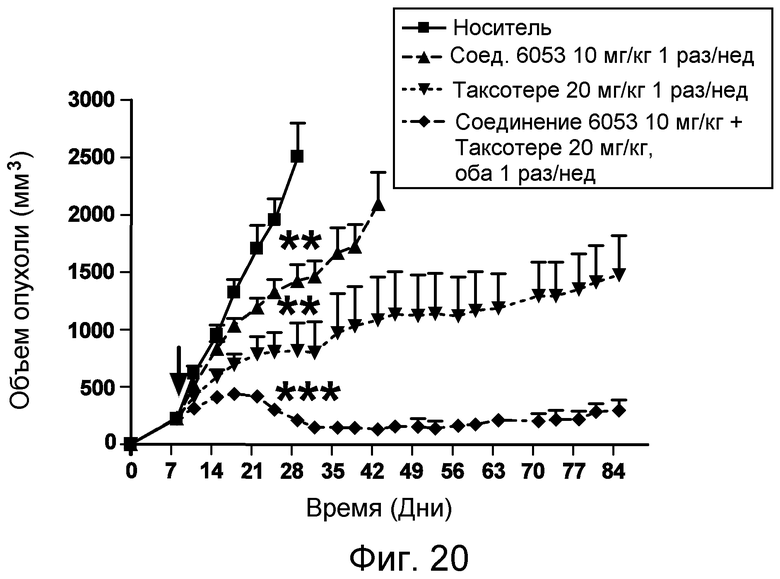
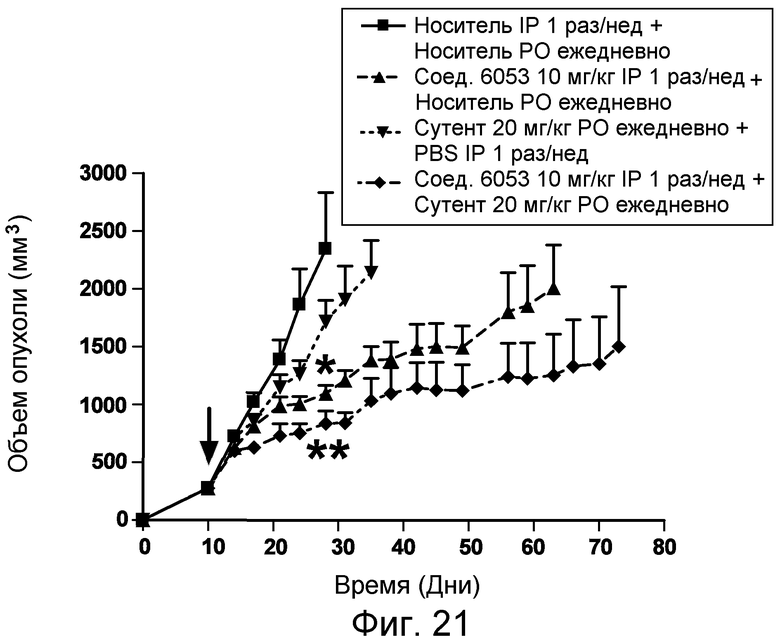
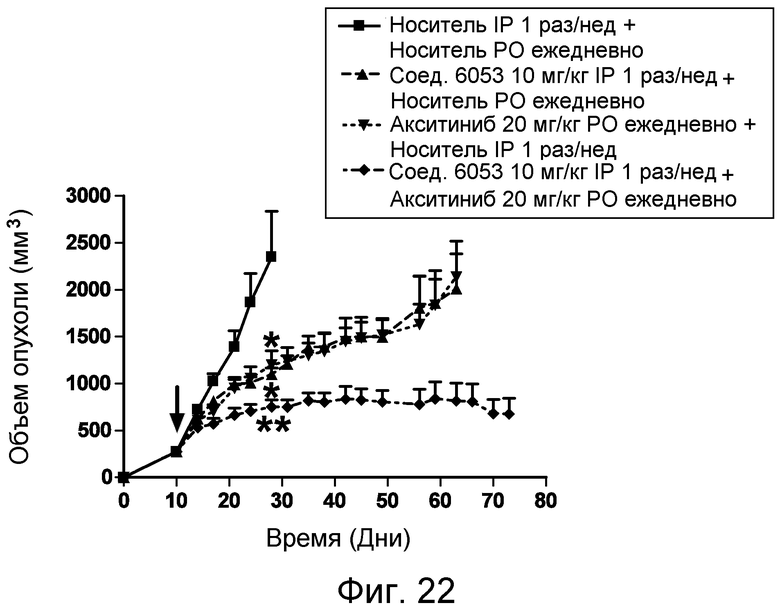
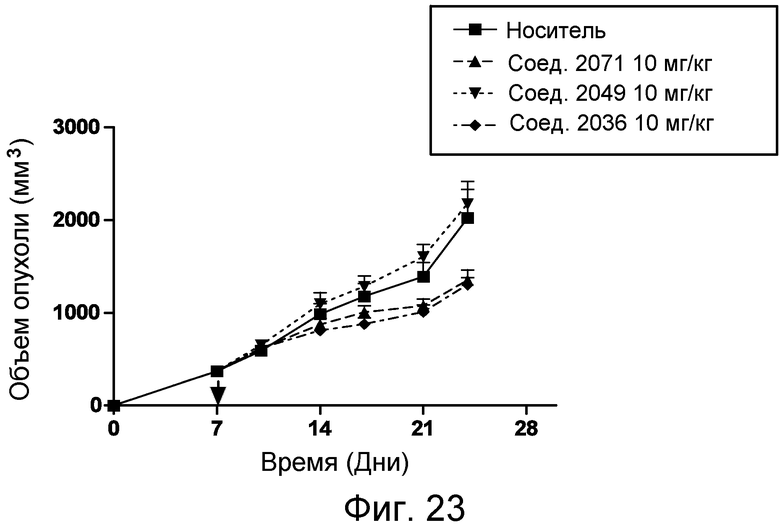
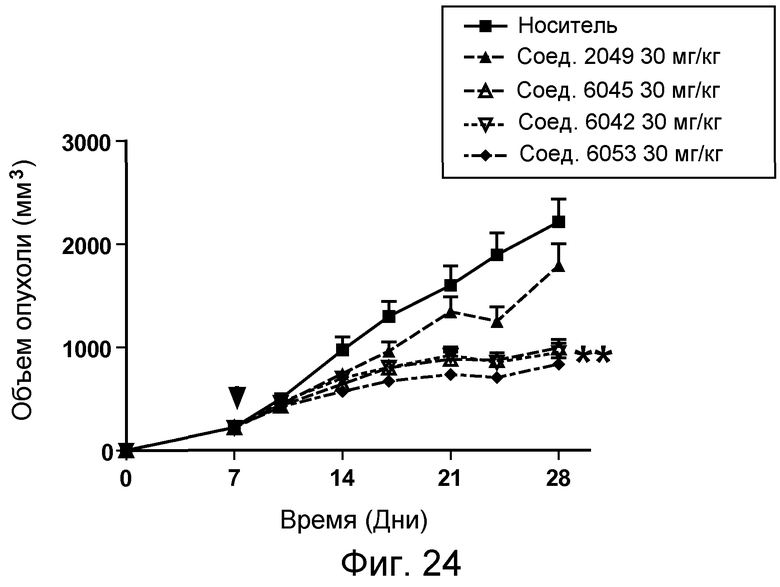
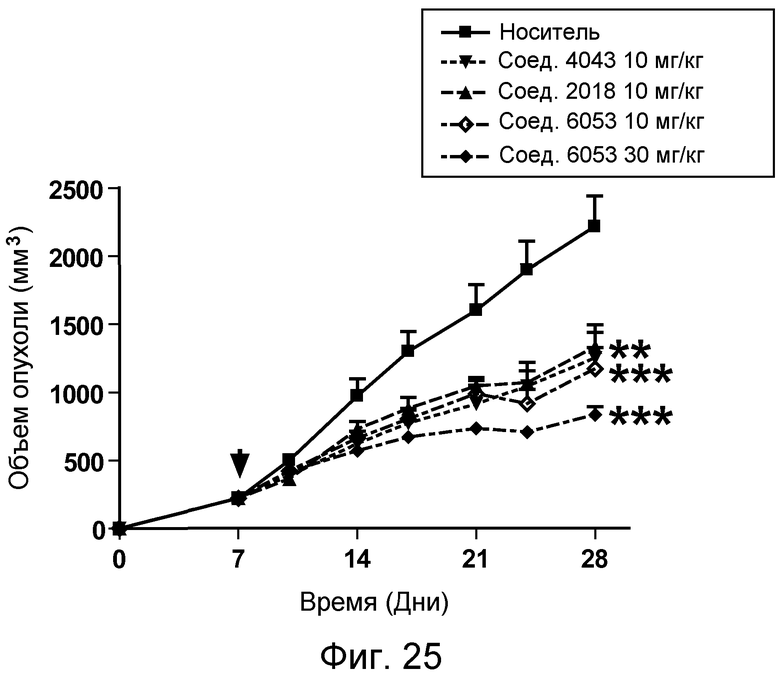
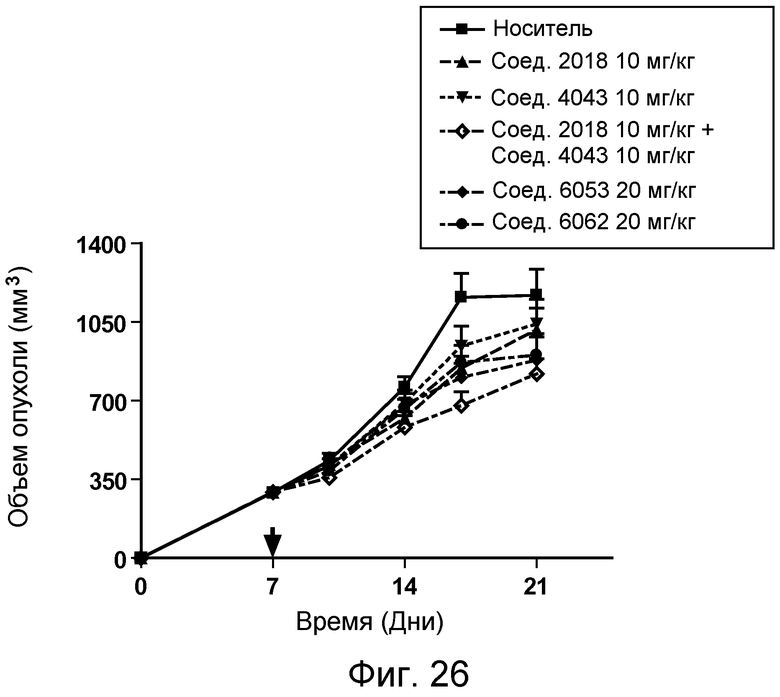
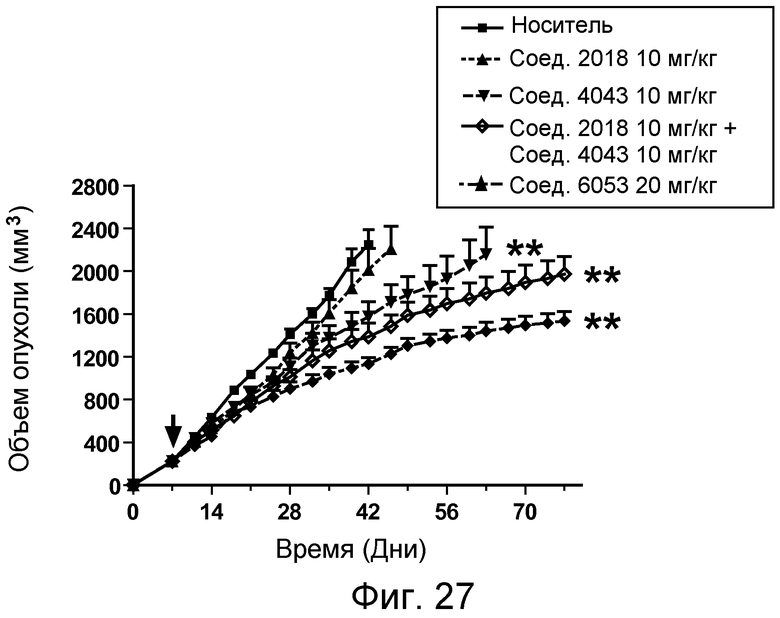
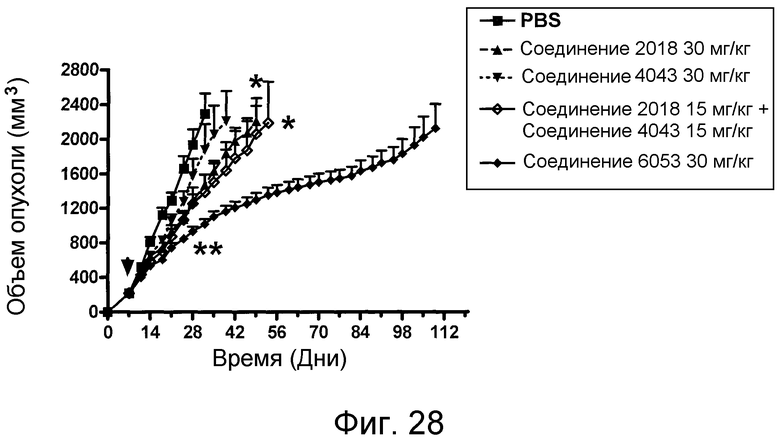
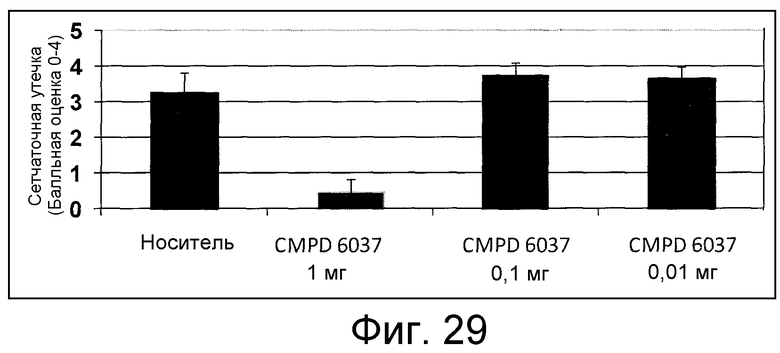
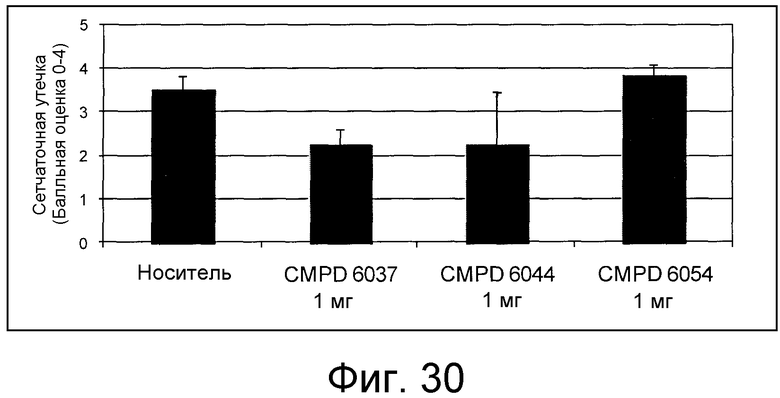
Изобретение относится к области биотехнологии и касается новых соединений, которые обладают анти-ангиогенной активностью. Охарактеризованное изобретение представляет собой пептид, связывающий эндотелиальный клеточный фактор роста (VEGF), а также пептид, связывающий VEGF, конъюгированный с молекулами антител отдельно и в сопряженной связи с другими анти-ангиогенными молекулами. Представленное решение может быть использовано для ингибирования или снижения ангиогенеза. 28 з.п. ф-лы, 14 табл., 17 пр.
1. VEGF-связывающее соединение формулы R1-[VEGF-Пептид]-R2, где [VEGF-Пептид] представляет пептид, имеющий последовательность:
V1-E2-P3-N4-C5-D6-I7-H8-V9-M10-W11-V12-W13-X14-C15-F16-E17-R18-X
19-X
20-
X
21-X
22-X
23 (SEQ ID NO:126), где R1 отсутствует или представляет CH3, C(O)CH3, C(O)CH2CH3, C(O)CH2CH2CH3, C(O)CH(CH3)CH3, C(O)CH2CH2CH2CH3, C(O)CH(CH3)CH2CH3, C(O)C6H5, C(O)CH2CH2(CH2CH2O)1-5Me, амидо-2-PEG, N-ацил и N-алкил, амино-защитную группу, группу жирной кислоты липида или углеводород; и R2 отсутствует или представляет OH, NH2, NH(CH3), NHCH2CH3, NHCH2CH2CH3, NHCH(CH3)CH3, NHCH2CH2CH2CH3, NHCH(CH3)CH2CH3, NHC6H5, NHCH2CH2OCH3, NHOCH3, NHOCH2CH3, карбокси-защитную группу, группу жирной кислоты липида или углеводород, и X14 представляет E или V, X19 может представлять любой остаток гидрофобной аминокислоты или ее D-изомер, X20 может отсутствовать или может представлять любую нейтральную, гидрофобную или ароматическую аминокислоту или ее D-изомер, X21 может отсутствовать или может представлять любой положительно заряженный остаток, или любой алифатический неполярный остаток, или его D-изоформу, X22 может отсутствовать или может быть выбран из группы, состоящей из G, V, L, I, P, S, T, W, F, E, Kac или их D-изомеров, X23 может отсутствовать или может быть выбран из группы, состоящей из G, A, I, L, Q, E, F, T, S, Y, Kac и их D-изомеров, и где одна из группы, состоящей из V1, E2, P3, N4, V9, M10, V12, X14, E17, и C-концевой остаток может быть замещен связывающим остатком, содержащим нуклеофильную боковую цепь аминогруппы N-конца или карбоксильной группы C-конца, ковалентно связанной со связывающим участком антитела непосредственно или через промежуточный линкер, причем соединяющий остаток выбран из группы, состоящей из K, R, Y, C, T, S, гомологов лизина, гомоцистеина, гомосерина, Dap, Dab, N-концевого остатка и C-концевого остатка или их фармацевтически приемлемой соли.
2. VEGF-связывающее соединение по п.1, где [VEGF-Пептид] включает последовательность, выбранную из группы, состоящей из SEQ ID NO: 35-56, 67-106, 129-130, 192-197, 200 и 210-218.
3. VEGF-связывающее соединение по п.1, где [VEGF-Пептид] включает последовательность: V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-(D-Ala)-(D-Leu) (SEQ ID NO:78).
4. VEGF-связывающее соединение по п.3, где M в положении 10 замещена связывающим остатком K, содержащим формулу (SEQ ID NO:195): V-E-P-N-C-D-I-H-V-K-W-V-W-E-C-F-E-R-L-Y-(D-Ala)-(D-Leu).
5. VEGF-связывающее соединение по п.1, где R1 обозначает C(O)CH3.
6. VEGF-связывающее соединение по п.1, где R2 обозначает NH2.
7. VEGF-связывающее соединение по п.1, где присутствует связывающий остаток, и, кроме того, включающее линейный или разветвленный линкер, ковалентно связанный с боковой цепью связывающего остатка.
8. VEGF-связывающее соединение по п.7, где линкер содержит формулу L или L', и L имеет формулу: -[Соединитель]-X-Y-Z, или -X-Y-Z-, а L' имеет формулу: -[Соединитель]-X-Y-Z', или -X-Y-Z'-, в которой: присутствует [Соединитель], где линкер является разветвленным, и, в случае присутствия, ковалентно связан со связывающим остатком, и одну или более дополнительных Активных молекул, X представляет биологически совместимую соединительную цепь, включающую любой атом, выбранный из группы, состоящей из C, H, N, O, P, S, F, CL, Br и I, и может содержать полимер или блок сополимер, и ковалентно связан с соединяющим остатком, где линкер является линейным, Y присутствует и имеет возможно замещенную структуру:

где a, b, c, d, и e независимо представляют углерод или азот; f представляет углерод, азот, кислород или серу; Y независимо присоединен к X и Z в любом из положений двух колец с достаточной валентностью; и не более чем четыре из a, b, c, d, e или f представляют одновременно азот, и предпочтительно каждый из a, b, c, d и e в кольцевой структуре представляет углерод, и Z, в случае присутствия, имеет структуру:
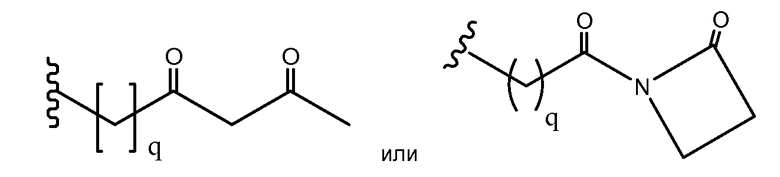
и где Z', в случае присутствия, имеет структуру:
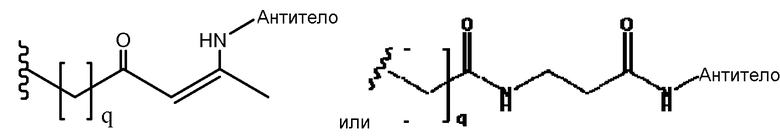
где q=0-5 и Антитело-N-, в случае присутствия, представляет ковалентную связь с боковой цепью в связывающем участке антитела.
9. VEGF-связывающее соединение по п.8, где:
X представляет:
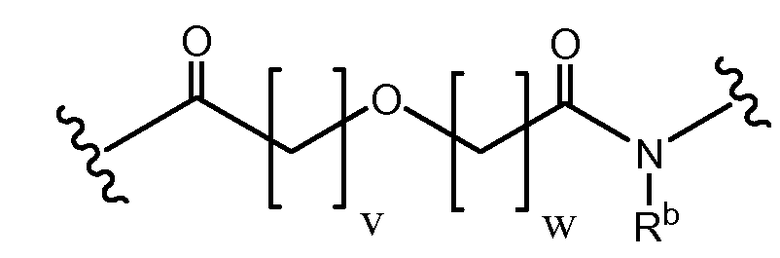
и
X-Y может представлять
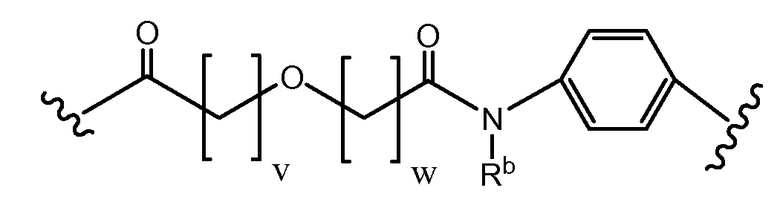
где v и w выбраны так, чтобы длина основной цепи X составляла 6-12 атомов, Rb представлял водород, замещенный или незамещенный C1-10 алкил, замещенный или незамещенный C3-7 циклоалкил-C1-6 алкил или замещенный или незамещенный арил-C1-6 алкил, V=1 или 2; w=1 или 2; и Rb представляет предпочтительно водород.
10. VEGF-связывающее соединение по п.9, где линкер является линейным и [Соединитель] отсутствует или выбран из группы, состоящей из Соединений 1001-1080, 1031-1040, 1043, 1042, 1045-1050, 1052, 1053 и 1079, как показано в Таблице 9, где Z присутствует и выбран из группы, состоящей из Соединений 2001-2005, 2007-2020, 2022-2035, 2037-2040, 2042-2043, 2045-2050, 2052-2054, 2071 и 2079, как показано в Таблице 10, где Z' присутствует.
11. VEGF-связывающее соединению по п.10, где Z' присутствует, включая формулу Соединение 2018.
12. VEGF-связывающее соединение по любому из пп.1-11, включающее формулу:
где [Активная Молекула-1] представляет [VEGF-Пептид], и [Соединитель] ковалентно связан и с [VEGF-Пептидом], и с [Активной Молекулой-2], и [Соединитель] также ковалентно связан с Линкером L или L'.
13. VEGF-связывающее соединение по п.12, где [Соединитель] имеет формулу: - [AM-1-Спейсер]-[Боковая цепь]-[AM-2-Спейсер]- и где каждый из [AM-1-Спейсера] и [AM-2-Спейсера] представляет собой независимо биологически совместимый полимер, блок сополимер C, H, N, O, P, S, галоген (F, Cl, Br, I), или их соль, алкильную, алкенильную, алкинильную, оксоалкильную, оксоалкенильную, оксоалкинильную, аминоалкильную, аминоалкенильную, аминоалкинильную, сульфоалкильную, сульфоалкенильную, сульфоалкинильную, фосфоалкильную, фосфоалкенильную или фосфоалкинильную группу, ковалентно связанную с [Боковой Цепью], и [Боковая цепь] представляет молекулу по меньшей мере с тремя реактивными группами, и [AM-1-Спейсер] ковалентно связан с [Боковой Цепью] и с [Активной Молекулой-1], и [AM-2-Спейсер] ковалентно связан с [Боковой Цепью] и с [Активной Молекулой-2].
14. VEGF-связывающее соединение по п.13, где каждый из [AM-1-Спейсера] и [AM-2-Спейсера] представляет собой независимо нейтральную, растворимую в воде молекулу, способную образовывать ковалентные связи с их соответствующей Активной Молекулой и [Боковой цепью], и выбраны из группы, состоящей из: аминокислот, модифицированных полиэтиленгликолем, двухосновных кислот полиэтиленгликоля, аминоалканоевых кислот, полиглицина, 2-PEG, 4-PEG и 6-PEG, и каждый может представлять 4-PEG.
15. VEGF-связывающее соединение по п.13, где [Боковая цепь] представляет химическую часть, содержащую три ортогональные реактивные группы и выбрана из группы, состоящей из цистеиновой боковой цепи, боковой цепи на основе диаминопропионовой кислоты, боковой цепи на основе диаминобутаноевой кислоты, боковой цепи на основе орнитина, боковой цепи на основе лизина, гомоцистеиновой боковой цепи, бисмалеимидной боковой цепи и малеимамид-кислотной боковой цепи и их производных и гомологов и следующих структур:
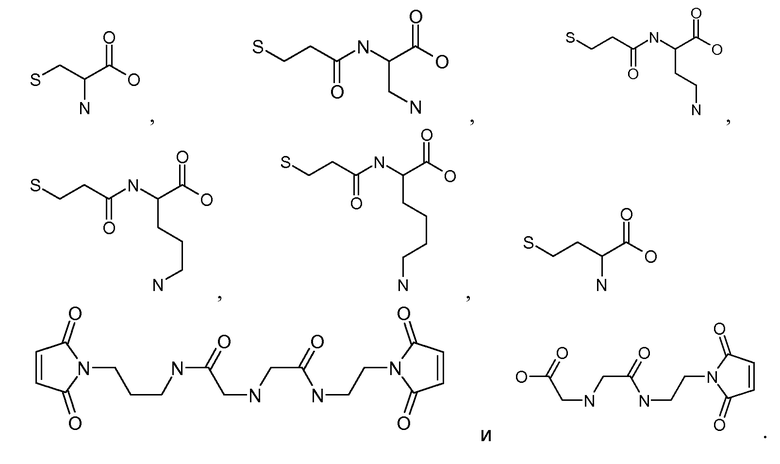
16. VEGF-связывающее соединение по п.15, где [Боковая цепь]-L выбрана из группы, состоящей из:
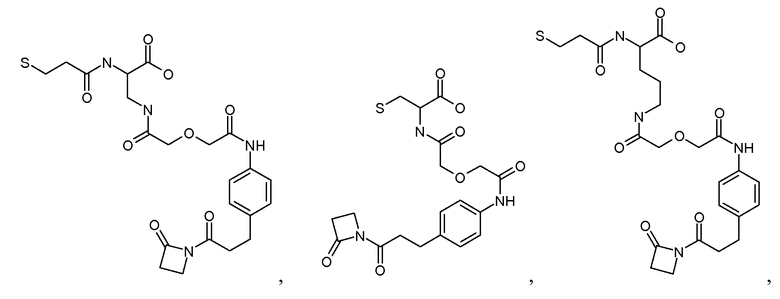
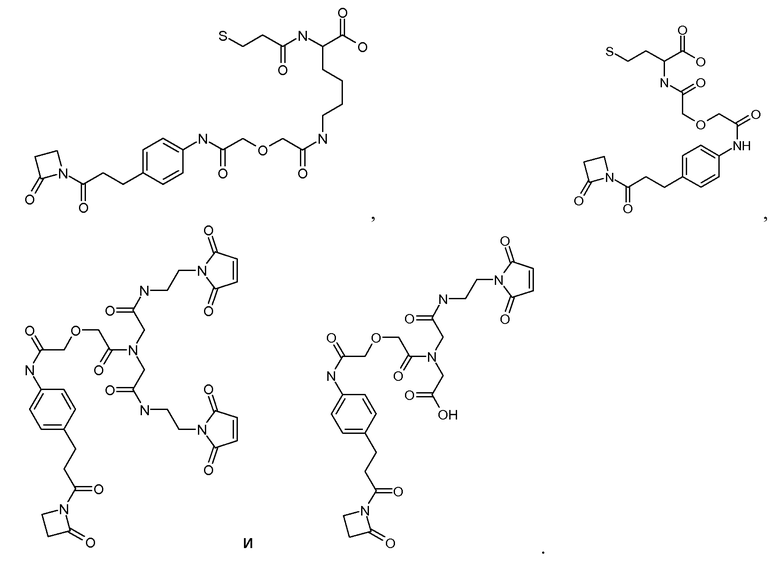
17. VEGF-связывающее соединение по п.12, где [Активная Молекула 2] представляет собой связывающий Ang-2 пептид формулы: R3-[Ang2-пептид]-R4, где R3 отсутствует или представляет CH3, C(O)CH3, C(O)CH2CH3, C(O)CH2CH2CH3, C(O)CH(CH3)CH3, C(O)CH2CH2CH2CH3, C(O)CH(CH3)CH2CH3, C(O)C6H5, C(O)CH2CH2(CH2CH2O)1-5Me, амидо-2-PEG, N-ацил и N-алкил, амино-защитную группу, группу жирной кислоты липида или углеводород; и R4 отсутствует или представляет OH, NH2, NH(CH3), NHCH2CH3, NHCH2CH2CH3, NHCH(CH3)CH3, NHCH2CH2CH2CH3, NHCH(CH3)CH2CH3, NHC6H5, NHCH2CH2OCH3, NHOCH3, NHOCH2CH3, карбокси-защитную группу, группу жирной кислоты липида или углеводород, и где [Ang2-Пептид] содержит последовательность: Q1X2Y3Q4X5L6D7E8X9D10X11X12X13X14D15X16F17M18X19Q20Q21G22 (SEQ ID NO:107), где x2 выбран из группы, состоящей из K, N, R, H, Kac, Nick и CbcK, и X5 выбран из группы, состоящей из P, hP, dhP и BnHP, и X9 выбран из группы, состоящей из L, I, ThA и Kac, и X11 выбран из группы, состоящей из Q, N, C, K, Kac, Dab и Dap, и X12 выбран из группы, состоящей из L, HL, Nva, I, HchA, HF и ThA, и X13 выбран из группы, состоящей из L, HL, Nva, I, HchA, HF и ThA, и X14 выбран из группы, состоящей из ароматических остатков, и X16 выбран из группы, состоящей из Q и N, и X19 выбран из группы, состоящей из L и I, и [Ang-2-Пептид] ковалентно связан с [Соединителем] через нуклеофильную боковую цепь N-концевой аминогруппы или C-концевую карбоксильную группу связывающего Ang2 остатка, причем связывающий Ang2 остаток выбран из группы, содержащей K, R, Y, C, T, S, гомологи лизина, гомоцистеин, гомосерин, Dap, Dab, N-концевой остаток и C-концевой остаток, и где одна из Q1, E8, X9, X11, X12, D15, X16, M18, X19 или G22 замещена связывающим Ang2 остатком.
18. VEGF-связывающее соединение по п.17, где [Ang2-пептид] содержит последовательность, выбранную из группы, состоящей из: SEQ ID NO: 137-191.
19. VEGF-связывающее соединение по п.18, где R1 представляет C(O)CH3; R2 представляет NH2 и
R1-[Ang-пептид]-R2 представляет (SEQ ID NO:153):
{C(O)CH3}-Q-(KaC)-Y-Q-P-L-D-E-(KaC)-D-K-T-L-Y-D-Q-F-M-L-Q-Q-G-{NH2} и K в положении 11 представляет связывающий Ang2 остаток, ковалентно связанный с [Соединителем].
20. VEGF-связывающее соединение по п.12, где [VEGF-Пептид] ковалентно связан с [Соединителем] через нуклеофильную боковую цепь или N-концевую аминогруппу или C-концевую карбоксильную группу связывающего VEGF остатка, причем связывающий VEGF остаток выбран из группы, содержащей K, R, Y, C, T, S, гомологи лизина, гомоцистеин, гомосерин, Dap, Dab, N-концевой остаток и C-концевой остаток.
21. VEGF-связывающее соединение по п.12, выбранное из группы, состоящей из: соединений 5004, 5011, 5018, 5022, 5032-5040, 5041-5057, 5060-5064, 5074, как показано в Таблице 11 и может быть выбрано из группы, состоящей из Соединений 5053, 5060, 5061 и 5062.
22. VEGF-связывающее соединение по п.12, где группа Z, в случае ее присутствия, ковалентно связана со связывающим участком антитела.
23. VEGF-связывающее соединение по п.22, где антитело присутствует, и соединение выбрано из группы, состоящей из: 6011, 6018, 6022, 6029, 6032-6051, 6053-6068 и 6074, как показано в Таблице 12, и может быть выбрано из группы, состоящей из Соединений 6053, 6060, 6061 и 6062.
24. VEGF-связывающее соединение по п.23, имеющее формулу Соединения 6053.
25. VEGF-связывающее соединение по п.22, где Антитело присутствует и представляет собой каталитическое антитело и может быть выбрано из группы, состоящей из антитела к альдолазе, антитела к бета-лактамазе, антитела к эстеразе и антитела к амидазе.
26. VEGF-связывающее соединение по п.25, где Антитело присутствует и представляет собой антитело полной длины, Fab, Fab', F(ab')2, Fv, dsFv, scFv, VH, VL, диатело, мини-антитело, содержащее домены VH и VL из h38c2, или антитело полной длины, содержащее домены VH и VL из h38c2 и константный домен, выбранный из группы, состоящей из IgG1, IgG2, IgG3 и IgG4, и может представлять собой h38C2 IgG1.
27. VEGF-связывающее соединение по п.26, где домен VL включает остатки 1-107 SEQ ID NO:1 и домен VH включает остатки 1-113 SEQ ID NO:2.
28. VEGF-связывающее соединение по п.27, включающее SEQ ID NO:1 и SEQ ID NO:2.
29. VEGF-связывающее соединение по п.28, включающее формулу:
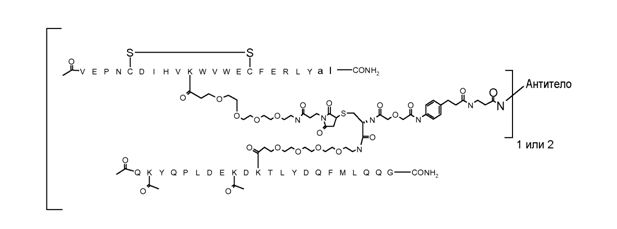
где -Антитело обозначает ковалентную связь с комбинирующим сайтом h38C2, и h38C2 включает SEQ ID NO:1 и SEQ ID NO:2, и ковалентная связь присоединена к боковой цепи Lys99 SEQ ID NO:2.
| WAYNE J.FAIRBROTHER et al., Novel Peptides Selected tj Bind Vascular Endothelial Growth Factor Target the Receptor-Binding Site, Biochemisrty 1998, Vol.37, p.p.17754-17764 | |||
| ГИДРОМЕХАНИЧЕСКИЙ ОЧИСТИТЕЛЬ КОРНЕЙ САХАРНОЙ СВЕКЛЫ | 0 |
|
SU183525A1 |
| US 2006205670 A1, 14.09.2006 | |||
| VENKATA R.DOPPALAPUDI et al., Chemically programmed antibodies: Endothelin receptor targeting Cov-BodiesTM, | |||
Авторы
Даты
2014-04-10—Публикация
2009-05-04—Подача