Ссылка на родственные заявки
[1] Согласно настоящей заявке испрашивается приоритет в соответствии с предварительной заявкой на выдачу патента США с серийным номером 62/475094, поданной 22 марта 2017 г., раскрытие которой включено в настоящий документ посредством ссылки.
Перечень последовательностей
[2] Настоящая заявка содержит перечень последовательностей, который был представлен посредством EFS-Web и настоящим полностью включен посредством ссылки. Указанная ASCII-копия, созданная 21 марта 2018 г., называется P34128_WO_Sequence Listing.txt и имеет размер 38 048 байт.
Область техники, к которой относится настоящее изобретение
[3] Настоящее изобретение относится к фармацевтическим композициям, связанным с ними способам получения и способам применения фармацевтических композиций для лечения одного или нескольких офтальмологических состояний.
Предшествующий уровень техники настоящего изобретения
[4] Основной причиной слепоты является неспособность в достаточной степени лечить определенные заболевания глаз. Основным ограничением является отсутствие подходящих вариантов введения лекарственных средств или терапевтических средств в глаз и поддержания этих лекарственных средств или агентов в терапевтически эффективной концентрации в глазах в течение необходимой продолжительности. Системное введение может не являться идеальным решением, потому что часто для достижения эффективных внутриглазных концентраций требуются неприемлемо высокие уровни системных доз при увеличении частоты возникновения неприемлемых побочных эффектов лекарственных средств. Простое закапывание глаз или нанесение на глаз во многих случаях не является приемлемой альтернативой, поскольку лекарственное средство может быстро вымываться под действием слез или истощаться из глаза, переходя в общую циркуляцию. Местная терапия глазными каплями ограничена плохой абсорбцией, необходимостью частого и/или постоянного введения доз в течение периодов времени, составляющих от нескольких дней до нескольких лет, быстрым метаболизмом в водянистой влаге, образованием и движением слезной пленки и другими причинами, которые могут эффективно удалять терапевтические средства задолго до завершения терапии или доставки надлежащей дозы.
[5] Внутриглазные инъекции обладают тем преимуществом, что они могут обеспечить улучшенную биодоступность для целевого участка (например, сетчатки) глаза по сравнению с другими механизмами доставки, такими как местная доставка. Однако они также имеют недостатки и могут представлять различные осложнения. Например, интравитреальные инъекции могут приводить к доставке нежелательно высоких концентраций терапевтического средства в целевой участок или в другой участок, особенно когда терапевтическое средство является относительно растворимым. Кроме того, внутриглазные инъекции крайне неприятны для пациента. Более того, поскольку внутриглазная инъекция сама по себе может вызывать осложнения, такие как эндофтальмит и отслоение сетчатки, очень желательно, чтобы между инъекциями был максимально возможный интервал, сохраняя при этом терапевтические уровни лекарственного средства в глазу.
[6] В дополнение к вышесказанному, терапевтические средства, доставляемые посредством интравитреальных инъекций, могут характеризоваться отсутствием продолжительности действия, поскольку средства часто могут быстро диспергироваться в глазу после инъекции. Такое отсутствие продолжительности особенно нежелательно, поскольку может потребовать большей частоты инъекций. Ранибизумаб и пегаптаниб, например, вводят пациенту посредством внутриглазной инъекции каждые 4 и 6 недель соответственно, что является крайне неприятным для пациента.
[7] Таким образом, широко распространено признание того, что более длительно действующие составы приведут к положительным результатам в области офтальмологии. Они будут полезны для ухода за пациентами и для здоровья глаз за счет обеспечения пролонгированной доставки терапевтических средств в глаз, сводя к минимуму проблемы, связанные с соблюдением пациентом предписанных терапевтических схем лечения.
[8] Экспрессия фактора роста сосудистого эндотелия (VEGF), сигнального белка, продуцируемого клетками, который стимулирует васкулогенез и ангиогенез, играет важную роль в различных офтальмологических состояниях, таких как определенные формы макулярной дегенерации и ретинопатий.
[9] На рынке представлены различные лекарственные средства для лечения таких офтальмологических состояний, например, ранибизумаб, афлиберцепт и пегаптаниб. Нанесение пациенту происходит путем внутриглазных инъекций каждые 4 и 8 недель.
[10] Ввиду вышесказанного, существует потребность в получении формы введения, которая по меньшей мере частично устраняет эти недостатки.
Краткое раскрытие настоящего изобретения
[11] Настоящее изобретение относится к конъюгатам поперечно-сшитой гиалуроновой кислоты (HA) с лекарственным средством, фармацевтическим композициям и способам применения таких конъюгатов для лечения офтальмологических показаний и способам получения конъюгатов.
[12] Согласно определенным вариантам осуществления настоящее изобретение относится к конъюгату поперечно-сшитой HA с лекарственным средством, содержащему множество полимеров гиалуроновой кислоты 2A и множество полимеров гиалуроновой кислоты 2B, где:
каждый 2A содержит множество линейно соединенных звеньев, причем звенья состоят по существу из следующего:
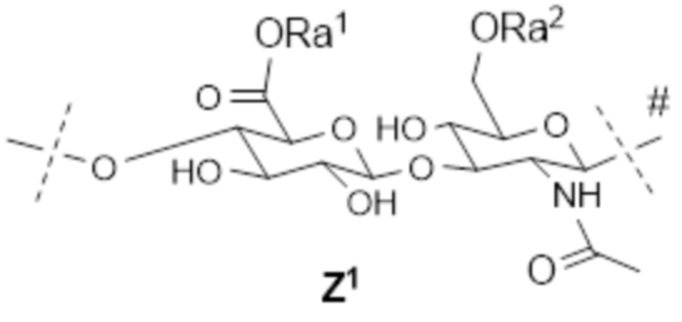 ; и
; и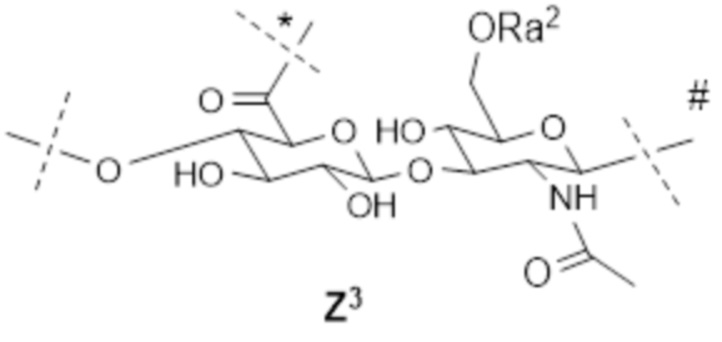 ;
;
каждый 2B содержит множество линейно соединенных звеньев, причем звенья состоят по существу из следующего:
 ;
; ; и
; и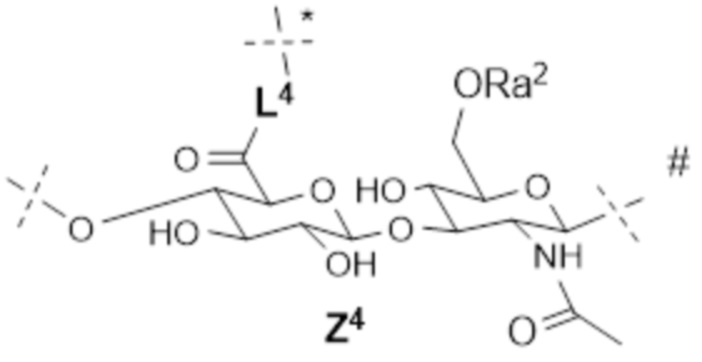 ;
;
где
пунктирная линия без отметки указывает на место прикрепления к соседнему звену на пунктирной линии, помеченной #, или к водороду,
пунктирная линия, помеченная #, указывает на место прикрепления к соседнему звену на пунктирной линии без отметки или к гидроксилу; и
пунктирная линия, помеченная *, указывает на место прикрепления поперечной сшивки между звеном Z3 в 2A и звеном Z4 в 2B, так что по меньшей мере один 2A поперечно-сшит по меньшей мере с одним 2B;
лекарственное средство представляет собой терапевтическое средство;
каждый из Ra1 и Ra2 независимо представляет собой водород; C1-4 алкил; ион щелочного металла, ион аммония, ион щелочноземельного металла или другой подходящий противоион;
L2 представляет собой обратимый линкер пролекарственного средства;
L4 представляет собой необязательно биоразлагаемый спейсер и может являться одинаковым или различным в Z2 и Z4;
2A содержит всего s звеньев, где s составляет от 25 до 2500, где;
количество звеньев Z1 в 2A составляет от приблизительно 0,8s до приблизительно 0,99s, и
количество звеньев Z3 составляет от приблизительно 0,2s до приблизительно 0,01s;
2B содержит всего t звеньев, где t составляет от 25 до 2500, где;
количество звеньев Z1 в 2B составляет от приблизительно 0,75t до приблизительно 0,94t;
объединенное количество звеньев Z2 и Z4 составляет от приблизительно 0,25t до приблизительно 0,06t;
количество звеньев Z2 составляет по меньшей мере 0,01t; и
количество звеньев Z4 составляет по меньшей мере 0,01t.
[13] Согласно определенным вариантам осуществления s составляет от 50 до 2000.
[14] Согласно определенным вариантам осуществления s составляет от 75 до 1500.
[15] Согласно определенным вариантам осуществления s составляет от 75 до 1000.
[16] Согласно определенным вариантам осуществления s составляет от 80 до 500.
[17] Согласно определенным вариантам осуществления s составляет от 100 до 250.
[18] Согласно определенным вариантам осуществления s составляет от 100 до 200.
[19] Согласно определенным вариантам осуществления s составляет от 200 до 800 или от 300 до 600.
[20] Согласно определенным вариантам осуществления t составляет от 50 до 2000.
[21] Согласно определенным вариантам осуществления t составляет от 75 до 1500.
[22] Согласно определенным вариантам осуществления t составляет от 75 до 1000.
[23] Согласно определенным вариантам осуществления t составляет от 80 до 500.
[24] Согласно определенным вариантам осуществления t составляет от 100 до 250.
[25] Согласно определенным вариантам осуществления t составляет от 100 до 200.
[26] Согласно определенным вариантам осуществления t составляет от 200 до 800 или от 300 до 600.
[27] Согласно определенным вариантам осуществления количество звеньев Z1 в 2A составляет от приблизительно 0,91s до приблизительно 0,98s.
[28] Согласно определенным вариантам осуществления количество звеньев Z1 в 2A составляет от приблизительно 0,8s до приблизительно 0,99s.
[29] Согласно определенным вариантам осуществления количество звеньев Z1 в 2A составляет от приблизительно 0,82s до приблизительно 0,99s.
[30] Согласно определенным вариантам осуществления количество звеньев Z1 в 2A составляет от приблизительно 0,84s до приблизительно 0,99s.
[31] Согласно определенным вариантам осуществления количество звеньев Z1 в 2A составляет от приблизительно 0,86s до приблизительно 0,99s.
[32] Согласно определенным вариантам осуществления количество звеньев Z1 в 2A составляет от приблизительно 0,88s до приблизительно 0,99s.
[33] Согласно определенным вариантам осуществления количество звеньев Z1 в 2A составляет от приблизительно 0,9s до приблизительно 0,99s.Согласно определенным вариантам осуществления количество звеньев Z1 в 2A составляет от приблизительно 0,92s до приблизительно 0,97s.
[34] Согласно определенным вариантам осуществления количество звеньев Z1 в 2A составляет от приблизительно 0,93s до приблизительно 0,96s.
[35] Согласно определенным вариантам осуществления количество звеньев Z1 в 2A составляет от приблизительно 0,94s до приблизительно 0,95s.
[36] Согласно определенным вариантам осуществления количество звеньев Z3 в 2A составляет от приблизительно 0,2s до приблизительно 0,01s.
[37] Согласно определенным вариантам осуществления количество звеньев Z3 в 2A составляет от приблизительно 0,18s до приблизительно 0,01s.
[38] Согласно определенным вариантам осуществления количество звеньев Z3 в 2A составляет от приблизительно 0,16s до приблизительно 0,01s.
[39] Согласно определенным вариантам осуществления количество звеньев Z3 в 2A составляет от приблизительно 0,14s до приблизительно 0,01s. Согласно определенным вариантам осуществления количество звеньев Z3 в 2A составляет от приблизительно 0,12s до приблизительно 0,01s.
[40] Согласно определенным вариантам осуществления количество звеньев Z3 в 2A составляет от приблизительно 0,10s до приблизительно 0,01s.
[41] Согласно определенным вариантам осуществления количество звеньев Z3 составляет от приблизительно 0,09s до приблизительно 0,02s.
[42] Согласно определенным вариантам осуществления количество звеньев Z3 составляет от приблизительно 0,08s до приблизительно 0,03s.
[43] Согласно определенным вариантам осуществления количество звеньев Z3 составляет от приблизительно 0,07s до приблизительно 0,04s.
[44] Согласно определенным вариантам осуществления количество звеньев Z1 в 2B составляет от приблизительно 0,88s до приблизительно 0,92s.
[45] Согласно определенным вариантам осуществления количество звеньев Z1 в 2B составляет от приблизительно 0,86s до приблизительно 0,94s.
[46] Согласно определенным вариантам осуществления количество звеньев Z1 в 2B составляет от приблизительно 0,89s до приблизительно 0,91s.
[47] Согласно определенным вариантам осуществления количество звеньев Z1 в 2B составляет от приблизительно 0,86s до приблизительно 0,94s.
[48] Согласно определенным вариантам осуществления объединенное количество звеньев Z2 и Z4 в 2B составляет от приблизительно 0,25t до приблизительно 0,05t.
[49] Согласно определенным вариантам осуществления объединенное количество звеньев Z2 и Z4 в 2B составляет от приблизительно 0,23t до приблизительно 0,05t.
[50] Согласно определенным вариантам осуществления объединенное количество звеньев Z2 и Z4 в 2B составляет от приблизительно 0,21t до приблизительно 0,05t.
[51] Согласно определенным вариантам осуществления объединенное количество звеньев Z2 и Z4 в 2B составляет от приблизительно 0,19t до приблизительно 0,05t.
[52] Согласно определенным вариантам осуществления объединенное количество звеньев Z2 и Z4 в 2B составляет от приблизительно 0,17t до приблизительно 0,05t.
[53] Согласно определенным вариантам осуществления объединенное количество звеньев Z2 и Z4 в 2B составляет от приблизительно 0,15t до приблизительно 0,05t.
[54] Согласно определенным вариантам осуществления объединенное количество звеньев Z2 и Z4 в 2B составляет от приблизительно 0,13t до приблизительно 0,05t.
[55] Согласно определенным вариантам осуществления объединенное количество звеньев Z2 и Z4 составляет от приблизительно 0,12t до приблизительно 0,06t.
[56] Согласно определенным вариантам осуществления объединенное количество звеньев Z2 и Z4 составляет от приблизительно 0,11t до приблизительно 0,07t.
[57] Согласно определенным вариантам осуществления объединенное количество звеньев Z2 и Z4 составляет от приблизительно 0,25t до приблизительно 0,06t.
[58] Согласно определенным вариантам осуществления количество звеньев Z2 составляет от 0,02t до 0,12t.
[59] Согласно определенным вариантам осуществления количество звеньев Z2 составляет от 0,04t до 0,10t.
[60] Согласно определенным вариантам осуществления количество звеньев Z2 составляет от 0,06t до 0,08t.
[61] Согласно определенным вариантам осуществления количество звеньев Z2 составляет от 0,07t до 0,08t.
[62] Согласно определенным вариантам осуществления количество звеньев Z2 составляет от 0,075t до 0,08t.
[63] Согласно определенным вариантам осуществления количество звеньев Z2 составляет 0,077t.
[64] Согласно определенным вариантам осуществления количество звеньев Z4 составляет от 0,01t до 0,12t.
[65] Согласно определенным вариантам осуществления количество звеньев Z4 составляет от 0,02t до 0,12t.
[66] Согласно определенным вариантам осуществления количество звеньев Z4 составляет от 0,04t до 0,10t.
[67] Согласно определенным вариантам осуществления количество звеньев Z4 составляет от 0,06t до 0,08t.
[68] Согласно определенным вариантам осуществления количество звеньев Z4 составляет от 0,01t до 0,04t.
[69] Согласно определенным вариантам осуществления количество звеньев Z4 составляет от 0,02t до 0,03t.
[70] Согласно определенным вариантам осуществления количество звеньев Z4 составляет от 0,02t до 0,025t.
[71] Согласно определенным вариантам осуществления количество звеньев Z4 составляет 0,023t.
[72] Согласно определенным вариантам осуществления обратимый линкер пролекарственного средства L2, присоединяющий лекарственное средство к спейсеру L4, характеризуется формулой XIIa
 XIIa
XIIa
где
пунктирная линия указывает на прикрепление к азоту соединения лекарственного средства (не показано) путем образования амидной связи;
X представляет собой C(R4R4a); N(R4); O; C(R4R4a)-C(R5R5a); C(R5R5a)-C(R4R4a); C(R4R4a)-N(R6); N(R6)-C(R4R4a); C(R4R4a)-O; O-C(R4R4a) или C(R7R7a);
X1 представляет собой C или S(O);
X2 представляет собой C(R8R8a) или C(R8R8a)-C(R9R9a);
=X3 представляет собой =O; =S или =N-CN;
R1, R1a, R2, R2a, R4, R4a, R5, R5a, R6, R8, R8a, R9, R9a независимо выбраны из группы, состоящей из H и C1-6 алкила;
R3, R3a независимо выбраны из группы, состоящей из H и C1-6 алкила, при условии, что в случае, когда один из R3, R3a или оба отличаются от H, они соединены с N, к которому они прикреплены через SP3-гибридизированный атом углерода;
R7 представляет собой N(R10R10a) или NR10-(C=O)-R11;
R7a, R10, R10a, R11 представляют собой независимо друг от друга H или C1-10 алкил;
необязательно одна или несколько из пар R1a/R4a, R1a/R5a, R1a/R7a, R4a/R5a, R8a/R9a образуют химическую связь;
необязательно одна или несколько из пар R1/R1a, R2/R2a, R4/R4a, R5/R5a, R8/R8a, R9/R9a соединены вместе с атомом, к которому они прикреплены, с образованием C3-10 циклоалкила или 3-10-членного гетероциклила;
необязательно одна или несколько из пар R1/R4, R1/R5, R1/R6, R1/R7a, R4/R5, R4/R6, R8/R9, R2/R3 соединены вместе с атомами, к которым они прикреплены, с образованием кольца A;
необязательно R3/R3a соединены вместе с атомом азота, к которому они прикреплены, с образованием 3-10-членного гетероцикла;
кольцо A выбрано из группы, состоящей из фенила; нафтила; инденила; инданила; тетралинила; C3-10 циклоалкила; 3-10-членного гетероциклила и 8-11-членного гетеробициклила; и
где группа согласно формуле XIIa замещена L4 при условии, что водород, помеченный звездочкой в формуле (XIIa), не замещен L4 или другим заместителем;
где L4 представляет собой одинарную химическую связь или фрагмент спейсера, как определено в настоящем документе.
[73] Согласно определенным вариантам осуществления обратимый линкер пролекарственного средства L2 характеризуется формулой VIIa:
 VIIa
VIIa
где:
каждая звездочка представляет независимый сайт прикрепления к спейсеру L4.
[74] Согласно определенным вариантам осуществления обратимый линкер пролекарственного средства L2 вместе со спейсером L4 характеризуется формулой VIIc:
 VIIc.
VIIc.
где:
крайняя правая волнистая линия представляет место прикрепления к атому азота лекарственного средства; и
крайняя левая волнистая линия представляет место прикрепления к звену Z2 гиалуроновой кислоты 2B.
[75] Согласно определенным вариантам осуществления спейсер L4, соединяющий полимер гиалуроновой кислоты 2A с полимером гиалуроновой кислоты 2B (путем соединения звена Z3 полимера 2A со звеном Z4 полимера 2B), характеризуется формулой:

где:
крайняя правая волнистая линия представляет место прикрепления к звену Z3 на полимере гиалуроновой кислоты 2A; и
крайняя левая волнистая линия представляет место прикрепления к звену Z4 на полимере гиалуроновой кислоты 2B.
[76] Спейсер L4, соединяющий полимер гиалуроновой кислоты 2A с полимером гиалуроновой кислоты 2B, согласно определенным вариантам осуществления может быть перевернут по ориентации так, что крайняя правая волнистая линия в приведенной выше формуле представляет место прикрепления к звену Z4 на полимере гиалуроновой кислоты 2B; а крайняя левая волнистая линия представляет место прикрепления к звену Z3 на полимере гиалуроновой кислоты 2A.
[77] Согласно определенным вариантам осуществления спейсер L4, соединяющий обратимый линкер пролекарственного средства L2 с полимером гиалуроновой кислоты 2B, характеризуется формулой
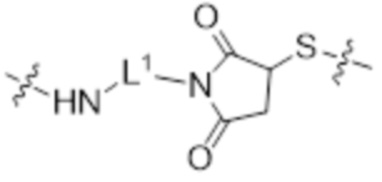
где:
крайняя правая волнистая линия представляет место прикрепления к L2; и
крайняя левая волнистая линия представляет место прикрепления к звену Z2 на полимере гиалуроновой кислоты 2B;
где:
L1 представляет собой спейсер; и
L3 представляет собой биоразлагаемый спейсер.
[78] Согласно определенным вариантам осуществления звено Z4 представляет собой ;
;
где L1, L3 и Ra2 являются такими, как определено в настоящем документе.
[79] Согласно определенным вариантам осуществления звено Z2 представляет собой ;
;
где L1, L2, L3 и Ra2 являются такими, как определено в настоящем документе.
[80] Согласно определенным вариантам осуществления спейсер L4, соединяющий полимер гиалуроновой кислоты 2A с полимером гиалуроновой кислоты 2B, характеризуется формулой:

где:
крайняя правая волнистая линия представляет место прикрепления к звену Z3 на полимере гиалуроновой кислоты 2B; и
крайняя левая волнистая линия представляет место прикрепления к звену Z4 на полимере гиалуроновой кислоты 2A;
LA представляет собой спейсер;
LB представляет собой спейсер; и
LC представляет собой биоразлагаемый спейсер.
[81] Согласно определенным вариантам осуществления спейсер L4, соединяющий полимер гиалуроновой кислоты 2A с полимером гиалуроновой кислоты 2B, характеризуется формулой:
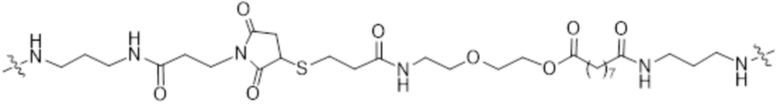
где:
крайняя правая волнистая линия представляет место прикрепления к звену Z3 на полимере гиалуроновой кислоты 2A; и
крайняя левая волнистая линия представляет место прикрепления к звену Z4 на полимере гиалуроновой кислоты 2B.
[82] Согласно определенным вариантам осуществления спейсер L4, соединяющий обратимый линкер пролекарственного средства L2 с полимером гиалуроновой кислоты 2A, характеризуется формулой

где:
крайняя правая волнистая линия представляет место прикрепления к L2; и
крайняя левая волнистая линия представляет место прикрепления к звену Z2 на полимере гиалуроновой кислоты 2B;
где:
LA представляет собой спейсер;
LB представляет собой спейсер; и
LC представляет собой биоразлагаемый спейсер.
[83] Согласно определенным вариантам осуществления LA представляет собой необязательно замещенный и/или необязательно прерванный C1-10 алкилен.
[84] Согласно определенным вариантам осуществления LA представляет собой неразветвленный C2-4 алкилен.
[85] Согласно определенным вариантам осуществления LB представляет собой неразветвленный -(O)-C1-5 алкилен.
[86] Согласно определенным вариантам осуществления LC представляет собой:
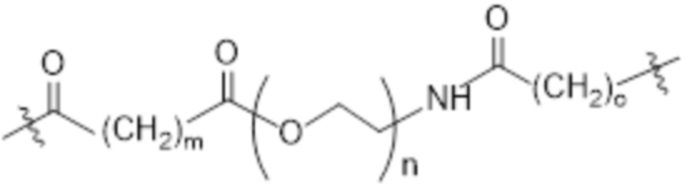
где m составляет от 0 до 10, n составляет от 1 до 4, и o составляет от 1 до 4.
[87] Согласно определенным вариантам осуществления LC представляет собой:
 .
.
[88] Согласно определенным вариантам осуществления спейсер L4, соединяющий обратимый линкер пролекарственного средства L2 с полимером гиалуроновой кислоты 2B, характеризуется формулой
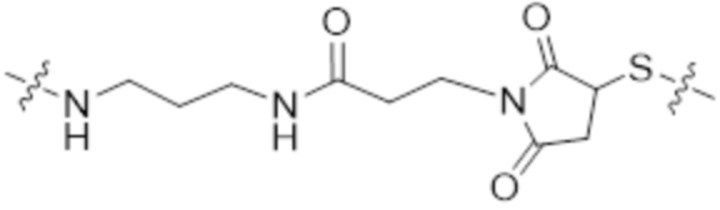
где:
крайняя правая волнистая линия представляет место прикрепления к звену Z3 на полимере гиалуроновой кислоты 2A; и
крайняя левая волнистая линия представляет место прикрепления к звену Z4 на полимере гиалуроновой кислоты 2B.
[89] Согласно определенным вариантам осуществления звено Z4 представляет собой:

где Ra2 является таким, как определено в настоящем документе.
[90] Согласно определенным вариантам осуществления звено Z2 представляет собой
 ;
;
где L2, Ra2 и лекарственное средство являются такими, как определено в настоящем документе.
[91] Согласно определенным вариантам осуществления звено Z2 представляет собой

где Ra2 и лекарственное средство являются такими, как определено в настоящем документе.
[92] Согласно определенным вариантам осуществления объединенный обратимый линкер пролекарственного средства L2 вместе со спейсером L4 характеризуется формулой VIId
 VIId
VIId
где:
крайняя правая волнистая линия представляет место прикрепления к атому азота лекарственного средства; и
крайняя левая волнистая линия представляет место прикрепления к звену Z2 гиалуроновой кислоты 2B.
[93] Согласно определенным вариантам осуществления лекарственное средство представляет собой антитело.
[94] Согласно определенным вариантам осуществления антитело представляет собой антагонист VEGF.
[95] Согласно определенным вариантам осуществления антитело представляет собой фрагмент антитела к VEGF.
[96] Согласно определенным вариантам осуществления фрагмент антитела представляет собой фрагмент антитела Fab.
[97] Согласно определенным вариантам осуществления фрагмент антитела Fab представляет собой ранибизумаб или LUCENTIS®.
[98] Согласно определенным вариантам осуществления антитело содержит следующие шесть гипервариабельных областей (HVR):
(a) HVR-H1, содержащая аминокислотную последовательность согласно DYWIH (SEQ ID NO: 1);
(b) HVR-H2, содержащая аминокислотную последовательность согласно GX1TPX2GGX3X4X5YX6DSVX7X8 (SEQ ID NO: 2), где X1 представляет собой Ile или His, X2 представляет собой Ala или Arg, X3 представляет собой Tyr или Lys, X4 представляет собой Thr или Glu, X5 представляет собой Arg, Tyr, Gln или Glu, X6 представляет собой Ala или Glu, X7 представляет собой Lys или Glu, и X8 представляет собой Gly или Glu;
(c) HVR-H3, содержащая аминокислотную последовательность согласно FVFFLPYAMDY (SEQ ID NO: 3);
(d) HVR-L1, содержащая аминокислотную последовательность согласно RASQX1VSTAVA (SEQ ID NO: 4), где X1 представляет собой Asp или Arg;
(e) HVR-L2, содержащая аминокислотную последовательность согласно X1ASFLYS (SEQ ID NO: 5), где X1 представляет собой Ser или Met; и
(f) HVR-L3, содержащая аминокислотную последовательность согласно X1QGYGX2PFT (SEQ ID NO: 6), где X1 представляет собой Gln, Asn или Thr, и X2 представляет собой Ala, Asn, Gln или Arg.
[99] Согласно определенным вариантам осуществления антитело содержит следующие шесть HVR:
(a) HVR-H1, содержащая аминокислотную последовательность согласно DYWIH (SEQ ID NO: 1);
(b) HVR-H2, содержащая аминокислотную последовательность согласно GITPAGGYTRYADSVKG (SEQ ID NO: 7), GITPAGGYEYYADSVKG (SEQ ID NO: 21) или GITPAGGYEYYADSVEG (SEQ ID NO: 22);
(c) HVR-H3, содержащая аминокислотную последовательность согласно FVFFLPYAMDY (SEQ ID NO: 3);
(d) HVR-L1, содержащая аминокислотную последовательность согласно RASQDVSTAVA (SEQ ID NO: 8);
(e) HVR-L2, содержащая аминокислотную последовательность согласно SASFLYS (SEQ ID NO: 9); и
(f) HVR-L3, содержащая аминокислотную последовательность согласно QQGYGAPFT (SEQ ID NO: 10) или QQGYGNPFT (SEQ ID NO: 23).
[100] Согласно определенным вариантам осуществления антитело содержит следующие шесть HVR:
(a) HVR-H1, содержащая аминокислотную последовательность согласно DYWIH (SEQ ID NO: 1);
(b) HVR-H2, содержащая аминокислотную последовательность согласно GITPAGGYTRYADSVKG (SEQ ID NO: 7);
(c) HVR-H3, содержащая аминокислотную последовательность согласно FVFFLPYAMDY (SEQ ID NO: 3);
(d) HVR-L1, содержащая аминокислотную последовательность согласно RASQDVSTAVA (SEQ ID NO: 8);
(e) HVR-L2, содержащая аминокислотную последовательность согласно SASFLYS (SEQ ID NO: 9); и
(f) HVR-L3, содержащая аминокислотную последовательность согласно QQGYGAPFT (SEQ ID NO: 10).
[101] Согласно определенным вариантам осуществления антитело дополнительно содержит следующие каркасные области (FR) вариабельного домена тяжелой цепи (VH):
(a) FR-H1, содержащая аминокислотную последовательность согласно EVQLVESGGGLVQPGGSLRLSCAASGFTIS (SEQ ID NO: 13);
(b) FR-H2, содержащая аминокислотную последовательность согласно WVRQAPGKGLEWVA (SEQ ID NO: 14);
(c) FR-H3, содержащая аминокислотную последовательность согласно RFTISADTSKNTAYLQMRSLRAEDTAVYYCAR (SEQ ID NO: 15); и
(d) FR-H4, содержащая аминокислотную последовательность согласно WGQGTLVTVSS (SEQ ID NO: 16).
[102] Согласно определенным вариантам осуществления антитело дополнительно содержит следующие FR вариабельного домена легкой цепи (VL):
(a) FR-L1, содержащая аминокислотную последовательность согласно DIQMTQSPSSLSASVGDRVTITC (SEQ ID NO: 17);
(b) FR-L2, содержащая аминокислотную последовательность согласно WYQQKPGKAPKLLIY (SEQ ID NO: 18);
(c) FR-L3, содержащая аминокислотную последовательность согласно GVPSRFSGSGSGTDFTLTISSLQPEDAATYYC (SEQ ID NO: 19); и
(d) FR-L4, содержащая аминокислотную последовательность согласно FGQGTKVEIK (SEQ ID NO: 20).
[103] Согласно определенным вариантам осуществления антитело содержит следующие шесть HVR:
[104] (a) HVR-H1, содержащая аминокислотную последовательность согласно DYWIH (SEQ ID NO: 1);
[105] (b) HVR-H2, содержащая аминокислотную последовательность согласно GITPAGGYEYYADSVEG (SEQ ID NO: 22);
[106] (c) HVR-H3, содержащая аминокислотную последовательность согласно FVFFLPYAMDY (SEQ ID NO: 3);
[107] (d) HVR-L1, содержащая аминокислотную последовательность согласно RASQDVSTAVA (SEQ ID NO: 8);
[108] (e) HVR-L2, содержащая аминокислотную последовательность согласно SASFLYS (SEQ ID NO: 9); и
(f) HVR-L3, содержащая аминокислотную последовательность согласно QQGYGNPFT (SEQ ID NO: 23).
[109] Согласно определенным вариантам осуществления антитело дополнительно содержит следующие FR домена VL:
(a) FR-L1, содержащая аминокислотную последовательность согласно DIQMTQSPSSLSASVGDRVTITC (SEQ ID NO: 17);
(b) FR-L2, содержащая аминокислотную последовательность согласно WYQQKPGKAPKLLIY (SEQ ID NO: 18);
(c) FR-L3, содержащая аминокислотную последовательность согласно GVPSRFSGSGSGTDFTLTISSLQPEDFATYYC (SEQ ID NO: 24); и
(d) FR-L4, содержащая аминокислотную последовательность согласно FGQGTKVEIK (SEQ ID NO: 20).
[110] Согласно определенным вариантам осуществления антитело содержит следующие шесть HVR:
(a) HVR-H1, содержащая аминокислотную последовательность согласно DYWIH (SEQ ID NO: 1);
(b) HVR-H2, содержащая аминокислотную последовательность согласно GITPAGGYEYYADSVEG (SEQ ID NO: 22);
(c) HVR-H3, содержащая аминокислотную последовательность согласно FVFFLPYAMDY (SEQ ID NO: 3);
(d) HVR-L1, содержащая аминокислотную последовательность согласно RASQDVSTAVA (SEQ ID NO: 8);
(e) HVR-L2, содержащая аминокислотную последовательность согласно SASFLYS (SEQ ID NO: 9); и
(f) HVR-L3, содержащая аминокислотную последовательность согласно QQGYGAPFT (SEQ ID NO: 10).
[111] Согласно определенным вариантам осуществления антитело дополнительно содержит следующие FR домена VL:
(a) FR-L1, содержащая аминокислотную последовательность согласно DIQMTQSPSSLSASVGDRVTITC (SEQ ID NO: 17), DIQMTQSPESLSASVGDEVTITC (SEQ ID NO: 25) или DIQMTQSPSSLSASVGDEVTITC (SEQ ID NO: 26);
(b) FR-L2, содержащая аминокислотную последовательность согласно WYQQKPGKAPKLLIY (SEQ ID NO: 18) или WYQQKPGEAPKLLIY (SEQ ID NO: 27);
(c) FR-L3, содержащая аминокислотную последовательность согласно GVPSRFSGSGSGTDFTLTISSLQPEDAATYYC (SEQ ID NO: 19) или GVPSRFSGSGSGTDFTLTIESLQPEDAATYYC (SEQ ID NO: 28); и
(d) FR-L4, содержащая аминокислотную последовательность согласно FGQGTKVEIK (SEQ ID NO: 20).
[112] Согласно определенным вариантам осуществления антитело дополнительно содержит следующие FR домена VH:
(a) FR-H1, содержащая аминокислотную последовательность согласно EEQLVEEGGGLVQPGESLELSCAASGFEIS (SEQ ID NO: 29) или EEQLVEEGGGLVQPGESLRLSCAASGFEIS (SEQ ID NO: 51);
(b) FR-H2, содержащая аминокислотную последовательность согласно WVRQEPGEGLEWVA (SEQ ID NO: 30);
(c) FR-H3, содержащая аминокислотную последовательность согласно RFTISADTSENTAYLQMNELRAEDTAVYYCAR (SEQ ID NO: 31); и
(d) FR-H4, содержащая аминокислотную последовательность согласно WGQGELVTVSS (SEQ ID NO: 32).
[113] Согласно определенным вариантам осуществления антитело дополнительно содержит следующие FR домена VH:
(e) FR-H1, содержащая аминокислотную последовательность согласно EEQLVEEGGGLVQPGESLELSCAASGFEIS (SEQ ID NO: 29) или EEQLVEEGGGLVQPGESLRLSCAASGFEIS (SEQ ID NO: 52);
(f) FR-H2, содержащая аминокислотную последовательность согласно WVRQEPGEGLEWVA (SEQ ID NO: 30);
(g) FR-H3, содержащая аминокислотную последовательность согласно RFTISADTSENTAYLQMNELRAEDTAVYYCAR (SEQ ID NO: 31); и
(h) FR-H4, содержащая аминокислотную последовательность согласно WGQGELVTVSS (SEQ ID NO: 32).
[114] Согласно определенным вариантам осуществления антитело содержит (a) домен VH, содержащий аминокислотную последовательность, характеризующуюся по меньшей мере 95% идентичности последовательности по отношению к аминокислотной последовательности согласно SEQ ID NO: 11, 40 или 42; (b) домен VL, содержащий аминокислотную последовательность, характеризующуюся по меньшей мере 95% идентичности последовательности по отношению к аминокислотной последовательности согласно SEQ ID NO: 12, 41 или 46; или (c) домен VH, как в (a), и домен VL, как в (b).
[115] Согласно определенным вариантам осуществления антитело содержит (a) домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO:11, 40 или 42; (b) домен VL, содержащий аминокислотную последовательность согласно SEQ ID NO: 12, 41 или 46; или (c) домен VH, как в (a), и домен VL, как в (b).
[116] Согласно определенным вариантам осуществления антитело содержит домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO:11, и домен VL, содержащий аминокислотную последовательность согласно SEQ ID NO:12.
[117] Согласно определенным вариантам осуществления антитело содержит тяжелую цепь, содержащую аминокислотную последовательность согласно SEQ ID NO:48, и легкую цепь, содержащую аминокислотную последовательность согласно SEQ ID NO:50.
[118] Согласно определенным вариантам осуществления антитело содержит тяжелую цепь, содержащую аминокислотную последовательность согласно SEQ ID NO:49, и легкую цепь, содержащую аминокислотную последовательность согласно SEQ ID NO:50.
[119] Согласно определенным вариантам осуществления конъюгат антитело с гидрогелем характеризуется офтальмологическим эффективным периодом полужизни, который является увеличенным по отношению к эталонному антителу, которое не является ковалентно прикрепленным к гидрогелю.
[120] Согласно определенным вариантам осуществления офтальмологический эффективный период полужизни является увеличенным по меньшей мере приблизительно 2-кратно по отношению к эталонному антителу.
[121] Согласно определенным вариантам осуществления офтальмологический эффективный период полужизни является увеличенным по меньшей мере приблизительно 5-кратно по отношению к эталонному антителу.
[122] Согласно определенным вариантам осуществления офтальмологический эффективный период полужизни является увеличенным по меньшей мере приблизительно 8-кратно по отношению к эталонному антителу.
[123] Согласно определенным вариантам осуществления офтальмологический эффективный период полужизни является увеличенным по меньшей мере приблизительно 10-кратно по отношению к эталонному антителу.
[124] Согласно определенным вариантам осуществления офтальмологический эффективный период полужизни является увеличенным по меньшей мере приблизительно 12-кратно по отношению к эталонному антителу.
[125] Согласно определенным вариантам осуществления офтальмологический эффективный период полужизни является увеличенным по меньшей мере приблизительно 15-кратно по отношению к эталонному антителу.
[126] Согласно определенным вариантам осуществления офтальмологический эффективный период полужизни является увеличенным по меньшей мере приблизительно 16-кратно по отношению к эталонному антителу.
[127] Согласно определенным вариантам осуществления офтальмологический эффективный период полужизни представляет собой витреальный период полужизни.
[128] Согласно определенным вариантам осуществления эталонное антитело является идентичным антителу конъюгата антитела.
[129] Согласно определенным вариантам осуществления настоящее изобретение относится к фармацевтической композиции для применения в качестве лекарственного средства, для применения при производстве лекарственного средства для лечения нарушения, ассоциированного с патологическим ангиогенезом у субъекта, для применения в снижении или ингибировании ангиогенеза у субъекта с нарушением, ассоциированным с патологическим ангиогенезом, и/или для использования при лечении нарушением, ассоциированного с патологическим ангиогенезом у субъекта
[130] Согласно определенным вариантам осуществления фармацевтическая композиция содержит конъюгат гидрогеля и фармацевтически приемлемый носитель, вспомогательное вещество или разбавитель.
[131] Согласно определенным вариантам осуществления фармацевтическая композиция дополнительно содержит второе средство, причем второе средство выбрано из группы, состоящей из антитела, антиангиогенного средства, цитокина, антагониста цитокина, кортикостероида, обезболивающего средства и соединения, которое связывается со второй биологической молекулой.
[132] Согласно определенным вариантам осуществления фармацевтическая композиция дополнительно содержит второе средство, причем второе средство выбрано из группы, состоящей из антитела, антиангиогенного средства, цитокина, антагониста цитокина, кортикостероида, обезболивающего средства и соединения, которое связывается со второй биологической молекулой.
[133] Согласно определенным вариантам осуществления антиангиогенное средство фармацевтической композиции представляет собой антагонист VEGF.
[134] Согласно определенным вариантам осуществления антагонист VEGF фармацевтической композиции представляет собой антитело к VEGF, антитело к рецептору VEGF, слитый белок растворимого рецептора VEGF, аптамер, DARPin® против VEGF или ингибитор тирозинкиназы VEGFR.®
[135] Согласно определенным вариантам осуществления антитело к VEGF фармацевтической композиции представляет собой ранибизумаб (LUCENTIS®), RTH-258 или биспецифическое антитело к VEGF.
[136] Согласно определенным вариантам осуществления биспецифическое антитело к VEGF представляет собой антитело к VEGF/к Ang2.
[137] Согласно определенным вариантам осуществления антитело к VEGF/к Ang2 представляет собой RG-7716.
[138] Согласно определенным вариантам осуществления слитый белок растворимого рецептора VEGF представляет собой афлиберцепт (EYLEA®).
[139] Согласно определенным вариантам осуществления аптамер представляет собой пегаптаниб (MACUGEN®).
[140] Согласно определенным вариантам осуществления DARPin® против VEGF представляет собой абиципар пегол.
[141] Согласно определенным вариантам осуществления ингибитор тирозинкиназы VEGFR выбран из группы, состоящей из следующего: 4-(4-бром-2-фторанилино)-6-метокси-7-(1-метилпиперидин-4-илметокси)хиназолин (ZD6474), 4-(4-фтор-2-метилиндол-5-илокси)-6-метокси-7-(3-пирролидин-1-илпропокси)хиназолин (AZD2171), ваталаниб (PTK787), семаксаниб (SU5416) и SUTENT® (сунитиниб).
[142] Согласно определенным вариантам осуществления вторая биологическая молекула выбрана из группы, состоящей из следующего:IL-1β; IL-6; IL-6R; IL-13; IL-13R; PDGF; ангиопоэтин; ангиопоэтин 2; Tie-2; S1P; интегрины αvβ3, αvβ5 и α5β1; бетацеллюлин; апелин/APJ; эритропоэтин; фактор комплемента D; TNFα; HtrA1; рецептор VEGF; рецептор ST-2 и белок, генетически связанный с риском AMD.
[143] Согласно определенным вариантам осуществления рецептор VEGF представляет собой VEGFR1, VEGFR2, VEGFR3, mbVEGFR или sVEGFR.
[144] Согласно определенным вариантам осуществления белок, генетически связанный с риском AMD, выбран из группы, состоящей из компонентов пути комплемента C2, фактора B, фактора H, CFHR3, C3b, C5, C5a и C3a; HtrA1; ARMS2; TIMP3; HLA; IL-8; CX3CR1; TLR3; TLR4; CETP; LIPC, COL10A1 и TNFRSF10A.
[145] Согласно определенным вариантам осуществления соединение, которое связывается со второй биологической молекулой, представляет собой антитело или его антигенсвязывающий фрагмент.
[146] Согласно определенным вариантам осуществления антигенсвязывающий фрагмент антитела выбран из группы, состоящей из фрагментов Fab, Fab-C, Fab’-SH, Fv, scFv и (Fab’)2.
[147] Согласно определенным вариантам осуществления нарушение, ассоциированное с патологическим ангиогенезом, представляет собой офтальмологическое нарушение.
[148] Согласно определенным вариантам осуществления офтальмологическое нарушение выбрано из группы, состоящей из следующего: возрастная макулярная дегенерация (AMD), макулярная дегенерация, макулярный отек, диабетический макулярный отек (DME) (включая в себя очаговый, нецентровый DME и диффузный, DME с вовлечением центра макулы), ретинопатия, диабетическая ретинопатия (DR) (включая в себя пролиферативную DR (PDR), непролиферативную DR (NPDR) и высотную DR), другие связанные с ишемией ретинопатии, ретинопатия недоношенных (ROP), окклюзия вен сетчатки (RVO) (включая в себя центральную (CRVO) и разветвленную (BRVO) формы), CNV (включая в себя миопическую CNV), неоваскуляризация роговицы, заболевание, ассоциированное с неоваскуляризацией роговицы, неоваскуляризация сетчатки, заболевание, ассоциированное с ретинальной/хориоидальной неоваскуляризацией, патологическая миопия, болезнь фон Хиппель-Линдау, гистоплазмоз глаза, семейная экссудативная витреоретинопатия (FEVR), болезнь Коутса, болезнь Норри, синдром остеопороза-псевдоглиомы (OPPG), субконъюнктивальное кровоизлияние, рубеоз радужки, неоваскулярные заболевания глаз, неоваскулярная глаукома, пигментный ретинит (RP), гипертоническая ретинопатия, ангиоматозная пролиферация сетчатки, макулярная телеангиэктазия, неоваскуляризация радужки, внутриглазная неоваскуляризация, дегенерация сетчатки, кистозный макулярный отек (CME), васкулит, отек диска зрительного нерва, ретинит, конъюнктивит (включая в себя инфекционный конъюнктивит и неинфекционный (например, аллергический) конъюнктивит), врожденный амавроз Лебера, увеит (включая в себя инфекционный и неинфекционный увеит), хориоидит, глазной гистоплазмоз, блефарит, сухость глаз, травматическое повреждение глаз и болезнь Шегрена.
[149] Согласно определенным вариантам осуществления офтальмологическое нарушение представляет собой AMD, DME, DR или RVO.
[150] Согласно определенным вариантам осуществления офтальмологическое нарушение представляет собой AMD.
[151] Согласно определенным вариантам осуществления AMD представляет собой влажную форму AMD.
[152] Согласно определенным вариантам осуществления настоящее изобретение относится к способу лечения офтальмологического показания, причем способ предусматривает введение терапевтического количества раствора фармацевтических композиций, описанных в настоящем документе.
[153] Согласно определенным вариантам осуществления введение фармацевтической композиции является внутриглазным.
[154] Согласно определенным вариантам осуществления фармацевтическую композицию вводят с помощью инъекции в стекловидное тело субъекта.
[155] Согласно определенным вариантам осуществления фармацевтическую композицию вводят с помощью инъекции с использованием иглы, характеризующейся калибром 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31 или 32.
[156] Согласно определенным вариантам осуществления офтальмологическое показание выбрано из следующего: возрастная макулярная дегенерация (AMD), макулярная дегенерация, макулярный отек, диабетический макулярный отек (DME) (включая в себя очаговый, нецентровый DME и диффузный, DME с вовлечением центра макулы), ретинопатия, диабетическая ретинопатия (DR) (включая в себя пролиферативную DR (PDR), непролиферативную DR (NPDR) и высотную DR), другие связанные с ишемией ретинопатии, ретинопатия недоношенных (ROP), окклюзия вен сетчатки (RVO) (включая в себя центральную (CRVO) и разветвленную (BRVO) формы), CNV (включая в себя миопическую CNV), неоваскуляризация роговицы, заболевание, ассоциированное с неоваскуляризацией роговицы, неоваскуляризация сетчатки, заболевание, ассоциированное с ретинальной/хориоидальной неоваскуляризацией, патологическая миопия, болезнь фон Хиппель-Линдау, гистоплазмоз глаза, семейная экссудативная витреоретинопатия (FEVR), болезнь Коутса, болезнь Норри, синдром остеопороза-псевдоглиомы (OPPG), субконъюнктивальное кровоизлияние, рубеоз радужки, неоваскулярные заболевания глаз, неоваскулярная глаукома, пигментный ретинит (RP), гипертоническая ретинопатия, ангиоматозная пролиферация сетчатки, макулярная телеангиэктазия, неоваскуляризация радужки, внутриглазная неоваскуляризация, дегенерация сетчатки, кистозный макулярный отек (CMЕ), васкулит, отек диска зрительного нерва, ретинит, конъюнктивит (включая в себя инфекционный конъюнктивит и неинфекционный (например, аллергический) конъюнктивит), врожденный амавроз Лебера, увеит (включая в себя инфекционный и неинфекционный увеит), хориоидит, глазной гистоплазмоз, блефарит, сухость глаз, травматическое повреждение глаз и болезнь Шегрена.
[157] Согласно определенным вариантам осуществления настоящее изобретение относится к способу получения конъюгата гидрогеля с лекарственным средством, причем способ предусматривает следующее:
(a) получение первой гиалуроновой кислоты или ее соли щелочного металла или производного, содержащих на себе по меньшей мере три первые реакционноспособные группы;
(b) получение второй гиалуроновой кислоты или ее соли щелочного металла или производного, содержащих на себе по меньшей мере две вторые реакционноспособные группы, где первая и вторая реакционноспособные группы способны реагировать друг с другом с образованием ковалентной связи;
(c) присоединение по меньшей мере одного лекарственного средства к одной из первых реакционноспособных групп; и
(d) поперечное сшивание первой и второй гиалуроновых кислот с помощью реакции первой реакционноспособной группы и второй реакционноспособной группы с образованием поперечно-сшивающего линкера и образованием конъюгата гидрогеля.
[158] Согласно определенным вариантам осуществления лекарственное средство присоединяют к первой гиалуроновой кислоте посредством обратимого линкера пролекарственного средства.
[160] Согласно определенным вариантам осуществления лекарственное средство присоединяют к обратимому линкеру пролекарственного средства и очищают с образованием очищенного конъюгата лекарственного средства с обратимым линкером пролекарственного средства перед присоединением к первой гиалуроновой кислоте, причем конъюгат лекарственного средства с обратимым линкером пролекарственного средства очищают следующим образом:
(a) метят конъюгат лекарственного средства с обратимым линкером пролекарственного средства с помощью метки очистки с образованием смеси меченого конъюгата лекарственного средства с обратимым линкером пролекарственного средства;
(b) очищают меченый моноконъюгат лекарственного средства с обратимым линкером пролекарственного средства от смеси с помощью хроматографического разделения; и
(c) удаляют метку очистки из меченого моноконъюгата лекарственного средства с обратимым линкером пролекарственного средства с образованием очищенного конъюгата лекарственного средства с обратимым линкером пролекарственного средства.
[161] Согласно определенным вариантам осуществления поперечно-сшивающий линкер содержит фрагмент биоразлагаемого спейсера.
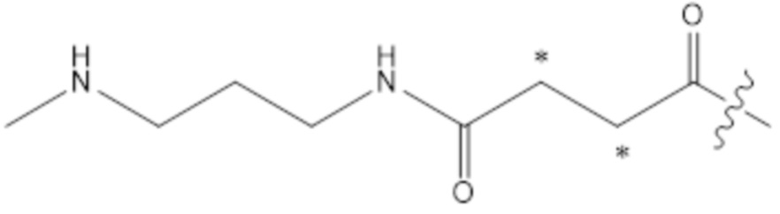
[162] Согласно определенным вариантам осуществления поперечно-сшивающий линкер содержит фрагмент сложного эфира азелаиновой кислоты.
Краткое описание графических материалов
[163] Фигура 1 представляет собой конъюгат поперечно-сшитой гиалуроновой кислоты с лекарственным средством согласно настоящему изобретению.
[164] Фигура 2 представляет собой схему реакции в соответствии с одним аспектом настоящего раскрытия для получения функционализированной малеимидом гиалуроновой кислоты (HA) и функционализированной малеимидом гиалуроновой кислоты, содержащей конъюгированное лекарственное средство.
[165] Фигура 3 представляет собой схему реакции в соответствии с одним аспектом настоящего раскрытия для получения гиалуроновой кислоты, функционализированной тиолом с защитной группой, функционализированной тиолом гиалуроновой кислоты и композиции поперечно-сшитой гиалуроновой кислоты и пролекарственного средства.
[166] Фигура 4 представляет собой схему реакции в соответствии с одним аспектом настоящего раскрытия для получения функционализированной малеимидом гиалуроновой кислоты и гиалуроновой кислоты, функционализированной дисульфидом с защитной группой.
[167] Фигура 5 представляет собой схему реакции в соответствии с одним аспектом настоящего раскрытия для получения функционализированной тиолом гиалуроновой кислоты, функционализированной тиолом гиалуроновой кислоты с конъюгированным лекарственным средством и композиции поперечно-сшитой гиалуроновой кислоты и пролекарственного средства.
[168] Фигура 6 представляет собой схему реакции в соответствии с одним аспектом настоящего раскрытия для получения функционализированной амином гиалуроновой кислоты и получения из нее функционализированной малеимидом гиалуроновой кислоты.
[169] Фигура 7 представляет собой схему реакции в соответствии с одним аспектом настоящего раскрытия, на которой показана функционализированная малеимидом гиалуроновая кислота и функционализированная малеимидом гиалуроновая кислота с конъюгированным лекарственным средством.
[170] Фигура 8 представляет собой схему реакции в соответствии с одним аспектом настоящего раскрытия для получения функционализированной амином гиалуроновой кислоты, гиалуроновой кислоты, функционализированной дисульфидом с защитной группой, и функционализированной тиолом гиалуроновой кислоты.
[171] Фигура 9 представляет собой схему реакции в соответствии с одним аспектом настоящего раскрытия для получения композиции поперечно-сшитой гиалуроновой кислоты и пролекарственного средства.
[172] Фигура 10 представляет собой схему реакции в соответствии с одним аспектом настоящего раскрытия для получения композиции поперечно-сшитой гиалуроновой кислоты и пролекарственного средства.
[173] Фигура 11 представляет собой схему реакции в соответствии с одним аспектом настоящего раскрытия для получения композиции поперечно-сшитой гиалуроновой кислоты и пролекарственного средства.
[174] На фигуре 12 показана витреальная фармакокинетика (PK) RabFab после высвобождения из конъюгата поперечно-сшитой HA с RabFab у кроликов NZW (красные точки и линия) по сравнению с этим параметром у свободного RabFab (синие точки и линия).
[175] На фигурах 13A и 13B проиллюстрирована минимальная фрагментация и движение частиц плацебо - гидрогеля поперечно-сшитой HA в глазу NHP.
[176] На фигуре 14 проиллюстрирована переносимость в глазу кролика конъюгата гидрогеля поперечно-сшитой HA с RabFab.
[177] На фигуре 15 проиллюстрирована переносимость в глазу яванского макака конъюгата поперечно-сшитой HA с G6.3.1 AAR.
Подробное раскрытие настоящего изобретения
[178] Согласно некоторым аспектам настоящее раскрытие в целом относится к способам получения пролекарственных композиций на основе гидрогеля, содержащих поперечно-сшитую гиалуроновую кислоту (HA), или ее производное или соль, где система поперечно-сшивающего линкера содержит биоразлагаемый спейсер, где поперечно-сшитая HA содержит лекарственное средство, конъюгированное с линкером, и где линкер способен высвобождать лекарственное средство при физиологических условиях. Согласно некоторым таким аспектам гидрогелевые композиции HA и пролекарственного средства согласно настоящему раскрытия характеризуются формулами 1, 10, 16 и 26, как показано на фигурах 1, 3, 5 и 9 соответственно. В формулах, структурах и схемах реакции в настоящем документе, любую открытую валентность на атоме углерода, азота, кислорода или серы следует понимать как представляющую атом водорода.
[179] Обращаясь к фигуре 1, показано соединение 1 - конъюгат поперечно-сшитой HA с лекарственным средством согласно настоящему изобретению. Соединение 1 можно получить, как описано дополнительно ниже. В соединении 1 фрагмент лекарственного средства соединен с фрагментом HA посредством линкера L2, который представляет собой фрагмент обратимого линкера пролекарственного средства, и спейсера L4, как описано дополнительно в настоящем документе. Фрагмент лекарственного средства может содержать любой терапевтический или биологически активный фрагмент, как также описанно дополнительно в настоящем документе. Фрагменты HA соединены или поперечно-сшиты вместе с помощью спейсера L4, и L2-фрагмент лекарственного средства соединен с фрагментом HA с помощью спейсера L4. Спейсеры L4 могут являться одинаковыми или различными в каждом случае и согласно многим вариантам осуществления могут являться биоразлагаемыми, как описано дополнительно в настоящем документе.
[180] Спейсеры L4 могут варьироваться в соответствии с типом химической реакции, используемой для поперечного сшивания фрагментов HA и прикрепления конъюгата L2-фрагмент лекарственного средства к фрагменту HA. Согласно многим вариантам осуществления в настоящем документе конъюгаты поперечно-сшитой HA с лекарственным средством согласно настоящему изобретению основаны на тиол-малеимидной химии и, таким образом, спейсеры L4 содержат тиосукцинимидные группы, которые являются результатом реакции тиолов и малеимидов. Тем не менее, следует понимать, что различные типы химических реакций можно использовать для поперечного сшивания фрагментов HA и прикрепления конъюгата L2-фрагмент лекарственного средства к фрагменту HA согласно настоящему изобретению, и они также находятся в пределах объема настоящего раскрытия. Например, клик-химию на основе реакции алкинов с азидами, как раскрыта в международных патентных публикациях WO2003101972, WO2011136645, WO2013036748 и WO2013171485, раскрытия которых включены в настоящий документ посредством ссылки, можно использовать для поперечного сшивания фрагментов HA и прикрепления конъюгата L2-фрагмент лекарственного средства к фрагменту HA. Химия поперечного сшивания на основе акрила, химия поперечного сшивания амина и эпоксида и другие химические реакции, образующие связь, также можно использовать согласно настоящему изобретению.
[181] Обращаясь также к фигурам 2 и 3, показан гидрогелевое соединение 10 -конъюгат поперечно-сшитой HA с лекарственным средством (фигура 3) согласно настоящему изобретению. В соединении 10 спейсер L4 соединения 1, который соединяет фрагменты HA вместе, более конкретно показан как

и спейсер L4, соединяющий L2-фрагмент лекарственного средства с фрагментом HA, показан более конкретно как

где L1 и L3 являются такими, как определено в настоящем документе. В общем, соединение 10 можно получить в соответствии со способом, изображенном на фигурах 2 и 3. На первой стадии соединение 2 - первую HA (или ее производное или соль) конъюгируют с соединением 3 - малеимидом с образованием соединения 4, содержащего малеимидные реакционноспособные группы, конъюгированные с HA с помощью спейсера L1.
[182] На второй стадии соединение 5 - конъюгат тиол-L2-лекарственное средство реагирует с малеимидными реакционноспособными группами соединения 4 с образованием соединения 6, содержащего конъюгированные фрагменты конъюгата -S-L2-лекарственное средство. Согласно некоторым аспектам L2 представляет собой фрагмент обратимого линкера пролекарственного средства, как описано дополнительно в другом месте в настоящем документе, который способен к контролируемому высвобождению лекарственного средства при физиологических условиях. Тиоловая группа в соединении 5 может являться частью обратимого линкера пролекарственного средства L2. Согласно некоторым аспектам лекарственное средство представляет собой терапевтическое средство, такое как молекула против VEGF, которая является применимой для лечения заболеваний глаза. Эквиваленты малеимидных групп на соединении 4 превышают эквиваленты соединения 5 - конъюгата лекарственного средства, так что соединение 6 содержит свободные малеимидные группы.
[182] На третьей стадии соединение 2 - вторую HA (или ее производное или соль) конъюгируют с защищенным (показано с помощью защитной группы PG) тиоловым соединением 7 с образованием соединения 8, содержащего защищенные тиоловые группы, конъюгированного с HA с помощью спейсера L3. Согласно некоторым аспектам L3 представляет собой биоразлагаемый спейсер фрагмент.
[184] На четвертой стадии защитные группы соединения 8 удаляют с образованием соединения 9, содержащего тиоловые группы. Согласно определенным вариантам осуществления защитная группа может образовывать дисульфид с тиоловыми группами, так что удаление защитной группы может быть достигнуто с помощью восстанавливающего средства.
[185] На пятой стадии соединение 6 и соединение 9 объединяют и приводят в реакцию с образованием соединения 10 - гидрогеля поперечно-сшитой HA с пролекарственным средством.
[186] Степень функционализации малеимида и тиола, как показано на фигурах, является только иллюстративной, и следует понимать, что не все карбоксилатные группы в соединении 2 - HA подвергаются реакции, и согласно большинству вариантов осуществления большинство карбоксилатных групп не прореагировало. Соединение 4 - функционализированная малеимидом HA на фиг. 2 будет обладать достаточной степенью функционализации, так что часть малеимидных функциональных групп в соединении 4 будет доступна для прикрепления лекарственного средства (как показано в соединении 6), а остальные малеимидные группы доступны для прохождения реакции поперечного сшивания с тиоловыми группами соединения 9, в конечном итоге, обеспечивает получение пролекарственной композиции 10 на основе гидрогеля поперечно-сшитой НА согласно настоящему изобретению. Например, степень функционализации малеимидного соединения 4 может находиться в диапазоне от приблизительно 5% до приблизительно 15%, тогда как степень функционализации тиолового соединения 9 может находиться в диапазоне от приблизительно 1% до приблизительно 7%.
[187] Согласно определенным вариантам осуществления степень функционализации соединения 4 - HA малеимидом может находиться в диапазоне от приблизительно 6% до приблизительно 14%, от приблизительно 7% до приблизительно 13%, от приблизительно 8% до приблизительно 12%, от приблизительно 10% до приблизительно 12% и от приблизительно 9% до приблизительно 11%. Степень функционализации соединения 9 - HA тиолом, как показано на фигуре 3, может, например, варьироваться от приблизительно 1% до приблизительно 7%, от приблизительно 2% до приблизительно 6% и от приблизительно 3% до приблизительно 5%.
[188] Согласно определенным вариантам осуществления степень функционализации малеимидом на соединении 4 - HA, как показано на фигуре 2, может составлять приблизительно 10%, так что приблизительно одна из десяти карбоксилатных групп на соединении 2 - первой HA дериватизирована малеимидом. Другими словами, если соединение 2 - HA содержит x число карбоксилатных групп, то соединение 4 включает в себя 0,1× малеимидных групп. Степень функционализации тиолом на соединении 9 - HA, как показано на фигуре 3, может составлять приблизительно 4%, или для x карбоксилатных групп на соединении 2 - HA, существуют 0,04× тиоловых групп на соединении 9 (и соответственно 0,04× защищенных тиоловых групп на соединении 8).
[189] В соединении 6 приблизительно 77% малеимидов в среднем будут замещены лекарственным средством, при этом оставшиеся приблизительно 23% используют для реакции поперечного сшивания с соединением 9 для получения поперечно-сшитого геля 10. Таким образом, например, 116 кДа HA, которая является на 10% функционализированной малеимидом, будет содержать приблизительно 28 малеимидных групп, из которых приблизительно 22 малеимидных групп будут заняты лекарственным средством.
[190] Обращаясь теперь к фигурам 4 и 5, показано получение соединения 16.
[191] На первой стадии a первой HA соединение 2 (или ее производное или соль) конъюгируют с малеимидом - соединением 3 с образованием соединения 11, содержащего малеимидные реакционноспособные группы, конъюгированные с HA с помощью спейсера L3 .
[192] На второй стадии вторую HA - соединение 2 (или ее производное или соль) конъюгируют с защищенным (PG) дисульфидом - соединением 7 с образованием соединения 12, содержащего защищенные дисульфидные группы, конъюгированные с HA с помощью спейсера L1. Согласно некоторым аспектам L1 представляет собой биоразлагаемый спейсер фрагмент.
[193] На третьей стадии защитные группы соединения 12 удаляют с образованием соединения 13, содержащего тиоловые группы.
[194] На четвертой стадии соединение 14 - конъюгат малеимид-L2-лекарственное средство реагирует с тиоловыми реакционноспособными группами соединения 13 с образованием соединения 15, содержащего фрагменты конъюгированного лекарственного средства. Эквиваленты тиоловых групп превышают эквиваленты соединения 14, так что соединение 15 содержит свободные тиоловые группы. Согласно некоторым аспектам L2 представляет собой фрагмент обратимого линкера пролекарственного средства, который способен к контролируемому высвобождению лекарственного средства при физиологических условиях. Согласно некоторым аспектам лекарственное средство представляет собой молекулу против VEGF.
[195] На стадии 5 соединение 11 и соединение 15 объединяют, так что свободные малеимидные и тиоловые группы на них, соответственно, реагируют с образованием соединения 16 - гидрогеля поперечно-сшитой HA, содержащего пролекарственное средство. В соединении 16 спейсер L4, как показано на фигуре 1, который соединяет фрагменты HA вместе, более конкретно представлен следующим образом:

и спейсер L4, соединяющий L2-фрагмент лекарственного средства с фрагментом HA представлен более конкретно как
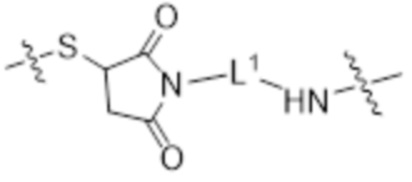
где L1 и L3 являются такими, как определено в настоящем документе.
[196] Как описано выше, степень функционализации карбоксилатных групп на HA - соединениях 2, как показано на фигурах, является произвольной и представлена в иллюстративных целях. Функционализированная тиолом HA - соединение 13 (и функционализированное защищенным тиолом соединение 12) будет иметь более высокую степень функционализации, чем функционализированная малеимидом НА - соединение 11. Часть тиоловых функциональных групп в соединении 13 будут использовать для прикрепления лекарственного средства, а оставшиеся тиоловые группы доступны для реакции поперечного сшивания с малеимидными группами соединения 11 для получения пролекарственной композиции 16 на основе гидрогеля поперечно-сшитой HA. Например, степень функционализация тиолом соединения 13 может находиться в диапазоне от приблизительно 5% до приблизительно 15%, при этом степень функционализации малеимидом соединения 11 может находиться в диапазоне от приблизительно 1% до приблизительно 7%. Изменение степени функционализации тиола и малеимида обеспечивает различные плотности поперечных связей и различные степени загрузки лекарственного средства в биоконъюгат согласно настоящему изобретению, как описано выше.
[197] Согласно некоторым аспектам, как показано на фиг. 6 - 9, пролекарственные средства на основе гидрогеля поперечно-сшитой НА можно получить путем (1) получения первой функционализированной амином HA и получение из нее малеимидо-функционализированной HA, (2) получения второй функционализированной амином HA и получение из нее функционализированной тиолом HA, (3) конъюгирования конъюгата лекарственное средство-линкер с малеимидо-функционализированной HA, где часть малеимидо-групп не конъюгирована с конъюгатом лекарственное средство-линкер, и (4) образования пролекарственных средств на основе гидрогеля поперечно-сшитой НА путем реакции малеимидо-групп на первой функционализированной HA с тиоловыми группами на второй функционализированной HA.
[198] На фиг. 6, стадии 1, первое соединение 2 - гиалуронат натрия (или его форма кислоты или его производное) реагирует с H2N-LA-NH2 - соединением 17 с образованием амин-функционализированной HA - соединения 18, где степень функционализации амином HA составляет от приблизительно 5% до приблизительно 15%, от приблизительно 6% до приблизительно 14%, от приблизительно 7% до приблизительно 13%, от приблизительно 8% до приблизительно 12%, от приблизительно 9% до приблизительно 11% или согласно некоторым вариантам осуществления приблизительно 10%; приблизительно 11% или приблизительно 12% Согласно некоторым аспектам LA представляет собой фрагмент спейсера, как определено в настоящем документе.
[199] Как показано на фиг. 6, стадии 2, соединение 18 реагирует с конъюгатом N-гидроксисукцинимид-LB-малеимид - соединением 19 с образованием малеимидо-функционализированной HA - соединения 20, изображенного на фиг. 7. Согласно некоторым аспектам LB представляет собой фрагмент спейсера, который образует активированный сложный эфир с сукцинимидной частью реагента 19
[200] Как показано на фиг. 7, стадии 3, соединение 20 реагирует с соединением 5 - конъюгатом тиола с лекарственным средством с образованием соединения 21 - предшественника пролекарственного средства. L2 представляет собой обратимый линкер пролекарственного средства, как определено в настоящем документе.
[201] Как показано на фиг. 8, стадии 4, второе соединение 2 - гиалуронат натрия (или его форма кислоты или его производное) реагирует с H2H-LA-NH2 - соединением 17 с образованием амин-функционализированной HA (соединением 22), где степень функционализации амином HA может варьироваться от приблизительно 1% до приблизительно 7%, от приблизительно 2% до приблизительно 6%, от приблизительно 3% до приблизительно 5% и согласно определенным вариантам осуществления 4%.
[202] Как дополнительно изображено на фиг. 8, стадии 5, соединение 22 реагирует с соединением 23 - N-гидроксисукцинимид-LC-S-защитная группа (защитная группа показана как "PG") с образованием соединения 24. С соединения 24 затем снимают защитную группу на стадии 6 для удаления защитной группы и образования тиол-функционализированной HA - соединения 25. Согласно некоторым аспектам LC представляет собой фрагмент биоразлагаемого спейсера, который образует активированный сложный эфир с сукцинимидной частью реагента 23. Как показано на фиг. 9, предшественник пролекарственного средства - соединение 21 поперечно-сшито с тиол-функционализированной HA - соединением 25 с образованием пролекарственной композиции на основе гидрогеля поперечно-сшитой HA 26. В соединении 26 спейсер L4, как показано на фигуре 1, который соединяет фрагменты HA вместе, более конкретно представлен следующим образом:
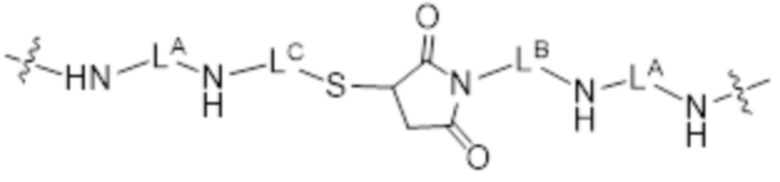
и спейсер L4, соединяющий L2-фрагмент лекарственного средства с фрагментом HA представлен более конкретно как
 ,
,
где LA, LB и LC являются такими, как определено в настоящем документе.
[203] Как и в варианте осуществления на фигурах 2-3, описанном выше, согласно варианту осуществления на фигурах 6-9 функционализированная малеимидом HA - соединение 20 на фигуре 7 будет характеризоваться более высокой степенью функционализации, чем функционализированная тиолом HA - соединение 25 на фигуре 8. Часть малеимидных функциональных групп в соединении 20 будут использованы для прикрепления лекарственного средства (как показано в соединении 21) и оставшиеся малеимидные группы доступны для реакции поперечного сшивания с тиоловыми группами соединения 25 с получением пролекарственной композиции на основе гидрогеля поперечно-сшитой HA 26 согласно настоящему изобретению. Диапазоны и значения степени функционализации малеимидных и тиоловых групп, диапазоны и значения плотности поперечного сшивания, а также диапазоны и значения для загрузки лекарственного средства, относящиеся к другому месту данного документа, также применимы к варианту осуществления на фиг. 6-9
Определения
[204] Используемая в настоящем документе гиалуроновая кислота (HA) относится к HA и ее любым производным и солям. Согласно определенным вариантам осуществления HA может характеризоваться формулой:

где каждый Ra1 и Ra2 независимо представляет собой водород, низший алкил или другую образующую сложный эфир группу, противоион металла или аммония (включая в себя моно-, ди-, три- и тетра-алкиламмония) или другой тип противоиона. Согласно определенным вариантам осуществления Ra1 независимо выбран из H, C1-4 алкила и противоиона щелочного металла, и каждый Ra2 независимо выбран из H, C1-4 алкила и противоиона щелочного металла. Согласно некоторым аспектам каждый Ra1 представляет собой Na+, и каждый Ra2 представляет собой H. В некоторых возможных производных HA, как показано выше, каждая из гидроксильных групп может быть независимо замещена C1-4 алкиловыми простыми эфирами (не показано) или C1-4 алкиловыми сложными эфирами (не показано), и атом азота каждой из амидных функциональных групп может быть необязательно замещенным (алкилированным) C1-4 алкилом (также не показано). Среднечисленная молекулярная масса HA составляет приблизительно 10 кДа, приблизительно 25 кДа, приблизительно 50 кДа, приблизительно 75 кДа, приблизительно 100 кДа, приблизительно 125 кДа, приблизительно 150 кДа, приблизительно 175 кДа, приблизительно 200 кДа, приблизительно 225 кДа, приблизительно 250 кДа, приблизительно 275 кДа, приблизительно 300 кДа, приблизительно 325 кДа, приблизительно 350 кДа, приблизительно 375 кДа, приблизительно 400 кДа, приблизительно 425 кДа, приблизительно 450 кДа, приблизительно 475 кДа, приблизительно 500 кДа, приблизительно 550 кДа, приблизительно 600 кДа, приблизительно 650 кДа, приблизительно 700 кДа, и их диапазоны, такие как от приблизительно 10 кДа до приблизительно 1000 кДа, от приблизительно 25 кДа до приблизительно 750 кДа, от приблизительно 50 кДа до приблизительно 250 кДа, от приблизительно 75 кДа до приблизительно 200 кДа, от приблизительно 75 кДа до приблизительно 175 кДа, от приблизительно 100 кДа до приблизительно 150 кДа или от приблизительно 100 кДа до приблизительно 125 кДа.
[205] Термин “обратимый линкер пролекарственного средства” или просто “линкер” относится к фрагменту, который на своем одном конце прикреплен к лекарственному средству, например, нейтрализующему VEGF лекарственному средству, через обратимую связь и на другом конце прикреплен через постоянную связь к носителю, такому как гидрогели согласно настоящему изобретению, тем самым связывая лекарственное средство с носителем. Иллюстративные обратимые линкеры пролекарственного средства, применимые согласно настоящему изобретению, раскрыты в международной патентной публикации WO2009095479, раскрытие которой включено в настоящий документ посредством ссылки. Согласно таким вариантам осуществления обратимый линкер пролекарственного средства представляет собой группу согласно формуле XIIa
,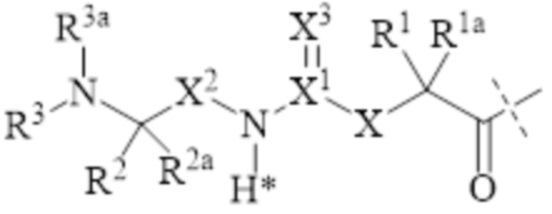 XIIa
XIIa
где
пунктирная линия указывает на прикрепление к азоту соединения лекарственного средства (не показано) путем образования амидной связи;
X представляет собой C(R4R4a); N(R4); O; C(R4R4a)-C(R5R5a); C(R5R5a)-C(R4R4a); C(R4R4a)-N(R6); N(R6)-C(R4R4a); C(R4R4a)-O; O-C(R4R4a) или C(R7R7a);
X1 представляет собой C или S(O);
X2 представляет собой C(R8R8a) или C(R8R8a)-C(R9R9a);
=X3 представляет собой =O; =S или =N-CN;
R1, R1a, R2, R2a, R4, R4a, R5, R5a, R6, R8, R8a, R9, R9a независимо выбраны из группы, состоящей из H; и C1-6 алкила;
R3, R3a независимо выбраны из группы, состоящей из H; и C1-6 алкила, при условии, что в случае, когда один из R3, R3a или оба отличаются от H, они связаны с N, к которому они прикреплены через SP3-гибридизированный атом углерода;
R7 представляет собой N(R10R10a) или NR10-(C=O)-R11;
R7a, R10, R10a, R11 представляют собой независимо друг от друга H; или C1-10 алкил;
необязательно одна или несколько из пар R1a/R4a, R1a/R5a, R1a/R7a, R4a/R5a, R8a/R9a образуют химическую связь;
необязательно одна или несколько из пар R1/R1a, R2/R2a, R4/R4a, R5/R5a, R8/R8a, R9/R9a соединены вместе с атомом, к которому они прикреплены, с образованием C3-10 циклоалкила или 3 - 10-членного гетероциклила;
необязательно одна или несколько из пар R1/R4, R1/R5, R1/R6, R1/R7a, R4/R5, R4/R6, R8/R9, R2/R3 соединены вместе с атомами, к которым они прикреплены, с образованием кольца A;
необязательно R3/R3a соединены вместе с атомом азота, к которому они прикреплены, с образованием 3 - 10-членного гетероцикла;
A выбран из группы, состоящей из фенила; нафтила; инденила; инданила; тетралинила; C3-10 циклоалкила; 3 - 10-членного гетероциклила; и 8 - 11-членного гетеробициклила; и
где группа согласно формуле XIIa замещена L4 при условии, что водород, помеченный звездочкой в формуле (XIIa), не замещен L4 или другим заместителем;
где L4 представляет собой одинарную химическую связь или фрагмент спейсера, как определено в настоящем документе; и
где C1-10 алкил может являться необязательно прерванным и/или необязательно замещенным, как определено в настоящем документе.
[206] Дополнительные обратимые линкеры пролекарственного средства, применимые согласно другим вариантам осуществления настоящего изобретения, описаны в патентных документах WO05099768A2, WO06136586A2, WO2011/012722A1, WO2011/089214A1, WO2011/089216A1, WO2011/089215A1, WO2013/024053A1, WO2013/160340A1, WO2016/020373A1, WO2016/196124A2, EP1536334B1, WO2009/009712A1, WO2008/034122A1, WO2009/143412A2, WO2011/082368A2, US8618124B2, US8946405B2, US8754190B2, WO2013/036857A1, US7585837B2 и WO2002/089789A1, раскрытия которых включено в настоящий документ посредством ссылки.
[207] Спейсер или фрагмент спейсера согласно многим вариантам осуществления можно выбрать из следующего: T, -C1-10 алкилен, C(O)O-, -O-, C(O)-, C(O)N(Ry1)-, S(O)2N(Ry1)-, S(O)N(Ry1)-, -S(O)2-, -S(O)-, N(Ry1)S(O)2N(Ry1a)-, S-, N(Ry1)-, OC(ORy1)(Ry1a), N(Ry1)C(O)N(Ry1a)-, OC(O)N(Ry1), C1-50 алкил, C2-50 алкенил и C2-50 алкинил; где T, C1-50 алкил, C2-50 алкенил и C2-50 алкинил являются необязательно замещенными одним или несколькими Ry2, которые являются одинаковыми или различными, и где C1-50 алкил, C2-50 алкенил и C2-50 алкинил являются необязательно прерванными одной или несколькими группами, выбранным из группы, состоящей из T, C(O)O-, -O-, C(O)-, C(O)N(Ry3)-, S(O)2N(Ry3)-, S(O)N(Ry3)-, -S(O)2-, -S(O)-, N(Ry3)S(O)2N(Ry3a)-, S-, N(Ry3)-, OC(ORy3)(Ry3a), N(Ry3)C(O)N(Ry3a)- и OC(O)N(Ry3);
где:
Ry1 и Ry1a независимо друг от друга выбраны из группы, состоящей из следующего: H, T, C1-50 алкил, C2-50 алкенил, и C2-50 алкинил; где T, C1-50 алкил, C2-50 алкенил и C2-50 алкинил являются необязательно замещенными одним или несколькими Ry2, которые являются одинаковыми или различными, и где C1-50 алкил, C2-50 алкенил и C2-50 алкинил являются необязательно прерванными одной или несколькими группами, выбранным из группы, состоящей из T, -C(O)O-, -O-, -C(O)-, -C(O)N(Ry4)-, S(O)2N(Ry4)-, -S(O)N(Ry4)-, -S(O)2-, -S(O)-, -N(Ry4)S(O)2N(Ry4a)-, -S-, -N(Ry4)-, OC(ORy4)(Ry4a), N(Ry4)C(O)N(Ry4a)- и OC(O)N(Ry4);
каждый T независимо выбран из группы, состоящей из следующего: фенил, нафтил, инденил, инданил, тетралинил, C3-10 циклоалкил, 3 - 10-членный гетероциклил, 8 - 11-членный гетеробициклил, 8 - 30-членный карбополициклил и 8 - 30-членный гетерополициклил; где каждый T является независимо необязательно замещенным одним или несколькими Ry2, которые являются одинаковыми или различными;
каждый Ry2 независимо выбран из группы, состоящей из следующего: галоген, CN, оксо (=O), COORy5, ORy5, -C(O)Ry5, C(O)N(Ry5Ry5a), S(O)2N(Ry5Ry5a), S(O)N(Ry5Ry5a), S(O)2Ry5, S(O)Ry5, N(Ry5)S(O)2N(Ry5aRy5b), SRy5, N(Ry5Ry5a), NO2, OC(O)Ry5, N(Ry5)C(O)Ry5a, N(Ry5)S(O)2Ry5a, N(Ry5)S(O)Ry5a, N(Ry5)C(O)ORy5a, N(Ry5)C(O)N(Ry5aRy5b), OC(O)N(Ry5Ry5a) и C1-6 алкил; где C1-6 алкил является необязательно замещенным одним или несколькими галогенами, которые являются одинаковыми или различными; и
каждый Ry3, Ry3a, Ry4, Ry4a, Ry5, Ry5a и Ry5b независимо выбран из группы, состоящей из H, и C1-6 алкила, где C1-6 алкил является необязательно замещенным одним или несколькими галогенами, которые являются одинаковыми или различными.
Такой спейсер представляет собой “биоразлагаемый спейсер”, если фрагмент спейсера содержит по меньшей мере одну биоразлагаемую связь.
[208] Согласно определенным вариантам осуществления фрагмент спейсера можно выбрать из следующего: T, C(O)O-, O-, C(O)-, -C(O)N(Ry1)-, S(O)2N(Ry1)-, -S(O)N(Ry1)-, -S(O)2-, -S(O)-, N(Ry1)S(O)2N(Ry1a)-, S-, -N(Ry1)-, OC(ORy1)(Ry1a), N(Ry1)C(O)N(Ry1a)-, -OC(O)N(Ry1), C1-50 алкил, C2-50 алкенил и C2-50 алкинил; где T, C1-20 алкил, C2-20 алкенил и C2-20 алкинил являются необязательно замещенными одним или несколькими Ry2, которые являются одинаковыми или различными, и где C1-20 алкил, C2-20 алкенил и C2-20 алкинил являются необязательно прерванными одной или несколькими группами, выбранным из группы, состоящей из T, C(O)O-, -O-, C(O)-, -C(O)N(Ry3)-, S(O)2N(Ry3)-, -S(O)N(Ry3)-, -S(O)2-, -S(O)-, N(Ry3)S(O)2N(Ry3a)-, S-, -N(Ry3)-, OC(ORy3)(Ry3a), N(Ry3)C(O)N(Ry3a)- и OC(O)N(Ry3);
где:
Ry1 и Ry1a независимо друг от друга выбраны из группы, состоящей из H, T, C1-10 алкила, C2-10 алкенила и C2-10 алкинила; где T, C1-10 алкил, C2-10 алкенил и C2-10 алкинил являются необязательно замещенными одним или несколькими Ry2, которые являются одинаковыми или различными, и где C1-10 алкил, C2-10 алкенил и C2-10 алкинил являются необязательно прерванными одной или несколькими группами, выбранным из группы, состоящей из T, -C(O)O-, -O-, -C(O)-, -C(O)N(Ry4)-, S(O)2N(Ry4)-, -S(O)N(Ry4)-, -S(O)2-, -S(O)-, -N(Ry4)S(O)2N(Ry4a)-, -S-, -N(Ry4)-, OC(ORy4)(Ry4a-, N(Ry4)C(O)N(Ry4a)- и OC(O)N(Ry4);
каждый T независимо выбран из группы, состоящей из следующего: фенил, нафтил, инденил, инданил, тетралинил, C3-10 циклоалкил, 3 - 10-членный гетероциклил, 8 - 11-членный гетеробициклил, 8 - 30-членный карбополициклил и 8 - 30-членный гетерополициклил; где каждый T является независимо необязательно замещенным одним или несколькими Ry2, которые являются одинаковыми или различными;
Ry2 выбран из группы, состоящей из следующего: галоген, CN, оксо (=O), COORy5, ORy5, C(O)Ry5, C(O)N(Ry5Ry5a), S(O)2N(Ry5Ry5a), S(O)N(Ry5Ry5a), S(O)2Ry5, S(O)Ry5, N(Ry5)S(O)2N(Ry5aRy5b), SRy5, N(Ry5Ry5a), NO2, OC(O)Ry5, N(Ry5)C(O)Ry5a, N(Ry5)S(O)2Ry5a, N(Ry5)S(O)Ry5a, N(Ry5)C(O)ORy5a, N(Ry5)C(O)N(Ry5aRy5b), OC(O)N(Ry5Ry5a) и C1-6 алкил; где C1-6 алкил является необязательно замещенным одним или несколькими галогенами, которые являются одинаковыми или различными; и
каждый Ry3, Ry3a, Ry4, Ry4a, Ry5, Ry5a и Ry5b независимо друг от друга выбран из группы, состоящей из H, и C1-6 алкила; где C1-6 алкил является необязательно замещенным одним или несколькими галогенами, которые являются одинаковыми или различными.
[209] Такой спейсер представляет собой “биоразлагаемый спейсер”, если фрагмент спейсера содержит по меньшей мере одну биоразлагаемую связь.
[210] Согласно другим вариантам осуществления фрагмент спейсера можно выбрать из T, C(O)O-, O-, -C(O)-, -C(O)N(Ry1)-, S(O)2N(Ry1)-, S(O)N(Ry1), -S(O)2-, S(O)-, N(Ry1)S(O)2N(Ry1a)-, S-, -N(Ry1)-, OC(ORy1)(Ry1a), N(Ry1)C(O)N(Ry1a)-, OC(O)N(Ry1), C1-50 алкила, C2-50 алкенила и C2-50 алкинила; где T, C1-50 алкил, C2-50 алкенил и C2-50 алкинил являются необязательно замещенными одним или несколькими Ry2, которые являются одинаковыми или различными, и где C1-50 алкил, C2-50 алкенил и C2-50 алкинил являются необязательно прерванными одной или несколькими группами, выбранным из группы, состоящей из T, C(O)O-, -O-, -C(O)-, C(O)N(Ry3)-, S(O)2N(Ry3)-, S(O)N(Ry3)-, -S(O)2-, -S(O)-, N(Ry3)S(O)2N(Ry3a)-, -S-, N(Ry3)-, OC(ORy3)(Ry3a), N(Ry3)C(O)N(Ry3a)- и OC(O)N(Ry3);
где:
Ry1 и Ry1a независимо выбраны из группы, состоящей из H, T, C1-10 алкила, C2-10 алкенила и C2-10 алкинила;
каждый T независимо выбран из группы, состоящей из следующего: фенил, нафтил, инденил, инданил, тетралинил, C3-10 циклоалкил, 3 - 10-членный гетероциклил, 8 - 11-членный гетеробициклил, 8 - 30-членный карбополициклил и 8 - 30-членный гетерополициклил;
каждый Ry2 независимо выбран из группы, состоящей из галогена и C1-6 алкила; и
каждый Ry3, Ry3a, Ry4, Ry4a, Ry5, Ry5a и Ry5b независимо друг от друга выбран из группы, состоящей из H и C1-6 алкила; где C1-6 алкил является необязательно замещенным одним или несколькими галогенами, которые являются одинаковыми или различными.
[211] Такой спейсер представляет собой “биоразлагаемый спейсер”, если фрагмент спейсера содержит по меньшей мере одну биоразлагаемую связь. Согласно дополнительным вариантам осуществления фрагмент спейсера может представлять собой C1-20 алкильную цепь, которая является необязательно прерванной одной или несколькими группами, независимо выбранными из -O-, T и -C(O)N(Ry1)-; и эта C1-20 алкильная цепь является необязательно замещенной одной или несколькими группами, независимо выбранными из OH, T и C(O)N(Ry6Ry6a); где Ry1, Ry6, Ry6a независимо выбраны из группы, состоящей из H и C1-4 алкила, и где T выбран из группы, состоящей из следующего: фенил, нафтил, инденил, инданил, тетралинил, C3-10 циклоалкил, 3 - 10-членного гетероциклил, 8 - 11-членный гетеробициклил, 8 - 30-членный карбополициклил и 8 - 30-членный гетерополициклил.
[212] Такой спейсер представляет собой “биоразлагаемый спейсер”, если фрагмент спейсера содержит по меньшей мере одну биоразлагаемую связь.
[213] Биоразлагаемая связь может представлять собой, например, сложноэфирную или карбонатную связь.
[214] Используемый в настоящем документе термин “метка (TAG)” и “метка очистки” относятся к фрагменту, который при конъюгировании со вторым фрагментом придает (а) физическое и/или химическое свойство/свойства, отсутствующие в указанном втором фрагменте без фрагмента метки и (b) такие различные физические и/или химические свойства позволяют очистить такой конъюгат.
[215] Используемые в настоящем документе термины “защитная группа” или “PG” относятся к фрагменту, который используют для обратимой защиты функциональных групп во время процессов химической реакции, чтобы сделать эти функциональные группы по существу нереакционноспособными в указанных процессах химической реакции.
[216] Используемый в настоящем документе термин “пролекарственное средство” означает конъюгат, в котором лекарственное средство ковалентно и обратимо конъюгировано с фрагментом обратимого линкера, причем фрагмент обратимого линкера пролекарственного средства либо прямо, либо опосредованно через фрагмент спейсера прикреплен к носителю, такому как гидрогель согласно настоящему изобретению. Пролекарственное средство высвобождает лекарственное средство при физиологических условиях (водный буфер, 37,4°C, pH 7,4). Такое высвобожденное лекарственное средство может являться немодифицированным, что означает, что ни один остаток от фрагмента обратимого линкера пролекарственного средства не остается прикрепленным к высвобожденному лекарственному средству.
[217] Используемый в настоящем документе термин "лекарственное средство" относится к любому веществу, которое может воздействовать на любые физические или биохимические свойства биологического организма, включая в себя без ограничения вирусы, бактерии, грибы, растения, животные и люди. В частности, используемые в настоящем документе термины включают в себя любое вещество, предназначенное для диагностики, излечения, смягчения, лечения или предотвращения заболевания у организмов, в частности людей или животных, или для иного улучшения физического или психического благополучия организмов, в частности людей или животных. Согласно некоторым аспектам лекарственное средство представляет собой биологически активный фрагмент, который модулирует активность одного или нескольких белков, выбранных из группы, содержащей основные факторы роста фибробластов (bFGF), кислотные факторы роста фибробластов (aFGF), трансформирующие факторы роста альфа (TGFa), трансформирующие факторы роста бета (TGFβ), тромбоцитарный фактор роста (PDGF), ангиогенин, тромбоцитарный фактор роста эндотелиальных клеток (PD-ECGF), интерлейкин-1 (IL-1), интерлейкин-8 (IL-8), интерлейкин-12, фактор роста эндотелия сосудов (VEGF), ангиопоэтин-I, Del-I, фоллистатин, гранулоцитарный колониестимулирующий фактор (G-CSF), фактор роста гепатоцитов (HGF), лептин, мидкин, плацентарный фактор роста, плейотрофин (PTN), програнулин, пролиферин, фактор некроза опухолей-альфа (TNF-альфа), ангиоаррестин, ангиостат - фрагмент плазминогена, антиангиогенный антитромбин III, ингибитор хрящевого происхождения (CDI), фрагмент комплемента CDS9, эндостатин - фрагмент коллагена XVIII, фрагмент фибронектина, GRO-бета, гепариназы, фрагмент гексасахарида гепарина, хорионический гонадотропин человека (hCG), интерферон альфа/бета/гамма, индуцируемый интерфероном белок (IP-IO), фрагмент крингла S плазминогена, ингибиторы металлопротеиназы (TIMP), 2-метоксиэстрадиол, ингибитор плацентарной рибонуклеазы, ингибитор активатора плазминогена, тромбоцитарный фактор 4 (PF4), 16 кДа фрагмент пролактина, связанный с пролиферином белок (PRP), ретиноиды, тетрагидрокортизол-S, тромбоспондин-I (TSP-I), васкулостатин, вазостатин - фрагмент кальретикулина, рецептор простагландина, гормон роста, инсулиноподобный фактор роста-I (IGF-I), сфингозин-1-фосфат, фактор D, RTP801, ингибиторы комплемента, α2-адренергический агонист, mTOR, цилиарный нейротрофический фактор (CNTF), нейротрофический фактор, происходящий из головного мозга (BDNF), нейротрофический фактор, происходящий из глиальных клеток (GDNF), полученный из эпителия хрусталика фактор роста (LEDGF), полученный из палочек фактор жизнеспособности колбочек (RdCVF), фактор, полученный из пигментного эпителия (PEDF), белок, активирующий нейтрофилы, белок - хемоаттрактант моноцитов, воспалительный белок макрофагов, белки с малой индуцируемой секрецией (SIS), тромбоцитарный фактор, основной белок тромбоцитов, активность, стимулирующая рост меланомы, эпидермальный фактор роста, фактор роста нервов, морфогенные белки кости, индуцирующий рост хряща кости фактор, интерлейкины, ингибиторы интерлейкина, рецепторы интерлейкина, гематопоэтические факторы, гранулоцитарный колониестимулирующий фактор, макрофагальный колониестимулирующий фактор, гранулоцитарно-макрофагальный колониестимулирующий фактор, ингибин и активин. Согласно некоторым аспектам лекарственное средство представляет собой антагонист VEGF. Термин “лекарственное средство” также используют для конъюгированного лекарственного средства, в котором по сравнению со свободным лекарственным средством отсутствует водород.
[218] Используемый в настоящем документе термин “антагонист VEGF” относится к молекуле, способной связываться с VEGF, снижать уровни экспрессии VEGF или нейтрализовать, блокировать, ингибировать, устранять, снижать или препятствовать биологическим активностям VEGF, включая в себя без ограничения связывание VEGF с одним или несколькими рецепторами VEGF, передачу сигналов VEGF и VEGF-опосредованный ангиогенез и выживание или пролиферацию эндотелиальных клеток. Например, молекула, способная нейтрализовать, блокировать, ингибировать, устранять, уменьшать или препятствовать биологическим активностям VEGF, может проявлять свои эффекты путем связывания с одним или несколькими рецепторами VEGF (VEGFR) (например, VEGFR1, VEGFR2, VEGFR3, мембраносвязанный рецептор VEGF (mbVEGFR) или растворимый рецептор VEGF (sVEGFR)). В качестве антагонистов VEGF, используемых в способах согласно настоящему изобретению, предусмотрены полипептиды, которые специфически связываются с VEGF, антитела к VEGF и их антигенсвязывающие фрагменты, рецепторные молекулы и производные, которые специфически связываются с VEGF, тем самым изолируют его от связывания с одним или несколькими рецепторами, слитые белки (например, VEGF-Trap (Regeneron)) и VEGF121-гелонин (Peregrine). Антагонисты VEGF также включают в себя антагонистические варианты полипептидов VEGF, олигомеров из антисмысловых нуклеотидов, комплементарных по меньшей мере фрагменту молекулы нуклеиновой кислоты, кодирующей полипептид VEGF; малые РНК, комплементарные по меньшей мере фрагменту молекулы нуклеиновой кислоты, кодирующей полипептид VEGF; рибозимы, которые нацелены на VEGF; пептидные антитела к VEGF и аптамеры VEGF. Антагонисты VEGF также включают в себя полипептиды, которые связываются с VEGFR, антитела к VEGFR и их антигенсвязывающие фрагменты, и производные, которые связываются с VEGFR, тем самым блокируя, ингибируя, устраняя, уменьшая или препятствуя биологическим активностям VEGF (например, передаче сигналов VEGF), или слитые белки. Антагонисты VEGF также включают в себя непептидные малые молекулы, которые связываются с VEGF или VEGFR и которые способны блокировать, ингибировать, устранять, уменьшать или препятствовать биологическим активностям VEGF. Таким образом, термин “активности VEGF”, в частности, включает в себя опосредованные VEGF биологические активности VEGF. Согласно определенным вариантам осуществления антагонист VEGF снижает или ингибирует по меньшей мере на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или более уровень экспрессии или биологическую активность VEGF. Согласно некоторым вариантам осуществления VEGF, ингибируемый VEGF-специфическим антагонистом, представляет собой VEGF (8-109), VEGF (1-109) или VEGF165.
[219] Используемый в настоящем документе термин “антагонисты VEGF” может включать в себя без ограничения антитела к VEGFR2 и родственные молекулы (например, рамуцирумаб, танибирумаб, афлиберцепт), антитела к VEGFR1 и родственные молекулы (например, икрукумаб, афлиберцепт (VEGF Trap-Eye; EYLEA®) и зив-афлиберцепт (VEGF Trap; ZALTRAP®)), биспецифические антитела к VEGF (например, MP-0250, вануцизумаб (VEGF-ANG2) и биспецифические антитела, раскрытые в US 2001/0236388), биспецифические антитела, включая в себя комбинации двух из анти-VEGF, анти-VEGFR1 и анти-VEGFR2 плеч, антитела к VEGF (например, бевацизумаб, севацизумаб и ранибизумаб) и непептидные низкомолекулярные антагонисты VEGF (например, пазопаниб, акситиниб, вандетаниб, стиварга, кабозантиниб, ленватиниб, нинтеданиб, орантиниб, телатиниб, довитиниб, седираниб, мотезаниб, сульфатиниб, апатиниб, форетиниб, фамитиниб и тивозаниб). Дополнительные антагонисты VEGF описаны ниже.
[220] “Нарушение” представляет собой любое состояние, для которого было бы благоприятно лечение конъюгатами антител, описанными в настоящем документе. Например, млекопитающие, которые страдают или нуждаются в профилактике аномального ангиогенеза (избыточного, несоответствующего или неконтролируемого ангиогенеза) или проницаемости сосудов. Это включает в себя хронические и острые нарушения или заболевания, включая в себя те патологические состояния, которые делают млекопитающее предрасположенным к рассматриваемому нарушению. Неограничивающие примеры нарушений, подлежащих лечению в настоящем документе, включают в себя нарушения, ассоциированные с патологическим ангиогенезом (например, офтальмологические нарушения и нарушения клеточной пролиферации) и нарушения, ассоциированные с нежелательной проницаемостью сосудов.
[221] “Эффективное количество” средства, например, фармацевтического состава, относится к количеству, эффективному, в необходимых дозировках и в течение необходимых периодов времени, для достижения требуемого терапевтического или профилактического результата.
[222] Используемый в настоящем документе термин “лечение” (и его грамматические вариации, такие как “лечить” или “осуществление лечения”) относится к клиническому вмешательству в попытке изменить естественное течение состояния индивидуума, которого лечат, и его можно проводить либо для профилактики, либо во время течения клинической патологии. Желательные эффекты лечения включают в себя без ограничения предотвращение возникновения или рецидива заболевания, ослабление симптомов, уменьшение любых прямых или косвенных патологических последствий заболевания, уменьшение скорости прогрессирования заболевания, улучшение или смягчение болезненного состояния и ремиссию или улучшение прогноза. Согласно некоторым вариантам осуществления конъюгаты антител согласно настоящему изобретению или другие композиции, которые включают в себя конъюгат антител согласно настоящему изобретению (например, фармацевтическую композицию), используют для задержки развития заболевания или для замедления прогрессирования заболевания.
[223] Термин “прерванный” означает, что фрагмент вставлен между двумя атомами углерода или - если вставка находится на одном из концов фрагмента - между углеродом или гетероатомом и атомом водорода, предпочтительно между атомом углерода и водорода. Неограничивающие примеры таких атомов и фрагментов включают в себя -O-, -S-, -N(H)-, -N(замещенный)- -NC(O)- и OC(O)-.
[224] Используемый в настоящем документе термин “C1-4 алкил” отдельно или в комбинации означает алкильный фрагмент с неразветвленной или разветвленной цепью с 1 - 4 атомами углерода. Если он присутствует на конце молекулы, примерами C1-4 алкила с неразветвленной или разветвленной цепью являются метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил и трет-бутил. Когда два фрагмента молекулы связаны C1-4-алкилом, примерами таких C1-4 алкильных групп являются CH2, CH2CH2, CH(CH3), CH2CH2CH2, CH(C2H5), C(CH3)2. Каждый водород на углероде C1-4 алкила может быть необязательно замещен заместителем, как определено выше. Необязательно C1-4 алкил может быть прерван одним или несколькими фрагментами, как определено ниже.
[225] Используемый в настоящем документе термин “C1-6 алкил” отдельно или в комбинации означает алкильный фрагмент с неразветвленной или разветвленной цепью с 1 - 6 атомами углерода. Если он присутствует на конце молекулы, примерами C1-4 алкила с неразветвленной или разветвленной цепью являются метил, этил, n-пропил, изопропил, n-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, 2-метилбутил, 2,2-диметилпропил, н-гексил, 2-метилпентил, 3-метилпентил, 2,2-диметилбутил, 2,3-диметилбутил и 3,3-диметилпропил. Когда два фрагмента молекулы связаны C1-6 алкильной группой, то примеры таких C1-6 алкильных групп представляют собой -CH2-, -CH2-CH2-, -CH(CH3)-, -CH2-CH2-CH2-, -CH(C2H5)- и C(CH3)2-. Каждый атом водорода на атоме углерода C1-6 может быть необязательно замещен заместителем, как определено выше. Необязательно C1-6 алкил может быть прерван одним или несколькими фрагментами, как определено ниже. Соответственно, “C1-10 алкил”, “C1-20 алкил” или “C1-50 алкил” означает алкильную цепь, характеризующуюся 1 - 10, 1 - 20 или 1 - 50 атомами углерода, соответственно, где каждый атом водорода на углероде C1-10, C1-20 или C1-50 может быть необязательно замещен заместителем, как определено выше. Необязательно C1-10 или C1-50 алкил может быть прерван одним или несколькими фрагментами, как определено ниже.
[226] Используемый в настоящем документе термин "алкилен" относится к бивалентному насыщенному алифатическому радикалу, такому как метилен, этилен, пропилен и тому подобное.
[227] Используемый в настоящем документе термин “C2-6 алкенил” отдельно или в комбинации означает углеводородный фрагмент с неразветвленной или разветвленной цепью, содержащий по меньшей мере одну углерод-углеродную двойную связь с 2 - 6 атомами углерода. Если он присутствует на конце молекулы, примерами являются CH=CH2, CH=CHCH3, CH2-CH=CH2, CH=CHCH2-CH3 и -CH=CH-CH=CH2. Когда два фрагмента молекулы связаны C2-6 алкенильной группой, то пример такого C2-6 алкенила представляет собой -CH=CH-. Каждый атом водорода C2-6 алкенильного фрагмента может быть необязательно замещен заместителем, как определено выше. Необязательно C2-6 алкенил может быть прерван одним или несколькими фрагментами, как определено ниже. Соответственно, термин “C2-10 алкенил”, “C2-20 алкенил” или “C2-50 алкенил” отдельно или в комбинации означает углеводородный фрагмент с неразветвленной или разветвленной цепью, содержащий по меньшей мере одну углерод-углеродную двойную связь с 2 - 10, 2 - 20 или 2 - 50 атомами углерода. Каждый атом водорода C2-10 алкенильное, C2-20 алкенильной или C2-50 алкенильной группы может быть необязательно замещен заместителем, как определено выше. Необязательно C2-10 алкенил, C2-20 алкенил или C2-50 алкенил может быть прерван одним или несколькими фрагментами, как определено ниже.
[228] Используемый в настоящем документе термин “C2-6 алкинил” отдельно или в комбинации означает углеводородный фрагмент с неразветвленной или разветвленной цепью, содержащий по меньшей мере одну углерод-углеродную тройную связь с 2 - 6 атомами углерода. Если он присутствует на конце молекулы, примерами являются -C≡CH, -CH2-C≡CH, CH2-CH2-C≡CH и CH2-C≡C-CH3. Когда два фрагмента молекулы связаны алкинильной группой, то пример представляет собой -C≡C-. Каждый атом водорода C2-6 алкинильной группы может быть необязательно замещен заместителем, как определено выше. Необязательно может присутствовать одна или несколько двойных связей. Необязательно C2-6 алкинил может быть прерван одним или несколькими фрагментами, как определено ниже. Соответственно, используемый в настоящем документе термин “C2-10 алкинил”, “C2-20 алкинил” и “C2-50 алкинил” отдельно или в комбинации означает углеводородный фрагмент с неразветвленной или разветвленной цепью, содержащий по меньшей мере одну углерод-углеродную тройную связь с 2 - 10, 2 - 20 или 2 - 50 атомами углерода, соответственно. Каждый атом водорода C2-10 алкинильной, C2-20 алкинильной или C2-50 алкинильной группы может быть необязательно замещен заместителем, как определено выше. Необязательно может присутствовать одна или несколько двойных связей. Необязательно C2-10 алкинил, C2-20 алкинил или C2-50 алкинил может быть прерван одним или несколькими фрагментами, как определено ниже.
[229] Как указано выше, C1-4 алкил, C1-6 алкил, C1-10 алкил, C1-20 алкил, C1-50 алкил, C2-6 алкенил, C2-10 алкенил, C2-20 алкенил, C2-50 алкенил, C2-6 алкинил, C2-10 алкинил, C2-20 алкенил или C2-50 алкинил могут быть необязательно прерванными одной или несколькими фрагментами, которые предпочтительно выбраны из группы, состоящей из следующего:

где
пунктирные линии указывают на прикрепление к оставшейся части фрагмента или реагента; и
R и Ra независимо друг от друга выбраны из группы, состоящей из H, метила, этила, пропила, бутила, пентила и гексила.
[230] Используемый в настоящем документе термин "C3-10 циклоалкил" означает циклическую алкильную цепь с 3 - 10 атомами углерода, которая может являться насыщенной или ненасыщенной, например, циклопропил, циклобутил, циклопентил, циклогексил, циклогексенил, циклогептил, циклооктил, циклононил или циклодецил. Каждый атом водорода на углероде C3-10 циклоалкила может быть замещен заместителем, как определено выше. Термин "C3-10 циклоалкил" также включает в себя соединенные мостиком бициклы, такие как норборнан или норборнен.
[231] Термин “8-30-членный карбополициклил” или “8-30-членный карбополицикл” означает циклический фрагмент из двух или более колец с 8-30 атомами кольца, где два соседних кольца характеризуются по меньшей мере одним общим атомом кольца и которое может содержать вплоть до максимального числа двойных связей (ароматическое или неароматическое кольцо, которое является полностью, частично насыщенным или ненасыщенным). Предпочтительно 8-30-членный карбополициклил означает циклический фрагмент из двух, трех, четырех или пяти колец, более предпочтительно из двух, трех или четырех колец.
[232] Используемый в настоящем документе термин "3-10-членный гетероциклил" или "3-10-членный гетероцикл" означает кольцо с 3, 4, 5, 6, 7, 8, 9 или 10 атомами кольца, которое может содержать вплоть до максимального числа двойных связей (ароматическое или неароматическое кольцо, которое является полностью, частично насыщенным или ненасыщенным), где по меньшей мере от одного атома кольца вплоть до 4 атомов кольца замещены гетероатомом, выбранным из группы, состоящей из серы (включая в себя -S(O)-, -S(O)2-), кислорода и азота (включая в себя =N(O)-) и где кольцо связано с остальной частью молекулы посредством атома углерода или азота. Примеры 3-10-членных гетероциклов включают в себя без ограничения азиридин, оксиран, тииран, азирин, оксирен, тиирен, азетидин, оксетан, тиетан, фуран, тиофен, пиррол, пирролин, имидазол, имидазолин, пиразол, пиразолин, оксазол, оксазолин, изоксазол, изоксазолин, тиазол, тиазолин, изотиазол, изотиазолин, тиадиазол, тиадиазолин, тетрагидрофуран, тетрагидротиофен, пирролидин, имидазолидин, пиразолидин, оксазолидин, изоксазолидин, тиазолидин, изотиазолидин, тиадиазолидин, сульфолан, пиран, дигидропиран, тетрагидропиран, имидазолидин, пиридин, пиридазин, пиразин, пиримидин, пиперазин, пиперидин, морфолин, тетразол, триазол, триазолидин, тетразолидин, диазепан, азепин и гомопиперазин. Каждый атом водорода 3-10-членной гетероциклильной или 3-10-членной гетероциклической группы может быть замещен заместителем, как определено ниже.
[233] Используемый в настоящем документе термин "8-11-членный гетеробициклил" или "8-11-членный гетеробицикл" означает гетероциклический фрагмент из двух колец с 8-11 атомами кольца, где по крайней мере один атом кольца является общим для обоих колец и который может содержать вплоть до максимального числа двойных связей (ароматическое или неароматическое кольцо, которое является полностью, частично насыщенным или ненасыщенным), где по меньшей мере от одного атома кольца до 6 атомов кольца замещены гетероатомом, выбранным из группы, состоящей из серы (включая в себя -S(O)-, -S(O)2-), кислорода и азота (включая в себя =N(O)-) и где кольцо связано с остальной частью молекулы через атом углерода или азота. Примерами 8 - 11-членного гетеробицикла являются индол, индолин, бензофуран, бензотиофен, бензоксазол, бензизоксазол, бензотиазол, бензизотиазол, бензимидазол, бензимидазолин, хинолин, хиназолин, дигидрохиназолин, хинолин, дигидрохинолин, тетрагидрохинолин, декагидрохинолин, изохинолин, декагидроизохинолин, тетрагидроизохинолин, дигидроизохинолин, бензазепин, пурин и птеридин. Термин 8-11-членный гетеробицикл также включает в себя спироструктуры двух колец, таких как 1,4-диокса-8-азаспиро[4.5]декан или мостиковые гетероциклы, такие как 8-аза-бицикло[3.2.1]октан. Каждый атом водорода 8-11-членного гетеробициклила или 8-11-членного гетеробициклического углерода может быть замещен заместителем, как определено ниже.
[234] Аналогично, термин “8-30-членный гетерополициклил” или “8-30-членный гетерополицикл” означает гетероциклический фрагмент из более чем двух колец с 8-30 атомами кольца, предпочтительно из трех, четырех или пяти колец, где два соседних кольца характеризуются по меньшей мере одним общим атомом кольца, и который может содержать вплоть до максимального числа двойных связей (ароматическое или неароматическое кольцо, которое является полностью, частично насыщенным или ненасыщенным), причем по меньшей мере от одного атом кольца имеет вплоть до 10 атомов кольца замещены гетероатомом, выбранным из группы, включающей в себя серу (включая в себя -S(O)-, S(O)2-), кислород и азот (включая в себя =N(O)-), и где кольцо связано с остальной частью молекулы через атом углерода или азота.
[235] Используемый в настоящем документе "галоген" означает фтор, хлор, бром или йод. Как правило, предпочтительно, что галоген представляет собой фтор или хлор.
[236] Используемый в настоящем документе термин "частично ненасыщенный" относится к кольцевому фрагменту, который включает в себя по меньшей мере одну двойную или тройную связь между атомами кольца, но не является ароматическим. Подразумевается, что термин "частично ненасыщенный" охватывает кольца с несколькими сайтами ненасыщенности, но не включает в себя арильные или гетероарильные фрагменты, как определено в настоящем документе.
[237] Термин "биоразлагаемый", используемый в настоящем документе в отношении спейсерного фрагмента или другого химического соединения, означает, что спейсерная группа или химическое соединение способны подвергаться разложению или расщеплению связей в биологических или физиологических условиях. Биоразложение может происходить посредством гидролиза, ферментативного расщепления или другого механизма. Описанные в настоящем документе спейсерные фрагменты, как правило, будут подвергаться разложению в витреальной жидкости в результате реакции расщепления связи, которая происходит с периодом полужизни не более 12 месяцев, согласно некоторым вариантам осуществления с периодом полужизни не более шести месяцев после инъекции в стекловидное тело или воздействия на стекловидное тело. Биоразложение спейсерных фрагментов может происходить на химических связях, прикрепляющих фрагмент спейсера к другим группам, а также на химических связях в спейсерном фрагменте.
[238] Используемый в настоящем документе термин "необязательно замещенный", если не указано иное, означает, что группа может быть замещена одним или несколькими (например, 1, 2, 3 или 4) заместителями, перечисленными для этой группы, в которой указанные заместители могут быть одинаковыми или различными. Согласно некоторым аспектам необязательно замещенная группа содержит 1 заместитель. Согласно другому аспекту необязательно замещенная группа содержит 2 заместителя. Согласно другому аспекту необязательно замещенная группа содержит 3 заместителя.
[239] Термин "прерванный", используемый в настоящем документе в отношении алкила, алкенила, алкинила или алкилена, означает, что один или несколько атомов углерода замещены функциональными группами или гетероатомами, так что алкил, алкенил, алкинил или алкилен являются прерванными. Иллюстративные группы, которые могут прерывать алкил, алкенил, алкинил или алкилен, если иное не указано в настоящем документе, включают в себя T, -C(O)O-; -O-; -C(O)-; -C(O)N(R17)-; -S(O)2N(R17)-; -S(O)N(R17)-; -S(O)2-; -S(O)-; -N(R17)S(O)2N(R17a)-; -S-; -N(R17)-; -OC(O)R17; -N(R17)C(O)-; -N(R17)S(O)2-; -N(R17)S(O)-; -N(R17)C(O)O-; -N(R17)C(O)N(R17a)- и -OC(O)N(R17R17a), где R17 в каждом случае представляет собой независимо H или C1-50 алкил.
[240] Термин “замещенный” означает, что один или несколько атомов -H молекулы замещены другим атомом или группой атомов, которые называются “заместитель” или “заместители”. Подходящие заместители выбраны из группы, состоящей из следующего: галоген; CN; COOR15; OR15; C(O)R15; C(O)N(R15R15a); S(O)2N(R15R15a); S(O)N(R15R15a); S(O)2R15; S(O)R15; N(R15)S(O)2N(R15aR15b); SR15; N(R15R15a); NO2; OC(O)R15; N(R15)C(O)R15a; N(R15)S(O)2R15a; N(R15)S(O)R15a; N(R15)C(O)OR15a; N(R15)C(O)N(R15aR15b); OC(O)N(R15R15a); T; C1-50 алкил; C2-50 алкенил или C2-50 алкинил, где T; C1-50 алкил; C2-50 алкенил; и C2-50 алкинил являются необязательно замещенными одним или несколькими R16, которые являются одинаковыми или различными, и где C1-50 алкил; C2-50 алкенил и C2-50 алкинил являются необязательно прерванными одной или несколькими группами, выбранными из группы, состоящей из T, -C(O)O-; -O-; -C(O)-; -C(O)N(R17)-; -S(O)2N(R17)-; -S(O)N(R17)-; -S(O)2-; -S(O)-; -N(R17)S(O)2N(R17a)-; -S-; -N(R17)-; -OC(O)R17; -N(R17)C(O)-; -N(R17)S(O)2-; -N(R17)S(O)-; -N(R17)C(O)O-; -N(R17)C(O)N(R17a)- и -OC(O)N(R17R17a). Согласно некоторым таким аспектам R15, R15a, R15b независимо выбраны из группы, состоящей из следующего: H; T; и C1-50 алкил; C2-50 алкенил или C2-50 алкинил, где T; C1-50 алкил; C2-50 алкенил и C2-50 алкинил являются необязательно замещенными одним или несколькими R16, которые являются одинаковыми или различными, и где C1-50 алкил; C2-50 алкенил и C2-50 алкинил являются необязательно прерванными одной или несколькими группами, выбранными из группы, состоящей из T, -C(O)O-; -O-; -C(O)-; -C(O)N(R17)-; S(O)2N(R17)-; -S(O)N(R17)-; -S(O)2-; -S(O)-; N(R17)S(O)2N(R17a)-; -S-; -N(R17)-; -OC(O)R17; -N(R17)C(O)-; -N(R17)S(O)2-; -N(R17)S(O)-; -N(R17)C(O)O-; N(R17)C(O)N(R17a)- и -OC(O)N(R17R17a). Согласно некоторым таким аспектам T выбран из группы, состоящей из следующего: фенил; нафтил; инденил; инданил; тетралинил; C3-10 циклоалкил; 4-7-членный гетероциклил; или 8-11-членный гетеробициклил, где T является необязательно замещенным одним или несколькими R16, которые являются одинаковыми или различными. Согласно некоторым таким аспектам R16 представляет собой галоген; CN; оксо (=O); COOR18; OR18; C(O)R18; C(O)N(R18R18a); S(O)2N(R18R18a); S(O)N(R18R18a); S(O)2R18; S(O)R18; N(R18)S(O)2N(R18aR18b); SR18; N(R18R18a); NO2; OC(O)R18; N(R18)C(O)R18a; N(R18)S(O)2R18a; N(R18)S(O)R18a; N(R18)C(O)OR18a; N(R18)C(O)N(R18aR18b); OC(O)N(R18R18a); или C1-6 алкил, где C1-6 алкил является необязательно замещенным одним или несколькими галогенами, которые являются одинаковыми или различными. Согласно некоторым таким аспектам R17, R17a, R18, R18a, R18b независимо выбраны из группы, состоящей из H или C1-6 алкила, где C1-6 алкил является необязательно замещенным одним или несколькими галогенами, которые являются одинаковыми или различными.
[241] Используемый в настоящем документе “противоион щелочного металла” относится к Na+, K+ и Li+.
[242] Используемый в настоящем документе термин “гидрогель” означает гидрофильную или амфифильную полимерную сеть, состоящую из гомополимеров или сополимеров, которая является нерастворимой из-за наличия ковалентных химических поперечных связей.
[243] Используемый здесь термин “среднечисленная молекулярная масса” означает обычное среднее арифметическое значение молекулярных масс отдельных полимеров. Специалисту в настоящей области техники понятно, что продукты полимеризации, полученные в результате реакции полимеризации, не все характеризуются одинаковой молекулярной массой, а скорее характеризуются молекулярно-массовым распределением. Следовательно, диапазоны молекулярной массы, молекулярные массы, диапазоны количества мономеров в полимере и количества мономеров в полимере, как используется в настоящем документе, относятся к среднечисленной молекулярной массе и среднечисловому количеству мономеров.
[244] Используемый в настоящем документе термин “фармацевтическая композиция” относится к композиции, содержащей один или несколько активных ингредиентов и один или несколько инертных ингредиентов, а также любой продукт, который прямо или косвенно возникает в результате комбинация, комплексообразования или агрегации любых двух или более ингредиентов, или в результате диссоциации одного или нескольких ингредиентов, или в результате других типов реакций или взаимодействий одного или нескольких ингредиентов.
[245] Используемый в настоящем документе термин "вспомогательное вещество" относится к разбавителю, адъюванту или несущей среде, с которыми вводят терапевтическое средство, т.е. нейтрализующее VEGF пролекарственное средство, такое как антитело к VEGF. Таким фармацевтическим вспомогательным веществом может являться вода; масла и нефтепродукты животного, растительного или синтетического происхождения, включая в себя без ограничения следующее: арахисовое масло, соевое масло, минеральное масло, кунжутное масло и т.п.; крахмал; глюкоза; лактоза; сахароза; маннит; трегалоза; желатин; солод; рис; мука; мел; силикагель; стеарат натрия; моностеарат глицерина; тальк; хлорид натрия; сухое обезжиренное молоко; глицерин; пропилен; гликоль; этиловый спирт; ацетат; сукцинат; трис; карбонат; фосфат; HEPES (4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота); MES (2-(N-морфолино)этансульфоновая кислота); Tween®; полоксамеры; полоксамины; CHAPS; Igepal®; аминокислоты, такие как, например, глицин, лизин или гистидин; триглицериды; маннит; лактоза; крахмал; стеарат магния; сахарин натрия; целлюлоза; и карбонат магния. Примеры подходящих фармацевтических вспомогательных веществ описаны в "Remington's Pharmaceutical Sciences", E.W. Martin. Состав должен соответствовать способу введения.
[246] Используемый в настоящем документе термин “фармацевтически приемлемый” означает, что молекула или реагент одобрены регулирующим органом, таким как EMA (Европа) и/или FDA (США), и/или любым другим национальным регулирующим органом, для использования животными, предпочтительно людьми.
[247] “Акцепторная каркасная область человека” для целей настоящего изобретения представляет собой каркасную область, содержащую аминокислотную последовательность каркасной области вариабельного домена легкой цепи (VL) или каркасной области вариабельного домена тяжелой цепи (VH), полученную из каркасной области иммуноглобулина человека или консенсусной каркасной области человека, как определено ниже. Акцепторная каркасная область человека, “полученная из“ каркасной области иммуноглобулина человека или консенсусной каркасной области человека, может содержать такую же аминокислотную последовательность или может содержать изменения аминокислотной последовательности. Согласно некоторым вариантам осуществления число замен аминокислот составляет 10 или менее, 9 или менее, 8 или менее, 7 или менее, 6 или менее, 5 или менее, 4 или менее, 3 или менее или 2 или менее. Согласно некоторым вариантам осуществления акцепторная каркасная область VL человека является идентичной, в отношении последовательности, последовательности каркасной области VL иммуноглобулина человека или последовательности консенсусной каркасной области человека.
[248] “Аффинность” относится к силе совокупности нековалентных взаимодействий между одним сайтом связывания молекулы (например, антитела) и его партнера по связыванию (например, антигена). Если не указано иное, используемый в настоящем документе термин “аффинность связывания” относится к характеристической аффинности связывания, которая отражает взаимодействие 1: 1 между представителями пары связывания (например, антителом и антигеном). Аффинность молекулы X по отношению к своему партнеру Y, как правило, можно представить константой диссоциации (Kd). Аффинность можно измерить общепринятыми способами, известными в настоящей области техники, включая в себя те, которые описаны в настоящем документе. Конкретные иллюстративные и примерные варианты осуществления для измерения аффинности связывания описаны ниже.
[249] Антитело “с созревшей аффинностью” относится к антителу с одним или несколькими изменениями в одной или нескольких гипервариабельных областях (HVR) и/или каркасных областях (FR) по сравнению с исходным антителом, которое не обладает такими изменениями, причем такие изменения приводят в результате к улучшению аффинности антитела к антигену.
[250] Термин “фактор роста сосудистого эндотелия” или “VEGF” относится к относится к белку А фактора роста сосудистого эндотелия, примером которого является SEQ ID NO: 47 (см. также регистрационный номер Swiss Prot P15692, Gene ID (NCBI): 7422). Термин “VEGF” охватывает белок с аминокислотной последовательностью согласно SEQ ID NO: 47, а также его гомологи и изоформы. Термин “VEGF” также охватывает известные изоформы, например изоформы сплайсинга VEGF, например VEGF111, VEGF121, VEGF145, VEGF165, VEGF189 и VEGF206, вместе с встречающимися в природе аллельными и процессированными их формами, включая в себя 110- аминокислотный человеческого фактора роста эндотелиальных клеток, образуемый за счет плазминового расщепления VEGF16п5, как описано в Ferrara Mol. Biol. Cell. 21:687 (2010), Leung et al., Science, 246:1306 (1989), и Houck et al., Mol. Endocrin., 5:1806 (1991). Термин “VEGF” также относится к VEGF из видов, не относящихся к человеку, таких как мышь, крыса или примат. Иногда VEGF из определенного вида обозначается такими терминами, как hVEGF для человеческого VEGF, mVEGF для мышиного VEGF и тому подобное. Термин “VEGF” также используют для обозначения усеченных форм полипептида, содержащих аминокислоты от 8 до 109 или от 1 до 109 фактора роста эндотелиальных клеток человека из 165 аминокислот. Ссылку на любые такие формы VEGF можно идентифицировать в настоящей заявке, например, по обозначению “VEGF109,” “VEGF (8-109),” “VEGF (1-109)” или “VEGF165”. Положения аминокислот для “усеченного” нативного VEGF пронумерованы, как указано в нативной последовательности VEGF. Например, аминокислотное положение 17 (метионин) в усеченном нативном VEGF также представляет собой положение 17 (метионин) в нативном VEGF. Усеченный нативный VEGF обладает аффинностью связывания по отношению к рецепторам KDR и Flt-1, сравнимой с нативным VEGF. Используемый в настоящем документе термин “вариант VEGF” относится к полипептиду VEGF, который включает в себя одну или несколько аминокислотных мутаций в нативной последовательности VEGF. Необязательно, одна или несколько аминокислотных мутаций включают в себя аминокислотную(ые) замену(ы). В целях краткого обозначения вариантов VEGF, описанных в настоящем документе, следует отметить, что числа относятся к положению аминокислотного остатка на аминокислотной последовательности предполагаемого нативного VEGF (предоставлено в Leung с соавт., выше, и Houck с соавт., выше). Если не указано иное, используемый в настоящем документе термин “VEGF” обозначает VEGF-A.
[251] Термины “антитело к VEGF,” “антитело, которое связывается с VEGF” и “антитело, которое специфически связывается с VEGF” относятся к антителу, которое способно связываться с VEGF с достаточной аффинностью, так что антитело является применимым в качестве диагностического и/или терапевтического средства в нацеленном воздействии на VEGF. Согласно одному варианту осуществления степень связывания антитела к VEGF с неродственным белком, не являющимся VEGF, составляет менее чем приблизительно 10% от связывания антитела с VEGF, как измерено, например, с помощью радиоиммуноанализа (RIA). Согласно определенным вариантам осуществления антитело, которое связывается с VEGF, характеризуется константой диссоциации (Kd), составляющей ≤ 1 мкM, ≤ 100 нM, ≤ 10 нM, ≤ 1 нM, ≤ 0,1 нM, ≤ 0,01 нM или ≤ 0,001 нM (например 10-8 M или меньше, например, от 10-8 M до 10-13 M, например, от 10-9 M до 10-13 M). Согласно определенным вариантам осуществления антитело к VEGF связывается с эпитопом VEGF, который является консервативным среди VEGF из разных видов.
[252] Термин “антитело” в настоящем документе используют в самом широком смысле и охватывает различные структуры антител, включая в себя без ограничения моноклональные антитела, поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела) и фрагменты антител, при условии, что они демонстрируют требуемую антигенсвязывающую активность.
[253] “Фрагмент антитела” относится к молекуле, отличной от интактного антитела, которая содержит часть интактного антитела, которая связывает антиген, с которым связывается интактное антитело. Примеры фрагментов антител включают в себя без ограничения Fv, Fab, Fab’, Fab-C, Fab’-SH, F(ab’)2; диатела; линейные антитела; молекулы одноцепочечных антител (например, scFv); и мультиспецифические антитела, образованные из фрагментов антител. В некоторых случаях примеры фрагментов антител включают в себя без ограничения Fv, Fab, Fab’, Fab’-SH, F(ab’)2; диатела; линейные антитела; молекулы одноцепочечных антител (например, scFv) и мультиспецифические антитела, образованные из фрагментов антител.
[254] При расщеплении антител папаином образуются два идентичных антигенсвязывающих фрагмента, называемых фрагментами “Fab”, и остаточный фрагмент “Fc”, обозначение которого отражает способность легко кристаллизоваться. Фрагмент Fab состоит из полной легкой (L) цепи вместе с доменом вариабельной области тяжелой (H) цепи (VH) и первым константным доменом одной тяжелой цепи (CH1). Обработка антителом пепсином дает один большой фрагмент F(ab’)2, который примерно соответствует двум связанным дисульфидным мостиком Fab-фрагментам, обладающим двухвалентной антигенсвязывающей активностью, и все еще способен к поперечному сшиванию антигена. Фрагменты Fab’ отличаются от фрагментов Fab наличием нескольких дополнительных остатков на карбоксиконце домена СН1, включая в себя один или несколько цистеинов из шарнирной области антитела. Молекулы Fab-C представляют собой молекулы Fab, которые экспрессируются так, что последовательность усекается на первом цистеине шарнирной области, что дает в результате Fab со свободным цистеином непосредственно после экспрессии (см., например, Shatz et al. Mol. Pharmaceutics 2016; идентификатор PubMed (PMID) 27244474). Например, молекула Fab-C может содержать свободный цистеин в положении Cys227 тяжелой цепи. В других случаях молекула Fab-C может содержать свободный цистеин в положении Cys229 тяжелой цепи. Fab’-SH является в настоящем документе обозначением Fab’, в котором остаток(остатки) цистеина константных доменов несут свободную тиоловую группу. Фрагменты F(ab’)2 антител первоначально были получены в виде пар Fab’-фрагментов, которые содержат между собой шарнирные цистеины. Также известны другие химические сочетания фрагментов антител.
[255] Термин “область Fc” в настоящем документе используют для определения С-концевой области тяжелой цепи иммуноглобулина, которая содержит по меньшей мере часть константной области. Термин включает в себя области Fc с нативной последовательностью и варианты областей Fc. Согласно одному варианту осуществления область Fc тяжелой цепи IgG человека простирается от Cys226 или от Pro230 до карбоксильного конца тяжелой цепи. Тем не менее, C-концевой лизин (Lys447) области Fc может присутствовать или не присутствовать. Если не указано иное, нумерацию аминокислотных остатков в области Fc или константной области осуществляют в соответствии с системой нумерации EU, также называемой индексом EU, как описано в Kabat et al., Sequences of Proteins of Immunological Interest, 5-е изд. Public Health Service, National Institutes of Health, Bethesda, MD (1991).
[256] “Fv” состоит из димера одного домена вариабельной области тяжелой цепи и одного домена вариабельной области легкой цепи в тесной нековалентной ассоциации. В результате сворачивания этих двух доменов образуются шесть гипервариабельных петель (по 3 петли из цепи H и из цепи L), которые вносят аминокислотные остатки для связывания антигена и придают антителу специфичность связывания с антигеном. Тем не менее, даже один вариабельный домен (или половина Fv, содержащая только три HVR, специфических в отношении антигена) обладает способностью распознавать и связывать антиген, хотя часто с более низкой аффинностью, чем целый сайт связывания.
[257] “Одноцепочечный Fv”, также сокращенно обозначаемый как “sFv” или “scFv”, представляют собой фрагменты антител, которые содержат домены антител VH и VL, соединенную в одну полипептидную цепь. Предпочтительно, полипептид sFv дополнительно содержит полипептидный линкер между доменами VH и VL, который позволяет sFv образовывать требуемую структуру для связывания антигена. Для обзора sFv см. Pluckthun в The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315 (1994).
[258] Термин “диатела” относится к небольшим фрагментам антитела, полученным путем конструирования фрагментов sFv (см. предыдущий абзац) с короткими линкерами (примерно 5-10 остатков) между доменами VH и VL, так что достигается межцепочечное, но не внутрицепочечное спаривание доменов V, в результате чего образуется двухвалентный фрагмент, т.е. фрагмент с двумя антигенсвязывающими сайтами. Биспецифические диатела представляют собой гетеродимеры двух “пересекающихся” фрагментов sFv, в которых домены VH и VL двух антител присутствуют в разных полипептидных цепях. Диатела описаны более полно, например, в EP 404097; WO 93/11161; и Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993).
[259] “Блокирующее” антитело или “антагонистическое” антитело представляет собой антитело, которое ингибирует или снижает биологическую активность антигена, с которым оно связывается. Определенные блокирующие антитела или антагонистические антитела по существу или полностью ингибируют биологическую активность антигена.
[260] “Антитело, которое связывается с тем же эпитопом”, что и эталонное антитело, относится к антителу, которое блокирует связывание эталонного антитела с его антигеном в конкурентном анализе на 50% или более, и наоборот, эталонное антитело блокирует связывание антитело с его антигеном в конкурентном анализе на 50% или более. Иллюстративный конкурентный анализ представлен в настоящем документе.
[261] Термин “химерное” антитело относится к антителу, в котором часть тяжелой и/или легкой цепи получена из определенного источника или вида, тогда как остальная часть тяжелой и/или легкой цепи получена из другого источника или вида.
[262] “Класс” антитела относится к типу константного домена или константной области, которой обладает его тяжелая цепь. Существует пять основных классов антител: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть дополнительно разделены на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, которые соответствуют различным классам иммуноглобулинов, называются α, δ, ε, γ и μ соответственно.
[263] “Исходное антитело” представляет собой антитело, содержащее аминокислотную последовательность, из которой один или несколько аминокислотных остатков заменены одним или несколькими остатками. Исходное антитело может содержать последовательность нативного или дикого типа. Исходное антитело может содержать ранее существовавшие модификации аминокислотной последовательности (такие как добавления, делеции и/или замены) относительно других нативных форм, форм дикого типа или модифицированных форм антитела. Исходное антитело может быть направлено против представляющего интерес целевого антигена, например, биологически важного полипептида, такого как VEGF. Любое из антител, описанных в настоящем документе (например, антитела к VEGF), может представлять собой исходное антитело.
[264] “Эффекторные функции” относятся к тем биологическим активностям, которые относятся к области Fc антитела, которые варьируются в зависимости от изотипа антитела. Примеры эффекторных функций антител включают в себя: связывание C1q и комплемент-зависимую цитотоксичность (CDC); связывание с Fc-рецептором; антителозависимая клеточная цитотоксичность (ADCC); фагоцитоз; отрицательная регуляция рецепторов клеточной поверхности (например, B-клеточного рецептора); и активация В-клеток.
[265] “Каркас” или “каркасная область” или “FR” относится к остаткам вариабельного домена, отличным от остатков гипервариабельной области (HVR). FR вариабельного домена, как правило, состоит из четырех доменов FR: FR1, FR2, FR3 и FR4.
[266] Термины “полноразмерное антитело”, “интактное антитело” и “полное антитело” используют в настоящем документе взаимозаменяемо для обозначения антитела, характеризующегося структурой, по существу сходной со структурой нативного антитела, или содержащего тяжелые цепи, которые содержат область Fc как определено в настоящем документе.
[267] “Консенсусная каркасная область человека” представляет собой каркасную область, которая представляет наиболее часто встречающиеся аминокислотные остатки при выборе каркасных последовательностей VL или VH иммуноглобулина человека. Как правило, выбор последовательностей VL или VH иммуноглобулина человека происходит из подгруппы последовательностей вариабельных доменов. Как правило, подгруппа последовательностей представляет собой подгруппу, как в Kabat et al., Sequences of Proteins of Immunological Interest, 5 Edition, NIH Publication 91-3242, Bethesda MD (1991), vols. 1-3. Согласно одному варианту осуществления для VL подгруппой является подгруппа каппа I, как в Kabat с соавт., выше. Согласно одному варианту осуществления для VH подгруппой является подгруппа III, как в Kabat с соавт., выше.
[268] “Гуманизированные” формы не относящихся к человеку (например, относящихся к грызунам) антител представляют собой химерные антитела, которые содержат минимальную последовательность, полученную из относящегося к человеку антитела. По большей части гуманизированные антитела представляют собой иммуноглобулины человека (реципиентное антитело), в которых остатки из гипервариабельной области реципиента заменены остатками из гипервариабельной области не относящегося к человеку вида (донорное антитело), например, мыши, крысы, кролика или примата, не являющегося человеком, с требуемой специфичностью, аффинностью и способностью антител. В некоторых случаях остатки FR иммуноглобулина человека заменены соответствующими не относящимися к человеку остатками. Кроме того, гуманизированные антитела могут содержать остатки, которые не обнаружены в реципиентном антителе или в донорном антителе. Эти модификации произведены для дополнительного улучшения характеристик антител. В общем, гуманизированное антитело будет содержать по существу все из по меньшей мере одного и, как правило, двух вариабельных доменов, в которых все или по существу все гипервариабельные петли соответствуют таковым у не относящегося к человеку иммуноглобулина, и все или по существу все FR представляют собой FR из последовательности иммуноглобулина человека. Гуманизированное антитело необязательно также будет содержать по меньшей мере часть константной области иммуноглобулина (Fc), как правило часть константной области иммуноглобулина человека. Для получения дополнительной информации см. Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature 332:323-329 (1988); и Presta, Curr. Op. Struct. Biol. 2:593-596 (1992).
[269] Термин “вариабельный” относится к тому факту, что определенные сегменты вариабельных доменов сильно различаются по последовательности среди антител. Вариабельный или V-домен опосредует связывание антигена и определяет специфичность конкретного антитела к его конкретному антигену. Тем не менее, изменчивость неравномерно распределена по всему диапазону вариабельных доменов. Вместо этого V-области состоят из относительно инвариантных участков, называемых каркасными областями (FR) из 15-30 аминокислот, разделенных более короткими областями с крайней степенью изменчивости, называемыми “гипервариабельными областями”, каждая из которых составляет 9-12 аминокислот в длину. Термин “гипервариабельная область” или “HVR” при использовании в настоящем документе относится к аминокислотным остаткам антитела, которые отвечают за связывание антигена. Гипервариабельная область, как правило, содержит аминокислотные остатки, например, в области приблизительно остатков 24-34 (L1), 50-56 (L2) и 89-97 (L3) в VL и в области приблизительно остатков 26-35 (H1) 49-65 (Н2) и 95-102 (Н3) в VH (согласно одному варианту осуществления H1 находится в области приблизительно остатков 31-35); Kabat et al., Sequences of Proteins of Immunological Interest, 5 Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)) и/или таких остатков из “гипервариабельной петли” (например, остатки 26-32 (L1), 50-52 (L2) и 91-96 (L3) в VL и 26-32 (H1), 53- 55 (H2) и 96-101 (H3) в VH; Chothia and Lesk, J. Mol. Biol. 196: 901-917 (1987). Каждый из вариабельных доменов нативных тяжелых и легких цепей содержит четыре FR, в основном принимающих конфигурацию бета-листа, соединенные тремя гипервариабельными областями, которые образуют петли, соединяющие и в некоторых случаях являющиеся частью структуры бета-листа. Гипервариабельные области в каждой цепи удерживаются вместе в непосредственной близости с помощью FR и, вместе с гипервариабельными областями из другой цепи, способствуют образованию антигенсвязывающего сайта антител (см. Kabat et al., Sequences of Proteins of Immunological Interest, 5 Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)). Соответственно последовательности HVR и FR, как правило, появляются в следующей последовательности в VH (или VL): FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4. Константные домены не участвуют непосредственно в связывании антитела с антигеном, но проявляют различные эффекторные функции, такие как участие антитела в антителозависимой клеточной цитотоксичности (ADCC).
[270] Термин “нумерация остатков вариабельных доменов согласно Kabat” или “нумерация аминокислотных положений согласно Kabat” и их вариации, относится к системе нумерации, используемой для вариабельных доменов тяжелой цепи или вариабельных доменов легкой цепи подборки антител в Kabat с соавт., выше. Используя эту систему нумерации, фактическая линейная аминокислотная последовательность может содержать меньше или дополнительные аминокислоты, соответствующие укорочению или вставке в FR или HVR вариабельного домена. Например, вариабельный домен тяжелой цепи может включать в себя одну аминокислотную вставку (остаток 52a в соответствии с Kabat) после остатка 52 H2 и вставленные остатки (например, остатки 82a, 82b и 82c и т.д. в соответствии с Kabat) после остатка 82 FR тяжелой цепи. Нумерацию остатков согласно Kabat можно определить для данного антитела путем выравнивания в областях гомологии последовательности антитела со “стандартной” последовательностью, пронумерованной в соответствии с Kabat.
[271] Система нумерации согласно Kabat, как правило, используют для обозначения остатка в вариабельном домене (приблизительно остатки 1-107 легкой цепи и остатки 1-113 тяжелой цепи) (например, Kabat et al., Sequences of Immunological Interest. 5 Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)). “Система нумерации EU” или “индекс EU”, как правило, используют для обозначения остатка в константной области тяжелой цепи иммуноглобулина (например, индекс EU, описанный в Kabat с соавт., выше). “Индекс EU по Kabat” относится к нумерации остатков антитела IgG1 EU человека. Если в настоящем документе не указано иное, ссылки на номера остатков в вариабельном домене антител означают нумерацию остатков с помощью системы нумерации Kabat. Если в настоящем документе не указано иное, ссылки на номера остатков в константном домене антител означают нумерацию остатков в системе нумерации ЕС (например, см. предварительную заявку на выдачу патента США № 60/640323, фигуры в отношении нумерации EU).
[272] Если не указано иное, остатки HVR и другие остатки в вариабельном домене (например, остатки FR) пронумерованы в настоящем документе согласно Kabat с соавт., выше.
[273] Термин “выделенное антитело” при использовании для описания различных антител, раскрытых в настоящем документе, означает антитело, которое было идентифицировано и отделено и/или извлечено из клетки или клеточной культуры, из которой оно было экспрессировано. Загрязняющие компоненты его естественной среды представляют собой материалы, которые, как правило, мешают диагностическому или терапевтическому использованию полипептида и могут включать в себя ферменты, гормоны и другие белковые или небелковые растворенные вещества. Согласно некоторым вариантам осуществления антитело очищают до чистоты более 95% или 99%, что определяют, например, с помощью электрофоретического (например, SDS-PAGE, изоэлектрического фокусирования (IEF), капиллярного электрофореза) или хроматографического (например, с помощью ионообменной или обращенно-фазовой ВЭЖХ). Для обзора способов оценки чистоты антител см., например, Flatman et al., J. Chromatogr. B 848: 79-87 (2007). Согласно предпочтительным вариантам осуществления антитело будет очищено (1) до степени, достаточной для получения по меньшей мере 15 остатков N-концевой или внутренней аминокислотной последовательности с использованием секвенатора с вращающимся стаканом или (2) до гомогенности с помощью SDS-PAGE при невосстанавливающих или восстанавливающих условиях с использованием кумасси синего или, предпочтительно, серебряного красителя. Выделенное антитело включает в себя антитела in situ в рекомбинантных клетках, поскольку по меньшей мере один компонент полипептидной природной среды не будет присутствовать. Как правило, однако, выделенный полипептид будет получен с помощью по меньшей мере одной стадии очистки.
[274] Используемый в настоящем документе термин “моноклональное антитело” относится к антителу, полученному из популяции по существу гомогенных антител, т.е. отдельные антитела, составляющие популяцию, являются идентичными и/или связывают один и тот же эпитоп, за исключением возможных вариантных антител, например, содержащих встречающиеся в природе мутации или возникающие во время производства препарата моноклональных антител, такие варианты, как правило, присутствуют в небольших количествах. В отличие от препаратов поликлональных антител, которые, как правило, включают в себя разные антитела, направленные против разных детерминант (эпитопов), каждое моноклональное антитело препарата моноклональных антител направлено против одной детерминанты на антигене. Таким образом, термин “моноклональное” указывает на характер антитела, получаемого из по существу гомогенной популяции антител, и его не следует истолковывать как требующее получения антитела каким-либо конкретным способом. Например, моноклональные антитела, которые должны использоваться в соответствии с настоящим изобретением, можно получить с помощью различных техник, включая в себя без ограничения способ гибридомы, способы рекомбинантной ДНК, способы фагового дисплея и способы с использованием трансгенных животных, содержащих все или часть локусов иммуноглобулина человека, такие способы и другие иллюстративные способы получения моноклональных антител описаны в настоящем документе.
[275] Термин “мультиспецифическое антитело” используют в самом широком смысле, и конкретно он охватывает антитело, содержащее вариабельный домен тяжелой цепи (VH) и вариабельный домен легкой цепи (VL), где звено VH-VL обладает полиэпитопной специфичностью (т.е. способен связываться с двумя разными эпитопами на одной биологической молекуле или с каждым эпитопом на другой биологической молекуле). Такие мультиспецифические антитела включают в себя без ограничения полноразмерные антитела, антитела с двумя или более доменами VL и VH, фрагменты антител, такие как Fab, Fab’, Fab-C. Fv, dsFv, scFv, диатела, биспецифические диатела и триатела, фрагменты антител, которые были связаны ковалентно или нековалентно. “Полиэпитопная специфичность” относится к способности специфически связываться с двумя или более различными эпитопами на одной или разных мишенях. “Двойная специфичность” или “биспецифичность” относится к способности специфически связываться с двумя разными эпитопами на одной или разных мишенях. Тем не менее, в отличие от биспецифических антител, биспецифические антитела содержат два антигенсвязывающих плеча, которые являются идентичными по аминокислотной последовательности, и каждое плечо Fab способно распознавать два антигена. Двойная специфичность позволяет антителам взаимодействовать с высокой аффинностью с двумя различными антигенами в виде одной молекулы Fab или IgG. Согласно одному варианту осуществления мультиспецифическое антитело в форме IgG1 связывается с каждым эпитопом с аффинностью от 5 мкМ до 0,001 пМ, от 3 мкМ до 0,001 пМ, от 1 мкМ до 0,001 пМ, от 0,5 мкМ до 0,001 пМ или от 0,1 мкМ до 0,001 пМ. “Моноспецифический” относится к способности связывать только один эпитоп.
[276] “Нативные антитела” относятся к встречающимся в природе молекулам иммуноглобулина с различной структурой. Например, нативные антитела IgG представляют собой гетеротетрамерные гликопротеины, составляющие приблизительно 150000 Да, состоящие из двух идентичных легких цепей и двух идентичных тяжелых цепей, которые связаны дисульфидной связью. От N- до C-конца каждая тяжелая цепь содержит вариабельную область (VH), также называемую вариабельным тяжелым доменом или вариабельным доменом тяжелой цепи, за которой следуют три константных домена (CH1, CH2 и CH3). Аналогично, от N- до C-конца каждая легкая цепь содержит вариабельную область (VL), также называемую вариабельным легким доменом или вариабельным доменом легкой цепи, за которой следует константный домен легкой цепи (CL). Легкая цепь антитела может быть отнесена к одному из двух типов, называемых каппа (κ) и лямбда (λ), на основе аминокислотной последовательности ее константного домена.
[277] Что касается связывания антитела с молекулой-мишенью, то термин “специфическое связывание” или “специфически связывается” или “является специфическим в отношении” конкретного полипептида или эпитопа на конкретном полипептиде-мишени означает связывание, которое измеримо отличается от неспецифического взаимодействия. Специфическое связывание можно измерить, например, путем определения связывания молекулы по сравнению со связыванием контрольной молекулы. Например, специфическое связывание можно определить путем конкуренции с контрольной молекулой, которая похожа на мишень, например, с избытком немеченой мишени. В этом случае специфическое связывание определяют, если связывание меченой мишени с зондом конкурентно ингибируется избытком немеченой мишени. Используемый в настоящем документе термин “специфическое связывание” или “специфически связывается с” или является “специфическим в отношении” конкретного полипептида или эпитопа на конкретной полипептидной мишени можно продемонстрировать, например, с помощью молекулы, характеризующейся значением Kd в отношении мишени, составляющим 10-4 М или ниже, альтернативно 10-5 М или ниже, альтернативно 10-6 М или ниже, альтернативно 10-7 М или ниже, альтернативно 10-8 М или ниже, альтернативно 10-9 М или ниже, альтернативно 10-10 М или ниже, альтернативно 10-11 М или ниже, альтернативно 10-12 М или ниже или Kd в диапазоне от 10-4 М до 10-6 М или от 106 М до 1010 М или 107 М до 109 М. Специалисту в настоящей области техники понятно, что значения аффинности и Kd обратно пропорциональны. Высокая аффинность к антигену измеряется низким значением Kd. Согласно одному варианту осуществления термин “специфическое связывание” относится к связыванию, где молекула связывается с конкретным полипептидом или эпитопом на конкретном полипептиде без существенного связывания с любым другим полипептидом или полипептидным эпитопом.
[278] “Идентичность аминокислотной последовательности в процентах (%)” по отношению к эталонной полипептидной последовательности определяют как процентное отношение аминокислотных остатков в последовательности-кандидате, которые идентичны аминокислотным остаткам в эталонной полипептидной последовательности после выравнивания последовательностей и введение пропусков, если необходимо, для достижения максимальной процентной идентичности последовательности и не рассматривая какие-либо консервативные замены как часть идентичности последовательности. Выравнивание в целях определения процента идентичности аминокислотной последовательности может быть достигнуто различными способами, которые известны специалисту в настоящей области техники, например, с использованием общедоступного компьютерного программного обеспечения, такого как программное обеспечение BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в настоящей области техники могут определить подходящие параметры для выравнивания последовательностей, включая в себя любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей. Однако для целей настоящего описания значения идентичности аминокислотной последовательности в % генерируют с использованием компьютерной программы сравнения последовательностей ALIGN-2. Компьютерная программа для сравнения последовательностей ALIGN-2 создана Genentech, Inc., а исходный код был подан вместе с пользовательской документацией в Бюро по охране авторских прав США, Вашингтон, округ Колумбия, 20559, где она зарегистрирована под регистрационным номером авторского права США № TXU510087. Программа ALIGN-2 является общедоступной от Genentech, Inc., Южный Сан-Франциско, Калифорния, или может быть скомпилирована из исходного кода. Программа ALIGN-2 должна быть скомпилирована для использования в операционной системе UNIX, включая в себя цифровую UNIX V4.0D. Все параметры сравнения последовательностей устанавливаются программой ALIGN-2 и не меняются.
[279] В ситуациях, когда ALIGN-2 используют для сравнения аминокислотных последовательностей идентичности аминокислотной последовательности в % для данной аминокислотной последовательности A по отношению к, с или против данной аминокислотной последовательности B (которая альтернативно может быть сформулирована как данная аминокислотная последовательность A, которая характеризуется или содержит определенный % идентичности аминокислотной последовательности по отношению к, с или против данной аминокислотной последовательности B), рассчитывают следующим образом: в 100 раз превышает долю X/Y, где X - количество аминокислотных остатков, оцененных как идентичные совпадения программой выравнивания последовательностей ALIGN-2 в этой программе выравнивания A и B, и где Y - общее количество аминокислотных остатков в B. Понятно, что если длина аминокислотной последовательности A не равна длине аминокислотной последовательности B, % идентичности аминокислотной последовательности A по отношению к B не будет равен % идентичности аминокислотной последовательности B по отношению к A. Если специально не указано иное, все значения % идентичности аминокислотной последовательности, использованные в настоящем документе, получены, как описано в непосредственно предшествующем абзаце, с использованием компьютерной программы ALIGN-2.
[280] Используемый в настоящем документе термин “введение” означает способ введения дозы соединения (например, конъюгата антитело-гидрогель согласно настоящему изобретению) или композиции (например, фармацевтической композиции, например, фармацевтической композиции, включающей в себя конъюгат антитело-гидрогель согласно настоящему изобретению) субъекту. Композиции, используемые в описанных в настоящем документе способах, можно вводить, например, интравитреально (например, с помощью интравитреальной инъекции), с помощью глазных капель, внутримышечным, местным, субъюнктивальным, интравезикулярным, внутриглазным, внутриорбитальным путем, с помощью инъекции, имплантации, инфузии, непрерывной инфузии, в липидных композициях.
[281] “Ангиогенез” относится к процессу, посредством которого новые кровеносные сосуды образуются из уже существующих кровеносных сосудов. Ангиогенез отличается от васкулогенеза, который представляет собой de novo образование эндотелиальных клеток из мезодермальных клеток-предшественников. Нарушения, ассоциированные с патологическим ангиогенезом, можно лечить композициями и способами согласно настоящему изобретению. Эти нарушения включают в себя как неопухолевые нарушения, так и нарушения клеточной пролиферации. Нарушения клеточной пролиферации включают в себя без ограничения те, которые описаны ниже. Неопухолевые нарушения включают в себя без ограничения офтальмологические состояния (неограничивающие офтальмологические состояния включают в себя, например, следующее: ретинопатия, включая в себя пролиферативную диабетическую ретинопатию, хориоидальную неоваскуляризацию (CNV), возрастную макулярную дегенерацию (AMD), диабетическую и другие связанные с ишемией ретинопатии, диабетический макулярный отек (DME), патологическая миопия, болезнь фон Хиппель-Линдау, гистоплазмоз глаза, окклюзия вен сетчатки (включая в себя центральную (CRVO) и разветвленную (BRVO) формы), неоваскуляризация роговицы, неоваскуляризация сетчатки, ретинопатия недоношенных (ROP), семейная экссудативная витреоретинопатия (FEVR), болезнь Коутса, болезнь Норри, синдром остеопороза-псевдоглиомы (OPPG), субконъюнктивальное кровоизлияние, рубеоз радужки, неоваскулярные заболевания глаз, неоваскулярная глаукома и гипертоническая ретинопатия), аутоиммунные заболевания (например, ревматоидный артрит (RA), псориаз, анкилозирующий спондилит и воспалительное заболевание кишечника (например, болезнь Крона и язвенный колит)), нежелательная или аберрантная гипертрофия, артрит, псориатический артрит, псориатические бляшки, саркоидоз, атеросклероз, атеросклеротические бляшки, артериальный атеросклероз, сосудистый рестеноз, артериовенозные мальформации (АВМ), менингиома, гемангиома, ангиофиброма, гиперплазия щитовидной железы (включая в себя болезнь Грейвса), трансплантация роговицы и других тканей, воспаление легких, острое повреждение легких/ОРДС (острый респираторный дистресс-синдром), сепсис, первичная легочная гипертензия, злокачественные выпоты в легких, отек головного мозга (например, связанный с острым инсультом/закрытой травмой/повреждением черепа), синовиальное воспаление, образование паннуса при РА, оссифицирующий миозит, гипертрофическое образование костей, остеоартрит (ОА), рефрактерный асцит, синдром поликистозных яичников, эндометриоз, заболевания с выходом жидкости из сосудов в другие компартменты тела (панкреатит, синдром длительного сдавливания, ожоги, заболевание кишечника), хроническая бронхиальная астма, миома матки, преждевременные роды, хроническое воспаление, такое как воспалительное заболевание кишечника (IBD) (болезнь Крона и язвенный колит), воспалительные заболевания почек (включая в себя гломерулонефрит, особенно мезангиопролиферативный гломерулонефрит, гемолитический уремический синдром, диабетическая нефропатия и гипертонический нефросклероз), заболевания, возникающие после трансплантации, отторжение почечного аллотрансплантата, воспалительные заболевания, нефротический синдром, нежелательный или аберрантный рост массы ткани (не рак), гемофилическая артропатия, гипертрофические рубцы, угнетение роста волос, синдром Ослера-Вебера, пиогенная гранулема, ретролентальная фиброплазия, склеродермия, трахома, сосудистые спайки, синовит, дерматит, преэклампсия, асцит, перикардиальный выпот (например, связанный с перикардитом) и плевральный выпот. Дополнительные офтальмологические нарушения описаны ниже.
[282] Другие нарушения, которые могут быть связаны с патологическим ангиогенезом, включают в себя следующее: несрастание переломов (переломы, которые не заживают), пиогенная гранулема, трахома, гемофилическая артропатия, сосудистые спайки и гипертрофические рубцы, отторжение трансплантата, сосудисто-волокнистая ткань, розовые угри, синдром приобретенного иммунодефицита, окклюзия артерии, атопический кератит, бактериальные язвы, болезнь Бехчета, обструктивная болезнь сонных артерий, хроническое воспаление, хроническое отслоение сетчатки, хронический увеит, хронический витрит, переутомляемость глаз от контактных линз, отторжение роговичного трансплантата, неоваскуляризация роговичного трансплантата, болезнь Илза, эпидемический кератоконъюнктивит, грибковые язвы, инфекции вируса простого герпеса, инфекции опоясывающего лишая, синдромы повышенной вязкости крови, саркома Капоши, лейкоз, липидная дегенерация, болезнь Лайма, краевой кератолиз, разъедающая язва роговицы, микобактериальные инфекции, кроме проказы, миопия, врождённые ямки в диске зрительного нерва, остеоартрит, болезнь Педжета, парспланит, пемфигоид, фликтенулез, полиартериит, осложнения после воздействия лазером, протозойные инфекции, эластическая псевдоксантома, крыловидная плева, синдром сухого глаза, радиальная кератотомия, ретролентальная фиброплазия, саркоидоз, склерит, серповидноклеточная анемия, синдром Шегрена, болезнь Старгарта, болезнь Стивенса-Джонсона, верхний лимбальный кератит, сифилис, системная волчанка, краевая дегенерация Терьена, токсоплазмоз, травма, окклюзия вен, дефицит витамина А и саркоидоз Вегенера, нежелательный ангиогенез, ассоциированный с диабетом, паразитарные заболевания, ненормальное заживление ран, гипертрофия после операции, повреждение или травма, угнетение роста волос, угнетение овуляции и образования желтого тела, угнетение имплантации и угнетение развития эмбриона в матке.
[283] Используемый в настоящем документе термин “офтальмологическое нарушение” включает в себя любое офтальмологическое нарушение (которое также взаимозаменяемо в настоящем документе называется “офтальмологическое состояние”), ассоциированное с патологическим ангиогенезом. Офтальмологическое нарушение может характеризоваться измененной или нерегулируемой пролиферацией и/или инвазией новых кровеносных сосудов в структуры тканей глаза, такие как сетчатка или роговица. Неограничивающие офтальмологические нарушения включают в себя, например, следующее: AMD (например, влажная AMD, сухая AMD, промежуточная AMD, прогрессирующая AMD и географическая атрофия (GA)), макулярная дегенерация, макулярный отек, DME (например, очаговый, нецентровый DME и диффузный, DME с вовлечением центра макулы), ретинопатия, диабетическая ретинопатия (DR) (например, пролиферативная DR (PDR), непролиферативная DR (NPDR) и высотная DR), другие связанные с ишемией ретинопатии, ROP, окклюзия вен сетчатки (RVO) (например, центральная (CRVO) и разветвленная (BRVO) формы), CNV (например, миопическая CNV), неоваскуляризация роговицы, заболевание, ассоциированное с неоваскуляризацией роговицы, неоваскуляризация сетчатки, заболевание, ассоциированное с ретинальной/хориоидальной неоваскуляризацией, патологическая миопия, болезнь фон Хиппель-Линдау, гистоплазмоз глаза, FEVR, болезнь Коутса, болезнь Норри, OPPG, субконъюнктивальное кровоизлияние, рубеоз радужки, неоваскулярные заболевания глаз, неоваскулярная глаукома, пигментный ретинит (RP), гипертоническая ретинопатия, ангиоматозная пролиферация сетчатки, макулярная телеангиэктазия, неоваскуляризация радужки, внутриглазная неоваскуляризация, дегенерация сетчатки, кистозный макулярный отек (CMЕ), васкулит, отек диска зрительного нерва, ретинит, конъюнктивит (например, инфекционный конъюнктивит и неинфекционный (например, аллергический) конъюнктивит), врожденный амавроз Лебера (также известный как амавроз Лебера, или LCA), увеит (включая в себя инфекционный и неинфекционный увеит), хориоидит (например, многоочаговый хориоидит), глазной гистоплазмоз, блефарит, сухость глаз, травматическое повреждение глаз, болезнь Шегрена и другие офтальмологические заболевания, причем заболевание или нарушение ассоциировано с глазной неоваскуляризацией, транссудацией и/или отеком сетчатки. Дополнительные иллюстративные офтальмологические нарушения включают в себя заболевания, ассоциированные с рубеозом радужки (неоваскуляризация угла передней камеры) и заболевания, вызванные аномальной пролиферацией сосудисто-волокнистой или фиброзной ткани, включая в себя все формы пролиферативной витреоретинопатии.
[284] Иллюстративное заболевание, ассоциированное с неоваскуляризацией роговицы, включает в себя без ограничения следующее: эпидемический кератоконъюнктивит, дефицит витамина А, переутомляемость глаз от контактных линз, атопический кератит, верхний лимбальный кератит, крыловидная плева, синдром сухого глаза, синдром Шегрена, розовые угри, фликтенулез, сифилис, микобактериальные инфекции, липидная дегенерация, химические ожоги, вызванные бактериями язвы, вызванные грибами язвы, инфекции вируса простого герпеса, протозойные инфекции, саркома Капоши, разъедающая язва роговицы, краевая дегенерация Терьена, краевой кератолиз, ревматоидный артрит, системная волчанка, полиартериит, травма, саркоидоз Вегенера, склерит, синдром Стивенса-Джонсона, периферигоидная радиальная кератотомия и отторжение роговичного трансплантата.
[285] Иллюстративное заболевание, ассоциированное с ретинальной/хориоидальной неоваскуляризацией, включает в себя без ограничения следующее: диабетическая ретинопатия, макулярная дегенерация, серповидно-клеточная анемия, саркоидоз, сифилис, эластическая псевдоксантома, болезнь Педжета, окклюзия вен, окклюзия артерий, обструктивная болезнь сонных артерий, хронический увеит/витрит, микобактериальные инфекции, болезнь Лайма, системная красная волчанка, ретинопатия недоношенных, пигментная дистрофия сетчатки, макулярный отек), болезнь Илза, болезнь Бехчета, инфекции, вызывающие ретинит или хориоидит (например, многоочаговый хориоидит), предполагаемый гистоплазмоз глаз, болезнь Беста (желточная дегенерация желтого пятна), миопия, врождённые ямки в диске зрительного нерва, болезнь Старгарта, парспланит, отслоение сетчатки (например, хроническое отслоение сетчатки), синдромы повышенной вязкости крови, токсоплазмоз, травмы и осложнения после воздействия лазера.
[286] Используемый в настоящем документе термин “нарушения, ассоциированные с нежелательной проницаемостью сосудов,” включают в себя, например, отек, ассоциированный с опухолями головного мозга, асцит, ассоциированный со злокачественными новообразованиями, синдром Мейгса, воспаление легких, нефротический синдром, перикардиальный выпот, плевральный выпот или проницаемость, ассоциированную с сердечно-сосудистыми заболеваниями, такими как состояние после инфаркта миокарда и инсультов и т.п.
[287] “Вариант” или “мутант” исходного или эталонного полипептида (например, эталонного антитела или его вариабельного домена(ов)/HVR(нескольких HVR)) представляет собой полипептид, который (1) характеризуется аминокислотной последовательностью, отличающейся от аминокислотной последовательности исходного или эталонного полипептида и (2) был получен из исходного или эталонного полипептида посредством естественного или искусственного (произведенного человеком) мутагенеза. Такие варианты включают в себя, например, делеции и/или вставки и/или замены остатков в аминокислотной последовательности представляющего интерес полипептида, называемые в настоящем документе “изменениями аминокислотных остатков”. Таким образом, вариант HVR относится к HVR, содержащей вариантную последовательность относительно исходной или эталонной полипептидной последовательности (такой как последовательность исходного антитела или антигенсвязывающего фрагмента). В данном контексте изменение аминокислотного остатка относится к аминокислоте, отличной от аминокислоты в соответствующем положении в исходной или эталонной полипептидной последовательности (такой как последовательность эталонного антитела или его фрагмента). Любую комбинацию делеции, вставки и замены можно осуществить для получения конечного вариантного или мутантного конструкта при условии, что конечный конструкт обладает требуемыми функциональными характеристиками. Изменения аминокислот также могут изменять посттрансляционные процессы полипептида, такие как изменение количества или положения сайтов гликозилирования.
[288] Последовательность “дикого типа” (WT) или “эталон” или последовательность белка/полипептида “дикого типа” или “эталона”, такого как HVR или вариабельного домена эталонного антитела, могут являться эталонной последовательностью, из каких вариантные полипептиды получают путем введения мутаций. В общем, последовательность “дикого типа” для данного белка является наиболее распространенной в природе последовательностью. Аналогично, последовательность гена “дикого типа” представляет собой последовательность этого гена, которая чаще всего встречается в природе. Мутации можно вводить в ген “дикого типа” (и, следовательно, в белок, который он кодирует) либо посредством естественных процессов, либо с помощью индуцированных человеком средств. Продуктами таких процессов являются “вариантные” или “мутантные” формы исходного белка или гена “дикого типа”.
[289] Используемый в настоящем документе термин “клиренс” относится к объему вещества (например, антитела к VEGF, конъюгата антител, слитого белка (например, слитого белка Fab) или полимерного состава), который выводиться из компартмента (например, глаза (например, стекловидного тела)) в единицу времени.
[290] Термин “период полужизни” относится к времени, необходимому для концентрации вещества (например, антитела к VEGF, конъюгата антитела, слитого белка (например, слитого белка Fab) или полимерного состава), чтобы уменьшиться наполовину, in vivo (например, в глазу (например, в стекловидном теле)) или in vitro.
[291] Термин “эффективный период полужизни” относится к времени, необходимому для снижения концентрации конъюгата, например, конъюгата гидрогель-линкер-антитело, на половину in vivo (например, в глазу, например, в стекловидном теле) или in vitro. Понятно, что каждый из компонентов конъюгата, например гидрогель, линкер и антитело, может вносить вклад в эффективный период полужизни конъюгата.
Очистка HA
[292] HA можно необязательно очищать перед дериватизацией в соответствии со способами согласно настоящему раскрытию. Согласно некоторым таким аспектам образуется водный раствор, содержащий НА и от приблизительно 0,5 до приблизительно 1 моль/л ацетата натрия. HA осаждают из раствора путем добавления этанола до приблизительно 80% этанола объем./объем. Осажденную НА собирают и промывают с помощью приблизительно 80% объем./объем. этанола, а затем с помощью абсолютного этанола. Процедуру растворения/осаждения/промывки можно повторять по мере необходимости, пока не будет достигнута требуемая чистота.
Получение амин-функционализированной гиалуроновой кислоты
[293] Согласно некоторым аспектам гиалуроновую кислоту подвергают функционализации амином путем реакции реакционной смеси, содержащей HA согласно формуле I, первичного амина (H2N-LA-NH2) и карбоксил-активирующего реагента для реакции присоединения с образованием амин-HA согласно формуле II и частично поперечно-сшитой амин-HA согласно формуле III в соответствии со схемой реакции 1 ниже.
[294] Схема реакции 1
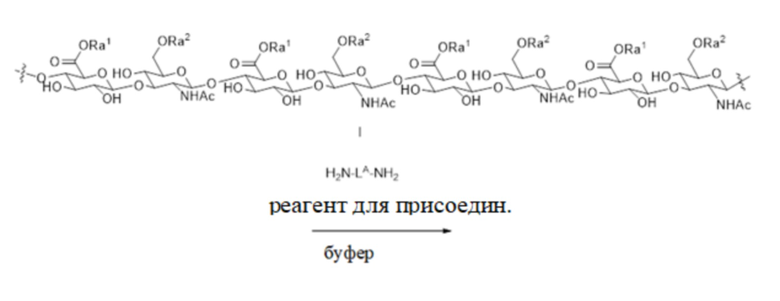

[295] Степень функционализации HA II и III с помощью аминного реагента H2N-LA-NH2, как показано на схеме реакции 1, описана в другом месте настоящего документа.
[296] На схеме реакции 1 каждый Ra1 независимо выбран из H, C1-4 алкила, противоиона щелочного металла, противоиона аммония или противоиона щелочноземельного металла. Каждый Ra2 независимо выбран из H, C1-4 алкила и противоиона щелочного металла. поперечно-сшивающую сложноэфирную связь в формуле III можно впоследствии гидролизовать, как описано дополнительно ниже, с получением дополнительного материала согласно формуле II, и чтобы сделать продукт реакции согласно схеме 1 пригодным для стерилизующей фильтрации.
[297] Согласно некоторым таким аспектам LA представляет собой спейсер. Согласно некоторым другим аспектам LA является необязательно замещенным и/или необязательно прерванным C1-10 алкиленом. Согласно некоторым таким аспектам LA представляет собой неразветвленный C2-4 алкилен или н-пропилен. Согласно другим аспектам LA может содержать оксиалкиленовый олигомер или полимер, такой как полиэтиленгликоль (PEG).
При образовании амида на схеме реакции 1 используют реагент для реакции присоединения, который согласно определенным вариантам осуществления можно выбрать из следующего: 1-этил-3-(3-диметиламинопропил)карбодиимид (EDC), дициклогексилкарбодиимид (DCC), диизопропилкарбодиимид (DIC), 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолинийхлорид (DMTMM) и 2-хлор-4,6-диметокси-1,3,5-триазин) (CDMT). Согласно некоторым конкретным аспектам реагент для реакции присоединения представляет собой EDC.
Согласно некоторым аспектам реакционная смесь может дополнительно содержать дополнительное средство для реакции присоединения. Согласно некоторым таким аспектам дополнительное средство для реакции присоединения можно выбрать из следующего: 1-гидроксибензотриазол (HOBt), 1-гидрокси-7-аза-1H-бензотриазол (HOAt), N-гидроксисукцинимид (HOSu) и этил-2-циано-2-(гидроксимино)ацетат (Oxyma pure®). Согласно некоторым конкретным аспектам дополнительное средство для реакции присоединения представляет собой HOBt. Согласно другим вариантам осуществления реагент для реакции присоединения может представлять собой 1-циано-2-этокси-2-оксоэтилиденаминоокси)диметиламино-морфолино-карбенийгексафторфосфат (COMU). Буфер, характеризующийся pH от приблизительно 5 до приблизительно 6 при концентрации, составляющей от приблизительно 50 мM до 150 мM, как правило, является подходящим для реакционной смеси для образования амин-функционализированной гиалуроновой кислоты. Согласно некоторым таким аспектам буфер представляет собой 2-(N-морфолино)этансульфоновую кислоту (MES).
[298] Реакционная смесь согласно некоторым вариантам осуществления может дополнительно содержать полярный апротонный растворитель для улучшения растворимости веществ, участвующих в реакции. Согласно таким аспектам подходящие отношения буфера к полярному апротонному растворителю составляют приблизительно 1:3 объем./объем., приблизительно 1:2 объем./объем., приблизительно 1:1,5 объем./объем., приблизительно 1:1 объем./объем., приблизительно 1,5:1 объем./объем., приблизительно 2:1 объем./объем., приблизительно 3:1 объем./объем., приблизительно 5:1 объем./объем. или приблизительно 10:1 объем./объем. Согласно некоторым таким аспектам полярный апротонный растворитель можно выбрать из следующего: ацетон, N,N-диметилформамид (DMF), ацетонитрил (ACN), диметилсульфоксид (DMSO) и их комбинации. Согласно одному аспекту растворитель представляет собой ацетонитрил.
[299] Функционализацию амином можно выполнить при температуре, составляющей приблизительно 10°C, приблизительно 15°C, приблизительно 20°C, приблизительно 25°C, приблизительно 30°C, приблизительно 35°C или приблизительно 40°C, в течение времени, подходящего для достижения по существу полного присоединения, такого как приблизительно 2 часа, приблизительно 4 часа, приблизительно 6 часов, приблизительно 8 часов, приблизительно 10 часов, приблизительно 12 часов или дольше.
[300] Согласно любому из различных аспектов настоящего раскрытия эквиваленты карбоксильных групп превышают эквиваленты первичного амина на образованной, функционализированной HA, как описано выше, так что не все карбоксильные группы HA являются функционализированными, как показано на схеме реакции I. Более конкретно, аминные функциональные группы вводят для обеспечения степени функционализации HA (или ее производного или ее соли щелочного металла), составляющей приблизительно 2%, приблизительно 3%, приблизительно 4%, приблизительно 5%, приблизительно 6%, приблизительно 7%, приблизительно 8%, приблизительно 9%, приблизительно 10%, приблизительно 11%, приблизительно 12%, приблизительно 13%, приблизительно 14% или приблизительно 15% и диапазон этих значений, или как описано в другом месте настоящего документа. Концентрация гиалуроната, первичного амина и дополнительного средства для реакции присоединения может поддерживаться постоянной, и указанные концентрации не зависят от требуемой загрузки амином образующейся функционализированной амином гиалуроновой кислоты.
[301] Примеры подходящих концентраций гиалуроната могут находиться в диапазоне, например, от 2 г/л до 16 г/л. Количество эквивалентов аминного реагента и амидных дополнительных средств для реакции присоединения по отношению к эквивалентам карбоксилатных групп на HA I может варьироваться, при необходимости, для обеспечения требуемой степени функционализации. Степень функционализации согласно некоторым вариантам осуществления можно контролировать на основе эквивалентов амидного реагента для реакции присоединения в присутствии избытка аминного реагента.
[302] Как показано на схеме реакции 1, часть НА может быть поперечно-сшита сложноэфирными связями с образованием частично поперечно-сшитой амин-НА. Такая частично поперечно-сшитая НА является растворимой в водных системах, но в большинстве случаев не фильтруется стерильно. поперечно-сшитую НА можно инкубировать в присутствии основания для гидролиза сложноэфирных связей и получения линейной амин-НА. Подходящие основания включают в себя основания щелочных металлов, такие как NaOH, KOH и LiOH. Гидролиз можно проводить при концентрации основания, такой как приблизительно 0,1 M, приблизительно 0,5 M, приблизительно 1 M, приблизительно 1,5 M или приблизительно 2 M, при значении pH, составляющем от приблизительно 12 до приблизительно 14, приблизительно 13 до приблизительно 14, или приблизительно 14, при температуре, составляющей приблизительно 10°C, приблизительно 15°C, приблизительно 20°C, приблизительно 25°C, приблизительно 30°C, приблизительно 35°C или приблизительно 40°C, в течение времени, подходящего для достижения по существу полного гидролиза. например, приблизительно 0,5 часа, приблизительно 1 часа, приблизительно 1,5 часа, приблизительно 2 часов или дольше. Такая гидролизованная амин-НА характеризуется среднечисловой молекулярной массой, по существу такой же, как исходный материал - нативная НА, является растворимой в водных системах и стерильно фильтруется. После гидролиза pH можно довести до значения от приблизительно 6 до приблизительно 8,5, от приблизительно 6,5 до приблизительно 8, или до приблизительно 7,5 с помощью неорганической кислоты или органической кислоты. Согласно некоторым аспектам кислота представляет собой уксусную кислоту.
Получение малеимидо-функционализированной HA
[303] Согласно некоторым аспектам настоящего раскрытия описанный в другом месте в настоящем документе амин-функционализированная HA реагирует с -N-гидроксисукцинимид (NHS)-La-малеимидом или NHS-LC-малеимидом с образованием малеимид-функционализированной HA. Согласно некоторым таким аспектам производное HA согласно формуле II реагирует с NHS-LB-малеимидом или NHS-LC-малеимидом (где NHS представляет собой N-гидроксисукцинимид и находится в форме активированного сложного эфира с LB или LC) с образованием малеимид-функционализированной HA согласно формуле IV в соответствии со схемой реакции 2 ниже.
[304] Схема реакции 2
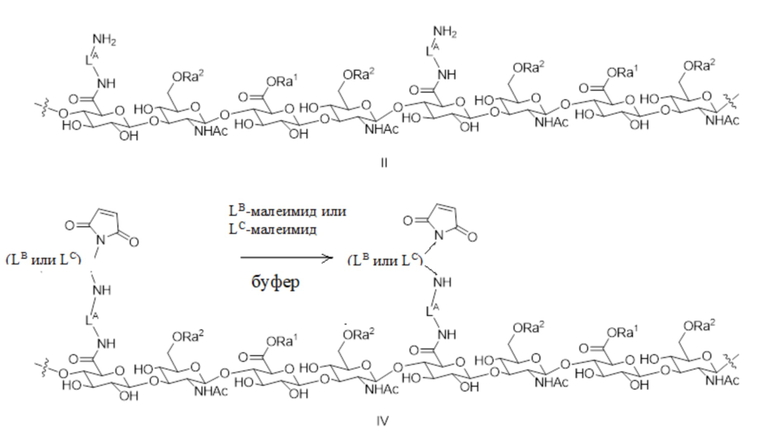
где Ra1, Ra2 и LA являются такими, как описано в другом месте настоящего документа. Согласно некоторым конкретным аспектам малеимидный спейсер представляет собой LB. Согласно другим аспектам малеимидный спейсер представляет собой LC. Степень функционализации HA II и IV с помощью аминного реагента H2N-LA-NH2 и LB-малеимида или LC-малеимида соответственно, как показано на схеме реакции 2, является произвольной, и следует понимать, что степень функционализации может варьироваться, как это необходимо для различных вариантов осуществления настоящего изобретения, и степень функционализации малеимидом может быть такой, как описано в другом месте настоящего документа. Согласно многим вариантам осуществления большинство или все аминные функциональные группы на HA II реагируют с LB-малеимидом или LC-малеимидом, но согласно определенным вариантам осуществления могут присутствовать остаточные аминные функциональные группы.
[305] Согласно некоторым аспектам LB представляет собой фрагмент спейсера, как описано в настоящем документе. Согласно некоторым аспектам LB представляет собой необязательно замещенный и/или необязательно прерванный C1-10 алкилен. Согласно некоторым аспектам LB представляет собой -C(O)-C1-5 алкилен. Согласно некоторым таким аспектам LB представляет собой неразветвленный -(O)-C2-3 алкилен или представляет собой -C(O)-этилен.
[306] Согласно некоторым аспектам LC представляет собой фрагмент биоразлагаемого спейсера, как описано в настоящем документе. Согласно некоторым аспектам LC может содержать по меньшей мере один сложноэфирный фрагмент, по меньшей мере одну карбонатную связь или их комбинации.
[307] Согласно некоторым аспектам LC характеризуется структурой:
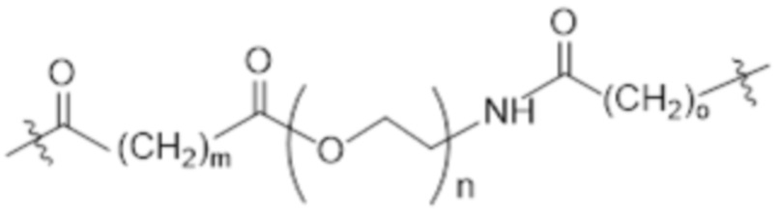
где m выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9 и 10 и построенных из них диапазонов, таких как от 1 до 10, от 2 до 8 или от 5 до 8. n выбран из 1, 2, 3 и 4, и построенных из них диапазонов, таких как от 1 до 4 или от 1 до 3. o выбран из 1, 2, 3 и 4, и построенных из них диапазонов, таких как от 1 до 4 или от 1 до 3. Согласно таким вариантам осуществления LС-малеимидный реагент характеризуется структурой:
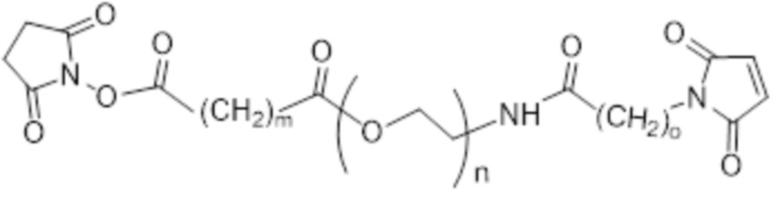 .
.
[308] Согласно некоторым аспектам где m равен 7, LC содержит фрагмент, полученный из азелаиновой кислоты, такой как фрагмент сложного эфира азелаиновой кислоты. Согласно одному такому аспекту LC характеризуется структурой:
 .
.
Согласно таким вариантам осуществления LC-малеимидный реагент характеризуется структурой:
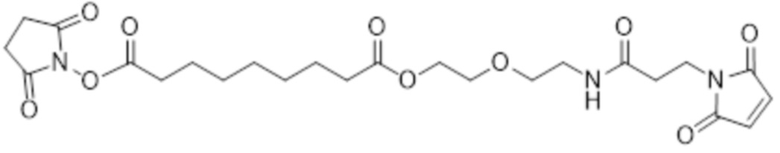
[309] pH реакции для событий согласно схеме реакции 2 составляет надлежащим образом от приблизительно 6,5 до приблизительно 9, от приблизительно 7 до приблизительно 8 или приблизительно 7,4. Концентрация буфер, составляющая от приблизительно 50 мM до приблизительно 150 мM, как правило, является подходящей для реакционной смеси для образования малеимид-функционализированной гиалуроновой кислоты. Согласно некоторым таким аспектам буфер выбран из следующего: (4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота) (HEPES), малеат, цитрат, BIS-трис, фосфат, N-(2-ацетамидо)иминодиуксусная кислота (ADA), карбонат, пиперазин-N,N′-бис(2-этансульфоновая кислота) (PIPES), 3-морфолино-2-гидроксипропансульфоновая кислота (MOPSO), имидазол, BIS-трис-пропан, N,N-бис(2-гидроксиэтил)-2-аминоэтансульфоновая кислота (BES), (3-(N-морфолино)пропансульфоновая кислота) (MOPS), 2-[(2-гидрокси-1,1-бис(гидроксиметил)этил)амино]этансульфоновая кислота (TES), 3-(бис(2-гидроксиэтил)амино)-2-гидроксипропан-1-сульфоновая кислота (DIPSO), 2-гидрокси-3-[трис(гидроксиметил)метиламино]-1-пропансульфоновая кислота (TAPSO), 4-(2-гидроксиэтил)пиперазин-1-(2-гидроксипропансульфоновая кислота) (HEPPSO), дегидрат пиперазин-1,4-бис(2-гидроксипропансульфоновой кислоты) (POPSO), трицин, глицилглицин и трис. Согласно некоторым конкретным аспектам буфер представляет собой HEPES. Реакционная смесь может дополнительно содержать полярный апротонный растворитель для улучшения растворимости участвующих в реакции веществ. Согласно таким аспектам подходящие соотношения буфера к полярному апротонному растворителю составляют приблизительно 1:3 объем./объем., приблизительно 1:2 объем./объем., приблизительно 1:1,5 объем./объем., приблизительно 1:1 объем./объем., приблизительно 1,5:1 объем./объем., приблизительно 2:1 объем./объем., приблизительно 3:1 объем./объем., приблизительно 5:1 объем./объем. или приблизительно 10:1 объем./объем. Согласно некоторым таким аспектам полярный апротонный растворитель можно выбрать из ацетона, DMF, ACN, DMSO и их комбинаций. Согласно одному аспекту растворитель представляет собой ACN. Температура реакция составляет приблизительно 10°C, приблизительно 15°C, приблизительно 20°C, приблизительно 25°C, приблизительно 30°C, приблизительно 35°C или приблизительно 40°C, и время реакции составляет приблизительно 0,5 часа, приблизительно 1 час, приблизительно 1,5 часа, приблизительно 2 часа или больше.
[310] Согласно некоторым аспектам схемы реакции 2 малеимид-функционализированную HA получают путем реакции первичного амина амин-функционализированной HA с реагентом NHS-LB-малеимидом в соответствии со схемой реакции 3 ниже.
[311] Схема реакции 3
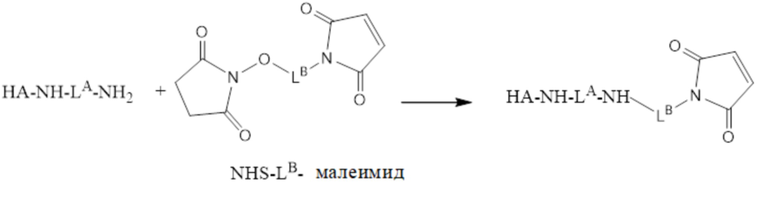
[312] Согласно некоторым конкретным аспектам LA представляет собой н-пропилен, и LB представляет собой -C(O)-(CH2)2-. Согласно некоторым аспектам буфер представляет собой HEPES, pH реакции составляет от приблизительно 7 до приблизительно 8 или приблизительно 7,4, буфер содержит ACN в объемном отношении буфера к ACN, составляющем приблизительно 2:1, температура реакции составляет от приблизительно 20°C до приблизительно 30°C, и время реакции составляет от приблизительно 0,5 часов до приблизительно 2 часов.
[313] Согласно некоторым другим аспектам схемы реакции 2 малеимидо-функционализированную HA получают путем реакции первичного амина амин-функционализированной HA с реагентом NHS-LC-малеимидом в соответствии со схемой реакции 4 ниже.
[314] Схема реакции 4

[315] Согласно некоторым конкретным аспектам LA представляет собой н-пропилен, и LC характеризуется структурой
 ,
,
где m равен 7, p равен 2, и o равен 2. Согласно некоторым аспектам буфер представляет собой HEPES, pH реакции составляет от приблизительно 8 до приблизительно 9 или приблизительно 7,4, буфер содержит ACN в объемном отношении буфера к ACN, составляющем приблизительно 2:1, температура реакции составляет от приблизительно 20°C до приблизительно 30°C, и время реакции составляет от приблизительно 1 часов до приблизительно 3 часов.
Прямое получение малеимидо-функционализированной HA
[316] Согласно некоторым аспектам, как показано на фиг. 2, малеимидные группы можно напрямую конъюгировать с HA путем реакции реакционной смеси, содержащей HA (или ее производное или соль), малеимидного соединения 2 со структурой и карбоксил-активирующего реагента для реакции присоединения с образованием соединения 4, характеризующегося конъюгированными малеимидными группами.
и карбоксил-активирующего реагента для реакции присоединения с образованием соединения 4, характеризующегося конъюгированными малеимидными группами.
[317] L1 представляет собой фрагмент спейсера, как описано в настоящем документе. Согласно некоторым аспектам L1 представляет собой C1-12 алкил, C2-10 алкил или C3-8 алкил. L1 может являться необязательно замещенным и/или необязательно прерванным, как описано в другом месте настоящего документа. Например, L1 может необязательно являться прерванным одним или несколькими из амида или амина.
Получение тиол-функционализированной HA
[318] Согласно некоторым аспектам настоящего раскрытия амин-функционализированная HA, описанная в другом месте в настоящем документе, реагирует с реагентом NHS-LB-S-защитная группа или реагентом NHS-LC-S-защитная группа с последующим снятием защитной группы с образованием тиол-функционализированной HA. Согласно некоторым таким аспектам формула II или формула IIa реагирует с реагентом NHS-LB-S-защитная группа или NHS-LC-S-защитная группа с образованием формулы V с последующим снятием защитной группы с образованием тиол-функционализированной HA согласно формуле VI в соответствии со схемой реакции 5 ниже.
[319] Схема реакции 5


где Ra1, Ra2, LA, LB и LC являются такими, как описано в другом месте настоящего документа. Согласно некоторым конкретным аспектам спейсер, соединяющийся с S-PG в соединении V и с -SH в соединении VI согласно схеме 5, представляет собой LC.
[320] Как и на схеме реакции 5 выше, степень функционализации HA V и VI с помощью NHS-LB-S-защитной группы или NHS-LC-S-защитной группы, показанная на схеме реакции 5, является произвольной, и следует понимать, что степень функционализации может варьироваться, при необходимости, для различных вариантов осуществления настоящего изобретения. Степень функционализации защищенным тиолом (и в итоге тиолом) является такой, как описано в другом месте настоящего документа. Согласно многим вариантам осуществления большинство или все аминные функциональные группы на HA II реагируют с NHS-LB-S-защитной группой или NHS-LC-S-защитной группой, но согласно определенным вариантам осуществления могут присутствовать остаточные аминные функциональные группы.
[321] pH реакции конъюгирования согласно схеме реакции 5 надлежащим образом составляет от приблизительно 7,5 до приблизительно 9,5 или от приблизительно 8 до приблизительно 9, например, приблизительно 8,5. Подходящие буферы в концентрации, составляющей от приблизительно 50 мM до приблизительно 150 мМ, описаны в другом месте в настоящем документе. Согласно некоторым аспектам буфер представляет собой HEPES. Реакционная смесь может дополнительно содержать полярный апротонный растворитель, как описано в другом месте настоящего документа, для улучшения растворимости участвующих в реакции веществ. Согласно некоторым аспектам растворитель представляет собой ACN. Соотношение буфера к полярному апротонному растворителю надлежащим образом составляет от приблизительно 1:2 объем./объем. до приблизительно 4:1 или от приблизительно 3:1 до приблизительно 1:1, например, приблизительно 2:1. Температура реакции составляет приблизительно 10°C, приблизительно 15°C, приблизительно 20°C, приблизительно 25°C, приблизительно 30°C, приблизительно 35°C или приблизительно 40°C, и время реакции составляет приблизительно 1 час, приблизительно 2 часа, приблизительно 3 часа, приблизительно 4 часа или больше.
[322] Производное HA согласно формуле V приводят в контакт с восстанавливающим средством для отщепления защитной группы на дисульфидной связи, тем самым образуя LB или LC с тиолом на конце (формула VI). Отщепляемые защитные группы известны в настоящей области техники, и неограничивающие примеры включают в себя пиридил-тиол и фенил-тиол, которые могут являться необязательно замещенными по меньшей мере одним заместителем, независимо выбранным из NO2, Cl, F, CN, CO2H и Br. Согласно одному такому аспекту уходящая группа представляет собой 2-меркаптопиридил. Восстанавливающие средства известны в настоящей области техники и включают в себя соль HCl и (трис(2-карбоксиэтил)фосфина) (TCEP), 2-меркаптоэтанол и дитиотреитол.
Прямое получение тиол-функционализированной HA
[323] Согласно некоторым аспектам, как показано на фиг. 3, защищенные дисульфид группы можно напрямую конъюгировать с HA путем реакции реакционной смеси, содержащей HA (или ее производное или соль), защищенное дисульфидное соединение 6 согласно структуре H2N-L3-S-PG, и карбоксил-активирующий реагент для реакции присоединения, с образованием соединения 8, характеризующегося конъюгированными защищенными дисульфидными группами. Защитную группу можно отщепить, как описано в другом месте настоящего документа, с образованием тиол-функционализированной HA.
Конъюгаты лекарственного средства с линкером
[324] Конъюгаты лекарственного средства с линкером (конъюгаты лекарственное средство-линкер), такие как реагент 5 на фигуре 2, реагент 14 на фигуре 5 и реагент 5 на фигуре 7, используют в получении конъюгатов поперечно-сшитой HA с лекарственным средством согласно настоящему изобретению. Согласно многим вариантам осуществления в конъюгате лекарственное средство-линкер можно использовать обратимый линкер пролекарственного средства L2 согласно формуле II, как описано выше. Согласно некоторым другим аспектам обратимый линкер пролекарственного средства фрагмент L2, используемый в таких моноконъюгатах лекарственного средства, может быть представлен формулой XIIa:
 XIIa
XIIa
где:
пунктирная линия указывает на прикрепление к азоту соединения лекарственного средства (не показано) путем образования амидной связи; и
X, X1, X2, X3, R1, R1a, R2, R2a, R3 и R3a являются такими, как определено выше;
[325] Согласно многим вариантам осуществления обратимый линкер пролекарственного средства L2, для удобства синтеза, можно получить вместе со спейсером L4 или частью спейсера L4.
[326] Согласно некоторым вариантам осуществления фрагмент обратимого линкера пролекарственного средства L2 вместе с частью спейсера L4 могут быть представлены соединением спейсер-линкер с формулой XIIc
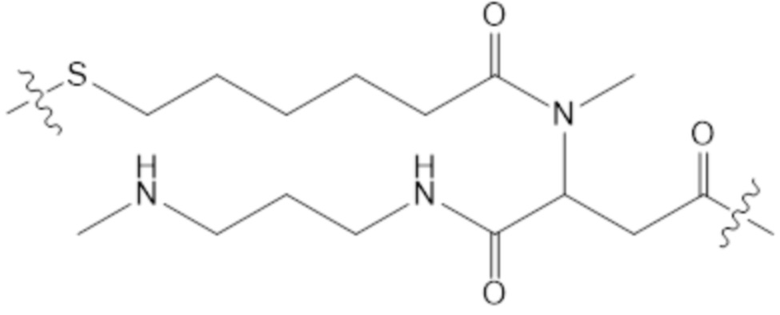 XIIc
XIIc
где крайняя правая волнистая линия представляет место прикрепления к атому азота лекарственного средства посредством амидной связи, и крайняя левая волнистая линия представляет место прикрепления к гидрогелю поперечно-сшитой HA или его предшественнику, как раскрыто в настоящем описании изобретения, посредством сульфидной связи (не показано). Фрагмент спейсера линкера XIIc представляет конкретную комбинацию фрагмента обратимого линкера пролекарственного средства L2 с частью спейсера L4, которые можно в целях удобства синтезировать вместе, как описано ниже, для применения согласно конкретным вариантам осуществления настоящего изобретения.
[327] Согласно некоторым аспектам фрагмент обратимого линкера пролекарственного средства L2 можно выбрать из следующего, где волнистая линия указывает на место прикрепления к азоту лекарственного средства, и где каждый L2 замещен одним фрагментом L4 при условии, что водород, помеченный звездочкой, не является замещенным:


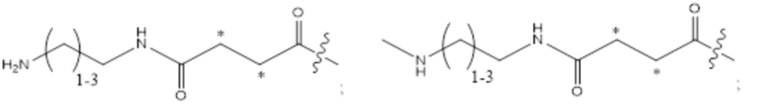


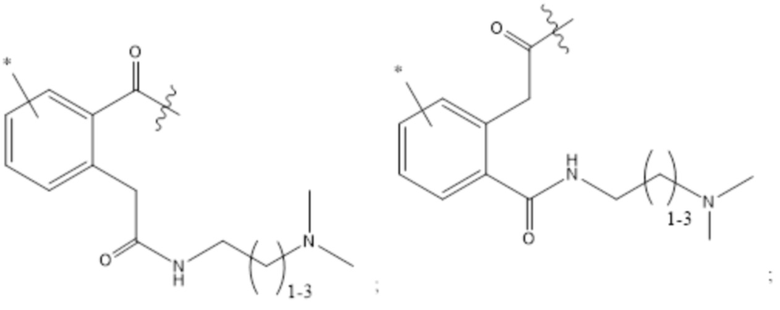


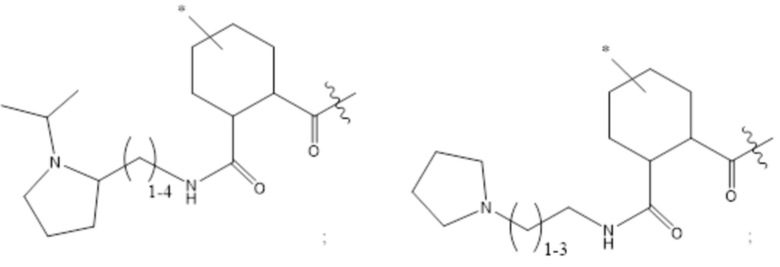
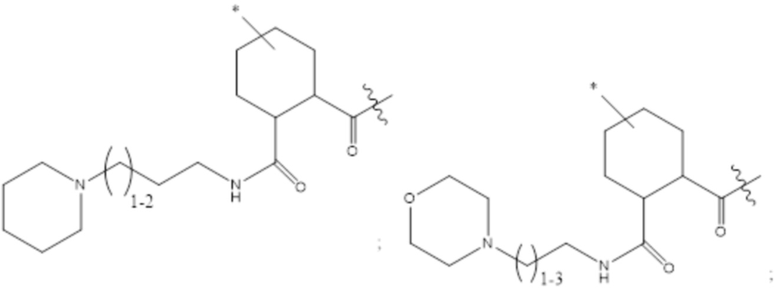
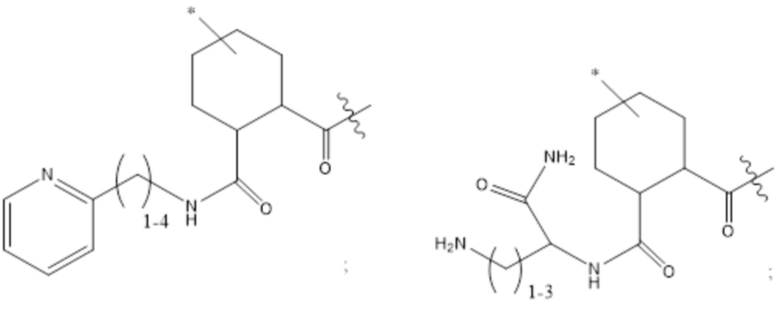
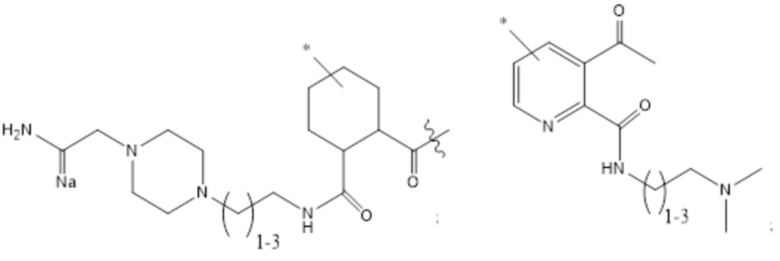


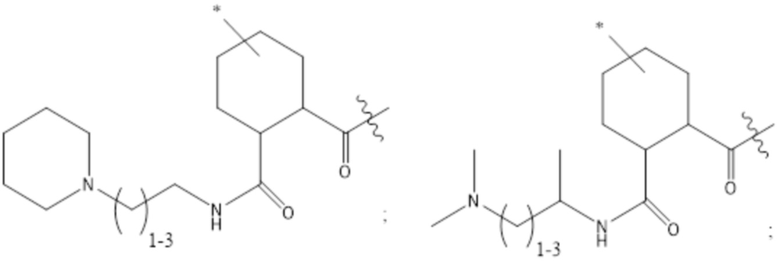
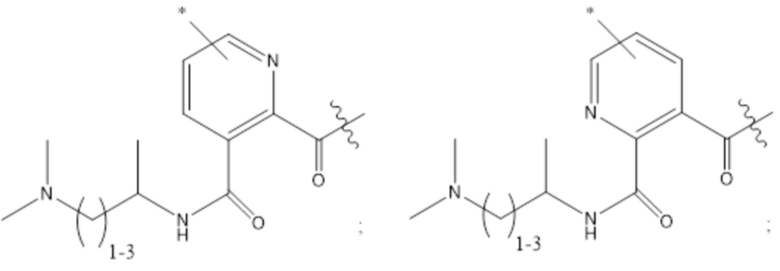
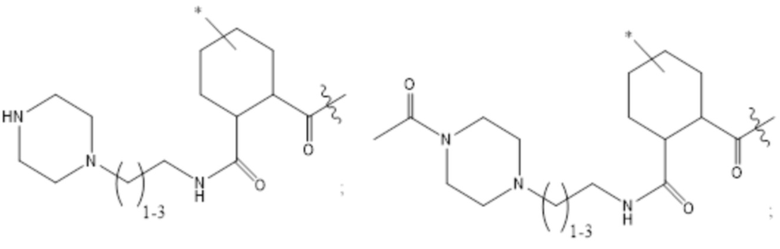


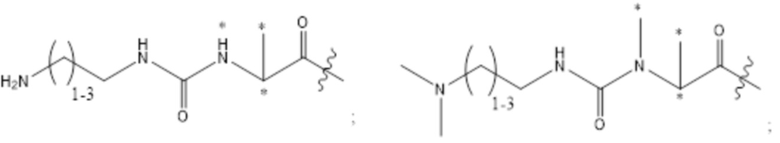
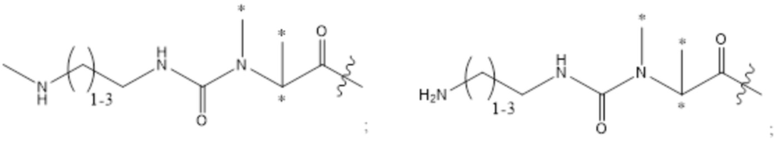


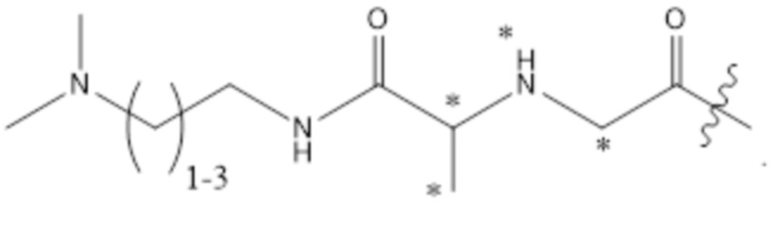
Получение и очистка конъюгатов лекарственное средство-спейсер-линкер
[328] Согласно любому из различных аспектов настоящего раскрытия конъюгат лекарственное средство-линкер с использованием обратимого линкера пролекарственного средства L2 можно получить следующим образом. Как указано выше, согласно многим вариантам осуществления обратимый линкер пролекарственного средства L2 для удобства синтеза можно получить вместе со спейсером L4 или частью спейсера L4. Фрагмент согласно формуле XIIb используют для иллюстративных целей, но специалистам в настоящей области техники понятно, что вариации в представленной ниже процедуре можно использовать для других вариантов осуществления линкера L2 и спейсера L4 согласно настоящему изобретению.
Соединение согласно формуле VIIIa
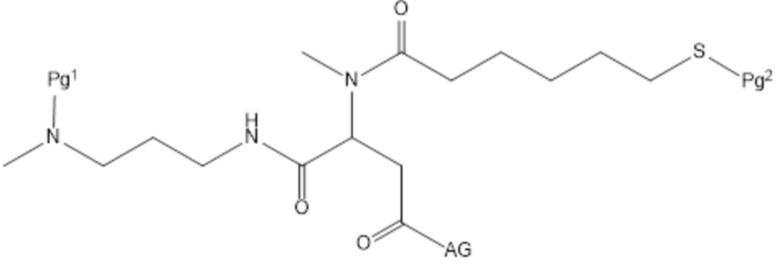 VIIIa
VIIIa
представляет фрагмент, содержащий обратимый линкер пролекарственного средства L2 с защитной группой амина Pg1, часть спейсера L4 с защитной группой тиола Pg2 на нем и активирующую группу AG. Защитная группа тиола представляет место прикрепления к конъюгатам поперечно-сшитой HA 10, 16 и 26 или частям соответствующего предшественника HA 5, 14 и 19, как показано на фигурах 2 - 9. Активирующая группа AG представляет собой группу, которая заменяется во время реакции группой лекарственного средства, такого как ранибизумаб или другое пептидное терапевтическое средство, содержащее свободную аминогруппу, с образованием амидной связи. Аминогруппа, защищенная группой Pg1, представляет собой каталитическую группу, которая участвует в расщеплении амидной связи, соединяющей лекарственное средство с линкером L2.
[329] Комбинированный линкер L2 и часть соединения - спейсера L4 согласно формуле VIIIa можно использовать для получения соединения согласно формуле VIIIb
 VIIIb
VIIIb
путем замещения группы активации AG с образованием амидной связи с лекарственным средством. Лекарственное средство может представлять собой, например, терапевтический белок, антитело или фрагмент антитела, как описано в настоящем документе, содержащим одну или несколько доступных свободных аминогрупп, которые доступны для взаимодействия с линкером с образованием конъюгата лекарственное средство-линкер через амидную связь.
[330] Защитные группы (PG) известны в настоящей области техники. Например, некоторые защитные группы в пределах объема настоящего раскрытия описаны в международной патентной публикации WO 2015/052155, содержание которой полностью включено в настоящий документ посредством ссылки. Специалистам в настоящей области техники понятно, что различные схемы прикрепления и снятия защитной группы, такие как те, которые описаны в "Greene's Protective Groups in Organic Synthesis," 5 изд., 2014, John Wiley& Sons, Inc., также включенной посредством ссылки, можно использовать согласно настоящему изобретению в качестве альтернатив конкретным примерам, показанным в настоящем документе.
[331] Согласно некоторым аспектам защитная группа амина Pg1 представляет собой саморасщепляющуюся защитную группу, которая может содержать один из фрагментов
 .
.
где R18 представляет собой необязательно замещенный и/или необязательно прерванный C1-10 алкил. Согласно некоторым аспектам R18 представляет собой C1-6 амин. Согласно другим аспектам R18 представляет собой C1-6 диамин.
[332] Один пример защитной группы амина Pg1 представляет собой следующее:

где волнистая линия указывает на место прикрепления к аминогруппе на линкере L2.
[333] Один пример защитной группы тиола представляет собой метансульфонил согласно формуле SO2CH3, так что образуется метантиосульфонат MTS.
[334] Активирующие группы также хорошо известны в настоящей области техники. Согласно определенным вариантам осуществления активирующая группа AG может представлять собой N-гидроксисукцинимид (NHS) в форме сложного эфира. Другие такие активированные сложноэфирные группы включают в себя 4-нитрофеноловые и пентафторфеноловые сложные эфиры.
[335] Согласно одному конкретному аспекту фрагмент согласно формуле VIIIa выше может представлять собой соединение сложный эфир N-гидроксисукцинимида (NHS) и метантиосульфоната согласно структуре VIIIc:
 VIIIc
VIIIc
Соединение VIIIc представляет соединение VIIIb более конкретно с метансульфонильной группой в качестве Pg2, сложным эфиром N-гидроксисукцинимида (NHS) в качестве AG и представленной выше защитной группой амина в качестве Pg1. Реакция соединения VIIIc с лекарственным средством затем обеспечивает получение соединения конъюгата спейсер-линкер-лекарственное средство согласно формуле VIIId
 VIIId.
VIIId.
Бисконъюгат и триконъюгат лекарственное средство-спейсер-линкер (не показано) также могут образовываться согласно некоторым вариантам осуществления вместе с моноконъюгатом VIIId, и моноконъюгат можно выделить из конъюгатов более высокого порядка путем разделения с помощью колонки, как описано в экспериментальных примерах ниже. Незащищенная тиоловая группа моноконъюгата VIIId реагирует с малеимидной группой на фрагменте HA, как описано выше, и незащищенная аминогруппа участвует в каталитическом расщеплении амидной связи, которая связывает лекарственное средство, для обеспечения контролируемого по времени высвобождения лекарственного средства.
[336] Лекарственное средство (например, ранибизумаб или другое терапевтическое средство), которое замещает группу NHS, может быть подходящим образом солюбилизировано в буфере при значении pH, составляющем от приблизительно 6 до приблизительно 9 или от приблизительно 7 до приблизительно 8, например, приблизительно 7,4, при концентрации, составляющей от приблизительно 20 мг/мл до приблизительно 100 мг/мл, от приблизительно 30 мг/мл до приблизительно 50 мг/мл или приблизительно 40 мг/мл. Согласно некоторым аспектам буфер содержит приблизительно 30 мM фосфата натрия. Линкер - сложный эфир N-гидроксисукцинимида может быть подходящим образом солюбилизирован в полярном апротонном растворителе, таком как DMSO.
[337] Растворы лекарственного средства и линкера - сложного эфира N-гидроксисукцинимида и объединяют при приблизительно 5°C при значении pH, составляющем от приблизительно 7 до приблизительно 8, таком как приблизительно 7,4, и приводят в реакцию в течение вплоть до приблизительно 10 минут, например, приблизительно 5 минут, с образованием раствора конъюгата линкер-лекарственное средство. Соотношение эквивалентов линкера сложного эфира N-гидроксисукцинимида к лекарственному средству составляет приблизительно 1:1, приблизительно 5:1, приблизительно 10:1, приблизительно 15:1 или приблизительно 20:1, например, приблизительно 5:1, приблизительно 10:1 или приблизительно 15:1. Конъюгат линкер-лекарственное средство, как правило, содержит смесь неконъюгированного лекарственного средства, моноконъюгатов лекарственного средства, бисконъюгатов лекарственного средства, триконъюгатов лекарственного средства и конъюгатов более высокого порядка. При необходимости используют большее время реакции и большие количества эквивалентов, а также повышенные температуры реакции.
[338] pH раствора конъюгата лекарственного средства можно довести, как необходимо для применения конкретных защитных групп. Для применения с соединением сложного эфира N-гидроксисукцинимида (NHS) и метантиосульфоната, показанным выше, pH можно довести до приблизительно 4. Согласно некоторым аспектам pH доводят с помощью буфера, характеризующегося значением pH, составляющим от приблизительно 2 до приблизительно 3,5. Согласно некоторым таким аспектам буфер представляет собой янтарную кислоту с pH 3 (например, приблизительно 3 M янтарная кислота). Согласно некоторым аспектам после доведения pH можно провести замену буфера раствора конъюгата линкер-лекарственное средство на буфер со значением рH, составляющим приблизительно 4. Согласно некоторым таким аспектам замену буфера можно провести на приблизительно 5 мM янтарную кислоту, pH 4,0.
[339] Фрагмент метки очистки можно использовать при получении и очистке моноконъюгатов лекарственное средство-линкер согласно настоящему изобретению. На стадии прикрепления метки метку очистки вводят путем замещения метансульфонильной группы так, что метка очистки соединена с конъюгатом посредством дисульфидной связи. Метки очистки, находящиеся в пределах объема настоящего раскрытия, описаны в международной патентной публикации № WO 2015/052155. Согласно некоторым аспектам метка очистки содержит фрагмент согласно формуле IX ниже:

IX
где:
SP представляет собой фрагмент спейсера;
Пунктирная линия указывает на прикрепление к оставшейся части метки или альтернативно на место прикрепления метки к конъюгату лекарственное средство-линкер (посредством, например, образования дисульфидной связи, где 4-меркапто-3-никотиновая кислота представляет собой спейсер);
каждый из R21, R21a, R21b, R22, R22a, R22b, R23, R23a, R23b, R24, R24a и R24b независимо представляет собой H или метил;
каждый s независимо друг от друга равен 1, 2, 3, 4, 5, 6, 7 или 8;
каждый t независимо друг от друга равен 1, 2, 3, 4, 5, 6, 7 или 8;
каждый u независимо друг от друга равен 1, 2, 3, 4, 5, 6, 7 или 8; и
каждый v независимо друг от друга равен 1, 2, 3, 4, 5, 6, 7 или 8.
[340] Согласно некоторым аспектам каждый из R21, R21a и R21b представляет собой метил. Согласно некоторым другим аспектам R21 представляет собой H, и R21a и R21b представляют собой метил. Согласно некоторым аспектам каждый из R22, R22a и R22b представляет собой метил. Согласно некоторым другим аспектам R22 представляет собой H, и R22a и R22b представляют собой метил. Согласно некоторым аспектам каждый из R23, R23a и R23b представляет собой метил. Согласно некоторым другим аспектам R23 представляет собой H, и R23a и R23b представляют собой метил. Согласно некоторым аспектам каждый из R24, R24a и R24b представляет собой метил. Согласно некоторым другим аспектам R24 представляет собой H, и R24a и R24b представляют собой метил.
[341] Согласно некоторым аспектам s равен 1, 2, 3, 4, 5 или 6; 2, 3, 4 или 5; 3, 4 или 5; или 4. Согласно некоторым аспектам t равен 1, 2, 3, 4, 5 или 6; 2, 3, 4 или 5; 2, 3 или 4; или 3. Согласно некоторым аспектам u равен 1, 2, 3, 4, 5 или 6; 1, 2, 3 или 4; 1, 2 или 3; или 1. Согласно некоторым аспектам v равен 1, 2, 3, 4, 5 или 6; 1, 2, 3 или 4; 1, 2 или 3; или 1.
[342] Согласно некоторым аспектам каждый из R21, R21a, R21b, R22, R22a, R22b, R23, R23a, R23b, R24, R24a и R24b представляет собой метил; s равен 4, t равен 3, u равен 1, и v равен 1. Согласно некоторым другим аспектам каждый из R21, R22, R23 и R24 представляет собой H; каждый из R21a, R21b, R22a, R22b, R23a, R23b, R24a и R24b представляет собой метил; s равен 4, t равен 3, u равен 1, и v равен 1.
[343] Противоионы для формулы IX в пределах объема настоящего раскрытия включают в себя Cl-, TFA-, HSO4- и SO42-.
[344] Следует понимать, что пунктирная линия в формуле IX указывает на прикрепление к остальной части метки, если соединение согласно формуле IX представляет собой реагент и представляет собой предпочтительно водород, и альтернативно указывает на прикрепление к конъюгату лекарственное средство-линкер после конъюгирования к указанным конъюгатом лекарственное средство-линкер.
[345] Согласно некоторым конкретным аспектам метка очистки характеризуется формулой X:
 X,
X,
где пунктирная линия указывает на прикрепление к фрагменту тиола согласно формуле X.
[346] Согласно некоторым конкретным аспектам реагент метки очистки характеризуется формулой Xa:
 Xa.
Xa.
[347] Согласно некоторым конкретным аспектам моноконъюгат метка очистки-спейсер-линкер-лекарственное средство со снятой защитной группой характеризуется формулой VIIIe:
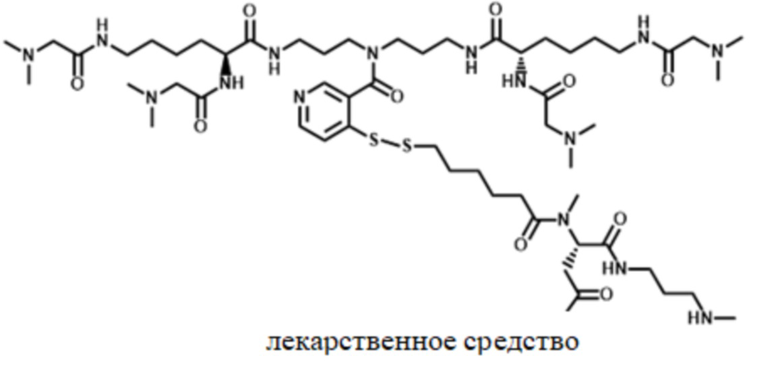 VIIIe
VIIIe
Моноконъюгат метка очистки-спейсер-линкер-лекарственное средство со снятой защитной группой VIIIe представляет конъюгат VIIId вместе с меткой очистки Xa вместо метансульфонильной защитной группы. Моноконъюгат метка очистки-спейсер-линкер-лекарственное средство со снятой защитной группой VIIIe может присутствовать вместе с конъюгатами более высокого порядка (не показано), как описано выше.
Следует понимать, что фрагмент VIIIe и другие соединения, упомянутые в следующих разделах, также содержат части L4. Для удобства и простоты наименования спейсерные части упускают из названий соединений, описанных ниже.
[348] Прикрепление метки и снятие защитной группы амина можно проводить следующим образом. Введение метки очистки проводят путем объединения раствора, содержащего стехиометрический избыток метки очистки, такой как приблизительно в 1,5, 2, 2,5 или 3 или даже больше эквивалентов метки очистки по отношению к конъюгату линкер-лекарственное средство, с раствором конъюгата линкер-лекарственное средство. Концентрация конъюгата линкер-лекарственное средство в его растворе надлежащим образом составляет приблизительно 5 мг/мл, приблизительно 10 мг/мл, приблизительно 15 мг/мл, приблизительно 20 мг/мл, приблизительно 25 мг/мл, приблизительно 30 мг/мл, приблизительно 35 мг/мл или приблизительно 40 мг/мл, например, от приблизительно 10 мг/мл до приблизительно 20 мг/мл или от приблизительно 10 мг/мл до приблизительно 40 мг/мл. Концентрация метки очистки в растворе, используемом для реакции с конъюгатом лекарственное средство-линкер надлежащим образом составляет от приблизительно 0,1 мM до приблизительно 1 мM, от приблизительно 0,2 мM до приблизительно 0,8 мM, от приблизительно 0,3 мM до приблизительно 0,7 мM, от приблизительно 0,4 мM до приблизительно 0,6 мM. Согласно определенным вариантам осуществления концентрация метки очистки составляет приблизительно 0,5 мM. Согласно некоторым аспектам раствор метки очистки представляет собой водный раствор. pH для реакции надлежащим образом составляет от приблизительно 3 до приблизительно 5, от приблизительно 3,5 до приблизительно 4,5 или приблизительно 4. Температура реакции надлежащим образом составляет от приблизительно 10°C до приблизительно 40°C, например, приблизительно 25°C. Время реакции надлежащим образом составляет по меньшей мере 5 минут, или по меньшей мере 10 минут, или по меньшей мере 30 минут, такая как приблизительно 15 минут или приблизительно 35 минут.
[349] Снятие защитной группы можно проводить путем инкубации при pH от приблизительно 7 до приблизительно 8, например, приблизительно 7,4. Согласно некоторым аспектам pH доводят до значения от приблизительно 7 до приблизительно 8 с помощью фосфатного буфера, содержащего N,N,N′-триметилэтилен-1,3-диамин (TriMED). Инкубацию надлежащим образом можно проводить при температуре, составляющей от приблизительно 10°C до приблизительно 40°C, такой как приблизительно 25°C, и в течение времени, составляющего по меньшей мере 8 часов, например, в течение приблизительно 16 часов.
[350] После снятия защитной группы рН раствора конъюгата метка очистки-линкер-лекарственное средство со снятой защитной группой доводят до значения от приблизительно 3,5 до приблизительно 4,5 или приблизительно 4,0 для последующей очистки. Согласно некоторым аспектам регулирование рН можно проводить с помощью буфера, характеризующегося значением pH, составляющим от приблизительно 2,5 до приблизительно 3,5, таким как буфер янтарной кислоты с pH 3,0. Раствор с доведенным рН можно необязательно разбавлять буфером перед последующей очисткой. Согласно некоторым аспектам разбавление можно проводить с помощью буфера янтарной кислоты с рН 4,0, например, с помощью 20 мМ буфера янтарной кислоты.
[351] После снятия защитной группы выделяют моноконъюгатный вид конъюгата метка очистки-линкер-лекарственное средство со снятой защитной группой. Согласно некоторым аспектам моноконъюгат можно выделить с помощью катионообменной хроматографии (CIEC). Согласно некоторым другим аспектам моноконъюгат можно выделить способом эксклюзионной хроматографии. Согласно некоторым другим аспектам моноконъюгат можно выделить с помощью аффинной хроматографии. В аспектах CIEC подходящие смолы известны в настоящей области техники и являются коммерчески доступными, например, от Bio-Rad Laboratories и GE Healthcare, и включают в себя, например, без ограничения AG® 50W, AG® MP-50, Bio-Rex 70, Chelex® 100, AG® 50W, серии Macro-Prep®, серии UNOsphere™, Source 15S, Source 30S и Nuvia™ S. Тот же самый буфер, используемый для разбавления на второй стадии, можно использовать для буферов CIEC. Например, буфер А может представлять собой 20 мМ янтарную кислоту (рН 4,0), а буфер В (для элюирования) может представлять собой 20 мМ янтарную кислоту, 1 М NaCl (рН 4,0). Неконъюгированное лекарственное средство элюируется первым при разделении CIEC, затем следует моноконъюгат лекарственного средства, а затем следуют конъюгаты более высокого порядка (бис- и триконъюгаты) и т.д.
[352] После выделения моноконъюгата метка очистки-линкер-лекарственное средство со снятой защитной группой моноконъюгат можно концентрировать с помощью способов, известных в настоящей области техники, таких как фильтрование тангенциальным потоком (TFF) или центрифугирование через мембрану. Концентрированный моноконъюгат можно необязательно фильтровать. После концентрирования конечная концентрация может надлежащим образом составлять от приблизительно 0,2 мг/мл до приблизительно 20 мг/мл, от приблизительно 0,2 мг/мл до приблизительно 10 мг/мл или приблизительно 5 мг/мл.
[353] Далее метку очистки отщепляют от выделенного и потенциально концентрированного моноконъюгата метка очистки-линкер-лекарственное средство со снятой защитной группой путем расщепления дисульфидной связи в присутствии восстанавливающего средства с образованием смеси, содержащей отщепленную метку очистки и моноконъюгат линкер-лекарственное средство.
[354] Восстанавливающее средство, как правило, представляет собой малую молекулу и его можно выбрать, например, из β-меркаптоэтанола, глутатиона, дитиотреитола (DTT) и TCEP. Согласно некоторым аспектам восстанавливающее средство представляет собой DTT. Отщепление метки очистки надлежащим образом можно провести при значении pH, составляющем от приблизительно 3,5 до приблизительно 5,5, например, приблизительно 4 или приблизительно 4,5. Согласно некоторым аспектам DTT добавляют к раствору моноконъюгата метка очистки-линкер-лекарственное средство до концентрации, составляющей от приблизительно 0,1 мM до приблизительно 20 мM, такой как приблизительно 1 мM при температуре, составляющей меньше чем приблизительно 15°C, такой как от приблизительно 2°C до приблизительно 8°C. Инкубацию надлежащим образом можно проводить в течение по меньшей мере 2 часов, по меньшей мере 4 часов, по меньшей мере 8 часов.
[355] Согласно некоторым аспектам моноконъюгат линкер-лекарственное средство после снятия защитной группы и удаления метки очистки характеризуется формулой VIIIf:
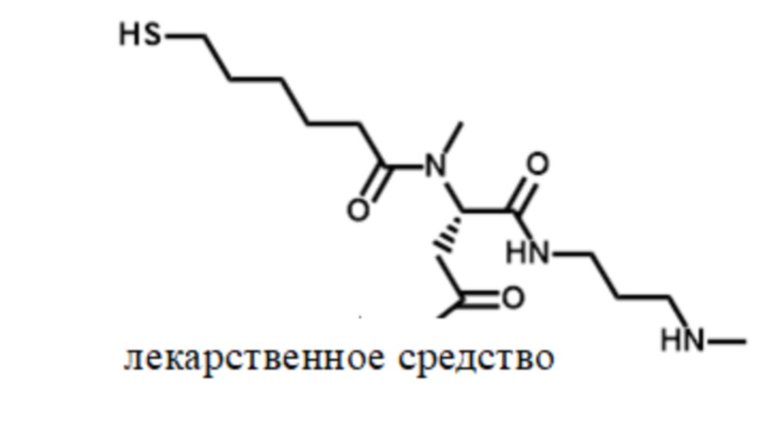 VIIIf
VIIIf
[356] Моноконъюгат линкер-лекарственное средство можно выделить из смеси, содержащей отщепленную метку очистки, с помощью хроматографии, как описано в другом месте настоящего документа. В аспектах CIEC подходящие смолы описаны в другом месте в настоящем документе. Как правило, CIEC для выделения моноконъюгата линкер-лекарственное средство выполняют с помощью буферной системы, характеризующейся значением рН, составляющим от приблизительно 4 до приблизительно 7, например, приблизительно 5,5. Например, буфер А может представлять собой 10 мМ гистидин (рН 5,5), а буфер В (для элюирования) может представлять собой 10 мМ гистидин, 500 мМ NaCl (рН 5,5). Моноконъюгат линкер-лекарственное средство элюируется первым при разделении CIEC, затем следует потенциальный дисульфид-связанный димер и отщепленная метка очистки.
[357] Дополнительный буфер B можно необязательно добавить для доведения осмолярности раствора белка. Выделенный моноконъюгат линкер-лекарственное средство можно необязательно концентрировать до концентрации, превышающей 50 мг/мл или превышающей 60 мг/мл для последующего применения в получении пролекарственных композиций, содержащих поперечно-сшитую HA согласно настоящему раскрытию. Концентрирование можно проводить с помощью TFF или путем центрифугирования через мембрану.
Конъюгирование моноконъюгата лекарственное средство-линкер с малеимидо-функционализированной HA
[358] Обращаясь снова к фигурам 2 и 3 и фигуре 6 - фигуре 9, моноконъюгат линкер-лекарственное средство VIIIf можно использовать в качестве реагента 5 - конъюгата линкер-лекарственное средство. Малеимидо-группы находятся в эквивалентном избытке по отношению к реагенту 5, так что некоторая доля малеимидо-групп является не конъюгированной с моноконъюгатом лекарственное средство-линкер и, следовательно, остается доступной для поперечного сшивания с тиол-функционализированной HA, как описано в другом месте настоящего документа. Согласно некоторым аспектам эквивалентной соотношение малеимидо-функционализированной HA к моноконъюгату лекарственное средство-линкер составляет от 1,1:1 до приблизительно 2:1, например, приблизительно 1,2:1, приблизительно 1,3:1, приблизительно 1,4:1, приблизительно 1,5:1, приблизительно 1,6:1, приблизительно 1,7:1 или приблизительно 1,8:1. Согласно некоторым аспектам реакционная смесь содержит концентрацию моноконъюгата лекарственное средство-линкер, составляющую от приблизительно 25 мг/мл до приблизительно 100 мг/мл (в перерасчете на количество белка), от приблизительно 35 мг/мл до приблизительно 55 мг/мл или приблизительно 55 мг/мл. Конъюгирование выполняют в буферной системе со значением pH, составляющим от приблизительно 4,5 до приблизительно 6,5 или от приблизительно 5 до приблизительно 6, например, приблизительно 5,5. Согласно некоторым аспектам буфер представляет собой 10 мM гистидина, 150 мM NaCl и 0,01% Tween 20. Температура реакции составляет приблизительно °0°C, приблизительно 5°C, 10°C, приблизительно 15°C, приблизительно 20°C, приблизительно 25°C, приблизительно 30°C, приблизительно 35°C, или приблизительно 40°C, и реакционную смесь инкубируют в течение периода времени, подходящего для достижения по существу полного конъюгирования, например, в течение от приблизительно 1 часа до приблизительно 12 часов или дольше, например, в течение приблизительно 2 часов, приблизительно 4 часов или приблизительно 6 часов.
[359] Согласно некоторым аспектам конъюгат лекарственное средство-линкер- функционализированная малеимидом HA характеризуется структурой XII:
 XII.
XII.
Степень функционализации соединения HA XII может варьироваться, как описано выше, и относительная степень функционализации в структуре XII является исключительно иллюстративной. Согласно некоторым вариантам осуществления от приблизительно 0,5% до приблизительно 6%, от приблизительно 1% до приблизительно 5%, от приблизительно 1,5% до приблизительно 4%, от приблизительно 2% до 3% или от приблизительно 2% до приблизительно 2,5% сайтов карбоксилатных групп на цепи HA соединения XII заняты непрореагировавшим малеимидом (и, таким образом, доступны для последующей реакции поперечного сшивания), тогда как от приблизительно 3% до приблизительно 10%, от приблизительно 5% до приблизительно 9%, от приблизительно 6% до приблизительно 8% или от приблизительно 7% до приблизительно 8% сайтов карбоксилатных групп заняты конъюгатом линкер-лекарственное средство. Согласно определенным вариантам осуществления приблизительно 4% сайтов карбоксилатных групп на цепи НА соединения XII заняты непрореагировавшим малеимидом, и приблизительно 6% сайтов карбоксилатных групп заняты конъюгатом линкер-лекарственное средство. Согласно определенным вариантам осуществления приблизительно 2,3% сайтов карбоксилатных групп на цепи НА соединения XII заняты непрореагировавшим малеимидом, и приблизительно 7,7% сайтов карбоксилатных групп заняты конъюгатом линкер-лекарственное средство. Конъюгат лекарственное средство-линкер связывается с цепью HA посредством реакции тиоловой группы конъюгата лекарственное средство-линкер, реагирующей с малеимидными группами на цепи НА, как описано в настоящем документе. Процент сайтов, занятых непрореагировавшим малеимидом и конъюгатом линкер-лекарственное средство, можно изменять для контроля степени поперечного сшивания и загрузки лекарственного средства в конечном конъюгате гидрогеля.
Получение пролекарственных композиций, содержащих поперечно-сшитую HA
[360] Согласно некоторым аспектам пролекарственные композиции согласно настоящему раскрытию можно получить путем образования реакционной смеси, содержащей раствор конъюгата лекарственное средство-линкер-малеимидо-функционализированная HA, как описано в другом месте настоящего документа, и раствор тиол-функционализированной HA, как описано в другом месте настоящего документа, и инкубации реакционной смеси при pH и в течение периода времени и при температуре, достаточных для достижения поперечного сшивания HA. Реакция, как правило, протекает в соответствии со стадией 7 согласно схеме реакции, изображенной на фиг. 9, где LA, LB, LC, L2 и лекарственное средство являются такими, как описано в другом месте настоящего документа. Согласно некоторым аспектам pH составляет от приблизительно от приблизительно 4,5 до приблизительно 6,5 или от приблизительно 5 до приблизительно 6, например, приблизительно 5,5. Температура реакции составляет приблизительно 0°C, приблизительно 5°C, приблизительно 10°C, приблизительно 15°C, приблизительно 20°C, приблизительно 25°C, приблизительно 30°C, приблизительно 35°C или приблизительно 40°C.
[361] Согласно некоторым аспектам реакционную смесь тщательно перемешивают и вскоре после этого заполняют ею шприцы. Предварительно заполненные шприцы можно затем инкубировать при температуре окружающей среды в течение от приблизительно 8 часов до приблизительно 4 недель для завершения поперечного сшивания и образования пролекарственных композиций поперечно-сшитой НА согласно настоящему раскрытию. Предварительно заполненные шприцы также можно хранить непосредственно при 2-8°C без дальнейшего хранения при температуре окружающей среды. Согласно одному варианту осуществления каждый из отдельных растворов конъюгата лекарственное средство-линкер-малеимидо-функционализированная HA и тиол-функционализированной HA непосредственно вводят в предварительно заполненное шприцевое устройство и смешивают в нем, и поперечное сшивание происходит в предварительном заполненном шприцевом устройстве и его содержимое подвергают реакции поперечного сшивания в нем с образованием пролекарственной композиции поперечно-сшитой НА in situ внутри предварительного заполненного шприцевого устройства. По прошествии подходящего для реакции поперечного сшивания времени (которое может варьироваться в зависимости от температуры и других условий) пролекарственная композиция на основе поперечно-сшитой НА готова для инъекции пациенту без дополнительного смешивания или переноса.
[362] Согласно другим вариантам осуществления можно провести периодическую полимеризацию для проведения реакции поперечного сшивания. Затем полученный гель измельчают, пропуская его через сетку, чтобы сделать его подходящим для введения с помощью шприца, и затем переносят в шприцевое устройство.
[363] Согласно некоторым аспектам пролекарственные композиции согласно настоящему раскрытию характеризуются формулой 10:
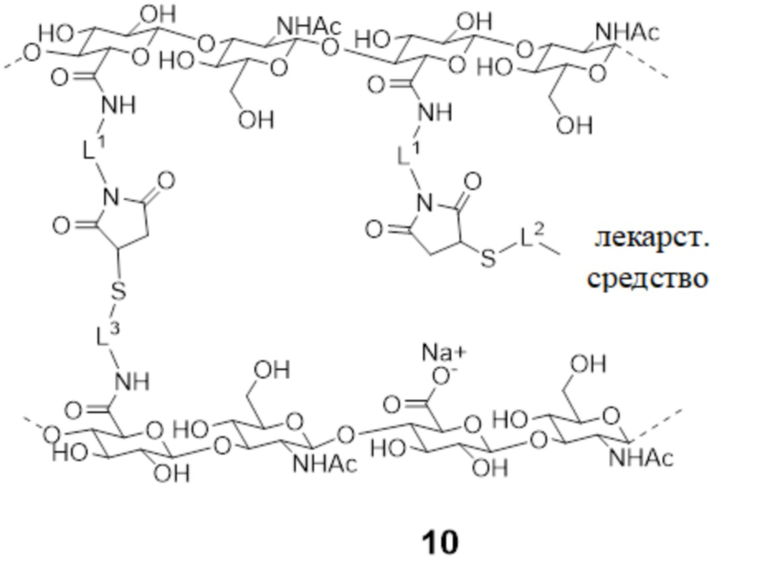
где L1, L2, L3, степень функционализации и лекарственное средство являются такими, как определено в другом месте в настоящем документе. Согласно некоторым другим аспектам HA может являться замещенной с помощью Ra1 и/или Ra2, как описано в другом месте настоящего документа.
[364] Согласно некоторым другим аспектам пролекарственные композиции согласно настоящему раскрытию характеризуются формулой 16:
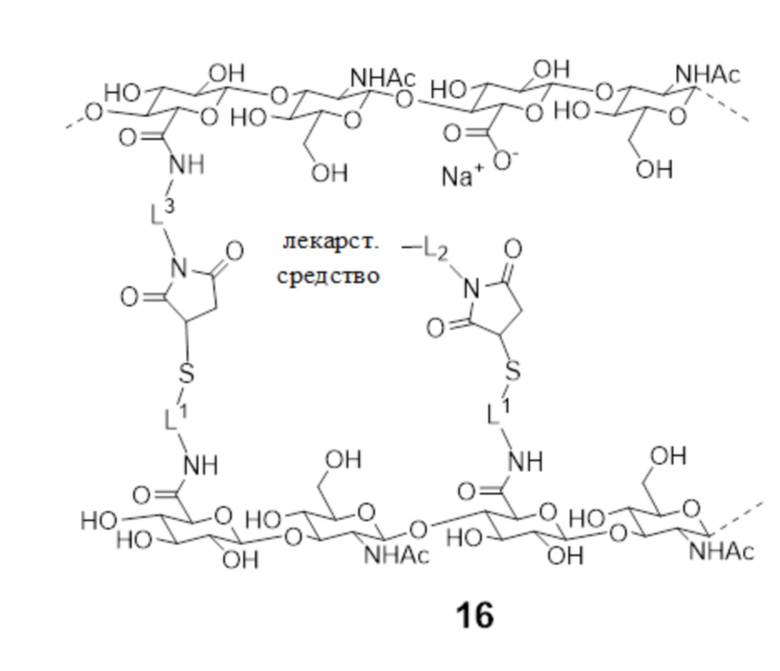
[365] где L1, L2, L3, степень функционализации и лекарственное средство являются такими, как определено в другом месте в настоящем документе. Согласно некоторым другим аспектам HA может являться замещенной с помощью Ra1 и/или Ra2, как описано в другом месте настоящего документа.
[366] Согласно некоторым другим аспектам пролекарственные композиции согласно настоящему раскрытию характеризуются формулой 26:

[367] где LA, LB, LC L2, степень функционализации и лекарственное средство являются такими, как определено в другом месте в настоящем документе. Согласно некоторым другим аспектам HA может являться замещенной с помощью Ra1 и/или Ra2, как описано в другом месте настоящего документа.
Общие способы получения пролекарственных композиций, содержащих поперечно-сшитую HA
[368] Общие способы получения пролекарственных композиций, содержащих поперечно-сшитую HA, изображены на фигурах 10 и 11.
[369] Один способ получения пролекарственных композиций, содержащих поперечно-сшитую HA, изображен на фиг. 10. На стадии 1 амин-HA 1 получают в соответствии со способами получения функционализированной амином HA, как описано в другом месте настоящего документа. На стадии 2 малеимид-HA, характеризующуюся наличием постоянного спейсера, получают из амин-HA 1 в соответствии со способами получения малеимидо-функционализированной HA, как описано в другом месте настоящего документа. На стадии 3 амин-HA 2 получают в соответствии со способами получения функционализированной амином HA, как описано в другом месте настоящего документа. На стадии 4 тиол-HA 2, содержащую разлагаемо-связанную тиоловую группу, получают в соответствии со способом получения функционализированной тиолом HA, как описано в другом месте настоящего документа. На стадии 5 моноконъюгат лекарственное средство-линкер-тиол получают в соответствии со способами, описанными в другом месте в настоящем документе. На стадии 6 моноконъюгат лекарственное средство-линкер-тиол конъюгируют с малеимид-НА, характеризующейся наличием спейсера, как описано в другом месте настоящего документа. На стадии 7 пролекарственные композиции, содержащие поперечно-сшитую НА, получают из конъюгата лекарственное средство-линкер-малеимид-HA и разлагаемой тиол-НА, как описано в другом месте настоящего документа. Стадия 7 может предусматривать стерилизующую фильтрацию конъюгата лекарственное средство-малеимид-HA согласно стадии 6 и разлагаемой тиол-НА согласно стадии 4 непосредственно в предварительно заполненном шприцевом устройстве, в котором проводят поперечное сшивание.
[370] Другой способ получения пролекарственных композиций, содержащих поперечно-сшитую HA, изображен на фиг. 11. На стадии 1 амин-HA 1 получают в соответствии со способами получения амин-функционализированной HA, как описано в другом месте настоящего документа. На стадии 2 малеимид-HA, характеризующуюся наличием спейсера, получают из амин-HA 1 в соответствии со способами получения малеимидо-функционализированной HA, как описано в другом месте настоящего документа. На стадии 3 амин-HA 2 получают в соответствии со способами получения амин-функционализированной HA, как описано в другом месте настоящего документа. На стадии 4 тиол-HA 2, содержащую разлагаемо-связанную тиоловую группу, получают в соответствии со способом получения тиол-функционализированной HA, как описано в другом месте настоящего документа. На стадии 5 моноконъюгат лекарственное средство-линкер-тиол получают в соответствии со способами, описанными в другом месте в настоящем документе. На стадии 6 моноконъюгат лекарственное средство-линкер-тиол, малеимид-HA, характеризующуюся наличием постоянного линкера, и тиол-HA, характеризующуюся наличием разлагаемого линкера, объединяют и конъюгируют с образованием пролекарственных композиций, содержащих поперечно-сшитую HA. Каждый из следующего: малеимид-HA, моноконъюгат лекарственное средство-линкер-тиол и тиол-HA, можно стерильно фильтровать и переносить в предварительно заполненное шприцевое устройство, где их подвергают реакции с образованием конечного пролекарственного средства с поперечно-сшитой HA. Условия реакции для фиг. 11, стадии 6, как правило, соответствуют условиям реакции для условий получения пролекарственных композиций, содержащих поперечно-сшитую HA, из конъюгата лекарственное средство-линкер-малеимид-HA и разлагаемой тиол-HA, как описано в другом месте настоящего документа.
Фармацевтические композиции
[371] Фармацевтическая композиция согласно настоящему изобретению содержит один или несколько фармацевтически приемлемых вспомогательных веществ, включая в себя буферные средства, модификаторы изотоничности, консерванты/противомикробные средства, стабилизаторы, антиадсорбционные средства, антиоксиданты, загустители/повышающие вязкость средства и/или другие вспомогательные средства.
[372] Буферные средства можно использовать для поддержания рН композиции в требуемом диапазоне. Неограничивающие примеры буферных средств включают в себя фосфат натрия, бикарбонат, сукцинат, гистидин, цитрат и ацетат, сульфат, нитрат, хлорид и пируват.
[373] Модификаторы изотоничности можно использовать для минимизации боли, которая может быть вызвана повреждением клеток из-за разницы осмотического давления на месте инъекции. Неограничивающие примеры модифицирующих изотоничность средств включают в себя глицерин и хлорид натрия.
[374] Консерванты/противомикробные средства можно использовать для минимизации риска заражения. Неограничивающие примеры консервантов включают в себя м-крезол, фенол, метилпарабен, этилпарабен, пропилпарабен, бутилпарабен, хлорбутанол, бензиловый спирт, фенилмеркуриевый нитрат, тиомерсал, сорбиновую кислоту, сорбат калия, бензойную кислоту, хлоркрезол и хлорид бензалкония.
[375] Стабилизаторы можно использовать для ингибирования разложения гидрогеля и лекарственного средства. Неограничивающие примеры стабилизаторов включают в себя следующее: аминокислоты, такие как аланин, аргинин, аспарагиновая кислота, глицин, гистидин, лизин, пролин; сахара, такие как глюкоза, сахароза, трегалоза; многоатомные спирты, такие как глицерин, маннит, сорбит; соли, такие как фосфат калия, сульфат натрия; хелатирующие средства, такие как EDTA, гексафосфат; лиганды, такие как ионы двухвалентных металлов (цинк, кальций и т.д.); олигомеры или полимеры, такие как циклодекстрины, декстран, дендримеры, PEG или PVP или протамин или HAS; и/или другие соли или органические молекулы, такие как фенольные производные.
[376] Антиадсорбционные средства можно использовать для конкурентного покрытия или адсорбции, например, на поверхности контейнера, такого как шприц, в котором содержится фармацевтическая композиция. Антиабсорбентами могут являться ионные или неионные поверхностно-активные вещества, белки или растворимые полимеры. Неограничивающие примеры поверхностно-активных веществ включают в себя следующее: алкилсульфаты, такие как лаурилсульфат аммония и лаурилсульфат натрия; алкилэфирсульфаты, такие как лауретсульфат натрия и миретсульфат натрия; сульфонаты, такие как диоктилсульфосукцинаты натрия, перфтороктансульфонаты, перфторбутансульфонаты, алкилбензолсульфонаты; фосфаты, такие как алкиларилэфирфосфаты и алкилэфирфосфаты; карбоксилаты, такие как соли жирных кислот (мыла) или стеарат натрия, лауроилсаркозинат натрия, перфторнонаноат, перфтороктаноат; октенидиндигидрохлорид; катионы четвертичного аммония, такие как цетилтриметиламмонийбромид, цетилтриметиламмонийхлорид, цетилпиридинийхлорид, полиэтоксилированный талловый амин, бензалконийхлорид, бензетонийхлорид, 5-бром-5-нитро-1,3-диоксан, диметилдиоктадециламмонийхлорид, диоктадецилдиметиламмонийбромид; цвиттер-ионы, такие как 3-[(3-холамидопропил)диметиламмонио]-1-пропансульфонат, кокамидопропилгидроксисультаин, аминокислоты, иминокислоты, кокамидопропилбетаин, лецитин; жирные спирты, такие как цетиловый спирт, стеариловый спирт, цетостеариловый спирт, олеиловый спирт; алкилэфиры полиоксиэтиленгликоля, такие как монододециловый эфир октаэтиленгликоля, монододециловый эфир пентаэтиленгликоля; алкилэфиры полиоксипропиленгликоля; алкилэфиры глюкозида, такие как децилглюкозид, лаурилглюкозид, октилглюкозид; простые эфиры полиоксиэтиленгликоля и октилфенола, такие как Тритон Х-100; простые эфиры полиоксиэтиленгликоля и алкилфенолов, такие как ноноксинол-9; алкилэфиры глицерина, такие как глицериллаурат; алкиловые сложные эфиры полиоксиэтиленгликоля сорбитана, такие как полисорбаты; алкиловые эфиры сорбитана; кокамид MEA и кокамид DEA; оксид додецилдиметиламина; блок-сополимеры полиэтиленгликоля и полипропиленгликоля, такие как полоксамеры (Pluronic F-68), ПЭГ-додециловый эфир (Brij 35), полисорбаты 20 и 80; другими антиадсорбционными средствами являются декстран, полиэтиленгликоль, ПЭГ-полигистидин, BSA и HSA и желатины.
[377] Неограничивающие примеры антиоксидантов включают в себя аскорбиновую кислоту, эктоин, метионин, глутатион, монотиоглицерин, морин, полиэтиленимин (PEI), пропилгаллат, витамин E, хелатирующие средства, такие как лимонная кислота, EDTA, гексафосфат и тиогликолевая кислота.
[378] Фармацевтические пролекарственные композиции на основе гидрогеля поперечно-сшитой HA могут быть предоставлены в контейнере, содержащем многократные дозы фармацевтической композиции. Такую многодозовую фармацевтическую композицию можно использовать для разных пациентов, нуждающихся в этом, или для одного пациента, причем оставшиеся дозы хранят после применения первой дозы до тех пор, пока это не потребуется. Согласно некоторым таким аспектам контейнер представляет собой предварительно заполненный шприц.
[379] Фармацевтические пролекарственные композиции на основе гидрогеля поперечно-сшитой HA могут быть предоставлены в виде фармацевтической композиции для однократного или многократного введения в предварительно заполненном шприце.
[380] Фармацевтические пролекарственные композиции на основе гидрогеля поперечно-сшитой HA согласно настоящему раскрытию можно надлежащим образом хранить в шприцах при температуре, составляющей меньше чем приблизительно 10°C.
[381] Терапевтические количества фармацевтических пролекарственных композиций на основе гидрогеля поперечно-сшитой HA можно вводить с помощью внутриглазной инъекции. Например, композицию можно вводить с помощью инъекции в стекловидное тело нуждающегося в этом субъекта с использованием иглы с калибром, составляющим 22, 23, 24, 25, 26, 27, 28, 29, 30, 31 или 32.
[382] Согласно некоторым аспектам фармацевтические пролекарственные композиции на основе гидрогеля поперечно-сшитой HA могут быть предоставлены в наборе. Согласно таким аспектам набор может содержать шприц, предварительно заполненный фармацевтической пролекарственной композицией на основе гидрогеля поперечно-сшитой НА, иглу для подкожных инъекций и инструкции по применению.
[383] Настоящее изобретение относится к конъюгатам антител, которые включают в себя антитела (например, антитела к VEGF), ковалентно связанные с композициями на основе гидрогеля поперечно-сшитой HA, как описано в настоящем документе.
Иллюстративные антитела для применения в композициях конъюгата гидрогеля поперечно-сшитой HA согласно настоящему изобретению
[384] Можно использовать любое подходящее антитело (например, антитело к VEGF). Например, антитело может специфически связываться с антигеном, выбранным из группы, состоящей из следующего: VEGF; интерлейкин-1 бета (IL-1β); интерлейкин-6 (IL-6); рецептор интерлейкина-6 (IL-6R); интерлейкин-13 (IL-13); рецептор IL-13 (IL-13R); PDGF (например, PDGF-BB); ангиопоэтин; ангиопоэтин 2 (Ang2); Tie-2; S1P; интегрины αvβ3, αvβ5 и α5β1; бетацеллюлин; апелин/APJ; эритропоэтин; фактор комплемента D; TNFα; HtrA1; рецептор VEGF (например, VEGFR1, VEGFR2, VEGFR3, мембраносвязанный рецептор VEGF (mbVEGFR) или растворимый рецептор VEGF (sVEGFR)); рецептор ST-2; и белок, генетически связанный с риском возрастной макулярной дегенерации (AMD) (например, компоненты пути комплемента C2, фактор B, фактор H, CFHR3, C3b, C5, C5a и C3a; HtrA1; ARMS2; TIMP3; HLA; интерлейкин-8 (IL-8); CX3CR1; TLR3; TLR4; CETP; LIPC; COL10A1 и TNFRSF10A). Такие антитела могут являться применимыми, например, для уменьшения ангиогенеза и/или для лечения или задержки прогрессирования нарушения, ассоциированного с патологическим ангиогенезом (например, офтальмологических нарушений или нарушений пролиферации клеток). Иллюстративные неограничивающие антитела к VEGF, которые можно использовать в конъюгатах антител согласно настоящему изобретению, описаны ниже.
[385] В некоторых случаях антитело к VEGF может включать в себя по меньшей мере одну, две, три, четыре, пять или шесть HVR, выбранных из следующего: (a) HVR-H1, содержащая аминокислотную последовательность согласно DYWIH (SEQ ID NO: 1); (b) HVR-H2, содержащая аминокислотную последовательность согласно GX1TPX2GGX3X4X5YX6DSVX7X8 (SEQ ID NO: 2), где X1 представляет собой Ile или His, X2 представляет собой Ala или Arg, X3 представляет собой Tyr или Lys, X4 представляет собой Thr или Glu, X5 представляет собой Arg, Tyr, Gln или Glu, X6 представляет собой Ala или Glu, X7 представляет собой Lys или Glu, и X8 представляет собой Gly или Glu; (c) HVR-H3, содержащая аминокислотную последовательность согласно FVFFLPYAMDY (SEQ ID NO: 3); (d) HVR-L1, содержащая аминокислотную последовательность согласно RASQX1VSTAVA (SEQ ID NO: 4), где X1 представляет собой Asp или Arg; (e) HVR-L2, содержащая аминокислотную последовательность согласно X1ASFLYS (SEQ ID NO: 5), где X1 представляет собой Ser или Met; и (f) HVR-L3, содержащая аминокислотную последовательность согласно X1QGYGX2PFT (SEQ ID NO: 6), где X1 представляет собой Gln, Asn или Thr и X2 представляет собой Ala, Asn, Gln или Arg, или комбинацию одной или нескольких представленных выше HVR и одного или нескольких их вариантов, характеризующихся по меньшей мере приблизительно 80% идентичности последовательности (например, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности) по отношению к любой из SEQ ID NO: 1-6.
[386] Например, антитело к VEGF может включать в себя по меньшей мере одну, две, три, четыре, пять или шесть HVR, выбранных из следующего: (a) HVR-H1, содержащая аминокислотную последовательность согласно DYWIH (SEQ ID NO: 1); (b) HVR-H2, содержащая аминокислотную последовательность согласно GITPAGGYTRYADSVKG (SEQ ID NO: 7), GITPAGGYEYYADSVKG (SEQ ID NO: 21) или GITPAGGYEYYADSVEG (SEQ ID NO: 22); (c) HVR-H3, содержащая аминокислотную последовательность согласно FVFFLPYAMDY (SEQ ID NO: 3); (d) HVR-L1, содержащая аминокислотную последовательность согласно RASQDVSTAVA (SEQ ID NO: 8); (e) HVR-L2, содержащая аминокислотную последовательность согласно SASFLYS (SEQ ID NO: 9); и (f) HVR-L3, содержащая аминокислотную последовательность согласно QQGYGAPFT (SEQ ID NO: 10) или QQGYGNPFT (SEQ ID NO: 23), или комбинацию одной или нескольких представленных выше HVR и одного или нескольких их вариантов, характеризующихся по меньшей мере приблизительно 80% идентичности последовательности (например, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности) по отношению к любой из SEQ ID NO: 1, 3, 7-10 или 21-23.
[387] Например, в некоторых случаях антитело к VEGF может включать в себя по меньшей мере одну, две, три, четыре, пять или шесть HVR, выбранных из следующего: (a) HVR-H1, содержащая аминокислотную последовательность согласно DYWIH (SEQ ID NO: 1); (b) HVR-H2, содержащая аминокислотную последовательность согласно GITPAGGYTRYADSVKG (SEQ ID NO: 7); (c) HVR-H3, содержащая аминокислотную последовательность согласно FVFFLPYAMDY (SEQ ID NO: 3); (d) HVR-L1, содержащая аминокислотную последовательность согласно RASQDVSTAVA (SEQ ID NO: 8); (e) HVR-L2, содержащая аминокислотную последовательность согласно SASFLYS (SEQ ID NO: 9); и (f) HVR-L3, содержащая аминокислотную последовательность согласно QQGYGAPFT (SEQ ID NO: 10), или комбинацию одной или нескольких представленных выше HVR и одного или нескольких их вариантов, характеризующихся по меньшей мере приблизительно 80% идентичности последовательности (например, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности) по отношению к любой из SEQ ID NO: 1, 3 или 7-10. Согласно конкретному примеру в некоторых случаях антитело к VEGF включает в себя следующие шесть HVR: (a) HVR-H1, содержащая аминокислотную последовательность согласно DYWIH (SEQ ID NO: 1); (b) HVR-H2, содержащая аминокислотную последовательность согласно GITPAGGYTRYADSVKG (SEQ ID NO: 7); (c) HVR-H3, содержащая аминокислотную последовательность согласно FVFFLPYAMDY (SEQ ID NO: 3); (d) HVR-L1, содержащая аминокислотную последовательность согласно RASQDVSTAVA (SEQ ID NO: 8); (e) HVR-L2, содержащая аминокислотную последовательность согласно SASFLYS (SEQ ID NO: 9); и (f) HVR-L3, содержащая аминокислотную последовательность согласно QQGYGAPFT (SEQ ID NO: 10).
[388] В некоторых случаях любое из предыдущих антител к VEGF может включать в себя одну, две, три или четыре из следующих каркасных областей вариабельного домена тяжелой цепи (FR): (a) FR-H1, содержащая аминокислотную последовательность согласно EVQLVESGGGLVQPGGSLRLSCAASGFTIS (SEQ ID NO: 13); (b) FR-H2, содержащая аминокислотную последовательность согласно WVRQAPGKGLEWVA (SEQ ID NO: 14); (c) FR-H3, содержащая аминокислотную последовательность согласно RFTISADTSKNTAYLQMRSLRAEDTAVYYCAR (SEQ ID NO: 15); и (d) FR-H4, содержащая аминокислотную последовательность согласно WGQGTLVTVSS (SEQ ID NO: 16).
[389] В некоторых случаях любое из предыдущих антител к VEGF может включать в себя одну, две, три или четыре из следующих FR вариабельного домена легкой цепи: (a) FR-L1, содержащая аминокислотную последовательность согласно DIQMTQSPSSLSASVGDRVTITC (SEQ ID NO: 17); (b) FR-L2, содержащая аминокислотную последовательность согласно WYQQKPGKAPKLLIY (SEQ ID NO: 18); (c) FR-L3, содержащая аминокислотную последовательность согласно GVPSRFSGSGSGTDFTLTISSLQPEDAATYYC (SEQ ID NO: 19); и (d) FR-L4, содержащая аминокислотную последовательность согласно FGQGTKVEIK (SEQ ID NO: 20).
[390] Например, в некоторых случаях антитело к VEGF включает в себя следующие шесть HVR: (a) HVR-H1, содержащая аминокислотную последовательность согласно DYWIH (SEQ ID NO: 1); (b) HVR-H2, содержащая аминокислотную последовательность согласно GITPAGGYTRYADSVKG (SEQ ID NO: 7); (c) HVR-H3, содержащая аминокислотную последовательность согласно FVFFLPYAMDY (SEQ ID NO: 3); (d) HVR-L1, содержащая аминокислотную последовательность согласно RASQDVSTAVA (SEQ ID NO: 8); (e) HVR-L2, содержащая аминокислотную последовательность согласно SASFLYS (SEQ ID NO: 9); и (f) HVR-L3, содержащая аминокислотную последовательность согласно QQGYGAPFT (SEQ ID NO: 10). В некоторых случаях антитело к VEGF включает в себя следующие четыре FR вариабельного домена тяжелой цепи: (a) FR-H1, содержащая аминокислотную последовательность согласно EVQLVESGGGLVQPGGSLRLSCAASGFTIS (SEQ ID NO: 13); (b) FR-H2, содержащая аминокислотную последовательность согласно WVRQAPGKGLEWVA (SEQ ID NO: 14); (c) FR-H3, содержащая аминокислотную последовательность согласно RFTISADTSKNTAYLQMRSLRAEDTAVYYCAR (SEQ ID NO: 15); и (d) FR-H4, содержащая аминокислотную последовательность согласно WGQGTLVTVSS (SEQ ID NO: 16). В дополнительных случаях антитело к VEGF включает в себя следующие четыре FR вариабельного домена легкой цепи: (a) FR-L1, содержащая аминокислотную последовательность согласно DIQMTQSPSSLSASVGDRVTITC (SEQ ID NO: 17); (b) FR-L2, содержащая аминокислотную последовательность согласно WYQQKPGKAPKLLIY (SEQ ID NO: 18); (c) FR-L3, содержащая аминокислотную последовательность согласно GVPSRFSGSGSGTDFTLTISSLQPEDAATYYC (SEQ ID NO: 19); и (d) FR-L4, содержащая аминокислотную последовательность согласно FGQGTKVEIK (SEQ ID NO: 20). В некоторых случаях антитело к VEGF включает в себя (a) домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 11 и (b) домен VL, содержащий аминокислотную последовательность согласно SEQ ID NO: 12.
[391] Например, в некоторых случаях антитело к VEGF может включать в себя по меньшей мере одну, две, три, четыре, пять или шесть HVR, выбранных из следующего: (a) HVR-H1, содержащая аминокислотную последовательность согласно DYWIH (SEQ ID NO: 1); (b) HVR-H2, содержащая аминокислотную последовательность согласно GITPAGGYEYYADSVEG (SEQ ID NO: 22); (c) HVR-H3, содержащая аминокислотную последовательность согласно FVFFLPYAMDY (SEQ ID NO: 3); (d) HVR-L1, содержащая аминокислотную последовательность согласно RASQDVSTAVA (SEQ ID NO: 8); (e) HVR-L2, содержащая аминокислотную последовательность согласно SASFLYS (SEQ ID NO: 9); и (f) HVR-L3, содержащая аминокислотную последовательность согласно QQGYGNPFT (SEQ ID NO: 23), или комбинацию одной или нескольких представленных выше HVR и одного или нескольких их вариантов, характеризующихся по меньшей мере приблизительно 80% идентичности последовательности (например, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности) по отношению к любой из SEQ ID NO: 1, 3, 8, 9, 22 или 23. Согласно конкретному примеру, в некоторых случаях антитело к VEGF включает в себя следующие шесть HVR: (a) HVR-H1, содержащая аминокислотную последовательность согласно DYWIH (SEQ ID NO: 1); (b) HVR-H2, содержащая аминокислотную последовательность согласно GITPAGGYEYYADSVEG (SEQ ID NO: 22); (c) HVR-H3, содержащая аминокислотную последовательность согласно FVFFLPYAMDY (SEQ ID NO: 3); (d) HVR-L1, содержащая аминокислотную последовательность согласно RASQDVSTAVA (SEQ ID NO: 8); (e) HVR-L2, содержащая аминокислотную последовательность согласно SASFLYS (SEQ ID NO: 9); и (f) HVR-L3, содержащая аминокислотную последовательность согласно QQGYGNPFT (SEQ ID NO: 23).
[392] В некоторых случаях любое из предыдущих антител к VEGF может включать в себя одну, две, три или четыре из следующих каркасных областей вариабельного домена тяжелой цепи (FR): (a) FR-H1, содержащая аминокислотную последовательность согласно EEQLVEEGGGLVQPGESLELSCAASGFEIS (SEQ ID NO: 29) или EEQLVEEGGGLVQPGESLRLSCAASGFEIS (SEQ ID NO: 51); (b) FR-H2, содержащая аминокислотную последовательность согласно WVRQEPGEGLEWVA (SEQ ID NO: 30); (c) FR-H3, содержащая аминокислотную последовательность согласно RFTISADTSENTAYLQMNELRAEDTAVYYCAR (SEQ ID NO: 31); и (d) FR-H4, содержащая аминокислотную последовательность согласно WGQGELVTVSS (SEQ ID NO: 32).
[393] В некоторых случаях любое из предыдущих антител к VEGF может включать в себя одну, две, три или четыре из следующих FR вариабельного домена легкой цепи: (a) FR-L1, содержащая аминокислотную последовательность согласно DIQMTQSPSSLSASVGDRVTITC (SEQ ID NO: 17); (b) FR-L2, содержащая аминокислотную последовательность согласно WYQQKPGKAPKLLIY (SEQ ID NO: 18); (c) FR-L3, содержащая аминокислотную последовательность согласно GVPSRFSGSGSGTDFTLTISSLQPEDFATYYC (SEQ ID NO: 24); и (d) FR-L4, содержащая аминокислотную последовательность согласно FGQGTKVEIK (SEQ ID NO: 20).
[394] Например, в некоторых случаях антитело к VEGF включает в себя следующие шесть HVR: (a) HVR-H1, содержащая аминокислотную последовательность согласно DYWIH (SEQ ID NO: 1); (b) HVR-H2, содержащая аминокислотную последовательность согласно GITPAGGYEYYADSVEG (SEQ ID NO: 22); (c) HVR-H3, содержащая аминокислотную последовательность согласно FVFFLPYAMDY (SEQ ID NO: 3); (d) HVR-L1, содержащая аминокислотную последовательность согласно RASQDVSTAVA (SEQ ID NO: 8); (e) HVR-L2, содержащая аминокислотную последовательность согласно SASFLYS (SEQ ID NO: 9); и (f) HVR-L3, содержащая аминокислотную последовательность согласно QQGYGNPFT (SEQ ID NO: 23). В некоторых случаях антитело к VEGF включает в себя следующие четыре FR вариабельного домена тяжелой цепи: (a) FR-H1, содержащая аминокислотную последовательность согласно EEQLVEEGGGLVQPGESLELSCAASGFEIS (SEQ ID NO: 29); (b) FR-H2, содержащая аминокислотную последовательность согласно WVRQEPGEGLEWVA (SEQ ID NO: 30); (c) FR-H3, содержащая аминокислотную последовательность согласно RFTISADTSENTAYLQMNELRAEDTAVYYCAR (SEQ ID NO: 31); и (d) FR-H4, содержащая аминокислотную последовательность согласно WGQGELVTVSS (SEQ ID NO: 32). В дополнительных случаях антитело к VEGF включает в себя следующие четыре FR вариабельного домена легкой цепи: (a) FR-L1, содержащая аминокислотную последовательность согласно DIQMTQSPSSLSASVGDRVTITC (SEQ ID NO: 17); (b) FR-L2, содержащая аминокислотную последовательность согласно WYQQKPGKAPKLLIY (SEQ ID NO: 18); (c) FR-L3, содержащая аминокислотную последовательность согласно GVPSRFSGSGSGTDFTLTISSLQPEDFATYYC (SEQ ID NO: 24); и (d) FR-L4, содержащая аминокислотную последовательность согласно FGQGTKVEIK (SEQ ID NO: 20). В некоторых случаях антитело к VEGF включает в себя (a) домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 33, и (b) домен VL, содержащий аминокислотную последовательность согласно SEQ ID NO: 38.
[395] В некоторых случаях антитело к VEGF включает в себя следующие шесть HVR: (a) HVR-H1, содержащая аминокислотную последовательность согласно DYWIH (SEQ ID NO: 1); (b) HVR-H2, содержащая аминокислотную последовательность согласно GITPAGGYEYYADSVEG (SEQ ID NO: 22); (c) HVR-H3, содержащая аминокислотную последовательность согласно FVFFLPYAMDY (SEQ ID NO: 3); (d) HVR-L1, содержащая аминокислотную последовательность согласно RASQDVSTAVA (SEQ ID NO: 8); (e) HVR-L2, содержащая аминокислотную последовательность согласно SASFLYS (SEQ ID NO: 9); и (f) HVR-L3, содержащая аминокислотную последовательность согласно QQGYGNPFT (SEQ ID NO: 23). В некоторых случаях антитело к VEGF включает в себя следующие четыре FR вариабельного домена тяжелой цепи: (a) FR-H1, содержащая аминокислотную последовательность согласно EEQLVEEGGGLVQPGESLRLSCAASGFEIS (SEQ ID NO: 51); (b) FR-H2, содержащая аминокислотную последовательность согласно WVRQEPGEGLEWVA (SEQ ID NO: 30); (c) FR-H3, содержащая аминокислотную последовательность согласно RFTISADTSENTAYLQMNELRAEDTAVYYCAR (SEQ ID NO: 31); и (d) FR-H4, содержащая аминокислотную последовательность согласно WGQGELVTVSS (SEQ ID NO: 32). В дополнительных случаях антитело к VEGF включает в себя следующие четыре FR вариабельного домена легкой цепи: (a) FR-L1, содержащая аминокислотную последовательность согласно DIQMTQSPSSLSASVGDRVTITC (SEQ ID NO: 17); (b) FR-L2, содержащая аминокислотную последовательность согласно WYQQKPGKAPKLLIY (SEQ ID NO: 18); (c) FR-L3, содержащая аминокислотную последовательность согласно GVPSRFSGSGSGTDFTLTISSLQPEDFATYYC (SEQ ID NO: 24); и (d) FR-L4, содержащая аминокислотную последовательность согласно FGQGTKVEIK (SEQ ID NO: 20). В некоторых случаях антитело к VEGF включает в себя (a) домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 51, и (b) домен VL, содержащий аминокислотную последовательность согласно SEQ ID NO: 38.
[396] Например, в некоторых случаях антитело к VEGF может включать в себя по меньшей мере одну, две, три, четыре, пять или шесть HVR, выбранных из следующего: (a) HVR-H1, содержащая аминокислотную последовательность согласно DYWIH (SEQ ID NO: 1); (b) HVR-H2, содержащая аминокислотную последовательность согласно GITPAGGYEYYADSVEG (SEQ ID NO: 22); (c) HVR-H3, содержащая аминокислотную последовательность согласно FVFFLPYAMDY (SEQ ID NO: 3); (d) HVR-L1, содержащая аминокислотную последовательность согласно RASQDVSTAVA (SEQ ID NO: 8); (e) HVR-L2, содержащая аминокислотную последовательность согласно SASFLYS (SEQ ID NO: 9); и (f) HVR-L3, содержащая аминокислотную последовательность согласно QQGYGAPFT (SEQ ID NO: 10), или комбинацию одной или нескольких представленных выше HVR и одного или нескольких их вариантов, характеризующихся по меньшей мере приблизительно 80% идентичности последовательности (например, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности) по отношению к любой из SEQ ID NO: 1, 3, 8-10 или 22. Согласно конкретному примеру, в некоторых случаях антитело к VEGF включает в себя следующие шесть HVR: (a) HVR-H1, содержащая аминокислотную последовательность согласно DYWIH (SEQ ID NO: 1); (b) HVR-H2, содержащая аминокислотную последовательность согласно GITPAGGYEYYADSVEG (SEQ ID NO: 22); (c) HVR-H3, содержащая аминокислотную последовательность согласно FVFFLPYAMDY (SEQ ID NO: 3); (d) HVR-L1, содержащая аминокислотную последовательность согласно RASQDVSTAVA (SEQ ID NO: 8); (e) HVR-L2, содержащая аминокислотную последовательность согласно SASFLYS (SEQ ID NO: 9); и (f) HVR-L3, содержащая аминокислотную последовательность согласно QQGYGAPFT (SEQ ID NO: 10).
[397] В некоторых случаях любое из предыдущих антител к VEGF может включать в себя одну, две, три или четыре из следующих каркасных областей вариабельного домена тяжелой цепи (FR): (a) FR-H1, содержащая аминокислотную последовательность согласно EEQLVEEGGGLVQPGESLELSCAASGFEIS (SEQ ID NO: 29) или EEQLVEEGGGLVQPGESLRLSCAASGFEIS (SEQ ID NO: 51); (b) FR-H2, содержащая аминокислотную последовательность согласно WVRQEPGEGLEWVA (SEQ ID NO: 30); (c) FR-H3, содержащая аминокислотную последовательность согласно RFTISADTSENTAYLQMNELRAEDTAVYYCAR (SEQ ID NO: 31); и (d) FR-H4, содержащая аминокислотную последовательность согласно WGQGELVTVSS (SEQ ID NO: 32).
[398] В некоторых случаях любое из предыдущих антител к VEGF может включать в себя одну, две, три или четыре из следующих FR вариабельного домена легкой цепи: (a) FR-L1, содержащая аминокислотную последовательность согласно DIQMTQSPSSLSASVGDRVTITC (SEQ ID NO: 17), DIQMTQSPESLSASVGDEVTITC (SEQ ID NO: 25) или DIQMTQSPSSLSASVGDEVTITC (SEQ ID NO: 26); (b) FR-L2, содержащая аминокислотную последовательность согласно WYQQKPGKAPKLLIY (SEQ ID NO: 18) или WYQQKPGEAPKLLIY (SEQ ID NO: 27); (c) FR-L3, содержащая аминокислотную последовательность согласно GVPSRFSGSGSGTDFTLTISSLQPEDAATYYC (SEQ ID NO: 19) или GVPSRFSGSGSGTDFTLTIESLQPEDAATYYC (SEQ ID NO: 28); и (d) FR-L4, содержащая аминокислотную последовательность согласно FGQGTKVEIK (SEQ ID NO: 20).
[399] Например, в некоторых случаях антитело к VEGF включает в себя следующие шесть HVR: (a) HVR-H1, содержащая аминокислотную последовательность согласно DYWIH (SEQ ID NO: 1); (b) HVR-H2, содержащая аминокислотную последовательность согласно GITPAGGYEYYADSVEG (SEQ ID NO: 22); (c) HVR-H3, содержащая аминокислотную последовательность согласно FVFFLPYAMDY (SEQ ID NO: 3); (d) HVR-L1, содержащая аминокислотную последовательность согласно RASQDVSTAVA (SEQ ID NO: 8); (e) HVR-L2, содержащая аминокислотную последовательность согласно SASFLYS (SEQ ID NO: 9); и (f) HVR-L3, содержащая аминокислотную последовательность согласно QQGYGAPFT (SEQ ID NO: 10). В некоторых случаях антитело к VEGF включает в себя следующие четыре FR вариабельного домена тяжелой цепи: (a) FR-H1, содержащая аминокислотную последовательность согласно EEQLVEEGGGLVQPGESLELSCAASGFEIS (SEQ ID NO: 29); (b) FR-H2, содержащая аминокислотную последовательность согласно WVRQEPGEGLEWVA (SEQ ID NO: 30); (c) FR-H3, содержащая аминокислотную последовательность согласно RFTISADTSENTAYLQMNELRAEDTAVYYCAR (SEQ ID NO: 31); и (d) FR-H4, содержащая аминокислотную последовательность согласно WGQGELVTVSS (SEQ ID NO: 32). В дополнительных случаях антитело к VEGF включает в себя следующие четыре FR вариабельного домена легкой цепи: (a) FR-L1, содержащая аминокислотную последовательность согласно DIQMTQSPESLSASVGDEVTITC (SEQ ID NO: 25); (b) FR-L2, содержащая аминокислотную последовательность согласно WYQQKPGKAPKLLIY (SEQ ID NO: 18); (c) FR-L3, содержащая аминокислотную последовательность согласно GVPSRFSGSGSGTDFTLTISSLQPEDAATYYC (SEQ ID NO: 19); и (d) FR-L4, содержащая аминокислотную последовательность согласно FGQGTKVEIK (SEQ ID NO: 20). В некоторых случаях антитело к VEGF включает в себя (a) домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 33, и (b) домен VL, содержащий аминокислотную последовательность согласно SEQ ID NO: 34.
[400] Например, в других случаях антитело к VEGF включает в себя следующие шесть HVR: (a) HVR-H1, содержащая аминокислотную последовательность согласно DYWIH (SEQ ID NO: 1); (b) HVR-H2, содержащая аминокислотную последовательность согласно GITPAGGYEYYADSVEG (SEQ ID NO: 22); (c) HVR-H3, содержащая аминокислотную последовательность согласно FVFFLPYAMDY (SEQ ID NO: 3); (d) HVR-L1, содержащая аминокислотную последовательность согласно RASQDVSTAVA (SEQ ID NO: 8); (e) HVR-L2, содержащая аминокислотную последовательность согласно SASFLYS (SEQ ID NO: 9); и (f) HVR-L3, содержащая аминокислотную последовательность согласно QQGYGAPFT (SEQ ID NO: 10). В некоторых случаях антитело к VEGF включает в себя следующие четыре FR вариабельного домена тяжелой цепи: (a) FR-H1, содержащая аминокислотную последовательность согласно EEQLVEEGGGLVQPGESLELSCAASGFEIS (SEQ ID NO: 29); (b) FR-H2, содержащая аминокислотную последовательность согласно WVRQEPGEGLEWVA (SEQ ID NO: 30); (c) FR-H3, содержащая аминокислотную последовательность согласно RFTISADTSENTAYLQMNELRAEDTAVYYCAR (SEQ ID NO: 31); и (d) FR-H4, содержащая аминокислотную последовательность согласно WGQGELVTVSS (SEQ ID NO: 32). В дополнительных случаях антитело к VEGF включает в себя следующие четыре FR вариабельного домена легкой цепи: (a) FR-L1, содержащая аминокислотную последовательность согласно DIQMTQSPSSLSASVGDEVTITC (SEQ ID NO: 26); (b) FR-L2, содержащая аминокислотную последовательность согласно WYQQKPGEAPKLLIY (SEQ ID NO: 27); (c) FR-L3, содержащая аминокислотную последовательность согласно GVPSRFSGSGSGTDFTLTIESLQPEDAATYYC (SEQ ID NO: 28); и (d) FR-L4, содержащая аминокислотную последовательность согласно FGQGTKVEIK (SEQ ID NO: 20). В некоторых случаях антитело к VEGF включает в себя (a) домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 33, и (b) домен VL, содержащий аминокислотную последовательность согласно SEQ ID NO: 35.
[401] Например, в других случаях антитело к VEGF включает в себя следующие шесть HVR: (a) HVR-H1, содержащая аминокислотную последовательность согласно DYWIH (SEQ ID NO: 1); (b) HVR-H2, содержащая аминокислотную последовательность согласно GITPAGGYEYYADSVEG (SEQ ID NO: 22); (c) HVR-H3, содержащая аминокислотную последовательность согласно FVFFLPYAMDY (SEQ ID NO: 3); (d) HVR-L1, содержащая аминокислотную последовательность согласно RASQDVSTAVA (SEQ ID NO: 8); (e) HVR-L2, содержащая аминокислотную последовательность согласно SASFLYS (SEQ ID NO: 9); и (f) HVR-L3, содержащая аминокислотную последовательность согласно QQGYGAPFT (SEQ ID NO: 10). В некоторых случаях антитело к VEGF включает в себя следующие четыре FR вариабельного домена тяжелой цепи: (a) FR-H1, содержащая аминокислотную последовательность согласно EEQLVEEGGGLVQPGESLRLSCAASGFEIS (SEQ ID NO: 51); (b) FR-H2, содержащая аминокислотную последовательность согласно WVRQEPGEGLEWVA (SEQ ID NO: 30); (c) FR-H3, содержащая аминокислотную последовательность согласно RFTISADTSENTAYLQMNELRAEDTAVYYCAR (SEQ ID NO: 31); и (d) FR-H4, содержащая аминокислотную последовательность согласно WGQGELVTVSS (SEQ ID NO: 32). В дополнительных случаях антитело к VEGF включает в себя следующие четыре FR вариабельного домена легкой цепи: (a) FR-L1, содержащая аминокислотную последовательность согласно DIQMTQSPSSLSASVGDEVTITC (SEQ ID NO: 26); (b) FR-L2, содержащая аминокислотную последовательность согласно WYQQKPGEAPKLLIY (SEQ ID NO: 27); (c) FR-L3, содержащая аминокислотную последовательность согласно GVPSRFSGSGSGTDFTLTIESLQPEDAATYYC (SEQ ID NO: 28); и (d) FR-L4, содержащая аминокислотную последовательность согласно FGQGTKVEIK (SEQ ID NO: 20). В некоторых случаях антитело к VEGF включает в себя (a) домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 51, и (b) домен VL, содержащий аминокислотную последовательность согласно SEQ ID NO: 35.
[402] Например, в других случаях антитело к VEGF включает в себя следующие шесть HVR: (a) HVR-H1, содержащая аминокислотную последовательность согласно DYWIH (SEQ ID NO: 1); (b) HVR-H2, содержащая аминокислотную последовательность согласно GITPAGGYEYYADSVEG (SEQ ID NO: 22); (c) HVR-H3, содержащая аминокислотную последовательность согласно FVFFLPYAMDY (SEQ ID NO: 3); (d) HVR-L1, содержащая аминокислотную последовательность согласно RASQDVSTAVA (SEQ ID NO: 8); (e) HVR-L2, содержащая аминокислотную последовательность согласно SASFLYS (SEQ ID NO: 9); и (f) HVR-L3, содержащая аминокислотную последовательность согласно QQGYGAPFT (SEQ ID NO: 10). В некоторых случаях антитело к VEGF включает в себя следующие четыре FR вариабельного домена тяжелой цепи: (a) FR-H1, содержащая аминокислотную последовательность согласно EEQLVEEGGGLVQPGESLELSCAASGFEIS (SEQ ID NO: 29); (b) FR-H2, содержащая аминокислотную последовательность согласно WVRQEPGEGLEWVA (SEQ ID NO: 30); (c) FR-H3, содержащая аминокислотную последовательность согласно RFTISADTSENTAYLQMNELRAEDTAVYYCAR (SEQ ID NO: 31); и (d) FR-H4, содержащая аминокислотную последовательность согласно WGQGELVTVSS (SEQ ID NO: 32). В дополнительных случаях антитело к VEGF включает в себя следующие четыре FR вариабельного домена легкой цепи: (a) FR-L1, содержащая аминокислотную последовательность согласно DIQMTQSPESLSASVGDEVTITC (SEQ ID NO: 25); (b) FR-L2, содержащая аминокислотную последовательность согласно WYQQKPGEAPKLLIY (SEQ ID NO: 27); (c) FR-L3, содержащая аминокислотную последовательность согласно GVPSRFSGSGSGTDFTLTISSLQPEDAATYYC (SEQ ID NO: 19); и (d) FR-L4, содержащая аминокислотную последовательность согласно FGQGTKVEIK (SEQ ID NO: 20). В некоторых случаях антитело к VEGF включает в себя (a) домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 33, и (b) домен VL, содержащий аминокислотную последовательность согласно SEQ ID NO: 36.
[403] Например, в дополнительных случаях антитело к VEGF включает в себя следующие шесть HVR: (a) HVR-H1, содержащая аминокислотную последовательность согласно DYWIH (SEQ ID NO: 1); (b) HVR-H2, содержащая аминокислотную последовательность согласно GITPAGGYEYYADSVEG (SEQ ID NO: 22); (c) HVR-H3, содержащая аминокислотную последовательность согласно FVFFLPYAMDY (SEQ ID NO: 3); (d) HVR-L1, содержащая аминокислотную последовательность согласно RASQDVSTAVA (SEQ ID NO: 8); (e) HVR-L2, содержащая аминокислотную последовательность согласно SASFLYS (SEQ ID NO: 9); и (f) HVR-L3, содержащая аминокислотную последовательность согласно QQGYGAPFT (SEQ ID NO: 10). В некоторых случаях антитело к VEGF включает в себя следующие четыре FR вариабельного домена тяжелой цепи: (a) FR-H1, содержащая аминокислотную последовательность согласно EEQLVEEGGGLVQPGESLELSCAASGFEIS (SEQ ID NO: 29); (b) FR-H2, содержащая аминокислотную последовательность согласно WVRQEPGEGLEWVA (SEQ ID NO: 30); (c) FR-H3, содержащая аминокислотную последовательность согласно RFTISADTSENTAYLQMNELRAEDTAVYYCAR (SEQ ID NO: 31); и (d) FR-H4, содержащая аминокислотную последовательность согласно WGQGELVTVSS (SEQ ID NO: 32). В дополнительных случаях антитело к VEGF включает в себя следующие четыре FR вариабельного домена легкой цепи: (a) FR-L1, содержащая аминокислотную последовательность согласно DIQMTQSPSSLSASVGDEVTITC (SEQ ID NO: 26); (b) FR-L2, содержащая аминокислотную последовательность согласно WYQQKPGKAPKLLIY (SEQ ID NO: 18); (c) FR-L3, содержащая аминокислотную последовательность согласно GVPSRFSGSGSGTDFTLTISSLQPEDAATYYC (SEQ ID NO: 19); и (d) FR-L4, содержащая аминокислотную последовательность согласно FGQGTKVEIK (SEQ ID NO: 20). В некоторых случаях антитело к VEGF включает в себя (a) домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 33, и (b) домен VL, содержащий аминокислотную последовательность согласно SEQ ID NO: 37.
[404] В других случаях антитело к VEGF включает в себя следующие шесть HVR: (a) HVR-H1, содержащая аминокислотную последовательность согласно DYWIH (SEQ ID NO: 1); (b) HVR-H2, содержащая аминокислотную последовательность согласно GITPAGGYEYYADSVEG (SEQ ID NO: 22); (c) HVR-H3, содержащая аминокислотную последовательность согласно FVFFLPYAMDY (SEQ ID NO: 3); (d) HVR-L1, содержащая аминокислотную последовательность согласно RASQDVSTAVA (SEQ ID NO: 8); (e) HVR-L2, содержащая аминокислотную последовательность согласно SASFLYS (SEQ ID NO: 9); и (f) HVR-L3, содержащая аминокислотную последовательность согласно QQGYGAPFT (SEQ ID NO: 10). В некоторых случаях антитело к VEGF включает в себя следующие четыре FR вариабельного домена тяжелой цепи: (a) FR-H1, содержащая аминокислотную последовательность согласно EEQLVEEGGGLVQPGESLRLSCAASGFEIS (SEQ ID NO: 51); (b) FR-H2, содержащая аминокислотную последовательность согласно WVRQEPGEGLEWVA (SEQ ID NO: 30); (c) FR-H3, содержащая аминокислотную последовательность согласно RFTISADTSENTAYLQMNELRAEDTAVYYCAR (SEQ ID NO: 31); и (d) FR-H4, содержащая аминокислотную последовательность согласно WGQGELVTVSS (SEQ ID NO: 32). В дополнительных случаях антитело к VEGF включает в себя следующие четыре FR вариабельного домена легкой цепи: (a) FR-L1, содержащая аминокислотную последовательность согласно DIQMTQSPSSLSASVGDEVTITC (SEQ ID NO: 26); (b) FR-L2, содержащая аминокислотную последовательность согласно WYQQKPGKAPKLLIY (SEQ ID NO: 18); (c) FR-L3, содержащая аминокислотную последовательность согласно GVPSRFSGSGSGTDFTLTISSLQPEDAATYYC (SEQ ID NO: 19); и (d) FR-L4, содержащая аминокислотную последовательность согласно FGQGTKVEIK (SEQ ID NO: 20). В некоторых случаях антитело к VEGF включает в себя (a) домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 51, и (b) домен VL, содержащий аминокислотную последовательность согласно SEQ ID NO: 37.
[405] Например, в других случаях антитело к VEGF включает в себя следующие шесть HVR: (a) HVR-H1, содержащая аминокислотную последовательность согласно DYWIH (SEQ ID NO: 1); (b) HVR-H2, содержащая аминокислотную последовательность согласно GITPAGGYEYYADSVEG (SEQ ID NO: 22); (c) HVR-H3, содержащая аминокислотную последовательность согласно FVFFLPYAMDY (SEQ ID NO: 3); (d) HVR-L1, содержащая аминокислотную последовательность согласно RASQDVSTAVA (SEQ ID NO: 8); (e) HVR-L2, содержащая аминокислотную последовательность согласно SASFLYS (SEQ ID NO: 9); и (f) HVR-L3, содержащая аминокислотную последовательность согласно QQGYGAPFT (SEQ ID NO: 10). В некоторых случаях антитело к VEGF включает в себя следующие четыре FR вариабельного домена тяжелой цепи: (a) FR-H1, содержащая аминокислотную последовательность согласно EEQLVEEGGGLVQPGESLELSCAASGFEIS (SEQ ID NO: 29); (b) FR-H2, содержащая аминокислотную последовательность согласно WVRQEPGEGLEWVA (SEQ ID NO: 30); (c) FR-H3, содержащая аминокислотную последовательность согласно RFTISADTSENTAYLQMNELRAEDTAVYYCAR (SEQ ID NO: 31); и (d) FR-H4, содержащая аминокислотную последовательность согласно WGQGELVTVSS (SEQ ID NO: 32). В дополнительных случаях антитело к VEGF включает в себя следующие четыре FR вариабельного домена легкой цепи: (a) FR-L1, содержащая аминокислотную последовательность согласно DIQMTQSPSSLSASVGDRVTITC (SEQ ID NO: 17); (b) FR-L2, содержащая аминокислотную последовательность согласно WYQQKPGKAPKLLIY (SEQ ID NO: 18); (c) FR-L3, содержащая аминокислотную последовательность согласно GVPSRFSGSGSGTDFTLTISSLQPEDAATYYC (SEQ ID NO: 19); и (d) FR-L4, содержащая аминокислотную последовательность согласно FGQGTKVEIK (SEQ ID NO: 20). В некоторых случаях антитело к VEGF включает в себя (a) домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 33, и (b) домен VL, содержащий аминокислотную последовательность согласно SEQ ID NO: 12.
[406] В других случаях антитело к VEGF включает в себя следующие шесть HVR: (a) HVR-H1, содержащая аминокислотную последовательность согласно DYWIH (SEQ ID NO: 1); (b) HVR-H2, содержащая аминокислотную последовательность согласно GITPAGGYEYYADSVEG (SEQ ID NO: 22); (c) HVR-H3, содержащая аминокислотную последовательность согласно FVFFLPYAMDY (SEQ ID NO: 3); (d) HVR-L1, содержащая аминокислотную последовательность согласно RASQDVSTAVA (SEQ ID NO: 8); (e) HVR-L2, содержащая аминокислотную последовательность согласно SASFLYS (SEQ ID NO: 9); и (f) HVR-L3, содержащая аминокислотную последовательность согласно QQGYGAPFT (SEQ ID NO: 10). В некоторых случаях антитело к VEGF включает в себя следующие четыре FR вариабельного домена тяжелой цепи: (a) FR-H1, содержащая аминокислотную последовательность согласно EEQLVEEGGGLVQPGESLRLSCAASGFEIS (SEQ ID NO: 51); (b) FR-H2, содержащая аминокислотную последовательность согласно WVRQEPGEGLEWVA (SEQ ID NO: 30); (c) FR-H3, содержащая аминокислотную последовательность согласно RFTISADTSENTAYLQMNELRAEDTAVYYCAR (SEQ ID NO: 31); и (d) FR-H4, содержащая аминокислотную последовательность согласно WGQGELVTVSS (SEQ ID NO: 32). В дополнительных случаях антитело к VEGF включает в себя следующие четыре FR вариабельного домена легкой цепи: (a) FR-L1, содержащая аминокислотную последовательность согласно DIQMTQSPSSLSASVGDRVTITC (SEQ ID NO: 17); (b) FR-L2, содержащая аминокислотную последовательность согласно WYQQKPGKAPKLLIY (SEQ ID NO: 18); (c) FR-L3, содержащая аминокислотную последовательность согласно GVPSRFSGSGSGTDFTLTISSLQPEDAATYYC (SEQ ID NO: 19); и (d) FR-L4, содержащая аминокислотную последовательность согласно FGQGTKVEIK (SEQ ID NO: 20). В некоторых случаях антитело к VEGF включает в себя (a) домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 51, и (b) домен VL, содержащий аминокислотную последовательность согласно SEQ ID NO: 12.
[407] В некоторых случаях антитело к VEGF содержит (a) вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность, характеризующуюся по меньшей мере 90% идентичности последовательности (например, по меньшей мере 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности последовательности) по отношению к любой из SEQ ID NO: 11, 40 или 42, или последовательность согласно любой из SEQ ID NO: 11, 40 или 42; (b) вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность, характеризующуюся по меньшей мере 90% последовательность (например, по меньшей мере 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности последовательности) по отношению к любой из SEQ ID NO: 12, 41 или 46, или последовательность согласно любой из SEQ ID NO: 12, 41 или 46; или (c) домен VH, как в (a), и домен VL, как в (b). Например, в некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 11, и домен VL, содержащий аминокислотную последовательность согласно SEQ ID NO: 12. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 40, и домен VL, содержащий аминокислотную последовательность согласно SEQ ID NO: 12. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 42, и домен VL, содержащий аминокислотную последовательность согласно SEQ ID NO: 12. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 42, и домен VL, содержащий аминокислотную последовательность согласно SEQ ID NO: 41. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 11, и домен VL, содержащий аминокислотную последовательность согласно SEQ ID NO: 46.
[408] В некоторых случаях любое из предыдущих антител к VEGF может включать в себя одну, две, три или четыре из следующих каркасных областей вариабельного домена тяжелой цепи (FR): (a) FR-H1, содержащая аминокислотную последовательность согласно EVQLVESGGGLVQPGGSLRLSCAASGFTIS (SEQ ID NO: 13); (b) FR-H2, содержащая аминокислотную последовательность согласно WVRQAPGKGLEWVA (SEQ ID NO: 14) или WVRQEPGKGLEWVA (SEQ ID NO: 39); (c) FR-H3, содержащая аминокислотную последовательность согласно RFTISADTSKNTAYLQMRSLRAEDTAVYYCAR (SEQ ID NO: 15); и (d) FR-H4, содержащая аминокислотную последовательность согласно WGQGTLVTVSS (SEQ ID NO: 16).
[409] В некоторых случаях любое из предыдущих антител к VEGF может включать в себя одну, две, три или четыре из следующих FR вариабельного домена легкой цепи: (a) FR-L1, содержащая аминокислотную последовательность согласно DIQMTQSPSSLSASVGDRVTITC (SEQ ID NO: 17) или DIQMTQSPSSLSASVGDRVTIDC (SEQ ID NO: 45); (b) FR-L2, содержащая аминокислотную последовательность согласно WYQQKPGKAPKLLIY (SEQ ID NO: 18); (c) FR-L3, содержащая аминокислотную последовательность согласно GVPSRFSGSGSGTDFTLTISSLQPEDAATYYC (SEQ ID NO: 19), GVPSRFSGSGSGTDFTLTISSLQPEDSATYYC (SEQ ID NO: 44), или GVPSRFSGSGSGTDFTLTISSLQPEDVATYYC (SEQ ID NO: 54); и (d) FR-L4, содержащая аминокислотную последовательность согласно FGQGTKVEIK (SEQ ID NO: 20) или FGQGTKVEVK (SEQ ID NO: 55).
[410] В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 11, и домен VL, содержащий аминокислотную последовательность согласно DIQMTQSPSSLSASVGDRVTITCRASQDVSTAVAWYQQKPGKAPKLLIYSASFLYSGVPSRFSGSGSGTDFTLTISSLQPEDVATYYCQQGYGNPFTFGQGTKVEIK (SEQ ID NO: 59).
[411] В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 33, и домен VL, содержащий аминокислотную последовательность согласно DIQMTQSPSSLSASVGDRVTITCRASQDVSTAVAWYQQKPGKAPKLLIYSASFLYSGVPSRFSGSGSGTDFTLTISSLQPEDVATYYCQQGYGNPFTFGQGTKVEIK (SEQ ID NO: 59).
[412] В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 40, и домен VL, содержащий аминокислотную последовательность согласно DIQMTQSPSSLSASVGDRVTITCRASQDVSTAVAWYQQKPGKAPKLLIYSASFLYSGVPSRFSGSGSGTDFTLTISSLQPEDVATYYCQQGYGNPFTFGQGTKVEIK (SEQ ID NO: 59).
[413] В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 42, и домен VL, содержащий аминокислотную последовательность согласно DIQMTQSPSSLSASVGDRVTITCRASQDVSTAVAWYQQKPGKAPKLLIYSASFLYSGVPSRFSGSGSGTDFTLTISSLQPEDVATYYCQQGYGNPFTFGQGTKVEIK (SEQ ID NO: 59).
[414] В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 51, и домен VL, содержащий аминокислотную последовательность согласно DIQMTQSPSSLSASVGDRVTITCRASQDVSTAVAWYQQKPGKAPKLLIYSASFLYSGVPSRFSGSGSGTDFTLTISSLQPEDVATYYCQQGYGNPFTFGQGTKVEIK (SEQ ID NO: 59).
[415] В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 11, и домен VL, содержащий аминокислотную последовательность согласно DIQMTQSPSSLSASVGDRVTITCRASQDVSTAVAWYQQKPGKAPKLLIYSASFLYSGVPSRFSGSGSGTDFTLTISSLQPEDVATYYCQQGYGAPFTFGQGTKVEIK (SEQ ID NO: 60).
[416] В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 33, и домен VL, содержащий аминокислотную последовательность согласно DIQMTQSPSSLSASVGDRVTITCRASQDVSTAVAWYQQKPGKAPKLLIYSASFLYSGVPSRFSGSGSGTDFTLTISSLQPEDVATYYCQQGYGAPFTFGQGTKVEIK (SEQ ID NO: 60).
[417] В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 40, и домен VL, содержащий аминокислотную последовательность согласно DIQMTQSPSSLSASVGDRVTITCRASQDVSTAVAWYQQKPGKAPKLLIYSASFLYSGVPSRFSGSGSGTDFTLTISSLQPEDVATYYCQQGYGAPFTFGQGTKVEIK (SEQ ID NO: 60).
[418] В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 42, и домен VL, содержащий аминокислотную последовательность согласно DIQMTQSPSSLSASVGDRVTITCRASQDVSTAVAWYQQKPGKAPKLLIYSASFLYSGVPSRFSGSGSGTDFTLTISSLQPEDVATYYCQQGYGAPFTFGQGTKVEIK (SEQ ID NO: 60).
[419] В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 51, и домен VL, содержащий аминокислотную последовательность согласно DIQMTQSPSSLSASVGDRVTITCRASQDVSTAVAWYQQKPGKAPKLLIYSASFLYSGVPSRFSGSGSGTDFTLTISSLQPEDVATYYCQQGYGAPFTFGQGTKVEIK (SEQ ID NO: 60). Например, в некоторых случаях антитело к VEGF содержит (a) домен VH, содержащий аминокислотную последовательность, характеризующуюся по меньшей мере 90% идентичности последовательности (например, по меньшей мере 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности последовательности) по отношению к последовательности согласно SEQ ID NO: 11, или последовательность согласно SEQ ID NO: 11; (b) домен VL, содержащий аминокислотную последовательность, характеризующуюся по меньшей мере 90% последовательность (например, по меньшей мере 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности последовательности) по отношению к последовательности согласно SEQ ID NO: 11, или последовательность согласно SEQ ID NO: 11; или (c) домен VH, как в (a), и домен VL, как в (b). В некоторых случаях антитело к VEGF может включать в себя (a) HVR-H1, содержащая аминокислотную последовательность согласно DYWIH (SEQ ID NO: 1); (b) HVR-H2, содержащая аминокислотную последовательность согласно GITPAGGYTRYADSVKG (SEQ ID NO: 7); (c) HVR-H3, содержащая аминокислотную последовательность согласно FVFFLPYAMDY (SEQ ID NO: 3); (d) HVR-L1, содержащая аминокислотную последовательность согласно RASQDVSTAVA (SEQ ID NO: 8); (e) HVR-L2, содержащая аминокислотную последовательность согласно SASFLYS (SEQ ID NO: 9); и (f) HVR-L3, содержащая аминокислотную последовательность согласно QQGYGAPFT (SEQ ID NO: 10). В некоторых случаях антитело к VEGF включает в себя следующие каркасные области тяжелой цепи: (a) FR-H1, содержащая аминокислотную последовательность согласно EVQLVESGGGLVQPGGSLRLSCAASGFTIS (SEQ ID NO: 13); (b) FR-H2, содержащая аминокислотную последовательность согласно WVRQAPGKGLEWVA (SEQ ID NO: 14); (c) FR-H3, содержащая аминокислотную последовательность согласно RFTISADTSKNTAYLQMRSLRAEDTAVYYCAR (SEQ ID NO: 15); и (d) FR-H4, содержащая аминокислотную последовательность согласно WGQGTLVTVSS (SEQ ID NO: 16). В некоторых случаях антитело к VEGF включает в себя следующие каркасные области легкой цепи: (a) FR-L1, содержащая аминокислотную последовательность согласно DIQMTQSPSSLSASVGDRVTITC (SEQ ID NO: 17); (b) FR-L2, содержащая аминокислотную последовательность согласно WYQQKPGKAPKLLIY (SEQ ID NO: 18); (c) FR-L3, содержащая аминокислотную последовательность согласно GVPSRFSGSGSGTDFTLTISSLQPEDAATYYC (SEQ ID NO: 19); и (d) FR-L4, содержащая аминокислотную последовательность согласно FGQGTKVEIK (SEQ ID NO: 20). В некоторых случаях антитело к VEGF включает в себя связывающий домен, содержащий (a) домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 11, и (b) домен VL, содержащий аминокислотную последовательность согласно SEQ ID NO: 12. В некоторых случаях иллюстративное антитело к VEGF представляет собой N94A.F83A.N82aR.Y58R (также называемое G6.31.AARR).
[420] В некоторых случаях антитело к VEGF содержит (a) VH домен, содержащий аминокислотную последовательность, характеризующуюся по меньшей мере 90% идентичности последовательности (например, по меньшей мере 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности последовательности) по отношению к последовательности согласно SEQ ID NO: 33 или 51, или последовательность согласно SEQ ID NO: 33 или 51; (b) домен VL, содержащий аминокислотную последовательность, характеризующуюся по меньшей мере 90% последовательность (например, по меньшей мере 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности последовательности) по отношению к любой из SEQ ID NO: 12, 34, 35, 36, 37 или 38, или последовательность согласно любой из SEQ ID NO: 12, 34, 35, 36, 37 или 38; или (c) домен VH, как в (a), и домен VL, как в (b). Например, в некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 33, и домен VL, содержащий аминокислотную последовательность согласно SEQ ID NO: 12. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 33, и домен VL, содержащий аминокислотную последовательность согласно SEQ ID NO: 34. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 33, и домен VL, содержащий аминокислотную последовательность согласно SEQ ID NO: 35. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 33, и домен VL, содержащий аминокислотную последовательность согласно SEQ ID NO: 36. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 33, и домен VL, содержащий аминокислотную последовательность согласно SEQ ID NO: 37. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 33, и домен VL, содержащий аминокислотную последовательность согласно SEQ ID NO: 38. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 51, и домен VL, содержащий аминокислотную последовательность согласно SEQ ID NO: 38. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 51, и домен VL, содержащий аминокислотную последовательность согласно SEQ ID NO: 35. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 51, и домен VL, содержащий аминокислотную последовательность согласно SEQ ID NO: 37. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 51, и домен VL, содержащий аминокислотную последовательность согласно SEQ ID NO: 12.
[421] В некоторых случаях антитело к VEGF содержит (a) VH домен, содержащий аминокислотную последовательность, характеризующуюся по меньшей мере 90% идентичности последовательности (например, по меньшей мере 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности последовательности) по отношению к последовательности SEQ ID NO: 33 или 51, или последовательность согласно SEQ ID NO: 33 или 51; (b) домен VL, содержащий аминокислотную последовательность, характеризующуюся по меньшей мере 90% последовательность (например, по меньшей мере 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности последовательности) по отношению к любой из SEQ ID NO: 12, 34, 35, 36, 37 или 38, или последовательность согласно любой из SEQ ID NO: 12, 34, 35, 36, 37 или 38; или (c) домен VH, как в (a), и домен VL, как в (b). Например, в некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 33 и домен VL, содержащий аминокислотную последовательность согласно SEQ ID NO: 12. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 33, и домен VL, содержащий аминокислотную последовательность согласно SEQ ID NO: 34. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 33, и домен VL, содержащий аминокислотную последовательность согласно SEQ ID NO: 35. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 33, и домен VL, содержащий аминокислотную последовательность согласно SEQ ID NO: 36. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 33, и домен VL, содержащий аминокислотную последовательность согласно SEQ ID NO: 37. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 33, и домен VL, содержащий аминокислотную последовательность согласно SEQ ID NO: 38. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 51, и домен VL, содержащий аминокислотную последовательность согласно SEQ ID NO: 38. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 51, и домен VL, содержащий аминокислотную последовательность согласно SEQ ID NO: 35. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 51, и домен VL, содержащий аминокислотную последовательность согласно SEQ ID NO: 37. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 51, и домен VL, содержащий аминокислотную последовательность согласно SEQ ID NO: 12,
[422] В некоторых случаях любое из предыдущих антител к VEGF может включать в себя одну, две, три или четыре из следующих каркасных областей вариабельного домена тяжелой цепи (FR): FR-H1, содержащая аминокислотную последовательность согласно EEQLVEEGGGLVQPGESLELSCAASGFEIS (SEQ ID NO: 29) или EEQLVEEGGGLVQPGESLRLSCAASGFEIS (SEQ ID NO: 52); (b) FR-H2, содержащая аминокислотную последовательность согласно WVRQEPGEGLEWVA (SEQ ID NO: 30) или WVRQEPGKGLEWVA (SEQ ID NO: 39); (c) FR-H3, содержащая аминокислотную последовательность согласно RFTISADTSENTAYLQMNELRAEDTAVYYCAR (SEQ ID NO: 31); и (d) FR-H4, содержащая аминокислотную последовательность согласно WGQGELVTVSS (SEQ ID NO: 32).
[423] В некоторых случаях любое из предыдущих антител к VEGF может включать в себя одну, две, три или четыре из следующих FR вариабельного домена легкой цепи: (a) FR-L1, содержащая аминокислотную последовательность согласно DIQMTQSPSSLSASVGDRVTITC (SEQ ID NO: 17), DIQMTQSPESLSASVGDEVTITC (SEQ ID NO: 25) или DIQMTQSPSSLSASVGDEVTITC (SEQ ID NO: 26); (b) FR-L2, содержащая аминокислотную последовательность согласно WYQQKPGKAPKLLIY (SEQ ID NO: 18) или WYQQKPGEAPKLLIY (SEQ ID NO: 27); (c) FR-L3, содержащая аминокислотную последовательность согласно GVPSRFSGSGSGTDFTLTISSLQPEDAATYYC (SEQ ID NO: 19), GVPSRFSGSGSGTDFTLTISSLQPEDFATYYC (SEQ ID NO: 24) или GVPSRFSGSGSGTDFTLTIESLQPEDAATYYC (SEQ ID NO: 28); и (d) FR-L4, содержащая аминокислотную последовательность согласно FGQGTKVEIK (SEQ ID NO: 20).
[424] В некоторых случаях настоящее изобретение относится к антителу, содержащему (a) тяжелую цепь, содержащую аминокислотную последовательность согласно SEQ ID NO: 48, и/или (b) легкую цепь, содержащую аминокислотную последовательность согласно SEQ ID NO: 50. Согласно определенным вариантам осуществления антитело представляет собой G6.31 AARR, экспрессированное в формате Fab.
[425] В некоторых случаях настоящее изобретение относится к антителу, содержащему (a) тяжелую цепь, содержащую аминокислотную последовательность согласно SEQ ID NO: 49, и/или (b) легкую цепь, содержащую аминокислотную последовательность согласно SEQ ID NO: 50. Согласно определенным вариантам осуществления антитело представляет собой вариантную версию G6.31 AARR, которая не обладает реакционной способностью в отношении антител к IgG человека.
[426] В дополнительном аспекте антитело (например, антитело к VEGF) в соответствии с любым из вышеуказанных вариантов осуществления может включать в себя любой из признаков, по отдельности или в комбинации, как описано в разделах 1-7 ниже.
Раздел 1: Аффинность антитела
[427] Согласно определенным вариантам осуществления антитело, предусмотренное в настоящем документе, характеризуется константой диссоциации (Kd), составляющей ≤ 1 мкM, ≤ 100 нM, ≤ 10 нM, ≤ 1 нM, ≤ 0,1 нM, ≤ 0,01 нM или ≤ 0,001 нM (например, 10-8 M или меньше, например, от 10-8 M до 10-13 M, например, от 10-9 M до 10-13 M). Например, в некоторых случаях антитело, предусмотренное в настоящем документе, связывается с антигеном (например, VEGF человека (hVEGF)) с Kd, составляющей приблизительно 10 нM или ниже. В некоторых случаях антитело, предусмотренное в настоящем документе, связывается с антигеном (например, hVEGF) с Kd, составляющей приблизительно 5 нM или ниже. В некоторых случаях антитело, предусмотренное в настоящем документе, связывается с hVEGF с Kd, составляющей приблизительно 2 нM или ниже. Например, в некоторых случаях антитело связывается с антигеном (например, hVEGF) с Kd от приблизительно 25 пM до приблизительно 2 нM (например, приблизительно 25 пM, приблизительно 50 пM, приблизительно 75 пM, приблизительно 100 пM, приблизительно 125 пM, приблизительно 150 пM, приблизительно 175 пM, приблизительно 200 пM, приблизительно 225 пM, приблизительно 250 пM, приблизительно 275 пM, приблизительно 300 пM, приблизительно 325 пM, приблизительно 350 пM, приблизительно 375 пM, приблизительно 400 пM, приблизительно 425 пM, приблизительно 450 пM, приблизительно 475 пM, приблизительно 500 пM, приблизительно 525 пM, приблизительно 550 пM, приблизительно 575 пM, приблизительно 600 пM, приблизительно 625 пM, приблизительно 650 пM, приблизительно 675 пM, приблизительно 700 пM, приблизительно 725 пM, приблизительно 750 пM, приблизительно 775 пM, приблизительно 800 пM, приблизительно 825 пM, приблизительно 850 пM, приблизительно 875 пM, приблизительно 900 пM, приблизительно 925 пM, приблизительно 950 пM, приблизительно 975 пM, приблизительно 1 нM, приблизительно 1,1 нM, приблизительно 1,2 нM, приблизительно 1,3 нM, приблизительно 1,4 нM, приблизительно 1,5 нM, приблизительно 1,6 нM, приблизительно 1,7 нM, приблизительно 1,8 нM, приблизительно 1,9 нM или приблизительно 2 нM). В некоторых случаях антитело связывается с антигеном (например, hVEGF) с Kd от приблизительно 75 пМ до приблизительно 600 пM (например, приблизительно 75 пM, приблизительно 100 пM, приблизительно 125 пM, приблизительно 150 пM, приблизительно 175 пM, приблизительно 200 пM, приблизительно 225 пM, приблизительно 250 пM, приблизительно 275 пM, приблизительно 300 пM, приблизительно 325 пM, приблизительно 350 пM, приблизительно 375 пM, приблизительно 400 пM, приблизительно 425 пM, приблизительно 450 пM, приблизительно 475 пM, приблизительно 500 пM, приблизительно 525 пM, приблизительно 550 пM, приблизительно 575 пM, приблизительно 600 пM). В некоторых случаях антитело связывается с антигеном (например, hVEGF) с Kd от приблизительно 75 пM до приблизительно 500 пM. В некоторых случаях антитело связывается с антигеном (например, hVEGF) с Kd от приблизительно 75 пM до приблизительно 400 пM. В некоторых случаях антитело связывается с антигеном (например, hVEGF) с Kd от приблизительно 75 пM до приблизительно 300 пM. В некоторых случаях антитело связывается с антигеном (например, hVEGF) с Kd от приблизительно 75 пM до приблизительно 200 пM. В некоторых случаях антитело связывается с антигеном (например, hVEGF) с Kd от приблизительно 75 пM до приблизительно 150 пM. В некоторых случаях антитело связывается с антигеном (например, hVEGF) с Kd от приблизительно 75 пM до приблизительно 125 пM. В некоторых случаях антитело связывается с антигеном (например, hVEGF) с Kd от приблизительно 75 пM до приблизительно 100 пM. В некоторых случаях антитело связывается с антигеном (например, hVEGF) с Kd, составляющей приблизительно 80 пM. В некоторых случаях антитело связывается с антигеном (например, hVEGF) с Kd, составляющей приблизительно 60 пM. В некоторых случаях антитело связывается с антигеном (например, hVEGF) с Kd, составляющей приблизительно 40 пM.
[428] Согласно одному варианту осуществления Kd измеряют с помощью анализа связывания антигена с радиоактивной меткой (RIA). Согласно одному варианту осуществления RIA выполняют с Fab-версией представляющего интерес антитела и его антигена. Например, аффинность связывания раствора Fab к антигену измеряют путем уравновешивания Fab с минимальной концентрацией (125I)-меченного антигена в присутствии серии титрования немеченого антигена, затем захвата связанного антигена планшетом, покрытым антителом к Fab (см., например, Chen et al., J. Mol. Biol. 293: 865-881 (1999)). Чтобы установить условия для анализа, многолуночные планшеты MICROTITER® (Thermo Scientific) покрывают в течение ночи 5 мкг/мл захватывающего антитела к Fab (Cappel Labs) в 50 мМ карбонате натрия (pH 9,6), а затем блокируют с помощью 2% (масс./об.) бычьего сывороточного альбумина (BSA) в фосфатно-солевом буфере (PBS) в течение двух-пяти часов при комнатной температуре (приблизительно 23°C). В неадсорбирующем планшете (Nunc # 269620) 100 пМ или 26 пМ [125I]-антигена смешивают с серийными разведениями представляющего интерес Fab (например, в соответствии с оценкой антитела к VEGF, Fab-12, в Presta et al., Cancer Res. 57: 4593-4599 (1997)). Представляющий интерес Fab затем инкубируют в течение ночи; однако инкубация может продолжаться в течение более длительного периода (например, приблизительно 65 часов), чтобы обеспечить достижение равновесия. После этого смеси переносят в планшет для захвата для инкубации при комнатной температуре (например, в течение одного часа). Затем раствор удаляют и планшет промывают восемь раз 0,1% полисорбатом 20 (TWEEN-20®) в PBS. Когда планшеты высохнут, добавляют 150 мкл на лунку сцинтилляционной жидкости (MICROSCINT-20™; Packard), и планшеты подсчитывают на счетчике гамма-излучения TOPCOUNT™ (Packard) в течение десяти минут. Концентрации каждого Fab, которые дают меньше чем или равное 20% максимального связывания, выбирают для использования в анализах конкурентного связывания.
[429] Согласно другому варианту осуществления Kd измеряют с использованием анализа поверхностного плазмонного резонанса BIACORE®. Например, анализ с использованием BIACORE®-2000 или BIACORE®-3000 (BIAcore, Inc., Piscataway, NJ) проводят при 25°C с использованием иммобилизованных чипов антигена CM5 при ~ 10 единицах ответа (RU). Согласно одному варианту осуществления чипы карбоксиметилированного декстранового биосенсора (CM5, BIAcore, Inc.) активируют N-этил-N’-(3-диметиламинопропил)-карбодиимидгидрохлоридом (EDC) и N-гидроксисукцинимидом (NHS) в соответствии с инструкциями поставщика. Антиген разбавляют 10 мМ ацетатом натрия, рН 4,8, до 5 мкг/мл (~ 0,2 мкМ) перед инъекцией со скоростью потока 5 мкл/мин, чтобы получить приблизительно 10 единиц ответа (RU) связанного белка. После инъекции антигена 1 М этаноламин вводят с помощью инъекции для блокирования непрореагировавших групп. Для измерения кинетики в PBS вводят двукратные серийные разведения Fab (от 0,78 нМ до 500 нМ) с 0,05% поверхностно-активного вещества полисорбата 20 (TWEEN-20™) (PBST) при 25°C при скорости потока приблизительно 25 мкл/мин. Скорости ассоциации (kon) и скорости диссоциации (koff) рассчитывают с использованием простой взаимнооднозначной модели связывания Ленгмюра (BIACORE® Evaluation Software, версия 3.2) путем одновременного подбора сенсограмм ассоциации и диссоциации. Равновесную константу диссоциации (Kd) рассчитывают как отношение koff/kon. См., например, Chen et al., J. Mol. Biol. 293: 865-881 (1999). Если скорость ассоциации превышает 106 М-1 с-1 с помощью анализа поверхностного плазмонного резонанса, описанного выше, то скорость ассоциации можно определить с помощью техники флуоресцентного гашения, в которой измеряют увеличение или уменьшение интенсивности флуоресцентного излучения (возбуждение = 295 нм; испускание = 340 нм, полоса пропускания 16 нм) при 25°С 20 нМ антитела к антигену (в форме Fab) в PBS, рН 7,2, в присутствии возрастающих концентраций антигена, как измерено в спектрометре, таком как оборудованный остановкой потока спектрофотометр (Aviv Instruments) или спектрофотометр SLM-AMINCO™ серии 8000 (ThermoSpectronic) с кюветой с мешалкой.
Раздел 2: Стабильность антитела
[430] В некоторых случаях антитело, используемое в конъюгатах антител согласно настоящему изобретению или их композициях, характеризуется усиленной стабильностью, например, по сравнению с антителом к VEGF, например, G6.31 (см., например, патент США № 7758859 и международная патентная публикация № WO 2005/012359, которые полностью включены в настоящий документ посредством ссылки). Стабильность антитела можно определить с использованием любого способа, известного в настоящей области техники, например, следующего: дифференциальная сканирующая флуориметрия (DSF), круговой дихроизм (CD), собственная флуоресценция белка, дифференциальная сканирующая калориметрия, спектроскопия, рассеяние света (например, динамическое рассеяние света (DLS) и статическое рассеяние света (SLS), хроматография с самовзаимодействием (SIC). Антитело к VEGF может характеризоваться, например, повышенной температурой плавления (Tm), температурой агрегации (Tagg) или другими показателями стабильности по сравнению с антителом к VEGF, например, G6.31.
[431] Согласно определенным вариантам осуществления антитело, предусмотренное в настоящем документе, характеризуется значением Tm, которое больше или равно приблизительно 80°C (например, приблизительно 81°C, приблизительно 82°C, приблизительно 83°C, приблизительно 84°C, приблизительно 85°C, приблизительно 86°C, приблизительно 87°C, приблизительно 88°C, приблизительно 89°C, приблизительно 90°C, приблизительно 91°C, приблизительно 92°C или приблизительно 93°C). Например, в некоторых случаях антитело к VEGF характеризуется значением Tm, которое больше или равно приблизительно 83,5°C (например, приблизительно 83,5°C, приблизительно 84°C, приблизительно 85°C, приблизительно 86°C, приблизительно 87°C, приблизительно 88°C, приблизительно 89°C, приблизительно 90°C, приблизительно 91°C, приблизительно 92°C или приблизительно 93°C). В некоторых случаях антитело к VEGF характеризуется значением Tm, которое составляет от приблизительно 82°C до приблизительно 92°C (например, приблизительно 82°C, приблизительно 83°C, приблизительно 84°C, приблизительно 85°C, приблизительно 86°C, приблизительно 87°C, приблизительно 88°C, приблизительно 89°C, приблизительно 90°C, приблизительно 91°C или приблизительно 92°C). В некоторых случаях антитело к VEGF характеризуется значением Tm, которое составляет приблизительно 82°C. В некоторых случаях любое из перечисленных выше значений Tm антитела к VEGF определяют с использованием DSF. Согласно некоторым вариантам осуществления значение Tm антитела к VEGF определяют, как описано, например, в примере 1 международной патентной заявки № PCT/US2016/053454, которая полностью включена в настоящий документ посредством ссылки.
Раздел 3: Фрагменты антител
[432] Согласно определенным вариантам осуществления антитело, предусмотренное в настоящем документе, представляет собой фрагмент антитела. Фрагменты антител включают в себя без ограничения фрагменты Fab, Fab’, Fab-C, Fab’-SH, F(ab’)2, Fv и scFv и другие фрагменты, описанные ниже. Для обзора определенных фрагментов антител см. Hudson et al., Nat. Med. 9:129-134 (2003). Для обзора фрагментов scFv см., например, Pluckthün, в The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., (Springer-Verlag, New York), pp. 269-315 (1994); см. также WO 93/16185; и патенты США №№ 5571894 и 5587458. Для обсуждения фрагментов Fab и F(ab’)2, содержащих остатки эпитопа связывания рецептора реутилизации и характеризующихся увеличенным in vivo периодом полужизни, см. патент США № 5869046.
[433] Диатела представляют собой фрагменты антител с двумя антигенсвязывающими сайтами, которые могут являться бивалентными или биспецифическими. См., например, EP 404,097; WO 1993/01161; Hudson et al., Nat. Med. 9:129-134 (2003); и Hollinger et al., Proc. Natl. Acad. Sci. USA 90: 6444-6448 (1993). Триатела и тетратела также описаны в Hudson et al., Nat. Med. 9:129-134 (2003).
[434] Однодоменные антитела представляют собой фрагменты антител, содержащие весь вариабельный домен тяжелой цепи антитела или его часть или весь вариабельный домен легкой цепи антитела или его часть. Согласно определенным вариантам осуществления однодоменное антитело представляет собой однодоменное антитело человека (Domantis, Inc., Waltham, MA; см., например, патент США № 6248516 B1).
[435] Фрагменты антител можно получить с помощью различных техник, включая в себя без ограничения протеолитическое расщепление интактного антитела, а также продукцию рекомбинантными клетками-хозяевами (например, кишечной палочкой или фагом), как описано в настоящем документе.
Раздел 4: Химерные и гуманизированные антитела
[436] Согласно определенным вариантам осуществления антитело, предусмотренное в настоящем документе, представляет собой химерное антитело. Определенные химерные антитела описаны, например, в патенте США № 4816567; и Morrison et al., Proc. Natl. Acad. Sci. USA, 81:6851-6855 (1984). Согласно одному примеру химерное антитело содержит не относящуюся к человеку вариабельную область (например, вариабельный домен, полученный от мыши, крысы, хомячка, кролика или не являющегося человеком примата, такого как обезьяна) и константный домен человека. Согласно дополнительному примеру химерное антитело представляет собой антитело “с переключенным классом”, в котором класс или подкласс был изменен по сравнению с исходным антителом. Химерные антитела включают в себя их антигенсвязывающие фрагменты.
[437] Согласно определенным вариантам осуществления химерное антитело представляет собой гуманизированное антитело. Как правило, не относящееся к человеку антитело гуманизируют для снижения иммуногенности в отношении организма человека, при этом сохраняя специфичноть и аффинность исходного не относящегося к человеку антитела. Как правило, гуманизированное антитело содержит один или несколько вариабельных доменов, в которых HVR, например, CDR (или их части) происходят из не относящегося к человеку антитела, а FR (или их части) происходят из последовательностей антитела человека. Гуманизированное антитело необязательно будет также содержать по меньшей мере часть константной области человека. Согласно некоторым вариантам осуществления некоторые остатки FR в гуманизированном антителе замещены соответствующими остатками из не относящегося к человеку антитела (например, антитела, из которого происходят остатки HVR), например, для восстановления или улучшения специфичности или аффинности антитела.
[438] Гуманизированные антитела и способы их получения представлены в обзорах, например, в Almagro and Fransson, Front. Biosci. 13:1619-1633 (2008), и дополнительно описаны, например, в Riechmann et al., Nature 332:323-329 (1988); Queen et al., Proc. Nat’l Acad. Sci. USA 86:10029-10033 (1989); патентах США №№ 5821337, 7527791, 6982321 и 7087409; Kashmiri et al., Methods 36:25-34 (2005) (где описано получение привитых определяющих специфичность областей (SDR)); Padlan, Mol. Immunol. 28:489-498 (1991) (где описано “изменение поверхности”); Dall’Acqua et al., Methods 36:43-60 (2005) (где описана “перестановка FR”); и Osbourn et al., Methods 36:61-68 (2005) и Klimka et al., Br. J. Cancer, 83:252-260 (2000) (где описан подход “направленной селекции” к перестановке FR).
[439] Каркасные области человека, которые можно использовать для гуманизации, включают в себя без ограничения: каркасные области, выбранные с использованием способа “максимального соответствия” (см., например, Sims et al., J. Immunol. 151:2296 (1993)); каркасные области, происходящие из консенсусной последовательности антител человека конкретной подгруппы вариабельных областей легкой или тяжелой цепи (см., например, Carter et al., Proc. Natl. Acad. Sci. USA, 89:4285 (1992); и Presta et al., J. Immunol., 151:2623 (1993)); зрелые (соматически мутированные) каркасные области человека или каркасные области зародышевой линии человека (см., например, Almagro and Fransson, Front. Biosci. 13:1619-1633 (2008)); и каркасные области, полученные из скрининга библиотек FR (см., например, Baca et al., J. Biol. Chem. 272:10678-10684 (1997) и Rosok et al., J. Biol. Chem. 271:22611-22618 (1996)).
Раздел 5: Полученные из библиотек антитела
[440] Антитела согласно настоящему изобретению можно выделить путем скрининга комбинаторных библиотек в отношении антител с требуемой активностью или активностями. Например, в настоящей области техники известны различные способы создания библиотек фагового дисплея и скрининга таких библиотек на наличие антител, обладающих требуемыми характеристиками связывания. Такие способы рассмотрены, например, в Hoogenboom et al., в Methods in Molecular Biology 178:1-37 (O’Brien et al., ed., Human Press, Totowa, NJ, 2001) и дополнительно описаны, например, в McCafferty et al., Nature 348:552-554; Clackson et al., Nature 352: 624-628 (1991); Marks et al., J. Mol. Biol. 222: 581-597 (1992); Marks and Bradbury, в Methods in Molecular Biology 248:161-175 (Lo, ed., Human Press, Totowa, NJ, 2003); Sidhu et al., J. Mol. Biol. 338(2): 299-310 (2004); Lee et al., J. Mol. Biol. 340(5): 1073-1093 (2004); Fellouse, Proc. Natl. Acad. Sci. USA 101(34): 12467-12472 (2004); и Lee et al., J. Immunol. Methods 284(1-2): 119-132(2004).
[441] В некоторых способах с использованием фагового дисплея репертуары генов VH и VL по отдельности клонируют с помощью полимеразной цепной реакции (ПЦР) и случайным образом рекомбинируют в фаговых библиотеках, которые затем можно подвергать скринингу в отношении антигенсвязывающего фага, как описано в Winter et al., Ann. Rev. Immunol., 12: 433-455 (1994). Фаг, как правило, содержит фрагменты антител, либо в виде одноцепочечных фрагментов Fv (scFv), либо в виде фрагментов Fab. Библиотеки из иммунизированных источников предоставляют высокоаффинные антитела к иммуногену без необходимости конструирования гибридом. Альтернативно, наивный репертуар можно клонировать (например, от человека) для обеспечения единого источника антител к широкому спектру не собственных, а также собственных антигенов без какой-либо иммунизации, как описано Griffiths et al., EMBO J, 12: 725-734 (1993). Наконец, наивные библиотеки также можно создать синтетически путем клонирования неаранжированных V-генных сегментов из стволовых клеток и использования ПЦР-праймеров, содержащих случайную последовательность, для кодирования в высокой степени вариабельных областей CDR3 и для осуществления реаранжировки in vitro, как описано в Hoogenboom and Winter, J. Mol. Biol., 227: 381-388 (1992). Патентные публикации, описывающие фаговые библиотеки антител человека, включают в себя, например: патент США № 5750373 и патентные публикации США №№ 2005/0079574, 2005/0119455, 2005/0266000, 2007/0117126, 2007/0160598, 2007/0237764, 2007/0292936 и 2009/0002360.
[442] Антитела или фрагменты антител можно получить из фаговых библиотек, как описано в международной патентной заявке № PCT/US2016/053454.
[443] Антитела или фрагменты антител, выделенные из библиотек антител человека, рассматриваются в настоящем документе как антитела человека или фрагменты антител человека.
Раздел 6: Мультиспецифические антитела
[444] Согласно определенным вариантам осуществления антитело, предусмотренное в настоящем документе, представляет собой мультиспецифическое антитело, например, биспецифическое антитело. Мультиспецифические антитела представляют собой моноклональные антитела, которые характеризуются специфичностями связывания в отношении по меньшей мере двух различных сайтов. Согласно определенным вариантам осуществления одна из специфичностей связывания представляет собой специфичность связывания по отношению к VEGF, а другая - по отношению к любому другому антигену (например, следующему: вторая биологическая молекула, например, интерлейкин-1 бета (IL-1β); интерлейкин-6 (IL-6); рецептор интерлейкина-6 (IL-6R); интерлейкин-13 (IL-13); рецептор IL-13 (IL-13R); PDGF (например, PDGF-BB); ангиопоэтин; ангиопоэтин 2 (Ang2); Tie2; S1P; интегрины αvβ3, αvβ5 и α5β1; бетацеллюлин; апелин/APJ; эритропоэтин; фактор комплемента D; TNFα; HtrA1; рецептор VEGF (например, VEGFR1, VEGFR2, VEGFR3, мембраносвязанный рецептор VEGF (mbVEGFR) или растворимый рецептор VEGF (sVEGFR)); рецептор ST-2; и белки, генетически связанные с риском возрастной макулярной дегенерации (AMD), такие как компоненты пути комплемента C2 фактор B, фактор H, CFHR3, C3b, C5, C5a и C3a; HtrA1; ARMS2; TIMP3; HLA; интерлейкин-8 (IL-8); CX3CR1; TLR3; TLR4; CETP; LIPC; COL10A1 и TNFRSF10A. Соответственно, биспецифическое антитело может характеризоваться специфичностью связывания в отношении следующего: VEGF и IL-1β; VEGF и IL-6; VEGF и IL-6R; VEGF и IL-13; VEGF и IL-13R; VEGF и PDGF (например, PDGF-BB); VEGF и ангиопоэтин; VEGF и Ang2; VEGF и Tie2; VEGF и S1P; VEGF и интегрин αvβ3; VEGF и интегрин αvβ5; VEGF и интегрин α5β1; VEGF и бетацеллюлин; VEGF и апелин/APJ; VEGF и эритропоэтин; VEGF и фактор комплемента D; VEGF и TNFα; VEGF и HtrA1; VEGF и рецептор VEGF (например, VEGFR1, VEGFR2, VEGFR3, mbVEGFR или sVEGFR); VEGF и рецептор ST-2; VEGF и C2; VEGF и фактор B; VEGF и фактор H; VEGF и CFHR3; VEGF и C3b; VEGF и C5; VEGF и C5a; VEGF и C3a; VEGF и ARMS2; VEGF и TIMP3; VEGF и HLA; VEGF и IL-8; VEGF и CX3CR1; VEGF и TLR3; VEGF и TLR4; VEGF и CETP; VEGF и LIPC; VEGF и COL10A1 или VEGF и TNFRSF10A. Согласно определенным вариантам осуществления биспецифические антитела могут связываться с двумя различными эпитопами VEGF. Биспецифические антитела также можно использовать для локализации цитотоксических средств в клетках, которые экспрессируют VEGF. Биспецифические антитела можно получить в виде полноразмерных антител или фрагментов антител (например, фрагментов Fab, Fab’ или Fab-C).
[445] В некоторых случаях биспецифическое антитело представляет собой биспецифическое антитело к VEGF/к ангиопоэтину 2 (Ang2), раскрытое в заявке на выдачу патента США № US 2014/0017244, которая полностью включена в настоящий документ посредством ссылки. Например, биспецифическое антитело к VEGF/к Ang2 может включать в себя первый связывающий домен, который связывается с VEGF (такой как любое из антител к VEGF, описанных в настоящем документе), и второй связывающий домен, который связывается с Ang2, который включает в себя следующее: (a) HVR-H1, содержащая аминокислотную последовательность согласно GYYMH (SEQ ID NO: 61); (b) HVR-H2, содержащая аминокислотную последовательность согласно WINPNSGGTNYAQKFQG (SEQ ID NO: 62); (c) HVR-H3, содержащая аминокислотную последовательность согласно SPNPYYYDSSGYYYPGAFDI (SEQ ID NO: 63); (d) HVR-L1, содержащая аминокислотную последовательность согласно GGNNIGSKSVH (SEQ ID NO: 64); (e) HVR-L2, содержащая аминокислотную последовательность согласно DDSDRPS (SEQ ID NO: 65); и (f) HVR-L3, содержащая аминокислотную последовательность согласно QVWDSSSDHWV (SEQ ID NO: 66), или комбинацию одной или нескольких представленных выше HVR и одного или нескольких их вариантов, характеризующихся по меньшей мере приблизительно 80% идентичности последовательности (например, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности) по отношению к любой из SEQ ID NO: 61-66.
[446] В некоторых случаях биспецифическое антитело к VEGF/к Ang2 может включать в себя первый связывающий домен, который связывается с VEGF (такой как любое из антител к VEGF, описанных в настоящем документе) и второй связывающий домен, который связывается с Ang2 В некоторых случаях биспецифическое антитело к VEGF/к Ang2 может включать в себя первый связывающий домен, который связывается с VEGF (такой как любое из антител к VEGF, описанных в настоящем документе) и второй связывающий домен, который специфически связывается с Ang2, где второй связывающий домен представляет собой любой связывающий домен антитела, описанный в международной патентной публикации № WO 2010/069532, которая полностью включена в настоящий документ посредством ссылки, или его вариант.
[447]В других случаях биспецифическое антитело к VEGF/к Ang2 представляет собой любое биспецифическое антитело к VEGF/к Ang2, описанное в международной патентной публикации № WO 2016/073157.
[448] В некоторых случаях биспецифическое антитело представляет собой биспецифическое антитело к VEGF/к IL-6. В некоторых случаях биспецифическое антитело к VEGF/к IL-6 может включать в себя первый связывающий домен, который связывается с VEGF (такой как любое из антител к VEGF, описанных в настоящем документе) и второй связывающий домен, который связывается с IL-6. Второй связывающий домен может представлять собой связывающий домен любого антитела к IL-6, известного в настоящей области техники, например, EBI-031 (Eleven Biotherapeutics; см., например, WO 2016/073890, которая полностью включена в настоящий документ посредством ссылки), силтуксимаб (SYLVANT®), олокизумаб, клазакизумаб, сирукумаб, элсилимомаб, герилимзумаб, OPR-003, MEDI-5117, PF-04236921 или их вариант.
[449] В некоторых случаях биспецифическое антитело представляет собой биспецифическое антитело к VEGF/к IL-6R. В некоторых случаях биспецифическое антитело к VEGF/к IL-6R может включать в себя первый связывающий домен, который связывается с VEGF (такой как любое из антител к VEGF, описанных в настоящем документе) и второй связывающий домен, который связывается с IL-6R. Второй связывающий домен может представлять собой связывающий домен любого антитела к IL-6R, известного в настоящей области техники, например, тоцилизумаб (ACTEMRA®) (см., например, WO 1992/019579, которая полностью включена в настоящий документ посредством ссылки), сарилумаб, вобарилизумаб (ALX-0061), SA-237 или их вариант.
[450] Техники получения мультиспецифических антител включают в себя без ограничения рекомбинантную коэкспрессию двух пар тяжелой цепи-легкой цепи иммуноглобулина с различными специфичностями (см. Milstein And Cuello, Nature 305: 537 (1983)), WO 93/08829 и Traunecker et al., EMBO J. 10: 3655 (1991)), и конструирование структуры “выступ-во-впадину” (см., например, патент США № 5731168). Мультиспецифические антитела также можно получить путем конструирования белков с использованием эффекта электростатического взаимодействия для получения Fc-гетеродимерных молекул антител (WO 2009/089004A1); поперечного сшивания двух или более антител или фрагментов (см., например, патент США № 4676980 и Brennan et al., Science, 229: 81 (1985)); использования лейциновых молний для получения биспецифических антител (см., например, Kostelny et al., J. Immunol., 148(5): 1547-1553 (1992)); использования технологии “диатела” для получения фрагментов биспецифических антител (см., например, Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993)); и использования одноцепочечных димеров Fv (sFv) (см., например, Gruber et al., J. Immunol., 152:5368 (1994)); и получения триспецифических антител, как описано, например, в Tutt et al., J. Immunol. 147:60 (1991).
[451] Сконструированные антитела с тремя или более функциональными антигенсвязывающими сайтами, включая в себя антитела-“осьминоги”, также включены в настоящий документ (см., например, US 2006/0025576A1).
[452] Антитело или фрагмент в настоящем документе также включает в себя “Fab двойного действия” или “DAF”, содержащую антигенсвязывающий сайт, который связывается с VEGF, а также другим, отличающимся антигеном (см., например, US 2008/0069820).
Раздел 7: Варианты антител
[453] Согласно определенным вариантам осуществления предусмотрены варианты аминокислотной последовательности (например, варианты антител, включая в себя одну или несколько замен аминокислотных остатков) антител, предусмотренных в настоящем документе. Например, может быть желательно улучшить аффинность связывания и/или другие биологические свойства антитела. Варианты аминокислотной последовательности антитела можно получить путем введения соответствующих модификаций в нуклеотидную последовательность, кодирующую антитело, или путем пептидного синтеза. Такие модификации включают в себя, например, делеции, и/или вставки, и/или замены остатков в аминокислотных последовательностях антитела. Любую комбинацию делеции, вставки и замены можно осуществить для достижения конечного конструкта, при условии, что конечный конструкт обладает требуемыми характеристиками, например, связыванием антигена.
(a) Варианты замен, вставок и делеций
[454] Согласно определенным вариантам осуществления предусмотрены варианты антител с одной или несколькими аминокислотными заменами. Представляющие интерес сайты для заместительного мутагенеза включают в себя области HVR и FR. Консервативные замены показаны в таблице 1 под заголовком “предпочтительные замены”. Более существенные изменения представлены в таблице 1 под заголовком “иллюстративные замены”, и как дополнительно описано ниже со ссылкой на классы аминокислотных боковых цепей. Аминокислотные замены можно ввести в представляющее интерес антитело и продукты подвергнуть скринингу в отношении требуемой активности, например, сохраненного/улучшенного связывания с антигеном, сниженной иммуногенности или других функциональных признаков, например, стабильности или эффекторной функции.
Таблица 1
остаток
[455] Аминокислоты можно разделить на группы в соответствии с общими свойствами боковых цепей: (1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile; (2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln; (3) кислые: Asp, Glu; (4) основные: His, Lys, Arg; (5) остатки, которые влияют на ориентацию цепи: Gly, Pro; (6) ароматические: Trp, Tyr, Phe; Неконсервативные замены повлекут за собой замену представителя одного из этих классов на другой класс.
[456] Один тип заместительного варианта включает в себя замену одного или нескольких остатков гипервариабельной области и/или остатков FR исходного антитела (например, гуманизированного антитела). Как правило, полученный(е) вариант(ы), выбранный(е) для дальнейшего исследования, будет(будут) содержать модификации (например, улучшения) в определенных биологических свойствах (например, повышенная аффинность, повышенная стабильность, повышенная экспрессия, измененный pI и/или пониженная иммуногенность) относительно исходного антитела и/или будет(будут) в значительной степени сохранять определенные биологические свойства исходного антитела. Иллюстративный заместительный вариант представляет собой антитело с созревшей аффинностью, которое можно успешно создать, например, с использованием техник созревания аффинности на основе фагового дисплея, таких как описанные в настоящем документе. Вкратце, один или несколько остатков HVR мутируют, и варианты антител “отображаются” на фаге и их подвергают скринингу в отношении определенной биологической активности (например, аффинности связывания).
[457] Изменения (например, замены) можно произвести в HVR, например, для улучшения сродства антитела. Такие изменения можно произвести в “горячих точках мутагенеза” HVR, т.е. остатках, кодируемых кодонами, которые подвергаются мутации с высокой частотой во время процесса соматического созревания (см., например, Chowdhury, Methods Mol. Biol. 207:179-196 (2008)), и/или в остатках, которые связываются с антигеном, причем полученную вариантную VH или VL испытывают в отношении аффинности связывания. Созревание аффинности путем конструирования и повторного выбора из вторичных библиотек было описано, например, в Hoogenboom et al., в Methods in Molecular Biology 178:1-37 (O'Brien et al., Ed. Human Press, Totowa, NJ, (2001)). Согласно некоторым вариантам осуществления аффинного созревания разнообразие вводят в вариабельные гены, выбранные для созревания любым из множества способов (например, ПЦР с повышенной частотой ошибок, перетасовка цепи или олигонуклеотид-направленный мутагенез). Затем создают вторичную библиотеку. Затем библиотеку подвергают скринингу для выявления любых вариантов антител с требуемой аффинностью. Другой способ введения разнообразия включает в себя HVR-ориентированные подходы, в которых несколько остатков HVR (например, 4-6 остатков за раз) рандомизируют. Остатки HVR, участвующие в связывании антигена, можно конкретно идентифицировать, например, с использованием сканирующего аланином мутагенеза или моделирования. CDR-H3 и CDR-L3, в частности, часто являются мишенями.
[458] Согласно определенным вариантам осуществления замены, вставки или делеции могут происходить в одной или нескольких HVR, при условии, что такие изменения существенно не снижают способность антитела связываться с антигеном. Например, консервативные изменения (например, консервативные замены, как предусмотрено в настоящем документе), которые существенно не снижают аффинность связывания, можно осуществить в HVR. Такие изменения могут, например, находиться вне антигенсвязывающих остатков в HVR. Согласно определенным вариантам осуществления из вариантных последовательностей VH и VL, представленных выше, каждая HVR либо не изменяется, либо содержит не более одной, двух или трех аминокислотных замен.
[459] Согласно определенным вариантам осуществления замены, вставки или делеции могут происходить в одной или нескольких FR, если такие изменения существенно не снижают способность антитела связываться с антигеном. Такие изменения могут, например, улучшать аффинность и/или стабильность антител (например, при оценке по повышенной температуре плавления).
[460] Применимый способ идентификации остатков или областей антитела, которые могут являться мишенью для мутагенеза, называется “сканирующим аланином мутагенезом”, как описано Cunningham and Wells (1989) Science, 244:1081-1085. В этом способе остаток или группа целевых остатков (например, заряженные остатки, такие как Arg, Asp, His, Lys и Glu) идентифицируют и заменяют нейтральной или отрицательно заряженной аминокислотой (например, аланином или полиаланином) для определения того, затрагивается ли взаимодействие антитела с антигеном. Дополнительные замены можно вводить в положениях аминокислот, демонстрирующих функциональную чувствительность к начальным заменам. Альтернативно или дополнительно, кристаллическую структуру комплекса антиген-антитело определяют для идентификации точек контакта между антителом и антигеном. Такие контактные остатки и соседние остатки могут являться мишенями или же их можно исключить в качестве кандидатов для замены. Варианты можно подвергнуть скринингу для определения того, содержат ли они требуемые свойства.
[461] Вставки аминокислотной последовательности включают в себя слияния на амино- и/или карбокси-конце длиной от одного остатка до полипептидов, содержащих сто или более остатков, а также вставки внутри последовательности одного или нескольких аминокислотных остатков. Примеры концевых вставок включают в себя антитело с N-концевым метионильным остатком. Другие варианты со вставками для молекулы антитела включают в себя слияние с N- или C-концом антитела с ферментом (например, для ADEPT) или полипептидом, который увеличивает период полужизни антитела в сыворотке.
(b) Варианты изоэлектрических точек
[462] Настоящее изобретение относится к вариантам антител с измененными изоэлектрическими точками. Например, настоящее изобретение относится к варианты антител с пониженной изоэлектрической точкой (pI), например, по сравнению с антителом к VEGF, например, G6.31. В некоторых случаях поверхностный заряд уменьшается при физиологическом pH. В некоторых случаях антитело к VEGF характеризуется значением pI, равным или ниже чем приблизительно 8 (например, приблизительно 8, приблизительно 7, приблизительно 6, приблизительно 5 или приблизительно 4). В некоторых случаях антитело характеризуется значением pI от приблизительно 4 до приблизительно 8 (например, приблизительно 4, приблизительно 5, приблизительно 6, приблизительно 7 или приблизительно 8). В некоторых случаях антитело к VEGF характеризуется значением pI от приблизительно 5 до приблизительно 7 (например, приблизительно 5, приблизительно 6 или приблизительно 7). В некоторых случаях антитело к VEGF характеризуется значением pI от приблизительно 5 до приблизительно 6 (например, приблизительно 5,1, приблизительно 5,2, приблизительно 5,3, приблизительно 5,4, приблизительно 5,5, приблизительно 5,6, приблизительно 5,7, приблизительно 5,8, приблизительно 5,9 или приблизительно 6).
[463] Антитела согласно настоящему изобретению можно сконструировать так, чтобы они характеризовались пониженным значением pI, например, путем замены аминокислотных остатков дикого типа в данном положении аминокислотой, характеризующейся более низким значением pI. pI аминокислоты можно определить на основе значений pKa амина (-NH2), карбоновой кислоты (-COOH) и боковой цепи аминокислоты, которые известны в настоящей области техники. Согласно некоторым вариантам осуществления экспонированные на поверхности аминокислотные остатки можно заменить для снижения pI антитела. Согласно одному варианту осуществления экспонированные на поверхности аминокислотные остатки можно заменить глутаматом (Е). Согласно одному варианту осуществления экспонированные на поверхности аминокислотные остатки можно заменить аспартатом (D).
Рекомбинантные способы и композиции
[464] Любое из антител (например, антител к VEGF), описанных в настоящем документе, можно получить с использованием рекомбинантных способов и композиций, например, как описано в патенте США № 4816567. Согласно одному варианту осуществления предусмотрена выделенная нуклеиновая кислота, кодирующая антитело к VEGF, описанное в настоящем документе. Такая нуклеиновая кислота может кодировать аминокислотную последовательность, содержащую VL, и/или аминокислотную последовательность, содержащую VH антитела (например, легкие и/или тяжелые цепи антитела). Согласно дополнительному варианту осуществления предусмотрен один или несколько векторов (например, экспрессионных векторов), содержащих такую нуклеиновую кислоту. Согласно дополнительному варианту осуществления предусмотрена клетка-хозяин, содержащая такую нуклеиновую кислоту. Согласно одному такому варианту осуществления клетка-хозяин содержит следующее (например, была трансформирована следующим): (1) вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VL антитела, и аминокислотную последовательность, содержащую VH антитела, или (2) первый вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VL антитела, и второй вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VH антитела. Согласно одному варианту осуществления клетка-хозяин является эукариотической, например клеткой яичника китайского хомячка (СНО) или лимфоидной клеткой (например, клетка Y0, NS0, Sp20). Согласно одному варианту осуществления предусмотрен способ получения антитела к VEGF, где способ предусматривает культивирование клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую антитело, как указано выше, в условиях, подходящих для экспрессии антитела, и, при необходимости, извлечение антитела из клетки-хозяина (или среды культивирования клеток-хозяев).
[465] Для рекомбинантной продукции антитела (например, антитела к VEGF) нуклеиновую кислоту, кодирующую антитело, например, как описано выше, выделяют и встраивают в один или несколько векторов для дальнейшего клонирования и/или экспрессии в клетке-хозяине. Такую нуклеиновую кислоту можно легко выделить и секвенировать с использованием общепринятых процедур (например, с использованием олигонуклеотидных зондов, которые способны специфически связываться с генами, кодирующими тяжелые и легкие цепи антитела).
[466] Подходящие клетки-хозяева для клонирования или экспрессии кодирующих антитела векторов включают в себя прокариотические или эукариотические клетки, описанные в настоящем документе. Например, антитела могут продуцироваться в бактериях, в частности, когда гликозилирование и эффекторная функция Fc не являются необходимыми. В отношении экспрессии фрагментов антител и полипептидов в бактериях, см., например, патенты США №№ 5648237, 5789199 и 5840523. См. также Charlton, Methods in Molecular Biology, Vol. 248 (B.K.C. Lo, ed., Humana Press, Totowa, NJ, 2003), стр. 245-254, где описана экспрессия фрагментов антител в E. coli. После экспрессии антитело можно выделить из пасты бактериальных клеток в растворимой фракции и можно дополнительно очистить.
[467] В дополнение к прокариотам эукариотические микроорганизмы, такие как гифомицеты или дрожжи, являются подходящими хозяевами для клонирования или экспрессии для векторов, кодирующих антитела, включая в себя грибы и штаммы дрожжей, пути гликозилирования которых были “гуманизированы”, что приводит к образованию антитела с частичным или полностью человеческим профилем гликозилирования. См. Gerngross, Nat. Biotech. 22:1409-1414 (2004) и Li et al., Nat. Biotech. 24:210-215 (2006).
[468] Подходящие клетки-хозяева для экспрессии гликозилированного антитела также получены из многоклеточных организмов (беспозвоночных и позвоночных). Примеры клеток беспозвоночных включают в себя клетки растений и насекомых. Были идентифицированы многочисленные бакуловирусные штаммы, которые можно использовать вместе с клетками насекомых, особенно для трансфекции клеток Spodoptera frugiperda.
[469] Культуры растительных клеток также можно использовать в качестве хозяев. См., например, патенты США №№ 5959177, 6040498, 6420548, 7125978 и 6417429 (описывающие технологию PLANTIBODIES™ для получения антител в трансгенных растениях).
[470] Клетки позвоночных также можно использовать в качестве хозяев. Например, применимыми могут являться клеточные линии млекопитающих, которые адаптированы для роста в суспензии. Другими примерами применимых линий клеток-хозяев млекопитающих являются линия CV1 почек обезьян, трансформированная SV40 (COS-7); линия клеток почки эмбриона человека (клетки 293 или 293, как описано, например, в Graham et al., J. Gen Virol. 36:59 (1977)); клетки почки новорождённого хомяка (BHK); клетки сертоли мыши (клетки TM4, как описано, например, в Mather, Biol. Reprod. 23:243-251 (1980)); клетки почки обезьяны (CV1); клетки почки африканской зеленой мартышки (VERO-76); клетки карциномы шейки матки человека (HELA); клетки почки собаки (MDCK); клетки печени крысы линии Buffalo (BRL 3A); клетки легкого человека (W138); клетки печени человека (Hep G2); опухоль молочной железы мыши (MMT 060562); клетки TRI, как описано, например, в Mather et al. Annals NY Acad. Sci. 383:44-68 (1982); клетки MRC 5 и клетки FS4. Другие применимые линии клеток-хозяев млекопитающих включают в себя клетки яичника китайского хомячка (CHO), включая в себя клетки DHFR-CHO (Urlaub et al. , Proc. Natl. Acad. Sci. USA 77:4216 (1980)) и клеточные линии миеломы, такие как Y0, NS0 и Sp2/0. Обзор некоторых линий клеток-хозяев млекопитающих, подходящих для продуцирования антител, см., например, в Yazaki and Wu, Methods in Molecular Biology, том 248 (BKC Lo, ed., Humana Press, Totowa, NJ), стр. 255-268 (2003).
Анализы
[471] Антитела (например, описанные в настоящем документе антитела к VEGF), а также конъюгаты антител (например, конъюгаты антител, которые включают в себя антитела к VEGF (например, любое антитело к VEGF, предусмотренное в настоящем документе)), можно идентифицировать, подвергнуть скринингу или охарактеризоваться по их физическим/химическим свойствам и/или биологическим активностям с помощью различных анализов, известных в настоящей области техники.
(a) Анализы связывания и другие анализы
[472] Согласно одному аспекту антитело (например, антитело к VEGF) или его конъюгат антитела, испытывают в отношении его антигенсвязывающей активности, например, с помощью известных способов, таких как ELISA, вестерн-блоттинг и т.д.
[473] Согласно другому аспекту конкурентные анализы можно использовать для идентификации антитела, которое конкурирует с антителом, как описано в настоящем документе, или его конъюгатом антитела, за связывание с антигеном (например, VEGF). Согласно определенным вариантам осуществления такое конкурирующее антитело связывается с тем же эпитопом (например, линейным или конформационным эпитопом), который связан антителом, как описано в настоящем документе. Подробные иллюстративные способы картирования эпитопа, с которым связывается антитело, представлены в Morris (1996) “Epitope Mapping Protocols”, в Methods in Molecular Biology vol. 66 (Humana Press, Totowa, NJ).
[474] В одном из примеров конкурентного анализа иммобилизованный VEGF инкубируют в растворе, содержащем первое меченое антитело, которое связывается с VEGF, и второе немеченое антитело, которое испытывают в отношении его способности конкурировать с первым антителом за связывание с VEGF. Второе антитело может присутствовать в супернатанте гибридомы. В качестве контроля иммобилизованный VEGF инкубируют в растворе, содержащем первое меченое антитело, но не второе немеченое антитело. После инкубации в условиях, разрешающих связывание первого антитела с VEGF, избыток несвязанного антитела удаляют и измеряют количество метки, связанной с иммобилизованным VEGF. Если количество метки, связанной с иммобилизованным VEGF, существенно снижается в испытуемом образце относительно контрольного образца, то это указывает на то, что второе антитело конкурирует с первым антителом за связывание с VEGF. Подобные анализы можно выполнить для других антигенов. См. Harlow and Lane (1988) Antibodies: A Laboratory Manual ch.14 (Cold Spring Harbor Laboratory, Cold Spring Harbor, NY).
(b) Анализы активности
[475] Согласно одному аспекту предусмотрены нализы для идентификации антител (например, антител к VEGF), или их конъюгатов антител, характеризующихся биологической активностью. Биологическая активность может включать в себя, например, связывание с антигеном (например, VEGF (например, VEGF в кровотоке)), или его пептидным фрагментом, либо in vivo, in vitro, либо ex vivo. Согласно определенным вариантам осуществления биологическая активность может включать в себя блокирование или нейтрализацию антигена. Например, согласно определенным вариантам осуществления биологическая активность может включать в себя блокирование или нейтрализацию VEGF или предотвращение связывания VEGF с лигандом, например, с рецептором, таким как KDR или Flt-1. Кроме того, предусмотрены антитела или их конъюгаты антител, характеризующиеся такой биологической активностью in vivo и/или in vitro. Согласно определенным вариантам осуществления антитело согласно настоящему изобретению или его конъюгат антитела испытывают в отношении такой биологической активности.
(c) Анализы стабильности
[476] Согласно одному аспекту предусмотрены анализы для определения стабильности (например, термостабильности) антитела (например, антитела к VEGF) или его конъюгата антитела. Например, стабильность антитела или его конъюгата антитела можно определить с использованием любого способа, известного в настоящей области техники, например, дифференциальной сканирующей флуориметрии (DSF), кругового дихроизма (CD), собственной флуоресценции белка, дифференциальной сканирующей калориметрии, спектроскопии, рассеяния света (например, динамического рассеяния света (DLS) и статического рассеяния света (SLS), хроматографии с самовзаимодействием (SIC). Стабильность антитела или его конъюгата антитела можно определить, как описано в настоящем документе, например, с использованием DSF, как описано, например, в примерах 1 и 2 международной патентной заявки № PCT/US2016/053454. В некоторых случаях стабильность конъюгата антитела можно определить с помощью эксклюзионной хроматографии, проводимой совместно с детекторами показателя преломления и многоуглового светорассеяния (SEC-RI-MALS).
Терапевтические способы и композиции
[477] Любые антитела (например, антитела к VEGF) или их конъюгаты антител (например, конъюгаты гидрогеля поперечно-сшитой HA), предусмотренные в настоящем документе, можно использовать в терапевтических способах.
[478] Согласно одному аспекту предусмотрено антитело к VEGF для применения в качестве лекарственного средства. Согласно другому аспекту предусмотрен конъюгат антитела (например, конъюгат гидрогеля поперечно-сшитой HA) для применения в качестве лекарственного средства. Согласно дополнительным аспектам настоящее изобретение относится к антителу к VEGF для применения в лечении нарушения, ассоциированного с патологическим ангиогенезом. Согласно другому аспекту настоящее изобретение относится к конъюгату антитела (например, конъюгату гидрогеля поперечно-сшитой HA) для применения в лечении нарушения, ассоциированного с патологическим ангиогенезом. Согласно некоторым вариантам осуществления нарушение, ассоциированное с патологическим ангиогенезом, представляет собой офтальмологическое нарушение или нарушение клеточной пролиферации. В некоторых случаях офтальмологическое нарушение представляет собой следующее: AMD (например, влажная форма AMD, сухая форма AMD, промежуточная форма AMD, прогрессирующая форма AMD или географическая атрофия (GA)), макулярная дегенерация, макулярный отек, DME (например, очаговый, нецентровый DME или диффузный, DME с вовлечением центра макулы), ретинопатия, диабетическая ретинопатия (DR) (например, пролиферативная DR (PDR), непролиферативная DR (NPDR), или высотная DR), другие связанные с ишемией ретинопатии, ROP, окклюзия вен сетчатки (RVO) (например, центральная (CRVO) и разветвленная (BRVO) формы), CNV (например, миопическая CNV), неоваскуляризация роговицы, заболевание, ассоциированное с неоваскуляризацией роговицы, неоваскуляризация сетчатки, заболевание, ассоциированное с ретинальной/хориоидальной неоваскуляризацией, патологическая миопия, болезнь фон Хиппель-Линдау, гистоплазмоз глаза, FEVR, болезнь Коутса, болезнь Норри, OPPG, субконъюнктивальное кровоизлияние, рубеоз радужки, неоваскулярные заболевания глаз, неоваскулярная глаукома, пигментный ретинит (RP), гипертоническая ретинопатия, ангиоматозная пролиферация сетчатки, макулярная телеангиэктазия, неоваскуляризация радужки, внутриглазная неоваскуляризация, дегенерация сетчатки, кистозный макулярный отек (CMЕ), васкулит, отек диска зрительного нерва, ретинит, конъюнктивит (например, инфекционный конъюнктивит и неинфекционный (например, аллергический) конъюнктивит), врожденный амавроз Лебера, увеит (включая в себя инфекционный и неинфекционный увеит), хориоидит (например, многоочаговый хориоидит), глазной гистоплазмоз, блефарит, сухость глаз, травматическое повреждение глаз или болезнь Шегрена. В некоторых случаях нарушение клеточной пролиферации представляет собой рак. В некоторых случаях рак представляет собой рак молочной железы, рак толстой и прямой кишки, немелкоклеточный рак легких, неходжкинскую лимфому (НХЛ), рак почки, рак предстательной железы, рак печени, рак головы и шеи, меланому, рак яичников, мезотелиому или множественную миелому. Согласно другому аспекту предусмотрено антитело к VEGF для применения в лечении нарушения, ассоциированного с нежелательной проницаемостью сосудов. В некоторых случаях нарушение, ассоциированное с нежелательной проницаемостью сосудов, представляет собой отек, ассоциированный с опухолями головного мозга, асцит, ассоциированный со злокачественными новообразованиями, синдром Мейгса, воспаление легких, нефротический синдром, перикардиальный выпот, плевральный выпот или проницаемость, ассоциированную с сердечно-сосудистыми заболеваниями.
[479] Согласно другому аспекту предусмотрено антитело к VEGF для применения в способе лечения. Согласно другому аспекту предусмотрен конъюгат антитела (например, конъюгат гидрогеля поперечно-сшитой HA) для применения в способе лечения. В определенных случаях настоящее изобретение относится к антителу к VEGF (например, антителу к VEGF) для применения в способе лечения субъекта с нарушением, ассоциированным с патологическим ангиогенезом, предусматривающем введение индивидууму эффективного количества антитела к VEGF. Настоящее изобретение также относится к конъюгату антитела (например, конъюгату гидрогеля поперечно-сшитой HA) для применения в способе лечения субъекта с нарушением, ассоциированным с патологическим ангиогенезом, предусматривающем введение индивидууму эффективного количества конъюгата антитела. В некоторых случаях нарушение, ассоциированное с патологическим ангиогенезом, представляет собой офтальмологическое нарушение. В некоторых случаях офтальмологическое нарушение представляет собой следующее: AMD (например, влажная форма AMD, сухая форма AMD, промежуточная форма AMD, прогрессирующая форма AMD или географическая атрофия (GA)), макулярная дегенерация, макулярный отек, DME (например, очаговый, нецентровый DME или диффузный, DME с вовлечением центра макулы), ретинопатия, диабетическая ретинопатия (DR) (например, пролиферативная DR (PDR), непролиферативная DR (NPDR) или высотная DR), другие связанные с ишемией ретинопатии, ROP, окклюзия вен сетчатки (RVO) (например, центральная (CRVO) и разветвленная (BRVO) формы), CNV (например, миопическая CNV), неоваскуляризация роговицы, заболевание, ассоциированное с неоваскуляризацией роговицы, неоваскуляризация сетчатки, заболевание, ассоциированное с ретинальной/хориоидальной неоваскуляризацией, патологическая миопия, болезнь фон Хиппель-Линдау, гистоплазмоз глаза, FEVR, болезнь Коутса, болезнь Норри, OPPG, субконъюнктивальное кровоизлияние, рубеоз радужки, неоваскулярные заболевания глаз, неоваскулярная глаукома, пигментный ретинит (RP), гипертоническая ретинопатия, ангиоматозная пролиферация сетчатки, макулярная телеангиэктазия, неоваскуляризация радужки, внутриглазная неоваскуляризация, дегенерация сетчатки, кистозный макулярный отек (CMЕ), васкулит, отек диска зрительного нерва, ретинит, конъюнктивит (например, инфекционный конъюнктивит и неинфекционный (например, аллергический) конъюнктивит), врожденный амавроз Лебера, увеит (включая в себя инфекционный и неинфекционный увеит), хориоидит (например, многоочаговый хориоидит), глазной гистоплазмоз, блефарит, сухость глаз, травматическое повреждение глаз или болезнь Шегрена. В некоторых случаях нарушение клеточной пролиферации представляет собой рак. В некоторых случаях рак представляет собой рак молочной железы, рак толстой и прямой кишки, немелкоклеточный рак легких, неходжкинскую лимфому (НХЛ), рак почки, рак предстательной железы, рак печени, рак головы и шеи, меланому, рак яичников, мезотелиому или множественную миелому.
[480] В других случаях настоящее изобретение относится к антителу к VEGF для применения в способе лечения индивидуума с нарушением, ассоциированным с нежелательной проницаемостью сосудов. В других случаях настоящее изобретение относится к конъюгату антитела (например, конъюгату гидрогеля поперечно-сшитой HA) для применения в способе лечения индивидуума с нарушением, ассоциированным с нежелательной проницаемостью сосудов. В некоторых случаях нарушение, ассоциированное с нежелательной проницаемостью сосудов, представляет собой отек, ассоциированный с опухолями головного мозга, асцит, ассоциированный со злокачественными новообразованиями, синдром Мейгса, воспаление легких, нефротический синдром, перикардиальный выпот, плевральный выпот или проницаемость, ассоциированную с сердечно-сосудистыми заболеваниями. Любое из приведенных выше применений может дополнительно предусматривать введение индивидууму эффективного количества по меньшей мере одного дополнительного терапевтического средства, например, как описано ниже.
[481] В некоторых случаях настоящее изобретение относится к антителу к VEGF для применения в снижении или ингибировании ангиогенеза у субъекта. Согласно другому аспекту предусмотрен конъюгат антитела (например, конъюгат гидрогеля поперечно-сшитой HA) для применения в снижении или ингибировании ангиогенеза у субъекта. Согласно определенным вариантам осуществления настоящее изобретение относится к антителу к VEGF для применения в способе снижения или ингибирования ангиогенеза у субъекта, предусматривающем введение индивидууму эффективного количества антитела к VEGF для снижения или ингибирования ангиогенеза. Настоящее изобретение также относится к конъюгату антитела (например, конъюгату гидрогеля поперечно-сшитой HA) для применения в способе снижения или ингибирования ангиогенеза у субъекта, предусматривающем введение индивидууму эффективного количества конъюгата антитела. В других случаях настоящее изобретение относится к антителу к VEGF или его конъюгату антитела (например, конъюгату гидрогеля поперечно-сшитой HA) для применения в снижении или ингибировании проницаемости сосудов у субъекта. Согласно определенным вариантам осуществления настоящее изобретение относится к антителу к VEGF или его конъюгату антитела (например, конъюгату гидрогеля поперечно-сшитой HA) для применения в снижении или ингибировании проницаемости сосудов у субъекта, предусматривающего введение индивидууму эффективного количества антитела к VEGF или конъюгата антитела для снижения или ингибирования проницаемости сосудов. “Субъект” в соответствии с любым из перечисленных выше применений может представлять собой человека.
[482] Настоящее изобретение относится к применению антитела к VEGF в производстве или получении лекарственного средства. Настоящее изобретение также относится к применению конъюгата антитела (например, конъюгата гидрогеля поперечно-сшитой HA) в производстве или получении лекарственного средства. Например, в одном случае лекарственное средство предусмотрено для лечения нарушения, ассоциированного с патологическим ангиогенезом. В дополнительном случае лекарственное средство предусмотрено для применения в способе лечения нарушения, ассоциированного с патологическим ангиогенезом, предусматривающем введение субъекту с нарушением, ассоциированным с патологическим ангиогенезом, эффективного количества лекарственного средства. В некоторых случаях нарушение, ассоциированное с патологическим ангиогенезом, представляет собой офтальмологическое нарушение. В некоторых случаях офтальмологическое нарушение представляет собой следующее: AMD (например, влажная форма AMD, сухая форма AMD, промежуточная форма AMD, прогрессирующая форма AMD или географическая атрофия (GA)), макулярная дегенерация, макулярный отек, DME (например, очаговый, нецентровый DME или диффузный, DME с вовлечением центра макулы), ретинопатия, диабетическая ретинопатия (DR) (например, пролиферативная DR (PDR), непролиферативная DR (NPDR), или высотная DR), другие связанные с ишемией ретинопатии, ROP, окклюзия вен сетчатки (RVO) (например, центральная (CRVO) и разветвленная (BRVO) формы), CNV (например, миопическая CNV), неоваскуляризация роговицы, заболевание, ассоциированное с неоваскуляризацией роговицы, неоваскуляризация сетчатки, заболевание, ассоциированное с ретинальной/хориоидальной неоваскуляризацией, патологическая миопия, болезнь фон Хиппель-Линдау, гистоплазмоз глаза, FEVR, болезнь Коутса, болезнь Норри, OPPG, субконъюнктивальное кровоизлияние, рубеоз радужки, неоваскулярные заболевания глаз, неоваскулярная глаукома, пигментный ретинит (RP), гипертоническая ретинопатия, ангиоматозная пролиферация сетчатки, макулярная телеангиэктазия, неоваскуляризация радужки, внутриглазная неоваскуляризация, дегенерация сетчатки, кистозный макулярный отек (CMЕ), васкулит, отек диска зрительного нерва, ретинит, конъюнктивит (например, инфекционный конъюнктивит и неинфекционный (например, аллергический) конъюнктивит), врожденный амавроз Лебера, увеит (включая в себя инфекционный и неинфекционный увеит), хориоидит (например, многоочаговый хориоидит), глазной гистоплазмоз, блефарит, сухость глаз, травматическое повреждение глаз или болезнь Шегрена. В некоторых случаях нарушение клеточной пролиферации представляет собой рак. В некоторых случаях рак представляет собой рак молочной железы, рак толстой и прямой кишки, немелкоклеточный рак легких, неходжкинскую лимфому (НХЛ), рак почки, рак предстательной железы, рак печени, рак головы и шеи, меланому, рак яичников, мезотелиому или множественную миелому. В дополнительном случае лекарственное средство предусмотрено для снижения или ингибирования ангиогенеза у субъекта. В дополнительном случае лекарственное средство предусмотрено для применения в способе снижения или ингибирования ангиогенеза у субъекта, предусматривающем введение субъекту эффективного количества лекарственного средства для снижения или ингибирования ангиогенеза. В любом из представленных выше применений лекарственных средств способ может предусматривать введение индивидууму эффективного количества по меньшей мере одного дополнительного терапевтического средства, например, как описано ниже.
[483] В другом случае лекарственное средство предусмотрено для лечения нарушения, ассоциированного с нежелательной проницаемостью сосудов. В некоторых случаях нарушение, ассоциированное с нежелательной проницаемостью сосудов, представляет собой отек, ассоциированный с опухолями головного мозга, асцит, ассоциированный со злокачественными новообразованиями, синдром Мейгса, воспаление легких, нефротический синдром, перикардиальный выпот, плевральный выпот или проницаемость, ассоциированную с сердечно-сосудистыми заболеваниями. В дополнительном случае лекарственное средство предусмотрено для применения в способе лечения нарушения, ассоциированного с нежелательной проницаемостью сосудов, предусматривающем введение субъекту с нарушением, ассоциированным с нежелательной проницаемостью сосудов, эффективного количества лекарственного средства. В другом случае лекарственное средство предусмотрено для снижения или ингибирования проницаемости сосудов у субъекта. В дополнительном случае лекарственное средство предусмотрено для применения в способе снижения или ингибирования проницаемости сосудов у субъекта, предусматривающем введение субъекту эффективного количества лекарственного средства для снижения или ингибирования ангиогенеза. В любом из представленных выше применений лекарственных средств способ может предусматривать введение субъекту эффективного количества по меньшей мере одного дополнительного терапевтического средства, например, как описано ниже. “Субъект” в соответствии с любым из представленных выше применений может представлять собой человека.
[484] Настоящее изобретение относится к способу лечения нарушения, ассоциированного с патологическим ангиогенезом. Согласно одному варианту осуществления способ предусматривает введение индивидууму с нарушением, ассоциированным с патологическим ангиогенезом, эффективного количества антитела к VEGF. В другом примере способ предусматривает введение индивидууму с нарушением, ассоциированным с патологическим ангиогенезом, эффективного количества конъюгата антитела (например, конъюгата гидрогеля поперечно-сшитой HA). В некоторых случаях нарушение, ассоциированное с патологическим ангиогенезом, представляет собой офтальмологическое нарушение. В некоторых случаях офтальмологическое нарушение представляет собой следующее: AMD (например, влажная форма AMD, сухая форма AMD, промежуточная форма AMD, прогрессирующая форма AMD или географическая атрофия (GA)), макулярная дегенерация, макулярный отек, DME (например, очаговый, нецентровый DME или диффузный, DME с вовлечением центра макулы), ретинопатия, диабетическая ретинопатия (DR) (например, пролиферативная DR (PDR), непролиферативная DR (NPDR), или высотная DR), другие связанные с ишемией ретинопатии, ROP, окклюзия вен сетчатки (RVO) (например, центральная (CRVO) и разветвленная (BRVO) формы), CNV (например, миопическая CNV), неоваскуляризация роговицы, заболевание, ассоциированное с неоваскуляризацией роговицы, неоваскуляризация сетчатки, заболевание, ассоциированное с ретинальной/хориоидальной неоваскуляризацией, патологическая миопия, болезнь фон Хиппель-Линдау, гистоплазмоз глаза, FEVR, болезнь Коутса, болезнь Норри, OPPG, субконъюнктивальное кровоизлияние, рубеоз радужки, неоваскулярные заболевания глаз, неоваскулярная глаукома, пигментный ретинит (RP), гипертоническая ретинопатия, ангиоматозная пролиферация сетчатки, макулярная телеангиэктазия, неоваскуляризация радужки, внутриглазная неоваскуляризация, дегенерация сетчатки, кистозный макулярный отек (CMЕ), васкулит, отек диска зрительного нерва, ретинит, конъюнктивит (например, инфекционный конъюнктивит и неинфекционный (например, аллергический) конъюнктивит), врожденный амавроз Лебера, увеит (включая в себя инфекционный и неинфекционный увеит), хориоидит (например, многоочаговый хориоидит), глазной гистоплазмоз, блефарит, сухость глаз, травматическое повреждение глаз или болезнь Шегрена. В некоторых случаях нарушение клеточной пролиферации представляет собой рак. В некоторых случаях рак представляет собой рак молочной железы, рак толстой и прямой кишки, немелкоклеточный рак легких, неходжкинскую лимфому (НХЛ), рак почки, рак предстательной железы, рак печени, рак головы и шеи, меланому, рак яичников, мезотелиому или множественную миелому. В дополнительных случаях способ дополнительно предусматривает введение индивидууму эффективного количества по меньшей мере одного дополнительного терапевтического средства, как описано ниже. “Субъект” в соответствии с любым из представленных выше способов может представлять собой человека.
[485] Настоящее изобретение относится к способу лечения нарушения, ассоциированного с нежелательной проницаемостью сосудов. Согласно одному варианту осуществления способ предусматривает введение индивидууму с нарушением, ассоциированным с нежелательной проницаемостью сосудов, эффективного количества антитела к VEGF. Согласно другому варианту осуществления способ предусматривает введение индивидууму с нарушением, ассоциированным с нежелательной проницаемостью сосудов, эффективного количества конъюгата антитела (например, конъюгата гидрогеля поперечно-сшитой HA). В некоторых случаях нарушение, ассоциированное с нежелательной проницаемостью сосудов, представляет собой отек, ассоциированный с опухолями головного мозга, асцит, ассоциированный со злокачественными новообразованиями, синдром Мейгса, воспаление легких, нефротический синдром, перикардиальный выпот, плевральный выпот или проницаемость, ассоциированную с сердечно-сосудистыми заболеваниями. В дополнительных случаях способ дополнительно предусматривает введение индивидууму эффективного количества по меньшей мере одного дополнительного терапевтического средства, как описано ниже. “Субъект” в соответствии с любым из представленных выше способов может представлять собой человека.
[486] Подразумевается, что антитело или конъюгат антитела (например, конъюгат гидрогеля поперечно-сшитой HA) согласно настоящему изобретению можно использовать для лечения млекопитающего. Согласно одному варианту осуществления антитело или конъюгат антитела (например, конъюгат гидрогеля поперечно-сшитой HA) вводят млекопитающему, не являющемуся человеком, например, для получения доклинических данных. Иллюстративные являющиеся человеком млекопитающие, подлежащие лечению, включают в себя не относящихся к человеку приматов, собак, кошек, грызунов (например, мышей и крыс) и других млекопитающих, у которых проводятся доклинические исследования. У таких млекопитающих можно создать животные модели заболевания, подлежащего лечению антителом, или их можно использовать для изучения токсичности или фармакокинетики представляющего интерес антитела. Согласно каждому из этих вариантов осуществления исследования с повышением дозы можно выполнять на млекопитающем. Антитело или конъюгат антитела (например, конъюгат гидрогеля поперечно-сшитой HA) можно вводить, например, грызуну-хозяину в модели солидной опухоли. Антитело или конъюгат антитела можно вводить хозяину (например, грызуну, например кролику) для глазных фармакокинетических исследований, например, путем интравитреального введения (например, интравитреальной инъекции).
[487] Согласно дополнительному аспекту настоящее изобретение относится к фармацевтическим составам, содержащим любое из антител (например, антител к VEGF) или конъюгатов антител (например, конъюгатов гидрогеля поперечно-сшитой HA), предусмотренных в настоящем документе, например, для применения в любом из представленных выше терапевтических способов. Согласно одному варианту осуществления фармацевтический состав содержит любое из антител (например, антител к VEGF) или конъюгатов антител (например, конъюгатов гидрогеля поперечно-сшитой HA), предусмотренных в настоящем документе, и фармацевтически приемлемый носитель. Согласно другому варианту осуществления фармацевтический состав содержит любое из антител (например, антител к VEGF) или конъюгатов антител (например, конъюгатов гидрогеля поперечно-сшитой HA), предусмотренных в настоящем документе, и по меньшей мере одно дополнительный терапевтическое средство, например, как описано ниже. Согласно определенным вариантам осуществления фармацевтический состав содержит одно или несколько дополнительных соединений. Согласно определенным вариантам осуществления дополнительное соединение связывается с второй биологической молекулой, выбранной из группы, состоящей из следующего: IL-1β; IL-6; IL-6R; IL-13; IL-13R; PDGF; ангиопоэтин; Ang2; Tie2; S1P; интегрины αvβ3, αvβ5, и α5β1; бетацеллюлин; апелин/APJ; эритропоэтин; фактор комплемента D; TNFα; HtrA1; рецептор VEGF; рецептор ST-2; и белки, генетически связанные с риском возрастной макулярной дегенерации (AMD), такие как компоненты пути комплемента C2, фактор B, фактор H, CFHR3, C3b, C5, C5a и C3a; HtrA1; ARMS2; TIMP3; HLA; интерлейкин-8 (IL-8); CX3CR1; TLR3; TLR4; CETP; LIPC, COL10A1 и TNFRSF10A. Согласно определенным вариантам осуществления дополнительное соединение представляет собой антитело или его антигенсвязывающий фрагмент. Например, в некоторых случаях дополнительное соединение представляет собой биспецифическое антитело (например, биспецифическое антитело к VEGF/к Ang2, такое как RG-7716 или любое биспецифическое антитело к VEGF/к Ang2, раскрытое в международной патентной публикации WO 2010/069532 или WO 2016/073157, или их вариант. Согласно другому примеру, в некоторых случаях дополнительное соединение представляет собой антитело к IL-6, например, EBI-031 (Eleven Biotherapeutics; см., например, WO 2016/073890), силтуксимаб (SYLVANT®), олокизумаб, клазакизумаб, сирукумаб, элсилимомаб, герилимзумаб, OPR-003, MEDI-5117, PF-04236921 или их вариант. Согласно дополнительному примеру, в некоторых случаях дополнительное соединение представляет собой антитело к IL-6R, например, тоцилизумаб (ACTEMRA®) (см., например, WO 1992/019579), сарилумаб, вобарилизумаб (ALX-0061), SA-237 или их вариант.
[488] Антитела (например, антитела к VEGF) или конъюгаты антител (например, конъюгаты гидрогеля поперечно-сшитой HA) можно использовать, либо отдельно, либо в комбинации с другими средствами в терапии. Например, антитело (например, антитело к VEGF) или конъюгат антитела (например, конъюгат гидрогеля поперечно-сшитой HA) можно вводить совместно по меньшей мере с одним дополнительным терапевтическим средством. Согласно определенным вариантам осуществления дополнительное терапевтическое средство представляет собой другое антитело, химиотерапевтическое средство, цитотоксическое средство, антиангиогенное средство, иммуносупрессор, пролекарственное средство, цитокин, антагонист цитокина, цитотоксическую лучевую терапию, кортикостероид, противорвотное средство, противораковую вакцину, обезболивающее средство, ингибирующее рост средство или их комбинации.
[489] Например, согласно определенным вариантам осуществления любой из предшествующих способов дополнительно предусматривает введение одного или нескольких дополнительных соединений. Согласно определенным вариантам осуществления антитело (например, антитело к VEGF) или конъюгат антитела (например, конъюгат гидрогеля поперечно-сшитой HA) вводят одновременно с дополнительным(и) соединением(ями). Согласно определенным вариантам осуществления антитело или конъюгат антитела вводят до или после дополнительного(ых) соединения(й). Согласно определенным вариантам осуществления дополнительное соединение связывается со второй биологической молекулой, выбранной из группы, состоящей из следующего: IL-1β; IL-6; IL-6R; IL-13; IL-13R; PDGF; ангиопоэтин; Ang2; Tie2; S1P; интегрины αvβ3, αvβ5 и α5β1; бетацеллюлин; апелин/APJ; эритропоэтин; фактор комплемента D; TNFα; HtrA1; рецептор VEGF; рецептор ST-2; и белки, генетически связанные с риском AMD, такие как компоненты пути комплемента C2, фактор B, фактор H, CFHR3, C3b, C5, C5a и C3a; HtrA1; ARMS2; TIMP3; HLA; интерлейкин-8 (IL-8); CX3CR1; TLR3; TLR4; CETP; LIPC; COL10A1 и TNFRSF10A. Согласно определенным вариантам осуществления дополнительное соединение представляет собой антитело или его антигенсвязывающий фрагмент. Согласно определенным вариантам осуществления согласно (или применительно к) любому из вариантов осуществления, представленных выше, офтальмологическое нарушение представляет собой внутриглазное неоваскулярное заболевание, выбранное из группы, состоящей из следующего: пролиферативные ретинопатии, хориоидальная неоваскуляризация (CNV), возрастная макулярная дегенерация (AMD), диабетическая и другие связанные с ишемией ретинопатии, диабетический макулярный отек, патологическая миопия, болезнь фон Хиппель-Линдау, гистоплазмоз глаза, окклюзия вен сетчатки (RVO), включая в себя CRVO и BRVO, неоваскуляризация роговицы, неоваскуляризация сетчатки и ретинопатия недоношенных (ROP). Например, в некоторых случаях дополнительное соединение представляет собой биспецифическое антитело (например, биспецифическое антитело к VEGF/к Ang2, такое как RG-7716 или любое биспецифическое антитело к VEGF/к Ang2, раскрытое в международной патентной публикации WO 2010/069532 или WO 2016/073157, или их вариант. Согласно другому примеру, в некоторых случаях дополнительное соединение представляет собой антитело к IL-6, например, EBI-031 (Eleven Biotherapeutics; см., например, WO 2016/073890), силтуксимаб (SYLVANT®), олокизумаб, клазакизумаб, сирукумаб, элсилимомаб, герилимзумаб, OPR-003, MEDI-5117, PF-04236921, или их вариант. Согласно дополнительному примеру, в некоторых случаях дополнительное соединение представляет собой антитело к IL-6R, например, тоцилизумаб (ACTEMRA®) (см., например, WO 1992/019579), сарилумаб, вобарилизумаб (ALX-0061), SA-237 или их вариант.
[490] В некоторых случаях антитело (например, антитело к VEGF) или конъюгат антитела (например, конъюгат гидрогеля поперечно-сшитой HA) согласно настоящему изобретению можно вводить в комбинации по меньшей мере с одним дополнительным терапевтическим средством для лечения офтальмологического нарушения, например, офтальмологического нарушения, описанного в настоящем документе (например, AMD (например, влажной AMD), DME, DR или RVO). Иллюстративные дополнительные терапевтические средства для комбинированной терапии для лечения офтальмологических нарушений включают в себя без ограничения следующее: антиангиогенные средства, такие как антагонисты VEGF, включая в себя, например, антитела к VEGF (например, Fab к VEGF LUCENTIS® (ранибизумаб)), слитые белки растворимых рецепторов (например, рекомбинантный слитый белок растворимого рецептора EYLEA® (афлиберцепт, также известный как VEGF Trap Eye; Regeneron/Aventis)), аптамеры (например, пегилированный аптамер к VEGF MACUGEN® (пегаптаниб натрия; NeXstar Pharmaceuticals/OSI Pharmaceuticals)) и ингибиторы тирозинкиназы VEGFR (например, 4-(4-бром-2-фторанилино)-6-метокси-7-(1-метилпиперидин-4-илметокси)хиназолин (ZD6474), 4-(4-фтор-2-метилиндол-5-илокси)-6-метокси-7-(3-пирролидин-1-илпрпокси)хиназолин (AZD2171), ваталаниб (PTK787), семаксаниб (SU5416; SUGEN) и SUTENT® (сунитиниб)); триптофанил-тРНК-синтетаза (TrpRS); скваламин; RETAANE® (анекортав ацетат для депо-суспензии; Alcon, Inc.); пролекарственное средство комбретастатина A4 (CA4P); MIFEPREX® (мифепристон-ru486); субтенон триамцинолон ацетонид; интравитреальный кристаллический триамцинолон ацетонид; ингибиторы матричной металлопротеиназы (например, приномастат (AG3340; Pfizer)); флуоцинолон ацетонид (включая в себя внутриглазной имплантат флуоцинолона; Bausch & Lomb/Control Delivery Systems); линомид; ингибиторы функции интегрина β3; ангиостатин и их комбинации. Эти и другие терапевтические средства, которые можно вводить в комбинации с конъюгатом антитела согласно настоящему изобретению, описаны, например, в заявке на выдачу патента США № US 2014/0017244, которая полностью включена в настоящий документ посредством ссылки.
[491] Дополнительные примеры дополнительных терапевтических средств, которые можно использовать в комбинации с антителом (например, антителом к VEGF) или конъюгатом антитела (например, конъюгатом гидрогеля поперечно-сшитой HA) согласно настоящему изобретению для лечения офтальмологического нарушения (например, AMD, DME, DR или RVO), включают в себя без ограничения следующее: VISUDYNE® (вертепорфин; активируемое светом лекарственное средство, которое, как правило, используют в сочетании с фотодинамической терапией с нетермическим лазером), PKC412, Endovion (NS 3728; NeuroSearch A/S), нейротрофические факторы (например, глиальный нейротрофический фактор (GDNF) и цилиарный нейротрофический фактор (CNTF)), дилтиазем, дорзоламид, PHOTOTROP®, 9-цис-ретиналь, лекарственные средства для глаз (например, фосфолинйодид, эхотиофат или ингибиторы карбоангидразы), веовастат (AE-941; AEterna Laboratories, Inc.), Sirna-027 (AGF-745; Sima Therapeutics, Inc.), нейротрофины (включая в себя, только в качестве примера, NT-4/5, Genentech), Cand5 (Acuity Pharmaceuticals), INS-37217 (Inspire Pharmaceuticals), антагонисты интегрина (включая в себя от Jerini AG и Abbott Laboratories), EG-3306 (Ark Therapeutics Ltd.), BDM-E (BioDiem Ltd.), талидомид (используемый, например, EntreMed, Inc.), кардиотрофин-1 (Genentech), 2-метоксиэстрадиол (Allergan/Oculex), DL-8234 (Toray Industries), NTC-200 (Neurotech), тетратиомолибдат (Университет Мичигана), LYN-002 (Lynkeus Biotech), соединение микроводорослей (Aquasearch/Albany, Mera Pharmaceuticals), D-9120 (Celltech Group plc), ATX-S10 (Hamamatsu Photonics), TGF-бета 2 (Genzyme/Celtrix), ингибиторы тирозинкиназы (например, от Allergan, SUGEN или Pfizer), NX-278-L (NeXstar Pharmaceuticals/Gilead Sciences), Opt-24 (OPTIS France SA), нейропротекторы ганглиозных клеток сетчатки (Cogent Neurosciences), производные N-нитропиразола (Texas A&M University System), KP-102 (Krenitsky Pharmaceuticals), циклоспорин A, терапевтические средства, используемые в фотодинамической терапии (например, VISUDYNE®; PDT, нацеленная на рецепторы, Bristol-Myers Squibb, Co.; порфимер натрия для инъекций с PDT; вертепорфин, QLT Inc.; ростапорфин с PDT, Miravent Medical Technologies; талапорфин натрия с PDT, Nippon Petroleum; и мотексафин лютеция, Pharmacyclics, Inc.), антисмысловые олигонуклеотиды (включая в себя, в качестве примера, продукты, протестированные Novagali Pharma SA и ISIS-13650, Isis Pharmaceuticals) и их комбинации.
[492] Антитело (например, антитело к VEGF) или конъюгат антитела (например, конъюгат гидрогеля поперечно-сшитой HA) согласно настоящему изобретению можно вводить в комбинации с терапией или хирургической процедурой для лечения офтальмологического нарушения (например, AMD, DME, DR или RVO), включая в себя, например, следующее: лазерная фотокоагуляция (например, панретинальная фотокоагуляция (PRP)), лазерная обработка друз, хирургические вмешательства на макулярной зоне, хирургическое перемещение макулярной зоны, имплантация миниатюрных телескопов, ангиография PHI-motion (также известная как микролазерная терапия и лечение питающих сосудов), протонная терапия, микростимуляционная терапия, отслоение сетчатки и операции на стекловидном теле, вдавливание склеры, хирургические вмешательства на субмакулярной зоне, транспупиллярная термотерапия, терапия с помощью фотосистемы I, использование РНК интерференции (PHKi); экстракорпоральный реоферез (также известный как мембранная дифференциальная фильтрация или реотерапия), имплантация микрочипов, терапия стволовыми клетками, генная заместительная терапия, генная терапия рибозимами (включая в себя генную терапию в отношении элементов ответа на гипоксию, Oxford Biomedica; Lentioak, Genetix; генную терапию PDEF, GenVec), трансплантация фоторецепторных/ретинальных клеток (включая в себя трансплантацию эпителиальных клеток сетчатки, Diacrin, Inc.; трансплантат клеток сетчатки, Cell Genesys, Inc.;) и акупунктура и их комбинации.
[493] В некоторых случаях антитело (например, антитело к VEGF) или конъюгат антитела (например, конъюгат гидрогеля поперечно-сшитой HA) согласно настоящему изобретению можно вводить в комбинации с антиангиогенным средством для лечения офтальмологического нарушения (например, AMD, DME, DR или RVO). Любое подходящее антиангиогенное средство можно использовать в комбинации с антителом (например, антителом к VEGF) или конъюгатом антитела согласно настоящему изобретению, включая в себя без ограничения те, которые перечислены в Carmeliet et al. Nature 407:249-257, 2000. Согласно некоторым вариантам осуществления антиангиогенное средство представляет собой следующее: антагонист VEGF, включая в себя без ограничения антитело к VEGF (например, Fab к VEGF LUCENTIS® (ранибизумаб), RTH-258 (ранее ESBA-1008, одноцепочечный фрагмент антитела к VEGF; Novartis) или биспецифическое антитело к VEGF (например, биспецифическое антитело к VEGF/к ангиопоэтину 2, такое как RG-7716; Roche)), рекомбинантный слитый белок растворимого рецептора (например, EYLEA® (афлиберцепт)), вариант VEGF, фрагмент растворимого VEGFR, аптамер, способный блокировать VEGF (например, пегаптаниб) или VEGFR, нейтрализующее антитело к VEGFR, низкомолекулярный ингибитор тирозинкиназ VEGFR, DARPin® против VEGF (например, абиципар пегол), малые интерферирующие РНК, которые ингибируют экспрессию VEGF или VEGFR, ингибитор тирозинкиназы VEGFR (например, 4-(4-бром-2-фторанилино)-6-метокси-7-(1-метилпиперидин-4-илметокси)хиназолин (ZD6474), 4-(4-фтор-2-метилиндол-5-илокси)-6-метокси-7-(3-пирролидин-1-илпропокси)хиназолин (AZD2171), ваталаниб (PTK787), семаксаниб (SU5416; SUGEN) и SUTENT® (сунитиниб)) и их комбинации. В некоторых случаях биспецифическое антитело к VEGF связывается со второй биологической молекулой, включая в себя без ограничения следующее: IL-1β; IL-6; IL-6R; PDGF (например, PDGF-BB); ангиопоэтин; ангиопоэтин 2; Tie2; S1P; интегрины αvβ3, αvβ5 и α5β1; бетацеллюлин; апелин/APJ; эритропоэтин; фактор комплемента D; TNFα; HtrA1; рецептор VEGF (например, VEGFR1, VEGFR2, VEGFR3, mbVEGFR или sVEGFR); рецептор ST-2; и белки, генетически связанные с риском возрастной макулярной дегенерации (AMD), такие как компоненты пути комплемента C2, фактор B, фактор H, CFHR3, C3b, C5, C5a и C3a; HtrA1; ARMS2; TIMP3; HLA; IL-8; CX3CR1; TLR3; TLR4; CETP; LIPC; COL10A1 и TNFRSF10A. Например, в некоторых случаях дополнительное соединение представляет собой биспецифическое антитело (например, биспецифическое антитело к VEGF/к Ang2, такое как RG-7716 или любое биспецифическое антитело к VEGF/к Ang2, раскрытое в международной патентной публикации WO 2010/069532 или WO 2016/073157, или их вариант.
[494] Другие подходящие антиангиогенные средства, которые можно вводить в комбинации с антителом (например, антителом к VEGF) или конъюгатом антитела (например, конъюгатом гидрогеля поперечно-сшитой HA) согласно настоящему изобретению для лечения офтальмологического нарушения (например, AMD, DME, DR или RVO), включают в себя следующее: кортикостероиды, ангиостатические стероиды, анекортав ацетат, ангиостатин, эндостатин, ингибиторы тирозинкиназы, ингибиторы матричной металлопротеиназы (ММР), белок 3, связывающий инсулиноподобный фактор роста (IGFBP3), антагонисты стромального фактора (SDF-1) (например, антитела к SDF-1), фактор, происходящий из пигментного эпителия (PEDF), гамма-секретаза, дельта-подобный лиганд 4, антагонисты интегрина, антагонисты индуцируемого гипоксией фактора (HIF)-1α, антагонисты протеинкиназы CK2, средства, которые ингибируют хоуминг стволовых клеток (например, эндотелиальных клеток-предшественников) в сайт неоваскуляризации (например, антитело к кадгерину сосудистого эндотелия (CD-144) и/или антитело к SDF-1) и их комбинации.
[495] В дополнительном примере, в некоторых случаях антитело (например, антитело к VEGF) или конъюгат антитела (например, конъюгат гидрогеля поперечно-сшитой HA) согласно настоящему изобретению можно вводить в комбинации со средством, которое характеризуется активностью против неоваскуляризации для лечения офтальмологического нарушения (например, AMD, DME, DR или RVO), таким как противовоспалительное лекарственное средство, ингибитор мишени рапамицина в клетках млекопитающих рапамицина (mTOR) (например, рапамицин, AFINITOR® (эверолимус) и TORISEL® (темсиролимус)), циклоспорин, антагонист фактора некроза опухоли (TNF) (например, антитело к TNFα или его антигенсвязывающий фрагмент (например, инфликсимаб, адалимумаб, цертолизумаб пегол и голимумаб) или слитый белок растворимого рецептора (например, этанерцепт), средство против комплемента, нестероидное противовоспалительное средство (NSAID) или их комбинации.
[496] В еще одном дополнительном примере в некоторых случаях антитело (например, антитело к VEGF) или конъюгат антитела (например, конъюгат гидрогеля поперечно-сшитой HA) согласно настоящему изобретению можно вводить в комбинации со средством, которое является нейропротективным и может потенциально уменьшить прогрессирование сухой формы AMD до влажной формы AMD, таким как класс лекарственных средств, называемых “нейростероиды”, которые включают в себя такие лекарственные средства, как дегидроэпиандростерон (DHEA) (торговые марки: PRASTERA™ и FIDELIN®), дегидроэпиандростерон сульфат и прегненолон сульфат.
[497] Любое подходящее терапевтическое средство для AMD можно вводить в виде дополнительного терапевтического средства в комбинации с антителом (например, антителом к VEGF) или конъюгатом антитела (например, конъюгатом гидрогеля поперечно-сшитой HA) согласно настоящему изобретению для лечения офтальмологического нарушения (например, AMD, DME, DR или RVO), включая в себя без ограничения следующее: антагонист VEGF, например, антитело к VEGF (например, LUCENTIS® (ранибизумаб), RTH-258 (ранее ESBA-1008, одноцепочечный фрагмент антитела к VEGF; Novartis), или биспецифическое антитело к VEGF (например, биспецифическое антитело к VEGF/к ангиопоэтину 2, такой как RG-7716; Roche)), слитый белок растворимого рецептора VEGF (например, EYLEA® (афлиберцепт)), DARPin® против VEGF (например, абиципар пегол; Molecular Partners AG/Allergan) или аптамер к VEGF (например, MACUGEN® (пегаптаниб натрия)); антагонист тромбоцитарного фактора роста (PDGF), например, антитело к PDGF, антитело к PDGFR (например, REGN2176-3), пегилированный аптамер к PDGF-BB (например, FOVISTA®; Ophthotech/Novartis), слитый белок растворимого рецептора PDGFR или двойной антагонист PDGF/VEGF (например, низкомолекулярный ингибитор (например, DE-120 (Santen) или X-82 (TyrogeneX)) или биспецифическое антитело к PDGF/антитело к VEGF)); VISUDYNE® (вертепорфин) в комбинации с фотодинамической терапией; антиоксидант; антагонист системы комплемента, например, антагонист фактора комплемента C5 (например, низкомолекулярный ингибитор (например, ARC-1905; Opthotech) или антитело к C5 (например, LFG-316; Novartis), антагонист пропердина (например, антитело к пропердину, например, CLG-561; Alcon) или антагонист фактора комплемента D (например, антитело к фактору комплемента D, например, лампализумаб; Roche)); модификатор цикла превращений родопсина (например, эмиксустат гидрохлорид); скваламин (например, OHR-102; Ohr Pharmaceutical); витаминные и минеральные добавки (например, те, которые описаны в исследовании 1 возрастных глазных заболеваний 1 (AREDS1; цинк и/или антиоксиданты) и исследовании 2 (AREDS2; цинк, антиоксиданты, лютеин, зеаксантин и/или омега-3 жирные кислоты)); клеточная терапия, например, NT-501 (Renexus); PH-05206388 (Pfizer), трансплантация клеток huCNS-SC (StemCells), CNTO-2476 (Janssen), OpRegen (Cell Cure Neurosciences) или трансплантация клеток MA09-hRPE (Ocata Therapeutics); антагонист тканевого фактора (например, hI-con1; Iconic Therapeutics); агонист альфа-адренергических рецепторов (например, бримонидин тартрат); пептидная вакцина (например, S-646240; Shionogi); антагонист бета-амилоида (например, моноклональное антитело к бета-амилоиду, например GSK-933776); антагонист S1P (например, антитело к S1P, например, iSONEP™; Lpath Inc); антагонист ROBO4 (например, антитело к ROBO4, например, DS-7080a; Daiichi Sankyo); лентивирусный вектор, экспрессирующий эндостатин и ангиостатин (например, RetinoStat); и любая их комбинация. В некоторых случаях терапевтические средства в отношении AMD (включая в себя любое из предшествующих терапевтических средств в отношении AMD) можно составить совместно. Например, антитело к PDGFR, REGN2176-3, можно составить совместно с афлиберцептом (EYLEA®). В некоторых случаях такой совместный состав можно вводить в комбинации с антителом согласно настоящему изобретению. В некоторых случаях офтальмологическое нарушение представляет собой AMD (например, влажную форму AMD).
[498] Такие виды комбинированной терапии, отмеченные выше, включают в себя комбинированное введение (при котором два или более терапевтических средств включены в один и тот же состав или отдельные составы) и раздельное введение, и в этом случае введение антитела или конъюгата антитела согласно настоящему изобретению может происходить до, одновременно и/или после введения дополнительного терапевтического средства или средств. Согласно одному варианту осуществления введение антитела или конъюгата антитела и введение дополнительного терапевтического средства происходит в течение приблизительно одного, двух, трех, четырех или пяти месяцев или в течение приблизительно одной, двух или трех недель или в течение приблизительно одного, двух, трех, четырех, пяти или шести дней друг от друга.
Примеры
[499] Следующие сокращения можно использовать в примерах ниже и в другом месте в настоящем документе.
Пример 1A: Синтез саморасщепляющейся защитной группы 4-(((перфторфенокси)карбонилокси)метил)фенил 2-(диметиламино)этил(метил)карбамат a3
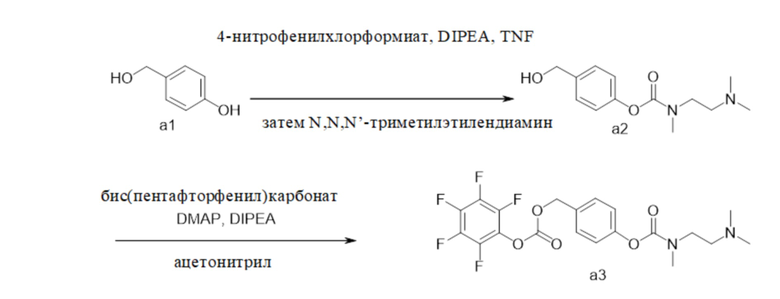
Схема 1A
[500] Синтез 4-(((перфторфенокси)карбонилокси)метил)фенил-2-(диметиламино)этил(метил)карбамата a3 проиллюстрирован на схеме 1A
Стадия 1: Получение 4-(гидроксиметил)фенил-2-(диметиламино)этил(метил)карбамата a2
[501] 4-Гидроксибензиловый спирт a1 (1,70 г; 13,69 ммоль; 1,00 экв.) растворяли в THF (20,5 мл) и DIPEA (4,8 мл; 27,39 ммоль; 2,00 экв.) добавляли при перемешивании. 4-Нитрофенилхлорформиат (2,90 г; 14,38 ммоль; 1,05 экв.) в THF (5 мл) добавляли по каплям в течение 25 мин. Реакционную смесь перемешивали в течение дополнительных 20 минут при комнатной температуре. IPC с помощью LCMS подтвердил образование требуемого промежуточного соединения. N,N,N'-триметилэтилендиамин (2,21 мл; 17,12 ммоль; 1,25 экв.) медленно добавляли к раствору и реакционную смесь перемешивали в течение дополнительных 20 мин. IPC с помощью LCMS подтвердил полное превращение карбоната. Реакционную смесь охлаждали на ледяной бане, гасили с помощью TFA (3,17 мл; 41,08 ммоль; 3,00 экв.) и разбавляли водой. Значение pH должно составлять ниже 2, как указано на лакмусовой индикаторной бумаге. Водную фазу отмывали этилацетатом (3×100 мл), после чего pH водной фазы возрастал до приблизительно pH 4,5. Водную фазу лиофилизировали с получением на выходе маслянистого остатка. Остаток испаряли совместно с этилацетатом (3×), растворяли в DCM и высушивали (Na2SO4). После фильтрования растворитель испаряли и маслянистый остаток высушивали в высоком вакууме (2 ч). QC с помощью LCMS выявил чистоту, составляющую 93%. Полученный сырой 4-(гидроксиметил)фенил-2-(диметиламино)этил(метил)карбамат a2 использовали в следующей стадии без очистки.
Стадия 2: Получение 4-(((перфторфенокси)карбонилокси)метил)фенил-2-(диметиламино)этил(метил)карбамата a3
[502] Сырой 4-(гидроксиметил)фенил-2-(диметиламино)этил(метил)карбамат a2 из стадии 1 (11,76 г; макс. 13,69 ммоль; 1,00 экв.; макс. чистота, составляющая 40 масс.%) растворяли в ацетонитриле (24 мл) и раствор охлаждали на ледяной бане. Бис(пентафторфенил)карбонат (10,15 г; 25,75 ммоль; 1,88 экв.), DMAP (315 мг; 2,58 ммоль; 0,19 экв.) и DIPEA (9,0 мл; 51,53 ммоль; 3,76 экв.) добавляли при перемешивании. Оранжевый раствор превращался в зеленый, затем серый. Реакционную смесь перемешивали в течение 15 минут. Образование продукта подтверждали с помощью LCMS. Реакционную смесь охлаждали до -15°C и гасили с помощью смеси воды с 0,1% TFA (12,38 мл) и беспримесного TFA (3,9 мл; 51,48 ммоль; 3,76 экв.). Желтый раствор очищали с помощью RP-LPLC за 4 цикла. Чистые фракции объединяли, замораживали и лиофилизировали с получением на выходе 4-(((перфторфенокси)карбонилокси)метил)фенил-2-(диметиламино)этил(метил)карбамата a3 в виде желтого масла, 4,73 г соли TFA (8,21 ммоль, 60% за 2 стадии).
Пример 1B: Синтез защищенного линкера b5
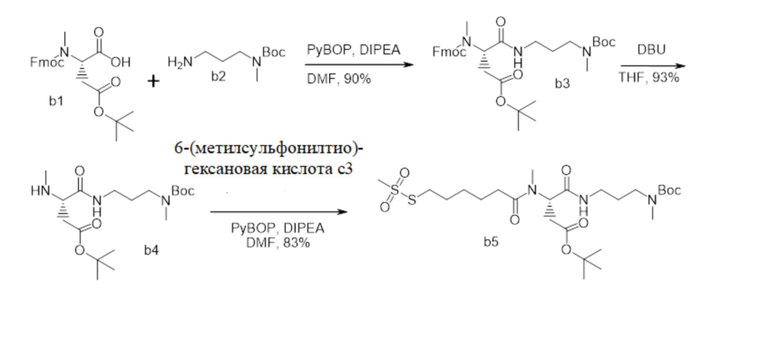
Схема 1B
[503] Синтез линкера b5 показан на схеме 1B
Стадия 1: Получение амидного соединения b3
[504] Fmoc-N-Me-Asp(tBu)-OH b1 (6,96 г; 16,36 ммоль; 1,00 экв.) растворяли в DMF (139 мл). PyBOP (12,77 г; 24,54 ммоль; 1,50 экв.) и DIPEA (14,25 мл; 81,79 ммоль; 5,00 экв.) добавляли и перемешивали до полного растворения. N-Boc-N-метил-1,3-диаминопропангидрохлорид b2 (4,04 г; 17,99 ммоль; 1,10 экв.) добавляли и реакционную смесь перемешивали при комнатной температуре в течение 15 мин. Полное превращение в продукт наблюдали с помощью LCMS. Реакционную смесь разбавляли с помощью 400 мл дихлорметана и отмывали три раза с помощью 400 мл 0,1 н. HCl. Органический слой отмывали трижды с помощью 400 мл насыщенного раствора NaHCO3 и один раз с помощью 200 мл рассола. Органический слой высушивали над MgSO4, фильтровали и концентрировали. Сырой материал растворяли в 14 мл дихлорметана и очищали с помощью нормально-фазовой флэш-хроматографии. Содержащие продукт фракции объединяли и растворитель испаряли. Конечный материал высушивали в высоком вакууме с получением на выходе амидного соединение b3 в виде белой пены. Выход: 8,81 г (14,79 ммоль, 90%).
Стадия 2: Получение амидного соединения b4
[505] Амидное соединение b3 (8,81 г; 14,79 ммоль; 1,00 экв.) растворяли в THF (130 мл). DBU (2,56 мл; 17,15 ммоль; 1,16 экв.) добавляли и смесь перемешивали при комнатной температуре в течение 5 минут. Хроматограмма LCMS показала полное превращение исходного материала. Кроме того, получали TLC (этилацетат/метанол 9:1, краситель - KMnO4), Rf(Pdt) = 0,48). Растворитель сырой реакционной смеси испаряли. Остаток растворяли в этилацетате до достижения конечного объема, составляющего 20 мл, и раствор очищали с помощью флэш-хроматографии. Содержащие продукт фракции объединяли и растворитель испаряли. Конечный материал высушивали в высоком вакууме в течение ночи с получением на выходе амидного соединения b4 в виде желтоватого масла. Выход: 5,13 г (13,74 ммоль, 87% выхода, 94% чистоты при 215 нм).
Стадия 3: Получение линкерного соединения b5
[506] DIPEA (7,19 мл; 41,21 ммоль; 3,00 экв.) добавляли к раствору карбоновой кислоты c3 из примера 1E (3,42 г; 15,11 ммоль; 1,10 экв.) и PyBOP (7,86 г; 15,11 ммоль; 1,10 экв.) в дихлорметане (35 мл), после чего смесь значительно нагревалась и превращалась из желтоватой в темно-желтую. Смесь перемешивали при комнатной температуре в течение 5 минут, чтобы предварительно активировать кислоту. К раствору активированной кислоты свежеприготовленный раствор амидного соединения b4 (5,13 г; 13,74 ммоль; 1,00 экв.) в дихлорметане (35 мл) добавляли весь сразу, после чего смесь превращалась в светло-коричневую. Раствор для реакции присоединения перемешивали при комнатной температуре в течение 100 мин. IPC с помощью LCMS показал почти полное превращение исходного материала. Реакционную смесь разбавляли с помощью 500 мл этилацетата и отмывали с помощью 0,2 н. HCl (4× 300 мл), рассола (1× 100 мл), насыщ. NaHCO3 (50, 25, 160 мл), 5% лимонной кислоты (1× 100 мл) и рассола (1× 100 мл). Органический слой высушивали над Na2SO4, фильтровали и концентрировали. Остаток высушивали в высоком вакууме в течение выходных (13,59 г сырого материала). Остаток растворяли в этилацетате до достижения конечного объема, составляющего приблизительно 22 мл. Сырой материал очищали с помощью флэш-хроматографии. Содержащие продукт фракции (TLC: этилацетат, краситель - KMnO4, Rf(Pdt) = 0,54) объединяли и растворитель испаряли с получением на выходе липкого, коричневого, камедеобразного остатка. Конечный материал высушивали в высоком вакууме в течение ночи с получением на выходе линкерного соединения b5 в виде пены. Выход: 6,61 г (11,36 ммоль, 83% выхода, 96% чистоты).
Пример 1C: Синтез линкера - (S)-4-(3-(((4-((2-(диметиламино)этил)(метил)карбамоилокси)-бензилокси)карбонил)(метил)амино)пропиламино)-3-(N-метил-6-(метилсульфонилтио)гексанамидо)-4-оксомасляной кислоты b7

Схема 1C
[507] Синтез (S)-4-(3-(((4-((2-(диметиламино)этил)(метил)карбамоилокси)бензилокси)карбонил)-(метил)амино)пропиламино)-3-(N-метил-6-(метилсульфонилтио)гексанамидо)-4-оксомасляной кислоты b7 проиллюстрирован на схеме 1C.
Стадия 1: Получение (S)-3-(N-метил-6-(метилсульфонилтио)гексанамидо)-4-(3-(метиламино)пропиламино)-4-оксомасляной кислоты b6
[508] Амидное соединение b5 (3,40 г; 5,84 ммоль; 1,00 экв.) растворяли в дихлорметане (19 мл) и добавляли TFA (19 мл). Реакционную смесь перемешивали в течение 75 минут при комнатной температуре в открытой колбе. IPC с помощью LCMS показал хорошее превращение в продукт. Удаление летучих веществ проводили контролируемым образом (роторный испаритель при 25°C и 12 мбар, затем высокий вакуум при комнатной температуре в течение 60 мин). Полученную сырую (S)-4-(3-(((4-((2-(диметиламино)этил)(метил)карбамоилокси)-бензилокси)карбонил)(метил)амино)пропиламино)-3-(N-метил-6-(метилсульфонилтио)гексанамидо)-4-оксомасляную кислоту b6 немедленно использовали в следующей стадии без дополнительной очистки.
Стадия 2: Получение (S)-4-(3-(((4-((2-(диметиламино)этил)(метил)карбамоилокси)-бензилокси)карбонил)(метил)амино)пропиламино)-3-(N-метил-6-(метилсульфонилтио)гексанамидо)-4-оксомасляной кислоты b7
[509] Раствор 4-(((перфторфенокси)карбонилокси)метил)фенил 2-(диметиламино)-этил(метил)карбамата a3 из примера 1 (4,38 г; 7,60 ммоль; 1,30 экв.) в ацетонитриле (35,00 мл) охлаждали до 0°C на ледяной бане. Добавляли DIPEA (10,19 мл; 58,44 ммоль; 10,00 экв.) и смесь перемешивали при этой температуре в течение 1 минуты до того, как раствор сырого соединения b6 в ацетонитриле (35,00 мл) добавляли по каплям в течение 10 мин. После полного добавления смесь перемешивали при 0°C в течение дополнительных 5 минут, затем реакционную смесь анализировали помощью LCMS. Наблюдали полное превращение цвиттер-иона b6. Реакцию гасили путем добавления TFA (4,00 мл; 51,92 ммоль; 8,88 экв.) при 0°C. Все летучие вещества удаляли и остаток высушивали при <10 мбар и 40°C в течение 10 минут на роторном испарителе. Сырой остаток растворяли в смеси 6 мл H2O/MeCN/TFA 1:1:0,002 и 12 мл 0,1% TFA. Светло-коричневый раствор очищали с помощью RP-флэш-хроматографии. Раствор хранили на льду до введения пробы. Содержащие продукт фракции объединяли, замораживали и лиофилизировали с получением (S)-4-(3-(((4-((2-(диметиламино) этил)(метил)карбамоилокси)-бензилокси)карбонил)(метил)амино)пропиламино)-3-(N-метил-6-(метилсульфонилтио)гексанамидо)-4-оксомасляной кислоты b7. Выход: 3,25 г в виде соли TFA (68% выхода).
Пример 1D: Синтез NHS-активированного линкера - (S)-2,5-диоксопирролидин-1-ил-4-(3-(((4-((2-(диметиламино)этил)-(метил)карбамоилокси)бензилокси)карбонил)(метил)амино)пропиламино)-3-(N-метил-6-(метилсульфонилтио)гексанамидо)-4-оксобутаноат b8
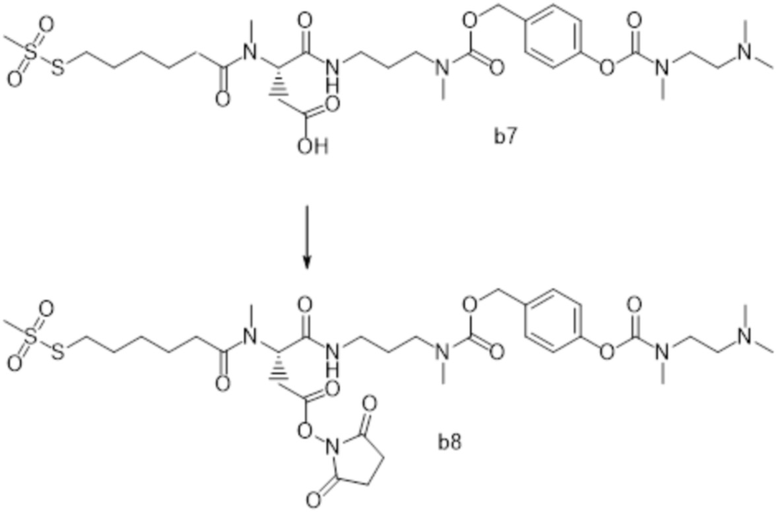
Схема 1D
[510] Получение (S)-2,5-диоксопирролидин-1-ил-4-(3-(((4-((2-(диметиламино)этил)(метил)-карбамоилокси)бензилокси)карбонил)(метил)амино)пропиламино)-3-(N-метил-6-(метилсульфонилтио)гексанамидо)-4-оксобутаноата b8 показано на схеме 1D
[511] Линкер b7 из примера 1C (2,02 г; 2,47 ммоль; 1,00 экв.) растворяли в дихлорметане (20 мл). Добавляли HOSu (852,72 мг; 7,41 ммоль; 3,00 экв.) и EDC (1,42 г; 7,41 ммоль; 3,00 экв.) и смесь перемешивали при комнатной температуре в атмосфере азота. При растворении добавленных реагентов смесь превращалась в слегка желтую. Через 1 ч IPC с помощью LCMS показал хорошее превращение в продукт. Через 75 мин реакционную смесь разбавляли DCM (75 мл) и отмывали один раз с помощью 75 мл подкисленного рассола (250 мл рассола смешивали с 2,5 мл 1 M HCl и полученный раствор насыщали с помощью дополнительной NaCl). Водный слой (pH приблизительно 6,5) экстрагировали с помощью 50 мл DCM. Комбинированные органические фазы высушивали над Na2SO4 и фильтровали. После добавления TFA (190 мкл; 2,47 ммоль; 1,00 экв.) летучие вещества испаряли. Маслянистый остаток высушивали в высоком вакууме в течение 30 минут с получением на выходе сырого (S)-2,5-диоксопирролидин-1-ил-4-(3-(((4-((2-(диметиламино)этил)(метил)-карбамоилокси)бензилокси)карбонил)(метил)амино)пропиламино)-3-(N-метил-6-(метилсульфонилтио)гексанамидо)-4-оксобутаноата b8 (приблизительно 2,4 г) в виде белой пены. Сырой продукт растворяли в 5 мл безводного ацетонитрила (общий объем ~ 6 мл) и очищали с помощью RP-LPLC. Элюенты для хроматографии охлаждали, затем замораживали и лиофилизировали. Лиофилизированный, сухой материал объединяли с безводным ацетонитрилом (всего приблизительно 20 мл). Растворитель удаляли (роторный испаритель, 40°C) и высушивали в высоком вакууме с получением на выходе 2,05 г (91% выхода) (S)-2,5-диоксопирролидин-1-ил-4-(3-(((4-((2-(диметиламино)этил)(метил)-карбамоилокси)бензилокси)карбонил)(метил)амино)пропиламино)-3-(N-метил-6-(метилсульфонилтио)гексанамидо)-4-оксобутаноата b8 в виде бесцветной пены. Материал растворяли в 22,37 мл безводного DMSO. Прозрачный, бесцветный раствор стерильно фильтровали (стерильные PTFE шприцевые фильтры, Millipore Millex-LG, 25 мм, 0,2 мкм) с получением на выходе приблизительно 23,5 мл прозрачного, бесцветного раствора. Материал хранили в аликвотах в атмосфере аргона при -80°C. С помощью анализа LCMS определяли, что активность NHS составляла 79%.
Пример 1E: Синтез 6-(метилсульфонилтио)гексановой кислоты c3

Схема 1E
[512] Получение 6-(метилсульфонилтио)гексановой кислоты c3 показано на схеме 1E.
[513] 6-бромегксановую кислоту (5,89 г; 30,19 ммоль; 1,00 экв.) и метантиосульфонат натрия (4,05 г; 30,19 ммоль; 1,00 экв.) растворяли в безводном N,N-диметилформамиде (47,10 мл). Реакционную смесь перемешивали при 80°C в течение 3 часов и затем оставляли остывать до комнатной температуры. Анализ LCMS подтвердил образование продукта c3. Реакционную смесь разбавляли с помощью 116 мл воды и отмывали трижды с помощью 233 мл диэтилового эфира. Органическую фазу отмывали рассолом (350 мл), высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении до объема, составляющего 40 мл. Полученный раствор осаждали в 2× 1000 мл холодного н-гептана при -18 °C в течение ночи. Супернатант декантировали и осадок растворяли в 80 мл диэтилового эфира (40°C). Полученный раствор осаждали в 2× 1000 мл холодного н-гептана при -18 °C в течение 3 часов. Осадок отфильтровывали и белое твердое вещество высушивали в высоком вакууме в течение ночи с получением 6-(метилсульфонилтио)гексановой кислоты c3. Выход: 5,72 г; 84 %.
Пример 1F. Синтез 1-(2,5-диоксопирролидин-1-ил)-9-(2-(2-(3-(пиридин-2-илдисульфанил)пропанамидо)этокси)этил)-нонандиоата d9

Схема 1F
[514] Получение 1-(2,5-диоксопирролидин-1-ил)-9-(2-(2-(3-(пиридин-2-илдисульфанил)пропанамидо)этокси)этил)-нонандиоата d9 показано на схеме 1F.
Стадия 1: Синтез 9-(бензилокси)-9-оксононановой кислоты d2
[515] Смесь азелаиновой кислоты d1 (103,00 г; 547,23 ммоль; 1,10 экв.), бензилового спирта (51,73 мл; 497,48 ммоль; 1,00 экв.) и моногидрата п-толуолсульфоновой кислоты (1,99 г; 10,45 ммоль; 0,02 экв.) в толуоле (561,82 мл) кипятили с обратным холодильником в течение 5 ч в аппарате Дина-Старка. Реакционную смесь затем оставляли охлаждаться до комнатной температуры и хранили в течение 1 ч при этой температуре. Затем твердое вещество отфильтровывали и отмывали с помощью 50 мл толуола. Остаток обрабатывали с помощью приблизительно 800 мл 0,4 M раствора NaOH и pH доводили до pH = 9 с использованием приблизительно 30 мл 4 M NaOH. Водную фазу отделяли, к органической фазе добавляли 100 мл воды и 80 мл 0,4 M NaOH, pH доводили до 9. Комбинированные водные фазы подкисляли с помощью 50 мл 1 M серной кислоты до pH = 5 и экстрагировали дважды с помощью 200 мл MTBE. Комбинированные органические фазы отмывали с помощью 200 мл рассола, высушивали над MgSO4 и растворитель испаряли в вакууме. Сырой продукт (62 г) растворяли в 40 мл гептана и 20 мл THF (общий объем 120 мл) и очищали за два цикла с помощью автоматизированной флэш-хроматографии. Элюент испаряли и остаток получали в виде масла (55,00 г; 39,72 %). Остаток растворяли в 80 мл MTBE и добавляли 2000 мл гептана, нагретого до 30°C. Для кристаллизации раствор хранили при -20°C в течение ночи. Продукт собирали с помощью фильтрования через стеклянный фильтр (размер пор 3 мкм) и отмывали с помощью 500 мл гептана. Белые кристаллы высушивали в течение 4 ч при <1 мбар с получением 9-(бензилокси)-9-оксононановой кислоты d2. Выход:48,02 г; 35%.
Стадия 2: Синтез Boc-защищенного 1-(2-(2-аминоэтокси)этил)-9-бензилнонандиоата d4
[516] DCC (3,32 г; 16,08 ммоль; 1,10 экв.) добавляли к раствору Boc-2-(2-аминоэтокси)этанола d3 (3,00 г; 14,62 ммоль; 1,00 экв.), соединения d2 (4,07 г; 14,62 ммоль; 1,00 экв.) и DMAP (446,41 мг; 3,65 ммоль; 0,25 экв.) в DCM (50,00 мл). Образующуюся суспензию перемешивали при комнатной температуре в течение ночи. Белую суспензию фильтровали через фритту 20 мл шприца и осадок на фильтре отмывали с помощью приблизительно 50 мл DCM. Продукт обнаруживали с помощью LCMS. Все летучие вещества удаляли и остаток растворяли в DCM (общий объем 20 мл). Полученную слегка мутную суспензию очищали с помощью флэш-хроматографии. Содержащие продукт фракции объединяли и все летучие вещества испаряли с получением на выходе Boc-защищенного 1-(2-(2-аминоэтокси)этил)-9-бензилнонандиоата d4 в виде бесцветного масла. Выход: 6,11 г; 90 %.
Стадия 3: Синтез Boc-защищенной 9-(2-(2-аминоэтокси)этокси)-9-оксононановой кислоты d5
[517] 10% Pd/C (348,58 мг; 0,33 ммоль; 0,03 экв.) добавляли к раствору Boc-защищенного 1-(2-(2-аминоэтокси)этил)-9-бензилнонандиоата d4 (6,10 г; 13,10 ммоль; 1,00 экв.) в THF (75,00 мл) и воздушный слой в колбе заменяли на азот. Затем колбу помещали в 50°C водяную баню и поток водорода пропускали через черную суспензию с использованием баллона и канюли 20G. Через 5 минут поток водорода останавливали и смесь энергично перемешивали в атмосфере водорода при 50°С до завершения процесса реакции снятия защитной группы. Полученную суспензию фильтровали через целитовую прокладку. Осадок на фильтре отмывали с помощью дополнительного EtOAc (25 мл). Летучие вещества комбинированных фильтратов испаряли и сырой материал растворяли в EtOAc (30 мл). Раствор фильтровали через 0,22 мкм-RC шприцевой фильтр и летучие вещества удаляли с получением на выходе Boc-защищенной 9-(2-(2-аминоэтокси)этокси)-9-оксононановой кислоты d5 в виде слегка желтого масла. Выход: 5,09 г, количественный.
Стадия 4: Синтез 9-(2-(2-аминоэтокси)этокси)-9-оксононановой кислоты d6
[518] TFA (5,00 мл; 64,90 ммоль; 4,79 экв.) добавляли к раствору Boc-защищенной 9-(2-(2-аминоэтокси)этокси)-9-оксононановой кислоты d5 (5,09 г; 13,55 ммоль; 1,00 экв.) в дихлорметане (10,00 мл). Через 40 минут дополнительную аликвоту TFA (5,00 мл; 64,90 ммоль; 4,79 экв.) добавляли к смеси и поток азота пропускали через реакционную смесь. LCMS через 70 мин выявила полное превращение исходного материала. Летучие вещества удаляли и коричневый, маслянистый остаток разбавляли с помощью диэтилового эфира (50 мл), после чего образовывалась двухфазная система. Эмульсию снова освобождали от всех летучих веществ на роторном испарителе и коричневый, маслянистый остаток высушивали в высоком вакууме в течение ночи. Толуол (30 мл) добавляли к остатку и смесь снова освобождали от всех летучих веществ на роторном испарителе (водяная баня при 60°C). Материал высушивали на роторном испарителе при <9 мбар и температурой водяной бани, составляющей 60°C, с получением на выходе 9-(2-(2-аминоэтокси)этокси)-9-оксононановой кислоты d6 в виде коричневого масла. Выход: 6,04 г; 97%.
Стадия 5: Синтез 9-оксо-9-(2-(2-(3-(пиридин-2-илдисульфанил)пропанамидо)этокси)этокси)нонановой кислоты d8
[519] DIPEA (951,90 мкл; 5,46 ммоль; 5,00 экв.) добавляли к раствору 9-(2-(2-аминоэтокси)этокси)-9-оксононановой кислоты d6 (500,00 мг; 1,09 ммоль; 1,00 экв.) и сукцинимидил-3-[[(2-пиридил)тио]тио]пропионата d7 (375,05 мг; 1,20 ммоль; 1,10 экв.) в ацетонитриле (5,00 мл). Реакционную смесь перемешивали при комнатной температуре в течение 45 мин. Реакцию гасили путем добавления уксусной кислоты (1,00 мл; 17,48 ммоль; 16,02 экв.). Смесь разбавляли с помощью 6,5 мл ацетонитрила и 14,5 мл воды и полученный раствор очищали с помощью препаративной HPLC. Содержащие продукт фракции объединяли, замораживали в жидком азоте и лиофилизировали в течение ночи. Партии продукта объединяли с DCM. Летучие вещества удаляли и маслянистый остаток высушивали в высоком вакууме с получением на выходе 9-оксо-9-(2-(2-(3-(пиридин-2-илдисульфанил)пропанамидо)этокси)-этокси)нонановой кислоты d8 в виде слегка желтого масла; 392,00 мг; 61%.
Стадия 6: Синтез 1-(2,5-диоксопирролидин-1-ил)-9-(2-(2-(3-(пиридин-2-илдисульфанил)-пропанамидо)этокси)этил)-нонандиоата d9
[520] К раствору 9-оксо-9-(2-(2-(3-(пиридин-2-илдисульфанил)пропанамидо)этокси)-этокси)нонановой кислоты d8 (392,00 мг; 0,67 ммоль; 1,00 экв.) в дихлорметане (5,00 мл) последовательно добавляли HOSu (153,81 мг; 1,34 ммоль; 2,00 экв.) и EDC*HCl (256,19 мг; 1,34 ммоль; 2,00 экв.). Суспензию перемешивали при комнатной температуре, после чего твердое содержимое медленно растворяли с течением времени и образовывался светло-желтый прозрачный раствор. Через 80 мин добавляли дополнительный HOSu (50,00 мг; 0,43 ммоль; 0,65 экв.) и EDC*HCl (50,00 мг; 0,26 ммоль; 0,39 экв.). Через 120 мин анализ с помощью LCMS выявил завершение реакции. Летучие вещества удаляли и остаток растворяли в ацетонитриле (5 мл). Добавляли воду (5 мл) и H2O/MeCN/TFA 1:1:0,002 (4 мл). Ацетонитрил добавляли к мутной эмульсии до получения прозрачного раствора. Полученный раствор очищали с помощью препаративной HPLC. Все содержащие продукт фракции хранили на льду до того, как их объединяли, замораживали и лиофилизировали. Партии продукта объединяли с дихлорметаном и все летучие вещества удаляли. Продукт высушивали в высоком вакууме с получением на выходе 1-(2,5-диоксопирролидин-1-ил)9-(2-(2-(3-(пиридин-2-илдисульфанил)пропанамидо)этокси)этил)-нонандиоата d9 в виде бесцветного масла; 455,00 мг; количественный выход.
Пример 1G: Синтез метки очистки N,N'-((10S,22S)-10-(2-(диметиламино)ацетамидо)-16-(4-меркаптоникотиноил)-2-метил-4,11,21-триоксо-2,5,12,16,20-пентаазагексакозан-22,26-диил)бис(2-(диметиламино)ацетамида) e8

Схема 1G
[521] Получение метки очистки N,N'-((10S,22S)-10-(2-(диметиламино)ацетамидо)-16-(4-меркаптоникотиноил)-2-метил-4,11,21-триоксо-2,5,12,16,20-пентаазагексакозан-22,26-диил)бис(2-(диметиламино)ацетамида) e8 показано на схеме 1G.
Стадия 1: Синтез (9H-флуорен-9-ил)метил-бис(3-аминопропил)карбамата e2
[522] Fmoc-OSu (9,77 г; 28,96 ммоль; 1,20 экв.) добавляли к раствору 1,9-бис-Boc-1,5,9-триазанонан e1 (8,00 г; 24,14 ммоль; 1,00 экв.) в THF (80,00 мл). К этой смеси раствор K2CO3 (5,00 г; 36,20 ммоль; 1,50 экв.) в воде (80,00 мл) добавляли по каплям в течение 10 минут при комнатной температуре. Белая эмульсия образовывалась во время добавления. Через 50 мин перемешивания при комнатной температуре реакционную смесь разбавляли этилацетатом (600 мл). Органический слой отмывали с помощью соляной кислоты (0,1 M, 3 × 200 мл), насыщенного раствора NaHCO3 (200 мл) и рассола (100 мл). После высушивания над MgSO4 и фильтрования все летучие вещества удаляли. Сырой остаток высушивали в высоком вакууме в течение 20 минут с получением белой пены. Эту пену растворяли в дихлорметане и очищали с помощью флэш-хроматографии. Содержащие продукт фракции объединяли и концентрировали с получением на выходе промежуточного соединения - 9H-флуорен-9-илметил-N,N-бис[3-(трет-бутоксикарбониламино)пропил]карбамата (не показано на схеме 1G) в виде бесцветного, стеклообразного твердого вещества; 12,81 г; 96%.
[523] Этот промежуточный продукт (12,78 г; 23,08 ммоль; 1,00 экв.) растворяли в TFA (30,00 мл; 389,39 ммоль; 16,87 экв.) при комнатной температуре. После полного растворения желтый раствор перемешивали при комнатной температуре в течение 35 мин. Продукт осаждали путем добавления по каплям реакционной смеси в диэтиловый эфир (2 мл реакционного раствора в 40 мл диэтилового эфира) в 50 мл пробирках Falcon. Пробирки Falcon центрифугировали при 7000×G и 0°C в течение 3 минут. Эфирный супернатант отбрасывали и остатки растворяли в метаноле (каждая пробирка - 1 мл). Комбинированные метанольные растворы добавляли по каплям к диэтиловому эфиру (200 мл) в 500 мл круглодонной колбе. Все пробирки отмывали метанолом (всего ~150 мл) и отмывочные растворы добавляли к смеси эфир/осадок, после чего образовывался бесцветный, прозрачный раствор. Этот раствор концентрировали и маслянистый остаток высушивали в высоком вакууме в течение ночи с получением (9H-флуорен-9-ил)метил-бис(3-аминопропил)карбамата e2 в виде белой пены: 13,68 г; количественный выход.
Стадия 2: Синтез (9H-флуорен-9-ил)метил-бис(3-((S)-2,6-диаминогексанамидо)пропил)карбамата e3
[524] DIPEA (20,44 мл; 117,20 ммоль; 5,00 экв.) добавляли к раствору соединения e2 (13,63 г; 23,44 ммоль; 1,00 экв.) и Boc-Lys(Boc)-OSu (24,95 г; 56,25 ммоль; 2,40 экв.) в DMF (250,00 мл) и светло-желтую смесь перемешивали при комнатной температуре в течение 45 мин. Реакционную смесь разбавляли этилацетатом (1200 мл) и органический слой отмывали соляной кислотой (0,1 M, 4 × 500 мл), насыщенным раствором NaHCO3 (3 × 250 мл) и рассолом (200 мл). После высушивания над MgSO4 и фильтрования все летучие вещества удаляли с получением на выходе Boc-защищенного промежуточного соединения (не показано на схеме 1G) в виде белой пены. Сырой остаток растворяли в дихлорметане (30 мл) и очищали с помощью колоночной флэш-хроматографии. Содержащие продукт фракции объединяли и все летучие вещества удаляли в вакууме. Чистый продукт осаждали из холодных растворов этилацетата. Метанол добавляли для полного растворения продукта. Испарение комбинированных фракций приводило к получению бесцветного масла, которое высушивали в высоком вакууме в течение ночи с получением Boc-защищенного промежуточного соединения: 18,27 г; 77%.
[525] Это промежуточное соединение (18,12 г; 17,94 ммоль; 1,00 экв.) растворяли в TFA (40,00 мл; 519,19 ммоль; 28,95 экв.). Во время растворения выделялось много газа, и смесь нагревалась приблизительно до 45°C и становилась желтой. Прозрачный, вязкий раствор перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь добавляли к диэтиловому эфиру (2 мл реакционного раствора в 40 мл эфира в 50 мл пробирке Falcon). После энергичного встряхивания двухфазная система превращалась в суспензию белого, порошкообразного осадка в кислом диэтиловом эфире. Смесь переносили в пробирки Falcon и все пробирки Falcon центрифугировали при 0°C и 7000×G в течение 3 мин и супернатант отбрасывали. Все осадки отмывали 40 мл диэтилового эфира каждый и центрифугирование повторяли. После того, как снова отбросили супернатанты, все осадки предварительно высушивали на роторном испарителе с образованием сухих порошков. Все аликвоты объединяли и высушивали в высоком вакууме в течение ночи с получением (9H-флуорен-9-ил)метил-бис(3-((S)-2,6-диаминогексанамидо)пропил)карбамата e3: 19,52 г; количественный выход.
Стадия 3: Синтез соединения e5
[526] DIPEA (18,02 мл; 103,29 ммоль; 6,00 экв.) добавляли к суспензии N,N-диметилглицина e4 (8,88 г; 86,08 ммоль; 5,00 экв.) и PyBOP (44,79 г; 86,08 ммоль; 5,00 экв.) в DMF (180,00 мл). Смесь перемешивали в течение 15 минут при комнатной температуре, после чего образовывался прозрачный раствор. Этот раствор добавляли одной порцией к раствору (9H-флуорен-9-ил)метил-бис(3-((S)-2,6-диаминогексанамидо)пропил)карбамата e3 (18,35 г; 17,22 ммоль; 1,00 экв.) и DIPEA (15,01 мл; 86,08 ммоль; 5,00 экв.) в DMF (180,00 мл). Желтую реакционную смесь перемешивали при комнатной температуре. Через 35 мин реакционную смесь гасили путем добавления TFA (22,02 мл; 285,82 ммоль; 16,60 экв.). Раствор концентрировали с получением на выходе желтого масла, которое затем растворяли в метаноле (450 мл) с получением на выходе 600 мл темно-желтого раствора. Этот промежуточный продукт (не показан на схеме 1G) осаждали дважды из диэтилового эфира. После отмывки осадка диэтиловым эфиром продукт - густую суспензию концентрировали и продукт высушивали в вакууме в течение 72 часов: 23,17 г; 96%. Пиперидин (17,50 мл; 0,18 моль; 10,83 экв.) добавляли одной порцией к раствору промежуточного продукта (23,00 г; 0,02 моль; 1,00 экв.) в DMF (69,00 мл) и оранжевый раствор перемешивали при комнатной температуре в течение 35 мин. Реакционную смесь концентрировали и TFA (200 мл) добавляли к остатку. Густую суспензию фильтровали через фритту PE. Продукт осаждали из диэтилового эфира и после того, как продукт отмывали диэтиловым эфиром, его высушивали в вакууме с получением на выходе соединения e5 в виде грязно-белого порошка: 19,82 г; 93%.
Стадия 4: Синтез N,N'-((10S,22S)-10-(2-(диметиламино)ацетамидо)-2-метил-16-(4-(метилдисульфанил)никотиноил)-4,11,21-триоксо-2,5,12,16,20-пентаазагексакозан-22,26-диил)бис(2-(диметиламино)ацетамида) e7
[527] PyBOP (528,17 мг; 1,01 ммоль; 1,00 экв.) и 4-(метилдисульфанил)никотиновую кислоту e6 (320,00 мг; 1,01 ммоль; 1,00 экв.), полученную путем реакции 4-меркаптоникотиновой кислоты с S-метилметантиолсульфонатом, суспендировали в ацетонитриле (10,00 мл). Добавляли DIPEA (1,59 мл; 9,13 ммоль; 9,00 экв.), после чего образовывался прозрачный, темно-желтый раствор. Через 2 мин при комнатной температуре смесь добавляли к раствору соединения e5 (1 317,49 мг; 1,01 ммоль; 1,00 экв.) в ацетонитриле (10,00 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Добавляли TFA (1,59 мл; 20,64 ммоль; 20,33 экв.) и продукт осаждали из диэтилового эфира (140 мл). Осадок отмывали диэтиловым эфиром (100 мл). Осадок растворяли в метаноле (8 мл) и осаждали из диэтилового эфира (140 мл) второй раз. Продукт высушивали в высоком вакууме в течение ночи с получением на выходе N,N'-((10S,22S)-10-(2-(диметиламино)ацетамидо)-2-метил-16-(4-(метилдисульфанил)никотиноил)-4,11,21-триоксо-2,5,12,16,20-пентаазагексакозан-22,26-диил)бис(2-(диметиламино)ацетамида) e7 в виде порошка: 1,231 г; 82%.
Стадия 5: Синтез N,N'-((10S,22S)-10-(2-(диметиламино)ацетамидо)-16-(4-меркаптоникотиноил)-2-метил-4,11,21-триоксо-2,5,12,16,20-пентаазагексакозан-22,26-диил)бис(2-(диметиламино)ацетамида) e8
[528] NaBH4 (220,07 мг; 5,82 ммоль; 7,00 экв.) добавляли четырьмя порциями к раствору N,N'-((10S,22S)-10-(2-(диметиламино)ацетамидо)-2-метил-16-(4-(метилдисульфанил)никотиноил)-4,11,21-триоксо-2,5,12,16,20-пентаазагексакозан-22,26-диил)бис(2-(диметиламино)ацетамида) e7 (1,231 г; 0,83 ммоль; 1,00 экв.) в воде (15,00 мл). После последнего добавления смесь перемешивали в течение 60 минут при комнатной температуре. TFA (1,00 мл; 12,98 ммоль; 15,62 экв.) добавляли к реакционной смеси. Реакционную смесь разбавляли водой до конечного объема, составляющего 25 мл. Раствор очищали с помощью препаративной HPLC. Содержащие продукт фракции объединяли, замораживали и лиофилизировали с получением TFA соли N,N'-((10S,22S)-10-(2-(диметиламино)ацетамидо)-16-(4-меркаптоникотиноил)-2-метил-4,11,21-триоксо-2,5,12,16,20-пентаазагексакозан-22,26-диил)бис(2-(диметиламино)ацетамида) e8; 942,00 мг; 79%.
Пример 2A: Получение функционализированной амином гиалуроновой кислоты (HA)
[529] Аминные функциональные группы вводили на HA. Согласно некоторым аспектам степень функционализации, составляющую вплоть до приблизительно 11%, вводили для последующей функционализированной малеимидом HA и прикрепления лекарственного средства к малеимиду, и вплоть до приблизительно 5% для последующей функционализированной тиолом HA.


 .
.
Схема 2A
[530] Аминная функционализация HA проходит в соответствии со схемой реакции 2A:
[531] 200 мг натриевой соли 116 кДа гиалуроновой кислоты f1 растворяли в 25 мл забуференного раствора (100 мM MES, 0,4 M 1,3-диаминопропана, pH 5,5) при интенсивном перемешивании. Добавляли 3,00 экв. (229,14 мг; 1,50 ммоль) HOBt по отношению к функциональным группам карбоновой кислоты на HA. Добавляли 0,93 экв. (88,92 мг; 0,46 ммоль) EDC⋅HCl, после чего суспензия медленно превращалась в раствор. Раствор перемешивали при температуре окружающей среды в течение ночи и впоследствии образовывалась суспензия. К суспензии добавляли 50,00 экв. (3,39 г; 24,94 ммоль) ацетата натрия с образованием раствора. Модифицированную HA f2 осаждали путем добавления абсолютного этанола, отмывали этанолом и высушивали в высоком вакууме в течение ночи. Осадки растворяли в 16 мл воды с образованием прозрачного раствора. Добавляли 5,40 мл 4 M NaOH и раствор перемешивали при температуре окружающей среды в течение двух часов. Добавляли 1,24 мл уксусной кислоты. Амин-функционализированную HA f3 осаждали путем добавления абсолютного этанола, отмывали с помощью 80 объем./объем.% этанола и абсолютного этанола и высушивали в высоком вакууме с получением белых осадков. 0,93 экв. EDC давали в результате аминную функционализацию, составляющую приблизительно 11% карбоксилатных групп на HA. Для получения амин-функционализированной HA с приблизительно 5% аминной функционализацией использовали 0,40 экв. (38,63 мг; 0,20 ммоль) EDC⋅HCl.
[532] Пример 2B: Получение функционализированной малеимидом HA
[533] Функционализированную малеимидом HA получали путем реакции амин-функционализированной HA f3 со сложным эфиром малеимидопропионовой кислоты NHS f4 в соответствии со следующей схемой реакции:

Схема 2B
[534] 176,1 мг амин-функционализированной HA f3 (0,252 ммоль/г амина) растворяли в 17,6 мл 100 мM буфера HEPES, pH 7,4. Добавляли 150,48 мг (0,57 ммоль; 10,00 экв.) N-гидроксисукцинимидного сложного эфира 3-малеимидопропионовой кислоты f4 в 9,50 мл ацетонитриле. Реакционную смесь перемешивали при температуре окружающей среды в течение точно 60 минут. 27,1 мл 1 M раствора ацетата натрия, pH 5,5, добавляли к раствору при перемешивании. Абсолютный этанол добавляли для осаждения HA. Полученные осадки последовательно отмывали с помощью 80 объем./объем.% этанола и абсолютного этанола. Осадки объединяли и материал высушивали в высоком вакууме в течение трех часов с последующим хранением при -20 °C. Полученные осадки растворяли в 17,6 мл 1% уксусной кислоты. 17,6 мл 1 M раствора ацетата натрия, pH 5,5, добавляли к раствору. Полученную смесь фильтровали через 0,22 мкм PES шприцевой фильтр диаметром 33 мм и малеимид-функционализированную HA f5 осаждали путем добавления абсолютного EtOH. Осадки последовательно отмывали с помощью 80% объем./объем. этанола и абсолютного этанола. Осадки объединяли и высушивали в высоком вакууме в течение 3 часов с получением 159,50 мг белых осадков. Определение содержания малеимида выполняли с помощью обратного анализа Эллмана путем добавления 2-меркаптоэтанола и обнаружения непрореагировавшего, остаточного 2-меркаптоэтанола. Обнаруживали степень малеимидной функционализации, составляющую приблизительно 10%, по отношению к изначально доступным карбоксилатным группам в нативной HA.
Пример 2C: Получение функционализированной тиолом HA
[535] Функционализированную тиолом HA разрабатывали для обеспечения разложения геля HA после инкубации геля поперечно-сшитой HA при физиологических условиях. В этом примере вводили сложноэфирную связь с использованием азелаиновой кислоты.
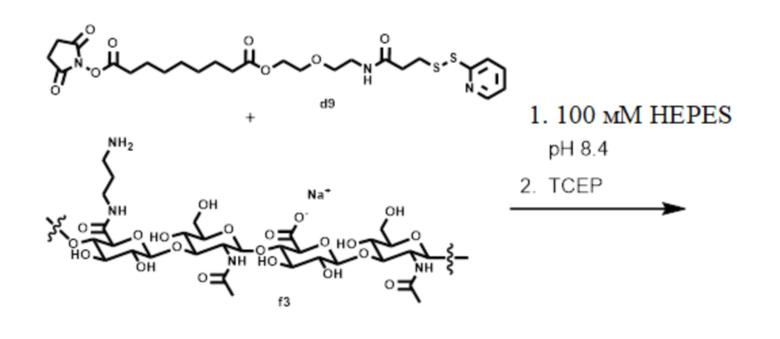

Схема 2C
[536] 166,90 мг амин-функционализированной HA f3 (0,104 ммоль/г функциональной аминогруппы) растворяли в 13,9 мл 100 мM буфера HEPES, pH 8,40. Свежеприготовленный раствор 75,3 мг (0,11 ммоль; 5,00 экв.) сложного эфира NHS d9 (см. схему 1F) в 7,5 мл ацетонитрила добавляли к смеси. Смесь перемешивали при температуре окружающей среды в течение 120 минут для получения дисульфид-функционализированной HA (не показано). Свежеприготовленный раствор 63,2 мг HCl-соли трис(2-карбоксиэтил)фосфина (TCEP) (0,22 ммоль; 10,00 экв.) в 2,1 мл воды добавляли к реакционной смеси. Раствор перемешивали в течение одного часа при температуре окружающей среды. 22,9 мл 1 M раствора ацетата натрия, pH 5,5, добавляли к реакционной смеси. Полученный раствор распределяли между пробирками Falcon. Для осаждения содержания HA добавляли абсолютный этанол. Пробирки закрывали, встряхивали и центрифугировали. Полученные осадки последовательно промывали с помощью 80 объем./объем.% этанола и абсолютного этанола. Осадки объединяли и высушивали в высоком вакууме в течение трех часов и затем хранили при -20 °C в атмосфере аргона до дальнейшего использования. Осадки растворяли в 16,7 мл 1% уксусной кислоты с энергичным перемешиванием в атмосфере аргона. 16,7 мл 1 M раствор ацетата натрия pH 5,5 добавляли к раствору. Полученную смесь фильтровали через 0,22 мкм PES шприцевой фильтр диаметром 33 мм в пробирки Falcon и осаждали путем добавления абсолютного этанола. Пробирки закрывали, встряхивали и центрифугировали. Осадки последовательно отмывали с помощью 80% объем./объем. этанола и абсолютного этанола. Осадки объединяли и высушивали в высоком вакууме в течение трех часов с получением 150,10 мг тиол-функционализированной HA f6 в виде белых осадков. Определение содержания тиола проводили с помощью анализа Эллмана. Обнаруживали степень тиоловой функционализации, составляющую приблизительно 4%, по отношению к изначально доступным карбоксилатным группам в нативной HA.
Пример 3A: Получение конъюгата линкер-ранибизумаб

Схема 3A
[537] Конъюгирование Rbz с линкером b8 из примера 1D выполняли в соответствии со схемой 3A
[538] Замену буфера и концентрирование можно проводить либо с помощью колонки HiPrep с последующим концентрированием посредством центрифужных фильтров (малый масштаб), либо с использованием системы фильтрования тангенциальным потоком (TFF) (большой масштаб).
[539] 62 мл Rbz в концентрации 40 мг/мл, составленные в 10 мM гистидина, 10 масс.% α,α-D-трегалозы, 0,01% Tween 20, pH 5,5 использовали в этом примере. После замены буфера на 30 мM фосфата, pH 7,4, и концентрирования раствор Rbz фильтровали с использованием 33 мм фильтров Millex GV с размером пор, составляющим 0,22 мкм. Выделяли приблизительно 50 г раствора белка. После определения концентрации образец разбавляли до 40 мг/мл путем добавления фосфатного буфера с получением конечного объема, составляющего 53,1493 г. 2118,5 мг (85%) Rbz извлекали с концентрацией 39,8 мг/мл, и общий объем составлял приблизительно 53 мл объема.
[540] 1990 мг Rbz (50 мл при 39,8 мг/мл) в 30 мM фосфата натрия, pH 7,4, охлаждали на льду. Добавляли 15 экв. (8,0 мл) соединения b8 (пример 1D) (с поправкой на содержание NHS, 100 мM маточного раствора в DMSO) и раствор осторожно встряхивали (без использования мешалки).
[541] Раствор инкубировали в течение 5 минут на льду, сразу после чего следовал сдвиг рН, и производили замену буфера для удаления избыточных молекул линкера из раствора конъюгата Rbz-линкер. Сдвиг буфера выполняли путем добавления 0,12 об. экв. (6 мл) 0,5 М янтарной кислоты, рН 3,0, и раствор осторожно встряхивали. рН раствора смещали в сторону приблизительно рН 4,0. Замену буфера проводили с использованием Äkta P-900, оборудованного колонкой GE HiPrep. Буфер представлял собой 5 мМ янтарную кислоту с pH 4,0, вводимую при скорости потока 8,0 мл/мин, с 13 циклами с объемом вводимой пробы 5 мл на цикл. Собрали 134 мл раствора продукта с концентрацией 14,5 мг/мл (расчет на основе коэффициента экстинкции нативного лекарственного средства).
[542] Образцы до и после конъюгирования анализировали с помощью масс-спектрометрии. Спектр деконволюции MS перед конъюгированием показал единственный пик Rbz при 48381. Спектр после конъюгирования показал пик Rbz при 48382, пик моноконъюгата g1 при 49066, бисконъюгата при 497543 и триконъюгата при 50437. Только основной продукт - моноконъюгат g1 показан на схеме 3А для ясности, и моноконъюгат выделяли из конъюгатов более высоких порядков, как описано ниже.
Пример 3B: Введение метки очистки в конъюгат Rbz-линкер


 .
.
Схема 3B
[543] Введение метки очистки e8 в конъюгат Rbz-линкер g1 выполняли в соответствии со схемой 3B
[544] К раствору 125 мл смеси конъюгата линкера, включая в себя моноконъюгат g1 (и конъюгаты более высокого порядка не показаны) (14,53 мг/мл, 1824 мг белка, 37,7 мкмоль), 2,5 молярных эквивалента метки очистки e8 (схема 1G) в отношении к содержанию белка добавляли при температуре окружающей среды (1886 мкл 50 мМ е8, 94,3 мкмоль, в воде) и раствор осторожно встряхивали с получением моноконъюгата Rbz-линкер с меткой очистки g2 и конъюгатов более высокого порядка (не показаны). Через 35 мин сдвиг рН до рН 7,4 и снятие защиты с амина осуществляли добавлением 0,170 об. экв. (21,4 мл) 0,5 М фосфата, 200 мМ TriMED, pH 7,8 (объем раствора прикрепления метки не принимали во внимание), в течение которого защитная группа отщеплялась с получением моноконъюгата Rbz-линкер с меткой g3 и конъюгатов более высокого порядка (не показаны). Раствор хранили при контролируемой температуре 25°С в течение ночи в термостате.
[545] Приблизительно 148 мл раствора белка удаляли из термостата при 25°С и 0,419 об. экв. (52,4 мл, исходя из начального объема белка 125 мл, фактически добавляли 52,7 мл) 0,5 М янтарной кислоты, pH 3,0, добавляли к раствору g3 и конъюгатов более высокого порядка для получения значения pH, составляющего приблизительно рН 4,0.
Пример 3C: Выделение моноконъюгата Rbz-линкер
[546] Для очистки CIEC раствор белка, содержащий смесь неконъюгированного Rbz и смесь моноконъюгата Rbz-линкер с прикрепленной меткой g3 и конъюгаты более высокого порядка, разбавляли в 3,3 раз с помощью 20 мM янтарной кислоты, pH 4,0, до конечного объема, составляющего приблизительно 660 мл. Колонку GE Healthcare Source 15S (колонка XK26, высота - 5,2 см) использовали со следующими буферами: 20 мM янтарная кислота, pH 4,0 (буфер A); и 20 мM янтарная кислота, 1 M NaCl, pH 4,0 (буфер B). Градиент являлся линейным, 10%-50% B, 32 CV (20 мл/мин - объемная скорость потока). Загрузка составляла приблизительно 300 мг. Смесь конъюгатов анализировали с помощью MS до CIEC и в спектре деконволюции MS указаны: пик m/z 48380 (нативный Rbz), пик 49573 (моноконъюгат g3), пик 50766 (бисконъюгат) и пик 51958 (триконъюгат). Фракция 1 CIEC преимущественно содержала нативный Rbz (пик m/z 48380), фракция 2 CIEC преимущественно содержала моноконъюгат g3 (пик m/z 49573) и фракция 3 CIEC преимущественно содержала бисконъюгат (пик m/z 50766).
[547] После выделения моноконъюгата Rbz-линкер g3 раствор белка концентрировали до приблизительно 5 мг/мл с использованием фильтрования в тангенциальном потоке. Исходный материал содержал приблизительно 450 мл моноконъюгата Rbz-линкер g3 в концентрации приблизительно 0,85 мг мл, составленного в сукцинатном буфере, рН 4,0. Образец фильтровали с использованием одного фильтра Millex GV диаметром 33 мм с размером пор 0,22 мкм. Получали 68 мл раствора моноконъюгата Rbz-линкер в концентрации 4,82 мг/мл.
Пример 3D: Расщепление метки очистки
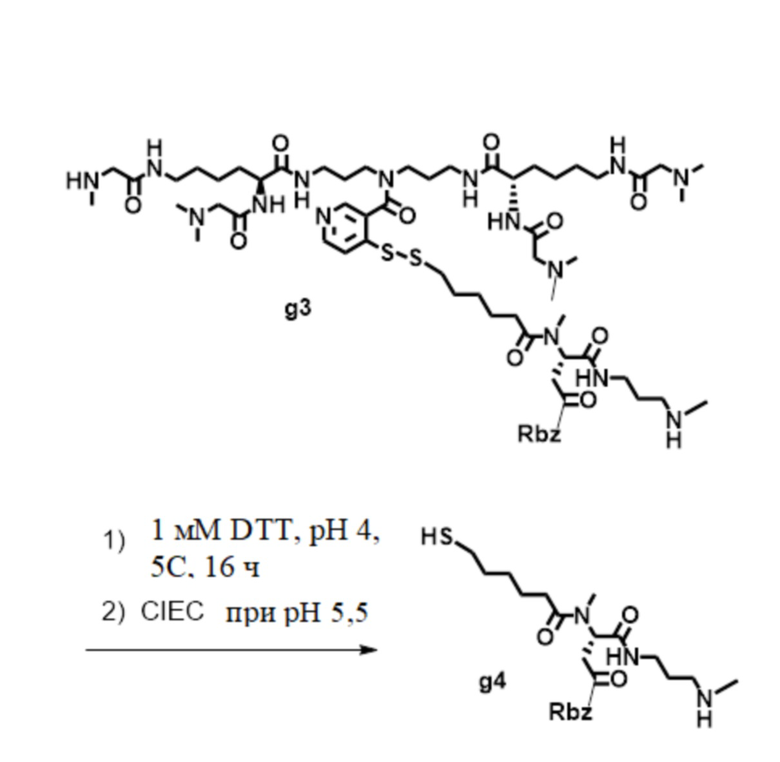
Схема 3D
[548] Метку очистки e8 удаляли с помощью процедуры, показанной на схеме 3C.
[549] Расщепление метки очистки e8 (снятие метки) осуществляли путем инкубации моноконъюгата Rbz- линкер g3 (68 мл, 4,82 мг/мл) с DTT в течение ночи при 2-8°C с концентрацией DTT, составляющей 1 мM. 25 мM маточного раствора DTT в 20 мM янтарной кислоты, pH 4,0, получали путем растворения 0,0161 г DTT в 4,175 мл сукцинатного буфера. Раствор фильтровали через 13 мм фильтр Millex-GV (размер пор - 0,22 мкм). Раствор моноконъюгата Rbz-линкер и 25 мM маточного раствора DTT охлаждали до 4°C на льду. 2,838 мл 25 мM раствора DTT добавляли к раствору белка с получением конечной концентрации DTT, составляющей 1 мM. Инкубацию проводили в течение ночи при 2-8°C. Удаление метки очистки подвергали мониторингу с помощью MS. Конъюгат Rbz-спейсер-линкер-метка очистки до расщепления характеризовался пиком при 49573, что указывало на моноконъюгат метки очистки g3. Конъюгат Rbz-линкер g4 после расщепления характеризовался пиком при 48709, что указывало на моноконъюгат Rbz-линкер после расщепления метки очистки.
[550] Конъюгат Rbz-линкер g4 очищали с помощью CIEC. 70,9 мл моноконъюгата Rbz-линкер после опосредованного DTT снятия защитной группы разбавляли в 12 раз с помощью 10 мM гистидина, pH 5,5, до конечного объема, составляющего приблизительно 850 мл. Колонка представляла собой колонку GE Healthcare Source 15S XK26 (высотой 5,2 см). Буферная система являлась следующей: 10 мM гистидин, pH 5,5 (буфер A); и 10 мM гистидин, 500 мM NaCl, pH 5,5 (буфер B). Градиент являлся следующим: линейный, 0%-50% B, 25 CV (17,5 мл/мин - объемная скорость потока). Загрузка составляла приблизительно 300 мг.
[551] После стадии CIEC осмолярность раствора белка доводили с помощью дополнительного разбавления с использованием буфера B (10 мM гистидина, 500 мM NaCl, pH 5,5) с получением концентрации NaCl, составляющей приблизительно 150 мM. 63 мл моноконъюгата Rbz-линкер собирали во время цикла CIEC. 15,6 мл 10 мM гистидина, 500 мM NaCl, pH 5,5 добавляли к образцу с получением общего объема, составляющего 78,6 мл моноконъюгата Rbz-спейсер-линкер g4.
Пример 3E: Концентрация конъюгата Rbz-линкер
[552] Для получения конъюгата HA-линкер-Rbz h1 с белковой загрузкой, составляющей 40 мг/мл, моноконъюгат Rbz-линкер g4 концентрировали до выше 60 мг/мл. Две мембраны Amicon Ultra 15 PLCG Ultracel с MWCO (номинальное отсечение по молекулярной массе) 10 кДа использовали для концентрирования раствора белка с помощью центрифугирования при 3000 g. Получали приблизительно 4,5 г раствора моноконъюгата Rbz-линкер g4 с содержанием белка, составляющим 64,6 мг/мл (293,8 мг). Моноконъюгат Rbz- линкер g4 анализировали с помощью MS и обнаружили пик при 48710, указывающий на моноконъюгат Rbz-линкер.
Пример 4A: Конъюгирование конъюгата линкер-Rbz с функционализированной малеимидом HA

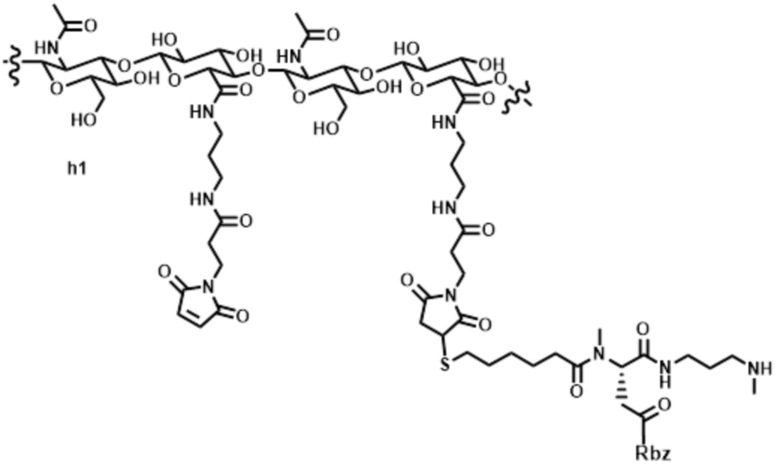
Схема 4A
[553] Конъюгирование моноконъюгата Rbz-линкер g4 с функционализированной малеимидом HA f5 проводили, как показано на схеме 4A
[554] Конъюгирование моноконъюгата Rbz-линкер g4 с функционализированной малеимидом HA f5 проводили путем добавления концентрированного раствора моноконъюгата Rbz-линкер g4 до 1,3 экв. малеимид-функционализированной HA f5 по отношению к содержанию тиола, что давало в результате концентрацию белка (Rbz), составляющую 44 мг/мл (на основании содержания тиола) и содержание HA, составляющее приблизительно 0,49%. Образцы моноконъюгата Rbz-линкер (раствор белка, составляющий 64,6 мг/мл, составленный в 10 мM гистидина, 150 мM NaCl, pH 5,5), полученные в соответствии с примером 3C, нагревали до окружающей температуры. Образцы фильтровали через 33 мм фильтр GV Millex с размером пор, составляющим 0,22 мкм. Определяли, что содержание тиола раствора моноконъюгата Rbz-линкер g4 составляло 69,0 мг/мл. 1300 мкл раствора моноконъюгата Rbz-линкер g4 переносили в 5 мл пробирки Эппендорф. Добавляли буфер, содержащий 336 мкл 10 мM гистидина, 150 мM NaCl, 0,01% Tween 20 pH 5,5. Добавляли 68 мкл 10 мM гистидина, 150 мM NaCl, 0,2% Tween 20 pH 5,5. Добавляли 335 мкл раствора HA-малеимид f5 (содержание 116 кДа HA - 30 мг/мл, а содержание малеимида - 0,24 ммоль/г). Полученный раствор тщательно перемешивали и инкубировали в течение 4 часов при температуре окружающей среды. Через 4 часов времени реакции образец, составляющий 25 мкл, отбирали и анализировали посредством SEC. 92% моноконъюгата Rbz-линкер были уже связанными с малеимид-функционализированной HA.
Пример 4B: Тиол-малеимидное поперечное сшивание с образованием гелей поперечно-сшитой НА, содержащих конъюгат линкер-лекарственное средство
[555] Поперечное сшивание выполняли в соответствии со схемой 4B:

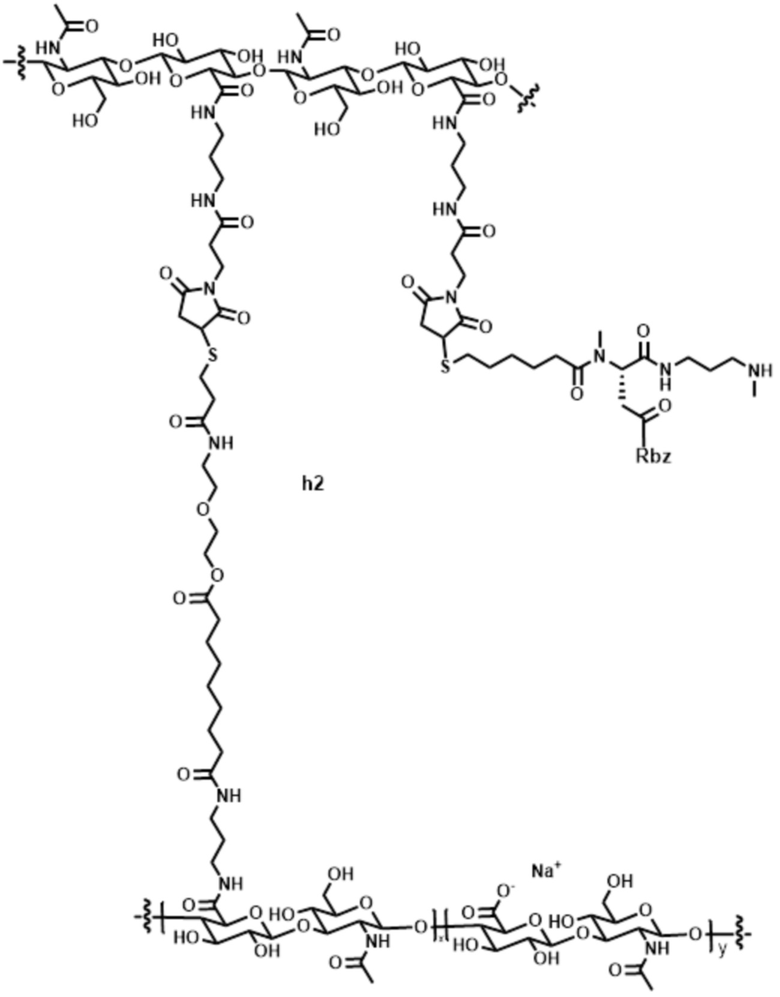
Схема 4B
[556] После 2014 мкл конъюгата линкер-Rbz HA h1 инкубировали в течение 4 часов. Добавляли 201 мкл раствора HA-тиола f6 (содержание 27,8 мг/мл 116 кДа HA с содержанием тиола, составляющим 0,098 ммоль/г), что приводило к конечному содержанию белка, составляющему 40 мг/мл (в расчете на содержание тиола), и конечному содержанию НА в полученном растворе, составляющему 7,01 мг/мл. Раствор тщательно перемешивали и набирали в шприц на 2 мл, снабженный тупой канюлей 18 G. Раствор быстро наполняли в восемь 1-мл шприцев с наконечником Люэра с использованием наконечника шприца для заполнения. На шприцах устанавливали завинчивающуюся крышку, и их инкубировали в течение примерно 24 часов в вертикальном положении при температуре окружающей среды. Впоследствии шприцы инкубировали при 5°С в течение трех недель. Реакция поперечного сшивания завершалась в шприцах с получением на выходе конъюгата Rbz на основе геля поперечно-сшитой HA h2.
Пример 4C. Высвобождение Rbz из геля поперечно-сшитой HA, содержащего Rbz
[557] Высвобождение Rbz из геля поперечно-сшитой HA, содержащего Rbz, анализировали in vitro с использованием материала, который получали в соответствии с пример 4B c небольшими поправками. 13-17 мг геля Rbz-HA h2 переносили в стерильную, апирогенную пробирку Эппендорф. Буфер для высвобождения (60 мМ фосфата натрия, 3 мМ EDTA, 0,01% Tween, рН 7,4) добавляли в соответствии с соотношением 975 мкл буфера для 25 мг НА. Пробирки не переворачивали или встряхивали. Все пробирки хранили при контролируемой температуре 37°С в термостате. В разные моменты времени из термостата вынимали пробирку и центрифугировали (9300 об/мин, 3 мин). Супернатант переносили в новую пробирку Эппендорф, и концентрацию белка в супернатанте определяли путем измерения оптической плотности при 280 нм с контрольной длиной волны 338 нм с использованием коэффициента экстинкции Rbz, составляющего 1,9 мл/см⋅мг. Для каждого образца высвобождение в % рассчитывали с использованием перенесенной массы и содержания белка в геле (таблица 4с).
Таблица 4C. Высвобождение ранибизумаба
Пример 5A: Получение конъюгата линкер-G6.31 AARR

Схема 5A
[558] Конъюгирование G6.31 AARR с линкером b8 из примера 1D выполняли в соответствии со схемой 5A.
[559] Замену буфера и концентрирование можно проводить либо с помощью колонки HiPrep, с последующим концентрированием с помощью центрифужных фильтров (малый масштаб), либо с использованием системы фильтрования тангенциальным потоком (TFF) (большой масштаб).
[560] 31 мл G6.31 AARR (показанный как "G6.31" на схеме 5A и схемах реакции ниже) в концентрации 40 мг/мл, составленной в 20 мM гистидина, 240 мM сахарозы, 0,01% Tween 20, pH 5,5 использовали в этом примере. После замены буфера на 30 мM фосфат, pH 7,4, и концентрирования приблизительно 23 г раствора белка извлекали и определяли концентрацию. Образец разбавляли до 40 мг/мл путем добавления фосфатного буфера. Получали общий объем 32,0 г раствора белка, содержащего 1277 мг G6.31 в концентрации, составляющей 39,9 мг/мл.
[561] 1277 мг G6.31 AARR (32,0 мл в концентрации 39,9 мг/мл) в 30 мM фосфата натрия, pH 7,4 охлаждали на льду. Добавляли 15 экв. (4,6 мл) соединения b8 (пример 1D) (с поправкой на содержание NHS, 100 мМ маточного раствора в DMSO) и раствор несколько раз переворачивали.
[562] Раствор немедленно инкубировали на льду. Через 5 мин реакцию конъюгирования останавливали, сдвигая pH до приблизительно 4,0. После этого добавляли 0,12 об. экв. (3,8 мл) 0,5 М янтарной кислоты, рН 3,0, и раствор переворачивали несколько раз. Замену буфера на 5 мМ янтарную кислоту, pH 4,0, проводили за 10 циклов при скорости потока 8 мл/мин с использованием Äkta Basic 10, оборудованного колонкой GE HiPrep. 4 мл раствора вводили за один цикл. Всего собрали 93,1 г раствора продукта с концентрацией 12,9 мг/мл.
[563] Образцы до и после конъюгирования анализировали с помощью масс-спектрометрии. Спектр деконволюции MS перед конъюгированием показал единственный пик G6.31 при 47390. Спектр после конъюгирования показал пик AARR G6.31 при 47392, пик моноконъюгата j1 при 48077, бисконъюгата при 48766, триконъюгата при 49452 и тетраконъюгата при 50147. Для ясности на схеме 3А показан только основной продукт - моноконъюгат j1, и моноконъюгат выделяли из конъюгатов более высокого порядка, как описано ниже.
Пример 5B: Введение метки очистки в конъюгат G6.31 AARR-линкер

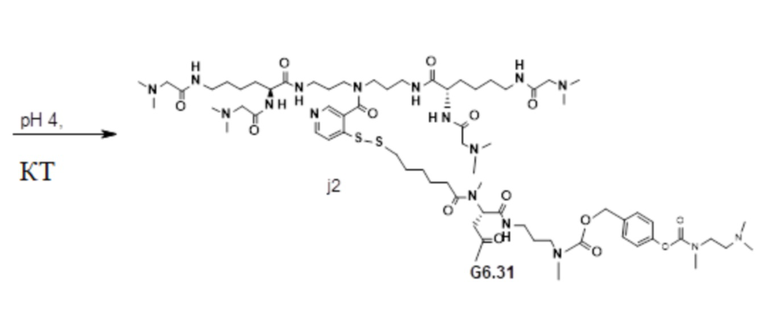
 .
.
Схема 5B
[564] Введение метки очистки e8 в конъюгат G6.31 AARR-линкер j1 выполняли в соответствии со схемой 5B.
[565] К раствору 93,1 мл смеси конъюгата линкера, включая в себя моноконъюгат j1 (нативный G6.31 AARR и конъюгаты более высокого порядка, не показано) (12,9 мг/мл, 1203 мг белка, 25,4 мкмоль (коэффициент экстинкции и молекулярная масса AARR G6.31 использовали для простоты)), 2,5 молярные эквиваленты метки очистки e8 (схема 1G) по содержанию белка добавляли при температуре окружающей среды (1270 мкл 50 мМ e8 в 20 мМ янтарной кислоты, рН 4,0, 63,5 мкмоль) и раствор осторожно встряхивали для получения моноконъюгат линкера с прикрепленной меткой G6.31 j2 и конъюгатов более высокого порядка (не показаны). Через 50 мин сдвиг рН до рН 7,4 и снятие защитной группы с амина осуществляли путем добавления 0,170 об. экв. (15,8 мл) 0,5 М фосфата, 200 мМ TriMED, рН 7,8 (объем добавленного раствора метки очистки не учитывали). Поскольку после сдвига pH в смеси все еще обнаруживается бисконъюгат с одной меткой, дополнительные 0,2 экв. (100 мкл 50 мМ е8 в 20 мМ янтарной кислоте, рН 4,0, 5 мкмоль) метки очистки е8 (схема 1G) в отношении содержания белка добавляли к смеси. Раствор хранили в термостате при контролируемой температуре 25°С в течение ночи, в течение которой защитная группа линкера моноконъюгата линкера с меткой j2 (и конъюгатов более высокого порядка) отщеплялась с образованием j3.
[566] Приблизительно 110 мл раствора белка удаляли из 25°C термостата и 0,419 об. экв. (39,0 мл в расчете на начальный объем белка 93,1 мл) 0,5 M янтарной кислоты, pH 3,0 добавляли к раствору j3 и конъюгатам более высокого порядка для получения значения pH, составляющего приблизительно pH 4,0.
Пример 5C: Выделение моноконъюгата G6.31 AARR-линкер
[567] Для очистки CIEC (катионообменной хроматографией) раствор белка, содержащий смесь неконъюгированного G6.31 и смесь моноконъюгата G6.31 AARR-линкер с меткой j3 и высших конъюгатов, разбавляли в 3,3 раза 20 мМ янтарной кислотой рН 4,0 до конечного объема, составляющего приблизительно 500 мл. Колонку GE Healthcare Source 15S (колонка HiScale26, высота 9,8 см) использовали со следующими буферами: 20 мМ янтарная кислота, рН 4,0 (буфер А); и 20 мМ янтарная кислота, 1 М NaCl, pH 4,0 (буфер B). Градиент был линейным: 0-50% B в 40 CV или 10-50% B в 32 CV при скорости потока 20 мл/мин. Загрузка составляла приблизительно 600 мг за цикл. Смесь конъюгата анализировали с помощью MS до CIEC и в спектре деконволюции MS, пик при 47395 (нативный G6.31 AARR), пик при 48584 (моноконъюгат j3), пик при 49782 (бисконъюгат), пик при 50986 (триконъюгат) и пик при 52174 (тетраконъюгат). Собирали все пики CIEC. Фракции, содержащие преимущественно моноконъюгат j3, объединяли (534,2 мл; 0,67 мг/мл) и использовали на следующей стадии.
Пример 5D: Расщепление метки очистки
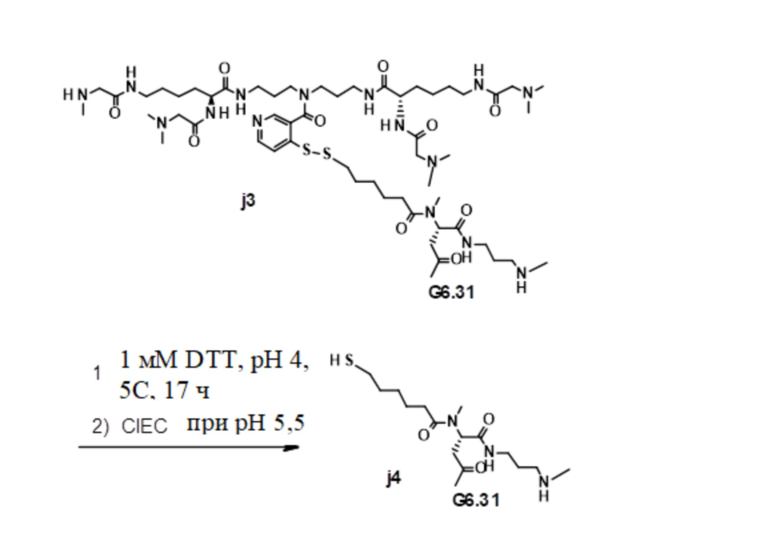
Схема 5D
[568] Метку очистки e8 удаляли с помощью процедуры, показанной на схеме 5D.
[569] Расщепление метки очистки e8 (удаление метки) проводили путем инкубации выделенного моноконъюгата G6.31AARR-линкер с меткой j3 (534,2 мл, 0,67 мг/мл) в присутствии DTT. 25 мМ маточного раствора DTT получали путем растворения 0,1364 г DTT в 35,4 мл 20 мМ янтарной кислоты, рН 4,0. Раствор моноконъюгата G6.31-линкер и 25 мМ маточный раствор DTT охлаждали до 4°С. 22,3 мл 25 мМ маточного раствора DTT добавляли к раствору белка с получением конечной концентрации DTT, составляющей 1 мМ. Полученный раствор хранили в течение ночи при контролируемой температуре 5°С в термостате. Удаление метки очистки подвергали мониторингу с помощью MS. Перед расщеплением обнаружили пик на 48585, указывающий на моноконъюгат с меткой j3. После расщепления обнаружили пик при 47720, что подтверждает удаление метки и образование моноконъюгата G6.31 AARR-линкер j4 .
[570] Моноконъюгат G6.31 AARR- линкер j4 очищали с помощью CIEC. 556,5 мл моноконъюгата G6.31-линкер после опосредованного DTT снятия защитной группы разбавляли в 3 раза с помощью 20 мM янтарная кислоты, pH 4,0, до конечного объема, составляющего приблизительно 1660 мл. Использовали колонку GE Healthcare Source 15S HiScale26 (высотой 9,8 см). Буферная система была следующей: 10 мM гистидин, pH 5,5 (буфер A); 20 мM янтарная кислота, pH 4,0 (A2); и 10 мM гистидин, 500 мM NaCl, pH 5,5 (буфер B). После загрузки колонки колонку отмывали с помощью 2 CV буфера A2 с последующей отмывкой колонки с помощью 2 CV A1. Далее прилагали нелинейный градиент: 0%-50% B, 25 CV (20 мл/мин - объемная скорость потока). Загрузка составляла приблизительно 300 мг.
[571] После стадии CIEC осмолярность раствора белка доводили с помощью дополнительного разбавления с использованием буфера B (10 мM гистидин, 500 мM NaCl, pH 5,5) с получением концентрации NaCl, составляющей приблизительно 150 мM. 130 мл моноконъюгата G6.31-линкер собирали во время цикла CIEC. 28 мл 10 мM гистидина, 500 мM NaCl, pH 5,5 добавляли к образцу с получением общего объема, составляющего 158 мл моноконъюгата G6.31 AARR-линкер j4.
Пример 5E: Концентрирование конъюгата G6.31 AARR-линкер
Для получения HA-линкер-G6.31 AARR k1 (пример 6A ниже) с содержанием белка, составляющим 40 мг/мл, моноконъюгат G6.31 AARR-линкер j4 концентрировали до концентрации выше 60 мг/мл. 4 мембраны Amicon Ultra 15 PLCG Ultracel с MWCO 10 кДа использовали для концентрирования раствора белка путем центрифугирования при 3000 g. Получали приблизительно 3,9 г раствора моноконъюгата G6.31 AARR-линкер j4 с содержанием белка, составляющим 76,5 мг/мл (298 мг). Концентрированный раствор анализировали с помощью MS и обнаруживали пик при 47723, соответствующий моноконъюгату G6.31-линкер j4. Образец разбавляли до 65 мг/мл путем добавления 689 мкл 10 мM гистидина, 150 мM NaCl, pH 5,5.
Пример 6A: Конъюгирование моноконъюгата G6.31 AARR-линкер j4 с функционализированной малеимидом HA


Схема 6A
[572] Конъюгирование моноконъюгата G6.31-линкер j4 с функционализированной малеимидом HA f5 с получением конъюгата линкер-G6.31 AARR-HA k1 проводили, как показано на схеме 6A.
[573] Конъюгирование моноконъюгата G6.31-линкер j4 с функционализированной малеимидом HA f5 (пример 2B) проводили путем добавления концентрированного раствора моноконъюгата G6.31-линкер j4 с 1,3 экв. функционализированной малеимидом HA f5 в отношении содержания тиола, что давало в результате концентрацию белка (G6.31 AARR), составляющую 44 мг/мл (в расчете на содержание тиола), и содержание HA, составляющее приблизительно 0,49%. Образцы моноконъюгата G6.31 AARR-линкер j4 (раствор белка с концентрацией 64,7 мг/мл, составленный в 10 мM гистидине, 150 мM NaCl, pH 5,5), полученные в соответствии с примером 5D, оставляли нагреваться до температуры окружающей среды. Образцы фильтровали через фильтр GV Millex диаметром 33 мм с размером пор, составляющим 0,22 мкм. Определили, что содержание тиола раствора моноконъюгата G6.31-линкер j4 составляет 73,4 мг/мл. 2190 мкл раствора моноконъюгата G6.31-линкер j4 переносили в 50 мл пробирку Falcon. Добавляли 735,5 мкл буфера, содержащего 10 мM гистидина, 150 мM NaCl, 0,01% Tween 20, pH 5,5. Добавляли 115,3 мкл 10 мM гистидина, 150 мM NaCl, 0,2% Tween 20, pH 5,5. Добавляли 612,5 мкл стерильно отфильтрованного (фильтр Millex GP, диаметр - 25 мм, размер пор - 0,22 мкм) раствора HA-малеимид f5 (30 мг/мл - содержание 116 кДа HA с содержанием малеимида, составляющим 0,24 ммоль/г). Полученный раствор тщательно перемешивали и инкубировали в течение 4 часов при температуре окружающей среды. Через 4 часа времени реакции образец в 25 мкл отбирали и анализировали с помощью SEC. 95% моноконъюгата G6.31 AARR-линкер j4 конъюгировали с функционализированной малеимидом HA f5 с получением конъюгата линкер-G6.31 AARR-HA k1.
Пример 6B: Тиол-малеимидное поперечное сшивание с образованием гелей, содержащих линкер-G6.31 AARR-сшитая HA
[574] Сшивание тиол-функционализированной HA f6 и конъюгата линкер-G6.31 AARR-HA k1 с получением гидрогеля, содержащего линкер-G6.31 AARR-сшитая HA k2 проводили в соответствии со схемой 6B:


Схема 6B
[575] После 3628 мкл конъюгата линкер-G6.31-HA k1 инкубировали в течение 4 часов. Добавляли 363 мкл стерильно отфильтрованного (фильтр Millex GP, диаметр 25 мм, размер пор - 0,22 мкм) раствора функционализированной тиолом HA f6 (пример 2C) (28,4 мг/мл - содержание 116 кДа HA с содержанием тиола, составляющим 0,098 ммоль/г), в результате чего конечное содержание белка составляет 40 мг / мл (в расчете на содержание тиола) и конечное содержание HA 7,16 мг/мл в полученном растворе. Раствор тщательно перемешивали и набирали в 5 мл шприц, снабженный тупой канюлей калибра 18 G. Раствор быстро наполняли в восемнадцать 1 мл шприцев с наконечником Люэра с использованием наконечника шприца для заполнения. На шприцах устанавливали завинчивающуюся крышку и их инкубировали в течение примерно 24 часов в вертикальном положении при температуре окружающей среды. Впоследствии шприцы инкубировали при 5°С в течение трех недель. Реакция поперечного сшивания завершалась в шприцах с получением на выходе конъюгата G6.31 на основе геля поперечно-сшитой HA k2.
Пример 6C: Высвобождение G6.31 AARR из геля поперечно-сшитой HA, содержащего G6.31
[576] Высвобождение G6.31 AARR из геля поперечно-сшитой HA, содержащего G6.31 AARR k2 анализировали in vitro с использованием материала из примера 6B. 11-16 мг геля G6.31-HA переносили в стерильную апирогенную пробирку Эппендорф. Буфер для высвобождения (60 мM фосфат натрия, 3 мM EDTA, 0,01% Tween, pH 7,4) добавляли в соответствии с соотношением 975 мкл буфера для 25 мг HA. Пробирки не переворачивали или встряхивали. Все пробирки хранили при контролируемой температуре 37°С в термостате. В разные моменты времени из термостата вынимали пробирку и центрифугировали (9300 об/мин, 3 мин). Супернатант переносили в новую пробирку Эппендорф и концентрацию белка в супернатанте определяли путем измерения оптической плотности при 280 нм с контрольной длиной волны 338 нм с использованием коэффициента экстинкции G6.31, составляющего 1,38 мл/см⋅мг. Для каждого образца высвобождение в % рассчитывали с использованием перенесенной массы и содержания белка в геле (таблица 6C).
Таблица 6C. Высвобождение G6.31
Пример 7A: Получение геля поперечно-сшитой HA, содержащего RabFab.
[577] Получение конъюгата RabFab-линкер проводили в соответствии с процедурами, описанными в примере 3A, 3B, 3C и 3D. Концентрированиe моноконъюгата RabFab-линкер проводили в соответствии с процедурой, описанной в примере 3E, за исключением того, что конъюгат концентрировали до концентрации, составляющей 46 мг/мл, из-за чего содержание белка в конечном геле составляло приблизительно 30 мг/мл.
[578] Конъюгирование конъюгата RabFab-линкер с функционализированной малеимидом HA проводили в соответствии с процедурой, описанной в примере 4A. 5502 мкл конъюгата RabFab-линкер смешивали с 1804 мкл буфера, содержащего 10 мM гистидин, 150 мM NaCl, 0,01% Tween 20 pH 5,5. Добавляли 289 мкл 10 мM гистидина, 150 мM NaCl, 0,2% Tween 20, pH 5,5. Добавляли 1124 мкл раствора HA-малеимид f5 (30 мг/мл - содержание 116 кДа HA с содержанием малеимида, составляющим 0,24 ммоль/г). Полученный раствор тщательно перемешивали и инкубировали в течение 4 часов при температуре окружающей среды.
[579] Получение геля поперечно-сшитой HA, содержащего RabFab, получали в соответствии с процедурой, описанной в примере 4B. К 8691 мкл конъюгата RabFab-линкер-HA добавляли 869 мкл раствора функционализированной тиолом HA f6 (22,6 мг/мл - содержание 116 кДа HA с содержанием тиола, составляющим 0,096 ммоль/г). Раствор тщательно перемешивали и набирали в шприц на 10 мл, снабженный тупой канюлей 18 G. Раствор быстро наполняли в 48 1 мл шприцев с наконечником Люэра с использованием наконечника шприца для заполнения. На шприцах устанавливали завинчивающуюся крышку и их инкубировали в течение приблизительно 24 часов в вертикальном положении при температуре окружающей среды. Впоследствии шприцы инкубировали при 5°С в течение трех недель. Реакция поперечного сшивания завершалась в шприцах с получением конъюгата RabFab на основе геля поперечно-сшитой HA m1.

Пример 7B: Получение меченного карбоксифлуоресцеином плацебо - геля HA
[580] Препарат амин-функционализированной HA получали в соответствии с процедурой, описанной в примере 2A. Для получения варианта HA с повышенной степенью функционализации амином 1,00 г 116 кДа HA растворяли в 125 мл 100 MES, 0,4 M 1,3-диаминопропанового буфера, pH 5,5, и использовали 1,15 г (7,48 ммоль) HOBt и 444,6 мг (2,32 ммоль) EDC. Далее получали мечение карбоксифлуоресцеином и малеимидом путем растворения 463 мг вышеупомянутой функционализированной амином HA в 46 мл 100 мM буфера HEPES pH 7,4 с последующим добавлением 1,5 мл раствора N-сукцинимидильного сложного эфира 5(6)-карбоксифлуоресцеина (5,28 мг/мл в ацетонитриле). Через один час инкубации при перемешивании при температуре окружающей среды свежеприготовленный раствор 396 мг NHS сложного эфира 3-малеимидопропионовой кислоты в 24 мл ацетонитриле добавляли к раствору. Через один дополнительный час инкубации при перемешивании при температуре окружающей среды обработку реакционной смеси проводили в соответствии с процедурой, описанной в примере 2B.
[581] Получение меченного карбоксифлуоресцеином геля HA проводили в соответствии со следующей процедурой: 140,6 мг меченной карбоксифлуоресцеином малеимидо-функционализированной HA растворяли в 6580 мкл буфера, содержащего 10 мM гистидин, 150 мM NaCl, 0,01% Tween 20, pH 5,5. 82,8 мг тиол-функционализированной HA растворяли в 2946 мкл буфера, содержащего 10 мM гистидин, 150 мM NaCl, 0,01% Tween 20, pH 5,5. 57,6 мг 2-меркаптоэтанола растворяли в 6216 мкл буфера, содержащего 10 мM гистидин, 150 мM NaCl, 0,01% Tween 20, pH 5,5. 500 мкл этого раствора 2-меркаптоэтанол переносили в новый флакон и разбавляли 49,5 мл буфера, содержащего 10 мM гистидин, 150 мM NaCl, 0,01% Tween 20, pH 5,5. 121,5 мг нативной 116 кДа HA растворяли в 8433 мкл разбавленного раствора 2-меркаптоэтанола. 8433 мкл этого раствора переносили в новый флакон и добавляли 2568 мкл раствора малеимид-HA. Полученный раствор кратковременно встряхивали, центрифугировали и инкубировали в течение 2 часов при температуре окружающей среды. 10 мл этого раствора переносили в новый флакон и добавляли 1 мл раствора тиол-HA. Раствор тщательно перемешивали и набирали в шприц на 10 мл, снабженный тупой канюлей 18 калибра. Раствор быстро наполняли в 34 шприца на 1 мл с наконечником Люэра с использованием наконечника шприца для наполнения и применяя объем наполнения, составляющий приблизительно 300 мкл на шприц. На шприцах устанавливали завинчивающуюся крышку, и их инкубировали в течение приблизительно 24 часов в вертикальном положении при температуре окружающей среды. Впоследствии шприцы инкубировали при 5°С в течение трех недель. Реакция поперечного сшивания завершалась в шприцах с получением плацебо - геля поперечно-сшитой, меченной карбоксифлуоресцеином HA m2.
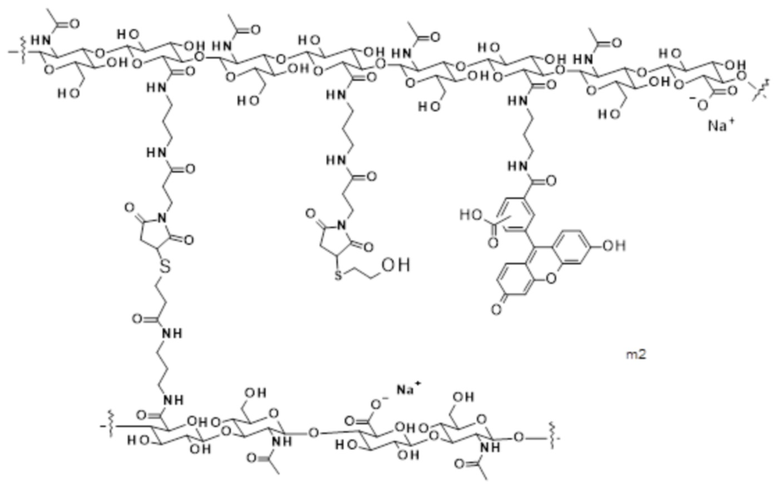
Пример 7C: In Vivo кинетические параметры высвобождения из гелей поперечно-сшитой HA, содержащих RabFab
[582] Гель поперечно-сшитой HA, содержащий RabFab, вводили не использовавшимся ранее в опытах новозеландским белым (NZW) кроликам посредством однократной билатеральной интравитреальной инъекции кроликам с последующим наблюдением, составляющим вплоть до 60 дней. Местный антибиотик (офтальмологическая мазь на основе тобрамицина) наносили на оба глаза дважды в день до лечения, сразу после инъекции и дважды в день после инъекции, за исключением животных, которых отправляли на вскрытие в дни 1 и 2. До введения дозы капли для расширения зрачков (1% тропикамида) наносили на каждый глаз для полного расширения зрачка. Проводили седацию животных изофлураном/газообразным кислородом до и во время процедуры. Алкаин (0,5%) также наносили на каждый глаз перед инъекцией. Конъюнктиву промывали хлоридом бензалкония (Zephiran™), разведенным в стерильной воде, фармакопея США до 1: 10000 (об./об.).
[583] Гель поперечно-сшитой HA, содержащий RabFab, вводили с помощью 30 мкл однократной интравитреальной инъекции (доза 0,3 мг) в оба глаза у всех животных. Дозы назначались сертифицированным ветеринаром-офтальмологом с использованием шприцов с наконечником Люэра объемом 1 мл с иглой 25 калибра х 1/2”. Чтобы имитировать клиническую дозировку, в глаза вводили дозу в нижневисочные квадранты, т.е. на 5 и 7 часов соответственно для левого и правого глаз (при взгляде на животного спереди). Глаза исследовали с помощью биомикроскопии с щелевой лампой и/или непрямой офтальмоскопии сразу после лечения.
[584] Всех животных подвергали обескровливанию путем разреза подмышечных или бедренных артерий после анестезии путем внутривенной инъекции пентобарбитала натрия. Водянистую влагу, стекловидное тело и ткань сетчатки собирали, быстро замораживали в жидком азоте и хранили при -80°С. Определение концентрации в стекловидном теле испытуемого изделия проводили с помощью антигенсвязывающего ELISA. Значения ниже LLOQ не использовали в фармакокинетическом анализе или для графических целей или целей обобщения.
[585] Анализ ELISA проводили с использованием способа целевого покрытия. В этом анализе целевое покрытие фосфорилировали пептидом cMet, конъюгированным с KLH (пептид P-cMet, от Yenzym, Южный Сан-Франциско, Калифорния). Для получения планшетов для анализа лиофилизированный пептид P-cMet восстанавливали с помощью 300 мкл буфера и дополнительно разбавляли до 1:200 в 0,05 М буфере бикарбоната натрия. Разбавленный пептид P-cMet (100 мкл на лунку) добавляли в 96-луночный планшет для микротитрования (Nunc, Thermo Scientific, Rockford, IL) и инкубировали в течение ночи при 2-8°C. После инкубации планшет трижды промывали 400 мкл промывочного буфера (BA029) с последующим блокированием разбавителем для анализа (промывочный буфер, содержащий 0,5% бычьего сывороточного альбумина и 0,05% проклина). Стандартную кривую получали путем разбавления Rabbit Fab (Genentech, Южный Сан-Франциско, Калифорния) до 200 нг/мл и затем серийного разбавления 1:2 в разбавителе для анализа. Контроли разбавляли 1:100 в разбавителе для анализа. Каждый образец разбавляли до количественного диапазона анализа с использованием разбавителя для анализа. Все образцы, контроли и стандарты добавляли в планшет при концентрации, составляющей 100 мкл, и инкубировали при комнатной температуре в течение 2 часов с аккуратным перемешиванием. После инкубации и промывания в каждую лунку добавляли 100 мкл детектирующего антитела (мышиное антитело к легкой цепи-HRP кролика, SouthernBiotech, Бирмингем, Алабама) после разведения 1/4000 в разбавителе для анализа. Затем планшеты инкубировали в течение 1 часа при комнатной температуре с легким перемешиванием. После дополнительной промывки в каждую лунку добавляли 100 мкл субстрата HRP (3,3',5,5'-тетраметилбензидин, TMB, от Kirkegard & Perry Laboratory, Гейтерсберг, Мэриленд) с последующей 15-минутной инкубацией при комнатной температуре с легким перемешиванием. Реакцию останавливали с помощью 100 мкл 1 М фосфорной кислоты. Планшет считывали при 450 нм для обнаружения и 630 нм в качестве эталонной длины волны (SpectraMax 384-plus; Molecular Devices, Саннивейл, Калифорния). Значения оптической плотности стандартов были наносили на график с использованием программного обеспечения для подбора 4-параметрической логистической кривой (Softmax, Molecular Devices), из которых значения концентрации для контрольных и испытуемых образцов получали путем экстраполяции.
[586] Концентрации в стекловидном теле определяли с помощью антигенсвязывающего анализа ELISA, как описано выше, и наносили на график как функцию времени. На фиг. 12 показан график, на котором обобщенно представлены витреальные концентрации как функция времени после инъекции. Свободный RabFab после введения IVT представлен синим цветом, тогда как свободный RabFab от высвобождения из поперечно-сшитой HA представлен красным. Точки представляют собой индивидуальные наблюдаемые данные, в то время как линии представляют собой модельные прогнозы ожидаемых витреальных концентраций на основе известных параметров PK для свободного Fab в стекловидном теле, высвобождения in vitro обратимого линкера пролекарственного средства, а также pH и температуры стекловидного тела кролика. Эти данные были подвергали некомпартментному анализу для получения фармакокинетических (PK) параметров.
[587] Фармакокинетические параметры определяли некомпартментным анализом с номинальным временем и дозой (Phoenix WinNonlin, Pharsight Corp, Маунтин-Вью, Калифорния). Параметры PK, рассчитанные с использованием некомпартментного анализа, приведены в таблице 2.
Таблица 1: Оценка параметров PK из исследования PK кроликов NZW
(мкг/мл)
(день*мкг/мл)
(мл/день)
(мл)
[588] Фармакокинетика RabFab в стекловидном теле после высвобождения из геля поперечно-сшитой HA и RabFab у новозеландских кроликов согласуется с прогнозами, основанными на высвобождении in vitro. Начальные более высокие концентрации обусловлены дозой раствора, содержащего ~ 3,6% свободного Fab и ~ 4,9% свободного Fab-HA. Период полувыведения из стекловидного тела кролика оценивается в 53 дня.
[589] Конечный период полужизни свободного Fab в стекловидном теле равен периоду полужизни обратимого линкера пролекарственного средства. Это означает, что как только динамика высвобождения лекарственного средства из НА и последующего выведения из стекловидного тела достигнет равновесия, эффективный период полувыведения активного лекарственного средства в стекловидном теле будет в 53/3,2 = 16,5 раз больше по сравнению с тем периодом, который, как правило, наблюдают после инъекции IVT свободного Fab.
Пример 5E: Отсутствие значительной фрагментации или движения частиц в глазу NHP.
[590] Двум яванским макакам вводили двустороннее однократное введение ITV плацебо-геля поперечно-сшитой HA-флуоресцеина (50 мкл/глаз) в нижний височный квадрант. Животных наблюдали в течение 30 дней в отношении клинических наблюдений, изменений массы тела, потребления пищи и глазных офтальмологических наблюдений (IOP, биомикроскопических (щелевая лампа) и фундоскопических исследований. Кроме того, в течение того же периода подвергали мониторингу местоположение и когезивность материала с использованием гониоскопии, визуализации передней камеры глаза, визуализации глазного дна с использованием конфокального сканирующего лазерного офтальмоскопа и флуорометрии с использованием Fluoroton.
[591] На фигуре 13A представлено репрезентативное изображение cSLO, полученное на 15-й день. TA (стрелка) остается в нижней части стекловидного тела и не закрывает центральную ямку (F) или диск зрительного нерва (ON). Фигура 13В представляет собой изображение, полученное при вскрытии с использованием кобальтово-синего света после удаления переднего отрезка глаза и хрусталика. Обратите внимание, что ТА (стрелка) остается когезивным. Как можно видеть, плацебо-гель поперечно-сшитой HA m2 продемонстрировал минимальную фрагментацию и движение через 30 дней.
Пример 7F: Исследование переносимости геля поперечно-сшитой HA, конъюгированного с RabFab, на кролике
[592] Трем новозеландским белым кроликам вводили одностороннее введение ITV геля поперечно-сшитой HA, конъюгированного с RabFab (50 мкл/глаз), в нижний височный квадрант. Животных наблюдали в течение 60 дней в отношении клинических наблюдений, изменений массы тела, потребления пищи и офтальмологических наблюдений (IOP, биомикроскопические (щелевая лампа) и фундоскопические исследования). Образцы сыворотки собирали для ADA и TK. При вскрытии глаза удаляли и обрабатывали в отношении гистопатологии. На фигуре 14 показан гистологический срез. Как можно видеть, гель поперечно-сшитой HA, конюгированный с RabFab, хорошо переносился в двухмесячном исследовании. Не наблюдалось клеточного инфильтрата, воспалительной реакции и реакции на инородное тело (6 глаз).
Пример 7G: Исследование переносимости геля поперечно-сшитой HA, конъюгированного с G6.31 AARR, у яванских макак
[593] Двум яванским макакам вводили двусторонне одну инъекцию ITV геля поперечно-сшитой HA, конъюгированного с Fab к VEGF, G6.31 AARR (50 мкл/глаз; 1,92 мг Fab/глаз) в нижнем височном квадранте. Животных наблюдали в течение 3 месяцев (92 дня) в отношении клинических наблюдений, изменений массы тела, потребления пищи и офтальмологических наблюдений (IOP, биомикроскопические (щелевая лампа) и фундоскопические исследования). Местонахождение и когезивность материала подвергали мониторингу в течение того же периода с использованием гониоскопии и визуализации передней камеры глаза. Образцы сыворотки брали для оценки ADA и TK, а глаза оценивали в отношении гистопатологии через 3 месяца.
[594] Гидрогель оставался когезивным и находился в нижней части стекловидного тела на протяжении всего периода оценки. Не наблюдалось значительного воспаления в течение жизни, несмотря на индукцию ADA у обоих животных к 28-му дню. Отсутствовали какие-либо связанные с испытуемым изделием изменения в клинических наблюдениях, качественном потреблении пищи и массе тела. На фигуре 15 показан самый нижний гистологический срез нижнего сферического сегмента глаза, который содержит испытуемое изделие. Как можно видеть, гель поперечно-сшитой HA, конъюгированный с G6.31 AARR, хорошо переносился в 3-месячном исследовании. Никакого клеточного инфильтрата, воспалительной реакции и реакции на инородное тело не наблюдалось (4 глаза).
[595] По сравнению с гидрогелем в форме частиц на основе ПЭГ, конъюгированным с ранибизумабом, гель поперечно-сшитой HA, конъюгированный с G6.31 AARR, демонстрирует превосходный профиль безопасности. При введении в нижнюю полость стекловидного тела гель поперечно-сшитой HA, конъюгированный с G6.31 AARR, не перемещается и остается ниже зрительной оси и, следовательно, не должен нарушать зрение пациента. И наоборот, гидрогели в форме частиц на основе ПЭГ свободно перемещаются в полости стекловидного тела.
[596] Гель поперечно-сшитой HA, конъюгированный с G6.31 AARR, остается когезивным и не образует значительного количества свободных фрагментов в форме частиц, что ограничивает риск блокады оттока. Фракция гидрогеля в форме частиц на основе ПЭГ наблюдалась в передней камере глаза яванского макака.
Пример 8: Иллюстративные оптимизированные антитела к VEGF для применения в конъюгатах антител согласно настоящему изобретению
[597] Любое из оптимизированных антител к VEGF, описанных в этом примере, можно использовать для получения конъюгатов антител, как описано в примерах 3A-4D выше. Например, можно использовать любое оптимизированное антитело к VEGF, описанное в международной заявке на патент № PCT/US2016/053454. В таблице 3 описаны иллюстративные оптимизированные антитела к VEGF, которые можно использовать, а также аминокислотные последовательности доменов VH и VL для каждого антитела. В таблице 4 описаны аминокислотные последовательности HVR VL для антител к VEGF, описанных в таблице 3. В таблице 5 описаны аминокислотные последовательности HVR VH для антител к VEGF, описанных в таблице 3. Согласно конкретным вариантам осуществления используют антитело к VEGF G6.31 AARR (также называемое в настоящем документе “G6.31.AARR”).
Таблица 3: Аминокислотные последовательности VH и VL для иллюстративных антител к VEGF
HC-A40E.HC-T57E
(G6.31 AAEE)
(G6.31 AARR)
Таблица 4: Последовательности HVR VL для антител из таблицы 3
(SEQ ID NO: 8)
(SEQ ID NO:9)
(SEQ ID NO: 23)
(SEQ ID NO: 8)
(SEQ ID NO:9)
(SEQ ID NO: 10)
(SEQ ID NO: 8)
(SEQ ID NO:9)
(SEQ ID NO: 10)
HC-A40E.HC-T57E
(G6.31 AAEE)
(SEQ ID NO: 8)
(SEQ ID NO:9)
(SEQ ID NO: 10)
(G6.31 AARR)
(SEQ ID NO: 8)
(SEQ ID NO:9)
(SEQ ID NO: 10)
(SEQ ID NO: 8)
(SEQ ID NO:9)
(SEQ ID NO: 23)
(SEQ ID NO: 8)
(SEQ ID NO:9)
(SEQ ID NO: 10)
(SEQ ID NO: 8)
(SEQ ID NO:9)
(SEQ ID NO: 10)
(SEQ ID NO: 8)
(SEQ ID NO:9)
(SEQ ID NO: 10)
(SEQ ID NO: 8)
(SEQ ID NO:9)
(SEQ ID NO: 10)
(SEQ ID NO: 8)
(SEQ ID NO:9)
(SEQ ID NO: 10)
(SEQ ID NO: 8)
(SEQ ID NO:9)
(SEQ ID NO: 23)
(SEQ ID NO: 8)
(SEQ ID NO:9)
(SEQ ID NO: 10)
(SEQ ID NO: 8)
(SEQ ID NO:9)
(SEQ ID NO: 10)
(SEQ ID NO: 8)
(SEQ ID NO:9)
(SEQ ID NO: 10)
Таблица 5: Последовательности HVR VH для антител из таблицы 3
(SEQ ID NO:1)
(SEQ ID NO: 53)
(SEQ ID NO:3)
(SEQ ID NO:1)
(SEQ ID NO: 53)
(SEQ ID NO:3)
(SEQ ID NO:1)
(SEQ ID NO: 53)
(SEQ ID NO:3)
HC-A40E.HC-T57E
(G6.31 AAEE)
(SEQ ID NO:1)
(SEQ ID NO:3)
(G6.31 AARR)
(SEQ ID NO:1)
(SEQ ID NO:3)
(SEQ ID NO:1)
(SEQ ID NO: 22)
(SEQ ID NO:3)
(SEQ ID NO:1)
(SEQ ID NO: 22)
(SEQ ID NO:3)
(SEQ ID NO:1)
(SEQ ID NO: 22)
(SEQ ID NO:3)
(SEQ ID NO:1)
(SEQ ID NO: 22)
(SEQ ID NO:3)
(SEQ ID NO:1)
(SEQ ID NO: 22)
(SEQ ID NO:3)
(SEQ ID NO:1)
(SEQ ID NO: 22)
(SEQ ID NO:3)
(SEQ ID NO:1)
(SEQ ID NO: 22)
(SEQ ID NO:3)
(SEQ ID NO:1)
(SEQ ID NO: 22)
(SEQ ID NO:3)
(SEQ ID NO:1)
(SEQ ID NO: 22)
(SEQ ID NO:3)
(SEQ ID NO:1)
(SEQ ID NO: 22)
(SEQ ID NO:3)
Верхнюю шарнирную область тяжелой цепи Fab любого из перечисленных выше антител, например, G6.31 AARR, можно мутировать для удаления реакционной способности по отношению к аутоантителам к шарниру IgG1, о чем сообщалось в литературе. См., Например, Brezski et al., J. Immunol. 181: 3183-3192, 2008 и Brezski et al., mAbs 2: 3, 212-220, 2010. Таким образом, C-концевая аминокислота тяжелой цепи G6.31 AARR может представлять собой T (версия дикого типа (WT)) или L (вариантная версия, которая не обладает реакционной способностью по отношению к Fab к IgG человека). Аминокислотная последовательность полноразмерной тяжелой цепи G6.31 AARR дикого типа представляет собой SEQ ID NO: 48. Аминокислотная последовательность полноразмерной тяжелой цепи вариантной версии, которая не обладает реакционной способностью по отношению к Fab к IgG человека, представляет собой SEQ ID NO 49. Аминокислотная последовательность полноразмерной легкой цепи как для G6.31 AARR, так и для вариантной версии, которая не обладает реакционной способностью по отношению к Fab к IgG человека, представляет собой SEQ ID NO: 50.
[598] В этом письменном описании используют примеры, раскрывающие настоящее изобретение, включая в себя лучший режим, а также позволяющие любому специалисту в настоящей области техники применять настоящее изобретение на практике, включая в себя создание и использование любых устройств или систем и выполнение любых включенных в него способов. Патентуемый объем настоящего изобретения определяется формулой изобретения и может включать в себя другие примеры, которые встречаются специалистам в настоящей области техники. Подразумевается, что такие другие примеры входят в объем формулы изобретения, если они содержат структурные элементы, которые не отличаются от буквальной формулировки формулы изобретения, или если они включают в себя эквивалентные структурные элементы с несущественными отличиями от буквальной формулировки формулы изобретения.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Дженентек, Инк. и Асцендис Фарма А/С
<120> ПРОЛЕКАРСТВЕННЫЕ КОМПОЗИЦИИ НА ОСНОВЕ ГИДРОГЕЛЯ ПОПЕРЕЧНО-СШИТОЙ
ГИАЛУРОНОВОЙ КИСЛОТЫ И СПОСОБЫ
<130> P34128-WO
<140> PCT/US2018/023857
<141> 2018-03-22
<150> 62/475,094
<151> 2017-03-22
<160> 66
<170> PatentIn version 3.5
<210> 1
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note=" Синтетический конструкт "
<400> 1
Asp Tyr Trp Ile His
1 5
<210> 2
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<220>
<221> Вариант
<222> (2)..(2)
<223> /replace="His"
<220>
<221> Вариант
<222> (5)..(5)
<223> /replace="Arg"
<220>
<221> Вариант
<222> (8)..(8)
<223> /replace="Lys"
<220>
<221> Вариант
<222> (9)..(9)
<223> /replace="Glu"
<220>
<221> Вариант
<222> (10)..(10)
<223> /replace="Tyr" or "Gln" or "Glu"
<220>
<221> Вариант
<222> (12)..(12)
<223> /replace="Glu"
<220>
<221> Вариант
<222> (16)..(16)
<223> /replace="Glu"
<220>
<221> Вариант
<222> (17)..(17)
<223> /replace="Glu"
<220>
<221> SITE
<222> (1)..(17)
<223> /note= "Варианты остатков, приведенные в последовательности, не являются
предпочтительными по сравнению с остатками в аннотациях для вариантов
позиций"
<400> 2
Gly Ile Thr Pro Ala Gly Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 3
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 3
Phe Val Phe Phe Leu Pro Tyr Ala Met Asp Tyr
1 5 10
<210> 4
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note=" Синтетический конструкт"
<220>
<221> Вариант
<222> (5)..(5)
<223> /replace="Arg"
<220>
<221> SITE
<222> (1)..(11)
<223> /note="Варианты остатков, приведенные в последовательности, не являются
предпочтительными по сравнению с остатками в аннотациях для вариантов
позиций"
<400> 4
Arg Ala Ser Gln Asp Val Ser Thr Ala Val Ala
1 5 10
<210> 5
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<220>
<221> Вариант
<222> (1)..(1)
<223> /replace="Met"
<220>
<221> SITE
<222> (1)..(7)
<223> /note=" Варианты остатков, приведенные в последовательности, не являются
предпочтительными по сравнению с остатками в аннотациях для вариантов
позиций "
<400> 5
Ser Ala Ser Phe Leu Tyr Ser
1 5
<210> 6
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<220>
<221> ВАРИАНТ
<222> (1)..(1)
<223> /replace="Asn" or "Thr"
<220>
<221> ВАРИАНТ
<222> (6)..(6)
<223> /replace="Asn" or "Gln" or "Arg"
<220>
<221> SITE
<222> (1)..(9)
<223> /note=" Варианты остатков, приведенные в последовательности, не являются
предпочтительными по сравнению с остатками в аннотациях для вариантов
позиций "
<400> 6
Gln Gln Gly Tyr Gly Ala Pro Phe Thr
1 5
<210> 7
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 7
Gly Ile Thr Pro Ala Gly Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 8
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 8
Arg Ala Ser Gln Asp Val Ser Thr Ala Val Ala
1 5 10
<210> 9
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 9
Ser Ala Ser Phe Leu Tyr Ser
1 5
<210> 10
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 10
Gln Gln Gly Tyr Gly Ala Pro Phe Thr
1 5
<210> 11
<211> 120
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 11
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Ile Ser Asp Tyr
20 25 30
Trp Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gly Ile Thr Pro Ala Gly Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Arg Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Val Phe Phe Leu Pro Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 12
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 12
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Gly Tyr Gly Ala Pro Phe
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 13
<211> 30
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 13
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Ile Ser
20 25 30
<210> 14
<211> 14
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 14
Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala
1 5 10
<210> 15
<211> 32
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 15
Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu Gln
1 5 10 15
Met Arg Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg
20 25 30
<210> 16
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 16
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
1 5 10
<210> 17
<211> 23
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 17
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys
20
<210> 18
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 18
Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr
1 5 10 15
<210> 19
<211> 32
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 19
Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr
1 5 10 15
Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Ala Ala Thr Tyr Tyr Cys
20 25 30
<210> 20
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 20
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
1 5 10
<210> 21
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 21
Gly Ile Thr Pro Ala Gly Gly Tyr Glu Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 22
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 22
Gly Ile Thr Pro Ala Gly Gly Tyr Glu Tyr Tyr Ala Asp Ser Val Glu
1 5 10 15
Gly
<210> 23
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 23
Gln Gln Gly Tyr Gly Asn Pro Phe Thr
1 5
<210> 24
<211> 32
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 24
Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr
1 5 10 15
Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys
20 25 30
<210> 25
<211> 23
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 25
Asp Ile Gln Met Thr Gln Ser Pro Glu Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Glu Val Thr Ile Thr Cys
20
<210> 26
<211> 23
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 26
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Glu Val Thr Ile Thr Cys
20
<210> 27
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 27
Trp Tyr Gln Gln Lys Pro Gly Glu Ala Pro Lys Leu Leu Ile Tyr
1 5 10 15
<210> 28
<211> 32
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 28
Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr
1 5 10 15
Leu Thr Ile Glu Ser Leu Gln Pro Glu Asp Ala Ala Thr Tyr Tyr Cys
20 25 30
<210> 29
<211> 30
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 29
Glu Glu Gln Leu Val Glu Glu Gly Gly Gly Leu Val Gln Pro Gly Glu
1 5 10 15
Ser Leu Glu Leu Ser Cys Ala Ala Ser Gly Phe Glu Ile Ser
20 25 30
<210> 30
<211> 14
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 30
Trp Val Arg Gln Glu Pro Gly Glu Gly Leu Glu Trp Val Ala
1 5 10
<210> 31
<211> 32
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 31
Arg Phe Thr Ile Ser Ala Asp Thr Ser Glu Asn Thr Ala Tyr Leu Gln
1 5 10 15
Met Asn Glu Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg
20 25 30
<210> 32
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 32
Trp Gly Gln Gly Glu Leu Val Thr Val Ser Ser
1 5 10
<210> 33
<211> 120
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 33
Glu Glu Gln Leu Val Glu Glu Gly Gly Gly Leu Val Gln Pro Gly Glu
1 5 10 15
Ser Leu Glu Leu Ser Cys Ala Ala Ser Gly Phe Glu Ile Ser Asp Tyr
20 25 30
Trp Ile His Trp Val Arg Gln Glu Pro Gly Glu Gly Leu Glu Trp Val
35 40 45
Ala Gly Ile Thr Pro Ala Gly Gly Tyr Glu Tyr Tyr Ala Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Glu Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Glu Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Val Phe Phe Leu Pro Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Glu Leu Val Thr Val Ser Ser
115 120
<210> 34
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 34
Asp Ile Gln Met Thr Gln Ser Pro Glu Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Glu Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Gly Tyr Gly Ala Pro Phe
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 35
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 35
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Glu Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Glu Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Glu Ser Leu Gln Pro
65 70 75 80
Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Gly Tyr Gly Ala Pro Phe
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 36
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 36
Asp Ile Gln Met Thr Gln Ser Pro Glu Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Glu Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Glu Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Gly Tyr Gly Ala Pro Phe
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 37
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 37
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Glu Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Gly Tyr Gly Ala Pro Phe
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 38
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 38
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Tyr Gly Asn Pro Phe
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 39
<211> 14
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 39
Trp Val Arg Gln Glu Pro Gly Lys Gly Leu Glu Trp Val Ala
1 5 10
<210> 40
<211> 120
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 40
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Ile Ser Asp Tyr
20 25 30
Trp Ile His Trp Val Arg Gln Glu Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gly Ile Thr Pro Ala Gly Gly Tyr Glu Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Val Phe Phe Leu Pro Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 41
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 41
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Tyr Gly Ala Pro Phe
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 42
<211> 120
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 42
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Ile Ser Asp Tyr
20 25 30
Trp Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gly Ile Thr Pro Ala Gly Gly Tyr Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Val Phe Phe Leu Pro Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 43
<211> 227
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 43
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Ile Ser Asp Tyr
20 25 30
Trp Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gly Ile Thr Pro Ala Gly Gly Tyr Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Val Phe Phe Leu Pro Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His
225
<210> 44
<211> 32
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 44
Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr
1 5 10 15
Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Ser Ala Thr Tyr Tyr Cys
20 25 30
<210> 45
<211> 23
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 45
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Asp Cys
20
<210> 46
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 46
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Asp Cys Arg Ala Ser Gln Asp Val Ser Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Gly Tyr Gly Ala Pro Phe
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 47
<211> 232
<212> PRT
<213> Homo sapiens
<400> 47
Met Asn Phe Leu Leu Ser Trp Val His Trp Ser Leu Ala Leu Leu Leu
1 5 10 15
Tyr Leu His His Ala Lys Trp Ser Gln Ala Ala Pro Met Ala Glu Gly
20 25 30
Gly Gly Gln Asn His His Glu Val Val Lys Phe Met Asp Val Tyr Gln
35 40 45
Arg Ser Tyr Cys His Pro Ile Glu Thr Leu Val Asp Ile Phe Gln Glu
50 55 60
Tyr Pro Asp Glu Ile Glu Tyr Ile Phe Lys Pro Ser Cys Val Pro Leu
65 70 75 80
Met Arg Cys Gly Gly Cys Cys Asn Asp Glu Gly Leu Glu Cys Val Pro
85 90 95
Thr Glu Glu Ser Asn Ile Thr Met Gln Ile Met Arg Ile Lys Pro His
100 105 110
Gln Gly Gln His Ile Gly Glu Met Ser Phe Leu Gln His Asn Lys Cys
115 120 125
Glu Cys Arg Pro Lys Lys Asp Arg Ala Arg Gln Glu Lys Lys Ser Val
130 135 140
Arg Gly Lys Gly Lys Gly Gln Lys Arg Lys Arg Lys Lys Ser Arg Tyr
145 150 155 160
Lys Ser Trp Ser Val Tyr Val Gly Ala Arg Cys Cys Leu Met Pro Trp
165 170 175
Ser Leu Pro Gly Pro His Pro Cys Gly Pro Cys Ser Glu Arg Arg Lys
180 185 190
His Leu Phe Val Gln Asp Pro Gln Thr Cys Lys Cys Ser Cys Lys Asn
195 200 205
Thr Asp Ser Arg Cys Lys Ala Arg Gln Leu Glu Leu Asn Glu Arg Thr
210 215 220
Cys Arg Cys Asp Lys Pro Arg Arg
225 230
<210> 48
<211> 228
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 48
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Ile Ser Asp Tyr
20 25 30
Trp Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gly Ile Thr Pro Ala Gly Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Arg Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Val Phe Phe Leu Pro Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr
225
<210> 49
<211> 228
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 49
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Ile Ser Asp Tyr
20 25 30
Trp Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gly Ile Thr Pro Ala Gly Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Arg Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Val Phe Phe Leu Pro Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Leu
225
<210> 50
<211> 214
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 50
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Gly Tyr Gly Ala Pro Phe
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 51
<211> 120
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 51
Glu Glu Gln Leu Val Glu Glu Gly Gly Gly Leu Val Gln Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Glu Ile Ser Asp Tyr
20 25 30
Trp Ile His Trp Val Arg Gln Glu Pro Gly Glu Gly Leu Glu Trp Val
35 40 45
Ala Gly Ile Thr Pro Ala Gly Gly Tyr Glu Tyr Tyr Ala Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Glu Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Glu Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Val Phe Phe Leu Pro Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Glu Leu Val Thr Val Ser Ser
115 120
<210> 52
<211> 30
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 52
Glu Glu Gln Leu Val Glu Glu Gly Gly Gly Leu Val Gln Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Glu Ile Ser
20 25 30
<210> 53
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 53
Gly Ile Thr Pro Ala Gly Gly Tyr Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 54
<211> 32
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 54
Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr
1 5 10 15
Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Val Ala Thr Tyr Tyr Cys
20 25 30
<210> 55
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 55
Phe Gly Gln Gly Thr Lys Val Glu Val Lys
1 5 10
<210> 56
<211> 34
<212> DNA
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 56
catcagatgg cgggaagatg aagacagatg gtgc 34
<210> 57
<211> 23
<212> DNA
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 57
gccatccaga tgacccagtc tcc 23
<210> 58
<211> 19
<212> DNA
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 58
ggctgcacca tctgtcttc 19
<210> 59
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 59
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Tyr Cys Gln Gln Gly Tyr Gly Asn Pro Phe
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 60
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Синтетический конструкт"
<400> 60
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Tyr Cys Gln Gln Gly Tyr Gly Ala Pro Phe
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 61
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Описание искусственной последовательности: Синтетический пептид"
<400> 61
Gly Tyr Tyr Met His
1 5
<210> 62
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note=" Описание искусственной последовательности: Синтетический пептид "
<400> 62
Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 63
<211> 20
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note=" Описание искусственной последовательности: Синтетический пептид "
<400> 63
Ser Pro Asn Pro Tyr Tyr Tyr Asp Ser Ser Gly Tyr Tyr Tyr Pro Gly
1 5 10 15
Ala Phe Asp Ile
20
<210> 64
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note=" Описание искусственной последовательности: Синтетический пептид "
<400> 64
Gly Gly Asn Asn Ile Gly Ser Lys Ser Val His
1 5 10
<210> 65
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note=" Описание искусственной последовательности: Синтетический пептид "
<400> 65
Asp Asp Ser Asp Arg Pro Ser
1 5
<210> 66
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /note=" Описание искусственной последовательности: Синтетический пептид "
<400> 66
Gln Val Trp Asp Ser Ser Ser Asp His Trp Val
1 5 10
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ОПТИМИЗИРОВАННЫЕ ВАРИАНТЫ АНТИ-VEGF АНТИТЕЛ | 2016 |
|
RU2763916C2 |
| ОПТИМИЗИРОВАННЫЕ КОМПОЗИЦИИ АНТИТЕЛ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ГЛАЗ | 2018 |
|
RU2782355C2 |
| АНТИТЕЛА ПРОТИВ НtrА1 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2750285C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА К CD19 ЧЕЛОВЕКА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2731156C1 |
| АНТИ-CD79b АНТИТЕЛА И ИММУНОКОНЪЮГАТЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2791984C2 |
| ПИРРОЛОБЕНЗОДИАЗЕПИНОВЫЕ КОНЪЮГАТЫ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2736725C1 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА И АНТИТЕЛА С СОЗРЕВШЕЙ АФФИННОСТЬЮ ПРОТИВ FcRH5 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2748943C2 |
| АНТИ-FcRH5 АНТИТЕЛА | 2014 |
|
RU2687132C2 |
| АНТИТЕЛА ПРОТИВ CD79b, КОНЪЮГАТЫ С ЛЕКАРСТВЕННЫМ СРЕДСТВОМ И ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2805251C2 |
| АНТИ-HLA-G АНТИТЕЛА И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2797724C2 |


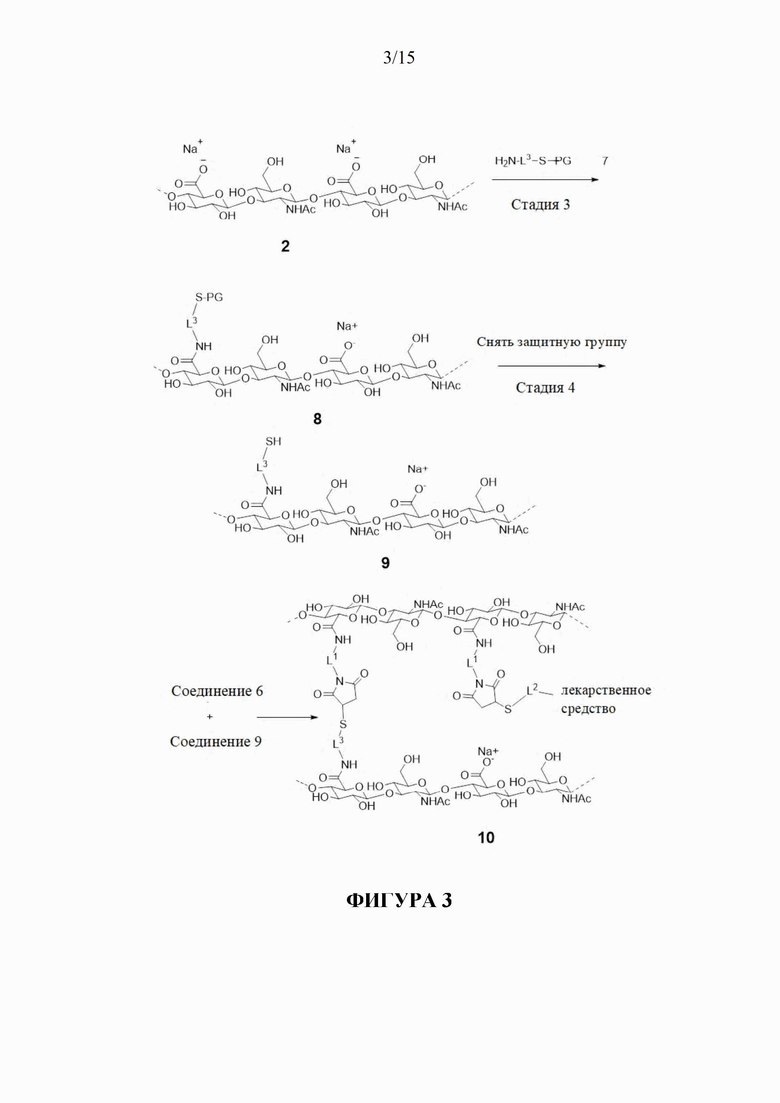

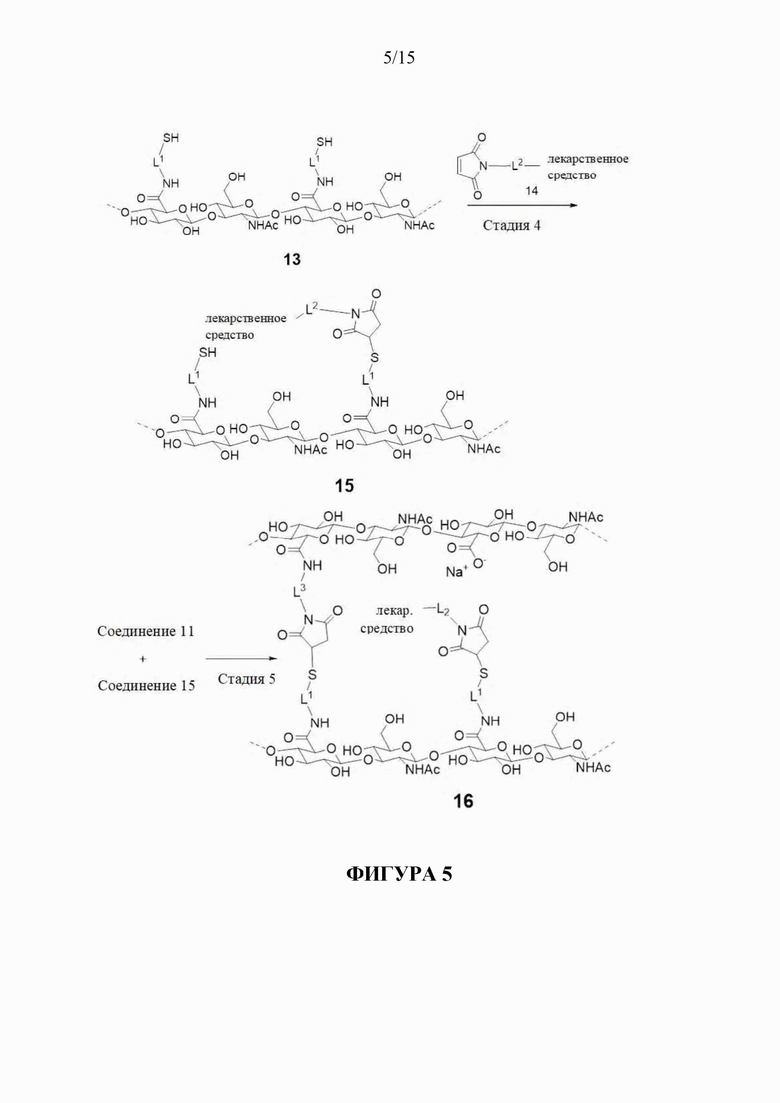






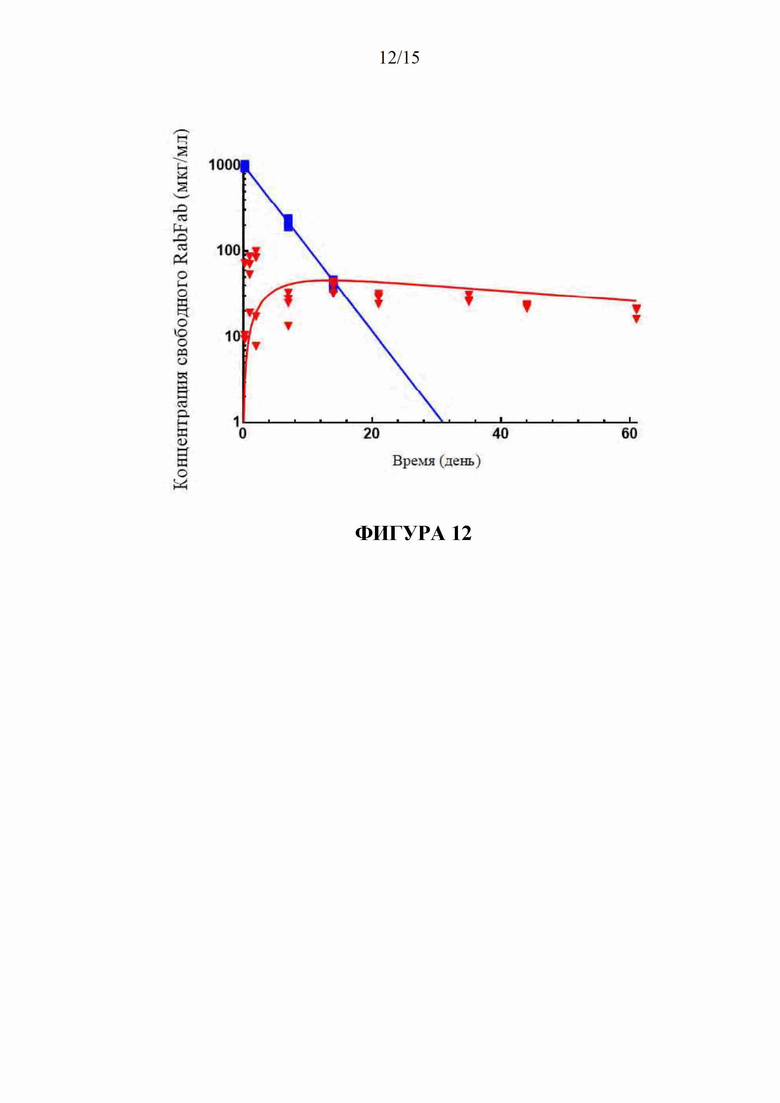
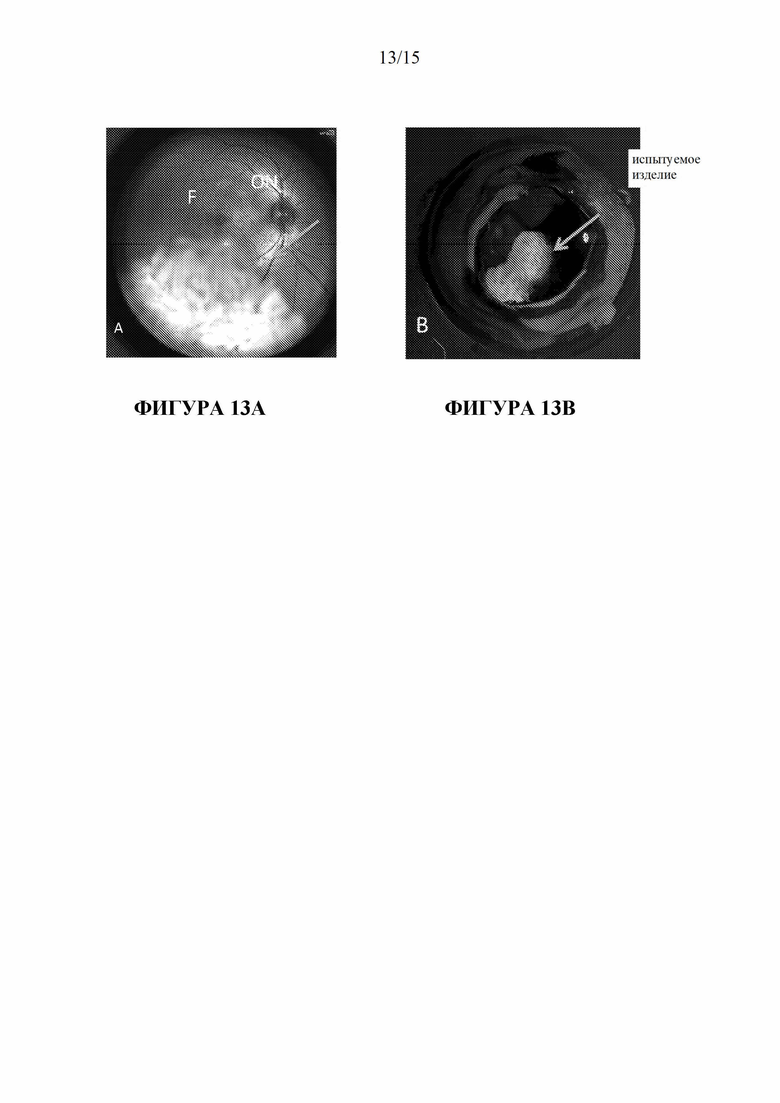


Группа изобретений относится к пролекарственным композициям на основе гидрогеля. Конъюгат гидрогеля поперечно-сшитой HA с лекарственным средством содержит множество полимеров гиалуроновой кислоты, содержащих множество линейно соединенных звеньев определенной структуры, лекарственное средство представляет собой фрагмент анти-VEGF антитела. Также раскрыты фармацевтическая композиция, применение фармацевтической композиции в качестве лекарственного средства для производства лекарственного средства для лечения нарушения, ассоциированного с патологическим ангиогенезом у субъекта, для снижения или ингибирования ангиогенеза у субъекта с нарушением, ассоциированным с патологическим ангиогенезом, для лечения нарушения, ассоциированного с патологическим ангиогенезом, у субъекта, способ лечения офтальмологического заболевания. Группа изобретений обеспечивает высвобождение лекарственного средства при физиологических условиях. 7 н. и 20 з.п. ф-лы, 15 ил., 8 табл., 8 пр.
1. Конъюгат гидрогеля поперечно-сшитой гиалуроновой кислоты (НА) с лекарственным средством, содержащий множество полимеров гиалуроновой кислоты 2А и множество полимеров гиалуроновой кислоты 2В, где
каждый 2А содержит множество линейно соединенных звеньев, причем звенья включают:

каждый 2В содержит множество линейно соединенных звеньев, причем звенья включают:

где
пунктирная линия без отметки указывает на место прикрепления к соседнему звену на пунктирной линии, помеченной #, или к водороду,
пунктирная линия, помеченная #, указывает на место прикрепления к соседнему звену на пунктирной линии без отметки, или к гидроксилу; и
пунктирная линия, помеченная *, указывает на место прикрепления поперечной сшивки между звеном Z3 2А и звеном Z4 2В, так что по меньшей мере один 2А поперечно сшит по меньшей мере с одним 2В;
лекарственное средство представляет собой фрагмент анти-VEGF антитела;
каждый из Ra1 и Ra2 независимо представляет собой водород; С1-4 алкил; ион щелочного металла, ион аммония или ион щелочноземельного металла;
L2 представляет собой обратимый линкер пролекарственного средства формулы XIIa
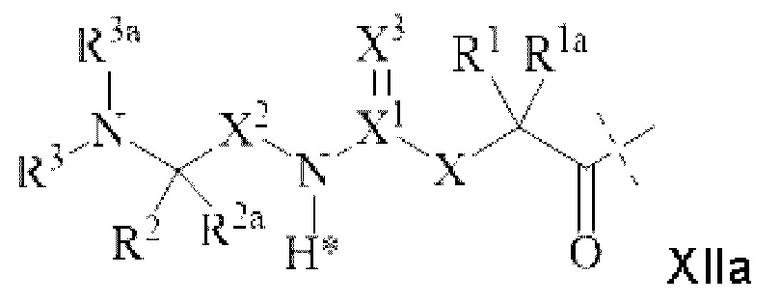
где
пунктирная линия указывает на прикрепление к азоту лекарственного средства путем образования амидной связи;
-Х- представляет собой -C(R4R4a)-; -N(R4)-; -О-; -C(R4R4a)-C(R5R5a)-; -C(R5R5a)-C(R4R4a); -C(R4R4a)-N(R6)-; -N(R6)-C(R4R4a)-; -C(R4R4a)-O-; -O-C(R4R4a)-или -C(R7R7a)-;
X1 представляет собой С или S(O);
-X2- представляет собой -C(R8R8a)- или -C(R8R8a)-C(R9R9a)-;
=Х3 представляет собой =O; =S или =N-CN;
-R1, -R1a, -R2, -R2a, -R4, -R4a, -R5, -R5a, -R6, -R8, -R8a, -R9, -R9a независимо выбраны из группы, состоящей из -Н и С1-6 алкила;
-R3, -R3a независимо выбраны из группы, состоящей из -Н и C1-6 алкила, при условии, что в случае, когда один из -R3, -R3a или оба отличаются от -Н, они связаны с N, к которому они прикреплены через sp3-гибридизированный атом углерода;
-R7 представляет собой -N(R10R10a) или-NR10-(C=O)-R11;
-R7a, -R10, -R10a, -R11 представляют собой независимо друг от друга -Н или C1-10 алкил;
необязательно одна или несколько из пар -R1a/-R4a, -R1a/-R5a, -R1a/-R7a, -R4a/-R5a, -R8a/-R9a образуют химическую связь;
необязательно одна или несколько из пар -R1/-R1a, -R2/-R2a, -R4/-R4a, -R5/-R5a, -R8/-R8a, -R9/-R9a соединены вместе с атомом, к которому они прикреплены, с образованием С3-10 циклоалкила или 3-10-членного гетероциклила;
необязательно одна или несколько из пар -R1/-R4, -R1/-R5, -R1/-R6, -R1/-R7a, -R4/-R5, -R4/-R6, -R8/-R9, -R2/-R3 соединены вместе с атомами, к которым они прикреплены, с образованием кольца А;
необязательно R3/R3a соединены вместе с атомом азота, к которому они прикреплены, с образованием 3-10-членного гетероцикла;
кольцо А выбрано из группы, состоящей из фенила; нафтила; инденила; инданила; тетралинила; С3-10 циклоалкила; 3-10-членного гетероциклила и 8-11-членного гетеробициклила; и
где группа согласно формуле XIIa замещена -L4 при условии, что водород, помеченный звездочкой в формуле XIIa, не замещен -L4 или другим заместителем;
L4 представляет собой необязательно биоразлагаемый спейсер;
причем спейсер L4, соединяющий полимер гиалуроновой кислоты 2А с полимером гиалуроновой кислоты 2В, характеризуется формулой:
где
крайняя правая волнистая линия представляет место прикрепления к звену Z4 на полимере гиалуроновой кислоты 2В; и
крайняя левая волнистая линия представляет место прикрепления к звену Z3 на полимере гиалуроновой кислоты 2А;
и спейсер L4, соединяющий обратимый линкер пролекарственного средства L2 с полимером гиалуроновой кислоты 2А, характеризуется формулой:
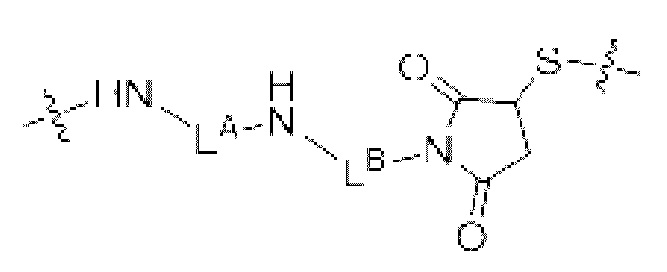
где
крайняя правая волнистая линия представляет место прикрепления к L2; и
крайняя левая волнистая линия представляет место прикрепления к звену Z2 на полимере гиалуроновой кислоты 2В;
где
LA представляет собой необязательно замещенный и/или необязательно прерванный С1-10 алкилен;
LB представляет собой неразветвленный -C(O)-C1-5 алкилен; и
LC представляет собой

где m составляет от 0 до 10, n составляет от 1 до 4, и о составляет от 1 до 4;
2А содержит всего s звеньев, где s составляет от 75 до 1000, где количество звеньев Z1 в 2А составляет от 0,9s до 0,99s, и количество звеньев Z3 составляет от 0,10s до 0,01s;
2В содержит всего t звеньев, где t составляет от 75 до 1000, где количество звеньев Z1 в 2В составляет от 0,75t до 0,94t;
объединенное количество звеньев Z2 и Z4 составляет от 0,25t до 0,06t;
количество звеньев Z2 составляет от 0,02t до 0,12t; и
количество звеньев Z4 составляет от 0,01t до 0,12t, и где
лекарственное средство только присоединено к полимеру 2В.
2. Конъюгат гидрогеля по п. 1, где
=Х3 представляет собой =O;
-R1 и -R1a представляют собой водород;
-R3 представляет собой метил, и R3a представляет собой водород; и
-Х- представляет собой -C(R7R7a)-; причем R7 представляет собой NR10-(C=O)-R11.
3. Конъюгат гидрогеля по п. 1, в котором обратимый линкер пролекарственного средства L2 вместе со спейсером L4 характеризуется формулой VIIc:

где
крайняя правая волнистая линия представляет место прикрепления к атому азота лекарственного средства; и
крайняя левая волнистая линия представляет место прикрепления к звену Z2 гиалуроновой кислоты 2В.
4. Конъюгат гидрогеля по п. 1, в котором LA представляет собой неразветвленный С2-4 алкилен.
5. Конъюгат гидрогеля по п. 1, в котором LC представляет собой:
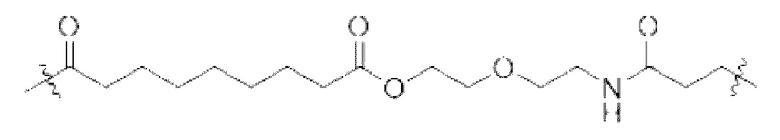
6. Конъюгат гидрогеля по п. 1, в котором фрагмент антитела представляет собой фрагмент антитела Fab.
7. Конъюгат гидрогеля по п. 6, в котором фрагмент антитела Fab представляет собой ранибизумаб.
8. Конъюгат гидрогеля по любому из пп. 1-7, причем конъюгат гидрогеля с лекарственным средством характеризуется офтальмологическим эффективным периодом полужизни, который является увеличенным по отношению к немодифицированному фрагменту анти-VEGF антитела.
9. Фармацевтическая композиция, содержащая конъюгат гидрогеля с лекарственным средством по любому из пп. 1-8 и фармацевтически приемлемый носитель, вспомогательное вещество или разбавитель.
10. Фармацевтическая композиция по п. 9, дополнительно содержащая второе средство, причем второе средство выбрано из группы, состоящей из антитела, антиангиогенного средства, цитокина, антагониста цитокина, кортикостероида, обезболивающего средства и соединения, которое связывается со второй биологической молекулой.
11. Применение фармацевтической композиции по п. 9 или 10 в качестве лекарственного средства.
12. Применение фармацевтической композиции по п. 9 или 10 для производства лекарственного средства для лечения нарушения, ассоциированного с патологическим ангиогенезом у субъекта.
13. Применение фармацевтической композиции по п. 9 или 10 для снижения или ингибирования ангиогенеза у субъекта с нарушением, ассоциированным с патологическим ангиогенезом.
14. Применение фармацевтической композиции по п. 9 или 10 для лечения нарушения, ассоциированного с патологическим ангиогенезом, у субъекта.
15. Применение по п. 13 или 14, где нарушение, ассоциированное с патологическим ангиогенезом, представляет собой офтальмологическое нарушение.
16. Применение по п. 15, где офтальмологическое нарушение выбрано из группы, состоящей из возрастной макулярной дегенерации (AMD), макулярной дегенерации, макулярного отека, диабетического макулярного отека (DME) (включая в себя очаговый, нецентровый DME и диффузный, DME с вовлечением центра макулы), ретинопатии, диабетической ретинопатии (DR) (включая в себя пролиферативную DR (PDR), непролиферативную DR (NPDR) и высотную DR), других связанных с ишемией ретинопатии, ретинопатии недоношенных (ROP), окклюзии вен сетчатки (RVO) (включая в себя центральную (CRVO) и разветвленную (BRVO) формы), CNV (включая в себя миопическую CNV), неоваскуляризации роговицы, заболевания, ассоциированного с неоваскуляризацией роговицы, неоваскуляризации сетчатки, заболевания, ассоциированного с ретинальной/хориоидальной неоваскуляризацией, патологической миопии, болезни фон Хиппель-Линдау, гистоплазмоза глаза, семейной экссудативной витреоретинопатии (FEVR), болезни Коутса, болезни Норри, синдрома остеопороза-псевдоглиомы (OPPG), субконъюнктивального кровоизлияния, рубеоза радужки, неоваскулярных заболеваний глаз, неоваскулярной глаукомы, пигментного ретинита (RP), гипертонической ретинопатии, ангиоматозной пролиферации сетчатки, макулярной телеангиэктазии, неоваскуляризации радужки, внутриглазной неоваскуляризации, дегенерации сетчатки, кистозного макулярного отека (СМЕ), васкулита, отека диска зрительного нерва, ретинита, конъюнктивита (включая в себя инфекционный конъюнктивит и неинфекционный конъюнктивит), врожденного амавроза Лебера, увеита (включая в себя инфекционный и неинфекционный увеит), хориоидита, глазного гистоплазмоза, блефарита, сухости глаз, травматического повреждения глаз и болезни Шегрена.
17. Применение по п. 16, где офтальмологическое нарушение представляет собой AMD, DME, DR или RVO.
18. Применение по п. 16 или 17, где офтальмологическое нарушение представляет собой AMD.
19. Применение по любому из пп. 16-18, где AMD представляет собой влажную форму AMD.
20. Способ лечения офтальмологического заболевания, причем способ предусматривает введение терапевтического количества раствора композиции по п. 9 или 10 субъекту, нуждающемуся в таком лечении.
21. Способ по п. 20, при котором введение является внутриглазным.
22. Способ по п. 20, при котором композицию вводят с помощью инъекции в стекловидное тело субъекта.
23. Способ по п. 22, при котором композицию вводят с помощью инъекции с использованием иглы с калибром, составляющим 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31 или 32.
24. Способ по п. 20, при котором офтальмологическое заболевание выбрано из группы, состоящей из возрастной макулярной дегенерации (AMD), макулярной дегенерации, макулярного отека, диабетического макулярного отека (DME) (включая в себя очаговый, нецентровый DME и диффузный, DME с вовлечением центра макулы), ретинопатии, диабетической ретинопатии (DR) (включая в себя пролиферативную DR (PDR), непролиферативную DR (NPDR) и высотную DR), других связанных с ишемией ретинопатий, ретинопатии недоношенных (ROP), окклюзии вен сетчатки (RVO) (включая в себя центральную (CRVO) и разветвленную (BRVO) формы), CNV (включая в себя миопическую CNV), неоваскуляризации роговицы, заболевания, ассоциированного с неоваскуляризацией роговицы, неоваскуляризации сетчатки, заболевания, ассоциированного с ретинальной/хориоидальной неоваскуляризацией, патологическая миопия, болезни фон Хиппель-Линдау, гистоплазмоза глаза, семейной экссудативной витреоретинопатии (FEVR), болезни Коутса, болезни Норри, синдрома остеопороза-псевдоглиомы (OPPG), субконъюнктивального кровоизлияния, рубеоза радужки, неоваскулярных заболеваний глаз, неоваскулярной глаукомы, пигментного ретинита (RP), гипертонической ретинопатии, ангиоматозной пролиферации сетчатки, макулярной телеангиэктазии, неоваскуляризации радужки, внутриглазной неоваскуляризации, дегенерации сетчатки, кистозного макулярного отека (СМЕ), васкулита, отека диска зрительного нерва, ретинита, конъюнктивита (включая в себя инфекционный конъюнктивит и неинфекционный конъюнктивит), врожденного амавроза Лебера, увеита (включая в себя инфекционный и неинфекционный увеит), хориоидита, глазного гистоплазмоза, блефарита, сухости глаз, травматического повреждения глаз и болезни Шегрена.
25. Способ по п. 24, при котором офтальмологическое заболевание представляет собой AMD, DME, DR или RVO.
26. Способ по п. 25, при котором офтальмологическое заболевание представляет собой AMD.
27. Способ по п. 26, при котором AMD представляет собой влажную форму AMD.
| WO 2016193371 А1, 08.12.2016 | |||
| US 2015010634 A1, 08.01.2015 | |||
| СПОСОБ СИНТЕЗА КОНЪЮГАТОВ ГЛИКОЗАМИНОГЛИКАНОВ (GAG) С БИОЛОГИЧЕСКИ АКТИВНЫМИ МОЛЕКУЛАМИ, ПОЛИМЕРНЫЕ КОНЪЮГАТЫ И ИХ СООТВЕТСТВУЮЩИЕ ПРИМЕНЕНИЯ | 2010 |
|
RU2530649C2 |
| SHENDI D | |||
| et al | |||
| Tunable, bioactive protein conjugated hyaluronic acid hydrogel for neural engineering applications // Journal of materials chemistry, v | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| СПОСОБ ПОЛУЧЕНИЯ ФЕРРОВОЛЬФРАМА | 1925 |
|
SU2803A1 |
Авторы
Даты
2024-02-02—Публикация
2018-03-22—Подача