Родственные заявки
[0001] По настоящей заявке испрашивается приоритет предварительной заявки США № 61/882377, зарегистрированной 25 сентября 2013 года, и предварительной заявки США № 61/971332, зарегистрированной 27 марта 2014 года, содержание которых полностью включено в настоящее описание посредством ссылки.
Область изобретения
[0002] Изобретение относится в основном к полипептидам, которые содержат расщепляемый фрагмент, который является субстратом по меньшей мере для одной матриксной металлопротеазы (MMP), для активируемых антител, и другим более крупным молекулам, которые содержат расщепляемый фрагмент, который является субстратом по меньшей мере для одной MMP протеазы, и к способам получения и использования таких полипептидов, которые содержат расщепляемый фрагмент, который является субстратом по меньшей мере для одной MMP протеазы, при различных терапевтических, диагностических и профилактических показаниях.
Уровень техники, предшествующий изобретению
[0003] Протеазы представляют собой ферменты, которые разрушают белки путем расщепления пептидных связей между аминокислотными остатками. Протеазы встречаются в природе во всех организмах и участвуют в ряде физиологических реакций от простого разрушения до высокорегулируемых путей. Известно, что некоторые протеазы разрывают конкретные пептидные связи в зависимости от наличия конкретной аминокислотной последовательности в белке.
[0004] Таким образом, существует необходимость идентификации новых субстратов протеаз и использования этих субстратов при различных терапевтических, диагностических и профилактических показаниях.
Сущность изобретения
[0005] Изобретение относится к аминокислотным последовательностям, которые содержат расщепляемый фрагмент (CM), который является субстратом по меньшей мере для одной матриксной металлопротеазы (MMP). Такие CM являются пригодными для ряда терапевтических, диагностических и профилактических показаний.
[0006] В некоторых вариантах осуществления CM является субстратом по меньшей мере для одной матриксной металлопротеазы (MMP). Примеры MMP включают MMP1, MMP2, MMP3, MMP7, MMP8, MMP9, MMP10, MMP11, MMP 12, MMP13, MMP 14, MMP 15, MMP 16, MMP 17, MMP 19, MMP20, MMP23, MMP24, MMP26 и MMP27. В некоторых вариантах осуществления CM является субстратом для MMP9, MMP14, MMP1, MMP3, MMP13, MMP17, MMP11 и MMP19. В некоторых вариантах осуществления CM является субстратом для MMP9. В некоторых вариантах осуществления CM является субстратом для MMP14. В некоторых вариантах осуществления CM является субстратом для двух или более MMP. В некоторых вариантах осуществления CM является субстратом по меньшей мере для MMP9 и MMP14. В некоторых вариантах осуществления CM содержит два или более субстратов для одной и той же MMP. В некоторых вариантах осуществления CM содержит по меньшей мере два или более субстрата MMP9. В некоторых вариантах осуществления CM содержит по меньшей мере два или более субстрата MMP 14.
[0007] В некоторых вариантах осуществления CM является субстратом для MMP и содержит последовательность ISSGLLSS (SEQ ID NO:14); QNQALRMA (SEQ ID NO:15); AQNLLGMV (SEQ ID NO:16); STFPFGMF (SEQ ID NO:17); PVGYTSSL (SEQ ID NO:18); DWLYWPGI (SEQ ID NO:19); MIAPVAYR (SEQ ID NO:20); RPSPMWAY (SEQ ID NO:21); WATPRPMR (SEQ ID NO:22); FRLLDWQW (SEQ ID NO:23); LKAAPRWA (SEQ ID NO:24); GPSHLVLT (SEQ ID NO:25); LPGGLSPW (SEQ ID NO:26); MGLFSEAG (SEQ ID NO:27); SPLPLRVP (SEQ ID NO:28); RMHLRSLG (SEQ ID NO:29); LAAPLGLL (SEQ ID NO:30); AVGLLAPP (SEQ ID NO:31); LLAPSHRA (SEQ ID NO:32); PAGLWLDP (SEQ ID NO:33) и/или ISSGLSS (SEQ ID NO:159).
[0008] В некоторых вариантах осуществления CM содержит аминокислотную последовательность ISSGLLSS (SEQ ID NO:14). В некоторых вариантах осуществления CM содержит аминокислотную последовательность QNQALRMA (SEQ ID NO:15). В некоторых вариантах осуществления CM содержит аминокислотную последовательность AQNLLGMV (SEQ ID NO:16). В некоторых вариантах осуществления CM содержит аминокислотную последовательность STFPFGMF (SEQ ID NO:17). В некоторых вариантах осуществления CM содержит аминокислотную последовательность PVGYTSSL (SEQ ID NO:18). В некоторых вариантах осуществления CM содержит аминокислотную последовательность DWLYWPGI (SEQ ID NO:19). В некоторых вариантах осуществления CM содержит аминокислотную последовательность MIAPVAYR (SEQ ID NO:20). В некоторых вариантах осуществления CM содержит аминокислотную последовательность RPSPMWAY (SEQ ID NO:21). В некоторых вариантах осуществления CM содержит аминокислотную последовательность WATPRPMR (SEQ ID NO:22). В некоторых вариантах осуществления CM содержит аминокислотную последовательность FRLLDWQW (SEQ ID NO:23). В некоторых вариантах осуществления CM содержит аминокислотную последовательность LKAAPRWA (SEQ ID NO:24). В некоторых вариантах осуществления CM содержит аминокислотную последовательность GPSHLVLT (SEQ ID NO:25). В некоторых вариантах осуществления CM содержит аминокислотную последовательность LPGGLSPW (SEQ ID NO:26). В некоторых вариантах осуществления CM содержит аминокислотную последовательность MGLFSEAG (SEQ ID NO:27).В некоторых вариантах осуществления CM содержит аминокислотную последовательность SPLPLRVP (SEQ ID NO:28). В некоторых вариантах осуществления CM содержит аминокислотную последовательность RMHLRSLG (SEQ ID NO:29). В некоторых вариантах осуществления CM содержит аминокислотную последовательность LAAPLGLL (SEQ ID NO:30). В некоторых вариантах осуществления CM содержит аминокислотную последовательность AVGLLAPP (SEQ ID NO:31). В некоторых вариантах осуществления CM содержит аминокислотную последовательность LLAPSHRA (SEQ ID NO:32). В некоторых вариантах осуществления CM содержит аминокислотную последовательность PAGLWLDP (SEQ ID NO:33). В некоторых вариантах осуществления CM содержит аминокислотную последовательность ISSGLSS (SEQ ID NO:159).
[0009] В некоторых вариантах осуществления CM является связанным или иным образом присоединенным к антителу. Например, CM используют для связывания одного или более средств с антителом или его антигенсвязывающего фрагмента (AB), который связывается с данной мишенью, таким образом, что CM расщепляется под воздействием MMP, и средство освобождается от AB. Иллюстративные мишени включают, но не ограничиваются ими, мишени, представленные в таблице 1. Иллюстративные AB включают, но не ограничиваются ими, мишени, представленные в таблице 2. В некоторых вариантах осуществления структурная организация антитела в нерасщепленном состоянии от N-конца к C-концу является такой, как указано ниже: средство-CM-AB или AB-CM-средство. В некоторых вариантах осуществления антитело содержит связывающий пептид между AB и CM. В некоторых вариантах осуществления антитело содержит связывающий пептид между CM и конъюгированным средством.
[0010] В некоторых вариантах осуществления антитело содержит первый связывающий пептид (LP1) и второй связывающий пептид (LP2), и структурная организация антитела в нерасщепленном состоянии от N-конца к C-концу является такой, как указано ниже: средство-LP1-CM-LP2-AB или AB-LP2-CM-LP1-средство. В некоторых вариантах осуществления каждый из LP1 и LP2 представляет собой пептид длиной приблизительно от 1 до 20 аминокислот. В некоторых вариантах осуществления два связывающих пептида не обязательно должны являться идентичными друг другу.
[0011] В некоторых вариантах осуществления по меньшей мере один из LP1 или LP2 содержит аминокислотную последовательность, выбранную из группы, состоящей из (GS)n, (GGS)n, (GSGGS)n (SEQ ID NO:1) и (GGGS)n (SEQ ID NO:2), где n представляет собой целое число по меньшей мере один.
[0012] В некоторых вариантах осуществления по меньшей мере один из LP1 или LP2 содержит аминокислотную последовательность, выбранную из группы, состоящей из GGSG (SEQ ID NO:3), GGSGG (SEQ ID NO:4), GSGSG (SEQ ID NO:5), GSGGG (SEQ ID NO:6), GGGSG (SEQ ID NO:7) и GSSSG (SEQ ID NO:8).
[0013] В некоторых вариантах осуществления LP1 содержит аминокислотную последовательность GSSGGSGGSGGSG (SEQ ID NO:9), GSSGGSGGSGG (SEQ ID NO:10),GSSGGSGGSGGS (SEQ ID NO:11), GSSGGSGGSGGSGGGS (SEQ ID NO:155), GSSGGSGGSG (SEQ ID NO:156) или GSSGGSGGSGS (SEQ ID NO:157).
[0014] В некоторых вариантах осуществления LP2 содержит аминокислотную последовательность GSS, GGS, GGGS (SEQ ID NO:158), GSSGT (SEQ ID NO:12) или GSSG (SEQ ID NO:13).
[0015] В некоторых вариантах осуществления равновесная константа диссоциации AB составляет приблизительно 100 нМ или менее для связывания с мишенью.
[0016] В некоторых вариантах осуществления антитело включает антитело или его антигенсвязывающий фрагмент, который специфически связывается с мишенью. В некоторых вариантах осуществления антитело или его иммунологически активный фрагмент, который связывается с мишенью, представляет собой моноклональное антитело, доменное антитело, одноцепочечный фрагмент, фрагмент Fab, фрагмент F(ab')2, scFv, scab, dAb, однодоменное антитело, состоящее из тяжелой цепи или однодоменное антитело, состоящее из легкой цепи. В некоторых вариантах осуществления такое антитело или его иммунологически активный фрагмент, который связывается с мишенью, представляет собой моноклональное антитело мыши, другого грызуна, химерное, гуманизированное или полностью принадлежащее человеку моноклональное антитело.
[0017] В некоторых вариантах осуществления протеаза MMP солокализована с мишенью в ткани, и протеаза MMP расщепляет CM в антителе, когда антитело подвергается действию протеазы.
[0018] В некоторых вариантах осуществления CM представляет собой полипептид длиной до 15 аминокислот.
[0019] В некоторых вариантах осуществления CM является субстратом по меньшей мере для одной матриксной металлопротеазы (MMP). Примеры MMP включают MMP1, MMP2, MMP3, MMP7, MMP8, MMP9, MMP10, MMP11, MMP12, MMP13, MMP14, MMP15, MMP16, MMP17, MMP19, MMP20, MMP23, MMP24, MMP26 и MMP27. В некоторых вариантах осуществления CM является субстратом для MMP9, MMP14, MMP1, MMP3, MMP13, MMP17, MMP11 и MMP19. В некоторых вариантах осуществления CM является субстратом для MMP9. В некоторых вариантах осуществления CM является субстратом для MMP14. В некоторых вариантах осуществления CM является субстратом для двух или более MMP. В некоторых вариантах осуществления CM является субстратом по меньшей мере для MMP9 и MMP14. В некоторых вариантах осуществления CM содержит два или более субстратов для одной и той же MMP. В некоторых вариантах осуществления CM содержит по меньшей мере два или более субстрата MMP9. В некоторых вариантах осуществления CM содержит по меньшей мере два или более субстратов MMP14.
[0020] В некоторых вариантах осуществления CM является субстратом для MMP и содержит последовательность ISSGLLSS (SEQ ID NO:14); QNQALRMA (SEQ ID NO:15); AQNLLGMV (SEQ ID NO:16); STFPFGMF (SEQ ID NO:17); PYGYTSSL (SEQ ID NO:18); DWLYWPGI (SEQ ID NO:19); MIAPVAYR (SEQ ID NO:20); RPSPMWAY (SEQ ID NO:21); WATPRPMR (SEQ ID NO:22); FRLLDWQW (SEQ ID NO:23); LKAAPRWA (SEQ ID NO:24); GPSHLVLT (SEQ ID NO:25); LPGGLSPW (SEQ ID NO:26); MGLFSEAG (SEQ ID NO:27); SPLPLRVP (SEQ ID NO:28); RMHLRSLG (SEQ ID NO:29); LAAPLGLL (SEQ ID NO:30); AVGLLAPP (SEQ ID NO:31); LLAPSHRA (SEQ ID NO:32); PAGLWLDP (SEQ ID NO:33) и/или ISSGLSS (SEQ ID NO:159).
[0021] В некоторых вариантах осуществления CM содержит аминокислотную последовательность ISSGLLSS (SEQ ID NO:14). В некоторых вариантах осуществления CM содержит аминокислотную последовательность QNQALRMA (SEQ ID NO:15). В некоторых вариантах осуществления CM содержит аминокислотную последовательность AQNLLGMV (SEQ ID NO:16). В некоторых вариантах осуществления CM содержит аминокислотную последовательность STFPFGMF (SEQ ID NO:17). В некоторых вариантах осуществления CM содержит аминокислотную последовательность PVGYTSSL (SEQ ID NO:18). В некоторых вариантах осуществления CM содержит аминокислотную последовательность DWLYWPGI (SEQ ID NO:19). В некоторых вариантах осуществления CM содержит аминокислотную последовательность MIAPVAYR (SEQ ID NO:20). В некоторых вариантах осуществления CM содержит аминокислотную последовательность RPSPMWAY (SEQ ID NO:21). В некоторых вариантах осуществления CM содержит аминокислотную последовательность WATPRPMR (SEQ ID NO:22). В некоторых вариантах осуществления CM содержит аминокислотную последовательность FRLLDWQW (SEQ ID NO:23). В некоторых вариантах осуществления CM содержит аминокислотную последовательность LKAAPRWA (SEQ ID NO:24). В некоторых вариантах осуществления CM содержит аминокислотную последовательность GPSHLVLT (SEQ ID NO:25). В некоторых вариантах осуществления CM содержит аминокислотную последовательность LPGGLSPW (SEQ ID NO:26). В некоторых вариантах осуществления CM содержит аминокислотную последовательность MGLFSEAG (SEQ ID NO:27). В некоторых вариантах осуществления CM содержит аминокислотную последовательность SPLPLRVP (SEQ ID NO:28). В некоторых вариантах осуществления CM содержит аминокислотную последовательность RMHLRSLG (SEQ ID NO:29). В некоторых вариантах осуществления CM содержит аминокислотную последовательность LAAPLGLL (SEQ ID NO:30). В некоторых вариантах осуществления CM содержит аминокислотную последовательность AVGLLAPP (SEQ ID NO:31). В некоторых вариантах осуществления CM содержит аминокислотную последовательность LLAPSHRA (SEQ ID NO:32). В некоторых вариантах осуществления CM содержит аминокислотную последовательность PAGLWLDP (SEQ ID NO:33). В некоторых вариантах осуществления CM содержит аминокислотную последовательность ISSGLSS (SEQ ID NO:159).
[0022] В некоторых вариантах осуществления CM является субстратом по меньшей мере для одной матриксной металлопротеазы (MMP) и содержит последовательность мотива, которую распознает MMP9. В некоторых вариантах осуществления CM является субстратом по меньшей мере для одной MMP и содержит последовательность мотива, которую распознает MMP14.
[0023] В некоторых вариантах осуществления CM является субстратом по меньшей мере для одной MMP, и полипептид CM и/или участок CM любого полипептида, который содержит полипептид, содержит CM длиной менее 50 аминокислот, менее 40 аминокислот, менее 30 аминокислот, менее 25 аминокислот, менее 20 аминокислот, менее 19 аминокислот, менее 18 аминокислот, менее 17 аминокислот, менее 16 аминокислот, менее 15 аминокислот, менее 14 аминокислот, менее 13 аминокислот, менее 12 аминокислот, менее 11 аминокислот или менее 10 аминокислот.
[0024] В некоторых вариантах осуществления CM является субстратом по меньшей мере для одной MMP и содержит полипептидную последовательность, которая не является по существу идентичной какой-либо полипептидной последовательности человека, которая естественным образом расщепляется той же протеазой MMP. В некоторых вариантах осуществления CM является субстратом по меньшей мере для одной MMP и содержит полипептидную последовательность, которая является не более, чем на 90% или более идентичной любой полипептидной последовательности человека, которая естественным образом расщепляется той же протеазой.
[0025] В некоторых вариантах осуществления последовательность мотива представляет собой субстрат по меньшей мере для MMP и содержит коровую консенсусную последовательность CM, представленную в таблицах 8A-8M ниже. В некоторых вариантах осуществления последовательность мотива включает подрод, т.е. субпопуляцию, коровой консенсусной последовательности CM, представленную в таблицах 8A-8M ниже.
[0026] В некоторых вариантах осуществления последовательность мотива представляет собой субстрат по меньшей мере для MMP9 и содержит коровую консенсусную последовательность CM, представленную в таблицах 8A-8D. В некоторых вариантах осуществления последовательность мотива представляет собой субстрат по меньшей мере для MMP9 и включает подрод, т.е. субпопуляцию, коровой консенсусной последовательности CM, представленной в таблицах 8A-8D ниже.
[0027] В некоторых вариантах осуществления последовательность мотива представляет собой субстрат по меньшей мере для MMP14 и содержит коровую консенсусную последовательность CM, представленную в таблицах 8E-8M. В некоторых вариантах осуществления последовательность мотива представляет собой субстрат по меньшей мере для MMP14 и включает подрод, т.е. субпопуляцию, коровой консенсусной последовательности CM, представленной в таблицах 8E-8M ниже.
Расщепляемая MMP9 коровая консенсусная последовательность 1 CM
X23 представляет собой L, M, P, S или T;
X24 представляет собой A, D, F, G, L, M, N, P, R, S, T или V;
X25 представляет собой A, D, E, G, H, I, M, P, S или V;
X26 представляет собой A, C, D, G, L, M, N, R, V, W или Y;
X27 представляет собой C, F, G, H, P, Q, R, T, V или W;
X28 представляет собой A, D, G, L, M, S, T, V или Y, и
X29 представляет собой C, H, L, R, S, V, W или Y.
Расщепляемая MMP9 коровая консенсусная последовательность 2 CM
X32 представляет собой F, G, V или W;
X33 представляет собой A, D, L, M, P, R, T или V;
X34 представляет собой C, G, H, L, Q, S, T, W,
X35 представляет собой D, G, L, P;
X36 представляет собой E, G, I, L, N, P, R или V;
X37 представляет собой G, L, P, R, S или V;
X38 представляет собой A, I, L, M, T или V, и
X39 представляет собой A, G, L, P, Q, R, S или V.
Расщепляемая MMP9 коровая консенсусная последовательность 3 CM
X42 представляет собой G, I, L, M, P, R, S, T или V;
X43 представляет собой A, D, H, I, L, P, S или T;
X44 представляет собой F, L, S или V;
X45 представляет собой H, L. M, P, Q, R, S или T;
X46 представляет собой A, D, F, G, L, M, R, S, T или V;
X47 представляет собой A, C, G, H, Q, T или Y;
X48 представляет собой C, G, I, M, R, S, T, V или W, и
X49 представляет собой F, L, S или Y.
Расщепляемая MMP9 коровая консенсусная последовательность 4 CM
X52 представляет собой D, G, H, L, N, P, Q, R, S, W или Y;
X53 представляет собой A, C, D, G, L, R, V, W или Y;
X54 представляет собой D, H, L, P, Q, R, S или Y;
X55 представляет собой D, F, H, I, L, M, P, S или Y;
X56 представляет собой A, C, E, F, G, K, M, R, S, V или W;
X57 представляет собой A, G, K L, M, N, P, R, S или T;
X58 представляет собой A, F, G, H, L, P, R, S или T, и
X59 представляет собой A, G, H, I, N, P, S, T или Y.
Расщепляемая MMP14 коровая консенсусная последовательность 5 CM
X62 представляет собой A, I, G, L, M, P, Q, S, T или V;
X63 представляет собой A, D, L, P, Q, S, T, V или Y;
X64 представляет собой A, C, E, F, G, H, K, L, P, Q, R, S или V;
X65 представляет собой D, E, G, S или V;
X66 представляет собой A, I, L, M или V;
X67 представляет собой C, E, G, I, K, L, M, N, Q, R или Y;
X68 представляет собой A, F, H, I, L, M, N, P, R, S или T, и
X69 представляет собой A, C, G, H, I, L, N, P, Q, R, S, T, V или W.
Расщепляемая MMP14 коровая консенсусная последовательность 6 CM
X72 представляет собой A, C, D, E, F, G, H, I, K, L, M, N, P, Q, R, S или V;
X73 представляет собой A, C, E, F, H, L, N, R, S или V;
X74 представляет собой A, D, E, K, N, P Q, S, T или Y;
X75 представляет собой A, E, G, H, K, L, N, P, R, S или T;
X76 представляет собой I, K, L, M, N, R, T, V или Y;
X77 представляет собой A, D, E, I, K, L, P, Q, R, S, T, V или Y;
X78 представляет собой A, C, D, E, G, I, L, M, Q, R, S, T или V, и
X79 представляет собой A, F, G, H, I, L, P, Q, R, S, T или Y.
Расщепляемая MMP14 коровая консенсусная последовательность 6A CM
X72 представляет собой A, C, D, E, F, G, H, I, K, L, M, N, P, Q, R, S или V;
X73 представляет собой A, C, E, F, H, L, N, R, S или V;
X74 представляет собой A, D, E, K, N, P Q, S, T или Y;
X75 представляет собой A, E, G, H, K, L, N, P, R, S или T;
X76 представляет собой I, K, L, M, N, R, T, V или Y;
X77 представляет собой A, D, E, I, K, L, P, Q, R, S, T, V или Y, и
X78 представляет собой A, C, D, E, G, I, L, M, Q, R, S, T или V.
Расщепляемая MMP14 коровая консенсусная последовательность 7 CM
X82 представляет собой A, F, L, Q, S, T или V;
X83 представляет собой A, E, G, H, K, Q, R, V или Y;
X84 представляет собой A, G, I, K, L, M, N, S, T или V;
X85 представляет собой A, D, F, G, I, L, N, P, R, S, T или V;
X86 представляет собой A, P или R;
X87 представляет собой A, D, G, L, M, P, R, S, T, V, W или Y;
X88 представляет собой A, C, E, F, H, I, L, N, R, S, T, W или Y; и
X89 представляет собой A, F, G, I, L, M, R, S, T или V.
Расщепляемая MMP14 коровая консенсусная последовательность 8 CM
X92 представляет собой A, D, F, G, H, I, L, M, N, P, Q, R, S, T, V или W;
X93 представляет собой A, P, R или T;
X94 представляет собой A, E, F, G, H, I, K, L, N, P, Q, R, S, T или V;
X95 представляет собой A, D, E, G, H, K, M, N, P, R, S или T;
X96 представляет собой C, F, H, I, L, M, P, R, S, V, W или Y;
X97 представляет собой A, C, F, G, H, I, K, L, M, R, S, T, V, W или Y, и
X98 представляет собой A, D, E, F, G, H, I, K, L, M, N, P, Q, R, S, T, V или Y.
Расширенная расщепляемая MMP14 коровая консенсусная последовательность 8 CM
X92 представляет собой A, D, F, G, H, I, L, M, N, P, Q, R, S, T, V или W;
X93 представляет собой A, P, R или T;
X94 представляет собой A, E, F, G, H, I, K, L, N, P, Q, R, S, T или V;
X95 представляет собой A, D, E, G, H, K, M, N, P, R, S или T;
X96 представляет собой C, F, H, I, L, M, P, R, S, V, W или Y;
X97 представляет собой A, C, F, G, H, I, K, L, M, R, S, T, V, W или Y;
X98 представляет собой A, D, E, F, G, H, I, K, L, M, N, P, Q, R, S, T, V или Y; и
X99 представляет собой A, D, E, F, G, H, I, K, L, N, P, Q, R, S, T, V, W или Y.
Расщепляемая MMP14 коровая консенсусная последовательность 9 CM
X102 представляет собой A, D, F, G, H, I, L, M, P, R, S, T или V;
X103 представляет собой A, D, E, L, M, P, Q, R, S, T, V или Y;
X104 представляет собой A, G, H, L, N, P, R, S, T или V;
X105 представляет собой A, D, E, H, L, M, N, P, Q, R, S, T или V;
X106 представляет собой A, G, R, S или T;
X107 представляет собой C, F, L, M, S, V, W или Y;
X108 представляет собой A, E, F, G, H, I, L, M, N, Q, R, S, V, W или Y, и
X109 представляет собой A, E, G, L, P, R, S или V.
Расщепляемая MMP14 коровая консенсусная последовательность 10 CM
X112 представляет собой A, D, G, H, I, L, N, P, R, S, T, V, W или Y;
X113 представляет собой A, D, G, H, L, M, N, P, Q, R, S, V или Y;
X114 представляет собой A, H, K, L, N, P, Q, R, S, T или V;
X115 представляет собой A, D, F, G, H, I, L, P, R, S, V или Y;
X116 представляет собой C, F, I, L, P, V или Y;
X117 представляет собой A, D, E, F, G, I, K, M, N, R, S, T, V или W;
X118 представляет собой A, D, E, F, H, K, L, M, N, Q, R, V или Y, и
X119 представляет собой A, F, I, L, M или V.
Расщепляемая MMP14 коровая консенсусная последовательность 11 CM
X122 представляет собой A, G, H, L, P, R, S или V;
X123 представляет собой A, G, R, S, T или V;
X124 представляет собой A, G, P, R, S или T;
X125 представляет собой H, I, L, P, R или V;
X126 представляет собой L или W;
X127 представляет собой F, H, L, M, Q, S, V или Y;
X128 представляет собой A, D, E, I, K, P, R, S, T или V, и
X129 представляет собой A, E, F, G, H, I, L, N, P, Q, R или V.
Расщепляемая MMP14 коровая консенсусная последовательность 12 CM
X2 представляет собой A, D, E, F, G, H, I, L, M, N, P, Q, R, S, T, V или Y;
X3 представляет собой A, E, F, G, H, I, K, L, M, P, Q, R, S, T, V, W или Y;
X4 представляет собой A, E, G, H, K, N, P, R, S, T, V или Y;
X5 представляет собой A, G, H, I, L, N, P, R, S, T или V;
X6 представляет собой I, L, M, Q, T, V, W или Y;
X7 представляет собой A, D, G, H, K, L, N, P, Q, R, S, T или V;
X8 представляет собой A, D, E, F, G, I, K, L, M, P, Q, R, S, V, W или Y, и
X9 представляет собой A, F, G, I, L, M, N, P, Q, R, S, T, V или Y.
Расщепляемая MMP14 коровая консенсусная последовательность 13 CM
X12 представляет собой F, I, L, M, R, S, T или V;
X13 представляет собой A, E, G, H, I, K, L, M, N, P, Q, R, S, T, V, W или Y;
X14 представляет собой A, D, E, F, G, H, I, K, L, M, N, P, Q, R, S, T, V или Y;
X15 представляет собой A, E, G, N, P, Q, S, T, V или W;
X16 представляет собой A, F, G, H, I, K, L, M, N, P, Q, R, S, T, V или Y;
X17 представляет собой A, D, E, F, G, H, I, L, M, N, P, Q, R, S, T, V или Y;
X18 представляет собой A, C, D, E, F, G, H, I, L, M, N, P, Q, R, S, T, V или Y; и
X19 представляет собой A, D, F, G, H, I, L, M, N, P, Q, R, S, T, V, W или Y.
[0028] В некоторых вариантах осуществления CM содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:352, 371, 394, 410, 425, 436, 453, 458, 473, 485 и 486. В некоторых вариантах осуществления CM содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:353-363, 372-375, 376-378, 395-401, 411-419, 426-433, 437-449, 454-456, 459-469, 475-482 и 487-495. В некоторых вариантах осуществления CM содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:353-363. В некоторых вариантах осуществления CM содержит аминокислотную последовательность, выбранную из группы, состоящей из 372-375. В некоторых вариантах осуществления CM содержит аминокислотную последовательность, выбранную из группы, состоящей из 376-378. В некоторых вариантах осуществления CM содержит аминокислотную последовательность, выбранную из группы, состоящей из 395-401. В некоторых вариантах осуществления CM содержит аминокислотную последовательность, выбранную из группы, состоящей из 411-419. В некоторых вариантах осуществления CM содержит аминокислотную последовательность, выбранную из группы, состоящей из 426-433. В некоторых вариантах осуществления CM содержит аминокислотную последовательность, выбранную из группы, состоящей из 437-449. В некоторых вариантах осуществления CM содержит аминокислотную последовательность, выбранную из группы, состоящей из 454-456. В некоторых вариантах осуществления CM содержит аминокислотную последовательность, выбранную из группы, состоящей из 459-469. В некоторых вариантах осуществления CM содержит аминокислотную последовательность, выбранную из группы, состоящей из 475-482. В некоторых вариантах осуществления CM содержит аминокислотную последовательность, выбранную из группы, состоящей из 487-495.
[0029] В некоторых вариантах осуществления CM содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:317, 324, 329 и 340. В некоторых вариантах осуществления CM содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:318-323, 325-327, 330-335 и 341-347. В некоторых вариантах осуществления CM содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:318-323. В некоторых вариантах осуществления, CM содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:325-327. В некоторых вариантах осуществления CM содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:330-335. В некоторых вариантах осуществления CM содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:341-347.
[0030] В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 1 CM, содержащую аминокислотную последовательность RPSPMWAY (SEQ ID NO:21).
[0031] В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 2 CM, содержащую аминокислотную последовательность WDHPISLL (SEQ ID NO:328). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 2 CM, содержащую аминокислотную последовательность WATPRPMR (SEQ ID NO:22).
[0032] В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 3 CM, содержащую аминокислотную последовательность LTFPTYIF (SEQ ID NO:336). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 3 CM, содержащую аминокислотную последовательность MTFPTYIF (SEQ ID NO:337). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 3 CM, содержащую аминокислотную последовательность LTFPTYWF (SEQ ID NO:338). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 3 CM, содержащую аминокислотную последовательность MTFPTYWF (SEQ ID NO:339). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 3 CM, содержащую аминокислотную последовательность STFPFGMF (SEQ ID NO:17).
[0033] В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 4 CM, содержащую аминокислотную последовательность DWLYWMGI (SEQ ID NO:348). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 4 CM, содержащую аминокислотную последовательность DWLYWPGI (SEQ ID NO:19). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 4 CM, содержащую аминокислотную последовательность DWLYWMSI (SEQ ID NO:349). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 4 CM, содержащую аминокислотную последовательность DWLYWPSI (SEQ ID NO:350). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 4 CM, содержащую аминокислотную последовательность HWHLGPPT (SEQ ID NO:351).
[0034] В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 5 CM, содержащую аминокислотную последовательность ISSGLLSS (SEQ ID NO:14). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 5 CM, содержащую аминокислотную последовательность SVSGLLSH (SEQ ID NO:364). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 5 CM, содержащую аминокислотную последовательность SVSGLLSS (SEQ ID NO:365). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 5 CM, содержащую аминокислотную последовательность SVSGLRSH (SEQ ID NO:366). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 5 CM, содержащую аминокислотную последовательность SVSGLRSS (SEQ ID NO:367). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 5 CM, содержащую аминокислотную последовательность TLSGLRSP (SEQ ID NO:368). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 5 CM, содержащую аминокислотную последовательность TSSGLRSP (SEQ ID NO:369). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 5 CM, содержащую аминокислотную последовательность TVSGLRSP (SEQ ID NO:370).
[00035] В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 6 CM, содержащую аминокислотную последовательность AFQALRM (SEQ ID NO:379). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 6 CM, содержащую аминокислотную последовательность AHQALRM (SEQ ID NO:380). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 6 CM, содержащую аминокислотную последовательность ANQALRM (SEQ ID NO:381). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 6 CM, содержащую аминокислотную последовательность ANQALRMA (SEQ ID NO:382). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 6 CM, содержащую аминокислотную последовательность LLEALRAL (SEQ ID NO:383). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 6 CM, содержащую аминокислотную последовательность LLNALRAL (SEQ ID NO:384). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 6 CM, содержащую аминокислотную последовательность LLQALRAL (SEQ ID NO:385). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 6 CM, содержащую аминокислотную последовательность LLSALRAL (SEQ ID NO:386). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 6 CM, содержащую аминокислотную последовательность LLESLRAL (SEQ ID NO:387). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 6 CM, содержащую аминокислотную последовательность LLNSLRAL (SEQ ID NO:388). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 6 CM, содержащую аминокислотную последовательность LLQSLRAL (SEQ ID NO:389). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 6 CM, содержащую аминокислотную последовательность LLSSLRAL (SEQ ID NO:390). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 6 CM, содержащую аминокислотную последовательность QFQALRM (SEQ ID NO:391). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 6 CM, содержащую аминокислотную последовательность QHQALRM (SEQ ID NO:392). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 6 CM, содержащую аминокислотную последовательность QNQALRM (SEQ ID NO:393). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 6 CM, содержащую аминокислотную последовательность QNQALRMA (SEQ ID NO:15).
[0036] В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 7 CM, содержащую аминокислотную последовательность LKAAPRWA (SEQ ID NO:24). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 7 CM, содержащую аминокислотную последовательность LKAAPVWA (SEQ ID NO:403). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 7 CM, содержащую аминокислотную последовательность LKAAPRWF (SEQ ID NO:404). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 7 CM, содержащую аминокислотную последовательность LKAAPVWF (SEQ ID NO:405). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 7 CM, содержащую аминокислотную последовательность LYAAPRWA (SEQ ID NO:406). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 7 CM, содержащую аминокислотную последовательность LYAAPVWA (SEQ ID NO:407). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 7 CM, содержащую аминокислотную последовательность LYAAPRWF (SEQ ID NO:408). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 7 CM, содержащую аминокислотную последовательность LYAAPVWF (SEQ ID NO:409).
[0037] В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 8 CM, содержащую аминокислотную последовательность GPSHLVLT (SEQ ID NO:25). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 8 CM, содержащую аминокислотную последовательность LPAGLLL (SEQ ID NO:402). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 8 CM, содержащую аминокислотную последовательность LPAGLLLR (SEQ ID NO:420). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 8 CM, содержащую аминокислотную последовательность LPAHLVLL (SEQ ID NO:421). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 8 CM, содержащую аминокислотную последовательность LPSHLVLL (SEQ ID NO:422). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 8 CM, содержащую аминокислотную последовательность LPAHLVLV (SEQ ID NO:423). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 8 CM, содержащую аминокислотную последовательность LPSHLVLV (SEQ ID NO:424).
[0038] В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 9 CM, содержащую аминокислотную последовательность RMHLRSLG (SEQ ID NO:29). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 9 CM, содержащую аминокислотная последовательность RRHDGLRA (SEQ ID NO:434). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 9 CM, содержащую аминокислотную последовательность RRHDGLRS (SEQ ID NO:435).
[0039] В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 10 CM, содержащую аминокислотную последовательность AQNLLGMV (SEQ ID NO:16). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 10 CM, содержащую аминокислотную последовательность IANLLSMV (SEQ ID NO:450). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 10 CM, содержащую аминокислотную последовательность ILNLLSMV (SEQ ID NO:451). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 10 CM, содержащую аминокислотную последовательность IQNLLSMV (SEQ ID NO:452).
[0040] В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 11 CM, содержащую аминокислотную последовательность PAGLWLDP (SEQ ID NO:33). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 11 CM, содержащую аминокислотную последовательность PASLWYTQ (SEQ ID NO:457).
[0041] В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 12 CM, содержащую аминокислотную последовательность ALGLLRLP (SEQ ID NO:470). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 12 CM, содержащую аминокислотную последовательность ALGLLSLP (SEQ ID NO:471). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 12 CM, содержащую аминокислотную последовательность ASGLLRFP (SEQ ID NO:472). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 12 CM, содержащую аминокислотную последовательность AVGLLAPP (SEQ ID NO:31).
[0042] В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 13 CM, содержащую аминокислотную последовательность LAAPLGLL (SEQ ID NO:30). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 13 CM, содержащую аминокислотную последовательность LLAPSHRA (SEQ ID NO:32).
[0043] В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 13 CM, содержащую аминокислотную последовательность LLLPAHGG (SEQ ID NO:474). В некоторых вариантах осуществления CM содержит коровую консенсусную последовательность 13 CM, содержащую аминокислотную последовательность LLLPLLGS (SEQ ID NO:483).
[0044] В некоторых вариантах осуществления CM является субстратом по меньшей мере для двух протеаз. В некоторых вариантах осуществления по меньшей мере одна протеаза представляет собой MMP, и по меньшей мере одна протеаза выбрана из группы, состоящей из протеаз, представленных в таблице 7.
Иллюстративные протеазы и/или ферменты
[00045] В некоторых вариантах осуществления антитело содержит по меньшей мере первый CM и второй CM. В некоторых вариантах осуществления каждый из первого CM и второго CM представляет собой полипептидов длиной н более 15 аминокислот. В некоторых вариантах осуществления первый CM и второй CM в антителе в нерасщепленном состоянии имеют структурную организацию от N-конца к C-концу такую, как указано ниже: средство-CM1-CM2-AB, AB-CM2-CM1-средство, средство-CM2-CM1-AB или AB-CM1-CM2-средство. В некоторых вариантах осуществления активируемое антитело содержит связывающий пептид между средством и CM1. В некоторых вариантах осуществления активируемое антитело содержит связывающий пептид между CM1 и CM2. В некоторых вариантах осуществления активируемое антитело содержит связывающий пептид между CM2 и AB. В некоторых вариантах осуществления активируемое антитело содержит связывающий пептид между средством и CM1 и связывающий пептид между CM2 и AB. В некоторых вариантах осуществления активируемое антитело содержит связывающий пептид между средством и CM1 и связывающий пептид между CM1 и CM2. В некоторых вариантах осуществления активируемое антитело содержит связывающий пептид между CM1 и CM2 и связывающий пептид между CM2 и AB. В некоторых вариантах осуществления активируемое антитело содержит связывающий пептид между средством и CM1, связывающий пептид между CM1 и CM2 и связывающий пептид между CM2 и AB.
[0046] В некоторых вариантах осуществления активируемое антитело содержит по меньшей мере первый CM, который содержит субстрат по меньшей мере для одной матриксной металлопротеазы (MMP), и второй CM, который содержит последовательность субстрата. Иллюстративные субстраты для второго CM (CM2) включают, но не ограничиваются ими, субстраты, расщепляемые одним или более следующими ниже ферментами или протеазами, перечисленными в таблице 7.
[0047] В некоторых вариантах осуществления CM2 выбирают для использования с конкретной протеазой. В некоторых вариантах осуществления CM2 представляет собой субстрат по меньшей мере для одной протеазы, выбранной из группы, состоящей из матриксной металлопротеазы (MMP), нейтрофильной эластазы, активатора плазминогена типа u (uPA, также обозначаемого как урокиназа), легумаина, матриптазы (также обозначаемой в настоящем описании как MT-SP1 или MTSP1), тромбина, цистеиновой протеазы, такой как катепсин, ADAM 17, BMP-1, HtrA1, и TMPRSS, такой как TMPRSS3 или TMPRSS4.
[0048] В некоторых вариантах осуществления CM2 представляет собой субстрат для нейтрофильной эластазы. В некоторых вариантах осуществления CM2 представляет собой субстрат для uPA. В некоторых вариантах осуществления CM2 представляет собой субстрат для легумаина. В некоторых вариантах осуществления CM2 представляет собой субстрат для матриптазы. В некоторых вариантах осуществления CM2 представляет собой субстрат для тромбина. В некоторых вариантах осуществления CM2 представляет собой субстрат для цистеиновой протеазы. В некоторых вариантах осуществления CM2 представляет собой субстрат для катепсина. В некоторых вариантах осуществления CM2 представляет собой субстрат для ADAM 17. В некоторых вариантах осуществления CM2 представляет собой субстрат для BMP-1. В некоторых вариантах осуществления CM2 представляет собой субстрат для HtrA1. В некоторых вариантах осуществления CM2 представляет собой субстрат для TMPRSS. В некоторых вариантах осуществления CM2 представляет собой субстрат для TMPRSS3. В некоторых вариантах осуществления CM2 представляет собой субстрат для TMPRSS4.
[0049] Например, подходящие CM2 расщепляются по меньшей мере одной протеазой и содержат последовательность TGRGPSWV (SEQ ID NO:34); SARGPSRW (SEQ ID NO:35); TARGPSFK (SEQ ID NO:36); FSGRSDNH (SEQ ID NO:37); GGWHTGRN (SEQ ID NO:38); HTGRSGAF (SEQ ID NO:39); PFTGRSGG (SEQ ID NO:40); AARGPAIH (SEQ ID NO:41); RGPAFNPM (SEQ ID NO:42); SSRGPAYF (SEQ ID NO:43); RGPATPIM (SEQ ID NO:44); RGPA (SEQ ID NO:45); GGQPSGMWGW (SEQ ID NO:46); FPRPFGITGF (SEQ ID NO:47); VHMPFGFFGP (SEQ ID NO:48); SPFTGRSG (SEQ ID NO:49); SAGFSFPA (SEQ ID NO:126); FAPFGFQRR (SEQ ID NO:50); SGGPFGVR (SEQ ID NO:51); PFGF (SEQ ID NO:52); GPRSFGF (SEQ ID NO:315) и/или GPRSFG (SEQ ID NO:316).
[0050] В некоторых вариантах осуществления CM2 содержит аминокислотную последовательность TGRGPSWV (SEQ ID NO:34). В некоторых вариантах осуществления CM2 содержит аминокислотную последовательность SARGPSRW (SEQ ID NO:35). В некоторых вариантах осуществления CM2 содержит аминокислотную последовательность TARGPSFK (SEQ ID NO:36). В некоторых вариантах осуществления CM2 содержит аминокислотную последовательность FSGRSDNH (SEQ ID NO:37). В некоторых вариантах осуществления CM2 содержит аминокислотную последовательность GGWHTGRN (SEQ ID NO:38). В некоторых вариантах осуществления CM2 содержит аминокислотную последовательность HTGRSGAF (SEQ ID NO:39). В некоторых вариантах осуществления CM2 содержит аминокислотную последовательность PFTGRSGG (SEQ ID NO:40). В некоторых вариантах осуществления CM2 содержит аминокислотную последовательность AARGPAIH (SEQ ID NO:41). В некоторых вариантах осуществления CM2 содержит аминокислотную последовательность RGPAFNPM (SEQ ID NO:42). В некоторых вариантах осуществления CM2 содержит аминокислотную последовательность SSRGPAYF (SEQ ID NO:43). В некоторых вариантах осуществления CM2 содержит аминокислотную последовательность RGPATPIM (SEQ ID NO:44). В некоторых вариантах осуществления CM2 содержит аминокислотную последовательность RGPA (SEQ ID NO:45). В некоторых вариантах осуществления CM2 содержит аминокислотную последовательность GGQPSGMWGW (SEQ ID NO:46). В некоторых вариантах осуществления CM2 содержит аминокислотную последовательность FPRPFGITGF (SEQ ID NO:47). В некоторых вариантах осуществления CM2 содержит аминокислотную последовательность VHMPFGFFGP (SEQ ID NO:48). В некоторых вариантах осуществления CM2 содержит аминокислотную последовательность SPFTGRSG (SEQ ID NO:49). В некоторых вариантах осуществления CM2 содержит аминокислотную последовательность FAPFGFQRR (SEQ ID NO:50). В некоторых вариантах осуществления CM2 содержит аминокислотную последовательность SGGPFGVR (SEQ ID NO:51). В некоторых вариантах осуществления CM2 содержит аминокислотную последовательность PLGL (SEQ ID NO:52). В некоторых вариантах осуществления CM2 содержит аминокислотную последовательность GPRSFGL (SEQ ID NO:315). В некоторых вариантах осуществления CM2 содержит аминокислотную последовательность GPRSFG (SEQ ID NO:316).
[0051] В некоторых вариантах осуществления CM2 представляет собой субстрат по меньшей мере для одной MMP. В некоторых вариантах осуществления CM2 представляет собой субстрат по меньшей мере для одной MMP, перечисленной в таблице 7. В некоторых вариантах осуществления CM2 представляет собой субстрат для MMP9. В некоторых вариантах осуществления CM2 представляет собой субстрат для MMP14. В некоторых вариантах осуществления CM1 представляет собой субстрат для первой MMP, и CM2 представляет собой субстрат для второй MMP, где первая MMP и вторая MMP являются различными MMP. В некоторых вариантах осуществления CM1 представляет собой первую последовательность субстрата для MMP, и CM2 представляет собой второй субстрат для одной и той же MMP, где CM1 и CM2 содержат различные последовательности субстрата. В некоторых вариантах осуществления CM2 представляет собой субстрат для двух или более MMP. В некоторых вариантах осуществления CM2 представляет собой субстрат по меньшей мере для MMP9 или MMP14. В некоторых вариантах осуществления CM2 представляет собой субстрат для двух или более MMP. В некоторых вариантах осуществления CM2 представляет собой субстрат по меньшей мере для MMP9 и MMP14. В некоторых вариантах осуществления CM1 и CM2 представляют собой субстраты для MMP9. В некоторых вариантах осуществления CM1 и CM2 представляют собой субстраты для MMP14. В некоторых вариантах осуществления CM1 представляет собой субстрат для MMP9, и CM2 представляет собой субстрат для MMP14. В некоторых вариантах осуществления CM1 представляет собой субстрат для MMP14, и CM2 представляет собой субстрат для MMP9.
[0052] В некоторых вариантах осуществления по меньшей мере один из CM1 и/или CM2 представляет собой субстрат для MMP и содержит последовательность ISSGLLSS (SEQ ID NO:14); QNQALRMA (SEQ ID NO:15); AQNLLGMV (SEQ ID NO:16); STFPFGMF (SEQ ID NO:17); PVGYTSSL (SEQ ID NO:18); DWLYWPGI (SEQ ID NO:19); MIAPVAYR (SEQ ID NO:20); RPSPMWAY (SEQ ID NO:21); WATPRPMR (SEQ ID NO:22); FRLLDWQW (SEQ ID NO:23); LKAAPRWA (SEQ ID NO:24); GPSHLVLT (SEQ ID NO:25); LPGGLSPW (SEQ ID NO:26); MGLFSEAG (SEQ ID NO:27); SPLPLRVP (SEQ ID NO:28); RMHLRSLG (SEQ ID NO:29); LAAPLGLL (SEQ ID NO:30); AVGLLAPP (SEQ ID NO:31); LLAPSHRA (SEQ ID NO:32); PAGLWLDP (SEQ ID NO:33) и/или ISSGLSS (SEQ ID NO:159).
[0053] В некоторых вариантах осуществления первое расщепляющее средство и второе расщепляющее средство представляют собой одну и ту же протеазу, и первый CM и второй CM представляют собой различные субстраты для фермента. В некоторых вариантах осуществления первое расщепляющее средство и второе расщепляющее средство представляют собой различные протеазы. В некоторых вариантах осуществления первое расщепляющее средство и второе расщепляющее средство солокализованы в ткани-мишени. В некоторых вариантах осуществления первый CM и второй CM расщепляются по меньшей мере одним расщепляющим средством в ткани-мишени.
[0054] В некоторых вариантах осуществления средство, конъюгированное с AB, представляет собой терапевтическое средство. В некоторых вариантах осуществления средство представляет собой антинеопластическое средство. В некоторых вариантах осуществления средство представляет собой токсин или его фрагмент. Как используют в настоящем описании, фрагмент токсина представляет собой фрагмент, который сохраняет токсическую активность. В некоторых вариантах осуществления средство конъюгировано с AB посредством расщепляемого линкера. В некоторых вариантах осуществления средство конъюгировано с AB посредством линкера, который содержит по меньшей мере одну последовательность расщепляемого MMP субстрата. В некоторых вариантах осуществления средство конъюгировано с AB посредством нерасщепляемого линкера. В некоторых вариантах осуществления средство представляет собой ингибитор микротрубочек. В некоторых вариантах осуществления средство представляет собой повреждающее нуклеиновую кислоту средство, такое как алкилирующее ДНК средство или интеркалятор ДНК, или другое повреждающее ДНК средство. В некоторых вариантах осуществления средство представляет собой средство, выбранное из группы, приведенной в таблице 3. В некоторых вариантах осуществления средство представляет собой доластатин. В некоторых вариантах осуществления средство представляет собой ауристатин или его производное. В некоторых вариантах осуществления средство представляет собой ауристатин E или его производное. В некоторых вариантах осуществления средство представляет собой монометилауристатин E (MMAE). В некоторых вариантах осуществления средство представляет собой монометилауристатин D (MMAD). В некоторых вариантах осуществления средство представляет собой майтанзиноид или производное майтанзиноида. В некоторых вариантах осуществления средство представляет собой DM1 или DM4. В некоторых вариантах осуществления средство представляет собой дуокармицин или его производное. В некоторых вариантах осуществления средство представляет собой калихимицин или его производное. В некоторых вариантах осуществления средство представляет собой пирролобензодиазепин.
[0055] В некоторых вариантах осуществления средство представляет собой противовоспалительное средство.
[0056] В некоторых вариантах осуществления антитело также содержит детектируемую молекулу. В некоторых вариантах осуществления детектируемая молекула представляет собой диагностическое средство.
[0057] В некоторых вариантах осуществления конъюгированное антитело и/или конъюгированное активируемое антитело содержит детектируемую метку. В некоторых вариантах осуществления детектируемая метка включает визуализирующее средство, контрастирующее средство, фермент, флуоресцентную метку, хромофор, краситель, один или более ионов металлов или метку на основе лиганда. В некоторых вариантах осуществления визуализирующее средство содержит радиоактивный изотоп. В некоторых вариантах осуществления радиоактивный изотоп представляет собой индий или технеций. В некоторых вариантах осуществления контрастирующее средство содержит йод, гадолиний или оксид железа. В некоторых вариантах осуществления фермент включает пероксидазу хрена, щелочную фосфатазу или β-галактозидазу. В некоторых вариантах осуществления флуоресцентная метка включает желтый флуоресцентный белок (YFP), синий флуоресцентный белок (CFP), зеленый флуоресцентный белок (GFP), модифицированный красный флуоресцентный белок (mRFP), красный флуоресцентн белок tdimer2 (RFP tdimer2), HCRED или производная европия. В некоторых вариантах осуществления люминесцентная метка содержит производную N-метилакридина. В некоторых вариантах осуществления метка включает метку Alexa Fluor®, такую как Alex Fluor® 680 или Alexa Fluor® 750. В некоторых вариантах осуществления метка на основе лиганда включает биотин, авидин, стрептавидин или один или более гаптенов.
[0058] В некоторых вариантах осуществления AB антитела естественным образом содержит одну или более дисульфидных связей. В некоторых вариантах осуществления AB можно конструировать так, чтобы он содержал одну или более дисульфидных связей.
[0059] В некоторых вариантах осуществления антитело и/или конъюгированное антитело является моноспецифическим. В некоторых вариантах осуществления антитело и/или конъюгированное антитело является полиспецифическим, обозначаемом в настоящем описании как полиспецифические антитела и/или конъюгированные полиспецифические антитела. В некоторых вариантах осуществления полиспецифическое антитело и/или конъюгированное полиспецифическое антитело является биспецифическим или трифункциональным. В некоторых вариантах осуществления антитело и/или конъюгированное антитело формулируют в виде части пробиспецифической молекулы-активатора T-клеток (pro-BITE). В некоторых вариантах осуществления антитело и/или конъюгированное антитело формулируют в виде модифицированного прохимерным антигенным рецептором (pro-CAR) T-клетки или другого конструируемого рецептора.
[0060] В некоторых вариантах осуществления активируемое антитело и/или конъюгированное активируемое антитело является моноспецифическим. В некоторых вариантах осуществления активируемое антитело и/или конъюгированное активируемое антитело является полиспецифическим, обозначаемым в настоящем описании как полиспецифические активируемые антитела и/или конъюгированные полиспецифические активируемые антитела. Как используют в настоящем описании, термины, такие как "активируемое антитело" и все его грамматические варианты, если не указано иное, предназначены включать, но не ограничиваются ими, варианты осуществления, где активируемое антитело представляет собой полиспецифическое активируемое антитело по изобретению. Как используют в настоящем описании, термины, такие как "конъюгированное активируемое антитело" и все его грамматические конструкции, если не указано иное, предназначены включать, но не ограничиваются ими, варианты осуществления, где конъюгированное активируемое антитело представляет собой конъюгированное полиспецифическое активируемое антитело по изобретению. В некоторых вариантах осуществления полиспецифическое активируемое антитело и/или конъюгированное полиспецифическое активируемое антитело является биспецифическим или трифункциональным. В некоторых вариантах осуществления активируемое антитело и/или конъюгированное активируемое антитело формулируют в виде части пробиспецифической молекулы-активатора T-клеток (pro-BITE). В некоторых вариантах осуществления активируемое антитело и/или конъюгированное активируемое антитело формулируют в виде части модифицированной прохимерным антигенным рецептором (pro-CAR) T-клетки или другого конструируемого рецептора.
[0061] В некоторых вариантах осуществления активируемые антитела, конъюгированные активируемые антитела, полиспецифические активируемые антитела и/или конъюгированные полиспецифические активируемые антитела, описываемые в настоящем описании, используют в сочетании с один или более дополнительных средств или комбинацией дополнительных средств. Подходящие дополнительные средства включают существующие в настоящее время фармацевтические и/или хирургические виды терапии для предполагаемого применения, такие как, например, злокачественная опухоль. Например, активируемые антитела, конъюгированные активируемые антитела, полиспецифические активируемые антитела и/или конъюгированные полиспецифические активируемые антитела можно использовать в сочетании с дополнительным химиотерапевтическим или антинеопластическим средством.
[0062] Активируемые антитела, описываемые в настоящем описании, в активированном состоянии связываются с данной мишенью и содержат (i) антитело или его антигенсвязывающий фрагмент (AB), который специфически связывается с мишенью; (ii) маскирующий фрагмент (MM), который ингибирует связывание AB с мишенью в нерасщепленном состоянии, и (c) расщепляемый фрагмент (CM), соединенный с AB, где CM представляет собой полипептид, который функционирует как субстрат для матриксной металлопротеазы.
[0063] В некоторых вариантах осуществления структурная организация активируемого антитела в нерасщепленном состоянии от N-конца к C-концу является такой, как указано ниже: MM-CM-AB или AB-CM-MM.
[0064] В некоторых вариантах осуществления активируемое антитело содержит связывающий пептид между MM и CM.
[0065] В некоторых вариантах осуществления активируемое антитело содержит связывающий пептид между CM и AB.
[0066] В некоторых вариантах осуществления активируемое антитело содержит первый связывающий пептид (LP1) и второй связывающий пептид (LP2), и структурная организация активируемого антитела в нерасщепленном состоянии от N-конца к C-концу является такой, как указано ниже: MM-LP1-CM-LP2-AB или AB-LP2-CM-LP1-MM.
[0067] В некоторых вариантах осуществления каждый из LP1 и LP2 представляет собой пептид длиной приблизительно от 1 до 20 аминокислот.
[0068] В некоторых вариантах осуществления два связывающих пептида необязательно должны являться идентичными друг другу.
[0069] В некоторых вариантах осуществления по меньшей мере один из LP1 или LP2 содержит аминокислотную последовательность, выбранную из группы, состоящей из (GS)n, (GGS)n, (GSGGS)n (SEQ ID NO:1) и (GGGS)n (SEQ ID NO:2), где n представляет собой целое число по меньшей мере один.
[0070] В некоторых вариантах осуществления по меньшей мере один из LP1 или LP2 содержит аминокислотную последовательность, выбранную из группы, состоящей из GGSG (SEQ ID NO:3), GGSGG (SEQ ID NO:4), GSGSG (SEQ ID NO:5), GSGGG (SEQ ID NO:6), GGGSG (SEQ ID NO:7) и GSSSG (SEQ ID NO:8).
[0071] В некоторых вариантах осуществления LP1 содержит аминокислотную последовательность GSSGGSGGSGGSG (SEQ ID NO:9), GSSGGSGGSGG (SEQ ID NO:10), GSSGGSGGSGGS (SEQ ID NO:11), GSSGGSGGSGGSGGGS (SEQ ID NO:155), GSSGGSGGSG (SEQ ID NO:156) или GSSGGSGGSGS (SEQ ID NO:157).
[0072] В некоторых вариантах осуществления LP2 содержит аминокислотную последовательность GSS, GGS, GGGS (SEQ ID NO:158), GSSGT (SEQ ID NO:12) или GSSG (SEQ ID NO:13).
[0073] В некоторых вариантах осуществления равновесная константа диссоциации AB составляет приблизительно 100 нМ или менее для связывания с мишенью.
[0074] В некоторых вариантах осуществления активируемое антитело включает антитело или его антигенсвязывающий фрагмент, который специфически связывается с мишенью. В некоторых вариантах осуществления антитело или его иммунологически активный фрагмент, который связывается с мишенью, представляет собой моноклональное антитело, доменное антитело, одноцепочечный фрагмент, фрагмент Fab, фрагмент F(ab')2, scFv, scab, dAb, однодоменное антитело, состоящее из тяжелой цепи, или однодоменное антитело, состоящее из легкой цепи. В некоторых вариантах осуществления такое антитело или его иммунологически активный фрагмент, который связывается с мишенью, представляет собой моноклональное антитело мыши, другого грызуна, химерное, гуманизированное или полностью принадлежащее человеку моноклональное антитело.
[0075] В некоторых вариантах осуществления активируемое антитело представляет собой полиспецифическое активируемое антитело. Полиспецифические активируемые антитела, предоставленные в настоящем описании, представляют собой полиспецифические антитела, которые распознают два или более различных антигена или эпитопа, и которые содержат по меньшей мере один маскирующий фрагмент (MM), связанный по меньшей мере с одним антигенсвязывающим или эпитопсвязывающим доменом полиспецифического антитела, таким образом, что связывание MM снижает способность антигенсвязывающего или эпитопсвязывающего домена связываться со своей мишенью. В некоторых вариантах осуществления MM соединен с антигенсвязывающим или эпитопсвязывающим доменом полиспецифического антитела через расщепляемый фрагмент (CM), который функционирует как субстрат по меньшей мере для одной протеазы MMP. Активируемые полиспецифические антитела, предоставленные в настоящем описании, являются стабильными в кровяном русле, активируются в предполагаемом участке проведения терапии и/или диагностики, а не в нормальной, т.е. здоровой ткани, и при активации характеризуются связыванием с мишенью, которое является по меньшей мере сравнимым с соответствующим, немодифицированным полиспецифическим антителом.
[0076] В некоторых вариантах осуществления активируемое антитело и/или конъюгированное активируемое антитело, предоставленное в настоящем описании, включая, но, не ограничиваясь ими, полиспецифическое активируемое антитело и/или конъюгированное полиспецифическое активируемое антитело по изобретению, включает по меньшей мере первое антитело или его антигенсвязывающий фрагмент (AB1), который специфически связывается с мишенью Jagged, например, Jagged 1 и/или Jagged 2 и который содержит комбинацию последовательности CDR1 VH, последовательности CDR2 VH и последовательности CDR3 VH, где по меньшей мере одна из последовательности CDR1 VH, последовательности CDR2 VH и последовательности CDR3 VH выбрана из CDR1 VH, последовательность которой содержит по меньшей мере аминокислотную последовательность SYAMS (SEQ ID NO:498); последовательность CDR2 VH, которая содержит по меньшей мере аминокислотную последовательность SIDPEGRQTYYADSVKG (SEQ ID NO:499); последовательности CDR3 VH, которая содержит по меньшей мере аминокислотную последовательность DIGGRSAFDY (SEQ ID NO:500), и их сочетаний.
[0077] В некоторых вариантах осуществления активируемое антитело и/или конъюгированное активируемое антитело, предоставленное в настоящем описании, включая, но, не ограничиваясь ими, полиспецифическое активируемое антитело и/или конъюгированное полиспецифическое активируемое антитело по изобретению, включает по меньшей мере первое антитело или его антигенсвязывающий фрагмент (AB1), который специфически связывается с мишенью Jagged, например, Jagged 1 и/или Jagged 2 и который содержит комбинацию последовательности CDR1 VL, последовательности CDR2 VL и последовательности CDR3 VL, где по меньшей мере одна из последовательности CDR1 VL, последовательности CDR2 VL и последовательности CDR3 VL выбрана из последовательности CDR1 VL, которая содержит по меньшей мере аминокислотную последовательность RASQSISSY (SEQ ID NO:501); последовательности CDR2 VL, которая содержит по меньшей мере аминокислотную последовательность AASSLQS (SEQ ID NO:502); последовательности CDR3 VL, которая содержит по меньшей мере аминокислотную последовательность QQTVVAPPL (SEQ ID NO:503), и их сочетаний.
[0078] В некоторых вариантах осуществления активируемое антитело и/или конъюгированное активируемое антитело, предоставленное в настоящем описании, включая, но, не ограничиваясь ими, полиспецифическое активируемое антитело и/или конъюгированное полиспецифическое активируемое антитело по изобретению, включает по меньшей мере первое антитело или его антигенсвязывающий фрагмент (AB1), который специфически связывается с мишенью Jagged, например, Jagged 1 и/или Jagged 2 и который содержит комбинацию последовательности CDR1 VH, последовательности CDR2 VH и последовательности CDR3 VH, где по меньшей мере одна из последовательности CDR1 VH, последовательности CDR2 VH и последовательности CDR3 VH выбрана из последовательности CDR1 VH, которая содержит последовательность, которая является по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичной аминокислотной последовательности SYAMS (SEQ ID NO:498); последовательности CDR2 VH, которая содержит последовательность, которая является по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичной аминокислотной последовательности SIDPEGRQTYYADSVKG (SEQ ID NO:499); последовательности CDR3 VH, которая содержит последовательность, которая является по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичной аминокислотной последовательности DIGGRSAFDY (SEQ ID NO:500), и их сочетаний.
[0079] В некоторых вариантах осуществления активируемое антитело и/или конъюгированное активируемое антитело, предоставленное в настоящем описании, включая, но, не ограничиваясь ими, полиспецифическое активируемое антитело и/или конъюгированное полиспецифическое активируемое антитело по изобретению, включает по меньшей мере первое антитело или его антигенсвязывающий фрагмент (AB1), который специфически связывается с мишенью Jagged, например, Jagged 1 и/или Jagged 2 и который содержит комбинацию последовательности CDR1 VL, последовательности CDR2 VL и последовательности CDR3 VL, где по меньшей мере одна из последовательности CDR1 VL, последовательности CDR2 VL и последовательности CDR3 VL выбрана из последовательности CDR1 VL, которая содержит последовательность, которая является по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичной аминокислотной последовательности RASQSISSY (SEQ ID NO:501); последовательности CDR2 VL, которая содержит последовательность, которая является по меньшей мере на 90%,91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичной аминокислотной последовательности AASSFQS (SEQ ID NO:502), и последовательности CDR3 VL, которая содержит последовательность, которая является по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичной аминокислотной последовательности QQTVVAPPF (SEQ ID NO:503), и их сочетаний.
[0080] В некоторых вариантах осуществления активируемое антитело и/или конъюгированное активируемое антитело, предоставленное в настоящем описании, включая, но, не ограничиваясь ими, полиспецифическое активируемое антитело и/или конъюгированное полиспецифическое активируемое антитело по изобретению, включает по меньшей мере первое антитело или его антигенсвязывающий фрагмент (AB1), который специфически связывается с мишенью Jagged, например, Jagged 1 и/или Jagged 2 и который содержит комбинацию последовательности CDR1 VH, последовательности CDR2 VH, последовательности CDR3 VH, последовательности CDR1 VL, последовательности CDR2 VL и последовательности CDR3 VL, где последовательность CDR1 VH содержит по меньшей мере аминокислотную последовательность SYAMS (SEQ ID NO:498); последовательность CDR2 VH содержит по меньшей мере аминокислотную последовательность SIDPEGRQTYYADSVKG (SEQ ID NO:499); последовательность CDR3 VH содержит по меньшей мере аминокислотную последовательность DIGGRSAFDY (SEQ ID NO:500); последовательность CDR1 VL содержит по меньшей мере аминокислотную последовательность RASQSISSY (SEQ ID NO:501); последовательность CDR2 VL содержит по меньшей мере аминокислотную последовательность AASSFQS (SEQ ID NO:502) и последовательность CDR3 VL содержит по меньшей мере аминокислотную последовательность QQTVVAPPF (SEQ ID NO:503).
[0081] В некоторых вариантах осуществления активируемое антитело и/или конъюгированное активируемое антитело, предоставленное в настоящем описании, включая, но, не ограничиваясь ими, полиспецифическое активируемое антитело и/или конъюгированное полиспецифическое активируемое антитело по изобретению, включает по меньшей мере первое антитело или его антигенсвязывающий фрагмент (AB1), который специфически связывается с мишенью Jagged, например, Jagged 1 и/или Jagged 2 и который содержит комбинацию последовательности CDR1 VH, последовательности CDR2 VH, последовательности CDR3 VH, последовательности CDR1 VL, последовательности CDR2 VL и последовательности CDR3 VL, где последовательность CDR1 VH содержит последовательность, которая является по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичной аминокислотной последовательности SYAMS (SEQ ID NO:498); последовательность CDR2 VH, содержит последовательность, которая является по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичной аминокислотной последовательности SIDPEGRQTYYADSVKG (SEQ ID NO:499); последовательность CDR3 VH, содержит последовательность, которая является по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичной аминокислотной последовательности DIGGRSAFDY (SEQ ID NO:500); последовательность CDR1 VL содержит последовательность, которая является по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичной аминокислотной последовательности RASQSISSY (SEQ ID NO:501); последовательность CDR2 VL содержит последовательность, которая является по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичной аминокислотной последовательности AASSLQS (SEQ ID NO:502), и последовательность CDR3 VL содержит последовательность, которая является по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичной аминокислотной последовательности QQTVVAPPL (SEQ ID NO:503).
[0082] В некоторых вариантах осуществления активируемое антитело и/или конъюгированное активируемое антитело, предоставленное в настоящем описании, включая, но, не ограничиваясь ими, полиспецифическое активируемое антитело и/или конъюгированное полиспецифическое активируемое антитело по изобретению, включает по меньшей мере первое антитело или его антигенсвязывающий фрагмент (AB1), который специфически связывается с рецептором эпидермального фактора роста (EGFR) и который содержит комбинацию последовательности CDR1 VH, последовательности CDR2 VH и последовательности CDR3 VH, где по меньшей мере одна из последовательности CDR1 VH, последовательности CDR2 VH и последовательности CDR3 VH выбрана из последовательности CDR1 VH, которая содержит по меньшей мере аминокислотную последовательность NYGVH (SEQ ID NO:504); последовательности CDR2 VH, которая содержит по меньшей мере аминокислотную последовательность VIWSGGNTDYNTPFTS (SEQ ID NO:505); последовательности CDR3 VH, которая содержит по меньшей мере аминокислотную последовательность ALTYYDYEFAY (SEQ ID NO:506), и их сочетаний.
[0083] В некоторых вариантах осуществления активируемое антитело и/или конъюгированное активируемое антитело, предоставленное в настоящем описании, включая, но, не ограничиваясь ими, полиспецифическое активируемое антитело и/или конъюгированное полиспецифическое активируемое антитело по изобретению, включает по меньшей мере первое антитело или его антигенсвязывающий фрагмент (AB1), который специфически связывается с EGFR и который содержит комбинацию последовательности CDR1 VL, последовательности CDR2 VL и последовательности CDR3 VL, где по меньшей мере одна из последовательности CDR1 VL, последовательности CDR2 VL и последовательности CDR3 VL выбрана из a последовательности CDR1 VL, которая содержит по меньшей мере аминокислотную последовательность RASQSIGTNIH (SEQ ID NO:507); последовательности CDR2 VL, которая содержит по меньшей мере аминокислотную последовательность KYASESIS (SEQ ID NO:508), и последовательности CDR3 VL, которая содержит по меньшей мере аминокислотную последовательность QQNNNWPTT (SEQ ID NO:509), и их сочетаний.
[0084] В некоторых вариантах осуществления активируемое антитело и/или конъюгированное активируемое антитело, предоставленное в настоящем описании, включая, но, не ограничиваясь ими, полиспецифическое активируемое антитело и/или конъюгированное полиспецифическое активируемое антитело по изобретению, включает по меньшей мере первое антитело или его антигенсвязывающий фрагмент (AB1), который специфически связывается с EGFR и который содержит комбинацию последовательности CDR1 VH, последовательности CDR2 VH и последовательности CDR3 VH, где по меньшей мере одна из последовательности CDR1 VH, последовательности CDR2 VH и последовательности CDR3 VH выбрана из последовательности CDR1 VH, которая содержит последовательность которая является по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичной аминокислотной последовательности NYGVH (SEQ ID NO:504); последовательности CDR2 VH, которая содержит последовательность, которая является по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичной аминокислотной последовательности VIWSGGNTDYNTPFTS (SEQ ID NO:505); последовательности CDR3 VH, которая содержит последовательность, которая является по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичной аминокислотной последовательности ALTYYDYEFAY (SEQ ID NO:506), и их сочетаний.
[0085] В некоторых вариантах осуществления активируемое антитело и/или конъюгированное активируемое антитело, предоставленное в настоящем описании, включая, но, не ограничиваясь ими, полиспецифическое активируемое антитело и/или конъюгированное полиспецифическое активируемое антитело по изобретению, включает по меньшей мере первое антитело или его антигенсвязывающий фрагмент (AB1), который специфически связывается с EGFR и который содержит комбинацию последовательности CDR1 VL, последовательности CDR2 VL и последовательности CDR3 VL, где по меньшей мере одна из последовательности CDR1 VL, последовательности CDR2 VL и последовательности CDR3 VL выбрана из последовательности CDR1 VL, которая содержит последовательность, которая является по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичной аминокислотной последовательности RASQSIGTNIH (SEQ ID NO:507); последовательности CDR2 VL, которая содержит последовательность которая является по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичной аминокислотной последовательности KYASESIS (SEQ ID NO:508), и последовательности CDR3 VL, которая содержит последовательность, которая является по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%,96%, 97%, 98%, 99% или более идентичной аминокислотной последовательности QQNNNWPTT (SEQ ID NO:509), и их сочетаний.
[0086] В некоторых вариантах осуществления активируемое антитело и/или конъюгированное активируемое антитело, предоставленное в настоящем описании, включая, но, не ограничиваясь ими, полиспецифическое активируемое антитело и/или конъюгированное полиспецифическое активируемое антитело по изобретению, включает по меньшей мере первое антитело или его антигенсвязывающий фрагмент (AB1), который специфически связывается с EGFR и который содержит комбинацию последовательности CDR1 VH, последовательности CDR2 VH, последовательности CDR3 VH, последовательности CDR1 VL, последовательности CDR2 VL и последовательности CDR3 VL, где последовательность CDR1 VH содержит по меньшей мере аминокислотную последовательность NYGVH (SEQ ID NO:504); последовательность CDR2 VH содержит по меньшей мере аминокислотную последовательность VIWSGGNTDYNTPFTS (SEQ ID NO:505); последовательность CDR3 VH содержит по меньшей мере аминокислотную последовательность ALTYYDYEFAY (SEQ ID NO:506); последовательность CDR1 VL содержит по меньшей мере аминокислотную последовательность RASQSIGTNIH (SEQ ID NO:507); последовательность CDR2 VL содержит по меньшей мере аминокислотную последовательность KYASESIS (SEQ ID NO:508), и последовательность CDR3 VL содержит по меньшей мере аминокислотную последовательность QQNNNWPTT (SEQ ID NO:509).
[0087] В некоторых вариантах осуществления активируемое антитело и/или конъюгированное активируемое антитело, предоставленное в настоящем описании, включая, но, не ограничиваясь ими, полиспецифическое активируемое антитело и/или конъюгированное полиспецифическое активируемое антитело по изобретению, включает по меньшей мере первое антитело или его антигенсвязывающий фрагмент (AB1), который специфически связывается с EGFR и который содержит комбинацию последовательности CDR1 VH, последовательности CDR2 VH, последовательности CDR3 VH, последовательности CDR1 VL, последовательности CDR2 VL и последовательности CDR3 VL, где последовательность CDR1 VH содержит последовательность, которая является по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичной аминокислотной последовательности NYGVH (SEQ ID NO:504); последовательность CDR2 VH содержит последовательность, которая является по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичной аминокислотной последовательности VIWSGGNTDYNTPFTS (SEQ ID NO:505); последовательность CDR3 VH содержит последовательность, которая является по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичной аминокислотной последовательности ALTYYDYEFAY (SEQ ID NO:506); последовательность CDR1 VL содержит последовательность, которая является по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичной аминокислотной последовательности RASQSIGTNIH (SEQ ID NO:507); последовательность CDR2 VL содержит последовательность, которая является по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичной аминокислотной последовательности KYASESIS (SEQ ID NO:508), и последовательность CDR3 VL содержит последовательность, которая является по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичной аминокислотной последовательности QQNNNWPTT (SEQ ID NO:509).
[0088] В некоторых вариантах осуществления активируемое антитело и/или конъюгированное активируемое антитело, предоставленное в настоящем описании, включая, но, не ограничиваясь ими, полиспецифическое активируемое антитело и/или конъюгированное полиспецифическое активируемое антитело по изобретению, содержит по меньшей мере аминокислотную последовательность тяжелой цепи, выбранную из группы, состоящей из SEQ ID NO:54, 56, 57, 58, 61, 63, 65, 68, 70, 72, 76, 78, 80, 82, 84, 86, 88, 90, 92, 94, 96, 98, 100, 102,104, 106, 108, 110, 112 и 114. В некоторых вариантах осуществления активируемое антитело и/или конъюгированное активируемое антитело, предоставленное в настоящем описании, включая, но, не ограничиваясь ими, полиспецифическое активируемое антитело и/или конъюгированное полиспецифическое активируемое антитело по изобретению, содержит по меньшей мере аминокислотную последовательность легкой цепи, выбранную из группы, состоящей из SEQ ID NO:55, 59, 60, 62, 64, 67, 69, 71, 73, 75, 77, 79, 81, 83, 85, 87, 89, 91, 93, 95,97, 99, 101, 103, 105, 107, 109, 111 и 113. В некоторых вариантах осуществления активируемое антитело и/или конъюгированное активируемое антитело, предоставленное в настоящем описании, включая, но, не ограничиваясь ими, полиспецифическое активируемое антитело и/или конъюгированное полиспецифическое активируемое антитело по изобретению, содержит по меньшей мере аминокислотную последовательность тяжелой цепи, выбранную из группы, состоящей из SEQ ID NO:54, 56, 57, 58, 61, 63, 65, 68, 70, 72, 76, 78, 80, 82, 84, 86, 88, 90, 92, 94, 96, 98, 100, 102, 104, 106, 108, 110, 112 и 114, и аминокислотную последовательность легкой цепи, выбранную из группы, состоящей из SEQ ID NO:55, 59, 60, 62, 64, 67, 69, 71, 73, 75, 77, 79, 81, 83, 85, 87, 89, 91, 93, 95, 97, 99, 101, 103, 105, 107, 109,111 и 113.
[0089] В некоторых вариантах осуществления активируемое антитело и/или конъюгированное активируемое антитело, предоставленное в настоящем описании, включая, но, не ограничиваясь ими, полиспецифическое активируемое антитело и/или конъюгированное полиспецифическое активируемое антитело по изобретению, содержит по меньшей мере аминокислотную последовательность тяжелой цепи, которая является по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:54, 56, 57, 58, 61, 63, 65, 68, 70, 72, 76, 78, 80, 82, 84, 86, 88, 90, 92, 94, 96, 98, 100, 102, 104, 106, 108, 110, 112 и 114. В некоторых вариантах осуществления активируемое антитело и/или конъюгированное активируемое антитело, предоставленное в настоящем описании, включая, но, не ограничиваясь ими, полиспецифическое активируемое антитело и/или конъюгированное полиспецифическое активируемое антитело по изобретению, содержит по меньшей мере аминокислотную последовательность легкой цепи, которая является по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:55, 59, 60, 62, 64, 67, 69, 71, 73, 75, 77, 79, 81, 83, 85, 87, 89, 91, 93, 95, 97, 99, 101, 103, 105, 107, 109, 111 и 113. В некоторых вариантах осуществления активируемое антитело и/или конъюгированное активируемое антитело, предоставленное в настоящем описании, включая, но, не ограничиваясь ими, полиспецифическое активируемое антитело и/или конъюгированное полиспецифическое активируемое антитело по изобретению, содержит по меньшей мере аминокислотную последовательность тяжелой цепи, которая является по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:54, 56, 57, 58, 61, 63, 65, 68, 70, 72, 76, 78, 80, 82, 84, 86, 88, 90, 92, 94, 96, 98, 100, 102, 104, 106, 108, 110, 112 и 114, и аминокислотную последовательность легкой цепи, которая является по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:55, 59, 60, 62, 64, 67, 69, 71, 73, 75, 77, 79, 81, 83, 85, 87, 89, 91, 93, 95, 97, 99, 101, 103, 105, 107, 109, 111 и 113.
[0090] В некоторых вариантах осуществления MM имеет равновесную константу диссоциации для связывания с AB, которая является больше, чем равновесная константа диссоциации AB с мишенью.
[0091] В некоторых вариантах осуществления MM имеет равновесную константу диссоциации для связывания с AB, которая не является больше, чем равновесная константа диссоциации AB с мишенью.
[0092] В некоторых вариантах осуществления MM не препятствует или не конкурирует с AB за связывание с мишенью в расщепленном состоянии.
[0093] В некоторых вариантах осуществления MM представляет собой полипептид длиной приблизительно от 2 до 40 аминокислот. Например, MM представляет собой полипептид длиной приблизительно до 40 аминокислот.
[0094] В некоторых вариантах осуществления полипептидная последовательность MM отличается от полипептидной последовательности любой природного партнера по связыванию AB. В некоторых вариантах осуществления полипептидная последовательность MM является не более, чем на 50% идентичной любому природному партнеру по связыванию AB. В некоторых вариантах осуществления полипептидная последовательность MM является не более, чем на 40%, 30%, 25%, 20%, 15% или 10% идентичной любому природному партнеру по связыванию AB.
[0095] В некоторых вариантах осуществления связывание MM с AB снижает способность AB связываться со своей мишенью, таким образом, что константа диссоциации (Kd) AB, когда он связан с MM, к мишени является по меньшей мере в два раза больше, чем Kd AB к мишени, когда он не связан с MM.
[0096] В некоторых вариантах осуществления связывание MM с AB снижает способность AB связываться со своей мишенью, таким образом, что константа диссоциации (Kd) AB, когда он связан с MM, к мишени является по меньшей мере в три раза больше, чем Kd AB к мишени, когда он не связан с MM.
[0097] В некоторых вариантах осуществления связывание MM с AB снижает способность AB связываться со своей мишенью, таким образом, что константа диссоциации (Kd) AB, когда он связан с MM, к мишени является по меньшей мере в пять раз больше, чем Kd AB к мишени, когда он не связан с MM.
[0098] В некоторых вариантах осуществления связывание MM с AB снижает способность AB связываться со своей мишенью, таким образом, что константа диссоциации (Kd) AB, когда он связан с MM, к мишени является по меньшей мере в 10 раз больше, чем Kd AB к мишени, когда он не связан с MM.
[0099] В некоторых вариантах осуществления связывание MM с AB снижает способность AB связываться со своей мишенью, таким образом, что константа диссоциации (Kd) AB, когда он связан с MM, к мишени является по меньшей мере в 20 раз больше, чем Kd AB к мишени, когда он не связан с MM.
[000100] В некоторых вариантах осуществления связывание MM с AB снижает способность AB связываться с мишенью, таким образом, что константа диссоциации (Kd) AB, когда он связан с MM, к мишени является по меньшей мере в 40 раз больше, чем Kd AB к мишени, когда он не связан с MM.
[000101] В некоторых вариантах осуществления связывание MM с AB снижает способность AB связываться с мишенью, таким образом, что константа диссоциации (Kd) AB, когда он связан с MM, к мишени является по меньшей мере в 100 раз больше, чем Kd AB к мишени, когда он не связан с MM.
[000102] В некоторых вариантах осуществления связывание MM с AB снижает способность AB связываться с мишенью, таким образом, что константа диссоциации (Kd) AB, когда он связан с MM, к мишени является по меньшей мере 1000 раз больше, чем Kd AB к мишени, когда он не связан с MM.
[000103] В некоторых вариантах осуществления связывание MM с AB снижает способность AB связываться с мишенью, таким образом, что константа диссоциации (Kd) AB, когда он связан с MM, к мишени является по меньшей мере 10,000 раз больше, чем Kd AB к мишени, когда он не связан с MM.
[000104] В некоторых вариантах осуществления протеаза MMP солокализована с мишенью в ткани, и MMP расщепляет CM в активируемом антителе, когда активируемое антитело подвергается действию MMP.
[000105] В некоторых вариантах осуществления в присутствии мишени MM снижает способность AB связываться с мишенью по меньшей мере на 90%, когда CM не отщеплен, по сравнению с тем, когда CM отщепляется при анализе in vitro с использованием анализ замещения мишени, такой как, например, анализ, описанный в публикациях PCT № WO 2009/025846 и WO 2010/081173.
[000106] В некоторых вариантах осуществления CM располагают в активируемом антителе таким образом, что в нерасщепленном состоянии связывание активируемого антитела с мишенью снижается при равновесной константе диссоциации, которая является по меньшей мере в два раза больше, чем равновесная константа диссоциации связывания немодифицированного AB с мишенью, если в расщепленном состоянии (т.е. когда активируемое антитело находится в расщепленном состоянии) AB связывается с мишенью.
[000107] В некоторых вариантах осуществления CM располагают в активируемом антителе таким образом, что в нерасщепленном состоянии связывание активируемого антитела с мишенью снижается при равновесной константе диссоциации, которая является по меньшей мере в пять раз большей, чем равновесная константа диссоциации связывания немодифицированного AB с мишенью, если в расщепленном состоянии (т.е. когда активируемое антитело находится в расщепленном состоянии) AB связывается с мишенью.
[000108] В некоторых вариантах осуществления CM располагают в активируемом антителе таким образом, что в нерасщепленном состоянии, связывание активируемого антитела с мишенью снижается при равновесной константе диссоциации, которая является по меньшей мере в десять раз больше, чем равновесная константа диссоциации связывания немодифицированного AB с мишенью, если в расщепленном состоянии (т.е. когда активируемое антитело находится в расщепленном состоянии) AB связывается с мишенью.
[000109] В некоторых вариантах осуществления CM располагают в активируемом антителе таким образом, что в нерасщепленном состоянии, связывание активируемого антитела с мишенью снижается при равновесной константе диссоциации, которая является по меньшей мере в 20 раз больше, чем равновесная константа диссоциации связывания немодифицированного AB с мишенью, если в расщепленном состоянии (т.е. когда активируемое антитело находится в расщепленном состоянии) AB связывается с мишенью.
[000110] В некоторых вариантах осуществления CM располагают в активируемом антителе таким образом, что в нерасщепленном состоянии, связывание активируемого антитела с мишенью снижается при равновесной константе диссоциации, которая является по меньшей мере в 40 раз больше, чем равновесная константа диссоциации связывания немодифицированного AB с мишенью, если в расщепленном состоянии AB связывается с мишенью.
[000111] В некоторых вариантах осуществления CM располагают в активируемом антителе таким образом, что в нерасщепленном состоянии, связывание активируемого антитела с мишенью снижается при равновесной константе диссоциации, которая является по меньшей мере в 50 раз больше, чем равновесная константа диссоциации связывания немодифицированного AB с мишенью, если в расщепленном состоянии AB связывается с мишенью.
[000112] В некоторых вариантах осуществления CM располагают в активируемом антителе таким образом, что в нерасщепленном состоянии, связывание активируемого антитела с мишенью снижается при равновесной константе диссоциации, которая является по меньшей мере в 100 раз больше, чем равновесная константа диссоциации связывания немодифицированного AB с мишенью, если в расщепленном состоянии AB связывается с мишенью.
[000113] В некоторых вариантах осуществления CM располагают в активируемом антителе таким образом, что в нерасщепленном состоянии, связывание активируемого антитела с мишенью снижается при равновесной константе диссоциации, которая является по меньшей мере в 200 раз больше, чем равновесная константа диссоциации связывания немодифицированного AB с мишенью, если в расщепленном состоянии AB связывается с мишенью.
[000114] В некоторых вариантах осуществления CM представляет собой полипептид длиной до 15 аминокислот.
[000115] В некоторых вариантах осуществления CM является субстратом по меньшей мере для одной матриксной металлопротеазы (MMP). Примеры MMP включают MMP1, MMP2, MMP3, MMP7, MMP8, MMP9, MMP10, MMP11, MMP 12, MMP13, MMP14, MMP 15, MMP 16,MMP 17, MMP 19, MMP20, MMP23, MMP24, MMP26 и MMP27. В некоторых вариантах осуществления CM является субстратом для MMP9, MMP14, MMP1, MMP3, MMP13, MMP17, MMP11 и MMP19. В некоторых вариантах осуществления CM является субстратом для MMP9. В некоторых вариантах осуществления CM является субстратом для MMP14. В некоторых вариантах осуществления CM является субстратом для двух или более MMP. В некоторых вариантах осуществления CM является субстратом по меньшей мере для MMP9 и MMP14. В некоторых вариантах осуществления CM содержит два или более субстратов для одной и той же MMP. В некоторых вариантах осуществления CM содержит по меньшей мере два или более субстратов MMP9. В некоторых вариантах осуществления CM содержит по меньшей мере два или более субстратов MMP14.
[000116] В некоторых вариантах осуществления CM является субстратом для MMP и содержит последовательность ISSGLLSS (SEQ ID NO:14); QNQALRMA (SEQ ID NO:15); AQNLLGMV (SEQ ID NO:16); STFPFGMF (SEQ ID NO:17); PVGYTSSL (SEQ ID NO:18); DWLYWPGI (SEQ ID NO:19); MIAPVAYR (SEQ ID NO:20); RPSPMWAY (SEQ ID NO:21); WATPRPMR (SEQ ID NO:22); FRLLDWQW (SEQ ID NO:23); LKAAPRWA (SEQ ID NO:24); GPSHLVLT (SEQ ID NO:25); LPGGLSPW (SEQ ID NO:26); MGLFSEAG (SEQ ID NO:27); SPLPLRVP (SEQ ID NO:28); RMHLRSLG (SEQ ID NO:29); LAAPLGLL (SEQ ID NO:30); AVGLLAPP (SEQ ID NO:31); LLAPSHRA (SEQ ID NO:32), PAGLWLDP (SEQ ID NO:33) и/или ISSGLSS (SEQ ID NO:159).
[000117] В некоторых вариантах осуществления CM содержит аминокислотную последовательность ISSGLLSS (SEQ ID NO:14). В некоторых вариантах осуществления CM содержит аминокислотную последовательность QNQALRMA (SEQ ID NO:15). В некоторых вариантах осуществления CM содержит аминокислотную последовательность AQNLLGMV (SEQ ID NO:16). В некоторых вариантах осуществления CM содержит аминокислотную последовательность STFPFGMF (SEQ ID NO:17). В некоторых вариантах осуществления CM содержит аминокислотную последовательность PVGYTSSL (SEQ ID NO:18). В некоторых вариантах осуществления CM содержит аминокислотную последовательность DWLYWPGI (SEQ ID NO:19). В некоторых вариантах осуществления CM содержит аминокислотную последовательность MIAPVAYR (SEQ ID NO:20). В некоторых вариантах осуществления CM содержит аминокислотную последовательность RPSPMWAY (SEQ ID NO:21). В некоторых вариантах осуществления CM содержит аминокислотную последовательность WATPRPMR (SEQ ID NO:22). В некоторых вариантах осуществления CM содержит аминокислотную последовательность FRLLDWQW (SEQ ID NO:23). В некоторых вариантах осуществления CM содержит аминокислотную последовательность LKAAPRWA (SEQ ID NO:24). В некоторых вариантах осуществления CM содержит аминокислотную последовательность GPSHLVLT (SEQ ID NO:25). В некоторых вариантах осуществления CM содержит аминокислотную последовательность LPGGLSPW (SEQ ID NO:26). В некоторых вариантах осуществления CM содержит аминокислотную последовательность MGLFSEAG (SEQ ID NO:27). В некоторых вариантах осуществления CM содержит аминокислотную последовательность SPLPLRVP (SEQ ID NO:28). В некоторых вариантах осуществления CM содержит аминокислотную последовательность RMHLRSLG (SEQ ID NO:29). В некоторых вариантах осуществления CM содержит аминокислотную последовательность LAAPLGLL (SEQ ID NO:30). В некоторых вариантах осуществления CM содержит аминокислотную последовательность AVGLLAPP (SEQ ID NO:31). В некоторых вариантах осуществления CM содержит аминокислотную последовательность LLAPSHRA (SEQ ID NO:32). В некоторых вариантах осуществления CM содержит аминокислотную последовательность PAGLWLDP (SEQ ID NO:33). В некоторых вариантах осуществления CM содержит аминокислотную последовательность ISSGLSS (SEQ ID NO:159).
[000118] В некоторых вариантах осуществления CM является субстратом по меньшей мере для двух протеаз. В некоторых вариантах осуществления по меньшей мере одна протеаза представляет собой MMP, и по меньшей мере одна протеаза выбрана из группы, состоящей из протеаз, представленных в таблице 7.
[000119] В некоторых вариантах осуществления активируемое антитело содержит по меньшей мере первый CM и второй CM. В некоторых вариантах осуществления каждый из первого CM и второго CM представляет собой полипептид длиной не более 15 аминокислот. В некоторых вариантах осуществления первый CM и второй CM в активируемом антителе в нерасщепленном состоянии имеют структурную организацию от N-конца к C-концу, как указано ниже: MM-CM1-CM2-AB, AB-CM2-CM1-MM, MM-CM2-CM1-AB или AB-CM1-CM2-MM. В некоторых вариантах осуществления активируемое антитело содержит связывающий пептид между MM и CM1. В некоторых вариантах осуществления активируемое антитело содержит связывающий пептид между CM1 и CM2. В некоторых вариантах осуществления активируемое антитело содержит связывающий пептид между CM2 и AB. В некоторых вариантах осуществления активируемое антитело содержит связывающий пептид между MM и CM1 и связывающий пептид между CM2 и AB. В некоторых вариантах осуществления активируемое антитело содержит связывающий пептид между MM и CM1 и связывающий пептид между CM1 и CM2. В некоторых вариантах осуществления активируемое антитело содержит связывающий пептид между CM1 и CM2 и связывающий пептид между CM2 и AB. В некоторых вариантах осуществления активируемое антитело содержит связывающий пептид между MM и CM1, связывающий пептид между CM1 и CM2 и связывающий пептид между CM2 и AB.
[000120] В некоторых вариантах осуществления активируемое антитело содержит по меньшей мере первый CM, который содержит субстрат по меньшей мере для одной матриксной металлопротеазы (MMP), и второй CM, который содержит последовательность субстрата. Иллюстративные субстраты для второго CM (CM2) включают, но не ограничиваются ими, субстраты, расщепляемые одним или более из следующих ниже ферментов или протеаз, перечисленных в таблице 7.
[000121] В некоторых вариантах осуществления CM2 выбирают для использования с конкретной протеазой. В некоторых вариантах осуществления CM2 представляет собой субстрат по меньшей мере для одной протеазы, выбранной из группы, состоящей из матриксной металлопротеазы (MMP), нейтрофильной эластазы, активатора плазминогена типа u (uPA, также обозначаемого как урокиназа), легумаина, матриптазы (MT-SP1), тромбина, цистеиновой протеазы, такой как катепсин, ADAM17, BMP-1, HtrA1 и TMPRSS, такой как TMPRSS3 или TMPRSS4.
[000122] В некоторых вариантах осуществления CM2 представляет собой субстрат для нейтрофильной эластазы. В некоторых вариантах осуществления CM2 представляет собой субстрат для uPA. В некоторых вариантах осуществления CM2 представляет собой субстрат для легумаина. В некоторых вариантах осуществления CM2 представляет собой субстрат для матриптазы. В некоторых вариантах осуществления CM2 представляет собой субстрат для тромбина. В некоторых вариантах осуществления CM2 представляет собой субстрат для цистеиновой протеазы. В некоторых вариантах осуществления CM2 представляет собой субстрат для катепсина. В некоторых вариантах осуществления CM2 представляет собой субстрат для ADAM 17. В некоторых вариантах осуществления CM2 представляет собой субстрат для BMP-1. В некоторых вариантах осуществления CM2 представляет собой субстрат для HtrA1. В некоторых вариантах осуществления CM2 представляет собой субстрат для TMPRSS. В некоторых вариантах осуществления CM2 представляет собой субстрат для TMPRSS3. В некоторых вариантах осуществления CM2 представляет собой субстрат для TMPRSS4.
[000123] Например, подходящий CM2 расщепляется по меньшей мере одной протеазой и содержит последовательность TGRGPSWV (SEQ ID NO:34); SARGPSRW (SEQ ID NO:35);TARGPSFK (SEQ ID NO:36); LSGRSDNH (SEQ ID NO:37); GGWHTGRN (SEQ ID NO:38); HTGRSGAL (SEQ ID NO:39); PLTGRSGG (SEQ ID NO:40); AARGPAIH (SEQ ID NO:41); RGPAFNPM (SEQ ID NO:42); SSRGPAYL (SEQ ID NO:43); RGPATPIM (SEQ ID NO:44); RGPA (SEQ ID NO:45); GGQPSGMWGW (SEQ ID NO:46); FPRPLGITGL (SEQ ID NO:47); VHMPLGFLGP (SEQ ID NO:48); SPLTGRSG (SEQ ID NO:49); SAGFSLPA (SEQ ID NO:126); LAPLGLQRR (SEQ ID NO:50); SGGPLGVR (SEQ ID NO:51); PLGL (SEQ ID NO:52); GPRSFGL (SEQ ID NO:315) и/или GPRSFG (SEQ ID NO:316).
[000124] В некоторых вариантах осуществления CM2 содержит аминокислотную последовательность TGRGPSWV (SEQ ID NO:34). В некоторых вариантах осуществления CM2 содержит аминокислотную последовательность SARGPSRW (SEQ ID NO:35). В некоторых вариантах осуществления CM2 содержит аминокислотную последовательность TARGPSFK (SEQ ID NO:36). В некоторых вариантах осуществления CM2 содержит аминокислотную последовательность LSGRSDNH (SEQ ID NO:37). В некоторых вариантах осуществления CM2 содержит аминокислотную последовательность GGWHTGRN (SEQ ID NO:38). В некоторых вариантах осуществления CM2 содержит аминокислотную последовательность HTGRSGAL (SEQ ID NO:39). В некоторых вариантах осуществления CM2 содержит аминокислотную последовательность PLTGRSGG (SEQ ID NO:40). В некоторых вариантах осуществления CM2 содержит аминокислотную последовательность AARGPAIH (SEQ ID NO:41). В некоторых вариантах осуществления CM2 содержит аминокислотную последовательность RGPAFNPM (SEQ ID NO:42). В некоторых вариантах осуществления CM2 содержит аминокислотную последовательность SSRGPAYL (SEQ ID NO:43). В некоторых вариантах осуществления CM2 содержит аминокислотную последовательность RGPATPIM (SEQ ID NO:44). В некоторых вариантах осуществления CM2 содержит аминокислотную последовательность RGPA (SEQ ID NO:45). В некоторых вариантах осуществления CM2 содержит аминокислотную последовательность GGQPSGMWGW (SEQ ID NO:46). В некоторых вариантах осуществления CM2 содержит аминокислотную последовательность FPRPLGITGL (SEQ ID NO:47). В некоторых вариантах осуществления CM2 содержит аминокислотную последовательность VHMPLGFLGP (SEQ ID NO:48). В некоторых вариантах осуществления CM2 содержит аминокислотную последовательность SPLTGRSG (SEQ ID NO:49). В некоторых вариантах осуществления CM2 содержит аминокислотную последовательность LAPLGLQRR (SEQ ID NO:50). В некоторых вариантах осуществления CM2 содержит аминокислотную последовательность SGGPLGVR (SEQ ID NO:51). В некоторых вариантах осуществления CM2 содержит аминокислотную последовательность PLGL (SEQ ID NO:52). В некоторых вариантах осуществления CM2 содержит аминокислотную последовательность GPRSFGL (SEQ ID NO:315). В некоторых вариантах осуществления CM2 содержит аминокислотную последовательность GPRSFG (SEQ ID NO:316).
[000125] В некоторых вариантах осуществления CM2 представляет собой субстрат по меньшей мере для одной MMP. В некоторых вариантах осуществления CM2 представляет собой субстрат по меньшей мере для одной MMP, приведенной в таблице 7. В некоторых вариантах осуществления CM2 представляет собой субстрат для MMP9. В некоторых вариантах осуществления CM2 представляет собой субстрат для MMP14. В некоторых вариантах осуществления CM1 представляет собой субстрат для первой MMP, и CM2 представляет собой субстрат для второй MMP, где первая MMP и вторая MMP представляют собой различные MMP. В некоторых вариантах осуществления CM1 представляет собой последовательность первого субстрата для MMP, и CM2 представляет собой второй субстрат для одной и той же MMP, где CM1 и CM2 имеют разные последовательности субстрата. В некоторых вариантах осуществления CM2 представляет собой субстрат для двух или более MMP. В некоторых вариантах осуществления CM2 представляет собой субстрат по меньшей мере для MMP9 или MMP14. В некоторых вариантах осуществления CM2 представляет собой субстрат для двух или более MMP. В некоторых вариантах осуществления CM2 представляет собой субстрат по меньшей мере для MMP9 и MMP14. В некоторых вариантах осуществления CM1 и CM2 являются субстратами для MMP9. В некоторых вариантах осуществления CM1 и CM2 являются субстратами для MMP14. В некоторых вариантах осуществления CM1 представляет собой субстрат для MMP9, и CM2 представляет собой субстрат для MMP14. В некоторых вариантах осуществления CM1 представляет собой субстрат для MMP14, и CM2 представляет собой субстрат для MMP9.
[000126] В некоторых вариантах осуществления по меньшей мере один из CM1 и/или CM2 представляет собой субстрат для MMP и содержит последовательность ISSGLLSS (SEQ ID NO:14); QNQALRMA (SEQ ID NO:15); AQNLLGMV (SEQ ID NO:16); STFPFGMF (SEQ ID NO:17); PVGYTSSL (SEQ ID NO:18); DWLYWPGI (SEQ ID NO:19); MIAPVAYR (SEQ ID NO:20); RPSPMWAY (SEQ ID NO:21); WATPRPMR (SEQ ID NO:22); FRLLDWQW (SEQ ID NO:23); LKAAPRWA (SEQ ID NO:24); GPSHLVLT (SEQ ID NO:25); LPGGLSPW (SEQ ID NO:26); MGLFSEAG (SEQ ID NO:27); SPFPFRVP (SEQ ID NO:28); RMHFRSFG (SEQ ID NO:29); FAAPFGFF (SEQ ID NO:30); AVGFFAPP (SEQ ID NO:31); FFAPSHRA (SEQ ID NO:32), PAGFWFDP (SEQ ID NO:33) и/или ISSGFSS (SEQ ID NO:159).
[000127] В некоторых вариантах осуществления первое расщепляющее средство и второе расщепляющее средство представляют собой одну и ту же матриксную металлопротеазу, и первый CM и второй CM являются различными субстратами для фермента. В некоторых вариантах осуществления первое расщепляющее средство и второе расщепляющее средство представляют собой различные протеазы, где по меньшей мере одна протеаза представляет собой MMP. В некоторых вариантах осуществления первое расщепляющее средство и второе расщепляющее средство солокализованы в ткани-мишени. В некоторых вариантах осуществления первый CM и второй CM расщепляются по меньшей мере одним расщепляющим средством в ткани-мишени.
[000128] В некоторых вариантах осуществления активируемое антитело подвергается действию и расщепляется MMP, таким образом, что в активированном или расщепленном состоянии активированное антитело содержит аминокислотную последовательность легкой цепи, которая содержит по меньшей мере участок последовательности LP2 и/или CM после того, как MMP расщепляла CM.
[000129] В некоторых вариантах осуществления CM содержит неосновную сторону участка расщепления протеазой; другими словами, CM содержит по меньшей мере аминокислоты P1 и P2, и в некоторых вариантах осуществления содержит аминокислоты P1, P2 и P3 и в некоторых вариантах осуществления содержит аминокислоты P1, P2, P3 и P4. В некоторых вариантах осуществления CM содержит неосновную сторону и основную сторону участка расщепления протеазой. В некоторых вариантах осуществления CM содержит неосновную сторону, но не содержит по меньшей мере часть основную сторону участка расщепления протеазой. В некоторых вариантах осуществления CM содержит неосновную сторону, но не содержит основную сторону участка расщепления протеазой. Такой CM можно связывать непосредственно или через линкер с антителом или другой молекулой, как описано в настоящем описании, такой как, но, не ограничиваясь ими, детектируемый фрагмент.
[000130] В некоторых вариантах осуществления активируемое антитело представляет собой активируемое антитело против EGFR, которое содержит по меньшей мере AB, который представляет собой цетуксимаб или панитумумаб или который получают из цетуксимаба или панитумумаба; MM, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:160, 167-200 и 497, и CM, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:14-33 и 159. В некоторых вариантах осуществления активируемое антитело представляет собой активируемое антитело против EGFR, которое содержит по меньшей мере AB, который представляет собой цетуксимаб или панитумумаб или который получают из цетуксимаба или панитумумаба; MM, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:160, 167-200 и 497, и CM, содержащий аминокислотную последовательность, выбранную из группы, состоящей из последовательностей, представленных в таблицах 8A-8M. В некоторых вариантах осуществления активируемое антитело против EGFR также содержит первый связывающий пептид (LP1) и второй связывающий пептид (LP2), и активируемое антитело в нерасщепленном состоянии имеет структурную организацию от N-конца к C-концу, как указано ниже: MM-LP1-CM-LP2-AB или AB-LP2-CM-LP1-MM. В некоторых вариантах осуществления каждый из LP1 и LP2 представляет собой пептид длиной приблизительно от 1 до 20 аминокислот. В некоторых вариантах осуществления два связывающих пептида необязательно являются идентичными друг другу. В некоторых вариантах осуществления по меньшей мере один из LP1 или LP2 содержит аминокислотную последовательность, выбранную из группы, состоящей из (GS)n, (GGS)n, (GSGGS)n (SEQ ID NO:1) и (GGGS)n (SEQ ID NO:2), где n представляет собой целое число по меньшей мере один. В некоторых вариантах осуществления по меньшей мере один из LP1 или LP2 содержит аминокислотную последовательность, выбранную из группы, состоящей из GGSG (SEQ ID NO:3), GGSGG (SEQ ID NO:4), GSGSG (SEQ ID NO:5), GSGGG (SEQ ID NO:6), GGGSG (SEQ ID NO:7) и GSSSG (SEQ ID NO:8). В некоторых вариантах осуществления LP1 содержит аминокислотную последовательность GSSGGSGGSGGSG (SEQ ID NO:9), GSSGGSGGSGG (SEQ ID NO:10), GSSGGSGGSGGS (SEQ ID NO:11), GSSGGSGGSGGSGGGS (SEQ ID NO:155), GSSGGSGGSG (SEQ ID NO:156) или GSSGGSGGSGS (SEQ ID NO:157). В некоторых вариантах осуществления LP2 содержит аминокислотную последовательность GSS, GGS, GGGS (SEQ ID NO:158), GSSGT (SEQ ID NO:12) или GSSG (SEQ ID NO:13).
[000131] В некоторых вариантах осуществления активируемое антитело представляет собой активируемое антитело против EGFR, которое содержит по меньшей мере AB, содержащий аминокислотную последовательность тяжелой цепи, содержащую последовательность CDR1 VH SEQ ID NO:504, последовательность CDR2 VH SEQ ID NO:505, последовательность CDR3 VH SEQ ID NO:506, последовательность CDR1 VL SEQ ID NO:507, последовательность CDR2 VL SEQ ID NO:508 и последовательность CDR2 VL SEQ ID NO:509; MM, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:160, 167-200 и 497; и CM, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:14-33 и 159. В некоторых вариантах осуществления активируемое антитело представляет собой активируемое антитело против EGFR, которое содержит по меньшей мере AB, содержащий аминокислотную последовательность тяжелой цепи, содержащую последовательность CDR1 VH SEQ ID NO:504, последовательность CDR2 VH SEQ ID NO:505, последовательность CDR3 VH SEQ ID NO:506, последовательность CDR1 VL SEQ ID NO:507, последовательность CDR2 VL SEQ ID NO:508 и последовательность CDR2 VL SEQ ID NO:509; MM, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:160, 167-200 и 497, и CM, содержащий аминокислотную последовательность, выбранную из группы, состоящей из последовательностей, представленных в таблицах 8A-8M. В некоторых вариантах осуществления активируемое антитело против EGFR также содержит первый связывающий пептид (LP1) и второй связывающий пептид (LP2), и активируемое антитело в нерасщепленном состоянии имеет структурную организацию от N-конца к C-концу, как указано ниже: MM-LP1-CM-LP2-AB или AB-LP2-CM-LP1-MM. В некоторых вариантах осуществления каждый из LP1 и LP2 представляет собой пептид длиной приблизительно от 1 до 20 аминокислот. В некоторых вариантах осуществления два связывающих пептида необязательно являются идентичными друг другу. В некоторых вариантах осуществления по меньшей мере один из LP1 или LP2 содержит аминокислотную последовательность, выбранную из группы, состоящей из (GS)n, (GGS)n, (GSGGS)n (SEQ ID NO:1) и (GGGS)n (SEQ ID NO:2), где n представляет собой целое число по меньшей мере один. В некоторых вариантах осуществления по меньшей мере один из LP1 или LP2 содержит аминокислотную последовательность, выбранную из группы, состоящей из GGSG (SEQ ID NO:3), GGSGG (SEQ ID NO:4), GSGSG (SEQ ID NO:5), GSGGG (SEQ ID NO:6), GGGSG (SEQ ID NO:7), и GSSSG (SEQ ID NO:8). В некоторых вариантах осуществления LP1 содержит аминокислотную последовательность GSSGGSGGSGGSG (SEQ ID NO:9), GSSGGSGGSGG (SEQ ID NO:10), GSSGGSGGSGGS (SEQ ID NO:11), GSSGGSGGSGGSGGGS (SEQ ID NO:155), GSSGGSGGSG (SEQ ID NO:156) или GSSGGSGGSGS (SEQ ID NO:157). В некоторых вариантах осуществления LP2 содержит аминокислотную последовательность GSS, GGS, GGGS (SEQ ID NO:158), GSSGT (SEQ ID NO:12) или GSSG (SEQ ID NO:13).
[000132] В некоторых вариантах осуществления активируемое антитело представляет собой активируемое антитело против EGFR, которое содержит по меньшей мере AB, содержащий аминокислотная последовательность тяжелой цепи SEQ ID NO:56, 57 или 58, и аминокислотную последовательность легкой цепи SEQ ID NO:59; MM, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:160, 167-200 и 497, и CM, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:14-33 и 159. В некоторых вариантах осуществления активируемое антитело представляет собой активируемое антитело против EGFR, которое содержит по меньшей мере AB, содержащий аминокислотную последовательность тяжелой цепи SEQ ID NO:56, 57 или 58 и аминокислотную последовательность легкой цепи SEQ ID NO:59; MM, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:160, 167-200 и 497, и CM, содержащий аминокислотную последовательность, выбранную из группы, состоящей из последовательностей, представленных в таблицах 8A-8M. В некоторых вариантах осуществления активируемое антитело против EGFR также содержит первый связывающий пептид (LP1) и второй связывающий пептид (LP2), и активируемое антитело в нерасщепленном состоянии имеет структурную организацию от N-конца к C-концу, как указано ниже: MM-LP1-CM-LP2-AB или AB-LP2-CM-LP1-MM. В некоторых вариантах осуществления каждый из LP1 и LP2 представляет собой пептид длиной приблизительно от 1 до 20 аминокислот. В некоторых вариантах осуществления два связывающих пептида необязательно являются идентичными друг другу. В некоторых вариантах осуществления по меньшей мере один из LP1 или LP2 содержит аминокислотную последовательность, выбранную из группы, состоящей из (GS)n, (GGS)n, (GSGGS)n (SEQ ID NO:1) и (GGGS)n (SEQ ID NO:2), где n представляет собой целое число по меньшей мере один. В некоторых вариантах осуществления по меньшей мере один из LP1 или LP2 содержит аминокислотную последовательность, выбранную из группы, состоящей из GGSG (SEQ ID NO:3), GGSGG (SEQ ID NO:4), GSGSG (SEQ ID NO:5), GSGGG (SEQ ID NO:6), GGGSG (SEQ ID NO:7), и GSSSG (SEQ ID NO:8). В некоторых вариантах осуществления LP1 содержит аминокислотную последовательность GSSGGSGGSGGSG (SEQ ID NO:9), GSSGGSGGSGG (SEQ ID NO:10), GSSGGSGGSGGS (SEQ ID NO:11), GSSGGSGGSGGSGGGS (SEQ ID NO:155), GSSGGSGGSG (SEQ ID NO:156) или GSSGGSGGSGS (SEQ ID NO:157). В некоторых вариантах осуществления LP2 содержит аминокислотную последовательность GSS, GGS, GGGS (SEQ ID NO:158), GSSGT (SEQ ID NO:12) или GSSG (SEQ ID NO:13).
[000133] В некоторых вариантах осуществления активируемое антитело представляет собой активируемое антитело против EGFR, которое содержит по меньшей мере AB, содержащий аминокислотную последовательность тяжелой цепи SEQ ID NO:56 и аминокислотную последовательность легкой цепи SEQ ID NO:59; MM, содержащий аминокислотную последовательность SEQ ID NO:160, и CM, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:14-33 и 159. В некоторых вариантах осуществления активируемое антитело представляет собой активируемое антитело против EGFR, которое содержит по меньшей мере AB, содержащий аминокислотную последовательность тяжелой цепи SEQ ID NO:56 и аминокислотную последовательность легкой цепи SEQ ID NO:59; MM, содержащий аминокислотную последовательность SEQ ID NO:160, и CM, содержащий аминокислотную последовательность, выбранную из группы, состоящей из последовательностей, представленных в таблицах 8A-8M. В некоторых вариантах осуществления активируемое антитело против EGFR также содержит первый связывающий пептид (LP1) и второй связывающий пептид (LP2), и активируемое антитело в нерасщепленном состоянии имеет структурную организацию от N-конца к C-концу, как указано ниже: MM-LP1-CM-LP2-AB или AB-LP2-CM-LP1-MM. В некоторых вариантах осуществления каждый из LP1 и LP2 представляет собой пептид длиной приблизительно от 1 до 20 аминокислот. В некоторых вариантах осуществления два связывающих пептида необязательно являются идентичными друг другу. В некоторых вариантах осуществления по меньшей мере один из LP1 или LP2 содержит аминокислотную последовательность, выбранную из группы, состоящей из (GS)n, (GGS)n, (GSGGS)n (SEQ ID NO:1) и (GGGS)n (SEQ ID NO:2), где n представляет собой целое число по меньшей мере один. В некоторых вариантах осуществления по меньшей мере один из LP1 или LP2 содержит аминокислотную последовательность, выбранную из группы, состоящей из GGSG (SEQ ID NO:3), GGSGG (SEQ ID NO:4), GSGSG (SEQ ID NO:5), GSGGG (SEQ ID NO:6), GGGSG (SEQ ID NO:7) и GSSSG (SEQ ID NO:8). В некоторых вариантах осуществления LP1 содержит аминокислотную последовательность GSSGGSGGSGGSG (SEQ ID NO:9), GSSGGSGGSGG (SEQ ID NO:10), GSSGGSGGSGGS (SEQ ID NO:11), GSSGGSGGSGGSGGGS (SEQ ID NO:155), GSSGGSGGSG (SEQ ID NO:156) или GSSGGSGGSGS (SEQ ID NO:157). В некоторых вариантах осуществления LP2 содержит аминокислотную последовательность GSS, GGS, GGGS (SEQ ID NO:158), GSSGT (SEQ ID NO:12) или GSSG (SEQ ID NO:13).
[000134] В некоторых вариантах осуществления активируемое антитело представляет собой активируемое антитело против EGFR, которое содержит по меньшей мере AB, содержащий аминокислотную последовательность тяжелой цепи, содержащую последовательность CDR1 VH SEQ ID NO:504, последовательность CDR2 VH SEQ ID NO:505, последовательность CDR3 VH SEQ ID NO:506, последовательность CDR1 VL SEQ ID NO:507, последовательность CDR2 VL SEQ ID NO:508 и последовательность CDR2 VL SEQ ID NO:509; MM, содержащий аминокислотную последовательность SEQ ID NO:160, и CM, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:14-33 и 159. В некоторых вариантах осуществления активируемое антитело представляет собой активируемое антитело против EGFR, которое содержит по меньшей мере AB, содержащий аминокислотную последовательность тяжелой цепи, содержащую последовательность CDR1 VH SEQ ID NO:504, последовательность CDR2 VH SEQ ID NO:505, последовательность CDR3 VH SEQ ID NO:506, последовательность CDR1 VL SEQ ID NO:507, последовательность CDR2 VL SEQ ID NO:508 и последовательность CDR2 VL SEQ ID NO:509; MM, содержащий аминокислотную последовательность SEQ ID NO:160, и CM, содержащий аминокислотную последовательность, выбранную из группы, состоящей из последовательностей, представленных в таблицах 8A-8M. В некоторых вариантах осуществления активируемое антитело против EGFR также содержит первый связывающий пептид (LP1) и второй связывающий пептид (LP2), и активируемое антитело в нерасщепленном состоянии имеет структурную организацию от N-конца к C-концу, как указано ниже: MM-LP1-CM-LP2-AB или AB-LP2-CM-LP1-MM. В некоторых вариантах осуществления каждый из LP1 и LP2 представляет собой пептид длиной приблизительно от 1 до 20 аминокислот. В некоторых вариантах осуществления два связывающих пептида необязательно являются идентичными друг другу. В некоторых вариантах осуществления по меньшей мере один из LP1 или LP2 содержит аминокислотную последовательность, выбранную из группы, состоящей из (GS)n, (GGS)n, (GSGGS)n (SEQ ID NO:1) и (GGGS)n (SEQ ID NO:2), где n представляет собой целое число по меньшей мере один. В некоторых вариантах осуществления по меньшей мере один из LP1 или LP2 содержит аминокислотную последовательность, выбранную из группы, состоящей из GGSG (SEQ ID NO:3), GGSGG (SEQ ID NO:4), GSGSG (SEQ ID NO:5), GSGGG (SEQ ID NO:6), GGGSG (SEQ ID NO:7) и GSSSG (SEQ ID NO:8). В некоторых вариантах осуществления LP1 содержит аминокислотную последовательность GSSGGSGGSGGSG (SEQ ID NO:9), GSSGGSGGSGG (SEQ ID NO:10), GSSGGSGGSGGS (SEQ ID NO:11), GSSGGSGGSGGSGGGS (SEQ ID NO:155), GSSGGSGGSG (SEQ ID NO:156) или GSSGGSGGSGS (SEQ ID NO:157). В некоторых вариантах осуществления LP2 содержит аминокислотную последовательность GSS, GGS, GGGS (SEQ ID NO:158), GSSGT (SEQ ID NO:12) или GSSG (SEQ ID NO:13).
[000135] В некоторых вариантах осуществления активируемое антитело представляет собой активируемое антитело против Jagged, которое содержит по меньшей мере AB, содержащий аминокислотную последовательность тяжелой цепи SEQ ID NO:61, 63, 65, 68, 70, 72, 76, 78, 80, 82, 84, 86, 88, 90, 92, 94, 96, 98, 100, 102, 104, 106, 108, 110, 112 или 114 и аминокислотную последовательность легкой цепи SEQ ID NO:60, 62, 64, 67, 69, 71, 73, 75, 77, 79, 81, 83, 85, 87, 89, 91, 93, 95, 97, 99, 101, 103, 105, 107, 109, 111 или 113; MM, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:201-263 и 496, и CM, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:14-33 и 159. В некоторых вариантах осуществления активируемое антитело представляет собой активируемое антитело против Jagged, которое содержит по меньшей мере AB, содержащий аминокислотную последовательность тяжелой цепи SEQ ID NO:61, 63, 65, 68, 70, 72, 76, 78, 80, 82, 84, 86, 88, 90, 92, 94, 96, 98, 100, 102, 104, 106, 108, 110, 112 или 114 и аминокислотную последовательность легкой цепи SEQ ID NO:60, 62, 64, 67, 69, 71, 73, 75, 77, 79, 81, 83, 85, 87, 89, 91, 93, 95, 97, 99, 101, 103, 105, 107, 109, 111 или 113; MM, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:201-263 и 496, и CM, содержащий аминокислотную последовательность, выбранную из группы, состоящей из последовательностей, представленных в таблицах 8A-8M. В некоторых вариантах осуществления активируемое антитело против Jagged также содержит первый связывающий пептид (LP1) и второй связывающий пептид (LP2), и активируемое антитело в нерасщепленном состоянии имеет структурную организацию от N-конца к C-концу, как указано ниже: MM-LP1-CM-LP2-AB или AB-LP2-CM-LP1-MM. В некоторых вариантах осуществления каждый из LP1 и LP2 представляет собой пептид длиной приблизительно от 1 до 20 аминокислот. В некоторых вариантах осуществления два связывающих пептида необязательно являются идентичными друг другу. В некоторых вариантах осуществления по меньшей мере один из LP1 или LP2 содержит аминокислотную последовательность, выбранную из группы, состоящей из (GS)n, (GGS)n, (GSGGS)n (SEQ ID NO:1) и (GGGS)n (SEQ ID NO:2), где n представляет собой целое число по меньшей мере один. В некоторых вариантах осуществления по меньшей мере один из LP1 или LP2 содержит аминокислотную последовательность, выбранную из группы, состоящей из GGSG (SEQ ID NO:3), GGSGG (SEQ ID NO:4), GSGSG (SEQID NO:5), GSGGG (SEQ ID NO:6), GGGSG (SEQ ID NO:7) и GSSSG (SEQ ID NO:8). В некоторых вариантах осуществления LP1 содержит аминокислотную последовательность GSSGGSGGSGGSG (SEQ ID NO:9), GSSGGSGGSGG (SEQ ID NO:10), GSSGGSGGSGGS (SEQ ID NO:11), GSSGGSGGSGGSGGGS (SEQ ID NO:155), GSSGGSGGSG (SEQ ID NO:156) или GSSGGSGGSGS (SEQ ID NO:157). В некоторых вариантах осуществления LP2 содержит аминокислотную последовательность GSS, GGS, GGGS (SEQ ID NO:158), GSSGT (SEQ ID NO:12) или GSSG (SEQ ID NO:13).
[000136] В некоторых вариантах осуществления активируемое антитело представляет собой активируемое антитело против Jagged, которое содержит по меньшей мере AB, содержащий аминокислотную последовательность тяжелой цепи SEQ ID NO:112 и аминокислотную последовательность легкой цепи SEQ ID NO:111; MM, содержащий аминокислотную последовательность, выбранную из SEQ ID NO:217, и CM, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:14-33 и 159. В некоторых вариантах осуществления активируемое антитело представляет собой активируемое антитело против Jagged, которое содержит по меньшей мере AB, содержащий аминокислотную последовательность тяжелой цепи SEQ ID NO:112 и аминокислотную последовательность легкой цепи SEQ ID NO:111; MM, содержащий аминокислотную последовательность, выбранную из SEQ ID NO:217, и CM, содержащий аминокислотную последовательность, выбранную из группы, состоящей из последовательностей, представленных в таблицах 8A-8M.В некоторых вариантах осуществления активируемое антитело против Jagged также содержит первый связывающий пептид (LP1) и второй связывающий пептид (LP2), и активируемое антитело в нерасщепленном состоянии имеет структурную организацию от N-конца к C-концу, как указано ниже: MM-LP1-CM-LP2-AB или AB-LP2-CM-LP1-MM. В некоторых вариантах осуществления каждый из LP1 и LP2 представляет собой пептид длиной приблизительно от 1 до 20 аминокислот. В некоторых вариантах осуществления два связывающих пептида необязательно являются идентичными друг другу. В некоторых вариантах осуществления по меньшей мере один из LP1 или LP2 содержит аминокислотную последовательность, выбранную из группы, состоящей из (GS)n, (GGS)n, (GSGGS)n (SEQ ID NO:1) и (GGGS)n (SEQ ID NO:2), где n представляет собой целое число по меньшей мере один. В некоторых вариантах осуществления по меньшей мере один из LP1 или LP2 содержит аминокислотную последовательность, выбранную из группы, состоящей из GGSG (SEQ ID NO:3), GGSGG (SEQ ID NO:4), GSGSG (SEQ ID NO:5), GSGGG (SEQ ID NO:6), GGGSG (SEQ ID NO:7) и GSSSG (SEQ ID NO:8). В некоторых вариантах осуществления LP1 содержит аминокислотную последовательность GSSGGSGGSGGSG (SEQ ID NO:9), GSSGGSGGSGG (SEQ ID NO:10), GSSGGSGGSGGS (SEQ ID NO:11), GSSGGSGGSGGSGGGS (SEQ ID NO:155), GSSGGSGGSG (SEQ ID NO:156) или GSSGGSGGSGS (SEQ ID NO:157). В некоторых вариантах осуществления, LP2 содержит аминокислотную последовательность GSS, GGS, GGGS (SEQ ID NO:158), GSSGT (SEQ ID NO:12) или GSSG (SEQ ID NO:13).
[000137] В некоторых вариантах осуществления активируемое антитело представляет собой активируемое антитело против Jagged, которое содержит по меньшей мере AB, содержащий аминокислотную последовательность тяжелой цепи, содержащую последовательность CDR1 VH SEQ ID NO:498, последовательность CDR2 VH SEQ ID NO:499, последовательность CDR3 VH SEQ ID NO:500, последовательность CDR1 VL SEQ ID NO:501, последовательность CDR2 VL SEQ ID NO:502 и последовательность CDR2 VL SEQ ID NO:503; MM, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:217, и CM, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:14-33 и 159. В некоторых вариантах осуществления активируемое антитело представляет собой активируемое антитело против Jagged, которое содержит по меньшей мере AB, содержащий аминокислотную последовательность тяжелой цепи, содержащую последовательность CDR1 VH SEQ ID NO:498, последовательность CDR2 VH SEQ ID NO:499, последовательность CDR3 VH SEQ ID NO:500, последовательность CDR1 VL SEQ ID NO:501, последовательность CDR2 VL SEQ ID NO:502 и последовательность CDR2 VL SEQ ID NO:503; MM, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:217, и CM, содержащий аминокислотную последовательность, выбранную из группы, состоящей из последовательностей, представленных в таблицах 8A-8M. В некоторых вариантах осуществления активируемое антитело против Jagged также содержит первый связывающий пептид (LP1) и второй связывающий пептид (LP2), и активируемое антитело в нерасщепленном состоянии имеет структурную организацию от N-конца к C-концу, как указано ниже: MM-LP1-CM-LP2-AB или AB-LP2-CM-LP1-MM. В некоторых вариантах осуществления каждый из LP1 и LP2 представляет собой пептид длиной приблизительно от 1 до 20 аминокислот. В некоторых вариантах осуществления два связывающих пептида необязательно являются идентичными друг другу. В некоторых вариантах осуществления по меньшей мере один из LP1 или LP2 содержит аминокислотную последовательность, выбранную из группы, состоящей из (GS)n, (GGS)n, (GSGGS)n (SEQ ID NO:1) и (GGGS)n (SEQ ID NO:2), где n представляет собой целое число по меньшей мере один. В некоторых вариантах осуществления по меньшей мере один из LP1 или LP2 содержит аминокислотную последовательность, выбранную из группы, состоящей из GGSG (SEQ ID NO:3), GGSGG (SEQ ID NO:4), GSGSG (SEQ ID NO:5), GSGGG (SEQ ID NO:6), GGGSG (SEQ ID NO:7) и GSSSG (SEQ ID NO:8). В некоторых вариантах осуществления LP1 содержит аминокислотную последовательность GSSGGSGGSGGSG (SEQ ID NO:9), GSSGGSGGSGG (SEQ ID NO:10), GSSGGSGGSGGS (SEQ ID NO:11), GSSGGSGGSGGSGGGS (SEQ ID NO:155), GSSGGSGGSG (SEQ ID NO:156) или GSSGGSGGSGS (SEQ ID NO:157). В некоторых вариантах осуществления LP2 содержит аминокислотную последовательность GSS, GGS, GGGS (SEQ ID NO:158), GSSGT (SEQ ID NO:12) или GSSG (SEQ ID NO:13).
[000138] В некоторых вариантах осуществления активируемое антитело также содержит средство, конъюгированное с AB. В некоторых вариантах осуществления средство представляет собой терапевтическое средство. В некоторых вариантах осуществления средство представляет собой антинеопластическое средство. В некоторых вариантах осуществления средство представляет собой токсин или его фрагмент. В некоторых вариантах осуществления средство конъюгировано с AB через линкер. В некоторых вариантах осуществления линкер представляет собой расщепляемый линкер. В некоторых вариантах осуществления средство представляет собой ингибитор микротрубочек. В некоторых вариантах осуществления средство представляет собой повреждающее нуклеиновую кислоту средство, такое как алкилирующее ДНК средство или интеркалятор ДНК, или другое повреждающее ДНК средство. В некоторых вариантах осуществления линкер представляет собой расщепляемый линкер. В некоторых вариантах осуществления средство конъюгировано с AB через линкер, который содержит по меньшей мере одну последовательность расщепляемого MMP субстрата. В некоторых вариантах осуществления средство представляет собой средство, выбранное из группы, приведенной в таблице 3. В некоторых вариантах осуществления средство представляет собой доластатин. В некоторых вариантах осуществления средство представляет собой ауристатин или его производное. В некоторых вариантах осуществления средство представляет собой ауристатин E или его производное. В некоторых вариантах осуществления средство представляет собой монометилауристатин E (MMAE). В некоторых вариантах осуществления средство представляет собой монометилауристатин D (MMAD). В некоторых вариантах осуществления средство представляет собой майтанзиноид или производное майтанзиноида. В некоторых вариантах осуществления средство представляет собой DM1 или DM4. В некоторых вариантах осуществления средство представляет собой дуокармицин или его производное. В некоторых вариантах осуществления средство представляет собой калихимицин или его производное. В некоторых вариантах осуществления средство представляет собой пирролобензодиазепин.
[000139] В некоторых вариантах осуществления средство представляет собой противовоспалительное средство.
[000140] В некоторых вариантах осуществления активируемое антитело также содержит детектируемый фрагмент. В некоторых вариантах осуществления детектируемый фрагмент представляет собой диагностическое средство.
[000141] В некоторых вариантах осуществления конъюгированное антитело содержит детектируемую метку. В некоторых вариантах осуществления детектируемая метка включает визуализирующее средство, контрастирующее средство, фермент, флуоресцентную метку, хромофор, краситель, один или более ионов металлов или метку на основе лиганда. В некоторых вариантах осуществления визуализирующее средство содержит радиоактивный изотоп. В некоторых вариантах осуществления радиоактивный изотоп представляет собой индий или технеций. В некоторых вариантах осуществления контрастирующее средство содержит йод, гадолиний или оксид железа. В некоторых вариантах осуществления фермент содержит пероксидазу хрена, щелочную фосфатазу или β-галактозидазу. В некоторых вариантах осуществления флуоресцентная метка включает желтый флуоресцентный белок (YFP), синий флуоресцентный белок (CFP), зеленый флуоресцентный белок (GFP), модифицированный красный флуоресцентный белок (mRFP), красный флуоресцентный белок tdimer2 (RFP tdimer2), HCRED или производное европия. В некоторых вариантах осуществления люминесцентная метка содержит производное N-метилакридина. В некоторых вариантах осуществления метка включает метку Alexa Fluor®, такую как Alex Fluor® 680 или Alexa Fluor® 750. В некоторых вариантах осуществления метка на основе лиганда включает биотин, авидин, стрептавидин или один или более гаптенов.
[000142] В некоторых вариантах осуществления активируемое антитело также содержит сигнальный пептид. В некоторых вариантах осуществления сигнальный пептид конъюгирован с активируемым антитело через спейсер. В некоторых вариантах осуществления спейсер конъюгирован с активируемым антителом при отсутствии сигнального пептида. В некоторых вариантах осуществления спейсер присоединен непосредственно к MM активируемого антитела. В некоторых вариантах осуществления спейсер присоединен непосредственно к MM активируемого антитела в структурной организации от N-конца к C-концу спейсер-MM-CM-AB. Пример спейсера, присоединенного непосредственно к N-концу MM активируемого антитела представляет собой QGQSGQ (SEQ ID NO:53). В некоторых вариантах осуществления спейсер содержит по меньшей мере аминокислотную последовательность QGQSGQ (SEQ ID NO:53).
[000143] В некоторых вариантах осуществления AB активируемого антитела естественным образом содержит одну или более дисульфидных связей. В некоторых вариантах осуществления AB можно конструировать так, чтобы он содержал одну или более дисульфидных связей.
[000144] В некоторых вариантах осуществления время полувыведения из сыворотки активируемого антитела является больше, чем время полувыведения соответствующего антитела; например, pK активируемого антитела является больше, чем pK соответствующего антитела. В некоторых вариантах осуществления время полувыведения из сыворотки активируемого антитела является аналогичным времени полувыведения соответствующего антитела. В некоторых вариантах осуществления время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 15 суток при введении в организм. В некоторых вариантах осуществления время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 12 суток при введении в организм. В некоторых вариантах осуществления время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 11 суток при введении в организм. В некоторых вариантах осуществления время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 10 суток при введении в организм. В некоторых вариантах осуществления время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 9 суток при введении в организм. В некоторых вариантах осуществления время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 8 суток при введении в организм. В некоторых вариантах осуществления время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 7 суток при введении в организм. В некоторых вариантах осуществления время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 6 суток при введении в организм. В некоторых вариантах осуществления время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 5 суток при введении в организм. В некоторых вариантах осуществления время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 4 суток при введении в организм. В некоторых вариантах осуществления время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 3 суток при введении в организм. В некоторых вариантах осуществления время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 2 суток при введении в организм. В некоторых вариантах осуществления время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 24 часа при введении в организм. В некоторых вариантах осуществления время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 20 часов при введении в организм. В некоторых вариантах осуществления время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 18 часов при введении в организм. В некоторых вариантах осуществления время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 16 часов при введении в организм. В некоторых вариантах осуществления время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 14 часов при введении в организм. В некоторых вариантах осуществления время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 12 часов при введении в организм. В некоторых вариантах осуществления время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 10 часов при введении в организм. В некоторых вариантах осуществления время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 8 часов при введении в организм. В некоторых вариантах осуществления время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 6 часов при введении в организм. В некоторых вариантах осуществления время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 4 часа при введении в организм. В некоторых вариантах осуществления время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 3 часа при введении в организм.
[000145] В некоторых вариантах осуществления активируемое антитело и/или конъюгированное активируемое антитело является моноспецифическим. В некоторых вариантах осуществления активируемое антитело и/или конъюгированное активируемое антитело является полиспецифическим, например, в качестве неограничивающего примера, биспецифическим или трифункциональным. В некоторых вариантах осуществления активируемое антитело и/или конъюгированное активируемое антитело формулируют в виде части пробиспецифической молекулы-активатора T-клеток (pro-BITE). В некоторых вариантах осуществления активируемое антитело и/или конъюгированное активируемое антитело формулируют в виде части модифицированной прохимерным антигенным рецептором (pro-CAR) T-клетки или другого конструируемого рецептора.
[000146] Изобретение также относится к композициям и способам, которые содержат активируемое антитело, которое включает антитело или фрагмент антитела (AB), который специфически связывается с данной мишенью, где AB является связанным с маскирующим фрагментом (MM), который снижает способность AB связываться со своей мишенью. В некоторых вариантах осуществления активируемое антитело дополнительно содержит расщепляемый фрагмент (CM), который представляет собой субстрат по меньшей мере для одной MMP. Композиции и способы, предоставленные в настоящем описании, обеспечивают присоединение одного или более средств к одному или более остаткам цистеина в AB без нарушения активности (например, маскирующей активности, актирующего действия или активности связывания) активируемого антитела. В некоторых вариантах осуществления композиции и способы, предоставленные в настоящем описании, обеспечивают присоединение одного или более средств к одному или более остаткам цистеина в AB без восстановления или иным образом разрушения одной или более дисульфидных связей в MM. Композиции и способы, предоставленные в настоящем описании, обеспечивают активируемое антитело, которое конъюгируют с одним или более средствами, например, любым из ряда терапевтических, диагностических и/или профилактических средств, например, в некоторых вариантах осуществления без конъюгации какого-либо средства(в) с MM активируемого антитела. Композиции и способы, предоставленные в настоящем описании, обеспечивают конъюгированные активируемые антитела, в которых MM сохраняет способность по существу и эффективно маскировать AB активируемого антитела в нерасщепленном состоянии. Композиции и способы, предоставленные в настоящем описании, обеспечивают конъюгированные активируемые антитела, в которых активируемое антитело все еще является активированным, т.е. расщепленный, в присутствии MMP, которая может отщеплять CM.
[000147] Активируемые антитела содержат по меньшей мере одну точку конъюгации для средства, но в способах и композициях, предоставленных в настоящем описании, не все возможные точки конъюгации являются доступными для конъюгации со средством. В некоторых вариантах осуществления одна или более точек конъюгации представляют собой атомы серы, участвующие в дисульфидных связях. В некоторых вариантах осуществления одна или более точек конъюгации представляют собой атомы серы, участвующие в межцепьевых дисульфидных связях. В некоторых вариантах осуществления одна или более точек конъюгации представляют собой атомы серы, участвующие в межцепьевых сульфидных связях, но не атомы серы, участвующие во внутрицепьевых дисульфидных связях. В некоторых вариантах осуществления одна или более точек конъюгации представляют собой атомы серы цистеина или других аминокислотных остатков, содержащих атом серы. Такие остатки могут существовать естественным образом в структуре антитела, или их можно вводить в антитело сайт-специфическим мутагенезом, химическим преобразованием или путем ошибки включения неприродных аминокислот.
[000148] Также раскрыты способы получения конъюгата активируемого антитела, содержащего одну или более межцепьевых дисульфидных связей в AB и одну или более внутрицепьевых дисульфидных связей в MM, и раскрыто лекарственное средство, способное реагировать со свободными тиолами. Способ, как правило, включает частичное восстановление межцепьевых дисульфидных связей в активируемом антителе восстановителем, таким как, например, TCEP, и конъюгацию лекарственного средства, способного реагировать со свободными тиолами, с частично восстановленным активируемым антителом. Как используют в настоящем описании, термин частичное восстановление относится к случаям, когда активируемое антитело приводят в контакт с восстановителем, и восстанавливают не все дисульфидные связи, например, не все не все возможные участки конъюгации. В некоторых вариантах осуществления восстанавливают менее 99%, 98%, 97%, 96%, 95%, 90%, 85%, 80%, 75%, 70%, 65%, 60%, 55%, 50%, 45%, 40%, 35%, 30%, 25%, 20%, 15%, 10% или менее 5% всех возможных участков конъюгации.
[000149] Некоторые варианты осуществления относятся к способу восстановления и конъюгации средства, например, лекарственного средства, с активируемым антителом, приводящей к избирательности в отношении расположения средства. Способ, как правило, включает частичное восстановление активируемого антитела восстановителем, таким образом, что не восстанавливается ни один из участков конъюгации в маскирующем фрагменте или другом не относящемся к AB участке активируемого антитела, и конъюгацию средства с межцепьевыми тиолами в AB. Участок(и) конъюгации выбраны таким образом, чтобы обеспечивать желаемое расположение средства для обеспечения возникновения конъюгации на желаемом участке. Восстановитель представляет собой, например, TCEP. Условия реакции восстановления, такие как, например, отношение восстановителя к активируемому антителу, продолжительность инкубации, температура во время инкубации, pH восстанавливающего реакционного раствора и т.д., определяют путем установления условий, при которых продуцируется конъюгированное активируемое антитело, в котором MM сохраняет способность по существу и эффективно маскировать AB активируемого антитела в нерасщепленном состоянии. Отношение восстановителя к активируемому антителу изменяется в зависимости от активируемого антитела. В некоторых вариантах осуществления отношение восстановителя к активируемому антителу находится в диапазоне приблизительно от 20:1 до 1:1, приблизительно от 10:1 до 1:1, приблизительно от 9:1 до 1:1, приблизительно от 8:1 до 1:1, приблизительно от 7:1 до 1:1, приблизительно от 6:1 до 1:1, приблизительно от 5:1 до 1:1, приблизительно от 4:1 до 1:1, приблизительно от 3:1 до 1:1, приблизительно от 2:1 до 1:1, приблизительно от 20:1 до 1:1,5, приблизительно от 10:1 до 1:1,5, приблизительно от 9:1 до 1:1,5, приблизительно от 8:1 до 1:1,5, приблизительно от 7:1 до 1:1,5, приблизительно от 6:1 до 1:1,5, приблизительно от 5:1 до 1:1,5, приблизительно от 4:1 до 1:1,5, приблизительно от 3:1 до 1:1,5, приблизительно от 2:1 до 1:1,5, приблизительно от 1,5:1 до 1:1,5 или приблизительно от 1:1 до 1:1,5. В некоторых вариантах осуществления отношение находится в диапазоне приблизительно от 5:1 до 1:1. В некоторых вариантах осуществления отношение находится в диапазоне приблизительно от 5:1 до 1,5:1. В некоторых вариантах осуществления отношение находится в диапазоне приблизительно от 4:1 до 1:1. В некоторых вариантах осуществления отношение находится в диапазоне приблизительно от 4:1 до 1,5:1. В некоторых вариантах осуществления отношение находится в диапазоне приблизительно от 8:1 приблизительно до 1:1. В некоторых вариантах осуществления отношение находится в диапазоне приблизительно от 2,5:1 до 1:1.
[000150] Некоторые варианты осуществления относятся к способу восстановления межцепьевых дисульфидных связей в AB активируемого антитела и конъюгации средства, например, содержащего тиол средства, такого как лекарственное средство, с получаемыми межцепьевыми тиолами для избирательного расположения средства(в) на AB. Способ, как правило, включает частичное восстановление AB восстановителем с образованием по меньшей мере двух межцепьевых тиолов без образования всех возможных межцепьевых тиолов в активируемом антителе, и конъюгацию средства с межцепьевыми тиолами частично восстановленного AB. Например, AB активируемого антитела частично восстанавливают в течение приблизительно 1 часа приблизительно при 37°C при желаемом отношении восстановителя к активируемому антителу. В некоторых вариантах осуществления отношение восстановителя к активируемому антителу находится в диапазоне приблизительно от 20:1 до 1:1, приблизительно от 10:1 до 1:1, приблизительно от 9:1 до 1:1, приблизительно от 8:1 до 1:1, приблизительно от 7:1 до 1:1, приблизительно от 6:1 до 1:1, приблизительно от 5:1 до 1:1, приблизительно от 4:1 до 1:1, приблизительно от 3:1 до 1:1, приблизительно от 2:1 до 1:1, приблизительно от 20:1 до 1:1,5, приблизительно от 10:1 до 1:1,5, приблизительно от 9:1 до 1:1,5, приблизительно от 8:1 до 1:1,5, приблизительно от 7:1 до 1:1,5, приблизительно от 6:1 до 1:1,5, приблизительно от 5:1 до 1:1,5, приблизительно от 4:1 до 1:1,5, приблизительно от 3:1 до 1:1,5, приблизительно от 2:1 до 1:1,5, приблизительно от 1,5:1 до 1:1,5 или приблизительно от 1:1 до 1:1,5. В некоторых вариантах осуществления отношение находится в диапазоне приблизительно от 5:1 до 1:1. В некоторых вариантах осуществления отношение находится в диапазоне приблизительно от 5:1 до 1,5:1. В некоторых вариантах осуществления отношение находится в диапазоне приблизительно от 4:1 до 1:1. В некоторых вариантах осуществления отношение находится в диапазоне приблизительно от 4:1 до 1,5:1. В некоторых вариантах осуществления отношение находится в диапазоне приблизительно от 8:1 приблизительно до 1:1. В некоторых вариантах осуществления отношение находится в диапазоне приблизительно от 2,5:1 до 1:1.
[000151] Содержащий тиол реагент может представлять собой, например, цистеин или N-ацетилцистеин. Восстановитель может представлять собой, например, TCEP. В некоторых вариантах осуществления восстановленное активируемое антитело перед конъюгацией можно очищать, например, колоночной хроматографией, диализом или диафильтрацией. В некоторых вариантах осуществления восстановленное антитело не очищают после частичного восстановления и перед конъюгацией.
[000152] Изобретение также относится к частично восстановленным активируемым антителам, в которых по меньшей мере одну межцепьевая дисульфидная связь в активируемом антителе восстанавливали восстановителем без нарушения каких-либо внутрицепьевых дисульфидных связей в активируемом антителе, где активируемое антитело содержит антитело или его антигенсвязывающий фрагмент (AB), который специфически связывается с мишенью, маскирующий фрагмент (MM), которые ингибирует связывание AB активируемого антитела в нерасщепленном состоянии с мишенью, и расщепляемый фрагмент (CM), связанный с AB, где CM представляет собой полипептид, который функционирует как субстрат по меньшей мере для одной MMP. В некоторых вариантах осуществления MM является связанным с AB посредством CM. В некоторых вариантах осуществления одна или более внутрицепьевых дисульфидных связей активируемого антитела не нарушаются восстановителем. В некоторых вариантах осуществления восстановитель не разрушает одну или более внутрицепьевых дисульфидных связей MM в активируемом антителе. В некоторых вариантах осуществления активируемое антитело в нерасщепленном состоянии имеет структурную организацию от N-конца к C-концу, как указано ниже: MM-CM-AB или AB-CM-MM. В некоторых вариантах осуществления восстановитель представляет собой TCEP.
[000153] Изобретение также относится к частично восстановленным активируемым антителам, включая, но, не ограничиваясь ими, полиспецифические активируемые антитела по изобретению, в которых по меньшей мере одну межцепьевую дисульфидную связь в активируемом антителе восстанавливали восстановителем без нарушения или иным образом ухудшения активности и/или эффективности активируемого антитела, где активируемое антитело содержит антитело или его антигенсвязывающий фрагмент (AB), который специфически связывается с мишенью, маскирующий фрагмент (MM), который ингибирует связывание AB активируемого антитела в нерасщепленном состоянии с мишенью, и расщепляемый фрагмент (CM), связанный с AB, и CM представляет собой полипептид, который функционирует как субстрат для протеазы. Активность и/или эффективность активируемого антитела в качестве неограничивающего примера представляет собой маскирующее действие, активацию активируемого антитела и/или активность связывания активированного активируемого антитела. В некоторых вариантах осуществления одна или более внутрицепьевых дисульфидных связей активируемого антитела не разрушается восстановителем. В некоторых вариантах осуществления одна или более внутрицепьевых дисульфидных связей MM в активируемом антителе не разрушается восстановителем. В некоторых вариантах осуществления активируемое антитело в нерасщепленном состоянии имеет структурную организацию от N-конца к C-концу, как указано ниже: MM-CM-AB или AB-CM-MM. В некоторых вариантах осуществления восстановитель представляет собой TCEP.
[000154] Изобретение также относится к конъюгированным активируемым антителам, которые включают активируемое антитело, связанное с нагрузкой монометилауристатином D (MMAD), где активируемое антитело содержит антитело или его антигенсвязывающий фрагмент (AB), который специфически связывается с мишенью, маскирующий фрагмент (MM), который ингибирует связывание AB активируемого антитела в нерасщепленном состоянии с мишенью, и расщепляемый фрагмент (CM), связанный с AB, и CM представляет собой полипептид, которые функционирует как субстрат по меньшей мере для одной протеазы MMP.
[000155] В некоторых вариантах осуществления Конъюгированное с MMAD активируемое антитело можно конъюгировать с любым из нескольких способов присоединения средств к AB: (a) присоединения к углеводным группам AB или (b) присоединения к сульфгидрильным группам AB или (c) присоединения к аминогруппам AB, или (d) присоединения к карбоксилатным группам AB.
[000156] В некоторых вариантах осуществления нагрузку MMAD конъюгируют с AB через линкер. В некоторых вариантах осуществления нагрузку MMAD конъюгируют с цистеином в AB через линкер. В некоторых вариантах осуществления нагрузку MMAD конъюгируют с лизином в AB через линкер. В некоторых вариантах осуществления нагрузку MMAD конъюгируют с другим остатком AB через линкер, таким как остатки, описываемые в настоящем описании. В некоторых вариантах осуществления линкер представляет собой содержащий тиол линкер. В некоторых вариантах осуществления линкер представляет собой расщепляемый линкер. В некоторых вариантах осуществления линкер представляет собой нерасщепляемый линкер. В некоторых вариантах осуществления линкер выбран из группы, состоящей из линкеров, представленных в таблицах 5 и 6. В некоторых вариантах осуществления активируемое антитело и нагрузку MMAD связывают чрез линкер малеинимид-капроил-валин-цитруллин. В некоторых вариантах осуществления активируемое антитело и нагрузку MMAD связывают чрез линкер малеинимид-PEG-валин-цитруллин. В некоторых вариантах осуществления активируемое антитело и нагрузку MMAD связывают чрез линкер малеинимид-капроил-валин-цитруллин-пара-аминобензилоксикарбонил. В некоторых вариантах осуществления активируемое антитело и нагрузка MMAD связывают чрез линкер-малеинимид-PEG-валин-цитруллин-пара-аминобензилоксикарбонил. В некоторых вариантах осуществления нагрузка MMAD конъюгируют с AB и использованием технологии частичного восстановления и конъюгации, описываемых в настоящем описании.
[000157] В некоторых вариантах осуществления мишень выбирают из группы мишеней, перечисленных в таблице 1. В некоторых вариантах осуществления мишень представляет собой EGFR. В некоторых вариантах осуществления мишень представляет собой белок Jagged, например, Jagged 1 и/или Jagged 2. В некоторых вариантах осуществления мишень представляет собой рецептор интерлейкина 6 (IL-6R). В некоторых вариантах осуществления AB представляет собой антитело, выбранное из группы антител, перечисленных в таблице 2, или его получают из такого антитела. В некоторых вариантах осуществления его антигенсвязывающий фрагмент выбран из группы, состоящей из фрагмента Fab, фрагмента F(ab')2, scFv, scab, dAb, однодоменного антитела, состоящего из тяжелой цепи, и однодоменного антитела, состоящего из легкой цепи. В некоторых вариантах осуществления AB имеет равновесную константу диссоциации приблизительно 100 нМ или менее для связывания с мишенью. В некоторых вариантах осуществления MM имеет равновесную константу диссоциации для связывания с AB, которая является больше, чем равновесная константа диссоциации AB к мишени. В некоторых вариантах осуществления MM не препятствует или не конкурирует с AB активируемого антитела в расщепленном состоянии за связывание с мишенью. В некоторых вариантах осуществления MM представляет собой полипептид длиной не более 40 аминокислот. В некоторых вариантах осуществления полипептидная последовательность MM отличается от полипептидной последовательности мишени, и полипептидная последовательность MM является не более чем 50% идентичной любому природному партнеру по связыванию AB. В некоторых вариантах осуществления для MM не предусматривают более чем 25% идентичность аминокислотных последовательностей с мишенью. В некоторых вариантах осуществления для MM не предусматривают более чем 10% идентичность аминокислотных последовательностей с мишенью. В некоторых вариантах осуществления CM представляет собой полипептид длиной до 15 аминокислот. В некоторых вариантах осуществления протеаза MMP солокализована с мишенью в ткани, и протеаза MMP расщепляет CM в активируемом антителе, когда активируемое антитело подвергается действию протеазы MMP. В некоторых вариантах осуществления протеаза MMP представляет собой протеазу MMP9. В некоторых вариантах осуществления протеаза MMP представляет собой протеазу MMP14. В некоторых вариантах осуществления активируемое антитело содержит связывающий пептид между MM и CM. В некоторых вариантах осуществления активируемое антитело содержит связывающий пептид между CM и AB. В некоторых вариантах осуществления активируемое антитело содержит первый связывающий пептид (LP1) и второй связывающий пептид (LP2), и активируемое антитело в нерасщепленном состоянии имеет структурную организацию от N-конца к C-концу, как указано ниже: MM-LP1-CM-LP2-AB или AB-LP2-CM-LP1-MM. В некоторых вариантах осуществления два связывающих пептида необязательно являются идентичными друг другу. В некоторых вариантах осуществления каждый из LP1 и LP2 представляет собой пептид длиной приблизительно от 1 до 20 аминокислот. В некоторых вариантах осуществления по меньшей мере один из LP1 или LP2 содержит аминокислотную последовательность, выбранную из группы, состоящей из (GS)n, (GGS)n, (GSGGS)n (SEQ ID NO:1) и (GGGS)n (SEQ ID NO:2), где n представляет собой целое число по меньшей мере один. В некоторых вариантах осуществления по меньшей мере один из LP1 или LP2 содержит аминокислотную последовательность, выбранную из группы, состоящей из GGSG (SEQ ID NO:3), GGSGG (SEQ ID NO:4), GSGSG (SEQ ID NO:5), GSGGG (SEQ ID NO:6), GGGSG (SEQ ID NO:7) и GSSSG (SEQ ID NO:8). В некоторых вариантах осуществления активируемое антитело содержит второй CM, в некоторых вариантах осуществления второй CM является субстратом для фермента, выбранного из группы, состоящей из ферментов, представленных в таблице 7.
[000158] Изобретение также относится к полипептидам и другим более крупным молекулам, которые содержат одну или более последовательностей расщепляемых MMP субстратов, приведенных в настоящем описании. В качестве неограничивающего примера, последовательности расщепляемых MMP субстратов, приведенные в настоящем описании, являются пригодными в композициях пролекарств и способах их использования. Такие последовательности расщепляемых MMP субстратов, приведенных в настоящем описании, являются пригодными в зондах и других детектируемых средствах и способах их использования. Например, последовательности расщепляемых MMP субстратов, приведенные в настоящем описании, можно использовать в сочетании с флуоресцирующими средствами и другими гасителями для получения детектируемых средств, таких как визуализирующие средства и/или другие диагностические средства. Специалистам в данной области понятно, что последовательности расщепляемых MMP субстратов, приведенные в настоящем описании, являются пригодными для любой композиции и/или способа в данной области, в которых используют субстрат, который расщепляется одной или более MMP, такими как MMP9 и/или MMP14.
[000159] Изобретение также относится к выделенной молекуле нуклеиновой кислоты, кодирующей антитело и/или активируемое антитело, описываемое в настоящем описании, а также к векторам, которые содержат такие выделенные последовательности нуклеиновой кислоты. Изобретение относится к способам получения антитела и/или активируемого антитела культивированием клетки в условиях, которые приводят к экспрессии антитела и/или активируемого антитела, где клетка содержит такой вектор.
[000160] Изобретение относится к способу получения конъюгированного антитела по изобретению, которое связывается с данной мишенью, путем (a) культивирования клетки, содержащей конструкцию нуклеиновой кислоты, кодирующей антитело, в условиях, которые приводят к экспрессии антитела, (i), где антитело содержит расщепляемый фрагмент (CM), и (ii), где CM представляет собой полипептид, который функционирует как субстрат для матриксной металлопротеазы; (b) выделения антитела и (c) конъюгации выделенного антитела с один или более дополнительных средств.
[000161] Изобретение также относится к способу получения активируемых антител по изобретению, которые связываются в активированном состоянии с данной мишенью, путем (a) культивирования клетки, содержащей конструкцию нуклеиновой кислоты, кодирующей активируемое антитело в условиях, которые приводят к экспрессии активируемого антитела, где активируемое антитело содержит маскирующий фрагмент (MM), расщепляемый фрагмент (CM) и антитело или его антигенсвязывающий фрагмент (AB), который специфически связывается с мишенью, (i), где CM представляет собой полипептид, который функционирует как субстрат для MMP, и (ii), где CM располагают в активируемом антителе таким образом, что в нерасщепленном состоянии MM препятствует специфическому связыванию AB с мишенью, и в расщепленном состоянии MM не препятствует или не конкурирует за специфическое связывание AB с мишенью, и (b) выделения активируемого антитела.
[000162] Изобретение относится к способам профилактики, замедления прогрессирования, лечения, облегчения симптома или иным образом улучшения состояния заболевания, связанного с мишенью, у индивидуума путем введения терапевтически эффективного количества конъюгированного антитела, активируемого антитела и/или конъюгированного активируемого антитела, описываемых в настоящем описании, нуждающемуся в этом индивидууму.
[000163] Изобретение относится к способам профилактики, замедления прогрессирования, лечения, облегчения симптома или иным образом улучшения состояния воспаление и/или воспалительного нарушения у индивидуума путем введения терапевтически эффективного количества конъюгированного антитела, активируемого антитела и/или конъюгированного активируемого антитела, описываемых в настоящем описании, нуждающемуся в этом индивидууму. Изобретение также относится к способам профилактики, замедления прогрессирования, лечения, облегчения симптома или иным образом улучшения состояния злокачественной опухоли у индивидуума путем введения терапевтически эффективного количества конъюгированного антитела, активируемого антитела и/или конъюгированного активируемого антитела, описываемых в настоящем описании, нуждающемуся в этом индивидууму. Изобретение также относится к способам профилактики, замедления прогрессирования, лечения, облегчения симптома или иным образом улучшения состояния аутоиммунного заболевания у индивидуума путем введения терапевтически эффективного количества конъюгированного антитела, активируемого антитела и/или конъюгированного активируемого антитела, описываемых в настоящем описании, нуждающемуся в этом индивидууму.
[000164] Конъюгированное антитело, активируемое антитело и/или конъюгированное активируемое антитело, используемые в любом из вариантов осуществления этих способов и применений можно вводить на любой стадии заболевания. Например, такое конъюгированное антитело, активируемое антитело и/или конъюгированное активируемое антитело можно вводить пациенту, страдающему злокачественной опухолью любой стадии от ранней до метастатической. Термины индивидуум и пациент в настоящем описании используют взаимозаменяемо.
[000165] В некоторых вариантах осуществления индивидуум представляет собой млекопитающее, такое как человек, не являющийся человеком примат, животное-компаньон (например, кошка, собака, лошадь), сельскохозяйственное животное, рабочее животное или животное в зоопарке. В некоторых вариантах осуществления индивидуум представляет собой грызуна. В некоторых вариантах осуществления индивидуум представляет собой человека. В некоторых вариантах осуществления индивидуум представляет собой животное-компаньона. В некоторых вариантах осуществления индивидуум представляет собой животное под присмотром ветеринара.
[000166] Конъюгированное антитело, активируемое антитело и/или конъюгированное активируемое антитело и их терапевтические составы вводят индивидууму, страдающему или предрасположенному к заболеванию или нарушению, связанному с аберрантной экспрессией и/или активностью мишени. Индивидуума страдающего или предрасположенного к заболеванию или нарушению, связанному с аберрантной экспрессией и/или активностью мишени, идентифицируют любым из ряда известных в данной области способов. Например, индивидуумов, страдающих злокачественной опухолью или другим неопластическим состоянием, идентифицируют с использованием любого из ряда клинических и/или лабораторных тестов, таких как, медицинский осмотр и анализ крови, мочи и/или кал, для оценки состояния здоровья. Например, индивидуумов, страдающих воспалением и/или воспалительным нарушением, идентифицируют с использованием любого из ряда клинических и/или лабораторных тестов, таких как медицинский осмотр и/или анализ жидкости организма, например, анализ крови, мочи и/или кала, для оценки состояния здоровья.
[000167] Введение конъюгированного антитела, активируемого антитела и/или конъюгированного активируемого антитела пациенту, страдающему заболеванием или нарушением, связанным с аберрантной экспрессией и/или активностью мишени, считают эффективным, если достигают любой из ряда лабораторных или клинических целей. Например, введение конъюгированного антитела, активируемого антитела и/или конъюгированного активируемого антитела пациенту, страдающему заболеванием или нарушением, связанным с аберрантной экспрессией и/или активностью мишени, считают эффективным, если один или более симптомов, связанных с заболеванием или нарушением, ослабляется, уменьшается, ингибируется или прогрессирует в будущем, т.е. не ухудшает состояние. Введение конъюгированного антитела, активируемого антитела и/или конъюгированного активируемого антитела пациенту, страдающему заболеванием или нарушением, связанным с аберрантной экспрессией и/или активностью мишени, считают эффективным, если заболевание или нарушение переходит в состояние ремиссии или не прогрессирует в будущем, т.е. не ухудшает состояние.
[000168] В некоторых вариантах осуществления конъюгированное антитело, активируемое антитело и/или конъюгированное активируемое антитело вводят во время и/или после лечения в комбинации с одним или более дополнительных средств, таких как, в качестве неограничивающего примера, противовоспалительное средство, иммуносупрессирующее средство, химиотерапевтическое средство, такое как алкилирующее средство, антиметаболит, антимикротубулярное средство, ингибитор топоизомеразы, цитотоксический антибиотик и/или любое другое повреждающее нуклеиновую кислоту средство. В некоторых вариантах осуществления дополнительное средство представляет собой таксан, такой как паклитаксел (например, Abraxane®). В некоторых вариантах осуществления дополнительное средство представляет собой антиметаболит, такой как гемцитабин. В некоторых вариантах осуществления дополнительное средство представляет собой алкилирующее средство, такое как химиотерапия на основе платины, такая как карбоплатин или цисплатин. В некоторых вариантах осуществления дополнительное средство представляет собой средство с направленной доставкой, такое как ингибитор киназы, например, сорафениб или эрлотиниб. В некоторых вариантах осуществления дополнительное средство представляет собой средство с направленной доставкой, такое как другое антитело, например, моноклональное антитело (например, бевацизумаб), биспецифическое антитело или полиспецифическое антитело. В некоторых вариантах осуществления дополнительное средство представляет собой ингибитор протеасомы, такой как бортезомиб или карфилзомиб. В некоторых вариантах осуществления дополнительное средство представляет собой иммуномодулирующее средство, такое как ленолидоминд, или IL-2. В некоторых вариантах осуществления дополнительное средство представляет собой облучение. В некоторых вариантах осуществления дополнительное средство представляет собой средство, которое специалисты в данной области считают стандартом лечения. В некоторых вариантах осуществления дополнительное средство представляет собой хорошо известное специалистам в данной области химиотерапевтическое средство.
[000169] В некоторых вариантах осуществления дополнительное средство представляет собой антитело, другое конъюгированное антитело, другое активируемое антитело и/или другое конъюгированное активируемое антитело. В некоторых вариантах осуществления конъюгированное антитело, активируемое антитело и/или конъюгированное активируемое антитело и дополнительное средство(а) вводят одномоментно. Например, конъюгированное антитело, активируемое антитело и/или конъюгированное активируемое антитело и дополнительное средство(а) можно формулировать в одной композиции или вводить в двух или более отдельных композициях. В некоторых вариантах осуществления конъюгированное антитело, активируемое антитело и/или конъюгированное активируемое антитело и дополнительное средство(а) вводят последовательно или антитело и/или конъюгированные антитела и дополнительное средство вводят в различные моменты времени во время схемы лечения. Например, антитело и/или конъюгированные антитела вводят до введения дополнительного средства, антитела и/или конъюгированные антитела вводят после введения дополнительного средства или антитела и/или конъюгированные антитела и дополнительное средство вводят поочередно. Как описано в настоящем описании, антитело и/или конъюгированные антитела и дополнительное средство вводят в однократных дозах или в многократных дозах.
[000170] В некоторых вариантах осуществления CM является связанным или иным образом присоединенным к активируемому антителу, которое включает антитело или его антигенсвязывающий фрагмент, который специфически связывается с данной мишенью, связанный с маскирующим фрагментом (MM), таким образом, что связывание MM с AB снижает способность антитела или его антигенсвязывающего фрагмента связываться с мишенью. В некоторых вариантах осуществления MM связывают посредством CM. Иллюстративные мишени включают, но не ограничиваются ими, мишени, представленные в таблице 1. Иллюстративные AB включают, но не ограничиваются ими, мишени, представленные в таблице 2. Активируемые антитела, предоставленные в настоящем описании, являются стабильными в кровяном русле, активируются в предполагаемом участке проведения терапии и/или диагностики, а не в нормальной, т.е. здоровой ткани или другой ткани, на которую не направлено лечение и/или диагностика, и при активации характеризуются связыванием с мишенью, которое является по меньшей мере сравнимым с соответствующим, немодифицированным антителом.
[000171] Изобретение также относится к способам и наборам для использования конъюгированных антител, активируемых антител и/или конъюгированных активируемых антител при различных терапевтических, диагностических и профилактических показаниях.
[000172] В некоторых вариантах осуществления изобретение относится к способам и наборам для детекции наличия или отсутствия расщепляющего средства и представляющей интерес мишени у индивидуума или в образце путем (i) приведения индивидуума или образца в контакт с активируемым антителом, где активируемое антитело содержит маскирующий фрагмент (MM), расщепляемый фрагмент (CM), который расщепляется расщепляющим средством, и антигенсвязывающий домен или его фрагмент (AB), который специфически связывается с представляющей интерес мишенью, где активируемое антитело в нерасщепленном, неактивированном состоянии имеет структурную организацию от N-конца к C-концу, как указано ниже: MM-CM-AB или AB-CM-MM; (a), где MM представляет собой пептид, который ингибирует связывание AB с мишенью, и где MM не содержит аминокислотную последовательность природного партнера по связыванию AB и не является модифицированной формой природного партнера по связыванию AB, и (b) где в нерасщепленном, неактивированном состоянии MM препятствует специфическому связыванию AB с мишенью, и в расщепленном, активированном состоянии MM не препятствует или не конкурирует за специфическое связывание AB с мишенью, и (ii) измерения уровня активированного активируемого антитела у индивидуума или в образце, где детектируемый уровень активированного активируемого антитела у индивидуума или в образце указывает на, что расщепляющее средство и мишень содержатся у индивидуума или в образце, и где недетектируемый уровень активированного активируемого антитела у индивидуума или в образце указывает на то, что расщепляющее средство, мишень или расщепляющее средство и мишень отсутствуют у индивидуума или в образце.
[000173] В некоторых вариантах осуществления активируемое антитело представляет собой активируемое антитело, с которым конъюгировано терапевтическое средство. В некоторых вариантах осуществления активируемое антитело не является конъюгированным со средством. В некоторых вариантах осуществления активируемое антитело содержит детектируемую метку. В некоторых вариантах осуществления детектируемую метку располагают на AB. В некоторых вариантах осуществления измерение уровня активируемого антитела у индивидуума или в образце проводят с использованием вторичного реагента, который специфически связывается с активированным антителом, где реагент содержит детектируемую метку. В некоторых вариантах осуществления вторичный реагент представляет собой антитело, содержащее детектируемую метку.
[000174] В некоторых вариантах осуществления этих способов и наборов активируемое антитело содержит детектируемую метку. В некоторых вариантах осуществления этих способов и наборов детектируем метка включает визуализирующее средство, контрастирующее средство, фермент, флуоресцентную метку, хромофор, краситель, один или более ионов металлов или метку на основе лиганда. В некоторых вариантах осуществления этих способов и наборов визуализирующее средство содержит радиоактивный изотоп. В некоторых вариантах осуществления этих способов и наборов радиоактивный изотоп представляет собой индий или технеций. В некоторых вариантах осуществления этих способов и наборов контрастирующее средство содержит йод, гадолиний или оксид железа. В некоторых вариантах осуществления этих способов и наборов фермент включает пероксидазу хрена, щелочную фосфатазу или β-галактозидазу. В некоторых вариантах осуществления этих способов и наборов флуоресцентная метка включает желтый флуоресцентный белок (YFP), синий флуоресцентный белок (CFP), зеленый флуоресцентный белок (GFP), модифицированный красный флуоресцентный белок (mRFP), красный флуоресцентный белок tdimer2 (RFP tdimer2), HCRED или производное европия. В некоторых вариантах осуществления этих способов и наборов люминесцентная метка содержит производное N-метилакридина. В некоторых вариантах осуществления этих способов метка включает метку Alexa Fluor®, такую как Alex Fluor® 680 или Alexa Fluor® 750. В некоторых вариантах осуществления этих способов и наборов метка на основе лиганда включает биотин, авидин, стрептавидин или один или более гаптенов.
[000175] В некоторых вариантах осуществления этих способов и наборов индивидуум представляет собой млекопитающее. В некоторых вариантах осуществления этих способов, индивидуум является человеком. В некоторых вариантах осуществления индивидуум представляет собой не принадлежащее человеку млекопитающее, такое как не являющийся человеком примат, животное-компаньон (например, кошка, собака, лошадь), сельскохозяйственное животное, рабочее животное или животное в зоопарке. В некоторых вариантах осуществления индивидуум представляет собой грызуна. В некоторых вариантах осуществления индивидуум является человеком. В некоторых вариантах осуществления индивидуум представляет собой животное-компаньона. В некоторых вариантах осуществления индивидуум представляет собой животное под присмотром ветеринара.
[000176] В некоторых вариантах осуществления этих способов и наборов способ представляет собой способ in vivo. В некоторых вариантах осуществления этих способов способ представляет собой способ in situ. В некоторых вариантах осуществления этих способов способ представляет собой способ ex vivo. В некоторых вариантах осуществления этих способов способ представляет собой способ in vitro.
[000177] В некоторых вариантах осуществления способов и наборов способ используют для идентификации или иным образом отбора популяции пациентов, подходящей для лечения активируемым антителом по изобретению с последующим лечением путем введения такого активируемого антитела и/или конъюгированного активируемого антитела нуждающемуся в этом индивидууму. Например, пациентов, результат теста которых является положительным на мишень и по меньшей мере на одну MMP, которая расщепляет субстрат в расщепляемом фрагменте (CM) активируемого антитела, которое тестировали в этих способах, идентифицируют как подходящих кандидатов для лечения таким активируемым антителом, содержащим такой CM, и затем пациенту вводят терапевтически эффективное количество активируемого антитела и/или конъюгированного активируемого антитела, которое тестировали. Аналогично, пациентов, результат теста которых является отрицательным на любую из или на мишень и MMP, которая расщепляет субстрат в CM в активируемом антителе, которое тестировали этими способами, можно идентифицировать как подходящих кандидатов для другой формы терапии. В некоторых вариантах осуществления таких пациентов можно тестировать с использованием других активируемых антител до тех пор, пока не идентифицируют подходящее активируемое антитело для лечения (например, активируемое антитело, содержащее CM, которое расщепляется у пациента в очаге заболевания). В некоторых вариантах осуществления затем пациенту вводят терапевтически эффективное количество активируемого и/или конъюгированного антитела, в отношении которого результат тестирования пациента являлся положительным.
[000178] Фармацевтические композиции по изобретению содержат антитело по изобретению и носитель. Такие фармацевтические композиции можно включать в наборы, такие как, например, диагностические наборы.
Краткое описание чертежей
[000179] Фигуры 1A и 1B представляют собой серию графиков, описывающих способность активируемого антитела против EGFR, содержащего маскирующий фрагмент, содержащий аминокислотную последовательность CISPRGCPDGPYVMY (SEQ ID NO:160), расщепляемый фрагмент, содержащий субстрат 520 MMP14 (также обозначаем в настоящем описании как MN520) ISSGLLSS (SEQ ID NO:14), и тяжелые и легкие цепи антитела против EGFR C225v5, где полную конструкцию активируемого антитела в настоящем описании обозначают как Pb-MN520, ингибировать рост опухоли на модели ксенотрансплантата рака легких H292.
[000180] Фигуры 2A и 2B представляют собой серию графиков, иллюстрирующих расщепление объединенного образца субстратов, обозначаемого в настоящем описании как SMP87, 5 нМ MMP9.
[000181] фигуры 3A и 3B представляют собой серию графиков, иллюстрирующих расщепление последовательности субстрата VAGRSMRP (SEQ ID NO:484) 5 нМ MMP9.
[000182] Фигура 4 представляет собой график, иллюстрирующий корреляцию частоты и функции последовательности субстрата.
[000183] Фигуры 5A и 5B представляют собой серию графиков, иллюстрирующих расщепление объединенного образца субстрата SMP39 60 нМ MMP14.
[000184] фигуры 6A и 6B представляют собой серию графиков иллюстрирующих расщепление последовательности субстрата QNQALRMA (SEQ ID NO:15)30 нМ MMP14.
[000185] Фигуры 7A и 7B представляют собой серию схематических представлений платформ пептидного дисплея, используемых в демонстрационных примерах, приведенных в настоящем описании. Фигура 7A представляет собой схематическое представление последовательности платформы дисплея, обозначаемого в настоящем описании как "Платформа дисплея CYTX-DP-XXXXXXXX" или "CYTX-DP-XXXXXXXX" (SEQ ID NO:512). Фигура 7B представляет собой схематическое представление последовательности платформы дисплея, обозначаемой в настоящем описании как "Платформа дисплея SP-CYTX-DP-XXXXXXXX" или "SP-CYTX-DP-XXXXXXXX" (SEQ ID NO:513), где SP-CYTX-DP-XXXXXXXX (SEQ ID NO:513) представляет собой платформу CYTX-DP-XXXXXXXX (SEQ ID NO:512)с сигнальным пептидом.
Подробное описание изобретения
[000186] Изобретение относится к аминокислотным последовательностям, которые содержат расщепляемый фрагмент (CM), который представляет собой субстрат по меньшей мере для одной матриксной металлопротеазы (MMP). Такие CM являются пригодными для различных терапевтических, диагностических и профилактических показаний.
[000187] Демонстрационные примеры, предоставленные в настоящем описании, демонстрируют, что такие CM, при предоставлении в платформе пептидного дисплея, обладают рядом желательных характеристик расщепления при воздействии протеазы MMP в конкретных условиях. Например, в таблице 9 описано (a) процент отобранных в отношении MMP9 субстратов, тестируемых в платформе дисплея CYTX-DP, которые характерзовались по меньшей мере 20% расщепления при инкубации с 50 нМ MMP9 человека в течение 1 часа при 37°C в 50 мМ Tris-HCl, pH 7,4, дополненной 150 мМ NaCl,10 мМ CaCl2 и 0,05% (масс./об.) Brij-35 (>20% расщепления 50 нМ MMP9); (b) процент отобранных в отношении MMP14 субстратов, тестируемых в платформе дисплея CYTX-DP, которые характеризовались по меньшей мере 20% расщепление при инкубации с 50 нМ MMP14 человека в течение 1 часа при 37°C в 50 мМ HEPES, pH 6,8, дополненной 10 мМ CaCl2 и 0,5 мМ MgCl2 (>20% расщепления 50 нМ MMP14), и (c) процент отобранных в отношении MMP9 или в отношении MMP-14 субстратов, тестируемых в платформе дисплея CYTX-DP, которые характеризовались менее чем 20% расщепления при инкубации с 500 пМ плазмина человека в течение 1 часа при 37°C в 50 мМ Tris-HCl, pH 7,4, дополненной 100 мМ NaCl, 0,01% Tween 20 и 1 мМ EDTA (<20% расщепления 500 пМ плазмина).
[000188] В некоторых вариантах осуществления субстрат MMP9 при предоставлении в платформе CYTX-DP характеризуется по меньшей мере 20% расщеплением при инкубации с 50 нМ MMP9 человека в течение 1 часа при 37°C в 50 мМ Tris-HCl, pH 7,4, дополненной 150 мМ NaCl, 10 мМ CaCl2 и 0,05% (масс./об.) Brij-35. В некоторых вариантах осуществления субстрат MMP9 при предоставлении в платформе CYTX-DP характеризуется менее чем 20% расщеплением при инкубации с 500 пМ плазмина человека в течение 1 часа при 37°C в 50 мМ Tris-HCl, pH 7,4, дополненной 100 мМ NaCl, 0,01% Tween 20 и 1 мМ EDTA. В некоторых вариантах осуществления субстрат MMP9 при предоставлении в платформе CYTX-DP характеризуется по меньшей мере чем 20% расщеплением при инкубации с 50 нМ MMP9 человека в течение 1 часа при 37°C в 50 мМ Tris-HCl, pH 7,4, дополненной 150 мМ NaCl, 10 мМ CaCl2 и 0,05% (масс./об.) Brij-35 и характеризуется менее чем 20% расщеплением при инкубации с 500 пМ плазмина человека в течение 1 часа при 37°C ы 50 мМ Tris-HCl, pH 7,4, дополненной 100 мМ NaCl, 0,01% Tween 20 и 1 мМ EDTA.
[000189] В некоторых вариантах осуществления субстрат MMP14 характеризуется по меньшей мере 20% расщеплением при инкубации с 50 нМ MMP14 человека в течение 1 часа при 37°C в 50 мМ HEPES, pH 6,8, дополненном 10 мМ CaCl2 и 0,5 мМ MgCl2. В некоторых вариантах осуществления субстрат MMP14 при предоставлении в платформе CYTX-DP характеризуется менее чем 20% расщеплением при инкубации с 500 пМ плазмина человека в течение 1 часа при 37°C в 50 мМ Tris-HCl, pH 7,4, дополненной 100 мМ NaCl, 0,01% Tween 20 и 1 мМ EDTA. В некоторых вариантах осуществления субстрат MMP14 характеризуется по меньшей мере 20% расщеплением при инкубации с 50 нМ MMP14 человека в течение 1 часа при 37°C в 50 мМ HEPES, pH 6,8, дополненном 10 мМ CaCl2, и 0,5 мМ MgCl2 и характеризуется менее чем 20% расщеплением при инкубации с 500 пМ плазмина человека в течение 1 часа при 37°C в 50 мМ Tris-HCl, pH 7,4, дополненной 100 mM NaCl, 0,01% Tween 20 и 1 мМ EDTA.
[000190] В некоторых вариантах осуществления наблюдаемое значение kcat/KM субстрата в активируемом антителе для MMP9 составляют более 100 M-1с-1. В некоторых вариантах осуществления наблюдаемое значение kcat/KM субстрата в активируемом антителе для MMP9 составляет более 1000 M-1с-1. В некоторых вариантах осуществления значение kcat/KM субстрата в активируемом антителе для MMP9 составляет более 10000 M-1с-1.
[000191] В некоторых вариантах осуществления значение kcat/KM субстрата в активируемом антителе для MMP14 составляет более 100 M-1с-1. В некоторых вариантах осуществления значение kcat/KM субстрата в активируемом антителе для MMP14 составляет более 1000 M-1с-1. В некоторых вариантах осуществления значение kcat/KM субстрата в активируемом антителе для MMP14 составляет более 10,000 M-1с-1.
[000192] Изобретение также относится к антителам, которые содержат один или более таких расщепляемых MMP субстратов. Например, такие расщепляемые MMP субстраты являются пригодными при конъюгации антитела с одним или более дополнительных средств для получения конъюгированных антител. Такие расщепляемые MMP субстраты являются пригодными в конструкциях активируемого антитела.
[000193] Конъюгированные антитела и/или активируемые антитела содержат антитело или его антигенсвязывающий фрагмент (AB), который специфически связывается с мишенью. Иллюстративные классы мишеней AB включают, но не обязательно ограничены ими, рецепторы клеточной поверхности и секретируемые связывающие белки (например, факторы роста), растворимые ферменты, структурные белки (например, коллаген, фибронектин) и т.п. В некоторых вариантах осуществления конъюгированные антитела и/или активируемые антитела содержат AB, которые связывается с внеклеточной мишенью, как правило, внеклеточной белковой мишенью. В некоторых вариантах осуществления конъюгированные антитела и/или активируемые антитела конструируют для поглощения клеткой и их можно переключать внутри клетки.
[000194] В качестве неограничивающего примера, AB представляет собой партнер по связыванию для любой мишени, перечисленной в таблице 1.
Иллюстративные мишени
[000195] В качестве неограничивающего примера, AB представляет собой антитело, или его получают из антитела, приведенного в таблице 2.
Иллюстративные источники Ab
[000196] Иллюстративные конъюгированные антитела и/или активируемые антитела по изобретению включают, например, антитела, которые связываются с рецептором интерлейкина 6 (IL-6R) и которые содержат тяжелую цепь и легкую цепь, которые представляют собой антитело, или которые выделяют из антитела, обозначаемого в настоящем описании как антитело "Av1", которое связывается с рецептором интерлейкина 6 (IL-6R). Аминокислотные последовательности для тяжелой цепи Av1 и легкой цепи Av1 представлены ниже в SEQ ID NO:54 и SEQ ID NO:55, соответственно.
Аминокислотная последовательность тяжелой цепи антитела Av1: QVQLQESGPGLVRPSQTLSLTCTVSGYSITSDHAWSWVRQPPGRGLEWIGYISYSGITTYNPSLKSRVTISRDNSKNTLYLQMNSLRAEDTAVYYCARSLARTTAMDYWGQGSLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (SEQ ID NO:54)
Аминокислотная последовательность легкой цепи антитела Av1: DIQMTQSPSSLSASVGDRVTITCRASQDISSYLNWYQQKPGKAPKLLIYYTSRLHSGVPSRFSGSGSGTDFTFTISSLQPEDIATYYCQQGNTLPYTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:55)
[000197] Иллюстративные конъюгированные антитела и/или активируемые антитела по изобретению включают, например, антитела, которые связываются с рецептором интерлейкина 6 (IL-6R) и которые содержат тяжелую цепь и легкую цепь, которые представляют собой антитело Av1 или которые получают из антитела Av1, и маскирующий фрагмент. Иллюстративные конъюгированные антитела и/или активируемые антитела по изобретению содержат аминокислотную последовательность, присоединенную к N-концу легкой цепи AV1. Эти N-концевые аминокислотные последовательности содержат, например, YGSCSWNYVHIFMDC (SEQ ID NO:161); QGDFDIPFPAHWVPIT (SEQ ID NO:162); MGVPAGCVWNYAHIFMDC (SEQ ID NO:163); QGQSGQYGSCSWNYVHIFMDC (SEQ ID NO:164); QGQSGQGDFDIPFPAHWVPIT (SEQ ID NO:165) или QGQSGQMGVPAGCVWNYAHIFMDC (SEQ ID NO:166). Также следует понимать, что такие аминокислотные последовательности можно присоединять к N-концу тяжелой цепи AV1 или к C-концу тяжелой или легкой цепи AV1.
[000198] Иллюстративные активируемые антитела по изобретению включают, например, антитела, которые связываются с рецептором эпидермального фактора роста (EGFR) и которые содержат тяжелую цепь и легкую цепь, которые представляют собой антитело или которые получают из антитела, выбранного из группы, состоящей из антитела, обозначаемого в настоящем описании как антитело "c225v5", антитела, обозначаемого в настоящем описании как антитело "c225v4", и антитела, обозначаемого в настоящем описании как антитело "c225v6", каждое из которых связывается с EGFR. Антитело c225v5, антитело c225v4 и антитело c225v6 содержат одинаковую последовательность легкой цепи, обозначаемую в настоящем описании как "легкая цепь c225". Аминокислотные последовательности для тяжелой цепи антитела c225v5, антитела c225v4, антитела c225v6 и легкой цепи c225 приведены ниже.
Аминокислотная последовательность тяжелой цепи антитела C225v5:
QVQLKQSGPGLVQPSQSLSITCTVSGFSLTNYGVHWVRQSPGKGLEWLGVIWSGGNTDYNTPFTSRLSINKDNSKSQVFFKMNSLQSQDTAIYYCARALTYYDYEFAYWGQGTLVTVSAASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK* (SEQ ID NO:56)
Аминокислотная последовательность тяжелой цепи антитела C225v4:
QVQLKQSGPGLVQPSQSLSITCTVSGFSLTNYGVHWVRQSPGKGLEWLGVIWSGGNTDYNTPFTSRLSINKDNSKSQVFFKMNSLQSNDTAIYYCARALTYYDYEFAYWGQGTLVTVSAASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSC SVMHEALHNHYTQKSLSLSPGK* (SEQ ID NO:57)
Аминокислотная последовательность тяжелой цепи антитела C225v6:
QVQLKQSGPGLVQPSQSLSITCTVSGFSLTNYGVHWVRQSPGKGLEWLGVIWSGGNTDYNTPFTSRLSINKDNSKSQVFFKMNSLQSQDTAIYYCARALTYYDYEFAYWGQGTLVTVSAASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYASTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK* (SEQ ID NO:58)
Аминокислотная последовательность легкой цепи антитела C225:
QILLTQSPVILSVSPGERVSFSCRASQSIGTNIHWYQQRTNGSPRLLIKYASESISGIPSRFSGSGSGTDFTLSINSVESEDIADYYCQQNNNWPTTFGAGTKLELKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC* (SEQ ID NO:59)
[000199] Иллюстративные конъюгированные антитела и/или активируемые антитела по изобретению включают, например, антитела, которые связываются с мишенью Jagged, например, Jagged-1, Jagged-2 и/или Jagged-1 и Jagged-2, и которые содержат комбинацию вариабельная область тяжелой цепи и вариабельная область легкой цепи, которые представляют собой или которые выделяют из последовательностей вариабельной области тяжелой цепи и вариабельной области легкой цепи, представленных ниже.
Аминокислотная последовательность вариабельной области легкой цепи Lc4
DIQMTQSPSSLSASVGDRVTITCRASQSISSYLNWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSVVAPLTFGQGTKVEIKR (SEQ ID NO:60)
Аминокислотная последовательность вариабельной области тяжелой цепи Hc4
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYAMSWVRQAPGKGLEWVSSIEQMGWQTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAKDIGGRSAFDYWGQGTLVTVSS (SEQ ID NO:61)
Аминокислотная последовательность вариабельной области легкой цепи Lc5
DIQMTQSPSSLSASVGDRVTITCRASQSISSYLNWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSVVAPLTFGQGTKVEIKR (SEQ ID NO:62)
Аминокислотная последовательность вариабельной области тяжелой цепи Hc5
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYAMSWVRQAPGKGLEWVSSIEQMGWQTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAKSPPYHGQFDYWGQGTLVTVSS (SEQ ID NO:63)
Аминокислотная последовательность вариабельной области легкой цепи Lc7
DIQMTQSPSSLSASVGDRVTITCRASQSISSYLNWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSVVAPLTFGQGTKVEIKR (SEQ ID NO:64)
Аминокислотная последовательность вариабельной области тяжелой цепи Hc7
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYAMSWVRQAPGKGLEWVSSIEQMGWQTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAKSPPFFGQFDYWGQGTLVTVSS (SEQ ID NO:65)
Аминокислотная последовательность вариабельной области легкой цепи Lc8
DIQMTQSPSSLSASVGDRVTITCRASQSISSYLNWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSVVAPLTFGQGTKVEIKR (SEQ ID NO:67)
Аминокислотная последовательность вариабельной области тяжелой цепи Hc8
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYAMSWVRQAPGKGLEWVSSIEQMGWQTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAKHIGRTNPFDYWGQGTLVTVSS (SEQ ID NO:68)
Аминокислотная последовательность вариабельной области легкой цепи Lc13
DIQMTQSPSSLSASVGDRVTITCRASQSISSYLNWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSVVAPLTFGQGTKVEIKR (SEQ ID NO:69)
Аминокислотная последовательность вариабельной области тяжелой цепи Hc13
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYAMSWVRQAPGKGLEWVSSIEQMGWQTEYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAKSAAAFDYWGQGTLVTVSS (SEQ ID NO:70)
Аминокислотная последовательность вариабельной области легкой цепи Lc16
DIQMTQSPSSLSASVGDRVTITCRASQSISSYLNWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSVVAPLTFGQGTKVEIKR (SEQ ID NO:71)
Аминокислотная последовательность вариабельной области тяжелой цепи Hc16
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYAMSWVRQAPGKGLEWVSSIEQMGWQTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAKSPPYYGQFDYWGQGTLVTVSS (SEQ ID NO:72)
Аминокислотная последовательность вариабельной области легкой цепи Lc19
DIQMTQSPSSLSASVGDRVTITCRASQSISSYLNWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSVVAPLTFGQGTKVEIKR (SEQ ID NO:73)
Аминокислотная последовательность вариабельной области легкой цепи Lc19
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYAMSWVRQAPGKGLEWVSSIEQMGWQTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAKSPPFFGQFDYWGQGTLVTVSS (SEQ ID NO:74)
Аминокислотная последовательность вариабельной области легкой цепи Lc21
DIQMTQSPSSLSASVGDRVTITCRASQSISSYLNWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSVVAPLTFGQGTKVEIKR (SEQ ID NO:75)
Аминокислотная последовательность вариабельной области тяжелой цепи Hc21
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYAMSWVRQAPGKGLEWVSSIEQMGWQTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAKDIGGRSAFDYWGQGTLVTVSS (SEQ ID NO:76)
Аминокислотная последовательность вариабельной области легкой цепи Lc24
DIQMTQSPSSLSASVGDRVTITCRASQSISSYLNWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSVVAPLTFGQGTKVEIKR (SEQ ID NO:77)
Аминокислотная последовательность вариабельной области тяжелой цепи Hc24
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYAMSWVRQAPGKGLEWVSSIEEMGWQTLYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAKSAAAFDYWGQGTLVTVSS (SEQ ID NO:78)
Аминокислотная последовательность вариабельной области легкой цепи Lc26
DIQMTQSPSSLSASVGDRVTITCRASQSISSYLNWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSVVAPLTFGQGTKVEIKR (SEQ ID NO:79)
Аминокислотная последовательность вариабельной области тяжелой цепи Hc26
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYAMSWVRQAPGKGLEWVSSIEQMGWQTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAKDIGGRSAFDYWGQGTLVTVSS (SEQ ID NO:80)
Аминокислотная последовательность вариабельной области легкой цепи Lc27
DIQMTQSPSSLSASVGDRVTITCRASQSISSYLNWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSVVAPLTFGQGTKVEIKR (SEQ ID NO:81)
Аминокислотная последовательность вариабельной области тяжелой цепи Hc27
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYAMSWVRQAPGKGLEWVSSIEQMGWQTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAKSPPFYGQFDYWGQGTLVTVSS (SEQ ID NO:82)
Аминокислотная последовательность вариабельной области легкой цепи Lc28
DIQMTQSPSSLSASVGDRVTITCRASQSISSYLNWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSVVAPLTFGQGTKVEIKR (SEQ ID NO:83)
Аминокислотная последовательность вариабельной области тяжелой цепи Hc28
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYAMSWVRQAPGKGLEWVSSIEQMGWQTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAKSPPFFGQFDYWGQGTLVTVSS (SEQ ID NO:84)
Аминокислотная последовательность вариабельной области легкой цепи Lc30
DIQMTQSPSSLSASVGDRVTITCRASQSISSYLNWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSVVAPLTFGQGTKVEIKR (SEQ ID NO:85)
Аминокислотная последовательность вариабельной области тяжелой цепи Hc30
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYAMSWVRQAPGKGLEWVSSIEEMGWQTLYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYAKSAAAFDYWGQGTLVTVSS (SEQ ID NO:86)
Аминокислотная последовательность вариабельной области легкой цепи Lc31
DIQMTQSPSSLSASVGDRVTITCRASQSISSYLNWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSVVAPLTFGQGTKVEIKR (SEQ ID NO:87)
Аминокислотная последовательность вариабельной области тяжелой цепи Hc31
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYAMSWVRQAPGKGLEWVSSIEQMGWQTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAKDIGGRSAFDYWGQGTLVTVSS (SEQ ID NO:88)
Аминокислотная последовательность вариабельной области легкой цепи Lc32
DIQMTQSPSSLSASVGDRVTITCRASQSISSYLNWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSVVAPLTFGQGTKVEIKR (SEQ ID NO:89)
Аминокислотная последовательность вариабельной области тяжелой цепи Hc32
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYAMSWVRQAPGKGLEWVSSIDPEGWQTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAKSAAAFDYWGQGTLVTVSS (SEQ ID NO:90)
Аминокислотная последовательность вариабельной области легкой цепи Lc37
DIQMTQSPSSLSASVGDRVTITCRASQSISSYLNWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSVVAPLTFGQGTKVEIKR (SEQ ID NO:91)
Аминокислотная последовательность вариабельной области тяжелой цепи Hc37
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYAMSWVRQAPGKGLEWVSSIEQMGWQTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAKSPPHNGQFDYWGQGTLVTVSS (SEQ ID NO:92)
Аминокислотная последовательность вариабельной области легкой цепи Lc39
DIQMTQSPSSLSASVGDRVTITCRASQSISSYLNWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSVVAPLTFGQGTKVEIKR (SEQ ID NO:93)
Аминокислотная последовательность вариабельной области тяжелой цепи Hc39
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYAMSWVRQAPGKGLEWVSSIEQMGWQTEYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAKSAAAFDYWGQGTLVTVSS (SEQ ID NO:94)
Аминокислотная последовательность вариабельной области легкой цепи Lc40
DIQMTQSPSSLSASVGDRVTITCRASQSISSYLNWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSVVAPLTFGQGTKVEIKR (SEQ ID NO:95)
Аминокислотная последовательность тяжелой цепи Hc40
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYAMSWVRQAPGKGLEWVSSIEQMGWQTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAKSPPFFGQFDYWGQGTLVTVSS (SEQ ID NO:96)
Аминокислотная последовательность вариабельной области легкой цепи Lc47
DIQMTQSPSSLSASVGDRVTITCRASQSISSYLNWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSVVAPLTFGQGTKVEIKR (SEQ ID NO:97)
Аминокислотная последовательность вариабельной области тяжелой цепи Hc47
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYAMSWVRQAPGKGLEWVSSIDEMGWQTEYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAKSAAAFDYWGQGTLVTVSS (SEQ ID NO:98)
Вариабельная область легкой цепи 4B2
DIQMTQSPSSLSASVGDRVTITCRASQSISSYLNWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQTLDAPPQFGQGTKVEIKR (SEQ ID NO:99)
Вариабельная область тяжелой цепи 4B2
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYAMSWVRQAPGKGLEWVSSIEQMGWQTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAKDIGGRSAFDYWGQGTLVTVSS (SEQ ID NO:100)
Вариабельная область легкой цепи 4D11
DIQMTQSPSSLSASVGDRVTITCRASQSISSYLNWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQTVVAPPLFGQGTKVEIKR (SEQ ID NO:101)
Вариабельная область тяжелой цепи 4D11
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYAMSWVRQAPGKGLEWVSSIDPEGRQTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAKDIGGRSAFDYWGQGTLVTVSS (SEQ ID NO:102)
Вариабельная область легкой цепи 4E7
DIQMTQSPSSLSASVGDRVTITCRASQSISSYLNWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSLVAPLTFGQGTKVEIKR (SEQ ID NO:103)
Вариабельная область тяжелой цепи 4E7
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYAMSWVRQAPGKGLEWVSSIEEMGWQTKYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAKSAAAFDYWGQGTLVTVSS (SEQ ID NO:104)
Вариабельная область легкой цепи 4E11
DIQMTQSPSSLSASVGDRVTITCRASQSISSYLNWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQALDAPLMFGQGTKVEIKR (SEQ ID NO:105)
Вариабельная область тяжелой цепи 4E11
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYAMSWVRQAPGKGLEWVSSIEPMGQLTEYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAKDIGGRSAFDYWGQGTLVTVSS (SEQ ID NO:106)
Вариабельная область легкой цепи 6B7
DIQMTQSPSSLSASVGDRVTITCRASQSISSYLNWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQALVAPLTFGQGTKVEIKR (SEQ ID NO:107)
Вариабельная область тяжелой цепи 6B7
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYAMSWVRQAPGKGLEWVSSIDEMGWQTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAKSAAAFDYWGQGTLVTVSS (SEQ ID NO:108)
Вариабельная область легкой цепи 6F8
DIQMTQSPSSLSASVGDRVTITCRASQSISSYLNWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQALVAPLTFGQGTKVEIKR (SEQ ID NO:109)
Вариабельная область тяжелой цепи 6F8
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYAMSWVRQAPGKGLEWVSSIDEMGWQTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAKSAAAFDYWGQGTLVTVSS (SEQ ID NO:110)
[000200] Иллюстративные конъюгированные антитела и/или активируемые антитела по изобретению включают, например, антитела, которые связываются с мишенью Jagged, например, Jagged-1, Jagged-2 и/или Jagged-1 и Jagged-2 и которые содержат комбинацию области тяжелой цепи и области легкой цепи, которые представляют собой или которые получают из последовательностей тяжелой цепи и легкой цепи, представленных ниже.
Последовательность легкой цепи 4D11:
DIQMTQSPSSLSASVGDRVTITCRASQSISSYLNWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQTVVAPPLFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:111)
Последовательность тяжелой цепи 4D11:
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYAMSWVRQAPGKGLEWVSSIDPEGRQTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAKDIGGRSAFDYWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (SEQ ID NO:112)
Последовательность тяжелой цепи 4D11v2:
EVHLLESGGGLVQPGGSLRLSCAASGFTFSSYAMSWVRQAPGKGLEWVSSIDPEGRQTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAKDIGGRSAFDYWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (SEQ ID NO:113)
Последовательность легкой цепи 4D11v2:
DIQMTQSPSSLSASVGDRVTITCRASQSISSYLNWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQTVVAPPLFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLXKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:114)
[000201] Активируемые антитела и композиции активируемых антител, предоставленные в настоящем описании, содержат по меньшей мере антитело или фрагмент антитела (обобщенно обозначаемый как AB на всем протяжении описания), который специфически связывается с мишенью, например, принадлежащей человеку мишенью, где AB модифицируют маскирующим фрагментом (MM).
[000202] В некоторых вариантах осуществления маскирующий фрагмент выбран для использования с конкретным антителом или фрагментом антитела. Например, подходящие маскирующие фрагменты для использования с антителами, которые связываются с EGFR, включают MM, которые содержат последовательность CISPRG (SEQ ID NO: 167). В качестве неограничивающих примеров, MM может содержать последовательность, такую как CISPRGC (SEQ ID NO:497); CISPRGCG (SEQ ID NO:168); CISPRGCPDGPYVMY (SEQ ID NO:160); CISPRGCPDGPYVM (SEQ ID NO:169), CISPRGCEPGTYVPT (SEQ ID NO:170) и CISPRGCPGQIWHPP (SEQ ID NO:171). Другие подходящие маскирующие фрагменты включают любую из специфичных к EGFR масок, описываемых в публикации PCT № WO 2010/081173, такие как, в качестве неограничивающего примера, GSHCLIPINMGAPSC (SEQ ID NO:172); CISPRGCGGSSASQSGQGSHCLIPINMGAPSC (SEQ ID NO:173); CNHHYFYTCGCISPRGCPG (SEQ ID NO:174); ADHVFWGSYGCISPRGCPG (SEQ ID NO:175); CHHVYWGHCGCISPRGCPG (SEQ ID NO:176); CPHFTTTSCGCISPRGCPG (SEQ ID NO:177); CNHHYHYYCGCISPRGCPG (SEQ ID NO:178); CPHVSFGSCGCISPRGCPG (SEQ ID NO:179); CPYYTLSYCGCISPRGCPG (SEQ ID NO:180); CNHVYFGTCGCISPRGCPG (SEQ ID NO:181); CNHFTLTTCGCISPRGCPG (SEQ ID NO:182); CHHFTLTTCGCISPRGCPG (SEQ ID NO:183); YNPCATPMCCISPRGCPG (SEQ ID NO:184); CNHHYFYTCGCISPRGCG (SEQ ID NO:185); CNHHYHYYCGCISPRGCG (SEQ ID NO:186); CNHVYFGTCGCISPRGCG (SEQ ID NO:187); CHHVYWGHCGCISPRGCG (SEQ ID NO:188); CPHFTTTSCGCISPRGCG (SEQ ID NO:189); CNHFTLTTCGCISPRGCG (SEQ ID NO:190); CHHFTLTTCGCISPRGCG (SEQ ID NO:191); CPYYTLSYCGCISPRGCG (SEQ ID NO:192); CPHVSFGSCGCISPRGCG (SEQ ID NO:193); ADHVFWGSYGCISPRGCG (SEQ ID NO:194); YNPCATPMCCISPRGCG (SEQ ID NO:195); CHHVYWGHCGCISPRGCG (SEQ ID NO:196); C(N/P)H(H/V/F)(Y/T)(F/W/T/л)(Y/G/T/S)(T/S/Y/H)CGCISPRGCG (SEQ ID NO:197); CISPRGCGQPIPSVK (SEQ ID NO:198); CISPRGCTQPYHVSR (SEQ ID NO:199) и/или CISPRGCNAVSGLGS (SEQ ID NO:200).
[000203] Подходящие маскирующие фрагменты для использования с антителами, которые связываются с мишенью Jagged, например, Jagged 1 и/или Jagged 2, включают, в качестве неограничивающего примера, маскирующие фрагменты, которые содержат последовательность, такую как QGQSGQCNIWLVGGDCRGWQG (SEQ ID NO:496); QGQSGQGQQQWCNIWINGGDCRGWNG (SEQ ID NO:201); PWCMQRQDFLRCPQP (SEQ ID NO:202); QLGLPAYMCTFECLR (SEQ ID NO:203); CNLWVSGGDCGGLQG (SEQ ID NO:204); SCSLWTSGSCLPHSP (SEQ ID NO:205); YCLQLPHYMQAMCGR (SEQ ID NO:206); CFLYSCTDVSYWNNT (SEQ ID NO:207); PWCMQRQDYLRCPQP (SEQ ID NO:208); CNLWISGGDCRGLAG (SEQ ID NO:209); CNLWVSGGDCRGVQG (SEQ ID NO:210); CNLWVSGGDCRGLRG (SEQ ID NO:211); CNLWISGGDCRGLPG (SEQ ID NO:212); CNLWVSGGDCRDAPW (SEQ ID NO:213); CNLWVSGGDCRDLLG (SEQ ID NO:214); CNLWVSGGDCRGLQG (SEQ ID NO:215); CNLWLHGGDCRGWQG (SEQ ID NO:216); CNIWLVGGDCRGWQG (SEQ ID NO:217); CTTWFCGGDCGVMRG (SEQ ID NO:218); CNIWGPSVDCGALLG (SEQ ID NO:219); CNIWVNGGDCRSFEG (SEQ ID NO:220); YCLNLPRYMQDMCWA (SEQ ID NO:221); YCLALPHYMQADCAR (SEQ ID NO:222); CFLYSCGDVSYWGSA (SEQ ID NO:223); CYLYSCTDSAFWNNR (SEQ ID NO:224); CYLYSCNDVSYWSNT (SEQ ID NO:225); CFLYSCTDVSYW (SEQ ID NO: 226); CFLYSCTDVAYWNSA (SEQ ID NO:227); CFLYSCTDVSYWGDT (SEQ ID NO:228); CFLYSCTDVSYWGNS (SEQ ID NO:229); CFLYSCTDVAYWNNT (SEQ ID NO:230); CFLYSCGDVSYWGNPGLS (SEQ ID NO:231); CFLYSCTDVAYWSGL (SEQ ID NO:232); CYLYSCTDGSYWNST (SEQ ID NO:233); CFLYSCSDVSYWGNI (SEQ ID NO:234); CFLYSCTDVAYW (SEQ ID NO:235); CFLYSCTDVSYWGST (SEQ ID NO:236); CFLYSCTDVAYWGDT (SEQ ID NO:237); GCNIWLNGGDCRGWVDPLQG (SEQ ID NO:238); GCNIWLVGGDCRGWIGDTNG (SEQ ID NO:239); GCNI WL V GGDCRG WIED SN G (SEQ ID NO:240); GCNIWANGGDCRGWIDNIDG (SEQ ID NO:241); GCNIWLVGGDCRGWLGEAVG (SEQ ID NO:242); GCNIWLVGGDCRGWLEEAVG (SEQ ID NO:243); GGPALCNIWLNGGDCRGWSG (SEQ ID NO:244); GAPVFCNIWLNGGDCRGWMG (SEQ ID NO:245); GQQQWCNIWINGGDCRGWNG (SEQ ID NO:246); GKSEF CNIWLN GGDCRG WIG (SEQ ID NO:247); GTPGGCNIWANGGDCRGWEG (SEQ ID NO:248); GASQYCNLWINGGDCRGWRG (SEQ ID NO:249); GCNIWLVGGDCRPWVEGG (SEQ ID NO:250); GCNIWAVGGDCRPFVDGG (SEQ ID NO:251); GCNIWLNGGDCRAWVDTG (SEQ ID NO:252); GCNIWIVGGDCRPFINDG (SEQ ID NO:253); GCNIWLNGGDCRPVVFGG (SEQ ID NO:254); GCNIWLSGGDCRMFMNEG (SEQ ID NO:255); GCNIWVNGGDCRSFVYSG (SEQ ID NO:256); GCNIWLNGGDCRGWEASG (SEQ ID NO:257); GCNIWAHGGDCRGFIEPG (SEQ ID NO:258); GCNIWLNGGDCRTFVASG (SEQ ID NO:259); GCNIWAHGGDCRGFIEPG (SEQ ID NO:260); GFLENCNIWLNGGDCRTG (SEQ ID NO:261); GIYENCNIWLNGGDCRMG (SEQ ID NO:262) и/или GIPDNCNIWINGGDCRYG (SEQ ID NO:263).
[000204] Подходящие маскирующие фрагменты для использования с антителами, которые связываются с мишенью интерлейкин 6, например, рецептором интерлейкина 6 (IL-6R), включают, в качестве неограничивающего примера, маскирующие фрагменты, которые содержат последовательность, такую как QGQSGQYGSCSWNYVHIFMDC (SEQ ID NO:264); QGQSGQGDFDIPFPAHWVPIT (SEQ ID NO:265); QGQSGQMGVPAGCVWNYAHIFMDC (SEQ ID NO:266); YRSCNWNYVSIFLDC (SEQ ID NO:267); PGAFDIPFPAHWVPNT (SEQ ID NO:268); ESSCVWNYVHIYMDC (SEQ ID NO:269); YPGCKWNYDRIFLDC (SEQ ID NO:270); YRTCSWNYVGIFLDC (SEQ ID NO:271); YGSCSWNYVHIFMDC (SEQ ID NO:161); YGSCSWNYVHIFLDC (SEQ ID NO:272); YGSCNWNYVHIFLDC (SEQ ID NO:273); YTSCNWNYVHIFMDC (SEQ ID NO:274); YPGCKWNYDRIFLDC (SEQ ID NO:275); WRSCNWNYAHIFLDC (SEQ ID NO:276); WSNCHWNYVHIFFDC (SEQ ID NO:277); DRSCTWNYVRISYDC (SEQ ID NO:278); SGSCKWDYVHIFFDC (SEQ ID NO:279); SRSCIWNYAHIHLDC (SEQ ID NO:280); SMSCYWQYERIFLDC (SEQ ID NO:281); YRSCNWNYVSIFLDC (SEQ ID NO:282); SGSCKWDYVHIFLDC (SEQ ID NO:283); YKSCHWDYVHIFLDC (SEQ ID NO:284); YGSCTWNYVHIFMEC (SEQ ID NO:285); FSSCNWNYVHIFLDC (SEQ ID NO:286); WRSCNWNYAHIFLDC (SEQ ID NO:287); YGSCQWNYVHIFLDC (SEQ ID NO:288); YRSCNWNYVHIFLDC (SEQ ID NO:289); NMSCHWDYVHIFLDC (SEQ ID NO:290); FGPCTWNYARISWDC (SEQ ID NO:291); XXsCXWXYvhIfXdC (SEQ ID NO:292); MGVPAGCVWNYAHIFMDC (SEQ ID NO:163); RDTGGQCRWDYVHIFMDC (SEQ ID NO:293); AGVPAGCTWNYVHIFMEC (SEQ ID NO:294); VGVPNGCVWNYAHIFMEC (SEQ ID NO:295); DGGPAGCSWNYVHIFMEC (SEQ ID NO:296); AVGPAGCWWNYVHIFMEC (SEQ ID NO:297); CTWNYVHIFMDCGEGEGP (SEQ ID NO:298); GGVPEGCTWNYAHIFMEC (SEQ ID NO:299); AEVPAGCWWNYVHIFMEC (SEQ ID NO:300); AGVPAGCTWNYVHIFMEC (SEQ ID NO:301); SGASGGCKWNYVHIFMDC (SEQ ID NO:302); TPGCRWNYVHIFMECEAL (SEQ ID NO:303); VGVPNGCVWNYAHIFMEC (SEQ ID NO:304); PGAFDIPFPAHWVPNT (SEQ ID NO:305); RGACDIPFPAHWIPNT (SEQ ID NO:306); QGDFDIPFPAHWVPIT (SEQ ID NO:162); XGafDIPFPAHWvPnT (SEQ ID NO:307); RGDGNDSDIPFPAHWVPRT (SEQ ID NO:308); SGVGRDRDIPFPAHWVPRT (SEQ ID NO:309); WAGGNDCDIPFPAHWIPNT (SEQ ID NO:310); WGDGMDVDIPFPAHWVPVT (SEQ ID NO:311); AGSGNDSDIPFPAHWVPRT (SEQ ID NO:312); ESRSGYADIPFPAHWVPRT (SEQ ID NO:313) и/или RECGRCGDIPFPAHWVPRT (SEQ ID NO:314).
[000205] Когда AB модифицируют MM, и он находится в присутствии мишени, специфическое связывание AB своей мишенью снижаются или ингибируется по сравнению со специфическим связыванием AB, не модифицированным MM, или специфическим связыванием исходного AB с мишенью.
[000206] Kd AB, модифицированного MM, к мишени является по меньшей мере в 5, 10, 25, 50, 100, 250, 500, 1000, 2500, 5000, 10000, 50000, 100000, 500000, 1000000, 5000000, 10000000, 50000000 или более или в диапазоне 5-10, 10-100, 10-1,000, 10-10,000, 10-100,000, 10-1000000, 10-10000000, 100-1000100-10000, 100-100000, 100-1000000, 100-10000000, 1000-10000, 1000-10000, 1000-1000000, 1000-10000000, 10000-100000, 10000-1000000, 10000-10000000, 100000-1000000 или 100000-10000000 раз более чем Kd AB, не модифицированного MM, или исходного AB с к мишени. В противоположность этому, аффинность связывания AB, модифицированного MM, к мишени является по меньшей мере в 2, 3, 4, 5, 10, 20, 25, 40, 50, 100, 250, 500, 1000, 2500, 5000, 10000, 50000, 100000, 500000, 1000000, 5000000, 10000000, 50000000 или более или в диапазоне 5-10, 10-100, 10-1000, 10-10000, 10-100000, 10-1000000, 10-10000000, 100-1000, 100-10000, 100-100000, 100-1000000, 100-10000000, 1000-10000, 1000-100000, 1000-1000000, 1000-10000000, 10000-100000, 10000-1000000, 10000-10000000, 100000-1000000 или 100000-10000000 раз ниже по сравнению с аффинностью связывания AB, не модифицированного MM, или исходного AB к мишени.
[000207] Константа диссоциации (Kd) MM к AB, как правило, является больше, чем Kd AB к мишени. Kd MM к AB может являться по меньшей мере в 5, 10, 25, 50, 100, 250, 500, 1000, 2500, 5000, 10000, 100000, 1000000 или даже 10000000 раз больше, чем Kd AB к мишени. В противоположность этому, аффинность связывания MM к AB, как правило, является ниже, чем аффинность связывания AB к мишени. Аффинность связывания MM к AB может являться по меньшей мере в 5, 10, 25, 50, 100, 250, 500, 1000, 2500, 5000, 10000, 100000, 1000000 или даже 10000000 раз ниже, чем аффинность связывания AB к мишени.
[000208] Когда AB является модифицированным MM и находится в присутствии мишени, специфическое связывание AB со своей мишенью снижается или ингибируется по сравнению со специфическим связыванием AB, не модифицированным MM, или специфическим связыванием исходного AB с мишенью. По сравнению со связыванием с AB, не модифицированным MM, или связыванием исходного AB с мишенью способность AB связываться с мишенью при модификации MM можно восстанавливать по меньшей мере на 50%, 60%, 70%, 80%, 90%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% и даже 100% в течение по меньшей мере 2, 4, 6, 8, 12, 28, 24, 30, 36, 48, 60, 72,84 или 96 часов или 5, 10, 15, 30, 45, 60, 90, 120, 150 или 180 суток, или 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 месяцев, или более при измерении in vivo или в анализе in vitro.
[000209] MM ингибирует связывание AB с мишенью. MM связывается с антигенсвязывающим доменом AB и ингибирует связывание AB с мишенью. MM может стерически ингибировать связывание AB с мишенью. MM может аллостерически ингибирует связывание AB с его мишенью. В этих вариантах осуществления, когда AB является модифицированным или связанным с MM и находится в присутствии мишени, не наблюдают ингибирования или по существу ингибирования связывания AB с мишенью или не более, чем 0,001%, 0,01%, 0,1%, 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 25%, 30%, 35%, 40% или 50% связывания AB с мишенью по сравнению со связыванием AB, не модифицированного MM, исходного AB или AB, не связанного с MM, с мишенью в течение по меньшей мере 2, 4, 6, 8, 12, 28, 24, 30, 36, 48, 60, 72, 84 или 96 часов или 5, 10, 15, 30, 45, 60, 90, 120, 150 или 180 суток, или 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 месяцев или дольше при измерении in vivo или в анализе in vitro.
[000210] Когда AB связывают или модифицируют MM, MM "маскирует" или уменьшает, или иным образом ингибирует специфическое связывание AB с мишенью. Когда AB связывают или модифицируют MM, такое связывание или модификация может приводить к изменению структуры, которое снижает или ингибирует способность AB специфически связываться со своей мишенью.
[000211] AB, связанный или модифицированный MM, можно представить следующими ниже формулами (в порядке от области амино(N)-конца к области карбоксил(C)-концу):
(MM)-(AB)
(AB)-(MM)
(MM)-L-(AB)
(AB)-L-(MM)
где MM представляет собой маскирующий фрагмент, AB представляет собой антитело или фрагмент антитело, и L представляет собой линкер. Во многих вариантах осуществления желательным может являться введение одного или более линкеров, например, гибких линкеров, в композицию таким образом, чтобы обеспечивать гибкость.
[000212] В определенных вариантах осуществления MM не является природным партнером по связыванию AB. В некоторых вариантах осуществления MM не обладает или по существу не обладает гомологией с каким-либо природным партнером по связыванию AB. В некоторых вариантах осуществления MM является не более чем на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75% или 80% подобным любому природному партнеру по связыванию AB. В некоторых вариантах осуществления MM является более чем на 5%,10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75% или 80% идентичным любому природному партнеру по связыванию AB. В некоторых вариантах осуществления MM является не более чем на 25% идентичным любому природному партнеру по связыванию AB. В некоторых вариантах осуществления MM является не более чем на 50% идентичным любому природному партнеру по связыванию AB. В некоторых вариантах осуществления MM является не более чем на 20% идентичным любому природному партнеру по связыванию AB. В некоторых вариантах осуществления MM является не более чем на 10% идентичным любому природному партнеру по связыванию AB.
[000213] В некоторых вариантах осуществления активируемые антитела содержат AB, который является модифицированным MM, а также содержит один или более расщепляемых фрагментов (CM). Такие активируемые антитела обладают активируемым/переключаемым связыванием с мишенью AB. Активируемые антитела, как правило, содержат антитело или фрагмент антитела (AB), модифицированный или связанный с маскирующим фрагментом (MM), и модифицируемый или расщепляемый фрагмент (CM). В некоторых вариантах осуществления CM содержит аминокислотную последовательность, которая служит в качестве субстрата по меньшей мере для одной представляющей интерес матриксной металлопротеазы.
[000214] Элементы активируемых антител располагают таким образом, чтобы MM и CM размешали таким образом, чтобы в расщепленном (или относительно активном) состоянии и в присутствии мишени, AB связывалась с мишенью, при этом в нерасщепленном (или относительно неактивном) состоянии в присутствии мишени специфическое связывание AB со своей мишенью снижается или ингибируется. Специфическое связывание AB со своей мишенью можно снижать в результате ингибирования или маскирования способности AB специфически связываться с мишенью посредством MM.
[000215] Kd AB, модифицированного MM и CM, к мишени является по меньшей мере в 5, 10, 20, 25, 40, 50, 100, 250, 500, 1,000, 2,500, 5,000, 10,000, 50,000, 100,000,500,000, 1000000, 5000000, 10000,000, 50000,000 или более или в диапазоне 5-10, 10-100, 10-1000, 10-10000, 10-100000, 10-1000000, 10-10000000, 100-1000, 100-10000, 100-100000, 100-1000000, 100-10000000, 1000-10000, 1000-100000, 1000-1000000, 1000-10000000, 10000-100000, 10000-1000000, 10000-10000000, 100000-1000000 или 100000-10000000 раз более чем Kd AB, немодифицированного MM и CM, или исходного AB к мишени. В противоположность этому, аффинность связывания AB, модифицированного MM и CM, к мишени является по меньшей мере в 2, 3, 4, 5, 10, 20, 25, 40, 50, 100, 250, 500, 1000, 2500, 5000, 10000, 50000, 100000, 500000, 1000000, 5000000, 10000000, 50000000 или более или в диапазоне 5-10, 10-100, 10-1000, 10-10000, 10-100000, 10-1000000, 10-10000000, 100-1000, 100-10000, 100-100000, 100-1000000, 100-10000000, 1000-10000, 1000-100000, 1000-1000000, 1000-10000000, 10000-100000, 10000-1000000, 10000-10000000, 100000-1000000 или 100000-10000000 раз ниже, чем аффинность связывания AB, не модифицированного MM и CM, или исходного AB к мишени.
[000216] Когда AB является модифицированным MM и CM и находится в присутствии мишени, но не в присутствии модифицирующего средства (например, MMP), специфическое связывание AB со своей мишенью уменьшается или ингибируется по сравнению со специфическим связыванием AB, не модифицированного MM и CM, или исходного AB с мишенью. По сравнению со связыванием исходного AB или связыванием AB, не модифицированного MM и CM, со своей мишенью способность AB связываться с мишенью при модификации MM и CM можно снижать по меньшей мере на 50%, 60%, 70%, 80%, 90%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% и даже 100% в течение по меньшей мере 2, 4, 6, 8, 12, 28, 24, 30, 36, 48, 60, 72, 84 или 96 часов или 5, 10, 15, 30, 45, 60, 90, 120, 150 или 180 суток, или 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 месяцев или дольше при измерении in vivo или в анализе in vitro.
[000217] Как используют в настоящем описании термин расщепленное состояние относится к состоянию активируемых антител подвергаться модификации CM по меньшей мере одной матриксной металлопротеазой. Термин нерасщепленное состояние, как используют в настоящем описании, относится к состоянию активируемых антител при отсутствии расщепления CM MMP. Как указано выше, термин "активируемые антитела" применяют в настоящем описании для обозначения активируемого антитела в его нерасщепленном (нативном) состоянии, а также в его расщепленном состоянии. Как правило, специалисту в данной области очевидно, что в некоторых вариантах осуществления расщепленное активируемое антитело может не содержать MM вследствие расщепления CM протеазой, что приводит к высвобождению по меньшей мере MM (например, когда MM не связан с активируемыми антителами ковалентной связью (например, дисульфидной связью между остатками цистеина).
[000218] Под активируемый или переключаемый подразумевают, что активируемое антитело характеризуется первым уровнем связывания с мишенью, когда в ингибированном, маскированном или нерасщепленном состоянии (т.е. первой конформации) и вторым уровнем связывания с мишенью в неингибированном, немаскированном и/или расщепленном состоянии (т.е. второй конформации), где второй уровень связывания мишени является большим, чем первый уровень связывания. В основном, доступ мишени к AB активируемого антитела является больше в присутствии расщепляющего средства, способного расщеплять CM, чем в отсутствие такого расщепляющего средства. Таким образом, когда активируемое антитело находится в нерасщепленном состоянии, ингибируется связывание AB с мишенью и можно маскировать связывание с мишенью (т.е. первая конформация является такой, что AB не может связываться с мишенью), и в расщепленном состоянии связывание AB с мишенью не ингибируется или не является маскированным.
[000219] CM и AB активируемых антител выбирают таким образом, чтобы AB представлял собой связывающий фрагмент для данной цели, и CM представлял собой субстрат для MMP, которая солокализована с мишенью в участке лечения или участке проведения диагностики у индивидуума. Активируемые антитела, описываемые в настоящем описании, находят конкретное применение, когда, например, MMP, способная расщеплять участок в CM, содержится при относительно высоких уровнях в содержащей мишень ткани участка лечения или участка проведения диагностики по сравнению с тканью, не являющуюся участком лечения (например, в здоровой ткани).
[000220] В некоторых вариантах осуществления активируемые антитела обеспечивают сниженную токсичность и/или нежелательные побочные эффекты, могут иным образом в результате связывания AB в участках, не являющихся участками лечения, если связывание AB с мишенью не маскировали или иным образом не ингибирование.
[000221] В основном, активируемое антитело можно конструировать путем отбора представляющего интерес AB и конструкции оставшейся части активируемого антитела, таким образом, что при ограниченной конформационной свободе MM обеспечивает маскирование AB или уменьшает связывание AB со своей мишенью. Для обеспечения такого функционального признака необходимо учитывать критерии дизайна структуры.
[000222] Предоставлены активируемые антитела, обладающие переключаемым фенотипом желаемого динамического диапазона для связывания с мишенью в ингибированной в сравнении с неингибированной конформацией. Динамический диапазон, как правило, относится к отношению (a) максимального детектируемого уровня параметра при первом наборе условий к (b) минимальному детектируемому значению такого параметра при втором наборе условий. Например, в отношении активируемого антитела динамический диапазон относится к отношению (a) максимального детектируемого уровня связывания белка-мишени с активируемым антителом в присутствии MMP, способной расщеплять CM активируемых антител, к (b) минимальному детектируемому уровню связывания белка-мишени с активируемым антителом в отсутствие протеазы. Динамический диапазон активируемого антитела можно рассчитывать как отношение равновесной константы диссоциации обработки расщепляющим средством (например, ферментом) активируемого антитела к равновесной константе диссоциации обработки расщепляющим средством активируемых антител. Чем больше динамический диапазон активируемого антитела, тем лучше переключаемый фенотип активируемого антитела. Активируемые антитела с относительно более высокими значениями динамического диапазона (например, более 1) обладают более желательными переключаемыми фенотипами, таким образом, что связывание белка-мишени активируемыми антителами происходит в большей степени (например, преимущественно происходит) в присутствии расщепляющего средства (например, фермента), способного расщеплять CM активируемых антител, чем в отсутствие расщепляющего средства.
[000223] Активируемые антитела можно предоставлять в различных структурных конфигурациях. Иллюстративные формулы для активируемых антител предоставлены ниже. Конкретно предусмотрено, что в порядке от N-конца к C-концу AB MM и CM могут располагаться в обратном порядке в активируемом антителе. Также конкретно предусмотрено, что CM и MM могут перекрываться в аминокислотной последовательности, например, таким образом, что CM содержится в MM.
[000224] Например, активируемые антитела можно представить следующей ниже формулой (в порядке от области амино(N)-конца к области карбоксил(C)-концу):
(MM)-(CM)-(AB)
(AB)-(CM)-(MM)
где MM представляет собой маскирующий фрагмент, CM представляет собой расщепляемый фрагмент, и AB представляет собой антитело или его фрагмент. Следует отметить, что хотя MM и CM указывают как отдельные компоненты в указанных выше формулах во всех иллюстративных вариантах осуществления (включая формулы), описываемых в настоящем описании, предусмотрено, что аминокислотные последовательности MM и CM могут перекрываться, например, таким образом, что CM полностью или частично содержится в MM. Кроме того, указанные выше формулы обеспечивают дополнительные аминокислотные последовательности, которые можно располагать на N-конце или C-конце к элементам активируемых антител.
[000225] В определенных вариантах осуществления MM не является природным партнером по связыванию AB. В некоторых вариантах осуществления MM не обладает или по существу не обладает гомологией к какому-либо природному партнеру по связыванию AB. В некоторых вариантах осуществления MM является не более чем на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75% или 80% подобным любому природному партнеру по связыванию AB. В некоторых вариантах осуществления MM является не более чем на 5%,10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75% или 80% идентичным любому природному партнеру по связыванию AB. В некоторых вариантах осуществления MM является не более чем на 50% идентичным любому природному партнеру по связыванию AB. В некоторых вариантах осуществления MM является не более чем на 25% идентичным любому природному партнеру по связыванию AB. В некоторых вариантах осуществления MM является не более чем на 20% идентичным любому природному партнеру по связыванию AB. В некоторых вариантах осуществления MM является не более чем 10% идентичным любому природному партнеру по связыванию AB.
[000226] Во многих вариантах осуществления желательным может являться введение одного или более линкеров, например, гибких линкеров, в конструкцию активируемого антитела так, чтобы обеспечивать гибкость в одном или более участков соединения MM-CM, участков соединения CM-AB или в обоих. Например, AB, MM и/или CM могут не содержать достаточное число остатков (например, Gly, Ser, Asp, Asn, особенно Gly и Ser, в частности Gly) для обеспечения желаемой гибкости. Таким образом, переключаемый фенотип таких конструкций активируемого антитела может получать преимущество от введения одной или более аминокислот для обеспечения гибкого линкера. Кроме того, как описано ниже, в случае, когда активируемое антитело предоставляют в виде конструкции с пространственно затрудненной конформацией, можно эффективно вводить гибкий линкер для облегчения образования и поддержания циклической структуры в нерасщепленном активируемом антителе.
[000227] Например, в определенных вариантах осуществления активируемое антитело содержит одну из следующих ниже формул (где формула ниже представляет собой аминокислотную последовательность в направлении от N-конца к C-концу или в направлении от C-конца к N-концу):
(MM)-L1-(CM)-(AB)
(MM)-(CM)-L2-(AB)
(MM)-L1-(CM)-L2-(AB),
где MM, CM и AB являются такими, как определено выше; где каждый из L1 и L2 независимо и необязательно присутствует или отсутствует, представляет собой один и тот же или отличный гибкие линкеры, которые содержат по меньшей мере 1 гибкую аминокислоту (например, Gly). Кроме того, указанная выше формула обеспечивает дополнительные аминокислотные последовательности, которые можно располагать в N-конце или C-конце к элементам активируемых антител. Примеры включают, но не ограничиваются ими, обеспечивающие направленную доставку молекулы (например, лиганд для клеток рецепторов, содержащихся в ткани-мишени) и увеличивающие время полувыведения из сыворотки молекулы (например, полипептиды, которые связываются с сывороточными белками, таким как иммуноглобулин (например, IgG) или сывороточным альбумином (например, сывороточным альбумином человека (HAS)).
[000228] CM специфически расщепляется по меньшей мере одной MMP со скоростью приблизительно 0,001-1500×104 M-1с-1 или по меньшей мере 0,001, 0,005, 0,01, 0,05, 0,1, 0,5, 1, 2,5, 5, 7,5, 10, 15, 20, 25, 50, 75, 100, 125, 150, 200, 250, 500, 750, 1000, 1250 или 1500×104 M-1с-1.
[000229] Для конкретного расщепления ферментом обеспечивают контактирование фермента и CM. Когда активируемое антитело, содержащее AB, связанный с MM и CM, находится в присутствии мишени и в условиях достаточной активности фермента, CM может расщепляться. Достаточная активность фермента может относиться к способности фермента создавать контакт с CM и обеспечивать расщепление. Легко можно предусматривать, что фермент может находиться в непосредственной близости к CM, но являться неспособным расщеплять вследствие других клеточных факторов или белковых модификаций фермента.
[000230] Линкеры, пригодные для использования в композициях, описываемых в настоящем описании, как правило, представляют собой линкеры, которые обеспечивают гибкость модифицированного AB или активируемых антител для облегчения ингибирования связывания AB с мишенью. Такие линкеры, как правило, обозначают как гибкие линкеры. Подходящие линкеры можно легко отбирать, и они могут являться любой подходящей различной длины, такой как от 1 аминокислоты (например, Gly) до 20 аминокислот, от 2 аминокислот до 15 аминокислот, от 3 аминокислот до 12 аминокислот, включая от 4 аминокислот до 10 аминокислот, от 5 аминокислот до 9 аминокислот, от 6 аминокислот до 8 аминокислот или от 7 аминокислот до 8 аминокислот, и их длина может составлять 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 аминокислот.
[000231] Иллюстративные гибкие линкеры включают полимеры глицина (G)n, полимеры глицин-серина (включая, например, (GS)n, (GSGGS)n (SEQ ID NO:1) и (GGGS)n (SEQ ID NO:2), где n представляет собой целое число по меньшей мере один), полимеры глицин-аланина, полимеры аланин-серина и другие гибкие линкеры, известные в данной области. Полимеры глицина и глицин-серина являются относительно неструктурированными, и, таким образом, могут случить в качестве нейтрального связывающего звена между компонентами. Глицин обеспечивает значительно больше фи-пси пространства даже чем аланин, и является в меньшей степени ограниченным, чем остатки с более длинными боковыми цепями (см. Scheraga, Rev. Computational Chem., 11173-142 (1992)). Иллюстративные гибкие линкеры включают, но не ограничиваются ими, Gly-Gly-Ser-Gly (SEQ ID NO:3), Gly-Gly-Ser-Gly-Gly (SEQ ID NO:4), Gly-Ser-Gly-Ser-Gly (SEQ ID NO:5), Gly-Ser-Gly-Gly-Gly (SEQ ID NO:6), Gly-Gly-Gly-Ser-Gly (SEQ ID NO:7), Gly-Ser-Ser-Ser-Gly (SEQ ID NO:8) и т.п. Как правило, специалисту в данной области известно, что конструкция активируемых антител может содержать линкеры, которые являются полностью или частично гибкими, таким образом, что линкер может включать гибкий линкер, а также один или более участков, которые обеспечивают менее гибкую структуру для обеспечения желаемой структуры активируемых антител.
[000232] В некоторых вариантах осуществления активируемые антитела, описываемые в настоящем описании, также включает средство, конъюгированное с активируемым антителом. В некоторых вариантах осуществления конъюгированное средство представляет собой терапевтическое средство, такое как противовоспалительное и/или антинеопластическое средство. В таких вариантах осуществления средство является конъюгированным с углеводной группой активируемого антитела, например, в некоторых вариантах осуществления, где углеводная группа располагается вне антигенсвязывающей области антитела или антигенсвязывающего фрагмента в активируемом антителе. В некоторых вариантах осуществления средство является конъюгированным с сульфгидрильной группой антитела или антигенсвязывающего фрагмента в активируемом антителе.
[000233] В некоторых вариантах осуществления средство представляет собой цитотоксическое средство, такое как токсин (например, ферментативно активный токсин бактериального, грибкового, растительного или животного происхождения или его фрагменты) или радиоактивный изотоп (т.е. радиоконъюгат).
[000234] В некоторых вариантах осуществления средство представляет собой детектируемую молекулу, такую как, например, метка или другой маркер. Например, средство представляет собой или содержит радиоактивно меченую аминокислоту, одну или более биотинильных группы, которые можно детектировать посредством меченого авидина (например, стрептавидина, содержащего флуоресцентный маркер, или ферментативной активности, которую можно детектировать оптическими или калориметрическими способами), один или более радиоактивных изотопов или радионуклидов, одну или более флуоресцентных меток, одну или более ферментативных меток и/или одно или более хемилюминесцентных средств. В некоторых вариантах осуществления детектируемые молекулы присоединяют посредством спейсерных молекул.
[000235] Изобретение также относится к иммуноконъюгатам, содержащим антитело, конъюгированное с цитотоксическим средством, таким как токсин (например, ферментативно активный токсин бактериального, грибкового, растительного или животного происхождения или его фрагменты) или радиоактивный изотоп (т.е. радиоконъюгат). Подходящие цитотоксические средства включают, например, доластатины и их производные (например, ауристатин E, AFP, MMAF, MMAE, MMAD, DMAF, DMAE). Например, средство представляет собой монометилауристатин E (MMAE) или монометилауристатин D (MMAD). В некоторых вариантах осуществления средство представляет собой средство, выбранное из группы, приведенной в таблице 3. В некоторых вариантах осуществления средство представляет собой доластатин. В некоторых вариантах осуществления средство представляет собой ауристатин или его производное. В некоторых вариантах осуществления средство представляет собой ауристатин E или его производное. В некоторых вариантах осуществления средство представляет собой монометилауристатин E (MMAE). В некоторых вариантах осуществления средство представляет собой монометилауристатин D (MMAD). В некоторых вариантах осуществления средство представляет собой майтанзиноид или производное майтанзиноида. В некоторых вариантах осуществления средство представляет собой DM1 или DM4. В некоторых вариантах осуществления средство представляет собой дуокармицин или его производное. В некоторых вариантах осуществления средство представляет собой калихимицин или его производное. В некоторых вариантах осуществления средство представляет собой пирролобензодиазепин.
[000236] В некоторых вариантах осуществления средство связывают с AB с использованием линкера малеинимид-капроил-валин-цитруллин или линкера малеинимид-PEG-валин-цитруллин. В некоторых вариантах осуществления средство связывают с AB с использованием линкера малеинимид-капроил-валин-цитруллин. В некоторых вариантах осуществления средство связывают с AB с использованием линкера малеинимид-PEG-валин-цитруллин. В некоторых вариантах осуществления средство представляет собой монометилауристатин D (MMAD), связанный с AB с использованием линкера малеинимид-PEG-валин-цитруллин-пара-аминобензилоксикарбонил, и такую конструкцию нагрузки линкером в настоящем описании обозначают как "vc-MMAD". В некоторых вариантах осуществления средство представляет собой монометилауристатин E (MMAE), связанный с AB с использованием линкера малеинимид-PEG-валин-цитруллин-пара-аминобензилоксикарбонил, и такую конструкцию нагрузки линкером обозначают в настоящем описании как "vc-MMAE". Структуры vc-MMAD и vc-MMAE представлены ниже:
vc-MMAD:
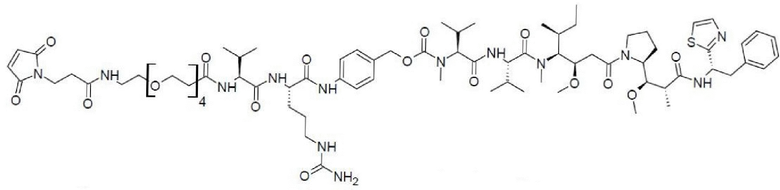
vc-MMAE:
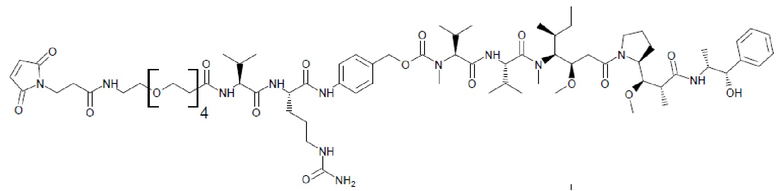
[000237] Ферментативно активные токсины и их фрагменты, которые можно использовать, включают цепь A дифтерийного токсина, несвязывающиеся актвиные фрагменты дифтерийного токсина, цепь A экзотоксина (из Pseudomonas aeruginosa), цепь A рицина, цепь A абрина, цепь A модессин, альфа-сарцину, белки Aleurites fordii, диантиновые белок белки, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор из Momordica Charantia, курцин, кротин, ингибитор из Sapaonaria Officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трихотецины. Ряд радионуклидов является доступным для получения радиоконъюгированных антител. Примеры включают 212Bi, 131I, 131In, 90Y и 186Re.
[000238] Конъюгаты антитела и цитотоксического средства получают с использованием ряда бифункциональных связывающих белок средств, таких как N-сукцинимидил-3-(2-пиридилдитиол)пропионат (SPDP), иминотиолан (IT), бифункциональные производные имидоэфиров (таких как диметил адипимидат HCL), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глютаральдегид), бис-азидосоединения (такие как бис(пара-азидобензоил)гександиамин), производные бис-диазония (такие как бис(пара-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, иммунотоксин рицин можно получать, как описано у Vitetta et al., Science, 238: 1098 (1987). Меченная углеродом 14 1-изотиоцианатобензил-3-метилдиэтилентриаминпентауксусная кислота (MX-DTPA) представляет собой иллюстративное хелатирующее средство для конъюгации радионуклеотида с антителом. (См. WO94/11026).
[000239] В таблице 3 приведены некоторые иллюстративные фармацевтические средства, которые можно применять в описываемом в настоящем описании изобретении, но она не предназначена являться каким-либо образом исчерпывающим списком.
Иллюстративные фармацевтические средства для конъюгации
Производные O6-бензилгуанина
[000240] Специалистам в данной области понятно, что целый ряд возможных молекул можно связывать с получаемыми антителами по изобретению. (См., например, "Conjugate Vaccines", Contributions to Microbiology and Immunology, J.M. Cruse and R.E. Lewis, Jr (eds), Carger Press, New York, (1989), полное содержание которой включено в настоящее описание посредством ссылки).
[000241] Связывание можно проводить любой химической реакцией, которая связывает две молекулы при условии, что антитело и другая молекула сохраняют свои соответствующие виды активности. Такое связывание может включать химические механизмы, например, ковалентное связывание, аффинное связывание, интеркаляцию, координационное связывание и комплексообразование. Тем не менее, в некоторых вариантах осуществления связывание представляет собой ковалентное связывание. Ковалентное связывание получают прямой реакцией конденсации существующих боковых цепей или введением внешних мостиковых молекулы. Многие бивалентные или поливалентные связывающие средства являются пригодными для связывания белковых молекул, таких как антитела по настоящему изобретению, с другими молекулами. Например, репрезентативные связывающие средства могут включать органические соединения, такие как сложные тиоэфиры, карбодиимиды, сложные эфиры сукцинимида, диизоцианаты, глутаральдегид, диазобензолы и гексаметилендиамины. Этот список не предназначен являться исчерпывающим в отношении различных классов связывающих средств, известных в данной области, а наоборот является иллюстративным в отношении наиболее распространенных связывающих средств. (См. Killen and Lindstrom, Jour. Immun., 133:1335-2549 (1984); Jansen et al., Immunological Reviews, 62:185-216 (1982); и Vitetta et al., Science, 238:1098 (1987).
[000242] В некоторых вариантах осуществления в дополнение к композициям и способам, предоставленные в настоящем описании, конъюгированное активируемое антитело также можно модифицировать для сайт-специфической конъюгации путем модифицированных аминокислотных последовательностей, вводимых или иным образом включаемых в последовательность активируемого антитела. Такие модифицированные аминокислотные последовательности конструируют для обеспечения возможности контролируемого размещения и/или дозирования конъюгированного средства в конъюгированном активируемом антителе. Например, активируемое антитело можно конструировать для введения замен цистеина в положениях на легкой и тяжелой цепях, которые предоставляют реакционноспособные тиольные группы и не оказывают отрицательного влияния на сворачивание и сборку белка, не изменяют связывание антигена. В некоторых вариантах осуществления активируемое антитело можно конструировать, чтобы включать или иным образом вводить один или более неприродных аминокислотных остатков в активируемое антитело для обеспечения подходящих участков для конъюгации. В некоторых вариантах осуществления активируемое антитело можно конструировать, чтобы включать или иным образом вводить ферментативно активируемые пептидные последовательности в последовательность активируемого антитела.
[000243] Подходящие линкеры описаны в литературе. (См., например, Ramakrishnan S. et al., Cancer Res., 44:201-208 (1984), в которой описано использование MBS (сложный эфир M-малеимидобензоил-N-гидроксисукцинимида), патент США № 5030719, в котором описано использование галогенированного производного ацетилгидразида, связанного с антителом посредством олигопептидного линкера. В некоторых вариантах осуществления подходящие линкеры включают: (i) EDC (1-этил-3-(3-диметиламинопропил)карбодиимидгидрохлорид; (ii) SMPT (4-сукцинимидилоксикарбонил-альфа-метил-альфа-(2-придилдитио)толуол (Pierce Chem. Co., кат. (21558G); (iii) SPDP (сукцинимидил-6-[3-(2-пиридилдитио)пропионамидо]гексаноат (Pierce Chem. Co., каталожный №21651G); (iv) сульфо-FC-SPDP (сульфосукцинимидил-6-[3-(2-пиридилдитиопропианамид]гексаноат (Pierce Chem. Co. кат. №2165-G) и (v) сульфо-NHS (N-гидроксисульфосукцинимид: Pierce Chem. Co., кат. №24510), конъюгированный с EDC. Дополнительные линкеры включают, но не ограничиваются ими, SMCC, сульфо-SMCC, SPDB или сульфо-SPDB.
[000244] Линкеры, описанные выше, содержат компоненты, которые обладают различными свойствами, таким образом, приводя к конъюгатам с различными физико-химическими свойствами. Например, сложные эфиры сульфо-NHS и алкилкарбоксилатов являются более устойчивыми, чем сложные эфиры сульфо-NHS и ароматических карбоксилатов. Содержащие NHS-сложные эфир линкеры являются менее растворимыми по сравнению со сложными эфирами сульфо-NHS. Кроме того, линкер SMPT содержит пространственно-затрудненную дисульфидную связь и моет образовывать конъюгаты с повышенной стабильностью. В основном, дисульфидные связи являются менее стабильными по сравнению с другими связями, т.к. дисульфидная связь расщепляется in vitro, что приводит к меньшей доступности конъюгата. В частности, сульфо-NHS может усиливать стабильность карбодиимидного связывания. Карбодиимидного связывания (такое как EDC) при использовании в сочетании с сульфо-NHS образует сложные эфиры, которые являются более устойчивыми к гидролизу, чем реакция связывания одного карбодиимида.
[000245] В некоторых вариантах осуществления линкеры являются расщепляемыми. В некоторых вариантах осуществления линкеры являются нерасщепляемыми. В некоторых вариантах осуществления содержатся два или более линкера. Два или более линкеры являются одинаковыми, т.е. расщепляемыми или нерасщепляемыми, или два или более линкера являются различными, т.е. по меньшей мере один расщепляемый и по меньшей мере один нерасщепляемый.
[000246] В настоящем изобретении используют несколько способов для присоединения средств к AB: (a) присоединение к углеводным группам AB или (b) присоединение к сульфгидрильным группам AB, или (c) присоединение к аминогруппам AB, или (d) присоединение к карбоксилатным группам AB. В соответствии с изобретением AB можно ковалентно присоединять к средству через промежуточный линкер, содержащий по меньшей мере две реакционноспособные группы, одну для взаимодействия с AB и одну для взаимодействия со средством. Линкер, который может содержать любое совместимое органическое соединение, можно выбирать таким образом, чтобы взаимодействие с AB (или средством) не оказывало отрицательного влияния на реактивность и селективность AB. Кроме того, присоединение линкера к средству может не нарушать активность средства. Подходящие линкеры для взаимодействия с окисленными антителами или окисленными фрагментами антител включают линкеры, содержащие амин, выбранный из группы, состоящей из первичного амина, вторичного амина, гидразина, гидразида, гидроксиламина, фенилгидразина, семикарбазидных и тиосемикарбазидных групп. Такие реакционноспособные функциональные группы могут существовать в качестве части структуры линкера, или их можно вводить подходящей химической модификацией линкеров, не содержащих такие группы.
[000247] По настоящему изобретению подходящие линкеры для присоединения к восстановленным AB включают линкеры, содержащие определенные реакционноспособные группы, способные взаимодействовать с сульфгидрильной группой восстановленного антитела или фрагмента. Такие реакционноспособные группы включают, но не ограничиваются ими: реакционноспособные галоалкильные группы (включая, например, галоацетильные группы), пара-меркурбензоатные группы и группы, способные к реакции присоединения по Михаэлю (включая, например, малеинимиды и группы типа, описываемого Mitra and Lawton, 1979, J. Amer. Chem. Soc. 101: 3097-3110).
[000248] По настоящему изобретению подходящие линкеры для присоединения к окисленным или восстановленным Ab включают линкеры, содержащие определенные функциональные группы, способные взаимодействовать с первичными аминогруппами, содержащимися в немодифицированных остатках лизина в AB. Такие реакционноспособные группы включают, но не ограничиваются ими, сложные эфиры NHS и карбоновой кислоты или угольной кислоты, сложные эфиры сульфо-NHS и карбоновой кислоты или угольной кислоты, сложные эфиры 4-нитрофенила и карбоновой кислоты или угольной кислоты, сложные эфиры пентафторфенила и карбоновой кислоты или угольной кислоты, ацилимидазолы, изоцианаты и изотиоцианаты.
[000249] По настоящему изобретению подходящие линкеры для присоединения к окисленным или восстановленным Ab включают линкеры, содержащие определенные функциональные группы, способные взаимодействовать с группами карбоновой кислоты, содержащимися в остатках аспартата или глутамата остатки в AB, которые активировали подходящими реагентами. Подходящие активирующие реагенты включают EDC с добавлением NHS или сульфо-NHS или без добавления, и другие дегидратирующие средства, используемые для образования карбоксамида. В этих случаях функциональные группы, содержащиеся в подходящих линкерах, включают первичные и вторичные амины, гидразины, гидроксиламины и гидразиды.
[000250] Средство можно присоединять к линкеру, до того как линкер присоединяют к AB или после. В определенных применениях желательным может являться сначала получать промежуточное соединение AB-линкер, в котором линкер не содержит связанное средство. В зависимости от конкретного применения затем можно ковалентно присоединять конкретное средство к линкеру. В некоторых вариантах осуществления AB сначала присоединяют к MM, CM и связанным линкерам, а затем присоединяют к линкеру для целей конфигурации.
[000251] Разветвленные линкеры: В конкретных вариантах осуществления используют разветвленные линкеры, которые содержат множественные участки для присоединения средств. Для линкеров с множественными участками единственное ковалентное присоединение к AB приводит к промежуточному соединению AB-линкер, способному связываться со средством на нескольких участках. Участки могут представлять собой альдегидные или сульфгидрильные группы или могут представлять собой любой химический участок, к которому можно присоединять средства.
[000252] В некоторых вариантах осуществления можно получать более высокую специфическую активность (или более высокое отношение средств к AB) присоединением линкера с одним участком с совокупностью участков на AB. Такую совокупность участков можно вводить в AB любым из двух способов. В первом можно получатель много альдегидных групп и/или сульфгидрильных групп в одном и том же AB. Во втором можно присоединять к альдегиду или сульфгидрилу AB "разветвленный линкер", содержащий множественные функциональные участки для последующего присоединения к линкерам. Функциональные участки разветвленного линкера или линкер с множественными участками может представлять собой альдегидные или сульфгидрильные группы или может представлять собой любой химический участок, к которому можно присоединять линкеры. Еще более высокие виды специфической активности можно получать комбинацией этих двух подходов, т.е. присоединением линкеров с множественными участками к нескольким участках на AB.
[000253] Расщепляемые линкеры: Пептидные линкеры, которые являются чувствительными к расщеплению ферментами системы комплемента, такими как, но, не ограничиваясь ими, урокиназу, тканевой активатор плазминогена, трипсин, плазмин или другой фермент, обладающий протеолитической активностью, можно использовать в одном из вариантов осуществления настоящего изобретения. В соответствии с одним из способом по настоящего изобретению средство присоединяют через линкер, чувствительный к расщеплению комплементом. Антитело выбирают из класса, который может активировать комплемент. Таким образом, конъюгат антитело-средство активирует каскад реакций комплемента и высвобождает средство в участке-мишени. В соответствии с другим способом по настоящему изобретению средство присоединяют через линкер, чувствительный к расщеплению ферментами, обладающими протеолитической активностью, такими как урокиназа, тканевой активатор плазминогена, плазмин или трипсин. Такие расщепляемые линкеры являются пригодными в конъюгированных активируемых антителах, которые содержат внеклеточный токсин, например, в качестве неограничивающего примера, любой внеклеточный токсины, представленный в таблице 3.
[000254] Неограничивающие примеры последовательностей расщепляемого линкера приведены в таблице 4.
Иллюстративные линкерные последовательности для конъюгации
[000255] Кроме того, средства можно присоединять через дисульфидные связи (например, дисульфидные связи на молекуле цистеина) к AB. Вследствие того, что многие опухоли естественным образом высвобождают высокие уровни глутатиона (восстановитель), он может восстанавливать дисульфидные связи с последующим высвобождением средства в участке доставки. В определенных конкретных вариантах осуществления восстановитель, который модифицирует CM, также модифицирует линкер конъюгированного активируемого антитела.
[000256] Спейсеры и расщепляемые элементы: В некоторых вариантах осуществления необходимым может являться конструкция линкера, таким образом, чтобы оптимизировать расстояние между средством и AB активируемого антитела. Это можно проводить с использованием линкера общей структуры:
W-(CH2)n-Q
где
W представляет собой -NH-CH2- или -CH2-;
Q представляет собой аминокислоту, пептид, и
n представляет собой целое число от 0 до 20.
[000257] В некоторых вариантах осуществления линкер может содержать спейсерный элемент и расщепляемый элемент. Спейсерный элемент служит для расположения расщепляемого элемента в стороне от ядра AB, таким образом, что расщепляемый элемент является в большей степени доступным для фермента, обеспечивающего расщепление. Определенные разветвленные линкеры, описанные выше, могут служить в качестве спейсерных элементов.
[000258] На всем протяжении этого описания следует понимать, что присоединение линкера к средству (или спейсерного элемента к расщепляемому элементу или расщепляемого элемента к средству) необязательно должно представлять собой конкретный способ присоединения или реакцию. Приемлемой является любая реакция, обеспечивающая продукт подходящей стабильности и биологической совместимости.
[000259] Комплемент сыворотки и выбор линкеров: В соответствии с одним из способов по настоящему изобретению, когда желательным является высвобождение средства, используют AB, который представляет собой антитело класса, который может активировать комплемент. Получаемый конъюгат сохраняет способность связывать антиген и активировать каскад реакций комплемента. Таким образом, по этому варианту осуществления настоящего изобретения средство присоединяют к одному концу расщепляемого линкера или расщепляемого элемента, и другой конец линкерной группы присоединяют к конкретному участку на AB. Например, если средство содержит гидроксигруппу или аминогруппу, его можно присоединять к C-концу пептида, аминокислоты или другого подходящим образом выбранного линкера через сложноэфирную или амидную связь соответственно. Например, такие средства можно присоединять к линкерному пептиду посредством реакции с карбодиимидом. Если средство содержит функциональные группы, которые препятствуют присоединению к линкеру, такие препятствующие функциональные группы можно блокировать перед присоединением и снимать блокирование после получения конъюгата продукта или промежуточного соединения. Затем используют противоположный или амино-конец линкера непосредственно или после дополнительной модификации для связывания с AB, который способен активировать комплемент.
[000260] Линкеры (или спейсерные элементы линкеров) могут являться любой желаемой длины, один конец, которых может быть ковалентно присоединен к конкретным участкам на AB активируемого антитела. Другой конец линкера или спейсерного элемента можно присоединять к аминокислотному или пептидному линкеру.
[000261] Таким образом, когда такие конъюгаты связываются с антигеном в присутствии комплемента амидная или сложноэфирная связь, которая присоединяет средство к линкеру, расщепляется, что приводит к высвобождению средства в его активной форме. Такие конъюгаты при введении индивидууму выполняют доставку и высвобождение средства в участке-мишени и являются особенно эффективными для доставки in vivo фармацевтических средств, антибиотиков, антиметаболитов, антипролиферативных средств и т.п., как приведено в таблице 3, но не ограничено этим.
[000262] Линкеры для высвобождения без активации комплемента: В еще одном другом применении направленной доставки желательным может являться высвобождение средства без активации комплемента, т.к. активации каскада реакций комплемента в конечном итоге приводит к лизису клетки-мишени. Таким образом, этот подход является пригодным, когда доставка и высвобождение средства следует проводить без уничтожения клетки-мишени. Такая цель возникает, когда желательной является доставка клеточных медиаторов, таких как гормоны, ферменты, кортикостероиды, нейромедиаторы, гены или ферменты, в клетки-мишени. Эти конъюгаты можно получать присоединением средства к AB, который не способен активировать комплемент, через линкер, который является слабо чувствительным к расщеплению протеазами сыворотки. Когда такой конъюгат вводят индивидууму, быстро образуются комплексы антиген-антитело, при этом расщепление средства происходит медленно, таким образом, приводя к высвобождению соединения в участке-мишени.
[000263] Биохимические кросс-линкеры: В некоторых вариантах осуществления активируемое антитело можно конъюгировать с одним или более терапевтических средств с использованием определенных биохимических кросс-линкеров. Поперечно-сшивающие реагенты образуют молекулярные мостики, которые связывают функциональные группы двух различных молекул. Для поэтапного связывания двух различных белков можно использовать гетеробифункциональные кросс-линкеры, которые предотвращают нежелательное образование гомополимеров.
[000264] Также пригодными являются пептидильные линкеры, расщепляемые лизосомальными протеазами, например, Val-Cit, Val-Ala или другие дипептиды. Кроме того, можно использовать неустойчивые в кислой среде линкеры, расщепляемые в среде с низким pH лизосомы, например: простой бис-сиалильный эфир. Другие подходящие линкеры включают неустойчивые к катепсину субстраты, в частности субстраты, для которых демонстрируют оптимальное действие при кислом pH.
[000265] Иллюстративные гетеробифункциональные кросс-линкеры указаны в таблице 5.
Иллюстративные гетеробифункциональные кросс-линкеры
[000266] Нерасщепляемые линкеры или прямое присоединение: В некоторых вариантах осуществления изобретения конъюгат можно конструировать так, чтобы доставлять средство к мишени, но без высвобождения. Это можно проводить присоединением средства к AB непосредственно или посредством нерасщепляемого линкера.
[000267] Такие нерасщепляемые линкеры могут содержать аминокислоты, пептиды, D-аминокислоты или другие органические соединения, которые можно модифицировать для введения функциональных групп, которые затем можно использовать в присоединении к AB способами, описываемыми в настоящем описании. Общая формула для такого органического линкера может представлять собой
W-(CH2)n-Q
где
W представляет собой -NH-CH2- или -CH2-;
Q представляет собой аминокислоту, пептид, и
n представляет собой целое число от 0 до 20.
[000268] Нерасщепляемые конъюгаты: В некоторых вариантах осуществления соединение можно присоединять к AB, которые не активируют комплемент. При использовании AB, которые неспособны активировать комплемент, такое присоединение можно проводить с использованием линкеров, которые являются чувствительными к расщеплению активируемым комплементом, или с использованием линкеров, которые не являются чувствительными к расщеплению активируемым комплементом.
[000269] Антитела, описываемые в настоящем описании, также можно формулировать в виде иммунолипосом. Липосомы, содержащие антитело, получают известными в данной области способами, такими как описано в Epstein et al., Proc. Natl. Acad. Sci. USA, 82: 3688 (1985); Hwang et al., Proc. Natl. Acad. Sci. USA, 77: 4030 (1980) и в патентах США № 4485045 и 4544545. Липосомы с увеличенным временем кровообращения описаны в патенте США № 5013556.
[000270] Особенно пригодные липосомы можно получать способом обращенно-фазового выпаривания с липидной композицией, содержащей фосфатидилхолин, холестерин и дериватизированный PEG фосфатидилэтаноламин (PEG-PE). Липосомы продавливают через фильтры с определенным размером пор с получением липосом с желаемым диаметром. Фрагменты Fab' антитела по настоящему изобретению можно конъюгировать с липосомами, как описано у Martin et al., J. Biol. Chem., 257: 286-288 (1982), посредством реакции обмена дисульфидами.
Определения
[000271] Если не определено иное, научные и технические термины, используемые применительно к настоящему изобретению, имеют значения, которые общепринято понятны специалистам в данной области. Термин объект в единственном числе относится к одному или более таких объектов. Например, соединение относится к одному или более соединений. Таким образом, термины "один или более" и "по меньшей мере один" можно использовать взаимозаменяемо. Кроме того, если из контекста не следует иное, термины в единственном числе включают множественные числа, и термины во множественном числе включают единственное число. Как правило, номенклатуры, используемые применительно к и техники культивирования клеток и тканей, молекулярной биологии и химии белков и олигонуклеотидов или полинуклеотидов, и гибридизации, описываемые в настоящем описании, представляют собой номенклатуры и техники, хорошо известные и общепринятые в данной области. Используют стандартные техники для рекомбинантной ДНК, синтеза олигонуклеотидов и культивирования тканей, и трансформации (например, электропорацию, липофекцию). Ферментативные реакции и способы очистки проводят по инструкциям производителя или как общепринято проводят в данной области, или как описано в настоящем описании. Указанные выше техники и способы, ка правило, проводят в соответствии с общепринятыми способами, хорошо известными в данной области, и как описано в различных общих и более конкретных ссылках, которые цитируются и обсуждаются на всем протяжении настоящего описания. См., например, Sambrook et al., Molecular Cloning: A Laboratory Manual (2d ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1989)). Номенклатуры, используемые применительно к и лабораторные способы и техники аналитической химии, химии органического синтеза и медицинской и фармацевтической химии, описываемые в настоящем описании, являются хорошо известными и общепринятыми в данной области. Используют стандартные способы для химического синтеза, химических анализов, фармацевтического препарата, состава и доставки, и лечения пациентов.
[000272] Как используют в соответствии с настоящим изобретением, если не указано иное, следует понимать, что следующие ниже термины имеют следующие ниже значения.
[000273] Как используют в настоящем описании, термин "антитело" относится к молекулам иммуноглобулина и иммунологически активным частям молекул иммуноглобулина (Ig), т.е. молекулам, которые содержат антигенсвязывающий участок, который специфически связывается с (иммунологически взаимодействует с) антигеном. Под "специфически связывается" или "иммунологически взаимодействует с" или "иммуноспецифически связывается " подразумевают, что антитело взаимодействует с одной или более антигенных детерминант желаемого антигена и не взаимодействует с другими полипептидами или связывается со значительно меньшей аффинностью (Kd>10-6). Антитела включают, но не ограничиваются ими, поликлональное, моноклональное, химерное, доменное антитело, одноцепочечные фрагменты, фрагменты Fab, и F(ab')2, экспрессионную библиотеку scFv и Fab.
[000274] Известно, что основная структурная единица антитела содержит тетрамер. Каждый тетрамер состоит из двух идентичных пар полипептидных цепей, где каждая пара содержит одну "легкую" (приблизительно 25 кДа) и одну "тяжелую" цепь (приблизительно 50-70 кДа). Амино-концевой участок каждой цепи содержит вариабельную область приблизительно от 100 до 110 или более аминокислот, преимущественно обеспечивающих распознавание антигена. Карбокси-концевой участок каждой цепи определяет константную область преимущественно обеспечивающую эффекторную функцию. В основном, молекулы антител, получаемые от людей, относятся к любому из классов IgG, IgM, IgA, IgE и IgD, которые отличаются друг от друга природой тяжелой цепи, содержащейся в молекуле. Определенные классы также включают подклассы, такие как IgG1, IgG2 и другие. Кроме того, у людей легкая цепь может представлять собой каппу-цепь или лямбду-цепь.
[000275] Термин "моноклональное антитело" (mAb) или "композиция моноклональных антител", как используют в настоящем описании, относится к популяции молекул антител, которая содержит только один тип молекулы антител, состоящей из уникального продукта гена легкой цепи и уникального продукта гена тяжелой цепи. В частности, определяющие комплементарность области (CDR) моноклонального антитела являются идентичными во всех популяциях молекул. MAb содержат антигенсвязывающий участок, способный иммунологически взаимодействовать с конкретным эпитопом антигена, характеризуемым уникальной аффинностью связывания к нему.
[000276] Термин "антигенсвязывающий участок" или "связывающий участок" относится к части молекулы иммуноглобулина, которая участвует в связывании антигена. Антигенсвязывающий участок образован аминокислотными остатками N-концевыми вариабельными ("V") областями тяжелой ("H") и легкой ("L") цепей. Высокодивергентные участки в V-областях тяжелой и легкой цепей, обозначаемые как "гипервариабельные области", располагаются между более консервативными фланкирующими участками, известными как "каркасные области" или "FR". Таким образом, термин "FR" относится к аминокислотным последовательностям, которые в природе встречаются между гипервариабельными областями в иммуноглобулинах и располагаются рядом с ними. В молекуле антитела три гипервариабельные области легкой цепи и три гипервариабельные области тяжелой цепи располагаются относительно друг друга в трех мерном пространстве с образованием антигенсвязывающей поверхности. Антигенсвязывающая поверхность является комплементарной трехмерной поверхности связанного антигена, и три гипервариабельные области каждой тяжелой и легкой цепей обозначают как "определяющие комплементарность области" или "CDR". Соотнесение аминокислот к каждому домену проводят в соответствии с определениями Kabat Sequences of Proteins of Immunological Interest (National Institutes of Health, Bethesda, Md. (1987 и 1991)), или Chothia&Lesk J. Mol. Biol., 196:901-917 (1987), Chothia et al., Nature, 342:878-883 (1989).
[000277] Как используют в настоящем описании, термин "эпитоп" включает любую белковую детерминанта, способную специфически связываться с иммуноглобулином, scFv или T-клеточным рецептором. Термин "эпитоп" включает любую белковую детерминанту, способную специфически связываться с иммуноглобулином или T-клеточным рецептором. Эпитопные детерминанты, как правило, состоят из химически активных групп на поверхности молекул, таких как аминокислоты или боковые цепи сахаров, и, как правило, обладают конкретными характеристиками трехмерной структуры, а также конкретными характеристиками заряда. Например, антитела можно индуцировать против N-концевых или C-концевых пептидов полипептида. Считают, что антитело специфически связывается с антигеном, когда константа диссоциации составляет ≤1 мкМ; в некоторых вариантах осуществления ≤100 нМ и в некоторых вариантах осуществления ≤10 нМ.
[000278] Как используют в настоящем описании, термины "специфическое связывание", "иммунологическое связывание" и "свойства иммунологического связывания" относятся к нековалентным взаимодействиям такого типа, который возникает между молекулой иммуноглобулина и антигеном, к которому иммуноглобулин является специфичным. Интенсивность или аффинность взаимодействий иммунологического связывания можно выражать через константу диссоциации (Kd) взаимодействия, где меньшая Kd означает большую аффинность. Свойства иммунологического связывания выбранных полипептидов можно количественно оценивать хорошо известными в данной области способами. Один из таких способов включает измерение скоростей образования комплекса антигенсвязывающий участок/антиген и диссоциации, где эти скорости зависят от концентраций партнеров по образованию комплекса, аффинности взаимодействия и геометрических параметров, которые в равной степени влияют на скорость в обоих направлениях. Таким образом, "константу ассоциации" (Kon) и "константу диссоциации" (Koff) можно определять путем вычисления концентраций и фактических скоростей ассоциации и диссоциации. (См., Nature, 361:186-87 (1993)). Отношение Koff/Kon обеспечивает расчет всех параметров, не относящихся к аффинности, и является равным константе диссоциации Kd. (В основном, см. Davies et al., (1990) Annual. Rev. Biochem., 59:439-473). Считают, что антитело по настоящему изобретению специфически связывается с мишенью, когда равновесная константа связывания (Kd) составляет ≤1 мкМ, в некоторых вариантах осуществления ≤100 нМ, в некоторых вариантах осуществления ≤10 нМ и в некоторых вариантах осуществления от ≤100 пМ приблизительно до 1 пМ, как измеряют анализами, такими как анализы связывания радиоактивного лиганда или аналогичными анализами, известными специалистам в данной области.
[000279] Как используют в настоящем описании, термин "выделенный полинуклеотид" означает полинуклеотид геномной ДНК, кДНК или синтетического происхождения, или некоторого их сочетания, где в силу своего происхождения "выделенный полинуклеотид" (1) не является связанным с полным полинуклеотидом или частью полинуклеотида, в котором "выделенный полинуклеотид" встречается в природе, (2) является функционально связанным с полинуклеотидом, с которым он не связан в природе, или (3) не существует в природе в виде части большей последовательности. Полинуклеотиды по изобретению включают молекулы нуклеиновой кислоты, кодирующие молекулы тяжелой цепи иммуноглобулина, продемонстрированные в настоящем описании, и молекулы нуклеиновой кислоты, кодирующие молекулы легкой цепи иммуноглобулина, продемонстрированные в настоящем описании.
[000280] Термин "выделенный белок", обозначаемый в настоящем описании, означает белок кДНК, рекомбинантной РНК или синтетического происхождения, или некоторого их сочетания, где в силу своего происхождения или источника деривации "выделенный белок" (1) не является связанным с белками, встречающимися в природе, (2) не содержит другие белки из того же источника, например, не содержит принадлежащие мыши белки, (3) экспрессируется клеткой от другого вида или (4) не встречается в природе.
[000281] Термин "полипептид" используют в настоящем описании в качестве общего термина для обозначения нативного белка, фрагментов или аналогов полипептидной последовательности. Таким образом, нативные белковые фрагменты и аналоги представляют собой вид рода полипептидов. Полипептиды по изобретению содержат молекулы тяжелой цепи иммуноглобулина, представленные в настоящем описании, и молекулы легкой цепи иммуноглобулина, представленные в настоящем описании, а также молекулы антител, образуемые комбинациями, содержащими молекулы тяжелой цепи иммуноглобулина с молекулами легкой цепи иммуноглобулина, такими как молекулы легкой каппа-цепи иммуноглобулина, и наоборот, а также их фрагменты и аналоги.
[000282] Термин "природный" как используют в настоящем описании, как применяют к объекту, относится к тому факту, что объект можно найти в природе. Например, полипептидная или полинуклеотидная последовательность, которая содержится в организме (включая вирусы), которую можно выделять из источника в природе и которая не была намеренно модифицирована человеком в лаборатории или иным образом, является природной.
[000283] Как используют в настоящем описании, термин "функционально связанный" относится к положениям компонентов, описываемых таким образом, которые находятся во взаимосвязи, позволяющей им функционировать предназначенным им образом. Контрольная последовательность, "функционально связанная" с кодирующей последовательностью, является легированной таким образом, что получают экспрессию кодирующей последовательности в условиях, совместимых с контрольными последовательностями.
[000284] Как используют в настоящем описании, термин "контрольная последовательность" относится к полинуклеотидным последовательностям, которые являются необходимыми для осуществления экспрессии и процессинга кодирующих последовательностей, с которыми они лигированы. Природа таких контрольных последовательностей отличается в зависимости от организма-хозяина, у прокариот, такие контрольные последовательности, как правило, включают промотор, участок связывания рибосомы и последовательность терминации транскрипции, у эукариот, как правило, такие контрольные последовательности включают промоторы и последовательность терминации транскрипции. Термин "контрольные последовательности" предназначен включать по меньшей мере все компоненты, присутствие которых является обязательным для экспрессии и процессинга, а также может включать дополнительные компоненты, присутствие которых является предпочтительным, например, лидерные последовательности и последовательности партнеров по слиянию. Термин "полинуклеотид", как обозначают в настоящем описании, означает нуклеотиды длиной по меньшей мере 10 оснований рибонуклеотидов или дезоксинуклеотидов, или модифицированной формы любого типа нуклеотида. Термин включает одноцепочечные и двухцепочечные формы ДНК.
[000285] Термин олигонуклеотид, обозначаемый в настоящем описании, включает природные и модифицированные нуклеотиды, связанные друг с другом природными и неприродными олигонуклеотидными связями. Олигонуклеотиды представляют собой подгруппу полинуклеотидов, как правило, длиной 200 оснований или менее. В некоторых вариантах осуществления длина олигонуклеотидов составляет от 10 до 60 оснований и в некоторых вариантах осуществления от 12, 13, 14, 15, 16, 17, 18, 19 или 20 до 40 оснований. Олигонуклеотиды, как правило, являются одноцепочечными, например, для зондов, хотя олигонуклеотиды могут являться двухцепочечными, например, для применения для конструкции мутанта гена. Олигонуклеотиды по изобретению представляют собой смысловые или антисмысловые олигонуклеотиды.
[000286] Термин "природные нуклеотиды", обозначаемый в настоящем описании, включает дезоксирибонуклеотиды и рибонуклеотиды. Термин "модифицированные нуклеотиды", обозначаемый в настоящем описании, включает нуклеотиды с модифицированными или замещенными группами сахаров и т.п. Термин "олигонуклеотидные связи", обозначаемый в настоящем описании, включает олигонуклеотидные связи, так как тиофосфат, фосфодитиоат, фосфоселерлоат, фосфодиселеноат, фосфоранилотиоат, фосфораниладат, фосфорамидат и т.п. См., например, LaPlanche et al., Nucl. Acids Res., 14:9081 (1986); Stec et al., J. Am. Chem. Soc., 106:6077 (1984), Stein et al., Nucl. Acids Res., 16:3209 (1988), Zon et al., AntiCancer Drug Design, 6:539 (1991); Zon et al., Oligonucleotides and Analogues: A Practical Approach, pp. 87-108 (F. Eckstein, Ed., Oxford University Press, Oxford England (1991)); Stec et al., патент США № 5151510; Uhlmann and Peyman Chemical Reviews 90:543 (1990). При желании олигонуклеотид может содержать метку для детекции.
[000287] Как используют в настоящем описании, двадцать общепринятых аминокислот и их сокращенные обозначения соответствуют общепринятому использованию. См. Immunology - A Synthesis (2nd Edition, E.S. Golub and D.R. Gren, Eds., Sinauer Associates, Sunderland7 Mass. (1991)). Стереоизомеры (например, D-аминокислоты) двадцати общепринятых аминокислот, неприродных аминокислот, таких как α,α-дизамещенные аминокислоты, N-алкиламинокислоты, молочная кислота и другие неклассические аминокислоты, также могут представлять собой подходящие компоненты для полипептидов по настоящему изобретению. Примеры неклассических аминокислот включают: 4 гидроксипролин, γ-карбоксиглутамат, ε-N,N,N-триметиллизин, ε-N-ацетиллизин, O-фосфосерин, N-ацетилсерин, N-формилметионин, 3-метилгистидин, 5-гидроксилизин, σ-N-метиларгинин и другие аналогичные аминокислоты и иминокислоты (например, 4-гидроксипролин). В обозначении полипептида, используемом в настоящем описании, левое направление представляет собой амино-концевое направление, и правое направление представляет собой карбокси-концевое направление в соответствие со стандартным использованием и соглашением.
[000288] Аналогично, если не указано иное, левый конец одноцепочечных полинуклеотидных последовательностей представляет собой 5'-конец, левое направления двухцепочечных полинуклеотидных последовательностей обозначают как 5'-направление. Направление добавления от 5' к 3' возникающих транскриптов РНК обозначают как области направления транскрипции последовательности на цепи ДНК, содержащей такую же последовательность как РНК, и которые располагают от 5'- к 5'-концу транскрипта РНК, обозначают как "лежащие выше последовательности", области последовательности на цепи ДНК, содержащие такую же последовательность как РНК, и которые располагаются от 3'- к 3'-концу транскрипта РНК, обозначают как "лежащие ниже последовательности".
[000289] Как применяют к полипептидам, термин "существенная идентичность" означает, что две пептидные последовательности при оптимальном выравнивании, таком как посредством программ GAP или BESTFIT, с использованием штрафов за пропуски по умолчанию, обладают по меньшей мере 80 процентами идентичности последовательности, в некоторых вариантах осуществления по меньшей мере 90 процентами идентичности последовательности, в некоторых вариантах осуществления по меньшей мере 95 процентами идентичности последовательности и в некоторых вариантах осуществления по меньшей мере 99 процентами идентичности последовательности.
[000290] В некоторых вариантах осуществления положения остатка, которые не являются идентичными, отличатся консервативными аминокислотными заменами.
[000291] Как описано в настоящем описании, предусматривают, что в настоящее изобретение входят незначительные изменения аминокислотных последовательностей антител или молекул иммуноглобулина, при условии, что изменения аминокислотной последовательности сохраняют по меньшей мере 75%, в некоторых вариантах осуществления по меньшей мере 80%, 90%, 95% и в некоторых вариантах осуществления 99%. В частности, предусматривают консервативные аминокислотные замены. Консервативные замены представляют собой замены, которые происходят в семействе аминокислот, боковые цепи которых являются родственными. Генетически кодируемые аминокислоты, как правило, делят на семейства: (1) кислые аминокислоты представляют собой аспартат, глутамат; (2) основные аминокислоты представляют собой лизин, аргинин, гистидин; (3) неполярные аминокислоты представляют собой аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан, и (4) незаряженные полярные аминокислоты представляют собой глицин, аспарагин, глутамин, цистеин, серин, треонин, тирозин. Гидрофильные аминокислоты включают аргинин, аспарагин, аспартат, глутамин, глутамат, гистидин, лизин, серин и треонин. Гидрофобные аминокислоты включают аланин, цистеин, изолейцин, лейцин, метионин, фенилаланин, пролин, триптофан, тирозин и валин. Другие семейства аминокислот включают (i) серин и треонин, которые представляют собой алифатическое-гидрокси семейство; (ii) аспарагин и глутамин, которые представляют собой содержащее амид семейство; (iii) аланин, валин, лейцин и изолейцин, которые представляют собой алифатическое семейство, и (iv) фенилаланин, триптофан и тирозин, которые представляют собой ароматическое семейство. Например, вполне можно ожидать, что выделенная замена лейцина изолейцином или валином, аспартата глутаматом, треонина серином или аналогичная замена аминокислоты структурно родственной аминокислотой не оказывает существенного эффекта на связывание или свойства получаемой молекулы, особенно если замена не включает аминокислоту в каркасном участке. Приводит ли аминокислотная замена к функциональному пептиду, можно легко определять по оценке специфической активности производного полипептида. В настоящем описании подробно описаны анализы. Специалисты в данной области могут легко получать фрагменты или аналоги антител, или молекул иммуноглобулина. Подходящие амино- и карбокси-концы фрагментов или аналогов встречаются около границ функциональных доменов. Структурные и функциональные домены можно идентифицировать сравнением данных нуклеотидной и/или аминокислотной последовательности с общедоступными или запатентованными базами данных последовательностей. В некоторых вариантах осуществления используют компьютеризированные способы сравнения для идентификации мотивов последовательности или прогнозирования конформационных доменов белков, которые встречаются в других белках известной структуры и/или функции. Способы идентификации белковых последовательностей, которые сворачиваются в известную трехмерную структуру, являются известными. Bowie et al., Science, 253:164 (1991). Таким образом, указанные выше примеры демонстрируют, что специалисты в данной области могут распознавать мотивы последовательностей и структурные конформации, которые можно использовать для определения структурных и функциональных доменов по изобретению.
[000292] Подходящие замены аминокислот представляют собой такие, которые: (1) снижают чувствительность к протеолизу, (2) снижают чувствительность к окислению, (3) изменяют аффинность связывания для образующих белок комплексов, (4) изменяют аффинности связывания, и (5) придают или модифицируют другие физико-химические или функциональные свойства таких аналогов. Аналоги могут включать различные последовательности мутеинов, отличные от природной пептидной последовательности. Например, одну или множественные замены аминокислот (например, консервативные аминокислотные замены) можно проводить в природной последовательности (например, в части полипептида вне домена(ов), образующего межмолекулярные контакты. Консервативная аминокислотная замена по существу не изменяет структурные характеристики исходной последовательности (например, заменяющая аминокислота не должна, как правило, разрушать спираль, которая встречается в исходной последовательности, или нарушать другие типы вторичной структуры, которая характеризует исходную последовательность). Примеры принятых в данной области вторичных и третичных структур полипептидов описаны в Proteins, Structures and Molecular Principles (Creighton, Ed., W.H. Freeman and Company, New York (1984)); Introduction to Protein Structure (C. Branden and J. Tooze, eds., Garland Publishing, New York, N.Y. (1991)); и Thornton et at., Nature, 354:105 (1991).
[000293] Как используют в настоящем описании, термин "полипептидный фрагмент" относится к полипептиду, который содержит делецию в амино-конце и/или карбокси-конце и/или один или более внутренних делеций, но где оставшаяся аминокислотная последовательность является идентичной соответствующим положениям в природной последовательности, получаемой, например, из полноразмерной последовательность кДНК. Длина фрагментов, как правило, составляет по меньшей мере 5, 6, 8 или 10 аминокислот, в некоторых вариантах осуществления по меньшей мере 14 аминокислот, в некоторых вариантах осуществления по меньшей мере 20 аминокислот, как правило, по меньшей мере 50 аминокислот, и в некоторых вариантах осуществления по меньшей мере 70 аминокислот. Как используют в настоящем описании, термин "аналог" относится к полипептидам, которые состоят из сегмента по меньшей мере 25 аминокислот, который обладает существенной идентичностью с участком получаемой аминокислотной последовательности, и который обладает специфическим связыванием с мишенью в подходящих условиях связывания. Как правило, аналоги полипептида содержат консервативную аминокислотную замену (или добавление или делецию) относительно природной последовательности. Как правило, аналоги являются по меньшей мере 20 аминокислот длиной, в некоторых вариантах осуществления по меньшей мере 50 аминокислот длиной или более и часто могут иметь такую же длину как полноразмерный природный полипептид.
[000294] Термин "средство" используют в настоящем описании для обозначения химического соединения, смеси химических соединений, биологической макромолекулы или экстракта, получаемого из биологических веществ.
[000295] Как используют в настоящем описании, термины "метка" или "меченый" относятся к введению детектируемого маркера, например, путем введения радиоактивно меченой аминокислоты или присоединения к полипептиду биотинильных групп, которые можно детектировать меченым авидином (например, содержащим стрептавидин флуоресцентным маркером или по ферментативной активности, которую можно детектировать оптическими или калориметрическими способами). При определенных обстоятельствах метка или маркер может являться терапевтической. Различные способы мечения полипептидов и гликопротеинов известны в данной области, и их можно использовать. Примеры меток для полипептидов включают, но не ограничиваются ими, следующие ниже: радиоактивные изотопы или радионуклиды (например, 3H, 14C, 15N, 35S, 90Y, 99Tc, 111In, 125I, 131I), флуоресцентные метки (например, FITC, родамин, люминофоры на основе лантанидов), ферментативные метки (например, пероксидазу хрена, пара-галактозидазу, люциферазу, щелочную фосфатазу), хемилюминесцентные, биотинильные группы, определенные эпитопы полипептидов, распознаваемые вторичным репортером (например, пара последовательностей лейциновой застежки, участки связывания для вторичных антител, связывающие металл домены, эпитопные метки). В некоторых вариантах осуществления метки присоединяют посредством спейсерных групп различных длин для уменьшения возможного стерического препятствия. Как используют в настоящем описании, термин "фармацевтическое средство или лекарственное средство" относится к химическому соединению или композиции, способной индуцировать желаемый терапевтический эффект при введении подходящим образом пациенту.
[000296] Другие химические термины в настоящем описании используют в соответствии с общепринятым использованием в данной области, как проиллюстрировано The McGraw-Hill Dictionary of Chemical Terms (Parker, S., Ed., McGraw-Hill, San Francisco (1985)).
[000297] Как используют в настоящем описании, "по существу чистый" означает, что вид объекта является преобладающим содержащимся видом (т.е. в пересчете на моль он является более избыточным чем любые другие отдельные виды в композиции), и в некоторых вариантах осуществления в значительной степени очищенная фракция представляет собой композицию, где вид объекта содержит по меньшей мере приблизительно 50 процентов (в пересчете на моль) всех содержащихся видов макромолекул.
[000298] Как правило, по существу чистая композиция содержит более чем приблизительно 80 процентов всех видов макромолекул, содержащихся в композиции, в некоторых вариантах осуществления более чем приблизительно 85%, 90%, 95% и 99%. В некоторых вариантах осуществления вид объекта очищают до существенной гомогенности (загрязняющие виды невозможно детектировать в композиции общепринятыми способами детекции), где композиция по существу состоит из одного вида макромолекул.
[000299] Термин пациент включает человек и индивидуумов, являющихся объектом ветеринарии.
[000300] Активируемые антитела по изобретению специфически связываются с данной мишенью, например, белком-мишенью человека. Также в изобретения входят активируемые антитела, которые связываются с одним и тем же эпитопом, как активируемые антитела, описываемые в настоящем описании.
[000301] Специалистам в данной области понятно, что без излишнего экспериментирования можно определять, если моноклональное антитело (например, моноклональное или гуманизированное антитело мыши) обладает такой же специфичностью как моноклональное антитело, используемое в способах, описываемых в настоящем описании, путем установления, предотвращает ли указанное выше антитело связывание с мишенью последнего. Если моноклональное антитело, подлежащее тестированию, конкурирует с моноклональным антителом по изобретению, как продемонстрировано по уменьшению связывания моноклональным антителом по изобретению, то два моноклональных антитела связываются с одним и тем же или близкородственным эпитопом. Способ определения, обладает ли моноклональное антитело специфичностью моноклонального антитела по изобретению, заключается в предварительной инкубации моноклонального антитела по изобретению с мишенью, а затем добавлении моноклонального антитела, подлежащего тестированию, для определения, ингибируется ли способность моноклональное антитело, подлежащее тестированию, связываться с мишенью. Если моноклональное антитело, подлежащее тестированию, ингибируют, то по всей вероятности, оно обладает такой же или функционально эквивалентной эпитопной специфичностью, как моноклональное антитело по изобретению.
Полиспецифические активируемые антитела
[000302] Изобретение также относится к полиспецифическим активируемым антителам. Полиспецифические активируемые антитела, предоставленные в настоящем описании, представляют собой полиспецифические антитела, которые распознают два или более различных антигена или эпитопа и которые содержат по меньшей мере один маскирующий фрагмент (MM), связанный по меньшей мере с одним антигенсвязывающим или эпитопсвязывающим доменом полиспецифического антитела, таким образом, что связывание MM снижает способность антигенсвязывающего или эпитопсвязывающего домена связываться со своей мишенью. В некоторых вариантах осуществления MM связывают с антигенсвязывающим или эпитопсвязывающим доменом полиспецифического антитела через расщепляемый фрагмент (CM), который функционирует как субстрат по меньшей мере для одной протеазы MMP. Активируемые полиспецифические антитела, предоставленные в настоящем описании, являются стабильными в кровяном русле, активируются в предполагаемом участке проведения терапии и/или диагностики, но не в нормальной, т.е. здоровой ткани, и при активации характеризуются связыванием с мишенью, которое является по меньшей мере сравнимым с соответствующим, немодифицированным полиспецифическим антителом.
[000303] В некоторых вариантах осуществления полиспецифические активируемые антитела конструирует для активации иммунных эффекторных клеток, также обозначаемые в настоящем описании как активирующие иммунные эффекторные клетки полиспецифические активируемые антитела. В некоторых вариантах осуществления полиспецифические активируемые антитела конструирует для активации лейкоцитов, также обозначаемые в настоящем описании как активирующие лейкоциты полиспецифические активируемые антитела. В некоторых вариантах осуществления полиспецифические активируемые антитела конструирует для активации T-клеток, также обозначаемые в настоящем описании как активирующие T-клетки полиспецифические активируемые антитела. В некоторых вариантах осуществления полиспецифические активируемые антитела активируют поверхностный антиген на лейкоците, таком как на T-клетке, на естественной клетке-киллере (NK), на миелоидной мононуклеарной клетке, на макрофаге и/или на другой иммунной эффекторной клетке. В некоторых вариантах осуществления иммунная эффекторная клетка представляет собой лейкоцит. В некоторых вариантах осуществления иммунная эффекторная клетка представляет собой T-клетку. В некоторых вариантах осуществления иммунная эффекторная клетка представляет собой NK-клетку. В некоторых вариантах осуществления иммунная эффекторная клетка представляет собой мононуклеарную клетку, такую как миелоидная мононуклеарная клетка. В некоторых вариантах осуществления полиспецифические активируемые антитела конструируют для связывания или иным образом взаимодействия более чем с одной мишенью и/или более чем с одним эпитопом, также обозначаемые в настоящем описании как направленные на несколько антигенов активируемые антитела. Как используют в настоящем описании, термины "мишень" и "антиген" используют взаимозаменяемо.
[000304] В некоторых вариантах осуществления иммунная эффекторная клетка, активируемая полиспецифическими активируемыми антителами по изобретению, включает антитело против клетки-мишени или его антигенсвязывающий фрагмент и активирующее иммунную эффекторную клетку антитело или его антигенсвязывающую часть, где по меньшей мере одно из антитела против клетки-мишени или его антигенсвязывающего фрагмента и/или активирующего иммунную эффекторную клетку антитела или его антигенсвязывающей части является маскированным. В некоторых вариантах осуществления активирующее иммунную эффекторную клетку антитело или его антигенсвязывающий фрагмент включает первое антитело или его антигенсвязывающий фрагмент (AB1), который связывается с первой активирующей иммунную эффекторную клетку мишенью, где AB1 является присоединенным к маскирующему фрагменту (MM1), таким образом, что такое связывание MM1 снижает способность AB1 связываться с первой мишенью. В некоторых вариантах осуществления антитело против клетки-мишени или его антигенсвязывающий фрагмент включает второе антитело или его фрагмент, который содержит второе антитело или его антигенсвязывающий фрагмент (AB2), который связывается со второй мишенью, где AB2 присоединяют к маскирующему фрагменту (MM2), таким образом, что связывание MM2 снижает способность AB2 связываться со второй мишенью. В некоторых вариантах осуществления активирующее иммунную эффекторную клетку антитело или его антигенсвязывающий фрагмент включает первое антитело или его антигенсвязывающий фрагмент (AB1), который связывается с первой мишенью, активирующей иммунную эффекторную клетку, где AB1 является присоединенным к маскирующему фрагменту (MM1), таким образом, что связывание MM1 снижает способность AB1 связываться с первой мишенью, и антитело против клетки-мишени или его антигенсвязывающий фрагмент включает второе антитело или его фрагмент, который включает второе антитело или его антигенсвязывающий фрагмент (AB2), который связывается со второй мишенью, где AB2 является присоединенным к маскирующему фрагменту (MM2), таким образом, что связывание MM2 снижает способность AB2 связываться со второй мишенью. В некоторых вариантах осуществления не активирующее иммунную эффекторную клетку антитело представляет собой направленное на злокачественную опухоль антитело. В некоторых вариантах осуществления не активирующее иммунную эффекторную клетку антитело представляет собой IgG. В некоторых вариантах осуществления активирующее иммунную эффекторную клетку антитело представляет собой scFv. В некоторых вариантах осуществления антитело против клетки-мишени (например, не активирующее иммунную эффекторную клетку антитело) представляет собой IgG, и активирующее иммунную эффекторную клетку антитело представляет собой scFv. В некоторых вариантах осуществления иммунная эффекторная клетка представляет собой лейкоцит. В некоторых вариантах осуществления иммунная эффекторная клетка представляет собой T-клетку. В некоторых вариантах осуществления иммунная эффекторная клетка представляет собой NK-клетку. В некоторых вариантах осуществления иммунная эффекторная клетка представляет собой миелоидную мононуклеарную клетку.
[000305] В некоторых вариантах осуществления активирующие T-клетку полиспецифические активируемые антитела по изобретению включают антитело против клетки-мишени или его антигенсвязывающий фрагмент и активирующее T-клетку антитело или его антигенсвязывающую часть, где по меньшей мере одно из антитела против клетки-мишени или его антигенсвязывающего фрагмента и/или активирующего T-клетку антитела или его антигенсвязывающей части является маскированным. В некоторых вариантах осуществления активирующее T-клетку антитело или его антигенсвязывающий фрагмент включает первое антитело или его антигенсвязывающий фрагмент (AB1), который связывается с первой мишенью, активирующей T-клетку, где AB1 присоединяют к маскирующему фрагменту (MM1), таким образом, что связывание MM1 снижает способность AB1 связываться с первой мишенью. В некоторых вариантах осуществления антитело против клетки-мишени или его антигенсвязывающий фрагмент включает второе антитело или его фрагмент, который включает второе антитело или его антигенсвязывающий фрагмент (AB2), который связывается со второй мишенью, где AB2 присоединяют к маскирующему фрагменту (MM2), таким образом, что связывание MM2 снижает способность AB2 связываться со второй мишенью. В некоторых вариантах осуществления активирующее T-клетку антитело или его антигенсвязывающий фрагмент включает первое антитело или его антигенсвязывающий фрагмент (AB1), который связывается с первой мишенью, активирующей T-клетку, где AB1 присоединяют к маскирующему фрагменту (MM1), таким образом, что связывание MM1 снижает способность AB1 связываться с первой мишенью, и антитело против клетки-мишени или его антигенсвязывающий фрагмент включает второе антитело или его фрагмент, который включает второе антитело или его антигенсвязывающий фрагмент (AB2), который связывается со второй мишенью, где AB2 присоединяют к маскирующему фрагменту (MM2), таким образом, что связывание MM2 снижает способность AB2 связываться со второй мишенью.
[000306] В некоторых вариантах осуществления активирующие T-клетку полиспецифические активируемые антитела включают направленное на злокачественную опухоль антитело или его антигенсвязывающий фрагмент и активирующее T-клетку антитело или его антигенсвязывающую часть, где по меньшей мере одно из направленного на злокачественную опухоль антитела или его антигенсвязывающего фрагмента, и/или активирующего T-клетку антитела или его антигенсвязывающей части является маскированным. В некоторых вариантах осуществления активирующее T-клетку антитело или его антигенсвязывающий фрагмент включает первое антитело или его антигенсвязывающий фрагмент (AB1), который связывается с первой мишенью активирующей T-клетку, где AB1 присоединяют к маскирующему фрагменту (MM1), таким образом, что связывание MM1 снижает способность AB1 связываться с первой мишенью. В некоторых вариантах осуществления направленное на злокачественную опухоль антитело или его антигенсвязывающий фрагмент включает второе антитело или его фрагмент, который включает второе антитело или его антигенсвязывающий фрагмент (AB2), который связывается со второй мишенью, связанной со злокачественной опухолью, где AB2 присоединяют к маскирующему фрагменту (MM2), таким образом, что связывание MM2 снижает способность AB2 связываться со второй мишенью, связанной со злокачественной опухолью. В некоторых вариантах осуществления активирующее T-клетку антитело или его антигенсвязывающий фрагмент включает первое антитело или его антигенсвязывающий фрагмент (AB1), который связывается с первой мишенью, активирующей T-клетку, где AB1 присоединяют к маскирующему фрагменту (MM1), таким образом, что связывание MM1 снижает способность AB1 связываться с первой мишенью, и направленное на злокачественную опухоль антитело или его антигенсвязывающий фрагмент включает второе антитело или его фрагмент, который включает второе антитело или его антигенсвязывающий фрагмент (AB2), который связывается со второй мишенью, связанной со злокачественной опухолью, где AB2 присоединяют к маскирующему фрагменту (MM2), таким образом, что связывание MM2 снижает способность AB2 связываться со второй мишенью, связанной со злокачественной опухолью.
[000307] В некоторых вариантах осуществления активирующие T-клетку полиспецифические активируемые антитела включают направленное на злокачественную опухоль антитело IgG или его антигенсвязывающий фрагмент и активирующий T-клетку scFv, где по меньшей мере одно из направленного на злокачественную опухоль антитела IgG или его антигенсвязывающего фрагмента и/или активирующего T-клетку антитела или его антигенсвязывающей части является маскированным. В некоторых вариантах осуществления активирующее T-клетку антитело или его антигенсвязывающий фрагмент включает первое антитело или его антигенсвязывающий фрагмент (AB1), который связывается с первой мишенью, активирующей T-клетку, где AB1 присоединяют к маскирующему фрагменту (MM1), таким образом, что связывание MM1 снижает способность AB1 связываться с первой мишенью. В некоторых вариантах осуществления направленное на злокачественную опухоль антитело IgG или его антигенсвязывающий фрагмент включает второе антитело или его фрагмент, который включает второе антитело или его антигенсвязывающий фрагмент (AB2), который связывается со второй мишенью, связанной со злокачественной опухолью, где AB2 присоединяют к маскирующему фрагменту (MM2), таким образом, что связывание MM2 снижает способность AB2 связываться со второй мишенью, связанной со злокачественной опухолью. В некоторых вариантах осуществления активирующее T-клетку антитело или его антигенсвязывающий фрагмент включает первое антитело или его антигенсвязывающий фрагмент (AB1), который связывается с первой мишенью, активирующей T-клетку, где AB1 присоединяют к маскирующему фрагменту (MM1), таким образом, что связывание MM1 снижает способность AB1 связываться с первой мишенью, и направленное на злокачественную опухоль антитело IgG или его антигенсвязывающий фрагмент включает второе антитело или его фрагмент, который включает второе антитело или его антигенсвязывающий фрагмент (AB2), который связывается со второй мишенью, связанной со злокачественной опухолью, где AB2 присоединяют к маскирующему фрагменту (MM2), таким образом, что связывание MM2 снижает способность AB2 связываться со второй мишенью, связанной со злокачественной опухолью.
[000308] В некоторых вариантах осуществления активирующего иммунную эффекторную клетку полиспецифического активируемого антитела один антиген, как правило, представляет собой антиген, предоставленный на поверхности опухолевой клетки или другого типа клеток, ассоциированного с заболеванием, такой как, но, не ограничиваясь ими, любая мишень, приведенная в таблице 1, такая как, но, не ограничиваясь ими, EGFR, erbB2, EpCAM, Jagged, PD-L1, B7H3 или CD71 (рецептор трансферрина), а другой антиген, как правило, представляет собой стимулирующий или ингибирующий рецептор, предоставленный на поверхности T-клетки, естественной клетки-киллера (NK), миелоидной мононуклеарной клетки, макрофага и/или другой иммунной эффекторной клетки, такой как, но, не ограничиваясь ими, B7-H4, BTLA, CD3, CD4, CD8, CD16a, CD25, CD27, CD28, CD32, CD56, CD137, CTLA-4, GITR, HVEM, ICOS, LAG3, NKG2D, OX40, PD-1, TIGIT, TIM3 или VISTA. В некоторых вариантах осуществления антиген представляет собой стимулирующий рецептор, предоставленный на поверхности T-клетки или NK-клетки; примеры таких стимулирующих рецепторов включают, но не ограничиваются ими, CD3, CD27, CD28, CD137 (также обозначаемый как 4-1BB), GITR, HVEM, ICOS, NKG2D и OX40. В некоторых вариантах осуществления антиген представляет собой ингибирующий рецептор, предоставленный на поверхности T-клетки; примеры таких ингибирующих рецепторов включают, но не ограничиваются ими, BTLA, CTLA-4, LAG3, PD-1, TIGIT, TIM3 и экспрессируемые NK KIR. Домен антитела, обеспечивающий специфичность к поверхностному антигену T-клетки, также можно заменять лигандом или доменом лиганда, который связывается с T-клеточным рецептором, NK-клеточным рецептором, рецептором макрофагов и/или другим рецептором иммунной эффекторной клетки, таким как, но, не ограничиваясь ими, B7-1, B7-2, B7H3, PD-L1, PD-L2 или TNFSF9.
[000309] Один из вариантов осуществления изобретению представляет собой полиспецифическое активируемое антитело, которое является активируемым в микроокружении злокачественной опухоли и которое включает антитело, например, IgG или scFv, направленное на опухоль-мишень, и антитело-агонист, например, IgG или scFv, направленное на костимулирующий рецептор, экспрессируемый на поверхности активированной T-клетки или NK-клетки, где по меньшей мере одно из антитела против злокачественной опухоли-мишени и/или антитела-агониста является маскированным. Примеры костимулирующих рецепторов включают, но не ограничиваются ими, CD27, CD137, GITR, HVEM, NKG2D и OX40. В этом варианте осуществления полиспецифическое активируемое антитело после активации ассоциированными с опухолью протеазами эффективно перекрестно связывается и активирует T-клетку или NK-клетку, экспрессирующую костимулирующий рецептор в зависимости от опухоли, с усилением активности T-клеток, которые реагируют на любой опухолевый антиген через свои эндогенные T-клеточные рецепторы антигена или NK-активирующие рецепторы. Зависящая от активации природа таких T-клеточных или NK-клеточных костимулирующих рецепторов фокусирует активность активируемого полиспецифического активируемого антитела на опухолеспецифичных T-клетках без активации всех T-клеток независимо от их антигенной специфичности. В одном из вариантов осуществления по меньшей мере костимулирующее рецепторное антитело полиспецифического активируемого антитела маскируют для предотвращения активации аутореактивных T-клеток, которые могут содержаться в тканях, которые также экспрессируют антиген, распознаваемый направленным на опухоль-мишень антителом в полиспецифическом активируемом антителе, но активность которого ограничена вследствие отсутствия вовлечения корецептора.
[000310] Один из вариантов осуществления изобретения представляет собой полиспецифическое активируемое антитело, которое является активируемым при заболевании, характеризующимся избыточной стимуляцией T-клеток, таком как, но, не ограничиваясь ими, микроокружение при аутоиммунном заболевании или воспалительном заболевании. Такое полиспецифическое активируемое антитело включает антитело, например, IgG или scFv, направленное на мишень, содержащую поверхностный антиген, экспрессируемый в ткани, на которую направлена T-клетка при аутоиммунном или воспалительном заболевании, и антитело, например, IgG или scFv, направленное на ингибирующий рецептор, экспрессируемый на поверхности T-клетки или NK-клетки, где по меньшей мере одно направленнее на пораженную ткань-мишень антитело и/или антитело против T-клеточного ингибирующего рецептора является маскированным. Примеры ингибирующих рецепторов включают, но не ограничиваются ими, BTLA, CTLA-4, LAG3, PD-1, TIGIT, TIM3 и экспрессируемые NK KIR. Примеры тканевого антигена, на который направлены T-клетки при аутоиммунном заболевании, включают, но не ограничиваются ими, поверхностный антиген, экспрессируемый на миелине или нервных клетках при рассеянном склерозе, или поверхностный антиген, экспрессируемый на клетках панкреатических островков при диабете 1 типа. В этом варианте осуществления полиспецифическое активируемое антитело при локализации в ткани в условиях аутоиммунного нарушения или воспаления актируется и совместно активирует T-клеточный или NK-клеточный ингибирующий рецептор для подавления активности аутореактивных T-клеток, реагирующих на любые направленные на пораженную ткань антигены через их эндогенный TCR или активирующие рецепторы. В одном из вариантов осуществления по меньшей мере одно или несколько антител маскируют для предотвращения подавления T-клеточных ответов в непораженной ткани, где антиген-мишень также может экспрессироваться.
[000311] В некоторых вариантах осуществления активирующее T-клетки полиспецифическое активируемое антитело включает scFv против CD3 эпсилон (CD3ε, также обозначаемые в настоящем описании как CD3ε и CD3) и антитело против клетки-мишени или его антигенсвязывающий фрагмент, где по меньшей мере одно из scFv против CD3ε и/или антитела против клетки-мишени или его антигенсвязывающей части является маскированным. В некоторых вариантах осуществления scFv против CD3ε включает первое антитело или его антигенсвязывающий фрагмент (AB1), который связывается с CD3ε, где AB1 присоединяют к маскирующему фрагменту (MM1), таким образом, что связывание MM1 снижает способность AB1 связываться с CD3ε. В некоторых вариантах осуществления антитело против клетки-мишени или его антигенсвязывающий фрагмент включает второе антитело или его фрагмент, который включает второе антитело или его антигенсвязывающий фрагмент (AB2), который связывается со второй мишенью, где AB2 присоединяют к маскирующему фрагменту (MM2), таким образом, что связывание MM2 снижает способность AB2 связываться со второй мишенью. В некоторых вариантах осуществления scFv против CD3ε включает первое антитело или его антигенсвязывающий фрагмент (AB1), который связывается с CD3ε, где AB1 присоединяют к маскирующему фрагменту (MM1), таким образом, что связывание MM1 снижает способность AB1 связываться с CD3ε, и антитело против клетки-мишени или его антигенсвязывающий фрагмент включает второе антитело или его фрагмент, который включает второе антитело или его антигенсвязывающий фрагмент (AB2), который связывается со второй мишенью, где AB2 присоединяют к маскирующему фрагменту (MM2), таким образом, что связывание MM2 снижает способность AB2 связываться со второй мишенью.
[000312] В некоторых вариантах осуществления активирующее T-клетки полиспецифическое активируемое антитело включает scFv против CD3ε и направленное на злокачественную опухоль антитело или его антигенсвязывающий фрагмент, где по меньшей мере одно из scFv против CD3ε и/или направленного на злокачественную опухоль антитела или его антигенсвязывающей части является маскированным. В некоторых вариантах осуществления scFv против CD3ε включает первое антитело или его антигенсвязывающий фрагмент (AB1), который связывается с CD3ε, где AB1 присоединяют к маскирующему фрагменту (MM1), таким образом, что связывание MM1 снижает способность AB1 связываться с CD3ε. В некоторых вариантах осуществления направленное на злокачественную опухоль антитело или его антигенсвязывающий фрагмент включает второе антитело или его фрагмент, который включает второе антитело или его антигенсвязывающий фрагмент (AB2), который связывается со второй мишенью, связанной со злокачественной опухолью, где AB2 присоединяют к маскирующему фрагменту (MM2), таким образом, что связывание MM2 снижает способность AB2 связываться со второй мишенью, связанной со злокачественной опухолью. В некоторых вариантах осуществления scFv против CD3ε включает первое антитело или его антигенсвязывающий фрагмент (AB1), который связывается с CD3ε, где AB1 присоединяют к маскирующему фрагменту (MM1), таким образом, что связывание MM1 снижает способность AB1 связываться с CD3ε, и направленное на злокачественную опухоль антитело или его антигенсвязывающий фрагмент включает второе антитело или его фрагмент, который включает второе антитело или его антигенсвязывающий фрагмент (AB2), который связывается со второй мишенью, связанной со злокачественной опухолью, где AB2 присоединяют к маскирующему фрагменту (MM2), таким образом, что связывание MM2 снижает способность AB2 связываться со второй мишенью, связанной со злокачественной опухолью.
[000313] В некоторых вариантах осуществления активирующее T-клетки полиспецифическое активируемое антитело включает scFv против CD3ε и направленное на злокачественную опухоль антитело IgG или его антигенсвязывающий фрагмент, где по меньшей мере одно из scFv против CD3ε и/или направленного на злокачественную опухоль антитела IgG или его антигенсвязывающей части является маскированным. В некоторых вариантах осуществления scFv против CD3ε включает первое антитело или его антигенсвязывающий фрагмент (AB1), который связывается с CD3ε, где AB1 присоединяют к маскирующему фрагменту (MM1), таким образом, что связывание MM1 снижает способность AB1 связываться с CD3ε. В некоторых вариантах осуществления направленное на злокачественную опухоль антитело IgG или его антигенсвязывающий фрагмент включает второе антитело или его фрагмент, который включает второе антитело или его антигенсвязывающий фрагмент (AB2)? который связывается со второй мишенью, связанной со злокачественной опухолью, где AB2 присоединяют к маскирующему фрагменту (MM2) таким образом, что связывание MM2 снижает способность AB2 связываться со второй мишенью, связанной со злокачественной опухолью. В некоторых вариантах осуществления scFv против CD3ε включает первое антитело или его антигенсвязывающий фрагмент (AB1), который связывается с CD3ε, где AB1 присоединяют к маскирующему фрагменту (MM1), таким образом, что связывание MM1 снижает способность AB1 связываться с CD3ε, и направленное на злокачественную опухоль антитело IgG или его антигенсвязывающий фрагмент включает второе антитело или его фрагмент, который включает второе антитело или его антигенсвязывающий фрагмент (AB2), который связывается со второй мишенью, связанной со злокачественной опухолью, где AB2 присоединяют к маскирующему фрагменту (MM2), таким образом, что связывание MM2 снижает способность AB2 связываться со второй мишенью, связанной со злокачественной опухолью.
[000314] В некоторых вариантах осуществления активирующее T-клетки полиспецифическое активируемое антитело включает scFv против CD3 эпсилон (CD3ε), которое получают из OKT3, где по меньшей мере одно из антитела против клетки-мишени или его антигенсвязывающего фрагмента и/или scFv OKT3 или получаемого из OKT3 scFv является маскированным. В некоторых вариантах осуществления scFv OKT3 или получаемый из OKT3 scFv включает первое антитело или его антигенсвязывающий фрагмент (AB1), который связывается с CD3ε, где AB1 присоединяют к маскирующему фрагменту (MM1), таким образом, что связывание MM1 снижает способность AB1 связываться с CD3ε. В некоторых вариантах осуществления антитело против клетки-мишени или его антигенсвязывающий фрагмент включает второе антитело или его фрагмент, который включает второе антитело или его антигенсвязывающий фрагмент (AB2), который связывается со второй мишенью, где AB2 присоединяют к маскирующему фрагменту (MM2), таким образом, что связывание MM2 снижает способность AB2 связываться со второй мишенью. В некоторых вариантах осуществления scFv OKT3 или получаемый из OKT3 scFv включает первое антитело или его антигенсвязывающий фрагмент (AB1), который связывается с CD3ε, где AB1 присоединяют к маскирующему фрагменту (MM1), таким образом, что связывание MM1 снижает способность AB1 связываться с CD3ε, и антитело против клетки-мишени или его антигенсвязывающий фрагмент включает второе антитело или его фрагмент, который включает второе антитело или его антигенсвязывающий фрагмент (AB2), который связывается со второй мишенью, где AB2 присоединяют к маскирующему фрагменту (MM2) таким образом, что связывание MM2 снижает способность AB2 связываться со второй мишенью.
[000315] В некоторых вариантах осуществления активирующее T-клетки полиспецифическое активируемое антитело включает scFv OKT3 или получаемый из OKT3 scFv и направленное на злокачественную опухоль антитело или его антигенсвязывающий фрагмент, где по меньшей мере одно из scFv OKT3 или получаемого из OKT3 scFv и/или направленного на злокачественную опухоль антитела или его антигенсвязывающей части является маскированным. В некоторых вариантах осуществления scFv OKT3 или получаемый из OKT3 scFv включает первое антитело или его антигенсвязывающий фрагмент (AB1), который связывается с CD3ε, где AB1 присоединяют к маскирующему фрагменту (MM1), таким образом, что связывание MM1 снижает способность AB1 связываться с CD3ε. В некоторых вариантах осуществления направленное на злокачественную опухоль антитело или его антигенсвязывающий фрагмент включает второе антитело или его фрагмент, который включает второе антитело или его антигенсвязывающий фрагмент (AB2), который связывается со второй мишенью, связанной со злокачественной опухолью, где AB2 присоединяют к маскирующему фрагменту (MM2), таким образом, что связывание MM2 снижает способность AB2 связываться со второй мишенью, связанной со злокачественной опухолью. В некоторых вариантах осуществления scFv OKT3 или получаемый из OKT3 scFv включает первое антитело или его антигенсвязывающий фрагмент (AB1), который связывается с CD3ε, где AB1 присоединяют к маскирующему фрагменту (MM1), таким образом, что связывание MM1 снижает способность AB1 связываться с CD3ε, и направленное на злокачественную опухоль антитело или его антигенсвязывающий фрагмент включает второе антитело или его фрагмент, который включает второе антитело или его антигенсвязывающий фрагмент (AB2), который связывается со второй мишенью, связанной со злокачественной опухолью, где AB2 присоединяют к маскирующему фрагменту (MM2), таким образом, что связывание MM2 снижает способность AB2 связываться со второй мишенью, связанной со злокачественной опухолью.
[000316] В некоторых вариантах осуществления активирующее T-клетки полиспецифическое активируемое антитело включает scFv OKT3 или получаемый из OKT3 scFv и направленное на злокачественную опухоль антитело IgG или его антигенсвязывающий фрагмент, где по меньшей мере одно из f scFv OKT3 или получаемого из OKT3 scFv и/или направленного на злокачественную опухоль антитела IgG или его антигенсвязывающей части является маскированным. В некоторых вариантах осуществления scFv OKT3 или получаемый из OKT3 scFv включает первое антитело или его антигенсвязывающий фрагмент (AB1), который связывается с CD3ε, где AB1 присоединяют к маскирующему фрагменту (MM1), таким образом, что связывание MM1 снижает способность AB1 связываться с CD3ε. В некоторых вариантах осуществления направленное на злокачественную опухоль антитело IgG или его антигенсвязывающий фрагмент включает второе антитело или его фрагмент, который включает второе антитело или его антигенсвязывающий фрагмент (AB2), который связывается со второй мишенью, связанной со злокачественной опухолью, где AB2 присоединяют к маскирующему фрагменту (MM2), таким образом, что связывание MM2 снижает способность AB2 связываться со второй мишенью, связанной со злокачественной опухолью. В некоторых вариантах осуществления scFv OKT3 или получаемый из OKT3 scFv включает первое антитело или его антигенсвязывающий фрагмент (AB1), который связывается с CD3ε, где AB1 присоединяют к маскирующему фрагменту (MM1), таким образом, что связывание MM1 снижает способность AB1 связываться с CD3ε, и направленное на злокачественную опухоль антитело IgG или его антигенсвязывающий фрагмент включает второе антитело или его фрагмент, который включает второе антитело или его антигенсвязывающий фрагмент (AB2), который связывается со второй мишенью, связанной со злокачественной опухолью, где AB2 присоединяют к маскирующему фрагменту (MM2) таким образом, что связывание MM2 снижает способность AB2 связываться со второй мишенью, связанной со злокачественной опухолью.
[000317] В некоторых вариантах осуществления активирующее T-клетки полиспецифическое активируемое антитело включает scFv против CTLA-4, где по меньшей мере одно из антитела против клетки-мишени или его антигенсвязывающего фрагмента и/или scFv против CTLA-4 является маскированным. В некоторых вариантах осуществления scFv против CTLA-4 включает первое антитело или его антигенсвязывающий фрагмент (AB1), который связывается с CTLA-4, где AB1 присоединяют к маскирующему фрагменту (MM1), таким образом, что связывание MM1 снижает способность AB1 связываться с CTLA-4. В некоторых вариантах осуществления антитело против клетки-мишени или его антигенсвязывающий фрагмент включает второе антитело или его фрагмент, который включает второе антитело или его антигенсвязывающий фрагмент (AB2), который связывается со второй мишенью, где AB2 присоединяют к маскирующему фрагменту (MM2) таким образом, что связывание MM2 снижает способность AB2 связываться со второй мишенью. В некоторых вариантах осуществления scFv против CTLA-4 включает первое антитело или его антигенсвязывающий фрагмент (AB1), который связывается с CTLA-4, где AB1 присоединяют к маскирующему фрагменту (MM1), таким образом, что связывание MM1 снижает способность AB1 связываться CTLA-4, и антитело против клетки-мишени или его антигенсвязывающий фрагмент включает второе антитело или его фрагмент, который включает второе антитело или его антигенсвязывающий фрагмент (AB2), который связывается со второй мишенью, где AB2 присоединяют к маскирующему фрагменту (MM2) таким образом, что связывание MM2 снижает способность AB2 связываться со второй мишенью.
[000318] В некоторых вариантах осуществления активирующее T-клетки полиспецифическое активируемое антитело включает scFv против CTLA-4 и антитело IgG против клетки-мишени или его антигенсвязывающий фрагмент, где по меньшей мере одно из scFv против CTLA-4 и/или антитела IgG против клетки-мишени или его антигенсвязывающей части является маскированным. В некоторых вариантах осуществления scFv против CTLA-4 включает первое антитело или его антигенсвязывающий фрагмент (AB1), который связывается с CTLA-4, где AB1 присоединяют к маскирующему фрагменту (MM1), таким образом, что связывание MM1 снижает способность AB1 связываться CTLA-4. В некоторых вариантах осуществления антитело IgG против клетки-мишени или его антигенсвязывающий фрагмент включает второе антитело или его фрагмент, который включает второе антитело или его антигенсвязывающий фрагмент (AB2) который связывается со второй мишенью, где AB2 присоединяют к маскирующему фрагменту (MM2) таким образом, что связывание MM2 снижает способность AB2 связываться со второй мишенью. В некоторых вариантах осуществления scFv против CTLA-4 включает первое антитело или его антигенсвязывающий фрагмент (AB1), который связывается с CTLA-4, где AB1 присоединяют к маскирующему фрагменту (MM1), таким образом, что связывание MM1 снижает способность AB1 связываться CTLA-4, и антитело против клетки-мишени IgG или его антигенсвязывающий фрагмент включает второе антитело или его фрагмент, который включает второе антитело или его антигенсвязывающий фрагмент (AB2) который связывается со второй мишенью, где AB2 присоединяют к маскирующему фрагменту (MM2) таким образом, что связывание MM2 снижает способность AB2 связываться со второй мишенью.
[000319] В некоторых вариантах осуществления направленные на множественные антигены антитела и/или направленные на множественные антигены активируемые антитела включают по меньшей мере первое антитело или его антигенсвязывающий фрагмент, который связывается с первой мишенью и/или первым эпитопом, и второе антитело или его антигенсвязывающий фрагмент, который связывается со второй мишенью и/или вторым эпитопом. В некоторых вариантах осуществления направленные на множественные антигены антитела и/или направленные на множественные антигены активируемые антитела связываются с двумя или более различными мишенями. В некоторых вариантах осуществления направленные на множественные антигены антитела и/или направленные на множественные антигены активируемые антитела связываются с двумя или более различными эпитопами на одной и той же мишени. В некоторых вариантах осуществления направленные на множественные антигены антитела и/или направленные на множественные антигены активируемые антитела связываются с комбинацией двух или более различных мишеней и двух или более различных эпитопами на одной и той же мишени.
[000320] В некоторых вариантах осуществления полиспецифическое активируемое антитело, содержащее IgG, содержит маскированные вариабельные домены IgG. В некоторых вариантах осуществления полиспецифическое активируемое антитело, содержащее scFv, содержит маскированные домены scFV. В некоторых вариантах осуществления полиспецифическое активируемое антитело содержит вариабельные домены IgG и домены scFV, где по меньшей мере один из вариабельных доменов IgG, является связанным с маскирующим фрагментом. В некоторых вариантах осуществления полиспецифическое активируемое антитело вариабельные домены IgG и домены scFV, где по меньшей мере один из доменов scFV является связанным с маскирующим фрагментом. В некоторых вариантах осуществления полиспецифическое активируемое антитело содержит вариабельные домены IgG и домены scFV, где по меньшей мере один из вариабельных доменов IgG является связанным с маскирующим фрагментом, и по меньшей мере один из доменов scFV является связанным с маскирующим фрагментом. В некоторых вариантах осуществления полиспецифическое активируемое антитело содержит вариабельные домены IgG и домены scFV, где каждый из вариабельных доменов IgG и доменов scFV является связанным со своим маскирующим фрагментом. В некоторых вариантах осуществления один домен антитела полиспецифического активируемого антитела обладает специфичностью к антигену-мишени, и другой домен-антитела обладает специфичностью к T-клеточному поверхностному антигену. В некоторых вариантах осуществления один домен антитела полиспецифического активируемого антитела обладает специфичностью к антигену-мишени, и другой домен антитела обладает специфичностью к другому антигену-мишени. В некоторых вариантах осуществления один домен антитела полиспецифического активируемого антитела обладает специфичностью к эпитопу антигена-мишени, и другой домен антитела обладает специфичностью к другому эпитопу антигена-мишени.
[000321] В полиспецифическом активируемом антителе scFv можно сливать с карбоксильным концом тяжелой цепи активируемого антитела IgG, с карбоксильным концом легкой цепи активируемого антитела IgG или с карбоксильными концами тяжелой и легкой цепей активируемого антитела IgG. В полиспецифическом активируемом антителе scFv можно сливать с амино-концом тяжелой цепи активируемого антитела IgG, с амино-концом легкой цепи активируемого антитела IgG или с амино-концами тяжелой и легкой цепей активируемого антитела IgG. В полиспецифическом активируемом антителе scFv можно сливать с любой комбинацией одного или более карбоксильных концов и одного или более амино-концов активируемого антитела IgG. В некоторых вариантах осуществления маскирующий фрагмент (MM), связанный с расщепляемым фрагментом (CM), является присоединенным к антигенсвязывающему домену IgG и маскирует его. В некоторых вариантах осуществления маскирующий фрагмент (MM), связанный с расщепляемым фрагментом (CM), является присоединенным к антигенсвязывающему домену по меньшей мере одного scFv и маскирует его. В некоторых вариантах осуществления маскирующий фрагмент (MM), связанный с расщепляемым фрагментом (CM), является присоединенным к антигенсвязывающему домену IgG и маскирует его, и маскирующий фрагмент (MM), связанный с расщепляемым фрагментом (CM), является присоединенным к антигенсвязывающему домену по меньшей мере одного scFv и маскирует его.
[000322] Изобретение относится к примерам структур полиспецифического активируемого антитела, которые содержат, но не ограничиваются ими, следующие ниже: (VL-CL)2:(VH-CH1-CH2-CH3-L4-VH*-L3-VL*-L2-CM-L1-MM)2; (VL-CL)2:(VH-CH1-CH2-CH3-L4-VL*-L3-VH*-L2-CM-L1-MM)2; (MM-L1-CM-L2-VL-CL)2:(VH-CH1-CH2-CH3-L4-VH*-L3-VL*)2; (MM-L1-CM-L2-VL-CL)2:(VH-CH1-CH2-CH3-L4-VL*-L3-VH*)2; (VL-CL)2:(MM-L1-CM-L2-VL*-L3-VH*-L4-VH-CH1-CH2-CH3)2; (VL-CL)2:(MM-L1-CM-L2-VH*-L3-VL*-L4-VH-CH1-CH2-CH3)2; (MM-L1-CM-L2-VL-CL)2:(VL*-L3-VH*-L4-VH-CH1-CH2-CH3)2; (MM-L1-CM-L2-VL-CL)2:(VH*-L3-VL*-L4-VH-CH1-CH2-CH3)2; (VL-CL-L4-VH*-L3-VL*-L2-CM-L1-MM)2:(VH-CH1-CH2-CH3)2; (VL-CL-L4-VL*-L3-VH*-L2-CM-L1-MM)2:(VH-CH1-CH2-CH3)2; (MM-L1-CM-L2-VL*-L3-VH*-L4-VL-CL)2:(VH-CH1-CH2-CH3)2; (MM-L1-CM-L2-VH*-L3-VL*-L4-VL-CL)2:(VH-CH1-CH2-CH3)2; (VL-CL-L4-VH*-L3-VL*-L2-CM-L1-MM)2:(MM-L1-CM-L2-VL*-L3-VH*-L4-VH-CH1-CH2-CH3)2; (VL-CL-L4-VH*-L3-VL*-L2-CM-L1-MM)2:(MM-L1-CM-L2-VH*-L3-VL*-L4-VH-CH1-CH2-CH3)2; (VL-CL-L4-VL*-L3-VH*-L2-CM-L1-MM)2:(MM-L1-CM-L2-VL*-L3-VH*-L4-VH-CH1-CH2-CH3)2; (VL-CL-L4-VL*-L3-VH*-L2-CM-L1-MM)2:(MM-L1-CM-L2-VH*-L3-VL*-L4-VH-CH1-CH2-CH3)2; (VL-CL-L4-VH*-L3-VL*)2:(MM-L1-CM-L2-VL*-L3-VH*-L4-VH-CH1-CH2-CH3)2; (VL-CL-L4-VH*-L3-VL*)2:(MM-L1-CM-L2-VH*-L3-VL*-L4-VH-CH1-CH2-CH3)2; (VL-CL-L4-VL*-L3-VH*)2:(MM-L1-CM-L2-VL*-L3-VH*-L4-VH-CH1-CH2-CH3)2; (VL-CL-L4-VL*-L3-VH*)2:(MM-L1-CM-L2-VH*-L3-VL*-L4-VH-CH1-CH2-CH3)2; (VL-CL-L4-VH*-L3-VL*-L2-CM-L1-MM)2:(VL*-L3-VH*-L4-VH-CH1-CH2-CH3)2; (VL-CL-L4-VH*-L3-VL*-L2-CM-L1-MM)2:(VH*-L3-VL*-L4-VH-CH1-CH2-CH3)2; (VL-CL-L4-VL*-L3-VH*-L2-CM-L1-MM)2:(VL*-L3-VH*-L4-VH-CH1-CH2-CH3)2 или (VL-CL-L4-VL*-L3-VH*-L2-CM-L1-MM)2:(VH*-L3-VL*-L4-VH-CH1-CH2-CH3)2, где:VL и VH представляют собой вариабельные домены легкой и тяжелой цепей первой специфичности, содержащиеся в IgG; VL* и VH* представляют собой вариабельные домены второй специфичности, содержащиеся в cFv; L1 представляет собой линкерный пептид, соединяющий маскирующий фрагмент (MM) и расщепляемый фрагмент (CM); L2 представляет собой линкерный пептид, соединяющий расщепляемый фрагмент (CM) и антитело; L3 представляет собой линкерный пептид, соединяющий вариабельные домены scFv; L4 представляет собой линкерный пептид, соединяющий антитело первой специфичности с антителом второй специфичности; CL представляет собой константный домен легкой цепи; и CH1, CH2, CH3 представляют собой константные домены тяжелой цепи. Первая и вторая специфичности могут быть направлены к любому антигену или эпитопу.
[000323] В некоторых вариантах осуществления активирующего T-клетки полиспецифического активируемого антитела один антиген, как правило, представляет собой антиген, содержащийся на поверхности опухолевой клетки или другого типа клеток, ассоциированных с заболеванием, таких как, но, не ограничиваясь ими, любая мишень, приведенная в таблице 1, такая как, но, не ограничиваясь ими, EGFR, erbB2, EpCAM, Jagged, PD-L1, B7H3 или CD71 (рецептор трансферрина), и другой антиген, как правило, представляет собой стимулирующий (также обозначаемый в настоящем описании как активирующий) или ингибирующий рецептор, содержащийся на поверхности T-клетки, естественной клетки-киллера (NK), миелоидной мононуклеарной клетки, макрофага и/или другой иммунной эффекторной клетки, такой как, но, не ограничиваясь ими, B7-H4, BTLA, CD3, CD4, CD8, CD16a, CD25, CD27, CD28, CD32, CD56, CD137 (также обозначаемый как TNFRSF9), CTLA-4, GITR, HVEM, ICOS, LAG3, NKG2D, OX40, PD-1, TIGIT, TIM3 или VISTA. Домен антитела, обеспечивающий специфичность к T-клеточному поверхностному антигену, также можно заменять лигандом или доменом лиганда, который связывается с T-клеточным рецептором, NK-клеточным рецептором, рецептором макрофага и/или другим рецептором иммунной эффекторной клетки, таким как, но, не ограничиваясь ими, B7-1, B7-2, B7H3, PD-L1, PD-L2 или TNFSF9. В некоторых вариантах осуществления направленного на множественные антигены активируемого антитела один антигенов выбран из группы мишеней, перечисленных в таблице 1, и другой антиген выбран из группы мишеней, перечисленных в таблице 1.
[000324] В некоторых вариантах осуществления антитело против клетки-мишени представляет собой антитело против EGFR. В некоторых вариантах осуществления антитело против клетки-мишени представляет собой C225v5, которое является специфическим в отношении связывания с EGFR. В некоторых вариантах осуществления антитело против клетки-мишени представляет собой C225, которое является специфическим в отношении связывания с EGFR. В некоторых вариантах осуществления антитело против клетки-мишени представляет собой C225v4, которое является специфическим в отношении связывания с EGFR. В некоторых вариантах осуществления антитело против клетки-мишени представляет собой C225v6, которое является специфическим в отношении связывания с EGFR. В некоторых вариантах осуществления антитело против клетки-мишени представляет собой антитело против Jagged. В некоторых вариантах осуществления антитело против клетки-мишени представляет собой 4D11, которое является специфическим в отношении связывания с Jagged 1 и Jagged 2 человека и мыши. В некоторых вариантах осуществления антитело против клетки-мишени представляет собой 4D11v2, которое является специфическим в отношении связывания с EGFR Jagged 1 и Jagged 2 человека и мыши.
[000325] В некоторых вариантах осуществления антитело против клетки-мишени может находиться в форме активируемого антитела. В некоторых вариантах осуществления scFv может (могут) находиться в форме про-scFv (см., например, WO 2009/025846, WO 2010/081173).
[000326] В некоторых вариантах осуществления scFv является специфическим в отношении связывания с CD3ε и представляет собой антитело или его фрагмент, или его получают из антитела или его фрагмента, который связывается с CD3ε, например, CH2527, FN18, H2C, OKT3, 2C11, UCHT1 или V9. В некоторых вариантах осуществления scFv является специфическим в отношении связывания с CTFA-4 (также обозначаемом в настоящем описании как CTFA и CTFA4).
[000327] В некоторых вариантах осуществления scFv против CTFA-4 содержит аминокислотную последовательность:
GGGSGGGGSGSGGGSGGGGSGGGEIVLTQSPGTLSLSPGERATLSCRASQSVSSSYLAWYQQKPGQAPRLLIYGASSRATGIPDRFSGSGSGTDFTLTISRLEPEDFAVYYCQQYGSSPLTFGGGTKVEIKRSGGSTITSYNVYYTKLSSSGTQVQLVQTGGGVVQPGRSLRLSCAASGSTFSSYAMSWVRQAPGKGLEWVSAISGSGGSTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCATNSLYWYFDLWGRGTLVTVSSAS (SEQ ID NO:510).
[000328] В некоторых вариантах осуществления scFv против CTLA-4 содержит аминокислотную последовательность, которая является по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичной аминокислотной последовательности SEQ ID NO:510.
[000329] В некоторых вариантах осуществления scFv против CD3ε содержит аминокислотную последовательность:
GGGSGGGGSGSGGGSGGGGSGGGQVQLQQSGAELARPGASVKMSCKASGYTFTRYTMHWVKQRPGQGLEWIGYINPSRGYTNYNQKFKDKATLTTDKSSSTAYMQLSSLTSEDSAVYYCARYYDDHYCLDYWGQGTTLTVSSGGGGSGGGGSGGGGSQIVLTQSPAIMSASPGEKVTMTCSASSSVSYMNWYQQKSGTSPKRWIYDTSKLASGVPAHFRGSGSGTSYSLTISGMEAEDAATYYCQQWSSNPFTFGSGTKLEINR (SEQ ID NO:511).
[000330] В некоторых вариантах осуществления scFv против CD3ε содержит аминокислотную последовательность, которая является по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичной аминокислотной последовательности SEQ ID NO:511.
[000331] В некоторых вариантах осуществления scFv является специфическим в отношении связывания с одной или более T-клетками, одной или более NK-клетками и/или одним или более макрофагами. В некоторых вариантах осуществления scFv является специфическим в отношении связывания с мишенью, выбранной из группы, состоящей из B7-H4, BTLA, CD3,CD4, CD8, CD 16a, CD25, CD27, CD28, CD32, CD56, CD137, CTLA-4, GITR, HVEM, ICOS, LAG3, NKG2D, OX40, PD-1, TIGIT, TIM3 или VISTA.
[000332] В некоторых вариантах осуществления полиспецифическое активируемое антитело также содержит средство, конъюгированное с AB. В некоторых вариантах осуществления средство представляет собой терапевтическое средство. В некоторых вариантах осуществления средство представляет собой антинеопластическое средство. В некоторых вариантах осуществления средство представляет собой токсин или его фрагмент. В некоторых вариантах осуществления средство конъюгировано с полиспецифическим активируемым антителом через линкер. В некоторых вариантах осуществления средство конъюгировано с AB через расщепляемый линкер. В некоторых вариантах осуществления средство конъюгировано с AB через линкер, который содержит по меньшей мере одну последовательность расщепляемого MMP субстрата. В некоторых вариантах осуществления линкер представляет собой нерасщепляемый линкер. В некоторых вариантах осуществления средство представляет собой ингибитор микротрубочек. В некоторых вариантах осуществления средство представляет собой повреждающее нуклеиновую кислоту средство, такое как алкилирующее ДНК средство или интеркалятор ДНК, или другое повреждающее ДНК средство. В некоторых вариантах осуществления линкер представляет собой расщепляемый линкер. В некоторых вариантах осуществления средство представляет собой средство, выбранное из группы, приведенной в таблице 4. В некоторых вариантах осуществления средство представляет собой доластатин. В некоторых вариантах осуществления средство представляет собой ауристатин или его производное. В некоторых вариантах осуществления средство представляет собой ауристатин E или его производное. В некоторых вариантах осуществления средство представляет собой монометилауристатин E (MMAE). В некоторых вариантах осуществления средство представляет собой монометилауристатин D (MMAD). В некоторых вариантах осуществления средство представляет собой майтанзиноид или производное майтанзиноида. В некоторых вариантах осуществления средство представляет собой DM1 или DM4. В некоторых вариантах осуществления средство представляет собой дуокармицин или его производное. В некоторых вариантах осуществления средство представляет собой калихимицин или его производное. В некоторых вариантах осуществления средство представляет собой пирролобензодиазепин.
[000333] В некоторых вариантах осуществления полиспецифическое активируемое антитело также содержит детектируемый фрагмент. В некоторых вариантах осуществления детектируемый фрагмент представляет собой диагностическое средство.
[000334] В некоторых вариантах осуществления полиспецифическое активируемое антитело естественным образом содержит одну или более дисульфидных связей. В некоторых вариантах осуществления полиспецифическое активируемое антитело можно конструировать так, чтобы вводить одну или более дисульфидных связей.
[000335] Изобретение также относится к выделенной молекуле нуклеиновой кислоты, кодирующей полиспецифическое активируемое антитело, описываемое в настоящем описании, а также векторы, которые содержат такие выделенные последовательности нуклеиновой кислоты. Изобретение относится к способам получения полиспецифического активируемого антитела культивированием клетки в условиях, которые приводят к экспрессии активируемого антитела, где клетка содержит такую молекулу нуклеиновой кислоты. В некоторых вариантах осуществления клетка содержит такой вектор.
[000336] Изобретение также относится к способу получения полиспецифических активируемых антител по изобретению путем (a) культивирования клетки, содержащей конструкцию нуклеиновой кислоты, кодирующей полиспецифическое активируемое антитело в условиях, которые приводят к экспрессии полиспецифического активируемого антитела, и (b) выделения полиспецифического активируемого антитела.
[000337] Изобретение также относится к полиспецифическим активируемым антителам и/или композициям полиспецифических активируемых антител, которые содержат по меньшей мере первое антитело или его антигенсвязывающий фрагмент (AB1), который специфически связывается с первой мишенью или первым эпитопом, и второе антитело или его антигенсвязывающий фрагмент (AB2), который связывается со второй мишенью или вторым эпитопом, где по меньшей мере AB1 является связанным или иным образом присоединенным к маскирующему фрагменту (MM1), таким образом, что связывание MM1 снижает способность AB1 связываться со своей мишенью. В некоторых вариантах осуществления MM1 является связанным с AB1 через последовательность первого расщепляемого фрагмента (CM1), которая содержит субстрат для протеазы, например, протеазы, которая является солокализованной с мишенью AB1 в участке лечения или участке проведения диагностики у индивидуума. Полиспецифические активируемые антитела, предоставленные в настоящем описании, являются стабильными в кровяном русле, активируются в предполагаемом участке проведения терапии и/или диагностики, но не в нормальной, т.е. здоровой ткани, и при активации характеризуются связыванием с мишенью AB1, которое является по меньшей мере сравнимым с соответствующим немодифицированным полиспецифическим антителом.
[000338] В некоторых вариантах осуществления полиспецифическое активируемое антитело содержит связывающий пептид между MM1 и CM1.
[000339] В некоторых вариантах осуществления полиспецифическое активируемое антитело содержит связывающий пептид между CM1 и AB1.
[000340] В некоторых вариантах осуществления активируемое антитело содержит первый связывающий пептид (LP1) и второй связывающий пептид (LP2), и по меньшей мере часть полиспецифического активируемого антитела в нерасщепленном состоянии имеет структурную организацию от N-конца к C-концу, как указано ниже: MM1-LP1-CM1-LP2-AB1 или AB1-LP2-CM1-LP1-MM1. В некоторых вариантах осуществления два связывающих пептида необязательно являются идентичными друг другу.
[000341] В некоторых вариантах осуществления по меньшей мере один из LP1 или LP2 содержит аминокислотную последовательность, выбранную из группы, состоящей из (GS)n, (GGS)n, (GSGGS)n (SEQ ID NO:1) и (GGGS)n (SEQ ID NO:2), где n представляет собой целое число по меньшей мере один. В некоторых вариантах осуществления по меньшей мере один из LP1 или LP2 содержит аминокислотную последовательность, выбранную из группы, состоящей из GGSG (SEQ ID NO:3), GGSGG (SEQ ID NO:4), GSGSG (SEQ ID NO:5), GSGGG (SEQ ID NO:6), GGGSG (SEQ ID NO:7) и GSSSG (SEQ ID NO:8).
[000342] В некоторых вариантах осуществления полиспецифическое активируемое антитело включает по меньшей мере первое антитело или его антигенсвязывающий фрагмент (AB1), который специфически связывается с первой мишенью или первым эпитопом, и второе антитело или его антигенсвязывающий фрагмент (AB2), который специфически связывается со второй мишенью или вторым эпитопом. В некоторых вариантах осуществления каждый из AB в полиспецифическом активируемом антителе независимо выбран из группы, состоящей из моноклонального антитела, доменного антитела, одноцепочечного фрагмента, фрагмента Fab, фрагмента F(ab')2, scFv, scab, dAb, однодоменного антитела, состоящего из тяжелой цепи, и однодоменного антитела, состоящего из легкой цепи. В некоторых вариантах осуществления каждый из AB в полиспецифическом активируемом антителе представляет собой моноклональное антитело грызуна (например, мыши или крысы), химерное, гуманизированное или полностью принадлежащее человеку моноклональное антитело.
[000343] В некоторых вариантах осуществления каждый из AB в полиспецифическом активируемом антителе имеет равновесную константу диссоциации связывания со своей соответствующей мишенью или эпитопом приблизительно 100 нМ или менее.
[000344] В некоторых вариантах осуществления MM1 имеет равновесную константу диссоциации связывания со своим соответствующим AB, которая является больше, чем равновесная константа диссоциации AB к своей соответствующей мишени или эпитопу.
[000345] В некоторых вариантах осуществления MM1 имеет равновесную константу диссоциации связывания со своим соответствующим AB, которая является больше, чем равновесная константа диссоциации AB к своей соответствующей мишени или эпитопу.
[000346] В некоторых вариантах осуществления MM1 не препятствует или не конкурирует со своим соответствующим AB за связывание с соответствующей мишенью или эпитопом, когда полиспецифическое активируемое антитело находится в расщепленном состоянии.
[000347] В некоторых вариантах осуществления MM1 представляет собой полипептид длиной приблизительно от 2 до 40 аминокислот. В некоторых вариантах осуществления каждый из MM в полиспецифическом активируемом антителе представляет собой полипептид длиной не более 40 аминокислот.
[000348] В некоторых вариантах осуществления MM1 содержит полипептидную последовательность, которая отличается от полипептидной последовательности мишени соответствующего AB.
[000349] В некоторых вариантах осуществления MM1 содержит полипептидную последовательность, которая является не более чем на 50% идентичной любому природному партнеру по связыванию соответствующего AB. В некоторых вариантах осуществления MM1 содержит полипептидную последовательность, которая является не более чем на 25% идентичной любому природному партнеру по связыванию соответствующего AB. В некоторых вариантах осуществления MM1 содержит полипептидную последовательность, которая является не более чем на 10% идентичной любому природному партнеру по связыванию соответствующего AB.
[000350] В некоторых вариантах осуществления связывание MM1 снижает способность соответствующего AB связываться со своей мишенью или эпитопом, таким образом, что константа диссоциации (Kd) AB при связывании с MM1 по отношению к своей соответствующей мишени или эпитопу является по меньшей мере в 20 раз больше, чем Kd AB, когда он не связан с MM1, по отношению к своей соответствующей мишени или эпитопу.
[000351] В некоторых вариантах осуществления связывание MM1 снижает способность соответствующего AB связываться со своей мишенью или эпитопом, таким образом, что константа диссоциации (Kd) AB при связывании с MM1 по отношению к своей соответствующей мишени или эпитопу является по меньшей мере в 40 раз больше, чем Kd AB, когда он не связан с MM1, по отношению к своей соответствующей мишени или эпитопу.
[000352] В некоторых вариантах осуществления связывание MM1 снижает способность соответствующего AB связываться со своей мишенью или эпитопом, таким образом, что константа диссоциации (Kd) AB при связывании с MM1 по отношению к своей соответствующей мишени или эпитопу является по меньшей мере в 100 раз больше, чем Kd AB, когда он не связан с MM1, по отношению к своей соответствующей мишени или эпитопу.
[000353] В некоторых вариантах осуществления связывание MM1 снижает способность соответствующего AB связываться со своей мишенью или эпитопом, таким образом, что константа диссоциации (Kd) AB при связывании с MM1 по отношению к своей соответствующей мишени или эпитопу является по меньшей мере в 1000 раз больше, чем Kd AB, когда он не связан с MM1, по отношению к своей соответствующей мишени или эпитопу.
[000354] В некоторых вариантах осуществления связывание MM1 снижает способность соответствующего AB связываться со своей мишенью или эпитопом, таким образом, что константа диссоциации (Kd) AB при связывании с MM1 по отношению к своей соответствующей мишени или эпитопу является по меньшей мере в 10000 раз больше, чем Kd AB, когда он не связан с MM1, по отношению к своей соответствующей мишени или эпитопу.
[000355] В некоторых вариантах осуществления MM1 представляет собой аминокислотную последовательность, выбранную из MM, описываемого в настоящем описании.
[000356] В некоторых вариантах осуществления полиспецифическое активируемое антитело содержит по меньшей мере второй маскирующий фрагмент (MM2), который ингибирует связывание AB2 с его мишенью, когда полиспецифическое активируемое антитело находится в нерасщепленном состоянии, и второй расщепляемый фрагмент (CM2), связанный с AB2, где CM2 представляет собой полипептид, который функционирует как субстрат для второй протеазы. В некоторых вариантах осуществления CM2 представляет собой полипептид длиной не более 15 аминокислот. В некоторых вариантах осуществления вторая протеаза солокализована со второй мишенью или эпитопом в ткани, и где вторая протеаза расщепляет CM2 в полиспецифическом активируемом антителе, когда полиспецифическое активируемое антитело подвергается действию второй протеазы. В некоторых вариантах осуществления первая протеаза и вторая протеаза являются солокализованными с первой мишенью или эпитопом и второй мишенью или эпитопом в ткани. В некоторых вариантах осуществления первая протеаза и вторая протеаза представляют собой одну и ту же протеазу. В некоторых вариантах осуществления CM1 и CM2 представляют собой разные субстраты для одной и той же протеазы. В некоторых вариантах осуществления протеаза выбрана из группы, состоящей из протеаз, представленных в таблице 7. В некоторых вариантах осуществления первая протеаза и вторая протеаза являются разными протеазами. В некоторых вариантах осуществления первая протеаза и вторая протеаза являются разными протеазами, выбранными из группы, состоящей из протеаз, представленных в таблице 7.
[000357] В некоторых вариантах осуществления каждый из MM в полиспецифическом активируемом антителе, например, MM1 и по меньшей мере MM2, имеет равновесную константу диссоциации связывания со своим соответствующим AB, которая является больше, чем равновесная константа диссоциации AB по отношению к своей соответствующей мишени или эпитопу.
[000358] В некоторых вариантах осуществления каждый из MM в полиспецифическом активируемом антителе имеет равновесную константу диссоциации связывания со своим соответствующим AB, которая является больше, чем равновесная константа диссоциации AB по отношению к своей соответствующей мишени или эпитопу.
[000359] В некоторых вариантах осуществления каждый из MM в полиспецифическом активируемом антителе не препятствует или не конкурирует со своим соответствующим AB за связывание с соответствующей мишенью или эпитопом, когда полиспецифическое активируемое антитело находится в расщепленном состоянии.
[000360] В некоторых вариантах осуществления каждый из MM в полиспецифическом активируемом антителе представляет собой полипептид длиной приблизительно от 2 до 40 аминокислот. В некоторых вариантах осуществления каждый из MM в полиспецифическом активируемом антителе представляет собой полипептид длиной не более 40 аминокислот.
[000361] В некоторых вариантах осуществления каждый из MM в полиспецифическом активируемом антителе содержит полипептидную последовательность, которая отличается от полипептидной последовательности мишени соответствующего AB.
[000362] В некоторых вариантах осуществления каждый из MM в полиспецифическом активируемом антителе содержит полипептидную последовательность, которая является не более чем 50% идентичной любому природному партнеру по связыванию соответствующего AB. В некоторых вариантах осуществления каждый из MM в полиспецифическом активируемом антителе содержит полипептидную последовательность, которая является не более чем на 25% идентичной любому природному партнеру по связыванию соответствующего AB. В некоторых вариантах осуществления каждый из MM в полиспецифическом активируемом антителе содержит полипептидную последовательность, которая является не более чем на 10% идентичной любому природному партнеру по связыванию соответствующего AB.
[000363] В некоторых вариантах осуществления связывание каждого из MM снижает способность соответствующего AB связываться со своей мишенью или эпитопом, таким образом, что константа диссоциации (Kd) AB при связывании с MM по отношению к своей соответствующей мишени или эпитопу является по меньшей мере в 20 раз больше, чем Kd AB, когда он не связан с MM, по отношению к своей соответствующей мишени или эпитопу.
[000364] В некоторых вариантах осуществления связывание каждого из MM снижает способность соответствующего AB связываться со своей мишенью или эпитопом, таким образом, что константа диссоциации (Kd) AB при связывании с MM по отношению к своей соответствующей мишени или эпитопу является по меньшей мере в 40 раз больше, чем Kd AB, когда он не связан с MM, по отношению к своей соответствующей мишени или эпитопу.
[000365] В некоторых вариантах осуществления связывание каждого из MM снижает способность соответствующего AB связываться со своей мишенью или эпитопом, таким образом, что константа диссоциации (Kd) AB при связывании с MM по отношению к своей соответствующей мишени или эпитопу является по меньшей мере в 100 раз больше, чем Kd AB, когда он не связан с MM, по отношению к своей соответствующей мишени или эпитопу.
[000366] В некоторых вариантах осуществления связывание каждого из MM снижает способность соответствующего AB связываться со своей мишенью или эпитопом, таким образом, что константа диссоциации (Kd) AB при связывании с MM по отношению к своей соответствующей мишени или эпитопу является по меньшей мере в 1000 раз больше, чем Kd AB, когда он не связан с MM, по отношению к своей соответствующей мишени или эпитопу.
[000367] В некоторых вариантах осуществления связывание каждого из MM снижает способность соответствующего AB связываться со своей мишенью или эпитопом, таким образом, что константа диссоциации (Kd) AB при связывании с MM по отношению к своей соответствующей мишени или эпитопу является по меньшей мере в 10000 раз больше, чем Kd AB, когда он не связан с MM, по отношению к своей соответствующей мишени или эпитопу.
[000368] В некоторых вариантах осуществления каждый из MM представляет собой аминокислотную последовательность, выбранную из MM, описываемого в настоящем описании.
[000369] В некоторых вариантах осуществления по меньшей мере один из CM1 и/или CM2 расщепляется по меньшей мере одной протеазой MMP. В некоторых вариантах осуществления по меньшей мере один из CM1 и/или CM2 содержит аминокислотную последовательность, выбранную из группы, состоящей из ISSGLLSS (SEQ ID NO:14); QNQALRMA (SEQ ID NO:15); AQNLLGMV (SEQ ID NO:16); STFPFGMF (SEQ ID NO:17); PVGYTSSL (SEQ ID NO:18); DWLYWPGI (SEQ ID NO:19); MIAPVAYR (SEQ ID NO:20); RPSPMWAY (SEQ ID NO:21); WATPRPMR (SEQ ID NO:22); FRLLDWQW (SEQ ID NO:23); LKAAPRWA (SEQ ID NO:24); GPSHLVLT (SEQ ID NO:25); LPGGLSPW (SEQ ID NO:26); MGLFSEAG (SEQ ID NO:27); SPLPLRVP (SEQ ID NO:28); RMHLRSLG (SEQ ID NO:29); LAAPLGLL (SEQ ID NO:30); AVGLLAPP (SEQ ID NO:31); LLAPSHRA (SEQ ID NO:32); PAGLWLDP (SEQ ID NO:33) и ISSGLSS (SEQ ID NO:159).
[000370] В некоторых вариантах осуществления по меньшей мере один из CM1 и/или CM2 содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:364-370, 379-393, 402-409, 420-424, 434, 435, 450-452, 457, 470-472, 474 и 483.
[000371] В некоторых вариантах осуществления по меньшей мере один из CM1 и/или CM2 содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:328, 336-339 и 348-351.
[000372] В некоторых вариантах осуществления протеаза, которая расщепляет последовательность первого расщепляемого фрагмента (CM1), солокализована с мишенью AB1 в полиспецифическом активируемом антителе в ткани, и протеаза расщепляет CM1 в полиспецифическом активируемом антителе, когда полиспецифическое активируемое антитело подвергается действию протеазы.
[000373] В некоторых вариантах осуществления полиспецифическое активируемое антитело содержит более чем одну последовательность расщепляемого фрагмента, и протеаза, которая расщепляет по меньшей мере одну последовательность расщепляемого фрагмента, солокализована с мишенью по меньшей мере одной из областей AB в полиспецифическом активируемом антителе в ткани, и протеаза расщепляет CM в полиспецифическом активируемом антителе, когда полиспецифическое активируемое антитело подвергается действию протеазы.
[000374] В некоторых вариантах осуществления каждый CM, например, CM1 и по меньшей мере CM2, располагают в полиспецифическом активируемом антителе, таким образом, что в нерасщепленном состоянии связывание полиспецифического активируемого антитела с мишенью одной из областей AB приводит в возникновению равновесной константы диссоциации, которая является по меньшей мере в два раза больше, чем равновесная константа диссоциации связывания немодифицированного AB со своей мишенью, и в расщепленном состоянии AB связывается со своей мишенью.
[000375] В некоторых вариантах осуществления каждый CM, например, CM1 и по меньшей мере CM2, располагают в полиспецифическом активируемом антителе, таким образом, что в нерасщепленном состоянии, связывание полиспецифического активируемого антитела с мишенью одной из областей AB приводит в возникновению равновесной константы диссоциации, которая является по меньшей мере в три раза больше, чем равновесная константа диссоциации связывания немодифицированного AB со своей мишенью, и в расщепленном состоянии AB связывается со своей мишенью.
[000376] В некоторых вариантах осуществления каждый CM, например, CM1 и по меньшей мере CM2, располагают в полиспецифическом активируемом антителе, таким образом, что в нерасщепленном состоянии, связывание полиспецифического активируемого антитела с мишенью одной из областей AB приводит в возникновению равновесной константы диссоциации, которая является по меньшей мере в четыре раза больше, чем равновесная константа диссоциации связывания немодифицированного AB со своей мишенью, и в расщепленном состоянии AB связывается со своей мишенью.
[000377] В некоторых вариантах осуществления каждый CM, например, CM1 и по меньшей мере CM2, располагают в полиспецифическом активируемом антителе, таким образом, что в нерасщепленном состоянии, связывание полиспецифического активируемого антитело с мишенью одной из областей AB приводит в возникновению равновесной константы диссоциации, которая является по меньшей мере в пять раз больше, чем равновесная константа диссоциации связывания немодифицированного AB со своей мишенью, и в расщепленном состоянии AB связывается со своей мишенью.
[000378] В некоторых вариантах осуществления каждый CM, например, CM1 и по меньшей мере CM2, располагают в полиспецифическом активируемом антителе, таким образом, что в нерасщепленном состоянии, связывание полиспецифического активируемого антитела с мишенью одной из областей AB приводит в возникновению равновесной константы диссоциации, которая является по меньшей мере в десять раз больше, чем равновесная константа диссоциации связывания немодифицированного AB со своей мишенью, и в расщепленном состоянии AB связывается со своей мишенью.
[000379] В некоторых вариантах осуществления каждый CM, например, CM1 и по меньшей мере CM2, располагают в полиспецифическом активируемом антителе, таким образом, что в нерасщепленном состоянии, связывание полиспецифического активируемого антитела с мишенью одной из областей AB приводит в возникновению равновесной константы диссоциации, которая является по меньшей мере в 20 раз больше, чем равновесная константа диссоциации связывания немодифицированного AB со своей мишенью, и в расщепленном состоянии, AB связывается со своей мишенью.
[000380] В некоторых вариантах осуществления каждый CM располагают в полиспецифическом активируемом антителе, таким образом, что в нерасщепленном состоянии, связывание полиспецифического активируемого антитела с мишенью одной из областей AB приводит в возникновению равновесной константы диссоциации, которая является по меньшей мере в 40 раз больше, чем равновесная константа диссоциации связывания немодифицированного AB со своей мишенью, и в расщепленном состоянии AB связывается со своей мишенью.
[000381] В некоторых вариантах осуществления каждый CM располагают в полиспецифическом активируемом антителе, таким образом, что в нерасщепленном состоянии, связывание полиспецифического активируемого антитела с мишенью одной из областей AB приводит в возникновению равновесной константы диссоциации, которая является по меньшей мере в 50 раз больше, чем равновесная константа диссоциации связывания немодифицированного AB со своей мишенью, и в расщепленном состоянии AB связывается со своей мишенью.
[000382] В некоторых вариантах осуществления каждый CM располагают в полиспецифическом активируемом антителе, таким образом, что в нерасщепленном состоянии, связывание полиспецифического активируемого антитела с мишенью одной из областей AB приводит в возникновению равновесной константы диссоциации, которая является по меньшей мере в 100 раз больше, чем равновесная константа диссоциации связывания немодифицированного AB со своей мишенью, и в расщепленном состоянии AB связывается со своей мишенью.
[000383] В некоторых вариантах осуществления каждый CM располагают в полиспецифическом активируемом антителе, таким образом, что в нерасщепленном состоянии, связывание полиспецифического активируемого антитела с мишенью одной из областей AB приводит в возникновению равновесной константы диссоциации, которая является по меньшей мере в 200 раз больше, чем равновесная константа диссоциации связывания немодифицированного AB со своей мишенью, и в расщепленном состоянии AB связывается со своей мишенью.
[000384] В некоторых вариантах осуществления каждый CM в полиспецифическом активируемом антителе представляет собой полипептид длиной до 15 аминокислот.
[000385] В некоторых вариантах осуществления по меньшей мере один CM в полиспецифическом активируемом антителе содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:14-33 и 159, и другой CM содержит аминокислотную последовательность LSGRSDNH (SEQ ID NO:26). В некоторых вариантах осуществления по меньшей мере один CM содержит аминокислотную последовательность LSGRSDNH (SEQ ID NO:26). В некоторых вариантах осуществления по меньшей мере один расщепляемый фрагмент выбирают для использования с конкретной протеазой, например, протеазой, для которой известно, что она солокализована по меньшей мере с одной мишенью полиспецифического активируемого антитела. Например, подходящие расщепляемые фрагменты для применения в полиспецифических активируемых антителах по изобретению расщепляются по меньшей мере протеазой, такой как урокиназа, легумаин и/или матриптаза (также обозначаемой в настоящем описании как MT-SP1 или MTSP1). В некоторых вариантах осуществления подходящий расщепляемый фрагмент содержит по меньшей мере одну из следующих ниже последовательностей: TGRGPSWV (SEQ ID NO:34); SARGPSRW (SEQ ID NO:35); TARGPSFK (SEQ ID NO:36); LSGRSDNH (SEQ ID NO:37); GGWHTGRN (SEQ ID NO:38); HTGRSGAL (SEQ ID NO:39); PLTGRSGG (SEQ ID NO:40); AARGPAIH (SEQ ID NO:41); RGPAFNPM (SEQ ID NO:42); SSRGPAYL (SEQ ID NO:43); RGPATPIM (SEQ ID NO:44); RGPA (SEQ ID NO:45); GGQPSGMWGW (SEQ ID NO:46); FPRPLGITGL (SEQ ID NO:47); VHMPLGFLGP (SEQ ID NO:48); SPLTGRSG (SEQ ID NO:49); SAGFSLPA (SEQ ID NO:126); LAPLGLQRR (SEQ ID NO:50); SGGPLGVR (SEQ ID NO:51) и/или PLGL (SEQ ID NO:52).
[000386] В некоторых вариантах осуществления один CM представляет собой субстрат по меньшей мере для одной протеазы MMP, и другой CM в полиспецифическом активируемом антителе представляет собой субстрат для протеазы, выбранной из группы, состоящей из протеаз, представленных в таблице 7. В некоторых вариантах осуществления протеаза выбрана из группы, состоящей из uPA, легумаина, матриптазы, ADAM 17, BMP-1, TMPRSS3, TMPRSS4, нейтрофильной эластазы, MMP-7, MMP-9, MMP-12, MMP-13 и MMP-14. В некоторых вариантах осуществления протеаза представляет собой катепсин, такой как, но, не ограничиваясь им, катепсин S. В некоторых вариантах осуществления каждый CM в полиспецифическом активируемом антителе представляет собой субстрат для протеазы, выбранной из группы, состоящей из uPA (урокиназного активатора плазминогена), легумаина и матриптазы. В некоторых вариантах осуществления протеаза представляет собой uPA. В некоторых вариантах осуществления протеаза представляет собой легумаин. В некоторых вариантах осуществления протеаза представляет собой матриптазу. В некоторых вариантах осуществления протеаза представляет собой матриксную металлопротеиназу (MMP).
[000387] В некоторых вариантах осуществления по меньшей мере один CM в полиспецифическом активируемом антителе представляет собой субстрат по меньшей мере для двух протеаз. В некоторых вариантах осуществления каждая протеаза выбрана из группы, состоящей из протеаз, представленных в таблице 7. В некоторых вариантах осуществления по меньшей мере один CM в полиспецифическом активируемом антителе представляет собой субстрат по меньшей мере для двух протеаз, где одна из протеаз выбрана из группы, состоящей из uPA, легумаина и матриптазы, а другая протеаза выбрана из группы, состоящей из протеаз, представленных в таблице 7. В некоторых вариантах осуществления по меньшей мере один CM в полиспецифическом активируемом антителе представляет собой субстрат по меньшей мере для двух протеаз, выбранных из группы, состоящей из uPA, легумаина и матриптазы.
[000388] В некоторых вариантах осуществления полиспецифическое активируемое антитело содержит по меньшей мере первый CM (CM1) и второй CM (CM2). В некоторых вариантах осуществления CM1 и CM2 являются частью одного расщепляемого линкера, который присоединяет MM к AB. В некоторых вариантах осуществления CM1 является частью расщепляемого линкера, который присоединяет MM1 к AB1, и CM2 является частью отдельного расщепляемого линкера, который присоединяет MM2 к AB2. В некоторых вариантах осуществления полиспецифическое активируемое антитело содержит более двух CM. В некоторых вариантах осуществления такое активируемое антитело содержит более двух CM и более двух MM. В некоторых вариантах осуществления каждый из CM1 и CM2 представляет собой полипептид длиной не более 15 аминокислот. В некоторых вариантах осуществления по меньшей мере один из первого CM и второго CM представляет собой полипептид, который функционирует как субстрат для протеазы, выбранной из группы, состоящей из протеаз, перечисленных в таблице 7. В некоторых вариантах осуществления по меньшей мере один из первого CM и второго CM представляет собой полипептид, который функционирует как субстрат для протеазы, выбранной из группы, состоящей из uPA, легумаина и матриптазы. В некоторых вариантах осуществления первый CM расщепляется первым расщепляющим средством, выбранным из группы, состоящей из uPA, легумаина и матриптазы в ткани-мишени, и второй CM расщепляется вторым расщепляющим средством в ткани-мишени. В некоторых вариантах осуществления другую протеазу выбирают из группы, состоящей из протеаз, представленных в таблице 7. В некоторых вариантах осуществления первое расщепляющее средство и второе расщепляющее средство представляют собой одну и ту же протеазу, выбранную из группы, состоящей из протеаз, перечисленных в таблице 7, и первый CM и второй CM представляют собой различные субстраты для фермента. В некоторых вариантах осуществления первое расщепляющее средство и второе расщепляющее средство представляют собой одну и ту же протеазу, выбранную из группы, состоящей из uPA, легумаина и матриптазы, и первый CM и второй CM представляют собой различные субстраты для фермента. В некоторых вариантах осуществления первое расщепляющее средство и второе расщепляющее средство представляют собой одну и ту же протеазу, выбранную из группы, приведенной в таблице 7, и первый CM и второй CM представляют собой один и тот же субстрат. В некоторых вариантах осуществления первое расщепляющее средство и второе расщепляющее средство представляют собой различные протеазы. В некоторых вариантах осуществления первое расщепляющее средство и второе расщепляющее средство представляют собой различные протеазы, выбранные из группы, состоящей из протеаз, представленных в таблице 7. В некоторых вариантах осуществления первое расщепляющее средство и второе расщепляющее средство солокализованы в ткани-мишени. В некоторых вариантах осуществления первый CM и второй CM расщепляются по меньшей мере одним расщепляющим средством в ткани-мишени.
[000389] В некоторых вариантах осуществления полиспецифическое активируемое антитело подвергается действию и расщепляется протеазой, таким образом, что в активированном или расщепленном состоянии активированное полиспецифическое активируемое антитело содержит аминокислотную последовательность легкой цепи, которая содержит по меньшей мере участок последовательности LP2 и/или CM после того, как протеаза расщепляет CM.
[000390] Изобретение также относится к композициям и способам, которые включают полиспецифическое активируемое антитело, которое включает по меньшей мере первое антитело или фрагмент антитела (AB1), который специфически связывается с мишенью, и второе антитело или фрагмент антитела (AB2), где по меньшей мере первый AB в полиспецифическом активируемом антителе является связанным с маскирующим фрагментом (MM1), который снижает способность AB1 связываться со своей мишенью. В некоторых вариантах осуществления каждый AB является связанным с MM, что снижает способность соответствующего AB связываться со своей мишенью. Например, в вариантах осуществления биспецифического активируемого антитела AB1 является связанным с первым маскирующим фрагментом (MM1), который снижает способность AB1 связываться со своей мишенью, и AB2 является связанным со вторым маскирующим фрагментом (MM2), который снижает способность AB2 связываться со своей мишенью. В некоторых вариантах осуществления полиспецифическое активируемое антитело содержит более двух областей AB; в таких вариантах осуществления AB1 является связанным с первым маскирующим фрагментом (MM1), который снижает способность AB1 связываться со своей мишенью, AB2 является связанным со вторым маскирующим фрагментом (MM2), который снижает способность AB2 связываться со своей мишенью, AB3 является связанным с третьим маскирующим фрагментом (MM3), который снижает способность AB3 связываться со своей мишенью, и так далее для каждого AB в полиспецифическом активируемом антителе.
[000391] В некоторых вариантах осуществления полиспецифическое активируемое антитело дополнительно содержит по меньшей мере один расщепляемый фрагмент (CM), который представляет собой субстрат для протеазы, где CM связывает MM с AB. Например, в некоторых вариантах осуществления полиспецифическое активируемое антитело включает по меньшей мере первое антитело или фрагмент антитела (AB1), который специфически связывается с мишенью, и второе антитело или фрагмент антитела (AB2), где по меньшей мере первый AB в полиспецифическом активируемом антителе присоединяют через первый расщепляемый фрагмент (CM1) к маскирующему фрагменту (MM1), что снижает способность AB1 связываться со своей мишенью. В некоторых вариантах осуществления биспецифического активируемого антитела AB1 присоединяют через CM1 к MM1, и AB2 присоединяют через второй расщепляемый фрагмент (CM2) ко второму маскирующему фрагменту (MM2), что снижает способность AB2 связываться со своей мишенью. В некоторых вариантах осуществления полиспецифическое активируемое антитело содержит более двух областей AB; в некоторых из этих вариантов осуществления AB1 присоединяют через CM1 к MM1, AB2 присоединяют через CM2 к MM2, и AB3 присоединяют через третий расщепляемый фрагмент (CM3) у третьему маскирующему фрагменту (MM3), что снижает способность AB3 связываться со своей мишенью, и так далее для каждого AB в полиспецифическом активируемом антителе.
Активируемые антитела, содержащие несвязывающие стерические фрагменты или партнеры по связыванию для несвязывающих стерических фрагментов
[000392] Изобретение также относится к активируемым антителам, которые содержат несвязывающие стерические фрагменты (NB) или партнеры по связыванию (BP) для несвязывающих стерических фрагментов, где BP рекрутирует или иным образом притягивает NB к активируемому антителу. Активируемые антитела, предоставленные в настоящем описании, включают, например, активируемое антитело, которое содержит несвязывающий стерический фрагмент (NB), расщепляемый линкер (CL) и антитело или фрагмент антитела (AB), который связывается с мишенью; активируемое антитело, которое содержит партнер по связыванию для несвязывающего стерического фрагмента (BP), CL и AB; и активируемое антитело, которое содержит BP, к которому рекрутировался NB, CL и AB, который связывается с мишенью. Активируемые антитела, в которых NB является ковалентно связанным с CL и AB активируемого антитела или является связанным в результате взаимодействия с BP, который является ковалентно связанным с CL и AB активируемого антитела, обозначают в настоящем описании как "содержащие NB активируемые антитела". Под активируемым или переключаемым подразумевают, что активируемое антитело характеризуется первым уровнем связывания с мишенью, когда активируемое антитело находится в ингибированном, маскированном или нерасщепленном состоянии (т.е. первой конформации), и вторым уровнем связывания с мишенью, когда активируемое антитело находится в неингибированном, немаскированном и/или расщепленном состоянии (т.е. второй конформации, т.е. активированное антитело), где второй уровень связывания с мишенью является больше, чем первый уровень связывания с мишенью. Композиции активируемого антитела могут обладать повышенной биодоступностью и более благоприятным биораспределением по сравнению с общепринятыми терапевтическими средствами на основе антитела.
[000393] В некоторых вариантах осуществления активируемые антитела обеспечивают пониженную токсичность и/или нежелательные побочные эффекты, которые могут иным образом возникать в результате связывания в участках, не относящихся к участкам лечения и/или диагностическим участкам, если не проводили маскирование AB или иным образом не ингибирование его связывание с таким участком.
[000394] В одном из вариантов осуществления активируемое антитело содержит несвязывающий стерический фрагмент (NB); расщепляемый линкер (CL) и антитело или фрагмент антитела (AB), который специфически связывается с мишенью, где NB представляет собой полипептид, который не связывается специфически с AB; CL представляет собой полипептид, который содержит субстрат (S) для фермента; CL располагают таким образом, чтобы в нерасщепленном состоянии NB препятствовал связыванию AB с мишенью, а в расщепленном состоянии NB не препятствовал связыванию AB с мишенью; и NB не ингибирует расщепление CL ферментом. Как используют в настоящем описании и на всем его протяжении термин полипептид относится к любому полипептиду, который содержит по меньшей мере два аминокислотных остатка, включая более крупные полипептиды, полноразмерные белки и их фрагменты, и термин полипептид не является ограниченным одноцепочечными полипептидами и может включать состоящие из многих звеньев, например, многоцепочечные, полипептиды. В случаях, когда полипептид имеет меньшую длину, например, всего менее 50 аминокислот, термины пептид и полипептид в настоящем описании используют взаимозаменяемо, и в случаях, когда полипептид имеет большую длину, например, 50 аминокислот или более, термины полипептид и белок в настоящем описании используют взаимозаменяемо.
[000395] В одном из вариантов осуществления активируемое антитело содержит несвязывающий стерический фрагмент (NB); расщепляемый линкер (CL) и антитело или фрагмент антитела (AB), который специфически связывается с мишенью, где (i) NB содержит полипептид, который не связывается специфически с AB; (ii) CL представляет собой полипептид длиной до 50 аминокислот, который содержит субстрат (S) для фермента; (iii) CL располагают таким образом, чтобы в нерасщепленном состоянии NB препятствовал связыванию AB с мишенью, а в расщепленном состоянии NB не препятствовал связыванию AB с мишенью, и (iv) NB не ингибирует расщепление CL ферментом. Например, CL имеет длину до 15 аминокислот, длину до 20 аминокислот, длину до 25 аминокислот, длину до 30 аминокислот, длину до 35 аминокислот, длину до 40 аминокислот, длину до 45 аминокислот, длину до 50 аминокислот, длину в диапазоне 10-50 аминокислот, длину в диапазоне 15-50 аминокислот, длину в диапазоне 20-50аминокислот, длину в диапазоне 25-50 аминокислот, длину в диапазоне 30-50 аминокислот, длину в диапазоне 35-50 аминокислот, длину в диапазоне 40-50 аминокислот, длину в диапазоне 45-50 аминокислот, длину в диапазоне 10-40 аминокислот, длину в диапазоне 15-40 аминокислот, длину в диапазоне 20-40 аминокислот, длину в диапазоне 25-40 аминокислот, длину в диапазоне 30-40 аминокислот, длину в диапазоне 35-40 аминокислот, длину в диапазоне 10-30 аминокислот, длину в диапазоне 15-30 аминокислот, длину в диапазоне 20-30 аминокислот, длину в диапазоне 25-30 аминокислот, длину в диапазоне 10-20 аминокислот или длину в диапазоне 10-15 аминокислот.
[000396] В одном из вариантов осуществления активируемое антитело содержит несвязывающий стерический фрагмент (NB); расщепляемый линкер (CL) и антитело или фрагмент антитела (AB), который специфически связывается с мишенью, где (i) NB содержит полипептид, который не связывается специфически с AB; (ii) CL представляет собой полипептид, который содержит субстрат (S) для фермента; (iii) CL располагают таким образом, чтобы в нерасщепленном состоянии NB препятствовал связыванию AB с мишенью, а в расщепленном состоянии NB не препятствовал связыванию AB с мишенью; (iv) NB не ингибирует расщепление CL ферментом, и (v) активируемое антитело в нерасщепленном состоянии имеет структурную организацию от N-конца к C-концу, как указано ниже: NB-CL-AB или AB-CL-NB.
[000397] В одном из вариантов осуществления активируемое антитело содержит несвязывающий стерический фрагмент (NB); расщепляемый линкер (CL) и антитело или фрагмент антитела (AB), который специфически связывается с мишенью, где (i) NB содержит полипептид, который не связывается специфически с AB; (ii) CL представляет собой полипептид, который содержит субстрат (S) для фермента; (iii) CL располагают таким образом, чтобы в нерасщепленном состоянии NB препятствовал связыванию AB с мишенью, а в расщепленном состоянии NB не препятствовал связыванию AB с мишенью, и где NB в нерасщепленном активируемом антителе снижает способность AB связываться мишень по меньшей мере на 50%, например, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 100% по сравнению со способностью расщепленного AB связываться с мишенью; и (iv) NB не ингибирует расщепление CL ферментом. Уменьшение способности AB связываться с мишенью определяют, например, с использованием анализа, как описано в настоящем описании, или анализа замещения мишени in vitro, таким как, например, анализ, описанный в публикациях PCT № WO 2009/025846 и WO 2010/081173.
[000398] В одном из вариантов осуществления активируемое антитело содержит партнер по связыванию (BP) для несвязывающего стерического фрагмента (NB); расщепляемый линкер (CL) и антитело или фрагмент антитела (AB), который специфически связывается с мишенью, где BP представляет собой полипептид, который связывается с NB, когда подвергается его воздействию; NB не связывается специфически с AB; CL представляет собой полипептид, который содержит субстрат (S) для фермента; CL располагают таким образом, чтобы в нерасщепленном состоянии в присутствии NB NB препятствовал связыванию AB с мишенью, а в расщепленном состоянии NB не препятствовал связыванию AB с мишенью, и BP не препятствовал связыванию AB с мишенью; и NB и BP не ингибируют расщепление CL ферментом. В некоторых примерах такого варианта осуществления BP активируемого антитела является необязательно связанным с NB. В одном из вариантов осуществления NB рекрутируется BP активируемого антитела in vivo.
[000399] В некоторых примерах любого из таких вариантов осуществления активируемого антитела активируемое антитело формулируют в виде композиции. В некоторых из этих вариантов осуществления композиция также содержит NB, где NB формулируют совместно с активируемым антителом, которое содержит BP, CL и AB. В некоторых примерах такого варианта осуществления BP выбран из группы, состоящей из связывающегося с альбумином пептида, связывающегося с фибриногеном пептида, связывающегося с фибронектином пептида, связывающегося с гемоглобином пептида, связывающегося с трансферрином пептида, связывающегося с доменом иммуноглобулина пептида и связывающихся с другими сывороточными белками пептидов.
[000400] В некоторых примерах любого из таких вариантов осуществления активируемого антитела NB представляет собой растворимый глобулярный белок. В некоторых примерах любого из таких вариантов осуществления активируемого антитела NB представляет собой белок, который циркулирует в кровотоке. В некоторых примерах любого из таких вариантов осуществления активируемого антитела NB выбран из группы, состоящей из альбумина, фибриногена, фибронектина, гемоглобина, трансферрина, домена иммуноглобулина и других сывороточных белков.
[000401] В некоторых примерах любого из таких вариантов осуществления активируемого антитела CL представляет собой полипептид, который содержит субстрат (S) для протеазы. В некоторых примерах любого из таких вариантов осуществления активируемого антитела протеаза солокализована в ткани, и протеаза расщепляет CL в активируемом антителе, когда активируемое антитело подвергается действию протеазы. В некоторых примерах любого из таких вариантов осуществления активируемого антитела CL представляет собой полипептид длиной до 50 аминокислот. В некоторых примерах любого из таких вариантов осуществления активируемого антитела CL представляет собой полипептид, который содержит субстрат (S) длиной до 15 аминокислоты, например, длиной 3 аминокислоты, длиной 4 аминокислоты, длиной 5 аминокислот, длиной 6 аминокислот, длиной 7 аминокислот, длиной 8 аминокислот, длиной 9 аминокислот, длиной 10 аминокислот, длиной 11 аминокислот, длиной 12 аминокислот, длиной 13 аминокислот, длиной 14 аминокислот или длиной 15 аминокислот.
[000402] В некоторых примерах любого из таких вариантов осуществления активируемого антитела активируемое антитело в нерасщепленном состоянии имеет структурную организацию от N-конца к C-концу, как указано ниже: NB-CL-AB, AB-CL-NB, BP-CL-AB или AB-CL-BP. В вариантах осуществления, где активируемое антитело содержит BP, и активируемое антитело находится в присутствии соответствующего NB, активируемое антитело в нерасщепленном состоянии имеет структурную организацию от N-конца к C-концу, как указано ниже: NB:BP-CM-AB или AB-CM-BP:NB, где существует взаимодействие, например, связывание между NB и BP.
[000403] В некоторых примерах любого из таких вариантов осуществления активируемого антитела активируемое антитело включает антитело или его антигенсвязывающий фрагмент, который специфически связывается с данной мишенью, и представляет собой моноклональное антитело, доменное антитело, одноцепочечный фрагмент, фрагмент Fab, фрагмент F(ab')2, scFv, scab, dAb, однодоменное антитело, состоящее из тяжелой цепи, или однодоменное антитело, состоящее из легкой цепи. В некоторых вариантах осуществления такое антитело или его иммунологически активный фрагмент, который связывается с мишенью, представляет собой моноклональное антитело мыши, другого грызуна, химерное, гуманизированное или полностью принадлежащее человеку моноклональное антитело.
[000404] В некоторых примерах любого из таких вариантов осуществления активируемого антитела активируемое антитело содержит комбинацию вариабельной области тяжелой цепи, содержащей аминокислотную последовательность, предоставленную в настоящем описании, и вариабельной области легкой цепи, содержащей аминокислотную последовательность, предоставленную в настоящем описании. В некоторых вариантах осуществления активируемое антитело содержит комбинацию вариабельной области тяжелой цепи, содержащей аминокислотную последовательность, которая является по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичной аминокислотной последовательности, предоставленной в настоящем описании, и вариабельной области легкой цепи, содержащей аминокислотную последовательность, которая является по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичной аминокислотной последовательности, предоставленной в настоящем описании.
[000405] В некоторых примерах любого из таких вариантов осуществления активируемого антитела активируемое антитело также содержит средство, конъюгированное с AB. В некоторых вариантах осуществления средство представляет собой терапевтическое средство. В некоторых вариантах осуществления средство представляет собой антинеопластическое средство. В некоторых вариантах осуществления средство представляет собой токсин или его фрагмент. В некоторых вариантах осуществления средство конъюгировано с AB через линкер. В некоторых вариантах осуществления линкер представляет собой расщепляемый линкер. В некоторых вариантах осуществления средство конъюгировано с AB через нерасщепляемый линкер. В некоторых вариантах осуществления средство представляет собой средство, выбранное из группы, приведенной в таблице 3. В некоторых вариантах осуществления средство представляет собой ингибитор микротрубочек. В некоторых вариантах осуществления средство представляет собой повреждающее нуклеиновую кислоту средство, такое как алкилирующее ДНК средство или интеркалятор ДНК, или другое повреждающее ДНК средство. В некоторых вариантах осуществления средство представляет собой доластатин. В некоторых вариантах осуществления средство представляет собой ауристатин или его производное. В некоторых вариантах осуществления средство представляет собой ауристатин E или его производное. В некоторых вариантах осуществления средство представляет собой монометилауристатин E (MMAE). В некоторых вариантах осуществления средство представляет собой монометилауристатин D (MMAD). В некоторых вариантах осуществления средство представляет собой майтанзиноид или производное майтанзиноида. В некоторых вариантах осуществления средство представляет собой DM1 или DM4. В некоторых вариантах осуществления средство представляет собой дуокармицин или его производное. В некоторых вариантах осуществления средство представляет собой калихимицин или его производное. В некоторых вариантах осуществления средство представляет собой пирролобензодиазепин.
[000406] В некоторых примерах любого из таких вариантов осуществления активируемого антитела активируемое антитело также содержит детектируемый фрагмент. В некоторых вариантах осуществления детектируемый фрагмент представляет собой диагностическое средство.
[000407] В некоторых примерах любого из таких вариантов осуществления активируемого антитела активируемое антитело также содержит спейсер. В некоторых примерах любого из таких вариантов осуществления активируемого антитела активируемое антитело также содержит сигнальный пептид. В некоторых вариантах осуществления сигнальный пептид конъюгирован с активируемым антителом через спейсер. В некоторых примерах любого из таких вариантов осуществления активируемого антитела спейсер присоединяют непосредственно к MM активируемого антитела.
[000408] В некоторых вариантах осуществления время полувыведения из сыворотки активируемого антитела является больше, чем соответствующего антитела; например, pK активируемого антитела является больше, чем pK соответствующего антитела. В некоторых вариантах осуществления время полувыведения из сыворотки активируемого антитела является таким же, как время полувыведения из сыворотки соответствующего антитела. В некоторых вариантах осуществления при введении в организм время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 15 суток. В некоторых вариантах осуществления при введении в организм время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 12 суток. В некоторых вариантах осуществления при введении в организм время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 11 суток. В некоторых вариантах осуществления при введении в организм время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 10 суток. В некоторых вариантах осуществления при введении в организм время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 9 суток. В некоторых вариантах осуществления при введении в организм время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 8 суток. В некоторых вариантах осуществления при введении в организм время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 7 суток. В некоторых вариантах осуществления при введении в организм время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 6 суток. В некоторых примерах любого из таких вариантов осуществления активируемого антитела при введении в организм время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 5 суток. В некоторых вариантах осуществления при введении в организм время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 4 суток. В некоторых вариантах осуществления при введении в организм время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 3 суток. В некоторых вариантах осуществления при введении в организм время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 2 суток. В некоторых вариантах осуществления при введении в организм время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 24 часа. В некоторых вариантах осуществления при введении в организм время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 20 часов. В некоторых вариантах осуществления при введении в организм время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 18 часов. В некоторых вариантах осуществления при введении в организм время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 16 часов. В некоторых вариантах осуществления при введении в организм время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 14 часов. В некоторых вариантах осуществления при введении в организм время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 12 часов. В некоторых вариантах осуществления при введении в организм время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 10 часов. В некоторых вариантах осуществления при введении в организм время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 8 часов. В некоторых вариантах осуществления при введении в организм время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 6 часов. В некоторых вариантах осуществления при введении в организм время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 4 часа. В некоторых вариантах осуществления при введении в организм время полувыведения из сыворотки активируемого антитела составляет по меньшей мере 3 часа.
[000409] Изобретение также относится к выделенной молекуле нуклеиновой кислоты, кодирующей любое из таких активируемых антител, а также к векторам, которые содержат такие выделенные последовательности нуклеиновой кислоты. Изобретение относится к способам получения активируемого антитела культивированием клетки в условиях, которые приводят к экспрессии активируемого антитела, где клетка содержит такую последовательность нуклеиновой кислоты. В некоторых вариантах осуществления клетка содержит такой вектор.
[000410] Константа диссоциации (Kd) содержащего NB активируемого антитела по отношению к мишени является больше, чем Kd AB по отношению к мишени, когда он не является связанным с NB или NB:BP. Константа диссоциации (Kd) содержащего NB активируемого антитела по отношению к мишени является больше, чем Kd исходного AB по отношению к мишени. Например, Kd содержащего NB активируемого антитела по отношению к мишени является по меньшей мере в 5, 10, 25, 50, 100, 250, 500, 1000, 2500, 5000, 10000, 50000, 100,000, 500000, 1000000, 5000000, 10000000, 50000000 или более или в диапазоне 5-10, 10-100, 10-1000, 10-10000, 10-100000, 10-1000000, 10-10000000, 100-1000, 100-10000, 100-100000, 100-1000000, 100-10000000, 1000-10000, 1000-100000, 1000-1000000, 1000-10000000, 10000-100000, 10000-1000000, 10000-10000000, 100000-1000000 или 100000-10000000 раз больше, чем Kd AB, когда он не является связанным с NB или NB:BP, или Kd исходного AB по отношению к мишени. В противоположность этому, аффинность связывания содержащего NB активируемого антитела к мишени является ниже, чем аффинность связывания AB, когда он не является связанным с NB или NB:BP, или ниже чем аффинность связывания исходного AB к мишени. Например, аффинность связывания содержащего NB активируемого антитела к мишени является по меньшей мере в 5, 10, 25, 50, 100, 250, 500, 1000, 2500, 5000, 10000, 50000, 100000, 500000, 1000000, 5000000, 10000000, 50000000 или более или в диапазоне 5-10, 10-100, 10-1000, 10-10000, 10-100000, 10-1000000, 10-10000000, 100-1000, 100-10000, 100-100000, 100-1000000, 100-10000000, 1000-10000, 1000-100000, 1000-1000000, 1000-10000000, 10000-100000, 10000-1000000, 10000-10000000, 100000-1000000 или 100000-10000000 раз ниже, чем аффинность связывания AB, когда он не является связанным с NB или NB:BP, или ниже, чем аффинность связывания исходного AB к мишени.
[000411] Когда содержащее NB активируемое антитело находится в присутствии мишени, специфическое связывание AB с мишенью снижается или ингибируется по сравнению со специфическим связыванием AB, когда он не является связанным с NB или NB:BP. Когда содержащее NB активируемое антитело находится в присутствии мишени, специфическое связывание AB с мишенью снижается или ингибируется по сравнению со специфическим связыванием исходного AB с мишенью. По сравнению со связыванием AB, не связанным с NB или NB:BP, или связыванием исходного AB с мишенью способность содержащего NB активируемого антитела связываться с мишенью снижается, например, по меньшей мере на 50%, 60%, 70%, 80%, 90%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или даже 100% в течение по меньшей мере 2, 4, 6, 8, 12, 28,24, 30, 36, 48, 60, 72, 84 или 96 часов или 5, 10, 15, 30, 45, 60, 90, 120, 150 или 180 суток, или 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 месяцев или дольше при измерении in vitro и/или in vivo.
[000412] Когда содержащее NB активируемое антитело находится в присутствии мишени, но не в присутствии модифицирующего средства (например, протеазы или другого фермента), специфическое связывание AB с мишенью снижается или ингибируется по сравнению со специфическим связыванием AB, когда он не является связанным с NB или NB:BP. Когда содержащее NB активируемое антитело находится в присутствии мишени но не в присутствии модифицирующего средства (например, протеазы, другого фермента, восстановителя или света), специфическое связывание AB с мишенью снижается или ингибируется по сравнению со специфическим связыванием исходного AB с мишенью. По сравнению со связыванием AB, не связанного с NB или NB:BP, или связыванием исходного AB с мишень способность содержащего NB активируемого антитела связываться с мишенью снижается, например, по меньшей мере на 50%, 60%, 70%, 80%, 90%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или даже 100% в течение по меньшей мере 2, 4, 6, 8, 12, 28, 24, 30, 36, 48, 60, 72, 84 или 96 часов или 5, 10, 15, 30, 45, 60, 90, 120, 150 или 180 суток, или 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 месяцев или дольше при измерении in vitro и/или in vivo.
[000413] В некоторых примерах любого из таких вариантов осуществления активируемого антитела активируемое антитело содержит средство, конъюгированное с AB, для получения конъюгата активируемого антитело. В некоторых вариантах осуществления конъюгата активируемого антитела средство представляет собой терапевтическое средство. В некоторых вариантах осуществления средство представляет собой диагностическое средство. В некоторых вариантах осуществления средство представляет собой детектируемый маркер. В некоторых вариантах осуществления конъюгата активируемого антитела средство представляет собой антинеопластическое средство. В некоторых вариантах осуществления конъюгата активируемого антитела средство представляет собой токсин или его фрагмент. В некоторых вариантах осуществления конъюгата активируемого антитела средство конъюгировано с AB через линкер. В некоторых вариантах осуществления конъюгата активируемого антитела линкер представляет собой расщепляемый линкер. В некоторых вариантах осуществления средство конъюгировано с AB через нерасщепляемый линкер. В некоторых вариантах осуществления средство представляет собой ингибитор микротрубочек. В некоторых вариантах осуществления средство представляет собой повреждающее нуклеиновую кислоту средство, такое как алкилирующее ДНК средство или интеркалятор ДНК, или другое повреждающее ДНК средство. В некоторых вариантах осуществления средство представляет собой средство, выбранное из группы, приведенной в таблице 3. В некоторых вариантах осуществления средство представляет собой доластатин. В некоторых вариантах осуществления средство представляет собой ауристатин или его производное. В некоторых вариантах осуществления средство представляет собой ауристатин E или его производное. В некоторых вариантах осуществления средство представляет собой монометилауристатин E (MMAE). В некоторых вариантах осуществления средство представляет собой монометилауристатин D (MMAD). В некоторых вариантах осуществления средство представляет собой майтанзиноид или производное майтанзиноида. В некоторых вариантах осуществления средство представляет собой DM1 или DM4. В некоторых вариантах осуществления средство представляет собой дуокармицин или его производное. В некоторых вариантах осуществления средство представляет собой калихимицин или его производное. В некоторых вариантах осуществления средство представляет собой пирролобензодиазепин.
[000414] В некоторых примерах любого из таких вариантов осуществления активируемого антитела активируемые антитела представляют собой связывающиеся с двойной мишенью активируемые антитела. Такие связывающиеся с двойной мишенью активируемые антитела содержат два Ab, которые могут связываться с одинаковыми или разными мишенями. В конкретных вариантах осуществления связывающиеся с двойной мишенью активируемые антитела включают биспецифические антитела или фрагменты антител.
[000415] Связывающиеся с двойной мишенью активируемые антитела конструируют таким образом, чтобы они содержали CL, расщепляемый расщепляющим средством, которое солокализовано в ткани-мишени с одной или более мишеней, способных связываться с AB активируемых антител. Связывающиеся с двойной мишенью активируемые антитела с более одного AB к одинаковым или различным мишеням можно конструировать таким образом, чтобы они содержали более одного CL, где первый CL расщепляется расщепляющим средством в первой ткани-мишени, и где второй CL расщепляется расщепляющим средством во второй ткани-мишени, с одним или более мишенями, связывающимися с AB активируемых антител. В одном из вариантов осуществления первая и вторая ткани-мишени являются пространственно разделенными, например, находятся в различных участках организма. В одном из вариантов осуществления первая и вторая ткани-мишени представляют собой одну и ту же ткань в различные интервалы времени, например, одну и ту же ткань в два разных момента времени, например, первый момент времени представляет собой момент, когда ткань является опухолью на ранней стадии, и второй момент времени представляет собой момент, когда ткань является опухолью на поздней стадии.
[000416] Изобретение также относится к молекулам нуклеиновой кислоты, кодирующим активируемые антитела, описываемые в настоящем описании. Изобретение также относится к векторам, которые содержат такие нуклеиновые кислоты. Активируемые антитела, описываемые в настоящем описании, получают культивированием клетки в условиях, которые приводят к экспрессии активируемого антитела, где клетка содержит такие молекулы нуклеиновой кислоты или векторы.
[000417] Изобретение также относится к способам получения активируемых антител. В одном из вариантов осуществления способ включает этапы (a) культивирования клетки, которая содержит конструкцию нуклеиновой кислоты, кодирующую активируемое антитело, в условиях, которые приводят к экспрессии активируемого антитела, где активируемое антитело содержит (i) несвязывающий стерический фрагмент (NB); (ii) расщепляемый линкер (CL) и (iii) антитело или его антигенсвязывающий фрагмент (AB), который специфически связывается с мишенью, где (1) NB не связывается специфически с AB; (2) CL представляет собой полипептид, который содержит субстрат (S) для фермента; (3) CL располагают таким образом, чтобы в нерасщепленном состоянии NB препятствовал связыванию AB с мишенью, а в расщепленном состоянии NB не препятствовал связыванию AB с мишенью, и (4) NB не ингибирует расщепление CL ферментом, и (b) выделения активируемого антитела.
[000418] В некоторых вариантах осуществления способ включает этапы: (a) культивирования клетки, которая содержит конструкцию нуклеиновой кислоты, кодирующую активируемое антитело, в условиях, которые приводят к экспрессии активируемого антитела, где активируемое антитело содержит (i) партнер по связыванию (BP) для несвязывающего стерического фрагмента (NB); (ii) расщепляемый линкер (CL), и (iii) антитело или его антигенсвязывающий фрагмент (AB), который специфически связывается с мишенью, где (1) NB не связывается специфически с AB; (2) CL представляет собой полипептид, который содержит субстрат (S) для фермента; (3) CL располагают таким образом, чтобы в нерасщепленном состоянии в присутствии NB NB препятствовал связыванию AB с мишенью, а в расщепленном состоянии NB не препятствовал связыванию AB с мишенью, и BP не препятствовал связыванию AB с мишенью, и (4) NB и BP не ингибируют расщепление CL ферментом, и (b) выделения активируемого антитела. В некоторых примерах такого варианта осуществления BP активируемого антитела является связанным с NB.
Использование активируемых антител и конъюгированных активируемых антител
[000419] Следует понимать, что введение терапевтических соединений по изобретению проводят с подходящими носителями, эксципиентами и другими средствами, которые вводят в составы для обеспечения улучшенного переноса, доставки, переносимости и т.п. Целый ряд подходящих составов можно найти в справочнике, известном всем химикам-фармацевтам: Remington's Pharmaceutical Sciences (15th ed, Mack Publishing Company, Easton, PA (1975)), в частности глава 87 Blaug, Seymour в этом справочнике. Такие составы включают, например, порошки, пасты, мази, желе, воски, масла, липиды, содержащие липиды (катионные или анионные) везикулы (такие как Lipofectin™), конъюгаты ДНК, безводные абсорбционные пасты, эмульсии масло-в-воде и вода-в-масле, эмульсии карбовакс (полиэтиленгликоли различных молекулярных масс), полутвердые гели и полутвердые смеси, содержащие карбовакс. Любая из указанных выше смесей может являться подходящей для способов лечения и терапии в соответствии с настоящим изобретением при условии, что активный ингредиент в составе не инактивируется составом, и состав является физиологически совместимым и переносимым при способе введения. Для дополнительной информации, касающейся составов, эксципиентов и носителей, хорошо известных химикам-фармацевтам, также см. Baldrick P. "Pharmaceutical excipient development: the need for preclinical guidance". Regul. Toxicol Pharmacol. 32(2):210-8 (2000), Wang W. "Lyophilization and development of solid protein pharmaceuticals". Int. J. Pharm. 203(1-2):1-60 (2000), Charman W.N. "Lipids, lipophilic drugs, and oral drug delivery-some emerging concepts". J. Pharm. Sci., 89(8):967-78 (2000), Powell et al., "Compendium of excipients for parenteral formulations" PDA J. Pharm. Sci. Technol., 52:238-311 (1998) и цитаты в них.
[000420] Терапевтические составы по изобретению, которые содержат конъюгированное антитело, активируемое антитело и/или конъюгированное активируемое антитело, используют для профилактики, лечения или иным образом улучшения состояния заболевание или нарушения, связанного с аберрантной экспрессией и/или активностью мишени. Например, терапевтические составы по изобретению, которые содержат конъюгированное антитело, активируемое антитело и/или конъюгированное активируемое антитело, используют для лечения или иным образом улучшения состояния воспаления, воспалительного нарушения, аутоиммунного заболевания и/или злокачественной опухоли или другого неопластического состояния. В некоторых вариантах осуществления злокачественная опухоль представляет собой солидную опухоль или гематологическое злокачественное новообразование, где экспрессируется мишень. В некоторых вариантах осуществления злокачественная опухоль представляет собой солидную опухоль, где экспрессируется мишень. В некоторых вариантах осуществления злокачественная опухоль представляет собой гематологическое злокачественное новообразование, где экспрессируется мишень. В некоторых вариантах осуществления мишень экспрессируется на паренхиме (например, в злокачественной опухоли, участке органа или ткани, который часто выполняет функцию(ии) органа или ткани). В некоторых вариантах осуществления мишень экспрессируется на клетке, ткани или органе. В некоторых вариантах осуществления мишень экспрессируется на строме (т.е. соединительном поддерживающем каркасе клетки, ткани или органа). В некоторых вариантах осуществления мишень экспрессируется на остеобласте. В некоторых вариантах осуществления мишень экспрессируется на эндотелии (сосудистая система). В некоторых вариантах осуществления мишень экспрессируется на злокачественной стволовой клетке. В некоторых вариантах осуществления средство, с которым конъюгировано активируемое антитело, представляет собой ингибитор микротрубочек. В некоторых вариантах осуществления средство, с которым конъюгировано активируемое антитело, представляет собой повреждающее нуклеиновую кислоту средство.
[000421] Эффективность профилактики, улучшения состояния или лечения определяют любым известным способом диагностики или лечения заболевания или нарушения, связанного с экспрессией и/или активностью мишени, такой как, например, аберрантная экспрессия и/или активность мишени. Увеличение выживаемости индивидуума или иным образом замедление прогрессирования заболевания или нарушения, связанного с экспрессией и/или активностью мишени, например, аберрантной экспрессией и/или активностью мишени, у индивидуума указывает на то, что конъюгированное антитело, активируемое антитело и/или конъюгированное активируемое антитело обеспечивают клиническое преимущество.
[000422] Конъюгированное антитело, активируемое антитело и/или конъюгированное активируемое антитело можно вводить в форме фармацевтических композиций. Принципы и факторы, принимаемые во внимание при получении таких композиций, а также руководство по выбору компонентов приведены, например, в Remington: The Science And Practice Of Pharmacy 19th ed. (Alfonso R. Gennaro et al., editors) Mack Pub. Co., Easton, Pa.: 1995; Drug Absorption Enhancement : Concepts, Possibilities, Limitations, And Trends, Harwood Academic Publishers, Langhorne, Pa., 1994; и Peptide And Protein Drug Delivery (Advances In Parenteral Sciences, Vol. 4), 1991, M. Dekker, New York.
[000423] В некоторых вариантах осуществления, где используют фрагменты антител, выбирают наименьший фрагмент, который специфически связывается со связывающим доменом белка-мишени. Например, в зависимости от вариабельной области последовательности антитела можно конструировать пептидные молекулы, которые сохраняют способность связываться с последовательностью белка-мишени. Такие пептиды можно синтезировать химически и/или получать посредством технологии рекомбинантных ДНК. (См., например, Marasco et al., Proc. Natl. Acad. Sci. USA, 90: 7889-7893 (1993)). Состав также могут содержать более одного активного соединения по мере необходимости для конкретного показания, в отношении которого проводят лечение, например, в некоторых вариантах осуществления активные соединения с комплементарными видами активности, которые не оказывают друг на друга отрицательного влияния. В некоторых вариантах осуществления или в дополнение композиция может содержать средство, которое усиливает ее функцию, такое как, например, цитотоксическое средство, цитокин, химиотерапевтическое средство или ингибирующее рост средство. Такие молекулы подходящим образом содержатся в комбинации в количествах, которые являются эффективными для предназначенной цели.
[000424] Активные ингредиенты также можно заключать в микрокапсулы, получаемые, например, способами коацервации или интерфазной полимеризации, например, микрокапсулы из гидроксиметилцеллюлозы или желатина и микрокапсулы из поли(метилметакрилата) соответственно, в коллоидные системы доставки лекарственного средства (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в микроэмульсии.
[000425] Составы, предназначенные для введения in vivo, должны быть стерильными. Это легко получать фильтрованием через стерильные фильтрационные мембраны.
[000426] Можно получать препараты с длительным высвобождением. Подходящие примеры препаратов с длительным высвобождением включают полупроницаемые матрицы твердых гидрофобных полимеров, содержащих антитело, где матрицы находятся в форме сформированных изделий, например, пленок или микрокапсул. Примеры матриц для длительного высвобождения включают сложные полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поли(виниловый спирт)), полилактиды (патент США № 3773919), сополимеры L-глутаминовой кислоты и γ-этил-L-глутамата, неразрушаемый этиленвинилацетат, разрушаемые сополимеры молочной кислоты-гликолевой кислоты, такие как the LUPRON DEPOT™ (инъецируемые микросферы, состоящие из сополимера молочной кислоты-гликолевой кислоты и лейпролидацетата), и поли-D-(-)-3-гидроксимасляную кислоту. В то время, как полимеры, такие как этиленвинилацетат и молочная кислота-гликолевая кислота, обеспечивают высвобождение молекул в течение более 100 суток, определенные гидрогели высвобождают белки в течение более коротких периодов времени.
[000427] В некоторых вариантах осуществления конъюгированное антитело, активируемое антитело и/или конъюгированное активируемое антитело содержит детектируемую метку. Используют интактное антитело или его фрагмент (например, Fab, scFv или F(ab)2). Термин "меченый" в отношении зонда или антитела предназначен включать непосредственное мечение зонда или антитела посредством связывания (т.е. физического связывания) детектируемого вещества с зондом или антителом, а также непрямого мечения зонда или антитела, обусловленного реакционной способностью с другим реагентом, который является непосредственно меченым. Примеры непрямого мечения включают детекцию первичного антитела с использованием флуоресцентно-меченного вторичного антитела и концевого мечения ДНК-зонда биотином, таким образом, что его можно детектировать с использованием флуоресцентно-меченного стрептавидина. Термин "биологический образец" предназначен включать ткани, клетки и биологические жидкости, получаемые от индивидуума, а также ткани, клетки и жидкости, содержащиеся у индивидуума. Таким образом, использование термина "биологический образец" также предусматривает кровь и фракцию или компонент крови включая сыворотку крови, плазму крови или лимфу. Другими словами, способ детекции по изобретению можно использовать для детекции иРНК-аналита, белка или геномной ДНК в биологическом образце in vitro, а также in vivo. Например, способы детекции in vitro иРНК-аналита включают виды нозерн-гибридизации и виды гибридизации in situ. Способы детекции in vitro белка аналита включают твердофазные иммуноферментные анализы (ELISA), вестерн-блоттинг, иммунопреципитации, иммунохимическое окрашивание и иммунофлуоресценцию. Способы детекции in vitro геномной ДНК аналита включают виды саузерн-гибридизации. процедуры проведения иммунологических анализов описаны, например, в "ELISA: Theory and Practice: Methods in Molecular Biology", Vol. 42, J.R. Crowther (Ed.) Human Press, Totowa, NJ, 1995; "Immunoassay", E. Diamandis and T. Christopoulus, Academic Press, Inc., San Diego, CA, 1996; и "Practice and Theory of Enzyme Immunoassays", P. Tijssen, Elsevier Science Publishers, Amsterdam, 1985. Кроме того, способы детекции in vivo белка-аналита включают введение индивидууму меченого антитела против белка-аналита. Например, антитело можно метить радиоактивным маркером, содержание и локализацию которого у индивидуума можно детектировать стандартными техниками визуализации.
[000428] Конъюгированные антитела, активируемые антитела и/или конъюгированные активируемые антитела по изобретению также являются пригодными для различных диагностических и профилактических составов. В одном из вариантов осуществления конъюгированное антитело, активируемое антитело и/или конъюгированное активируемое антитело вводят пациентам, которые подвергаются риску развития одного или более из указанных выше нарушений. Предрасположенность пациента или органа к одному или более из указанных выше нарушений можно определять с использованием генотипических, серологических или биохимических маркеров.
[000429] В некоторых вариантах осуществления конъюгированное антитело, активируемое антитело и/или конъюгированное активируемое антитело вводят являющимся людьми индивидуумам, у которых диагностировали клиническое показание, связанное с одним или более из указанных выше нарушений. После диагностики конъюгированное антитело, активируемое антитело и/или конъюгированное активируемое антитело вводят для ослабления или купирования эффектов клинического показания.
[000430] Конъюгированное антитело, активируемое антитело и/или конъюгированное активируемое антитело по изобретению также является пригодным для детекции мишени в образцах от пациента и, таким образом, является пригодным в качестве диагностических средств. Например, антитела и/или активируемые антитела, и их конъюгированные варианты по изобретению используют в анализах in vitro, например, ELISA, детекции уровней мишени в образце у пациента.
[000431] В одном из вариантов осуществления конъюгированное антитело, активируемое антитело и/или конъюгированное активируемое антитело по изобретению является иммобилизованном на твердой подложке (например, лунке(ах) планшета для микротитрования). Иммобилизованное конъюгированное антитело, активируемое антитело и/или конъюгированное активируемое антитело служит в качестве захватывающего антитела для любой мишени, которая может присутствовать в тестируемом образце. Перед приведением иммобилизованного антитела в контакт с образцом пациента твердую подложку ополаскивают и обрабатывают блокирующим средством, таким как белок молока или альбумин, для предотвращения неспецифической адсорбции аналита.
[000432] Затем лунки обрабатывают тестируемым образцом, предположительно содержащим антиген, или раствором, содержащим стандартное количество антигена. Такой образец представляет собой, например, образец сыворотки от индивидуума, для которого подозревают наличие уровней циркулирующего антигена, которые расценивают как диагностику патологии. После отмывания от тестируемого образца или стандарта твердую подложку обрабатывают вторым антителом, которое является меченным с возможностью детекции. Меченое второе антитело служит в качестве детектирующего антитела. Измеряют уровень детектируемой метки и определяют концентрацию антигена-мишени в тестируемом образце сравнением со стандартной кривой, получаемой при использовании стандартных образцов.
[000433] Следует понимать, что на основании результатов, получаемых с использованием антител по изобретению и их конъюгированных вариантов в диагностическом анализе in vitro, возможно определять стадию заболевания у индивидуума на основании уровней экспрессии антигена-мишени. Для данного заболевания образцы крови получают от индивидуумов, у которых диагностировали, что они находится на различных стадиях прогрессирования заболевания, и/или в различные моменты времени при терапевтическом лечении заболевания. С использованием совокупности образцов, которая обеспечивает статистически значимые результаты для каждой стадии прогрессирования или терапии, определяют диапазон концентраций антигена, который можно считать характерным для каждой стадии.
[000434] Конъюгированное антитело, активируемое антитело и/или конъюгированное активируемое антитело также можно использовать в способах диагностики и/или визуализации. В некоторых вариантах осуществления такие способы представляют собой способы in vitro. В некоторых вариантах осуществления такие способы представляют собой способы in vivo. В некоторых вариантах осуществления такие способы представляют собой способы in situ. В некоторых вариантах осуществления такие способы представляют собой способы ex vivo. Например, активируемые антитела, содержащие ферментативно расщепляемый CM, можно использовать для детекции наличия или отсутствия фермента, который расщепляет расщепляемый CM. Такие активируемые антитела можно использовать в диагностике, которая может включать детекцию in vivo (например, качественную или количественную) активности фермента (или в некоторых вариантах осуществления среды повышенного восстановительного потенциала, такой как среда, которая обеспечивает восстановление дисульфидной связи) посредством измеряемого накопления активируемых антител (т.е. антител, возникающих в результате расщепления активируемого антитела) в данной клетке или ткани данного организма-хозяина. Такое накопление активируемых антител указывает не только на то, что ткань обладает ферментативной активностью (или повышенным восстановительным потенциалом в зависимости от природы CM), а также на то, что ткань экспрессирует мишень, с которой связывается активированное антитело.
[000435] Например, CM можно выбирать так, чтобы он являлся субстратом для матриксной металлопротеазы (MMP), встречающейся в очаге опухоли, в очаге вирусной или бактериальной инфекции на биологически ограниченном участке (например, таком как в абсцессе, в органе и т.п.) и т.п. AB может представлять собой AB, который связывается с антигеном-мишенью. Способами, как описано в настоящем описании, или при необходимости способами, хорошо известными специалисту в данной области, детектируемую метку (например, флуоресцентную метку или радиоактивную метка или радиоактивный индикатор) можно конъюгировать с AB или другой областью антитела и/или активируемого антитела. Подходящие детектируемые метки описаны в контексте указанных выше способов скрининга, и ниже приведены дополнительные конкретные примеры. С использованием AB, специфичного к белку или пептиду, характерному для состояния болезни, наряду с MMP, активность которой повышается в представляющей интерес пораженной ткани, для активируемых антител демонстрируют повышенную скорость связывания с пораженной тканью относительно тканей, где специфичный к CM фермент не содержится на детектируемом уровне или содержится на более низком уровне, чем в пораженной ткани, или является неактивным (например, в форме зимогена или в комплексе с ингибитором). Вследствие того, что малые белки и пептиды быстро выводятся из крови фильтрационной системой почек, и вследствие того, что фермент, специфичный к CM, не содержится на детектируемом уровне (или содержится на более низких уровнях в непораженных тканях или содержится в неактивной конформации), накопление активируемых антител в пораженной ткани повышается относительно непораженных тканей.
[000436] В другом примере активируемые антитела можно использовать для детекции наличия или отсутствия расщепляющего средства в образце. Например, в случае, когда активируемые антитела содержат CM, чувствительный к расщеплению ферментом, активируемые антитела можно использовать для детекции (качественно или количественно) содержания фермента в образце. В другом примере в случае, когда активируемые антитела содержат CM, чувствительный к расщеплению восстановителем, активируемые антитела можно использовать для детекции (качественно или количественно) наличия восстановительных условий в образце. Для облегчения анализа в этих способах активируемые антитела можно метить с возможностью детекции и можно связывать с подложкой (например, твердой подложкой, такой как предметное стекло или гранула). Детектируемую метку можно располагать на участке активируемого антитела, который не высвобождается после расщепления, например, детектируемая метка может представлять собой флуоресцентную метку с гашением флуоресценции или другу метку, которая не является детектируемой, до тех пор, пока не происходит расщепление. Анализ можно проводить, например, путем приведения иммобилизованных, меченных с возможностью детекции активируемых антител в контакт с образцом, предположительно содержащим фермент и/или восстановитель, в течение периода времени, достаточного для того, чтобы происходило расщепление, затем промывания для удаления избытка образца и загрязнителей. Затем оценивают наличие или отсутствие расщепляющего средства (например, фермента или восстановителя) в образце по изменению детектируемого сигнала активируемых антител до приведения в контакт с образцом, например, по наличию и/или увеличению детектируемого сигнала вследствие расщепления активируемого антитела расщепляющим средством в образце.
[000437] Такие способы детекции можно адаптировать, чтобы они также обеспечивали детекцию наличия или отсутствия мишени, которая способна связываться с AB активируемых антител при расщеплении. Таким образом, анализы можно адаптировать для оценки наличия или отсутствия расщепляющего средства и наличия или отсутствия представляющей интерес мишени. Наличие или отсутствие расщепляющего средства можно детектировать по наличию и/или отсутствию детектируемой метки активируемых антител, как описано выше, и можно детектировать наличие или отсутствие мишени детекцией комплекса мишень-AB, например, с использованием меченного с возможностью детекции антитела против мишени.
[000438] Активируемые антитела также являются пригодными при визуализации in situ для подтверждения активации активируемого антитела, например, в результате расщепления протеазой, и связывания с конкретной мишенью. Визуализация in situ представляет собой способ, который обеспечивает локализацию протеолитической активности и мишени в биологических образцах, таких как культуры клеток или тканевые срезы. С использованием этого способа можно подтверждать как связывание с данной мишенью, так и протеолитическую активность на основании наличия детектируемой метки (например, флуоресцентной метки).
[000439] Такие техники являются пригодными для любых замороженных клеток или тканей, получаемых из очага заболевания (например, опухолевой ткани) или здоровых тканей. Такие техники также являются пригодными для свежих образцов клеток или тканей.
[000440] В этих техниках активируемое антитело метят детектируемой меткой. Детектируемая метка может представлять собой флуоресцентный краситель, (например, флуорофор, флуоресцеинизотиоцианат (FITC), родамин изотиоцианат (TRITC), метку Alexa Fluor®), поглощающий в ближней ИК-области краситель (NIR) (например, нанокристаллы Qdot®), коллоидный металл, гаптен, радиоактивный маркер, биотин и усиливающий сигнал реагент, такой как стрептавидин или фермент (например, пероксидазу хрена или щелочную фосфатазу).
[000441] Детекция метки в образце, который инкубировали с меченым активируемым антителом, указывает на то, что образец содержит мишень и содержит матриксную металлопротеазу (MMP), которая является специфической для CM активируемого антитела. В некоторых вариантах осуществления наличие MMP можно подтверждать с использованием широкого спектра ингибиторов протеаз, таких как ингибиторы, описываемые в настоящем описании, и/или с использованием средства, которое является специфическим для протеазы, например, антитела, такого как A11, которое является специфическим для протеазы матриптазы (MT-SP1) и ингибирует протеолитическую активность матриптазы; см., например, международную публикацию номер WO 2010/129609, опубликованную 11 ноября 2010 года. Тот же подход использования широкого спектра ингибиторов протеаз, таких как ингибиторы, описываемые в настоящем описании, и/или с использованием более селективного ингибирующего средства можно использовать для идентификации MMP, специфической для CM активируемого антитела. В некоторых вариантах осуществления наличие мишени можно подтверждать с использованием средства, которое является специфическим для мишени, например, другое антитело или детектируемая метка может конкурировать с немеченой мишенью. В некоторых вариантах осуществления немеченое активируемое антитело можно использовать при детекции посредством меченого вторичного антитела или более сложной системы детекции.
[000442] Аналогичные техники также являются пригодными для визуализации in vivo, где детекция флуоресцентного сигнала у индивидуума, например, млекопитающего, включая человека, свидетельствует о том, что очаг поражения содержит мишень и содержит MMP, которая является специфичной к CM активируемого антитела.
[000443] Эти техники также являются пригодными в наборах и/или в качестве реагентов для детекции, идентификации или характеризации активности протеазы в различных клетках, тканях и организмах на основании специфичного до протеазы CM в активируемом антителе.
[000444] Изобретение относится к способам применения антител и/или активируемых антител при различных терапевтических, диагностических и профилактических показаниях. Например, изобретение относится к способам детекции наличия или отсутствия расщепляющего средства и представляющей интерес мишени у индивидуума или в образце путем (i) приведения индивидуума или образца в контакт с активируемым антителом, где активируемое антитело содержит маскирующий фрагмент (MM), расщепляемый фрагмент (CM), которые который расщепляется расщепляющим средством, и антигенсвязывающий домен или его фрагмент (AB), который специфически связывается с представляющей интерес мишенью, где активируемое антитело в нерасщепленном, неактивированном состоянии имеет структурную организацию от N-конца к C-концу, как указано ниже: MM-CM-AB или AB-CM-MM; (a), где MM представляет собой пептид, который ингибирует связывание AB с мишенью, и где MM не содержит аминокислотную последовательность природного партнера по связыванию AB и не является модифицированной формой природного партнера по связыванию AB; и (b) где, в нерасщепленном неактивированном состоянии MM препятствует специфическому связыванию AB с мишенью, и в расщепленном активированном состоянии MM не препятствует или не конкурирует за специфическое связывание AB с мишенью; и (ii) измерения уровня активированного активируемого антитела у индивидуума или в образце, где детектируемый уровень активированного активируемого антитела у индивидуума или в образце указывает на то, что расщепляющее средство и мишень содержатся у индивидуума или в образце, и где недетектируемый уровень активированного активируемого антитела у индивидуума или в образце указывает на то, что расщепляющее средство, мишень или расщепляющее средство и мишень не содержатся и/или не содержатся в достаточной степени у индивидуума или в образце. В некоторых вариантах осуществления активируемое антитело представляет собой активируемое антитело, с которым конъюгировано терапевтическое средство. В некоторых вариантах осуществления активируемое антитело не является конъюгированным со средством. В некоторых вариантах осуществления активируемое антитело содержит детектируемую метку. В некоторых вариантах осуществления детектируемую метку располагают на AB. В некоторых вариантах осуществления измерение уровня активируемого антитела у индивидуума или в образце проводят с использованием вторичного реагента, который специфически связывается с активированным антителом, где реагент содержит детектируемую метку. В некоторых вариантах осуществления вторичный реагент представляет собой антитело, содержащее детектируемую метку.
[000445] Изобретение также относится к способам детекции наличия или отсутствия расщепляющего средства у индивидуума или в образце путем (i) приведения индивидуума или образца в контакт с активируемым антителом в присутствии представляющей интерес мишени, например, мишени, где активируемое антитело содержит маскирующий фрагмент (MM), расщепляемый фрагмент (CM), который расщепляется расщепляющим средством, и антигенсвязывающий домен или его фрагмент (AB), который специфически связывается с представляющей интерес мишенью, где активируемое антитело в нерасщепленном, неактивированном состоянии имеет структурную организацию от N-конца к C-концу, как указано ниже: MM-CM-AB или AB-CM-MM; (a), где MM представляет собой пептид, который ингибирует связывание AB с мишенью, и где MM не содержит аминокислотную последовательность природного партнера по связыванию AB и не является модифицированной формой природного партнера по связыванию AB; и (b) где, в нерасщепленном, неактивированном состоянии MM препятствует специфическому связыванию AB с мишенью, и в расщепленном, активированном состоянии MM не препятствует или не конкурирует за специфическое связывание AB с мишенью; и (ii) измерения уровня активированного активируемого антитела у индивидуума или в образце, где детектируемый уровень активированного активируемого антитела у индивидуума или в образце указывает на то, что расщепляющее средство содержится у индивидуума или в образце, и где недетектируемый уровень активированного активируемого антитела у индивидуума или в образце указывает на то, что расщепляющее средство не содержится и/или не содержится в достаточной степени у индивидуума или в образце. В некоторых вариантах осуществления активируемое антитело представляет собой активируемое антитело, с которым конъюгировано терапевтическое средство. В некоторых вариантах осуществления активируемое антитело не является конъюгированным со средством. В некоторых вариантах осуществления активируемое антитело содержит детектируемую метку. В некоторых вариантах осуществления детектируемую метку располагают на AB. В некоторых вариантах осуществления измерение уровня активируемого антитела у индивидуума или в образце проводят с использованием вторичного реагента, который специфически связывается с активированным антителом, где реагент содержит детектируемую метку. В некоторых вариантах осуществления вторичный реагент представляет собой антитело, содержащее детектируемую метку.
[000446] Изобретение также относится к наборам для применения в способах детекции наличия или отсутствия расщепляющего средства и мишени у индивидуума или в образце, где наборы содержат по меньшей мере активируемое антитело, которое содержит маскирующий фрагмент (MM), расщепляемый фрагмент (CM), который расщепляется расщепляющим средством, и антигенсвязывающий домен или его фрагмент (AB), который специфически связывается с представляющей интерес мишенью, где активируемое антитело в нерасщепленном, неактивированном состоянии имеет структурную организацию от N-конца к C-концу, как указано ниже: MM-CM-AB или AB-CM-MM; (a), где MM представляет собой пептид, который ингибирует связывание AB с мишенью, и где MM не содержит аминокислотную последовательность природного партнера по связыванию AB и не является модифицированной формой природного партнера по связыванию AB; и (b) где, в нерасщепленном, неактивированном состоянии MM препятствует специфическому связыванию AB с мишенью, и в расщепленном, активированном состоянии MM не препятствует или не конкурирует за специфическое связывание AB с мишенью; и (ii) измерения уровня активированного активируемого антитела у индивидуума или в образце, где детектируемый уровень активированного активируемого антитела у индивидуума или в образце указывает на то, что расщепляющее средство содержится у индивидуума или в образце, и где недетектируемый уровень активированного активируемого антитела у индивидуума или в образце указывает на то, что расщепляющее средство не содержится и/или не содержится в достаточной степени у индивидуума или в образце. В некоторых вариантах осуществления активируемое антитело представляет собой активируемое антитело, с которым конъюгировано терапевтическое средство. В некоторых вариантах осуществления активируемое антитело не является конъюгированным со средством. В некоторых вариантах осуществления активируемое антитело содержит детектируемую метку. В некоторых вариантах осуществления детектируемую метку располагают на AB. В некоторых вариантах осуществления измерение уровня активируемого антитела у индивидуума или в образце проводят с использованием вторичного реагента, который специфически связывается с активированным антителом, где реагент содержит детектируемую метку. В некоторых вариантах осуществления вторичный реагент представляет собой антитело, содержащее детектируемую метку.
[000447] Изобретение также относится к способам детекции наличия или отсутствия расщепляющего средства у индивидуума или в образце путем (i) приведения индивидуума или образца в контакт с активируемым антителом,, где активируемое антитело содержит маскирующий фрагмент (MM), расщепляемый фрагмент (CM), который расщепляется расщепляющим средством, антигенсвязывающий домен (AB), который специфически связывается с мишенью, и детектируемую метку, где активируемое антитело в нерасщепленном, неактивированном состоянии имеет структурную организацию от N-конца к C-концу, как указано ниже: MM-CM-AB или AB-CM-MM; где MM представляет собой пептид, который ингибирует связывание AB с мишенью, и где MM не содержит аминокислотную последовательность природного партнера по связыванию AB и не является модифицированной формой природного партнера по связыванию AB; где в нерасщепленном, неактивированном состоянии MM препятствует специфическому связыванию AB с мишенью, и в расщепленном, активированном состоянии MM не препятствует или не конкурирует за специфическое связывание AB с мишенью; и где детектируемую метку располагают на участке активируемого антитела, который высвобождается после расщепления CM; и (ii) измерения уровня детектируемой метки у индивидуума или в образце, где детектируемый уровень детектируемой метки у индивидуума или в образце указывает на то, что расщепляющее средство не содержится и/или не содержится в достаточной степени у индивидуума или в образце, и где недетектируемый уровень детектируемой метки у индивидуума или в образце указывает на то, что расщепляющее средство содержится у индивидуума или в образце. В некоторых вариантах осуществления активируемое антитело представляет собой активируемое антитело, с которым конъюгировано терапевтическое средство. В некоторых вариантах осуществления активируемое антитело не является конъюгированным со средством. В некоторых вариантах осуществления активируемое антитело содержит детектируемую метку. В некоторых вариантах осуществления детектируемую метку располагают на AB. В некоторых вариантах осуществления измерение уровня активируемого антитела у индивидуума или в образце проводят с использованием вторичного реагента, который специфически связывается с активированным антителом, где реагент содержит детектируемую метку. В некоторых вариантах осуществления вторичный реагент представляет собой антитело, содержащее детектируемую метку.
[000448] Изобретение также относится к наборам для применения в способах детекции наличия или отсутствия расщепляющего средства и мишени у индивидуума или в образце, где наборы содержат по меньшей мере активируемое антитело и/или конъюгированное активируемое антитело (например, активируемое антитело, с которым конъюгировано терапевтическое средство), описываемое в настоящем описании, для применения при приведении в контакт с индивидуумом или биологическим образцом и средства детекции уровня активированного активируемого антитела и/или конъюгированного активируемого антитела у индивидуума или в биологическом образце, где детектируемый уровень активированного активируемого антитела у индивидуума или в биологическом образце указывает на то, что расщепляющее средство и мишень содержатся у индивидуума или в биологическом образце, и где недетектируемый уровень активированного активируемого антитела у индивидуума или в биологическом образце указывает на то, что расщепляющее средство, мишень или расщепляющее средство и мишень не содержатся и/или не содержатся в достаточной степени у индивидуума или в биологическом образце, таким образом, что связывание мишени и/или расщепление протеазой активируемого антитела невозможно детектировать у индивидуума или в биологическом образце.
[000449] Изобретение также относится к способам детекции наличия или отсутствия расщепляющего средства у индивидуума или в образце путем (i) приведения индивидуума или биологического образца в контакт с активируемым антителом в присутствии мишени, и (ii) измерения уровня активированного активируемого антитела у индивидуума или в биологическом образце, где детектируемый уровень активированного активируемого антитела у индивидуума или в биологическом образце указывает на то, что расщепляющее средство содержится у индивидуума или в биологическом образце, и где недетектируемый уровень активированного активируемого антитела у индивидуума или в биологическом образце указывает на то, что расщепляющее средство не содержится и/или не содержится в достаточной степени у индивидуума или в биологическом образце на детектируемом уровне, таким образом, что расщепление протеазой активируемого антитела невозможно детектировать у индивидуума или в биологическом образце. Такое активируемое антитело содержит маскирующий фрагмент (MM), расщепляемый фрагмент (CM), который расщепляется расщепляющим средством, и антигенсвязывающий домен или его фрагмент (AB), который специфически связывается с мишенью, где активируемое антитело в нерасщепленном (т.е. неактивированном) состоянии имеет структурную организацию от N-конца к C-концу, как указано ниже: MM-CM-AB или AB-CM-MM; (a), где MM представляет собой пептид, который ингибирует связывание AB с мишенью, и где MM не содержит аминокислотную последовательность природного партнера по связыванию AB; и (b) где MM активируемого антитела в нерасщепленном состоянии препятствует специфическому связыванию AB с мишенью, и где MM активируемого антитела в расщепленном (т.е. активированном) состоянии не препятствует или не конкурирует за специфическое связывание AB с мишенью. В некоторых вариантах осуществления активируемое антитело представляет собой активируемое антитело, с которым конъюгировано терапевтическое средство. В некоторых вариантах осуществления активируемое антитело не является конъюгированным со средством. В некоторых вариантах осуществления детектируемую метку присоединяют к маскирующему фрагменту. В некоторых вариантах осуществления детектируемую метку присоединяют к N-концу расщепляемого фрагмента участка расщепления протеазы. В некоторых вариантах осуществления один антигенсвязывающий участок AB является маскированным. В некоторых вариантах осуществления, где антитело по изобретению содержит по меньшей мере два антигенсвязывающих участка, по меньшей мере один антигенсвязывающий участок является маскированным, и по меньшей мере один антигенсвязывающий участок не является маскированным. В некоторых вариантах осуществления все антигенсвязывающие участки являются маскированными. В некоторых вариантах осуществления этап измерения включает использование вторичного реагента, содержащего детектируемую метку.
[000450] Изобретение также относится к наборам для применения в способах детекции наличия или отсутствия расщепляющего средства и мишени у индивидуума или в образце, где наборы содержат по меньшей мере активируемое антитело и/или конъюгированное активируемое антитело, описываемое в настоящем описании, для применения при приведении индивидуума или биологического образца в контакт с активируемым антителом в присутствии мишени и измерения уровня активированного активируемого антитела у индивидуума или в биологическом образце, где детектируемый уровень активированного активируемого антитела у индивидуума или в биологическом образце указывает на то, что расщепляющее средство содержится у индивидуума или в биологическом образце, и где недетектируемый уровень активированного активируемого антитела у индивидуума или в биологическом образце указывает на то, что расщепляющее средство не содержится и/или не содержится в достаточной степени у индивидуума или в биологическом образце на детектируемом уровне, таким образом, что расщепление протеазой активируемого антитела невозможно детектировать у индивидуума или в биологическом образце. Такое активируемое антитело содержит маскирующий фрагмент (MM), расщепляемый фрагмент (CM), который расщепляется расщепляющим средством, и антигенсвязывающий домен или его фрагмент (AB), который специфически связывается с мишенью, где активируемое антитело в нерасщепленном (т.е. неактивированном) состоянии имеет структурную организацию от N-конца к C-концу, как указано ниже: MM-CM-AB или AB-CM-MM; (a) где MM представляет собой пептид, который ингибирует связывание AB с мишенью, и где MM не содержит аминокислотную последовательность природного партнера по связыванию AB; и (b) где MM активируемого антитела в нерасщепленном состоянии препятствует специфическому связыванию AB с мишенью, и где MM активируемого антитела в расщепленном (т.е. активированном) состоянии не препятствует или не конкурирует за специфическое связывание AB с мишенью. В некоторых вариантах осуществления активируемое антитело представляет собой активируемое антитело, с которым конъюгировано терапевтическое средство. В некоторых вариантах осуществления активируемое антитело не является конъюгированным со средством. В некоторых вариантах осуществления детектируемую метку присоединяют к маскирующему фрагменту. В некоторых вариантах осуществления детектируемую метку присоединяют к N-концу расщепляемого фрагмента к участку расщепления протеазой. В некоторых вариантах осуществления один антигенсвязывающий участок AB является маскированным. В некоторых вариантах осуществления, где антитело по изобретению содержит по меньшей мере два антигенсвязывающих участка, по меньшей мере один антигенсвязывающий участок является маскированным, и по меньшей мере один антигенсвязывающий участок не является маскированным. В некоторых вариантах осуществления все антигенсвязывающие участки являются маскированными. В некоторых вариантах осуществления этап измерения включает использование вторичного реагента, содержащего детектируем метка.
[000451] Изобретение также относится к наборам для применения в способах детекции наличия или отсутствия расщепляющего средства у индивидуума или в образце, где наборы содержат по меньшей мере активируемое антитело и/или конъюгированное активируемое антитело, описываемое в настоящем описании, для применения при приведении в контакт индивидуума или биологического образца и средства для детекции уровня активированного активируемого антитела и/или конъюгированного активируемого антитела у индивидуума или в биологическом образце, где активируемое антитело содержит детектируемую метку, которую располагают на участке активируемого антитела, который высвобождается после расщепления CM, где детектируемый уровень активированного активируемого антитела у индивидуума или в биологическом образце указывает на то, что расщепляющее средство не содержится и/или не содержится в достаточной степени у индивидуума или в биологическом образце, таким образом, что связывание мишени и/или расщепление протеазой активируемого антитела невозможно детектировать у индивидуума или в биологическом образце, и где недетектируемый уровень активированного активируемого антитела у индивидуума или в биологическом образце указывает на то, что расщепляющее средство содержится у индивидуума или в биологическом образце на детектируемом уровне.
[000452] Изобретение относится к способам детекции наличия или отсутствия расщепляющего средства и мишени у индивидуума или в образце путем (i) приведения индивидуума или биологического образца в контакт с активируемым антителом, где активируемое антитело содержит детектируемую метку, которую располагают на участке активируемого антитела, который высвобождается после расщепления CM, и (ii) измерения уровня активированного активируемого антитела у индивидуума или в биологическом образце, где детектируемый уровень активированного активируемого антитела у индивидуума или в биологическом образце указывает на то, что расщепляющее средство, мишень или расщепляющее средство и мишень не содержатся и/или не содержатся в достаточной степени у индивидуума или в биологическом образце, таким образом, что связывание мишени и/или расщепление протеазой активируемого антитела невозможно детектировать у индивидуума или в биологическом образце, и где пониженный детектируемый уровень активированного активируемого антитела у индивидуума или в биологическом образце указывает на то, что расщепляющее средство и мишень содержатся у индивидуума или в биологическом образце. Пониженный уровень детектируемой метки представляет собой, например, снижение приблизительно на 5%, приблизительно на 10%, приблизительно на 15%, приблизительно на 20%, приблизительно на 25%, приблизительно на 30%, приблизительно на 35%, приблизительно на 40%, приблизительно на 45%, приблизительно на 50%, приблизительно на 55%, приблизительно на 60%, приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95% и/или приблизительно на 100%. Такое активируемое антитело содержит маскирующий фрагмент (MM), расщепляемый фрагмент (CM), который расщепляется расщепляющим средством, и антигенсвязывающий домен или его фрагмент (AB), который специфически связывается с мишенью, где активируемое антитело в нерасщепленном (т.е. неактивированном) состоянии имеет структурную организацию от N-конца к C-концу, как указано ниже: MM-CM-AB или AB-CM-MM; (a), где MM представляет собой пептид, который ингибирует связывание AB с мишенью, и где MM не содержит аминокислотную последовательность природного партнера по связыванию AB; и (b) где MM активируемого антитела в нерасщепленном состоянии препятствует специфическому связыванию AB с мишенью, и где MM активируемого антитела в расщепленном (т.е. активированном) состоянии не препятствует или не конкурирует за специфическое связывание AB с мишенью. В некоторых вариантах осуществления активируемое антитело представляет собой активируемое антитело, с которым конъюгировано терапевтическое средство. В некоторых вариантах осуществления активируемое антитело не является конъюгированным со средством. В некоторых вариантах осуществления активируемое антитело содержит детектируемую метку. В некоторых вариантах осуществления детектируемую метку располагают на AB. В некоторых вариантах осуществления измерение уровня активируемого антитела у индивидуума или в образце проводят с использованием вторичного реагента, который специфически связывается с активированным антителом, где реагент содержит детектируемую метку. В некоторых вариантах осуществления вторичный реагент представляет собой антитело, содержащее детектируемую метку.
[000453] Изобретение также относится к наборам для применения в способах детекции наличия или отсутствия расщепляющего средства и мишени у индивидуума или в образце, где наборы содержат по меньшей мере активируемое антитело и/или конъюгированное активируемое антитело, описываемое в настоящем описании, для применения в приведении в контакт индивидуума или биологического образца и средства для детекции уровня активированного активируемого антитела и/или конъюгированного активируемого антитела у индивидуума или в биологическом образце, где детектируемый уровень активированного активируемого антитела у индивидуума или в биологическом образце указывает на то, что расщепляющее средство, мишень или расщепляющее средство и мишень не содержатся и/или не содержатся в достаточной степени у индивидуума или в биологическом образце, таким образом, что связывание мишени и/или расщепление протеазой активируемого антитела невозможно детектировать у индивидуума или в биологическом образце, и где пониженный детектируемый уровень активированного активируемого антитела у индивидуума или в биологическом образце указывает на то, что расщепляющее средство и мишень содержатся у индивидуума или в биологическом образце. Пониженный уровень детектируемой метки представляет собой, например, снижение приблизительно 5%, приблизительно на 10%, приблизительно на 15%, приблизительно на 20%, приблизительно на 25%, приблизительно на 30%, приблизительно на 35%, приблизительно на 40%, приблизительно на 45%, приблизительно на 50%, приблизительно на 55%, приблизительно на 60%, приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95% и/или приблизительно на 100%.
[000454] Изобретение также относится к способам детекции наличия или отсутствия расщепляющего средства у индивидуума или в образце путем (i) приведения индивидуума или биологического образца в контакт с активируемым антителом, где активируемое антитело содержит детектируемую метку, которую располагают на участке активируемого антитела, который высвобождается после расщепления CM; и (ii) измерения уровня детектируемой метки у индивидуума или в биологическом образце, где детектируемый уровень детектируемой метки у индивидуума или в биологическом образце указывает на то, что расщепляющее средство не содержится и/или не содержится в достаточной степени у индивидуума или в биологическом образце на детектируемом уровне, таким образом, что расщепление протеазой активируемого антитела невозможно детектировать у индивидуума или в биологическом образце, и где пониженный детектируемый уровень детектируемой метки у индивидуума или в биологическом образце указывает на то, что расщепляющее средство содержится у индивидуума или в биологическом образце. Пониженный уровень детектируемой метки представляет собой, например, снижение приблизительно на 5%, приблизительно на 10%, приблизительно на 15%, приблизительно на 20%, приблизительно на 25%, приблизительно на 30%, приблизительно на 35%, приблизительно на 40%, приблизительно на 45%, приблизительно на 50%, приблизительно на 55%, приблизительно на 60%, приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95% и/или приблизительно на 100%. Такое активируемое антитело содержит маскирующий фрагмент (MM), расщепляемый фрагмент (CM), который расщепляется расщепляющим средством, и антигенсвязывающий домен или его фрагмент (AB), который специфически связывается с мишенью, где активируемое антитело в нерасщепленном (т.е. неактивированном) состоянии имеет структурную организацию от N-конца к C-концу, как указано ниже: MM-CM-AB или AB-CM-MM; (a), где MM представляет собой пептид, который ингибирует связывание AB с мишенью, и где MM не содержит аминокислотную последовательность природного партнера по связыванию AB; и (b) где MM активируемого антитела в нерасщепленном состоянии препятствует специфическому связыванию AB с мишенью, и где MM активируемого антитела в расщепленном (т.е. активированном) состоянии не препятствует или не конкурирует за специфическое связывание AB с мишенью. В некоторых вариантах осуществления активируемое антитело представляет собой активируемое антитело, с которым конъюгировано терапевтическое средство. В некоторых вариантах осуществления активируемое антитело не является конъюгированным со средством. В некоторых вариантах осуществления активируемое антитело содержит детектируемую метку. В некоторых вариантах осуществления детектируемую метку располагают на AB. В некоторых вариантах осуществления измерение уровня активируемого антитела у индивидуума или в образце проводят с использованием вторичного реагента, который специфически связывается с активированным антителом, где реагент содержит детектируемую метку. В некоторых вариантах осуществления вторичный реагент представляет собой антитело, содержащее детектируемую метку.
[000455] Изобретение также относится к наборам для применения в способах детекции наличия или отсутствия представляющего интерес расщепляющего средства у индивидуума или в образце, где наборы содержат по меньшей мере активируемое антитело и/или конъюгированное активируемое антитело, описываемое в настоящем описании, для применения в приведении в контакт индивидуума или биологического образца и средства для детекции уровня активированного активируемого антитела и/или конъюгированного активируемого антитела у индивидуума или в биологическом образце, где активируемое антитело содержит детектируемую метку, которую располагают на участке активируемого антитела, который высвобождается после расщепления CM, где детектируемый уровень детектируемой метки у индивидуума или в биологическом образце указывает на то, что расщепляющее средство, мишень или расщепляющее средство и мишень не содержатся и/или не содержатся в достаточной степени у индивидуума или в биологическом образце, таким образом, что связывание мишени и/или расщепление протеазой активируемого антитела невозможно детектировать у индивидуума или в биологическом образце, и где пониженный детектируемый уровень детектируемой метки у индивидуума или в биологическом образце указывает на то, что расщепляющее средство и мишень содержатся у индивидуума или в биологическом образце. Пониженный уровень детектируемой метки представляет собой, например, снижение приблизительно на 5%, приблизительно на 10%, приблизительно на 15%, приблизительно на 20%, приблизительно на 25%, приблизительно на 30%, приблизительно на 35%, приблизительно на 40%, приблизительно на 45%, приблизительно на 50%, приблизительно на 55%, приблизительно на 60%, приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95% и/или приблизительно на 100%.
[000456] В некоторых вариантах осуществления этих способов и наборов активируемое антитело содержит детектируемую метку. В некоторых вариантах осуществления этих способов и наборов детектируем метка включает визуализирующее средство, контрастирующее средство, фермент, флуоресцентную метку, хромофор, краситель, один или более ионов металлов или метку на основе лиганда. В некоторых вариантах осуществления этих способов и наборов визуализирующее средство содержит радиоактивный изотоп. В некоторых вариантах осуществления этих способов и наборов радиоактивный изотоп представляет собой индий или технеций. В некоторых вариантах осуществления этих способов и наборов контрастирующее средство содержит йод, гадолиний или оксид железа. В некоторых вариантах осуществления этих способов и наборов фермент представляет собой пероксидазу хрена, щелочную фосфатазу или β-галактозидазу. В некоторых вариантах осуществления этих способов и наборов флуоресцентная метка представляет собой желтый флуоресцентный белок (YFP), синий флуоресцентный белок (CFP), зеленый флуоресцентный белок (GFP), модифицированный красный флуоресцентный белок (mRFP), красный флуоресцентный белок tdimer2 (RFP tdimer2), HCRED или производное европия. В некоторых вариантах осуществления этих способов и наборов люминесцентная метка представляет собой производное N-метилакридина. В некоторых вариантах осуществления этих способов метка представляет собой метку Alexa Fluor®, такую как Alex Fluor® 680 или Alexa Fluor® 750. В некоторых вариантах осуществления этих способов и наборов метка на основе лиганда содержит биотин, авидин, стрептавидин или один или более гаптенов.
[000457] В некоторых вариантах осуществления этих способов и наборов индивидуум представляет собой млекопитающее. В некоторых вариантах осуществления этих способов и наборов индивидуум является человеком. В некоторых вариантах осуществления индивидуум представляет собой не принадлежащее человеку млекопитающее, такое как не являющийся человеком примат, животное-компаньон (например, кошка, собака, лошадь), сельскохозяйственное животное, рабочее животное или животное в зоопарке. В некоторых вариантах осуществления индивидуум представляет собой грызуна.
[000458] В некоторых вариантах осуществления этих способов способ представляет собой способ in vivo. В некоторых вариантах осуществления этих способов способ представляет собой способ in situ. В некоторых вариантах осуществления этих способов способ представляет собой способ ex vivo. В некоторых вариантах осуществления этих способов способ представляет собой способ in vitro.
[000459] В некоторых вариантах осуществления визуализация in situ и/или визуализация in vivo являются пригодными в методах для идентификации, каких пациентов необходимо лечить. Например, при визуализации in situ активируемые антитела используют для скрининга образцов от пациентов для идентификации таких пациентов, у которых соответствующая протеаза(ы) и мишень(и) имеют соответствующую локализацию, например, в очаге опухоли.
[000460] В некоторых вариантах осуществления визуализацию in situ используют для идентификации или иным образом определения популяции пациентов, подходящей для лечения активируемым антителом по изобретению. Например, пациентов, результаты теста которых являются положительными в отношении мишени (например, мишени) и протеазы, которая расщепляет субстрат ы расщепляемом фрагменте (CM) тестируемого активируемого антитела, (например, накапливаются активируемые антитела в очаге поражения) идентифицируют как подходящих кандидатов для лечения таким активируемым антителом, содержащим такой CM. Аналогично, пациентов, результаты теста которых являются отрицательными в отношении мишени (например, мишени) и протеазы, которая расщепляет субстрат в CM в активируемом антителе, тестируемом этими способами, можно идентифицировать как подходящих кандидатов для другой формы терапии. В некоторых вариантах осуществления таких пациентов, результаты тестоа которых являются отрицательными в отношении первого активируемого антитела, можно тестировать другими активируемыми антителами, содержащими различные CM, до тех пор, пока не идентифицируют подходящее активируемое антитело для лечения (например, активируемое антитело, содержащее CM, которое расщепляется у пациента в очаге заболевания). В некоторых вариантах осуществления пациенту затем вводят терапевтически эффективное количество конъюгированного активируемого антитела, по отношению к которому результаты теста пациента являются положительными.
[000461] В некоторых вариантах осуществления визуализацию in vivo используют для идентификации или иным образом определения популяции пациентов, подходящей для лечения активируемым антителом по изобретению. Например, пациентов, результаты теста которых являются положительными в отношении мишени (например, мишени) и протеазы, которая расщепляет субстрат в расщепляемом фрагменте (CM) тестируемого активируемого антитела, (например, накапливаются активированные антитела в очаге поражения) идентифицируют как подходящих кандидатов для лечения таким активируемым антителом, содержащим такой CM. Аналогично, пациентов, результаты теста которых являются отрицательными, можно идентифицировать как подходящих кандидатов для другой формы терапии. В некоторых вариантах осуществления таких пациентов, результаты теста которых являются отрицательными в отношении первого активируемого антитела, можно тестировать с использованием других активируемых антител, содержащих различные CM, до тех пор, пока не идентифицируют подходящее активируемое антитело для лечения (например, активируемое антитело, содержащее CM, которое расщепляется у пациента в очаге заболевания). В некоторых вариантах осуществления пациенту затем вводят терапевтически эффективное количество конъюгированного активируемого антитела, по отношению к которому результаты теста пациента являются положительными.
[000462] В некоторых вариантах осуществления способов и наборов способ или набор используют для идентификации или иным образом определения популяции пациентов, подходящей для лечения активируемым антителом по изобретению. Например, пациентов, результаты теста которых являются положительными в отношении мишени (например, мишени) и протеазы, которая расщепляет субстрат в расщепляемом фрагменте (CM) активируемого антитела, тестируемого в этих способах, идентифицируют как подходящих кандидатов для лечения таким активируемым антителом, содержащим такой CM. Аналогично, пациентов, результаты теста которых являются отрицательными в отношении мишени (например, мишени) и протеазы, которая расщепляет субстрат в CM в активируемом антителе, тестируемом этими способами, можно идентифицировать как подходящих кандидатов для другой формы терапии. В некоторых вариантах осуществления таких пациентов можно тестировать с использованием других активируемых антител до тех пор, пока не идентифицируют подходящее активируемое антитело для лечения (например, активируемое антитело, содержащее CM, которое расщепляется у пациента в очаге заболевания). В некоторых вариантах осуществления пациентов, результаты теста которых являются отрицательными в отношении мишени (например, мишени), идентифицируют как подходящих кандидатов для лечения таким активируемым антителом, содержащим такой CM. В некоторых вариантах осуществления пациентов, результаты теста которых являются отрицательными в отношении мишени (например, мишени), идентифицируют как не являющихся подходящими кандидатами для лечения таким активируемым антителом, содержащим такой CM. В некоторых вариантах осуществления таких пациентов можно тестировать с использованием других активируемых антител до тех пор, пока не идентифицируют подходящее активируемое антитело для лечения (например, активируемое антитело, содержащее CM, которое расщепляется у пациента в очаге заболевания). В некоторых вариантах осуществления активируемое антитело представляет собой активируемое антитело, с которым конъюгировано терапевтическое средство. В некоторых вариантах осуществления активируемое антитело не является конъюгированным со средством. В некоторых вариантах осуществления активируемое антитело содержит детектируемую метку. В некоторых вариантах осуществления детектируемую метку располагают на AB. В некоторых вариантах осуществления измерение уровня активируемого антитела у индивидуума или в образце проводят с использованием вторичного реагента, который специфически связывается с активированным антителом, где реагент содержит детектируемую метку. В некоторых вариантах осуществления вторичный реагент представляет собой антитело, содержащее детектируемую метку.
[000463] В некоторых вариантах осуществления способ или набор используют для идентификации или иным образом определения популяции пациентов, подходящей для лечения активируемым антителом против мишени и/или конъюгированным активируемом антителом против мишени (например, активируемым антителом, с которым конъюгировано терапевтическое средство) по изобретению с последующим лечением путем введения такого активируемого антитела и/или конъюгированного активируемого антитела нуждающемуся в этом индивидууму. Например, пациентов, результаты теста которых являются положительными в отношении мишени (например, мишени) и протеазы, которая расщепляет субстрат в расщепляемом фрагменте (CM) активируемого антитела и/или конъюгированного активируемого антитела, тестируемого в этих способах, идентифицируют как подходящих кандидатов для лечения таким антителом и/или таким конъюгированным активируемым антителом, содержащим такой CM, и пациенту затем вводят терапевтически эффективное количество активируемого антитела и/или конъюгированного активируемого антитела, которое тестировали. Аналогично, пациенты, результаты теста которых валяются отрицательными для любой из мишени (например, мишени) и протеазы, которая расщепляет субстрат в CM в активируемом антителе, тестируемом этими способами, или для обеих, можно идентифицировать как подходящих кандидатов для другой формы терапии. В некоторых вариантах осуществления таких пациентов можно тестировать с использованием другого антитела и/или конъюгированного активируемого антитела до тех пор, пока не идентифицируют подходящее антитело и/или конъюгированное активируемое антитело для лечения (например, активируемое антитело и/или конъюгированное активируемое антитело, содержащее CM, которое расщепляется у пациента в очаге заболевания). В некоторых вариантах осуществления пациенту затем вводят терапевтически эффективное количество активируемого антитела и/или конъюгированного антитела, по отношению к которому результаты теста пациента являются положительными.
[000464] В некоторых вариантах осуществления этих способов и наборов MM представляет собой пептид длиной приблизительно от 4 до 40 аминокислот. В некоторых вариантах осуществления этих способов и наборов активируемое антитело содержит линкерный пептид, где линкерный пептид располагается между MM и CM. В некоторых вариантах осуществления этих способов и наборов активируемое антитело содержит линкерный пептид, где линкерный пептид располагается между AB и CM. В некоторых вариантах осуществления этих способов и наборов активируемое антитело содержит первый линкерный пептид (L1) и второй линкерный пептид (L2), где первый линкерный пептид располагается между MM и CM, и втор линкерный пептид располагается между AB и CM. В некоторых вариантах осуществления этих способов и наборов каждый из L1 и L2 представляет собой пептид длиной приблизительно от 1 до 20 аминокислот, и где каждый из L1 и L2 необязательно представляет собой один и тот же линкер. В некоторых вариантах осуществления этих способов и наборов один или оба L1 и L2 содержат полимер глицин-серина. В некоторых вариантах осуществления этих способов и наборов по меньшей мере один из L1 и L2 содержит аминокислотную последовательность, выбранную из группы, состоящей из (GS)n, (GSGGS)n (SEQ ID NO:1) и (GGGS)n (SEQ ID NO:2), где n представляет собой целое число по меньшей мере один. В некоторых вариантах осуществления этих способов и наборов по меньшей мере один из L1 и L2 содержит аминокислотную последовательность, имеющую формулу (GGS)n, где n представляет собой целое число по меньшей мере один. В некоторых вариантах осуществления этих способов и наборов по меньшей мере один из L1 и L2 содержит аминокислотную последовательность, выбранную из группы, состоящей из Gly-Gly-Ser-Gly (SEQ ID NO:3), Gly-Gly-Ser-Gly-Gly (SEQ ID NO:4), Gly-Ser-Gly-Ser-Gly (SEQ ID NO:5), Gly-Ser-Gly-Gly-Gly (SEQ ID NO:6), Gly-Gly-Gly-Ser-Gly (SEQ ID NO:7) и Gly-Ser-Ser-Ser-Gly (SEQ ID NO:8).
[000465] В некоторых вариантах осуществления этих способов и наборов AB содержит последовательность антитела или фрагмента антитела, выбранную из последовательностей перекрестно-реагирующих антител, представленных в настоящем описании. В некоторых вариантах осуществления этих способов и наборов AB представляет собой фрагмент Fab, scFv или одноцепочечное антитело (scAb).
[000466] В некоторых вариантах осуществления этих способов и наборов расщепляющее средство представляет собой протеазу, которая солокализована у индивидуума или в образце с мишенью, и CM представляет собой полипептид, который функционирует как субстрат для протеазы, где протеаза расщепляет CM в активируемом антителе, когда активируемое антитело подвергается действию протеазы. В некоторых вариантах осуществления этих способов и наборов CM представляет собой полипептид длиной до 15 аминокислот. В некоторых вариантах осуществления этих способов и наборов CM присоединяют к N-концу AB. В некоторых вариантах осуществления этих способов и наборов CM присоединяют к C-концу AB. В некоторых вариантах осуществления этих способов и наборов CM присоединяют к N-концу цепи VL AB.
[000467] Активируемые антитела и/или конъюгированные активируемые антитела по изобретению используют в диагностических и профилактических составах. В одном из вариантов осуществления активируемое антитело вводят пациентам, которые подвергаются риску развития одного или более из указанного выше воспаления, воспалительных нарушений, злокачественной опухоли или других нарушений.
[000468] Предрасположенность пациента или органа к одному или более из указанных выше нарушений можно определять с использованием генотипических, серологических или биохимических маркеров.
[000469] В некоторых вариантах осуществления активируемое антитело и/или конъюгированные активируемые антитела вводят являющимся людьми индивидуумам, у которых диагностировали клинические показания, ассоциированные с одним или более из указанных выше нарушений. После диагностики вводят активируемое антитело и/или конъюгированные активируемые антитела для ослабления или купирования эффектов клинического показания.
[000470] Активируемые антитела и/или конъюгированные активируемые антитела по изобретению также являются пригодными для детекции мишени в образцах от пациентов и, таким образом, являются пригодными в качестве диагностических средств. Например, активируемые антитела и/или конъюгированные активируемые антитела по изобретению используют в анализах in vitro, например, ELISA, для детекции уровней мишени в образце от пациента.
[000471] В одном из вариантов осуществления активируемое антитело по изобретению является иммобилизованным на твердой подложке (например, лунке(ах) планшета для микротитрования). Иммобилизованное активируемое антитело служит в качестве захватывающего антитела для любой мишени, которая может содержаться в тестируемом образце. Перед приведением иммобилизованного антитела в контакт с образцом пациента твердую подложку ополаскивают и обрабатывают блокирующим средством, таким как белок молока или альбумин, для предотвращения неспецифического адсорбции аналита.
[000472] Затем лунки обрабатывают тестируемым образцом, который предположительно содержит антиген, или раствором, содержащим стандартное количество антигена. Такой образец представляет собой, например, образец сыворотки от индивидуума, у которого подозревают уровни циркулирующего антигена, которые расценивают как диагностику патологии. После отмывания от тестируемого образца или стандарта твердую подложку обрабатывают вторым антителом, которое является меченным с возможностью детекции. Меченое второе антитело служит в качестве детектируемого антитела. Измеряют уровень детектируемой метки и определяют концентрацию антигена-мишени в тестируемом образце сравнением со стандартной кривой, получаемой из стандартных образцов.
[000473] Следует понимать, что на основании результатов, получаемых с использованием антител по изобретению в диагностическом анализе in vitro, возможно определять стадию заболевания у индивидуума на основании уровней экспрессии антигена-мишени. Для данного заболевания образцы крови получают от индивидуумов, у которых диагностировали, что они находится на различных стадиях прогрессирования заболевания, и/или в различные моменты времени при терапевтическом лечении заболевания. С использованием совокупности образцов, которая обеспечивает статистически значимые результаты для каждой стадии прогрессирования или терапии, определяют диапазон концентраций антигена, который можно считать характерным для каждой стадии.
[000474] Активируемые антитела и/или конъюгированные активируемые антитела также можно использовать в способах диагностики и/или визуализации. В некоторых вариантах осуществления такие способы представляют собой способы in vitro. В некоторых вариантах осуществления такие способы представляют собой способы in vivo. В некоторых вариантах осуществления такие способы представляют собой способы in situ. В некоторых вариантах осуществления такие способы представляют собой способы ex vivo. Например, активируемые антитела, содержащие ферментативно расщепляемый CM, можно использовать для детекции наличия или отсутствия фермента, который способен расщеплять расщепляемый CM. Такие активируемые антитела можно использовать в диагностике, которая может включать детекцию in vivo (например, качественную или количественную) активности фермента (или в некоторых вариантах осуществления среды повышенного восстановительного потенциала, такой как среда, которая обеспечивает восстановление дисульфидной связи) посредством измеряемого накопления активируемых антител (т.е. антител, возникающих в результате расщепления активируемого антитела) в данной клетке или ткани данного организма-хозяина. Такое накопление активируемых антител указывает не только на то, что ткань обладает ферментативной активностью (или повышенным восстановительным потенциалом в зависимости от природы CM), а также на то, что ткань экспрессирует мишень, с которой связывается активированное антитело.
[000475] Например, CM можно выбирать так, чтобы он являлся субстратом протеазы для протеазы, встречающейся в очаге опухоли, в очаге вирусной или бактериальной инфекции на биологически ограниченном участке (например, таком как в абсцессе, в органе и т.п.) и т.п. AB может представлять собой AB, который связывается с антигеном-мишенью. Способами, хорошо известными специалисту в данной области можно конъюгировать детектируемую метку (например, флуоресцентную метку или радиоактивную метка или радиоактивный индикатор) с AB или другой областью активируемого антитела. Подходящие детектируемые метки описаны в контексте указанных выше способов скрининга, и ниже приведены дополнительные конкретные примеры. С использованием AB, специфичного к белку или пептиду, характерному для состояния болезни, наряду с протеазой, активность которой повышается в представляющей интерес пораженной ткани, для активируемых антител демонстрируют повышенную скорость связывания с пораженной тканью относительно тканей, где специфичный к CM фермент не содержится на детектируемом уровне или содержится на более низком уровне, чем в пораженной ткани или является неактивным (например, в форме зимогена или в комплексе с ингибитором). Вследствие того, что малые белки и пептиды быстро выводятся из крови фильтрационной системой почек, и вследствие того, что фермент, специфичный к CM, не содержится на детектируемом уровне (или содержится на более низких уровнях в непораженных тканях или содержится в неактивной конформации), накопление активируемых антител в пораженной ткани повышается относительно непораженных тканей.
[000476] В другом примере активируемые антитела можно использовать для детекции наличия или отсутствия расщепляющего средства в образце. Например, в случае, когда активируемые антитела содержат CM, чувствительный к расщеплению ферментом, активируемые антитела можно использовать для детекции (качественно или количественно) содержания фермента в образце. В другом примере в случае, когда активируемые антитела содержат CM, чувствительный к расщеплению восстановителем, активируемые антитела можно использовать для детекции (качественно или количественно) наличия восстановительных условий в образце. Для облегчения анализа в этих способах активируемые антитела можно метить с возможностью детекции и можно связывать с подложкой (например, твердой подложкой, такой как предметное стекло или гранула). Детектируемую метку можно располагать на участке активируемого антитела, который не высвобождается после расщепления, например, детектируемая метка может представлять собой флуоресцентную метку с гашением флуоресценции или другу метку, которая не является детектируемой до тех пор, пока не происходит расщепление. Анализ можно проводить, например, путем приведения иммобилизованных, меченных с возможностью детекции активируемых антител в контакт с образцом, предположительно содержащим фермент и/или восстановитель, в течение периода времени, достаточного для того, чтобы происходило расщепление, затем промывания для удаления избытка образца и загрязнителей. Затем оценивают наличие или отсутствие расщепляющего средства (например, фермента или восстановителя) в образце по изменению детектируемого сигнала активируемых антител до приведения в контакт с образцом, например, по наличию и/или увеличению детектируемого сигнала вследствие расщепления активируемого антитела расщепляющим средством в образце.
[000477] Такие способы детекции можно адаптировать, чтобы они также обеспечивали детекцию наличия или отсутствия мишени, которая способна связываться с AB активируемых антител при расщеплении. Таким образом, анализы можно адаптировать для оценки наличия или отсутствия расщепляющего средства и наличия или отсутствия представляющей интерес мишени. Наличие или отсутствие расщепляющего средства можно детектировать по наличию и/или отсутствию детектируемой метки активируемых антител, как описано выше, и можно детектировать наличие или отсутствие мишени детекцией комплекса мишень-AB, например, с использованием меченного с возможностью детекции антитела против мишени.
[000478] Активируемые антитела также являются пригодными для визуализации in situ для подтверждения активации активируемого антитела, например, в результате расщепления протеазой, и связывания с конкретной мишенью. Визуализация in situ представляет собой способ, который обеспечивает локализацию протеолитической активности и мишени в биологических образцах, таких как культуры клеток или тканевые срезы. С использованием этого способа можно подтверждать как связывание с данной мишенью, так и протеолитическую активность на основании наличия детектируемой метки (например, флуоресцентной метки).
[000479] Такие техники являются пригодными для любых замороженных клеток или тканей, получаемых из очага заболевания (например, опухолевой ткани) или здоровых тканей. Такие техники также являются пригодными для свежих образцов клеток или тканей.
[000480] В этих техниках активируемое антитело метят детектируемой меткой. Детектируемая метка может представлять собой флуоресцентный краситель, (например, флуорофор, флуоресцеинизотиоцианат (FITC), родамин изотиоцианат (TRITC), метку Alexa Fluor®), поглощающий в ближней ИК-области краситель (NIR) (например, нанокристаллы Qdot®), коллоидный металл, гаптен, радиоактивный маркер, биотин и усиливающий сигнал реагент, такой как стрептавидин или фермент (например, пероксидазу хрена или щелочную фосфатазу).
[000481] Детекция метки в образце, который инкубировали с меченым активируемым антителом, указывает на то, что образец содержит мишень и содержит протеазу, которая является специфической для CM активируемого антитела. В некоторых вариантах осуществления наличие протеазы можно подтверждать с использованием широкого спектра ингибиторов протеаз, таких как ингибиторы, описываемые в настоящем описании, и/или с использованием средства, которое является специфическим для протеазы, например, антитела, такого как A11, которое является специфическим для протеазы матриптазы (MT-SP1) и ингибирует протеолитическую активность матриптазы; см., например, международную публикацию номер WO 2010/129609, опубликованную 11 ноября 2010 года. Тот же подход использования широкого спектра ингибиторов протеаз, таких как ингибиторы, описываемые в настоящем описании, и/или с использованием более селективного ингибирующего средства можно использовать для идентификации протеазы или класса протеаз, специфических к CM активируемого антитела. В некоторых вариантах осуществления наличие мишени можно подтверждать с использованием средства, которое является специфическим для мишени, например, другое антитело или детектируемая метка может конкурировать с немеченой мишенью. В некоторых вариантах осуществления немеченое активируемое антитело можно использовать при детекции посредством меченого вторичного антитела или более сложной системы детекции.
[000482] Аналогичные техники также являются пригодными для визуализации in vivo, где детекцию флуоресцентного сигнала у индивидуума, например, млекопитающего, включая человека, свидетельствует о том, что очаг поражения содержит мишень и содержит протеаз, которая является специфической для CM активируемого антитела.
[000483] Такие техники также являются пригодными в наборах и/или в качестве реагентов для детекции, идентификации или характеризации активности протеаз в различных клетках, тканях и организмах на основании специфического для протеазы CM в активируемом антителе.
[000484] В некоторых вариантах осуществления визуализация in situ и/или визуализация in vivo являются пригодными в способах для идентификации, какого пациента следует лечить. Например, в визуализации in situ активируемые антитела используют для скрининга образцов от пациентов для идентификации, тех пациентов, у которых соответствующие протеаза(ы) и мишень(и) находится в соответствующей локализации, например, в очаге опухоли.
[000485] В некоторых вариантах осуществления визуализацию in situ используют для идентификации или иным образом определения популяции пациентов, подходящей для лечения активируемым антителом по изобретению. Например, пациентов, результаты теста которых являются положительными в отношении мишени и протеазы, которая расщепляет субстрат в расщепляемом фрагменте (CM) тестируемого активируемого антитела, (например, накапливаются активированные антитела в очаге поражения) идентифицируют как подходящих кандидатов для лечения таким активируемым антителом, содержащим такой CM. Аналогично, пациенты, результаты теста которых являются отрицательными в отношении любой из мишени и протеазы, которая расщепляет субстрат в CM в активируемом антителе, тестируемом этими способами, или в отношении обеих, идентифицируют как подходящих кандидатов для другой формы терапии (т.е. не подходящих для лечения тестируемым активируемым антителом). В некоторых вариантах осуществления такие пациенты, результаты теста которых являются отрицательными в отношении первого активируемого антитела, можно тестировать с использованием других активируемых антител, содержащих различные CM, до тех пор, пока не идентифицируют подходящее активируемое антитело для лечения (например, активируемое антитело, содержащее CM, которое расщепляется у пациента в очаге заболевания).
[000486] В некоторых вариантах осуществления визуализацию in vivo используют для идентификации или иным образом определения популяции пациентов, подходящей для лечения активируемым антителом по изобретению. Например, пациентов, результаты теста которых являются положительными в отношении мишени и протеазы, которая расщепляет субстрат в расщепляемом фрагменте (CM) тестируемого активируемого антитела, (например, накапливаются активированные антитела в очаге поражения) идентифицируют как подходящих кандидатов для лечения таким активируемым антителом, содержащим такой CM. Аналогично, пациенты, результаты теста которых являются отрицательными, идентифицируют как подходящих кандидатов для другой формы терапии (т.е. не подходящих для лечения тестируемым активируемым антителом). В некоторых вариантах осуществления такие пациенты, результаты теста которых являются отрицательными в отношении первого активируемого антитела, можно тестировать другими активируемыми антителами, содержащими различные CM, до тех пор, пока не идентифицируют подходящее активируемое антитело для лечения (например, активируемое антитело, содержащее CM, которое расщепляется у пациента в очаге заболевания).
Фармацевтические композиции
[000487] Конъюгированные антитела, активируемые антитела и/или конъюгированные активируемые антитела по изобретению (также обозначаемые в настоящем описании как "активные соединения"), и их производные, фрагменты, аналоги и гомологи можно вводить в фармацевтические композиции, подходящие для введения. Такие композиции, как правило, содержат конъюгированное антитело, активируемое антитело и/или конъюгированное активируемое антитело и фармацевтически приемлемый носитель. Как используют в настоящем описании, термин "фармацевтически приемлемый носитель" предназначен включать любой и все растворители, диспергирующие среды, покрытия, антибактериальные и противогрибковые средства, изотонические и замедляющие всасывание средства и т.п., совместимые с фармацевтическим введением. Подходящие носители описаны в последнем издании Remington's Pharmaceutical Sciences, стандартный текст в данной области, включенный в настоящее описание посредством ссылки. Подходящие примеры таких носителей или разбавителей включают, но не ограничиваются ими, воду, физиологический раствор, растворы Рингера, раствор декстрозы и 5% сывороточный альбумин человека. Также можно использовать липосомы и неводные носители, такие как жирные масла. Использование таких сред и средств для фармацевтически активных веществ хорошо известно в данной области. За исключением тех случаев, когда какая-либо общепринятая среда или средство является несовместимым с активным соединением, предусматривается его использование в композициях. В композиции также можно вводить дополнительные активные соединения.
[000488] Фармацевтическую композицию по изобретению формулируют, чтобы она являлась совместимой с предполагаемым ее путем введения. Примеры путей введения включают парентеральное, например, внутривенное, внутрикожное, подкожное, пероральное (например, ингаляцию), чрескожное (т.е. местное), трансмукозальное и ректальное введение. Растворы или суспензии, используемые для парентерального, внутрикожного или подкожного применения, могут содержать следующие компоненты: стерильный разбавитель, такой как вода для инъекции, физиологический раствор, жирное масла, полиэтиленгликоли, глицерин, пропиленгликоль или другие синтетические растворители; антибактериальные средства, такие как бензиловый спирт или метилпарабены; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатирующие средства, такие как этилендиаминтетрауксусная кислота (EDTA); буферы, такие как ацетаты, цитраты или фосфаты, и средства регуляции тоничности, такие как хлорид натрия или декстроза. pH можно доводить кислотами или основаниями, такими как соляная кислота или гидроксид натрия. Парентеральные препарат можно заключать в ампулы, одноразовые шприцы или многодозовые флаконы, выполненные из стекла или пластика.
[000489] Фармацевтические композиции, подходящие для инъекционного использования, включают стерильные водные растворы (в случае водорастворимых соединений) или дисперсии и стерильные порошки для экстемпорального получения стерильных инъецируемых растворов или дисперсии. Для внутривенного введения подходящие носители включают физиологический раствор, бактериостатическую воду, Cremophor EL™ (BASF, Parsippany, N.J.) или фосфатно-солевой буфер (PBS). Во всех случаях, композиция должна являться стерильной и должна быть жидкой в тех случаях, когда существует возможность простого введения через шприц. Она должна быть стабильной в условиях производства и хранения и должна быть защищена от загрязняющего действия микроорганизмов, таких как бактерии и грибы. Носитель может представлять собой растворитель или диспергирующую среду, содержащую, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль, и т.п.), и подходящие их смеси. Соответствующую текучесть можно поддерживать, например, с использованием покрытия, такого как лецитин, путем поддержания требуемого размера частиц в случае дисперсии и с использованием поверхностно-активных веществ. Предотвращение действия микроорганизмов можно получать посредством различных антибактериальных и противогрибковых средств, например, парабенов, хлорбутанола, фенола, аскорбиновой кислоты, тимеросала и т.п. В некоторых вариантах осуществления желательным является введение средств для придания изотоничности, например, сахаров, полиспиртов, таких как манитол, сорбит, хлорида натрия в композицию. Пролонгированное всасывание инъецируемых композиций можно получать введением в композицию средства, которое замедляет всасывание, например, моностеарата алюминия и желатина.
[000490] Стерильные инъецируемые растворы можно получать введением активного соединения в необходимом количестве в подходящем растворителе с одним или комбинацией ингредиентов, перечисленных выше, при необходимости с последующей стерилизацией фильтрованием. Как правило, дисперсии получают введением активного соединения в стерильный носитель, который содержит основную диспергирующую среду и необходимые другие ингредиенты, из ингредиентов, перечисленных выше. В случае стерильных порошков для получения стерильных инъецируемых растворов способы получения представляют собой вакуумную сушку и лиофильную сушку, которая приводит к получению порошка активного ингредиента плюс любой дополнительный желаемый ингредиент из его предварительно стерильно профильтрованного раствора.
[000491] Пероральные композиции, как правило, содержат инертный разбавитель или съедобный носитель. Их можно заключать в желатиновые капсулы или прессовать в таблетки. Для целей перорального терапевтического введения активное соединение можно вводить с эксципиентами и использовать в форме таблеток, пастилок или капсул. Пероральные композиции также можно получать с использованием жидкого носителя для применения в качестве ополаскивателя рта, где соединение в жидком носителе применяют перорально и поласкают рот, и сплевывают или проглатывают. Фармацевтически совместимые связывающие средства и/или вещества адъювантов можно вводить в виде части композиции. Таблетки, пилюли, капсулы, пастилки и т.п. могут содержать любой из следующих ниже ингредиентов или соединений сходной природы: связывающее средство, такое как микрокристаллическая целлюлоза, трагакантовая камедь или желатин; эксципиент, такой как крахмал или лактоза, дезинтегрирующее средство, такое как альгиновая кислота, примогель или кукурузный крахмал; смазочное средство, такое как стеарат магния или Sterote; способствующее скольжению средство, такое как коллоидный диоксид кремния; подсластитель, такой как сахароза или сахарин, или ароматизатор, такой как перечная мята, метилсалицилат или ароматизирующая добавка апельсина.
[000492] Для введения путем ингаляции соединения доставляют в форме аэрозольного спрея из контейнера под давлением или дозатора, который содержит подходящий пропеллент, например, газ, такой как диоксид углерода, или распылителя.
[000493] Системное введение также можно проводить трансмукозальным или чрескожным путем. Для трансмукозального или чрескожного введения в составе используют усиливающие проницаемость средства, подходящие для того, чтобы проходить через барьер. Такие усиливающие проницаемость средства, как правило, известны в данной области и включают, например, для трансмукозального введения детергенты, соли желчных кислот и производные фусидовой кислоты. Трансмукозальное введение можно проводить путем использования назальных спреев или суппозиторий. Для трансдермального введения активные соединения формулируют в мази, бальзамы, гели или кремы, как в основном известно в данной области.
[000494] Соединения также можно получать в форме суппозиториев (например, с общепринятыми основами суппозиториев, такими как масло какао и другие глицериды) или удерживающей клизмой для ректальной доставки.
[000495] В одном из вариантов осуществления активные соединения получают с носителями, которые защищают соединение от быстрой элиминации из организма, такими как состав с контролируемым высвобождением, включая имплантаты и микроинкапсулированные системы доставки. Можно использовать биоразрушаемые, биосовместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, полиортоэфиры и полимолочная кислота. Способы получения таких составов известны специалистам в данной области. Вещества также можно получать коммерческим путем от Alza Corporation и Nova Pharmaceuticals, Inc. Липосомные суспензии (включая липосомы, направленные на инфицированные клетки, моноклональными антителами к антигенам вируса) также можно использовать в качестве фармацевтически приемлемых носителей. Их можно получать способами, известными специалистам в данной области, например, как описано в патенте США № 4522811.
[000496] Особенно предпочтительно формулировать пероральные или парентеральные композиции в стандартной лекарственной форме для простоты введения и однородности дозирования. Стандартная лекарственная форма, как используют в настоящем описании, относится к физически дискретным единицам, подходящих в качестве однократных доз для индивидуума, подлежащего лечению; где каждая единица содержит определенное количество активного соединения, предназначенного для оказания желаемого терапевтического эффекта, в сочетании с необходимым фармацевтическим носителем. Спецификация стандартных лекарственных форм по изобретению обусловлена и непосредственно зависит от уникальных характеристик активного соединения и конкретного терапевтического эффекта, который необходимо получать, и ограничений, характерных в данной области составления такого активного соединения для лечения индивидуумов.
[000497] Фармацевтические композиции могут содержаться в контейнере, упаковке или дозаторе совместно с инструкциями по введению.
[000498] Изобретение дополнительно описано в следующих ниже примерах, которые не ограничивают объем изобретения, описанный в формуле изобретения.
Примеры
Пример 1. Способность синовиальной жидкости активировать зонды с тушением флуоресценции, содержащие субстраты по изобретению
[000499] Этот пример демонстрирует способность образцов синовиальной жидкости расщеплять последовательности субстрата MMP по изобретению. В частности, расщепляемые MMP последовательности тестировали в отношении конструкции активируемого антитела, содержащей маскирующий фрагмент, связанный с последовательностью антитела против IL-6R посредством области линкера, которая содержит расщепляемую MMP последовательность, которую оценивают.
[000500] Следующие ниже расщепляемые MMP активируемые антитела инкубировали с синовиальной жидкостью:
Аминокислота 479210419AV1
QGQSGQYGSCSWNYVHIFMDCGSSGGSGGSGGSGISSGLSSGGSDIQMTQSPSSLSASVGDRVTITCRASQDISSYLNWYQQKPGKAPKLLIYYTSRLHSGVPSRFSGSGSGTDFTFTISSLQPEDIATYYCQQGNTLPYTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:115)
Нуклеотид 479210419AV1
Caaggccagtctggccagtatgggtcctgcagttggaactatgtacacatattcatggattgcggctcgagcggtggcagcggtggctctggtggctcaggtattagtagtggtcttagcagtggcggttctgacatccagatgactcagtctcctagctccctgtccgcctctgtgggggaccgagtcaccatcacatgcagagccagccaggatatttctagttacctgaactggtatcagcagaagcccggaaaagcacctaagctgctgatctactatacctccaggctgcactctggcgtgcccagtcggttcagtggctcagggagcggaaccgacttcacttttaccatctcaagcctgcagccagaggatattgccacatactattgtcagcagggcaatacactgccctacacttttggccaggggaccaaggtggaaatcaaacgtacggtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt (SEQ ID NO:116)
Аминокислота 4792559AV1
QGQSGQYGSCSWNYVHIFMDCGSSGGSGGSGGSQNQALRMAGGSDIQMTQSPSSLSASVGDRVTITCRASQDISSYLNWYQQKPGKAPKLLIYYTSRLHSGVPSRFSGSGSGTDFTFTISSLQPEDIATYYCQQGNTLPYTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:117)
Нуклеотид 4792559AV1
caaggccagtctggccagtatgggtcctgcagttggaactatgtacacatattcatggattgcggctcgagcggtggcagcggtggctctggtggctcacagaatcaggcattacgtatggcaggcggttctgacatccagatgactcagtctcctagctccctgtccgcctctgtgggggaccgagtcaccatcacatgcagagccagccaggatatttctagttacctgaactggtatcagcagaagcccggaaaagcacctaagctgctgatctactatacctccaggctgcactctggcgtgcccagtcggttcagtggctcagggagcggaaccgacttcacttttaccatctcaagcctgcagccagaggatattgccacatactattgtcagcagggcaatacactgccctacacttttggccaggggaccaaggtggaaatcaaacgtacggtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt (SEQ ID NO:118)
Аминокислота 4792601AV1
QGQSGQYGSCSWNYVHIFMDCGSSGGSGGSGGSAQNLLGMVGGSDIQMTQSPSSLSASVGDRVTITCRASQDISSYLNWYQQKPGKAPKLLIYYTSRLHSGVPSRFSGSGSGTDFTFTISSLQPEDIATYYCQQGNTLPYTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:119)
Нуклеотид 4792601AV1
Caaggccagtctggccagtatgggtcctgcagttggaactatgtacacatattcatggattgcggctcgagcggtggcagcggtggctctggtggctcagcacagaatctgttaggtatggtaggcggttctgacatccagatgactcagtctcctagctccctgtccgcctctgtgggggaccgagtcaccatcacatgcagagccagccaggatatttctagttacctgaactggtatcagcagaagcccggaaaagcacctaagctgctgatctactatacctccaggctgcactctggcgtgcccagtcggttcagtggctcagggagcggaaccgacttcacttttaccatctcaagcctgcagccagaggatattgccacatactattgtcagcagggcaatacactgccctacacttttggccaggggaccaaggtggaaatcaaacgtacggtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt (SEQ ID NO:120)
Аминокислота 47923457AV1
QGQSGQYGSCSWNYVHIFMDCGSSGGSGGSGGSSTFPFGMFGGSDIQMTQSPSSLSASVGDRVTITCRASQDISSYLNWYQQKPGKAPKLLIYYTSRLHSGVPSRFSGSGSGTDFTFTISSLQPEDIATYYCQQGNTLPYTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:121)
Нуклеотид 47923457AV1
Caaggccagtctggccagtatgggtcctgcagttggaactatgtacacatattcatggattgcggctcgagcggtggcagcggtggctctggtggctcaagtacatttccattcggtatgttcggcggttctgacatccagatgactcagtctcctagctccctgtccgcctctgtgggggaccgagtcaccatcacatgcagagccagccaggatatttctagttacctgaactggtatcagcagaagcccggaaaagcacctaagctgctgatctactatacctccaggctgcactctggcgtgcccagtcggttcagtggctcagggagcggaaccgacttcacttttaccatctcaagcctgcagccagaggatattgccacatactattgtcagcagggcaatacactgccctacacttttggccaggggaccaaggtggaaatcaaacgtacggtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt (SEQ ID NO:122)
Аминокислота 47923458AV1
QGQSGQYGSCSWNYVHIFMDCGSSGGSGGSGGSPVGYTSSLGGSDIQMTQSPSSLSASVGDRVTITCRASQDISSYLNWYQQKPGKAPKLLIYYTSRLHSGVPSRFSGSGSGTDFTFTISSLQPEDIATYYCQQGNTLPYTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:123)
Нуклеотид 47923458AV1
Caaggccagtctggccagtatgggtcctgcagttggaactatgtacacatattcatggattgcggctcgagcggtggcagcggtggctctggtggctcacctgttggatatacgagtagtctgggcggttctgacatccagatgactcagtctcctagctccctgtccgcctctgtgggggaccgagtcaccatcacatgcagagccagccaggatatttctagttacctgaactggtatcagcagaagcccggaaaagcacctaagctgctgatctactatacctccaggctgcactctggcgtgcccagtcggttcagtggctcagggagcggaaccgacttcacttttaccatctcaagcctgcagccagaggatattgccacatactattgtcagcagggcaatacactgccctacacttttggccaggggaccaaggtggaaatcaaacgtacggtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt (SEQ ID NO:124)
Аминокислота 47923463AV1
QGQSGQYGSCSWNYVHIFMDCGSSGGSGGSGGSDWLYWPGIGGSDIQMTQSPSSLSASVGDRVTITCRASQDISSYLNWYQQKPGKAPKLLIYYTSRLHSGVPSRFSGSGSGTDFTFTISSLQPEDIATYYCQQGNTLPYTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:125)
Нуклеотид 47923463AV1
Caaggccagtctggccagtatgggtcctgcagttggaactatgtacacatattcatggattgcggctcgagcggtggcagcggtggctctggtggctcagactggttatactggcctggtattggcggttctgacatccagatgactcagtctcctagctccctgtccgcctctgtgggggaccgagtcaccatcacatgcagagccagccaggatatttctagttacctgaactggtatcagcagaagcccggaaaagcacctaagctgctgatctactatacctccaggctgcactctggcgtgcccagtcggttcagtggctcagggagcggaaccgacttcacttttaccatctcaagcctgcagccagaggatattgccacatactattgtcagcagggcaatacactgccctacacttttggccaggggaccaaggtggaaatcaaacgtacggtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt (SEQ ID NO:66)
[000501] Степень активации активируемого антитела форматом ELISA, в котором измеряли способность активируемого антитела после инкубации в синовиальной жидкости связываться с IL6R человека по сравнению со связыванием исходного антитела против IL6R с IL6R. В кратком изложении, планшеты Nunc Maxisorp покрывали в течение ночи при 4°C 100 мкл/лунку (микролитров/лунку) раствором 500 нг/мл IL6R человека (R and D Systems, каталожный номер 227-SR/CF) в PBS, pH 7,4. Планшеты промывали 3 раза h PBST (PBS, pH 7,4, 0,05% Tween 20). Затем лунки блокировали 200 мкл/лунку 2% NFDM (обезжиренное сухо молоко) в PBST в течение 2 часов при комнатной температуре. Покрытые IL6R планшеты промывали 3 раза PBST (PBS, pH 7,4, 0,05% Tween 20). В соответствующие планшета лунки ELISA, покрытого IL6R добавляли серийное разведение каждой реакционной смеси активируемое антитело-синовиальная жидкость, а также серийное разведение исходного антитела против IL6R. Планшеты инкубировали 1 час при комнатной температуре, а затем промывали 3 раза PBST (PBS, pH 7,4, 0,05% Tween 20). Добавляли сто мкл/лунку антитела козы против IgG человека (Fab specific, Sigma, каталожный номер A0293) разведение 1:3000 в 2% NFDM-PBST и инкубировали планшет в течение 1 часа при комнатной температуре. Планшеты промывали 6 раз PBST (PBS, pH 7,4, 0,05% Tween 20), а затем проявляли TMB и 1н. HCl.
[000502] В таблице 6 приведены результаты этого эксперимента. Данные указывают на то, что активируемые антитела против IL6R, содержащие субстраты из таблицы 6, расщепляются по меньшей мере некоторыми образцами синовиальной жидкости (SyF), получаемыми от пациентов с RA.
Активация активируемого антитела
ISSGLSS (SEQ ID NO:159)
QNQALRMA (SEQ ID NO:15)
Пример 2. Активируемое антитело против EGFR с расщепляемым MMP субстратом для ингибирования роста опухоли
[000503] Этот пример демонстрирует способность активируемого антитела против EGFR, которое содержит маскирующий фрагмент, содержащую аминокислотную последовательность CISPRGCPDGPYVMY (SEQ ID NO:160),расщепляемый фрагмент, содержащий субстрат MMP14 520 (также обозначаемый в настоящем описании как MN520) ISSGLLSS (SEQ ID NO:14), и тяжелую цепь (SEQ ID NO:56) и легкую цепь (SEQ ID NO:59) антитела против EGFR C225v5, где полную конструкцию активируемого антитела обозначают в настоящем описании как Pb-MN520, ингибировать рост опухоли на модели ксенотрансплантата рака легких H292. Конфигурация легкой цепи активируемого антитела представляла собой маскирующий фрагмент-субстрат MMP- легкая цепь C225v5.
[000504] Фигура 1A представляет собой график, иллюстрирующий эффекты, наблюдаемые у мышей, несущих ксенотрансплантат опухоли H292, которых обрабатывали с использованием Pb-520 (12,5 мг/кг, жирная синяя линия) и IVIG (12,5 мг/кг, зеленая пунктирная линия), дозируемых в разные моменты времени. Данные приведены в виде среднего объема опухоли±SEM.
Фигура 1B представляет собой график, иллюстрирующий общую стабильность активируемого антитела Pb-520 у мышей, несущих опухоль H292. Образцы крови получали посредством заборов крови в ретроорбитальной области на сутки 7 и определяли стабильность субстрата 520 в кровообращении анализом осаждения IgG с капиллярным электрофорезом (GXII; Caliper FifeSciences). Концентрации расщепленной и нерасщепленной легкой цепи определяли с использованием программного обеспечения FabChip GX (Caliper FifeSciences).
Пример 3. Материалы и методы
[000505] Реагенты и штаммы: Конъюгированный со стрептавидином фикоэритрин (SA-PE) (Invitrogen, Fife Technologies) использовали без модификации. MMP9 человека (Research&Diagnostics Systems, Inc.) активировали в соответствии с поставляемым протоколом и использовали без модификации. MMP14 человека (Research&Diagnostics Systems, Inc.) активировали в соответствии с поставляемым протоколом и использовали без модификации. Плазмин человека (Haematologic Technologies Inc.) использовали без модификации. tPA человека (Molecular Innovations) использовали без модификации. YPet, слитый с доменом SH3 Mona (моноцитарный адаптерный белок), получали от CytomX Therapeutics и использовали без модификации. Использовали буфер HCM MMP14 (50 мМ HEPES (pH 6,8), 10 мМ CaCl2, 0,5 мM MgCl2). Использовали Буфер TCNB MMP9 (50 мМ Tris-HCl, 10 мМ CaCl2, 150 мМ NaCl, 0,05% (масс./об.) Brij-35, pH 7,5). Использовали буфер для плазмина (50 мМ Tris-Cl pH 7,5, 100 мМ NaCl, 0,01% Tween 20 и 1 мМ EDTA. Использовали TBST (50 мМ Tris-HCl, 150 мМ NaCl, 0,05% Tween 20, pH 7,4). Использовали E. coli MC1061 (Casadaban et al., JMB 138(2): 179-207 (1980). Все вращение бактерий проводили при 37°C при интенсивном перемешивании в бульоне Луриа-Бертани (LB), дополненном 34 пг/мл хлорамфеникола, если не указан другой антибиотик.
[000506] Анализ расщепления субстрата и стабильности каркаса: Для скрининга и анализа клонов ночные культуры субкультивировали разбавлением в свежей среде (1:50) и растили в течение 1,5-2 часов. Затем субкультуру индуцировали 0,04% арабинозы и инкубировали при встряхивании при 37°C в течение 45 минут-1 часа. Бля блокирования дальнейшего роста клетки инкубировали на льду в течение 15 минут-1 часа. Собирали аликвоты клеток и промывали PBS (pH 7,4). Клетки осаждали центрифугированием, удаляли супернатант и ресуспендировали клетки в реакционном буфере, содержащем фермент; реакционную смесь инкубировали при 37°C в статических условиях. Для остановки реакции удаляли клетки и разбавляли в 10 раз в PBS, осаждали центрифугированием и ресуспендировали в PBS, содержащем (CLiPS) SA-PE (20 мкг/мл) или YPet-MONA (50 нМ). После инкубации на льду (30 минут) клетки промывали PBS и анализировали с использованием клеточного сортера FACSAria™.
[000507] Для анализов расщепления протеазой MMP9 культуры индуцировали в течение 45 минут-1 часа. Реакционный буфер для MMP9 представлял собой TCNB. Анализы гидролиза MMP9 проводили после того, как свежие клетки инкубировали с 5 нМ-25 нМ MMP9 в течение 1 часа. Фоновый уровень гидролиза областей, фланкирующих участок субстрата (с использованием платформы eCLiPS3.0-NSUB_SP, описанной в патентной заявке PCT PCT/US13/54378, зарегистрированной 9 августа 2013 года, которая была опубликована как международную публикация № WO 2014/02613613 февраля 2014 года, содержание которой, таким образом, полностью включено ссылки) измеряли для каждого условия реакции для подтверждения того, что гидролиз происходил в установленной области субстрата.
[000508] Для анализов расщепления протеазой MMP14 культуры индуцировали в течение 45 минут-1 часа. Реакционный буфер для MMP14 представлял собой HCM. Анализы гидролиза MMP14 проводили после реакций с3 нМ-250 нМ MMP14 или 1 часа. Фоновый уровень гидролиза областей, фланкирующих участок субстрата (с использованием платформы eCLiPS3.0-NSUB_SP, описываемой в настоящем описании) измеряли для каждого условия реакции для подтверждения того, что гидролиз происходил в установленной области субстрата.
[000509] Для анализов стабильности плазмина человека используют платформу eCLiPS3.0-NSUB_SP; культуры индуцируют в течение 45 минут-1 часа. Реакционный буфер для плазмина представляет собой 50 мМ Tris-HCl pH 7,5, дополненный 100 мМ NaCl, 0,01% Tween 20 и 1 мМ EDTA. Анализы гидролиза плазмин проводят после реакций с плазмином в течение 1 часа.
[000510] Для анализов стабильности tPA человека используют платформу eCLiPS3.0-NSUB_SP; культуры индуцируют в течение 45 минут-1 часа. Реакционный буфер для tPA представляет собой TBST. Анализы гидролиза tPA проводят после реакций с tPA в течение 1 часа.
[000511] Условия амино- и карбокси-концевого мечения. Использовали конъюгированный со стрептавидином фикоэритрин (SAPE) для мечения связывающегося со стрептавидином аффинного лиганда на N-концах CPX. Флуоресцентный белок YPet, слитый с доменом SH3, Mona использовали для мечения связывающегося с MONA аффинного лиганда на C-концах CPX. Для оптимального мечения клеток без взаимодействия протеазы клетки инкубировали в течение 30 минут при 4°C с SAPE (20 пг/мл) или YPet-MONA (50 нМ). Для описываемого примера использовали инкубацию менее 30 минут.
[000512] Анализ данных кинетики: Для измерения изменений средней флуоресценции популяция клональных клеток после обработки протеазой непосредственно измеряли степень преобразования предоставляемых на клеточной поверхности пептидных субстратов с использованием проточной цитометрии. В частности, для каждого образца определяли преобразование посредством анализов проточной цитометрии с использованием отношения
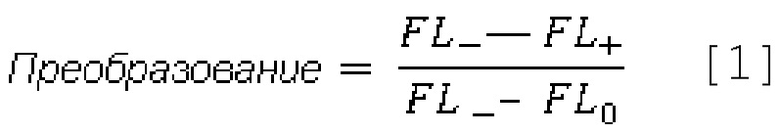
где (FL_) представляет собой флуоресценцию после инкубации без фермента, (FL+) представляет собой флуоресценцию после инкубации с ферментом, и (FL0) представляет собой флуоресценцию немеченых клеток. Принимая во внимание, что ожидаемые концентрации субстрата, которые использовали, являются значительно ниже ожидаемой KM субстрата для мишени протеазы, модель Михаэлис-Ментен упрощают до:
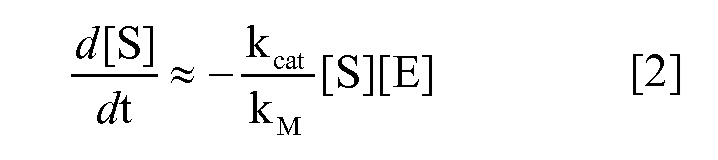
что позволяет выражать преобразование субстрата как
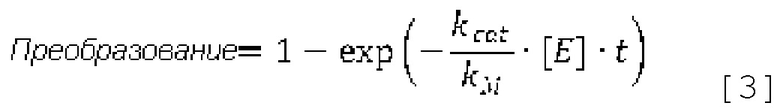
где [S] представляет собой концентрацию субстрата, [E] представляет собой концентрацию фермента, и t представляет собой время. Для определения константы скорости второго порядка (kcat/KM), уравнение [3] упрощали до:
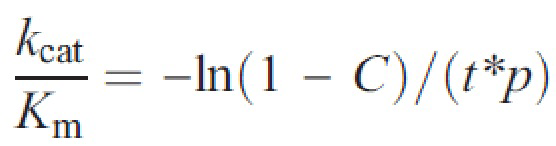
где C представляет собой преобразование продукта, t представляет собой время, и p представляет собой концентрацию протеазы.
[000513] Анализ данных последовательности - направленное семейство: Субстраты подвергали секвенированию Ion Torrent™ (см., например, Rothenberg J.M., Nature 475, 348-352). Прочтения Raw Ion Torrent обрезали инвариантами последовательностями вектора для получения только переменной ставки пептида. Транслировали последовательности вставки и исключали из дальнейшего анализа последовательности со стоп-кодонами. Частоты для каждой последовательности получали по числу наблюдаемых случаев для всех наблюдаемых прочтений переменного пептида. получали обогащение последовательностей получали сравнением наблюдаемой частоты каждой последовательности после отбора с частотой каждой последовательности до отбора. Идентифицировали индивидуальные последовательности и выделяли из этих данных, и выравнивали последовательности в CLC Main Lab (CLC Main Workbench 6.6.2, доступной в режиме реального времени). Файл выравнивания импортировали в Jalview (см., например, Waterhouse A.M., et al, 2009, 9 Bioinformatics 9, 1189-1191) и собирали дерево средних расстояний с использованием алгоритма BLOSUM62 (S Henikoff S. et al., 1992, Proc. Natl. Acad. Sci. USA, 89, 10915-10919). Ограниченная группа последовательностей включает представителей кластера, ближайшего к представляющей интерес последовательности. Расширенная группа последовательностей включает ограниченную группу последовательностей плюс представители ветки, которая имеет ближайшего общего предка (где применимо).
Пример 4. Отбор и характеризация совокупности субстрата в платформе Scaffold
[000514] Использование многокопийного дисплея субстрата на целых клетках обеспечивало возможность отбора популяций субстратов, расщепляемых MMP9. Отборы проводили, как описано в патенте США № 7666817 B2, опубликованном 23 февраля 2010 года, с использованием рекомбинантной MMP9 человека. Для каждого условия реакции измеряли фоновый уровень гидролиза областей, фланкирующих участок субстрата (с использованием платформы eCFiPS3.0-NSUB_SP) для подтверждения того, что гидролиз происходил в установленной области субстрата. Отобранные совокупности тестировали с использованием MMP9 и MMP14. На фигурах 2A и 2B представлено расщепление совокупности SMP87 MMP9 при 5 нМ в буфере TCNB.
Пример 5. Характеризация кинетики расщепления субстрата в платформе Scaffold
[000515] Использование многокопийного дисплея субстрата на целых клетках обеспечивало простую и прямую количественную характеризацию кинетики расщепления. Таким образом, проточную цитометрия использовали для классификации индивидуальных выделенных клонов на основании преобразования субстрата и идентифицировали клоны секвенированием ДНК. Таким образом, можно было определять степень преобразования для каждого клона при нескольких различных концентрациях протеазы и адаптировать к модели Михаэлиса-Ментен (раздел Анализ данных кинетики). Наблюдаемую константу скорости второго порядка (kcat/KM) определяли для каждого субстрата в зависимости от MMP9. Для каждого условия реакции измеряли фоновый уровень гидролиза областей, фланкирующих участок субстрата, (с использованием платформы eCFiPS3.0-NSUB_SP) для подтверждения того, что гидролиз происходил в установленной области субстрата. Например, на фигурах 3A и 3B представлено расщепление субстрата, содержащего аминокислотную последовательность VAGRSMRP (SEQ ID NO:484), 5 нМ MMP9 в TBST.
Пример 6. Корреляция частоты секвенирования нового поколения и кинетики расщепления субстрата в платформе Scaffold
[000516] Конечные совокупности обогащенных субстратов секвенировали с использованием секвенирования нового поколения Ion Torrent. Необработанный данные прочтений Ion Torrent обрезали инвариантами последовательностями вектора для получения только переменной ставки пептида. Транслировали последовательности вставки и исключали из дальнейшего анализа последовательности со стоп-кодонами. Для функционального анализа проводили отбор клонов (диапазон предоставления частот). Отобранные клоны расщепляли MMP9 человека и для каждого определяли kcat/KM. Затем наносили на график значение log числа копий клонов в совокупности в зависимости от log kcat/KM. На фигуре 4 представлена корреляция частоты конкретного расщепляемого фрагмента (число копий) и их доступностей для расщепления MMP9 (MMP9 kcat/KM M-1с-1).
Пример 7. Отбор и характеризация совокупности субстрата в платформе Scaffold
[000517] Использование многокопийного дисплея субстрата на целых клетках обеспечивало отбор популяций субстратов, расщепляемых MMP14. Отборы проводили, как описано в патенте США № 7666817 B2, с использованием рекомбинантной MMP14 человека. Для каждого условия реакции измеряли фоновый уровень гидролиза областей, фланкирующих участок субстрата, (с использованием платформы eCFiPS3.0-NSUB_SP) для подтверждения того, что гидролиз происходил в установленной области субстрата. Отобранные совокупности тестировали MMP9 и MMP14. На фигурах 5A и 5B представлено расщепление совокупности SMP39 MMP14 при 60 нМ в буфере HCM.
Пример 8. Характеризация кинетики расщепления субстрата в платформе Scaffold
[000518] Использование многокопийного дисплея субстрата на целых клетках обеспечивало простую и прямую количественную характеризацию кинетики расщепления. Таким образом, проточную цитометрия использовали для классификации индивидуальных выделенных клонов на основании преобразования субстрата и идентифицировали клоны секвенированием ДНК. Таким образом, можно было определять степень преобразования для каждого клона при нескольких различных концентрациях протеазы и адаптировать к модели Михаэлиса-Ментен (раздел Анализ данных кинетики). Наблюдаемую константу скорости второго порядка (kcat/KM) определяли для каждого субстрата в зависимости от MMP14. Для каждого условия реакции измеряли фоновый уровень гидролиза областей, фланкирующих участок субстрата (с использованием платформы eCFiPS3.0-NSUB_SP) для подтверждения того, что гидролиз происходил в установленной области субстрата. Например, на фигурах 6A и 6B представлено расщепление субстрата, содержащего аминокислотную последовательность QNQALRMA (SEQ ID NO:15), 30 нМ MMP14 в буфере HCM.
Пример 9. Активность in vitro субстрата в активируемых антителах
[000519] Этот пример демонстрирует активность in vitro субстратов по изобретению, когда их вводят в активируемые антитела.
[000520] Несколько субстратов, идентифицированных в этих исследованиях, вводили в активируемые антитела с маскированием 3954 и вариантом C225v5 цетуксимаба, который описан в публикации PCT № WO 2013/163631, и полностью включенной в настоящее описание посредством ссылки.
[000521] Способность субстратов в получаемых активируемых антителах расщепляться MMP9 или MMP14 определяли так, как указано ниже. Расщепления протеазой MMP9 проводили в TCNB, 50 мМ Tris-HCl, 10 мМ CaCl2, 150 мМ NaCl, 0,05% (масс./об.) Brij-35, pH 7,5. Расщепления MMP14 проводили в 50 мМ HEPES (pH 6,8), 10 мМ CaCl2, 0,5 мМ MgCl2. Изменяющиеся концентрации титруемого активного центра MMP9 или MMP14 комбинировали с фиксированными концентрациями активируемого антитела для поддержания отношения субстрата к протеазе по меньшей мере 50. Образцы, содержащие субстраты MMP9, инкубировали при 37°C в течение периода времени до 24 часов. Образцы, содержащие субстрата MMP14, инкубировали при 37°C в течение 4 часов. Для остановки реакции 5 мкл гидролизата добавляли к 7 мкл буфера HT Protein Express Sample (Caliper LifeSciences), содержащего 20 мМ 2-меркаптоэтанола, в течение 10 минут при 95°C. После тепловой денатурации добавляли 32 мкл ddH2O и анализировали образцы на LabChip GXII по инструкциям производителя. Для количественного анализа области пика легкой цепи использовали программное обеспечение LabChip GXII. Преобразование продукта рассчитывали подстановкой площадей пиков легкой цепи в следующее уравнение: расщепленная LC/(расщепленная LC+нерасщепленная LC), LC=легкая цепь. Значения kcat/KM определяли по следующей ниже формуле
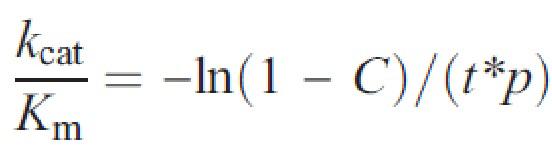
где C представляет собой преобразование продукта, t представляет собой время (с), и p представляет собой концентрацию протеазы (M), что допускает, что концентрация субстрата является ниже Km и больше концентрации протеазы.
[000522] Получаемые активируемые антитела, содержащие субстраты, отбираемые для расщепления MMP14, тестированные на расщепление MMP14, имели значения kcat/KM в диапазоне приблизительно от 400 до 60,000 M-1с-1 для MMP14. Получаемые активируемые антитела, содержащие субстраты, отбираемые для расщепления MMP9, тестированные на расщепление MMP9, расщеплялись MMP9.
Пример 10. Стабильность субстрата активируемых антител in vivo
[000523] Этот пример демонстрирует стабильность субстратов in vivo по изобретению, когда их вводят в активируемые антитела и инъецируют мышам.
[000524] Три бестимусные мыши (CrkNU-Foxnlnu) получали однократную дозу и/п каждого активируемого антитела при 12,5 мг/кг на сутки 0. Мышей подвергали эвтаназии на сутки 4 (~96 часов после дозирования) путем удушения CO2 и сразу же собирали кровь в виде плазмы-EDTA и хранили при -80°C.
[000525] Активируемые антитела выделяли из плазмы иммунопреципитацией антителом против IgG человека с использованием магнитных гранул. Для анализа капиллярным электрофорезом получали элюированные активируемые антитела, как описано в разделе kcat/KM. В кратком изложении, 5 мкл элюированного IgG добавляли к 7 мкл буфера Protein Express Sample с 2-меркаптоэтанолом. Количественное определение стабильности в кровотоке являлось идентичным количественному определению преобразования продукта.
[000526] Из десяти активируемых антител, содержащих субстраты по изобретению, отобранных для расщепления MMP14, для семи демонстрировали менее 20% расщепления в собранных образцах плазмы. Из семи активируемых антител, содержащих субстраты по изобретению, отобранных для расщепления MMP9, для четырех демонстрировали не более 20% расщепления в собранных образцах плазмы.
Пример 11.Материалы и методы
[000527] Реагенты и штаммы: MMP9 человека (каталожный № 911-MP, Research&Diagnostics Systems, Inc.) активировали по протоколу поставщика и использовали без модификации. MMP14 человека (каталожный № 918-M), Research&Diagnostics Systems, Inc.) активировали по протоколу поставщика и использовали без модификации. Плазмин человека (каталожный № HCPM-0140, Haematologic Technologies Inc.) использовали без модификации. Моноклональное антитело против EE (Covance, Princeton, NJ) метили Alexa 647 (Life Sciences) и использовали без других модификаций (named EE647). Для всех экспериментов использовали получаемые штаммы E. coli MC1061 или MC1061 (DH10β) (Casadaban et al., JMB, 138(2): 179-207 (1980)). Все выращивание бактерий проводили при 37°C при интенсивном встряхивании в бульоне Луриа-Бертани (LB), дополненном 34 мкг/мл хлорамфеникола (cm), если конкретно не указан другой антибиотик.
[000528] Платформы дисплея: Получали платформы дисплея, где каждую конструировали так, чтобы содержать субстрат 8-аминокислоты вариантов осуществления, и использовали, как описано в международной публикации № WO 2014/026136, опубликованной 13 февраля 2014 года, содержание которой включено, таким образом, полностью посредством ссылки. Аминокислотная последовательность зрелой платформы дисплея (т.е. без сигнального пептида) CYTX-DP-XXXXXXXX (SEQ ID NO:512) представлена на фигуре 7A. XXXXXXXX (SEQ ID NO:514) означает местоположение, куда вводят каждый субстрат. Аминокислотная последовательность платформы дисплея CYTX-DP-XXXXXXXX (SEQ ID NO:512), также содержащая свой сигнальный пептид, т.е. платформы дисплея SP-CYTX-DP-XXXXXXXX (SEQ ID NO:513), представлена на фигуре 7B.
Платформа дисплея CYTX-DP-XXXXXXXX:
GQSGQEYMPMEGGSGQXXXXXXXXSGGQGGSGGSGGSGGSGGSAYYGITAGPAYRINDWASIYGVVGVGYGSGPGGSYGFSYGAGLQFNPMENVALDFSYEQSRIRSVDVGTWILSVGYRFGSKSRRATSTVTGGYAQSDAQGQMNKMGGFNLKYRYEEDNSPLGVIGSFTYTGGSGGSSGQAAAGHHHHHHHH (SEQ ID NO:512)
Платформа дисплея SP-CYTX-DP-XXXXXXXX:
MKKIACLSALAAVLAFTAGTSVAGQSGQEYMPMEGGSGQXXXXXXXXSGGQGGSGGSGGSGGSGGSAYYGITAGPAYRINDWASIYGVVGVGYGSGPGGSYGFSYGAGLQFNPMENVALDFSYEQSRIRSVDVGTWILSVGYRFGSKSRRATSTVTGGYAQSDAQGQMNKMGGFNLKYRYEEDNSPLGVIGSFTYTGGSGGSSGQAAAGHHHHHHHH (SEQ ID NO:513)
[000529] Анализ расщепление субстрата и кинетики расщепления: Для анализа клонов ночные культуры субкультивировали разбавлением в свежей среде (1:40) и растили в течение 1,5-2 часов. Затем субкультуры индуцировали 0,04% арабинозы и инкубировали при встряхивании при 37°C в течение 40 минут-1 часа. Затем для остановки дальнейшего роста клетки инкубировали на льду в течение 15 минут-1 часа. Собирали аликвоты клеток и промывали PBS (pH 7,4). Клетки осаждали центрифугированием, удаляли супернатант и ресуспендировали клетки в реакционном буфере, содержащем фермент; реакционную смесь инкубировали при 37°C при встряхивании. Для остановки реакции удаляли клетки и разбавляли в 10 раз в PBS, осаждали центрифугированием и ресуспендировали в PBS, содержащем EE647 (20 микрограмм на мл (также обозначаемых в настоящем описании как мкг/мл или μг/мл)). После инкубации на льду (1 час) клетки промывали PBS и анализировали с использованием клеточного сортера Accuri C6.
[000530] Для анализов расщепления протеазой MMP9 культуры индуцировали в течение 45 минут. Реакционный буфер для MMP9 представлял собой 50 мМ Tris-HCl, pH 7,4, дополненный 150 мM NaCl, 10 мМ CaCl2 и 0,05% (масс./об.) Brij-35. Анализы гидролиза MMP9 проводили после расщепления 5 нМ-150 нМ MMP9 в течение 1 часа. Для каждого условия реакции измеряли фоновый уровень гидролиза областей, фланкирующих участок субстрата (с использованием, например, CYTX-DP-NSUB платформы дисплея, в которой "субстрат" представляет собой нерасщепляемый линкер GGGSGGGS (SEQ ID NO:515)) для подтверждения того, что гидролиз происходил в установленной области субстрата.
[000531] Для анализов расщепления протеазой MMP14 культуры индуцировали в течение 45 минут. Реакционный буфер для MMP14 представлял собой 50 мМ HEPES, pH 6,8, дополненный 10 мМ CaCl2 и 0,5 мМ MgCl2. Анализы гидролиза MMP14 проводили после расщепления 5 нМ-150 нМ MMP14 в течение 1 часа. Для каждого условия реакции измеряли фоновый уровень гидролиза областей, фланкирующих участок субстрата (с использованием, например, CYTX-DP-NSUB) для подтверждения того, что гидролиз происходил в установленной области субстрата.
[000532] Для анализов плазмина человека культуры индуцировали в течение 45 минут. Реакционный буфер для плазмина представлял собой 50 мМ Tris-HCl pH 7,4, дополненный 100 мМ NaCl, 0,01% Tween 20 и 1 мМ EDTA. Анализы гидролиза плазмина проводили после расщепления 500 пМ плазмина в течение 1 часа. Для каждого условия реакции измеряли фоновый уровень гидролиза областей, фланкирующих участок субстрата (с использованием, например, CYTX-DP-NSUB) для подтверждения того, что гидролиз происходил в установленной области субстрата.
[000533] Условия амино- и карбокси-концевого мечения. Конъюгированное с Alexa-647 антитело против EE (EE647) использовали для мечения связывающегося с EE аффинного лиганда на N-концах платформы дисплея CYTX-DP. Конъюгированное с Alexa-647 антитело против His (His647) использовали для мечения связывающегося с 8His аффинного лиганда на C-концах платформы дисплея CYTX-DP. Для оптимального мечения клеток без взаимодействия протеазы клетки инкубировали в течение 1 часа при 4°C с EE647 (20 мкг/мл) или His647 (2 мкг/мл). Для описываемого ниже примера использовали инкубацию в течение 1 часа.
[000534] Анализ данных кинетики. Для измерения изменений средней флуоресценции популяций клональных клеток после обработки протеазой показатель преобразования предоставляемых на клеточной поверхности пептидных субстратов измеряли непосредственно с использованием проточной цитометрии. В частности, для каждого образца определяли анализом проточной цитометрии с использованием отношения
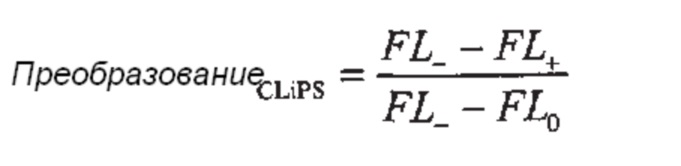 [1]
[1]
где (FL_) представляет собой флуоресценцию после инкубации без фермента, (FL+) представляет собой флуоресценцию после инкубации с ферментом, и (FL0) представляет собой флуоресценцию немеченых клеток. Принимая во внимание, что ожидаемые концентрации субстрата, которые использовали, являются значительно ниже ожидаемой KM субстрата для мишени протеазы, модель Михаэлис-Ментен упрощают до
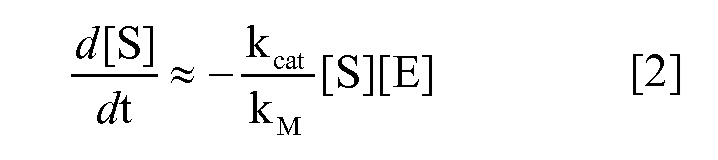
что позволяет выражать преобразование субстрата как
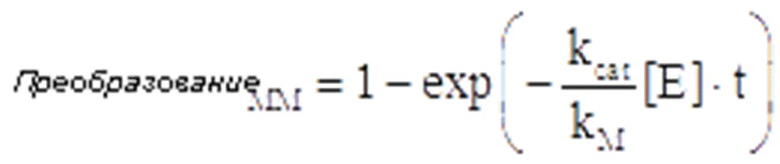 [3]
[3]
где [S] представляет собой концентрацию субстрата, [E] представляет собой концентрацию фермента, и t представляет собой время. Для определения константы скорости второго порядка (kcat/KM) зависящее от времени преобразование для каждого субстрата адаптировали к уравнению [3].
Пример 12. Характеризация способности субстрата расщепляться в платформе дисплея CYTX-DP
[000535] Этот пример демонстрирует способность субстратов вариантов осуществления расщепляться MMP, но не плазмином.
[000536] Использование многокопийного дисплея субстрата на целых клетках обеспечивало простую и прямую количественную характеризацию кинетики расщепления. Клоны, кодирующие субстраты идентифицировали секвенированием ДНК и субклонировали в платформу дисплея CYTX-DP, таким образом, что экспрессируемая платформа дисплея содержала субстрат длиной 8 аминокислот вместо XXXXXXXX (SEQ ID NO:514). Индивидуальных клонов, предоставляющих субстрат, (всего 127 независимых содержащих субстрат платформ дисплея) оценивали в отношении расщепления MMP9 или MMP14 (целевые протеазы, т.е. протеазы, используемые для отбора субстрата) и плазмином (нецелевая протеаза); оборот определяли проточной цитометрией. Из первой совокупности выбирали тридцать один субстрат, отобранный с использованием MMP9, который являлся источников субстратов, содержащих аминокислотные последовательности SEQ ID NO:17, 18, 19, 20, 21, 22 или 23 (субстраты MMP9 из совокупности). Девять субстратов, отобранных с использованием MMP9, содержат консенсусные аминокислотные последовательности SEQ ID NO:328, 336, 337, 338, 339, 348, 349, 350 или 351 (консенсусные последовательности MMP9). Из той же совокупности отбирали тридцать восемь субстратов, отобранных с использованием MMP14, которые являлись источником субстратов, содержащих аминокислотные последовательности SEQ ID NO:14, 15, 16, 24, 25, 26, 27, 28, 29, 30 или 33 (субстраты MMP14 из 1ой совокупности). Из той же совокупности отбирали десять субстратов, отобранных с использованием MMP14, которые являлись источником субстратов, содержащих аминокислотные последовательности SEQ ID NO:31 или 32 (субстраты MMP14 из 2ой совокупности). Тридцать девять субстратов из отобранных с использованием MMP14 отбирали из консенсусных аминокислотных последовательностей SEQ ID NO:364-370, 379-393, 402-409, 420-424, 434-435,450-452, 457, 470-472, 474 или 483 (консенсусные последовательности MMP14).
[000537] Таким образом, можно было определять степень расщепления для каждого клона и собирать данные для определения процента клонов, которые расщеплялись целевой протеазой и не расщеплялись нецелевой протеазой. Для каждого условия реакции измеряли фоновый уровень гидролиза областей, фланкирующих участок субстрата (с использованием, например, CYTX-DP-NSUB) для подтверждения того, что гидролиз происходил в установленной области субстрата. Результаты представлены в таблице 9.
Обобщение статистики способности субстратов расщепляться
[000538] В таблице 9 проиллюстрированы (a) процент отобранных с использованием MMP9 субстратов, тестируемых в платформе дисплея CYTX-DP, для которых демонстрировали по меньшей мере 20% расщепление при инкубации с 50 нМ MMP9 человека (каталожный № 911-MP, Research&Diagnostics Systems, Inc., активировали по протоколу поставщика и использовали без модификации) в течение 1 часа при 37°C в 50 мМ Tris-HCl, pH 7,4, дополненной 150 мМ NaCl, 10 мМ CaCl2 и 0,05% (масс./об.) Brij-35 (>20% расщепления 50 нМ MMP9); (b) процент отобранных с использованием MMP14 субстратов, тестируемых в платформе дисплея CYTX-DP, для которых демонстрировали по меньшей мере 20% расщепление при инкубации с 50 нМ MMP14 человека (каталожный № 918-MP, Research&Diagnostics Systems, Inc., активировали по протоколу поставщика и использовали без модификации) в течение 1 часа при 37°C в 50 мМ HEPES, pH 6,8, дополненного 10 мМ CaCl2 и 0,5 мМ MgCl2 (>20% расщепление 50 нМ MMP14); и (c) процент отобранных с использованием MMP9 или отобранных с использованием MMP-14 субстратов, тестируемых в платформе дисплея CYTX-DP, для которых демонстрировали менее 20% расщепление при инкубации с 500 пМ плазмина человека (каталожный номер HCPM-0140, Haematologic Technologies, Inc., использовали без модификаций) в течение 1 часа при 37°C в 50 мМ Tris-HCl, pH 7,4, дополненной 100 мМ NaCl, 0,01% Tween 20 и 1 мМ EDTA (< 20% расщепление 500 пМ плазмина).
Пример 13. Характеризация кинетики расщепления субстрата в платформах дисплея CYTX-DP
[000539] Этот пример демонстрирует кинетику расщепления различных субстратов.
[000540] Использование многокопийного дисплея субстрата на целых клетках обеспечивало простую и прямую количественную характеризацию кинетики расщепления. Клоны идентифицировали секвенированием ДНК и субклонировали в платформу дисплея CYTX-DP-XXXXXXXX (SEQ ID NO:512), как описано в предшествующем примере. Семьдесят два индивидуальных клонов, предоставляющих субстрат, оценивали на расщепление и выбирали подгруппу для оценки кинетики расщепления их целевой протеазой. Показатель преобразования для каждого из клонов можно было определять при нескольких различных концентрациях протеазы и адаптировать для модели Михаэлиса-Ментен, описываемой в настоящем описании. Затем наблюдаемые значения kcat/KM наносили на график в зависимости от частоты клона в совокупности субстратов и наблюдало корреляцию между частотой и kcat/KM. Для каждого условия реакции измеряли фоновый уровень гидролиза областей, фланкирующих участок субстрата (с использованием, например, CYTX-DP-NSUB) для подтверждения того, что гидролиз происходил в установленной области субстрата. Результаты представлены в таблице 10.
Обобщение статистики кинетики субстратов
Пример 14. Эффективность in vivo и активация in situ активируемых антител, содержащих субстрат MMP
[000541] Этот пример демонстрирует, что активируемые антитела, содержащие субстраты MMP вариантов осуществления, являются эффективными in vivo. Этот пример также демонстрирует, что такие активируемые антитела являются расщепляемыми в анализе визуализация in situ, такой как анализ, описанный в международной публикации № WO 2014/107559, опубликованной 10 июля 2014 года, содержание которой полностью включено, таким образом, посредством ссылки. Шесть активируемых антител, содержащих различные субстраты MMP (один отобранный с использованием MMP9 и пять отобранных с использованием MMP14) вариантов осуществления, вводили при 10 мг/кг или 12,5 мг/кг мышам, несущим ксенотрансплантат опухоли H292 (рака легких). Все шесть активируемых антител также содержали маскирующий фрагмент, содержащий аминокислотную последовательность CISPRGCPDGPYVMY (SEQ ID NO:160), и антитело против EGFR C225v5, содержащее легкую цепь (SEQ ID NO:59) и тяжелую цепь (SEQ ID NO:56). Конфигурация легкой цепи активируемого антитела представлял собой маскирующий фрагмент-субстрат MMP-легкая цепь C225v5. Для всех шести активируемых антител демонстрировали ингибирование роста опухоли в диапазоне от 22% до 81%, как измеряют по Δ % среднего ингибирования. Δ % среднего ингибирования рассчитывают как (среднее(C)-среднее(C0))-(среднее(T)-среднее(T0))/(среднее(C)-среднее(C0))×100%, где T представляет собой значение текущей тестируемой группы, T0 представляет собой исходное значение текущей группы, C представляет собой значение контрольной группы, и C0 представляет собой исходное значение текущей группы. Для антитела против EGFR цетуксимаб демонстрировали 96-98% ингибирование в этом исследовании.
[000542] Те же шесть активируемых антител подвергали анализам визуализация in situ опухолевой ткани H292 с использованием условий, описанных в примерах WO 2014/107559. Все шесть активируемых антител активировались, что демонстрировало, что все шесть субстратов MMP расщеплялись и высвобождаемые антитела связывались с EGFR в опухолевой ткани. Сигналы окрашивания находились в диапазоне от 15% до 65% от интенсивности сигнала IHC цетуксимаба. В основном, процент активации каждого активируемого антитела демонстрировал положительную корреляцию с эффективностью, которую демонстрировали для активируемого антитела на модели H292 на мышах.
[000543] Ткань от десяти пациентов с тройным негативным раком молочной железы подвергали визуализации in situ с использованием активируемого антитела против Jagged (например, активируемого антитела против Jagged, цитируемого в международной публикация № WO 2013/192550, опубликованной 27 декабря 2013 года, содержание которой полностью включено, таким образом, посредством ссылки), содержащего субстрат, отобранный с использованием MMP14, в условиях, описанных в примерах WO 2014/107559. Для девяти из десяти образцов ткани демонстрировали баллы окрашивания активации активируемого антитела в диапазоне от 15% до 100% по сравнению с интенсивностью сигнала IHC цетуксимаба. Для восьми из десяти образцов ткани демонстрировали баллы окрашивания активации активируемого антитела в диапазоне от 30% до 100% по сравнению с интенсивностью сигнала IHC цетуксимаба.
[000544] Несмотря на то, что изобретение описано в сочетании с подробным его описанием, указанное выше описание предназначено иллюстрировать, а не ограничивать объем изобретения, который определяется объемом прилагаемой формулы изобретения. Другие аспекты, преимущества и модификации входят в объем.
| название | год | авторы | номер документа |
|---|---|---|---|
| СУБСТРАТЫ МАТРИКСНОЙ МЕТАЛЛОПРОТЕИНАЗЫ И ДРУГИЕ РАСЩЕПЛЯЕМЫЕ ФРАГМЕНТЫ И СПОСОБЫ ИХ ИСПОЛЬЗОВАНИЯ | 2014 |
|
RU2832636C2 |
| КОНЪЮГАТЫ АНТИ-CD71 АКТИВИРУЕМОЕ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2771292C2 |
| АКТИВИРУЕМЫЕ АНТИТЕЛА, КОТОРЫЕ СВЯЗЫВАЮТСЯ С РЕЦЕПТОРОМ ЭПИДЕРМАЛЬНОГО ФАКТОРА РОСТА, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2713121C2 |
| МУЛЬТСПЕЦИФИЧЕСКИЕ АНТИТЕЛА, МУЛЬТСПЕЦИФИЧЕСКИЕ АКТИВИРУЕМЫЕ АНТИТЕЛА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2014 |
|
RU2815683C2 |
| МУЛЬТСПЕЦИФИЧЕСКИЕ АНТИТЕЛА, МУЛЬТСПЕЦИФИЧЕСКИЕ АКТИВИРУЕМЫЕ АНТИТЕЛА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2014 |
|
RU2727836C2 |
| ПОЛИСПЕЦИФИЧЕСКИЕ ПОЛИПЕПТИДНЫЕ КОНСТРУКЦИИ, ОБЛАДАЮЩИЕ ОГРАНИЧЕННЫМ СВЯЗЫВАНИЕМ С СD3, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2813816C2 |
| КОМПОЗИЦИИ МОДИФИЦИРОВАННЫХ АНТИТЕЛ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2010 |
|
RU2799787C2 |
| КОМПОЗИЦИИ МОДИФИЦИРОВАННЫХ АНТИТЕЛ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2010 |
|
RU2636046C2 |
| СВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ, СПЕЦИФИЧНЫЕ В ОТНОШЕНИИ ASCT2, И ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2710194C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА ПРОТИВ CD269 (BCMA) | 2015 |
|
RU2749041C2 |
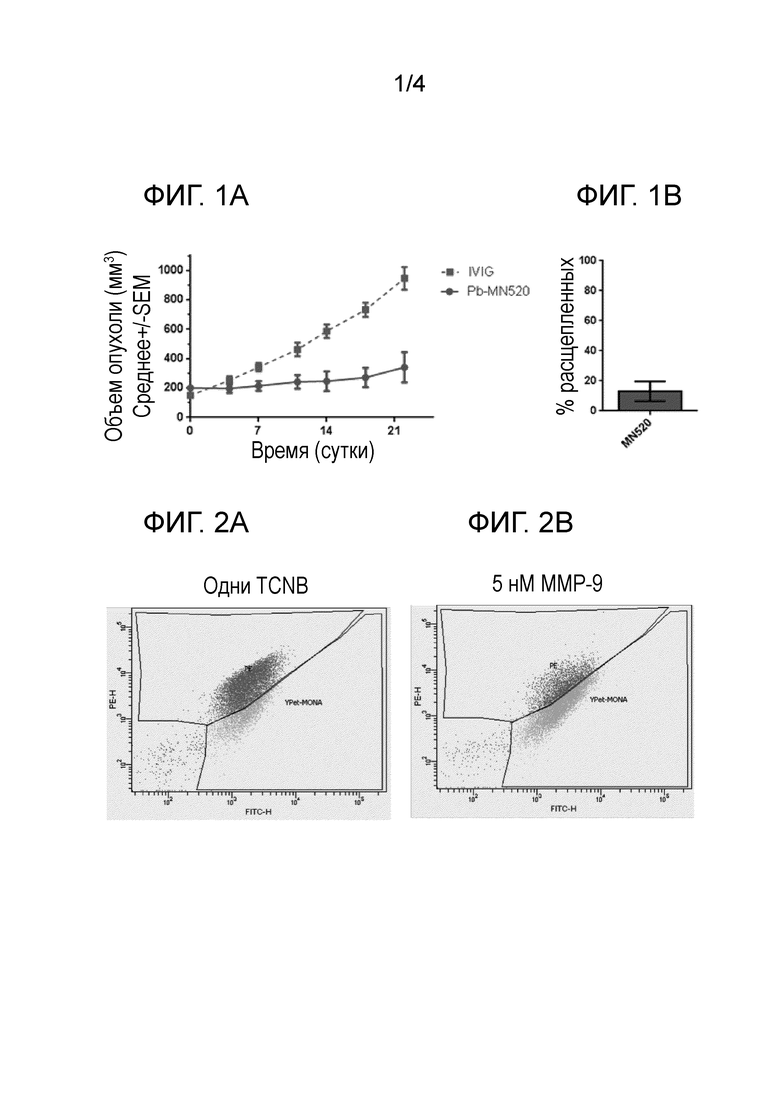
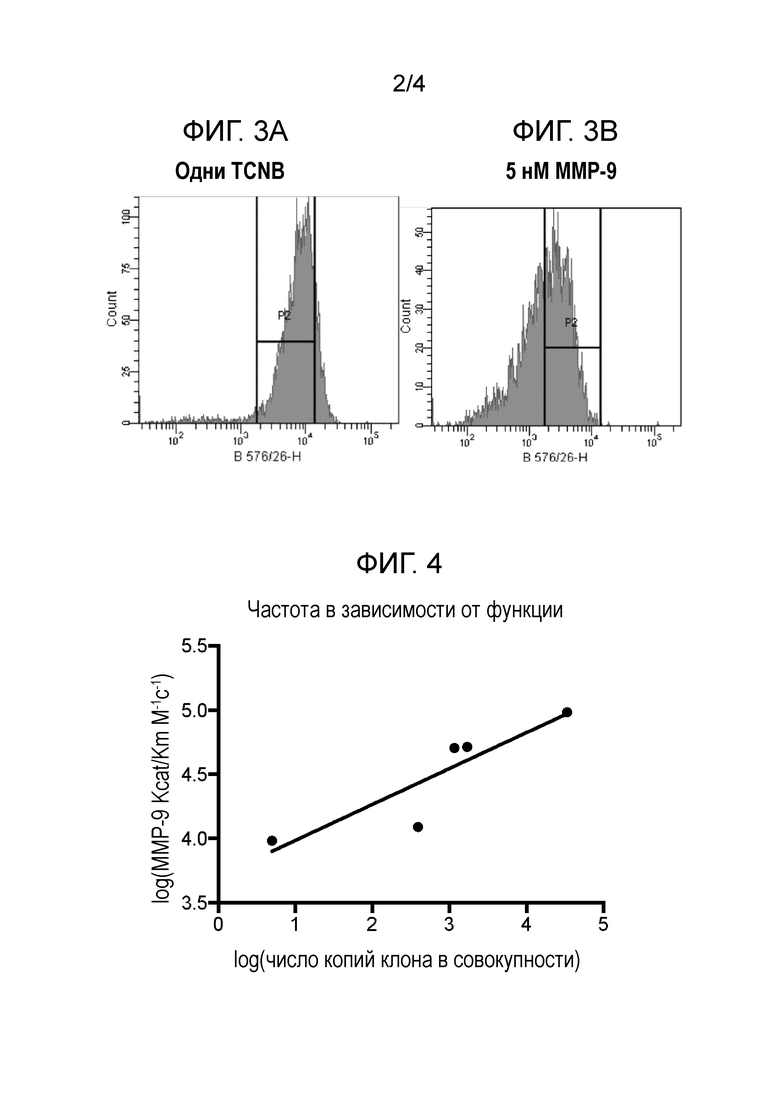
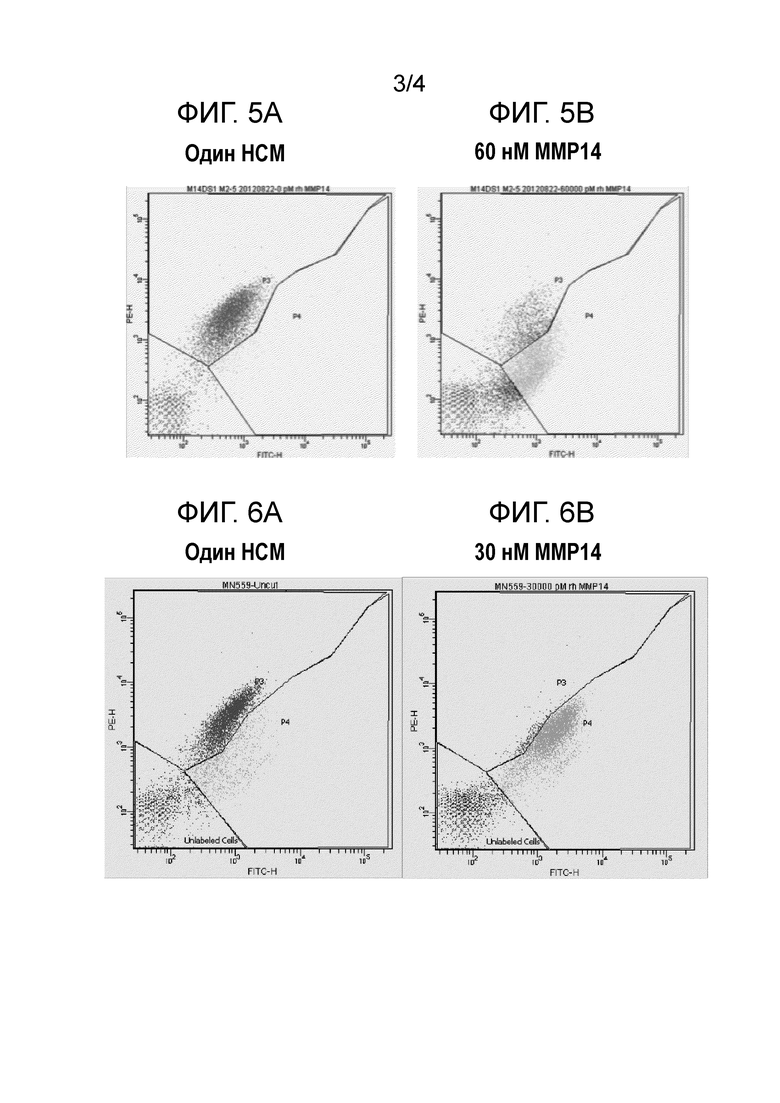
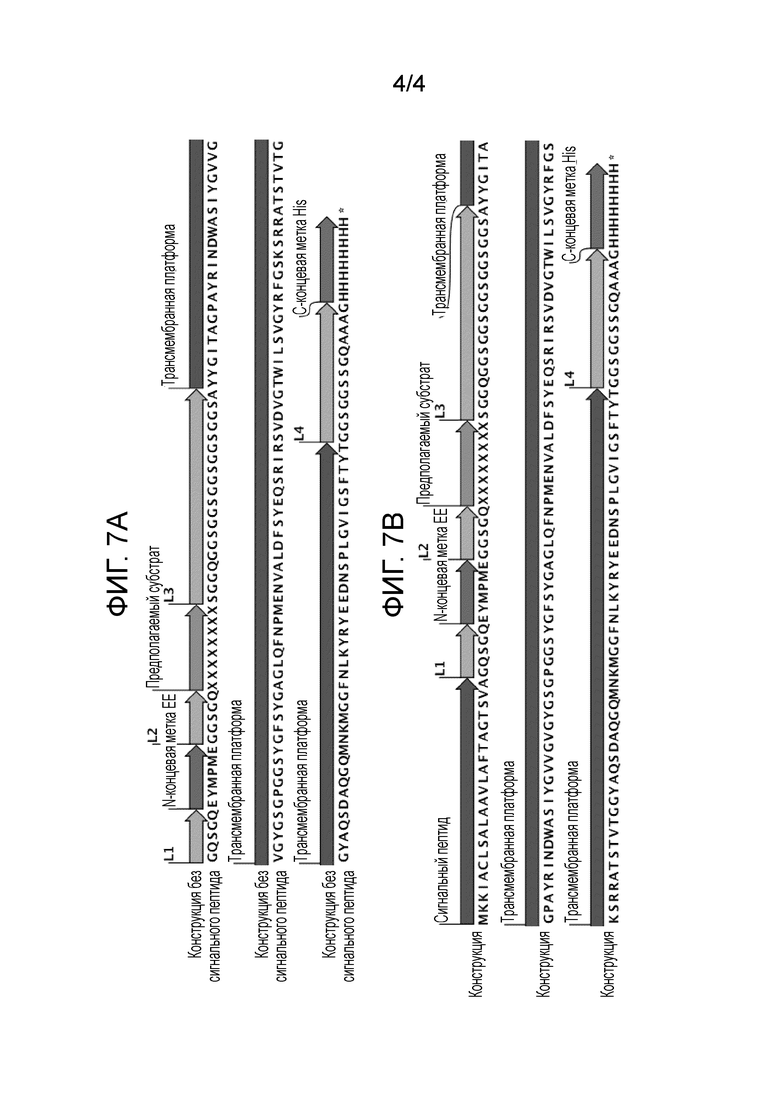
Изобретение относится к медицине и касается выделенного полипептида, содержащего расщепляемый фрагмент (CM), содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:459-469 и 31, где расщепляемый фрагмент представляет собой субстрат для матричной металлопротеазы. Изобретение обеспечивает расщепление выделенного полипептида матричной металлопротеазой. 14 з.п. ф-лы, 7 ил., 10 табл., 14 пр.
1. Выделенный полипептид, содержащий расщепляемый фрагмент (CM), содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:459-469 и 31, где расщепляемый фрагмент представляет собой субстрат для матричной металлопротеазы.
2. Выделенный полипептид по п.1, где CM содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:459-469.
3. Выделенный полипептид по п.1, где CM содержит аминокислотную последовательность SEQ ID NO:31.
4. Выделенный полипептид по п.1, где СМ содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:470-472.
5. Выделенный полипептид по п.1, где CM расщепляется по меньшей мере одной матриксной металлопротеазой (MMP), необязательно, где CM расщепляется по меньшей мере одной из MMP9 или MMP14.
6. Выделенный полипептид по п.1, где полипептид представляет собой антитело или его антигенсвязывающий фрагмент (AB), которое связывается с мишенью, необязательно, где его антигенсвязывающий фрагмент выбран из группы, состоящей из фрагмента Fab, фрагмента F(ab')2, scFv, scАb, dAb, однодоменного антитела на основе тяжелой цепи и однодоменного антитела на основе легкой цепи.
7. Выделенный полипептид по п.1, где CM является субстратом для матричной металлопротеазы, которая локализована в ткани вместе с мишенью.
8. Выделенный полипептид по п.6, где AB связан с CM, необязательно, где AB непосредственно связан с CM или где AB связан с CM через связывающий пептид.
9. Выделенный полипептид по любому из пп.6-8, где выделенный полипептид содержит маскирующий фрагмент (MM), необязательно, где MM имеет равновесную константу диссоциации для связывания с AB больше, чем равновесная константа диссоциации AB для связывания с мишенью.
10. Выделенный полипептид по п.9, где MM представляет собой полипептид длиной не более 40 аминокислот.
11. Выделенный полипептид по п.9, где MM связан с CM таким образом, что выделенный полипептид в нерасщепленном состоянии имеет следующую структурную организацию от N-конца к C-концу: MM-CM-AB или AB-CM-MM.
12. Выделенный полипептид по п.11, где выделенный полипептид содержит связывающий пептид между MM и CM и/или где выделенный полипептид содержит связывающий пептид между CM и AB.
13. Выделенный полипептид по п.9, где выделенный полипептид содержит первый связывающий пептид (LP1) и второй связывающий пептид (LP2) и где выделенный полипептид в нерасщепленном состоянии имеет следующую структурную организацию от N-конца к C-концу: MM-LP1-CM-LP2-AB или AB-LP2-CM-LP1-MM, необязательно, где два связывающих пептида необязательно являются идентичными друг другу, необязательно, где каждый LP1 и LP2 представляет собой пептид длиной приблизительно от 1 до 20 аминокислот.
14. Выделенный полипептид по п.9, где аминокислотная последовательность MM отличается от аминокислотной последовательности мишени и является не более чем на 50% идентичной аминокислотной последовательности природного партнера по связыванию AB.
15. Выделенный полипептид по п.9, где MM не препятствует или не конкурирует с AB за связывание с мишенью в расщепленном состоянии.
| WO2009025846 A2, 26.02.2009 | |||
| WO2010081173 A2, 15.07.2010 | |||
| NANGIA-MAKKER P | |||
| et al | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| ZHAO T | |||
| et al | |||
| A novel strategy to tag matrix metalloproteinases-positive cells for in vivo imaging of invasive and | |||
Авторы
Даты
2020-02-26—Публикация
2014-09-25—Подача