Родственные заявки
Данная заявка испрашивает приоритет на основании даты подачи предварительной заявки США № 60/527886, озаглавленной "Ингибиторы рецепторов фактора роста эндотелия сосудов" и поданной 5 декабря 2003. Все доктрины вышеуказанной заявки включены в данное описание в качестве ссылки.
Предпосылки создания изобретения
Настоящее изобретение относится к новым полипептидам, связывающим рецепторы факторов роста эндотелия сосудов (VEGFR), а также к способам применения данных полипептидов для ингибирования биологических активностей, опосредованных факторами роста эндотелия сосудов (VEGF).
Ангиогенез представляет собой процесс формирования новых кровеносных сосудов из предсуществующих капилляров или пост-капиллярных венул; он является важной составной частью многих физиологических процессов, включающих в себя овуляцию, эмбриональное развитие, заживление раны и образование коллатеральных сосудов в миокарде. Ангиогенез также играет центральную роль в ряде патологических состояний, таких как опухолевые рост и метастазирование, диабетическая ретинопатия и дегенерация желтого пятна. Во многих случаях процесс начинается с активации существующих клеток эндотелия сосудов в ответ на ряд цитокинов и факторов роста. При раковом заболевании высвобождаемые опухолью цитокины или ангиогенные факторы стимулируют клетки эндотелия сосудов посредством взаимодействия с рецепторами клеточной поверхности. Активированные эндотелиальные клетки секретируют ферменты, которые разрушают базальную мембрану сосудов и создают возможность для инвазии эндотелиальных клеток в опухолевую ткань. Заняв определенное положение, эндотелиальные клетки дифференцируются с образованием новых ответвлений уже существующих сосудов. Новые кровеносные сосуды поставляют опухоли питательные вещества, обеспечивая дальнейший рост, и, кроме того, они определяют направление метастазирования.
В настоящее время идентифицировано большое количество ангиогенных факторов, в том числе особенно активный фактор VEGF. Изначально VEGF был выделен из кондиционированной среды звездчатых фолликулярных клеток и из ряда клеточных линий. Позже был идентифицирован ряд структурных гомологов и образующихся в результате альтернативного сплайсинга форм VEGF. Различные формы VEGF связываются как высокоаффинные лиганды с семейством рецепторов VEGF (VEGFR). VEGFR представляют собой тирозинкиназные рецепторы, многие из которых являются важными регуляторами ангиогенеза. Семейство VEGFR включает в себя 3 основных подтипа: VEGFR-1, VEGFR-2 (также известный как рецептор с инсерцией киназного домена, "KDR", встречающийся у людей) и VEGFR-3. Известно, что такие формы VEGF, как VEGF-A, VEGF-C и VEGF-D, связывают и активируют VEGFR-2.
VEGF, действуя через распознающие его рецепторы, в процессе ангиогенеза может функционировать как специфичный эндотелиальный митоген. Кроме того, существуют убедительные доказательства того, что при состояниях, характеризующихся аномальным ангиогенезом, таких как рак, существует повышающая регуляция VEGF и VEGFR. Поэтому внимание многих исследователей было сосредоточено на идентификации терапевтических средств, направленных на VEGF или VEGFR, или ингибирующих VEGF или VEGFR.
Существующие в настоящее время терапевтические средства, направленные на VEGF или VEGFR или ингибирующие VEGF или VEGFR, включают в себя антитела, пептиды и низкомолекулярные ингибиторы киназ. Из них наиболее часто используются антитела, распознающие и ингибирующие in vivo лиганды и клеточные рецепторы. Высокоспецифичные антитела используют для блокировки взаимодействия рецептора с лигандом и нейтрализации посредством этого биологической активности компонентов, а также для специфической доставки токсичных агентов к клеткам, экспрессирующим на поверхности узнаваемый рецептор. Хотя антитела и обладают высокой эффективностью, они представляют собой большие сложные молекулы, получение которых основано на экспрессии в рекомбинантных клетках млекопитающих. Антитела также вызывают ряд побочных эффектов, зачастую нежелательных, в том числе активацию путей комплемента и антитело-зависимую клеточную цитотоксичность. Следовательно, остается потребность в эффективных терапевтических средствах, которые могут специфично ингибировать пути VEGF/VEGFR и использоваться для лечения заболеваний, характеризующихся аномальным ангиогенезом, таких как рак.
Краткое описание изобретения
В частности, данное описание предлагает новые однодоменные полипептиды, которые связываются с рецепторами VEGFR-2, особенно с человеческим рецептором VEGFR-2 (также известным как KDR) и мышиным VEGFR-2 (также известным как Flk-1). Описанные в данном документе VEGFR-2-связывающие белки можно использовать, например, для детекции VEGFR-2 in vivo или in vitro. Кроме того, некоторые из описанных в данном документе VEGFR-2-связывающих белков можно использовать для лечения заболеваний, связанных с биологической активностью, опосредованной VEGFR-2. Например, KDR опосредует про-ангиогенные эффекты VEGF и, соответственно, некоторые KDR-связывающие белки данного описания можно использовать для ингибирования ангиогенеза у людей. Некоторые VEGFR-2-связывающие белки данного изобретения можно использовать для лечения таких заболеваний, как рак, воспалительные заболевания, аутоиммунные заболевания и ретинопатии. Многие нарушения, связанные с гиперпролиферацией клеток ткани, включают в себя ангиогенный компонент и, следовательно, полагают, что некоторые описанные в данном документе VEGFR-2-связывающие белки можно использовать для лечения таких нарушений.
Описанный в данном документе однодоменный полипептид, как правило, представляет собой полипептид, который связывается с мишенью, такой как VEGFR-2, где мишень-связывающую активность обеспечивает один структурный домен, в отличие, например, от антител и одноцепочечных антител, в которых проявление антиген-связывающей активности обусловлено наличием и вариабельного домена тяжелой цепи, и вариабельного домена легкой цепи. Данное описание также предлагает более крупные белки, которые могут содержать однодоменные полипептиды, связывающиеся с мишенью. Например, несколько однодоменных полипептидов могут быть соединены с образованием композитной молекулы с повышенной авидностью. Аналогично, однодоменный полипептид может быть соединен (например, с образованием гибридного белка) с любым числом других полипептидов. В некоторых аспектах однодоменный полипептид может содержать, по меньшей мере, от пяти до семи бета-цепей или бета-подобных цепей, распределенных, по меньшей мере, среди двух бета-слоев, как, например, в иммуноглобулиновых и иммуноглобулин-подобных доменах. Бета-подобная цепь представляет собой нить аминокислот, участвующих в стабилизации однодоменного полипептида, но не обязательно принимает конформацию бета-цепи. Чтобы определить, участвует ли бета-цепь в стабилизации белка, осуществляют делецию нити или изменяют последовательность нити и анализируют, изменилась ли стабильность белка. Стабильность можно определить, например, путем термической денатурации и ренатурации молекулы. Предпочтительно, однодоменный полипептид содержит не более двух бета-подобных цепей. Бета-подобная цепь обычно находится не в альфа-спиральной конформации, а в виде статистического клубка. В иммуноглобулиновом домене или иммуноглобулин-подобном домене бета-подобная цепь чаще всего находится в положении, которое обычно занимает основная часть N-концевой бета-цепи или основная часть C-концевой бета-цепи. Если аминокислотная нить находится в средней части белковой последовательности, она обычно образует бета-цепь, а если аминокислотная нить находится в положении, близком к N- или C-концу, ее конформация отличается от бета-цепи и в данном описании упоминается как бета-подобная цепь.
В некоторых воплощениях данное изобретение предлагает однодоменные полипептиды, которые связываются с VEGFR-2. Предпочтительно однодоменные полипептиды связываются с человеческим KDR, мышиным Flk-1 или и с тем, и с другим. Однодоменный полипептид может содержать приблизительно от 80 до 150 аминокислот, которые образуют структуру, включающую в себя: по меньшей мере, семь бета-цепей или бета-подобных цепей, распределенных между, по меньшей мере, двумя бета-слоями, и, по меньшей мере, один петлеобразный участок, соединяющий две бета-цепи или бета-подобные цепи, причем указанный петлеобразный участок участвует в связывании VEGFR-2. Другими словами, петлеобразный участок может соединять две бета-цепи, две бета-подобные цепи, или одну бета-цепь и одну бета-подобную цепь. Как правило, в связывании VEGFR-2 участвуют один или несколько петлеобразных участков, хотя один или несколько участков бета-цепи или бета-подобной цепи также могут участвовать в связывании VEGFR-2, особенно участков бета-цепи или бета-подобной цепи, расположенных вблизи петлеобразных участков. Однодоменный полипептид может содержать в качестве структурного элемента иммуноглобулиновый домен или иммуноглобулин-подобный домен. Однодоменный полипептид может связываться с любой частью VEGFR-2, хотя полипептиды, которые связываются с внеклеточным доменом VEGFR-2, являются предпочтительными. Связывание можно оценить с помощью равновесных констант (например, константы диссоциации, KD) и кинетических констант (например, константы скорости прямой реакции, kon, и константы скорости обратной реакции, koff). Как правило, выбирают такой однодоменный полипептид, который связывает VEGFR-2 с KD менее чем 10-6 M или менее чем 10-7 M, 5×10-8, 10-8 M или менее чем 10-9 M. Полипептиды, связывающие VEGFR-2, могут конкурировать за связывание с одним, двумя или более членами семейства VEGF, особенно с VEGF-A, VEGF-C и VEGF-D, и могут ингибировать одно или несколько VEGFR-2-опосредованных биологических событий, таких как пролиферация эндотелиальных клеток, пермеабилизация кровеносных сосудов и повышение подвижности эндотелиальных клеток. Полипептиды, связывающие VEGFR-2, можно использовать для терапевтических целей, а также для других целей, включающих в себя детекцию или связывание VEGFR-2. Как правило, полипептиды, предназначенные для терапевтического применения, имеют KD менее 5×10-8 M, менее 10-8 M или менее 10-9 M, хотя могут быть приемлемыми более высокие значения KD, если koff является достаточно низкой, а kon является достаточно высокой. В некоторых воплощениях однодоменный полипептид, который связывается с VEGFR-2, содержит VEGFR-2-связывающую консенсусную последовательность, выбранную из группы, состоящей из: SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3 и SEQ ID NO:4. Предпочтительно, такая последовательность расположена в петле, особенно в петле FG.
В некоторых воплощениях однодоменный полипептид содержит иммуноглобулиновый (Ig) вариабельный домен. Вариабельный домен Ig может быть выбран, например, из группы, состоящей из: человеческого домена VL, человеческого домена VH и верблюжьего домена VHH. В связывании VEGFR-2 может участвовать одна, две, три или более петель вариабельного домена Ig, как правило, в связывании VEGFR-2 участвует любая из петель, известных как CDR1, CDR2 или CDR3.
В некоторых воплощениях однодоменный полипептид содержит иммуноглобулин-подобный домен. В связывании VEGFR-2 могут участвовать одна, две, три или более петли иммуноглобулин-подобного домена. Предпочтительным иммуноглобулин-подобным доменом является домен фибронектина типа III (Fn3). Такой домен может содержать в направлении от N-конца к C-концу бета-цепь или бета-подобную цепь A; петлю AB; бета-цепь B; петлю, BC; бета-цепь C; петлю CD; бета-цепь D; петлю DE; бета-цепь F; петлю FG и бета-цепь или бета-подобную цепь G. Пример структурной организации приведен на фиг.22. В связывании VEGFR-2 необязательно может участвовать любая из петель или все петли AB, BC, CD, DE, EF и FG, хотя предпочтительными петлями являются BC, DE и FG. Предпочтительным доменом Fn3 является домен Fn3 из человеческого фибронектина, особенно 10ый домен Fn3 фибронектина, обозначаемый 10Fn3. Следует отметить, что ни один из VEGFR-2-связывающих полипептидов, раскрытых в данном описании, не имеет аминокислотной последовательности, идентичной нативному 10Fn3; данная последовательность была модифицирована с получением VEGFR-2-связывающих белков, тем не менее белки, обладающие основными структурными признаками 10Fn3, в особенности те из них, которые сохраняют распознаваемую гомологию последовательности по сравнению с нативным 10Fn3, тоже называют "полипептиды 10Fn3". Данная система присвоения терминов согласуется с терминологией, используемой для обозначения антител, где, например, домен VL рекомбинантного антитела, полученный против конкретного белка-мишени, может не быть идентичным какому-либо природному домену VL, однако данный белок распознается как белок VL. Полипептид 10Fn3 может быть идентичен человеческому домену 10Fn3 с последовательностью SEQ ID NO:5, по меньшей мере, на 60%, 65%, 70%, 75%, 80%, 85% или 90%. Наибольшая вариабельность преимущественно наблюдается в одной или нескольких петлях. Каждая из бета- или бета-подобных цепей полипептида 10Fn3 может по существу состоять из аминокислотной последовательности, по меньшей мере, на 80%, 85%, 90%, 95% или 100% идентичной последовательности бета- или бета-подобной цепи SEQ ID NO: 5, при условии, что такие вариации не нарушают стабильность полипептида в физиологических условиях. Каждая из петель AB, CD и EF полипептида 10Fn3 может по существу состоять из аминокислотной последовательности, по меньшей мере, на 80%, 85%, 90%, 95% или 100% идентичной последовательности соответствующей петли из SEQ ID NO: 5. Во многих случаях любая из петель BC, DE и FG или все петли BC, DE и FG обладают низкой степенью консервативности по сравнению с SEQ ID NO: 5. Например, все петли BC, DE и FG могут быть менее чем на 20%, 10% или 0% идентичны соответствующим петлям из SEQ ID NO: 5.
В некоторых воплощениях данное изобретение предлагает отличный от антитела полипептид, содержащий домен, имеющий иммуноглобулин-подобную складку, которая связывается с VEGFR-2. Отличный от антитела полипептид может иметь молекулярную массу менее 20 кДа или менее 15 кДа, и, как правило, его получают (например, путем изменения аминокислотной последовательности) из базового белка или "каркаса", например из каркаса Fn3. Отличный от антитела полипептид может связывать VEGFR-2 с KD менее 10-6 M или менее 10-7 M, менее 5×10-8 M, менее 10-8 M или менее 10-9 M. Неизмененный базовый белок либо не способен в значительной степени связывать VEGFR-2, либо связывает его с KD более 10-6 M. Отличный от антитела полипептид может ингибировать сигнальный путь VEGF, особенно, если отличный от антитела полипептид имеет KD менее 5×10-8 M, менее 10-8 M или менее 10-9 M, хотя и более высокие значения KD могут быть приемлемыми, если koff является достаточно низким (например, менее 5×10-4 с-1). Иммуноглобулин-подобная складка может представлять собой полипептид 10Fn3.
В некоторых воплощениях описание предлагает полипептид, состоящий из одного домена, содержащего иммуноглобулиновую складку, которая связывается с VEGFR-2. Полипептид может иметь молекулярную массу менее 20 кДа или менее 15 кДа и, как правило, его получают (например, путем изменения аминокислотной последовательности) из вариабельного домена иммуноглобулина. Данный полипептид может связывать VEGFR-2 с KD менее 10-6 M или менее 10-7 M, менее 5×10-8 M, менее 10-8 M или менее 10-9 M. Полипептид может ингибировать сигнальный путь VEGF, особенно, если он имеет KD менее 5×10-8 M, менее 10-8 M или менее 10-9 M, хотя и более высокие значения KD могут быть приемлемыми, если koff является достаточно низким или если kon является достаточно высоким. В некоторых предпочтительных воплощениях однодоменный полипептид, содержащий иммуноглобулиновую складку, полученную из вариабельного домена легкой цепи иммуноглобулина, и способный связывать VEGFR-2, может содержать аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 241-310.
В некоторых предпочтительных воплощениях описание предлагает VEGFR-2-связывающие полипептиды, содержащие любую из аминокислотных последовательностей SEQ ID NO: 192-194. В случае полипептида, содержащего аминокислотную последовательность SEQ ID NO: 194, фрагмент PEG или другой представляющий интерес фрагмент может быть ковалентно связан с цистеином в положении 93. Фрагмент PEG также может быть ковалентно связан с аминовым фрагментом полипептида. Аминовый фрагмент может представлять собой, например, первичный амин, расположенный на N-конце полипептида, или аминогруппу, присутствующую в аминокислоте, такой как лизин или аргинин. В некоторых воплощениях фрагмент PEG присоединен в положении полипептида, выбранном из группы, состоящей из: a) N-конца; b) положения между N-концом и основной частью N-концевой бета-цепи или бета-подобной цепи; c) петли, расположенной на стороне полипептида, противоположной мишень-связывающему сайту; d) положения между C-концом и основной частью С-концевой бета-цепи или бета-подобной цепи и e) C-конца.
В некоторых аспектах данное изобретение предлагает короткие пептидные последовательности, которые опосредуют связывание VEGFR-2. Такие последовательности могут опосредовать связывание VEGFR-2 в выделенном виде, или в составе конкретной белковой структуры, такой как иммуноглобулиновый или иммуноглобулин-подобный домен. Примеры таких последовательностей включают в себя последовательности, раскрытые как SEQ ID NO: 1-4, а также другие последовательности, которые, по меньшей мере, на 85%, 90% или 95% идентичны последовательностям SEQ ID NO: 1-4 и сохраняют VEGFR-2-связывающую активность. Соответственно, данное изобретение предлагает по существу чистые полипептиды, содержащие аминокислотную последовательность, по меньшей мере, на 85% идентичную любой из последовательностей SEQ ID NO: 1-4, где указанные полипептиды связывают VEGFR-2 и конкурируют с разновидностями VEGF за связывание с VEGFR-2. Примеры таких полипептидов включают в себя полипептид, содержащий аминокислотную последовательность, по меньшей мере, на 80%, 85%, 90%, 95% или 100% идентичную аминокислотной последовательности, по меньшей мере, на 85% идентичной любой из последовательностей SEQ ID NO: 6-183, 186-197 и 199. Предпочтительно, такой полипептид ингибирует биологическую активность VEGF и может связываться с VEGFR-2 с KD менее 10-6 M или менее 10-7 M, менее 5×10-8 M, менее 10-8 M или менее 10-9 M.
В некоторых воплощениях любой из VEGFR-2-связывающих полипептидов, описанных в данном документе, может быть связан с одним или несколькими дополнительными фрагментами, в том числе, например, с фрагментом, который также связывается с VEGFR-2 (например, со вторым VEGFR-2-связывающим полипептидом, идентичным первому или отличающимся от него), с фрагментом, который связывается с другой мишенью (например, с получением агента, обладающего двойной специфичностью связывания), маркирующим фрагментом, с фрагментом, который облегчает очистку, или с фрагментом, который улучшает фармакокинетику. Улучшенную фармакокинетику можно оценить в соответствии с осознаваемой терапевтической потребностью. Зачастую желательно увеличить биодоступность и/или увеличить время между приемами доз, возможно, путем увеличения времени, в течение которого белок остается доступным в сыворотке после введения дозы. В некоторых случаях желательно повысить постоянство концентрации белка в сыворотке с течением времени (например, уменьшить разницу в сывороточной концентрации белка сразу после введения и сразу перед следующим введением). Фрагменты, которые способны замедлять выведение белка из крови, включают в себя полиэтиленгликоль, сахара (например, сиаловые кислоты) и хорошо переносимые белковые фрагменты (например, фрагмент Fc или сывороточный альбумин). Однодоменный полипептид может быть присоединен к фрагменту, который уменьшает скорость выведения полипептида у млекопитающего (например, мыши, крысы или человека) более чем в три раза по сравнению с немодифицированным полипептидом. Другие показатели улучшения фармакокинетики могут включать в себя период полужизни в сыворотке, который часто подразделяют на альфа-фазу и бета-фазу. Одну или обе фазы можно существенно улучшить путем добавления подходящего фрагмента. Если используют полиэтиленгликоль, одна или несколько молекул PEG могут быть присоединены к белку в разных положениях путем взаимодействия с аминогруппами, тиольными группами или другими подходящими реакционноспособными группами. Пэгилирование можно проводить сайт-направленным способом, при котором в белок вводят реакционноспособную группу, чтобы создать участок, по которому будет предпочтительно проходить пэгилирование. В предпочтительном воплощении белок модифицируют путем введения в желательное положение цистеинового остатка, чтобы обеспечить направленное пэгилирование по цистеину. PEG может иметь разную молекулярную массу и может быть разветвленным или линейным. Следует отметить, что в настоящем изобретении показано, что пэгилирование совместимо с мишень-связывающей активностью полипептидов 10Fn3 и что пэгилирование не улучшает фармакокинетику таких полипептидов. Соответственно, в одном воплощении данное изобретение предлагает пэгилированные формы полипептидов 10Fn3 независимо от мишени, которую могут связывать такие полипептиды.
В некоторых воплощениях данное изобретение предлагает композицию, содержащую любой из описанных VEGFR-2-связывающих полипептидов. Композиция может представлять собой терапевтическую композицию, содержащую VEGFR-2-связывающий полипептид и фармацевтически приемлемый носитель. Композиция также может представлять собой сочетанную композицию, содержащую дополнительное активное средство, такое как противораковое или противоангиогенное средство.
В некоторых аспектах изобретение предлагает способы применения VEGFR-2-связывающего белка, связанные с ингибированием биологической активности VEGF в клетке или с ингибированием биологической активности, опосредованной VEGFR-2. Клетка может находиться in vivo или ex vivo и может представлять собой, например, клетку живого организма, культивируемую клетку или клетку образца ткани.
Данный способ может предусматривать контактирование указанной клетки с любым из VEGFR-2-ингибирующих полипептидов, раскрытых в данном описании, в количестве и в течение времени, достаточных для ингибирования такой биологической активности.
В некоторых аспектах изобретение предлагает способы лечения субъекта, страдающего от состояния, реагирующего на ингибирование VEGF или VEGFR-2. Такой способ может предусматривать введение указанному субъекту эффективного количества любого из описанных в данном документе VEGFR-2-ингибирующих полипептидов. Состояние может сопровождаться аномальным ангиогенезом. Состояние может представлять собой гиперпролиферативное состояние. Примеры подходящих для лечения состояний (или нарушений) включают в себя аутоиммунные нарушения, воспалительные нарушения, ретинопатии (особенно, пролиферативные ретинопатии) и раковые заболевания. Любой из описанных в данном документе VEGFR-2-ингибирующих полипептидов можно использовать для получения лекарственного средства для лечения нарушения, особенно нарушения, выбранного из группы, состоящей из аутоиммунного нарушения, воспалительного нарушения, ретинопатии и ракового заболевания.
В некоторых аспектах изобретение предлагает способы детекции VEGFR-2 в образце. Способ может предусматривать контактирование образца с описанным в данном документе VEGFR-2-связывающим полипептидом, где указанное контактирование осуществляют в условиях, обеспечивающих образование комплекса полипептид-VEGFR-2, с последующей детекцией указанного комплекса, а следовательно, и детекцией указанного VEGFR-2 в указанном образце. Детекцию можно проводить с использованием любого известного в данной области метода, такого как, например, радиография, иммунологический анализ, флуоресцентная детекция, масс-спектроскопия или метод поверхностного плазмонного резонанса. Образец зачастую представляет собой биологический образец, такой как биопсийный материал, особенно биопсийный материал опухоли и предполагаемой опухоли, или ткань, которая предположительно подвержена нежелательному ангиогенезу.
Образец может быть взят от человека или от другого млекопитающего. VEGFR-2-связывающий полипептид можно метить маркирующим фрагментом, таким как радиоактивный фрагмент, флуоресцентный фрагмент, хромогенный фрагмент, хемилюминесцентный фрагмент или гаптеновый фрагмент. VEGFR-2-связывающий полипептид можно иммобилизовать на твердом носителе.
Другой аспект описания относится к нуклеиновой кислоте, содержащей нуклеотидную последовательность, кодирующую раскрытый в данном описании полипептид. В некоторых воплощениях нуклеиновая кислота может содержать нуклеотидную последовательность, кодирующую полипептид, выбранный из группы, состоящей из SEQ ID No. 6-183, 186-197, 199 и 241-528. В некоторых воплощениях нуклеиновая кислота содержит нуклеиновую кислоту, которая гибридизуется в жестких условиях с нуклеотидной последовательностью SEQ ID NO: 184 и кодирует полипептид, который связывается с человеческим KDR с KD менее 1×10-6 M. В конкретных воплощениях нуклеиновая кислота может содержать нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 184 и SEQ ID NO: 185.
В другом аспекте данное изобретение относится к вектору экспрессии, содержащему нуклеиновую кислоту, функционально связанную с промотором, где нуклеиновая кислота кодирует раскрытый в данном описании полипептид. Другой аспект данного описания относится к клетке, содержащей раскрытую в данном описании нуклеиновую кислоту. Также предлагается способ получения полипептида, связывающегося с VEGFR-2, например KDR, предусматривающий экспрессию нуклеиновой кислоты, кодирующей полипептид данного изобретения. В некоторых воплощениях нуклеиновая кислота может содержать последовательность, кодирующую полипептид, выбранный из группы, состоящей из любой из последовательностей SEQ ID NO: 6-183, 186-197, 199 и 241-528. В некоторых воплощениях нуклеиновая кислота содержит последовательность, которая гибридизуется в жестких условиях с нуклеотидной последовательностью SEQ ID NO: 184. В некоторых воплощениях нуклеиновая кислота содержит нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 184 и SEQ ID NO: 185. В некоторых воплощениях нуклеиновая кислота экспрессируется в клетке. Альтернативно нуклеиновая кислота экспрессируется в бесклеточной системе.
В некоторых аспектах изобретение предлагает открытия, применимые к любому полипептиду 10Fn3 независимо от того, с какой мишенью связывается полипептид, полученный методом генной инженерии. Как указано выше, изобретение демонстрирует, что PEG можно успешно использовать для улучшения фармакокинетики полипептида 10Fn3 и что он по существу не препятствует связыванию мишени. Соответственно, изобретение предлагает пэгилированные полипептиды 10Fn3, которые связываются с мишенью и обладают улучшенной фармакокинетикой по сравнению с непэгилированным полипептидом. В следующем воплощении изобретение демонстрирует, что делеция первых восьми аминокислот полипептида 10Fn3 может увеличить сродство связывания с мишенью. Соответственно, данное изобретение предлагает полипептиды 10Fn3, утратившие восемь исходных аминокислот (аминокислоты пронумерованы в соответствии с последовательностью SEQ ID No: 5). Понятно, что к делетированной форме пептида снова можно добавить одну или две аминокислоты, чтобы обеспечить трансляцию и соответствующий процессинг. Изобретение демонстрирует, что подкожное введение полипептида 10Fn3 приводит к замедленному высвобождению полипептида в кровоток и к уменьшению максимальной сывороточной концентрации полипептида 10Fn3. Соответственно, данное изобретение предлагает способы введения полипептида 10Fn3 пациенту путем подкожного введения. Данный способ введения позволяет достичь замедленного высвобождения по сравнению с внутривенным введением и/или уменьшения максимального сывороточного уровня полипептида 10Fn3, по меньшей мере, на 25% или, по меньшей мере, на 50% по сравнению с максимальным сывороточным уровнем, достигаемым при внутривенном введении равной дозы. Вводимый полипептид 10Fn3 может быть присоединен к фрагменту, который увеличивает период полужизни в сыворотке (или уменьшает скорость выведения, или подобным образом влияет на другой фармакокинетический параметр) полипептида 10Fn3, такому как фрагмент полиэтиленгликоля. Предпочтительно, вводимый полипептид 10Fn3 содержит аминокислотную последовательность, которая, по меньшей мере, на 60%, 65%, 70%, 75%, 80%, 85%, 90% идентична SEQ ID NO: 5.
В некоторых аспектах изобретение предлагает однодоменные полипептиды, которые связываются с предварительно выбранным белком-мишенью из первого млекопитающего и с его гомологом из второго млекопитающего. Такие однодоменные полипептиды являются особенно полезными, если первое млекопитающее представляет собой человека, а второе млекопитающее представляет собой животное, подходящее для проведения предклинических испытаний, такое как мышь, крыса, морская свинка, собака или отличный от человека примат. Данное изобретение демонстрирует, что с помощью методов генной инженерии можно получить однодоменные полипептиды, обладающие такой двойной специфичностью, что двойная специфичность упрощает разработку лекарственного препарата, поскольку она позволяет проводить испытания одного и того же полипептида на клетках человека, на людях и на животных моделях. Предпочтительно, предварительно выбранный белок-мишень из первого млекопитающего и его гомолог из второго млекопитающего имеют достаточно похожие аминокислотные последовательности, чтобы обеспечить получение полипептидов с двойной специфичностью. Например, предварительно выбранный белок-мишень из первого млекопитающего и его гомолог из второго млекопитающего могут обладать, по меньшей мере, 80%, 90% или 95% идентичностью на участке, состоящем, по меньшей мере, из 50 аминокислот, и необязательно могут обладать, по меньшей мере, 80%, 90% или 95% идентичностью на протяжении всей последовательности белка или на протяжении последовательности внеклеточного домена в случае мембранного белка. Однодоменный полипептид, характеризующийся двойной специфичностью связывания данного типа, может содержать иммуноглобулиновый или иммуноглобулин-подобный домен и предпочтительно связывается как с предварительно выбранным человеческим белком-мишенью, так и с его гомологом - с константой диссоциации менее 1×10-6 M, 1×10-7 M, 5×10-8 M, 1×10-8 M или 1×10-9 M.
Краткое описание чертежей
На фиг.1A-1D приведены графики и фотографии, характеризующие KDR-связывающие отдельные клоны из 6 цикла KDR-селекции. На фиг.1A приведен график, демонстрирующий специфическое связывание связывающих белков на основе фибронектина с 25 нМ KDR-Fc, полученный с помощью радиоактивного равновесного анализа связывания. На фиг.1B приведен график, демонстрирующий ингибирование специфического связывания KDR-Fc с выбранными связывающими белками на основе фибронектина в присутствии 100-кратного избытка VEGF165. Как показано на данной фигуре, некоторые связывающие белки конкурируют с VEGF165 за связывание с KDR-Fc, тогда как другие, например, относящиеся к клону 8, не конкурируют с VEGF165. На фиг.1C приведен график, демонстрирующий ингибирование взаимодействия KDR-Fc с иммобилизованным VEGF165 в присутствии выбранных связывающих белков на основе фибронектина, полученный с помощью анализа BIAcore. На фиг.1D приведена фотография, демонстрирующая связывание VR28 с KDR-экспрессирующими и контрольными клетками, обнаруженное с помощью иммунофлюоресцентного анализа.
На фиг.2 приведен график, демонстрирующий профиль селекции для созревания аффинности VR28, связывающего KDR. Слева показано связывание клона VR28 с KDR-Fc и Flk1-Fc (очень низкий, непомеченный столбик). В центре показано связывание KDR-Fc с мутировавшим пулом до селекции и после обогащающих циклов селекции. Справа показано связывание Flk-1-Fc с клонами, полученными в результате последующих обогащающих циклов. Связывание оценивают с помощью радиоактивного равновесного анализа связывания как процент от исходного, используя 1 нМ KDR-Fc или Flk1-Fc.
На фиг.3A и 3B приведены графики, характеризующие KDR-связывающие отдельные клоны из 4 цикла аффинного созревания VR28, связывающегося с KDR. На фиг.3A показано насыщающее связывание VR28 (-■-) и аффинно зрелых K1 (-▲-), K6 (-▼-), K9 (-♦-), K10 (-•-), K12 (-□-), K13(-∆-), K14 (-∇-), K15 (-◇-) c KDR-Fc, определенное с помощью радиоактивного равновесного анализа связывания. На фигуре 3B показано связывание клонов, содержащих или не содержащих N-концевую делецию, с KDR-Fc. Делеция ∆1-8 в N-конце связывающих белков на основе фибронектина улучшает связывание с KDR-Fc. Данные представляют среднее связывание с KDR-Fc 23 независимых клонов, содержащих или не содержащих N-концевую делецию.
На фиг.4 приведен график, демонстрирующий связывание выбранных клонов с KDR и Flk-1. Специфическое связывание VR28 с выбранными клонами после четырех циклов аффинного созревания к человеческому KDR (клоны K) и семи циклов аффинного созревания к человеческому (KDR) и мышиному (flk-1) (клоны E). Химерные белки VEGFR-2-Fc сравнивают с помощью радиоактивного равновесного анализа связывания. Данные представляют среднее значение по 3 независимым экспериментам. Как показано в данном описании, после созревания против мышиных и человеческих белков VEGFR-2 получают связывающие средства, которые связываются с обоими белками.
На фиг.5A и 5B приведены графики, характеризующие VEGFR-2-связывающие отдельные клоны из 7 цикла аффинного созревания связывающего белка VR28. Насыщающее связывание VR28 (-■-) и клонов со зрелой специфичностью Е3 (-▲-), Е5 (-▼-), Е6 (-♦-), Е9 (-•-), Е18 (-□-), Е19 (-∆-), Е25 (-∇-), Е26 (-◇-), Е28 (-○-), Е29 (-×-) c KDR (фиг.5A) и химерными белками Flk1 (фигура 5B)-Fc анализируют с помощью радиоактивного равновесного анализа связывания.
На фиг.6A и 6B приведены графики, характеризующие связывание VEGFR-2 отдельными клонами из 7 цикла аффинного созревания связывающего белка VR28. Фиг.6A демонстрирует значение аргинина в положениях 79 и 82 в связывающих балках с двойной специфичностью к человеческому и мышиному VEGFR-2 для связывания с мышиным VEGFR-2 (Flkl). Если аминокислоту в любом из данных положений заменить на аминокислоту, отличную от R (X79=E, Q, W, P; X82=L, K), связывание с Flk1, но не с KDR, значительно уменьшается. Фиг.6B демонстрирует значение всех трех вариабельных петель (BC, DE и FG) KDR-связывающих белков на основе фибронектина для связывания данных белков с мишенью. Замена любой петли за один прием последовательностью NNS влияет на связывание с KDR и Flk1. Результаты связывания представлены в виде среднего от клонов E6 и E26.
На фиг.7A и 7B приведены графики, демонстрирующие связывание выбранных связывающих белков на основе фибронектина с клетками CHO, экспрессирующими человеческий рецептор KDR (фиг.7A) и химерным белком EpoR-Flk1 (фиг.7B). Анализируют каркасные белки на основе фибронектина E18 (-■-), E19 (-▲-), E26 (-▼-), E29 (-♦-) и WT (-□-). Связывание с контрольными клетками CHO не наблюдается (данные не показаны).
На фиг.8A и 8B приведены графики, демонстрирующие ингибирование VEGF-индуцированной пролиферации клеток Ba/F3-KDR (фиг.8A) и Ba/F3-Flk1 (фиг.8B), экспрессирующих KDR и Flk1 в присутствии разных количеств связывающих белков на основе фибронектина: E18 (-■-), E19 (-▲-), E26 (-▼-), E29 (-♦-), WT (-□-) и Ab(-∆-) против KDR или против flk-1. Данные представлены в виде среднего значения по 2 независимым экспериментам.
На фиг.9 приведен график, демонстрирующий результаты пролиферации HUVEC в присутствии разных количеств каркасных белков на основе фибронектина: E18 (-■-), E19 (-▲-), E26 (-▼-), E29 (-♦-), M5 (-○-), WT (-□-). Данные представлены в виде среднего значения по 2 независимым экспериментам. Показано, что белки, связывающие KDR, уменьшают пролиферацию приблизительно на 40%.
На фиг.10 приведен ряд графиков, демонстрирующих обратимое повторное свертывание M5FL в оптимизированном буфере.
На фиг.11 приведена фотография с результатами анализа SDS-PAGE пэгилированных форм M5FL. M, маркеры молекулярной массы [Sea Blue Plus, Invitrogen]; -, M5FL; 20, M5FL, содержащий PEG массой 20 кДа; 40, M5FL, содержащий PEG массой 40 кДа.
На фиг.12 приведен график, демонстрирующий ингибирование VEGF-индуцированной пролиферации клеток Ba/F3-KDR с разными количествами M5FL (-♦-), M5FL PEG20 (-■-) и M5FL PEG40 (-▲-) соответственно. В данном анализе пэгилирование оказывает небольшое влияние или совсем не оказывает влияния на активность M5FL.
На фиг.13 приведены результаты вестерн-анализа сигнального пути VEGFR-2 в эндотелиальных клетках. Фосфо-VEGFR-2 - визуализация фосфорилированного VEGFR-2. Контроль загрузки образца - VEGFR-2. Фосфо-ERK1/2 - визуализация фосфорилированного ERK1/2 (MAPK). Контроль загрузки образца - ERK1. Результаты демонстрируют, что 130 пМ CT-01 блокируют активацию VEGFR-2 и сигнальный путь, опосредованный VEGF-A.
На фиг.14 показано, что разные молекулы, производные 10Fn3 (например, M5FL, F10, CT-01) могут блокировать VEGF-A и сигнальный путь VEGF-D.
На фиг.15 показано сравнение 125I-нативного и пэгилированного CT-01, вводимых внутривенно и внутрибрюшинно. CT-01 представляет собой белок с массой 12 кДа. Он быстро выводится из крови. Добавление PEG с массой 40 кДа уменьшает скорость выведения и увеличивает AUC в 10 раз. Период полужизни 16 ч у крыс эквивалентен введению 2 доз в неделю у людей. Способ введения: при внутрибрюшинном введении CT-01-PEG40 имеет AUC, который составляет только 50% от AUC, полученном при внутривенном введении.
На фиг.16 показано распределение 125I-CT01PEG40 в тканях нормальных крыс. Распределение 125I-CT01PEG40 в тканях показывает, что секреция в первую очередь происходит в печени и во вторую очередь в почках. Предположительно, это относится к высокомолекулярной форме PEG. Длительная аккумуляция CT-01PEG40 не детектируется.
На фиг.17 приведено схематическое изображение анализа Майлса, используемого для измерения проницаемости сосудов.
На фиг.18 приведены результаты анализа Майлса, демонстрирующие, что CT-01 блокирует VEGF in vivo. Полученные данные показывают, что CT01-PEG40 в количестве 5 мг/кг блокирует эффект от введения VEGF.
На фиг.19 приведены результаты анализа мышиной меланомы B16-F10, демонстрирующие, что CT-01 ингибирует рост опухоли.
На фиг.20 показано с использованием человеческой глиобластомы U87, что CT-01 ингибирует рост опухоли.
На фиг.21A и 21B приведены последовательности VEGFR-связывающих полипептидов, полученных на основе остовного/каркасного участка легкой цепи антитела (SEQ ID NO: 241-310).
На фиг.22 показана структурная организация однодоменного полипептида, имеющего иммуноглобулиновую складку (домен VH иммуноглобулина, с левой стороны), и однодоменного полипептида, имеющего иммуноглобулин-подобную складку (домен 10Fn3, с правой стороны).
Подробное описание изобретения
1. Обзор
В данном описании в числе прочего описывается идентификация и получение новых однодоменных полипептидов, которые связываются с рецепторами VEGFR-2. VEGFR-2, также называемый KDR у людей и Flk-1 у мышей, является первичным медиатором про-ангиогенных эффектов сигнального пути VEGF. VEGF-A, VEGF-C и VEGF-D связывают и активируют VEGFR-2. В эндотелиальных клетках активация VEGFR-2 стимулирует пролиферацию и миграцию клеток, а in vivo активация VEGFR-2 запускает ангиогенез и увеличивает проницаемость сосудов. Точно установлено, что повышенный ангиогенез является важным признаком опухолевого роста и различных ретинопатий, а увеличение проницаемости сосудов является важным событием для многих воспалительных процессов.
Настоящее изобретение предлагает сотни однодоменных полипептидов, связывающихся с VEGFR-2, многие из которых in vitro и/или in vivo обладают антагонистической активностью по отношению к VEGF. Однодоменные полипептиды, обладающие антагонистической активностью по отношению к VEGF, можно использовать для разных терапевтических целей. Установлено, что антитела против KDR можно использовать in vivo против заболеваний и состояний, варьирующих от раковых заболеваний и осложнений, вызванных раковыми заболеваниями, до пролиферативных ретинопатий, воспалительных нарушений и фиброзов. Представленные в данном описании результаты in vivo и in vitro экспериментов позволяют предположить, что однодоменные полипептиды можно использовать для лечения указанного спектра заболеваний.
Помимо терапевтических применений, однодоменные полипептиды, связывающие VEGFR-2, можно использовать во всех случаях, в которых желательно провести детекцию VEGFR-2. Например, многие стволовые клетки экспрессируют VEGFR-2, в том числе особенно полезные клетки гематопоэтических линий. KDR-связывающие полипептиды можно использовать, в частности, в меченном виде для детекции стволовых клеток и облегчения сортировки клеток. In vivo меченные VEGFR-2-связывающие полипептиды можно использовать для визуализации тканей, в которых экспрессируется VEGFR-2. Повышенная экспрессия VEGFR-2 может быть характерна для тканей с особенно высоким уровнем ангиогенной и воспалительной активности. Детекцию VEGFR-2 также можно использовать для гистологических анализов образцов тканей. Например, иногда желательно детектировать экспрессию VEGFR-2 в образце для опухолевой биопсии, чтобы оценить вероятную эффективность анти-VEGFR-2- или анти-VEGF-терапии. Интересно, что многие раскрытые в данном описании VEGFR-2-связывающие белки связывают VEGFR-2 с наномолярными константами диссоциации и не оказывают существенного влияния на VEGFR-2-опосредованные биологические события. Соответственно, такие связывающие белки можно использовать для методов визуализации in vivo или для методов мечения клеток, где зачастую желательно селективно пометить клетки, экспрессирующие VEGFR-2, не вызывая значительных изменений в VEGFR-2-опосредованных событиях.
Данное изобретение описывает применение технологии отображения in vitro, называемой PROfusionTM, в которой для идентификации новых однодоменных полипептидов и аминокислотных мотивов, имеющих значение для связывания с VEGFR-2, используются гибриды нуклеиновая кислота-белок (гибриды РНК- и ДНК-белок). Способ с использованием гибридов нуклеиновая кислота-белок представляет собой технологию отображения, в которой белок ковалентно связывается с кодирующим его генетическим материалом. Технологию PROfusionTM используют для скрининга коллекций нуклеиновых кислот, кодирующих однодоменные полипептиды, сконструированные с использованием каркаса на основе трех доменов, относящихся к типу доменов человеческого фибронектина (10Fn3), или сконструированные из вариабельных доменов легких цепей антител. Экспрессированные полипептиды, называемые "библиотекой" каркасных белков, подвергают скринингу для выявления полипептидов, способных связывать VEGFR-2 с высоким сродством. Авторы данного изобретения выделили из указанной библиотеки каркасных белков новые однодоменные полипептиды, которые связываются с VEGFR-2 и в некоторых случаях ингибируют биологическую активность VEGF. Кроме того, было обнаружено, что многие независимо рандомизированные петли, расположенные в иммуноглобулиновых или иммуноглобулин-подобных каркасных белках, имеют тенденцию к конвергенции с образованием родственного набора консенсусных последовательностей, участвующих в связывании VEGFR-2. Следовательно, ожидается, что полипептиды, содержащие указанные консенсусные последовательности, можно использовать в качестве агентов, связывающих VEGFR-2, даже если они отделены от белкового окружения, в котором их идентифицировали. См., например, SEQ ID No: 1-4. Такие полипептиды можно использовать в качестве VEGFR-2-связывающих агентов в виде отдельных небольших пептидов или в составе других белков, в частности белков, имеющих иммуноглобулиновую или иммуноглобулин-подобную складку.
Как указано выше, настоящее описание демонстрирует, что однодоменные полипептиды, имеющие определенные желательные свойства, такие как высокое сродство связывания с VEGFR-2, антагонистическое действие по отношению к одному или нескольким из VEGF-A, -C или -D и улучшенная фармакокинетика, можно использовать в качестве эффективных противораковых средств. Предположительно эффективность таких полипептидов, как противораковые средства, связана с их участием в раковом ангиогенезе, однако авторы данного изобретения предпочитают не ограничиваться каким-либо конкретным механизмом. Формально противораковое действие однодоменных полипептидов настоящего изобретения может быть обусловлено причинами, не связанными с ангиогенными процессами.
Насколько известно авторам, настоящее изобретение является первой успешной работой, связанной с использованием полипептида на основе Fn3 для достижения терапевтического эффекта in vivo. Многие достижения и открытия в области эффективности in vivo можно широко применять к другим полипептидам на основе Fn3. Другими словами, хотя лиганд-связывающие свойства полипептидов на основе Fn3, как правило, определяются относительно небольшим количеством аминокислот, расположенных в доступных для растворителя петлеобразных участках, другие свойства полипептидов на основе Fn3, такие как фармакокинетические характеристики, преимущественно определяются основной частью белка, которая не принимает непосредственного участия в связывании лиганда и которая является консервативной для разных белков независимо от вида белка-мишени. Данное утверждение справедливо для антител, в которых несколько петель, называемых областями CDR, опосредуют связывание антигена, в то время как другие особенности поведения антител in vivo в основном определяются консервативными каркасными участками и константными доменами.
Под "ингибированием" подразумевается поддающееся измерению уменьшение активности, в данном описании зачастую относимой к одному из следующих процессов: взаимодействие VEGF с VEGFR, VEGF- или VEGFR-опосредованный ангиогенез, ангиогенез, симптомы ангиогенеза, жизнеспособность VEGFR-содержащих клеток, жизнеспособность VEGF-зависимых клеток Ba/F3 или VEGF- или VEGFR-опосредованная пролиферация клеток по сравнению с контрольным образцом, не обработанным полипептидом. Полипептид ингибирует VEGF- или VEGFR-2-опосредованную активность, если активность или взаимодействие снижается, по меньшей мере, на 10%, предпочтительно, на 20%, 30%, 40% или 50% и, более предпочтительно, на 60%, 70%, 80%, 90% или более.
Под "биологической активностью VEGF" подразумевается любая функция любого члена семейства VEGF, действующего через рецептор VEGF, в особенности сигнальный путь, опосредованный рецептором VEGFR-2. Семейство VEGF включает в себя VEGF-A, VEGF-B, VEGF-C, VEGF-D и плацентарный фактор роста (PIGF), а также формы VEGF, образующиеся в результате альтернативного сплайсинга, в том числе VEGF121, VEGF145, VEGF165, VEGF189 и VEGF206 (Tischer et al., J. Biol. Chem, 266: 11947-11954, 1991). Семейство VEGFR тирозинкиназных рецепторов включает в себя VEGFR-1 (также известный как Flt-1), VEGFR-2 (также известный как KDR (человеческий) или Flk-1 (мышиный)) и VEGFR-3 (также известный как Flt-4). Лиганды VEGF связываются с рецепторами VEGF, индуцируя, например, ангиогенез, образование и развитие сосудов, пролиферацию эндотелиальных клеток, расширение кровеносных сосудов и миграцию клеток. Лиганды VEGF также могут ингибировать апоптоз посредством связывания с распознающими их рецепторами. Полагают, что VEGFR-2 является членом семейства VEGFR, наиболее активно участвующим в ангиогенезе. Биологическая активность, опосредованная VEGFR-2 или KDR, представляет собой любую биологическую функцию, в осуществлении которой принимают активное участие VEGFR-2 или KDR, так что антагонист VEGFR-2 или KDR вызывает поддающееся измерению уменьшение биологической активности. Биологическую активность VEGF и VEGFR можно измерить с помощью стандартных методов, известных в данной области. Примеры включают в себя лигандный анализ связывания и анализ с использованием графика Скэтчарда; анализ димеризации рецептора; анализ фосфорилирования клеток; анализ тирозинкиназного фосфорилирования (см., например, Meyer et al., Ann. N. Y. Acad. Sci. 995: 200-207, 2003); анализ пролиферации эндотелиальных клеток, например, путем мечения BrdU и подсчета клеток; анализ VEGF-зависимой пролиферации клеток и анализ ангиогенеза. Стандартные методы измерения ангиогенеза описаны, например, в Jain et al. (Nat. Rev. Cancer 2: 266-276, 2002). Ангиогенез можно анализировать путем измерения количества неразветвленных сегментов кровеносных сосудов (количества сегментов на единицу площади), функциональной плотности сосудов (общей длины перфузированных кровеносных сосудов на единицу площади), диаметра сосудов, образования сосудистых каналов или объемной плотности сосудов (общего объема кровеносных сосудов, рассчитанного по длине и диаметру каждого сегмента, на единицу площади). Примеры анализов VEGF-опосредованной пролиферации и ангиогенеза можно найти в U.S.P.N. 6559126, Lyden et al, Nature Medicine 7: 1194 (2001), Jacob et al, Exp. Pathol. 15: 1234 (1978) и Bae et al, J. Biol. Chem. 275: 13588 (2000). Данные анализы можно проводить с использованием либо очищенного рецептора или лиганда, либо обоих in vitro или in vivo. Данные анализы также можно проводить в клетках с использованием введенного генетическими методами или природного лиганда, или рецептора, или обоих. Полипептид, ингибирующий биологическую активность VEGF, вызывает уменьшение биологической активности VEGF, по меньшей мере, на 10%, предпочтительно, на 20%, 30%, 40% или 50% и, более предпочтительно, на 60%, 70%, 80%, 90% или больше. Ингибирование биологической активности также можно оценить посредством IC50. Предпочтительно полипептид, который ингибирует биологическую активность VEGF или VEGFR-2, имеет IC50 менее 100 нМ, более предпочтительно, менее 10 нМ и, наиболее предпочтительно, менее 1 нМ.
2. Полипептиды
Описанная в данном документе методология успешно используется для развития однодоменных VEGFR-2-связывающих полипептидов, полученных из двух родственных групп белковых структур: белков, имеющих иммуноглобулиновую складку, и белков, имеющих иммуноглобулин-подобную складку. Под "полипептидом" подразумевается любая последовательность из двух или более аминокислот независимо от длины, посттрансляционной модификации или функции. Термины "полипептид", "пептид" и "белок" в данном описании используются как взаимозаменяемые. Полипептиды могут включать в себя природные аминокислоты и неприродные аминокислоты, такие как описанные в U.S.P.N. 6559126, включенном в данном описании в качестве ссылки. Полипептиды также могут быть модифицированы любыми стандартными химическими способами (например, аминокислота может быть модифицирована защитной группой; карбоксиконцевая аминокислота может быть преобразована в концевую амидную группу; аминоконцевой остаток может быть модифицирован с помощью групп, например, увеличивающих липофильность; или полипептид можно гликозилировать химическим способом, или иначе модифицировать для увеличения стабильности или периода полужизни in vivo). Модификации полипептида могут включать в себя присоединение другой структуры, такой как циклическое соединение или другая молекула, к полипептиду и также могут включать в себя полипептиды, которые содержат одну или несколько аминокислот с другой конфигурацией (т.е. R или S; или L или D). Термин "однодоменный полипептид" используется для указания, что целевая связывающая активность (например, VEGFR-2-связывающая активность) анализируемого полипептида находится в одном структурном домене в отличие, например, от антител и одноцепочечных антител, где проявление антиген-связывающей активности обусловлено наличием вариабельного домена тяжелой цепи и вариабельного домена легкой цепи. Предположительно несколько однодоменных полипептидов раскрываемого в данном описании типа можно соединить с получением композитной молекулы с повышенной авидностью. Подобным образом однодоменный полипептид можно присоединить (например, с получением гибридного белка) с любым числом других полипептидов, таких как флуоресцентные полипептиды, нацеливающие полипептиды и полипептиды, обладающие другим терапевтическим эффектом.
Однодоменные полипептиды с иммуноглобулиновым или иммуноглобулин-подобным каркасом могут иметь некоторые общие структурные признаки. Например, полипептид может содержать приблизительно от 80 до 150 аминокислот, причем данные аминокислоты структурно организованы в ряд бета- или бета-подобных цепей, образующих бета-слои, где бета- или бета-подобные цепи соединены находящимися между ними петлеобразными участками. Примеры структурной организации вариабельного домена тяжелой цепи и домена 10Fn3 приведены на фиг.22. Бета-слои образуют стабильное ядро однодоменных полипептидов и в то же время создают две "лицевые поверхности", состоящие из петель, которые соединяют бета или бета-подобные цепи. Как описано в данном документе, указанные петли могут варьировать с образованием специализированных сайтов связывания лиганда и при наличии правильного контроля такие вариации могут генерироваться без нарушения общей стабильности белка. В антителах три из таких петель представляют собой хорошо известные гипервариабельные участки (или "CDR").
Каркасы для формирования однодоменных полипептидов должны быть хорошо растворимыми и стабильными в физиологических условиях. Примерами иммуноглобулиновых каркасов являются однодоменные каркасы VH или VL, а также верблюжий домен VHH (форма вариабельного домена тяжелой цепи, обнаруженная у верблюжьих) или другие вариабельные домены иммуноглобулинов, обнаруженные в природе или созданные в лаборатории с помощью методов генной инженерии. В случае раскрытого в данном описании однодоменного формата для достижения связывающей активности не требуется образование димера иммуноглобулинового полипептида со вторым полипептидом. Соответственно, любой из таких полипептидов, которые в естественной форме содержат цистеин, участвующий в образовании поперечных дисульфидных связей, соединяющих полипептид со вторым белком, можно модифицировать путем удаления цистеина. Альтернативно, цистеин можно сохранить и использовать для получения конъюгатов однодоменного полипептида с другими фрагментами, такими как PEG.
Другие каркасы могут представлять собой отличные от антител каркасные белки. Под "отличным от антитела каркасным белком или доменом" подразумевается отличный от антитела полипептид, имеющий иммуноглобулин-подобную складку. Под "иммуноглобулин-подобной складкой" подразумевается белковый домен, состоящий приблизительно из 80-150 аминокислотных остатков и включающий в себя два слоя антипараллельных бета-слоев, где плоские гидрофобные поверхности двух бета-слоев уложены друг против друга. Примером такого каркаса является "каркасный белок на основе фибронектина", под которым подразумевается полипептид, в основе которого лежит домен фибронектина типа III (Fn3). Фибронектин представляет собой крупный белок, который играет важную роль в образовании внеклеточного матрикса и осуществлении межклеточных взаимодействий; он состоит из многочисленных повторов маленьких доменов трех типов (типы I, II и III) (Baron et al., 1991). Сам Fn3 относится к большому подсемейству, которое включает в себя молекулы клеточной адгезии, клеточные поверхностные гормоны и рецепторы цитокинов, молекулы-спутники (chaperoning) и домены, связывающие углеводы. Обзоры см. в Bork & Doolittle, Proc Natl Acad Sci U S A. 1992 Oct 1; 89 (19): 8990-4; Bork et al., J Mol Biol. 1994 Sep 30; 242 (4): 309-20; Campbell & Spitzfaden, Structure. 1994 May 15; 2 (5): 333-7; Harpez & Chothia, J Mol Biol. 1994 May 13; 238 (4): 528-39).
Предпочтительно каркасный белок на основе фибронектина представляет собой каркас "10FN3", под которым подразумевается полипептидный вариант, в основе которого лежит десятый модуль человеческого фибронектина типа III, в котором одна или несколько доступных для растворителя петель подвергнуты рандомизации или мутации, в особенности одна или несколько из трех петель, идентифицированных как петля BC (аминокислоты 23-30), петля DE (аминокислоты 52-56) и петля FG (аминокислоты 77-87) (в основе системы нумерации лежит нумерация последовательности десятого домена типа III человеческого фибронектина, а аминокислоты Val-Ser-Asp-Val-Pro имеют номера 1-5). Десятый модуль домена человеческого фибронектина типа III дикого типа имеет следующую аминокислотную последовательность: VSDVPRDLEVVAATPTSLLISWDAPAVTVRYYRITYGETGGNSPVQEFTVPGSKSTATISGLKPGVDYTITGYAVTGRGDSPASSKPISINYRT (SEQ ID NO: 5). Таким образом, петля BC дикого типа имеет последовательность DAPAVTVR; петля DE дикого типа имеет последовательность GSKST; петля FG дикого типа имеет последовательность GRGDSPASSKP. Последовательности, фланкирующие BC, DE и FG, также называют каркасные участки 1, 2, 3 и 4, например, в таблицах 1-3.
Был идентифицирован ряд мутантных каркасов 10Fn3 с улучшенными свойствами. Например, с модификацией по Asp7, который заменяют на аминокислотный остаток, не имеющий отрицательного заряда (например, Asn, Lys и др.). Обе указанные мутации способствуют увеличению стабильности мутанта 10Fn3 при нейтральном pH по сравнению с формой дикого типа. Были описаны другие изменения каркаса 10Fn3, которые являются либо благоприятными, либо нейтральными. См., например, Batori et al. Protein Eng. 2002 Dec; 15 (12): 1015-20; Koide et al., Biochemistry 2001 Aug 28; 40 (34): 10326-33.
Кроме того, в данном описании раскрывается несколько новых модификаций каркаса 10Fn3. Особое значение имеет открытие, заключающееся в том, что делеция первых 8 аминокислот человеческого 10Fn3 дикого типа приводит приблизительно к трехкратному улучшению связывания VEGFR-2. Поскольку первые 8 аминокислот имеют тенденцию укладываться в положении, близком к петлям BC, DE и FG, ожидается, что данная мутация также будет улучшать связывание мишени в других каркасах 10Fn3, отобранных по связыванию с другими мишенями. Соответственно, можно сконструировать библиотеку нуклеиновых кислот, кодирующих каркас 10Fn3, в котором отсутствуют первые 8 аминокислот, и провести скрининг в данной библиотеке нуклеиновых кислот с улучшенными свойствами.
Белки 10Fn3, как вариантные, так и дикого типа, характеризуются одинаковой структурой, а именно семь доменных последовательностей, образующих бета-цепи (обозначенных от A до...), и шесть петлеобразных участков (петля AB, петля BC, петля CD, петля DE, петля EF и петля FG), которые соединяют семь доменных последовательностей, образующих бета-цепи. Бета-цепи, расположенные вблизи N- и C-концов, в растворе могут принимать бета-подобную конформацию. В SEQ ID No: 5 петля AB соответствует остаткам 15-16, петля BC соответствует остаткам 22-30, петля CD соответствует остаткам 39-45, петля DE соответствует остаткам 51-55, петля EF соответствует остаткам 60-66, а петля FG соответствует остаткам 76-87. Как показано на фиг.22, петля BC, петля DE и петля FG расположены на одном конце полипептида. Подобным образом иммуноглобулиновые каркасы предпочтительно имеют, по меньшей мере, семь бета- или бета-подобных цепей и зачастую девять бета- или бета-подобных цепей.
Раскрытый в данном описании однодоменный полипептид может иметь, по меньшей мере, от пяти до семи бета- или бета-подобных цепей, распределенных, по меньшей мере, между двух бета-слоев, и, по меньшей мере, один петлеобразный участок, соединяющий две бета- или бета-подобные цепи, причем данный петлеобразный участок участвует в связывании VEGFR-2, особенно KDR, а связывание характеризуется константой диссоциации менее 1×10-6 M, предпочтительно, менее 1×10-8 M. Как указано в данном описании, для терапевтического применения in vivo с ингибированием сигнального пути VEGF особенно желательны полипептиды, имеющие константу диссоциации менее 5×10-9 M. Для детекции или мечения белков VEGFR-2 ex vivo или in vivo желательно использовать полипептиды, имеющие константу диссоциации в интервале от 1×10-6 M до 5×10-9 M.
VEGFR-2-связывающий белок необязательно специфично связывается с VEGFR-2 по сравнению с другими родственными белками из таких же видов. Под "специфическим связыванием" подразумевается, что полипептид распознает белок-мишень (например, VEGFR-2) и взаимодействует с ним, но по существу не распознает другие молекулы в образце, например в биологическом образце, и не взаимодействует с ними. В предпочтительных воплощениях полипептид данного изобретения специфически связывается с VEGFR с KD, составляющей приблизительно 500 нМ. Предпочтительно, полипептид специфически связывается с VEGFR с KD, составляющей от 1 пМ до 500 нМ, более предпочтительно от 1 пМ до 100 нМ, более предпочтительно от 1 пМ до 10 нМ и наиболее предпочтительно от 1 пМ до 1 нМ или ниже.
Как правило, библиотеку каркасных однодоменных полипептидов подвергают скринингу для идентификации специфических полипептидных вариантов, которые могут связываться с выбранной мишенью. Данные библиотеки могут представлять собой, например, библиотеки фаговых дисплеев или библиотеки PROfusionTM.
В иллюстративном воплощении для выделения полипептидов, которые связываются и с человеческим (KDR), и с мышиным (Flk-1) VEGFR-2 и ингибируют VEGF-зависимую биологическую активность, авторы используют новую технологию отображения in vitro с использованием гибридов РНК-белок. Данные полипептиды идентифицируют из библиотек каркасных белков на основе фибронектина (Koide et al, JMB 284: 1141 (1998)) и библиотек доменов VL, в которых расхождение CDR3 увеличивается в результате обмена на домены CDR3 из популяции молекул VH. Fn3 содержит приблизительно 94 аминокислотных остатка, как показано в SEQ ID NO: 5.
Кроме того, как описано выше, аминокислотные последовательности N-конца 10Fn3 также могут подвергаться мутациям или делециям. Например, рандомизация петель BC, DE и FG может происходить в полноразмерном 10Fn3, или в 10Fn3 с делецией или мутацией 1-8 аминокислот в N-конце. Например, L в положении 8 может быть заменен на Q. После рандомизации с созданием разнотипной библиотеки каркасные белки на основе фибронектина можно использовать для отборочного анализа с целью выбора полипептидов с высоким сродством к белку, в данном случае к VEGFR. (Подробное описание технологии с использованием гибридов РНК-белок и методов скрининга с использованием библиотеки каркасных белков на основе фибронектина можно найти в Szostak et al., патенты США №№: 6258558; 6261804; 6214553; 6281344; 6207446; 6518018; публикации PCT №№ WO 00/34784; WO 01/64942; WO 02/032925 и Roberts and Szostak, Proc Natl.Acad.Sci. 94: 12297-12302,1997, включенных в данное описание в качестве ссылок).
Чтобы провести начальную селекцию, описанную в данном документе, три участка 10Fn3 в положениях 23-29, 52-55 и 77-86 рандомизируют и используют для селекции in vitro против внеклеточного домена человеческого VEGFR-2 (аминокислоты 1-764 KDR, гибридизованные с человеческим IgG1Fc). Используя дисплей мРНК (гибрид РНК-белок) и селекцию in vitro, авторы анализируют библиотеку на основе 10Fn3, содержащую приблизительно десять триллионов вариантов. С помощью начальной селекции идентифицируют полипептиды со средним сродством (KD=10-200 нМ), которые конкурируют с VEGF за связывание с KDR (человеческим VEGFR-2). Затем один клон (KD=11-13 нМ), выбранный в результате начальной селекции, подвергают мутагенезу и дальнейшей селекции. Данный процесс аффинного созревания дает новые VEGFR-связывающие полипептиды с константами диссоциации от 60 пМ до 2 нМ. Молекулы, связывающие KDR, приведены в таблице 3. Кроме того, авторы также выделяют полипептиды, которые могут связываться с Flk-1, мышиным гомологом KDR, из мутировавших популяций молекул, связывающих KDR, которые изначально не обладали детектируемым связывающим сродством к Flk-1, получая в результате полипептиды, которые обладают двойной специфичностью к человеческому и мышиному VEGFR-2. Показано, что данные полипептиды связывают клетки, экспонирующие внеклеточные домены KDR или Flk-1. Они также ингибируют клеточный рост в анализе с использованием VEGF-зависимой пролиферации. Полипептиды, которые связываются с KDR и Flk-1, приведены в таблице 2, тогда как результаты селекции предпочтительных KDR-связывающих молекул и KDR/Flk-1-связывающих молекул приведены в таблице 1.
С использованием VEGFR-2-связывающих полипептидов, идентифицированных в процессе указанной селекции, авторы определили консенсусные аминокислотные последовательности петли FG, необходимые для связывания полипептидов с VEGFR-2. Последовательности приведены ниже как SEQ ID NO: 1-4.
VEGFR-2-связывающие полипептиды, такие как имеющие последовательности SEQ ID NO: 1-4, можно использовать отдельно (как выделенные пептиды) как часть однодоменного полипептида 10Fn3, как часть полноразмерного фибронектина (с полноразмерным аминоконцом или с аминоконцом, содержащим делецию) или его фрагмента в контексте иммуноглобулина (особенно однодоменного иммуноглобулина), в контексте другого белка, имеющего иммуноглобулин-подобную складку, или в контексте другого, не родственного белка. Полипептиды также можно использовать в составе гибридного белка, содержащего гетерологичный белок, который сам не связывается с VEGFR, или не участвует в связывании VEGFR. Кроме того, полипептиды данного изобретения также могут гибридизоваться с нуклеиновыми кислотами. Полипептиды могут быть получены методами генной инженерии в виде мономеров, димеров или мультимеров.
Последовательности предпочтительных консенсусных VEGFR-2-связывающих пептидов:
SEQ ID NO: 1-(L/M)GXN(G/D)(H/R)EL(L/M)TP
[X может представлять собой любую аминокислоту; (/) представляет альтернативную аминокислоту в данном положении]
SEQ ID NO: 2-XERNGRXL(L/M/N)TP
[X может представлять собой любую аминокислоту; (/) представляет альтернативную аминокислоту в данном положении]
SEQ ID NO: 3-(D/E)GXNXRXXIP
[X может представлять собой любую аминокислоту; (/) представляет альтернативную аминокислоту в данном положении]
SEQID NO: 4-(D/E)G(R/P)N(G/E)R(S/L)(S/F)IP
[X может представлять собой любую аминокислоту; (/) представляет альтернативную аминокислоту в данном положении]
Последовательности предпочтительных VEGFR-2-связывающих полипептидов 10Fn3:



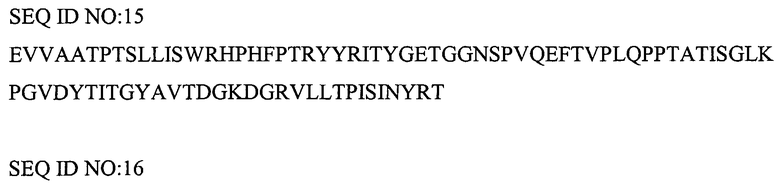


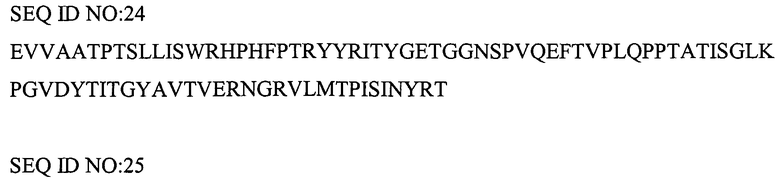


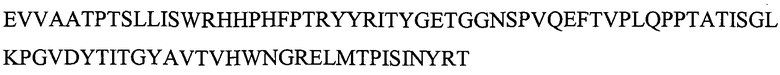



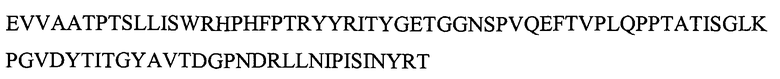





Указанная выше молекула CT-01 содержит делецию первых 8 аминокислот и может содержать дополнительные аминокислоты на N- или C-конце. Например, дополнительная последовательность MG может быть помещена на N-конце. M обычно отщепляют, оставляя на N-конце последовательность GEV... Повторное добавление собственных 8 аминокислот на N-конце также дает KDR-связывающий белок с желательными свойствами. N-концевой метионин обычно отщепляют, получая последовательность: VSDVPRDLEVVAATPTSLLISWRHPHFPTRYYRITYGETGGNSPVQEFTVPLQPPTATISGLKPGVDYTITVYAVTDGRNGRLLSIPISINYRT (SEQ ID NO: 193).
Раскрытый в данном описании полипептид можно модифицировать путем одной или нескольких консервативных замен, в частности, во фрагментах белка, которые предположительно не взаимодействуют с белком-мишенью. Полагают, что 5%, 10%, 20% или даже 30% или более аминокислот в иммуноглобулиновом или иммуноглобулин-подобном домене можно изменить путем консервативных замен без существенного изменения сродства белка к мишени. Такие замены могут приводить к изменению иммуногенности полипептида in vivo, и если иммуногенность уменьшается, то изменения являются желательными. В данном описании термин "консервативные замены" относится к остаткам, которые физически или функционально подобны соответствующим исходным остаткам. То есть консервативная замена и соответствующий исходный остаток имеют подобные размеры, формы, электрические заряды, химические свойства, в том числе способность образовывать ковалентные или водородные связи и т.п. Предпочтительными консервативными заменами являются замены, удовлетворяющие критериям, определенным для разрешенных точечных мутаций в Dayhoff et al., Atlas of Protein Sequence and Structure 5: 345-352 (1978 & Supp.). Примерами консервативных замен являются замены в следующих группах: (a) валин, глицин; (b) глицин, аланин; (c) валин, изолейцин, лейцин; (d) аспарагиновая кислота, глутаминовая кислота; (e) аспарагин, глутамин; (f) серин, треонин; (g) лизин, аргинин, метионин и (h) фенилаланин, тирозин.
Раскрытые в данном описании полипептиды также можно модифицировать, чтобы повысить активность, биодоступность, химическую стабильность и/или эффективность. Например, в одном воплощении данного изобретения для улучшения биодоступности и химической стабильности полипептидной структуры можно получить пептиды, содержащие D-аминокислоты, или ретроэнантио-пептидные последовательности (см., например, Juwadi et al., J. Am. Chem. Soc. 118: 8989-8997, 1996; Freidinger et al., Science, 210: 656-658, 1980). Для улучшения биологических и фармакологических свойств нативных пептидов в качестве заместителей также можно использовать лактамные связи (см. Freidinger, supra) и/или азабициклоалкановые аминокислоты в качестве заменителей дипептидов (см., например, Hanessian et al., Tetrahedron 53: 12789-12854, 1997).
Для предотвращения ферментативного разрушения полипептидного скелета и, следовательно, увеличения активности также можно использовать заменители амидной связи, такие как тиоамиды, вторичные и третичные амины, гетероциклические и другие соединения (обзор см. в Spatola, A. F. in "Chemistry and Biochemistry of Amino Acids, Peptides and Proteins" Wenstein, B. Ed. Marcel Dekker, New York, 1983 Vol. 7, pp. 267-357). Для повышения метаболической стабильности также можно использовать превращение линейных полипептидов в циклические полипептидные аналоги, поскольку циклические полипептиды гораздо менее чувствительны к ферментативной деградации (в основном см. Veber, et al. Nature 292: 55-58, 1981).
Чтобы замедлить или предотвратить метаболизм и увеличить липофильность, полипептиды также можно модифицировать путем кэпирования концевых групп с получением сложных эфиров и амидов. Димеры пептидов, полученные с использованием различных линкеров, тоже могут способствовать увеличению активности и специфичности (см., например: Y. Shimohigashi et al, in Peptide Chemistry 1988, Proceedings of the 26th Symposium on Peptide Chemistry, Tokyo, October 24-26, pgs. 47-50, 1989). Другие примеры модификаций полипептидов, такие как введение неприродных аминокислот, можно найти в U. S. P. N. 6559126.
Для применения in vivo может быть получена форма, подходящая для пэгилирования. Например, как показано ниже, к С-концу формы CT-01, утратившей восемь N-концевых аминокислот, добавляют фрагмент, содержащий цистеин, с последующей экспрессией (по С-концу добавляют EIDKPCQ).
GEVVAATPTSLLISWRHPHFPTRYYRITYGETGGNSPVQEFTVPLQPPTATISGL KPGVDYTITVYAVTDGRNGRLLSIPISINYRTEIDKPCQ (SEQ ID NO: 194). Пэгилированную форму данной молекулы используют в описанных ниже экспериментах in vivo. Также используют контрольную форму, содержащую вместо цистеина серин: GEVVAATPTSLLISWRHPHFPTRYYRITYGETGGNSPVQEFTVPLQPPTATISGLKPGVDYTITVYAVTDGRNGRLLSIPISINYRTEIDKPSQ (SEQ ID NO: 195).
Такие же C-концевые фрагменты можно добавить к формам CT-01, содержащим восемь N-концевых аминокислот, например, имеющим последовательность SEQ ID NO: 193. Выделяют другие варианты, обладающие желательными KDR-связывающими свойствами. Нижеследующая последовательность ядра содержит несколько отличающуюся петлю FG и может экспрессироваться, например, с N-концевой последовательностью MG, N-концевой последовательностью, в которую возвращены 8 удаленных аминокислот, и/или C-концевым фрагментом, которые содержат цистеин, необходимый для пэгилирования.
EVVAATPTSLLISWRHPHFPTRYYRITYGETGGNSPVQEFTVPLQPPTATISGLK PGVDYTITVYAVTEGPNERSLFIPISINYRT (SEQ ID NO: 196). Другой такой вариант имеет следующую последовательность ядра:
VSDVPRDLEVVAATPTSLLISWRHPHFPTRYYRITYGETGGNSPVQEFTVPLQPPTATISGLKPGVDYTITVYAVTEGPNERSLFIPISINYRT (SEQ ID NO: 197).
Кроме того, с помощью подобных методов выделяют предпочтительные однодоменные иммуноглобулиновые полипептиды в каркасной области VL, которые приведены на фиг.21.
В объем настоящего изобретения также входят нуклеотидные последовательности, кодирующие любые описанные здесь полипептиды. Как известно специалистам в данной области, вследствие вырожденности генетического кода почти каждая аминокислота может быть представлена в кодирующей нуклеотидной последовательности несколькими триплет-кодонами. Кроме того, изменения минорных пар оснований могут приводить к консервативным заменам в кодируемой аминокислотной последовательности, но, как полагают, не оказывают существенного влияния на биологическую активность генного продукта.
Следовательно, нуклеотидная последовательность, кодирующая описанный здесь полипептид, может быть немного модифицированной и при этом может кодировать соответствующий генный продукт.
Полипептиды настоящего изобретения также можно использовать в качестве исходных полипептидов, которые можно подвергать последующим модификациям и скринингу с выявлением полипептидов, которые связывают VEGFR с еще более высоким сродством. В одном примере описанный здесь полипептид используют в качестве исходного полипептида, который подвергают последующим модификациям или рандомизации с получением полипептидов, несущих мутации аминокислот, отличающиеся от мутаций в исходном полипептиде. Затем можно осуществить рандомизацию полипептидов с последующим скринингом по полипептидам, которые ингибируют биологическую активность VEGF, как описано в данном документе (например, связываются с VEGFR и блокируют связывание VEGF с тем же рецептором).
3. Нуклеиновые кислоты и продукция полипептидов
Полипептиды настоящего изобретения можно получать с использованием любых стандартных методов, известных в данной области.
В одном примере полипептиды получают с помощью методов рекомбинантных ДНК путем вставки нуклеотидной последовательности (например, кДНК), кодирующей полипептид, в рекомбинантный вектор экспрессии с последующей экспрессией последовательности ДНК в условиях, способствующих осуществлению экспрессии. Примерами нуклеотидных последовательностей, кодирующих раскрытый в данной описании полипептид CT-01, являются:

Нуклеиновые кислоты, кодирующие любые из раскрытых в данном описании различных полипептидов, можно синтезировать химическими способами. Используемые кодоны могут быть подобраны соответствующим образом для улучшенной экспрессии в клетке. Используемые кодоны зависят от выбранного типа клетки. Конкретные образцы используемых кодонов разработаны для E. coli и других бактерий, а также для клеток млекопитающих, растительных клеток, клеток дрожжей и клеток насекомых. См., например: Mayfield et al., Proc Natl Acad Sci U S A. 2003 Jan 21; 100 (2): 438-42; Sinclair et al. Protein Expr Purif. 2002 Oct; 26(1): 96-105; Connell ND. Curr Opin Biotechnol. 2001 Oct; 12 (5): 446-9; Makrides et al. Microbiol Rev. 1996 Sep; 60 (3): 512-38; и Sharp et al. Yeast. 1991 Oct; 7 (7): 657-78.
Общие методы манипуляции с нуклеиновыми кислотами описаны, например, в Sambrook et al., Molecular Cloning: A Laboratory Manual, Vols. 1-3, Cold Spring Harbor Laboratory Press, 2 ed., 1989, или F. Ausubel et al., Current Protocols in Molecular Biology (Green Publishing and Wiley-Interscience: New York, 1987) и в периодических изданиях, включенных в данное описание в качестве ссылки. ДНК, кодирующая полипептид, функционально связана с элементами, регулирующими транскрипцию или трансляцию, полученными из генов млекопитающих, вирусов или насекомых. Такие регуляторные элементы включают в себя промотор транскрипции, необязательную операторную последовательность, контролирующую транскрипцию, последовательность, кодирующую рибосомальные сайты связывания соответствующей мРНК, и последовательности, контролирующие терминацию транскрипции и трансляции. В состав ДНК также вводят репликатор, обеспечивающий способность к репликации в хозяине, и ген селекции, облегчающий распознавание трансформантов.
Рекомбинантная ДНК также может включать в себя последовательность, кодирующую белковый таг, который используют при очистке белка. Примеры белковых тагов включают в себя, без ограничения, гистидиновый таг, таг FLAG, таг myc, таг HA, или таг GST. Векторы клонирования и экспрессии, подходящие для применения в бактериальных, грибковых, дрожжевых клетках-хозяевах и в клетках-хозяевах млекопитающих, можно найти в Cloning Vectors: A Laboratory Manual, (Elsevier, New York, 1985), соответствующее раскрытие которого включено в данное описание в качестве ссылки.
Экспрессионную конструкцию вводят в клетку-хозяина с помощью способа, подходящего для данной клетки-хозяина, что очевидно для специалиста в данной области. В данной области известны разные способы введения нуклеиновых кислот в клетки-хозяева, в том числе, без ограничения, электропорация; трансфекция с применением хлорида кальция, хлорида рубидия, фосфата кальция, DEAE-декстрана или других веществ; бомбардировка микрочастицами; липофекция и инфицирование (если вектор представляет собой инфицирующий агент).
Подходящие клетки-хозяева включают в себя клетки прокариотов, дрожжей, млекопитающих или бактериальные клетки. Подходящие бактерии включают в себя грамотрицательные или грамположительные организмы, например E. coli или Bacillus spp. Для получения полипептидов также можно использовать дрожжи, предпочтительно из видов Saccharomyces, например S. cerevisiae. Для экспрессирования рекомбинантных белков также можно использовать культуры клеток млекопитающих или насекомых. Обзор бакуловирусных систем для продукции гетерологичных белков в клетках насекомых опубликован Luckow and Summers, (Bio/Technology, 6: 47,1988). Примеры подходящих линий клеток-хозяев млекопитающих включают в себя линии эндотелиальных клеток, клеток почек обезьян COS-7, CV-1, L-клеток, C127, 3T3, клеток яичников китайского хомячка (CHO), клеток почек эмбрионов человека, HeLa, 293, 293T и клеток BHK. Очищенные полипептиды получают путем культивирования подходящих систем хозяин/вектор с экспрессией рекомбинантных белков. Зачастую из-за того, что многие полипептиды, раскрытые в данном описании, имеют маленький размер, экспрессию предпочтительно проводить в E. coli. Затем белок выделяют из культуральной среды или клеточных экстрактов.
Белки, раскрытые в данном описании, также можно получить с использованием бесклеточных систем трансляции. Для этого нуклеиновые кислоты, кодирующие полипептид, должны быть модифицированы так, чтобы обеспечить транскрипцию in vitro с получением мРНК и трансляцию мРНК в конкретно используемой бесклеточной системе (например, эукариотической, такой как бесклеточная система трансляции млекопитающих или дрожжей, или прокариотической, такой как бактериальная бесклеточная система трансляции).
VEGFR-связывающие полипептиды также можно получить с помощью химического синтеза (например, с помощью методов, описанных в Solid Phase Peptide Synthesis, 2nd ed., 1984, The Pierce Chemical Co., Rockford, IL). Модификации белков также можно осуществить путем химического синтеза.
Полипептид настоящего изобретения можно очистить с помощью методов выделения/очистки белков, широко известных в области белковой химии. Неограничивающие примеры включают в себя экстракцию, перекристаллизацию, высаливание (например, сульфатом аммония или сульфатом натрия), центрифугирование, диализ, ультрафильтрацию, абсорбционную хроматографию, ионно-обменную хроматографию, гидрофобную хроматографию, хроматографию на нормальной фазе, хроматографию на обращенной фазе, гель-фильтрацию, гель-проникающую хроматографию, аффинную хроматографию, электрофорез, противоточное распределение или любое сочетание перечисленных методов. После очистки полипептида можно заменить буфер или сконцентрировать раствор полипептида с помощью ряда методов, известных в данной области, включающих в себя, без ограничения, фильтрацию и диализ.
Чистота очищенного полипептида предпочтительно составляет, по меньшей мере, 85%, более предпочтительно, по меньшей мере, 95% и наиболее предпочтительно, по меньшей мере, 98%. Независимо от точного числового значения чистоты полипептид является достаточно чистым для применения в качестве фармацевтического продукта.
4. Пост-трансляционные модификации полипептидов
В некоторых воплощениях связывающие полипептиды данного изобретения могут дополнительно содержать пост-трансляционные модификации. Примеры пост-трансляционной модификации белков включают в себя фосфорилирование, ацетилирование, метилирование, АДФ-рибозилирование, убихитинирование, гликозилирование, карбонилирование, сумоилирование, биотинилирование или добавление боковой цепи полипептида или гидрофобной группы. В результате модифицированные растворимые полипептиды могут содержать отличные от аминокислот элементы, такие как липиды, поли- или моносахариды и фосфаты. Предпочтительной формой гликозилирования является сиалилирование, которое представляет собой присоединение к полипептиду одного или нескольких фрагментов сиаловых кислот. Фрагменты сиаловых кислот улучшают растворимость и период полужизни в сыворотке, снижая в то же время возможную иммуногенность белка. См., например, Raju et al. Biochemistry. 2001 Jul 31; 40 (30): 8868-76. Влияние таких отличных от аминокислот элементов на функционирование полипептида можно определить по способности полипептида играть антагонистическую роль в осуществлении функций VEGFR-2 или VEGF, например, по ингибированию ангиогенеза или опухолевого роста.
В одном конкретном воплощении настоящего изобретения модифицированные формы исследуемых растворимых полипептидов включают в себя присоединение к исследуемым растворимым полипептидам небелковых полимеров. В одном конкретном воплощении полимер представляет собой полиэтиленгликоль ("PEG"), полипропиленгликоль или полиоксиалкилены, как описано в патентах США 4640835; 4496689; 4301144; 4670417; 4791192 или 4179337. Примеры модифицированных полипептидов данного изобретения включают в себя пэгилированный M5FL и пэгилированный CT-01.
PEG представляет собой хорошо известный водорастворимый полимер, который является коммерчески доступным или который можно получить путем полимеризации с раскрытием цикла этиленгликоля с помощью хорошо известных в данной области методов (Sandler and Karo, Polymer Synthesis, Academic Press, New York, Vol. 3, pages 138-161). Термин "PEG" используется в широком смысле и охватывает все молекулы полиэтиленгликоля независимо от размера или модификации концевого фрагмента PEG, которые могут быть представлены формулой:
X-O(CH2CH2О)n-1CH2CH2ОH (1), где n обозначает число от 20 до 2300, а X обозначает H или концевую модификацию, например C1-4 алкил. В одном воплощении данного изобретения PEG на одном конце содержит гидроксильную группу или метоксигруппу, т.е. X обозначает H или CH3 ("метокси-PEG"). PEG может содержать другие химические группы, необходимые для осуществления реакций связывания; которые образуются в результате химического синтеза молекулы или которые представляют собой спейсерные группы, обеспечивающие оптимальное расстояние между частями молекулы. Кроме того, такой PEG может содержать одну или несколько связанных вместе полиэтиленгликолевых боковых цепей. Молекулы PEG с несколькими PEG цепями называют многоплечими или разветвленными PEG. Разветвленные PEG можно получить, например, путем добавления полиэтиленоксида к различным полиолам, включающим в себя глицерин, пентаэритриол и сорбит. Например, четырехплечий разветвленный PEG можно получить из пентаэритриола и этиленоксида. Разветвленный PEG описан, например, в EP-A 0473084 и патенте США № 5932462. Одна из форм PEG содержит две боковые цепи PEG (PEG2), соединенные через первичные аминогруппы лизина (Monfardini, C., et al., Bioconjugate Chem. 6 (1995) 62-69).
Хотя PEG является хорошо известным соединением, насколько известно авторам, данное изобретение впервые демонстрирует, что после пэгилирования полипептид 10Fn3 может сохранять лиганд-связывающую активность. В предпочтительном воплощении пэгилированный полипептид 10Fn3 получают путем направленного пэгилирования, в частности путем конъюгации PEG с цистеиновым фрагментом на N- или C-конце. Соответственно, настоящее изобретение предлагает полипептид 10Fn3, связывающий мишень с улучшенными фармакокинетическими параметрами, причем данный полипептид содержит: домен 10Fn3, содержащий приблизительно от 80 до 150 аминокислот, где по меньшей мере одна из петель указанного домена 10Fn3 участвует в связывании мишени; и ковалентно связанный фрагмент PEG, где указанный полипептид 10Fn3 связывается с мишенью с KD менее 100 нМ и имеет скорость выведения у млекопитающих менее 30 мл/ч/кг. Фрагмент PEG может быть присоединен к полипептиду 10Fn3 путем направленного пэгилирования, например путем присоединения к остатку Cys, а остаток Cys может находиться на N-конце полипептида 10Fn3, или между N-концом и основной частью N-концевой бета- или бета-подобной цепи, или на С-конце полипептида 10Fn3, или между С-концом и основной частью С-концевой бета- или бета-подобной цепи. Остаток Cys также может находиться в других положениях, в частности в любой из петель, которые не участвуют в связывании мишени. Фрагмент PEG можно также присоединять с помощью других химических способов, в том числе путем конъюгации с аминами.
Конъюгация PEG с пептидами или белками обычно включает в себя активацию PEG и присоединение активированных промежуточных молекул PEG непосредственно к целевым белкам/пептидам или к линкеру, который затем активируется и присоединяется к целевым белкам/пептидам (см. Abuchowski, A. et al, J. Biol. Chem., 252, 3571 (1977) и J. Biol. Chem., 252, 3582 (1977), Zalipsky, et al., and Harris et. al., in: Poly (ethylene glycol) Chemistry: Biotechnical and Biomedical Applications; (J. M. Harris ed.) Plenum Press: New York, 1992; Chap. 21 and 22). Следует отметить, что связывающий полипептид, содержащий молекулу PEG, также называют конъюгированным белком, тогда как белок, утративший присоединенную молекулу PEG, может называться неконъюгированным.
Для конъюгации с VEGFR-2-связывающими полипептидами можно использовать формы PEG с разной молекулярной массой, например, составляющей приблизительно от 1000 дальтон (Да) до 100000 Да (n составляет от 20 до 2300). Число повторяющихся элементов "n" в PEG соответствует молекулярной массе, описанной в дальтонах. Предпочтительно, чтобы суммарная молекулярная масса PEG на активированном линкере была подходящей для фармацевтического применения. Следовательно, в одном воплощении молекулярная масса молекул PEG не превышает 100000 Да. Например, если к линкеру присоединены три молекулы PEG, причем все молекулы PEG имеют одинаковую молекулярную массу 12000 Да (для каждой молекулы n составляет приблизительно 270), то общая молекулярная масса PEG на линкере составляет приблизительно 36000 Да (общее значение n составляет приблизительно 820). Молекулы PEG, присоединенные к линкеру, также могут иметь разную молекулярную массу, например из трех молекул, присоединенных к линкеру, две молекулы PEG могут иметь молекулярную массу по 5000 Да каждая (для каждой молекулы n составляет приблизительно 110), а одна молекула PEG может иметь молекулярную массу 12000 Да (n составляет приблизительно 270).
В конкретном воплощении данного изобретения VEGFR-2-связывающий полипептид ковалентно связан с поли(этиленгликольной) группой формулы: -CO-(CH2)х-(OCH2CH2)m-OR, причем -CO (т.е. карбонил) поли(этиленгликольной) группы образует амидную связь с одной из аминогрупп связывающего полипептида; R обозначает низший алкил; x равен 2 или 3; m обозначает число в интервале приблизительно от 450 до 950; а n и m выбраны так, что молекулярная масса конъюгата за вычетом молекулярной массы связывающего полипептида составляет приблизительно от 10 до 40 кДа. В одном воплощении ε-аминогруппа лизина в связывающем полипептиде является доступной (свободной) аминогруппой.
Вышеуказанные конъюгаты могут быть конкретно представлены формулой (II): P-NHCO-(CH2)х-(OCH2CH2)m-OR (II), где P обозначает группу связывающего полипептида, как описано в данном документе (т.е. не содержащую аминогруппы или аминогруппы, образующие амидную связь с карбонилом, изображенным в формуле (II); и где R обозначает низший алкил; x равен 2 или 3; m обозначает число в интервале приблизительно от 450 до 950, выбранное так, что молекулярная масса конъюгата за вычетом молекулярной массы связывающего полипептида составляет приблизительно от 10 до 40 кДа. В данном описании приведенные интервалы "m" имеют ориентировочное значение. Интервалы значений "m" во всех случаях точно определяются по молекулярной массе группы PEG.
Специалист в данной области может выбрать подходящую молекулярную массу для PEG, например, в зависимости от способа терапевтического применения пэгилированного связывающего полипептида, желаемой дозы, времени циркуляции в кровотоке, устойчивости к протеолизу, иммуногенности и других факторов. PEG и его применение для улучшения свойств белков описаны, например, в N. V. Katre, Advanced Drug Delivery Reviews 10: 91-114 (1993).
В одном воплощении данного изобретения молекулы PEG можно активировать для взаимодействия с аминогруппами связывающего полипептида, например с аминогруппами остатков лизина (Bencham C.O. et al., Anal. Biochem., 131,25 (1983); Veronese, F. M. et al., Appl. Biochem., 11, 141 (1985).; Zalipsky, S. et al., Polymeric Drugs and Drug Delivery Systems, adrs 9-110 ACS Symposium Series 469 (1999); Zalipsky, S. et al., Europ. Polym. J., 19, 1177-1183 (1983); Delgado, C. et al., Biotechnology and Applied Biochemistry, 12, 119-128 (1990)).
В одном конкретном воплощении для получения конъюгатов PEG-связывающий полипептид используются карбонатные сложные эфиры PEG. PEG может взаимодействовать с N,N'-дисукцинимидилкарбонатом (DSC) с образованием активированного смешанного PEG-сукцинимидилкарбоната, который затем может взаимодействовать с нуклеофильной группой линкера или с аминогруппой связывающего полипептида (см. патент США № 5281698 и патент США № 5932462). 1,1'-(дибензотриазолил)карбонат и ди-(2-пиридил)карбонат могут взаимодействовать подобным образом с PEG с образованием PEG-бензотриазолильных и PEG-пиридильных смешанных карбонатов (патент США № 5382657) соответственно.
Пэгилированный полипептид 10Fn3 можно получить с помощью способов, известных из уровня техники, например путем взаимодействия связывающего полипептида с электрофильноактивными молекулами PEG (поставщик: Shearwater Corp., USA, www.shearwatercorp.com). Предпочтительными PEG-реагентами настоящего изобретения являются, например, N-гидроксисукцинимидилпропионаты (PEG-SPA), бутаноаты (PEG-SBA), PEG-сукцинимидилпропионат или разветвленные N-гидроксисукцинимиды, такие как mPEG2-NHS (Monfardini, C., et al., Bioconjugate Chem. 6 (1995) 62-69). Такие методы можно использовать для пэгилирования по ε-аминогруппам лизина связывающего полипептида или по N-концевой аминогруппе связывающего полипептида.
В другом воплощении молекулы PEG можно присоединить к сульфгидрильным группам связывающего полипептида (Sartore, L., et al., Appl. Biochem. Biotechnol., 27, 45 (1991); Morpurgo et al., Biocon. Chem., 7, 363-368 (1996); Goodson et al., Bio/Technology (1990) 8, 343; патент США № 5766897). В патентах США №№ 6610281 и 5766897 описаны примеры реакционноспособнных производных PEG, которые могут взаимодействовать с сульфгидрильными группами.
В некоторых воплощениях, где молекулы PEG взаимодействуют с цистеиновыми остатками на связывающем полипептиде, цистеиновые остатки изначально присутствуют на связывающем полипептиде, тогда как в других воплощениях один или несколько цистеиновых остатков добавляют в связывающий полипептид с помощью методов генной инженерии. Чтобы в полипептид ввести цистеиновые остатки, последовательность, кодирующую связывающий полипептид, подвергают мутациям. Этого можно достичь, например, путем замены одного или нескольких аминокислотных остатков на цистеин. Предпочтительные аминокислоты, подходящие для замены на цистеин, включают в себя серин, треонин, аланин и другие гидрофильные остатки. Предпочтительно, остаток, заменяемый на цистеин, представляет собой остаток, экспонированный на поверхности. В данной области хорошо известны алгоритмы, позволяющие предсказать поверхностную доступность остатков на основе первичной последовательности белка. Альтернативно, поверхностные остатки можно предсказать путем сравнения аминокислотных последовательностей связывающих полипептидов при условии, что раскрыта кристаллическая структура каркасного участка, на основе которого создают и разрабатывают связывающие полипептиды (см. Himanen et al., Nature. (2001) 20-27; 414 (6866): 933-8), и, следовательно, идентифицированы экспонированные на поверхности остатки. В одном воплощении цистеиновые остатки вводят в связывающие полипептиды в области N- и/или C-конца, или вблизи от N- и/или C-конца, или в петлеобразных участках.
В некоторых воплощениях пэгилированный связывающий полипептид содержит молекулу PEG, ковалентно связанную с альфа-аминогруппой N-концевой аминокислоты. Сайт-специфическое N-концевое восстановительное аминирование описано в Pepinsky et al., (2001) JPET, 297, 1059 и патенте США № 5824784. Применение PEG-альдегида для восстановительного аминирования белка с использованием других доступных нуклеофильных аминогрупп описано в патенте США № 4002531, в Wieder et al., (1979) J. Biol. Chem. 254, 12579, и в Chamow et al., (1994) Bioconjugate Chem. 5, 133.
В другом воплощении пэгилированный связывающий полипептид содержит одну или несколько молекул PEG, ковалентно связанных с линкером, который, в свою очередь, соединен с альфа-аминогруппой аминокислотного остатка на N-конце связывающего полипептида. Такой способ описан в патентной публикации США № 2002/0044921 и в W094/01451.
В одном воплощении связывающий полипептид пэгилируют по C-концу. В конкретном воплощении белок пэгилируют по C-концу путем введения C-концевого азидометионина с последующей конъюгацией метил-PEG-триарилфосфинового соединения посредством реакции Штаудингера. Данный способ C-концевой конъюгации описан в Cazalis et al., C-Terminal Site-Specific PEGylation of a Truncated Thrombomodulin Mutant with Retention of Full Bioactivity, Bioconjug Chem. 2004; 15 (5): 1005-1009.
Монопэгилирование связывающего полипептида также можно осуществлять в соответствии с общими способами, описанными в WO 94/01451. В WO 94/01451 описан способ получения рекомбинантного полипептида, содержащего модифицированную концевую аминокислоту с реакционноспособной группой при альфа-углеродном атоме. Стадии данного метода включают в себя получение рекомбинантного полипептида и защиту его одной или несколькими биологически добавленными защитными группами по N-концевой альфа-аминогруппе и C-концевой альфа-карбоксильной группе. Затем полипептид можно подвергнуть взаимодействию с химическими защитными средствами, чтобы селективно защитить реакционноспособные группы боковых цепей и таким образом предотвратить их модификацию. Затем полипептид расщепляют расщепляющим реагентом, специфичным для биологической защитной группы с получением незащищенной концевой альфа-углеродной реакционно-способной группы аминокислоты. Незащищенную концевую альфа-углеродную реакционно-способную группу аминокислоты модифицируют, используя химический модифицирующий агент. Затем однокопийный полипептид с защищенной боковой цепью, модифицированный по концевой группе, подвергают удалению защитных групп с боковой цепи и получают модифицированный по концевой группе рекомбинантный однокопийный полипептид. Число и последовательность стадий в данном методе можно варьировать с целью достижения селективной модификации N- и/или C-концевой аминокислоты полипептида.
Отношение связывающего полипептида к активированному PEG в реакции конъюгации может составлять приблизительно от 1:0,5 до 1:50, приблизительно от 1:1 до 1:30 или приблизительно от 1:5 до 1:15. Чтобы катализировать ковалентное присоединение PEG к связывающему полипептиду, в способе настоящего изобретения можно использовать разные водные буферы. В одном воплощении pH используемого буфера составляет приблизительно от 7,0 до 9,0. В другом воплощении pH находится в слабощелочном интервале, например приблизительно от 7,5 до 8,5. Можно использовать буферы, имеющие pKa, близкий к нейтральному интервалу pH, например фосфатный буфер.
Для очистки пэгилированного связывающего полипептида можно использовать традиционные методы разделения и очистки, известные в данной области, такие как исключение по размеру (например, гель-фильтрация) и ионно-обменная хроматография. Продукты также можно разделить методом SDS-PAGE. Продукты, которые можно разделить, включают в себя моно-, ди-, три-, поли- и непэгилированные связывающие полипептиды, а также свободный PEG. Процент монопэгилированных конъюгатов можно регулировать путем объединения более широкого диапазона фракций вблизи пика элюции с увеличением процента моно-PEG в композиции. Приблизительно девяносто процентов монопэгилированных конъюгатов дает хороший баланс выхода и активности. Могут быть желательными композиции, в которых, например, по меньшей мере, девяносто два процента или, по меньшей мере, девяносто шесть процентов конъюгатов являются монопэгилированными. В воплощении данного изобретения процент монопэгилированных конъюгатов варьирует от девяноста процентов до девяносто шести процентов.
В одном воплощении пэгилированный связывающий полипептид данного изобретения содержит один, два или более фрагментов PEG. В одном воплощении фрагмент(ы) PEG связаны с аминокислотным остатком, который находится на поверхности белка и/или далеко от поверхности, которая контактирует с лигандом-мишенью. В одном воплощении объединенная или общая молекулярная масса PEG в PEG-связывающем полипептиде составляет приблизительно от 3000 Да до 60000 Да, необязательно приблизительно от 10000 Да до 36000 Да. В одном воплощении PEG в пэгилированном связывающем полипептиде представляет собой по существу линейный PEG с прямой цепью.
В одном воплощении данного изобретения не происходит гидролизного отщепления PEG от пэгилированного аминокислотного остатка связывающего полипептида при анализе с использованием гидроксиламина, например 450 мМ гидроксиламина (pH 6,5) в течение 8-16 часов при комнатной температуре, следовательно, конъюгат является стабильным. В одном воплощении стабильный конъюгат моно-PEG-связывающий полипептид составляет более 80%, более предпочтительно, по меньшей мере, 90% и, наиболее предпочтительно, по меньшей мере, 95% от массы композиции.
В другом воплощении пэгилированные связывающие полипептиды данного изобретения предпочтительно сохраняют, по меньшей мере, 25%, 50%, 60%, 70%, по меньшей мере, 80%, 85%, 90%, 95% или 100% от биологической активности немодифицированного белка. В одном воплощении биологическая активность относится к способности связываться с VEGFR-2, которую оценивают с помощью KD, kon или koff. В конкретном воплощении пэгилированный связывающий полипептид обладает повышенной способностью связывать VEGFR по сравнению с непэгилированным связывающим полипептидом.
Скорость выведения из сыворотки PEG-модифицированного полипептида может быть уменьшена приблизительно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или даже 90% по отношению к скорости выведения немодифицированного связывающего полипептида. Период полужизни (t1/2) PEG-модифицированного полипептида может быть выше, чем у немодифицированного белка. Период полужизни PEG-связывающего полипептида может быть увеличен, по меньшей мере, на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 125%, 150%, 175%, 200%, 250%, 300%, 400% или 500%, или даже на 1000% по отношению к периоду полужизни немодифицированного связывающего полипептида. В некоторых воплощениях период полужизни белка определяют in vitro, например, в забуференном физиологическом растворе или в сыворотке. В других воплощениях период полужизни представляет собой период полужизни in vivo, например период полужизни белка в сыворотке или в другой жидкости организма животного.
5. Терапевтические композиции и способы введения
Настоящее изобретение предлагает способы лечения состояний или профилактики предсостояний, которые отвечают на ингибирование биологической активности VEGF. Предпочтительными примерами являются состояния, которые характеризуются аномальным ангиогенезом. Способы введения и дозы варьируют в зависимости от типа конкретного полипептида и конкретного состояния, подлежащего лечению, но легко устанавливаются опытным специалистом. Как правило, разрешительные органы требуют, чтобы белковый реагент, используемый в качестве терапевтического средства, имел состав с приемлемо низким уровнем пирогенов. Соответственно, терапевтические композиции обычно отличаются от других композиций тем, что они практически не содержат пирогена или, по меньшей мере, содержат не более, чем приемлемые уровни пирогена, которые определяются соответствующим разрешительным органом (например, Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA)).
Терапевтические композиции настоящего изобретения можно вводить вместе с фармацевтически приемлемым разбавителем, носителем или наполнителем в виде стандартной лекарственной формы. Неограничивающими примерами способов введения являются парентеральное (например, внутривенное, подкожное), пероральное или местное введение. Кроме того, можно использовать любой метод генной терапии с использованием нуклеиновых кислот, кодирующих полипептиды данного изобретения, такой как доставка "оголенной" ДНК, рекомбинантные гены и векторы, доставка на клеточной основе, в том числе ex vivo манипуляции с клетками пациентов и т.п.
Композиция может находиться в виде пилюли, таблетки, капсулы, жидкости или таблетки с замедленным высвобождением для перорального введения; или жидкости для внутривенного, подкожного или парентерального введения; геля, лосьона, мази, крема или полимера, или другого средства для местного введения с замедленным высвобождением.
Хорошо известные в данной области способы получения композиций можно найти, например, в "Remington: The Science and Practice of Pharmacy" (20th ed., ed. A. R. Gennaro AR., 2000, Lippincott Williams & Wilkins, Philadelphia, PA). Композиции для парентерального введения могут содержать, например, наполнители, стерильную воду, физиологический раствор, полиалкиленгликоли, например полиэтиленгликоль, растительные масла или гидрированные нафталины. Для регуляции высвобождения соединений можно использовать биосовместимый, биоразрушаемый лактидный полимер, лактид/гликолидный сополимер, или полиоксиэтилен-полиоксипропиленовые сополимеры. Для регуляции биораспределения соединений можно использовать композиции, содержащие наночастицы (например, биоразрушаемые наночастицы, твердые липидные наночастицы, липосомы). Также можно использовать другие системы парентеральной доставки, которые включают в себя частицы этилен-винилацетатного сополимера, осмотические насосы, имплантируемые инфузионные системы и липосомы. Концентрация соединения в композиции варьирует в зависимости от ряда факторов, включающих в себя вводимую дозу лекарственного средства и способ введения.
Полипептид можно вводить в виде фармацевтически приемлемых солей, таких как нетоксичные кислотно-аддитивные соли или комплексы металлов, которые обычно используются в фармацевтической промышленности. Примеры кислотно-аддитивных солей включают в себя соли органических кислот, таких как уксусная, молочная, памоевая, малеиновая, лимонная, яблочная, аскорбиновая, щавелевая, бензойная, пальмитиновая, пробковая, салициловая, винная, метансульфоновая, толуолсульфоновая или трифторуксусная кислота и т.п.; полимерных кислот, таких как дубильная кислота, карбоксиметилцеллюлоза и т.п.; и неорганических кислот, таких как соляная кислота, бромистоводородная кислота, серная кислота и фосфорная кислота и т.п. Комплексы металлов включают в себя комплексы цинка, железа и т.п. В одном примере в состав композиции полипептида вводят ацетат натрия для увеличения термической стабильности.
Композиции для перорального применения включают в себя таблетки, содержащие активный ингредиент (активные ингредиенты) в смеси с нетоксичными фармацевтически приемлемыми наполнителями. Данные наполнители могут представлять собой, например, инертные разбавители или наполнители (например, сахароза или сорбитол), смазывающие средства, средства, обеспечивающие скольжение, и средства, препятствующие склеиванию (например, стеарат магния, стеарат цинка, стеариновая кислота, оксиды кремния, гидрированные растительные масла или тальк).
Композиции для перорального применения также можно получить в виде жевательных таблеток или твердых желатиновых капсул, где активный ингредиент смешан с инертным твердым разбавителем, или в виде мягких желатиновых капсул, где активный ингредиент смешан с водной или масляной средой.
Терапевтически эффективной дозой называется доза, которая вызывает желательные терапевтические эффекты. Точная доза зависит от нарушения, подлежащего лечению, и может быть установлена специалистом в данной области с помощью известных методов. Как правило, полипептид вводят в дозе, составляющей приблизительно от 0,01 мкг/кг до 50 мкг/кг в день, предпочтительно, от 0,01 мкг/кг до приблизительно 30 мкг/кг в день, наиболее предпочтительно, от 0,1 мкг/кг до приблизительно 20 мкг/кг в день. Полипептид можно принимать ежедневно (например, один, два, три или четыре раза в день) или реже (например, через день, один или два раза в неделю или месяц). Кроме того, как известно в данной области, иногда дозу необходимо корректировать в зависимости от возраста, массы тела, общего состояния здоровья, пола, диеты, времени введения, взаимодействия лекарственных препаратов и тяжести заболевания, данную корректировку производит специалист в данной области с помощью стандартных экспериментов.
6. Примерное использование
VEGFR-2-связывающие белки, описанные в данном документе, и родственные им варианты используются в ряде терапевтических и диагностических применений. Данные применения включают в себя ингибирование биологической активности VEGF путем конкуренции за связывание с VEGFR-2 или блокирования связывания VEGFR-2, а также доставку цитотоксических или визуализирующих фрагментов к клеткам, предпочтительно, к клеткам, экспрессирующим VEGFR-2.
Маленький размер и стабильная структура данных молекул могут быть особенно полезными для производства лекарственного препарата, быстрого выведения из организма при некоторых применениях, где желательно быстрое выведение, или для введения в состав новых систем доставки, которые подходят для использования молекул с такими характеристиками, или улучшаются при использовании таких молекул.
Поскольку полипептиды данного изобретения ингибируют биологическую активность VEGF, они являются эффективными против ряда состояний, связанных с аномальным ангиогенезом, которые включают в себя, без ограничения, аутоиммунные нарушения (например, ревматоидный артрит, воспалительную болезнь кишечника или псориаз); сердечные заболевания (например, атеросклероз или рестеноз кровеносных сосудов); ретинопатии (например, большинство пролиферативных ретинопатий, диабетическая ретинопатия, возрастная дегенерация желтого пятна или реваскуляризационная глаукома), почечную болезнь (например, диабетическую нефропатию, злокачественный нефросклероз, синдромы тромбозной микроангиопатии; отторжение трансплантата; воспалительную болезнь почек; гломерулонефрит; мезангиопролиферативный гломерулонефрит; гемолитический-уремический синдром; и гипертензивный нефросклероз); гемангиобластому; гемангиомы; тиреоидную гиперплазию; тканевые трансплантанты; хроническое воспаление; синдром Мейджа; экссудативный перикардит; плевральный выпот; аутоиммунные заболевания; диабет; эндометриоз; хроническую астму; нежелательный фиброз (особенно, печеночный фиброз) и рак, а также осложнения при раке, такие как плевральный выпот и асцит. Предпочтительно, VEGFR-связывающие полипептиды данного изобретения можно использовать для лечения или профилактики гиперпролиферативных заболеваний или рака и метастатического распространения рака. Неограничивающие примеры раковых заболеваний включают в себя рак мочевого пузыря, крови, костей, мозга, молочной железы, хрящей, толстой кишки, почек, печени, легких, лимфатических узлов, нервной ткани, яичников, поджелудочной железы, простаты, скелетной мускулатуры, кожи, спинного мозга, селезенки, желудка, яичек, тимуса, щитовидной железы, трахеи, мочеполовых путей, мочеточников, уретры, матки или влагалища. Другие поддающиеся лечению состояния можно найти в U.S.P.N. 6524583, включенном в данное описание в качестве ссылки. Другие ссылки, описывающие применение VEGFR-2-связывающих полипептидов, включают в себя: McLeod DS et al., Invest Ophthalmol Vis Sci. 2002 Feb; 43 (2): 474-82; Watanabe et al. Exp Dermatol. 2004 Nov; 13(11): 671-81; Yoshiji H et al., Gut. 2003 Sep; 52 (9): 1347-54; Verheul et al., Oncologist. 2000; 5 Suppl 1: 45-50; Boldicke et al., Stem Cells. 2001; 19(1): 24-36.
Как описано в данном документе, связанные с ангиогенезом заболевания включают в себя, не ограничиваясь ими, ангиогенеззависимый рак, в том числе, например, солидные опухоли, опухоли кроветворных органов, такие как лейкемии и опухолевые метастазы; доброкачественные опухоли, например гемангиомы, акустические нейромы, нейрофибромы, трахомы и пиогенные гранулемы; воспалительные нарушения, такие как иммунное и неиммунное воспаление; хронический суставный ревматизм и псориаз; глазные ангиогенные заболевания, например диабетическая ретинопатия, ретинопатия преждевременного созревания, дегенерация желтого пятна, отторжение трансплантированной роговицы, реваскуляризационная глаукома, ретролетальная фиброплазия, покраснение радужки; синдром Ослер-Вебера (Osler-Webber); миокардиальный ангиогенез; реваскуляризация бляшек; телеангиэктазия; гемофильные суставы; ангиофиброма; грануляция раны и заживление раны; телеангиэктазийная псориазная склеродермия, пиогенная гранулема, коронарные коллатерали, ангиогенез ишемизированных конечностей, заболевания роговицы, покраснение радужки, артрит, диабетическая реваскуляризация, разрывы, образование и развитие сосудов, гематопоэз.
VEGFR-2-связывающий полипептид можно вводить отдельно или в сочетании с одной или несколькими другими терапиями, такими как химиотерапия, радиотерапия, иммунотерапия, хирургическое вмешательство, или с любым сочетанием указанных терапий. Как указано выше, длительная терапия является равновозможной как дополнительная терапия в контексте других стратегий лечения.
В некоторых воплощениях таких способов один или несколько из полипептидных терапевтических средств можно вводить вместе (одновременно) или в разное время (последовательно). Кроме того, полипептидные терапевтические средства можно вводить вместе с другим типом соединений для лечения рака или для ингибирования ангиогенеза.
В некоторых воплощениях испытуемые терапевтические средства данного изобретения можно вводить отдельно. Альтернативно, испытуемые средства можно использовать в сочетании с другими традиционными противораковыми терапевтическими способами, направленными на лечение или профилактику пролиферативных заболеваний (например, опухоли). Например, такие способы можно использовать для профилактики рака, предотвращения рецидивов рака и метастазирования после хирургического вмешательства, а также в качестве дополнения к другой традиционной раковой терапии. Настоящее изобретение показывает, что эффективность традиционных противораковых терапий (например, химиотерапии, лучевой терапии, фототерапии, иммунотерапии и хирургического вмешательства) можно повысить путем применения испытуемого полипептидного терапевтического средства.
Было показано, что широкий ряд традиционных соединений обладает противоопухолевой активностью. Данные соединения использовались в химиотерапии в качестве фармацевтических средств для уменьшения размера солидных опухолей, предотвращения метастазирования и роста опухолей или для уменьшения числа злокачественных клеток при лейкемии или злокачественных заболеваниях костного мозга. Хотя химиотерапия является эффективным способом лечения разных типов злокачественных заболеваний, многие противоопухолевые соединения вызывают нежелательные побочные эффекты. Было показано, что при объединении двух или более способов лечения данные способы могут действовать синергически, что позволяет снизить дозу каждого лекарственного средства и таким образом уменьшить вредные побочные эффекты, оказываемые каждым соединением в более высоких дозах. В других случаях неподдающиеся лечению злокачественные заболевания могут отвечать на сочетание двух или более разных способов лечения.
Если полипептидное терапевтическое средство настоящего изобретения вводят в сочетании с другим традиционным противоопухолевым средством либо совместно, либо последовательно, такое терапевтическое средство может увеличивать терапевтический эффект противоопухолевого средства или преодолевать устойчивость клеток к такому противоопухолевому средству. Это позволяет снизить дозу противоопухолевого средства и, следовательно, уменьшить нежелательные побочные эффекты или восстановить эффективность противоопухолевого средства в устойчивых клетках.
Фармацевтические соединения, которые можно использовать для комбинаторной противоопухолевой терапии, включают в себя в качестве иллюстративных примеров: аминоглутетимид, амсакрин, анастрозол, аспарагиназу, bcg, бикалютамид, блеомицин, бусерелин, бусульфан, кампотецин, капецитабин, карбоплатин, кармустин, хлорамбуцил, цисплатин, кладрибин, клодронат, колхицин, циклофосфамид, ципротерон, цитарабин, дакарбазин, дактиномицин, даунорубицин, диенестрол, диэтилстилбестрол, доцетаксел, доксорубицин, эпирубицин, эстрадиол, эстрамустин, этопозид, экземестан, филграстим, флударабин, флудрокортизон, фторурацил, флюоксиместерон, флутамид, гемцитабин, генистейн, гозерелин, гидроксимочевину, идарубицин, ифосфамид, иматиниб, интерферон, иринотекан, иронотекан, летрозол, лейковорин, лейпролид, левамизол, ломустин, мехлоретамин, медроксипрогестерон, мегестрол, мелфалан, меркаптопурин, месну, метотрексат, митомицин, митотан, митоксантрон, нилутамид, нокодазол, октреотид, оксалиплатин, паклитаксел, памидронат, пентостатин, пликамицин, порфимер, прокарбазин, ралтитрексед, ритуксимаб, стрептозоцин, сурамин, тамоксифен, темозоломид, тенипозид, тестостерон, тиогуанин, тиотепу, титаноцена дихлорид, топотекан, трастузумаб, третиноин, винбластин, винкристин, виндезин и винорелбин.
Некоторые химиотерапевтические противоопухолевые соединения можно подразделить по механизму действия, например, на следующие группы: антиметаболиты/противораковые средства, такие как пиримидиновые аналоги (5-фторурацил, флоксуридин, капецитабин, гемцитабин и цитарабин) и аналоги пуринов, антагонисты фолата и родственные ингибиторы (меркаптопурин, тиогуанин, пентостатин и 2-хлордезоксиаденозин (кладрибин)); антипролиферативные/антимитотические средства, включающие в себя природные продукты, такие как алкалоиды барвинка (винбластин, винкристин и винорелбин), дезинтеграторы микротрубочек, такие как таксан (паклитаксел, доцетаксел), винкристин, винбластин, нокодазол, эпотилоны и навелбин, эпидиподофиллотоксины (этопозид, тенипозид), средства, разрушающие ДНК (актиномицин, амсакрин, антрациклины, блеомицин, бусульфан, камптотецин, карбоплатин, хлорамбуцил, цисплатин, циклофосфамид, цитоксан, дактиномицин, даунорубицин, доксорубицин, эпирубицин, гексаметилмеламиноксалиплатин, ифосфамид, мелфалан, мерхлорэфтамин, митомицин, митоксантрон, нитрозомочевина, пликамицин, прокарбазин, таксол, таксотер, тенипозид, триэтилентиофосфорамид и этопозид (VP16)); антибиотики, такие как дактиномицин (актиномицин D), даунорубицин, доксорубицин (адриамицин), идарубицин, антрациклины, митоксантрон, блеомицины, пликамицин (митрамицин) и митомицин; ферменты (L-аспарагиназа, которая системно метаболизирует L-аспарагин и удаляет клетки, которые не способны синтезировать собственный аспарагин); антитромбоцитарные средства; антипролиферативные/антимитотические алкилирующие средства, такие как азотистые иприты (мехлорэтамин, циклофосфамид и аналоги, мелфалан, хлорамбуцил), этиленимины и метилмеламины (гексаметилмеламин и тиотепа), алкилсульфонаты-бусульфан, нитрозомочевины (кармустин (BCNU) и аналоги, стрептозоцин), тразены-дакарбазинин (DTIC); антипролиферативные/антимитотические антиметаболиты, такие как аналоги фолиевой кислоты (метотрексат); координационные комплексы платины (цисплатин, карбоплатин), прокарбазин, гидроксимочевина, митотан, аминоглутетимид; гормоны, аналоги гормонов (эстроген, тамоксифен, гозерелин, бикалутамид, нилутамид) и ингибиторы ароматазы (летрозол, анастрозол); антикоагулянты (гепарин, синтетические соли гепарина и другие ингибиторы тромбина); фибринолитические средства (такие, как тканевый активатор плазминогена, стрептокиназа и урокиназа), аспирин, дипиридамол, тиклопидин, клопидогрел, абциксимаб; средства, подавляющие миграцию; средства, подавляющие секрецию (бревелдин); иммуносупрессоры (циклоспорин, такролимус (FK-506), сиролимус (рапамицин), азатиоприн, микофенолят мофетил); противоангиогенные соединения (TNP-470, генистеин) и ингибиторы факторов роста (например, ингибиторы VEGF, инигбиторы фактора роста фибробластов (FGF)); блокатор рецептора ангиотензина; доноры оксида азота; антисмысловые олигонуклеотиды; антитела (трастузумаб); ингибиторы клеточного цикла и индукторы дифференциации (третиноин); ингибиторы mTOR, ингибиторы топоизомеразы (доксорубицин (адриамицин), амсакрин, камптотецин, даунорубицин, дактиномицин, энипозид, эпирубицин, этопозид, идарубицин и митоксантрон, топотекан, иринотекан), кортикостероиды (кортизон, дексаметазон, гидрокортизон, метилпреднизолон, преднизон и преднизолон); киназные ингибиторы передачи сигнала, опосредованной фактором роста; индукторы митохондриальной дисфункции и активаторы каспазы; а также средства, разрушающие хроматин.
В некоторых воплощениях фармацевтические соединения, которые можно использовать для сочетанной терапии против ангиогенза, включают в себя: (1) ингибиторы высвобождения "ангиогенных молекул", такие как bFGF (основной фактор роста фибробластов); (2) средства, нейтрализующие ангиогенные молекулы, такие как антитела против βbFGF; и (3) ингибиторы ответа эндотелиальных клеток на ангиогенные стимулы, включающие в себя ингибитор коллагеназы, ингибиторы выворачивания мембраны, ангиостатические стероиды, грибковые ингибиторы ангиогенеза, тромбоцитарный фактор 4, тромбоспондин, противоартритные средства, такие как D-пеницилламин и золотой тиомалат, аналоги витамина D3, альфа-интерферон и т.п. другие ингибиторы ангиогенеза можно найти в Blood et al., Bioch. Biophys. Acta., 1032: 89-118 (1990), Moses et al., Science, 248: 1408-1410 (1990), Ingber et al., Lab. Invest., 59: 44-51 (1988) и в патентах США № 5092885, 5112946, 5192744, 5202352 и 6573256. Кроме того, существует широкий ряд соединений, которые можно использовать для ингибирования ангиогенеза, например белок эндостатин и его производные, фрагменты ангиостатина, связывающие лизин, меланин или меланин-стимулирующие соединения, фрагменты плазминогена (например, Kringles 1-3 плазминогена), субъединицы тропоина, антагонисты витронектина αvβ3, пептиды, полученные из сапосина B, антибиотики или аналоги (например, тетрациклин или неомицин), диеногестсодержащие композиции, соединения, содержащие MetAP-2 ингибиторное ядро, связанное с пептидом, соединение EM-138, халкон и его аналоги, а также ингибиторы нааладазы. См., например, патенты США № 6395718, 6462075, 6465431, 6475784, 6482802, 6482810, 6500431, 6500924, 6518298, 6521439, 6525019, 6538103, 6544758, 6544947, 6548477, 6559126 и 6569845.
В зависимости от природы лекарственных средств, использующихся для сочетанной терапии, введение полипептидных терапевтических средств данного изобретения можно осуществлять одновременно с введением другого лекарственного средства, и/или после него. Введение полипептидных терапевтических средств можно осуществлять в виде однократной дозы или в виде нескольких доз. В некоторых случаях введение полипептидных терапевтических средств начинают, по меньшей мере, за несколько дней до традиционной терапии, тогда как в других случаях введение начинают либо непосредственно перед введением традиционного лекарственного средства, либо одновременно с ним.
Описанные в данном документе VEGFR-2-связывающие белки также можно пометить детектируемой меткой и использовать для визуализации и диагностики в качестве соединения, связывающегося с клетками, экспрессирующими VEGFR-2. Для диагностических целей полипептид данного изобретения предпочтительно иммобилизуют на твердом носителе. Предпочтительные твердые носители включают в себя колонки (например, аффинные колонки, например агарозные аффинные колонки), микрочипы или шарики.
В одном примере диагностического применения биологический образец, такой как сыворотка или образец ткани для биопсии, взятый у пациента, предположительно имеющего состояние, характеризующееся аномальным ангиогенезом, приводят в контакт с полипептидом данного изобретения, меченным детектируемой меткой, чтобы определить уровень VEGFR-2. Затем измеренный уровень VEGFR-2 сравнивают с уровнем VEGFR-2 в нормальном образце, который также определяют путем приведения образца в контакт с меченным полипептидом. Увеличение уровня VEGFR-2, по меньшей мере, на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или 90% может считаться диагностическим показателем состояния, характеризующегося аномальным ангиогенезом.
В некоторых воплощениях VEGFR-2-связывающие полипептиды данного изобретения также соединяют с детектируемой меткой (например, метка может представлять собой радиоизотоп, флуоресцентное соединение, фермент или кофактор фермента). Активный фрагмент может представлять собой радиоактивный агент, такой как: радиоактивные тяжелые металлы, например хелаты железа, радиоактивные хелаты гадолиния или марганца, позитронные эмиттеры кислорода, азота, железа, углерода или галлия, 43K, 52Fe, 57Co, 67Cu, 67Ga, 68Ga, 123I, 125I, 131I, 132I или 99Tc. Связывающий агент, присоединенный к такому фрагменту, можно использовать в качестве визуализирующего средства и вводить в количестве, эффективном для диагностического применения, млекопитающему, такому как человек, с последующей детекцией локализации и аккумуляции визуализирующего средства. Локализацию и аккумулляцию визуализирующего средства можно детектировать методом радиосцинтиграфии, ядерно-магнитно-резонансной томографии, компьютерной томографии или позитронно-эмиссионной томографии. Иммуносцинтиграфию с использованием VEGFR-2-связывающих полипептидов, направленную на VEGFR, можно использовать для детекции и/или диагностики раковых заболеваний и образования сосудов. Например, для такой визуализации можно эффективно использовать любой из VEGFR-2-связывающих полипептидов, содержащих маркер, меченный 99технецием, 111индием или 125иодом. Для опытного специалиста очевидно, что количество вводимого радиоизотопа зависит от вида радиоизотопа. Рядовые специалисты в данной области могут легко определить количество вводимого визуализирующего средства исходя из удельной активности и энергии конкретного радионуклида, используемого в качестве активного фрагмента. Как правило, вводят 0,1-100 милликюри на дозу визуализирующего средства, предпочтительно 1-10 милликюри, чаще всего 2-5 милликюри. Так, композиции настоящего изобретения, используемые в качестве визуализирующих средств, содержащие нацеливающий фрагмент, конъюгированный с радиоактивным фрагментом, содержат 0,1-100 милликюри, в некоторых воплощениях предпочтительно 1-10 милликюри, в некоторых воплощениях предпочтительно 2-5 милликюри, в некоторых воплощениях более предпочтительно 1-5 милликюри.
VEGFR-2-связывающие полипептиды настоящего изобретения также можно использовать для доставки других терапевтических средств (включающих в себя, без ограничения, лекарственные соединения, химиотерапевтические соединения и радиотерапевтические соединения) к клеткам или тканям, экспрессирующим VEGFR-2. В одном примере VEGFR-2-связывающий полипептид соединяют с химиотерапевтическим средством для направленной доставки химиотерапевтического средства к опухолевым клеткам или тканям, экспрессирующим VEGFR-2.
VEGFR-2-связывающие полипептиды настоящего изобретения могут иметь разные применения, в том числе исследовательские, диагностические и терапевтические применения. Например, их можно использовать для выделения и/или очистки рецептора или его фрагментов и для исследования структуры (например, конформации) и функции рецептора.
В некоторых аспектах различные связывающие полипептиды настоящего изобретения можно использовать для детекции или измерения экспрессии VEGFR-2, например, в эндотелиальных клетках (таких, как венозные эндотелиальные клетки), или в клетках, трансфицированных геном VEGFR-2. Следовательно, их можно использовать, например, для сортинга и визуализации клеток (например, с использованием проточной цитометрии и клеточного сортинга с активацией флуоресценцией) для диагностических или исследовательских целей.
В некоторых воплощениях для диагностических целей используются меченные или немеченные связывающие полипептиды или их фрагменты. Как правило, диагностические анализы проводят путем детекции комплекса, образующегося в результате связывания связывающего полипептида с VEGFR-2. Связывающие полипептиды или их фрагменты можно метить непосредственно подобно антителам. Можно использовать ряд меток, включающих в себя, без ограничения, радионуклиды, флуоресцентные фрагменты, ферменты, субстраты ферментов, кофакторы ферментов, ингибиторы и лиганды ферментов (например, биотин, гаптены). Специалистам в данной области известны многочисленные подходящие иммунологические анализы (см., например, патенты США № 3817827; 3850752; 3901654 и 4098876). Немеченные связывающие полипептиды можно использовать в таких анализах, как анализ агглютинации. Немеченные связывающие полипептиды также можно использовать в сочетании с другим (одним или несколькими) подходящим реагентом, который можно использовать для детекции связывающего полипептида, например с меченным антителом, взаимодействующим со связывающим полипептидом, или с другим подходящим реагентом (например, с меченным белком A).
В одном воплощении связывающие полипептиды настоящего изобретения можно использовать в иммуноферментных анализах, где исследуемые полипептиды подвергают конъюгации с ферментом. Если биологический образец, содержащий белок VEGFR-2, объединяют с испытуемыми связывающими полипептидами, происходит связывание между связывающими полипептидами и белком VEGFR-2. В одном воплощении образец, содержащий клетки, экспрессирующие белок VEGFR (например, эндотелиальные клетки), объединяют с испытуемыми антителами, после чего происходит связывание связывающих полипептидов с клетками, несущими белок VEGFR-2, распознаваемый связывающим полипептидом. Связанные клетки можно отделить от несвязанных реагентов и затем можно определить наличие конъюгата связывающий полипептид-фермент, связанного с клетками, например, путем приведения в контакт образца и субстрата фермента, который при воздействии фермента продуцирует окрашивание или другое детектируемое изменение. В другом воплощении испытуемые связывающие полипептиды могут быть немеченными, но они могут использоваться вместе со вторым меченным полипептидом (например, антителом), который распознает испытуемый связывающий полипептид.
В некоторых аспектах также могут быть получены наборы для определения присутствия белка VEGFR-2 в биологическом образце. Такие наборы содержат VEGFR-2-связывающий полипептид, который связывается с белком VEGFR-2 или с фрагментом указанного рецептора, а также один или несколько дополнительных реагентов, подходящих для определения присутствия комплекса связывающего полипептида с рецепторным белком или его фрагментами. Полипептидные композиции настоящего изобретения могут предоставляться в лиофилизованном виде либо отдельно, либо в сочетании с другими антителами, специфичными к другим эпитопам. Связывающие полипептиды и/или антитела, которые могут быть меченными или немеченными, могут входить в состав наборов вместе с вспомогательными ингредиентами (такими, как буферы, например Tris, фосфатный и карбонатный, стабилизаторы, наполнители, биоциды и/или инертные белки, например бычий сывороточный альбумин). Например, связывающие полипептиды и/или антитела могут предоставляться в виде лиофилизированной смеси, содержащей вспомогательные ингредиенты, либо вспомогательные ингредиенты могут предоставляться отдельно и объединяться с другими компонентами по усмотрению пользователя. Как правило, данные вспомогательные вещества присутствуют в количестве, составляющем менее 5% по отношению к массе активного связывающего полипептида или антитела, и обычно общее количество вспомогательных веществ составляет, по меньшей мере, приблизительно 0,001% по отношению к концентрации полипептида или антитела. Если используется второе антитело, способное связывать связывающий полипептид, такое антитело может предоставляться в наборе, например в отдельном флаконе или контейнере. Если второе антитело присутствует, оно обычно бывает меченным и может входить в состав композиции, аналогичной описанным выше композициям антител.
Подобным образом, настоящее изобретение также относится к способу детекции и/или количественного определения экспрессии VEGFR-2, где композицию, содержащую клетку или ее фракцию (например, мембранную фракцию), приводят в контакт со связывающим полипептидом, который связывается с VEGFR-2 или с фрагментом рецептора в условиях, подходящих для их связывания, и связывание регистрируют. Детекция связывающего полипептида, свидетельствующая об образовании комплекса связывающего полипептида с VEGFR-2 или с его фрагментом, указывает на присутствие рецептора. Связывание полипептида с клеткой можно определить с помощью стандартных методов, таких как описаны в рабочих примерах. Можно использовать метод детекции экспрессии VEGFR-2 на клетках, взятых у субъекта. Количественное определение экспрессии VEGFR-2 на поверхности эндотелиальных клеток можно проводить, например, путем проточной цитометрии, причем интенсивность окрашивания может коррелировать с предрасположенностью к заболеванию, развитием заболевания или риском возникновения заболевания.
Настоящее изобретение также относится к способу определения предрасположенности млекопитающего к некоторым заболеваниям. Например, данный способ можно использовать для определения предрасположенности млекопитающего к заболеваниям, развитие которых связано с количеством VEGFR-2, присутствующего на поверхности клеток, и/или с числом VEGFR-2-положительных клеток у млекопитающего. В одном воплощении данное изобретение относится к определению предрасположенности млекопитающего к опухолевому заболеванию. В данном воплощении анализируемый образец приводят в контакт со связывающим полипептидом, который связывается с VEGFR-2, или с его фрагментом в условиях, подходящих для их связывания, где образец содержит клетки, которые у нормальных субъектов экспрессируют VEGFR-2. Определяют связывание и/или количество связывания, которое характеризует предрасположенность субъекта к опухолевому заболеванию, где повышенные уровни рецептора коррелируют с повышенной предрасположенностью субъекта к опухолевому заболеванию.
ПРИМЕРЫ
Нижеследующие примеры приведены для иллюстрации данного изобретения и не должны истолковываться как ограничивающие.
Пример 1. Начальная идентификация молекул, связывающих KDR
Библиотеку, содержащую приблизительно 1013 вариантов гибридов РНК-белок, получали на основе десятого домена человеческого фибронектина типа 3, содержащего три рандомизированных участка в положениях 23-29, 52-55 и 77-86 (номера аминокислот соответствуют нумерации SEQ ID NO: 5) (библиотека трех петель; Xu et al, Chemistry & Biology 9: 933-942, 2002). Получали подобные библиотеки, содержащие рандомизированные участки только в положениях 23-29 и 77-86 (библиотека двух петель) или только в положениях 77-86 (библиотека одной петли). Смесь трех полученных библиотек использовали для селекции in vitro против внеклеточного домена человеческого VEGFR-2 (KDR, внеклеточный домен, остатки 1-764 сопряженные с Fc человеческого IgG1). В соответствии с данным применением положения аминокислотных остатков в петлях определяли как остатки 23-30 (петля BC), 52-56 (петля DE) и 77-87 (петля FG). Связывающую мишень популяцию анализировали путем секвенирования ДНК после шести циклов селекции и обнаруживали, что она является разнотипной с некоторым количеством повторов. Белки, кодируемые пятнадцатью независимыми клонами, подвергали скринингу по связыванию с KDR (фиг.1A) и затем молекулы, обладающие наилучшим связыванием, анализировали на ингибирование связывания мишени в присутствии VEGF (фиг.1B). Идентифицировали несколько клонов, которые ингибируют связывание KDR-VEGF, предположительно данные клоны связывали KDR в области центра связывания природного лиганда (VEGF) или вблизи него. Способность двух связывающих молекул (VR28 и VR12) непосредственно ингибировать взаимодействие VEGF-KDR оценивали с помощью анализа BIAcore с использованием иммобилизованного VEGF и мобильной фазы, содержащей KDR-Fc в присутствии или в отсутствие выбранного связывающего белка. VR28 и, в меньшей степени, VR12, но не неконкурирующий клон (VR17), ингибировали связывание KDR с VEGF дозозависимым способом (фиг.1C). Наконец, кроме связывания с очищенным рекомбинантным KDR, VR28 также связывается с рекомбинантными клетками CHO, экспрессирующими KDR, но не с контрольными клетками (фиг.1D).
Последовательность связывающих петель клона VR28 приведена в первом ряду таблицы 4.
Хотя VR28 не является самым многочисленным клоном в секвенированной связывающей популяции (одна копия из 28 секвенированного клона), в данной связывающей популяции он обладает наилучшим связывающим сродством к KDR с константой диссоциации 11-13 нМ, которую определяли с помощью радиоактивного равновесного анализа связывания (фиг.3 и таблица 5) и анализа BIAcore (таблица 7). В остальной каркасной области молекулы изменения по сравнению с диким типом 10Fn3 отсутствуют (после коррекции случайного изменения каркаса в положении 69, которое не оказывает влияния на связывание). Однако VR28 демонстрирует небольшое ингибирование сигнального пути VEGF-KDR в анализе VEGF-зависимой клеточной пролиферации. Таким образом, в то время как в результате селекции наивной библиотеки получали имитаторы антител, которые препятствуют взаимодействию VEGF с KDR в биохимических анализах связывания, улучшение сродства имеет значение для нейтрализующей функции в биологическом анализе передачи сигнала.
Пример 2. Аффинное созревание клона VR28
Использовали стратегию мутагенеза, направленную на изменение последовательностей только в связывающих петлях. Чтобы идентифицировать петли, которые с большей вероятностью приводят к улучшению, проводили направленную на петли гипермутагенную ПЦР, чтобы ввести до 30% мутаций независимо в каждую петлю VR28. После трех циклов селекции против KDR наблюдали появление трех клонов с улучшенными характеристиками связывания с KDR-Fc. В результате анализа последовательностей выбранных пулов обнаружили, что основная часть мутаций накапливается в петле FG, тогда как петли BC и DE остаются практически интактными. Данный результат показывает, что петля FG является наиболее подходящей мишенью для дальнейшей модификации.
Затем в результате изменения последовательности VR28 в петле FG путем олигонуклеотидного мутагенеза получали новую библиотеку, содержащую приблизительно 1012 вариантов. Для каждого положения петли FG (остатки 77-86 [VAQNDHELIT (SEQ ID NO: 198)], а также для следующего пролина [остаток 87]), вводили смесь 50:50 VR28-кодирующей ДНК и NNS по каждому положению. В результате анализа последовательности ДНК случайной выборки приблизительно из 80 клонов обнаружили, что, как и ожидалось, в среднем на клон происходит шесть аминокислотных изменений. Чтобы выявить клоны, обладающие лучшим сродством к мишени, в процессе селекции использовали более низкие концентрации KDR-Fc. Профиль связывания мишени на протяжении четырех циклов селекции приведен на фиг.2. После четырех циклов селекции связывающую популяцию субклонировали и анализировали. В таблице 5 и на фиг.3A приведены результаты измерения сродства отдельных связывающих клонов. Измеренные константы связывания с KDR-Fc варьировали от <0,4 до <1,8 нМ, в 10-30 раз лучше, чем в случае VR28 (11 нМ).
Результаты анализа последовательностей, некоторые из них приведены в таблице 4 (клоны K), показывают, что хотя связывающая популяция является разнотипной, среди клонов можно идентифицировать несколько консенсусных мотивов. Особого внимания заслуживает то, что Pro87 и Leu84 обнаружены почти во всех клонах (как и в VR28), это позволяет предположить, что указанные остатки могут играть важную роль в формировании структуры связывающего центра. По-видимому, в положении 82 необходимо присутствие положительно заряженной аминокислоты, поскольку среди секвенированных клонов наблюдаются только изменения H82K или H82R, а в положении 78 преимущественно присутствует алифатическая кислота. D81 часто заменяется на G, приводя к утрате отрицательного заряда в данном положении и к увеличению гибкости. Кроме того, общая частота мутаций в выбранной популяции сравнима с частотой мутаций в исходном пуле, это позволяет предположить, что петля FG является легкодоступной для изменений.
Анализ структуры позволяет предположить, что несколько остатков в N-концевой области домена 10Fn3 человеческого фибронектина расположены в непосредственной близости от петли FG (Main et al, Cell 71: 671-678, 1992). Непосредственная близость двух участков может оказывать негативное влияние на связывание мишени. Две случайные мутации в N-концевой области, L8P и L8Q, приводят к улучшению связывания с KDR в ряде выбранных клонов, вероятно, в результате изменения положения N-конца относительно петли FG. Чтобы дополнительно проанализировать влияние N-конца, получали связывающие молекулы для 23 разных KDR-связывающих соединений, в которых удалены первые восемь остатков N-конца перед β-слоем. Затем определяли связывание мишени по сравнению с аналогами, не содержащими делеций. Как показано на фиг.3В, после делеции связывание с KDR-Fc в среднем улучшалось в 3 раза.
Пример 3. Селекция связывающих соединений с двойной специфичностью к человеческому (KDR) и мышиному (Flk-1) VEGFR-2
Как показано на фиг.4, VR28 и большинство аффинно-зрелых вариантов (клоны K) не связываются с мышиным гомологом KDR, Flk1. Однако, поскольку KDR и Flk1 обладают высоким уровнем идентичности последовательностей (85%, Claffey et al., J. Biol. Chem. 267: 16317-16322 (1992), Shima et al., J. Biol. Chem. 271: 3877-3883 (1996)), существует возможность выделения имитаторов антител, которые способны связываться и с KDR, и с Flkl. Такие связывающие соединения с двойной специфичностью являются желательными, поскольку они позволяют проводить функциональное тестирование одной и той же молекулы на животных моделях и затем на людях.
Популяция клонов после мутагенеза петли FG и селекции против KDR в течение четырех циклов подвергалась селекции против Flkl в течение трех дополнительных циклов. Как показано на фиг.2, от цикла 5 к циклу 7 наблюдалось увеличение способности связывать Flk1, что свидетельствует об увеличении числа соединений, связывающих Flk1. Анализ связывания нескольких отдельных клонов показал, что в отличие от клонов, выбираемых только против KDR (клоны K), большая часть клонов, полученных в результате дополнительной селекции против Flk1 (клоны E), способна взаимодействовать и с KDR, и с Flk1. Константы связывания с обоими мишенями, определенные с помощью радиоактивного равновесного анализа связывания (таблица 6 и фиг.5) и BIAcore (таблица 7), показывают, что отдельные клоны способны связываться с обоими мишенями с высоким сродством.
Например, E19 имеет Kd 60 пМ для KDR и 340 пМ для Flk-1. Полученные результаты показывают, что простая стратегия смены мишеней в процессе селекции, вероятно, вследствие селекционного давления, оказываемого обеими мишенями, позволяет выделить из мутировавшей популяции VR28, обладающей умеренным связыванием с KDR и не способной связываться с Flk-1, молекулы с двойной специфичностью связывания к KDR и Flk-1. Выбранные связанные белки на основе фибронектина обладают высокой специфичностью по отношению к VEGFR-2 (KDR), поскольку даже при высокой концентрации мишени связывание с VEGFR1 не наблюдалось.
В результате анализа последовательностей обнаружили несколько мотивов, подобных наблюдаемым в пуле, связывающем KDR (Leu и Pro в положениях 84 и 87 соответственно; положительно заряженная аминокислота в положении 82 преимущественно Arg), и несколько мотивов, которые не сохраняются (алифатический в положении 78). Кроме того, мотив ERNGR (остатки 78-82) присутствует почти во всех клонах, связывающих Flk-1 (таблица 4); а в пуле, связывающем KDR, данный мотив еле различим. По-видимому, R79 и R82 играют особенно важную роль в связывании Flk-1 с высоким сродством, поскольку связывание с Flk-1, но не с KDR, сильно уменьшается, если в данном положении присутствует другой остаток (фиг.6A). Чтобы определить значение каждой петли для связывания с KDR и Flk-1, петли клонов E6 и E26 приведены в таблице 4, одну петлю сразу заменяли на рандомизированную последовательность NNS. Как показано на фиг.6B, после замены белки утрачивают способность связывать и KDR, и Flk-1. Полученные результаты показывают, что все петли нужны для связывания с мишенями, и позволяют предположить, что все три петли принимают совместное участие во взаимодействии с мишенями.
Для получения клонов, способных связываться с обеими мишенями, независимо использовали альтернативную стратегию мутагенеза. В качестве исходного клона выбирали 159Q(8)L (таблица 4), продукт аффинного созревания VR28 с использованием гипермутагенной ПЦР, который связывает KDR с высоким сродством (Kd=2 нМ; таблица 7) и Flk-1 с низким сродством (Kd>3000 нМ). Первые шесть аминокислот петли FG являются полностью рандомизированными (NNS), а следующие пять остатков (ELFTP) оставляют интактными. После шести циклов селекции против Flk-1 связывающий пул повторно рандомизировали по петле DE (положения 52-56) и проводили три дополнительных цикла селекции против Flk-1 и один против KDR. В результате получали ряд молекул с высоким сродством связывания и к KDR, и к Flk-1 (таблица 4 и фиг.4). Например, клон M5FL при сохранении высокого связывающего сродства к KDR (Kd=890 пМ) может связывать Flk-1 с Kd 2,1 нМ в 1000 раз лучше, чем исходный клон. Интересно, что мотив ERNGR, обнаруженный в Flk-1-связывающих молекулах, выбранных из мутировавшей популяции VR28, также присутствует в нескольких клонах, полученных после мутагенеза и селекции клона 159Q(8)L, несмотря на полную рандомизацию данного участка петли FG. Выделение подобных связывающих молекул из двух независимых библиотек позволяет предположить, что процесс созревания аффинности является робастным для выделения оптимальных Flk-1-связывающих мотивов, расположенных в петле FG.
Пример 4. Связывание на клеточной поверхности и нейтрализация активности VEGF in vitro
Функциональные характеристики молекул, связывающих KDR и Flk-1, оценивали на модельной системе клеточной культуры с использованием E.coli, продуцирующей связывающие молекулы. С помощью системы детекции, состоящей из мышиного антитела против маркера His6 (белки, экспрессирующиеся в E.coli, имеют His-маркер) и флуоресцентно-меченного антитела против мышиного антитела, было показано, что связывающие молекулы специфически связываются с клетками млекопитающих, экспрессирующими KDR или Flk-1 с низкими наномолярными значениями EC50 (фиг.7 и таблица 8).
Более важно, что при использовании рекомбинантных клеток BA/F3 (DSMZ-Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH), экспрессирующих внеклеточный домен KDR или Flk-1, связанный с сигнальным доменом рецептора эритропоэтина, данные молекулы ингибировали VEGF-стимулированную клеточную пролиферацию в дозозависимой манере с IC50 3-12 нМ для KDR-экспрессирующих клеток и 2-5 нм для Flk-1-экспрессирующих клеток. Как показано на фиг.8 и в таблице 9, эффективность ингибирования является такой же, как у контрольных моноклональных антител против KDR и против Flk-1.
Затем ряд клонов тестировали на VEGF-опосредованное ингибирование роста клеток HUVEC (Human Umbilical Vein Endothelial Cells). Клетки HUVEC являются природными человеческими клетками, близкородственными клеткам, отвечающими на VEGF. Как показано на фиг.9 и в таблице 10, связывающие белки на основе фибронектина также способны ингибировать активность VEGF в данной системе человеческих клеток, тогда как каркасный белок на основе фибронектина дикого типа является неактивным.
Пример 5. Термическая стабильность и обратимая повторная укладка белка M5FL
Термическую стабильность KDR-связывающего M5FL определяли с помощью дифференциальной сканирующей калориметрии (DSC). Обнаружено, что в условиях стандартного буфера PBS (натрий-фосфатный, pH 7,4, 150 мм NaCl) M5FL имеет один необратимый фазовый переход термического плавления при 56°C. Затем было установлено, что, с точки зрения растворимости белка M5FL, предпочтительным буфером является натрий-ацетатный буфер pH 4,5. Эксперименты с использованием DSC, проводимые в данном буфере (100 мМ), показали, что в данных условиях M5FL является более стабильным (Т.пл.=67-77°C) и что фазовый переход плавления является обратимым (фиг.10). Обратимые термические переходы использовали для идентификации благоприятных условий, обеспечивающих длительное хранение белковых терапевтических средств (Remmele et al, Biochemistry 38: 5241 (1999)), следовательно, Na-ацетатный буфер pH 4,5 идентифицировали как оптимальный буфер для хранения белка M5FL.
Пример 6. Связывание in vitro и связанная с клетками активность пэгилированного белка M5FL
Белок M5FL продуцировался в экспрессионной системе E.coli с C-концевым удлинением с получением нижеследующей белковой последовательности (C-концевое удлинение подчеркнуто, Cys100 затушеван; значительный процент белка продуцировался с изначально удаленным метионином):
MGVSDVPRDLEVVAATPTSLLISWRHPHFPTRYYRITYGETGGNSPVQEFTVPLQPPLATISGLKPGVDYTITVYAVTKERNGRELFTPISINYRTEIDKPCQHHHHHH (SEQ ID NO: 199)
Одна сульфгидрильная группа цистеинового остатка в положении 100 использовалась для присоединения вариантов PEG с помощью стандартных методов малеимидной химии с получением двух разных пэгилированных форм M5FL. M5FL конъюгировали с линейным PEG массой 20 кДа и с разветвленным PEG массой 40 кДа (Shearwater Corporation) с получением M5FL-PEG20 и M5FL-PEG40 соответственно. Пэгилированные белковые формы отделяли от непрореагировавшего белка и PEG путем катионно-обменной хроматографии. Наличие ковалентной связи в двух пэгилированных формах M5FL подтверждали методом SDS-PAGE (фиг.11) и масс-спектроскопии.
Сродство in vitro измеряли методом поверхностного плазмонного резонанса (SPR) (BIAcore) для человеческого и мышиного VEGF-рецепторных белков-мишеней, иммобилизованных с помощью методов амидной химии на чипе BIAcore. Для обоих белков мишеней обнаружено, что и 20, и 40 кДа пэгилированные формы M5FL имеют более низкую константу скорости прямой реакции (ka) по сравнению с немодифицированным M5FL и малоизмененную константу скорости обратной реакции (kd; таблица 11).
Функциональные характеристики пэгилированных препаратов M5FL анализировали с использованием системы Ba/F3, описанной в примере 4. На фиг.12 приведен график A490 (представляющий степень клеточной пролиферации) как функция от концентрации каждого из связывающих соединений. Кривые являются почти идентичными, это указывает на то, что пэгилирование мало влияет на биологическую активность всех пэгилированных форм.
Для подгруппы KDR-связывающих полипептидов определяли kon, koff и KD и сравнивали с EC50, полученным в анализе ингибирования VEGF на клетках BaF3. Диаграмма разброса показывала, что kon хорошо коррелирует с EC50, а koff плохо коррелирует. Более 90% KDR-связывающих белков с kon 105s-1 или выше имеют EC50 10 нМ или ниже. KD представляет собой отношение kon и koff и предположительно имеет среднюю степень корреляции с EC50.
Многие KDR-связывающие белки, в том числе CT-01, анализировали на связывание с VEGFR-1, VEGFR-2 и VEGFR-3. Белки имели высокую степень селективности по отношению к VEGFR-2.
Пример 6: Получение KDR-связывающего белка CT-01, блокирующего опосредованный VEGFR-2 сигнальный путь в эндотелиальных клетках человека
Используя методы, описанные в предшествующих примерах, получали другие KDR-связывающие белки на основе 10Fn3. Как описано для белка M5FL в приведенном выше примере 5, определяли KD для связывания белков с человеческим KDR и мышиным Flk-1 с помощью анализа связывания BIAcore и IC50 с помощью анализа с использованием Ba/F3. Белок, называемый CT-01, обладал желательными свойствами по данным каждого анализа и использовался в следующих анализах.
Исходный клон, из которого получали CT-01, имеет следующую последовательность: GEVVAATPTSLLISWRHPHFPTRYYRITYGETGGNSPVQEFTVPLQPPTATISGL KPGVDYTITVYAVTDGWNGRLLSIPISINYRT (SEQ ID NO: 200). Подчеркнута последовательность петли FG.
После аффинного созревания, как описано выше, получали основную форму CT-01: EVVAATPTSLLISWRHPHFPTRYYRITYGETGGNSPVQEFTVPLQPPTATISGLKPGVDYTITVYAVTDGRNGRLLSIPISINYRT (SEQ ID NO: 192).
Указанная выше молекула CT-01 имеет делецию первых 8 аминокислот и может содержать добавочные аминокислоты на N- или C-конце. Например, добавочная последовательность MG может быть помещена на N-конце. M обычно отщепляли, оставляя последовательность GEV... на N-конце. Повторное добавление собственных 8 аминокислот на N-конце также давало KDR-связывающий белок с желательными свойствами. N-концевой метионин обычно отщепляли, получая последовательность: VSDVPRDLEVVAATPTSLLISWRHPHFPTRYYRITYGETGGNSPVQEFTVPLQPP TATISGLKPGVDYTITVYAVTDGRNGRLLSIPISINYRT (SEQ ID NO: 193).
В случае применения in vivo может быть получена форма, подходящая для пэгилирования. Например, добавляли и экспрессировали C-концевой фрагмент, содержащий цистеин, как показано ниже для формы, утратившей восемь N-концевых аминокислот.
GEVVAATPTSLLISWRHPHFPTRYYRITYGETGGNSPVQEFTVPLQPPTATISGLKPGVDYTITVYAVTDGRNGRLLSIPISINYRTEIDKPCQ (SEQ ID NO: 194). Пэгилированную форму данной молекулы использовали в описанных ниже экспериментах in vivo. Также использовали контрольную форму, содержащую серин вместо цистеина: GEVVAATPTSLLISWRHPHFPTRYYRITYGETGGNSPVQEFTVPLQPPTATISGLKPGVDYTITVYAVTDGRNGRLLSIPISINYRTEIDKPSQ (SEQ ID NO: 195).
Такие же C-концевые фрагменты можно добавить к формам CT-01, содержащим восемь N-концевых аминокислот, например, имеющим последовательность SEQ ID NO: 193.
Выделяли другие варианты с желательными KDR-связывающими свойствами. Нижеследующая основная последовательность имеет несколько отличающуюся петлю FG и может экспрессироваться, например, с N-концевой последовательностью MG, с N-концевой последовательностью, в которой восстановлены 8 делетированных аминокислот, и/или с C-концевым фрагментом, предоставляющим цистеин для пэгилирования.
EVVAATPTSLLISWRHPHFPTRYYRITYGETGGNSPVQEFTVPLQPPTATISGLKPGVDYTITVYAVTEGPNERSLFIPISINYRT (SEQ ID NO: 196). Другой такой вариант имеет основную последовательность: VSDVPRDLEVVAATPTSLLISWRHPHFPTRYYRITYGETGGNSPVQEFTVPLQPPTATISGLKPGVDYTITVYAVTEGPNERSLFIPISINYRT (SEQ ID NO: 197).
Сравнение данных вариантов позволяет выявить консенсусную последовательность для петли FG: D/E)GXNXRXXIP (SEQ ID NO: 3). В более подробном варианте консенсусная последовательность может экспрессироваться как (D/E)G(R/P)N(G/E)R(S/L)(S/F)IP (SEQ ID NO: 4).
Пример 7: CT-01 блокирует опосредованный VEGFR-2 сигнальный путь в эндотелиальных клетках человека.
Как показано на фиг.13, VEGF-A-сигнальный путь через VEGFR-2 опосредуется фосфорилированием внеклеточного домена VEGFR-2 с последующей активации пути, включающего в себя фосфолипазу C гамма (PLCγ), протеинкиназу C (PKC), Raf-1, MEK1/2, ERK1/2, приводящего к пролиферации эндотелиальных клеток.
Чтобы определить, действительно ли KDR-связывающие соединения ингибировали активацию данного сигнального пути, эндотелиальные клетки микрососудов человека обрабатывали VEGFR-связывающим полипептидом (например, CT-01) в течение 30 мин и стимулировали VEGF-A в течение 5 мин. Общие клеточные лизаты анализировали методами SDS-PAGE и вестерн-анализа, используя антитела, специфичные к фосфо-VEGFR-2, нефосфо-VEGFR-2, фосфо-ERK1/2 и нефосфо-ERK1/2.
Как показано на фиг.13, 130 пМ CT-01 ингибирует образование фосфо-VEGFR-2 и также уменьшает последующее фосфорилирование ERK1/2. Фосфорилированный ERK1/2 полностью не устраняется, возможно, благодаря тому, что ERK1/2 получает сигналы от ряда других сигнальных путей.
Пример 8: KDR-связывающие белки на основе фибронектина прерывают сигнальный путь, опосредованный VEGF-A и VEGF-D.
VEGFR-2 является рецептором трех видов VEGF, VEGF-A, VEGF-C и VEGF-D. Проводили эксперименты, чтобы оценить влияние KDR-связывающих белков на VEGF-A- и VEGF-D-опосредованный сигнальный путь через KDR.
Получали клеточную линию Ba/F3, зависимую от Flk-1-опосредованного сигнального пути. Как показано в левой части фиг.14, жизнеспособность клеток можно поддерживать путем обработки клеток VEGF-A или VEGF-D, хотя VEGF-D требуется в значительно больших количествах.
Как показано в средней части фиг.14, клетки поддерживали в присутствии 15 нг/мл VEGF-A и приводили в контакт с раскрытыми в данном описании белками M5FL или CT-01 или с антителом DC-101 против Flk-1. Каждый реагент уменьшал VEGF-A-опосредованную жизнеспособность клеток, указывая, что сигнальный путь VEGF-A через Flk-1 блокируется.
Как показано в правой части фиг.14, клетки поддерживали в присутствии 300 нг/мл VEGF-D и приводили в контакт с раскрытыми в данном описании белками M5FL или F10, или с антителом против VEGF-A. M5FL и F10 уменьшали VEGF-D-опосредованную жизнеспособность клеток, указывая, что сигнальный путь VEGF-D через Flk-1 блокируется. Антитело против VEGF-A не оказывало эффекта, демонстрируя специфичность анализа.
Пример 9. Фармакокинетика
Фармакокинетические исследования: нативный CT-01 или его пэгилированную форму (40 кДа PEG, CT-01PEG40) иодировали 125I. 10-20 мКи иодированных белков вводили взрослым самцам крыс либо внутривенно, либо внутрибрюшинно и уровни иодированных белков определяли в указанные моменты времени. Для изучения распределения в тканях крыс умерщвляли через 15 мин, 2 ч и 6 ч и определяли уровни радиоактивности. См. фиг.15 и 16. Немодифицированный CT-01 представляет собой белок массой 12 кДа, который быстро выводится из крови. Значение площади под кривой (AUC) составляет 14,6 ч*мг/мл со скоростью выведения 69,9 мл/ч/кг, максимальная концентрация в сыворотке составляет 9,1 мг/мл. Начальный период полужизни (α) составляет 0,3 часа, а период полужизни второй фазы (β) составляет 13,5 часов. В сравнении при внутривенном введении пэгилированного CT-01 сильно увеличивалось время пребывания в крови, в основном, из-за драматического уменьшения начальной фазы выведения. AUC увеличивался более, чем в 10 раз, до 193, скорость выведения уменьшалась более, чем в 10 раз, до 5,2, Cmax составлял 12,9 мг/мл. Период полужизни α увеличивался до 1 часа, а β увеличивался до 16,2 часов. Данные фармакокинетические характеристики у крыс соответствовали двухнедельному дозировочному режиму у людей, данная частота дозирования попадала в приемлемые интервалы.
Внутрибрюшинное введение (в.б.) пэгилированного CT-01 имеет резервуар-подобную фармакокинетику. Начальный выброс концентрации CT-01 в крови отсутствует. Наоборот, количество CT-01 более медленно растет и медленно уменьшается. Такая фармакокинетика может быть желательной, если имеют место побочные эффекты от начального выброса концентрации CT-01 при внутривенном введении. Вероятно, другие агенты на основе 10FN3 будут иметь подобное поведение при внутрибрюшинном введении. Соответственно, это может служить общим способом достижения задержанного во времени эффекта от ведения доз при использовании средств на основе 10FN3.
Как показано на фиг.16, секреция пэгилированной формы CT-01 в первую очередь происходит в печени. Длительной аккумуляции CT-01 не наблюдается.
Подобные результаты получали при использовании CT-01, конъюгированного с фрагментом PEG массой 20 кДа.
Пример 10: Эффективность CT-01 in vivo
Чтобы оценить влияние дозы, дозировочного режима и параметров введения на эффективность препарата, проводили анализ Майлса. Самкам мышей Balb/c внутрибрюшинно вводили буфер или CT-O1PEG40 в дозе 1, 5 и 20 мг/кг за 4 ч до введения VEGF. Внутрикожное очаговое введение VEGF-A в кожу спины вызывало просачивание через стенки сосудов красителя голубого Эванса (фиг.17 и 18).
У мышей, обработанных KDR-связывающим средством, наблюдалось статистически значимое уменьшение уровня VEGF-опосредованного просачивания через стенки сосудов. Заметные результаты наблюдались при применении CT-01 в дозах 5 мг/кг и 20 мг/кг. Следовательно, для исследования мышиных моделей опухолей выбирали дозу 5 мг/кг.
Пример 11: CT-01 ингибирует рост опухоли
Анализ с использованием мышиной меланомы B16-F10:
2×106 опухолевых клеток мышиной меланомы B16-F10 имплантировали подкожно самцам мышей C57/BL в 1 день. На 6 день детектировалась пальпируемая масса. На 8 день, если опухоли достигали измеримого размера, начинали ежедневные инъекции контрольной среды или 5, 15 или 40 мг/кг CT-01 PEG40. Самая маленькая доза 5 мг/кг уменьшала рост опухоли. На 18 день у мышей, получающих 15 и 40 мг/кг, наблюдалось 50% и 66% уменьшение роста опухоли. См. фиг.19.
Анализ с использованием человеческой глиобластомы U87:
5×106 опухолевых клеток человеческой глиобластомы U87 имплантировали подкожно самцам голых мышей. Когда объем опухоли достигал приблизительно 50 мм3, начинали обработку (0 день). Через день (EOD) внутривенно вводили контрольную среду, 3, 10 или 30 мг/кг CT-01 PEG40. Антитело DC101 против Flk-1 вводили в дозе 40 мг/кг два раза в неделю, что по литературным данным является оптимальным дозировочным режимом для данного антитела. Самая маленькая доза 3 мг/кг уменьшала рост опухоли. На 12 день у мышей, получающих 10 и 30 мг/кг, наблюдалось 50% уменьшение роста опухоли. См. фиг.20. Эффективность сравнима с эффективностью антитела против Flk-1.
В экспериментах, описанных в примерах 1-11, использовали нижеследующие материалы и методы.
Рекомбинантные белки:
Рекомбинантный человеческий VEGF165, мышиный VEGF164, человеческий нейротрофин-4 (NT4), химерные белки, состоящие из человеческого и мышиного рецепторов фактора роста эндотелия сосудов-2 и фрагментов Fc (KDR-Fc и Flk-l-Fc), получали от R&D systems (Minneapolis, MN). Биотинилирование белков-мишеней проводили в 1×PBS при 4°C в течение 2 часов в присутствии EZ-LinkTM Sulfo-NHS-LC-LC-Biotin (Pierce, IL). Избыток EZ-Link Sulfo-NHS-LC-LC-Biotin удаляли диализом против 1×PBS. Уровень биотинилирования определяли методом масс-спектроскопии, а концентрацию белка-мишени определяли с помощью анализа Кумасси плюс (Pierce, IL).
Праймеры:
Нижеследующие олигонуклеотиды получали путем химического синтеза для последующего использования в конструировании библиотек и проведении мутагенеза выбранных клонов.








Буферы
В описанных в данном документе экспериментах использовали нижеследующие буферы. Буфер A (100 мM TrisHCl, 1M NaCl, 0,05% Tween-20, pH 8,0); буфер B (1×PBS, 0,02% Тритон X100); Буфер C (100 мM TrisHCl, 60 мМ EDTA, 1 M NaCl, 0,05% Тритон X100, pH 8,0); Буфер Ca (100 мM TrisHCl, 1M NaCl, 0,05% Тритон X100, pH 8,0); Буфер D (2M NaCl, 0,05% Тритон); Буфер E (1×PBS, 0,05% Тритон X100, pH 7,4); Буфер F (1×PBS, 0,05% Тритон X100, 100 мМ имидазол, pH 7,4); Буфер G (50 мМ HEPES, 150 мМ NaCl, 0,02% Тритон X-100, 1 мг/мл бычьего сывороточного альбумина, 0,1 мг/мл ДНК спермы лосося, pH 7,4); Буфер H (50 мМ HEPES, 150 мМ NaCl, 0,02% Тритон X-100, pH 7,4); Буфер I (1×PBS, 0,02% Тритон X-100, 1 мг/мл бычьего сывороточного альбумина, 0,1 мг/мл ДНК спермы лосося, pH 7,4); Буфер J (1×PBS, 0,02% Тритон X-100, pH 7,4); Буфер K (50 мM NaH2PO4, 0,5 M NaCl, 5% глицерин, 5 мМ CHAPS, 25 мМ имидазол, 1× смесь протеазных ингибиторов CompleteTM (Roche), pH 8,0); Буфер L (50 мM NaH2PO4, 0,5 M NaCl, 5% глицерин, 25 мМ имидазол, pH 8,0); Буфер M (1×PBS, pH 7,4, 25 мМ имидазол, pH 7,4); Буфер N (1×PBS, 250 мМ имидазол, pH 7,4); Буфер O (10 мМ HEPES, 150 мМ NaCl, 0,005% твин 20, pH 7,4).
Первичное получение библиотеки:
Получение библиотеки с использованием десятого домена человеческого фибронектина в качестве каркаса было описано ранее (Xu et al, 2002, supra). Три петлеобразных участка, соответствующих положениям 23-29, 52-55 и 77-86 соответственно, рандомизировали с использованием NNS (стандартные нуклеотидные смеси, где N=эквимолярная смесь A, G, T, C; S=эквимолярная смесь G и C) в качестве кодирующей схемы. Получали подобные библиотеки, содержащие рандомизированные участки только в положениях 23-29 и 77-86 (библиотека двух петель) или только в положениях 77-86 (библиотека одной петли). Полученные библиотеки смешивали приблизительно в эквимолярных количествах. Данная смешанная библиотека содержит ~1×1013 клонов и используется для KDR-селекции, идентифицирующей VR28.
Мутагенное получение библиотеки:
Гипермутагенная ПЦР. После исправления методом ПЦР (см. ниже) каркасной мутации T(69)I в клоне VR28 с получением последовательности дикого типа изменения харектеристик связывания связывающего соединения VR28 с KDR не наблюдаются. Мутации вводят в петлеобразные участки VR28 с использованием ранее описанных условий (Vartanian et al, Nuc. Acid Res. 24: 2627-2631, 1996). Три цикла гипермутагенной ПЦР проводили с использованием в качестве матрицы VR28 и пар праймеров, фланкирующих каждую петлю (N-концевой прямой/BCDE обратный, BCDE прямой/DEFG обратный, DEFG прямой/C-концевой полиА). Полученные фрагменты собирали, используя удлинение с перекрыванием и ПЦР с фланкирующими праймерами T7TMV Fn и MK165-4 A20. ДНК-секвенирование клонов после последней реакции ПЦР подтверждали правильную сборку библиотеки. Частота мутаций в петлеобразных участках составляла до 30%, а в каркасных участках только до 1,5%.
Олигомутагенез. Для олигомутагенеза петли FG VR28 методом ПЦР использовали праймер VR28FG-50, обратный праймер DEFG и фланкиркующие праймеры. В каждом нуклеотидном положении, кодирующем петлю FG, праймер VR28FG-50 содержит 50% нуклеотида VR28 и 50% эквимолярной смеси всех четырех нуклеотидов (N) или G и C (S). В результате применения данной схемы приблизительно 67% аминокислот петли FG VR28 подвергались случайной замене на другие аминокислотные остатки, что подтверждается ДНК-секвенированием.
Рандомизированные суббиблиотеки 159(Q8L). Проводили олигомутагенез петли FG клона 159(Q8L), трехстадийное удлинение и амплификацию. Для первого удлинения пары праймеров (a: F1U2/F2, b: F3159/F4, c: F5159/F6, d: F7X6159/F8) смешивали в равных концентрациях (100 пмоль каждого) и амплифицировали в течение 10 циклов. Для второго удлинения 1/20 от первых реакций объединяли (a/b и c/d) и амплификацию продолжали в течение еще 10 циклов. Чтобы амплификация предпочтительно проходила в направлении удлинения, а не повторного отжига полностью комплементарных фрагментов, проводили линейную амплификацию наполовину сконструированных продуктов (0,5 пмоль каждого) в течение еще 20 циклов с использованием 50 пмоль либо прямого праймера F1U2 для фрагмента ab, либо обратного праймера C2asaiA20 для фрагмента cd. Наконец, удлиненные, наполовину сконструированные продукты ab и cd объединяли и амплифицировали в течение 20 циклов без дополнительных компонентов. Праймер F7X6159, содержащий NNS в каждом из 6 первых кодирующих положений клона 159(Q8L), иначе идентичен клону 159(Q8L). Правильность сборки библиотеки 159 (Q8L)-FGX6 подтверждали ДНК-секвенированием клонов, полученных после последней реакции ПЦР. Полученная суббиблиотека содержит ~1×109 клонов.
Для рандомизиции петли DE пула библиотеки 159(Q8L)-FGX6 после 6 цикла (PR6) селекции методом ПЦР получали два наполовину сконструированных фрагмента с использованием праймеров F1U2/F4 и F5X5/C2asaiA20. Праймер F5X5 содержит NNS в четырех положениях петли DE, а также в положении 56. Затем удлиненные фрагменты ab и cd объединяли и амплифицировали в течение 20 циклов, не используя дополнительные компоненты.
Введение петлеобразных последовательностей, содержащих точечные мутации, делецию и рандомизацию (NNS), в каркасные белки на основе фибронектина:
Каркасную мутацию T(69)I связывающего соединения VR28 исправляли с получением последовательности дикого типа методом двухстадийной ПЦР с использованием в качестве матрицы клона VR28. Наполовину сконструированные фрагменты, полученные с использованием праймеров N-концевой прямой/DEFG обратный и DEFG прямой/C-концевой полиА, объединяли и конструировали целый клон VR28 (I69T) (обозначаемый в тексте VR28) с использованием праймеров T7TMV Fn и MK165-4 A20. Коррекцию N-концевых мутаций в клоне 159 (Q8 на L) проводили методом ПЦР с использованием праймеров N-концевой прямой/C-концевой полиА с последующим удлинением с использованием праймеров T7TMV Fn и MK165-4 A20.
Введение делеции Δ1-8 в N-концевую область каркасных белков на основе фибронектина проводили путем амплификации с использованием праймеров T7 TMV N-концевая делеция и MK 165-4 A20.
Химерные белки на основе клонов E, содержащих петлеобразные последовательности с NNS, получали методом двухстадийной ПЦР. Петлеобразные участки амплифицировали с использованием праймеров T7 TMV N-концевая делеция/BCDE обратный (a: петля BC клонов E); N-концевой прямой/hfOl BC обратный (b: BC NNS); BCDE прямой/Front FG обратный (c: петля DE клонов E); BCDE прямой/hfUl DE обратный (d: DE NNS); hfDl DE-FG прямой/hf01 RT-Flag полиА обратный (e: FG клонов E); hfDl DE-FG прямой/hf01 FG обратный (f: FG NNS). Фрагменты b/c/e, a/d/e, a/c/f объединяли и конструировали целые пулы путем удлинения и амплификации с использованием праймеров T7Tmv N-концевая делеция и hf01 RT Flag полиА обратный.
Последовательности всех конструкций подтверждали и/или анализировали путем ДНК-секвенирования. Все конструкции и мутагенные библиотеки содержали промотор T7 TMV в 5'-фланкирующем участке и маркерные последовательности Flag или His6 в 3'-фланкирующем участке, обеспечивающие получение гибрида РНК-белок и очистку in vitro.
Получение гибрида РНК-белок
Для каждого цикла ПЦР-селекции ДНК подвергали транскрипции при 37°С в течение 4 часов с использованием набора для транскрипции MegaScript (Ambion). Матрицу ДНК удаляли путем расщепления ДНКазой I (Ambion) при 37°C в течение 20 минут. РНК очищали путем экстракции смесью фенол/хлороформ с последующей гель-фильтрацией на колонке NAP-25 (Amersham). Пиромициновый линкер PEG 6/10 (5'Pso u agc gga ugc XXX XXX CC Pu3', где Pso=C6-Psoralen, u, a, g, c=2'OMe-RNA, C=стандартные амидиты, X: спейсер фосфорамидит 9(9-O-диметокситритил-триэтиленгликоль,1-[(2-цианоэтил)-(N,N-диизопропил)]-фосфорамидит); Pu=пуромицин-CPG) синтезировали с помощью описанного ранее способа (Kurz et al, Nuc. Acid Res. 28: 83, 2000). Линкер подвергали отжигу с библиотекой РНК в 0,1 M NaCl, 25 мM TrisHCl, pH 7,0, путем постепенного уменьшения температуры от 85°C до 4°C. Затем осуществляли поперечную сшивку линкера и РНК под воздействием УФ-света (365 нм) в течение 15 минут. Смесь, полученную после поперечной сшивки (600 пмоль РНК), вводили в реакцию трансляции, проводимую in vitro с использованием набора для трансляции, содержащего лизат кроличьих ретикулоцитов (Ambion), в присутствии 35S-меченного метионина при 30°C в течение 60 минут. Чтобы увеличить образование гибрида, в реакционную среду добавляли 0,5 M KC1 и 0,05 M MgCl2 и инкубировали в течение 30 минут при 4°C. Гибридные молекулы очищали с помощью хроматографии на олиго-dT-целлюлозе (Sigma) следующим образом. Смесь, содержащую гибриды и реагенты для трансляции, разбавляли буфером A (100 мM TrisHCl, 1 M NaCl, 0,05% твин-20, pH 8,0) и добавляли к олиго-dT-целлюлозе. Взвесь перемешивали вращением при 4°C в течение 1 часа и переносили на вращающуюся колонку. Колонку с шариками олиго-dT-целлюлозы промывали 10 объемами (по отношению к объему колонки) буфера A и элюировали 3 объемами H2О. Реакцию обратной транскрипции проводили с использованием набора для обратной транскрипции SuperScript II (Invitrogen) в течение 1 часа при 42°C с использованием праймера Hu3'FLAGSTOP. Чтобы уменьшить возможное неспецифическое связывание через реакционноспособные остатки цистеина, тиольные группы в течение селекции подвергали взаимодействию с 1 мM 2-нитро-5-тиоцианатобензойной кислотой (NTCB) или, альтернативно, N-этилмалеимидом (NEM). Реакцию проводили в течение одного часа при комнатной температуре. Затем гибридные молекулы очищали аффинной хроматографией против FLAG с использованием агарозы M2 (Sigma). Шарики M2 добавляли в реакционную среду и центрифугировали в буфере B (1×PBS, 0,02% Тритон X100) в течение 1 часа при 4°C. Затем шарики наносили на вращающуюся колонку, промывали 5 объемами буфера B и элюировали гибридные молекулы, используя 3 объема 100 мкM раствора Flag-пептида DYKDDDDK (Sigma) в буфере G. Выход рассчитывали на основе удельной активности, измеряемой путем подсчета сцинтилляций в образцах, содержащих 35S-метионин.
Гибрид РНК-белок получали для рандомизированной библиотеки 159(Q8L) с использованием модернизированного полуавтоматизированного способа в KingfisherTM (ThermoLabSystems). Данный способ содержит такие же стадии, как и в описанном выше способе, за исключением нескольких стадий, описанных ниже. Очистку молекул гибрида РНК-белок проводили в буфере C (100 мM TrisHCl, 60 мМ EDTA, 1 M NaCl, 0,05% Тритон X100, pH 8,0) на магнитных шариках олиго-dT (GenoVision). Шарики промывали 10 объемами (по отношению к объему реакционной среды) буфера Ca (100 мM TrisHCl, 1M NaCl, 0,05% Тритон X100, pH 8,0) и гибридные белки элюировали одним объемом H2О. Обратную транскрипцию (RT) проводили с использованием праймера C2RT. Затем гибридные белки очищали His-tag-аффинной хроматографией с использованием магнитных шариков Ni-NTA (Qiagen). Реакционную смесь RT инкубировали с шариками Ni-NTA в буфере D (2 M NaCl, 0,05% Тритон) в течение 20 минут при комнатной температуре, затем шарики промывали 10 объемами (по отношению к объему реакционной среды) буфера E (1×PBS, 0,05% Тритон X100, pH 7,4) и гибридные молекулы элюировали одним объемом буфера F (1X PBS, 0,05% Тритон X100, 100 мМ имидазол, pH 7,4).
Селекция:
Первичная селекция против KDR. Библиотеку гибридов (~10l3 клонов в 1 мл) инкубировали со 150 мкл шариков с белком A (Dynal), на которых перед селекцией иммобилизовали 200 нM человеческого IgG1 в течение 1 часа при 30°C, чтобы уменьшить неспецифическое связывание как с шариками с белком А, так и с белком Fc (предварительная очистка). Затем супернатант инкубировали в буфере G (50 мМ HEPES, 150 мM NaCl, 0,02% Тритон X-100, 1 мг/мл бычьего сывороточного альбумина, 0,1 мг/мл ДНК спермы лосося, pH 7,4) с химерным белком KDR-Fc в течение 1 часа при 30°C, переворачивая "с донышка на крышку". Конечная концентрация KDR-Fc составляла 250 нM в цикле 1, 100 нM в циклах 2-4 и 10 нM в циклах 5 и 6. Мишень улавливалась на 300 мкл шариков с белком A (цикл 1) или на 100 мкл шариков с белком A (циклы 2-6) в течение 30 минут при 30°C при переворачивании "с донышка на крышку", и шарики промывали 5 раз 1 мл буфера G (50 мМ HEPES, 150 мM NaCl, 0,02% Тритон X-100, pH 7,4). Связанные гибридные молекулы элюировали 100 мкл 0,1 M KOH в 50 мкл 1 M TrisHCl, pH 8,0. ДНК амплифицировали из элюата методом ПЦР с использованием фланкирующих праймеров T7TMV Fn и MK165-4 A20.
Созревание аффинности и специфичности KDR-связывающего VR28. Клон VR28 подвергали мутагенезу с помощью гипермутагенной ПЦР или олигонаправленного мутагенеза, как описано выше, и получали суббиблиотеки гибридов. После предварительной очистки шариками с белком А проводили селекцию в буфере I (1×PBS, 0,02% Тритон X-100, 1 мг/мл бычьего сывороточного альбумина, 0,1 мг/мл ДНК спермы лосося, pH 7,4) в течение четырех циклов, используя описанный выше способ. ДНК амплифицировали из элюата методом ПЦР с использованием фланкирующих праймеров T7TMV Fn и MK165-4 A20. Для библиотек, полученных в результате олигомутагенеза, использовали более низкие концентрации мишени (0,1 нM KDR в первых четырех циклах селекции), затем добавляли 1 нM мышиного VEGF-R2 (Flk-1) и проводили три дополнительных цикла селекции. Для ПЦР последних трех циклов в качестве праймеров использовали T7 TMV N-концевая делеция и MK165-4 A20.
Для созревания специфичности KDR-связывающего соединения 159 первые 6 положений петли FG клона 159 Q(8)L рандомизировали методом ПЦР, используя описанный выше способ. Связывание суббиблиотеки гибридов с биотинилированным мышиным VEGF-R2 (70 нM) проводили в буфере I при комнатной температуре в течение 30 минут. Остальную процедуру селекции проводили в KingfisherТМ (ThermoLabSystems). Биотинилированную мишень улавливали на 50 мкл покрытых стрептавидином магнитных шариков (Dynal), после чего шарики промывали 10 объемами буфера I и одним объемом буфера J (1×PBS, 0,02% Тритон X-100, pH 7,4). Связанные гибридные молекулы элюировали 100 мкл 0,1 M KOH на 50 мкл 1 M TrisHCl, pH 8,0. ДНК амплифицировали из элюата с использованием праймеров F1U2 и C2asaiA20. После четырех раундов селекции проводили два дополнительных цикла селекции по скорости обратной реакции/повторному связыванию против 7 нM Flk-1, используя описанный ниже способ. Реакции связывания с биотинилированным мышиным Flk-1 давали протекать в течение 30 минут, после чего добавляли 100-кратный избыток небиотинилированного Flk-1 и реакцию оставляли протекать в течение еще 6 часов, чтобы слабые связывающие средства успели продисоциировать. Биотинилированную мишень улавливали на 50 мкл стрептавидиновых шариков (Dynal), после чего шарики промывали 5 раз 1 мл буфера J. Связанные гибридные молекулы элюировали путем инкубации при 75°C в течение 5 минут. Супернатант подвергали повторному связыванию с 7 нM Flk-1 и продолжали стандартную процедуру селекции. ДНК из последнего пула элюатов подвергали рандомизации по петле DE (см. выше) и проводили селекцию полученной суббиблиотеки гибридов против 7 нM мышиного VEGF-R2 в течение трех циклов. В четвертом цикле проводили селекцию по обратной скорости с повторным связыванием с 1 нМ человеческого VEGF-R2. Конечную ДНК амплифицировали из элюата методом ПЦР с использованием праймеров F1U2 и C2asaiA20.
Радиоактивный равновесный анализ связывания
Чтобы получить 35S-меченные связывающие белки, требующиеся для проведения анализа, получали мРНК по способу, описанному выше для получения гибрида РНК-белок, но стадию связывания линкера пропускали. мРНК экспрессировали с использованием набора для трансляции, содержащим лизат кроличьих ретикулоцитов (Ambion), в присутствии 35S-меченного Met при 30°C в течение 1 часа. Экспрессированный белок очищали на шариках M2-агарозы Flag (Sigma), используя описанный выше способ. С помощью данного способа получали кодируемый белок, не содержащий остатка нуклеиновой кислоты. В непосредственном анализе связывания добавляли гибриды VEGF-R2-Fc с концентрацией от 0 до 200 нM до получения постоянной концентрации очищенного белка (0,2 или 0,5 нM) и инкубировали при 30°C в течение 1 часа в буфере B. Комплексы рецептор-связывающее соединение улавливались магнитными шариками с белком А в течение 10 минут при комнатной температуре с использованием KingfisherТМ. Шарики промывали шестью объемами (по отношению к объему реакционной смеси) буфера B. Белок элюировали из шариков 100 мкл 0,1 M KOH. 50 мкл реакционной смеси и элюат сушили на LumaPlate-96 (Packard) и измеряли количество 35S на пластине с помощью прибора TopCount NXT (Packard). Количество каркасного белка на основе фибронектина, связанного с мишенью, определяли как процент радиоактивности, элюированной с магнитных шариков с белком А по сравнению с радиоактивностью в реакционной смеси. Неспецифическое связывание каркасных белков на основе фибронектина с шариками определяли путем измерения связывания в отсутствие KDR-Fc, оно составляет менее 1-2% от исходного количества радиоактивности. Специфическое связывание определяли путем вычитания неспецифического связывания из общего связывания. Данные анализировали с помощью программы GraphPad Prizm (GraphPad Software, Inc, San Diego, CA), используя нелинейное уравнение связывания.
Экспрессия и очистка соединений, связывающих каркасные белки на основе фибронектина:
Чтобы осуществить экспрессию в E.coli, остатки 1-101 в каждом клоне с последующим маркером His6 клонировали в векторе, полученном из pET9d, и затем экспрессировали в клетках E.coli BL21 (DE3) pLysS (Invitrogen). 20 мл культуры после культивирования в течение ночи вносили в 1 литр среды LB, содержащей 50 мкг/мл канамицина и 34 мкг/мл хлорамфеникола. Культуру выращивали при 37°C до получения значения A600 0,4-0,6. После индукции 1 мМ изопропил-β-тиогалактозидом (IPTG, Invitrogen) культуру выращивали в течение еще 3 часов при 37°C и собирали путем центрифугирования в течение 30 минут при 3000 g и 4°C. Клеточный осадок ресуспендировали в 50 мл буфера для лизиса K (50 мM NaH2PO4, 0,5 M NaCl, 5% глицерин, 5 мМ CHAPS, 25 мМ имидазол, 1× смесь протеазных ингибиторов CompleteTM (Roche), pH 8,0). Добавляли буфер L и обрабатывали ультразвуком на льду при 80 Вт с использованием четырех импульсов по 15 секунд с паузами между ними по 10 секунд. Растворимую фракцию отделяли центрифугированием в течение 30 минут при 30000 g и 4°C. Супернатант перемешивали вращением в течение 1 часа при 4°C с 10 мл металлосодержащей аффинной смолы TALONTM SuperflowTM (Clontech), предварительно уравновешенной буфером для промывания L (50 мM NaH2PO4, 0,5 MNaCl, 5% глицерин, 25 мМ имидазол, pH 8,0). Затем смолу промывали 10 объемами (по отношению к объему колонки) буфера L и 30 объемами буфера M (1×PBS, pH 7,4, 25 мМ имидазол, pH 7,4). Белок элюировали 5 объемами (по отношению к объему колонки) буфера N (1×PBS, 250 мМ имидазол, pH 7,4) и диализовали против 1×PBS при 4°C. Все осадки удаляли фильтрацией через фильтр с порами 0,22 мкм (Millipore).
Анализ BIAcore растворимых каркасных белков на основе фибронектина:
Кинетику связывания белков, связывающих каркасные белки на основе фибронектина, с мишенью измеряли с помощью датчика биологических параметров BIAcore 2000 (Pharmacia Biosensor). Гибриды человеческого и мышиного VEGF-R2 с Fc иммобилизовали на чипе датчика CM5 и вводили растворимые связывающие белки в концентрации, варьирующей от 0 до 100 нМ, в буфере O (10 мМ HEPES, 150 мМ NaCl, 0,005% твин 20, pH 7,4). Для каждой концентрации получали сенсограмы, анализировали их с помощью программы BIA Evaluation 2.0 (BIAcore) и определяли константы скорости ka (kon) и kd (koff.) Константу сродства KD рассчитывали как отношение констант скоростей koff/kon.
Для анализа ингибирования человеческий VEGF165 иммобилизовали на поверхности чипа CM-5 и вводили KDR-Fc в концентрации 20 нM в присутствии разных концентраций растворимых связывающих белков, варьирующих от 0 до 100 нM. IC50 определяли как концентрацию, при которой только 50% KDR-Fc связывается с чипом.
Обратимое повторное сворачивание VEGFR-связывающего полипептида:
Белок M5FL анализировали методом дифференциальной сканирующей калориметрии (DSC) в 100 мМ натрий-ацетатном буфере (pH 4,5). Начальный цикл DSC (скан 1) проводили в калориметре N-DSC II (Calorimetry Sciences Corp) путем постепенного повышения температуры от 5 до 95°C со скоростью 1 градус в минуту с последующим снижением температуры (не показано) до 10 градусов, затем проводили второй цикл (скан 2). В данных условиях данные подгонялись наилучшим образом с использованием модели двойного перехода (Tпл=77°C и 67°C, данные значения получали с использованием программы Orgin (OrginLab Corp)). См. Фиг.10.
Пэгилирование белка M5FL:
C100-форма белка M5FL, которая имеет полную последовательность M5FL с заменой Ser в положении 100 на цистеин, включая дополнительный C-концевой His-маркер, используемый для очистки белка. Очищенный белок M5FL-C 100 модифицировали по одному цистеиновому остатку путем конъюгации с различными малеимид-дериватизированными формами PEG (Shearwater). Полученные родственные белки разделяли на 4-12% полиакриламидном геле (фиг.11).
Получение клеточных линий:
Получение плазмиды. Плазмиды, кодирующие химерные рецепторы, состоящие из трансмембранного и цитоплазматического доменов рецептора человеческого эритропоэтина (EpoR), гибридизованных с внеклеточными доменами KDR, Flk-1, или человеческого TrkB, получали методом двухстадийной ПЦР. Продукты ПЦР, кодирующие внеклеточные домены, амплифицировали из плазмид, кодирующих полноразмерный ген рецептора: KDR (аминокислоты 1-764) получали из клона PR1371_H11 (OriGene Technologies, Rockville, MD) с использованием праймеров 5-RI-hKDR-1B/3-EPO/hKDR-2312B, flk-1 (аминокислоты 1-762) получают из клона #4238984 (IMAGE) с использованием праймеров 5-RI-mKDR-1/3-EPO/mKDR-2312, и человеческий TrkB (аминокислоты 1-430) получают из клона #X75958 (Invitrogen Genestorm) с использованием праймеров 5-RI-hTrkB-1/3-EpoR/hTrkB-1310. Продукты ПЦР, кодирующие трансмембранный и цитоплазматический домены EpoR (аминокислоты 251-508), амплифицировали из клона #M60459 (Invitrogen Genestorm) с использованием общего праймера 3-XHO-EpoR-3066 и одного из трех ген-специфических праймеров 5-hKDR/EPO-2274B (KDR), 5-mKDR/EPO-2274 (flk-1) и 5'hTrkB/EpoR-1274 (человеческий TrkB), которые добавляли короткую последовательность, комплементарную к концу продукта ПЦР рецепторного фрагмента. Затем продукты ПЦР, кодирующие две половины химерных генов, смешивали и амплифицировали с использованием 3-XHO-EpoR-3066 и 5'-праймеров (5-RI-hKDR-1B, 5-RI-mKDR-1 и 5-RI-hTrkB-1), специфичных для каждого гена, используемого в предыдущем цикле амплификации.
Полученные продукты ПЦР расщепляли EcoRI и XhoI и клонировали в pcDNA3.1(+) (Invitrogen) с получением плазмид phKE8 (гибрид человеческий KDR/EpoR), pmKE2 (гибрид flk-1/EpoR) и phTE (гибрид TrkB/EpoR).
Получение клеточных линий для проточной цитометрии. Клетки CHO-K1 (American Type Culture Collection, Manassas, VA) стабильно трансфицировали с использованием Lipofectamine 2000 (Invitrogen) либо одним pcDNA 3.1 (Invitrogen), одним pmKE2, либо смесью pcDNA 3.1 и плазмиды, кодирующей полноразмерный человеческий KDR (Origene Inc., клон PR1371-H11). Стабильные трансфектанты отбирали и поддерживали в присутствии 0,5 мг/мл Geneticin (Invitrogen). Человеческий KDR-экспрессирующий клон, обозначаемый CHO-KDR, и мышиную популяцию, экспрессирующую химерный белок VEGFR-2/EpoR, обозначаемую CHO-Flk, получали путем клеточного сортинга с активацией флуоресценцией трансфицированной популяции после окрашивания поликлональной антисывороткой против KDR (R&D Systems). Клеточные линии CHO-KDR и CHO-Flk выращивали обычным способом в модифицированной по Иглу среде Дульбекко (DMEM; Gibco), дополненной 10% (об./об.) фетальной бычьей сыворотки (FBS), 0,5 мг/мл генетицина, 100 ед./мл пенициллина, 0,25 мкг/мл амфотерицина B, 100 мкг/мл стрептомицина и 2 мМ L-глутамина.
Получение клеточных линий Ba/F3. Клеточные линии, которые пролиферировали в ответ на связывание VEGF с VEGFR-2, получают путем трансфекции мышиной пре-B-клеточной линии Ba/F3 (DSMZ, Braunschweig, Germany) с phKE8 или pmKE2, рецепторными химерами, состоящими из внеклеточных доменов человеческого или мышиного VEGFR-2, гибридизованных с трансмембранным и цитоплазматическим доменами рецептора человеческого эритропоэтина (см. выше). Ba/F3 поддерживали в минимальной Ba/F3 среде (RPMI-1640 (Gibco), содержащей 10% FBS, 0,25 мкг/мл амфотерицина B, 100 мкг/мл стрептомицина и 2 мМ L-глутамина), дополненной 10% кондиционированной средой, из клеток WEHI-3B (DSMZ; выращенных в среде Дульбекко, модифицированной по способу Исков (Gibco)/10% FBS/25 мкM β-меркаптоэтанол) как источник необходимых факторов роста. После электропорации с использованием плазмид pmKE2 или phKE8 проводили селекцию стабильных трансфектантов в 0,75 мг/мл генетицина. Устойчивые к генетицину популяции переносили в минимальную Ba/F3 среду, содержащую 100 нг/мл человеческого VEGF165 (R&D Systems), и полученные VEGF-зависимые популяции обозначали Ba/F3-Flk и Ba/F3-KDR. Контрольную линию клеток, экспрессирующих химерный рецептор TrkB (Ba/F3-TrkB), которые отвечали на стимуляцию NT-4, природный лиганд TrkB, получали подобным образом с использованием плазмиды phTE и человеческого NT-4 (R&D Systems).
Анализ клеточного поверхностного связывания каркасных белков на основе фибронектина:
Связывание каркасных белков на основе фибронектина с экспонированными на клеточной поверхности KDR и Flk-1 анализировали одновременно на VEGF-R2-экспрессирующих и контрольных клетках методом проточной цитометрии. Клетки CHO-pcDNA3 (контроль) высвобождали из чашек с помощью трипсин-EDTA, промывали Dulbecco's PBS, не содержащей кальция и магния (D-PBS-; Invitrogen), и окрашивали в течение 30 минут при 37°C 1,5 мкM CMTMR (5-(и-6)-(((4-хлорметил)бензоил)амино)-тетраметилродамин) (Molecular Probes). Клетки промывали D-PBS- и инкубировали еще 30 минут при 37°C, после чего ресуспендировали в блокирующем буфере (D-PBS-/10% фетальная бычья сыворотка) на льду. Клетки CHO-KDR или CHO-Flk обрабатывали идентично за исключением того, что CMTMR не используется. 75000 CMTMR-окрашенных клеток CHO-pcDNA3 смешивали с равным количеством неокрашенных клеток CHO-KDR или CHO-Flk в каждой лунке 96-луночного планшета с V-образным дном. Все антитела и каркасные белки на основе фибронектина разбавляли 25 мкл/лунку блокирующего буфера и каждую обработку проводили в течение 1 часа при 4°C. Смеси клеток окрашивали His6-меченными каркасными белками на основе фибронектина, дважды промывали холодным D-PBS- и затем обрабатывают 2,5 мкг/мл антитела MAb против His6 (R&D Systems), промывали и окрашивали 4 мкг/мл антитела против мышиных антител, конъюгированного с Alexa Fluor 488 (Molecular Probes). Для клеток, обработанных мышиным моноклональным антителом против KDR (Accurate Chemical, Westbury, NY) или козлиным поликлональным антителом против flk-1 (R&D Systems), стадию с использованием антител против His6 опускали, и связывание антитела детектировали с использованием вид-специфичного вторичного антитела, конъюгированного с Alexa Fluor 488 (Molecular Probes). После окрашивания клетки ресуспендировали в 200 мкл/лунку D-PBS-/1% FBS/1 мкг/мл 7-аминоактиномицина D (7-AAD; Molecular Probes) и анализировали проточной цитометрией на FACSCalibur (Becton Dickinson, San Jose, CA), оборудованном 488 нM лазером. После синхронизации для исключения мертвых клеток (7-AAD-положительных) в VEGFR-2-экспрессирующих клетках и клетках CHO-pcDNA3 независимо измеряли флуоресценцию Alexa Fluor 488 путем синхронизации по CMTMR-отрицательным или -положительным популяциям соответственно. Контрольные эксперименты демонстрировали, что CMTMR не препятствует детекции антител, конъюгированных с Alexa Fluor 488, на поверхности окрашенных клеток.
Клеточное поверхностное связывание также оценивали методом флуоресцентной микроскопии с использованием описанных выше вторичных антител. Для данных исследований антитела разбавляли DPBS, содержащим кальций и магний (D-PBS+)/10% FBS. Клетки выращивали на 24- или 96-луночных планшетах и после окрашивания держали в D-PBS+ для наблюдения под инвертированным флуоресцентным микроскопом.
Анализ пролиферации клеток Ba/F3:
Клетки Ba/F3 промывали три раза минимальной Ba/F3 средой и ресуспендировали в такой же среде, содержащей 15,8 нг/мл фактора, вызывающего пролиферацию (человеческого VEGF165, мышиного VEGF164 или hNT-4 для клеток Ba/F3-KDR, Ba/F3-Flk или Ba/F3-TrkB соответственно), после чего в 96-луночный планшет для культивирования тканей добавляли 95 мкл, содержащие 5×104 клеток Ba/F3-KDR или 2×104 клеток Ba/F3-Flk или Ba/F3-TrkB. 5 мкл серийного разведения тестируемого белка в PBS добавляли в каждую лунку до конечного объема 100 мкл среды Ba/F3/5% PBS/15 нг/мл фактора роста. После инкубации в течение 72 часов при 37°C измеряли пролиферацию, для этого в каждую лунку добавляли 20 мкл реагента CellTiter 96® Aqueous One Solution (Promega), инкубировали 4 часа при 37°C и измеряли поглощение при 490 нм с помощью ридера титрационных микропланшетов (Molecular Dynamics).
Анализ пролиферации клеток HUVEC:
Клетки HUVEC (Clonetics, Walkersville, MD) от 2-6 пассажей выращивали в среде EGM-2 (Clonetics). 5000 клеток/лунку ресуспендировали в 200 мкл минимальной среды (равные объемы DMEM (Gibco) и среды F-12K (ATCC), дополненной 0,2% фетальной бычьей сыворотки и 1× раствора пенициллина/стрептомицина/фунгизона (Gibco)), помещали в 96-луночные планшеты для культивирования тканей и инкубировали в течение 48 часов. В лунки добавляли связывающие белки на основе фибронектина и инкубировали 1 час при 37°С, затем добавляли человеческий VEGF165 до конечной концентрации 16 нг/мл. После инкубации в течение 48 часов измеряли жизнеспособность клеток путем добавления 30 мкл/лунку смеси 1,9 мг/мл реагента CellTiter96® AQueous MTS (Promega) и 44 мкг/мл феназинметасульфата (Sigma) и измерения поглощения при 490 нм, как описано выше для клеток Ba/F3.
Пример 12: VEGFR-связывающие полипептиды на основе легкой цепи антитела
На фиг.21A и 21B показаны аминокислотные последовательности VEGFR-связывающих полипептидов (SEQ ID NO: 241-310) на основе вариабельного участка легкой цепи (VL) антитела, используемого в качестве каркаса/остова.
Белки на основе вариабельного домена легкой цепи получали с использованием системы PROfusionТМ, как описано выше для Fn3-производных белков.
Все приведенные ссылки включены в данное описание в качестве ссылки во всей их полноте.
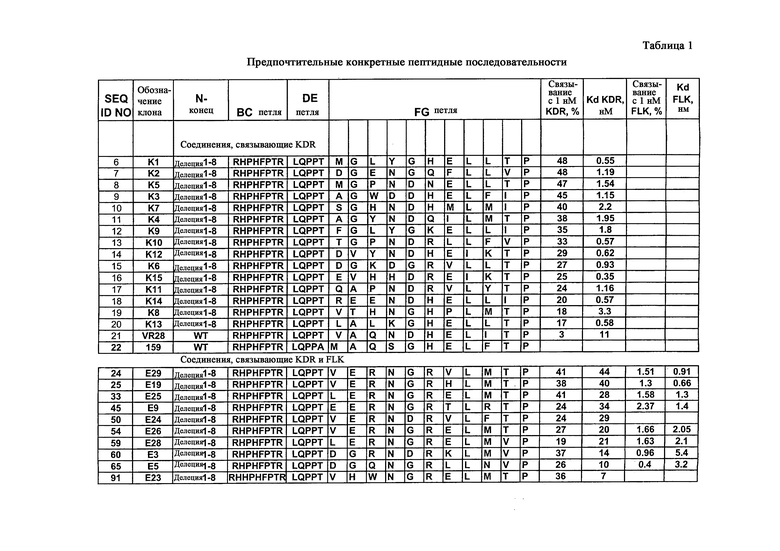
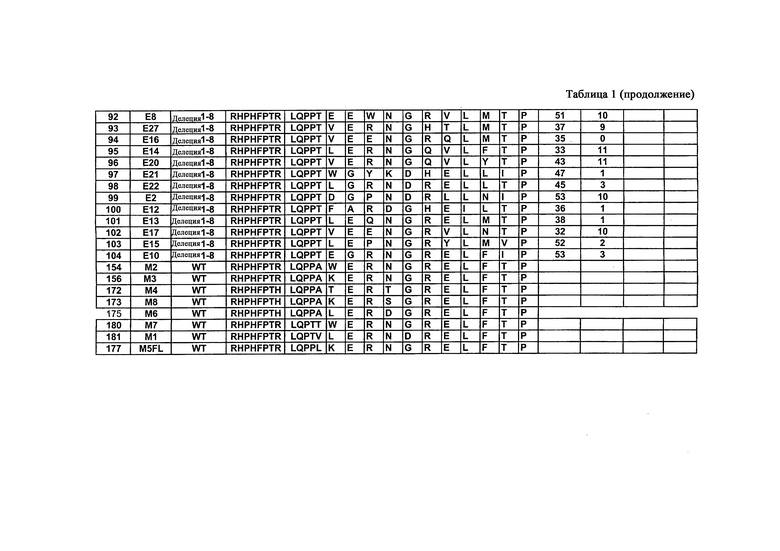
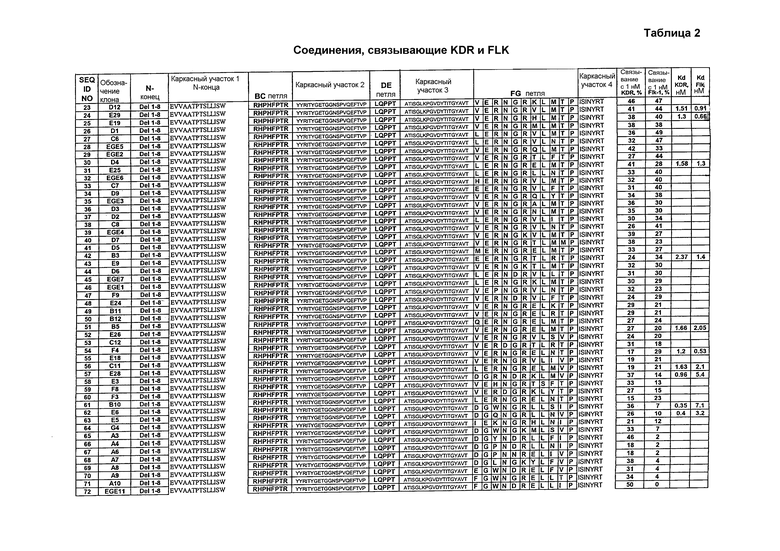

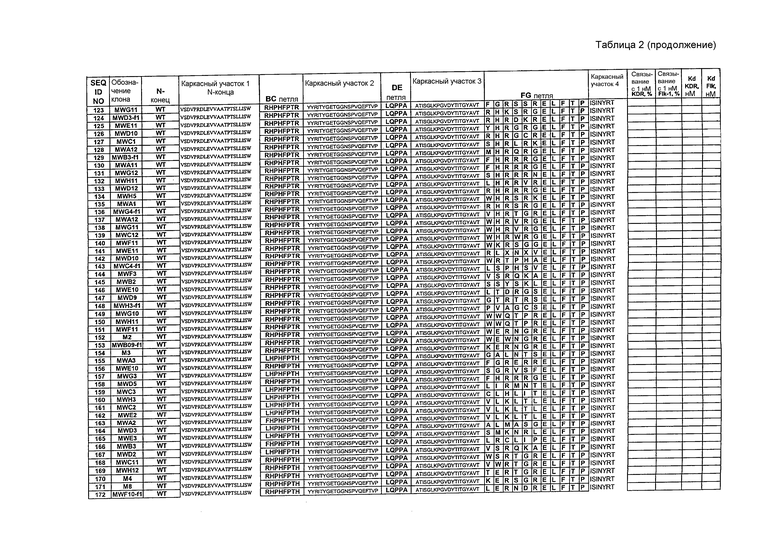
ID NO
с 1 нМ
KDR %
KDR нМ

(EC50, нМ)
(EC50, нМ)
KDR (Ba/F3-KDR) и Flk-1 (Ba/F3-Flk)
(IC50, нМ)
(IC50, нМ)
(1/Mс)×10-4
(1/с)
×105
(1/Mс)×10-4
(1/с)
×105
C100
PEG
PEG
| название | год | авторы | номер документа |
|---|---|---|---|
| СВЯЗЫВАЮЩИЕ БЕЛКИ, ИНГИБИРУЮЩИЕ ВЗАИМОДЕЙСТВИЯ VEGF-A РЕЦЕПТОРА | 2009 |
|
RU2550258C2 |
| СВЯЗЫВАЮЩИЕ БЕЛКИ, ИНГИБИРУЮЩИЕ ВЗАИМОДЕЙСТВИЕ VEGF-A РЕЦЕПТОРА | 2009 |
|
RU2650765C1 |
| АНТИ-АНГИОГЕННЫЕ СОЕДИНЕНИЯ | 2009 |
|
RU2511420C2 |
| ДНК-ВАКЦИНА ПРОТИВ ПРОЛИФЕРИРУЮЩИХ ЭНДОТЕЛИАЛЬНЫХ КЛЕТОК И СПОСОБЫ ЕЕ ПРИМЕНЕНИЯ | 2003 |
|
RU2318019C2 |
| НАНОАНТИТЕЛО V9, СВЯЗЫВАЮЩЕЕ VEGF, И СПОСОБ ЕГО ПОЛУЧЕНИЯ, КОДИРУЮЩАЯ V9 НУКЛЕОТИДНАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ И СОДЕРЖАЩИЙ ЕЕ ВЕКТОР, СПОСОБ ИНГИБИРОВАНИЯ ПРОЛИФЕРАЦИИ ЭНДОТЕЛИАЛЬНЫХ КЛЕТОК | 2008 |
|
RU2395521C1 |
| КОМПОЗИЦИИ ГУМАНИЗИРОВАННЫХ СЛИТЫХ БЕЛКОВ NOTCH И СПОСОБЫ ЛЕЧЕНИЯ | 2008 |
|
RU2532830C2 |
| АКТИВНАЯ ИММУНОТЕРАПИЯ ПРОТИВ АНГИОГЕНЕЗА | 2003 |
|
RU2329824C2 |
| ОСНОВАННЫЕ НА Notch3 ЧЕЛОВЕКА ГИБРИДНЫЕ БЕЛКИ В КАЧЕСТВЕ ЛОВУШЕК-ИНГИБИТОРОВ ПЕРЕДАЧИ СИГНАЛА Notch3 | 2009 |
|
RU2567662C2 |
| СТАБИЛЬНЫЕ И РАСТВОРИМЫЕ АНТИТЕЛА, ИНГИБИРУЮЩИЕ VEGF | 2016 |
|
RU2648152C2 |
| ТЕРАПЕВТИЧЕСКИЕ АГЕНТЫ, СОДЕРЖАЩИЕ ПРОАПОПТОЗНЫЕ БЕЛКИ | 2002 |
|
RU2319709C2 |
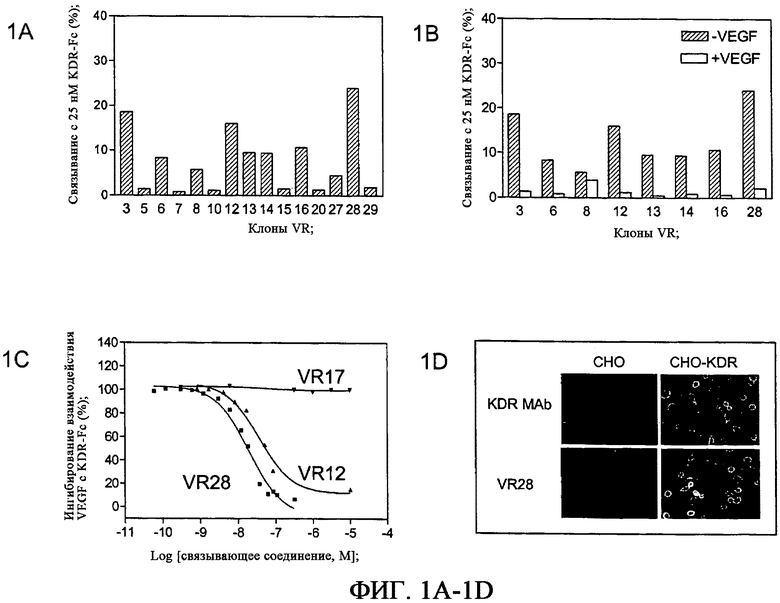
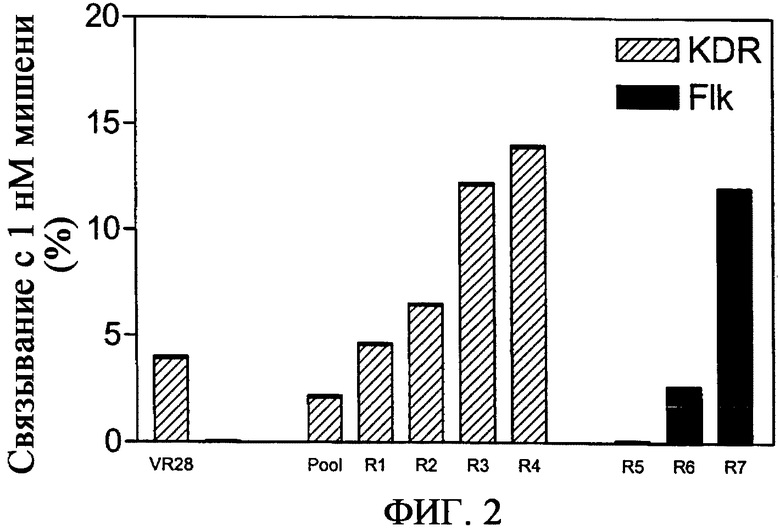
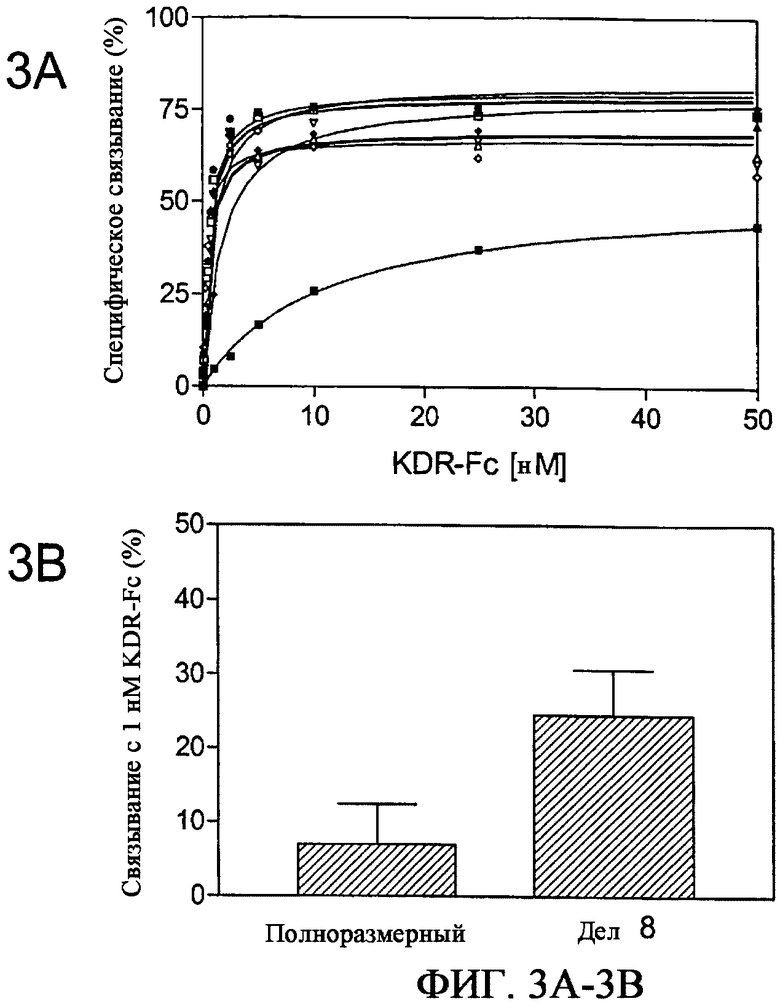

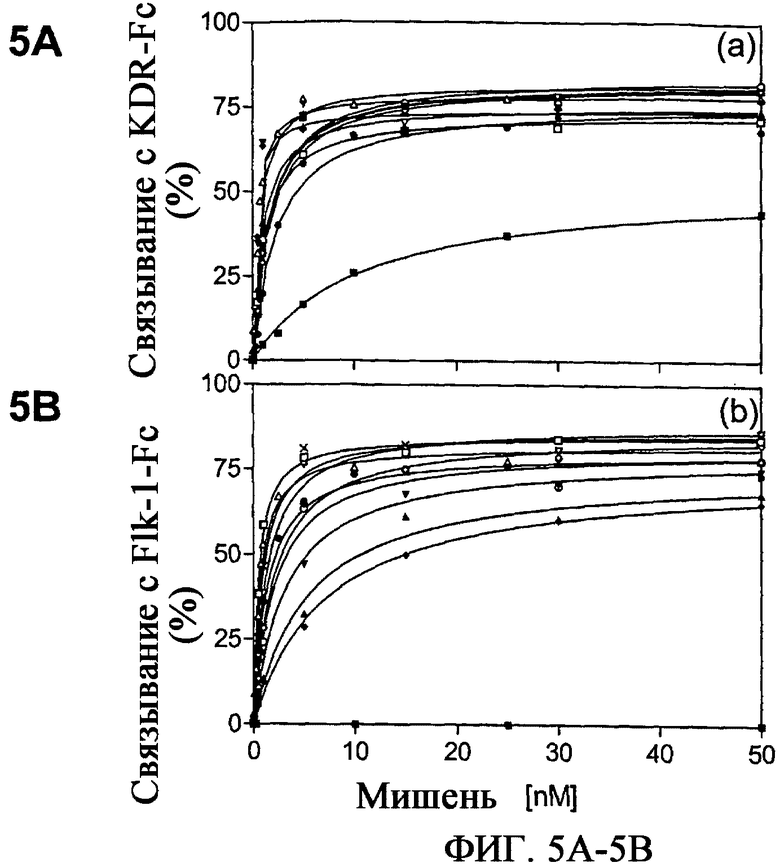

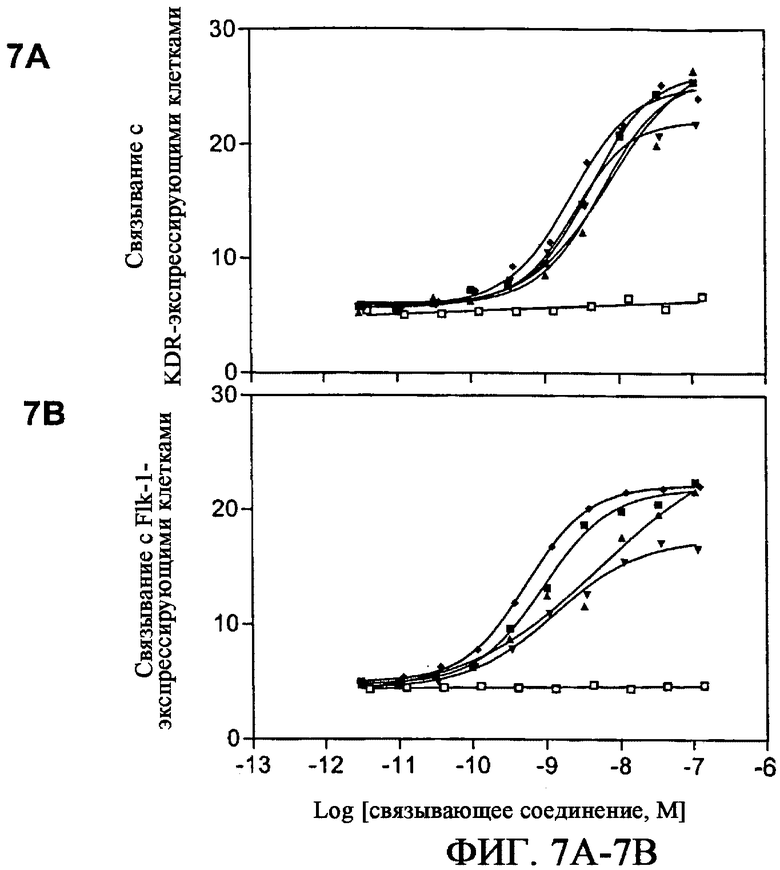
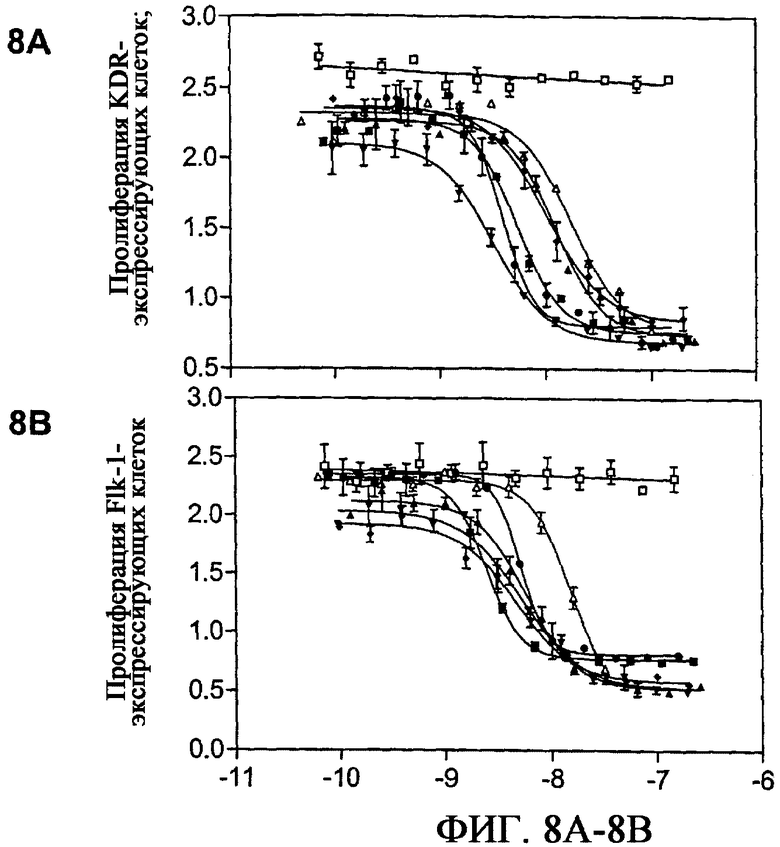
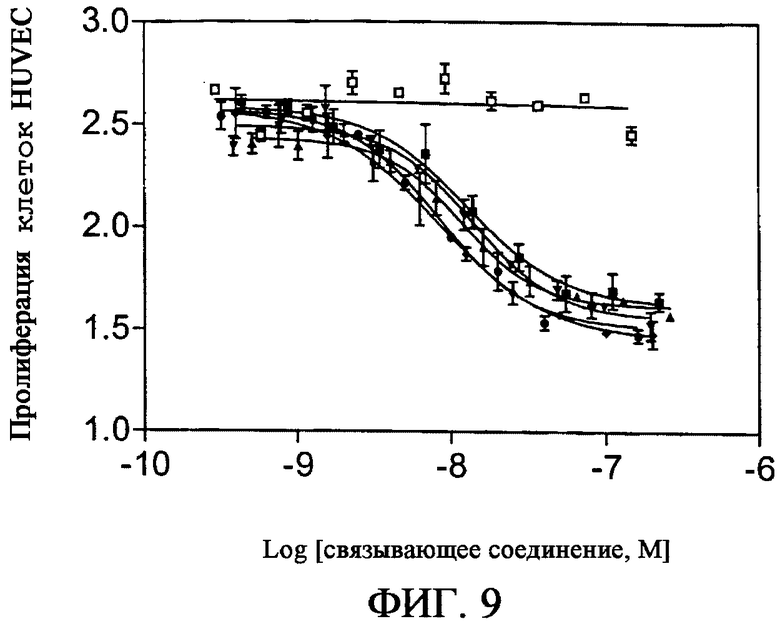
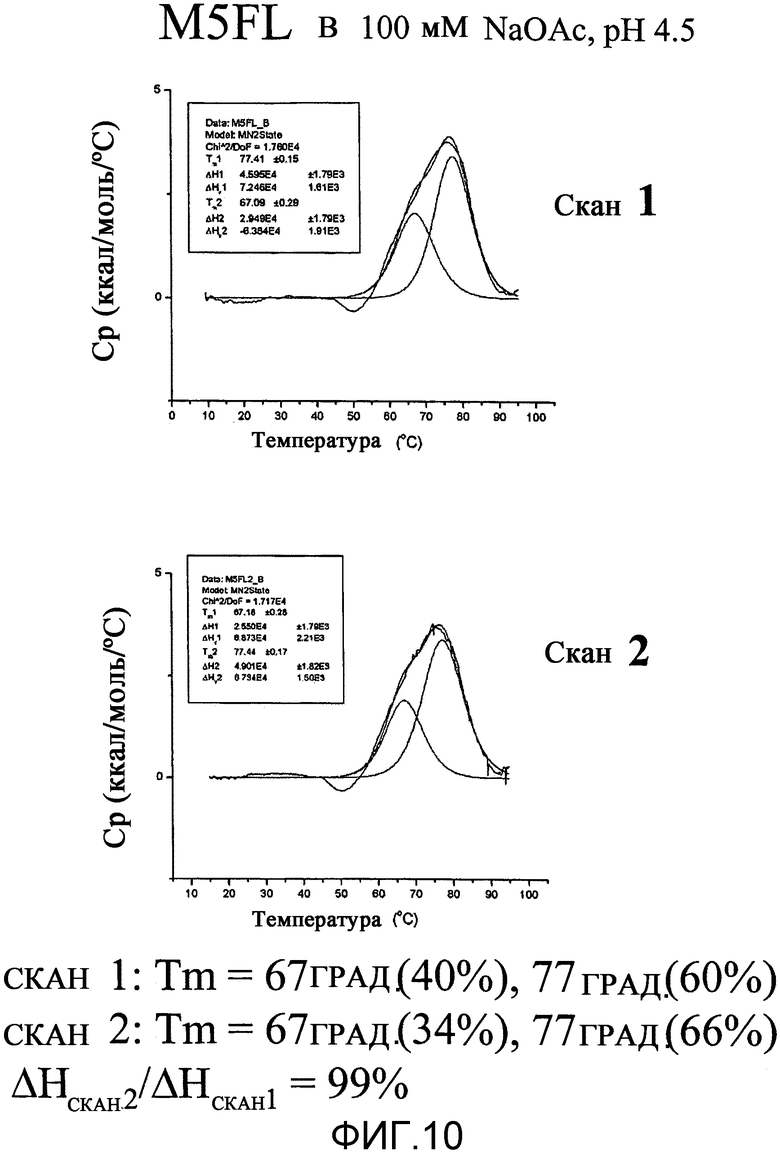
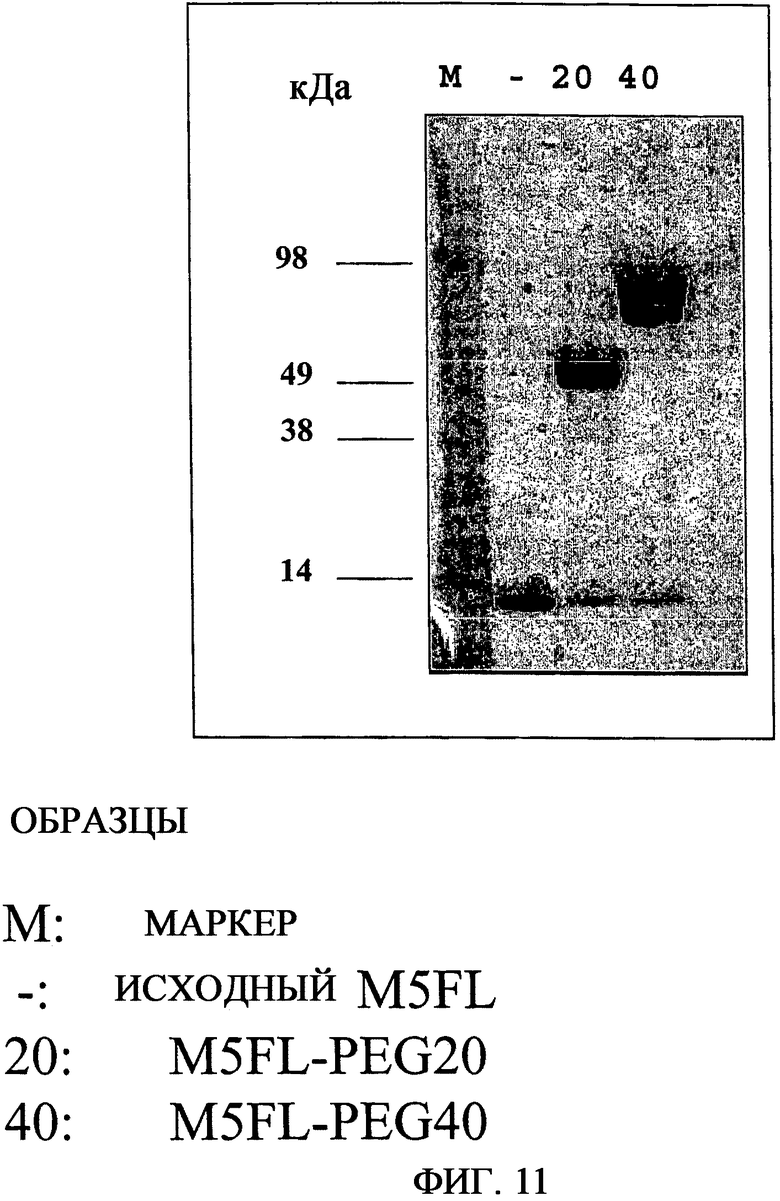
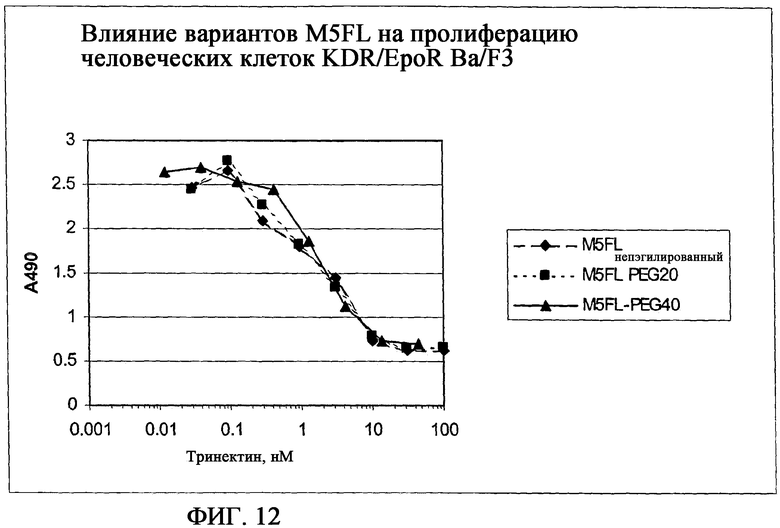
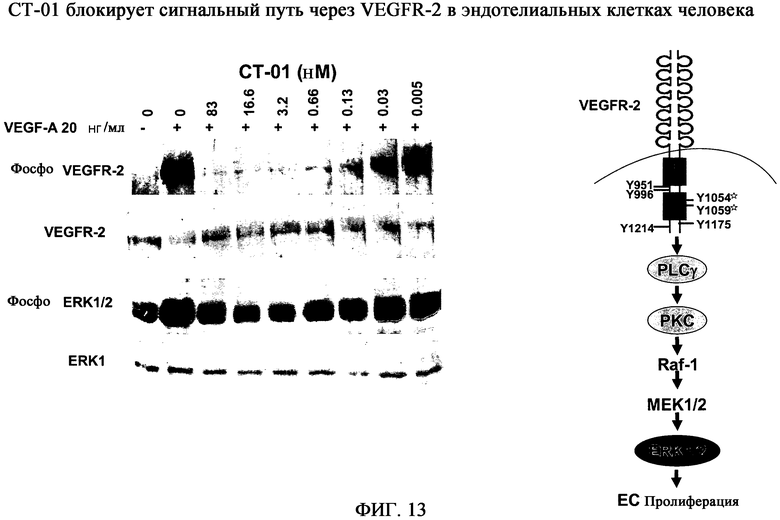
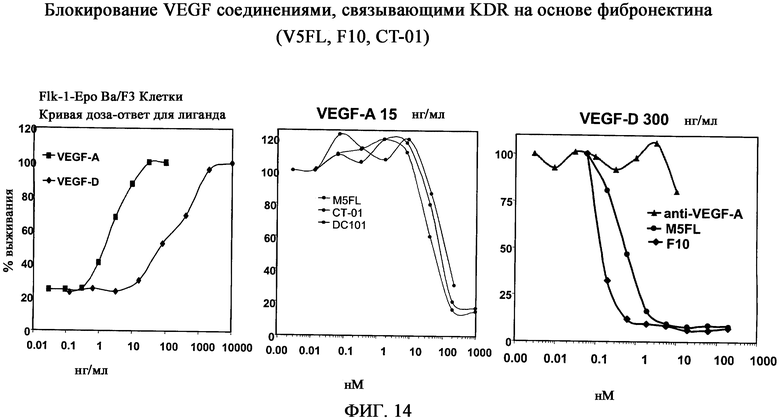
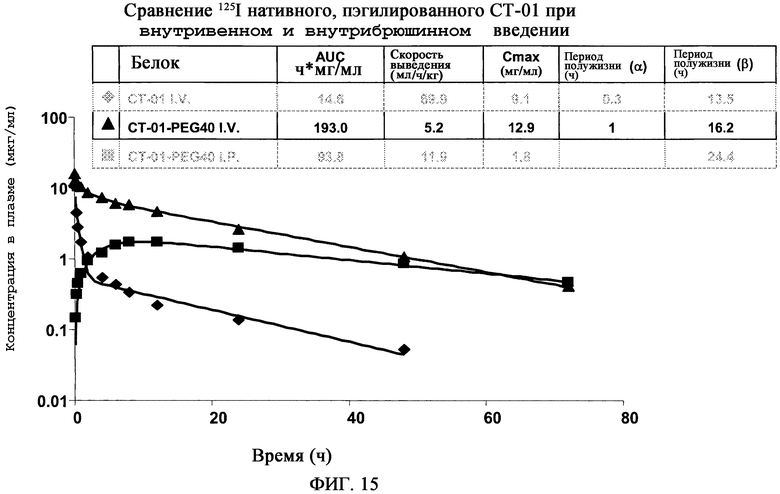
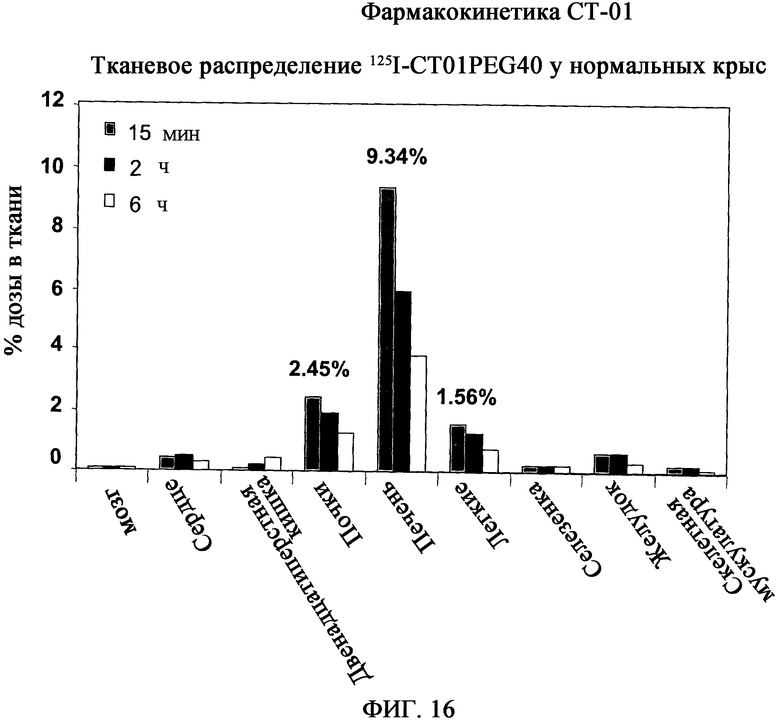
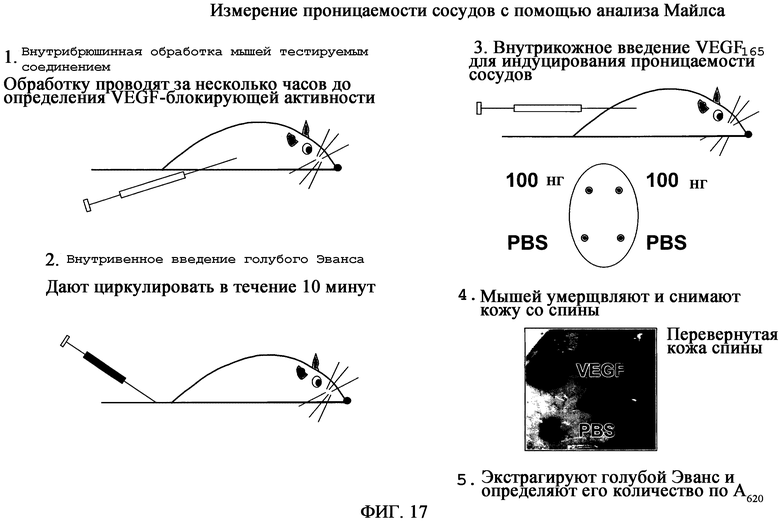

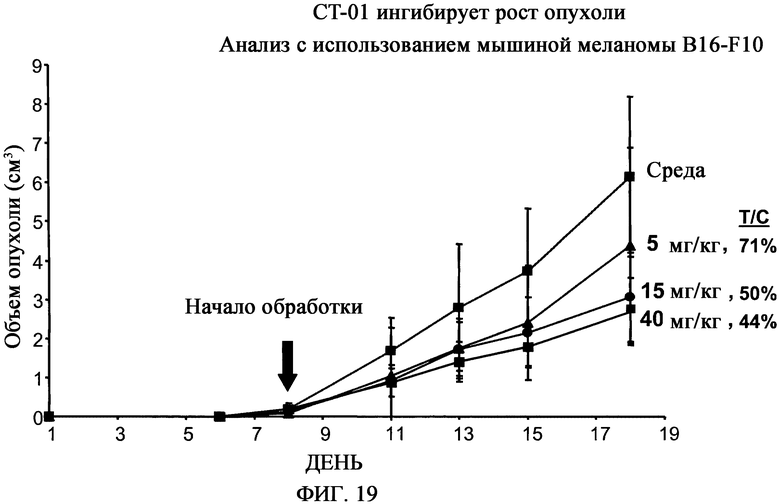
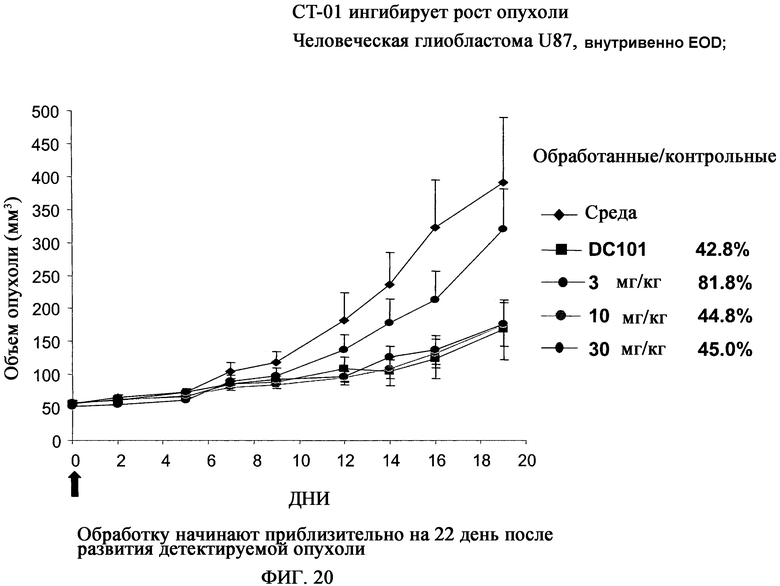


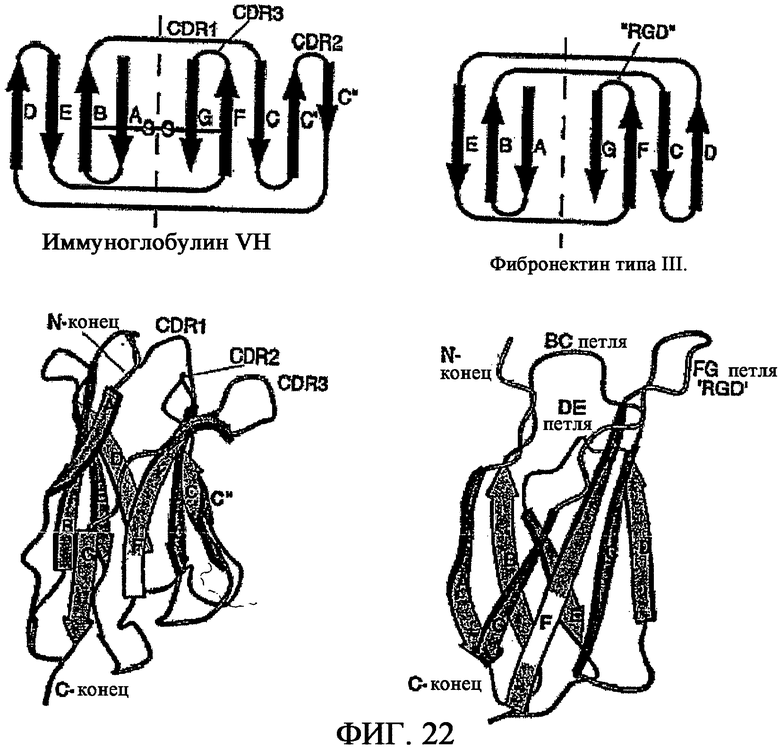
Настоящее изобретение относится к области биотехнологии и может быть использовано в медицине при диагностике и лечении состояний, связанных с аномальным ангиогенезом. На основе аминокислотной последовательности домена 10 человеческого фибронектина III типа (10Fn3) получена группа мутантных полипептидов, способных конкурировать с природным фактором роста эндотелия сосудов (VEGF-A) за связывание с рецептором VEGFR-2 (KDR), а также ПЭГ-илированные формы этих полипептидов с улучшенными фармакокинетическими характеристиками. Предлагается использовать новые полипептиды и их ПЭГ-производные для ингибирования биологических активностей, опосредованных VEGF, в частности, в терапии раковых заболеваний. 7 н. и 11 з.п., 31 ил., 11 табл.
1. По существу, чистый полипептид, способный связываться с KDR и конкурировать с VEGF-A за связывание с KDR, отличающийся аминокислотной последовательностью, которая идентична любой из последовательностей SEQ ID NO:6-112 и 192-197 или получена из указанных последовательностей путем консервативных замен.
2. Полипептид по п.1, где указанный полипептид связывает указанный KDR с KD, составляющей 50 нМ или менее.
3. Полипептид по п.1, где полипептид связывает KDR с KD, составляющей менее 1·10-7 М, и ингибирует KDR-опосредованную активность VEGF.
4. Полипептид, способный связываться с KDR и конкурировать с VEGF-A за связывание с KDR и имеющий аминокислотную последовательность SEQ ID NO: 192.
5. Полипептид, способный связываться с KDR и конкурировать с VEGF-A за связывание с KDR и имеющий аминокислотную последовательность SEQ ID NO: 193.
6. Полипептид, способный связываться с KDR и конкурировать с VEGF-A за связывание с KDR и имеющий аминокислотную последовательность SEQ ID NO: 194.
7. Терапевтическая композиция для использования в раковой терапии, содержащая полипептид по любому из пп.1-6 и фармацевтически приемлемый носитель.
8. Способ детекции VEGFR-2 человека (KDR) в образце, предусматривающий
a) контактирование указанного образца с полипептидом по любому из пп.1-6, где указанное контактирование осуществляют в условиях, обеспечивающих образование комплекса полипептид-KDR, и
b) детекцию указанного комплекса и посредством этого детекцию указанного KDR в указанном образце.
9. Способ по п.8, где указанную детекцию проводят с использованием метода, выбранного из группы, состоящей из радиографии, иммунологического анализа, флуоресцентной детекции, масс-спектроскопии или поверхностного плазмонного резонанса.
10. Способ по п.8, где указанный образец представляет собой биологический образец.
11. Способ по п.8, где указанный полипептид помечен маркирующим фрагментом, обеспечивающим детекцию.
12. Способ по п.11, где указанный маркирующий фрагмент выбран из группы, состоящей из радиоактивного фрагмента, флуоресцентного фрагмента, хромогенного фрагмента, хемилюминесцентного фрагмента или гаптенового фрагмента.
13. Способ по п.8, где указанный полипептид иммобилизован на твердом носителе.
14. Производное полипептида, которое связывается с человеческим KDR, с улучшенными фармакокинетическими свойствами по сравнению с соответствующим полипептидом, представляющее собой полипептид по любому из пп.1-6, ковалентно связанный с фрагментом полиэтиленгликоля (PEG).
15. Производное полипептида по п.14, где фрагмент PEG присоединен к тиольной группе или к аминогруппе.
16. Производное полипептида по п.14, где фрагмент PEG присоединен к полипептиду путем сайт-направленного пэгилирования.
17. Производное полипептида по п.16, где фрагмент присоединен к остатку Cys.
18. Производное полипептида по п.14, где молекулярная масса фрагмента PEG находится в интервале приблизительно от 2 до 100 кДа.
| LI В | |||
| ЕТ AL., J.Biol | |||
| Chem., 2000, 275, 29823-29828 | |||
| BATORI V | |||
| ЕТ AL., Protein Eng | |||
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| US 5922676, 13.07.1999. | |||
Авторы
Даты
2010-10-27—Публикация
2004-12-06—Подача