Настоящее изобретение относится к органической химии, а именно к N-арил-1,8-нафталимидам, конкретно к новым соединениям - 4-замещенным N-арил-1,8-нафталимидам, содержащим в N-арильном заместителе остаток краун-эфира (с различной комбинацией атомов кислорода, азота и серы) общей формулы (I)
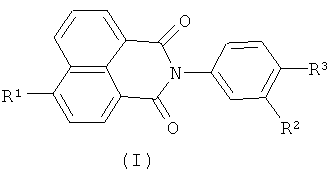
где R1=NO2, Br, NH2, OCH3, NHCOCH3
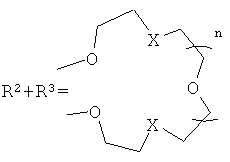
Ia: Rl=NO2, X=S, n=1
Ib: R1=NO2, x=NCH3, n=1
Ic: R1=NO2, X=NCH3, n=2
Id: R1=Br, X=NCH3, n=2
Ie: R1=NH2, X=S, n=1
If: R1=NHCOCH3, X=S, n=1
Ig: R1=OMe, X=S, n=1
Ih: R1=OMe, X=NCH3, n=1
Ii: R1=OMe, X=NCH3, n=2,
и к способам их получения.
Изобретение наиболее успешно может быть использовано для создания оптических сенсоров и оптических датчиков, применяемых для оперативного контроля концентраций примесей в жидкостях в лабораторных и полевых условиях.
Указанные соединения, их свойства и способ получения в литературе не описаны. Соединения содержат неизвестное ранее сочетание хромофлуорофорного фрагмента 1,8-нафталимида и бензокраун-эфира с новой электронной структурой связи между ними, что позволяет отнести это соединение к новому классу красителей - флуоресцентных рецепторов на катионы металлов.
Известны тиакраун- и азатиакраун-соединения различного строения (М.Хираока. Краун-соединения: свойства и применение. М.: Мир, 1986, 363 С.), для которых обнаружена способность к связыванию катионов тяжелых металлов, однако отсутствует поглощение в видимой и ближней УФ-области спектра, например:
Известны люминесцентные pH сенсоры на основе нафталимидов, которые способны менять свои оптические характеристики только в зависимости от концентрации протонов в растворах, но не пригодны для детектирования катионов металлов (патент США №8,097,725).
Известно, что 1,8-нафталимид используют для контроля степени разложения масел, которую определяют по концентрации и активности катионов водорода в растворе. Протон при взаимодействии с нафталимидом вызывает его оптические изменения, и по разнице спектров поглощения и флуоресценции определяют степень деструкции масла (патент США №5,472,878).
Известно, что для флуоресцентной детекции катионов щелочных металлов используют оксоазакраунсодержащие производные нафталимида, нанесенные на инертную подложку - аминоцеллюлозу. В качестве ионофорных фрагментов для детекции катионов натрия используют моноаза-15-краун-5 эфир (патент США №5,952,491), а для детекции катионов калия применяют диазакраунсодержащие криптанды (патент США №6,124,135).
Известны производные 1,8-нафталимида, которые могут использоваться в качестве флуоресцентных сенсоров на парамагнитные катионы металлов в неводных растворах. Представленные данные свидетельствуют о разрушении комплекса с катионом металла в растворах, содержащих 50% объемных долей воды (патенты Великобритании №2306496, №2287317).
Таким образом, известные сенсоры на катионы щелочно-земельных, переходных и тяжелых металлов имеют ряд общих недостатков, а именно:
- не поглощают свет в видимой области спектра, поэтому визуальное определение комплексообразования невозможно;
- имеют низкую константу устойчивости комплексов, т.е. возможно разрушение комплекса, что делает невозможным детекцию катиона металла;
- как правило, не имеют флуоресцентного отклика на связывание детектируемых катионов, т.е. не являются флуоресцентными сенсорами.
Известны два способа получения 4-замещенных N-арил-1,8-нафталимидов.
Первый способ состоит в ацилировании аминов бензольного ряда 4-нитронафталевым ангидридом при кипячении в 80% уксусной кислоте, восстановлении нитрогруппы до аминогруппы хлоридом олова (II) в соляной кислоте и последующем ацилировании аминонафталимидов ангидридом уксусной кислоты (Панченко П.А., Федоров Ю.В., Федорова О.А., Перевалов В.П., Йонушаускас Г. Синтез и спектрально-люминесцентные свойства 4-(ацетил)-амино-H-арилнафталимидов, содержащих электронодонорные группы в N-арильном заместителе // Изв. АН. Сер. хим. - 2009. - №6, c.1199-1206).
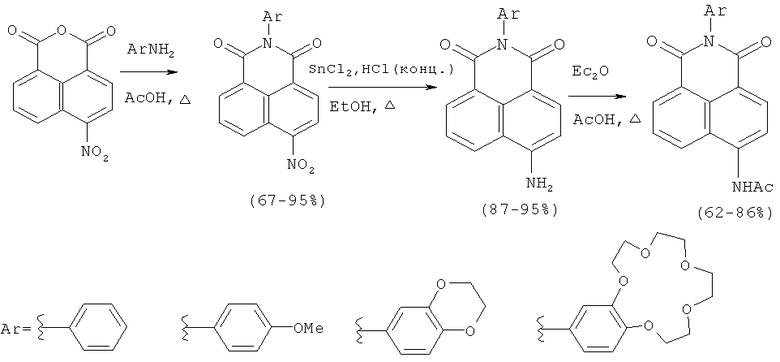
Известно, что указанный способ применяют для синтеза производных 4-амино- и 4-ацетиламинонафталимида, содержащих в качестве арильного заместителя фенильную, 4-метоксифенильную, бензодиоксановую группы или бензо-15-краун-5-эфирный фрагмент, в состав макроцикла которого входят только атомы кислорода. Недостатком способа является ограниченность его применения: он не применим для синтеза нафталимидов, содержащих такие гетероатомы, как азот и сера в макроцикле арильного заместителя, так как на стадии восстановления образуются прочные комплексы с катионами олова. Указанный способ выбран в качестве прототипа для одного из заявляемых способов (способ А) получения соединений формулы (I).
Известен способ получения 4-замещенных N-арил-1,8-нафталимидов путем ацилирования замещенных аминов бензольного ряда 4-бромнафталевым ангидридом в присутствии ацетата цинка и молекулярных сит при кипячении с последующим замещением брома в продукте ацилирования на метоксигруппу кипячением с метилатом натрия и бромидом меди(I) в метаноле (Cao Н., Chang V., Hernandez R., Heagy M.D. Matrix screening of substituted N-aryl-1,8-naphthalimides reveals new dual fluorescent dyes and unusuallv bright pyridine derivatives. // J. Org. Chem. - 2005. - Vol.70. - P.4929-4934).
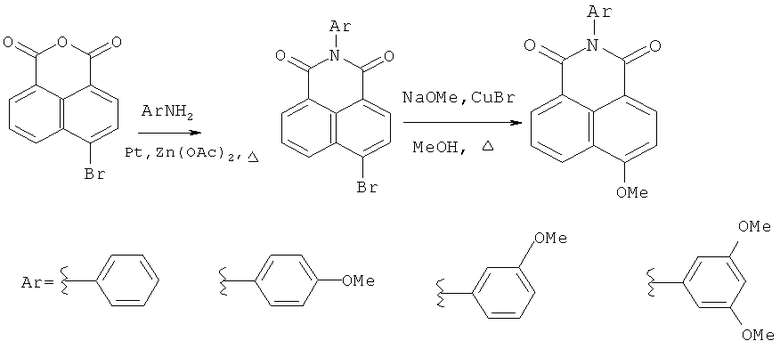
Для получения N-арил-1,8-нафталимидов, в которых N-арильный заместитель содержит остаток краун-эфира, данный способ не применяли. Способ не применим для синтеза замещенных N-арил-1,8-нафталимидов, арильный заместитель которых содержит остаток краун-эфира с атомами азота или серы в составе макроцикла, так как подобные ионофоры способны к образованию прочных комплексов с катионами меди в ходе реакции замещения.
Задачей настоящего изобретения является получение новых соединений, проявляющих свойства оптических флуоресцентных сенсоров на катионы щелочно-земельных, переходных и тяжелых металлов, и разработка способов их получения.
Поставленная задача решается заявляемыми соединениями формулы (I) - 4-замещенными N-арил-1,8-нафталимидами (If-i), в которых арильный заместитель содержит краун-эфирный фрагмент с гетероатомами О, N и S в макроцикле, и разработкой способов их получения (А и Б), в которых в качестве полупродуктов используют заявляемые соединения формул (1а-е).
Способ А, включающий (i) ацилирование первичных ароматических аминов нитрофталевым ангидридом при кипячении в 80% уксусной кислоте, (ii) восстановление нитрогруппы в образующихся нитронафталимидах, (ii) ацилирование полученных аминонафталимидов уксусным ангидридом и последующее выделение целевого продукта формулы I известными методами, отличается тем, что в качестве первичных ароматических аминов используют ариламины, содержащие краун-эфирный фрагмент с гетероатомами О, N и S в макроцикле, а восстановление нитрогруппы в нитронафталимидах проводят гидразин-гидратом в присутствии никеля Ренея при кипячении в диметилформамиде (Схема 1).
Схема 1
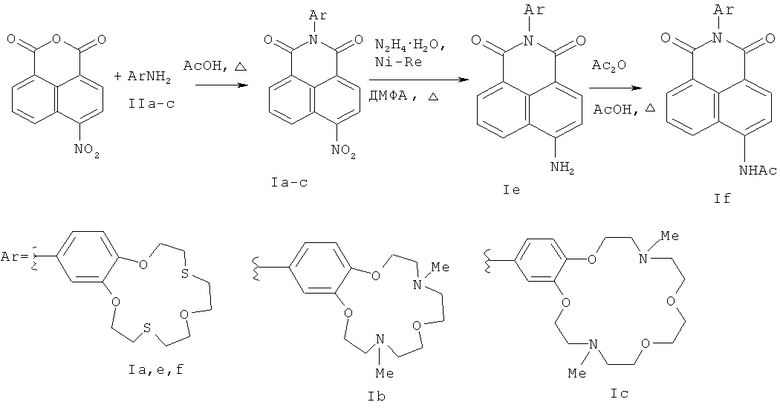
Способ Б включает (1) ацилирование первичных ароматических аминов 4-замещенным нафталевым ангидридом в присутствии ацетата цинка и молекулярных сит при кипячении в пиридине, (2) последующее взаимодействие полученных продуктов ацилирования с метилатом натрия в метаноле и выделение соответствующего целевого соединения формулы I (где R1=ОМе) известными приемами, заявляемый способ отличается тем, что взаимодействие с метилатом натрия в метаноле проводят при температурах от 20 до 50°С, в качестве 4-замещенного нафталевого ангидрида возможно использовать 4-нитронафталевый ангидрид, а в качестве первичных ароматических аминов используют ариламины, содержащие краун-эфирный фрагмент с гетероатомами О, N и S в макроцикле (Схема 2).
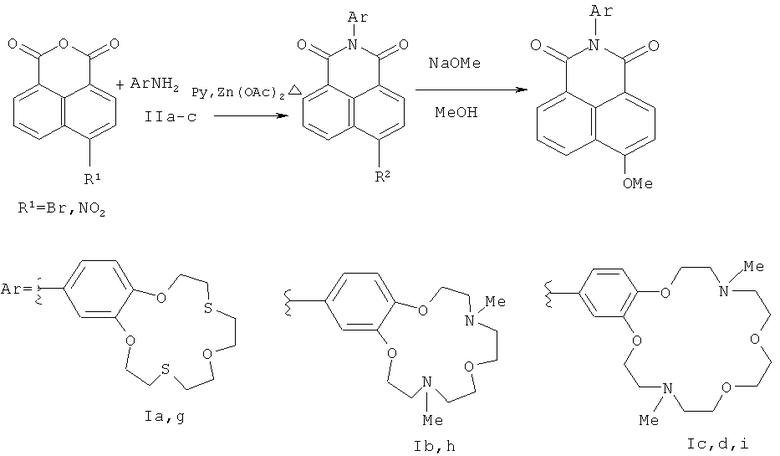
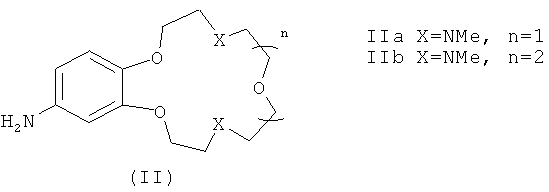
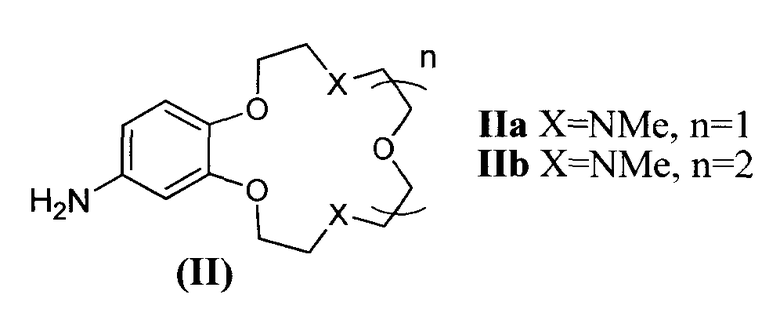
В качестве исходных веществ в заявляемых способах А и Б для получения соединений формулы (I) используют ароматические амины формулы (II)
Заявляемый способ А (схема 1) является более универсальным, чем его прототип. Использование никеля Ренея в качестве восстановителя вместо хлорида олова, используемого в способе-прототипе, позволяет получать производные нафталимидов, содержащие гетероатомы N и S в макроцикле.
В заявляемом способе Б (схема 2) для ацилирования ароматических аминов в качестве исходного соединения 4-замещенным нафталевым ангидридом можно использовать 4-нитронафталевый ангидрид наряду с 4-бромнафталевым ангидридом. В отличие от известного способа (Cao Н., Chang V., Hernandez R., Heagy M. D. Matrix screening of substituted N-aryl-1,8-naphthalimides reveals new dual fluorescent dyes and unusually bright pyridine derivatives. // J. Org. Chem. - 2005. - Vol.70. - P.4929-4934), способ Б может быть осуществлен в мягких условиях, даже при комнатной температуре. Кроме того, способ не требует использования солей меди, что позволяет получать 4-метоксизамещенные нафталимиды формулы (I), арильный заместитель которых содержит макроциклы с N- и S-гетероатомами.
Соединения (Iа-с, е), получаемые на первой стадии способа А, могут далее использоваться как полупродукты для проведения второй стадии способа Б, а не только на последующих стадиях способа А. Соответственно, полупродукты (Iа-с, е), получаемые на первой стадии способа Б, можно использовать для последующих стадий способа А.
В заявляемых способах получения соединений формулы (I) в качестве исходных веществ используют первичные ароматические амины формулы (II)
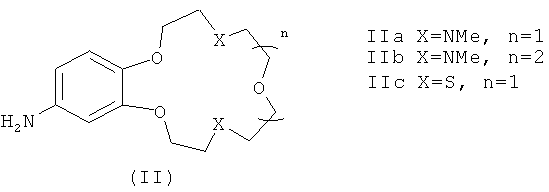
в которые уже введен остаток краун-эфира, и последующие превращения затрагивают только заместители в положении 4 нафталимидного фрагмента.
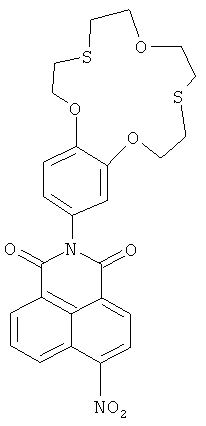
Ариламин IIс - 4-амино-бензодитиа-15-краун-5-эфир - представляет собой известное соединение (Abramov A.A., Averina N.V., Iofa В.Z., Samoshin V.V., Ivanova N.A., Sapozhnlkov Yu.A., Zefirov N.S. Study of the extraction of strontium (II) and lead (II) by crown and dithiacrown ethers // Chemistry of Heterocyclic Compounds. - 1997. - Vol.33. - №8. - P.982-985), а его солянокислая соль является коммерчески доступным продуктом (Acros).
Ариламины IIа, b представляют собой новые соединения, которые были получены восстановлением соответствующих нитросоединений, содержащих остаток краун-эфира (IIIа, b) (схема 3), и охарактеризованы.
Схема 3
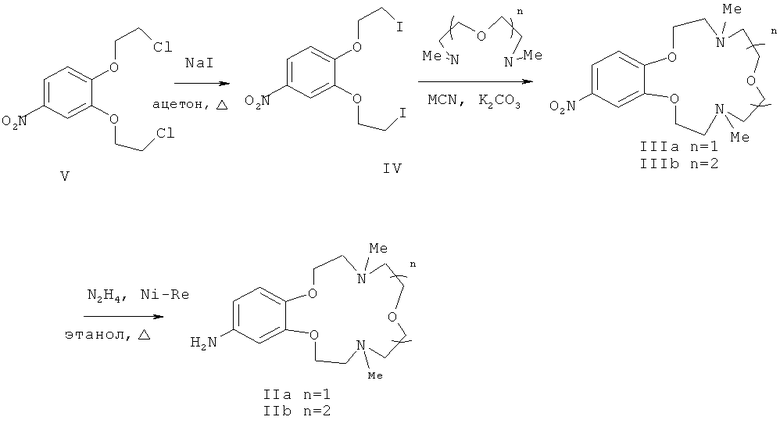
Вышеупомянутые 4-нитросоединения (IIа, b) получают конденсацией 3,4-ди(2-йодэтокси)нитробензола (IV), полученного из 3,4-бис(2-хлорэтокси) нитробензола (V), с 1,5-бис(метиламино)-3-оксапентаном или 1,8-бис(метиламино)-3,6-диоксаоктаном соответственно по способу, аналогичному описанному в статье (М.С.Ощепков, В.П.Перевалов, Л.Г.Кузьмина, А.В.Анисимов, О.А.Федорова. Высококонцентрационная макроциклизация подандов в синтезе азакраун-эфиров и бензокриптандов // Изв. А.Н. Сер. Хим., 2011, 3, 468-475). Соединение V получают из 2-хлорэтанола и пирокатехина известным способом (Abramov A.A., Averina N.V., Iofa В.Z., Samoshin V.V., Ivanova N.A., Sapozhnlkov Yu. A., Zefirov N.S. Study of the extraction of strontium(II) and lead(II) by crown and dithiacrown ethers // Chemistry of Heterocyclic Compounds. - 1997. - Vol.33. - №8. - P.982-985).
Строение всех полученных соединений доказано с помощью ЯМР- и УФ-спектроскопии, а также подтверждено данными элементного и масс-спектрометрического анализа. Необходимые для осуществления заявляемых способов исходные соединения, такие как аценафтен, 4-нитронафталевый ангидрид, 4-бромнафталевый ангидрид, пирокатехин, 2-хлорэтанол, 1,8-бис(метиламино)-3,6-диоксаоктан, 1,5-бис(метиламино)-3-оксапентан, 2,2'-оксидиэтантиол, 4-амино-бензодитиа-15-краун-5-эфир (IIс) в виде солянокислой соли (Acros), являются коммерчески доступными реагентами.
Изобретение иллюстрируется следующими примерами.
Пример 1. Получение соединения If (способ А)
(i) 6-Нитро-2-(2,3,5,6,8,9,11,12-октагидробензо[b] [1,4,10,7,13]иоксадитиа-циклопентадецин-15-ил)-1Н-бензо[d,е]изохинолин-1,3(2Н)-дион (Ia)
К суспензии 0.3 г (1.2 ммоль) 4-нитронафталевого ангидрида в 10 мл 80% водной уксусной кислоты прибавляют 0.65 г (1.8 ммоль) солянокислой соли ароматического амина IIс, 0.16 г (2.0 ммоль) ацетата натрия (для генерации свободного основания IIc). Реакционную массу нагревают до кипения, кипятят 1,5 часа, охлаждают до комнатной температуры. Выпавший осадок нитропроизводного N-арилнафталимида Iа отфильтровывают, промывают на фильтре 5% соляной кислотой, горячим 10% раствором Na2CO3, водой и этиловым спиртом. Продукт сушат при 80°C. Получают 0.56 г соединения Iа с выходом 84%. Т.пл. 228-230°C. Спектр 1Н ЯМР (300.13 МГц, ДМСО-d6, 23°C, δ/м. д., J/Гц): 2.85-3.11 (м, 8Н, СН2(16), СН2(17), СН2(20), СН2(21)), 3.68-3.78 (м. 4Н, СН2(18), СН2(19)), 4.08-4.17 (м, 2Н, СН2ОAr), 4.22-4.30 (м, 2Н, СН2OAr), 6.95 (дд, 1H, Н(14), 4J=2.2, 3J=8.6), 7.08 (д, 1Н, Н(10), 4J=2.2), 7.11 (д, 1Н, Н(13), 3J=8.6), 8.13 (дд, 1H, Н(6), 3J=7.4,3J=8.6), 8.58 (д, 1Н, Н(3), 3J=8.0), 8.62 (д, 1Н, Н(2), 3J=8.0), 8.64 (д,1H, Н(7), 3J=7.4), 8.76 (д, 1H, Н(5), 3J=8.6). Спектр 13С ЯМР (100.62 МГц, ДМСО-d6, 27°C, δ/м. д.): 30.28 (CH2S), 30.40 (CH2S), 30.74 (2×CH2S), 70.65 (CH2O), 70.69 (CH2O), 70.98 (2×СН2O), 112.96 (С(13)), 114.04 (С(10)), 121.51 (С(14)), 122.85 (С(4а)), 123.38 (С(8)), 124.31 (С(3)), 127.27 (С(1)), 128.44 (С(9)), 128.71 (С(8а)), 128.86 (С(5)), 129.62 (С(2)), 130.17 (С(6)), 131.72 (С(7)), 148.08 (С(12)), 148.21 (С(11)), 149.23 (С(4)), 162.53 (С(8b)), 163.33 (С(8 с)). Масс-спектр (ИЭР), вычислено, m/z (I, %): 647.01 ([M+Ag]+) (92), 649.00 ([M+Ag+2]+) (100); найдено: 647.02 ([M+Ag]+) (88), 648.94 ([M+Ag+2]+) (100). Вычислено для C26H24N2O7S2 (%): С, 57.76; Н, 4.47; N, 5.18; S, 11.86. Найдено (%): С, 57.79; Н, 4.46; N,5.14; S, 11.62.
(II) 6-Амино-2-(2,3,5,6,8,9,11,12-октагидробензо[b][1,4,10,7,13]триоксадитиацикло-пентадецин-15-ил)-1Н-бензо[d,е]изохинолин-1,3(2Н)-дион (Iе)
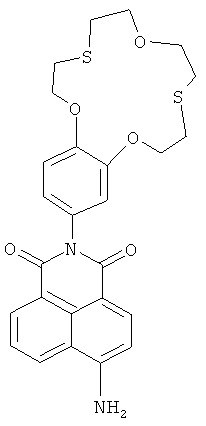
К раствору 0.2 ммоль нитросоединения 1а в 5 мл ДМФА, нагретого до 90°C, прибавляют 0.8 мл 100% гидразин-гидрата. В полученный раствор при интенсивном перемешивании порциями в течение 30 мин вносят скелетный никелевый катализатор, приготовленный из 0.5 г сплава Ni-Al с массовой долей никеля 50%. Реакционную массу выдерживают при 90°C в течение 1 часа. Затем реакционную массу охлаждают до комнатной температуры, катализатор отфильтровывают, фильтрат упаривают в вакууме. Остаток хроматографируют на колонке с силикагелем, используя в качестве элюента смесь PhH-EtOH (градиентное элюирование). Выход соединения Iе 16%. Т.пл. 249-250°C. Спектр 1Н ЯМР (300.13 МГц, ДМСО-d6, 19°C, δ/м. д., J/Гц): 2.85-3.10 (м, 8Н, СН2(16), СН2(17), СН2(20), СН2(21)), 3.67-3.79 (м. 4Н, СН2(18), СН2(19)), 4.07-4.17 (м, 2Н, CH2OAr), 4.19-4.29 (м, 2Н, CH2OAr), 6.82 (дд, 1H, Н(14), 4J=2.2, 3J=8.6), 6.86 (д, 1H, Н(3), 3J=8.4), 6.95 (д, 1H, Н(10), 4J=2.2), 7.05 (д, 1H, Н(13), 3J=8.6), 7.49 (уш. с, 2Н, NH2), 7.63-7.72 (м, 1Н, Н(6)), 8.18 (д, 1H, Н(2), 3J=8.4), 8.42 (д, 1H, Н(7), 3J=7.3), 8.65 (д, 1Н, Н(5), 3J=8.5). Спектр 13С ЯМР (100.62 МГц, ДМСО-d6, 27°C, δ/м. д.): 30.31 (CH2S), 30.40 (CH2S), 30.72 (2×CH2S), 70.66 (CH2O), 70.69 (CH2O), 70.94 (СН2O), 70.98 (СН2O), 107.92 (С(1)), 108.20 (С(3)), 112.95 (С(13)), 114.48 (С(10)), 119.48 (С(4а)), 121.67 (С(14)), 122.33 (С(8)), 124.03 (С(6)), 129.43 (С(9)), 129.66 (С(5)), 130.17 (С(8а)), 131.10 (С(7)), 133.99 (С(2)), 147.64 (С(12)), 148.16 (С(11)), 152.76 (С(4)), 163.29 (С(8b)), 164.15 (С(8с)). ЭСП (CH3CN), λmax/нм (lg ε): 417 (4.13). Масс-спектр (ИЭР), вычислено, m/z (I, %): 617.03 ([M+Ag]+) (92), 619.02 ([M+Ag+2]+) (100); найдено: 617.08 ([M+Ag]+) (92), 618.97 ([M+Ag+2]+) (100). Вычислено для C26H26N2O5S2 (%): С, 61.16; Н, 5.13; N, 5.49. Найдено (%): С, 61.32; Н, 5.18; N, 5.45.
(III) N-(2-(2,3,5,6,8,9,11,12-октагидробензо [b][1,4,10,7,13] триоксадитиациклопентадецин-15-ил)-1,3-диоксо-2,3-дигидро-1Н-бензо[(d,е]изохинолин-6-ил)ацетамид (If)
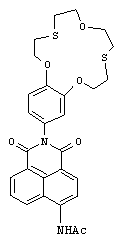
К перемешиваемой суспензии 25 мг (0.049 ммоль) соединения Iе в 0.5 мл ледяной уксусной кислоты при 80°c прибавляют 0.2 мл (2.122 ммоль) уксусного ангидрида. Реакционную массу нагревают до кипения и кипятят в течение 1.5 часов. Осадок отфильтровывают, промывают на фильтре водой, этиловым спиртом и сушат при 80°c, получая 22 мг продукта If. Выход 81%. Т.пл. 264-267°C. Спектр 1Н ЯМР (300.13 МГц, ДМСО-d6, 19°C, δ/м. д., J/Гц): 2.30 (с, 3Н, СН3), 2.84-3.11 (м, 8Н, СН2(16), СН2(17), СН2(20), СН2(21)), 3.65-3.81 (м. 4Н, СН2(18), СН2(19)), 4.06-4.18 (м, 2Н, CH2OAr), 4.19-4.31 (м, 2Н, CH2OAr), 6.91 (дд, 1H, Н(14), 4J=1.8, 3J=8.6), 7.05 (д, 1Н, Н(10), 4J=1.8), 7.08 (д, 1Н, Н(13), 3J=8.6), 7.86-7.98 (м, 1H, Н(6)), 8.34 (д, 1H, Н(3), 3J=8.2), 8.48 (д, 1H, Н(2), 3J=8.2), 8.53 (д, 1H, Н(7), 3J=7.3), 8.75 (д, 1H, Н(5), 3J=8.5), 10.46 (уш. с, 1H, NHCO). Спектр 13С ЯМР (150.93 МГц, ДМСО-d6, 22°C, δ/м. д.): 24.11 (СН3СО), 30.30 (CH2S), 30.40 (CH2S), 30.72 (CH2S), 30.74 (CH2S), 70.64 (CH2O), 70.69 (CH2O), 70.95 (CH2O), 70.97 (СН2O), 112.98 (С(13)), 114.34 (С(10)), 118.04 (С(1)), 119.44 (С(3)), 121.63 (С(14)), 122.90 (С(8)), 124.16 (С(4а)), 126.42 (С(6)), 128.77 (С(8а)), 129.02 (С(9)), 129.33 (С(5)), 130.90 (С(7)), 131.64 (С(2)), 140.36 (С(4)), 147.87 (С(12)), 148.19 (С(11)), 163.31 (С(8b)), 163.87 (С(8с)), 169.95 (СН3 СО). ЭСП (CH3CN), λmax/нм (lg ε): 367 (4.16). Масс-спектр (ИЭР), вычислено, m/z (I, %): 659.04 ([M+Ag]+) (92), 661.03 ([M+Ag+2]+) (100); найдено: 659.11 ([M+Ag]+) (84), 661.00 ([M+Ag+2]+) (100). Вычислено для C28H28N2O6S2 (%): С, 60.85; Н, 5.11; N, 5.07. Найдено (%): С, 60.90; Н, 5.14; N, 5.03.
Пример 2. Получение соединения 1b (способ А)
(i) 2-(4,10-Диметил-3,4,5,6,9,10,11,12-октагидро-2Н,8Н-1,7,13,4,10-бензотриоксадиазациклопентадекан-15-ил)-6-нитро-1Н-бензо[d,е]изохинолин-1,3(2Н)-дион (Ib)
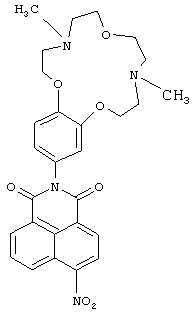
К суспензии 0.3 г (1.2 ммоль) 4-нитронафталевого ангидрида в 10 мл 80%-ной водной уксусной кислоты прибавляют 0.56 г (1.8 ммоль) ариламина IIа. Реакционную массу нагревают до кипения, кипятят 1,5 часа, охлаждают до комнатной температуры. Выпавший осадок соединения Ib отфильтровывают, промывают на фильтре горячим 10%-ным раствором Na2CO3, водой и этиловым спиртом. Продукт сушат при 80°C. Получают 0.18 г. соединения Ib. Выход 28%. Т.пл. 126-129°C. Спектр ЯМР 1Н (CDCl3, 25°C, δ, м.д., J/Гц): 2.36 (с, 3Н, NCH3), 2.40 (с, 3Н, NCH3), 2.78-2.84 (м, 4Н, CH2N), 2.92 (т, 2Н, CH2N, J=4.5, J=4.8), 2.97 (т, 2Н, CH2N, J=4.5, J=4.8), 3.74-3.78 (дд, 4H, CH2O, J=5.8, J=4.8), 4.07 (т, 2Н, CH2O, J=4.8), 4.14 (т, 2Н, CH2O, J=4.8), 6.80(д, 1Н, ArH(10), J=2.3), 6.85 (дд, 1Н, ArH(14), J=8.4, J=2.3), 7.01 (д, 1Н, ArH(13), J=8.4), 8.01 (дд, 1Н, H(6),J=7.2, J=8.4), 8.42 (д, 1Н, Н(3), J=8.0), 8.71 (д, 1Н, Н(2), J=8.0), 8.78 (д, 1Н, Н(7), J=7.2), 8.88 (д, 1Н, Н(5), J=8.4).Спектр ЯМР 13С (CDCl3, 25°C, δ, м.д.): 43.8 (С-17, С-22), 55.9 (С-16, С-23), 57.5 (С-18, С-21), 67.1 (С-19, С-20), 68.9 (С-15, С-24), 113.1(С-13), 113.7 (С-10), 122.0 (С-14), 123.3 (С-4а), 123.8 (С-8),124.39 (С-3), 127.2 (С-1), 128.3 (С-9), 128.7 (С-8а), 129.4 (С-5), 129.9 (С-2), 130.1 (С-6), 132.7 (С-7), 148.9 (С-12),149.1 (С-11), 149.8 (С-4), 162.7 (С-8b), 163.5 (С-8 с). Масс-спектр (ИЭР), m/z: вычислено 534.3; найдено 534.7-[М]+. Найдено (%): С, 62.88; Н, 5.62. C28H30N4O7. Вычислено (%): С, 62.91; Н, 5.66.
Пример 3. Получение соединения Iс (способ А)
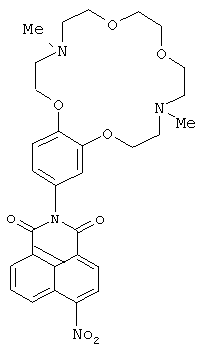
(i) 2-(4,13-Диметил-3,4,5,6,8,9,12,13,14,15-декагидро-2Н,11H-1,7,10,16,4,13-бензотетра-оксадиазациклооктадекан-18-ил)-6-нитро 1H-бензоo[d,e] изохинолин-1,3(2Н)-дион (Iс)
Соединение Iс получают из 0.3 г (1.2 ммоль) 4-нитронафталевого ангидрида и 0.64 г (1.8 ммоль) ариламина IIb по методике, аналогичной описанной в примере 2 для получения соединения Ib. Получают 0.20 г соединение Ic с выходом 29%. Т.пл. 137-142°C. Спектр ЯМР 1Н (CDCl3, 25°C, δ, м.д., J/Гц): 2.35 (с, 3H, NCH3), 2.40 (с, 3Н, NCH3), 2.82-2.89 (м, 4Н, CH2N), 3.00-3.08 (м, 4Н, CH2N), 3.63 (с, 4Н, СН2O), 3.63-3.70 (м, 4Н, СН2O), 4.08-4.12 (м, 2Н, СН2O), 4.15-4.18 (м, 2Н, СН2O), 6.79 (уш с, 1Н, Ar Н(10)), 6.84 (д, 1Н, ArН(14), J=8.4), 7.01 (д, 1Н, Ar Н(13), J=8.4), 8.01(т, 1Н, 4(6), J=7.5), 8.42 (д, 1Н, Н(3), J=8.0), 8.72 (д, 1Н, Н(2), J=8.0), 8.78 (д, 1Н, Н(7), J=7.5), 8.89 (д, 1Н, Н(5), J=8.7). Спектр ЯМР 13С (CDCl3, 25°C, δ, м.д.): 43.5 (С-17, С-24), 55.6 (С-16, С-25), 57.2 (С-18, С-23), 67.1 (С-19, С-22), 68.7 (С-15, С-26), 70.5 (С-20, С-21), 113.2(С-13), 113.6 (С-10), 122.2 (С-14), 123.4 (С-4а), 123.9 (С-8), 124.39 (С-3), 127.1 (С-1), 128.3 (С-9), 128.7 (С-8а), 129.4 (С-5), 129.9 (С-2), 130.1 (С-6), 132.6 (С-7), 148.9 (С-12),149.2 (С-11), 149.7 (С-4), 162.8 (С-8b), 164.3 (С-8с). Масс-спектр (ИЭР),m/z: вычислено 578.4; найдено 578,7-[М]+. Найдено (%): С, 62.30; Н, 5.89. C30H34N4O8. Вычислено (%): С, 62.27; Н, 5.92.
Пример 4. Получение соединения Ih (Способ Б)
(1) 2-(4,10-Диметт-3,4,5,6,9,10,11,12-октагидро-2Н,8Н-1,7,13,4,10-бензотриоксадиазациклопентадекан-15-ил)-6-нитро-1Н-бензо[d,е]изохинолин-1,3(2Н)-дион (Ib)
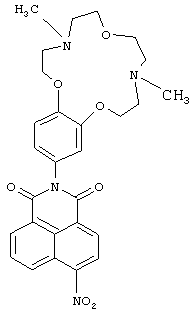
4-Нитронафталевый ангидрид (0.3 г, 1.2 ммоль), ариламин IIа (0.37 г (1.2 ммоль), 4А молекулярные сита, 0,4 мг Zn(OAc)2 и 300 мл пиридина помещают в круглодонную колбу объемом 500.0 мл, снабженную насадкой Дина-Старка. Реакционную смесь кипятят 8 ч. Отгоняют пиридин в вакууме, остаток экстрагируют ацетоном, ацетон упаривают на роторном испарителе. Продукт выделяют колоночной хроматографией на окиси алюминия, элюент - смесь бензол-этанол. Получают 0.19 г соединения Ib с выходом 31%. Т.пл. 126-129С. Спектр ЯМР 1Н (CDCl3, 25°C, δ, м.д., J/Гц): 2.36 (с, 3Н, NCH3), 2.40 (с, 3Н, NCH3), 2.78-2.84 (м, 4Н, CH2N), 2.92 (т, 2Н, CH2N, J=4.5, J=4.8), 2.97 (т, 2Н, CH2N, J=4.5, J=4.8), 3.74-3.78 (дд, 4H, CH2O, J=5.8, J=4.8), 4.07 (т, 2Н, CH2O, J=4.8), 4.14 (т, 2Н, CH2O, J=4.8), 6.80(д, 1Н, ArH(10), J=2.3), 6.85 (дд, 1Н, ArH(14), J=8.4, J=2.3), 7.01 (д, 1Н, ArH(13), J=8.4), 8.01 (дд, 1Н, Н(6), J=7.2, J=8.4), 8.42 (д, 1Н, Н(3), J=8.0), 8.71 (д, 1Н, Н(2), J=8.0), 8.78 (д, 1Н, Н(7), J=7.2), 8.88 (д, 1Н, Н(5), J=8.4).Спектр ЯМР 13С (CDCl3, 25°C, δ, м.д.): 43.8 (С-17, С-22), 55.9 (С-16, С-23), 57.5 (С-18, С-21), 67.1 (С-19, С-20), 68.9 (С-15, С-24), 113.1(С-13), 113.7 (С-10), 122.0 (С-14), 123.3 (С-4а), 123.8 (С-8),124.39 (С-3), 127.2 (С-1), 128.3 (С-9), 128.7 (С-8а), 129.4 (С-5), 129.9 (С-2), 130.1 (С-6), 132.7 (С-7), 148.9 (С-12),149.1 (С-11), 149.8 (С-4), 162.7 (С-8b), 163.5 (С-8с). Масс-спектр (ИЭР), m/z: вычислено 534.3; найдено 534.7-[М]+. Вычислено для C28H30N4O7 (%): С, 62.91; Н, 5.66. Найдено (%): С, 62.88; Н, 5.62.
(2) 2-(4,10-Диметил-3,4,5,6,9,10,11,12-октагидро-2Н,8H-1,7,13,4,10-бензотриокса-диазациклопентадекан-15-ил)-6-метокси-1H-бензо[d,е]изохинолин-1,3(2Н)-дион (Ih)
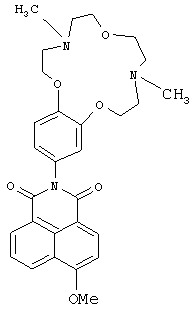
К раствору 0.2 ммоль метилата натрия в 5 мл метанола прибавляют при перемешивании 0.116 г (0.2 ммоль) соединения Ib (можно также использовать соединение Ib, полученное в примере 2). Реакционную массу выдерживают при комнатной температуре в течение 30 ч. Метанол отгоняют на роторном испарителе. Продукт Ih очищают методом колоночной хроматографии на оксиде алюминия, элюент - смесь бензола с этанолом (v/v 75:1). Получают 0.058 г соединения Ih с выходом 56%. Т.пл. 115-118°C. Спектр ЯМР 1Н (CDCl3, 25°C, δ, м.д., J/Гц): 2.38 (с, 3Н, NCH3), 2.43 (с, 3Н, NCH3), 2.82-2.85 (м, 4Н, CH2N), 2.94-3.01 (м, 4Н, CH2N), 3.75-3.77 (м, 4Н, СН2O), 4.07-4.10 (м, 4Н, 2СН2O), 4.17 (с, 3Н, СН3O), 6.82-6.87 (м, 2Н, Ar H(10), Ar H(14)), 7.01 (д, 1Н, Ar Н(13), J=8.3), 7.09 (д, 1Н, Н(3), J=8.6), 7.74 (т, 1Н, Н(6) J=7.6, J=8.0), 8.60-8.66 (м, 3Н, Н(2), Н(5), Н(7)). Спектр ЯМР 13С (CDCl3, 25°C, δ, м.д.): 43.5 (С-17, С-22), 55.8 (С-16, С-23), 56.4 (OCH3), 57.3 (С-18, С-21), 66.8 (С-15, С-24), 68.6 (С-19, С-20), 105.3 (С-3), 113.1(С-13), 113.5 (С-10), 115.3 (С-4а), 120.9 (С-14), 122.6 (С-8), 123.7 (С-1), 126.0 (С-6), 128.3 (С-9), 129.0 (С-5), 129.8 (С-8а), 132.0 (С-7), 133.9 (С-2), 149.0 (С-12),149.5 (С-11), 161.1 (С-4), 164.3 (С-8b), 164.8 (С-8с). Масс-спектр (ИЭР), m/z: вычислено 519.2; найдено 519.6-[М]+. Найдено (%): С, 67.07; Н, 6.39. C29H33N3O6. Вычислено (%): С, 67.04; Н, 6.40.
Пример 5. Получение соединения Ii (Способ Б)
(1) 6-Бром-2-(4,13-диметил-3,4,5,6,8,9,12,13,14,15-декагидро-2Н,1H-1,7,10,16,4,13-бензотетраоксадиазациклооктадекан-18-ил)-1H-бензо[d,е]изохинолин-1,3(2Н)-дион (Id)
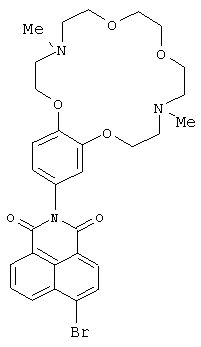
4-Бромнафталевый ангидрид (0.83 г, 3.0 ммоль), 0.088 г (2.5 ммоль) ариламина IIIb, 4A молекулярные сита, 0.3 мг Zn(OAc)2 и 250 мл пиридина помещают в круглодонную колбу объемом 500.0 мл, снабженную насадкой Дина-Старка. Реакционную смесь кипятят 8 ч. Отгоняют пиридин в вакууме, остаток экстрагируют ацетоном, ацетон упаривают на роторном испарителе. Продукт выделяют колоночной хроматографией на окиси алюминия, элюент - смесь бензол-этанол. Получают 0.41 г соединения Id. Выход 27%. Т.пл. 129-133°C. Спектр ЯМР 1Н (CDCl3, 25°C, δ, м.д, J/Гц): 2.35 (с, 3Н, NCH3), 2.40 (с, 3Н, NCH3), 2.82-2.89 (м, 4Н, CH2N), 3.00-3.08 (м, 4Н, CH2N), 3.62 (с, 4Н, СН2O), 3.63-3.70 (м, 4Н, СН2O), 4.08 (т, 2Н, CH2O, J=5.7), 4.16 (т, 2 H, CH2O, J=5.7), 6.79-6.85 (м, 2Н, ArG(14), ArH(10)), 7.00 (д, 1Н, ArH(13), J=8.4), 7,87 (т, 1Н, Н(6), J=7,45), 8.06 (д, 1Н, Н(3),.7=8.0), 8.44 (д, 1Н, Н(2), J=8.0), 8.61 (д, 1Н, Н(7), J=7.45), 8.67 (д, 1Н, Н(5), J=7.2).Спектр ЯМР 13С (CDCl3, 25°C, δ, м.д.): 42.9 (С-17, С-24), 55.7 (С-16, С-25), 56.9 (С-18, С-23), 67.1 (С-19, С-22), 68.2 (С-15, С-26), 70.6 (С-20, С-21), 113.4 (С-13), 113.6 (С-10), 122.4 (С-14), 123.3 (С-4а), 124.0 (С-8), 127.8 (С-3), 128.2 (С-1), 129.3 (С-9), 130.59 (С-8а), 131.2 (С-5), 131.5 (С-2), 132.4 (С-6), 133.6 (С-7), 149.1 (С-12), 149.4 (С-11), 153.1 (С-4), 162.9 (С-8b), 164.4 (С-8с). Масс-спектр (ИЭР), m/z: вычислено 612.1; найдено 612.6-[М]+. Вычислено для C30H34BrN3O6 (%): С, 58.83; Н, 5.59. Найдено (%): С, 58.78; Н, 5.52.
(2) 2-(4,13-Диметил-3,4,5,6,8,9,12,13,14,15-декагидро-2Н,11Н-1,7,10,16,4,13-бензотетраоксадиазациклооктадекан-18-ил)-6-метокси-1-бензо [d,e] изохинолин-1,3(2Н)-дион (Ii)
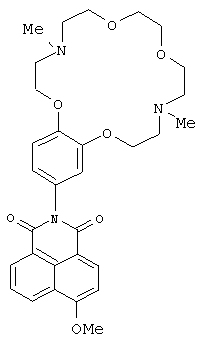
К раствору 0.2 ммоль метилата натрия в 5 мл метанола прибавляют при перемешивании 122 г (0.2 ммоль) соединения Id. Реакционную массу выдерживают при комнатной температуре в течение 30 ч. Метанол отгоняют на роторном испарителе. Продукт очищают методом колоночной хроматографии на оксиде алюминия, элюент - смесь бензола с этанолом (v/v 75:1). Получают 0.058 г соединения (Ii). Выход 54%. Т.пл. 122-125°C. Спектр ЯМР 1Н (CDCl3, 25°C, δ, м.д., J/Гц): 2.39(с, 3Н, NCH3), 2.43 (с, 3Н, NCH3), 2,87-2.91 (м, 4Н, CH2N), 3.06-3.09 (м, 4Н, CH2N), 3.65 (с, 4Н, СН2O), 3.66-3.72 (м, 4Н, СН2O), 4.11-4.17 (м, 4Н, 2СН2O), 4.17 (с, 3Н, СН3O), 6.82-6.87 (м, 2Н, Ar Н(10), Ar Н(14)), 7.01 (д, 1Н, Ar Н(13), J=8.7), 7.09 (д, 1Н, Н(3), J=8.3) 7.75 (т, 1Н, Н(6) J=7.6, J=8.0), 8.61-8.66 (м, 3Н, Н(2), Н(5), Н(7)). Спектр ЯМР 13С (CDCl3, 25°C, δ, м.д.): 42.9 (С-17, С-24), 55.6 (С-16, С-25), 56.3 (OCH3), 56.9 (С-18, С-23), 68.3 (С-19, С-22), 69.3 (С-15, С-26), 70.7 (С-20, С-21), 105.3 (С-3), 113.4 (С-13), 113.8 (С-10), 115.2 (С-4а), 121.1 (С-14), 122.6 (С-8), 123.7 (С-1), 126.0 (С-6), 128.0 (С-9), 129.0 (С-5), 129.8 (С-8а), 132.0 (С-7), 133.9 (С-2), 148.9 (С-12),149.4 (С-11), 161.1 (С-4), 164.3 (С-8b), 164.9 (С-8с). Масс-спектр (ИЭР), m/z: вычислено 563.1; найдено 563.7-[М]+. Вычислено для C31H37N3O7 (%): С, 66.06; Н, 6.62. Найдено (%): С, 66.08; Н, 6.64.
Пример 6. Получение соединения Ii (Способ Б)
(1) 2-(4,13-Диметил-3,4,5,6,8,9,12,13,14,15-декагидро-2Н,11Н-1,7,10,16,4,13-бензотетраоксадиазациклооктадекан-18-ил)-6-нитро 1H-бензо[d,e]изохинолин-1,3(2Н)-дион (Iс)
Соединение Iс получают из 0.3 г (1.2 ммоль) 4-нитронафталевого ангидрида и 0.43 г (1.2 ммоль) ариламина IIb по методике, описанной в примере 4. Выделяют 0.21 г соединения Iс. Выход 30%.
(2) 2-(4,13-Диметил-3,4,5,6,8,9,12,13,14,15-декагидро-2Н,11Н-1,7,10,16,4,13-бензотетраоксадиазациклооктадекан-18-ил)-6-метокси-1Н-бензо[d,е]изохинолин-1,3(2Н)-дион (Ii)
Соединение Ii получают из 0.116 г (0.2 ммоль) соединения 1с, полученного на первой стадии (можно также использовать соединение 1с, полученное в примере 3) и 0.2 ммоль метилата натрия в 5 мл метанола по методике, описанной в примере 4. Выделено 0.066 г соединения Ii. Выход 59%.
Пример 7. Получение соединения Ig (способ Б)
(1) 6-Нитро-2-(2,3,5,6,8,9,11,12-октагидробензо[b][1,4,10,7,13]триоксадитиациклопентадецин-15-ил)-1Н-бензо[d,е]изохинолин-1,3(2Н)-дион (Iа)
Соединение Iа получают из 0.3 г (1.2 ммоль) 4-нитронафталевого ангидрида и 0.42 г (1.2 ммоль) солянокислой соли соединения IIc по методике, описанной в примере 5. Выделяют 0.45 г соединения Iа. Выход 68%.
(2) 6-Метокси-2-(2,3,5,6,8,9,11,12-октагидробензо[b][1,4,10,7,13]триоксадитиациклопентадецин-15-ил)-1H-бензо[d,e]изохинолин-1,3(2Н)-дион (Ig)
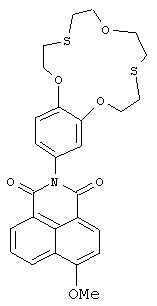
К раствору 100 мг метилата натрия в 7 мл метанола прибавляют при перемешивании 100 мг (0.180 ммоль) N-арил-нитронафталимид полученного соединения Iа (можно также использовать соединение Iа, полученное в примере 1). Реакционную массу выдерживают при температуре 50°C в течение 30 ч и охлаждают до комнатной температуры. Осадок отфильтровывают, промывают на фильтре водой и этиловым спиртом. Получают 85 мг соединения Ig. Выход 90%. Т.пл. 233-235°C. Спектр 1Н ЯМР (600.22 МГц, ДМСО-d6, 20°C, δ/м. д., J/Гц): 2.84-3.11 (м, 8Н, СН2(16), СН2(17), СН2(20), СН2(21)), 3.65-3.81 (м. 4Н, СН2(18), СН2(19)), 4.06-4.14 (м, 2Н, CH2OAr), 4.16 (с, 3Н, ОСН3), 4.22-4.31 (м, 2Н, CH2OAr), 6.89 (дд, 1H, Н(14), 4J=1.8, 3J=8.6), 7.04 (д, 1H, Н(10), 4J=1.8), 7.08 (д, 1H, Н(13), 3J=8.6), 7.35 (д, IH, Н(3), 3J=8.2), 7.81-7.90 (м, 1Н, Н(6)), 8.47 (д, 1Н, Н(2), 3J=8.2), 8.52 (д, 1H, Н(7), 3J=7.3), 8.58 (д, 1H, Н(5), 3J=8.5). Спектр 13С ЯМР (150.93 МГц, ДМСО-d6, 20°C, δ/м. д.): 32.30 (CH2S), 32.40 (CH2S), 32.73 (CH2S), 32.75 (CH2S), 57.02 (OCH3), 71.64 (CH2O), 71.69 (CH2O), 71.95 (СН2O), 71.97 (СН2O), 106.88 (С(3)), 113.86 (С(13)), 115.05 (С(10)), 115.50 (С(1)), 122.01 (С(14)), 123.00 (С(8)), 123.14 (С(4а)), 127.01 (С(6)), 129.21 (С(5)), 129.97 (С(8а)), 130.02 (С(9)), 131.97 (С(7)), 133.98 (С(2)), 147.52 (С(12)), 147.99 (С(11)), 160.06 (С(4)), 163.03 (С(8b)), 163.57 (С(8с)). ЭСП (CH3CN), λmax/нм (lg ε): 361 (4.09). Масс-спектр (ИЭР), вычислено, m/z: 580.19; найдено: 580.13 ([М+Н]+). Вычислено для C30H33N3O5S2 (%): С, 62.15; Н, 5.74; N, 7.25. Найдено (%): С, 62.21; Н, 5.78; N, 7.16.
Получение исходных ароматических аминов IIа, b
(1) 3,4-Бис-(2-йодэтокси)нитробензол (IV)
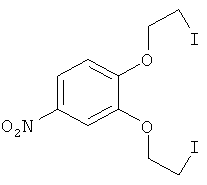
Смесь 1.85 г (6.6 ммоль) 3,4-бис-(2-хлорэтокси)нитробензола, полученного из пирокатехина и 2-хлорэтанола, 9.84 г (65.6 ммоль) безводного NaI и 30 мл сухого ацетона кипятят при интенсивном перемешивании в течение 45 ч. Осадок отфильтровывают, маточник упаривают в вакууме. Твердый остаток обрабатывают бензолом (3×20 мл), бензольный раствор промывают последовательно водой, и 5% водным раствором Na2SO3 (2×20 мл), и водой. Упаривают бензол в вакууме. Получают 2.57 г соединения IV в виде желтого порошка. Выход 84%. Т. пл. 46-49°C. Спектр ЯМР 1H(CDC13, 25°C, δ, м.д., J/Гц): 3.48 (м, 4Н, 2СН2I), 4.34-4.40 (м, 4Н, СН2O), 6.93 (д, 1Н, Н(6), J=8.8), 7.77 (д, 1 Н, Н(3), J=2.8), 7.91 (дд, 1Н, Н(5), J=8.8, J=2.8).
(2) Получение нитропроизводных диазакраун-эфиров IIIа,b
К 0.48 ммоль 3,4-бис(2-йодэтокси) нитробензола прибавляют 0.50 ммоль 1,5-бис(метиламино)-3-оксапентана (для получения IIIа) или 1,8-бис(метиламино)-3,6-диоксаоктана (для получения IIIb) и 0.320 г (2.3 ммоль) K2CO3 в 6.0 мл ацетонитрила. Выдерживают реакционную смесь при комнатной температуре без перемешивания в течение 45 часов. Затем растворитель упаривают в вакууме, остаток экстрагируют хлористым метиленом (3×20 мл). Экстракт промывают водой и упаривают в вакууме, получая соответствующее нитросоединение или IIIа, или IIIb.
4,10-Диметил-15-нитро-1,7,13,4,10-бензотриоксадиазациклопентадецен (IIIа)
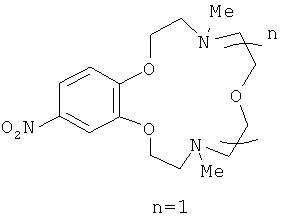
представляет собой масло желтого цвета. Выход 78%. Спектр ЯМР 1Н (CDCl3, 25°C, δ, м.д., J/Гц): 2.36 (с, 6Н, 2NCH3), 2.76 (т, 4H, 2CH2N,.J=5.7, J=5.9), 2.91 (т, 4H, 2CH2N, J=4.4, J=4.5), 3.72 (м,4H, 2CH2O), 4.10 (м, 4Н, 2СН2O), 6.84 (д, 1Н, Н(6), J=8.9), 7.69 (д, 1Н, Н(3), J=2.6), 7.86 (дд, 1Н, Н(5), J=8.9, J=2.6).Спектр ЯМР 13С (CDCl3, 25°C, δ, м.д.): 43.6 (С-9, С-14), 55.0 (С-8, С-15), 57.4 (С-10, С-13), 66.6 (С-11, С-12), 68.4 (С-7, С-16), 106.8 (С-3), 110.0 (С-6), 117.3 (С-5), 141.5 (С-4), 147.9 (С-2), 154.3 (С-1). Масс-спектр (ИЭР), m/z: вычислено 339.1; найдено 340 [МН]+. Вычислено для C16H25N3O5 (%): С, 56.62; Н, 7.42. Найдено (%): С, 56.71; Н, 7.45.
4,13-Диметил-18-нитро-1,7,10,16,4,13-бензотетраоксадиазациклооктадецен (IIIb)
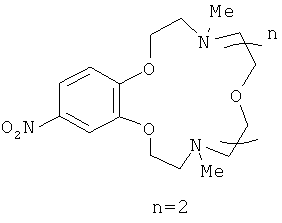
представляет собой вязкое масло желтого цвета. Выход 74%. Спектр ЯМР 1H (CDCl3, 25°C, δ, м.д., J/Гц): 234 (с, 3H, NCH3), 2.35 (с, 3Н, NCH3), 2,78-2.82 (м, 4Н, CH2N), 2.99-3.05 (м, 4 Н, Me CH2N), 3.56 (с, СН2O), 3.58-3.63 (м, 4Н, СН2O), 4.09-4.15 (м, 4Н, CH2O), 6.83 (д, 1Н, Н(6), J=9.0), 7.66 (д, 1Н, Н(3), J=2.6), 7.82 (дд, 1Н, Н(5), J=9.0, J=2.6). Спектр ЯМР 13С (CDCl3, 25°C, 5, м.д.): 43.8 (С-9, С-16), 55.2 (С-8, С-17), 57.5 (С-10, С-15), 64.2 (С-11, С-14), 68.8 (С-7, С-18), 70.1 (С-12, С-13), 107.2 (С-3), 110.4 (С-6), 117.5 (С-5), 141.1 (С-4), 148.7 (С-2), 154.2 (С-1). Масс-спектр (ИЭР), m/z: вычислено 383,3; найдено 384.5 [МН]+. Вычислено для C18H29N3O6 (%): С, 56.38; Н, 7.62. Найдено (%): С, 56.42; Н, 7.59.
(3) Получение ариламинов IIа, b
К нагретому до кипения раствору 1.966 ммоль нитросоединения (IIIа или IIIb) в 13.0 мл этанола в атмосфере аргона прибавляют 1.0 мл 100%-ного гидразин-гидрата, затем порциями при перемешивании вносят скелетный никелевый катализатор, приготовленный из 0.5 г сплава никеля с алюминием (массовая доля никеля 50%). После добавления всего катализатора реакционную массу выдерживают при кипении 1 час, катализатор отфильтровывают, фильтрат упаривают в вакууме. Образующийся после отгонки растворителя маслообразный остаток (600 мг) представляет собой соответствующий продукт реакции (IIа или IIb), который далее используют в способах А и Б.
4,10-Диметил-15-амино-1,7,13,4,10-бензотриоксадиазациклопентадецен (IIа)
представляет собой масло желтого цвета. Выход 88%. Масс-спектр (ИЭР), m/z: вычислено 309; найдено 312 [МН]+. Вычислено для C16H27N3O3 (%): С, 62.11; Н, 8.80. Найдено (%): С, 62.56; Н, 8.68.
4,13-Диметил-18-амино-1,7,10,16,4,13-бензотетраоксадиазациклооктадецен (IIb) представляет собой масло желтого цвета. Выход 89%. Масс-спектр (ИЭР), m/z: вычислено 353; найдено 354 [МН]+. Вычислено для C18H31N3O4 (%): С, 61.17; Н, 8.84. Найдено (%): С, 61.08; Н, 8.81.
Исследование хемосенсорных свойств
Методы исследования. Оценку сенсорной способности соединений If-i по отношению к катионам Cu2+, Ag+, Hg2+, Ni2+, Fe2+, Zn2+, Cd2+, Mg2+, Ca2+, Pb2+ проводили по зависимости спектров локальной флуоресценции фрагмента нафталимида от концентрации катионов. Для этого к раствору соединения I (с~1×10-6 моль/л) в ацетонитриле или воде порциями добавляли расчетное количество раствора перхлората соответствующего металла, записывая спектры флуоресценции исходного раствора и раствора после добавления соли металла в интервале длин волн 250-750 нм. Возбуждение флуоресценции проводили светом с длиной волны 350 нм. Съемка спектров флуоресценции проводилась на спектрофлуориметре FluoroMax-3.
При добавлении солей металлов происходило увеличение интенсивности флуоресценции, пропорциональное количеству добавленной соли. В таблицах 2 и 3 показана степень увеличения интенсивности флуоресценции (FE - Fluorescence Enhancement - англ., разгорание флуоресценции) для каждого катиона металла в ацетонитрильном и водном растворах при добавлении одного эквивалента катиона металла. Расчет относительного изменения интенсивности флуоресценции соединений If-i проводили по формуле:
FE=I/I0,
где
I0 - исходная интенсивность флуоресценции раствора соединения I;
I - интенсивность флуоресценции раствора соединения I после добавления раствора катионов металла.
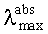
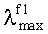
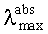
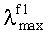
Результаты испытаний
Исследование спектральных свойств соединений If-i показало, что данные соединения проявляют высокую сенсорную активность по отношению к катионам металлов как в ацетонитрильном, так и в водном растворе. Различная селективность к катионам металлов достигается за счет варьирования количества и природы гетероатомов в макроцикле. Так, например, бензокраунсодержащий ацетамид If демонстрировал увеличение интенсивности флуоресценции в присутствии катионов ртути в 10 раз, влияние катионов серебра проявлялось в меньшей степени, в то время как для других катионов флуоресцентный отклик не наблюдался. Соединение Ig селективно взаимодействует с катионами свинца (II). При этом наблюдается увеличение интенсивности флуоресценции соединения Ig в 45 раз. Интенсивность флуоресценции соединения Ih возрастает в 20 раз при добавлении перхлоратов кадмия или кальция.
Значительное изменение интенсивности флуоресценции при комплексообразовании облегчает визуальное определение присутствия катионов при концентрациях до 10-6 моль/л.
Впервые обнаруженные флуоресцентные сенсорные свойства соединений формулы If-i, обусловленные сочетанием хромофлуорофорного фрагмента 1,8-нафталимида и бензокраун-эфира с новой электронной структурой и связи между ними, дают возможность их использования, например, при разработке флуоресцентных сенсоров на катионы кальция, ртути, кадмия, серебра или свинца.
Заявляемые новые флуоресцентные сенсоры обладают близкими оптическими характеристиками (близкие значения 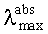
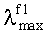
Преимуществом предлагаемых новых сенсоров является значительный контраст флуоресценции (степень увеличения интенсивности флуоресценции) в видимой области спектра, возникающий в процессе детектирования катионов металлов. Это обстоятельство облегчает визуальный способ определения катиона металла при концентрации 10-6 моль/л, делает аналитическое количественное определение катиона металла более точным.
Изобретение наиболее успешно может быть использовано для создания оптических сенсоров и датчиков, применяемых для оперативного контроля концентраций примесей в жидкостях в различных областях: в пищевой промышленности, в медицине, в экологии, на предприятиях, производящих или использующих в производстве опасные химические вещества.
Заявляемые способы получения краунсодержащих нафталимидов достаточно просты в исполнении и позволяют получать целевые продукты с высокими выходами из коммерчески доступных реагентов.
Техническим результатом является получение новых соединений, применимых в качестве флуоресцентных сенсоров на катионы щелочно-земельных, переходных и тяжелых металлов.
| название | год | авторы | номер документа |
|---|---|---|---|
| АЗАКРАУНСОДЕРЖАЩИЕ N-АРИЛ-1,8-НАФТАЛИМИДЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2017 |
|
RU2656106C1 |
| КРАУНСОДЕРЖАЩИЕ СТИРИЛОВЫЕ КРАСИТЕЛИ С АММОНИЙНОЙ ГРУППОЙ В N-ЗАМЕСТИТЕЛЕ ГЕТЕРОЦИКЛИЧЕСКОГО ОСТАТКА В КАЧЕСТВЕ ФОТО- И ТЕРМОЧУВСТВИТЕЛЬНЫХ СОЕДИНЕНИЙ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2005 |
|
RU2278134C1 |
| ОПТИЧЕСКИЕ СЕНСОРНЫЕ МАТЕРИАЛЫ НА КАТИОНЫ ТЯЖЕЛЫХ И ПЕРЕХОДНЫХ МЕТАЛЛОВ НА ОСНОВЕ ДИТИАКРАУНСОДЕРЖАЩИХ БУТАДИЕНИЛЬНЫХ КРАСИТЕЛЕЙ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2005 |
|
RU2292368C1 |
| Новые флуоресцентные производные α-гидрокси-бисфосфонатов в качестве ингибиторов солеотложений и способы их получения | 2018 |
|
RU2699104C1 |
| Четвертичные аммониевые соли на основе производных витамина В6 | 2015 |
|
RU2607522C1 |
| АНТИБАКТЕРИАЛЬНЫЕ СРЕДСТВА НА ОСНОВЕ ЧЕТВЕРТИЧНЫХ АММОНИЕВЫХ СОЛЕЙ | 2014 |
|
RU2561281C1 |
| ПРОИЗВОДНЫЕ 1,2,3,4-ТЕТРАГИДРОПИРИДО[4,3-b]ИНДОЛСОДЕРЖАЩИХ ФЕНОТИАЗИНОВ В КАЧЕСТВЕ ИНГИБИТОРОВ ХОЛИНЭСТЕРАЗ И БЛОКАТОРОВ СЕРОТОНИНОВЫХ РЕЦЕПТОРОВ 5-HT, СПОСОБЫ ПОЛУЧЕНИЯ ИХ ХЛОРГИДРАТОВ И ФАРМАКОЛОГИЧЕСКОЕ СРЕДСТВО НА ИХ ОСНОВЕ | 2013 |
|
RU2530881C1 |
| НОВЫЕ 2',5'-ДИАРИЛСПИРО[ИНДОЛ-3,3'-ПИРРОЛИДИН]-2(1Н)-ОНЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2019 |
|
RU2730287C1 |
| НОВЫЕ СУБСТРАТЫ КОНЦЕВОЙ ДЕЗОКСИНУКЛЕОТИДИЛТРАНСФЕРАЗЫ | 2003 |
|
RU2278869C2 |
| ФТОРСОДЕРЖАЩИЕ ПРОИЗВОДНЫЕ ТЕВИНОЛА И ОРВИНОЛА И СПОСОБЫ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ) | 2012 |
|
RU2506265C1 |
Настоящее изобретение относится к области органической химии, а именно к новым 4-замещенным-N-фенил-1,8-нафталимидам, содержащим в N-арильном ядре остаток краун-эфира (с различной комбинацией атомов кислорода, азота и серы) общей формулы (I), где R1=NO2, Br, NH2, OCH3, NHCOCH3,  Ia: Rl=NO2, X=S, n=1; Ib: R1=NO2, x=NCH3, n=1; Ic: R1=NO2, X=NCH3, n=2; Id: R1=Br, X=NCH3, n=2; Ie: R1=NH2, X=S, n=1; If: R1=NHCOCH3, X=S, n=1; Ig: R1=OMe, X=S, n=1; Ih: R1=OMe, X=NCH3, n=1; Ii: R1=OMe, X=NCH3, n=2, где соединения If-Ii проявляют свойства флуоресцентных сенсоров на катионы щелочно-земельных, переходных и тяжелых металлов, а соединения Ia-Ie являются промежуточными соединениями в процессе синтеза соединений If-Ii. Также изобретение относится к способу получения соединения формулы (I) и к промежуточным соединениям формулы (II). Технический результат: получены новые сенсоры на катионы щелочно-земельных, переходных и тяжелых металлов, а также разработаны новые способы получения соединений формулы (I). 5 н. и 2 з.п. ф-лы, 3 табл., 7 пр.
Ia: Rl=NO2, X=S, n=1; Ib: R1=NO2, x=NCH3, n=1; Ic: R1=NO2, X=NCH3, n=2; Id: R1=Br, X=NCH3, n=2; Ie: R1=NH2, X=S, n=1; If: R1=NHCOCH3, X=S, n=1; Ig: R1=OMe, X=S, n=1; Ih: R1=OMe, X=NCH3, n=1; Ii: R1=OMe, X=NCH3, n=2, где соединения If-Ii проявляют свойства флуоресцентных сенсоров на катионы щелочно-земельных, переходных и тяжелых металлов, а соединения Ia-Ie являются промежуточными соединениями в процессе синтеза соединений If-Ii. Также изобретение относится к способу получения соединения формулы (I) и к промежуточным соединениям формулы (II). Технический результат: получены новые сенсоры на катионы щелочно-земельных, переходных и тяжелых металлов, а также разработаны новые способы получения соединений формулы (I). 5 н. и 2 з.п. ф-лы, 3 табл., 7 пр.

1. Соединения общей формулы I
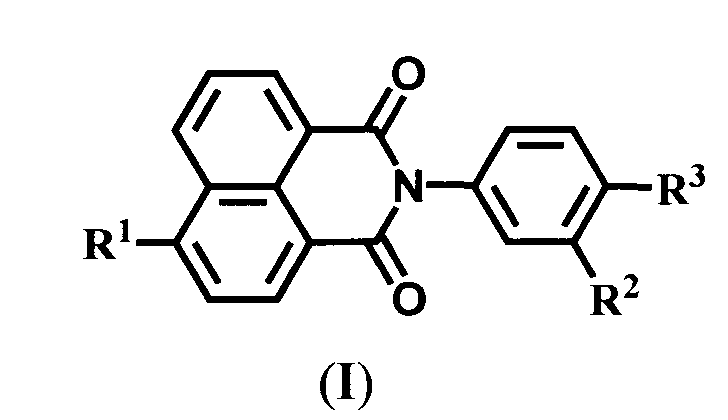
где R1=NO2, Br, NH2,
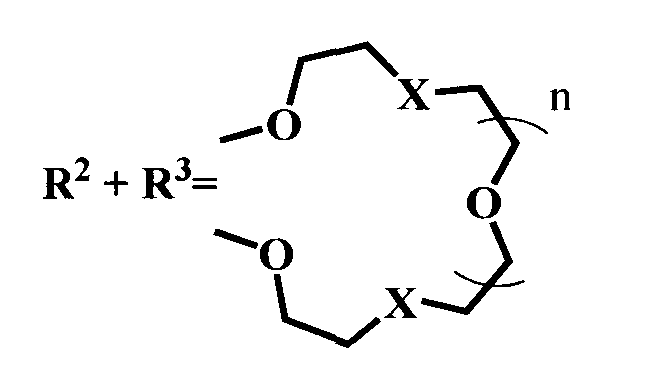
Ia: R1=NO2 X=S, n=1
Ib: R1=NO2 Х=NCH3, n=1
Ic: R1=NO2 Х=NCH3, n=2
Id: R1=Br, Х=NCH3, n=2
Ie: R1=NH2, X=S, n=1
2. Соединения общей формулы I

где R1=OCH3, NHCOCH3,

If: R1=НСОСН3, X=S, n=1
Ig: R1=OMe, X=S, n=1
Ih: R1=OMe, X=NCH3, n=1
Ii: R1=OMe, Х=NCH3, n=2
3. Соединения по п.2 (If-i), где R1=NHCOCH3, ОСН3; X=S, NCH3, n=1, 2; в качестве флуоресцентных сенсоров на катионы щелочно-земельных, переходных и тяжелых металлов.
4. Соединения по п.1 (Ia-е), в качестве полупродуктов для получения соединений по пп.2 и 3.
5. Способ получения соединений по пп.1-4, включающий (i) ацилирование первичных ароматических аминов 4-нитронафталевым ангидридом при кипячении в 80% уксусной кислоте, (ii) восстановление нитрогруппы в образующихся нитронафталимидах, (iii) ацилирование полученных аминонафталимидов уксусным ангидридом и последующее выделение целевого продукта I известными методами, отличающийся тем, что в качестве первичных ароматических аминов используют ариламины, содержащие краун-эфирный фрагмент с гетероатомами O, N и S в макроцикле, а (ii) восстановление нитрогруппы в нитронафталимидах проводят гидразин-гидратом в присутствии никеля Ренея при кипячении в диметилформамиде.
6. Способ получения соединений по пп.1-4, включающий (1) ацилирование первичных ароматических аминов 4-замещенным нафталевым ангидридом в присутствии ацетата цинка и молекулярных сит при кипячении в пиридине, (2) последующее взаимодействие продуктов ацилирования с метилатом натрия в метаноле и выделение целевого соединения формулы I (где R1=ОМе) известными приемами, отличающийся тем, что взаимодействие с метилатом натрия в метаноле можно проводить при температурах от 20 до 50°С, в качестве 4-замещенного нафталевого ангидрида возможно использовать или 4-нитронафталевый ангидрид, а в качестве первичных алифатических аминов используют ариламины, содержащие краун-эфирный фрагмент с гетероатомами О, N и S в макроцикле.
7. Ароматические амины формулы (II)

в качестве исходных веществ для получения соединений по пп.1-4.
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| ТИАКРАУНСОДЕРЖАЩИЕ СТИРИЛОВЫЕ КРАСИТЕЛИ В КАЧЕСТВЕ СЕЛЕКТИВНЫХ СЕНСОРОВ НА КАТИОНЫ ТЯЖЕЛЫХ ИЛИ ПЕРЕХОДНЫХ МЕТАЛЛОВ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2000 |
|
RU2176256C1 |
Авторы
Даты
2014-05-10—Публикация
2012-12-27—Подача