Изобретение относится к наборам праймеров для выявления генетического материала (РНК) и дифференциации вируса парагриппа человека 1, 2, 3 и 4 типов в клинических образцах, секционных пробах, образцах окружающей среды, культуральных вируссодержащих жидкостях и прочих биопрепаратах с целью постановки диагноза, коррекции лечения, эпидемиологического расследования, а также для решения научно-исследовательских задач по мониторингу и изучению свойств вируса парагриппа, созданию диагностических, профилактических и лечебных препаратов и может быть использовано в медицине, биотехнологии и эпидемиологии.
При помощи разработанных диагностических праймеров и флуоресцентно-меченых зондов возможно выявление генетического материала (РНК) и дифференциация вируса парагриппа человека 1, 2, 3 и 4 типов.
Метод обратно-транскриптазной полимеразной цепной реакции (ОТ-ПЦР) с детекцией продуктов амплификации в режиме реального времени обладает высокой чувствительностью и является основным методом выявления вирусной РНК. Метод ОТ-ПЦР основан на получении комплементарной ДНК (кДНК) на матрице вирусной РНК с последующим многократным избирательным удвоением участка кДНК. Амплифицируемый участок кДНК, являясь маркерным, позволяет выявить вирусный агент в исследуемом образце. Для эффективного проведения ОТ-ПЦР в режиме реального времени необходимы флуоресцентно-меченый ДНК-зонд и ДНК-затравки - праймеры (синтетические олигонуклеотиды) - строго специфичные к кДНК вирусного генома. Сложность выбора праймеров и зонда обусловлена требованием их строгой видоспецифичности. Праймеры должны быть комплементарны нуклеотидным последовательностям кДНК, ограничивая амлифицируемый участок справа и слева таким образом, чтобы синтез ДНК ДНК-полимеразой проходил строго в выбранном регионе. Флуоресцентно-меченый ДНК-зонд, в свою очередь, должен лежать внутри участка кДНК, ограниченного праймерами. Правильный выбор праймеров позволяет осуществить экспоненциальное увеличение количества копий целевого участка кДНК. Правильный выбор сочетания пары праймеров и ДНК-зонда позволяет осуществлять детекцию накопления продуктов амплификации в режиме реального времени. В целом от правильности выбора олигодезоксирибонуклеотидных праймеров и зондов зависит специфичность проводимой ОТ-ПЦР, а значит, и достоверность исследования.
Известны зарубежные аналоги, представляющие собой наборы праймеров, обеспечивающих специфичный синтез фрагментов кДНК на матрице геномной РНК. Патент США № 5744299 (МПК С12Q 1/68, опубл. 1998 г.) получен на набор праймеров для детекции вируса парагриппа типа 1-3 методом ПЦР с электрофоретической детекцией. Патент США № 6881835 (МПК С12Q 1/68, опубл. 2005 г.) получен на набор праймеров для детекции семи вирусов (вирус парагриппа типа 1-3, респираторно-синцитиальный вирус, вирус гриппа типа А и В, аденовирус) методом ПЦР-РВ. Патент США № 7851148 (МПК С12Q 1/68, опубл. 2010 г.) получен на набор праймеров для детекции 15 агентов ОРЗ человека (ТОРС-ассоциированный коронавирус, вирус гриппа типа А и В, аденовирус, вирус парагриппа типа 1 и 3, респираторно-синцитиальный вирус серотипа А и В, M. pneumonia, C. pneumonia, энтеровирус, риновирус, коксакивирус типа А и В, эховирус) методом ПЦР-РВ. Патент США № 8232058 (МПК С12Q 1/68, опубл. 2012 г.) получен на набор праймеров для детекции вируса гриппа типа А, в том числе патогенных для человека субтипов вируса H1, H3, H5, H7, вируса гриппа типа В, вируса парагриппа типа 2, респираторно-синцитиального вируса и аденовируса. Заявка на патент США № 20040253582 (МПК С12Q 1/68, опубл. 2004 г.) подана на набор праймеров для детекции вируса парагриппа типа 1-3, респираторно-синцитиального вируса серотипов А и В, вируса гриппа типа А и В. Заявка на патент США № 20060177849 (МПК С12Q 1/68, опубл. 2006 г.) подана на набор праймеров для детекции 13 вирусов, вызывающих заболевания респираторного тракта человека (вирус кори, энтеровирус, риновирус, коронавирус-ТОРС, вирус герпеса 3 типа, аденовирус, вирус парагриппа типа 1-3, вируса гриппа типа А и В, респираторно-синцитиального вируса серотипов А и В. Заявка на патент США № 20070141575 (МПК С12Q 1/68, опубл. 2007 г.) подана на набор праймеров для детекции одновременно 14 патогенов, вызывающих респираторные заболевания у людей, а именно: аденовирус, вирус гриппа типа А и В, вируса парагриппа типа 1 и 3, респираторно-синцитиальный вирус, коронавирус-ТОРС, энтеровирус, вируса коксаки типа А и В, риновирус, эховирус, M. pneumonia, C. pneumonia. Заявка на патент США № 20090148830 (МПК С12Q 1/68, опубл. 2009 г.) относится к набору праймеров для детекции одновременно 9 патогенов, вызывающих поражения респираторного тракта человека: респираторно-синцитиальный вирус, вирус парагриппа типа 1 и 3, M. pneumonia, C. pneumonia, энтеровирус, вирус гриппа типа А и В, аденовирус. Заявка на патент США № 20100279273 (МПК С12Q 1/68, опубл. 2010 г.) относится к набору праймеров для детекции одновременно 15 агентов ОРВИ человека: вирус гриппа типа А и В, респираторно-синцитиальный вирус, метапневмовирус, энтеровирус, риновирус, аденовирус, вирус парагриппа типа 1-4, коронавирусы видов NL63, 229E, OC43, коронавирус-ТОРС. Патент Китая № 102115795 (МПК С12Q 1/68, опубл. 2011 г.) получен к набору олигонуклеотидов для детекции вируса парагриппа методом ПЦР-РВ. Патент Китая №101948931 (МПК С12Q 1/68, опубл. 2011 г.) получен на набор олигонуклеотидов для детекции вируса парагриппа типа 1-3 методом ПЦР-РВ. Заявка на патент США № 2009148830 (МПК С12Q 1/68, опубл. 2009 г.) относится к набору олигонуклеотидов для детекции вирусов, вызывающих ОРЗ у человека (респираторно-синцитиальный вирус, вирус парагриппа типа 1 и 2, энтеровирус, вирус гриппа типа А и В, аденовирус, M. pneumonia, C. pneumonia) методом ОТ-ПЦР. Международная заявка на патент №2008042450 (МПК С12Q 1/68, опубл. 2008 г.) относится к набору олигонуклеотидов детектирующих вирус гриппа типа А (включая субтипы H1, H3, H5 и H7), вирус гриппа типа В, вирус парагриппа типа 2, респираторно-синцитиальный вирус, аденовирус с использованием технологии суспензионного ДНК-биочипа на платформе Luminex xMAP. Патент Китая №N101812532 (МПК С12Q 1/68, опубл. 2010 г.) получен на набор олигонуклеотидов для детекции вирусов, вызывающих поражения респираторного тракта человека (респираторно-синцитиальный вирус, аденовирус, вирус парагриппа, вирус гриппа). Патент Франции № 2918995 (МПК С12Q 1/68, опубл. 2009 г.) получен на набор олигонуклеотидов позволяющих детектировать новый вариант (I) вируса парагриппа человека типа 2. Патент Японии №2007129923 (МПК С12Q 1/68, опубл. 2007 г.) получен на набор олигонуклеотидов для детекции вируса парагриппа типа 1 и 3 методом ОТ-ПЦР с электрофоретической детекцией. Заявка на патент США №2004253582 (МПК С12Q 1/68, опубл. 2004 г.) относится к набору олигонуклеотидов для детекции вируса парагриппа типа 1-3, респираторно-синцитиального вируса серотипов А и В, вируса гриппа типа А и В методом ПЦР.
Предлагаемый к патентованию набор праймеров в сравнении со всеми изученными аналогами имеет ряд значительных преимуществ. Во-первых, разработанный нами набор олигонуклеотидов позволяет одновременно в одной пробирке провести ПЦР в режиме реального времени, идентифицирующую одновременно 4 типа вируса парагриппа человека. Во-вторых, при работе по дизайну праймеров и ДНК-зондов нами был проведен подробный анализ всех имеющихся в международной базе данных NCBI последовательностей геномов вируса парагриппа человека типа 1-4. Выбранные в результате анализа олигонуклеотиды с учетом вырожденности имеют высокий уровень гомологии к геномам вируса парагриппа человека, депонированным в международной базе данных NCBI. В-третьих, помимо выше сказанного была смоделирована дополнительная внешняя пара праймеров, позволяющая провести ПЦР в два раунда, что увеличивает чувствительность предлагаемого к патентованию набора олигонуклеотидов.
Наиболее близким аналогом (прототипом) является отечественный набор для амплификации кДНК и дифференциации вируса парагриппа 1, 2, 3 и 4 типов - «АмплиСенс Parainfluenza virus - FL» (http://www.pacxodka39.ru/ product_3083.html). Комплект реагентов для ПЦР-амплификации и дифференциации кДНК Parainfluenza virus 1 и 3 типов (род Respirovirus)и Parainfluenza virus 2 и 4 типов (род Rubula virus) с гибридизационно-флуоресцентной детекцией в режиме «реального времени» рассчитан на проведение 55 реакций амплификации, включая контроли. Дополнительно к комплекту реагентов прилагаются контрольные образцы этапа выделения. Общий объем реакции - 25 мкл, объем кДНК-пробы - 10 мкл. В комплекте реагентов применяется «горячий старт», который обеспечивается разделением нуклеотидов и Taq-полимеразы прослойкой воска, раскапан по ПЦР-пробиркам (0,2 мл).
Однако коммерческий набор-прототип существует на рынке лабораторной диагностики уже несколько лет. Стоит предположить, что в связи с большим прогрессом в области точности и скорости секвенирования в последние несколько лет были выделены и секвенированы новые последовательности геномов вируса парагриппа человека.
Техническим результатом заявляемого изобретения является создание набора олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченых зондов, позволяющего идентифицировать и дифференцировать вирус парагриппа человека 1, 2, 3 и 4 типов методом ПЦР в реальном времени и обладающего более высокой гомологией к циркулирующим в настоящее время вирусам парагриппа, что повышает достоверность и надежность анализов.
Указанный технический результат достигается разработкой набора олигодезоксирибонуклеотидных праймеров для детекции кДНК вируса парагриппа человека типа 1-4, содержащего пару внутренних и пару внешних олигонуклеотидов, обладающих активностью прямого и обратного праймеров в полимеразной цепной реакции, а также флуоресцентно-меченые ДНК-зонды. Указанные олигонуклеотиды имеют следующую структуру:
1. Последовательности олигонуклеотидов видоспецифических к вирусу парагриппа человека типа 1:
• внешние прямой (NF) и обратный (NR) праймеры 5`→3`
NF: 5`-TTCTGGAGATGTCCCGTAGG-3` (20 н.)
NR: 5`-TCCTGTTR(G/A)TCR(G/A)TTGATGTCATAR(G/A)-3` (23 н.)
• внутренние прямой (F) и обратный (R) праймеры 5`→3`
F: 5`-GATGTGTTAGR(G/A)Y(C/T)TACCTTCATTATCA-3` (26 н.)
R: 5`-AAACCTGR(G/A)TATGACTTY(C/T)CCTATATCT-3` (26 н.)
• флуоресцентно-меченый ДНК-зонд (Z) 5`→3`
Z: 5`-FAM-TATTCATCAAACTTAATCACTCAAGGATGTG-BHQ1-3` (31 н.)
2. Последовательности олигонуклеотидов видоспецифических к вирусу парагриппа человека типа 2:
• внешний прямой (NF) праймер 5`→3`
NF: 5`-CCCCTCAGCAACATCTCY(C/T)-3` (18 н.)
• внутренние прямой (F) и обратный (R) праймеры 5`→3`
F: 5`-CATTGGTGTTACACTCACAATGTAA-3` (25 н.)
R: 5`-GGTATR(G/A)GCAS(G/C)TGACTGAACAGCTT-3` (24 н.)
• флуоресцентно-меченый ДНК-зонд (Z) 5`→3`
Z:5`-ROX-TTTACCTAAGTGATGGAATCAATCGS(G/C)AA-BHQ2-3`(28н.)
3. Последовательности олигонуклеотидов видоспецифических к вирусу парагриппа человека типа 3:
• внешние прямой (NF) и обратный (NR) праймеры 5`→3`
NF: 5`-GTTGAY(C/T)GAAAGATCAGAY(C/T)TATGCA-3` (24 н.)
NR: 5`-TTGACCATCY(C/T)TTCTR(G/A)TCTGAAAA-3` (23 н.)
• внутренние прямой (F) и обратный (R) праймеры 5`→3`
F: 5`-TCAATCTCAACAACAAGATTTAAR(A/G)AA-3` (26 н.)
R: 5`-TTGGR(A/G)TGTTCAAGW(A/T)CCTCCATA-3` (22 н.)
R: 5`-TTGACCATCCTY(C/T)CTR(A/G)TCTGAAA-3` (22 н.)
• флуоресцентно-меченый ДНК-зонд (Z) 5`→3`
Z: 5`-Cy5-ATACCCATCTGTTGGACCAGGGATATA-BHQ2-3` (27 н.)
4. Последовательности олигонуклеотидов видоспецифических к вирусу парагриппа человека типа 4:
• внешние прямой (NF) и обратный (NR) праймеры 5`→3`
NF: 5`-TTCAGCAAACAAAR(G/A)AATGACAC-3` (22 н.)
NR: 5`-TTTAAGTGCATCTATACGR(G/A)ACR(G/A)C-3` (23 н.)
• внутренние прямой (F) и обратный (R) праймеры 5`→3`
F: 5`-CAACAAATY(C/T)AAAGGY(C/T)TCACTTGC-3` (23 н.)
R: 5`-Y(C/T)GR(A/G)R(A/G)TCAAGTGTAATTGTATTGTCT-3` (25 н.)
• флуоресцентно-меченый ДНК-зонд (Z) 5`→3`
Z: 5`-R6G-AAATAATGGAY(C/T)CCTGGAGTCCCATC-BHQ1-3` (25 н.)
Дизайн предлагаемых к патентованию праймеров и зонда включает все данные международной базы GenBank о нуклеотидных последовательностях вируса парагриппа человека. Используемые в работе праймеры и зонды обладают большей гомологией к циркулирующим в настоящее время вирусам парагриппа, что в свою очередь повышает чувствительность заявляемого набора диагностических праймеров и зонда. Кроме того, используя предлагаемые к патентованию праймеры, можно проводить двухраундовый ПЦР, что позволяет повысить чувствительность набора. Представляемые к патентованию олигодезоксирибонуклеотидные праймеры и ДНК-зонды позволяют выявить в образце кДНК вируса парагриппа человека типов 1-4 в режиме реального времени, а также амплифицировать продолжительные фрагменты ДНК, что дает возможность секвенировать полученный ампликон, с которым можно проводить молекулярно-биологические работы, а следовательно, и более глубокое изучение свойств вируса. Помимо этого, использование в качестве положительного контроля плазмидной конструкции несущей вирусспецифическую вставку (как описано ниже) позволяет разработать количественную ПЦР, что в свою очередь дает возможность оценить вирусную нагрузку в исследуемом образце.
Разработанные праймеры и ДНК-зонды обладают высокой степенью гомологии ко всем известным нуклеотидным последовательностям NH-гена (вирус парагриппа человека 1, 2, 3 типа) и F-гена (вирус парагриппа человека 4 типа), доступным в международной базе данных биотехнологической информации GenBank.
Апробация праймеров была осуществлена с использованием биотехнологической конструкции, в основе которой лежит плазмида со вставкой вирусспецифического ДНК-фрагмента. Экспериментально было показано, что выбранные праймеры и ДНК-зонд обеспечивают надежный синтез целевых ДНК-фрагментов. Специфичность амплификации дополнительно подтверждали секвенированием.
Характеристика набора праймеров и участка амплифицируемой геномной РНК. Предлагаемые к патентованию праймеры фланкируют участок гена, кодирующего протеин гемагглютинин-нейраминидазы (NH-ген) вируса парагриппа человека 1, 2, 3 типов и участок гена, кодирующего белок слияния (F-ген) вируса парагриппа человека типа 4.
В первом раунде ПЦР амплифицируются фрагменты генома с 7374 по 7668 нуклеотид (272 п.н.) вируса парагриппа человека 1 типа, с 7291 по 7533 нуклеотид (240 п.н.) вируса парагриппа человека 2 типа, с 7625 по 7941 нуклеотид (316 п.н.) вируса парагриппа человека 3 типа и с 2863 по 3155 нуклеотид (292 п.н.) вируса парагриппа 4 типа.
Во втором раунде ПЦР амплифицируются фрагменты генома с 7474 по 7553 нуклеотид (105 п.н.) вируса парагриппа человека 1 типа, с 7352 по 7533 нуклеотид (181 п.н.) вируса парагриппа человека 2 типа, с 7698 по 7836 нуклеотид (144 п.н.) вируса парагриппа человека 3 типа и с 2886 по 3077 нуклеотид (191 п.н.) вируса парагриппа 4 типа. Использование в комплекте с диагностическими праймерами флуоресцентно-меченых ДНК-зондов позволяет производить детекцию накопления продуктов амплификации в режиме реального времени.
Важно отметить, что оптимизация условий проведения ПЦР осуществлялась с использованием наборов коммерчески доступных реагентов, приборов и ферментов, предназначенных для массового использования в лабораторной практике, что позволяет быстрое и надежное применение данного изобретения в медицинских и научно-исследовательских лабораториях.
Перечень графических материалов. На фиг.1 представлены результаты анализа образцов методом ПЦР в реальном времени. Предлагаемый к патентованию набор олигонуклеотидов был апробирован с использованием плазмидных конструкций, несущих видоспецифическую вставку к вирусу парагриппа человека 1, 2, 3 и 4 типов.
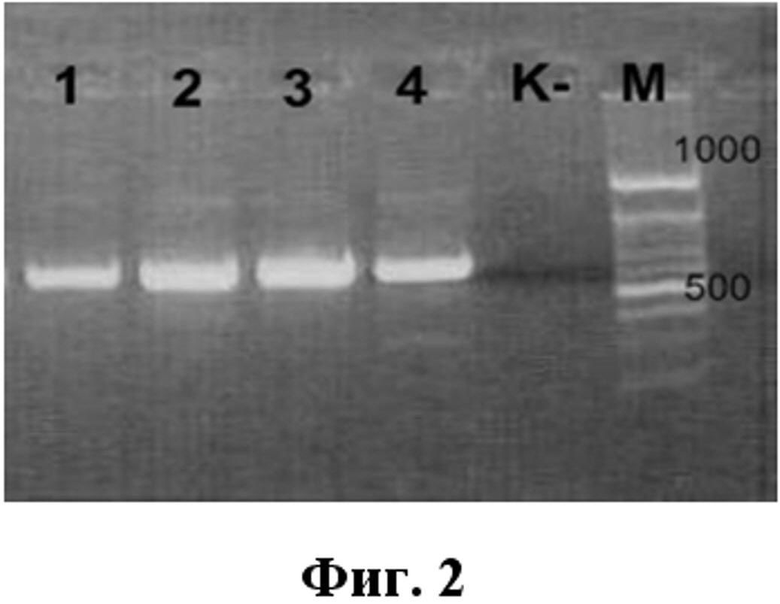
На фиг.2 приведена электрофореграмма разделения в 2% агарозном геле продуктов ПЦР, полученных с использованием патентуемых олигонуклеотидов.
Пример 1. Методика конструирования набора диагностических праймеров и флуоресцентно-меченых зондов.
На основе теоретического изучения структуры генома вируса парагриппа человека типа 1-4 на консервативные области генов гемагглютинин-нейраминидазы (NH-ген) и белка слияния (F-ген) были рассчитаны и синтезированы праймеры и флуоресцентно-меченые ДНК-зонды для проведения полимеразной цепной реакции.
Таблица 1
Праймеры для первого раунда ПЦР
5' - 3'
Таблица 2
Праймеры и ДНК-зонды для первого раунда ПЦР
5' → 3'
7842-7821
TTGACCATCCTYCTRTCTGAAA
51
В рамках заявляемого технического решения было выровнено и проанализировано 236 нуклеотидных последовательностей (н.п.) генома вируса парагриппа человека типа 1, 92 н.п. генома вируса парагриппа типа 2, 76 н.п. генома вируса парагриппа типа 3, 59 н.п. генома вируса парагриппа типа 4. Предлагаемые к патентованию последовательности олигонуклеотидов приведены в таблице 1 и таблице 2.
Пример 2. Методика получения положительных контрольных образцов Положительные контрольные образцы были получены методом ТОРО-Т/А клонирования вирусспецифических ДНК-дуплексов в плазмиду pCR2.1 (Invitrogen, США). После чего компетентные клетки E. coli линии TOP 10 (Invitrogen, США) были трансформированы полученными плазмидами, несущими типоспецифические к вирусу парагриппа человека фрагменты ДНК. В ходе проделанной работы были сконструированы четыре рекомбинантные плазмиды: pPIV-1 (вирус парагриппа человека типа 1), pPIV-2 (вирус парагриппа человека типа 2), pPIV-3 (вирус парагриппа человека типа 3) и pPIV-4 (вирус парагриппа человека типа 4). Наличие специфической к вирусному геному ДНК-вставки подтверждали секвенированием.
Анализ эффективности проведенной трансформации осуществляли проведением ПЦР в режиме реального времени в соответствии с протоколом, описанным ниже, где в реакционную смесь в качестве положительного образца добавляли 1×ТЕ-буфер, содержащий рекомбинантные плазмиды, со встройкой вирусспецифического синтезированного ДНК-дуплекса. В качестве отрицательного контрольного образца в реакционную смесь добавляли 1×ТЕ-буфер.
Пример 3. Проведение полимеразной цепной реакции с использованием заявляемого набора
Условия проведения амплификации оптимизировали по концентрации ионов магния, концентрации праймеров и зондов в реакционной смеси, температуре отжига праймеров.
Таблица 3
ПЦР-смесь для превого раунда (из расчета на одну пробирку)
Реакцию амплификации проводили в 30 мкл смеси для ПЦР (табл. 3 и 4), содержащей 1×Taq буфер для амплификации, 2.5 мМ MgCl2, 0.17 мМ каждого из нуклеозид-трифосфатов, 1.5 активных единиц Smart Taq ДНК-полимеразы (все компоненты ООО «Лаборатория МЕДИГЕН»), 20 пМ каждого из восьми праймеров и 7,5 пМ каждого из четырех флуоресцентно-меченых ДНК-зондов (для ПЦР в «реальном времени»).
Реакцию амплификации с электрофоретической детекцией продукта амплификации (первый раунд ПЦР) проводили на приборе Mastercycler gradient (Eppendorf, Германия) согласно программе табл. 5. Продукты ПЦР разделяли методом электрофореза в 2 % агарозном геле в присутствии бромистого этидия. Результаты оценивали по наличию флуоресцирующих полос, соответствующих фрагментам ДНК в 720 п.н.
Таблица 4
ПЦР-смесь для второго раунда (из расчета на одну пробирку)
Таблица 5
Программа амплификатора для ПЦР
На фиг. 2 представлена электрофореграмма разделения в 2 % агарозном геле продуктов ПЦР, полученных с использованием патентуемых олигонуклеотидов.
Примечание:
1. плазмидная конструкция pPIV-1, несущая специфическую вставку к вирусу парагриппа человека типа 1;
2. плазмидная конструкция pPIV-2, несущая специфическую вставку к вирусу парагриппа человека типа 2;
3. плазмидная конструкция pPIV-4, несущая специфическую вставку к вирусу парагриппа человека типа 4;
4. плазмидная конструкция pPIV-3, несущая специфическую вставку к вирусу парагриппа человека типа 3;
К - отрицательный контрольный образец (однократный ТЕ-буфер);
М - маркер молекулярного веса.
Полосы флуоресценции в геле соответствовали полученным в реакции амплификации участкам плазмидной ДНК.
ПЦР в режиме реального времени (второй раунд ПЦР) проводили согласно программе амплификации, приведенной в таблице 6. Детекцию интенсивности флуоресценции проводили по каналам - по каналам FAM (470/510 нм), ROX(585/610 нм), R6G (530/555 нм) и Cy5 (625/660 нм). Измерение флуоресценции проводили на приборах “Rotor Gene 6000” (Corbet Research, Австралия) и iQ5 (BioRad, США). Результаты оценивали по наличию флюоресценции до 30 цикла. На фиг. 1 представлены результаты анализа образцов методом ПЦР в реальном времени с использованием патентуемых олигонуклеотидов. Примечание:
1. плазмидная конструкция pPIV-1, несущая специфическую вставку к вирусу парагриппа человека типа 1 (канал FAM (470/510 нм));
2. плазмидная конструкция pPIV-2, несущая специфическую вставку к вирусу парагриппа человека типа 2 (канал ROX(585/610 нм));
3. плазмидная конструкция pPIV-4, несущая специфическую вставку к вирусу парагриппа человека типа 4 (канал R6G (530/555 нм));
4. плазмидная конструкция pPIV-3, несущая специфическую вставку к вирусу парагриппа человека типа 3 (канал Cy5 (625/660 нм)).
Таблица 6
Программа амплификатора для ПЦР-РВ
Из вышеприведенных данных (примеры 1-3) видно, что заявляемый набор олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченых зондов, обеспечивает достижение заявляемого технического результата, а именно повышение достоверности и надежности детекции и дифференциации вируса парагриппа человека 1, 2, 3 и 4 типов в клинических образцах.
Приложение
ПЕРЕЧЕНЬ
последовательностей олигонуклеотидов видоспецифических
к вирусу парагриппа человека 1, 2, 3 и 4 типов:
<110> Федеральное бюджетное учреждение науки «Государственный научный центр вирусологии и биотехнологии "Вектор"» (ФБУН ГНЦ ВБ "Вектор").
<120> Набор олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченых зондов для идентификации РНК и дифференциации вируса парагриппа человека 1, 2, 3 и 4 типов.
1. Последовательности олигонуклеотидов видоспецифических к вирусу парагриппа человека типа 1:
• внешние прямой (NF) и обратный (NR) праймеры 5`→3`
NF: 5`-TTCTGGAGATGTCCCGTAGG-3` (20 н.)
NR: 5`-TCCTGTTR(G/A)TCR(G/A)TTGATGTCATAR(G/A)-3` (23 н.)
• внутренние прямой (F) и обратный (R) праймеры 5`→3`
F: 5`-GATGTGTTAGR(G/A)Y(C/T)TACCTTCATTATCA-3` (26 н.)
R: 5`-AAACCTGR(G/A)TATGACTTY(C/T)CCTATATCT-3` (26 н.)
• флуоресцентно-меченый ДНК-зонд (Z) 5`→3`
Z: 5`-FAM-TATTCATCAAACTTAATCACTCAAGGATGTG-BHQ1-3` (31 н.)
2. Последовательности олигонуклеотидов видоспецифических к вирусу парагриппа человека типа 2:
• внешний прямой (NF) праймер 5`→3`
NF: 5`-CCCCTCAGCAACATCTCY(C/T)-3` (18 н.)
• внутренние прямой (F) и обратный (R) праймеры 5`→3`
F: 5`-CATTGGTGTTACACTCACAATGTAA-3` (25 н.)
R: 5`-GGTATR(G/A)GCAS(G/C)TGACTGAACAGCTT-3` (24 н.)
• флуоресцентно-меченый ДНК-зонд (Z) 5`→3`
Z: 5`-ROX-TTTACCTAAGTGATGGAATCAATCGS(G/C)AA-BHQ2-3`(28 н.)
3. Последовательности олигонуклеотидов видоспецифических к вирусу парагриппа человека типа 3:
• внешние прямой (NF) и обратный (NR) праймеры 5`→3`
NF: 5`-GTTGAY(C/T)GAAAGATCAGAY(C/T)TATGCA-3` (24 н.)
NR: 5`-TTGACCATCY(C/T)TTCTR(G/A)TCTGAAAA-3` (23 н.)
• внутренние прямой (F) и обратный (R) праймеры 5`→3`
F: 5`-TCAATCTCAACAACAAGATTTAAR(A/G)AA-3` (26 н.)
R: 5`-TTGGR(A/G)TGTTCAAGW(A/T)CCTCCATA-3` (22 н.)
R: 5`-TTGACCATCCTY(C/T)CTR(A/G)TCTGAAA-3` (22 н.)
• флуоресцентно-меченый ДНК-зонд (Z) 5`→3`
Z: 5`-Cy5-ATACCCATCTGTTGGACCAGGGATATA-BHQ2-3` (27 н.)
4. Последовательности олигонуклеотидов видоспецифических к вирусу парагриппа человека типа 4:
• внешние прямой (NF) и обратный (NR) праймеры 5`→3`
NF: 5`-TTCAGCAAACAAAR(G/A)AATGACAC-3` (22 н.)
NR: 5`-TTTAAGTGCATCTATACGR(G/A)ACR(G/A)C-3` (23 н.)
• внутренние прямой (F) и обратный (R) праймеры 5`→3`
F: 5`-CAACAAATY(C/T)AAAGGY(C/T)TCACTTGC-3` (23 н.)
R: 5`-Y(C/T)GR(A/G)R(A/G)TCAAGTGTAATTGTATTGTCT-3` (25 н.)
• флуоресцентно-меченый ДНК-зонд (Z) 5`→3`
Z: 5`-R6G-AAATAATGGAY(C/T)CCTGGAGTCCCATC-BHQ1-3` (25 н.)

Изобретение относится к области биотехнологии и касается набора праймеров для выявления генетического материала (РНК) и дифференциации вируса парагриппа человека 1, 2, 3 и 4 типов в клинических образцах. Представленный набор олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченых ДНК-зондов содержит четыре пары внутренних и четыре пары внешних олигонуклеотидов, обладающих активностью прямого и обратного праймеров в полимеразной цепной реакции, а также четыре флуоресцентно-меченых ДНК-зонда. Представленное изобретение позволяет проводить более достоверное и надежное выявление генетического материала (РНК) и дифференциацию вируса парагриппа человека 1, 2, 3 и 4 типов и может быть использовано в медицине, биотехнологии и эпидемиологии. 2 ил., 6 табл., 3 пр.
Набор олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченых ДНК-зондов для выявления генетического материала (РНК) и дифференциация вируса парагриппа человека 1, 2, 3 и 4 типов, содержащий четыре пары внутренних и четыре пары внешних олигонуклеотидов, обладающих активностью прямого и обратного праймеров в полимеразной цепной реакции, а также четыре флуоресцентно-меченых ДНК-зонда, имеющих следующую структуру:
1. Последовательности олигонуклеотидов видоспецифических к вирусу парагриппа человека типа 1:
• внешние прямой (NF) и обратный (NR) праймеры 5`→3`
NF: 5`-TTCTGGAGATGTCCCGTAGG-3` (20 н.)
NR: 5`-TCCTGTTR(G/A)TCR(G/A)TTGATGTCATAR(G/A)-3` (23 н.)
• внутренние прямой (F) и обратный (R) праймеры 5`→3`
F: 5`-GATGTGTTAGR(G/A)Y(C/T)TACCTTCATTATCA-3` (26 н.)
R: 5`-AAACCTGR(G/A)TATGACTTY(C/T)CCTATATCT-3` (26 н.)
• флуоресцентно-меченый ДНК-зонд (Z) 5`→3`
Z: 5`-FAM-TATTCATCAAACTTAATCACTCAAGGATGTG-BHQ1-3` (31 н.)
2. Последовательности олигонуклеотидов видоспецифических к вирусу парагриппа человека типа 2:
• внешний прямой (NF) праймер 5`→3`
NF: 5`-CCCCTCAGCAACATCTCY(C/T)-3` (18 н.)
• внутренние прямой (F) и обратный (R) праймеры 5`→3`
F: 5`-CATTGGTGTTACACTCACAATGTAA-3` (25 н.)
R: 5`-GGTATR(G/A)GCAS(G/C)TGACTGAACAGCTT-3` (24 н.)
• флуоресцентно-меченый ДНК-зонд (Z) 5`→3`
Z: 5`-ROX-TTTACCTAAGTGATGGAATCAATCGS(G/C)AA-BHQ2-3`(28 н.)
3. Последовательности олигонуклеотидов видоспецифических к вирусу парагриппа человека типа 3:
• внешние прямой (NF) и обратный (NR) праймеры 5`→3`
NF: 5`-GTTGAY(C/T)GAAAGATCAGAY(C/T)TATGCA-3` (24 н.)
NR: 5`-TTGACCATCY(C/T)TTCTR(G/A)TCTGAAAA-3` (23 н.)
• внутренние прямой (F) и обратный (R) праймеры 5`→3`
F: 5`-TCAATCTCAACAACAAGATTTAAR(A/G)AA-3` (26 н.)
R: 5`-TTGGR(A/G)TGTTCAAGW(A/T)CCTCCATA-3` (22 н.)
R: 5`-TTGACCATCCTY(C/T)CTR(A/G)TCTGAAA-3` (22 н.)
• флуоресцентно-меченый ДНК-зонд (Z) 5`→3`
Z: 5`-Cy5-ATACCCATCTGTTGGACCAGGGATATA-BHQ2-3` (27 н.)
4. Последовательности олигонуклеотидов видоспецифических к вирусу парагриппа человека типа 4:
• внешние прямой (NF) и обратный (NR) праймеры 5`→3`
NF: 5`-TTCAGCAAACAAAR(G/A)AATGACAC-3` (22 н.)
NR: 5`-TTTAAGTGCATCTATACGR(G/A)ACR(G/A)C-3` (23 н.)
• внутренние прямой (F) и обратный (R) праймеры 5`→3`
F: 5`-CAACAAATY(C/T)AAAGGY(C/T)TCACTTGC-3` (23 н.)
R: 5`-Y(C/T)GR(A/G)R(A/G)TCAAGTGTAATTGTATTGTCT-3` (25 н.)
• флуоресцентно-меченый ДНК-зонд (Z) 5`→3`
Z: 5`-R6G-AAATAATGGAY(C/T)CCTGGAGTCCCATC-BHQ1-3` (25 н.)
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ РЕСПИРАТОРНЫХ ВИРУСНЫХ ИНФЕКЦИЙ МЕТОДОМ МУЛЬТИПЛЕКСНОЙ ПЦР С ДЕТЕКЦИЕЙ В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ И ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2010 |
|
RU2460803C2 |
| US 20100279273 A1, 04.11.2010 | |||
| US 5744299 A, 28.04.1998 | |||
| GENEVIE`VE EUGENE-RUELLAN et al., Detection of Respiratory Syncytial Virus A and B and | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Gene and Differential Hybridization, JOURNAL OF CLINICAL MICROBIOLOGY, Mar | |||
| Способ и аппарат для получения гидразобензола или его гомологов | 1922 |
|
SU1998A1 |
| Коридорная многокамерная вагонеточная углевыжигательная печь | 1921 |
|
SU36A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
Авторы
Даты
2014-05-20—Публикация
2012-12-25—Подача