ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам удаления избытка растворимого белка и других примесей из лизатов клеток серотипов Streptococcus pneumoniae (S. pneumoniae), используемых для получения очищенных полисахаридов пневмококков.
УРОВЕНЬ ТЕХНИКИ
Бактерии Streptococcus pneumoniae относятся к грамположительным ланцетовидным коккам, которые обычно объединяются в пары (диплококки), но также могут существовать в виде коротких цепей или в виде отдельных клеток. Они легко растут на чашках с кровяным агаром, образуя блестящие колонии, и способны к альфа-гемолизу, если только их не выращивают в анаэробных условиях, в которых они проявляют бета-гемолиз. Они чувствительны к солям желчных кислот, которые могут разрушить клеточную стенку с помощью присутствующего в самих клетках фермента - аутолизина. Указанный микроорганизм представляет собой аэротолерантный анаэроб, и он прихотлив в том отношении, что он имеет комплексную потребность в питательных веществах.
Клетки большинства серотипов пневмококков имеют капсулу, которая представляет собой слой полисахарида, окружающий каждую клетку. Эта капсула является определяющей для вирулентности в отношении человека, поскольку она препятствует фагоцитозу путем предотвращения присоединения антител к бактериальным клеткам. На сегодняшний день идентифицировано 90 капсульных серотипов, при этом 23 серотипа ответственны за приблизительно 90% инвазивных заболеваний. В виде вакцины указанный полисахарид может придать приемлемую степень иммунитета к S. pneumoniae индивидуумам с развитыми или неослабленными иммунными системами. Тем не менее, если полисахарид конъюгирован с высокомолекулярным белком, таким как CRM197, и входит в состав вакцины, содержащей конъюгаты множества серотипов, такие конъюгатные вакцины позволяют вызывать иммунный ответ у детей и людей преклонного возраста, которые также имеют наибольший риск пневмококковых инфекций.
Капсульный полисахарид для каждого серотипа S. pneumoniae, применяемого для получения продуктов вакцины, получают путем выращивания микроорганизма в жидкой среде. Размер популяции организма часто увеличивают от посевных пробирок до посевных колб и пропускают через один или более посевных ферментеров с возрастающим объемом до тех пор, пока не будут достигнуты промышленные масштабы объемов ферментации. Окончание цикла роста можно определить с помощью нескольких средств, на этом этапе клетки лизируют посредством добавления детергента или другого реагента, который способствует разрушению клеточной стенки и высвобождению аутолизина, который вызывает лизис клеток по достижении клетками стационарной фазы. Бульон затем собирают для последующей переработки (очистки). Основными примесями являются клеточные белки, нуклеиновые кислоты, С-полисахарид и компоненты среды.
Способы получения очищенных индивидуальных полисахаридов из растворов известны из уровня техники, в частности из документов US 5847112 и US 4242501.
Для большинства серотипов, для реализуемой на сегодняшний день на рынке 7-валентной пневмококковой конъюгатной (7vPnC) вакцины (Prevnar®), а также для недавно разработанной 13-валентной пневмококковой конъюгатной (13vPnC) вакцины, известный из уровня техники способ очистки требует шестнадцать этапов, включающих множество дорогостоящих, трудоемких и технологически сложных операций, таких как хроматография и множество разделений на мембранах. Предшествующие попытки улучшить способы очистки полисахаридов S. Pneumoniae включали, например, изменение рН во время ферментации и выделения (см. заявку на патент США, номер публикации 2006/0228381), а также осаждение растворителем и детергентом. Тем не менее удаление примесей в этих способах все еще требует многих трудоемких и дорогостоящих этапов. Уровень содержания белка является наиболее проблематичным техническим требованием, которое нужно удовлетворить, вследствие физических и химических свойств растворимых белков.
Таким образом, существует потребность в упрощенном способе очистки для уменьшения уровней растворимого белка в лизатах S. pneumoniae и устранения неэффективности известного из уровня техники способа очистки для получения по существу очищенных капсульных полисахаридов, подходящих для включения в пневмококковые конъюгатные вакцины.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способу получения раствора, содержащего очищенные капсульные полисахариды из лизата клеток Streptococcus pneumoniae. Указанный способ включает следующие стадии:
(a) обеспечение ферментативного бульона, который содержит бактериальные клетки, которые продуцируют выбранный серотип Streptococcus pneumoniae;
(b) лизирование бактериальных клеток, полученных на стадии (а) литическим агентом, с получением лизата клеток, который содержит остатки клеток, растворимые белки, нуклеиновые кислоты и полисахариды;
(c) осветление лизата клеток, полученного на стадии (b), посредством центрифугирования или фильтрования для удаления остатков клеток с получением осветленного лизата клеток;
(d) ультрафильтрование и диафильтрование осветленного лизата клеток, полученного на стадии (с), для удаления низкомолекулярных примесей и повышения концентрации полисахарида с получением ретентата;
(e) понижение рН ретентата, полученного на стадии (d), до значения менее чем 4.5 для преципитации белка и нуклеиновых кислот с получением подкисленного раствора ретентата;
(f) выдерживание подкисленного раствора ретентата, полученного на стадии (е), в течение времени, достаточного для осаждения преципитата, а затем фильтрование или центрифугирование подкисленного раствора ретентата с получением осветленного раствора полисахарида;
(g) фильтрование осветленного раствора полисахарида, полученного на стадии (f) через фильтр с активированным углем;
(h) ультрафильтрование и диафильтрование указанного фильтрованного раствора, полученного на стадии (g), с получением концентрированного очищенного раствора полисахарида; и
(i) фильтрование концентрированного очищенного раствора полисахарида, полученного на стадии (h), с применением стерильного фильтра;
в результате чего получают очищенные капсульные полисахариды в виде раствора. Типичные неограничивающие примеры серотипов S. pneumoniae, выбранные для этого варианта реализации настоящего изобретения, представляют собой 1, 4, 5, 6А, 6В, 7F, 9V, 14, 18С, 19А, 19F, и 23F. В конкретном варианте реализации, рН на стадии (е) понижают до значения приблизительно 3.5. В следующем варианте реализации, диафильтрация на стадии (h) включает подведение рН до значения между приблизительно 5.5 и приблизительно 7.5. В следующем варианте реализации, диафильтрация на стадии (h) включает подведение рН до значения между приблизительно 7.0 и приблизительно 7.5. В следующем варианте реализации, диафильтрация на стадии (h) включает подведение рН до значения приблизительно 7.4. В еще одном варианте реализации, на стадии (е) удаляют по меньшей мере 98% белка из ретентата, полученного на стадии (d). В следующем варианте реализации, на стадии (g) удаляют по меньшей мере 90% белка из осветленного раствора полисахарида, полученного на стадии (f). В следующем варианте реализации, фильтр с активированным углем, который применяют на стадии (g), включает древесный уголь, активированный фосфорной кислотой. В следующем варианте реализации, стадия (f) включает выдерживание подкисленного раствора ретентата, полученного на стадии (е), в течение по меньшей мере 2 часов. В еще одном варианте реализации, литический агент, который применяют на стадии (b), представляет собой дезоксихолат натрия (DOC). В следующем варианте реализации, литический агент на стадии (b), представляет собой литический агент неживотного происхождения. В еще одном варианте реализации, литический агент, который применяют на стадии (b) представляет собой литический агент неживотного происхождения - N-лаурилсаркозинат натрия (NLS).
Указанный очищенный капсульный полисахарид, полученный с помощью способа согласно настоящему изобретению из лизата клеток Streptococcus pneumoniae, можно применять для производства пневмококковой вакцины, предпочтительно пневмококковой вакцины, содержащей полисахарид, конъюгированный с белковым носителем.
Настоящее изобретение также относится к способу получения раствора, содержащего очищенные капсульные полисахариды из лизата клеток Streptococcus pneumoniae, включающего серотип 1, 4, 5, 6А, 6В, 7F, 9V, 14, 18С, 19F или 23F. Этот способ включает следующие стадии:
(a) обеспечение ферментативного бульона, который содержит бактериальные клетки, которые продуцируют серотип Streptococcus pneumoniae 1, 4, 5, 6А, 6В, 7F, 9V, 14, 18С, 19F или 23F;
(b) лизирование бактериальных клеток, полученных на стадии (а), литическим агентом, с получением лизата клеток, который содержит остатки клеток, растворимые белки, нуклеиновые кислоты и полисахариды;
(c) осветление лизата клеток, полученного на стадии (b), посредством центрифугирования или фильтрования для удаления остатков клеток с получением осветленного лизата клеток;
(d) ультрафильтрование и диафильтрование осветленного клеточного лизата, полученного на стадии (с), при комнатной температуре при нейтральном рН в бессолевых средах для удаления низкомолекулярных примесей и повышения концентрации полисахарида с получением бессолевого ретентата;
(e) понижение рН бессолевого ретентата, полученного на стадии (d), до значения менее чем 4.5 для преципитации белка и нуклеиновых кислот с получением подкисленного раствора ретентата;
(f) выдерживание подкисленного раствора ретентата, полученного на стадии (е), в течение по меньшей мере 2 часов при комнатной температуре для осаждения преципитата, а затем фильтрование или центрифугирование подкисленного раствора ретентата с получением осветленного раствора полисахарида;
(g) фильтрование осветленного раствора полисахарида, полученного на стадии (f), через фильтр с активированным углем;
(h) ультрафильтрование и диафильтрование указанного фильтрованного раствора, полученного на стадии (g), с получением концентрированного очищенного раствора полисахарида; и
(i) фильтрование концентрированного очищенного раствора полисахарида, полученного на стадии (h), с применением стерильного фильтра;
в результате чего получают очищенные капсульные полисахариды, включая серотип 1, 4, 5, 6А, 6В, 7F, 9V, 14, 18С, 19F или 23F в виде раствора. В конкретном варианте реализации, рН на стадии (е) понижают до значения приблизительно 3.5. В следующем варианте реализации, диафильтрация на стадии (h) включает подведение рН до значения между приблизительно 5.5 и приблизительно 7.5. В следующем варианте реализации, диафильтрация на стадии (h) включает подведение рН до значения между приблизительно 7.0 и приблизительно 7.5. В следующем варианте реализации, диафильтрация на стадии (h) включает подведение рН до значения приблизительно 7.4. В еще одном варианте реализации, на стадии (е) удаляют по меньшей мере 98% белка из бессолевого ретентата, полученного на стадии (d). В следующем варианте реализации, на стадии (g) удаляют по меньшей мере 90% белка из осветленного раствора полисахарида, полученного на стадии (f). В следующем варианте реализации, фильтр с активированным углем, который применяют на стадии (g) включает древесный уголь, активированный фосфорной кислотой. В еще одном варианте реализации, литический агент, который применяют на стадии (b), представляет собой дезоксихолат натрия (DOC). В следующем варианте реализации, литический агент, который применяют на стадии (b), представляет собой литический агент неживотного происхождения. В еще одном варианте реализации, литический агент на стадии (b) представляет собой литический агент неживотного происхождения - N-лаурилсаркозинат натрия (NLS).
Настоящее изобретение также относится к способу получения раствора, содержащего очищенные капсульные полисахариде из лизата клеток Streptococcus pneumoniae, включающего серотип 19А. Этот способ включает следующие стадии:
(a) обеспечение ферментативного бульона, который содержит бактериальные клетки, которые продуцируют серотип Streptococcus pneumoniae 19А;
(b) лизирование бактериальных клеток, полученных на стадии стадии (а), литическим агентом, с получением лизата клеток, который содержит остатки клеток, растворимые белки, нуклеиновые кислоты и полисахариды;
(c) осветление лизата клеток, полученного на стадии (b), посредством центрифугирования или фильтрования для удаления остатков клеток с получением осветленного лизата клеток;
(d) ультрафильтрование и диафильтрование осветленного лизата клеток, полученного на стадии (с), при приблизительно 4°С при рН, равном приблизительно 6, в натриево-фосфатном буфере для удаления низкомолекулярных примесей и повышения концентрации полисахарида с получением ретентата;
(e) понижение рН ретентата, полученного на стадии (d), до значения менее чем 4.5 для преципитации белка и нуклеиновых кислот с получением подкисленного раствора ретентата;
(f) выдерживание подкисленного раствора ретентата, полученного на стадии (е), в течение по меньшей мере 2 часов при приблизительно 4°С для осаждения преципитата, а затем фильтрование или центрифугирование подкисленного раствора ретентата с получением осветленного раствора полисахарида;
(g) подведение рН осветленного раствора полисахарида, полученного на стадии (f), до значения приблизительно 6 с получением осветленного раствора полисахарида с подведенным рН;
(h) фильтрование осветленного раствора полисахарида с подведенным рН, полученного на стадии (g), через фильтр с активированным углем;
(i) ультрафильтрование и диафильтрование указанного фильтрованного раствора, полученного на стадии (h), с получением концентрированного очищенного раствора полисахарида; и
(j) фильтрование концентрированного очищенного раствора полисахарида, полученного на стадии (i), с применением стерильного фильтра;
в результате чего получают очищенные капсульные полисахариды, включая серотип 19А, в виде раствора. В конкретном варианте реализации, рН на стадии (е) понижают до значения приблизительно 3.5. В следующем варианте реализации, диафильтрация на стадии (i) включает подведение рН до значения между приблизительно 5.5 и приблизительно 7.5. В следующем варианте реализации, диафильтрация на стадии (i) включает подведение рН до значения между приблизительно 7.0 и приблизительно 7.5. В следующем варианте реализации, диафильтрация на стадии (i) включает подведение рН до значения приблизительно 7.4. В еще одном варианте реализации, на стадии (е) из ретентата, полученного на стадии (d), удаляют по меньшей мере 98% белка. В следующем варианте реализации, на стадии (h) удаляют по меньшей мере 90% белка из осветленного раствора полисахарида с подведенным рН, полученного на стадии (g). В следующем варианте реализации, фильтр с активированным углем, который применяют на стадии (h) включает древесный уголь, активированный фосфорной кислотой. В следующем варианте реализации, натриево-фосфатный буфер, который применяют на стадии (d) представляет собой 25 мМ фосфат натрия. В еще одном варианте реализации, литический агент, который применяют на стадии (b), представляет собой дезоксихолат натрия (DOC). В следующем варианте реализации, литический агент на стадии (b) представляет собой литический агент неживотного происхождения. В еще одном варианте реализации, литический агент, который применяют на стадии (b), представляет собой литический агент неживотного происхождения - N-лаурилсаркозинат натрия (NLS).
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
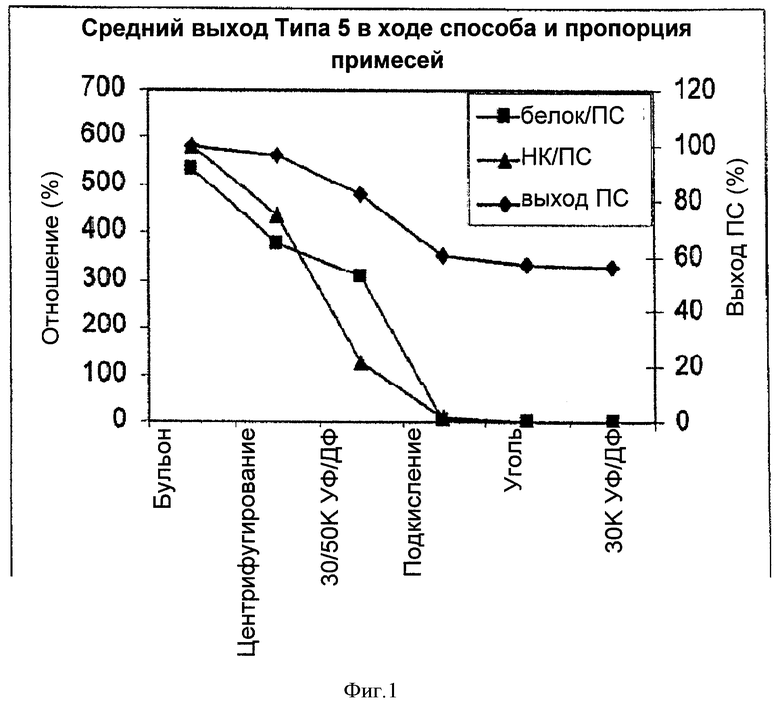
На Фигуре 1 показан средний выход полисахарида (ПС) для способа согласно настоящему изобретению, отношение белок/ПС и отношение нуклеиновая кислота (НК)/ПС для серотипа 5, с применением ускоренного способа очистки согласно настоящему изобретению. Результаты приведены для каждого этапа очистки.
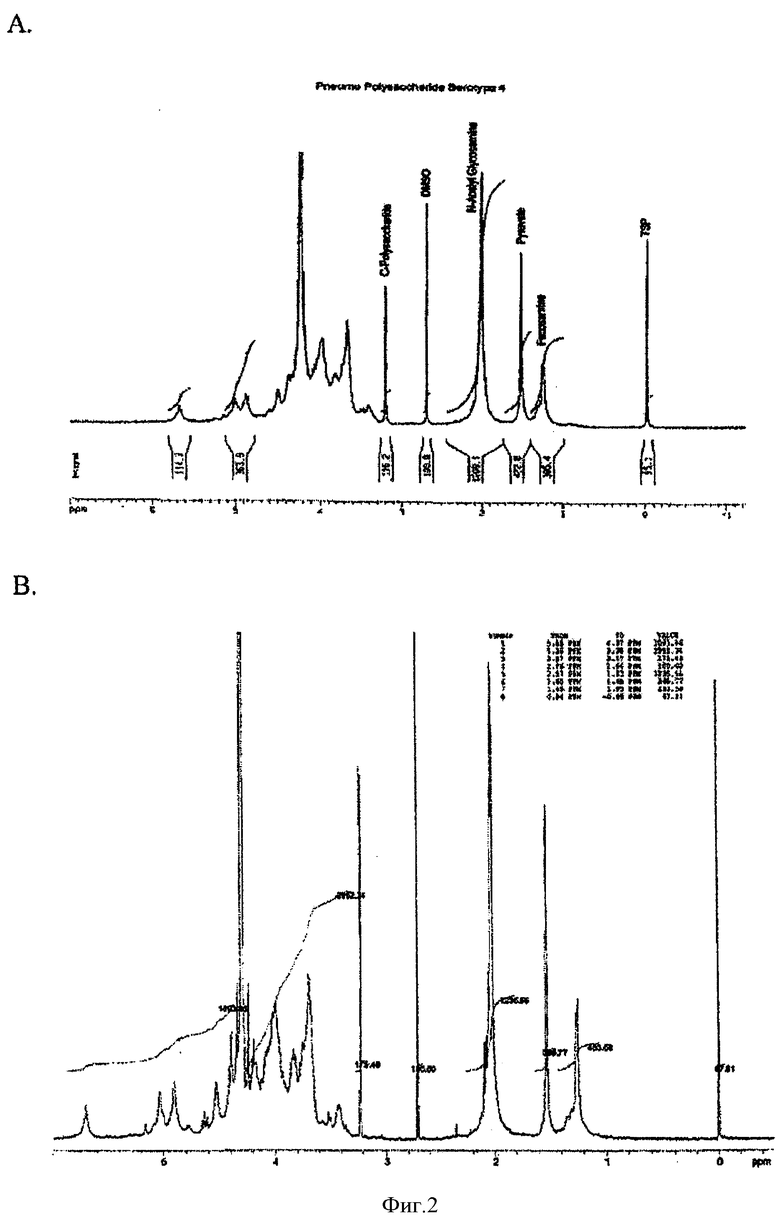
На Фигуре 2 показаны ЯМР-спектры для ПС серотипа 4 из известного способа очистки (А) по сравнению с ПС серотипа 4 из ускоренного способа очистки (В). Не наблюдалось значительных отличий между указанными двумя спектрами. Вторым пиком справа в обоих спектрах был пируват, и высота пика пируватной группы была сравнимой в обоих спектрах.
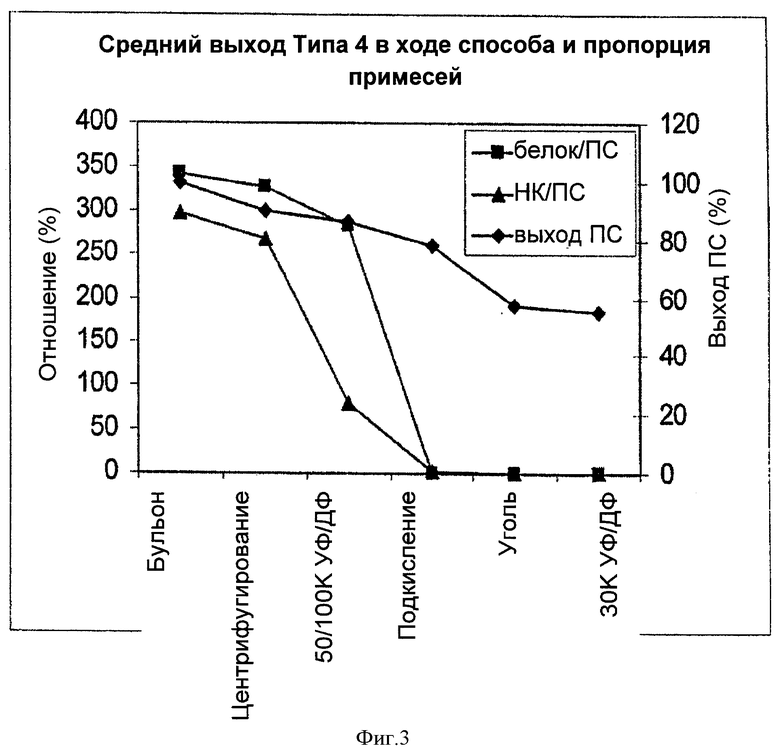
На Фигуре 3 показан средний выход ПС для способа согласно настоящему изобретению, отношение белок/ПС, и отношение НК/ПС для серотипа 4, с применением ускоренного способа очистки согласно настоящему изобретению. Результаты показаны для каждого этапа очистки.
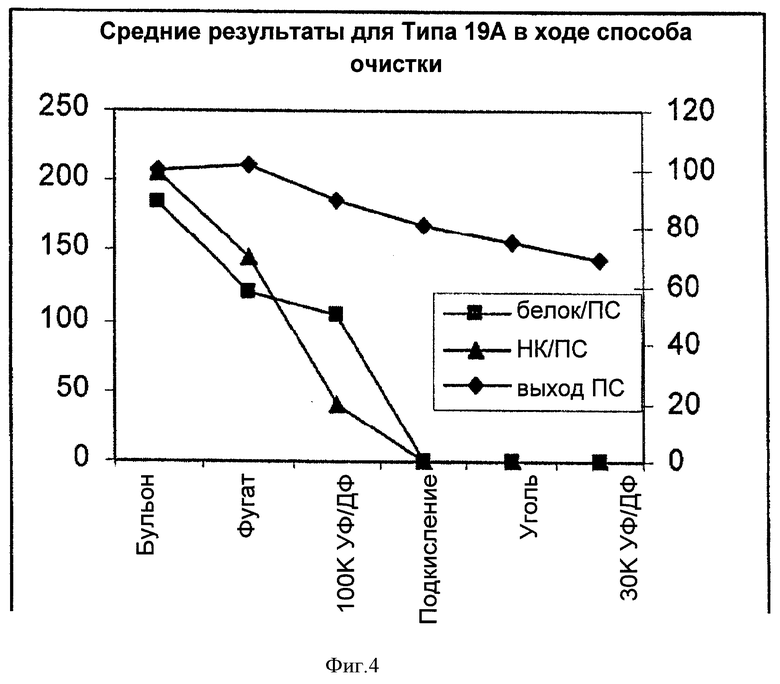
На Фигуре 4 показан средний выход ПС для способа согласно настоящему изобретению, отношение белок/ПС, и отношение НК/ПС для серотипа 19А, с применением ускоренного способа очистки согласно настоящему изобретению. Результаты показаны для каждого этапа очистки.
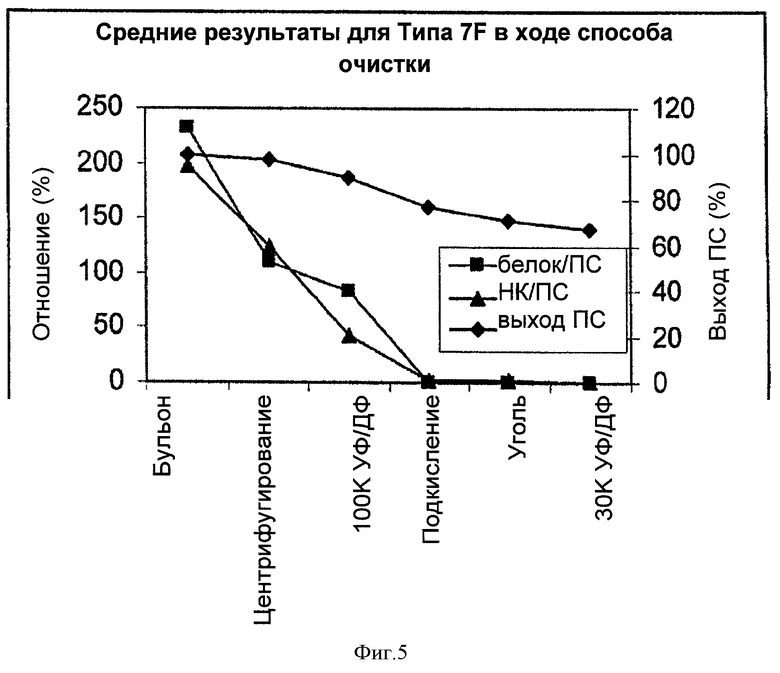
На Фигуре 5 показан средний выход ПС для способа согласно настоящему изобретению, отношение белок/ПС и отношение НК/ПС для серотипа 7F, с применением ускоренного способа очистки согласно настоящему изобретению. Результаты показаны для каждого этапа очистки.
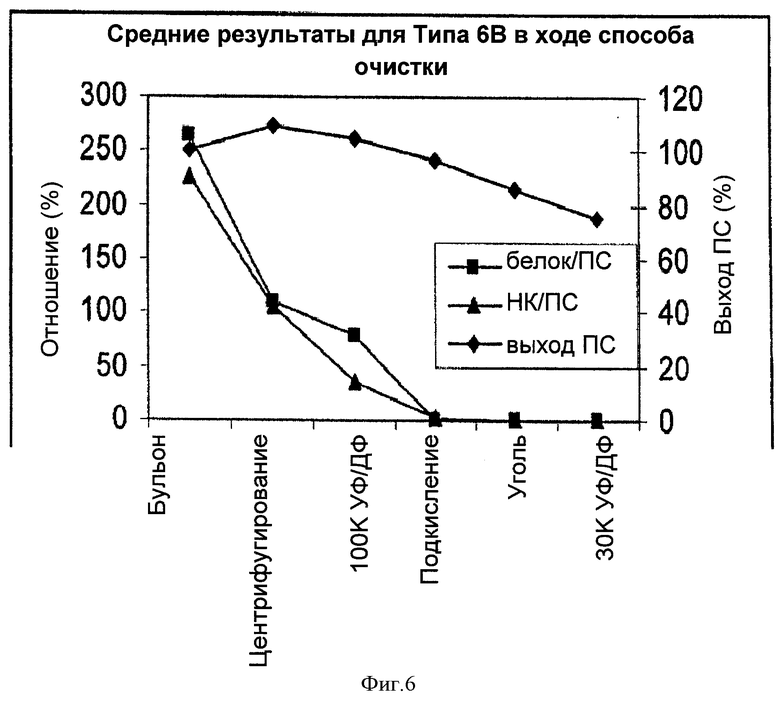
На Фигуре 6 показан средний выход ПС для способа согласно настоящему изобретению, отношение белок/ПС и отношение НК/ПС для серотипа 6В, с применением ускоренного способа очистки согласно настоящему изобретению. Результаты показаны для каждого этапа очистки.
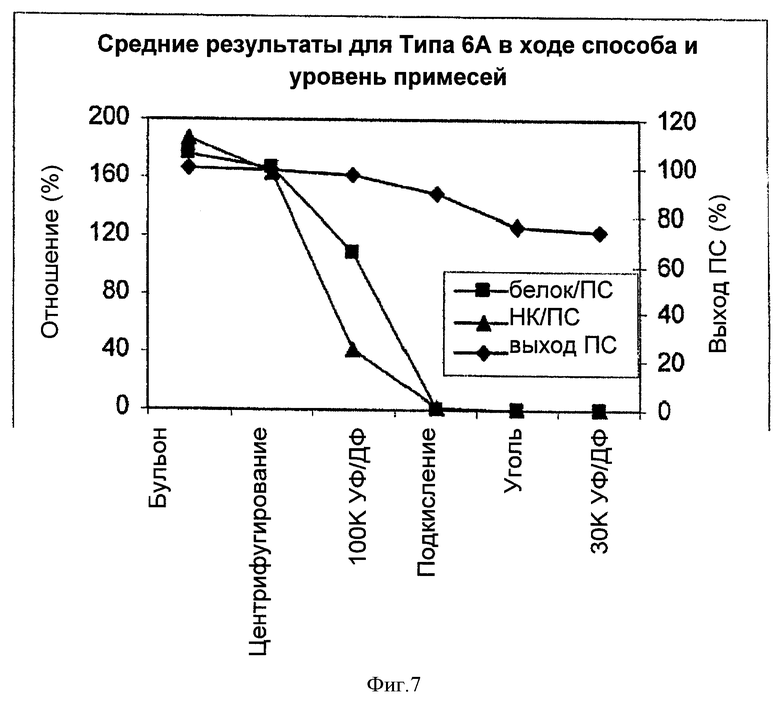
На Фигуре 7 показан средний выход ПС для способа согласно настоящему изобретению, отношение белок/ПС и отношение НК/ПС для серотипа 6А, с применением ускоренного способа очистки согласно настоящему изобретению. Результаты показаны для каждого этапа очистки.
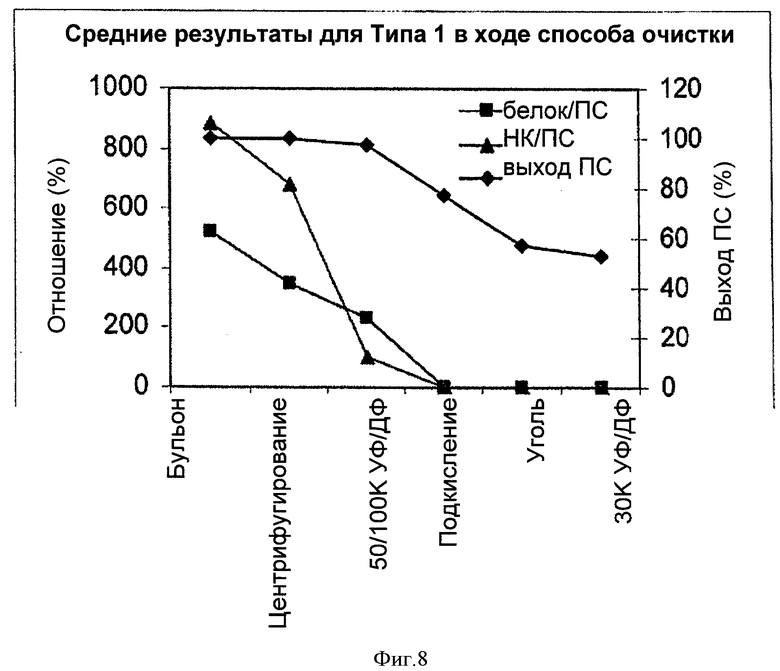
На Фигуре 8 показан средний выход ПС для способа согласно настоящему изобретению, отношение белок/ПС и отношение НК/ПС для серотипа 1, с применением ускоренного способа очистки согласно настоящему изобретению. Результаты показаны для каждого этапа очистки.
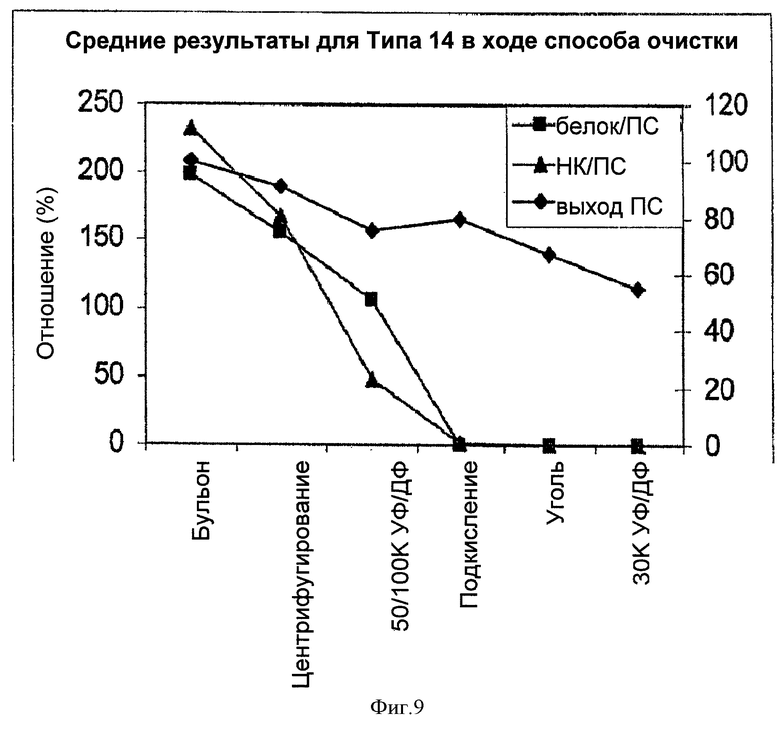
На Фигуре 9 показан средний выход ПС для способа согласно настоящему изобретению, отношение белок/ПС и отношение НК/ПС для серотипа 14, с применением ускоренного способа очистки согласно настоящему изобретению. Результаты показаны для каждого этапа очистки.
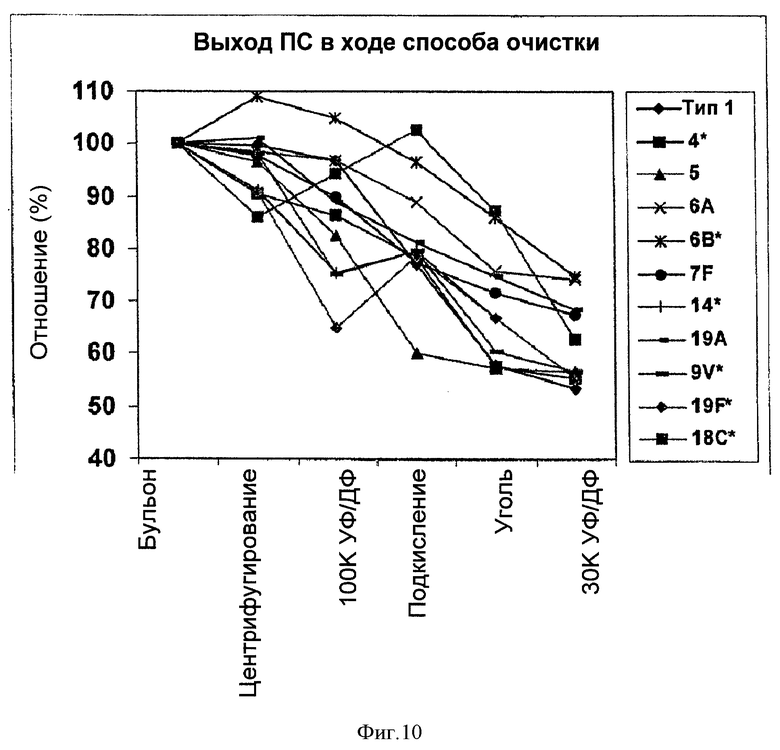
На Фигуре 10 показано сравнение выходов ПС для способа согласно настоящему изобретению для серотипов 1, 4, 5, 6А, 6В, 7F, 9V, 14, 18С, 19А, и 19F, очищенных с применением ускоренного способа очистки согласно настоящему изобретению.
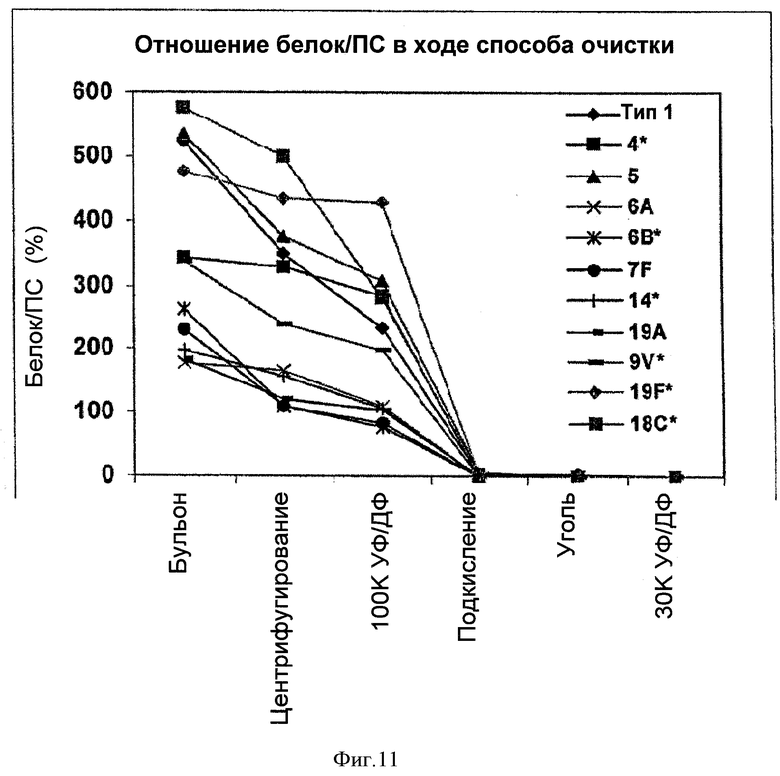
На Фигуре 11 показано сравнение отношений белок/ПС для серотипов 1, 4, 5, 6А, 6В, 7F, 9V, 14, 18С, 19А, и 19F, очищенных с применением ускоренного способа очистки согласно настоящему изобретению. Результаты сравнивали для каждого этапа очистки.
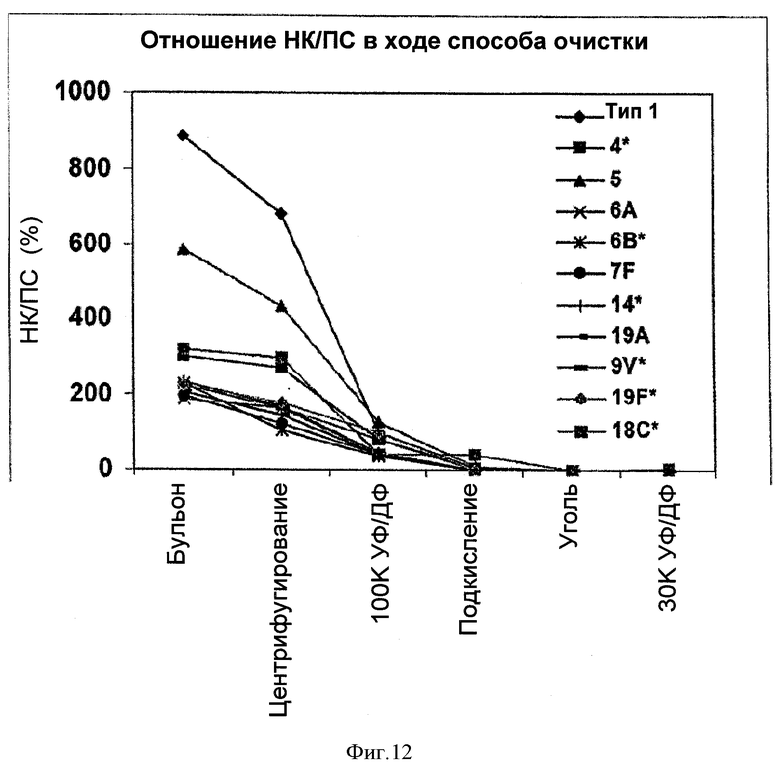
На Фигуре 12 показано сравнение отношений НК/ПС для серотипов 1, 4, 5, 6А, 6В, 7F, 9V, 14, 18С, 19А, и 19F, очищенных с применением ускоренного способа очистки согласно настоящему изобретению. Результаты сравнивали для каждого этапа очистки.
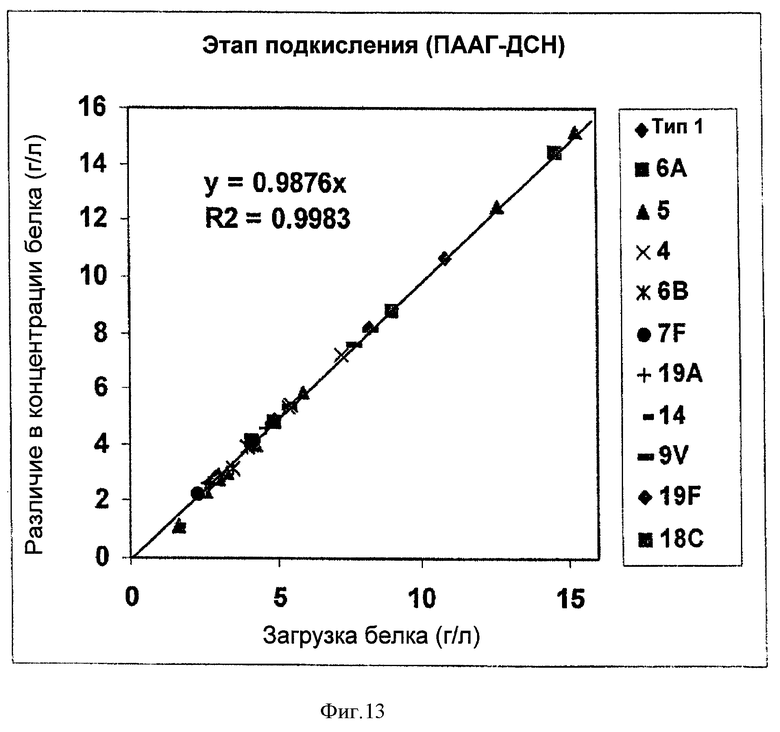
На Фигуре 13 показана эффективность удаления белка благодаря этапу подкисления при ускоренном способе очистки согласно настоящему изобретению. Различие в концентрации белка (ПААГ-ДСН) перед и после подкисления наносили на график в зависимости от исходной концентрации белка перед подкислением для загрузок серотипов 1, 4, 5, 6А, 6В, 7F, 9V, 14, 18С, 19А и 19F. Различие в концентрации белка, поделенное на исходную концентрацию белка, отражало уровень удаления белка на стадии подкисления.
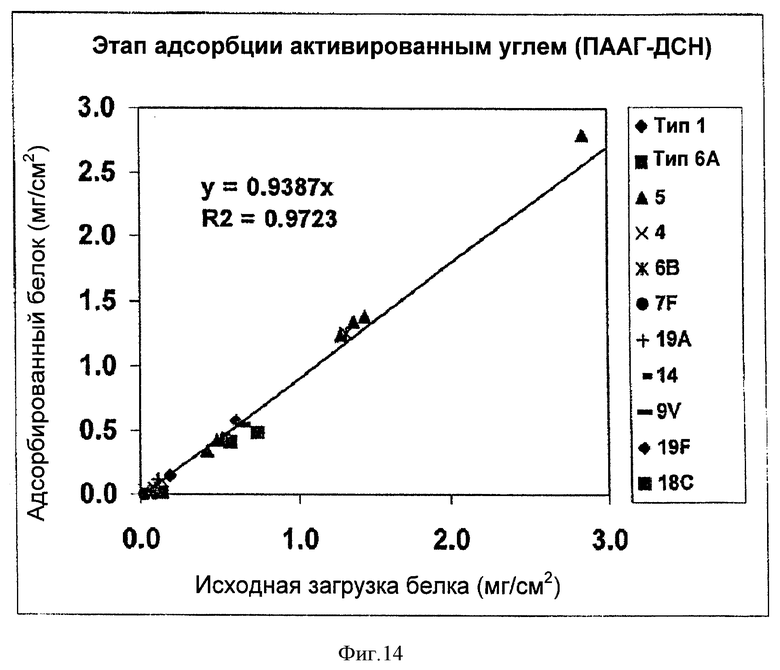
На Фигуре 14 показана эффективность удаления белка на этапе адсорбции активированным углем для ускоренного способа очистки согласно настоящему изобретению. Количество удаленного белка (адсорбированного на активированный уголь) наносили на график в зависимости от исходных количеств загрузки белка для загрузок серотипов 1, 4, 5, 6А, 6В, 7F, 9V, 14, 18С, 19А и 19F. Количество удаленного белка, поделенное на исходные количества загрузки белка, отражало уровень удаления белка на стадии адсорбции активированным углем.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к ускоренному способу очистки для уменьшения уровней растворимого белка в лизатах клеток Streptococcus pneumoniae для получения по существу очищенных капсульных полисахаридов, подходящих для включения в пневмококковые конъюгатные вакцины. Для большинства серотипов для реализуемой на сегодняшний день на рынке 7-валентной пневмококковой конъюгатной (7vPnC) вакцины (Prevnar®), а также недавно разработанной 13-валентной пневмококковой конъюгатной (13vPnC) вакцины, известный из уровня техники способ очистки полисахаридов требует до шестнадцати этапов. Эти этапы включают множество дорогостоящих, трудоемких и технологически сложных операций, таких как хроматография и множество мембранных разделений. Способ согласно настоящему изобретению освобождает от осуществления вплоть до восьми из этих этапов, при этом позволяет достичь аналогичной степени очистки и освобождает от потребности в хроматографии. Таким образом, настоящее изобретение относится к более эффективному способу очистки, который является менее дорогостоящим, занимает меньше времени и включает меньше этапов.
Ускоренный способ очистки согласно настоящему изобретению основан на обнаружении того, что ультрафильтрование и диафильтрование осветленного раствора лизата клеток S. pneumoniae, а затем подкисление концентрированного раствора лизата клеток до значения рН менее чем 4.5, предпочтительно приблизительно 3.5, позволяет преципитировать по меньшей мере 98% белка из раствора без значительного влияния на выход полисахарида. С помощью ультрафильтрования и диафильтрования лизированного и осветленного ферментативного бульона перед подкислением до значения рН менее чем 4.5, предпочтительно около 3.5, эффекты «удерживания» белков устранены и фракция белка, который "высаливается", повышается. Термин "удерживание" относится к повышенной растворимости белков, тогда как "высаливание" относится к преципитации белков из раствора, как только они достигают своих изоэлектрических точек. Этап ультрафильтрации и диафильтрации также предотвращает пенообразование, наблюдаемое, когда обработанный карбонатом натрия бульон подкисляют даже до значения рН 5.0 (см. заявку на патент США, номер публикации 2006/0228381). Таким образом, ультрафильтрация и диафильтрация осветленного лизатного бульона делают возможным применение любого низкомолекулярного рН-титранта, такого как карбонат натрия, в способе ферментации серотипа S. pneumoniae и предотвращает пенообразование осветленного лизатного бульона, когда он подкислен до рН менее чем 4.5.
Термин "осветленный лизатный бульон/раствор" относится к лизатному бульону, который подвергли центрифугированию или фильтрованию для удаления остатков клеток.
Термин "диафильтрование", "диафильтрация", "ДФ" и тому подобные термины относятся, например, к применению полупроницаемых мембран с подходящими физическими и химическими свойствами для удаления малых молекул из раствора.
Термин "ультрафильтрование", "ультрафильтрация", "УФ" и тому подобные термины относятся, например, к применению полупроницаемых мембран с подходящими физическими и химическими свойствами, позволяющими различать молекулы в растворе и концентрировать одинаковые молекулы в меньший объем раствора.
В рамках способов согласно настоящему изобретению, ультрафильтрация и диафильтрация обычно включают проточную фильтрацию "в перекрестном потоке" или "вдоль потока", чтобы избежать забивания фильтровальной мембраны. При фильтрации "в перекрестном потоке", фильтруемый раствор пропускают через поверхность мембраны. Материалы, которые проходят через мембрану, называют фильтратом. Материалы, которые не проходят через мембрану, называют ретентатом. Ретентат возвращают в подающий резервуар для повторной фильтрации.
В данной заявке, можно использовать любую кислоту для понижения значения рН ультрафильтрованного и диафильтрованного лизатного бульона до тех пор, пока не будет достигнуто значение рН менее чем 4.5, особенно приблизительно 3.5. Соответственно, в способах согласно настоящему изобретению можно применять, как органические, так и минеральные кислоты. В данной заявке термин "минеральная кислота" относится к кислоте, полученной из неорганического минерала с помощью химической реакции, в противоположность органическим кислотам. Например, неограничивающие примеры минеральных кислот, которые можно применять в способах согласно настоящему изобретению, включают соляную кислоту, азотную кислоту, фосфорную кислоту и серную кислоту. В конкретных вариантах реализации, рН концентрированного лизатного бульона понижают до значения менее чем 4.4, 4.3, 4.2, 4.1, 4.0, 3.9, 3.8, 3.7, 3.6, 3.5, 3.4, 3.3, 3.2, 3.1 или 3.0. В других вариантах реализации, рН концентрированного лизатного бульона понижают до значения приблизительно 4.4, приблизительно 4.3, приблизительно 4.2, приблизительно 4.1, приблизительно 4.0, приблизительно 3.9, приблизительно 3.8, приблизительно 3.7, приблизительно 3.6, приблизительно 3.5, приблизительно 3.4, приблизительно 3.3, приблизительно 3.2, приблизительно 3.1, приблизительно 3.0, приблизительно 2.9, приблизительно 2.8, приблизительно 2.7, приблизительно 2.6, приблизительно 2.5, приблизительно 2.4, приблизительно 2.3, приблизительно 2.2, приблизительно 2.1 или приблизительно 2.0.
Ускоренный способ очистки согласно настоящему изобретению также основан на обнаружении того, что в комбинации с этапами концентрирования и понижения рН, описанными выше, фильтрация с применением активированного угля позволяет преципитировать по меньшей мере 90% оставшегося белка, сильно не влияя на выход полисахарида. В конкретных вариантах реализации, было обнаружено, что угольная фильтрация с применением угля, полученного из древесных опилок или других древесных продуктов и активированного фосфорной кислотой, является более эффективной для уменьшения или удаления примесей белков, чем уголь, применяемый в известных из уровня техники способах угольной фильтрации.
Соответственно, настоящее изобретение относится к способу получения по существу очищенных капсульных полисахаридов из лизата клеток Streptococcus pneumoniae, включающему следующие стадии:
(a) обеспечение ферментативного бульона, который содержит бактериальные клетки, которые продуцируют выбранный серотип Streptococcus pneumoniae;
(b) лизирование бактериальных клеток, полученных на стадии (а), литическим агентом с получением лизата клеток, который содержит остатки клеток, растворимые белки, нуклеиновые кислоты и полисахариды;
(c) осветление лизата клеток, полученного на стадии (b), посредством центрифугирования или фильтрования для удаления остатков клеток с получением осветленного лизата клеток;
(d) ультрафильтрование и диафильтрование осветленного лизата клеток, полученного на стадии (с), для удаления низкомолекулярных примесей и повышения концентрации полисахарида с получением ретентата;
(e) понижение рН ретентата, полученного на стадии (d), до значения менее чем 4.5, особенно приблизительно 3.5, для преципитации белка и нуклеиновых кислот с получением подкисленного раствора ретентата;
(f) выдерживание подкисленного раствора ретентата, полученного на стадии (е), в течение промежутка времени, достаточного для осаждения преципитата, особенно в течение по меньшей мере 2 часов, со встряхиванием или без, а затем фильтрование или центрифугирование подкисленного раствора ретентата с получением осветленного раствора полисахарида;
(g) фильтрование осветленного раствора полисахарида, полученного на стадии (f), через фильтр с активированным углем, в частности через фильтр с активированным углем, который содержит древесный уголь, активированный фосфорной кислотой;
(h) ультрафильтрование и диафильтрование указанного фильтрованного раствора, полученного на стадии (g), с получением концентрированного очищенного раствора полисахарида; и
(i) фильтрование концентрированного очищенного раствора полисахарида, полученного на стадии (h), с применением стерильного фильтра;
в результате чего получают по существу очищенные капсульные полисахариды в виде раствора. Стерильная фильтрация на стадии (i) полезна для удаления бактерий и твердых включений из концентрированного очищенного раствора полисахарида. Например, неограничивающие серотипы S. pneumoniae, выбранные для этого варианта реализации настоящего изобретения, представляют собой 1, 4, 5, 6А, 6В, 7F, 9V, 14, 18С, 19А, 19F и 23F. В конкретном варианте реализации, на стадии (е) удаляют по меньшей мере 98% белка из ретентата, полученного на стадии (d). В следующем варианте реализации, на стадии (g) удаляют по меньшей мере 90% белка из осветленного раствора полисахарида, полученного на стадии (f). В следующем варианте реализации, диафильтрация на стадии (h) включает подведение рН до значения между приблизительно 5.5 и приблизительно 7.5. Однако, для улучшения стабильности по существу очищенного капсульного полисахарида во время длительного хранения, диафильтрация на стадии (h) включает подведение рН до значения между приблизительно 7.0 и приблизительно 7.5, особенно до приблизительно 7.4.
В данной заявке термин "по существу очищенный лизат, содержащий капсульный полисахарид", или "раствор, содержащий по существу очищенный капсульный полисахарид", относится к лизату клеток Streptococcus pneumoniae или раствору, из которых белок удалили таким образом, что процентное отношение белка к полисахариду (белок/ПС) составляет менее чем 10%, менее чем 9%, менее чем 8%, менее чем 7%, менее чем 6%, менее чем 5%, менее чем 4%, менее чем 3%, менее чем 2%, или менее чем 1% и процентное отношение нуклеиновой кислоты к полисахариду (НК/ПС) составляет менее чем 5%, менее чем 4%, менее чем 3%, менее чем 2% или менее чем 1%. В конкретных вариантах реализации, процентные отношения белок/ПС и НК/ПС для по существу очищенных лизатов или растворов, содержащих капсульные полисахариды, включающие определенные серотипы, представляют собой такие, как перечислено далее: для серотипа 1 отношение белок/ПС составляет менее чем 2% и отношение НК/ПС составляет менее чем 2%, для серотипа 4 отношение белок/ПС составляет менее чем 3% и отношение НК/ПС составляет менее чем 2%, для серотипа 5 отношение белок/ПС составляет менее чем или равно 7.5% и отношение НК/ПС составляет менее чем или равно 2%, для серотипа 6А отношение белок/ПС составляет менее чем 2% и отношение НК/ПС составляет менее чем 2%, для серотипа 6В отношение белок/ПС составляет менее чем 4% и отношение НК/ПС составляет менее чем 1%, для серотипа 7F отношение белок/ПС составляет менее чем 5% и отношение НК/ПС составляет менее чем 2%, для серотипа 9V отношение белок/ПС составляет менее чем 2% и отношение НК/ПС составляет менее чем 1%, для серотипа 14 отношение белок/ПС составляет менее чем 3% и отношение НК/ПС составляет менее чем 2%, для серотипа 18С отношение белок/ПС составляет менее чем 2% и отношение НК/ПС составляет менее чем 2%, для серотипа 19А отношение белок/ПС составляет менее чем 2% и отношение НК/ПС составляет менее чем 2%, для серотипа 19F отношение белок/ПС составляет менее чем 3% и отношение НК/ПС составляет менее чем 2% и для серотипа 23F отношение белок/ПС составляет менее чем 2% и отношение НК/ПС составляет менее чем 2%. Способы количественного анализа концентраций белка, полисахарида и нуклеиновой кислоты в клеточном лизате или растворе хорошо известны в данной области и включают, например, анализ методом ПААГ-ДСН (электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия), ВЭЖХ (высокоэффективную жидкостную хроматографию) и SEC (эксклюзионную хроматографию), модифицированные методы Лоури, спектрофотометрию, SEC-MALLS (эксклюзионную хроматографию/многоугловое рассеяние лазерного излучения) и ЯМР (ядерный магнитный резонанс).
В способах согласно настоящему изобретению, бактериальные клетки можно лизировать, применяя любой литический агент. "Литический агент" представляет собой любой агент, который способствует разрушению клеточной стенки и высвобождению аутолизина, который вызывает лизис клеток, включая, например, детергенты. В данной заявке термин "детергент" относится к любому анионному или катионному детергенту, способному вызывать лизис бактериальных клеток. Типичные примеры таких детергентов для применения в способах согласно настоящему изобретению включают дезоксихолат натрия (DOC), N-лаурилсаркозинат (NLS), натриевую соль хенодезоксихолевой кислоты и сапонины.
В одном варианте реализации настоящего изобретения, литический агент, применяемый для лизирования бактериальных клеток, представляет собой DOC. DOC представляет собой натриевую соль желчной кислоты - дезоксихолевой кислоты, которую обычно получают из биологических источников, таких как коровы или быки. DOC активирует белок LytA, который представляет собой аутолизин, который участвует в росте клеточной стенки и делении Streptococcus pneumoniae. Белок LytA имеет холин-связывающие домены в С-концевом участке, и известно, что мутации гена lytA дают мутантов LytA, которые устойчивы к лизису DOC.
Хотя нет доказательств того, что применение DOC в способе очистки полисахаридов Streptococcus pneumoniae представляет риск для здоровья, применение подобных реагентов биологического происхождения может вызывать потенциальные проблемы связанные с (официальным) регулированием их применения. Соответственно, в одном варианте реализации настоящего изобретения, литический агент, применяемый для лизирования бактериальных клеток, представляет собой литический агент неживотного происхождения. Литические агенты неживотного происхождения для применения в способах согласно настоящему изобретению включают агенты из неживотных источников со способами действия, аналогичными действию DOC (т.е., которые влияют на функцию LytA и приводят к лизису клеток Streptococcus pneumoniae). Такие литические агенты неживотного происхождения включают, но не ограничены перечисленными: аналоги DOC, поверхностно-активные вещества, детергенты и структурные аналоги холина, и их можно определить, применяя процедуры, описанные ниже в Экспериментальном разделе данной заявки. В одном варианте реализации, литический агент неживотного происхождения выбирают из группы, состоящей из декансульфоновой кислоты, трет-октилфеноксиполи(оксиэтилен)этанолов (например, Igepal® СА-630, CAS #: 9002-93-1, доступных от Sigma Aldrich, Сент-Луис, Миссури), конденсатов оксида октилфенол-этилена (например, Triton® Х-100, доступный от Sigma Aldrich, Сент-Луис, Миссури), N-лаурилсаркозината натрия (NLS), лаурилиминодипропионата, додецилсульфата натрия, хенодезоксихолата, гиодезоксихолата, гликодезоксихолата, тауродезоксихолата, таурохенодезоксихолата и холата. В следующем варианте реализации, литический агент неживотного происхождения представляет собой NLS.
Настоящее изобретение также относится к модификациям способа, описанного выше, специфичным для конкретного серотипа. Например, поскольку полисахарид серотипа 19А нестабилен и его молекулярная масса изменяется в ходе очистки, обнаружили, что модификации описанного способа были полезны для стабилизации полисахарида 19А. Эти модификации включали проведение этапа ультрафильтрации и диафильтрации перед подкислением при приблизительно 4°С при рН, равном приблизительно 6, в натриево-фосфатном буфере, выдерживание подкисленного раствора ретентата в течение по меньшей мере 2 часов при приблизительно 4°С, чтобы обеспечить осаждение преципитата, и подведение рН осветленного раствора полисахарида до значения 6 перед этапом фильтрации активированным углем. Напротив, обнаружили, что для серотипов 1, 4, 5, 6А, 6В, 7F, 9V, 14, 18С, 19F, и 23F меньшая потеря полисахарида и лучшее удаление белка достигается, когда этап ультрафильтрации и диафильтрации перед подкислением осуществляют в бессолевых средах, таких как вода, и этот этап можно осуществить при комнатной температуре при нейтральном значении рН.
Соответственно, настоящее изобретение также относится к способу получения по существу очищенных капсульных полисахаридов из лизата клеток Streptococcus pneumoniae, включая серотип 1, 4, 5, 6А, 6В, 7F, 9V, 14, 18С, 19F или 23F, включающему следующие стадии:
(a) обеспечение ферментативного бульона, который содержит бактериальные клетки, которые продуцируют серотип Streptococcus pneumoniae 1, 4, 5, 6А, 6В, 7F, 9V, 14, 18С, 19F или 23F;
(b) лизирование бактериальных клеток, полученных на стадии (а), детергентом с получением лизата клеток, который содержит остатки клеток, растворимые белки, нуклеиновые кислоты и полисахариды;
(c) осветление клеточного лизата, полученного на стадии (b), посредством центрифугирования или фильтрования для удаления остатков клеток с получением осветленного лизата клеток;
(d) ультрафильтрование и диафильтрование осветленного клеточного лизата, полученного на стадии (с), при комнатной температуре при нейтральном рН в бессолевых средах для удаления низкомолекулярных примесей и повышения концентрации полисахарида с получением бессолевого ретентата;
(e) понижение рН бессолевого ретентата, полученного на стадии (d), до значения менее чем 4.5, особенно приблизительно 3.5, для преципитации белка и нуклеиновых кислот с получением подкисленного раствора ретентата;
(f) выдерживание подкисленного раствора ретентата, полученного на стадии (е), в течение по меньшей мере 2 часов при комнатной температуре, со встряхиванием или без, для осаждения преципитата, а затем фильтрование или центрифугирование подкисленного раствора ретентата с получением осветленного раствора полисахарида;
(g) фильтрование осветленного раствора полисахарида, полученного на стадии (f), через фильтр с активированным углем, в частности фильтр с активированным углем, который содержит древесный уголь, активированный фосфорной кислотой;
(h) ультрафильтрование и диафильтрование указанного фильтрованного раствора, полученного на стадии (g), с получением концентрированного очищенного раствора полисахарида; и
(i) фильтрование концентрированного очищенного раствора полисахарида, полученного на стадии (h), с применением стерильного фильтра;
в результате чего получают по существу очищенные капсульные полисахариды, включая серотип 1, 4, 5, 6А, 6В, 7F, 9V, 14, 18С, 19F или 23F, в виде раствора. В конкретном варианте реализации, на стадии (е) удаляют по меньшей мере 98% белка из бессолевого ретентата, полученного на стадии (d). В следующем варианте реализации, на стадии (g) удаляют по меньшей мере 90% белка из осветленного раствора полисахарида, полученного на стадии (f). В следующем варианте реализации, диафильтрация на стадии (h) включает подведение рН до значения между приблизительно 5.5 и приблизительно 7.5. Однако, для улучшения стабильности по существу очищенного капсульного полисахарида во время длительного хранения, диафильтрация на стадии (h) включает подведение рН до значения между приблизительно 7.0 и приблизительно 7.5, особенно до приблизительно 7.4.
Настоящее изобретение также относится к способу получения по существу очищенных капсульных полисахаридов из клеточного лизата Streptococcus pneumoniae, включая серотип 19А, включающему следующие стадии:
(a) обеспечение ферментативного бульона, который содержит бактериальные клетки, которые продуцируют серотип 19А Streptococcus pneumoniae;
(b) лизирование бактериальных клеток, полученных на стадии (а), детергентом с получением лизата клеток, который содержит остатки клеток, растворимые белки, нуклеиновые кислоты и полисахариды;
(c) осветление клеточного лизата, полученного на стадии (b), посредством центрифугирования или фильтрования для удаления остатков клеток с получением осветленного лизата клеток;
(d) ультрафильтрованияе и диафильтрование осветленного клеточного лизата, полученного на стадии (с), при приблизительно 4°С при рН, равном приблизительно 6, в натриево-фосфатном буфере, 25 мМ фосфате натрия для удаления низкомолекулярных примесей и повышения концентрации полисахарида с получением ретентата;
(e) понижение рН ретентата, полученного на стадии (d), до значения менее чем 4.5, в частности до значения приблизительно 3.5, для преципитации белка и нуклеиновых кислот с получением подкисленного раствора ретентата;
(f) выдерживание подкисленного раствора ретентата, полученного на стадии (е), в течение по меньшей мере 2 часов при приблизительно 4°С, со встряхиванием или без, для осаждения преципитата, а затем фильтрование или центрифугирование подкисленного раствора ретентата с получением осветленного раствора полисахарида;
(g) подведение рН осветленного раствора полисахарида, полученного на стадии (f), до значения приблизительно 6 с получением осветленного раствора полисахарида с подведенным рН;
(h) фильтрование осветленного раствора полисахарида с подведенным рН, полученного на стадии (g), через фильтр с активированным углем, в частности фильтр с активированным углем, который содержит древесный уголь, активированный фосфорной кислотой;
(i) ультрафильтрование и диафильтрование указанного фильтрованного раствора, полученного на стадии (h), с получением концентрированного очищенного раствора полисахарида; и
(j) фильтрование концентрированного очищенного раствора полисахарида, полученного на стадии (i), с применением стерильного фильтра;
в результате чего получают по существу очищенные капсульные полисахариды, включая серотип 19А, в виде раствора. В конкретном варианте реализации, на стадии (е) удаляют по меньшей мере 98% белка из ретентата, полученного на стадии (d). В следующем варианте реализации, на этапе (h) удаляют по меньшей мере 90% белка из осветленного раствора полисахарида с подведенным рН, полученного на стадии (g). В следующем варианте реализации, диафильтрация из этапа (i) включает подведение рН до значения между приблизительно 5.5 и приблизительно 7.5. Однако, для улучшения стабильности по существу очищенного из 19А полисахарида во время длительного хранения, диафильтрация на стадии (i) включает подведение рН до значения между приблизительно 7.0 и приблизительно 7.5, в частности до приблизительно 7.4.
Следующие примеры предложены с целью иллюстрации, но не с целью ограничения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Следующие Примеры представляют результаты для полисахаридов серотипов 1, 4, 5, 6А, 6В, 7F, 9V, 14, 18С, 19А, и 19F S. pneumoniae, очищенных в масштабе 10 л с применением улучшенного способа согласно настоящему изобретению, и указанные результаты сравнивают с характеристиками известного способа очистки.
Пример 1. Ускоренный способ очистки полисахаридов серотипов 1, 4, 5, 6А, 6В, 7F, 14 и 19А S. pneumoniae
Ферментативные бульоны S. pneumoniae, лизированных дезоксихолатом натрия (DOC), получали либо в течение двух дней после их сбора, или хранили при 4°С и использовали в течение следующей недели. Описанный ниже способ очистки согласно настоящему изобретению включал следующие изменения относительно существующего способа очистки: 1) этап подкисления передвинули с начала процедуры на этап после первой ультрафильтрации/диафильтрации (УФ/ДФ) и рН подводили до 3.5 вместо 5; 2) диафильтрационный буфер изменили с 0.025 М фосфата на деионизированную (DI) воду; 3) адсорбцию активированным углем изменили на 2 угольных диска CUNO R32SP (CUNO Inc., Уэйн, Нью-Джерси) с применением древесного угля, активированного фосфорной кислотой, и время адсорбции продлили от 4 до 12 циклов (каждый цикл длился 22 минуты); и 4) рН подводили до значения 7.4 в ходе последнего этапа 30К диафильтрации, на котором диафильтровали приблизительно 5 раз. Такую же процедуру очистки применяли для серотипов 1, 4, 5, 6А, 6В или 7F. Для серотипа 19А, указанные этапы были дополнительно модифицированы, и очистку проводили в холодной комнате, как описано ниже.
Этапы очистки
Все этапы проводили при комнатной температуре, кроме очистки 19А, когда этапы указанного способа осуществляли при 4°С в холодной комнате.
Осветление лизата: Целью этого этапа было удаление остатков клеток и осветление бульона. Это осуществляли либо путем центрифугирования, либо путем фильтрации. Бульон центрифугировали при 10,000 g в течение 30 мин или до тех пор, пока бульон не просветлился при 20°С (4°С для типа 19А), или фильтровали через Millipore Prefilter (Millipore Corp., Биллерика, Массачусетс) с добавлением вспомогательного фильтрующего материала Celpure® (Advanced Minerals, Санта-Барбара, Калифорния). Осветленный лизат собирали для дополнительной переработки и осадки отбрасывали.
Первая УФ/ДФ (ультрафильтрация/диафильтрация): Этот этап обеспечивал уменьшение объема и замену буфера, а также позволял удалить низкомолекулярные примеси. Осветленный лизат концентрировали до приблизительно 1/8 от исходного объема. Диафильтрацию осуществляли, используя приблизительно 10 объемов DI воды (рН 6, 25 мМ фосфат для 19А).
Подкисление: На этой стадии удаляли более чем 98% белков. При помешивании, в ретентат аккуратно добавляли концентрированную фосфорную кислоту. рН ретентата подводили до целевого значения рН 3.5. Подкисленный ретентат помешивали в течение получаса и выдерживали при комнатной температуре в течение ночи (2 часов при 4°С для 19А), что приводило к преципитации белка и нуклеиновых кислот.
Осветление подкисленного ретентата: Это был этап осветления для удаления преципитатов после подкисления. Взвесь подкисленного раствора центрифугировали в роторе при 10,000 об/мин (17,000 относительной центробежной силы, или RCF) в течение одного часа при 20°С (за исключением 6В, для которого центрифугирование длилось 6 часов при 37°С). Супернатант собирали и осадок отбрасывали. На этой стадии также можно применять объемную фильтрацию через фильтр Millipore Prefilter (Millipore Corp., Биллерика, Массачусетс) с добавлением вспомогательного фильтрующего материала Celpure® (Advanced Minerals, Санта-Барбара, Калифорния).
Адсорбция активированным углем: В большинстве случаев, после центрифугирования подкисленного 100К ретентата он имел светло-желтый цвет. Обесцвечивание достигалось адсорбцией активированным углем с применением древесного угля, активированного фосфорной кислотой. Этот этап также позволял удалить оставшийся белок, который остался после подкисления. Осветленный раствор полисахарида повторно пропускали через угольный фильтр в течение 5-6 часов или в течение ночи (для 19А, рН подводили до 6 перед адсорбцией активированным углем).
Окончательная 30К УФ/ДФ: Это был еще один этап концентрации и смены буфера, чтобы концентрировать раствор до конечной концентрации полисахарида (ПС), составляющей >2 г/л, который диафильтровали в деионизированную (DI) воду. Фильтрованный через уголь раствор ПС концентрировали. Затем концентрат диафильтровали 10Х DI водой. рН подводили до 7.4 на этапе диафильтрации.
Окончательная стерильная фильтрация через 0.2 мкм фильтр: Конечный раствор ПС фильтровали через стерильный 0.22 мкм фильтр или через стерильный одноразовый фильтрующий элемент и хранили в холодильнике при 4°С.
Аналитические методы
Количественный анализ концентраций белка, ПС и нуклеиновой кислоты осуществляли, применяя способы, которые хорошо известны в данной области, включая анализ ПААГ-ДСН (электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия), ВЭЖХ (высокоэффективную жидкостную хроматографию) и SEC (эксклюзионную хроматографию), модифицированные методы Лоури, спектрофотометрию, SEC-MALLS (эксклюзионную хроматографию/многоугловое рассеяние лазерного излучения) и ЯМР (ядерный магнитный резонанс).
Результаты и обсуждение
Партии Типа 5 после ускоренной очистки: Сравнение конечного выхода ПС, молекулярной массы ПС и уровней основных примесей для трех очищенных партий с применением ускоренного способа и с применением известного из уровня техники способа для Типа 5 показано в Таблице 1. Все исходные бульоны представляли собой лизированные DOC ферментативные партии с высокой плотностью клеток, которые имели более высокую концентрацию полисахарида (~0.5 г/л), чем стандартизированный SOP ферментативный бульон (~0.3 г/л). Для первого этапа УФ/ДФ применяли мембрану 30К или 50К. Уровни примесей вычисляли, используя отношения примесь/ПС. Такой же подход применяли для всех других серотипов, описанных в данной заявке.
Как видно из результатов, приведенных в Таблице 1, содержание белков для всех трех партий, полученных с применением ускоренного способа очистки, удовлетворяют техническим требованиям, составляющим <7.5%, и были также сравнимы с таковыми для известного способа. Количества нуклеиновых кислот (НК), а также С-полисахарида (С-ПС) также были значительно ниже технических требований, составляющих <2.0% и <35%, соответственно, и были сравнимы с таковыми для известного способа. Результаты для конечного выхода ПС и уровней примесей для трех партий, представленные в Таблице 1, демонстрируют воспроизводимость и надежность ускоренного способа согласно настоящему изобретению.
Для исследования возможности гидролиза полисахаридов при более низком значении рН, составляющем 3.5, отслеживали изменение длительности сохранения ПС в ходе очистки и измеряли молекулярную массу конечного очищенного ПС. На хроматограмме ВЭЖХ не наблюдали значительных изменений времени удержания ПС серотипа 5. Также не наблюдали значительных отличий в молекулярных массах ПС, очищенного с помощью ускоренного способа и известного способа (284 кг/моль (кДа)), на основании измерения MALLS. Таким образом, пришли к заключению, что ускоренный способ очистки не оказывал неблагоприятного влияния на молекулярную массу очищенного ПС.
Выход полисахарида в ходе процесса, отношение белок/полисахарид и отношение нуклеиновая кислота/полисахарид на каждой стадии переработки для указанных трех партий, полученных с помощью ускоренного способа, суммированы в Таблице 2.
Всегда происходит потеря продукта в процессе каждой стадии любого способа очистки. Для этих трех партий, полученных с помощью ускоренного способа, потеря ПС происходила по большей части на первой стадии УФ/ДФ и стадии подкисления. Потеря ПС на первой стадии УФ/ДФ происходила вследствие адсорбции ПС или комплекса ПС-белок на поверхности мембраны. Эту потерю минимизировали путем промывки стороны мембраны, на которую подавался ретентат, DI-водой после диафильтрации и объединения смытого материала с исходным ретентатом. Потеря ПС на стадии подкисления может происходить вследствие двух причин: физической адсорбции ПС к преципитировавшим твердым веществам, и связывания полисахарида с белком с ко-преципитацией в процессе подкисления. Эту вторую возможность дополнительно изучили, и результаты представили доказательства связывания ПС/белок.
На Фигуре 1 показано уменьшение отношения белок/ПС на каждой стадии очистки. Хотя на стадии центрифугирование удалялся небольшой процент белков, большую часть белков удаляли на стадии подкисления. Лишь следовое количество белка обнаруживалось после обработки с понижением рН до 3.5, даже для партии с наибольшим содержанием белка.
Аналогично отношению белок/ПС, наблюдали отличия в содержании примесей по отношению нуклеиновая кислота/ПС для разных партий. Этап 30/50К УФ/ДФ позволял удалить значительное количество нуклеиновой кислоты по сравнению с удалением белка на той же стадии переработки. Без привязки к какой-либо теории, это могло быть следствием молекулярного размера нуклеиновых кислот, которые имеют меньший размер, чем белки, что относительно облегчает их удаление на стадии 30/50К УФ/ДФ. Первое центрифугирование и этап подкисления также позволяют удалить значительное количество нуклеиновой кислоты.
В Таблице 2 показано, что этап адсорбции на активированном угле также уменьшает уровень белок/ПС и НК/ПС. Процентное уменьшение было не настолько значительным, как в первых двух этапах, но этот этап был важен для удаления цвета раствора и обеспечивал соответствие уровня примесей техническим требованиям.
Партии Типа 4 после ускоренной очистки: Краткое описание трех партий после ускоренной очистки для Типа 4 показаны в Таблице 3. Загруженные бульоны для всех трех партий лизировали DOC.
Выход ПС типа 4 также составлял 50-60%. Отношение белок/ПС и отношение нуклеиновая кислота/ПС хорошо соответствовали техническим требованиям. Отношение С-ПС также хорошо соответствовало техническим требованиям. Молекулярные массы всех трех партий были близки к ~300 кг/моль (кДа). ПС серотипа 4, очищенный с помощью известного способа очистки с применением аналогичного ферментативного бульона, также имел более низкую молекулярную массу 285 кг/моль (кДа). Сравнение хроматограмм ВЭЖХ ПС из ферментативного бульона и конечного очищенного раствора показало, что не было различий в длительности сохранения ПС. Это позволяет предположить, что различие в разнице молекулярных масс было вызвано не изменением способа, а, скорее, происходило вследствие естественных свойств процесса ферментации.
ПС Типа 4 содержит пируватную группу в очищенной молекуле, и этот пируват был важен для конъюгации для применения в пневмококковой конъюгатной вакцине. Чтобы удостовериться в том, что на количество пирувата не оказывала неблагоприятного влияния обработка кислотой, проводили анализ ЯМР. На Фигуре 2 показаны ЯМР-спектры стандартного ПС типа 4 и таковые для партии L29276-47. Не наблюдалось значительных отличий между указанными двумя спектрами. Вторым пиком справа в обоих спектрах был пируват, и высота пика пируватной группы была сравнимой на обоих спектрах. Содержание пирувата для всех трех партий после ускоренного способа составляло 0.8 моль/моль и удовлетворяло техническим требованиям, составляющим >0.7 моль/моль.
Выход ПС в ходе способа, отношения белок/ПС и НК/ПС для трех партий типа 4 суммированы в Таблице 4. Потеря ПС возникала, по большей части, на этапах первого центрифугирования, подкисления и адсорбции активированным углем, со средним уровнем 10%, 8% и 20%, соответственно. Общий выход ПС был близок к данному параметру для типа 5 и составлял около 55%.
На Фигуре 3 показано изменение среднего выхода ПС, отношений белок/ПС и НК/ПС на каждом из этапов очистки для трех указанных партий из Таблицы 4. Удаление белка происходило, главным образом, на стадии подкисления, как и ожидали. Этапы первого центрифугирования и УФ/ДФ также совместно позволяли удалить некоторое количество белка, но уменьшение содержания белка было меньшим, чем на стадии подкисления.
Аналогично типу 5, наибольшее уменьшение отношения нуклеиновая кислота/ПС было на этапах 50/100К УФ/ДФ, первого центрифугирования и подкисления, и уменьшение НК на первой стадии УФ/ДФ было более значительным, чем уменьшение количества белков. Аналогично, как показано на Фигуре 3, адсорбция активированным углем позволяла удалить некоторое количество белка и НК и опустить уровни примесей ниже технических требований. Она также позволяла обесцветить раствор.
Партии Типа 19А после ускоренной очистки: Полисахарид Типа 19А нестабилен и его молекулярная масса изменяется в процессе очистки. Ускоренный способ очистки слегка модифицировали, чтобы стабилизировать полисахарид 19А. Эти модификации обобщены, как указано далее: 1) этапы очистки, в основном, проводили при 4°С в холодной комнате; 2) при первой 100К диафильтрации понижали температуру, применяя 25 мМ фосфатный буфер (4°С) с рН 6 вместо применения воды комнатной температуры; 3) продолжительность подкисления снижали от в течение ночи до 2 часов; и 4) после осветления подкисленного 100К ретентата, рН подводили до 6 и адсорбцию активированным углем проводили при рН 6 вместо 3.5.
Результаты для двух партий 19А, очищенных с помощью ускоренного способа очистки, показаны в Таблице 5.
Выходы ПС для двух партий после ускоренной очистки составляли 62 и 76% соответственно. Конечное отношение белок/ПС, содержание нуклеиновых кислот и содержание С-ПС удовлетворяли соответствующим техническим требованиям. Конечные молекулярные массы полисахаридов из двух партий составляли 525 кг/моль (кДа) и 488 кг/моль (кДа) соответственно и были близки к значению молекулярной массы для ПС 19А, используемого в фазе III клинических испытаний (486 кг/моль (кДа)).
Отношение белок/ПС для двух указанных партий удовлетворяло техническим требованиям, которые составляли <2%. Как пропорция НК, так и пропорция С-ПС для двух партий хорошо удовлетворяли техническим требованиям.
Уменьшение выхода ПС, белка и НК на каждом из этапов очистки показаны в Таблице 6 и на Фигуре 4. Результаты показали потерю ПС на каждом из этапов очистки, за исключением этапа первого центрифугирования. Аналогично серотипам 5 и 4, удаление белка и НК, в основном, происходило на первых трех этапах, и практически не оставалось детектируемого белка и НК после подкисления. Хотя этап адсорбции активированным углем не позволял удалить значительное количество белка и НК, возможно, вследствие очень низкой концентрации белка и НК после подкисления, этот этап все же был необходим для обесцвечивания раствора.
Партии Типа 7F после ускоренной очистки: Тип 7F представляет собой неионогенный полисахарид, который обычно требует изменения этапов применяемого способа очистки, по сравнению с серотипами, описанными выше. Тем не менее ускоренный способ очистки согласно настоящему изобретению успешно применяли для серотипа 7F без необходимости его изменения. Два образца бульона типа 7F очищали с применением ускоренного способа. Один образец представлял собой стандартный ферментативный бульон (L29276-107), а второй представлял собой бульон с высокой плотностью клеток (L29276-157). Результаты для двух образцов суммированы в Таблице 7.
Выход ПС типа 7F был фактически выше, чем для других серотипов, возможно вследствие меньшего связывания неионогенного полимера с заряженными белковыми молекулами. Соотношения конечного белка, НК и С-ПС хорошо удовлетворяли техническим требованиям. Молекулярная масса типа 7F была сравнима с данным параметром для стандартных партий и даже несмотря на то, что молекулярная масса 7F была довольно большой, раствор ПС не был очень вязким вследствие меньшего вытесняющего объема неионного полимера.
Выход ПС Типа 7F, отношение белка и НК на каждом из этапов очистки показаны в Таблице 8 и среднее для двух партий приведено на графике на Фигуре 5.
Происходила небольшая потеря ПС Типа 7F на каждой стадии очистки. В целом, потеря ПС была меньше, чем для серотипов 5 и 4. Уменьшение отношения белка к НК происходило, в основном, на этапах первого центрифугирования, 100К УФ/ДФ и подкисления. Аналогично другим серотипам, 100К УФ/ДФ позволяла более эффективно удалить НК, чем белки. Хотя этап адсорбции активированным углем не позволял удалить значительное количество белка и НК вследствие очень низких уровней примесей после подкисления, этот этап был все же необходим для удаления цвета.
Партии Типа 6В после ускоренной очистки: Две партии 6В очищали с применением ускоренного способа очистки. Обнаружили, что осветление подкисленного 100К ретентата заняло больше времени, чем для других серотипов (6 часов вместо 1 часа). За исключением этого отличия, данный способ очистки был аналогичен способу для указанных серотипов. Результаты для двух указанных партий суммированы в Таблице 9.
Все уровни примесей (белок, НК, и С-ПС) хорошо удовлетворяли техническим требованиям. Выход ПС был относительно высоким, и пропорция белка и НК была такой же, как для других серотипов.
Выход ПС в ходе способа, соотношения белка и НК на каждом из этапов очистки показаны в Таблице 10 и на Фигуре 6.
Аналогично 19А, потеря ПС происходила на каждом из этапов очистки, кроме этапа первого центрифугирования, в котором было небольшое увеличение количества ПС. Удаление белка и НК достигали, в основном, на этапах первого центрифугирования, первой 100К УФ/ДФ и подкисления. Тем не менее было также небольшое уменьшение соотношения белка и НК на стадии адсорбции активированным углем.
Партии Типа 6А после ускоренной очистки: Две партии типа 6А очищали с применением ускоренного способа очистки. Выход ПС, уровни примесей и молекулярная масса конечных растворов суммированы в Таблице 11.
Конечные выходы ПС для двух партий 6А составляли >70% и были наиболее высокими среди всех серотипов, очищенных с применением ускоренного способа. Соотношения белка, НК и С-ПС удовлетворяли техническим требованиям.
В Таблице 12 и на Фигуре 7 показан выход ПС в ходе способа, изменение соотношения белка и НК на каждом из этапов очистки. Практически не происходило потери ПС на этапах первого центрифугирования и 100К УФ/ДФ. Потеря приблизительно 10-15% ПС происходила на этапах подкисления и адсорбции активированным углем, что было близко к потере для других серотипов. Наибольшее уменьшение соотношения белка и НК происходило при первом центрифугировании, 100К УФ/ДФ и подкислении. После подкисления, соотношения, как белка, так и НК были уже ниже технических требований. Для удаления белка наиболее эффективным этапом было подкисление, тогда как для НК наиболее всего соотношение НК/ПС понижалось при 100К УФ/ДФ. Хотя этап адсорбции активированным углем не позволял удалить значительное количество белка и НК вследствие очень низких уровней примесей после подкисления, этот этап был все же необходим для обесцвечивания.
Партии Типа 1 после ускоренной очистки: Результаты для двух партий типа 1, очищенных ускоренным способом согласно настоящему изобретению, суммированы в Таблице 13. Партию L29276-170 очищали из ферментативного бульона с высокой плотностью клеток и L29276-173 очищали из стандартного ферментативного бульона.
Выходы ПС для обеих партий составляли приблизительно 50%, и уровни примесей белка, НК и С-ПС удовлетворяли техническим требованиям.
Выход ПС в ходе способа, соотношения белка и НК после каждого из этапов очистки приведены в Таблице 14 и на Фигуре 8. Тенденции были аналогичны данным параметром для других очищенных серотипов. Потеря ПС происходила, в основном, на этапах подкисления и адсорбции активированным углем, и наибольшее удаление белка и НК происходило на первых трех этапах. На стадии 100К УФ/ДФ удалялось больше НК, чем белков. Хотя этап адсорбции активированным углем не позволял удалить значительное количество белка и НК вследствие очень низких уровней примесей после подкисления, этот этап был все же необходим для удаления цвета.
Партии Типа 14 после ускоренной очистки: Две партии серотипа 14 очищали с применением ускоренного способа очистки без отклонений от способа. Конечный выход ПС и уровни примесей суммированы в Таблице 15.
Аналогично серотипу 7F, серотип 14 представляет собой неионогенный полисахарид, и известный из уровня техники способ его очистки слегка отличается от такового для других серотипов. Тем не менее ускоренный способ очистки согласно настоящему изобретению успешно применяли для серотипа 14 без необходимости проведения дополнительных этапов. Выход ПС для двух партий после ускоренного способа очистки составлял 50-60%, и соотношения белка и НК удовлетворяли техническим требованиям. Молекулярная масса очищенного ПС также удовлетворяла техническим требованиям.
Выход ПС в ходе способа, соотношения белка и НК суммированы в Таблице 16 и на Фигуре 9. Наблюдали аналогичные тенденции для потери ПС, удаления белка и НК, как и для других тестируемых серотипов, описанных выше.
Пример 2. Сравнение различных серотипов (серотипов 1, 4, 5, 6А, 6В, 7F, 9V, 14, 18С. 19А, и 19F)
Чтобы сравнить очистку различных серотипов, с применением ускоренного способа очистки согласно настоящему изобретению, удаление ПС для всех серотипов, описанных в Примере 1, плюс серотипы 9V, 18С и 19F нанесли на один график на Фигуре 10. Большинство серотипов имели аналогичную тенденцию потери ПС на каждом из этапов очистки. Выявили увеличение выхода ПС для типа 6В на стадии первого центрифугирования и для типа 14 на стадии подкисления. Процент потери ПС изменялся от серотипа к серотипу. Для Типа 5, похоже, терялось больше всего ПС на стадии подкисления и для типа 4 на стадии адсорбции активированным углем.
Отношения белок/ПС для каждого этапа очистки для каждого из серотипов показаны на Фигуре 11. На этой Фигуре показано, что было некоторое различие в исходных отношениях белок/ПС для различных серотипов, при этом типы 1, 4, 5, 9V, 19F и 18С имели наиболее высокие исходные отношения белок/ПС. Несмотря на то что отношения белок/ПС были гораздо выше для типов 1, 4, 5, 9V, 19F и 18С по сравнению с другими серотипами, уже после этапа первой УФ/ДФ, этап подкисления позволял существенно уменьшить отношение белок/ПС и после этого этапа белка практически не оставалось.
Как показано на Фигуре 12, отношения НК/ПС также изменялись от серотипа к серотипу. Типы 1 и 5 имели наиболее высокие отношения НК/ПС, следующими по этому параметру были типы 18С и 4. Этапы первого центрифугирования и УФ/ДФ позволяли удалить значительное количество НК для этих серотипов, и наиболее эффективное удаление, похоже, происходило для типа 1. После этапа подкисления оставалось очень мало НК.
Пример 3. Анализ эффективности этапов подкисления и адсорбции активированным углем (серотипы 1, 4, 5, 6А, 6В, 7F, 9V, 14, 18С, 19А и 19F)
Для очистки полисахаридов PnC, наиболее значительной и сложной для удаления примесью были белки. Чтобы лучше понять эффективность удаления примесей ускоренным способом очистки, два основных этапа очистки, подкисление и адсорбция активированным углем, анализировали в отношении удаления белка. Для этапа подкисления, различие в концентрации белка (ПААГ-ДСН) перед и после подкисления наносили на график в зависимости от исходной концентрации белка перед подкислением для серотипов 1, 4, 5, 6А, 6В, 7F, 9V, 14, 18С, 19А и 19F, очищенных с применением ускоренного способа очистки согласно настоящему изобретению (Фигура 13).
Вследствие относительно небольших изменений в объеме раствора перед и после этапа подкисления, различие в концентрации белка, поделенное на исходную концентрацию белка, отражало степень удаления белка на стадии подкисления. На Фигуре 13 показан наклон прямой при линейной аппроксимации для значений различия в концентрации белка по отношению к исходной концентрации белка (при анализе на ПААГ-ДСН). Между изменением концентрации белка и исходной концентрацией наблюдали очень четкую линейную зависимость, при этом R был близок к 1. Наклон составлял 0.9876, что соответствует 98.76% удаления белка (если предположить незначительное изменение объема раствора). Поэтому, для всех исследуемых серотипов, этап подкисления был очень эффективным и в среднем позволял удалить более 98% белка.
Аналогично этапу подкисления, эффективность этапа адсорбции активированным углем также оценивали путем нанесения на график количества удаленного белка (адсорбированного на активированный уголь) по отношению к исходной загрузке белка (Фигура 14). Наблюдали четкую линейную зависимость между удаленным белком и исходной загрузкой белка, хотя R (0.9723) был ниже, чем на стадии подкисления. Поскольку наклон прямой при линейном приближении соответствует уровню удаления белка, на стадии адсорбции активированным углем происходило удаление 93.87% белка.
На основании анализа этапов подкисления и адсорбции активированным углем, после двух указанных этапов в растворе оставалось лишь приблизительно 0.1% белка.
Выводы для Примеров 1-3
Ускоренный способ очистки был разработан для замены известного из уровня техники способа очистки капсульных полисахаридов S. pneumoniae. Ускоренный способ очистки согласно настоящему изобретению непосредственно применяли для серотипов 1, 4, 5, 6А, 6В, 7F, 9V, 14, 18С и 19F и для 19А с небольшим отклонением. Указанный способ проводили в масштабе 10 л, применяя ферментативные бульоны, лизированные DOC. Уровни примесей, включая все отношения белок/ПС, НК/ПС и С-ПС/ПС, удовлетворяли соответствующим техническим требованиям. Выход ПС превышал 50% и был сравним с данными параметрами для известных из уровня техники способов очистки. Выход ПС в ходе способа, отношения белок/ПС и НК/ПС наносили на график, чтобы сравнить поведение различных серотипов. На основании отношений белок/ПС перед и после этапа 100К УФ/ДФ, было обнаружено, что серотипы 1, 5, 9V, 19F и 18С наиболее трудно поддаются очистке.
Анализ этапов показал, что этапы подкисления и адсорбции активированным углем позволяют удалить более чем 98% и 90% белка соответственно (что измеряли с помощью ПААГ-ДСН).
Пример 4. Замена дезоксихолата натрия на литические агенты неживотного происхождения для получения полисахаридов
В настоящем примере исследовали, можно ли применять литические агенты неживотного происхождения вместо дезоксихолата натрия (DOC) в способе, описанном выше, для получения по существу очищенных капсульных полисахаридов Streptococcus pneumoniae. Как описано выше, DOC активирует белок LytA, который представляет собой аутолизин, который участвует в росте и делении клеточной стенки у Streptococcus pneumoniae. Белок LytA имеет холин-связывающие домены в С-концевой части, и известно, что мутации в гене lytA позволяют образоваться мутантам LytA, которые устойчивы к лизису DOC.
Быстрый тест в микротитрационном планшете был разработан для идентификации соединений, которые вызывают лизис клеток по механизму, аналогичному механизму DOC. Было идентифицировано несколько альтернатив DOC неживотного происхождения, которые также эффективны, как и DOC, в разрушении клеток Streptococcus pneumoniae и высвобождении полисахарида. После переработки с использованием стандартных условий, размер и чистота полисахаридов, полученных с применением соединений неживотного происхождения, были идентичны таковым для DOC.
Методы
Лизис клеток: Тестируемые соединения добавляли в ферментативный бульон в конечной концентрации от 0.1 до 0.01% (в объемном отношении) и раствору позволяли инкубироваться при 37°С в течение одного часа. Раствор затем хранили при 2-8°С в течение ночи. На следующее утро раствор центрифугировали для удаления всех остатков клеток. Бесклеточный бульон анализировали с помощью SEC-ВЭЖХ чтобы определить концентрацию высвобожденного полисахарида. Лизис можно осуществлять при любой температуре между 2-37°С, предпочтительно при диапазоне рН 6.0-7.5. Концентрация детергента, как правило, была между 0.05-0.2%, в зависимости от конкретного детергента.
Микротитрационный тест: Быстрый тест в микротитрационном планшете был разработан для изучения lytA-зависимого лизиса пневмококков различными детергентами или поверхностно-активными веществами. Две пары изогенных штаммов S. pneumoniae использовали в этом тесте; один элемент из каждой пары был диким типом по гену lytA, тогда как другой штамм нес делецию в гене lytA. Таким образом, если лизис был зависимым от активной функции lytA, этот детергент не мог лизировать мутантные штаммы. Четыре штамма, R6X, R6X ΔlytA, D39 и D39 ΔlytA, культивировали на среде Hy-Soy до приблизительно середины логарифмического роста (OD600 ~0.2-0.8; OD600 = оптическая плотность на 600 нм). Клетки затем центрифугировали и осадки клеток ресуспендировали в среде Hy-Soy. В каждую лунку микротитрационного планшета добавляли 100 мкл клеточной суспензии, вместе с 10 мкл концентрированных растворов детергентов или водой в качестве контроля. Через приблизительно 15 минут измеряли OD600 образцов с помощью спектрофотометра Spectramax® (Molecular Devices, Саннивейл, Калифорния) при 36°С. Следующие результаты были получены для свежеприготовленных клеток или замороженных и оттаявших клеток: клетки дикого типа, подвергнутые воздействию DOC, додецилсульфата натрия, Triton® Х-100 и N-лаурилсаркозина, имели значения OD, сравнимые с таковыми для среды, что указывало на осуществление лизиса. С другой стороны, клетки ΔlytA не лизировались в присутствии этих детергентов, что указывает на то, что функция LytA требуется для этих детергентов, чтобы лизировать клетки.
Выделение ПС, используемое для сравнительных аналитических исследований: Культуры выращивали в среде Hy-Soy в 10 л биореакторах. рН поддерживали на уровне около 7.0, применяя либо NaOH, либо Na2CO3. По окончании роста (о чем свидетельствовало отсутствие дальнейшего повышения оптической плотности), культуры подвергали обработке либо 0.12% DOC, либо 0.1% NLS. Культуры инкубировали в течение 12-16 часов. Эффективность разрушения клеток подтверждали путем посева образца подвергнутого обработке бульона на чашки с кровяным агаром TSA. Полисахарид очищали из осветленного лизата, применяя стандартные процедуры (описанные выше).
Очищенный полисахарид исследовали, применяя множество стандартных аналитических методик, подходящих для определения чистоты и идентичности материала.
Содержание ПС в лизате определяли, применяя SEC-ВЭЖХ, соединенной с детектором показателя преломления (RI).
Скрининг литических агентов неживотного происхождения с применением серотипов 1 и 6В
Серотипы S. pneumoniae 1 и 6В отдельно выращивали в основанных на Hy-Soy средах. Культуры отдельно собирали и отдельно распределяли по пробиркам. Соединения неживотного происхождения, проверяемые на литическую активность по сравнению с DOC, получали в виде концентрированных растворов (в подходящих растворителях) и добавляли в культуры. После инкубации в течение ночи, пробирки центрифугировали, определяли содержание ПС в лизатах каждого серотипа с помощью SEC-ВЭЖХ и сравнивали с DOC.
Скрининг литических агентов неживотного происхождения с применением мутантов lytA
Изогенные пары штаммов, содержащих мутацию lytA, выращивали в основанных на Hy-Soy средах. Клетки собирали и распределяли по лункам в микротитрационном планшете. Добавляли тестируемое соединение и инкубировали культуру. Через 15 мин при 36°С оптическую плотность (OD600) каждой лунки определяли, применяя планшет-ридер Spectramax® (Molecular Devices, Саннивейл, Калифорния) (см. Таблицы 17 и 18, которые суммируют результаты для двух отдельных тестов типичных соединений).
Изменение оптической плотности мутантных штаммов lytA (Тест 2)
На основании скрининговых исследований, описанных выше, были идентифицированы следующие альтернативные DOC литические агенты неживотного происхождения: декансульфоновая кислота, Igepal® СА-630 (трет-октилфеноксиполи(оксиэтилен)этанол; CAS #: 9002-93-1; доступный от Sigma Aldrich, Сент-Луис, Миссури), N-лаурилсаркозинат натрия (NLS), лаурилиминодипропионат, додецилсульфат натрия, Triton® Х-100, хенодезоксихолат, гиодезоксихолат, гликодезоксихолат, тауродезоксихолат, таурохенодезоксихолат и холат.
Сравнение лизированных РОС ПС с лизированными NLS ПС
Полисахариды из S. pneumoniae серотипов 1, 4, 5, 6А, 6В, и 7F были очищены в 10 л масштабе, как описано выше в Примерах 1 и 2, с применением улучшенного способа согласно настоящему изобретению. Тем не менее для одной группы в качестве литического агента применяли NLS (0.1%), тогда как для другой группы в качестве литического агента применяли DOC (0.12%).
Выход ПС, отношения белок/ПС, отношения НК/ПС и молекулярную массу ПС измеряли, как описано выше, и результаты суммировали в Таблице 19. Эти результаты показали, что применение NLS в качестве литического агента в способах очистки согласно настоящему изобретению позволяло получить относительно высокие выходы ПС при относительно низких уровнях белка и нуклеиновой кислоты. Фактически, для большинства тестируемых серотипов, применение NLS в качестве литического агента позволяло получить более высокие выходы ПС по сравнению с применением DOC.
Все публикации и заявки на патент, упомянутые в настоящем описании, указывают на уровень знаний специалистов в области, к которой принадлежит настоящее изобретение. Все публикации и заявки на патент включены в данную заявку посредством ссылки в одинаковой степени, как если бы каждая отдельная публикация или заявка на патент была особенно и отдельно указана включенной посредством ссылки.
Хотя описанное выше изобретение было описано более подробно с помощью иллюстрирования и примеров с целью ясности понимания, должно быть очевидно, что могут осуществляться некоторые изменения и модификации в рамках объема прилагаемой формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| МУЛЬТИВАЛЕНТНАЯ КОМПОЗИЦИЯ НА ОСНОВЕ КОНЪЮГАТА ПНЕВМОККОВЫЙ ПОЛИСАХАРИД-БЕЛОК | 2007 |
|
RU2493870C2 |
| МУЛЬТИВАЛЕНТНАЯ КОМПОЗИЦИЯ НА ОСНОВЕ КОНЪЮГАТА ПНЕВМОККОВЫЙ ПОЛИСАХАРИД-БЕЛОК | 2007 |
|
RU2484846C2 |
| СПОСОБ ПОЛУЧЕНИЯ РАСТВОРА, СОДЕРЖАЩЕГО ВЫСОКОМОЛЕКУЛЯРНЫЕ ИЗОЛИРОВАННЫЕ КАПСУЛЬНЫЕ ПОЛИСАХАРИДЫ STREPTOCOCCUS PNEUMONIAE СЕРОТИПА 19А (ВАРИАНТЫ) | 2009 |
|
RU2511404C2 |
| СПОСОБ ПОЛУЧЕНИЯ КАПСУЛЬНОГО ПОЛИСАХАРИДА С ПНЕВМОКОККОВЫМ СЕРОТИПОМ | 2013 |
|
RU2606022C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЖИДКОЙ ФРАКЦИИ, СОДЕРЖАЩЕЙ ИЗОЛИРОВАННЫЕ ВЫСОКОМОЛЕКУЛЯРНЫЕ КАПСУЛЬНЫЕ ПОЛИСАХАРИДЫ STREPTOCOCCUS PNEUMONIAE, И ЖИДКАЯ ФРАКЦИЯ, ПОЛУЧЕННАЯ ТАКИМ СПОСОБОМ | 2009 |
|
RU2524436C2 |
| ИММУНОГЕННЫЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ КОНЪЮГИРОВАННЫЕ КАПСУЛЬНЫЕ САХАРИДНЫЕ АНТИГЕНЫ, И ИХ ПРИМЕНЕНИЕ | 2021 |
|
RU2774075C1 |
| СПОСОБЫ ОЧИСТКИ БАКТЕРИАЛЬНЫХ ПОЛИСАХАРИДОВ | 2020 |
|
RU2817197C2 |
| СПОСОБЫ ГЛИКОКОНЪЮГИРОВАНИЯ И КОМПОЗИЦИИ | 2013 |
|
RU2645071C2 |
| ПОЛИВАЛЕНТНАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ КОНЪЮГАТЫ ПНЕВМОКОККОВЫЙ ПОЛИСАХАРИД-БЕЛОК | 2013 |
|
RU2605834C2 |
| ИММУНОГЕННЫЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ КОНЪЮГИРОВАННЫЕ КАПСУЛЬНЫЕ САХАРИДНЫЕ АНТИГЕНЫ, И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2778704C2 |
Группа изобретений относится к биотехнологии. Предложены варианты способа получения раствора, содержащего очищенные капсульные полисахариды, из лизата клеток выбранного серотипа Streptococcus pneumoniae. Проводят лизис клеток выбранного серотипа S. pneumoniae. Осветляют полученный лизат центрифугированием или фильтрованием. Затем проводят ультрафильтрацию и диафильтрацию осветленного лизата в бессолевой среде с получением ретентата. Понижают pH ретентата до значения менее чем 4,5. Выдерживают подкисленный раствор ретентата для осаждения преципитата. Далее фильтруют или центрифугируют раствор ретентата с получением осветленного раствора капсульного полисахарида. Далее осветленный раствор полисахарида фильтруют через фильтр с активированным углем. Полученный фильтрованный раствор ультрафильтруют и диафильтруют. Полученный концентрированный очищенный раствор капсульного полисахарида фильтруют через стерильный фильтр. При этом серотипы S. pneumoniae выбирают из группы, состоящей из серотипов 1, 4, 5, 6А, 6В, 7F, 9V, 14, 18C, 19A, 19F и 23F. Также предложена модификация этого способа для серотипа 19А. Эта модификация включает проведение ультрафильтрации и диафильтрации перед подкислением при 4ºС при рН 6 в натриево-фосфатном буфере, выдерживание подкисленного раствора ретентата в течение по меньшей мере 2 часов при 4ºС и подведение рН осветленного раствора полисахарида до значения 6 перед этапом фильтрации активированным углем. Также предложены растворы, содержащие очищенные капсульные полисахариды выбранного серотипа S. pneumoniae, полученные указанными способами, и их применение в производстве пневмококковой вакцины. Также предложены выделенные из указанных растворов очищенные капсульные полисахариды S. pneumoniae серотипа 6А с мол. весом 640000-670000 Да и 19А с мол. весом 488000-525000 Да. Ускоренный способ позволяет на этапах подкисления и адсорбции активированным углем преципитировать более чем 98% и 90% белка соответственно, сильно не влияя на выход полисахарида. 10 н. и 37 з.п. ф-лы, 14 ил., 19 табл., 4 пр.
1. Способ получения раствора, содержащего очищенные капсульные полисахариды из лизата клеток Streptococcus pneumoniae, причем указанный способ включает следующие стадии:
(a) ультрафильтрование и диафильтрование осветленного лизата клеток, полученного путем проведения лизиса бактериальных клеток выбранного серотипа Streptococcus pneumoniae с применением литического агента и осветления указанного лизата клеток с применением центрифугирования или фильтрования, с получением ретентата;
(b) понижение рН ретентата, полученного на стадии (а), до значения менее чем 4,5 для преципитации белка и нуклеиновых кислот с получением подкисленного раствора ретентата;
(c) выдерживание подкисленного раствора ретентата, полученного на стадии (b), в течение времени, достаточного для осаждения преципитата, а затем фильтрование или центрифугирование подкисленного раствора ретентата с получением осветленного раствора капсульного полисахарида;
(d) фильтрование осветленного раствора капсульного полисахарида, полученного на стадии (с), через фильтр с активированным углем;
(e) ультрафильтрование и диафильтрование указанного фильтрованного раствора, полученного на стадии (d), с получением концентрированного очищенного раствора капсульного полисахарида; и
(f) фильтрование концентрированного очищенного раствора капсульного полисахарида, полученного на стадии (е), с применением стерильного фильтра, с получением очищенных капсульных полисахаридов в виде раствора.
2. Способ по п.1, отличающийся тем, что выбранный серотип Streptococcus pneumoniae выбран из группы, состоящей из серотипов 1, 4, 5, 6А, 6В, 7F, 9V, 14, 18С, 19А, 19F, 23F.
3. Способ по п.1 или 2, отличающийся тем, что рН на стадии (b) понижают до значения, равного 3,5.
4. Способ по п.1 или 2, отличающийся тем, что при диафильтрации на стадии (е) рН доводят до значения между 5,5 и 7,5.
5. Способ по п.1 или 2, отличающийся тем, что при диафильтрации на стадии (е) рН доводят до значения между 7,0 и 7,5.
6. Способ по п.1 или 2, отличающийся тем, что при диафильтрации на стадии (е) рН доводят до значения 7,4.
7. Способ по п.1 или 2, отличающийся тем, что на стадии (b) удаляют по меньшей мере 98% белка из ретентата, полученного на стадии (а).
8. Способ по п.1 или 2, отличающийся тем, что на стадии (d) удаляют по меньшей мере 90% белка из осветленного раствора капсульного полисахарида, полученного на стадии (с).
9. Способ по п.1 или 2, отличающийся тем, что указанный фильтр с активированным углем, который применяют на стадии (d), включает древесный уголь, активированный фосфорной кислотой.
10. Способ по п.1 или 2, отличающийся тем, что стадия (с) включает выдерживание подкисленного раствора ретентата, полученного на стадии (b), в течение по меньшей мере 2 часов.
11. Способ по п.1 или 2, отличающийся тем, что указанный литический агент, который применяют на стадии (а), представляет собой дезоксихолат натрия.
12. Способ по п.1 или 2, отличающийся тем, что указанный литический агент, который применяют на стадии (а), представляет собой литический агент неживотного происхождения.
13. Способ по п.12, отличающийся тем, что указанный литический агент неживотного происхождения выбран из группы, состоящей из: декансульфоновой кислоты, трет-октилфеноксиполи(оксиэтилен)этанолов, конденсатов оксида октилфенол-этилена, N-лаурилсаркозината натрия (NLS), лаурилиминодипропионата, додецилсульфата натрия, хенодезоксихолата, гиодезоксихолата, гликодезоксихолата, тауродезоксихолата, таурохенодезоксихолата и холата.
14. Способ по п.12, отличающийся тем, что указанный литический агент неживотного происхождения представляет собой N-лаурилсаркозинат натрия.
15. Способ получения раствора, содержащего очищенные капсульные полисахариды из лизата клеток Streptococcus pneumoniae, включая серотипы 1, 4, 5, 6А, 6В, 7F, 9V, 14, 18С, 19F или 23F, причем указанный способ включает следующие стадии:
(a) ультрафильтрование и диафильтрование при комнатной температуре при нейтральном рН в бессолевых средах осветленного лизата клеток, полученного в результате проведения лизиса бактериальных клеток серотипа Streptococcus pneumoniae, выбранного из группы, состоящей из серотипов 1, 4, 5, 6А, 6В, 7F, 9V, 14, 18С, 19F и 23F, с применением литического агента и осветления указанного лизата клеток с применением центрифугирования или фильтрования, с получением бессолевого ретентата;
(b) понижение рН бессолевого ретентата, полученного на стадии (а), до значения менее чем 4,5 для преципитации белка и нуклеиновых кислот с получением подкисленного раствора ретентата;
(c) выдерживание подкисленного раствора ретентата, полученного на стадии (b), в течение по меньшей мере 2 часов при комнатной температуре для осаждения преципитата, а затем фильтрование или центрифугирование подкисленного раствора ретентата с получением осветленного раствора капсульного полисахарида;
(d) фильтрование осветленного раствора капсульного полисахарида, полученного на стадии (с), через фильтр с активированным углем;
(e) ультрафильтрование и диафильтрование указанного фильтрованного раствора, полученного на стадии (d), с получением концентрированного очищенного раствора капсульного полисахарида; и
(f) фильтрование концентрированного очищенного раствора капсульного полисахарида, полученного на стадии (е), с применением стерильного фильтра, с получением очищенных капсульных полисахаридов серотипа, выбранного из группы, состоящей из серотипов 1, 4, 5, 6А, 6В, 7F, 9V, 14, 18С, 19F и 23F, в виде раствора.
16. Способ по п.15, отличающийся тем, что рН на стадии (b) понижают до значения 3,5.
17. Способ по п.15 или 16, отличающийся тем, что при диафильтрации на стадии (е) рН доводят до значения между 5,5 и 7,5.
18. Способ по п.15 или 16, отличающийся тем, что при диафильтрации на стадии (е) рН доводят до значения между 7,0 и 7,5.
19. Способ по п.15 или 16, отличающийся тем, что при диафильтрации на стадии (е) рН доводят до значения 7,4.
20. Способ по п.15 или 16, отличающийся тем, что на стадии (b) удаляют по меньшей мере 98% белка из бессолевого ретентата, полученного на стадии (а).
21. Способ по п.15 или 16, отличающийся тем, что на стадии (d) удаляют по меньшей мере 90% белка из осветленного раствора капсульного полисахарида, полученного на стадии (с).
22. Способ по п.15 или 16, отличающийся тем, что указанный фильтр с активированным углем на стадии (d) включает древесный уголь, активированный фосфорной кислотой.
23. Способ по п.15 или 16, отличающийся тем, что указанный литический агент, который применяют на стадии (а), представляет собой дезоксихолат натрия.
24. Способ по п.15 или 16, отличающийся тем, что указанный литический агент, который применяют на стадии (а), представляет собой литический агент неживотного происхождения.
25. Способ по п.24, отличающийся тем, что указанный литический агент неживотного происхождения выбран из группы, состоящей из: декансульфоновой кислоты, трет-октилфеноксиполи(оксиэтилен)этанолов, конденсатов оксида октилфенол-этилена, N-лаурилсаркозината натрия (NLS), лаурилиминодипропионата, додецилсульфата натрия, хенодезоксихолата, гиодезоксихолата, гликодезоксихолата, тауродезоксихолата, таурохенодезоксихолата и холата.
26. Способ по п.24, отличающийся тем, что указанный литический агент неживотного происхождения представляет собой N-лаурилсаркозинат натрия.
27. Способ получения раствора, содержащего очищенные капсульные полисахариды из лизата клеток Streptococcus pneumoniae серотипа 19А, причем указанный способ включает следующие стадии:
(a) ультрафильтрование и диафильтрование при 4°С при рН, равном 6, в натриево-фосфатном буфере осветленного лизата клеток, полученного в результате проведения лизиса бактериальных клеток Streptococcus pneumoniae серотипа 19А с применением литического агента и осветления указанного лизата клеток с применением центрифугирования или фильтрования, с получением ретентата;
(b) понижение рН ретентата, полученного на стадии (а), до значения менее чем 4,5 для преципитации белка и нуклеиновых кислот с получением подкисленного раствора ретентата;
(c) выдерживание подкисленного раствора ретентата, полученного на стадии (b), в течение по меньшей мере 2 часов при 4°С для осаждения преципитата с последующим фильтрованием или центрифугированием подкисленного раствора ретентата с получением осветленного раствора капсульного полисахарида;
(d) доведение рН осветленного раствора капсульного полисахарида, полученного на стадии (с), до значения 6, с получением осветленного раствора капсульного полисахарида с подведенным рН;
(e) фильтрование осветленного раствора капсульного полисахарида с подведенным рН со стадии (d) через фильтр с активированным углем;
(f) ультрафильтрование и диафильтрование указанного фильтрованного раствора, полученного на стадии (е), с получением концентрированного очищенного раствора капсульного полисахарида; и
(g) фильтрование концентрированного очищенного раствора капсульного полисахарида, полученного на стадии (f), с применением стерильного фильтра, с получением очищенных капсульных полисахаридов серотипа 19А в виде раствора.
28. Способ по п.27, отличающийся тем, что рН на стадии (b) понижают до значения 3,5.
29. Способ по п.27 или 28, отличающийся тем, что при диафильтрации на стадии (f) рН доводят до значения между 5,5 и 7,5.
30. Способ по п.27 или 28, отличающийся тем, что при диафильтрации на стадии (f) рН доводят до значения между 7,0 и 7,5.
31. Способ по п.27 или 28, отличающийся тем, что при диафильтрации на стадии (f) рН доводят до значения 7,4.
32. Способ по п.27 или 28, отличающийся тем, что на стадии (b) удаляют по меньшей мере 98% белка из ретентата, полученного на стадии (а).
33. Способ по п.27 или 28, отличающийся тем, что на стадии (е) удаляют по меньшей мере 90% белка из осветленного раствора капсульного полисахарида с подведенным рН, полученного на стадии (d).
34. Способ по п.27 или 28, отличающийся тем, что указанный фильтр с активированным углем, который применяют на стадии (е), включает древесный уголь, активированный фосфорной кислотой.
35. Способ по п.27 или 28, отличающийся тем, что указанный натриево-фосфатный буфер, который применяют на стадии (а), представляет собой 25 мМ фосфат натрия.
36. Способ по п.27 или 28, отличающийся тем, что указанный литический агент на стадии (а) представляет собой дезоксихолат натрия.
37. Способ по п.27 или 28, отличающийся тем, что указанный литический агент, который применяют на стадии (а), представляет собой литический агент неживотного происхождения.
38. Способ по п.37, отличающийся тем, что указанный литический агент неживотного происхождения выбран из группы, состоящей из: декансульфоновой кислоты, трет-октилфеноксиполи(оксиэтилен)этанолов, конденсатов оксида октилфенол-этилена, N-лаурилсаркозината натрия (NLS), лаурилиминодипропионата, додецилсульфата натрия, хенодезоксихолата, гиодезоксихолата, гликодезоксихолата, тауродезоксихолата, таурохенодезоксихолата и холата.
39. Способ по п.37, отличающийся тем, что указанный литический агент неживотного происхождения представляет собой N-лаурилсаркозинат натрия.
40. Способ производства пневмококковой вакцины, который включает получение раствора, содержащего очищенные капсульные полисахариды из лизата клеток Streptococcus pneumoniae, с помощью способа по любому из пп.1-39.
41. Способ по п.40, отличающийся тем, что указанная пневмококковая вакцина содержит капсульный полисахарид, конъюгированный с белковым носителем.
42. Применение раствора, содержащего очищенные капсульные полисахариды Streptococcus pneumoniae, полученного с помощью способа по любому из пп.1-39, для производства пневмококковой вакцины.
43. Раствор, содержащий очищенные капсульные полисахариды из лизата клеток серотипа Streptococcus pneumoniae, выбранного из группы, состоящей из серотипов 1, 4, 5, 6А, 6В, 7F, 9V, 14, 18С, 19А, 19F и 23F, причем указанный раствор получен согласно способу по п.1.
44. Раствор, содержащий очищенные капсульные полисахариды из лизата клеток серотипа Streptococcus pneumoniae, выбранного из группы, состоящей из серотипов 1, 4, 5, 6А, 6В, 7F, 9V, 14, 18С, 19F и 23F, отличающийся тем, что указанный раствор получен согласно способу по п.15.
45. Раствор, содержащий очищенные капсульные полисахариды из лизата клеток Streptococcus pneumoniae серотипа 19А, отличающийся тем, что указанный раствор получен согласно способу по п.27.
46. Очищенный капсульный полисахарид серотипа 6А Streptococcus pneumoniae, полученный из раствора по п.43 или 44, причем указанный капсульный полисахарид имеет молекулярный вес от 640000 Да до 670000 Да, и по меньшей мере 98% белка в лизате клеток, содержащем указанный капсульный полисахарид, удалено посредством ультрафильтрования и диафильтрования и последующего подкисления.
47. Очищенный капсульный полисахарид серотипа 19А Streptococcus pneumoniae, полученный из раствора по п.43 или 45, причем указанный капсульный полисахарид имеет молекулярный вес от 488000 Да до 525000 Да, и по меньшей мере 98% белка в лизате клеток, содержащем указанный капсульный полисахарид, удалено посредством ультрафильтрования и диафильтрования и последующего подкисления.
| US 2006228381 A1, 12.10.2006 | |||
| GONСALVES V.M | |||
| ET AL | |||
| Прибор для равномерного смешения зерна и одновременного отбирания нескольких одинаковых по объему проб | 1921 |
|
SU23A1 |
| ПРИБОР ДЛЯ ОПРЕДЕЛЕНИЯ ОСАДКИ ВАЛОВ ПАРОВЫХ ТУРБИН | 1917 |
|
SU283A1 |
| Устройство для моделирования относительного содержания микропримесей в шихте | 1986 |
|
SU1401489A1 |
| Способ электрических измерений с применением параметрического мостового преобразователя | 1988 |
|
SU1762245A1 |
| WO 8201995 A1, 24.06.1982 | |||
| Устройство для движения судна реакцией вытекающей струи пара и продуктов горения | 1925 |
|
SU2404A1 |
| US 5623057 A, 22.04.1997 | |||
| ВАКЦИНА ПРОТИВ ПНЕВМОКОККОВОЙ ИНФЕКЦИИ | 1995 |
|
RU2087156C1 |
Авторы
Даты
2014-05-20—Публикация
2008-03-20—Подача