ОБЛАСТЬ ИЗОБРЕТЕНИЯ
[0001] Настоящее изобретение относится к способу получения капсульного полисахарида с пневмококковым серотипом и более конкретно к способу получения капсульного полисахарида с пневмококковым серотипом путем удаления примесей, таких как белки и нуклеиновые кислоты из культуральной жидкости бактериальных клеток, продуцирующих капсульный полисахарид с пневмококковым серотипом.
УРОВЕНЬ ТЕХНИКИ
[0002] Pneumococcus (Streptococcus pneumoniae) представляет собой грамположительную бактерию, принадлежащую к семейству Streptococcaceae порядка Lactobacillus, и она вызывает у людей такие заболевания, как пневмония, бактериемия, отит среднего уха и менингит. Клетки, принадлежащие к серотипам пневмококков, имеют капсулу, которая представляет собой полисахаридную оболочку, окружающую каждую клетку. Данная капсула препятствует фагоцитозу, предотвращая прикрепление антител к бактериальным клеткам. Клетки были разделены на 90 серотипов, исходя из иммунологических характеристик, некоторые из которых, как сообщается, вызывают инвазионные заболевания. В общей сложности было идентифицировано 37 серотипов инвазивных Streptococcus pneumoniae, собранных с 1996 по 2008, и основные серотипы, частота которых убывает в следующем порядке 19F>23F>19А>6А>3>9V>6В, представляют большую часть, составляющую 53,4%. Капсульные полисахариды данных пневмококковых серотипов применялись в получении вакцин, таких как полисахаридные вакцины и вакцины на основе конъюгатов полисахарид-белок.
[0003] Капсульные полисахариды, применяемые в получении полисахаридных вакцин и вакцин на основе конъюгатов полисахарид-белок, получают из культуральных жидкостей бактериальных клеток, продуцирующих капсульные полисахариды с соответствующими серотипами. Каждый штамм культивируют при оптимальных температуре, рН и перемешивании до момента достижения максимальной плотности. Для получения пневмококковых капсульных полисахаридов, не секретируемых вовне цитоплазмы, осуществляют лизис клеток с использованием лизирующего средства, такого как дезоксихолат натрия (DOC). При лизисе клеток штамма высвобождаются различные белки и нуклеиновые кислоты, а также капсульные полисахариды, и их необходимо удалять с помощью процесса посткультивационной очистки. Для минимизации риска неблагоприятных эффектов, вызванных каким-либо веществом, не являющимся антигеном, после вакцинации существуют строгие требования к содержанию белка и нуклеиновой кислоты. Например, в случае Prevnar 7™ содержание белка и нуклеиновой кислоты для каждого серотипа удовлетворяют требованиям 2-5% или менее и 1-2% или менее, исходя из сухого веса, соответственно.
[0004] В публикации международной заявки на патент № WO 2006/110352 раскрывается способ получения капсульных полисахаридов, включающий культивирование Streptococcus pneumonia, лизис клеток, осаждение белка путем повышения кислотности клеточного лизата до рН менее 5,5, инкубирование без перемешивания и центрифугирование и/или фильтрацию. Кроме того, в публикации международной заявки на патент № WO 2008/118752 раскрывается способ получения капсульных полисахаридов путем осуществления ультрафильтрации и диафильтрации клеточного лизата с последующим процессом осаждения белка посредством повышения кислотности. Однако, все данные сходные способы получения требуют процесса осаждения белка путем повышения кислотности при помощи регулятора рН, что делает весь процесс сложным, а также вызывает модификацию капсульного полисахарида и образование вредных веществ.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ ТЕХНИЧЕСКАЯ ПРОБЛЕМА
[0005] Авторы настоящего изобретения провели различные исследования, чтобы улучшить способ получения капсульного полисахарида с пневмококковым серотипом. Авторы настоящего изобретения неожиданно обнаружили, что рН может быть снижен до диапазона, подходящего для осаждения белка, а именно до рН 5,5 или ниже, с помощью продуктов, образовавшихся при культивировании (в частности, молочной кислоты и т.д.), если осуществляют дополнительное культивирование при таких же условиях без регуляции рН. Таким образом, авторы настоящего изобретения обнаружили, что процесс осаждения белка посредством повышения кислотности при помощи регулятора рН может быть исключен при осуществлении дополнительного культивирования без регуляции рН, а затем осуществления лизиса клеток и процесса осаждения белка.
[0006] Соответственно, целью настоящего изобретения является обеспечение улучшенного способа получения капсульного полисахарида с пневмококковым серотипом.
ТЕХНИЧЕСКОЕ РЕШЕНИЕ
[0007] В соответствии с аспектом настоящего изобретения представлен способ получения капсульного полисахарида с пневмококковым серотипом, включающий следующие стадии:
[0008] (а) культивирование бактериальных клеток, которые продуцируют капсульный полисахарид с пневмококковым серотипом, при поддержании рН культуральной жидкости в диапазоне от 7,0 до 9,4;
[0009] (b) прекращение культивирования на стадии (а) в момент между тем, когда коэффициент поглощения культуральной жидкости остается постоянным и тем, когда коэффициент поглощения начинает снижаться;
[0010] (с) осуществление дополнительного культивирования культуральной жидкости, полученной на стадии (b), без регуляции рН до момента, когда рН культуральной жидкости достигает значения рН 5,5 или ниже;
[0011] (d) добавление лизирующего средства в культуральную жидкость, полученную на стадии (с), для лизиса клеток, осаждение белков и удаление осажденных белков и клеточного дебриса с получением очищенного клеточного лизата и
[0012] (е) выделение и очистку капсульного полисахарида из лизата, полученного на стадии (d).
[0013] В способе получения по настоящему изобретению пневмококковый серотип может быть следующим: 1, 2, 3, 4, 5, 6А, 6В, 7F, 9N, 9V, 14, 18С, 19А, 19F, 22F, 23F или 33F.
[0014] Культивирование на стадии (а) можно осуществлять при 34-38°C с перемешиванием при 50-150 об./мин.
[0015] В одном варианте осуществления настоящего изобретения стадию (b) можно осуществлять путем прекращения культивирования на стадии (а) через 1-3 часа после того, как коэффициент поглощения культуральной жидкости становится постоянным.
[0016] Дополнительное культивирование на стадии (с) можно осуществлять при 34-38°C с перемешиванием при 50-150 об./мин. без регуляции рН.
[0017] Лизирующее средство, применяемое на стадии (d), может представлять собой дезоксихолат натрия. В другом варианте осуществления настоящего изобретения стадию (d) можно осуществлять путем добавления лизирующего средства в культуральную жидкость, полученную на стадии (с), для лизиса клеток, затем инкубирования полученного в результате клеточного лизата при 10-20°С в течение 3-24 часов без перемешивания для осаждения белков и удаления осажденных белков и клеточного дебриса посредством центрифугирования.
[0018] В еще одном варианте осуществления настоящего изобретения выделение и очистка на стадии (е) могут включать следующие стадии:
[0019] (i) фильтрацию лизата, полученного на стадии (d), с помощью глубинного фильтра;
[0020] (ii) концентрирование фильтрата, полученного на стадии (i), с последующей ультрафильтрацией и центрифугированием;
[0021] (iii) осуществление реакции надосадочной жидкости, полученной на стадии (ii), с катионным поверхностно-активным веществом, а затем центрифугирование полученного раствора с получением осадка или надосадочной жидкости, содержащих капсульные полисахариды;
[0022] (iv) осуществление реакции капсульных полисахаридов, полученных на стадии (iii), с йодидом натрия с последующим центрифугированием для получения, таким образом, надосадочной жидкости;
[0023] (v) добавление активированного угля к раствору, полученному на стадии (iv), с последующей фильтрацией и
[0024] (vi) концентрирование фильтрата, полученного на стадии (v), с последующей ультрафильтрацией и центрифугированием для получения, таким образом, капсульных полисахаридов.
[0025] В вышеприведенном варианте осуществления концентрирование на стадии (ii) можно осуществлять при помощи мембраны с размером пор 100 кДа, а концентрирование на стадии (vi) можно осуществлять при помощи мембраны с размером пор 30 кДа. Кроме того, катионное поверхностно-активное вещество, используемое на стадии (iii), может представлять собой бромид цетилтриметиламмония, и бромид цетилтриметиламмония можно использовать в концентрации 0,5~3,0%. Помимо этого, активированный уголь, используемый на стадии (v), можно использовать в концентрации 1~5% (вес/объем).
ПРЕДПОЧТИТЕЛЬНЫЕ ЭФФЕКТЫ
[0026] В способе получения в соответствии с настоящим изобретением регулятор рН для осаждения белка не применяют. То есть настоящее изобретение показало, что если дополнительное культивирование бактериальных клеток, продуцирующих капсульный полисахарид с пневмококковым серотипом, осуществляют при таких же условиях без регуляции рН, то рН может быть снижен до диапазона, подходящего для осаждения белка, а именно до рН 5,5 или ниже, с помощью продуктов, образовавшихся при культивировании (в частности, молочной кислоты и т.д.). Ввиду этого, способ получения по настоящему изобретению не требует применения регулятора рН для осаждения белка, тем самым минимизируя модификацию капсульных полисахаридов и образование каких-либо вредных веществ и упрощая процесс получения. Капсульный полисахарид с пневмококковым серотипом, полученный с помощью способа получения по настоящему изобретению, можно предпочтительно применять для получения полисахаридных вакцин и вакцин на основе конъюгатов полисахарид-белок.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
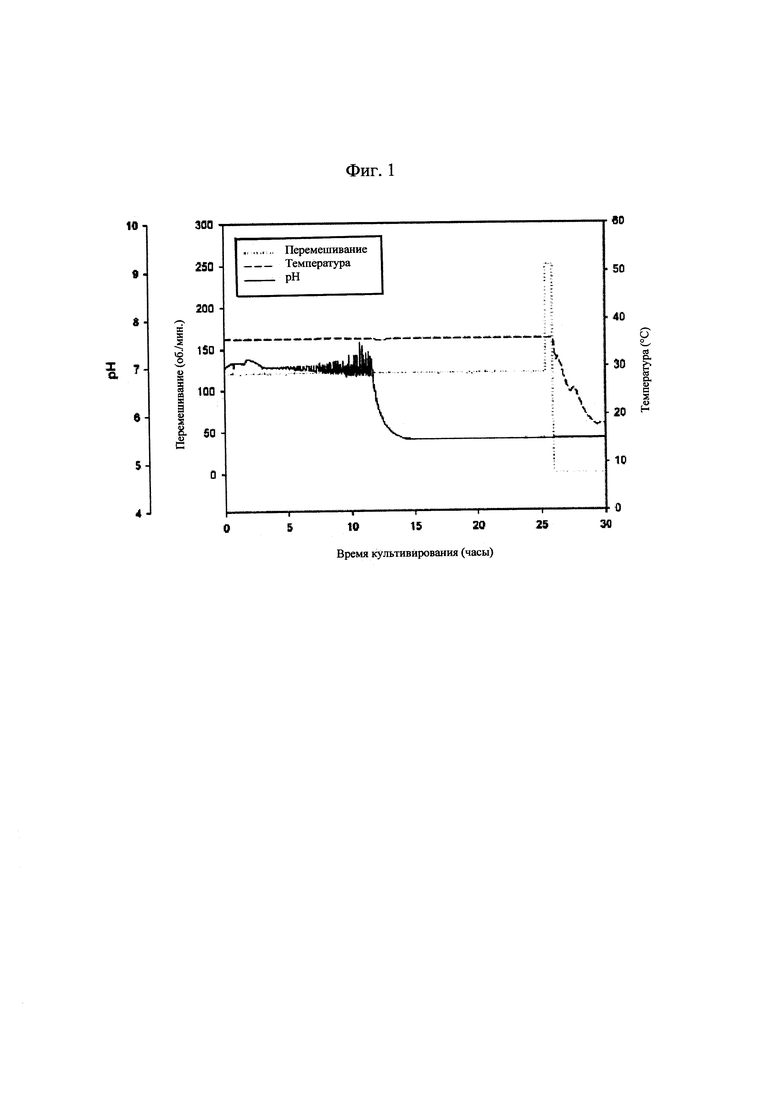
[0027] На фиг. 1 показаны изменения рН культуральной жидкости и условий культивирования бактериальных клеток, продуцирующих капсульный полисахарид с пневмококковым серотипом 3;
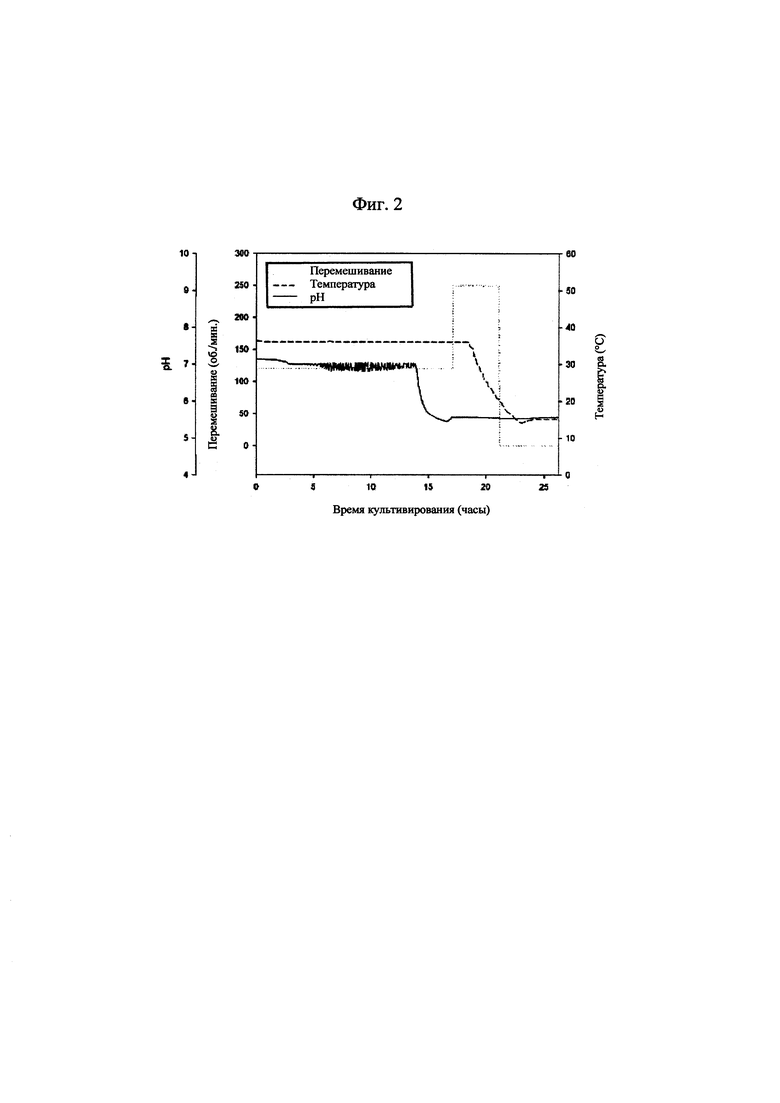
[0028] на фиг. 2 показаны изменения рН культуральной жидкости и условий культивирования бактериальных клеток, продуцирующих капсульный полисахарид с пневмококковым серотипом 6В;
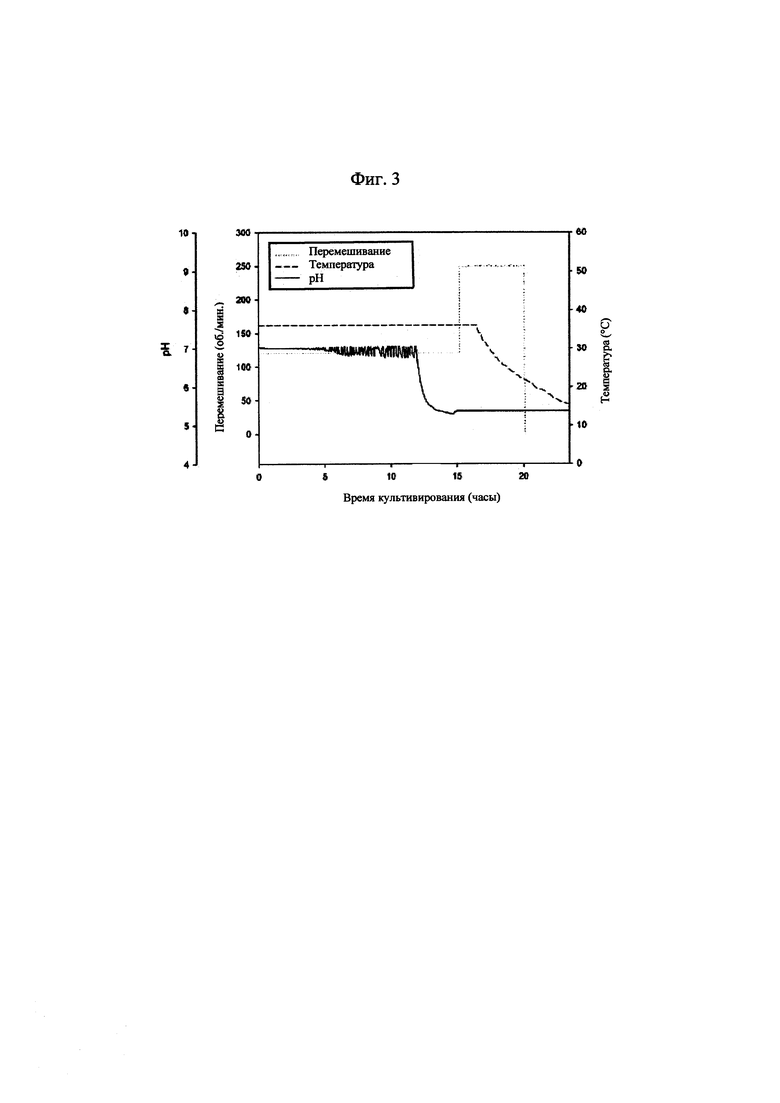
[0029] на фиг. 3 показаны изменения рН культуральной жидкости и условий культивирования бактериальных клеток, продуцирующих капсульный полисахарид с пневмококковым серотипом 7F;
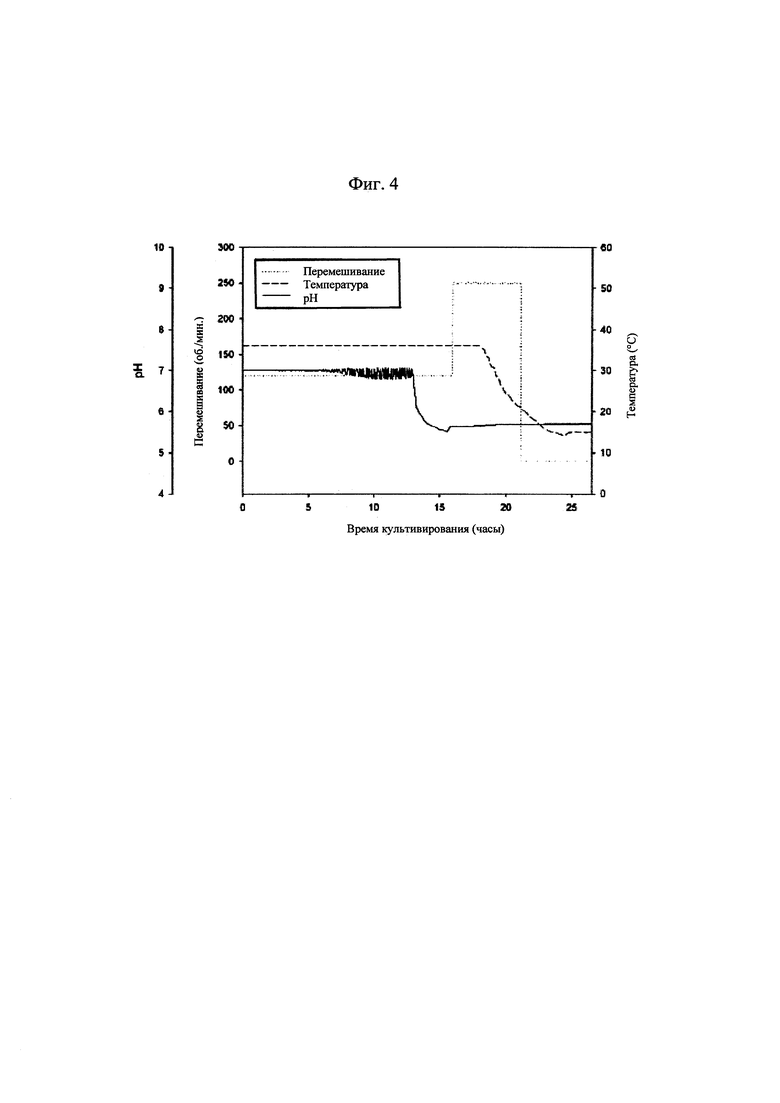
[0030] на фиг. 4 показаны изменения рН культуральной жидкости и условий культивирования бактериальных клеток, продуцирующих капсульный полисахарид с пневмококковым серотипом 14;
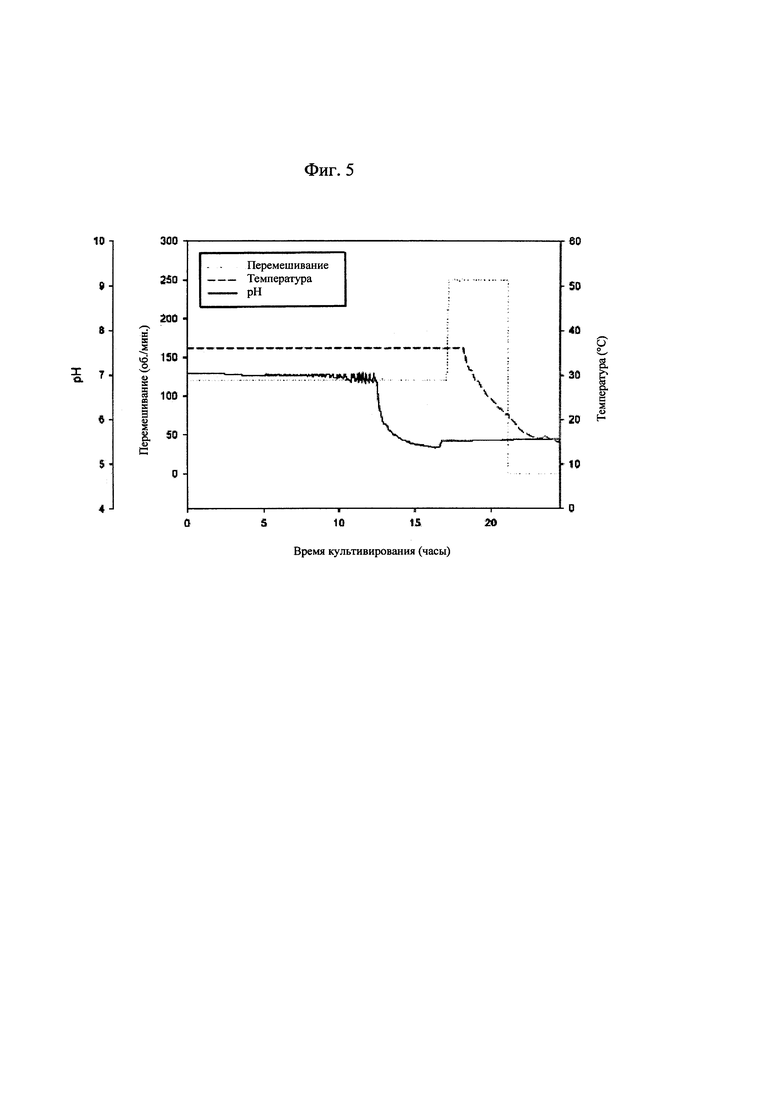
[0031] на фиг. 5 показаны изменения рН культуральной жидкости и условий культивирования бактериальных клеток, продуцирующих капсульный полисахарид с пневмококковым серотипом 19А; и
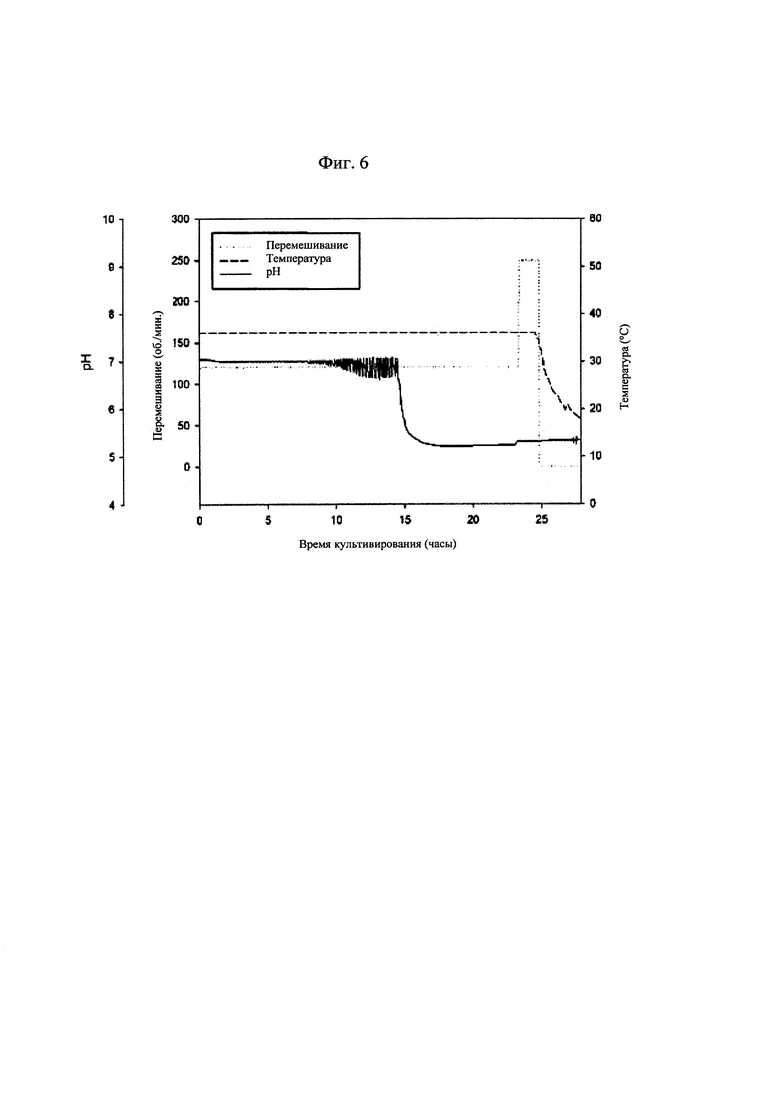
[0032] на фиг. 6 показаны изменения рН культуральной жидкости и условий культивирования бактериальных клеток, продуцирующих капсульный полисахарид с пневмококковым серотипом 23F.
ПРЕДПОЧТИТЕЛЬНЫЙ ВАРИАНТ ОСУЩЕСТВЛЕНИЯ
[0033] Настоящее изобретение обеспечивает способ получения капсульного полисахарида с пневмококковым серотипом, включающий следующие стадии:
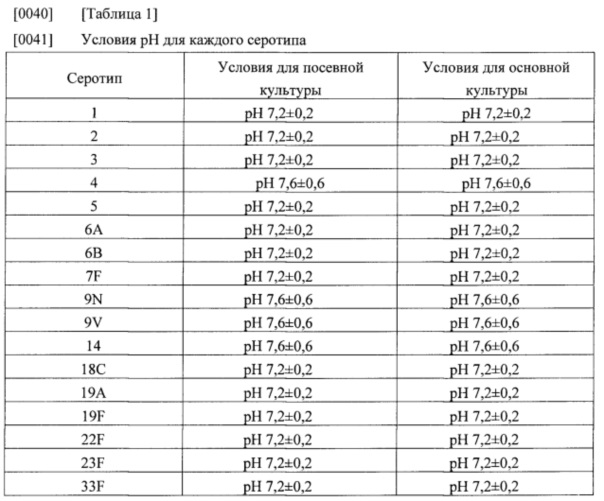
[0034] (а) культивирование бактериальных клеток, которые продуцируют капсульный полисахарид с пневмококковым серотипом, при поддержании рН культуральной жидкости в диапазоне от 7,0 до 9,4;
[0035] (b) прекращение культивирования на стадии (а) в момент между тем, когда коэффициент поглощения культуральной жидкости остается постоянным и тем, когда коэффициент поглощения начинает снижаться;
[0036] (с) осуществление дополнительного культивирования культуральной жидкости, полученной на стадии (b), без регуляции рН до момента, когда рН культуральной жидкости достигает значения рН 5,5 или ниже;
[0037] (d) добавление лизирующего средства в культуральную жидкость, полученную на стадии (с), для лизиса клеток, осаждение белков и удаление осажденных белков и клеточного дебриса с получением очищенного клеточного лизата и
[0038] (е) выделение и очистку капсульного полисахарида из лизата, полученного на стадии (d).
[0039] На стадии (а) способа получения в соответствии с настоящим изобретением пневмококковый серотип может представлять собой любой серотип, применяемый в получении пневмококковых вакцин; например, серотипы могут включать серотип 1, 2, 3, 4, 5, 6А, 6В, 7F, 9N, 9V, 14, 18С, 19А, 19F, 22F, 23F и 33F, но не ограничиваются ими. Бактериальные клетки, продуцирующие капсульный полисахарид с пневмококковым серотипом, известны из уровня техники, и можно использовать любую известную бактериальную клетку без ограничения (например, см. WO 2006/110381). Культивирование на стадии (а) способа получения в соответствии с настоящим изобретением можно осуществлять в универсальной среде, такой как соевая среда, поддерживая при этом рН культуральной жидкости в диапазоне от 7,0 до 9,4, предпочтительно, от 7,2 до 8,2, при помощи, например, гидроксида натрия. Культивирование можно осуществлять при любых известных условиях культивирования, например, при 34-38°C с перемешиванием при 50-150 об./мин. Условия рН, подходящие для посевной культуры и основной культуры, для получения характерных серотипов Streptococcus pneumoniae приведены в нижеследующей таблице 1.
[0042] Способ получения в соответствии с настоящим изобретением не требует применения регулятора рН для осаждения белка. То есть авторы настоящего изобретения неожиданно обнаружили, что рН может быть снижен до диапазона, подходящего для осаждения белка, а именно до рН 5,5 или ниже, с помощью продуктов, образовавшихся при культивировании (в частности, молочной кислоты и т.д.), если осуществляют дополнительное культивирование при таких же условиях без регуляции рН. Таким образом, способ получения по настоящему изобретению предполагает осуществление дополнительного культивирования без регуляции рН после культивирования бактериальных клеток, которые продуцируют пневмококковый серотип, предпочтительно, в момент времени, когда бактериальные клетки достигают максимального роста, а затем осуществление лизиса клеток и процессов осаждения белка. Следовательно, способ получения по настоящему изобретению не требует применения регулятора рН для осаждения белка, тем самым минимизируя модификацию капсульного полисахарида и образование каких-либо вредных веществ и упрощая процесс получения.
[0043] Таким образом, способ получения по настоящему изобретению включает стадию прекращения культивирования на стадии (а) в момент между тем, когда коэффициент поглощения культуральной жидкости остается постоянным и тем, когда коэффициент поглощения начинает снижаться [т.е. стадией (b)]; и стадию осуществления дополнительного культивирования культуральной жидкости, полученной на стадии (b), без регуляции рН до момента, когда рН культуральной жидкости достигает значения рН 5,5 или ниже [т.е. стадии (с)].
[0044] Если культивирование осуществляют в соответствии со стадией (а) способа получения по настоящему изобретению, бактериальные клетки пролиферируют, а коэффициент поглощения [например, коэффициент поглощения при 590 нм (OD590)] культуральной жидкости постепенно повышается с достижением плато (максимальный рост), а затем остается постоянным (приблизительно 7-24 часа после начала культивирования). В дальнейшем коэффициент поглощения снижается в течение 1-3 часов. В одном варианте осуществления настоящего изобретения, таким образом, стадию (b) можно осуществлять путем прекращения культивирования на стадии (а) через 1-3 часа после того, как коэффициент поглощения культуральной жидкости становится постоянным. Дополнительное культивирование на стадии (с) можно осуществлять без регуляции рН при таких же условиях, что и на стадии (а), то есть при 34-38°C с перемешиванием при 50-150 об./мин. Когда осуществляют такое дополнительное культивирование, рН культуральной жидкости самопроизвольно снижается до значения 5,5 или ниже, обеспечивая, таким образом, надлежащее значение рН, необходимое для осаждения белка.
[0045] Способ получения по настоящему изобретению включает стадию добавления лизирующего средства в культуральную жидкость, полученную на стадии (с), для лизиса клеток, осаждения белков и удаления осажденных белков и клеточного дебриса с получением очищенного клеточного лизата [т.е. стадию (d)].
[0046] Лизис клеток можно осуществлять в соответствии с известным способом, например, способом, раскрытым в WO 2006/110381, WO 2008/118752 и т.д. Например, лизис клеток можно осуществлять с помощью дезоксихолата натрия в качестве лизирующего средства. Дезоксихолат натрия можно использовать в концентрации 0,10-0,15% (концентрация после добавления дезоксихолата натрия), но не ограничивается ею. При лизисе клеток капсульные полисахариды с пневмококковым серотипом высвобождаются вовне цитоплазмы. Кроме того, осаждение белка можно осуществлять, например, путем инкубирования при 10-20°С, а удаление осажденных белков и клеточного дебриса можно осуществлять с помощью стандартного способа (например, центрифугирования). В одном варианте осуществления настоящего изобретения стадию (d) можно осуществлять путем добавления лизирующего средства в культуральную жидкость, полученную на стадии (с), для лизиса клеток, осаждения белков посредством инкубирования полученного лизата при 10-20°С в течение 3-24 часов без перемешивания и удаления осажденных белков и клеточного дебриса посредством центрифугирования.
[0047] Способ получения по настоящему изобретению включает стадию выделения и очистки капсульного полисахарида из лизата путем удаления примесей (например, белков и нуклеиновых кислот, содержавшихся в клетках) из лизата, полученного на стадии (d) [т.е. стадию (е)]. Выделение и очистку капсульного полисахарида можно осуществлять в соответствии с известным способом очистки, например, способом, раскрытым в WO 2006/110381 и WO 2008/118752. В одном варианте осуществления выделение и очистка на стадии (е) могут включать следующие стадии:
[0048] (i) фильтрацию лизата, полученного на стадии (d), с помощью глубинного фильтра;
[0049] (ii) концентрирование фильтрата, полученного на стадии (i), с последующей ультрафильтрацией и центрифугированием;
[0050] (iii) осуществление реакции надосадочной жидкости, полученной на стадии (ii), с катионным поверхностно-активным веществом, а затем центрифугирование полученного в результате раствора с получением осадка или надосадочной жидкости, содержащих капсульные полисахариды;
[0051] (iv) осуществление реакции капсульных полисахаридов, полученных на стадии (iii), с йодидом натрия с последующим центрифугированием для получения, таким образом, надосадочной жидкости;
[0052] (v) добавление активированного угля к надосадочной жидкости, полученной на стадии (iv), с последующей фильтрацией и
[0053] (vi) концентрирование фильтрата, полученного на стадии (v), с последующей ультрафильтрацией и центрифугированием для получения, таким образом, капсульного полисахарида.
[0054] В вышеприведенном варианте осуществления лизаты, оставшиеся даже после центрифугирования для удаления осажденных белков и клеточного дебриса, удаляют посредством фильтрации с помощью глубинного фильтра.
[0055] Кроме того, белки и нуклеиновые кислоты можно удалить, повторяя концентрацию/ультрафильтрацию дважды. В одном варианте осуществления концентрирование на стадии (ii) можно осуществлять при помощи мембраны с размером пор 100 кДа, а концентрирование на стадии (vi) можно осуществлять при помощи мембраны с размером пор 30 кДа. В данном способе ультрафильтрация может также упоминаться как "диафильтрация".
[0056] Кроме того, катионное поверхностно-активное вещество, применяемое на стадии (iii), может представлять собой бромид цетилтриметиламмония. Бромид цетилтриметиламмония (бромид цетримония, бромид гексадецилтриметиламмония (НВ)) можно использовать в концентрации 0,5-3% (концентрация после добавления бромида цетилтриметиламмония). Использованное катионное поверхностно-активное вещество, такое как НВ, можно осадить и удалить с помощью йодида натрия. Если осуществляют центрифугирование на стадии (iii), капсульные полисахариды могут находиться в осадке (например, серотип 1, 2, 3, 4, 5, 6А, 6В, 9N, 9V, 18С, 19А, 19F, 22F, 23F и т.д.) или надосадочной жидкости (например, серотип 7F, 14, 33F и т.д.).
Капсульные полисахариды, полученные в форме осадка, можно растворять в подходящем растворителе (например, водном растворе хлорида натрия и т.д.), а затем использовать на последующей стадии (т.е. реакции с йодидом натрия). Капсульные полисахариды, находящиеся в надосадочной жидкости, можно использовать на последующей стадии (т.е. реакции с йодидом натрия) без дополнительного отделения.
[0057] Кроме того, активированный уголь на стадии (v) можно предпочтительно использовать в концентрации 1~5% (вес/объем).
[0058] Далее в данном документе настоящее изобретение будет более подробно описано на основании примеров. Однако, следующие примеры, описанные в данном документе, следует рассматривать исключительно в значении описания, а не для целей ограничения.
[0059] Пример
[0060] Соевая среда, использованная в следующих примерах, имеет состав, приведенный в таблице 2 ниже.

[0062] Пример 1. Получение капсульных полисахаридов с пневмококковыми серотипами 3, 6В и 19А
[0063] <Получение клеточного банка>
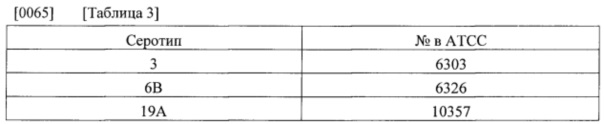
[0064] Соответствующий посевной материал, продуцирующий капсульные полисахариды с пневмококковыми серотипами 3, 6В и 19А, получали из Американской коллекции типовых культур [АТСС]. Штаммы, использованные в посевной культуре и основной культуре, приведены в нижеследующей таблице 3.
[0066] Получали несколько поколений посевного материала (поколения F1, F2 и F3). Получали два дополнительных поколения посевного материала. Первое дополнительное поколение культивировали из емкости F3, а последующее поколение культивировали из емкости с первым дополнительным поколением. Емкости с посевным материалом хранили замороженными (<-70°С) с синтетическим глицерином в качестве криоконсерванта. Для получения клеточного банка все культуры выращивали в соевой среде. Перед замораживанием клетки концентрировали посредством центрифугирования, использованную среду удаляли, а клеточную массу повторно суспендировали в свежей среде, содержавшей криоконсервант (например, синтетический глицерин).
[0067] <Культивирование и извлечение>
[0068] Культуры из рабочего клеточного банка использовали для инокуляции содержимого колб с посевным материалом, содержавших соевую среду для культивирования. После достижения целевого коэффициента поглощения колбу с посевным материалом использовали для инокуляции содержимого биореактора, содержавшего соевую среду. Культивирование осуществляли при 34-38°С и 120 об./мин., поддерживая при этом рН на значении приблизительно 7,2 или выше с помощью 3 н. NaOH. Отбор образцов осуществляли каждые 2-3 часа для измерения коэффициента поглощения. Когда коэффициент поглощения начинал резко повышаться, отбор образцов осуществляли каждые 0,5-1 час и измеряли коэффициент поглощения. Культивирование прекращали через приблизительно 1 час после того, как коэффициент поглощения достигал определенного значения и оставался постоянным. После прекращения культивирования дополнительное культивирование осуществляли без регуляции рН при таких же условиях температуры и значениях об./мин. до достижения значения рН 5,5 или ниже. После прекращения дополнительного культивирования добавляли дезоксихолат натрия в концентрации 0,12% для лизиса клеток. Полученный таким образом лизат охлаждали до 10-15°С, а затем инкубировали при такой же температуре в течение приблизительно 3 часов без перемешивания, что приводило к осаждению белка. Далее полученный в результате лизат центрифугировали для удаления осажденных белков и клеточного дебриса.
[0069] <Очистка>
[0070] Раствор, полученный посредством центрифугирования, фильтровали с помощью глубинного фильтра для удаления белков и клеточного дебриса, которые не осели в ходе центрифугирования. Полученный в результате фильтрат концентрировали при помощи мембраны с размером пор 100 кДа, а затем полученный в результате концентрированный раствор подвергали ультрафильтрации с использованием 25 мМ буфера на основе фосфата натрия (рН 7,2). Ультрафильтрацию осуществляли до тех пор, пока проводимость диализата не достигала значения приблизительно 3-4 мСм/см, а трансмембранное давление (ТМР) не устанавливалось на значении 0,5-1,5 бар или менее. Примеси удаляли из полученного в результате раствора и добавляли к раствору бромид цетримония (бромид гексадецилтриметиламмония (НВ)) в концентрации приблизительно 1,0 вес/объем % с последующим перемешиванием в течение приблизительно 1 часа. Затем осуществляли центрифугирование для осаждения полисахаридов. Полученный таким образом осадок растворяли в приблизительно 0,25 М водного раствора хлорида натрия и добавляли к нему йодид натрия (NaI) в концентрации приблизительно 0,5 вес/объем %. Этот раствор центрифугировали для извлечения надосадочной жидкости и к полученному в результате раствору медленно добавляли активированный уголь в концентрации приблизительно 2,0 вес/объем %, при этом перемешивая, с последующим перемешиванием в течение приблизительно 1 часа и фильтрацией. Полученный в результате фильтрат концентрировали при помощи мембраны с размером пор 30 кДа, а затем концентрированный раствор подвергали ультрафильтрации с использованием приблизительно 10 объемов трижды дистиллированной воды. Ультрафильтрацию осуществляли до тех пор, пока проводимость диализата не достигала значения приблизительно 10 мкСм/см, а трансмембранное давление (ТМР) не устанавливалось на значении 0,5-1,5 бар или менее. Полученный в результате концентрированный раствор подвергали стерилизующему фильтрованию и хранили замороженным при температуре -20°С или ниже.
[0071] Общее содержание белка, общее содержание нуклеиновой кислоты, общее содержание полисахарида и выход после очистки, которые оценивали на каждой стадии очистки, приведены в нижеследующих таблицах 4-6.
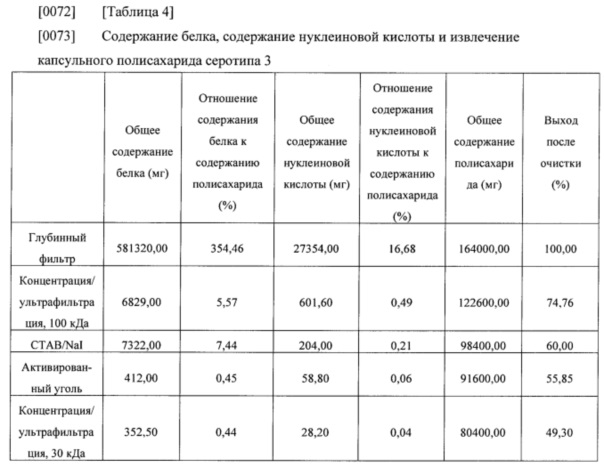
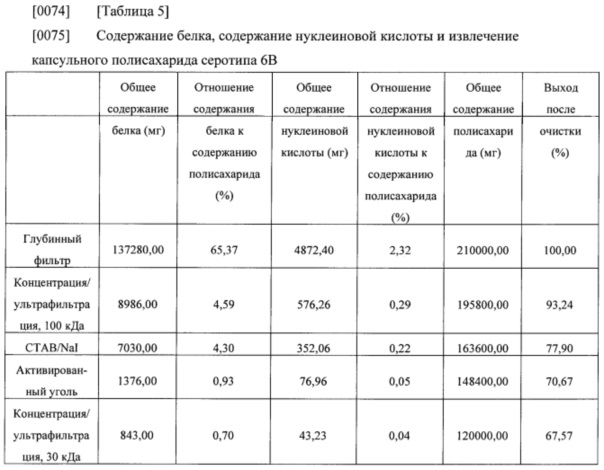
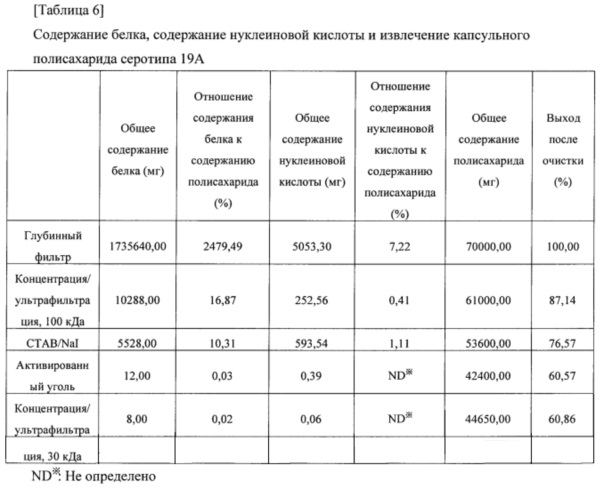
[0076] Результаты из таблиц 4-6 показали, что капсульные полисахариды, полученные с помощью способа получения в соответствии с настоящим изобретением, удовлетворяли стандарту содержания остаточного белка без какого-либо отдельного процесса повышения кислотности, и нормы извлечения капсульных полисахаридов также составляли 49% или выше (капсульный полисахарид серотипа 3), 65% или выше (капсульный полисахарид серотипа 6В) и 60% или выше (капсульный полисахарид серотипа 19А), соответственно. Таким образом, способ получения в соответствии с настоящим изобретением можно применять для эффективного получения капсульных полисахаридов с помощью упрощенного процесса.
[0077] Пример 2. Получение капсульных полисахаридов с пневмококковыми серотипами 7F и 14
[0078] <Получение клеточного банка>
[0079] Соответствующий посевной материал, продуцирующий капсульные полисахариды с пневмококковыми серотипами 7F и 14, получали из Американской коллекции типовых культур [АТСС]. Штаммы, использованные в посевной культуре и основной культуре, приведены в нижеследующей таблице 7.
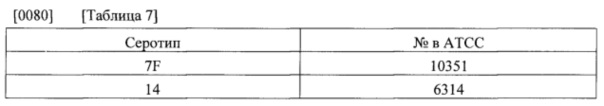
[0081] Получали несколько поколений посевного материала (поколения Fl, F2 и F3). Получали два дополнительных поколения посевного материала. Первое дополнительное поколение культивировали из емкости F3, а последующее поколение культивировали из емкости с первым дополнительным поколением. Емкости с посевным материалом хранили замороженными (<-70°С) с синтетическим глицерином в качестве криоконсерванта. Для получения клеточного банка все культуры выращивали в соевой среде. Перед замораживанием клетки концентрировали посредством центрифугирования, использованную среду удаляли, а клеточную массу повторно суспендировали в свежей среде, содержавшей криоконсервант (например, синтетический глицерин).
[0082] <Культивирование и извлечение>
[0083] Культуры из рабочего клеточного банка использовали для инокуляции содержимого колб с посевным материалом, содержавших соевую среду для культивирования. После достижения целевого коэффициента поглощения колбу с посевным материалом использовали для инокуляции содержимого биореактора, содержавшего соевую среду. Культивирование осуществляли при 34-38°С и 120 об./мин, поддерживая при этом рН на значении приблизительно 7,2 или выше с помощью 3 н. NaOH. Отбор образцов осуществляли каждые 2-3 часа для измерения коэффициента поглощения. Когда коэффициент поглощения начинал резко повышаться, отбор образцов осуществляли каждые 0,5~1 час для измерения коэффициента поглощения. Культивирование прекращали через приблизительно 1 час после того, как коэффициент поглощения достигал определенного значения и оставался постоянным. После прекращения культивирования дополнительное культивирование осуществляли без регуляции рН при таких же условиях температуры и значениях об./мин. до достижения значения рН 5,5 или ниже. После прекращения дополнительного культивирования добавляли дезоксихолат натрия в концентрации 0,12% для лизиса клеток. Полученные таким образом лизаты охлаждали до 10~15°С, а затем инкубировали при такой же температуре в течение приблизительно 3 часов без перемешивания, что приводило к осаждению белка. Далее полученный в результате лизат центрифугировали для удаления осажденных белков и клеточного дебриса.
[0084] <Очистка>
[0085] Раствор, полученный посредством центрифугирования, фильтровали с помощью глубинного фильтра для удаления белков и клеточного дебриса, которые не осели в ходе центрифугирования. Полученный в результате фильтрат концентрировали при помощи мембраны с размером пор 100 кДа, а затем полученный в результате концентрированный раствор подвергали ультрафильтрации с использованием 25 мМ буфера на основе фосфата натрия (рН 7,2). Ультрафильтрацию осуществляли до тех пор, пока проводимость диализата не достигала значения приблизительно 3-4 мСм/см, а трансмембранное давление (ТМР) не устанавливалось на значении 0,5-1,5 бар или менее. Примеси удаляли из полученного в результате раствора и добавляли бромид цетримония (бромид гексадецилтриметиламмония (НВ)) в концентрации приблизительно 1,0 вес/объем % с последующим перемешиванием в течение приблизительно 1 часа и центрифугированием для извлечения надосадочной жидкости. Затем к надосадочной жидкости добавляли йодид натрия (NaI) в концентрации приблизительно 0,5 вес/объем %. Полученный раствор центрифугировали для извлечения надосадочной жидкости и к полученному раствору медленно добавляли активированный уголь в концентрации приблизительно 2,0 вес/объем %, при этом перемешивая, с последующим перемешиванием в течение приблизительно 1 часа и фильтрацией. Полученный в результате фильтрат концентрировали при помощи мембраны с размером пор 30 кДа, а затем концентрированный раствор подвергали ультрафильтрации с использованием приблизительно 10 объемов трижды дистиллированной воды. Ультрафильтрацию осуществляли до тех пор, пока проводимость диализата не достигала значения приблизительно 10 мкСм/см, а трансмембранное давление (ТМР) не устанавливалось на значении 0,5-1,5 бар или менее. Полученный в результате концентрированный раствор подвергали стерилизующему фильтрованию и хранили замороженным при температуре -20°С или ниже.
[0086] Общее содержание белка, общее содержание нуклеиновой кислоты, общее содержание полисахарида и выход после очистки, которые оценивали на каждой стадии очистки, приведены в нижеследующих таблицах 8-9.
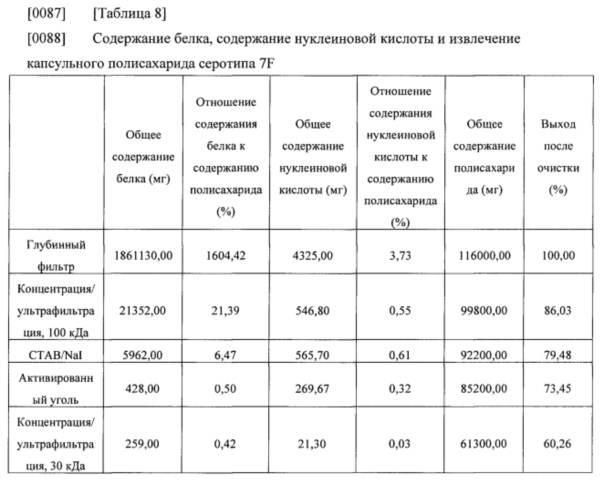
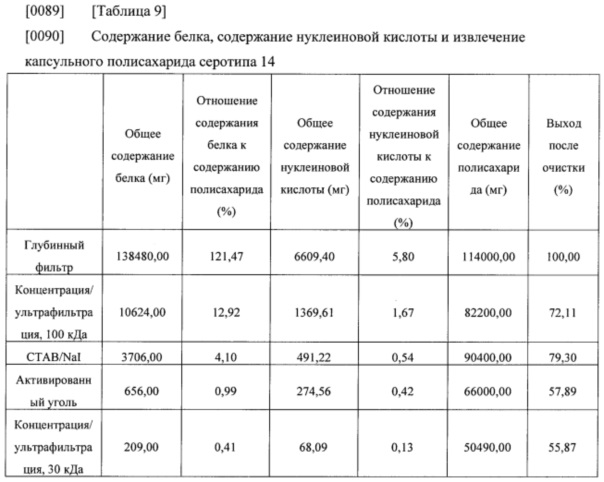
[0091] Результаты из таблиц 8-9 показали, что капсульные полисахариды, полученные с помощью способа получения в соответствии с настоящим изобретением, удовлетворяли стандарту содержания остаточного белка без какого-либо отдельного процесса повышения кислотности, и нормы извлечения капсульных полисахаридов также составляли 60% или выше (капсульный полисахарид серотипа 7F) и 55% или выше (капсульный полисахарид серотипа 14), соответственно. Таким образом, способ получения в соответствии с настоящим изобретением можно применять для эффективного получения капсульных полисахаридов с помощью упрощенного процесса.
[0092] Пример 3. Получение капсульных полисахаридов с пневмококковым серотипом 23F
[0093] <Получение клеточного банка>
[0094] Посевной материал, продуцирующий капсульные полисахариды с пневмококковым серотипом 23F, получали из Американской коллекции типовых культур [№ в АТСС 6323]. Получали несколько поколений посевного материала (поколения F1, F2 и F3). Получали два дополнительных поколения посевного материала. Первое дополнительное поколение культивировали из емкости F3, а последующее поколение культивировали из емкости с первым дополнительным поколением. Емкости с посевным материалом хранили замороженными (<-70°С) с синтетическим глицерином в качестве криоконсерванта. Для получения клеточного банка все культуры выращивали в соевой среде. Перед замораживанием клетки концентрировали посредством центрифугирования, использованную среду удаляли, а клеточную массу повторно суспендировали в свежей среде, содержавшей криоконсервант (например, синтетический глицерин).
[0095] <Культивирование и извлечение>
[0096] Культуру из рабочего клеточного банка использовали для инокуляции содержимого колбы с посевным материалом, содержавшей соевую среду для культивирования. После достижения целевого коэффициента поглощения колбу с посевным материалом использовали для инокуляции содержимого биореактора, содержавшего соевую среду. Культивирование осуществляли при 34-38°С и 120 об./мин., поддерживая при этом рН на значении приблизительно 7,2 или выше с помощью 3 н. NaOH. Отбор образцов осуществляли каждые 2-3 часа для измерения коэффициента поглощения. Когда коэффициент поглощения начинал резко повышаться, отбор образцов осуществляли каждые 0,5-1 час для измерения коэффициента поглощения. Культивирование прекращали через приблизительно 1 час после того, как коэффициент поглощения достигал определенного значения и оставался постоянным. После прекращения культивирования дополнительное культивирование осуществляли без регуляции рН при таких же условиях температуры и значениях об./мин. до достижения значения рН 5,5 или ниже. После прекращения дополнительного культивирования добавляли дезоксихолат натрия в концентрации 0,12% для лизиса клеток. Полученный таким образом лизат охлаждали до 10~15°С, а затем инкубировали при такой же температуре в течение приблизительно 3 часов без перемешивания, что приводило к осаждению белка. Далее полученный в результате лизат центрифугировали для удаления осажденных белков и клеточного дебриса.
[0097] <Очистка>
[0098] Раствор, полученный посредством центрифугирования, фильтровали с помощью глубинного фильтра для удаления белков и клеточного дебриса, которые не осели в ходе центрифугирования. Полученный в результате фильтрат концентрировали при помощи мембраны с размером пор 100 кДа, а затем полученный в результате концентрированный раствор подвергали ультрафильтрации с использованием 25 мМ буфера на основе фосфата натрия (рН 7,2). Ультрафильтрацию осуществляли до тех пор, пока проводимость диализата не достигала значения приблизительно 3~4 мСм/см, а трансмембранное давление (ТМР) не устанавливалось на значении 0,5~1,5 бар или менее. Примеси удаляли из полученного в результате раствора и добавляли бромид цетримония (бромид гексадецилтриметиламмония (НВ)) в концентрации приблизительно 2,5 вес/объем % с последующим перемешиванием в течение приблизительно 1 часа и центрифугированием для осаждения полисахаридов. Полученный таким образом осадок растворяли в приблизительно 0,25 М водного раствора хлорида натрия и добавляли к нему йодид натрия (NaI) в концентрации приблизительно 0,5 вес/объем %. Этот раствор центрифугировали для извлечения надосадочной жидкости и к полученному в результате раствору медленно добавляли активированный уголь в концентрации приблизительно 2,0 вес/объем %, при этом перемешивая, с последующим перемешиванием в течение приблизительно 1 часа и фильтрацией. Полученный в результате фильтрат концентрировали при помощи мембраны с размером пор 30 кДа, а затем концентрированный раствор подвергали ультрафильтрации с использованием приблизительно 10 объемов трижды дистиллированной воды. Ультрафильтрацию осуществляли до тех пор, пока проводимость диализата не достигала значения приблизительно 10 мкСм/см, а трансмембранное давление (ТМР) не устанавливалось на значении 0,5~1,5 бар или менее. Полученный в результате концентрированный раствор подвергали стерилизующему фильтрованию и хранили замороженным при температуре -20°С или ниже.
[0099] Общее содержание белка, общее содержание нуклеиновой кислоты, общее содержание полисахарида и выход после очистки, которые оценивали на каждой стадии очистки, приведены в нижеследующей таблице 10.

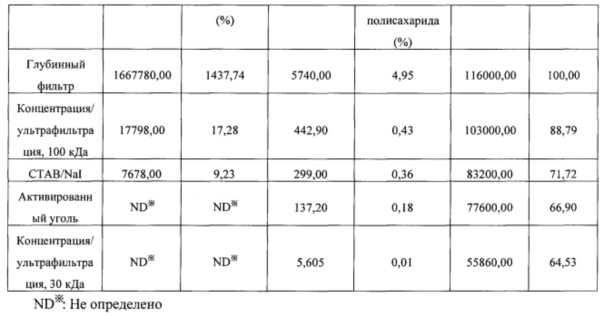
[00102] Результаты из таблицы 10 показали, что капсульный полисахарид серотипа 23F, полученный с помощью способа получения в соответствии с настоящим изобретением, удовлетворял стандарту содержания остаточного белка без применения дополнительного процесса повышения кислотности, и норма извлечения капсульного полисахарида также составляла 60% или выше. Таким образом, способ получения в соответствии с настоящим изобретением можно применять для эффективного получения капсульных полисахаридов с помощью упрощенного процесса.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛИВАЛЕНТНАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ КОНЪЮГАТЫ ПНЕВМОКОККОВЫЙ ПОЛИСАХАРИД-БЕЛОК | 2013 |
|
RU2605834C2 |
| Мультивалентная композиция на основе конъюгатов пневмококковый полисахарид-белок | 2013 |
|
RU2606152C1 |
| Мультивалентная композиция на основе конъюгатов пневмококковый полисахарид-белок | 2013 |
|
RU2613148C2 |
| УСКОРЕННЫЙ СПОСОБ ОЧИСТКИ ДЛЯ ПОЛУЧЕНИЯ КАПСУЛЬНЫХ ПОЛИСАХАРИДОВ STREPTOCOCCUS PNEUMONIAE | 2008 |
|
RU2516340C2 |
| СПОСОБ ПОЛУЧЕНИЯ РАСТВОРА, СОДЕРЖАЩЕГО ВЫСОКОМОЛЕКУЛЯРНЫЕ ИЗОЛИРОВАННЫЕ КАПСУЛЬНЫЕ ПОЛИСАХАРИДЫ STREPTOCOCCUS PNEUMONIAE СЕРОТИПА 19А (ВАРИАНТЫ) | 2009 |
|
RU2511404C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЖИДКОЙ ФРАКЦИИ, СОДЕРЖАЩЕЙ ИЗОЛИРОВАННЫЕ ВЫСОКОМОЛЕКУЛЯРНЫЕ КАПСУЛЬНЫЕ ПОЛИСАХАРИДЫ STREPTOCOCCUS PNEUMONIAE, И ЖИДКАЯ ФРАКЦИЯ, ПОЛУЧЕННАЯ ТАКИМ СПОСОБОМ | 2009 |
|
RU2524436C2 |
| МУЛЬТИВАЛЕНТНАЯ КОМПОЗИЦИЯ НА ОСНОВЕ КОНЪЮГАТА ПНЕВМОККОВЫЙ ПОЛИСАХАРИД-БЕЛОК | 2007 |
|
RU2493870C2 |
| МУЛЬТИВАЛЕНТНАЯ КОМПОЗИЦИЯ НА ОСНОВЕ КОНЪЮГАТА ПНЕВМОККОВЫЙ ПОЛИСАХАРИД-БЕЛОК | 2007 |
|
RU2484846C2 |
| Способ получения иммуногенного конъюгата капсульный полисахарид Streptococcus pneumoniae-белок-носитель | 2015 |
|
RU2710393C2 |
| СВОБОДНЫЕ ОТ ПРИМЕСИ С-ПОЛИСАХАРИДА КАПСУЛЬНЫЕ ПОЛИСАХАРИДЫ STREPTOCOCCUS PNEUMONIAE С ОСТАТКОМ 2,5-АНГИДРОМАННОЗЫ НА ВОССТАНАВЛИВАЮЩЕМ КОНЦЕ | 2023 |
|
RU2818894C1 |
Настоящее изобретение относится к биотехнологии. Предложен способ получения капсульного полисахарида с пневмококковым серотипом. Культивируют бактериальные клетки при рН культуральной жидкости в диапазоне от 7,0 до 9,4. Затем прекращают культивирование на стадии в момент между тем, когда коэффициент поглощения культуральной жидкости остается постоянным, и тем, когда коэффициент поглощения начинает снижаться. Осуществляют дополнительное культивирование без регуляции рН до момента, когда рН культуральной жидкости достигнет значения 5,5 или ниже. Добавляют лизирующее средство в полученную культуральную жидкость для лизиса клеток. Удаляют осажденные белки и клеточный дебрис с получением очищенного клеточного лизата. Выделяют и очищают капсульный полисахарид из полученного лизата. Изобретение исключает процесс осаждения белка путем повышения кислотности при помощи регулятора рН, что упрощает процесс и не приводит к модификации капсульного полисахарида и образованию вредных веществ. 12 з.п. ф-лы, 6 ил., 10 табл., 3 пр.
1. Способ получения капсульного полисахарида с пневмококковым серотипом, включающий:
(a) культивирование бактериальных клеток, которые продуцируют капсульный полисахарид с пневмококковым серотипом, при поддержании рН культуральной жидкости в диапазоне от 7,0 до 9,4;
(b) прекращение культивирования на стадии (а) в момент между тем, когда коэффициент поглощения культуральной жидкости остается постоянным, и тем, когда коэффициент поглощения начинает снижаться;
(c) осуществление дополнительного культивирования культуральной жидкости, полученной на стадии (b), без регуляции рН до момента, когда рН культуральной жидкости достигает значения рН 5,5 или ниже;
(d) добавление лизирующего средства в культуральную жидкость, полученную на стадии (с), для лизиса клеток, осаждение белков и удаление осажденных белков и клеточного дебриса с получением очищенного клеточного лизата и
(e) выделение и очистку капсульного полисахарида из лизата, полученного на стадии (d).
2. Способ по п. 1, отличающийся тем, что пневмококковый серотип является следующим: 1, 2, 3, 4, 5, 6А, 6В, 7F, 9N, 9V, 14, 18С, 19A, 19F, 22F, 23F или 33F.
3. Способ по п. 1, отличающийся тем, что культивирование на стадии (а) осуществляют при 34-38°C с перемешиванием при 50-150 об/мин.
4. Способ по п. 1, отличающийся тем, что стадию (b) осуществляют путем прекращения культивирования на стадии (а) через 1-3 часа после того, как коэффициент поглощения культуральной жидкости становится постоянным.
5. Способ по п. 1, отличающийся тем, что дополнительное культивирование на стадии (с) осуществляют при 34-38°C с перемешиванием при 50-150 об/мин без регуляции рН.
6. Способ по п. 1, отличающийся тем, что лизирующее средство, используемое на стадии (d), представляет собой дезоксихолат натрия.
7. Способ по п. 1, отличающийся тем, что стадию (d) осуществляют путем добавления лизирующего средства в культуральную жидкость, полученную на стадии (с), для лизиса клеток, затем инкубирования полученного в результате клеточного лизата при 10-20°С в течение 3-24 часов без перемешивания для осаждения белков и удаления осажденных белков и клеточного дебриса посредством центрифугирования.
8. Способ по п. 1, отличающийся тем, что выделение и очистка на стадии (е) включают:
(i) фильтрацию лизата, полученного на стадии (d), с помощью глубинного фильтра;
(ii) концентрирование фильтрата, полученного на стадии (i), с последующей ультрафильтрацией и центрифугированием;
(iii) осуществление реакции надосадочной жидкости, полученной на стадии (ii), с катионным поверхностно-активным веществом, а затем центрифугирование полученного в результате раствора с получением осадка или надосадочной жидкости, содержащих капсульные полисахариды;
(iv) осуществление реакции капсульных полисахаридов, полученных на стадии (iii), с йодидом натрия с последующим центрифугированием для получения, таким образом, надосадочной жидкости;
(v) добавление активированного угля к раствору, полученному на стадии (iv), с последующей фильтрацией и
(vi) концентрирование фильтрата, полученного на стадии (v), с последующей ультрафильтрацией и центрифугированием для получения, таким образом, капсульных полисахаридов.
9. Способ по п. 8, отличающийся тем, что концентрирование на стадии (ii) осуществляют при помощи мембраны с размером пор 100 кДа.
10. Способ по п. 8, отличающийся тем, что концентрирование на стадии (vi) осуществляют при помощи мембраны с размером пор 30 кДа.
11. Способ по п. 8, отличающийся тем, что катионное поверхностно-активное вещество, используемое на стадии (iii), представляет собой бромид цетилтриметиламмония.
12. Способ по п. 11, отличающийся тем, что бромид цетилтриметиламмония используют в концентрации 0,5-3,0%.
13. Способ по п. 8, отличающийся тем, что активированный уголь, используемый на стадии (v), используют в концентрации 1-5% (вес/объем).
| WO 2008118752 A2, 02.10.2008 | |||
| WO 2006110352 A2, 19.10.2006 | |||
| US 20100158953 A1, 24.06.2010 | |||
| LEAL et al | |||
| Паровоз для отопления неспекающейся каменноугольной мелочью | 1916 |
|
SU14A1 |
| US 5847112 A, 08.12.1998 | |||
| US 20080286838 Al, 20.11.2008 | |||
| KR 20100030729 A, 19.03.2010 | |||
| RU 2009112453 A, 20.11.2010. | |||
Авторы
Даты
2017-01-10—Публикация
2013-09-06—Подача