Изобретение относится к медицине, конкретно к фармакологии, неврологии и клеточным технологиям.
Известно большое количество церебропротекторных средств и способов терапии и профилактики поражений головного мозга [1].
Недостатком данных средств является зачастую их недостаточная эффективность [2].
Задачей, решаемой настоящим изобретением, является расширение арсенала высокоэффективных церебропротекторных средств.
Поставленная задача достигается применением гипаконитина в качестве церебропротекторного средства.
Новым в предлагаемом изобретении является использование в качестве церебропротекторного средства гипаконитина.
Используемое оригинальное средство гипаконитина разработано и получено ФГБУ «НИИ фармакологии» СО РАМН (г.Томск) совместно с Национальным исследовательским Иркутским Государственным Техническим Университетом (г.Иркутск) и представляло собой 0,00025% водный раствор данного алкалоида. Гипаконитин извлекался из травы растений семейства лютиковых в виде свободных оснований экстракцией стандартным методом [3].
Фармакологическое действие существующих церебропротекторных средств заключается преимущественно в защите либо стимуляции сохранившихся клеточных элементов [1]. Однако данная концепция фармакологического вмешательства в ряде случаев оказывается абсолютно несостоятельной. Имеющиеся церебропротекторы оказываются не способными зачастую не только полностью восстановить морфофункциональное состояние органа, но и предупреждать развитие прогредиентного характера течения патологического процесса [2].
В связи с этим, безусловно, актуальным представляется разработка принципиально новых церебропротекторных средств с качественно новыми механизмами действия.
Полученные в последние годы сведения о свойствах и закономерностях жизнедеятельности мультипотентных клеток-предшественников взрослого организма открыли возможность развития нового направления в лечении многих заболеваний - с помощью клеточной терапии. При этом наиболее физиологичным и перспективным подходом к решению задач регенеративной медицины является фармакологическая стратегия клеточной терапии, основанная на принципе стимуляции эндогенных стволовых клеток (СК) путем подражания деятельности естественных регуляторных систем их функционирования в организме [4].
В ФГБУ «НИИ фармакологии» СО РАМН показана принципиальная возможность и высокая эффективность фармакологической стратегии клеточной терапии на разных моделях заболеваний, в том числе и при патологических состояниях ЦНС [4].
Важная роль в регенерации тканей принадлежит резидентным прогениторным, в том числе стволовым (СК), клеткам [4, 5]. При этом существует фармакологическая стратегия регенеративной медицины, заключающаяся в стимуляции эндогенных родоначальных элементов [5]. Причем активация последних может являться следствием как прямого воздействия фармакологических агентов на прогениторные элементы, так и результатом стимуляции клеток микроокружения тканей, опосредованно определяющей ускоренное течение репаративных процессов [4, 5].
При этом ранее нами было показано ускорение заживления ран кожи комплексными экстрактами и алкалоидной фракцией живокости высокой [6]. При этом максимальный ранозаживляющий эффект наблюдался при использовании суммы алкалоидов, среди которых доминирующим является элатин [7]. В то же время с помощью метода тонкослойной хроматографии в алкалоидной фракции было установлено содержание других алкалоидов, в том числе гипаконитина. Гипаконитин (C33H45NO10)
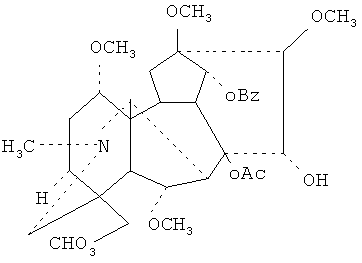
представляет собой гетероциклическое азотсодержащее органическое соединение растительного происхождения. Чаще всего его извлекают из растений рода Аконит, хотя он встречается и в других растениях [6, 8]. Известно, что гипоаконитин, как и некоторые другие алкалоиды аконитиновой группы, обладают анальгетической активностью [9]. В то же время нами было выявлено его стимулирующее влияние в отношении стромальных прогениторных клеток кожи и процессов заживления ран поверхностных тканей при использовании наружно [10].
При этом влияние гипаконитина на процессы регенерации тканей внутренних органов, в том числе пораженной патологическим процессом ЦНС, и возможность осуществления церебропротекции за счет активации механизмов регенерации, связанных со стволовыми клетками (СК) при его применении in vivo, не изучено. Эксперимент показал непредсказуемые результаты.
Факт применения гипоаконитина с достижением нового технического результата, заключающегося в получении выраженных церебропротекторных эффектов, для специалиста является не очевидным.
Новые свойства не вытекают явным образом из уровня техники в данной области и не обнаружены в патентной и научно-технической литературе.
Предлагаемое изобретение может быть использовано в медицине.
Исходя из вышеизложенного, следует считать заявляемое техническое решение соответствующим критериям: «Новизна», «Изобретательский уровень», «Промышленная применимость».
Эксперименты были проведены на 74 беспородных мышах-самцах. Животные получены из питомника отдела экспериментального биомедицинского моделирования ФГБУ «НИИ фармакологии» СО РАМН.
Исследования проводили в соответствии с правилами лабораторной практики (GLP), Приказом МЗСР РФ №708н от 23.08.2010 «Об утверждении правил лабораторной практики», Федеральным Законом от 12 апреля 2010 г. №61-ФЗ «Об обращении лекарственных средств», «Руководством по экспериментальному (доклиническому) изучению новых фармакологических веществ» (Москва, 2005).
Пример 1
Предлагаемое средство получали из травы аконита байкольского и живокости высокой. Надземная часть растений, собранная в период цветения в Иркутской области, измельчалась до размера частиц менее 5 мм, обрабатывалась раствором карбоната натрия и подвергалась непрерывной экстракции хлороформом в течение 5 суток. Хлороформный экстракт упаривали до небольшого объема и тщательно экстрагировали 5% серной кислотой. Кислотную вытяжку подщелачивали карбонатом натрия до рН 9-10 и экстрагировали сначала эфиром. Эфирный экстракт упаривали досуха, растворяли в небольшом количестве эфира и хроматографировали на дезактивированной окиси алюминия в системе гексан-ацетон (90→50%). При этом гипаконитин, дополнительно очищенный перекристаллизацией из смеси тех же растворителей, элюировался после мезаконитина. Вещество растворяли в дистиллированной воде до конечной концентрации 0,00025%.
Пример 2
Фармакологические свойства средства изучали на модели гипоксического поражения ЦНС. Гипоксическое воздействие представляло собой гипоксию гермобъема и моделировалось с использованием гермокамеры [11]. Гермокамера представляла собой стеклянный сосуд с выверенным объемом в 500 мл (±<1,0%) и герметически закрывающейся крышкой. Животных помещали в гермокамеру, после чего ее крышка плотно закрывалась. Мыши находились там до появления предсмертного судорожного припадка или первого агонального вдоха, после чего их извлекали и давали «раздышаться». Для получения выраженной энцефалопатии гипоксическое воздействие моделировалось дважды с интервалом в 48 часов. При этом при использовании гермокамеры 500 мл у животных сразу после гипоксической травмы наблюдается быстрое (в течение 2-3 часов) восстановление всех функций. Функциональные нарушения со стороны центральной нервной системы, вызванные гипоксическим воздействием, оценивались по изменению ориентировочно-исследовательского поведения в открытом поле и сохранности УРПИ [7].
При такой постановке методики в течение 10-15 дней после последней гипоксии мыши, подвергнутые ее воздействию, практически ничем не отличаются от нормальных животных, однако начиная с 14-21 дня у них начинают проявляться нарушения мнестической деятельности, а к концу четвертой недели наблюдается частичная гибель. Оценку состояния животных по сохранности УРПИ проводили через 48 часов, на 7, 14, 21 и 28 дни после выработки рефлекса. Гибель животных учитывалась к 35 дню эксперимента. Результаты оценивались по доле животных с сохранившимся рефлексом и по доле животных погибших к исходу пятой недели после гипоксической травмы. Ориентировочно-исследовательское поведение в открытом поле и выработку УРПИ осуществляли через 1 час после повторной гипоксической травмы.
Экспериментальная установка «открытое поле» представляла собой камеру размером 40×40×20 см с квадратным полом и стенками белого цвета [12]. Ее пол, разделенный на 16 квадратов, имел в каждом квадрате круглое отверстие диаметром 3 см. Сверху камера освещалась электрической лампой накаливания мощностью 100 ватт, расположенной на высоте 1 м от пола. Мышь помещалась в один из ее углов и в течение 3-х минут, раздельно в первую и две последующие минуты, регистрировали количество перемещений с квадрата на квадрат (горизонтальная активность), количество вставаний на задние лапки (вертикальная активность), количество обследований отверстий (норковый рефлекс), количество умываний (груминг) и количество актов дефекации по количеству фекальных шариков (болюсов) и вычислялся коэффициент асимметрии поведения в виде отношения количества горизонтальных перемещений к общей двигательной активности, выраженного в процентах. Результаты первой и двух последующих минут тестирования оценивались раздельно и в сумме.
Методика УРПИ основана на подавлении врожденного рефлекса предпочтения темного пространства, имеющегося у грызунов [12]. Экспериментальная установка представляла собой камеру, состоящую из двух отсеков: большого - освещенного и малого - темного. Животное помещалось в светлый отсек и вскоре (через 10-20 секунд), в силу врожденного рефлекса предпочтения темного пространства, переходило в малый отсек, после чего дверка, соединяющая оба отсека, перекрывалась и на пол темного отсека, состоящего из параллельных чередующихся электродов, подавали электрический ток импульсами продолжительностью 50 мс, частотой 5 Гц и амплитудой 50 мА. Через 10 секунд дверку открывали, и животное могло выскочить в светлый отсек с обычным полом. В результате описанной процедуры у животных вырабатывался условный рефлекс избегания темного пространства. При проверке воспроизводимости рефлекса животных помещали в светлый отсек в угол, противоположный от входа в темный отсек, и наблюдали в течение 3-х минут. Регистрировали время первого захода в темный отсек (латентное время захода), суммарное время пребывания в темном отсеке. Выработанным рефлекс считался, если в течение всех 3-х минут наблюдения животное ни разу не посетило темный отсек или латентное время захода превышало 150 с. О качестве рефлекса судили по доле животных с наличием рефлекса. Дополнительными показателями, характеризующими условно-рефлекторную деятельность и поведенческий статус служили количество дефекаций, груминг, количество обследований входа в темный отсек, время пребывания в светлом отсеке, количество заходов в темный отсек и время пребывания в темном отсеке. Животные, которые после помещения в светлый отсек сохраняли неподвижность и не приближались ко входу в темный отсек, при подсчете результатов не учитывались.
С целью изучения механизмов действия препарата с помощью метода клонирования in vitro на 5-е сутки после гипоксического воздействия изучали его влияние на содержание нейральных СК в паравентрикулярной области головного мозга животных, перенесших гипоксию [13].
Для изучения церебропротекторных свойств средство в дозе 0,2 мл вводили перорально в виде 0,00025% раствора по двум схемам: 1) ежедневно, начиная за 4 дня до гипоксического воздействия, и 5-й раз за 1 час перед гипоксией; 2) 1 раз в сутки в течение 5 дней после моделирования патологического состояния. Указанные схемы введения позволяют оценивать церебропротекторное, антигипоксическое и ноотропное действие фармакологических веществ [14].
В качестве препарата сравнения использовали Г-КСФ (Нейпоген, «Hoffman-la Roche», Швейцария), который вводили подкожно в дозе 125 мкг/кг по аналогичным схемам. Данное средство является наиболее близким по технической сущности достигаемого результата. Оно обладает выраженным церебропротекторным действием, определяемым стимуляцией механизмов регенерации «глубокого резерва», связанных с СК [11], однако является достаточно токсичным [4], что делает маловероятным его применение в эффективных режимах в клинике по данным показаниям.
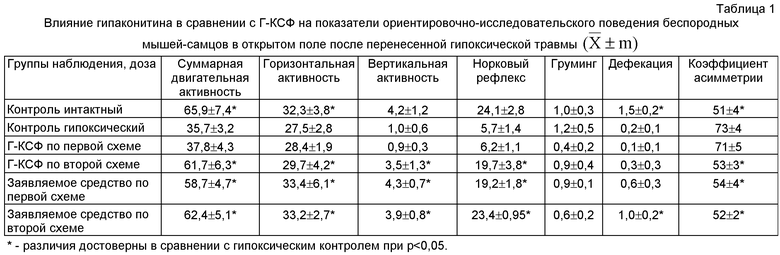
Проведенные исследования показали (табл.1, 2) что перенесенная гипоксия вызывала снижение ориентировочно-исследовательского поведения в открытом поле со сдвигом коэффициента асимметрии поведения. В группе гипоксического контроля отмечалось увеличение латентного времени захода в темную камеру при выработке рефлекса, что свидетельствует о нарушении ориентировочного рефлекса. Применение заявляемого средства по обеим схемам приводило к нормализации ориентировочно-исследовательского поведения в открытом поле, в то время как Г-КСФ был эффективен лишь при 2 схеме введения (табл.1).
Проявления постгипоксической энцефалопатии у животных гипоксического контроля при регистрации мнестических функций (УРПИ) начались с 14 суток, прогрессивно нарастая к 28 дню, при этом в этой группе отмечалась гибель 65% животных. Применение гипоконитина оказало защитное действие на животных. Имело место повышение уровня воспроизводимости рефлекса и предотвращение гибели животных. При этом использование препарата сравнения сопровождалось развитием терапевтических эффектов только при его введении после моделирования патологического состояния (табл.2).
Исследование механизмов церебропротекторного действия данного средства выявило его значительное стимулирующее влияние в отношении регионарных нейральных клеток-предшественников паравентрикулярной области головного мозга, что проявлялось в значительном увеличении их количества (табл.3).
Исходя из представленных результатов следует, что гипаконитин обладает выраженной церебропротекторной активностью, определяемой активацией нейральных СК головного мозга, очевидно, за счет как прямого действия на них алкалоида, так и в результате возрастания фидерной способности клеточных элементов микроокружения в отношении родоначальных клеток [5, 10].

Цитируемая литература
1. Машковский М.Д. Лекарственные средства, 15-е изд. - М.: 00 «Изд-во Новая Волна», 2008. - 1206 с.
2. Алексеева Г.В., Гурвич A.M., Семченко В.В. Постреанимационная энцефалопатия (патогенез, клиника, профилактика и лечение). - Омск: Омская областная типография, 2003. - 152 с.
3. Погодаева Н.Н., Жапова Ц., Верещагин А.Л., Горшков А.Г., Семенов А.А. Изучение алкалоидного состава некоторых видов сибирских аконитов // Раст. ресурсы, вып.2, 2000 г., с.79-84.
4. Дыгай A.M., Зюзьков Г.Н. Фундаментальные аспекты перспективы использования нанотехнологичных модификаторов функций стволовых клеток в регенеративной медицине // Нанотехнологии и охрана здоровья. - 2012. - Том IV. - №2 (11). - С.30-38.
5. Дыгай A.M., Зюзьков Г.Н., Жданов В.В. и др. Иммобилизированный гранулоцитарный колониестимулирующий фактор. Фармакологические свойства и перспективы использования. - Томск: Изд-во: ООО «Печатная мануфактура», 2011. - 149 с.
6. Нестерова Ю.В., Поветьева Т.Н., Нагорняк Ю.Г., Перова А.В., Андреева Т.И., Рослякова Е.П., Суслов Н.И. Механизмы влияния комплексных и выделенных веществ на репаративную активность тканей в эксперименте // Экспериментальная и клиническая фармакология. - 2009. - Т.72, №3. - С.40-43.
7. Муравьева Д.А., Самылина И.А., Яковлев Г.П. Фармакогнозия: Учебник, 3-е изд. М.: Медицина, 2002.
8. Осадчий С.А., Ганбаатар Ж., Шульц Э.Э., Толстиков Г.А. Алкалоиды сибирских видов живокости и аконита и их превращения // Материалы Первой Международной конференции "Химия и биологическая активность азотистых гетероциклов и алкалоидов" (том 1) Москва, 9-12 октября 2001 г.
9. Алефиров А.Н. Борец за жизнь. Аконит / А.Н. Алефиров. - СПб.: ИД «Весь», 2002. - 192 с.
10. Зюзьков Г.Н., Крапивин А.В., Нестерова Ю.В., Поветьева Т.Н., Жданов В.В., Суслов Н.И., Фомина Т.И., Удут Е.В., Мирошниченко Л.А., Симанина Е.В., Семенов А.А., Кравцова С.С., Дыгай A.M. Механизмы регенераторного действия дитерпеновых алкалоидов аконита байкальского // Бюл. эксперим. биол. и медицины, 2012. - №6. - С.823-827.
11. Патент (RU) на изобретение №2240604 «Способ моделирования постгипоксической энцефалопатии и связанных с ней нарушений в системе крови», 2004 г.(опубл. 20.11.2004 г., Бюл. №32). Авторы: Гольдберг Е.Д., Дыгай A.M., Зюзьков Г.Н., Суслов Н.И.
12. Буреш Я., Бурешова О., Хьюстон Дж. П. Методики и основные эксперименты по изучению мозга и поведения. / Пер. с англ. Под ред проф. А.С.Батуева). - М.: Высшая школа, 1991. - 398 с.
13. Патент (RU) на изобретение №2284060 «Способ экспериментальной терапии энцефалопатии», 2006 г. (опубл. 20.09.2006 г., Бюл. №26). Авторы: Гольдберг Е.Д., Дыгай A.M., Зюзьков Г.Н., Жданов В.В., Суслов Н.И.
14. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ / Под ред Р.У. Хабриева. - 2-е изд. - М.: ОАО «Изд-во «Медицина», 2005. - С.54-69.
| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДСТВО, ОБЛАДАЮЩЕЕ ЦЕРЕБРОПРОТЕКТОРНОЙ АКТИВНОСТЬЮ | 2012 |
|
RU2501562C1 |
| ЦЕРЕБРОПРОТЕКТОРНОЕ СРЕДСТВО | 2012 |
|
RU2497540C1 |
| СРЕДСТВА, СТИМУЛИРУЮЩИЕ РЕГЕНЕРАЦИЮ ТКАНЕЙ | 2013 |
|
RU2599289C2 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ ГЕМОСТИМУЛИРУЮЩИМ, АНТИМУТАГЕННЫМ, ПРОТИВООПУХОЛЕВЫМ, ЦЕРЕБРОПРОТЕКТОРНЫМ, АНТИГИПОКСИЧЕСКИМ, НООТРОПНЫМ, АНКСИОЛИТИЧЕСКИМ И ПРОТИВОНЕВРОТИЧЕСКИМ ДЕЙСТВИЕМ | 2010 |
|
RU2438691C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ РЕГЕНЕРАТИВНОЙ АКТИВНОСТЬЮ | 2011 |
|
RU2480236C1 |
| СПОСОБ ЭКСПЕРИМЕНТАЛЬНОЙ ТЕРАПИИ ЭНЦЕФАЛОПАТИИ | 2004 |
|
RU2284060C1 |
| СРЕДСТВО ДЛЯ РЕГЕНЕРАТИВНОЙ МЕДИЦИНЫ | 2009 |
|
RU2406528C2 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ РАНОЗАЖИВЛЯЮЩЕЙ АКТИВНОСТЬЮ | 2012 |
|
RU2481836C1 |
| АНТИГИПОКСИЧЕСКОЕ СРЕДСТВО | 1996 |
|
RU2121357C1 |
| АКТИВНЫЙ КОМПОНЕНТ ЛЕКАРСТВЕННОГО СРЕДСТВА С ЦЕРЕБРОПРОТЕКТОРНОЙ, АНТИГИПОКСИЧЕСКОЙ И АНТИАМНЕСТИЧЕСКОЙ АКТИВНОСТЬЮ ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ НЕЙРОДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЙ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2023 |
|
RU2821508C1 |
Предложено применение гипаконитина (гетероциклического азотсодержащего органического соединения, извлекаемого из растений рода Аконит семейства лютиковых с известной ранее анальгетической активностью) в качестве церебропротекторного средства. Показано предотвращение гибели животных после перенесенной гипоксии. Механизмом действия средства является активация нейральных стволовых клеток головного мозга. Изобретение может найти применение в медицине, конкретно в фармакологии, неврологии и клеточных технологиях. 3 табл.
Применение гипаконитина в качестве церебропротекторного средства.
| СБОР ДЛЯ ЛЕЧЕНИЯ БОЛЬНЫХ С ТРОМБООККЛЮЗИРУЮЩИМИ ПОРАЖЕНИЯМИ АРТЕРИЙ ГОЛОВЫ И ШЕИ | 2006 |
|
RU2313359C1 |
| СПОСОБ ВЫРАБОТКИ КОНСЕРВОВ "КОТЛЕТЫ РЫБООВОЩНЫЕ В ТОМАТНО-ГАРНИРНОМ СОУСЕ" | 2011 |
|
RU2474314C1 |
| НЕСТЕРОВА Ю.В | |||
| и др | |||
| Антидепрессантная активность дитерпеновых алкалоидов аконита байкальского | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| CHAN TY | |||
| Aconite poisoning. | |||
Авторы
Даты
2014-05-27—Публикация
2013-03-12—Подача