Область техники
Настоящее изобретение относится к медицине и биологии, а более точно - к способу определения пространственно-временного распределения активности протеолитического фермента в гетерогенной системе, устройству для реализации указанного способа и способу диагностики нарушений системы гемостаза по изменению пространственно-временного распределения активности ферментов свертывания крови.
Изобретение может быть использовано в медицине, в частности, для диагностических и исследовательских целей для определения характеристик свертываемости крови и ее компонентов, а также в биотехнологии и в фундаментальных биологических исследованиях.
Предшествующий уровень техники
В настоящее время существует большая проблема исследования динамики сложных биологических систем и происходящих в них процессов, где есть пространственная неоднородность. К таким процессам относятся, в частности, процессы свертывания крови, комплемент, апоптоз, пищеварение, фибринолиз, где ключевую роль играют протеолитические ферменты.
Можно измерить концентрацию этих протеолитических ферментов, если эта величина фиксирована, т.е. она неизменна во времени и одинакова во всех точках исследуемого образца, с помощью специфического флуорогенного субстрата или хромогенного субстрата. В настоящее время появились способы измерения изменения концентрации во времени. Для определения нарушения свертывания крови сейчас используется тест генерации тромбина в плазме, раскрытый в основополагающей работе Hemker H.C., Wielders S., Kessels H., Béguin S. Continuous registration of thrombin generation in plasma, its use for the determination of the thrombin potential. J. Thromb. Haemost. 1993, Oct. 18;70(4):617-24. Он продемонстрировал много преимуществ по сравнению с традиционными тестами свертывания, но является пространственно однородным, т.е. исследуется гомогенная среда. Это не соответствует ситуации в организме.
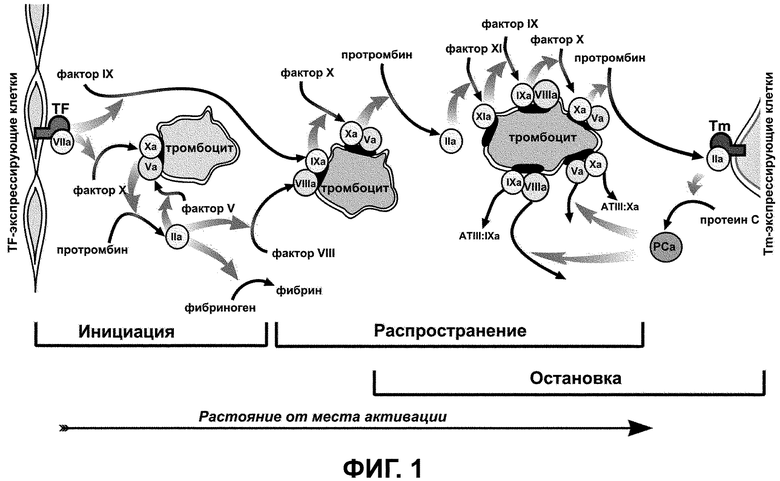
На фиг. 1 схематически представлена пространственная концепция регуляции свертывания крови. Свертывание активируется клетками, экспрессирующими трансмембранный белок тканевый фактор, неферментный кофактор, являющийся фактором свертывания (слева), и распространяется вглубь плазмы. Генерация тромбина регулируется активированным фактором X (фактором Ха, сериновой протеиназой) - лимитирующим компонентом протромбиназы. Свертывание около активатора (фаза инициации) определяется исключительно производством фактора Ха внешней теназой - комплексом тканевого фактора и сериновой протеиназы фактора VIIa. Однако фактор Ха быстро ингибируется и не может диффундировать далеко от активатора. Поэтому в фазе распространения сгустка он образуется внутренней теназой. Лимитирующий компонент внутренней теназы, фактор свертывания IХа, производится внешней теназой. В отличие от фактора Ха он ингибируется медленно и поэтому диффундирует далеко. При дальнейшем увеличении сгустка дополнительный фактор IХа производится фактором ХIа, который в свою очередь производится тромбином в петле положительной обратной связи. Формирование сгустка останавливается вследствие действия тромбомодулина: петля отрицательной обратной связи активирует протеин С, который останавливает распространение тромбина, разрушая факторы Vа и VIIIа (см. Panteleev MA, Ovanesov MV, Kireev DA, Shibeko AM, Sinauridze EI, Ananyeva NM, Butylin AA, Saenko EL, Ataullakhanov FI. Spatial propagation and localization of blood coagulation are regulated by intrinsic and protein C pathways, respectively. Biophys J. 2006 Mar 1;90(5):1489-500). Несмотря на то что отдельные детали этой концепции могут уточняться, ключевая роль процессов диффузии и пространственной неоднородности в свертывании не вызывает сомнений (Hoffman M, Monroe DM 3rd. A cell-based model of hemostasis. Thromb. Haemost. 2001 Jun;85(6):958-65).
Тромбин - главный фермент системы свертывания крови. Он катализирует основную реакцию - превращение фибриногена в фибрин. Кроме того, именно тромбин активирует факторы свертывания V, VIII, VII, XI, XIII, протеин С, тромбоциты, тромбин-активируемый ингибитор фибринолиза. Тромбина при свертывании образуется в 10-100 раз больше, чем остальных протеиназ, что облегчает его детекцию. Протеиназы (протеазы), называемые также протеолитическими ферментами, - это ферменты класса гидролаз, расщепляющие пептидные связи в белках и пептидах.
В реакции, катализируемой тромбином, фибриноген превращается в фибрин, который полимеризуется и тем самым желирует плазму крови.
Исследования свертывания крови представляют большой практический интерес, поскольку не только позволяют диагностировать отдельные заболевания, но и оценивать активность препаратов, влияющих на параметры свертывания крови.
Появление хромогенных, а затем и флуорогенных субстратов позволило ускорить изучение свертывания крови. Такой синтетический субстрат представляет собой молекулу, которая распознается и разрезается протеолитическим ферментом. Разрез ведет к отщеплению от субстрата сигнальной молекулы, также называемой меткой. Метка либо меняет оптическую плотность раствора (хромогенный или окрашивающий субстрат), либо способна флуоресцировать при освещении (флуорогенный субстрат), либо способна спонтанно испускать свет без внешнего возбуждения (хемилюминесцирующая метка). Субстраты для тромбина можно добавлять непосредственно в плазму и записывать сигнал (оптическую плотность или интенсивность света), получающийся при свертывании. Скорость увеличения сигнала пропорциональна концентрации тромбина. Зависимость тромбина от времени получается из экспериментальной зависимости сигнала от времени путем простого дифференцирования и вычисления концентрации тромбина из скорости расщепления субстрата с помощью калибровочной кривой, полученной путем добавления в буфер или исследуемую плазму известных концентраций тромбина или иного калибратора (например, комплекса тромбина и альфа2-макроглобулина).
Известны различные способы и устройства для определения параметров свертывания крови in vitro. Однако все известные способы и устройства предназначены для работы с гомогенными системами, в которых образец крови или плазмы равномерно перемешан с активатором, что существенно отличает данные системы от системы in vivo, являющейся сложной гетерогенной средой.
В существующих модельных системах in vitro условия протекания процесса свертывания принципиально отличаются от тех условий, в которых сгусток образуется в живом организме. Известно, что в кровеносной системе человека и животных сгусток образуется не во всем объеме плазмы крови, а строго локально, т.е. в небольшой области повреждения стенки кровеносного сосуда. Свертывание в организме протекает неоднородно. Формирование сгустка происходит в пространстве. Оно запускается внешней теназой на поврежденной стенке сосуда, распространяется с участием протромбиназы на активированных тромбоцитах в объеме плазмы и тормозится реакциями с участием тромбомодулина на здоровом эндотелии. При этом факторы свертывания закономерным образом распределяются в небольшом объеме плазмы, и в нем образуется тромб. Это отражает основные защитные механизмы системы гемостаза - поддержание целостности кровеносного русла за счет образования тромба в месте повреждения. Адекватно изучить эти процессы с помощью способов, проводимых в гомогенной среде, невозможно.
Таким образом, в настоящее время существует проблема экспериментального моделирования свертывания крови in vitro, в которой желательно наиболее полно смоделировать ту пространственную ситуацию, в которой кровь свертывается непосредственно в кровеносном сосуде. Она существует как для фундаментальных исследований тромбоза и гемостаза, так и для прикладных диагностических и фармакологических задач.
Задача определения изменения концентрации протеолитических ферментов во времени и пространстве, т.е. в различных точках в объеме исследуемого образца, до сих пор не решена.
В последнее время стали использоваться приборы, позволяющие учитывать пространственную неоднородность и диффузию факторов свертывания. В этих приборах свертывание происходит в кювете, содержащей рекальцифицированную плазму. В качестве активатора используется поверхность с иммобилизованным активатором свертывания, например тканевым фактором. При контакте с плазмой начинается свертывание, которое затем распространяется вглубь плазмы и которое можно наблюдать по светорассеянию от растущего сгустка.
Известно устройство для исследования характеристик свертываемости крови и ее компонентов (см., например, RU 2395812), содержащее термостатируемую, заполненную жидкостью камеру с окном, в которую помещена кювета удлиненной формы с исследуемым образцом плазмы и активатором свертывания, в качестве которого используется тромбопластин (тканевый фактор свертывания), нанесенный на вставку, которую вставляют в кювету, светодиоды для освещения содержимого кюветы и образующийся у активатора сгусток, цифровую камеру, размещенную напротив окна и фиксирующую растущий сгусток, и компьютер для обработки полученных данных. Кювета размещена в держателе, продольная ось которого расположена под углом 20-40º к вертикали, а стенки кюветы прозрачны для облучающего света. В боковой стенке камеры выполнено окно для съемки.
Устройство работает следующим образом. После того как температура по всему объему плазмы установится одинаковой и конвекционные потоки в плазме прекратятся, в нее медленно погружают вставку, чтобы вещество, способствующее свертыванию и нанесенное на торец вставки, коснулось поверхности плазмы. Одновременно включают цифровую камеру, связанную с компьютером. В камеру через прозрачное окно и объектив начинают поступать изображения растущего у конца вставки тромба. При этом компьютер управляет по программе блоком синхронизации, сигналы с которого через заданные интервалы времени поступают на шторку, открывая ее, и на светодиоды, которые включаются лишь на то время, когда шторка открыта и осуществляется процесс съемки. Минимальное время засветки плазмы не позволяет плазме нагреться и тем самым уменьшает конвекционные потоки.
Указанное устройство позволяет реализовать способ, в котором регистрируется только процесс образования фибринового сгустка, являющегося конечным продуктом работы системы свертывания.
Способ не обеспечивает возможность регистрации процесса образования и пространственного распределения отдельных факторов свертывания, например IIa, Xa, VIIa, XIa, которые регулируют процесс пространственного роста фибринового сгустка.
Использование водяного термостата приводит к усложнению конструкции кюветы, поскольку канал кюветы должен быть длинным для полного погружения части кюветы с исследуемым образцом в воду, что вызывает проблемы при заполнении кюветы, поскольку образец плохо затекает в глубокий узкий канал, и к усложнению конструкции устройства.
При нагреве исследуемых образцов происходит образование пузырьков газа в области регистрации, которые искажают сигнал светорассеяния от фибринового сгустка.
Регистрация изображения при использовании водяного термостата осуществляется сквозь слой термостатируемой жидкости, омывающей кювету, в котором могут находиться движущиеся пузырьки воздуха и другие включения, искажающие полученные данные.
Наличие источников освещения только одной длины волны, например красного света, не позволяет исследовать пространственно-временное распределение флуоресцирующих веществ.
Известны также способ и устройство для мониторинга пространственного образования фибринового сгустка (см., например, заявку РСТ/СН2007/000543 от 2.11.2007 (номер публикации WO 2009/055940).
Устройство представляет собой блок кювет, предназначенных для фотометрического анализа, вставку и активатор, причем кювета разделена на несколько лунок разделительными стенками для одновременного проведения нескольких анализов. Активатор свертывания расположен на нижней грани вставки. Активатор свертывания является физиологическим активатором, например тканевым фактором, или нефизиологическим активатором, например стеклом. Лунки выполнены плоскопараллельными и/или прямоугольной формы в поперечном сечении, размещены в одну линию и имеют одинаковый объем. Кювета выполнена из пропускающего свет полистирола.
Держатель кюветы содержит термостат для термической стабилизации кюветы и приспособления для удерживания кюветы в термостате вдоль оптического пути. Термостат заполнен жидкостью, которая по меньшей мере частично прозрачна, причем жидкость также находится в пределах оптического пути. Держатель кюветы выполнен так, что кювета располагается перпендикулярно оптическому пути и наклонена по отношению к вертикали предпочтительно на 10-40º.
Способ мониторинга образования и/или лизирования фибринового сгустка in vitro содержит следующие шаги:
при образовании сгустка:
помещают в кювету один или более образцов плазмы крови в соответствии с количеством лунок,
вводят в кювету вставку с активатором и обеспечивают соприкосновение плазмы с активатором свертывания и
регистрируют рост фибринового сгустка как функцию времени;
при лизировании сгустка:
помещают в кювету один или более образцов плазмы крови, содержащих один или более фибриновых сгустков,
обеспечивают соприкосновение плазмы с активатором фибринолиза и
регистрируют лизис фибринового сгустка как функцию времени.
При осуществлении мониторинга поддерживают температуру предпочтительно при 37ºС. Принципиальное преимущество указанного способа и устройства для мониторинга пространственного образования фибринового сгустка состоит в малом объеме требуемой плазмы. С небольшим количеством, как 20 мкл (вместо от 300 до 1500 мкл, т.е. в 75 раз меньше, чем в других похожих системах и в 5 раз меньше, чем минимальное количество плазмы, требуемой для стандартных тестов свертывания), могут быть получены достоверные результаты высокого разрешения.
Исследуемые образцы быстро заливаются в кювету, загрузка образцов требует не более 1-2 минут. Экспериментальное время составляет 25-30 минут, изображения регистрируются каждые 10 секунд. Нормальная схема образования фибринового сгустка включает в себя время задержки 2-5 минут, в течение которого видимого свертывания не наблюдается, причем время задержки зависит от типа активатора. Последующее образование и распространение фибринового сгустка в объем плазмы осуществляется со скоростью 30-40 мкм/мин. При патологии время задержки может быть увеличено или укорочено. При патологии скорость роста сгустка может быть увеличена или снижена. Кроме того, в случае прокоагулянтных изменений в плазме в кювете может наблюдаться спонтанное, не зависящее от активатора свертывание.
Указанное устройство позволяет реализовать способ, в котором регистрируется только процесс образования фибринового сгустка, являющегося конечным продуктом работы системы свертывания.
Способ не обеспечивает возможность регистрации процесса образования и пространственного распределения отдельных факторов свертывания, например IIa, Xa, VIIa, XIa, которые регулируют процесс пространственного роста фибринового сгустка.
При нагреве исследуемых образцов происходит образование пузырьков газа в области регистрации, которые искажают сигнал светорассеяния от фибринового сгустка.
Наличие источников освещения только одной длины волны, например красного света, не позволяет исследовать пространственно-временное распределение флуоресцентных веществ.
Наиболее близким к заявленному способу и устройству можно рассматривать устройство и способ, раскрытые в статье Кондратовича А.Ю., Похилко А.В. и Атауллаханова Ф.И. Пространственно-временная динамика факторов контактной активации коагуляции крови. 2002 год (Kondratovich AY, Pokhilko AV, Ataullakhanov FI. Spatiotemporal dynamics of contact activation factors of blood coagulation. Biochim Biophys Acta. 2002 Jan 15; 1569(1-3):86-104).
Способ осуществляется следующим образом. Для эксперимента используют бедную тромбоцитами плазму, которую сохраняют в стерильных условиях при комнатной температуре не более трех дней. Определение распределения фактора XIa, калликреина и тромбина исследуемого образца плазмы осуществляют, регистрируя излучение в синей области спектра 7-амино-4-метилкумарина (АМС), образующегося в результате расщепления флуорогенных субстратов, специфичных для данных факторов.
До эксперимента к каждому исследуемому образцу плазмы добавлялся субстрат и образец перемешивался при 37°С в течение 20 минут, рН среды поддерживался равным 7,4 при указанной температуре.
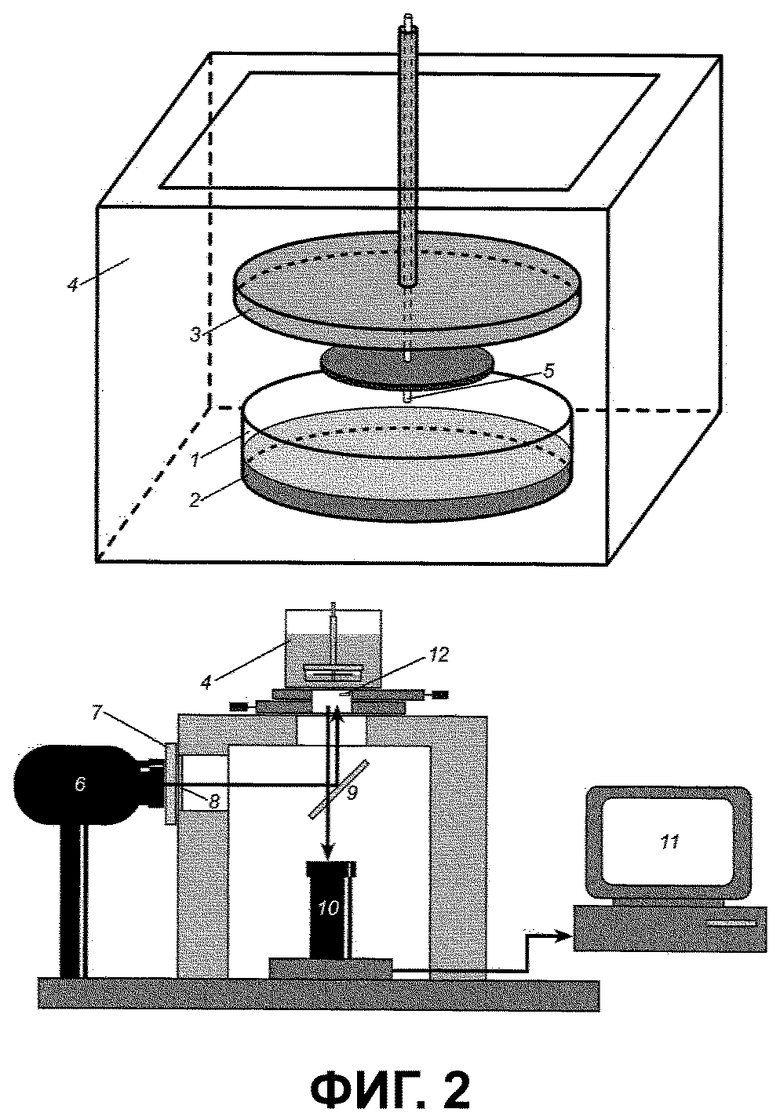
На фиг.2 схематично показано устройство, используемое для реализации способа. Устройство содержит чашку Петри 1, изготовленную из полистирола, снабженную непрозрачной крышкой 3 и водяной рубашкой 4. В чашку Петри помещают плазму 2, в которую добавлен субстрат. Активатором коагуляции служит конец 5 стеклянной капиллярной трубки. Устройство содержит также ртутную лампу 6, водный фильтр 7, блокирующий тепло, стеклянный фильтр 8, полупрозрачное зеркало 9, цифровую камеру 10, компьютер 11, флуоресцентную пластиковую наклейку 12.
Образование факторов свертывания изучалось в двумерной (плоской) среде, т.е. в тонком слое неперемешанной плазмы. Чашка Петри из полистирола является сама по себе слабым активатором, ее заполняли 2 мл рН-стабилизированной плазмы с добавленным в нее субстратом. Стабилизация pH осуществлялась посредством инкубации с молочной кислотой и доступом воздуха. Чашку плотно закрывали непрозрачной крышкой, имеющей отверстие в центре, через которое проходит активатор в виде стеклянной капиллярной трубки 1,3 мм диаметром, нижний конец которой запаян. Диск из полистирола плотно надевался на трубку под прямым углом к оси. При сборке конец трубки не касался поверхности плазмы, а диск находился под крышкой. Чашку помещали в водяную рубашку при температуре 37°С, выдерживали 5 минут и быстро опускали активатор, чтобы конец трубки погрузился в плазму. Плазма образовывала горизонтальный слой толщиной 2 мм между дном чашки и полистироловым диском. Область контакта стекла с плазмой составляла 8,2 кв.мм.
Фактор коагуляции, активируемый контактом со стеклом, расщеплял субстрат, что приводило к образованию АМС. Флуоресценцию АМС записывали следующим образом. Образец плазмы освещали излучением ртутной лампы, отраженным от полупрозрачного зеркала. Фильтры блокировали видимую часть спектра. Флуоресценция АМС записывалась цифровой камерой, установленной позади полупрозрачного зеркала. Записанное поле обзора составило 9×6,5 мм. Синий канал RGB выходного сигнала камеры охватывал весь диапазон флуоресценции АМС. Данные изображения непрерывно передавались в компьютер и отображались на мониторе, а также сохранялись с заданными интервалами. Кусочек флуоресцирующего пластика был закреплен под водяной рубашкой, чтобы его изображение было всегда в поле зрения камеры, оно использовалось для калибровок и учета колебаний в освещении.
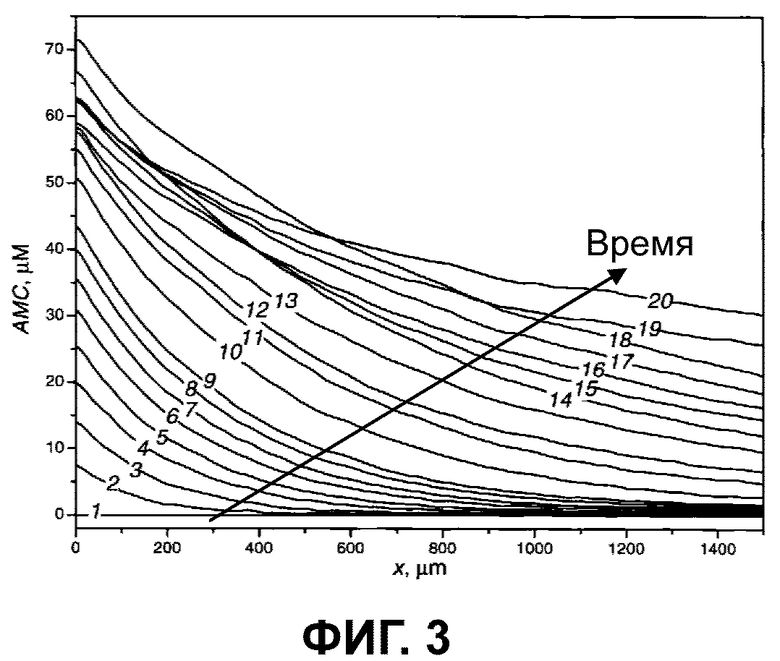
При анализе изображений выбирали радиальный луч с началом в центре активатора. При помощи специального программного обеспечения определялось пространственно-временное распределение концентрации АМС вдоль этого луча (фиг. 3), а на его основе восстанавливалось пространственно-временное распределение концентрации фактора свертывания.
К недостаткам указанного способа можно отнести возможность измерения только факторов контактной активации (а именно, факторов XIa, XIIa, калликреина), с плохой возможностью различения между вкладами этих факторов в сигнал, без возможности измерения пространственной динамики процесса свертывания, т.е. образования фибринового сгустка.
К недостаткам устройства можно отнести: использование водяного термостата, что приводит к усложнению конструкции устройства; неудобство используемой кюветы для высокопроизводительных исследований; использование нестабильного освещения с помощью флуоресцентной лампы, не позволяющего производить точные измерения.
При нагреве исследуемых образцов происходит образование пузырьков газа в области регистрации процесса, которые искажают сигнал флуоресценции.
Устройство обеспечивает возможность освещать образец излучением только одной длины волны.
Предложенный способ не позволяет моделировать системы in vitro, приближенные по своим физиологическим свойствам к системам in vivo, а также проводить более точную диагностику нарушений в системе свертывания крови.
Указанный способ не позволяет полноценно исследовать пространственную кинетику факторов свертывания, в первую очередь тромбина, в процессе роста фибринового сгустка, а также не обеспечивает возможность оценки роли фактора свертывания в различных фазах процесса свертывания крови в гетерогенной системе.
Краткое изложение существа изобретения
Задачей настоящего изобретения является создание способа определения пространственно-временного распределения активности протеолитического фермента в гетерогенной системе, который может быть использован для решения широкого круга фундаментальных и прикладных задач по исследованию пространственно неоднородных и нестационарных биологических систем, в частности: позволит получить более точную информацию о механизме работы системы свертывания крови, исследовать пространственную кинетику факторов свертывания в процессе роста фибринового сгустка и оценить роли факторов свертывания в различных фазах процесса свертывания крови в гетерогенной системе.
Задачей настоящего изобретения является создание устройства для реализации указанного способа, которое позволит приблизить условия пространственно-временного распределения активности протеолитического фермента в условиях in vitro, т.е. в эксперименте, к условиям in vivo, т.е. к условиям в живом организме.
Еще одной задачей настоящего изобретения является создание способа диагностики нарушений системы гемостаза по изменению пространственно-временного распределения активности протеолитического фермента в гетерогенной системе.
Поставленная задача решена путем создания способа определения пространственно-временного распределения активности протеолитического фермента в гетерогенной системе, в котором:
обеспечивают систему in vitro, которая содержит образец исследуемой среды, выбранной из группы, состоящей из плазмы крови, цельной крови, воды, лимфы, коллоидного раствора, кристаллоидного раствора или геля, и протеолитический фермент или его предшественник, который распределен в образце исследуемой среды,
погружают в систему in vitro флуорогенный субстрат,
обеспечивают одинаковую температуру по всему объему системы in vitro,
поддерживают давление в системе in vitro,
при взаимодействии протеолитического фермента с флуорогенным субстратом происходит расщепление субстрата с отделением от него флуорофора,
облучают образец исследуемой среды в заданные моменты времени возбуждающим излучением для возбуждения свечения флуорофора, образовавшегося в результате расщепления флуорогенного субстрата протеолитическим ферментом,
в заданные моменты времени одновременно с облучением регистрируют фотокамерой пространственное распределение излучения флуорофора в образце, тем самым определяя пространственное распределение флуорофора в образце,
в заданные моменты времени освещают образец исследуемой среды и регистрируют фотокамерой оптические характеристики исследуемого образца, выбранные из группы, состоящей из пространственного распределения светорассеяния, пространственного распределения светопропускания в образце или их комбинации,
из распределения интенсивности флуоресценции флуорофора получают пространственно-временное распределение активности протеолитического фермента путем решения обратной задачи типа «реакция-диффузия-конвекция» с учетом связывания флуорофора в среде с компонентами среды и искажения флуоресценции компонентами среды.
Предпочтительно в систему in vitro помещают активирующий агент, который вызывает изменение в пространственно-временном распределении активности протеолитического фермента.
Предпочтительно в качестве активирующего агента используют агент, выбранный из группы, состоящей из иммобилизированного на поверхности тканевого фактора, растворимого тканевого фактора, тканевого активатора плазминогена, клеток, обеспечивающих возможность экспрессии тканевого фактора, образцов тканей организма, стекла или пластика.
Возможно, что исследуемый протеолитический фермент образуется в исследуемой среде из своего предшественника в результате протекания биохимических процессов.
Возможно также, что исследуемый протеолитический фермент постепенно разрушается в исследуемой среде в результате протекающих в среде биохимических процессов.
Предпочтительно регистрацию распределения светорассеяния и излучения флуорофора в образце среды осуществляют посредством конфокальной микроскопии, обеспечивающей перефокусировку оптической системы и системы освещения/облучения в заданные моменты времени.
Предпочтительно визуализируют пространственное распределение флуорофора и образовавшегося сгустка в заданные моменты времени.
Предпочтительно регистрируют светорассеяние от образца среды по методу темного поля.
Предпочтительно регистрируют излучение флуорофора методом флуоресцентной микроскопии.
Поставленная задача решена также путем создания способа определения пространственно-временного распределения активности протеолитического фермента в гетерогенной системе, в котором
обеспечивают систему in vitro, которая содержит образец исследуемой среды, выбранной из группы, состоящей из плазмы крови, цельной крови, воды, лимфы, коллоидного раствора, кристаллоидного раствора или геля, и протеолитический фермент или его предшественник, который распределен в образце исследуемой среды,
погружают в систему in vitro хромогенный субстрат,
при взаимодействии протеолитического фермента с хромогенным субстратом происходит расщепление субстрата с отделением от него хромофора,
в заданные моменты освещают образец исследуемой среды светом на длине волны, где поглощение света хромофором значительно,
в заданные моменты времени регистрируют изменение пространственного распределения цвета среды,
по изменению пространственного распределения цвета в образце определяют пространственное распределение хромофора в образце,
в заданные моменты времени освещают образец исследуемой среды и регистрируют фотокамерой оптические характеристики исследуемого образца, выбранные из группы, состоящей из пространственного распределения светорассеяния, пространственного распределения светопропускания в образце или их комбинации,
из этого распределения хромофора получают пространственно-временное распределение активности протеолитического фермента путем решения обратной задачи типа «реакция-диффузия-конвекция» с учетом связывания хромофора в среде с компонентами среды и искажения светопоглощения компонентами среды.
Поставленная задача решена также путем создания способа определения пространственно-временного распределения активности протеолитического фермента в гетерогенной системе, в котором
обеспечивают систему in vitro, которая содержит образец исследуемой среды, выбранной из группы, состоящей из плазмы крови, цельной крови, воды, лимфы, коллоидного раствора, кристаллоидного раствора или геля, и протеолитический фермент или его предшественник, который распределен в образце исследуемой среды,
погружают в систему in vitro субстрат, который при взаимодействии с протеолитическим ферментом расщепляется с образованием продукта, обладающего хемолюминесценцией,
в заданные моменты времени регистрируют пространственное распределение интенсивности люминесценции в образце,
в заданные моменты времени освещают образец исследуемой среды и регистрируют фотокамерой оптические характеристики исследуемого образца, выбранные из группы, состоящей из пространственного распределения светорассеяния, пространственного распределения светопропускания в образце или их комбинации,
из этого распределения получают пространственно-временное распределение активности протеолитического фермента путем решения обратной задачи типа «реакция - диффузия - конвекция» с учетом связывания люминофора в среде.
Поставленная задача решена также путем создания способа определения пространственно-временного распределения активности протеолитического фермента в гетерогенной системе, в котором
обеспечивают систему in vitro, которая содержит образец исследуемой среды, выбранной из группы, состоящей из плазмы крови, цельной крови, воды, лимфы, коллоидного раствора, кристаллоидного раствора или геля, и протеолитический фермент или его предшественник, который распределен в образце исследуемой среды,
погружают в систему in vitro флуорогенный субстрат,
при взаимодействии протеолитического фермента с флуорогенным субстратом происходит расщепление субстрата с отделением от него флуорофора,
в заданные моменты времени облучают образец исследуемой среды излучением для возбуждения свечения флуорофора, образовавшегося в результате расщепления,
в заданные моменты времени одновременно с облучением регистрируют фотокамерой пространственное распределение интенсивности флуоресценции флуорофора в образце,
в заданные моменты времени освещают образец исследуемой среды и регистрируют фотокамерой оптические характеристики исследуемого образца, выбранные из группы, состоящей из пространственного распределения светорассеяния, пространственного распределения светопропускания в образце или их комбинации,
из указанного пространственного распределения интенсивности флуоресценции флуорофора получают пространственно-временное распределение активности протеолитического фермента путем решения обратной задачи типа «реакция-диффузия-конвекция» с учетом связывания флуорофора в среде и искажения флуоресценции компонентами среды.
Предпочтительно субстрат добавляют в виде раствора в образец исследуемой среды.
Возможно, что субстрат наносят в лиофилизированной форме на стенки системы in vitro до размещения образца исследуемой среды.
Предпочтительно облучение и регистрацию флуоресценции флуорофора осуществляют с частотой от 1 до 1800 раз в минуту.
Предпочтительно облучение осуществляют после установления стабильной температуры в образце.
Предпочтительно используют в качестве образца цельную кровь или плазму, выбранную из группы, состоящей из свободной от тромбоцитов плазмы и бедной тромбоцитами плазмы.
Предпочтительно все этапы способа выполняют при термостатировании при температуре около 37ºС.
Предпочтительно стабилизируют рН образца до диапазона 7,2-7,4.
Предпочтительно приготавливают смесь, состоящую из исследуемого образца, ингибитора контактной фазы свертывания, хлорида кальция, флуорогенного субстрата к исследуемому фактору свертывания, которую помещают в кювету.
Предпочтительно в качестве фактора свертывания определяют тромбин.
Предпочтительно в качестве основного компонента среды, искажающего флуоресценцию, учитывается формирующийся фибриновый сгусток.
Предпочтительно в качестве основного свойства среды, искажающего диффузию флуорофора и требующего внесения поправок в уравнение "реакция-диффузия-конвекция", учитывается связывание молекул флуорофора с альбумином плазмы крови.
Поставленная задача решена также путем создания устройства определения пространственно-временного распределения активности протеолитического фермента в гетерогенной системе, содержащего
систему in vitro, которая содержит кювету для размещения образца исследуемой среды, выбранной из группы, состоящей из плазмы крови, цельной крови, воды, лимфы, коллоидного раствора, кристаллоидного раствора или геля, и протеолитического фермента или его предшественника, который распределен в образце исследуемой среды,
активирующее средство для размещения и ввода в кювету активатора процесса, обеспечивающего инициирование изменения пространственно-временного распределения активности протеолитического фермента,
средство для обеспечения одинаковой температуры в системе in vitro,
средство поддержания давления системы in vitro,
средство для облучения образца исследуемой среды в заданные моменты времени возбуждающим излучением для возбуждения свечения флуорофора,
средство для освещения образца исследуемой среды излучением видимого спектра по методу темного поля,
средство регистрации пространственного распределения интенсивности свечения субстрата/светорассеяния в образце исследуемой среды в заданные моменты времени, причем интенсивность свечения зависит от активности исследуемого протеолитического фермента,
средство управления средствами облучения/освещения, позволяющее управлять временем включения/выключения, интенсивностью облучения/освещения и синхронизировать между собой работу средств облучения/освещения и средства регистрации,
вычислительное средство для расчета пространственного распределения активности протеолитического фермента во времени,
средство визуализации пространственного распределения интенсивности свечения субстрата/светорассеяния в образце исследуемой среды в заданные моменты времени.
Поставленная задача решена также путем создания способа диагностики нарушений системы гемостаза по изменению пространственно-временного распределения активности протеолитического фермента (фактора свертывания) в гетерогенной системе, в котором
в качестве образца используют цельную кровь либо плазму, выбранную из группы, состоящей из свободной от тромбоцитов плазмы и бедной тромбоцитами плазмы,
поддерживают стабильную температуру образца с точностью 1 градус в диапазоне температур 25-45°С,
стабилизируют рН образца до диапазона 7,2-7,4,
приготавливают смесь, состоящую из исследуемого образца, ингибитора контактной фазы свертывания, водного раствора хлорида кальция, флуорогенного субстрата для исследуемого фактора свертывания,
помещают приготовленную смесь в измерительную кювету, которую помещают в устройство для исследования,
погружают в кювету средство, служащее активатором свертывания,
определяют пространственное распределение протеолитического фермента (фактора свертывания) в заданные моменты времени путем флуорометрического анализа, для чего
облучают кювету УФ излучением, и
регистрируют пространственное распределение интенсивности свечения флуорогенного субстрата в образце в заданные моменты времени, причем интенсивность свечения зависит от концентрации исследуемого фактора свертывания,
рассчитывают пространственное распределение концентрации фактора свертывания во времени согласно уравнению, получая пространственно-временной 2D, 3D или 4D массив данных,
на основе полученного массива данных находят в каждой точке пространства скорости изменения активности протеолитических ферментов во времени,
в заданные моменты времени освещают образец исследуемой среды и регистрируют фотокамерой оптические характеристики исследуемого образца, выбранные из группы, состоящей из пространственного распределения светорассеяния, пространственного распределения светопропускания в образце или их комбинации.
Предпочтительно в качестве фактора свертывания (протеолитического фермента) исследуют тромбин, фактор Ха, фактор VIIа.
Предложенный способ позволяет моделировать системы in vitro, приближенные по своим физиологическим свойствам к системам in vivo, а также проводить более точную диагностику нарушений в системе свертывания крови.
Полученный в результате исследования пространственно-временной массив данных, т.е. пространственно-временное распределение активности протеолитического фермента используется для расчета в каждой точке скорости изменения активности протеолитического фермента в пространстве и во времени, по которому выполняют действия, выбранные из следующей группы:
рассчитывают числовые параметры для лучшей характеризации процесса свертывания (скорость движения и амплитуда волны тромбина, максимальная скорость формирования и максимальная концентрация тромбина, время задержки свертывания, площадь под зависимостью тромбина от расстояния и времени)
судят о статусе состояния системы свертывания крови в образце,
делают вывод о состоянии системы свертывания у пациента посредством сравнения со здоровыми донорами,
оценивают эффективность терапии,
подбирают оптимальную индивидуальную дозу лекарственного препарата,
определяют механизм действия лекарственного препарата,
осуществляют скрининг химических веществ в процессе разработки лекарственных препаратов,
получают информацию о механизме работы системы свертывания,
изучают патогенез и этиологию заболеваний системы крови,
исследуют пространственную динамику факторов свертывания в процессе роста фибринового сгустка,
обеспечивают возможность оценки роли фактора свертывания в различных фазах процесса свертывания крови в гетерогенной системе.
Предложенный способ позволяет надежно диагностировать гиперкоагулянтные состояния на ранних стадиях, когда все прочие тесты их не чувствуют. Впервые в медицинской практике это дает возможность с высокой степенью точности выявлять склонность пациентов к широкому кругу патологий, включая гиперкоагуляционный синдром различной этиологии, геморрагии, тромбозы, инфаркты и инсульты, изучать патогенез заболеваний, осуществлять мониторинг классических препаратов и лекарств нового поколения, включая шунтирующие антигемофилические средства.
Предложенное устройство позволяет реализовать заявленный способ и обеспечить более точное определение пространственно-временного распределения активности протеолитического фермента в гетерогенной системе.
Краткое описание чертежей
В дальнейшем изобретение поясняется описанием предпочтительных вариантов воплощения со ссылками на сопровождающие чертежи, на которых:
Фиг. 1 изображает схематически пространственную концепцию регуляции свертывания крови;
Фиг. 2 изображает схему известного устройства для определения фактора свертывания;
Фиг. 3 изображает типичные зависимости концентрации АМС от расстояния и от времени, получаемые при исследовании пространственно-временного распределения фактора свертывания XIа; активатор свертывания расположен в начале координат;
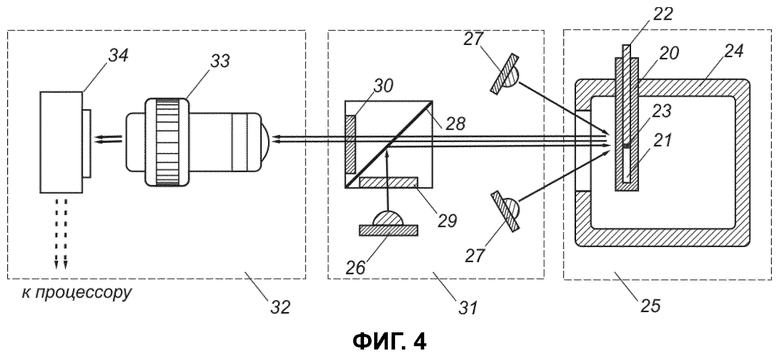
Фиг. 4 изображает схему устройства для определения пространственно-временного распределения активности протеолитического фермента в гетерогенной системе согласно изобретению;
Фиг. 5 a,b изображают визуализацию пространственной динамики образования фибринового сгустка (a) и флуорофора (b) согласно изобретению;
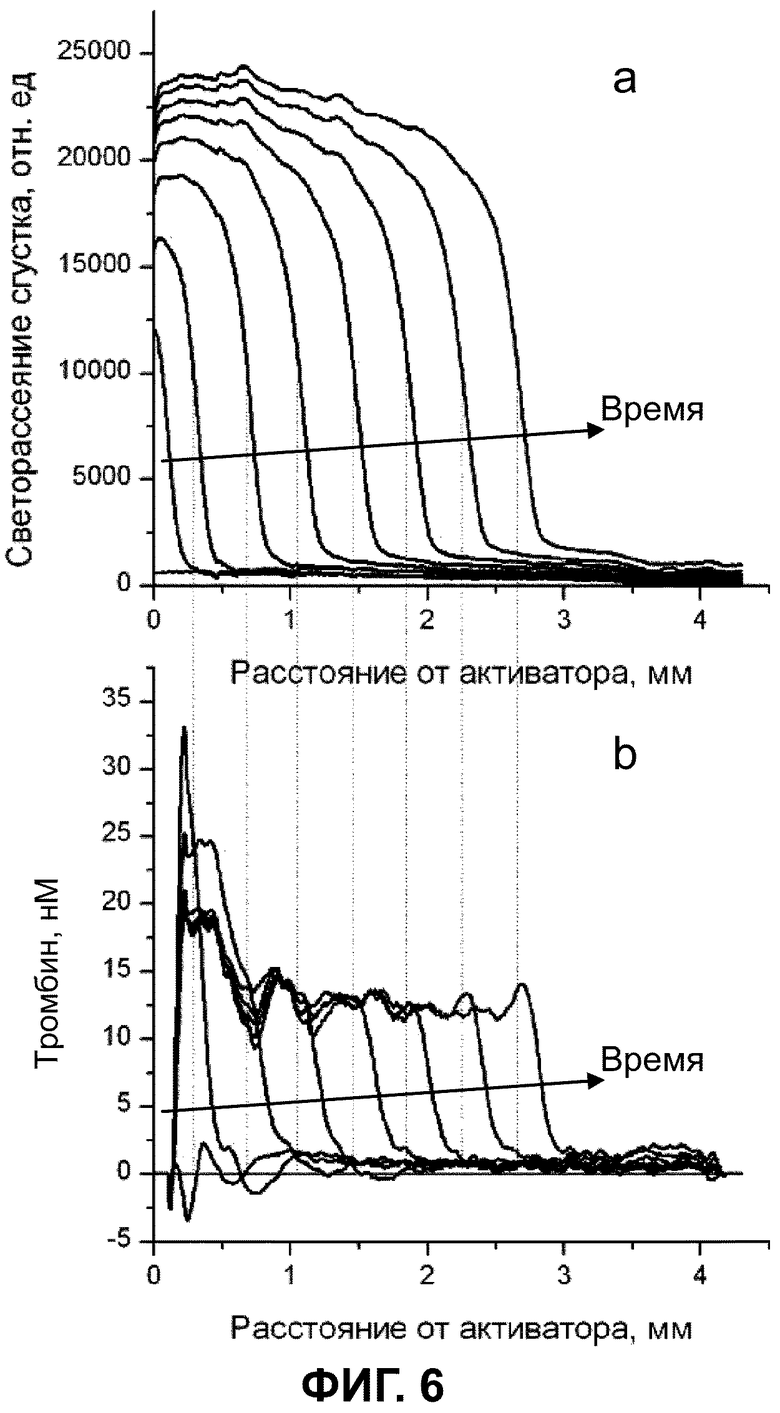
Фиг. 6 a,b изображают пример пространственно-временной динамики образования фибринового сгустка (a) и концентрации протеолитического фермента (тромбина) (b) в системе in vitro, полученный при помощи устройства, согласно изобретению; активатор свертывания расположен в начале координат.
Описание вариантов воплощения изобретения
Первый вариант выполнения способа.
Согласно изобретению предложен способ определения пространственно-временного распределения активности протеолитического фермента в гетерогенной системе, который осуществляется следующим образом.
Используют систему in vitro, в которую помещают образец исследуемой среды, выбранной из группы, состоящей из плазмы крови, цельной крови, воды, лимфы, коллоидного раствора, кристаллоидного раствора или геля, и протеолитический фермент или его предшественник, который распределен в образце исследуемой среды.
Погружают в систему in vitro флуорогенный субстрат.
Обеспечивают одинаковую температуру по всему объему системы in vitro, для чего систему термостатируют. Поддерживают давление в системе in vitro для избежания появления пузырьков воздуха, выделяющихся из образца среды.
При взаимодействии протеолитического фермента с флуорогенным субстратом происходит расщепление субстрата с отделением от него флуорофора.
Облучают образец исследуемой среды в заданные моменты времени возбуждающим излучением для возбуждения свечения флуорофора, образовавшегося в результате расщепления флуорогенного субстрата протеолитическим ферментом. В заданные моменты времени одновременно с облучением регистрируют фотокамерой пространственное распределение излучения флуорофора в образце, тем самым определяя пространственное распределение флуорофора в образце.
В заданные моменты времени освещают образец исследуемой среды и регистрируют фотокамерой оптические характеристики исследуемого образца, выбранные из группы, состоящей из пространственного распределения светорассеяния, пространственного распределения светопропускания в образце или их комбинации.
Из распределения интенсивности флуоресценции флуорофора получают пространственно-временное распределение активности протеолитического фермента путем решения обратной задачи типа «реакция-диффузия-конвекция» с учетом связывания флуорофора в среде с компонентами среды и искажения флуоресценции компонентами среды.
Длина волны облучения подбирается в соответствии со спектром возбуждения флуорофора. Длина волны освещения подбирается так, чтобы обеспечить максимальное отношение сигнал/шум, в частности, при исследовании системы свертывания сигнал - светорассеяние фибринового сгустка, шум - светорассеяние плазмы и остальных элементов системы in vitro.
При проведении экспериментов в систему in vitro помещают активирующий агент, который вызывает изменение в пространственно-временном распределении активности протеолитического фермента. В качестве активирующего агента используют агент, выбранный из группы, состоящей из иммобилизированного на поверхности тканевого фактора, растворимого тканевого фактора, тканевого активатора плазминогена, клеток, обеспечивающих возможность экспрессии тканевого фактора, образцов тканей организма, стекла или пластика.
Возможен вариант выполнения изобретения, когда исследуемый протеолитический фермент образуется непосредственно в исследуемой среде из своего предшественника в результате протекания биохимических процессов. Возможен также вариант, в котором исследуемый протеолитический фермент постепенно разрушается в исследуемой среде в результате протекающих в среде биохимических процессов.
Регистрацию пространственного распределения светорассеяния и излучения флуорофора в образце осуществляют посредством конфокальной микроскопии, обеспечивающей перефокусировку оптической системы и системы освещения/облучения в заданные моменты времени.
Визуализируют пространственное распределение флуорофора и образовавшегося сгустка в заданные моменты времени.
Светорассеяние от образца среды регистрируют по методу темного поля.
Излучение флуорофора регистрируют методом флуоресцентной микроскопии.
Второй вариант выполнения способа
Второй вариант выполнения отличается от первого варианта тем, что в качестве субстрата используют хромогенный субстрат.
При взаимодействии протеолитического фермента с хромогенным субстратом происходит расщепление субстрата с отделением от него хромофора. Система освещается светом с длиной волны, на которой происходит значительное поглощение излучения хромофором. В заданные моменты времени регистрируют изменение пространственного распределения цвета исследуемой среды. По изменению пространственного распределения цвета в образце определяют пространственное распределение хромофора в образце. Из этого распределения хромофора получают пространственно-временное распределение активности протеолитического фермента путем решения обратной задачи типа «реакция-диффузия-конвекция» с учетом связывания хромофора в среде с компонентами среды.
В заданные моменты времени освещают образец исследуемой среды и регистрируют фотокамерой оптические характеристики исследуемого образца, выбранные из группы, состоящей из пространственного распределения светорассеяния, пространственного распределения светопропускания в образце или их комбинации.
Третий вариант осуществления способа
Третий вариант выполнения способа отличается от первого варианта тем, что в качестве субстрата используют субстрат, который при взаимодействии с протеолитическим ферментом расщепляется с образованием продукта, обладающего хемилюминесценцией. В заданные моменты времени регистрируют пространственное распределение интенсивности люминесценции в образце. Из этого распределения получают пространственно-временное распределение активности протеолитического фермента путем решения обратной задачи типа «реакция-диффузия-конвекция» с учетом связывания люминофора в среде.
В заданные моменты времени освещают образец исследуемой среды и регистрируют фотокамерой оптические характеристики исследуемого образца, выбранные из группы, состоящей из пространственного распределения светорассеяния, пространственного распределения светопропускания в образце или их комбинации.
Возможно добавление субстрата в образец исследуемой среды в виде раствора. Возможно также наносить субстрат в лиофилизированной форме на стенки системы in vitro до размещения образца исследуемой среды.
Облучение и регистрацию флоуресценции флуорофора осуществляют с частотой от 1 до 1800 раз в минуту.
Облучение осуществляют после установления стабильной температуры в образце.
В качестве образца используют цельную кровь либо плазму, выбранную из группы, состоящей из свободной от тромбоцитов плазмы и бедной тромбоцитами плазмы.
Все этапы способа выполняют при термостатировании при температуре около 37°С, при этом стабилизируют рН образца до диапазона 7,2-7,4.
Приготавливают смесь, состоящую из исследуемого образца, ингибитора контактной фазы, хлорида кальция, флуорогенного субстрата к исследуемому фактору свертывания, указанную смесь используют для исследования.
В качестве фактора свертывания определяют тромбин.
Согласно изобретению предложен также способ диагностики нарушений системы гемостаза по изменению пространственно-временного распределения активности протеолитического фермента (фактора свертывания) в гетерогенной системе, заключающийся в том, что в качестве образца используют цельную кровь либо плазму, выбранную из группы, состоящей из свободной от тромбоцитов плазмы и бедной тромбоцитами плазмы.
Поддерживают стабильную температуру образца с точностью до 1 градуса в диапазоне температур 25-45°С. Стабилизируют рН образца до диапазона 7,2-7,4.
Приготавливают смесь, состоящую из исследуемого образца, ингибитора контактной фазы, водного раствора хлорида кальция, флуорогенного субстрата для исследуемого фактора свертывания. Помещают приготовленную смесь в измерительную кювету, которую помещают в устройство для исследования. Погружают в кювету средство, служащее активатором свертывания.
Определяют пространственное распределение протеолитического фермента (фактора свертывания) в заданные моменты времени путем флуорометрического анализа, для чего облучают кювету УФ излучением, и регистрируют пространственное распределение интенсивности свечения флуорогенного субстрата в образце в заданные моменты времени, причем интенсивность свечения зависит от концентрации исследуемого фактора свертывания. Рассчитывают пространственное распределение концентрации фактора свертывания во времени согласно уравнению, получая пространственно-временной 2D, 3D или 4D массив данных,
На основе полученного массива данных находят в каждой точке пространства в исследуемом образце скорости изменения активности протеолитических ферментов во времени.
В заданные моменты времени освещают содержимое кюветы и регистрируют фотокамерой пространственное распределение светорассеяния от образовавшегося фибринового сгустка в образце среды для визуализации образовавшегося фибринового сгустка методом темного поля.
В качестве фактора свертывания исследуется тромбин, фактор Ха, фактор VIIа.
Устройство для определения пространственно-временного распределения активности протеолитического фермента в гетерогенной системе содержит систему in vitro, которая содержит кювету 20 (фиг. 4) для размещения образца 21 исследуемой среды, выбранной из группы, состоящей из плазмы крови, цельной крови, воды, лимфы, коллоидного раствора, кристаллоидного раствора или геля, и протеолитического фермента или его предшественника, который распределен в образце исследуемой среды. Кювета 20 имеет определенные геометрические размеры, в сечении прямоугольник, выполнена из пластика.
Для снижения конвективных потоков (чем тоньше слой, тем быстрее затухает движение жидкости) и обеспечения быстрого прогрева толщина слоя образца должна быть минимальной. Для повышения уровня сигнала - максимальной. Оптимальная толщина лежит в пределах 0,1-1,5 мм.
Устройство содержит также активирующее средство 22, предназначенное для размещения и ввода в кювету активатора 23 процесса, обеспечивающего инициирование изменения пространственно-временного распределения активности протеолитического фермента.
Устройство снабжено также средством 24 для обеспечения одинаковой температуры в системе in vitro. Устройство позволяет обеспечить различные виды термостатирования, включая водяное термостатирование и воздушное термостатирование, а также для термостатирования может использоваться гель, но при этом следует учитывать, что среда должна быть прозрачна для излучения. В описываемом варианте термостатирование водяное. При термостатировании поддерживается температура в пределах 25-45°С с точностью в 1°С. Устройство снабжено также средством (не показано) поддержания давления системы in vitro, указанное средство предназначено для поддержания постоянного воздушного давления в пространстве, окружающем исследуемый образец среды (совместно со средством 24 для поддержания одинаковой температуры они образуют блок 25 термостатирования и давления). Указанное средство поддерживает избыточное атмосферное давление от 0,2 до 0,5 атм, что предотвращает образование пузырей газа в исследуемом образце. Образование пузырей связано с уменьшением растворимости содержащихся в образце растворенных газов. Обычно это явление связано с нагревом образца. Пузыри приводят к локальным искажениям как с точки зрения повышения нефизиологичности окружения, т.е. ухода от моделируемых условий, так и с точки зрения расчета распределения ферментов.
Устройство содержит средство 26 для облучения образца 21 исследуемой среды в заданные моменты времени возбуждающим излучением для возбуждения свечения флуорофора или изменения цвета хромофора. Средство 26 обеспечивает подачу излучения перпендикулярно стенке кюветы 20 через окно в термостате 24. В качестве средства 26 для облучения используют источники УФ излучения, например светодиоды УФ спектра. Средство 27 для освещения образца исследуемой среды излучением видимого спектра обеспечивает подачу излучения под углом к стенке кюветы 20. Устройство содержит зеркало 28, направляющее излучение, а также фильтр 29 возбуждения и фильтр 30 эмиссии, обеспечивающие выделение сигнала флуоресценции, при этом излучение оптических элементов не должно вызывать локального нагрева образца. Совокупность средств с 26 по 30 образует блок 31 облучения/освещения.
Устройство содержит также блок 32 регистрации пространственного распределения интенсивности свечения флуорофора/светорассеяния (или изменения цвета хромофора) в образце исследуемой среды и в заданные моменты времени. Блок 32 регистрации содержит средства получения изображения с различной глубины образца, содержащие оптическую систему 33 для фокусировки оптики и диафрагмы (не показаны). Интенсивность свечения зависит от активности исследуемого протеолитического фермента. Излучение от субстрата проходит перпендикулярно стенке кюветы 20, проходит через зеркало 28, прозрачное для этого спектра излучения, и через оптическую систему 33 попадает в цифровую фотокамеру 34. Фермент в разных точках сгустка имеет разные свойства, зависящие от физико-химических параметров среды в данной точке.
Устройство содержит средство управления включения/ выключения средств облучения/освещения, выполненное в виде процессора (не показан), обеспечивающего управление временем включения/выключения, интенсивностью и длительностью облучения/освещения, и синхронизацией функционирования средств облучения/освещения и средства регистрации (не показано).
Вычислительное средство (не показано) обеспечивает расчет пространственного распределения активности протеолитического фермента во времени.
К средству управления подключено также средство визуализации формирующегося/распадающегося сгустка методом темного поля и средство визуализации пространственного изображения образования/разрушения флуорофора/хромофора (не показаны).
Работа устройства осуществляется следующим образом.
Материалы
Использовались следующие реагенты: фосфатидилсерин и фосфатидилхолин; 7-амино-4-метилкумарин (АМС); Z-Гли-Гли-Арг-AMC; ингибитор трипсина из кукурузы; фактор VIII; тест на активность фактора VIII; плазма, дефицитная по фактору VIII; антагонист гликопротеина IIb-IIIa .
Сбор крови и приготовление плазмы
Образцы нормальной плазмы были получены из свежесобранной человеческой крови здоровых доноров. Кровь собирали в 3,8% цитрата натрия (рН 5,5) в соотношении 9:1 по объему. Кровь центрифугировали в течение 15 мин при 1600 g, а затем супернатант дополнительно центрифугировали в течение 5 мин при 10 000 g для получения плазмы без тромбоцитов, супернатант затем был заморожен и хранился при температуре -70°C. Перед каждым экспериментом образцы оттаивали на водяной бане. Для рН стабилизации на уровне 7,2-7,4 пробы плазм инкубировали с 10% молочной кислотой в течение 1 часа при температуре 37°C. Коммерчески доступные плазмы, дефицитные по отдельным факторам свертывания, оттаивали и обрабатывали как нормальные.
Подготовка активатора
Свертывание активировалось с использованием монослоя иммобилизованного тканевого фактора (TF). Вкратце, TF был иммобилизован на пластиковой поверхности, обработанной полиэтиленимином через глутаровый альдегид. Активаторы хранились при +4°С.
Эксперимент
Эксперименты проводились с помощью специально разработанной системы видеомикроскопии, что позволяло наблюдать пространственное распространение или рост фибринового сгустка и тромбина одновременно. Проба плазмы помещалась в экспериментальную кювету толщиной 1 мм, свертывание активировалось активатором с поверхностью, покрытой тканевым фактором, подготовленной, как указано выше, который приводился в контакт с плазмой. Температура в камере поддерживалась на уровне 37°С и освещение осуществлялось посредством красного (625 нм) и ультрафиолетового (365 нм) светодиодов. Рост сгустка детектировался по светорассеянию образца при освещении красным светом (фиг. 5, а), а флуоресценция AMC (фиг. 5, b) возбуждалась ультрафиолетовыми светодиодами. Многополосный эмиссионный фильтр был использован для разделения рассеяния красного света, излучения AMC и излучения для возбуждения. Флуоресценция и рассеяние красного света, проходящего через макрообъектив, детектировались цифровой ПЗС камерой. Изображения в красном и синем свете получали последовательно, обычно один раз в минуту. Чтобы устранить выгорание АМС, светодиоды были синхронизированы с камерой и включались только на время экспозиции, т.е. около 0,5 сек.
Пространственный рост сгустка в свободной от тромбоцитов плазме
Плазма была дополнена ингибитором трипсина из кукурузы (0,2 мг/мл), 0,1 мкм липидных везикул (фосфатидилсерин/ фосфатидилхолин, в молярном соотношении 20/80). Субстрат Z-GGR-AMС (800 мкМ) был добавлен для мониторинга формирования тромбина. Образец инкубировали в течение 10 мин при 37°С, а затем дополняли CaCl2 (20 мМ), сразу после этого инициировали образование сгустка.
Пространственный рост сгустка в обогащенной тромбоцитами плазме
Чтобы предотвратить ретракцию сгустка использовали 25 мкг/ мл антагониста гликопротеина IIb/IIIa. Также были проведены эксперименты на 0,5% низкотемпературном агарозном геле, так как в некоторых случаях даже большая концентрация антагониста полностью не ингибирует ретракцию.
Подготовка образцов выполнялась, как описано выше. После рекальцификации плазма предварительно нагревалась до 42°C в течение 2 мин. Агарозный раствор добавляли и смесь инкубировали в экспериментальной кювете в течение 3 мин для образования геля. Затем эксперимент был начат, как описано выше.
Дополнение плазмы недостающими факторами
Активность фактора VIII определяли по АЧТВ с использованием теста на фактор VIII. Фактор VIII аликвоты оттаивали на льду и использовали после одного часа инкубации при комнатной температуре. Фактор необходимой концентрации был добавлен к образцу плазмы, приготовленному, как описано выше в разделе «Пространственный рост сгустка в свободной от тромбоцитов плазме».
Обработка данных
Обработка изображения
Изображения в красном и УФ-свете были первично обработаны одинаковым образом. Для получения профилей светорассеяния (фиг. 6, а) или флуоресценции АМС для каждого кадра была измерена интенсивность света в соответствующем диапазоне вдоль линии, перпендикулярной к поверхности активатора. Значения были усреднены для 150-300 линий.
Скорость роста сгустка рассчитывалась по движению точки полумаксимальной интенсивности на профилях светорассеяния. Начальная скорость роста определялась как тангенс угла наклона линеаризованного участка диаграммы зависимости размера сгустка от времени в первые 10 мин роста сгустка. Стационарная скорость рассчитывается таким же образом через 40 мин роста сгустка, когда граница сгустка оказывается так далеко от активатора, что его влияние на рост сгустка становится незначительным.
Профили интенсивности флуоресценции АМС переводятся в профили его концентрации посредством калибровки. Профиль калибровки интенсивности рассчитан в рамках равномерного распределения с известной концентрацией АМС в той же плазме. АМС концентрация в каждой точке (Ci) была рассчитана следующим образом:
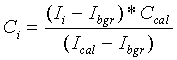
где: Ii - интенсивность флуоресценции, Ibgr - интенсивность фона, Ical - интенсивность флуоресценции с известной концентрацией АМС, все в одной и той же точке кадра, Ccal - калибровочная концентрация AMС.
Расчет концентрации тромбина
Концентрация тромбина (фиг. 6, b) рассчитывалась по одномерному распределению АМС путем решения обратной задачи для следующего уравнения реакция - диффузия.
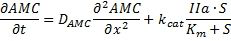
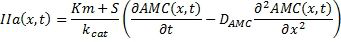
где: АМС, S и IIa являются концентрациями АМС, флуорогенного субстрата и тромбина соответственно, DAMС - коэффициент диффузии АМС; Km, kcat являются константами Михаэлиса.
Коэффициент диффузии АМС был измерен экспериментально путем фиттинга экспериментальных профилей диффузии к теоретическим.
Обратная задача для распределения концентрации тромбина является некорректной, поэтому экспериментальный шум и даже небольшие искажения профилей АМС приводят к отсутствию ее решения. Для преодоления этого были использованы численные алгоритмы для снижения шума и уровня искажения сигнала АМС.
Искажения АМС сигнала происходят из-за возбуждения рассеяния света на фибриновом сгустке. Интенсивность флуоресценции увеличивается внутри сгустка. Это увеличение пропорционально АМС концентрации и плотности сгустка. Чтобы преодолеть это и рассчитать реальную концентрацию АМС, была использована следующая формула.
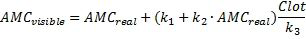
где: AMСvisible - концентрация АМС, полученная путем калибрования, AMСreal - реальная концентрация АМС, Clot - рассеяние интенсивности света фибрином, коэффициенты k1, k2, k3 были измерены экспериментально.
Для снижения шума были использованы следующие алгоритмы вычисления производных:
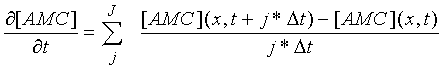
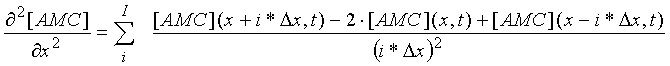
где: ∆t -время между кадрами, обычно 1 мин.; ∆х - размер пикселя (4,3 мкм); значения I и J выбраны оптимальными для максимального снижения шума при минимальном искажении сигнала. Обычно выбирались J=3 и I=40, при этом суммирование могло начинаться со значений i и j, больших единицы.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ ПОКАЗАТЕЛЕЙ КОАГУЛЯЦИИ ПЛАЗМЫ КРОВИ - АКТИВНОСТИ ТРОМБИНА, ВРЕМЕНИ РЕКАЛЬЦИФИКАЦИИ ПЛАЗМЫ И ТОЛЕРАНТНОСТИ ПЛАЗМЫ К ГЕПАРИНУ | 2020 |
|
RU2786591C2 |
| ВЫСОКОСЕЛЕКТИВНЫЙ ИНГИБИТОР КОНТАКТНОЙ АКТИВАЦИИ НА ОСНОВЕ ИНФЕСТИНА 4 | 2013 |
|
RU2556116C2 |
| ИЗМЕРЕНИЕ АКТИВНОСТИ ТРОМБИНА В ЦЕЛЬНОЙ КРОВИ | 2006 |
|
RU2422835C2 |
| Способ определения антикоагулянтного потенциала плазмы крови для диагностики предтромботических состояний | 2024 |
|
RU2835822C1 |
| РАСТВОР ДЛЯ КОРРЕКЦИИ ПЕРВИЧНЫХ НАРУШЕНИЙ ГЕМОСТАЗА ПЛАЗМОЗАМЕЩАЮЩИМИ РАСТВОРАМИ НОВОГО СОСТАВА | 2005 |
|
RU2300385C1 |
| НОВЫЕ СОЕДИНЕНИЯ, ОБЛАДАЮЩИЕ ФУНКЦИЕЙ АНТИКОАГУЛЯНТОВ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ ДЛЯ ЛЕЧЕНИЯ ТРОМБОТИЧЕСКИХ СОСТОЯНИЙ И ПЛАЗМОЗАМЕЩАЮЩИЙ РАСТВОР ДЛЯ КОРРЕКЦИИ ГИПЕРКОАГУЛЯЦИОННЫХ НАРУШЕНИЙ ПРИ ГЕМОДИЛЮЦИИ | 2007 |
|
RU2353619C2 |
| НАБОР РЕАГЕНТОВ ДЛЯ ДИАГНОСТИКИ СТЕПЕНИ НЕЙРОВОСПАЛЕНИЯ | 2018 |
|
RU2698206C1 |
| Устройство для исследования пространственного свертывания крови и ее компонентов | 2018 |
|
RU2682883C1 |
| Способ определения тромбинового пути активации системы комплемента | 2019 |
|
RU2717946C1 |
| Определение чувствительности эритроцитов человека к лизису при активации системы комплемента по тромбиновому пути | 2019 |
|
RU2696981C1 |

Настоящее изобретение относится к области биофизики. Предложены способы определения пространственно-временного распределения активности протеолитического фермента в гетерогенной системе, в соответствии с которыми обеспечивают систему in vitro, которая содержит образец плазмы крови, цельной крови, воды, лимфы, коллоидного раствора, кристаллоидного раствора или геля, и протеолитический фермент или его предшественник, добавляют флуорогенный, хромогенный или люминесцентный субстрат для упомянутого фермента, регистрируют в заданные моменты времени пространственное распределение сигнала высвобождающейся метки субстрата и получают пространственно-временное распределение активности протеолитического фермента путем решения обратной задачи типа «реакция - диффузия - конвекция» с учетом связывания метки с компонентами среды. Также рассмотрено устройство для реализации способов по настоящему изобретению и способ диагностики нарушений гемостаза, основанный на их применении. Настоящее изобретение может найти дальнейшее применение в исследованиях системы свертывания крови и диагностике заболеваний, связанных с нарушениями свертывания крови. 5 н. и 17 з.п. ф-лы, 6 ил.
1. Способ определения пространственно-временного распределения активности протеолитического фермента в гетерогенной системе, заключающийся в том, что
обеспечивают систему in vitro, которая содержит образец исследуемой среды, выбранной из группы, состоящей из плазмы крови, цельной крови, воды, лимфы, коллоидного раствора, кристаллоидного раствора и геля, и распределенный в образце исследуемой среды протеолитический фермент или его предшественник,
добавляют в систему in vitro флуорогенный субстрат, специфичный для определяемого протеолитического фермента, с последующим высвобождением метки при расщеплении указанного субстрата упомянутым протеолитическим ферментом,
освещают образец исследуемой среды в заданные моменты времени для возбуждения сигнала флуоресценции метки,
регистрируют одновременно с освещением в заданные моменты времени пространственное распределение сигнала флуоресценции метки в образце,
получают из совокупности пространственных распределений сигнала флуоресценции метки для заданных моментов времени пространственно-временное распределение активности протеолитического фермента путем решения обратной задачи типа «реакция - диффузия - конвекция» с учетом степени связывания метки с компонентами исследуемой среды.
2. Способ определения пространственно-временного распределения активности протеолитического фермента в гетерогенной системе, заключающийся в том, что
обеспечивают систему in vitro, которая содержит образец исследуемой среды, выбранной из группы, состоящей из плазмы крови, цельной крови, воды, лимфы, коллоидного раствора, кристаллоидного раствора и геля, и распределенный в образце исследуемой среды протеолитический фермент или его предшественник,
добавляют в систему in vitro хромогенный субстрат, специфичный для определяемого протеолитического фермента, с последующим высвобождением метки при расщеплении указанного субстрата упомянутым протеолитическим ферментом,
освещают образец исследуемой среды в заданные моменты времени светом с длиной волны его значительного поглощения меткой,
регистрируют в заданные моменты времени пространственное распределение поглощения света меткой в образце,
получают (определяют или рассчитывают) из совокупности пространственных распределений поглощения света меткой для заданных моментов времени пространственно-временное распределение активности протеолитического фермента путем решения обратной задачи типа «реакция - диффузия - конвекция» с учетом степени связывания метки в образце исследуемой среды с компонентами среды.
3. Способ определения пространственно-временного распределения активности протеолитического фермента в гетерогенной системе, заключающийся в том, что
обеспечивают систему in vitro, которая содержит образец исследуемой среды, выбранной из группы, состоящей из плазмы крови, цельной крови, воды, лимфы, коллоидного раствора, кристаллоидного раствора и геля, и распределенный в образце исследуемой среды протеолитический фермент или его предшественник,
добавляют в систему in vitro люминесцентный субстрат с последующим высвобождением метки при расщеплении указанного субстрата протеолитическим ферментом,
регистрируют в заданные моменты времени пространственное распределение сигнала люминесценции метки в образце,
получают (определяют или рассчитывают) из совокупности пространственных распределений сигналов люминесценции метки для заданных моментов времени пространственно-временное распределение активности протеолитического фермента путем решения обратной задачи типа «реакция - диффузия - конвекция» с учетом степени связывания метки в образце исследуемой среды с компонентами среды.
4. Способ по любому из пп.1-3, в котором дополнительно в систему in vitro помещают активирующий агент, который вызывает изменение в пространственно-временном распределении активности протеолитического фермента.
5. Способ по п.4, в котором в качестве активирующего агента используют агент, выбранный из группы, состоящей из иммобилизованного на поверхности подложки тканевого фактора, растворимого тканевого фактора, тканевого активатора плазминогена, клеток, обеспечивающих возможность экспрессии тканевого фактора, образцов тканей организма, стекла и пластика.
6. Способ по любому из пп.1-3, в котором дополнительно освещают образец исследуемой среды в заданные моменты времени и регистрируют пространственные характеристики исследуемого образца, выбранные из группы, состоящей из пространственного распределения светорассеяния, пространственного распределения светопропускания в исследуемом образце и их комбинации.
7. Способ по любому из пп.1-3, в котором субстрат добавляют в виде раствора в образец исследуемой среды.
8. Способ по любому из пп.1-3, в котором наносят субстрат в лиофилизированной форме на стенки системы in vitro до размещения в ней образца исследуемой среды.
9. Способ по любому из пп.1-3, в котором в качестве исследуемой среды используют плазму крови, выбранную из группы, состоящей из богатой тромбоцитами плазмы, свободной от тромбоцитов плазмы и бедной тромбоцитами плазмы.
10. Способ по любому из пп.1-3, в котором освещение и регистрацию изменения сигнала метки осуществляют с частотой от 1 до 1800 раз в минуту.
11. Способ по любому из пп.1-3, в котором обеспечивают стабильную температуру по всему объему исследуемого образца, предпочтительно 37°С.
12. Способ по любому из пп.1-3, в котором обеспечивают стабильное давление по всему объему исследуемого образца, предпочтительно повышенное по отношению к атмосферному.
13. Способ по любому из пп.1-3, в котором обеспечивают стабильный рН исследуемого образца, предпочтительно с диапазоном 7,2 - 7,4.
14. Устройство определения пространственно-временного распределения активности протеолитического фермента в гетерогенной системе с использованием способа по п.1, 2 или 3, содержащее
систему in vitro, которая включает кювету для размещения образца исследуемой среды, выбранной из группы, состоящей из плазмы крови, цельной крови, воды, лимфы, коллоидного раствора, кристаллоидного раствора и геля, распределенного в образце исследуемой среды протеолитического фермента или его предшественника, и флуорогенного, или хромогенного, или люминесцентного субстрата, специфичного для определяемого протеолитического фермента,
средство обеспечения стабильного давления по всему объему исследуемого образца, предпочтительно повышенного, по отношению к атмосферному,
средство для освещения образца исследуемой среды в заданные моменты времени,
средство для освещения образца исследуемой среды излучением видимого спектра по методу темного поля
средство регистрации пространственного распределения сигнала метки, образовавшейся при расщеплении указанного субстрата протеолитическим ферментом, в заданные моменты времени,
средство управления средствами освещения и регистрации.
15. Устройство по п.14, которое содержит активирующее средство для размещения и ввода в кювету активатора процесса, обеспечивающего инициирование изменения пространственно-временного распределения активности протеолитического фермента.
16. Устройство по п.14, которое содержит средство для обеспечения стабильной температуры в образце исследуемой среды, предпочтительно 37°С.
17. Устройство по п.14, в котором средство управления средствами освещения и регистрации выполнено с возможностью регулирования времени включения/выключения, интенсивности освещения и синхронизации работы средств освещения и регистрации между собой.
18. Устройство по п.14, которое соединено с вычислительным средством, выполненным с возможностью осуществления расчета пространственного распределения активности протеолитического фермента во времени, или включает указанное вычислительное средство.
19. Способ диагностики нарушений системы гемостаза посредством регистрации пространственно-временного распределения активности протеолитического фермента (фактора свертывания) способом по п.1, 2 или 3 в гетерогенной системе in vitro, заключающийся в том, что
используют в качестве исследуемого образца компоненты крови, выбранные из группы: цельная кровь, свободная от тромбоцитов плазма крови, бедная тромбоцитами плазма крови, богатая тромбоцитами плазма крови, кровь с добавлением антикоагулянта, плазма крови с добавлением антикоагулянта,
обеспечивают условия для формирования протеолитического фермента в исследуемом образце и наблюдения за ним посредством совершения, по меньшей мере, одной операции, выбранной из группы: приведение исследуемого образца в контакт с иммобилизованным на поверхности активатором свертывания крови; добавление субстрата, расщепляемого исследуемым протеолитическим ферментом; добавление соли кальция; добавление ингибитора контактной активации свертывания,
регистрируют в заданные моменты времени пространственное распределение сигнала отщепляемой от субстрата метки в образце,
получают из совокупности пространственных распределений сигнала метки для заданных моментов времени пространственно-временное распределение активности протеолитического фермента (фактора свертывания) путем решения обратной задачи типа «реакция диффузия - конвекция» с учетом степени связывания метки с компонентами исследуемой среды,
оценивают состояние системы гемостаза по отклонению пространственно-временного распределения протеолитического фермента от нормального.
20. Способ по п.19, в котором дополнительно в заданные моменты времени освещают содержимое кюветы и регистрируют пространственное распределение светорассеяния от образовавшегося фибринового сгустка в образце среды для регистрации образовавшегося фибринового сгустка методом темного поля.
21. Способ по п.19, в котором в качестве фактора свертывания исследуют протеолитический фермент, выбранный из группы: тромбин, фактор Ха, фактор VIIa, фактор IXa, фактор XIIa, фактор ХIа, плазмин.
22. Способ по п.19, в котором используют, по меньшей мере, один параметр пространственно-временного распределения тромбина или фибрина, для оценки состояния системы свертывания в образце и постановки диагноза, выбранный из группы: скорость пространственного распространения волны тромбина, максимальная концентрация тромбина в образце, максимальная концентрация тромбина в движущейся части волны, скорость увеличения концентрации тромбина, интеграл от концентрации тромбина по пространству, интеграл от концентрации тромбина по времени и по пространству, скорость пространственного распространения фронта фибрина (светорассеяния), максимальная концентрация фибрина (величина светорассеяния) в образце.
| KONDRATOVICH A.Y | |||
| et al., "Spatiotemporal dynamics of contact activation factors of blood coagulation." Biochim Biophys Acta | |||
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| FADEEVA O.A | |||
| et al., "Thromboplastin immobilized on polystyrene surface exhibits kinetic characteristics close to those for the native protein and activates in vitro blood coagulation similarly to | |||
Авторы
Даты
2014-06-10—Публикация
2011-07-26—Подача