Область изобретения
Настоящее изобретение относится к области вирусологии, иммунологии и онкологии, в частности к созданию фармацевтических композиций, предназначенных для лечения онкологических заболеваний, и способам лечения онкологических заболеваний, а так же иммунопрофилактики метастазирования. Конкретно настоящее изобретение относится к созданию терапевтической фармацевтической композиции на основе вируса Сендай штамм Москва РТА-13024, эффективной при лечении и иммунопрофилактике пациентов, страдающих злокачественными онкологическими заболеваниями.
Предшествующий уровень техники
Во многих случаях метастатический рак остается неизлечимым заболеванием и, следовательно, необходима разработка новых терапевтических противораковых методов и новых методов воздействия на метастазы. Идея применения вирусов для лечения злокачественных заболеваний не является новой. Ее возникновение относят к началу XX века, когда было замечено, что у некоторых пациентов происходит спонтанная регрессия опухоли после вирусного заболевания или вакцинаций живым вирусом (1), (2). В онкологию был введен термин "онколитический вирус" для вирусов, способных специфично разрушать злокачественные клетки и оставлять невредимыми нормальные. Подобное специфическое разрушение злокачественных клеток происходит за счет преимущественной репликации вируса в этих клетках либо же опосредовано иммунной системой, простимулированной вирусом.
Настоящее изобретение относится к онколитическому вирусу Сендай, принадлежащему к семейству Paramyxoviridae. Среди представителей этого семейства были исследованы в качестве противораковых агентов ослабленные штаммы вирусов: кори (3) (4) и эпидемического паротита, а также различные патогены животных, такие как вирус болезни Ньюкасла. Ослабленный штамм вируса кори продемонстрировал сильную противоопухолевую активность в ряде модельных систем (5), (6), (7), (8), (9), (10) (10), (11), (12), (13), (14), где использовали различные пути введения вируса (внутриопухолевый, внутривенный (в/в), интраперитонеальный (и/п) или интраплевральный) при однодозовой или мультидозовой схеме введения (5). У получавших лечение животных в опухолях наблюдали признаки, характерные для цитопатогенного действия, включая образование скоплений многоядерных клеток, за которыми следовала гибель опухолевых клеток, инфицированных вирусом кори.
Противораковая активность вируса Сендай
В мировой практике противораковое действие вируса Сендай, также известного как вирус парагриппа мышей 1 типа, или гемагглютинирующий японский вирус, еще только начинают исследовать. Этот парамиксовирус (семейство Paramyxoviridae) принадлежит к роду Respirovirus. Геном вируса представлен минус цепью РНК длиной 15,3 Кб. Всего у вируса выявляется шесть генов, кодирующих белки. Из них два кодируют поверхностные гликопротеины HN и F, три кодируют нуклеокапсиды: белки NP, P и L, и один негликозилированный внутренний белок М. вируса Сендай вызывает легко передающуюся инфекцию дыхательных путей у мышей, хомяков, морских свинок, крыс и иногда - у свиней (25). Вирус Сендай способен распространятся как через воздух, так и при непосредственном контакте. Его можно обнаружить в колониях мышей по всему миру, но считается, что он совершенно безопасен для людей (25). В США вирус Сендай был одобрен соответствующим агентством, ответственным за безопасность питания и лекарств (FDA), для проведения клинического испытания с участием людей для профилактики педиатрического заболевания, вызываемого вирусом парагриппа 1 типа. Испытание показало, что интраназальное введение вируса Сендай хорошо переносилось и продемонстрировало признаки иммуногенности против вируса парагриппа 1 типа (26).
Ряд работ, проведенных в Японии, показал, что ослабленный генно-инженерными методами непатогенный для грызунов вирус может интенсивно распространяться в опухолевых клетках, не затрагивая окружающие их нормальные клетки. Такое распространение часто приводит к ингибированию роста опухолей у мышей. Среди протестированных ксенотрансплантационных моделей опухолей человека были клетки фибросаркомы, панкреатической эпителиоидной карциномы и клетки рака толстой кишки (27). Также на мышиных моделях с применением другой конструкции вируса Сендай было продемонстрировано существенное подавление роста опухоли, и даже полное рассасывание сформировавшихся опухолей мозга (28). Сходные результаты были получены в случае ксенотрансплантации мышам клеток саркомы и рака простаты человека (29), (30). На крысиных ксенотрансплантационных моделях было показано, что рекомбинантный вирус Сендай с высокой частотой уничтожает человеческие опухоли меланомы, гепатоцеллюлярного рака, нейробластомы, плоскоклеточного рака и рака простаты (31). На мышиных сингенных моделях было показано, что даже после инактивации УФ вирус Сендай эффективен против карциномы толстой кишки (32), (33) и карцином почки (34). На мышиной ксенотрансплантационной модели человеческого рака простаты было также показано, что после инактивации УФ вирус Сендай может быть эффективен (35). Во всех указанных исследованиях вирус Сендай приводил к полной регрессии опухолей или к серьезному подавлению их роста.
Кратковременная ремиссия после внутривенной инъекции живого вируса Сендай была описана у пациента с острой лейкемией еще в 1964 году (36).
Механизмы противоракового действия вируса Сендай
1. Прямое уничтожение злокачественных клеток:
а) Повреждение интерфероновой и апоптической систем клеток.
Хорошо известно, что по мере усиления прогрессии опухоли накапливаются мутации, способствующие повреждению интерфероновой и апоптической (апоптоз-запрограммированная клеточная гибель) систем клеток. В результате раковые клетки теряют способность отвечать на антипролиферативные сигналы, индуцированные интерфероном. Они также теряют способность уходить в апоптоз, несмотря на принимаемые клеткой сигналы. Эти нарушения ведут к прогрессии злокачественного образования и росту опухоли.
Те же самые клеточные нарушения, которые способствуют росту опухоли, вирус Сендай может использовать для собственной репликации, что приводит к более широкомасштабной гибели злокачественных клеток по сравнению с нормальными клетками.
б) Образование синцития из злокачественных клеток. У некоторых представителей парамиксовирусов, в частности у вируса Сендай, развился механизм распространения инфекции, который включает слияние инфицированных и неинфицированных клеток. Такое слияние приводит к образованию синцития, который представляет собой крупную многоядерную клеточную структуру. Инфицированные клетки могут сливаться и образовывать синцитий с 50-100 соседними клетками (5). Инфицирование новых клеток-хозяев путем их слияния делает возможным распространение вирусной инфекции без высвобождения вируса из инфицированных клеток. Следовательно, способность образовывать синцитий является одной из стратегий, используемых вирусом для избегания воздействия нейтрализующих антител хозяина, которые могли бы его инактивировать. В системе in vivo синцитий обычно существует не более 4-5 дней. В настоящее время предполагается, что способность некоторых вирусов индуцировать образование синцития и их онколитический потенциал взаимосвязаны. В поддержку этой гипотезы свидетельствуют следующие факты.
С помощью генной инженерии гены, которые кодируют белки слияния, необходимые для процесса образования синцития, можно перенести из вируса одного типа в другой. Показано, что такой перенос придает онколитический потенциал вирусам, которые до этого не обладали таким потенциалом (37), (38). Этот потенциал можно было дополнительно повысить с помощью аминокислотных замен, приводящих к созданию более активных белков с увеличенной способностью вызывать слияние клеток (39), (40). Даже плазмиды (41), (42), (43) или вирусные векторы (44), (45), (46), кодирующие мембранные гликопротеины со сходной функцией, были способны вызывать существенную регрессию опухолей.
2. Уничтожение злокачественных клеток посредством специфического противоопухолевого иммунитета:
а) Нейраминидаза (НА) парамиксовирусов удаляет сиаловые кислоты с поверхности злокачественных клеток. Многие опубликованные работы продемонстрировали, что повышенный уровень сиалирования мембран клеток связан с процессом их малигнизации: с клеточным инвазивным и метастатическим потенциалом (47), (48), (49), (50), (51), (52), (53).
Исследования, проведенные с использованием некоторых ингибиторов сиалирования, показали снижение злокачественности раковых клеток (54), (55), (56).
Возможно, сиалирование развилось как механизм, способствующий избеганию злокачественными клетками иммунологического надзора организма хозяина путем обеспечения клеточной поверхности толстой "оболочкой", которая скрывает раковые антигены. Было показано, что десиалирование опухолевых клеток снижает их потенциал роста посредством активации натуральных клеток-киллеров (НК). Более того, обработанные сиалидазой опухолевые клетки лучше активируют секрецию ИНФ-гамма НК-клетками. Показано, что активность и цитотоксичность НК-клеток зависит от экспрессии специфичных для поверхности опухолевых клеток сиаловых кислот (57).
Гемагглютинин-нейраминидаза (ГН) - это белок со способностью вызывать гемагглютинацию, а также с ферментативной активностью. Нейраминидазы (НА) - это часть молекулы ГН, которая является ферментом (сиалидазой) и расщепляет сиаловую кислоту на поверхности клетки. НА можно обнаружить у некоторых представителей онколитических парамиксовирусов: вируса болезни Ньюкасла, вируса Сендай и вируса эпидемического паротита (58), (59). НА распознает рецепторы на поверхности клетки, которые представляют из себя полимеры сиаловой кислоты. НА также способствует слиянию клеток, что помогает вирионам-потомкам распространяться, избегая взаимодействия с антителами хозяина. НА также способна удалять остатки сиаловой кислоты с поверхности злокачественных клеток (59), (60). Было показано, что такое удаление может приводить к существенному изменению способности клеток В-лимфомы стимулировать цитолитические Т-лимфоциты. Был проведен эксперимент с тремя различными типами сиалидаз, из них одна являлась НА вируса болезни Ньюкасла (60). Показано, что НА вируса болезни Ньюкасла может расщеплять 2,3- и 2,6- (61) и 2,8-связи между остатками сиаловой кислоты (62). Также было показано, что в системе in vitro не наблюдается существенного различия в специфичности по отношению к субстрату расщепления между вирусом болезни Ньюкасла, вирусом Сендай и вирусом эпидемического паротита (63). Данные наблюдения позволяют предположить, что злокачественные клетки становятся десиалированными после обработки опухоли вирусом Сендай и этот процесс вносит вклад в усиление противоопухолевого иммунологического надзора.
б) Предпочтительная высокая аффинность парамиксовирусов в отношении злокачественных, а не нормальных клеток. Полимеры сиаловых кислот являются клеточными рецепторами для некоторых парамиксовирусов, в том числе для вируса Сендай. Поскольку любой вирус связывается со своим рецептором с высокой аффинностью, присутствие сиаловых кислот на поверхности опухолевых клеток в большом количестве способствует предпочтительной ассоциации вируса со злокачественной, а не с нормальной клеткой, что приводит к более высокой концентрации вирусов в опухолях и метастазах по сравнению с нормальными тканями.
В настоящее время показано, что жизнеспособность двух типов клеток рака простаты человека, РСЗ и DU145, существенно подавляется инактивированным УФ вирусом Сендай. Апоптоз клеток РСЗ наблюдается через 24 ч после обработки вирусом Сендай, при этом ингибирования роста нормального эпителия простаты не наблюдается (35). Данное исследование, по мнению авторов, подтверждает, что чувствительность опухолевых клеток простаты к вирусу Сендай в значительной степени вызвана большим количеством содержащих сиаловую кислоту рецепторов к этому вирусу на поверхности этих клеток и, следовательно, его большей аффинностью к этим клеткам.
в) Стимуляция продукции интерферонов (ИФН) типа I и II. Показано, что в лейкоцитах периферической крови человека (ЛПКЧ) вирус Сендай является сильным стимулятором интерферона альфа (ИФН-альфа) (64). Он индуцирует секрецию по меньшей мере девяти различных видов ИФН-альфа: ИФН-альфа 1a, ИФН-альфа 2b, ИФН-альфа 4b, ИФН-альфа 7а, ИФН-альфа 8b, ИФН-альфа 10а, ИФН-альфа 14с, ИФН-альфа 17b и ИФН-альфа 21b. Среди них основным подтипом являлся ИФН-альфа 1а, который составлял примерно 30% суммарного лейкоцитарного ИФН-альфа (65). Вирус Сендай также способен стимулировать в ЛПКЧ продукцию ИФН-гамма (66). Вирус Сендай был выбран среди множества других вирусов для применения в производстве ИФН из лейкоцитов человека в промышленном масштабе (67).
Инактивированный УФ вирус Сендай может индуцировать секрецию ИФН-альфа и ИФН-бета в некоторых линиях опухолевых клеток (35). Такой инактивированный вирус также индуцирует секрецию ИФН I типа дендритными клетками мыши. Показано, что эта индукция происходит по независимому от слияния клеток механизму, однако, по-видимому, за этот эффект отвечает белок слияния F (68).
В настоящее время известно, что стимуляция интерферонов способствует онколитическому иммунонадзору несколькими способами. Интерфероны I типа и ИФН-гамма существенно повышают уровень представления антигенов, зависимых от главного комплекса гистосовместимости I (ГКГС I). ИФН-гамма значительно активирует ГКГС II-зависимое представление антигенов. Оба эти процесса вызывают повышение уровня представленности опухолеспецифичных антигенов злокачественными и специальными антиген-презентирующими клетками, что ведет к стимулированию пролиферации и активности противоопухолевых цитотоксичных Т-клеток. Интерфероны также способны ингибировать ангиогенез, изменяя стимулы, поступающие от опухолевых клеток, и подавляя размножение эндотелиальных клеток. Это ингибирование коррелирует с пониженной васкуляризацией опухоли и последующим замедлением роста опухоли (см. обзоры в (69), (70), (71)).
г) Вирус Сендай стимулирует продукцию других цитокинов. Показано, что вирус Сендай способен стимулировать в лейкоцитах периферической крови человека (ЛПКЧ) продукцию интерлейкина-2 (66), макрофагального воспалительного белка-1 альфа (MIP-1альфа), MIP-1бета, RANTES, интерлейкина-6 (IL-6), IL-8 и МСР-1 (64). Введение вируса Сендай животным показало, что как живой, так и облученный УФ вирус стимулирует высвобождение IL-6 (32). Было продемонстрировано, что в дендритных клетках за стимуляцию секреции IL-6 отвечал белок слияния F вируса Сендай (68). Инактивированный УФ вирус Сендай индуцировал экспрессию белка-10, индуцированного интерфероном гамма, после его инъекции в опухоли рака почки (Renca) (34).
д) Параминсовирусы способны стимулировать натуральные киллеры (НК). Активированные НК способны разрушать опухолевые клетки без предварительной стимуляции антигеном. Эти клетки являются частью важной ветви врожденной иммунной системы организма, действие которой запускается сразу после обнаружения патогена и не включает развития иммунологической памяти на антиген. У НК есть несколько рецепторов, ответственных за их активацию. Среди этих рецепторов - два белка, NKp46 и NKp44. Были получены свидетельства того, что НК активируются всего одним белком парамиксовирусов, а именно - ГН (72). Предполагается, что активация НК инактивированным действием УФ вирусом Сендай, которую наблюдали в исследовании (34), связана с взаимодействием белка ГН с NKp46 и/или NKp44. Вирусы способны внедрять молекулы ГН в поверхность опухолевых клеток, что может приводить к их гибели. Было показано, что эффективное связывание белков NKp46 и/или NKp44 с ГН приводит к лизису клетки, имеющей на своей поверхности белок ГН (73), (74), (75).
Исследование инактивированного УФ вируса Сендай показало, что НК играют важную роль в опосредованной вирусом регрессии роста опухоли. На модели рака почки у мыши противоопухолевое действие вируса было снижено при совместной инъекции антитела против GM1, которое снижает количество НК-клеток (34).
е) Индукция противоопухолевой цитотоксической активности Т-лимфоцитов. Показано, что вирус птичьей болезни Ньюкасла (ВПБН) усиливает опухолеспецифический цитотоксический ответ CD8 Т-клеток (CTL) и повышает активность CD4 Т-хелперных клеток в отсутствие антивирусного ответа Т-клеток (76). Инактивированный УФ вирус, который не способен реплицироваться, оказался таким же активным, как и интактный, способный к репликации, ВПБН в отношении стимуляции противоопухолевого CTL-ответа. По-видимому, влияние ВПБН на CTL-ответ вызвано внедрением функциональных молекул вирусного белка ГН в поверхность опухолевых клеток, а также стимуляцией нейраминидазной активности (76), так как белки ГН вирусов Сендая и ВПБН являются в высокой степени гомологичными. Эти данные позволяют утверждать, что белок ГН, независимо от того, происходит он от вируса Сендай или от ВПБН или от других родственных парамиксовирусов, активирует как НК-, так и ответы, связанные с цитотоксичными лимфоцитами.
ж) Стимуляция дендритных клеток. Дендритные клетки (ДК) являются специализированными антиген-презентирующими клетками, которые способны эффективно стимулировать как врожденные, так и приобретенные иммунные ответы против различных патогенов и опухолей. После обнаружения вируса или иного патогена в ДК запускается специальная программа развития, в результате чего ДК становятся компетентными к активации наивных Т-клеток.
Даже инактивированный УФ вирус Сендай вызывает интенсивную инфильтрацию опухоли дендритными клетками (ДК) (32), при этом ex vivo инфекция ДК рекомбинантным вирусом Сендай индуцирует созревание и активацию ДК всего за один час (77). Обработка с применением активированных ДК, несущих различные варианты рекомбинантных вирусов Сендай, существенно повышает выживание животных, привитых клетками злокачественных меланом (78), (79), карциномы толстой кишки (80), плоскоклеточной карциномы (81) гепатоцеллюлярного рака, нейробластомы и рака простаты (31). Введение таких ДК перед инокуляцией опухолевых клеток продемонстрировало способность эффективно предотвращать образование легочных метастазов клетками нейробластомы (82) и аденокарциномы простаты (83).
з) Подавление регуляторных клеток. Эксперименты на животных моделях показали, что некоторые штаммы даже инактивированного УФ вируса Сендай подавляют регуляторную, опосредованную Т-клетками иммуносупрессию посредством секреции IL-6 зрелыми ДК (32).
Таким образом, в настоящее время известен целый ряд механизмов, посредством которых может осуществляться онколитическое действие вируса Сендай. Степень онколитического действия и преобладающий механизм зависят от индивидуальных особенностей штамма. Вирус может напрямую убивать злокачественные клетки, реплицируясь в них. Вирус Сендай вызывает образование клеточного синцития. Клетки, слившиеся в синцитий, более не могут делиться и обречены на коллективную синхронную гибель. Кроме того, вирус вызывает опосредованное иммунной системой уничтожение злокачественных клеток, происходящее за счет сильной противоопухолевой активации натуральных киллеров, а также благодаря усилению противоопухолевой цитотоксической активности Т-клеток, стимуляции антигенпрезентирующих дендритных клеток и подавления иммуносупрессорной активности Т-клеток. Содержащийся в капсидной оболочке вируса фермент нейраминидаза способна отщеплять сиаловые кислоты с поверхности злокачественных клеток, демаскируя присутствующие на клеточной мембране раковые антигены. При этом раковые клетки становятся заметны для иммунной системы. Кроме того, вирусная нейраминидаза может обеспечивать большое специфическое сродство вируса к полимерам сиаловых кислот, присутствующим в избытке на мембранах раковых клеток. За счет этого увеличивается вирусная специфичность к клеткам первичных опухолей и метастазов по отношению к нормальным клеткам.
Раскрытие изобретения
В середине 50-х годов из Японии академиком АМН В.М. Ждановым был получен штамм вируса Сендай, который в дальнейшем был использован в Институте Вирусологии им. Д.И. Ивановского РАМН в качестве модельного патогена (84) (85) (86). В конце 60-х годов из лаборатории В.М. Жданова данный штамм был передан авторам изобретения и получил название Московский штамм. Штамм в дальнейшем прошел примерно 30 пассажей в куриных яйцах в лаборатории Всесоюзного Онкологического Научного Центра (ВОНЦ) АМН. Известно, что длительное пассирование вируса в культуре клеток или тканей часто приводит к модификации вируса. Таким образом, были получены многие известные в настоящее время вакцинные штаммы. В данном случае длительное пассирование московского вируса Сендай привело к получению его модифицированного варианта. Его высокая безопасность для человека и животных делали его перспективным агентом для использования в терапии пациентов и животных, страдающих злокачественными опухолями.
Авторы изобретения разработали фармацевтическую иммуногенную композицию, состав которой основан на очищенном изолированном биологически активном вирусе и способ лечения пациентов, страдающих злокачественными солидными опухолями или нуждающимися в иммунотерапии против метастазов, посредством введения им данной композиции. При включении в состав композиции дополнительно клеток, полученных из опухолевого материала больного, достигается дополнительный терапевтический эффект за счет усиления вирусом иммунного ответа против аутологичных опухолевых клеток.
В предпочтительном воплощении в состав композиции должен вводиться живой вирус. Однако вирус может быть предварительно до введения в композицию инактивирован при помощи ультрафиолетового излучения. Вирус может быть размножен в куриных эмбрионах либо может быть адаптирован к размножению в клеточной культуре. Вирус может представлять из себя исходный штамм или генно-инженерный конструкт, созданный на основе вируса Сендай. Вирусный материал может быть собран из аллантоисной жидкости или из клеточной среды. Вирус может быть введен в композицию в форме суспензии в аллантоисной жидкости либо лиофилизированным. Фармацевтически приемлемыми носителями, которые могут быть использованы в композиции настоящего изобретения, являются (яичная аллантоисная жидкость) свежая аллантоисная жидкость эмбрионов кур, лиофилизированная аллантоисная жидкость, физиологический раствор или водные буферы, такие как PBS и т.п. Кроме того, композиция настоящего изобретения может содержать другие добавки, такие как адъюванты, стабилизаторы, антиоксиданты и т.п.
Вирус вводят в организм пациента в очищенной форме в составе фармацевтической вакцинной композиции в сочетании с физиологическим раствором или другим фармацевтически приемлемым носителем. Композиция может быть введена в организм различными способами, в частности внутрикожно, подкожно, внутримышечно или внутрь опухоли. Наиболее предпочтительным является введение внутрь опухоли. Следующим по уровню предпочтения является внутрикожное введение. Вирус может входить в состав композиции в нативной или инактивированной форме. Наиболее предпочтительным является введение живого вируса.
Композиция может содержать также вирус в комбинации с инактивированными радиацией клетками, полученными дисперсией из опухолевого материала больного. Кроме того, композиция может быть введена в организм пациента в комбинации с инактивированными радиацией клетками, полученными из иммуногенных опухолевых клеточных линий. Композиция может быть введена в организм пациента в сочетании с клетками куриных эмбрионов, при этом возможна дополнительная репликация вируса в клетках куриных эмбрионов в теле пациента, что усиливает его терапевтическое действие.
Способ лечения включает, по меньшей мере, одно введение пациенту эффективного количества композиции по изобретению. В предпочтительном воплощении курс иммунотерапии включает 12 инъекций вакцинной композиции. Инъекции производятся с интервалом 7-10 дней. Предпочтительно вводить инъекционный материал небольшими дозами. Например, если необходимо ввести в опухоль 1 мл композиции, введение предпочтительно произвести в 10 точек по 100 мкл для достижения максимально равномерного распространения вируса внутри опухоли. Предпочтительно даже при отсутствии признаков прогрессии онкологического заболевания повторять курс иммунотерапии каждые 2-3 года.
При введении лиофилизированного препарата вируса титр вируса составляет обычно от 6 до 7, а при введении нативного (нелиофилизированного) варианта от 7 до 8 эмбриональной инфекционной дозы 50% (ЭИД 50%) на мл. Если по каким-либо причинам фармацевтическую композицию невозможно ввести внутрь опухоли, то ее предпочтительно вводить внутрикожно. Введение предпочтительно произвести в 10 точек по 100 мкл для достижения максимально равномерного распространения вируса внутри кожи.
Раскрытый в изобретении способ лечения был успешно применен на практике в Москве и в Санкт-Петербурге в 80-90-х годах для лечения онкологических больных с солидными опухолями (карциномами и саркомами). В примерах 1-5 описаны краткие истории болезни пациентов, в примерах 6 и 7 описаны ветеринарные случаи. В примере 8 представлено заключение о результатах совместного оперативно-иммунного лечения онкологических больных с солидными опухолями III- IV стадии на базе Городской клинической больницы №26 г. Санкт-Петербурга. После операций все больные проходили в течение 3-4 месяцев курс иммунотерапии в соответствии с раскрытым в настоящем изобретении способом. Выживание без признаков онкозаболеваний наблюдалось у 11 из 12 больных после проведения радикальных операций и у 4 из 15 больных после туморредуктивных операций.
В настоящее время раскрытый в изобретении штамм Сендай-Москва депонирован для целей патентной процедуры в коллекцию клеточных культур АТСС, где ему присвоен номер РТА-13024.
Осуществление изобретения
Протокол наращивания вируса
Для выращивания вируса Сендай применяют стандартную методику размножения вируса в амниотической полости эмбрионов оплодотворенных куриных яиц.
Вирус выращивали в свободных от патогенной микрофлоры куриных эмбрионах. Для инъекций пациентам вирус проверяли на стерильность.
Оплодотворенное яйцо 7-го дня эмбрионального развития инокулировали вирусным материалом. Для обеспечения асептики скорлупу стерилизовали 70% раствором этилового спирта, затем в скорлупе яйца проделывали отверстие, через которое в аллантоисную жидкость вводили шприцем 100 мкл вирусного материала. После инокуляции вируса это отверстие заклеивали расплавленным воском. Инкубацию зараженных яиц производили при температуре 37.5°С в течение трех суток. После инкубации из яиц через окно в скорлупе шприцем собирали аллантоисную жидкость. Выход составлял примерно 3 мл аллантоисной жидкости из каждого яйца. Аллантоисную жидкость центрифугировали 10 мин 1000g при 4°С, для избавления от кусочков, и далее расфасовывали на аликвоты. Хранение аллантоисной жидкости с суспендированным вирусным материалом производили при -80°С. Частично препарат с вирусом был лиофилизирован. Хранение лиофилизированного материала может производится при -20°С. Титр лиофилизированной части препарата составляет обычно от 6 до 7, а нелиофилизированной от 7 до 8 эмбриональной инфекционной дозы 50% (ЭИД 50%) на мл.
Приготовление клеточного материала для вакцинации
А. Приготовление клеток для дополнительной репликации вируса в теле пациента
Трех-пятидневные куриные эмбрионы собирают стерильно и диспергируют сначала мельчением ножницами и затем пипетированием в физрастворе, содержащем 10% сыворотку и антибиотики: пенициллин 100 IU/мл и стрептомицин 100 мкг/мл (ПС). В случае приготовления суспензии клеток куриных эмбрионов впрок к суспензии добавляют 10% DMSO и замораживают с контролируемой скоростью замерзания по стандартному протоколу. Суспензию хранят в аликвотах в жидком азоте или при -130°С. Всю работу с клетками куриных эмбрионов после размораживания следует проводить в холодной комнате и/или в ледяной бане. Отмывку от DMSO производят 10-кратным разведением содержимого размороженной аликвоты полным физраствором с 10% сыворотки и ПС с последующим центрифугированием.
После отмывки клетки ресуспендируют в 1 мл аллантоисной жидкости, содержащей вирус Сендай, и инкубируют 30 мин в ледяной бане для адсорбции вируса на поверхность клеток. Полученную композицию вводят больному внутрикожно, в несколько точек, примерно по 100 мкл в точку. Для проведения одной инъекции требуется использовать все количество клеток, полученное из 2-3 эмбрионов.
В случае доступности операционного опухолевого материала больного, суспензию эмбриональных клеток смешивают с суспензией инактивированных опухолевых клеток. Эту суспензию следует готовить заранее путем клеточной дисперсии опухолевого материала. Для проведения одной инъекции требуется около 5-20 млн живых опухолевых клеток. Вирус может пролиферировать, правильно процессироваться и в культурах клеток млекопитающих. Такие клетки, обезвреженные радиацией тоже можно вводить пациентам.
Б. Приготовление собственного опухолевого материала без высадки в культуру.
После операции опухолевый материал разделяют на две части. Одну часть используют для патологогистологической идентификации, другую часть сохраняют при 4°С, поместив в культуральную среду или полный физраствор с 10% сывороткой и ПС, для последующего приготовления материала вакцины. Крайне желательно последующую обработку опухоли производить в течение первых часов после хирургической операции. В 1 г опухолевого материала содержится примерно 1 млрд клеток, но эта оценка сильно варьирует для разных опухолей.
Для приготовления аутологичной вакцины опухолевый материал подвергают механической дисперсии и последующей энзиматической обработке. Стерильными острыми ножницами опухоль размельчают до кусочков размером 2-3 мм в чашке Петри. Полученные фрагменты опухоли обрабатывают ферментами. Для этого размельченный ножницами опухолевый материал заливают раствором 0.2% коллагеназы и 10 мг/мл ДНКазы в полной среде с 10% сывороткой (вместо среды можно использовать полный физраствор) с ПС. Полученную смесь инкубируют 15 мин при 37°С или ночь при 4-8°С. После инкубации с ферментами, для дальнейшей клеточной дисперсии, материал подвергают неинтенсивному осторожному пипетированию. После пипетирования смесь центрифугируют 1 мин при 1000g для удаления кусочков опухоли, плохо подвергшихся дисперсии. Для достижения той же цели клеточную суспензию можно подвергать фильтрованию через нейлоновую сетку с размером пор 40 p~m. После удаления кусочков опухоли, плохо подвергшихся дисперсии, в клеточную суспензию добавляют проназу (0.1%) для переваривания мертвых клеток. При короткой инкубации проназа переваривает погибшие клетки, а при более длительной начинает переваривать живые, поэтому обработка проназой должна быть очень короткой. Суспензию инкубируют с ферментами 2 мин при комнатной температуре и дальше подвергают центрифугированию на холоде в течение 5 мин для осаждения клеток. В случае последующего использования свежеполученных опухолевых клеток для приготовления вакцины клетки после центрифугирования ресуспендируют в культуральной среде или полном физрастворе с добавлением 10% сыворотки и ПС. Жизнеспособность клеток после процесса дисперсии оценивают с помощью раствора красителя трипанового синего. На одну вакцинацию необходимо использовать 5-20 млн живых опухолевых клеток.
В случае последующего замораживания клеток после центрифугирования их ресуспендируют в полной среде с 15% сывороткой и 10% DMSO. После добавления DMSO суспензию клеток замораживают с контролируемой скоростью замерзания по стандартному протоколу. Суспензию хранят в аликвотах в жидком азоте или при -130°С. Отмывку клеток от DMSO проводят в 10-кратном объеме культуральной среды или полного физраствора с добавлением не менее 10% сыворотки и ПС. Инактивацию клеточной способности к пролиферации производят с помощью гамма-облучения (200 Gy). Можно облучать клетки до и после замораживания, в последнем случае клетки транспортируют к источнику радиации в сухом льду и облучают замороженными. Жизнеспособность клеток после процесса дисперсии оценивают с помощью раствора красителя трипанового синего. Тест на жизнеспособность клеток должен выявлять не менее 75% живых клеток. На одну вакцинацию необходимо использовать 5-20 млн живых опухолевых клеток.
В. Приготовление иммуногенных клеточных линий
Целями высадки клеток в культуру являлись: 1) избавление от поврежденных и мертвых клеток и получение одноклеточной суспензии живых клеток; 2) пролиферация опухолевых клеток для получения большего их количества. Для приготовления иммуногенных клеточных композиций опухолевый материал самого больного или материал больных с опухолями сходного гистогенеза подвергают механической дисперсии и последующей энзиматической обработке по протоколу, приведенному выше в пункте Б.
После диспергирования ткани опухоли опухолевые клетки помещали в культуральные матрасы с полной культуральной средой (RPMI, DMEM), 10% сыворотки и антибиотиками (ПС). Клетки растили в культуральных условиях 2-3 суток. Затем клетки снимали с матрасов трипсином по стандартной методике. Подсчет клеток производили под микроскопом после окраски трипановым синим. На одну вакцинацию использовали 5-20 млн живых, но инактивированных радиацией опухолевых клеток. Инактивацию клеточной способности к пролиферации производят с помощью гамма-облучения (200 Gy).
Варианты введения фармацевтических композиций
1. Фармацевтическую композицию можно вводить внутрь опухоли (см.примеры 2, 6, 7)
2. Фармацевтическую композицию можно вводить внутрикожно (см примеры 1, 3-5, 8)
3. Первый и второй способы введения фармацевтической композиции являются предпочтительным, однако эту композицию можно вводить и другими парентеральными способами, в частности подкожно, внутримышечно и, вероятно, внутривенно. Способ внутривенной инъекции высокоочищенного вируса может быть разработан на основе фармацевтической композиции, включающей высокоочищенный вирус Сендай в дозировках, сходных с дозировками введения вируса болезни НьюКастла, ранее описанными в литературе. Соответствующие клинические испытания ранее были проведены с штаммом вируса НьюКастла PV101 http://www.cancer.gov/cancertopics/pdq/cam/NDV/HealthProfessional/page2
Оценка развивающейся иммунной реакции к собственным раковым клеткам по мере вакцинации
Для оценки развивающейся иммунной реакции к собственным раковым клеткам по мере вакцинации использовалась реакция замедленной гиперчувствительности. Для. этого пациентам вводились гамма-облученные опухолевые клетки (200 Gy) без вируса. Диаметр образовавшейся после введения клеток эритемы измерялся через 24 часа после инъекции. Реакция считалась позитивной, если диаметр эритемы был больше 7 мм. По мере увеличения чипа вакцинаций, проведенных для каждого пациента, и соответственно регулярной стимуляции иммунного ответа к раковым клеткам эритема должна увеличиваться.
Примеры терапевтического действия вируса Сендай
Ниже приведены примеры значительного положительного эффекта, полученного после применения заявленного способа для лечения неинкурабельных онкологических больных.
Пример 1
Больной К.В., 1922 г.р. В I-1989 г. больному был поставлен диагноз - аденокарцинома предстательной железы. У него был выявлен метастаз в позвоночник с началом компрессии L-1. Больной был полностью обездвижен из-за непереносимых болей в позвоночнике, тазовых костях и правом голеностопном суставе на протяжении 3-х месяцев. Выписан из больницы на наркотиках как безнадежный. Прошел курс иммунотерапии согласно изобретению со II-1989 по V-1989. К концу лечения боли полностью исчезли, больной приобрел нормальную физическую подвижность. Через 3 месяца после окончания иммунотерапии прошел обследование в Онкологическом Научном Центре (ОНЦ) АМН. По результатам обследования на VIII-IX-1989 ни опухоли, ни признаков метастазов не обнаружено. На рентгенограмме найдена деструкция позвонка L-1. Через 5 лет после окончания иммунотерапии объективных и субъективных симптомов онкологического заболевания не имел. Больной жив и не обнаруживает признаков онкологического заболевания в 2012 году.
Пример 2
Больная З.Л., 1929 г.р. В Х-1991 больной была проведена мастэктомия по поводу рака правой молочной железы. В начале 1992 г. в операционном рубце и в прилежащей коже появились множественные метастазы, образующие сливной рост (панцирный рак). От предложенной химиотерапии больная отказалась. Прошла 2 курса иммунотерапии согласно изобретению с III-92 по XII-92 г. Метастазы полностью рассосались. Через 5 лет после окончания иммунотерапии объективных и субъективных симптомов онкологического заболевания не имела.
Пример 3
Больная Ф.Л., 1941 г.р. В VII-1991 у больной произведена экстирпация матки с придатками по поводу рака яичника (низкодифференцированная аденокарцинома). В связи с обтурационной тонкокишечной непроходимостью была наложена колостома. На лапаротомии был обнаружен спаечный процесс в малом тазу с наличием нескольких крупных метастазов диаметром до 5 см, один из которых пророс в просвет тонкой кишки. От предложенной химиотерапии отказалась. Выписана на симптоматическое лечение по месту жительства. Прошла курс иммунотерапии согласно изобретению с XI-91 по I-92 гг. Через 5 лет после окончания иммунотерапии объективных и субъективных симптомов онкологического заболевания не имела.
Пример 4
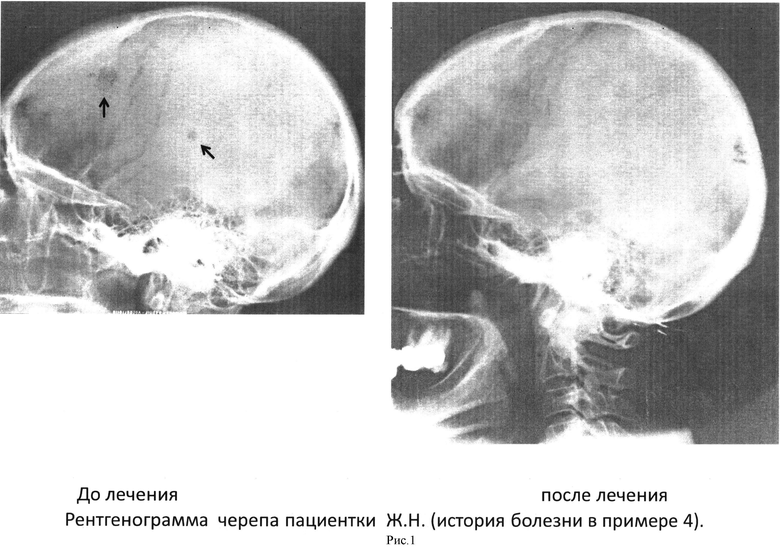
Больная Ж.Н., 1939 г.р. В Х-1986 больной была проведена радикальная мастэктомия по поводу инфильтративного мультицентричного рака левой молочной железы. В II-91 г. появились внутрикожные узлы в рубце, которые были иссечены. В начале 91 г. был обнаружен метастаз в диафизе левой большеберцовой кости. В связи с этим прошла курс иммунотерапии. При обследовании в ОНЦ в Х-91 были обнаружены еще метастазы в левой теменной кости, в медиальном отделе крыла левой подвздошной кости и в области левого крестцово-подвздошного сочленения. Рекомендовано гормональное лечение, от которого больная отказалась. Прошла 2-й курс иммунотерапии с Х-91 по II-92 г. Результаты рентгенологических обследований в ОНЦ. Таз, бедренные кости и крестец: 1993 г. - практически нормализовалась структура поврежденных костей. 1997 г. - в видимых отделах скелета нет признаков метастазов - полная репарация. Череп: 04.92 - плохо виден только метастаз в лобной кости, в теменных костях метастазов нет. Рентгенограмма черепа показана на фиг.1. 12.92 - метастазы не определяются - полная репарация. Через 5 лет после окончания иммунотерапии объективных и субъективных симптомов онкологического заболевания не имела.
Пример 5
Больной М.И., 1940 г.р. В V-1992 г. произведена операция резекции прямой кишки по поводу аденокарциномы. Проведено предоперационное облучение. На лапаротомии обнаружены метастазы в регионарные лимфоузлы, обсеменение брюшины, асцит, метастаз в печень. Прошел курс иммунотерапии согласно изобретению с I-93 по IV-93. После окончания иммунотерапии развилась обтурационная непроходимость, связанная со спаечным процессом в кишечнике. Была проведена операция по устранению непроходимости. На лапаротомии признаков онкологического заболевания не найдено. На нижней поверхности печени обнаружены рубцы. Через 5 лет после окончания иммунотерапии объективных и субъективных симптомов онкологического заболевания не имел.
Пример 6
Собака Люся, 1993 г.р. В 2004 г. была произведена радикальная операция: резекции всех молочных желез в связи с множественными опухолями. Патологогистологическое исследование определило, что опухоли являются тубулярными аденокарциномами. Через месяц при послеоперационном осмотре у собаки было обнаружено два новых растущих узла. Один из них располагался внутри шовного рубца в области грудной клетки (примерно 1 см в диаметре), другой в лимфоузле паховой области (тоже примерно 1 см в диаметре). Было принято решение использовать вирус Сендай-Москва для борьбы с этими метастатическими новообразованиями. После трех инъекций вирусного материала внутрь опухоли, располагающейся в шовном рубце, метастаз рассосался. После 9 инъекций вирусного материала подкожно в паховую область, где располагался метастаз лимфоузла, этот метастаз тоже рассосался.
У этого же животного в 2006 г. была выявлена крайне быстро растущая междигитальная опухоль (III-IV) на передней правой лапе. За полтора месяца опухоль выросла с 3 мм до 1.5 см. Аспиратная биопсия и последующее патогистологическое исследование определило, что опухоль содержит злокачественные тучные клетки и является низкодифференцированной. Было предложено удалить лапу, поскольку без такой радикальной операции прогноз долгосрочного выживания животного был крайне неблагоприятным. С помощью инъекций вируса удалось вызвать стабилизацию быстро растущей опухоли у этой собаки. Опухоль перестала расти после первой инъекции вируса, однако последующие 12 инъекций не привели к ее рассасыванию. Аспиратная биопсия и последующее патогистологическое исследование по-прежнему определяли, что опухоль содержит злокачественные тучные клетки и является низкодифференцированной, в связи с чем было принято решение о хирургическом вмешательстве. После частичного хирургического удаления и однократного введения вируса в операционный шов через две недели после операции остатки опухоли регрессировали.
Пример 7
Собака Али, 2001 г.р. У животного наблюдался медленный рост опухоли. Опухоль была обнаружена в ноябре 2007 года на предплечье. К февралю 2009 года опухоль удвоилась и достигла размера примерно 5 см в диаметре. Аспиратная биопсия и последующее патогистологическое исследование определили, что опухоль является фибросаркомой. С помощью инъекций вируса Сендай-Москва, проведенных с марта по май 2009 г. удалось вызвать сначала стабилизацию роста опухоли, а потом и ее регрессию. Всего было сделано 10 инъекций вируса. Примерно через три месяца после первой инъекции вируса опухоль начала медленно уменьшаться в размере. Она уменьшилась до размера 1 см еще через три месяца, к концу августа. При этом проведенная вновь аспиратная биопсия из нескольких точек опухоли злокачественных клеток не выявила.
Пример 8
Заключение о результатах совместного оперативно-иммунного лечения онкологических больных III-IV стадии
(выдано вед.научн. сотр. ОНЦ РАМН к.м.н. В.М. Сенину)
В настоящем заключении представлены результаты наблюдения за состоянием онкологических больных с солидными опухолями, поступивших в торако-абдоминальное отделение Гор.клин. больницы №26 Санкт-Петербурга в инкурабельном и иноперабельном состоянии по данным других клиник.
Оперативное и последующее иммунное лечение проведено с II-95 по IV-96. За это время прооперировано 27 больных с различной локализацией и гистогенезом опухолей. Около половины из них подверглись радикальным операциям с удалением основной опухоли и всех обнаруженных метастазов. Другая половина подверглась паллиативным, максимально туморредуктивным операциям. После операций все больные проходили на протяжении 3-4 месяцев курс иммунотерапии аутогенными онковакцинами в модификации В.М. Сенина.
За годичный срок последующего наблюдения получены такие результаты. После радикальных операций выживание без признаков онкозаболеваний наблюдается у 11 из 12 (92%) больных. После туморредуктивных операций выживание отмечено у 4 из 15 пациентов (27%) без признаков прогрессии заболевания. Такие результаты существенно отличаются от данных исторического и синхронного контроля и свидетельствуют о достаточно высокой эффективности и перспективности послеоперационной иммунотерапии онкобольных аутовакцинами, с учетом инкурабельного и иноперабельного состояния этих больных перед началом оперативно-иммунного лечения.
20.12.96.
Главный врач Гор.клин. больницы №26 г. Санкт-Петербурга Заслуженный врач России Е.С. Железняк (подпись)
Главный хирург 6-цы, д.м.н. проф. Зав. Кафедры торакальной хирургии Мед. Акад. Последипломн. Образования В.А. Тарасов (подпись)
Зав. Торако-абдоминального отделения больницы В.В. Ставровиецкий (подпись)
Круглая печать: Комитет по здравоохранению мэрии Санкт-Петербурга, Гор.клин. больница №26
Приложение к заключению о результатах совместного оперативно-иммунного лечения онкологических больных III-IV стадии
Больные после радикальных операций
1) Шефов П.А. 1914 г.р., ист.б-ни №26621. Рак ректосигмоидного отдела толстой кишки IV ст. T4N2M0. Дифференцированная аденокарцинома (тубулярная) с прорастанием всех слоев стенки кишки. Дата опер. 4.12.95. Результат через год и более = 1 (см. примечание)
2) Сизов В.М., 1954 г.р., ист.б-ни №23974. Рак щитовидной железы с метастазами в легкие, IV ст. Солидный медуллярный рак с амилоидозом стромы. T4N3M1. Опер. 30.10.95. Рез-т=1.
3) Прилуцкая М.Н., 1940 г.р., ист.б-ни №2624. Опухоль забрюшинного пространства 30×40×20 см. Низкодифференцированная адренокортикальная карцинома. Метастазы по брюшине. T4N1M1. Опер. 15.02.96. Рез-т=1.
4) Телица Н.В. 1962 г.р. ист.б-ни 24176. Периферический рак левого легкого III ст. Аденокарцинома. T4N3M0. Опер. 16.10.95. Рез-т=1.
5) Гордеев В.А., 1937 г.р., ист.б-ни №25882. Рак ректо-сигмоидного отдела толстой кишки, метастаз в брыжейку. IV ст. Сосочковая карцинома, прорастающая в стенку кишки. T3N1M0. Опер. 29.11.95. Рез-т=1.
6) Павлов Л.И., 1930 г.р., ист.б-ни №26620. Инфильтративный периферический рак В6 левого легкого III ст. Эпидермоидная низкодифференцированная карцинома. T3N0M0. Опер. 7.12.95. Рез-т=1.
7) Резун М.Я., 1925 г.р. ист.б-ни №13277. Рак кардиального отдела желудка IV ст. Низкодифференцированный рак. T4N1M0. Опер. 21.6.95. Рез-т=1.
8) Щербакова Н.Д., 1953 г.р. ист.б-ни №22237. Мезотелиома плевры тубулярно-солидного строения, злокачественная форма. T4N2M0. Опер. 11.10.95. Рез-т=1.
9) Спиридонова Н.П., 1934 г.р., ист.б-ни №4757. Рак левой молочной железы с метастазами в лимфоузлы. Инфильтрирующий рак. T3N2M0. Опер. 6.3.95. Рез-т=1.
10) Алтунашвили М.Г, 1978 г.р., ист.б-ни №1336. Синовиальная ангиосаркома лев. голеностопного сустава. T2N0M0. Опер. 19.1.96. Рез-т=1.
11) Билык Д. М., 1941 г.р., ист.б-ни №21590. Низкодифференцир. рак IV ст. прямой кишки T3N2M1. Опер. 29.9.95. Рез-т=1.
12) Целиков. Рак нижнедолевого бронха пр. л-го, T2N2M0. Рез-т=3.
Выжившие больные после туморредуктивных операций
1) Дмитриев В.М., 1930 г.р. ист.б-ни №354. Гипернефроидный рак солиднотубулярного строения левой почки с метастазами в прескаленные л/у слева. Метастаз светлоклеточного рака. IV ст. T3N1M1. Опер. 18.12.95. Рез-т=2.
2) Васильев Г.М., 1948 г.р. ист.б-ни №25310. Инфильтративный рак головки поджелудочной железы. T2N1M0. Опер.30.3.95. Опухоль не убрана. Наложен анастомоз. Рез-т=2
3) Новоселова А.Н., 1932 г.р., ист.б-ни №15130. Рак правой молочной железы IIIб ст. Инфильтрир. аденокарцинома T4N2M0. Опер. 12.7.95. Рез-т=2
4) Удодов (амбул.б-ной). Миксома брюшной полости. T4N1M1 опер. 4.95. Рез-т=2. Опер. в госпитале им. Бурденко, г. Москва.
Примечание. Расшифровка цифровых обозначений результатов
1 - В настоящее время нет признаков онкозаболевания
2 - Стабилизация процесса, отсутствие признаков прогрессии заболевания или регрессия опухоли.
3 - Рецидив, летальный исход.
Главный хирург Гор.клин. больницы №26 г. Санкт-Петербурга, д.м.н. проф. В.А. Тарасов(подпись)
Зав. Торако-абдоминального отделения больницы В.В. Ставровиецкий (подпись)
Авторы патента выражают глубокую благодарность всем сотрудникам торако-абдоминального отделения Городской Клинической больницы №26 г. Санкт-Петербурга. Особенно отмечают огромный вклад в совместную работу проф. В.А. Тарасова, зав.отделения В.В. Ставровиецкого и врача И.В. Львова.
Список цитированной литературы
1. Mullen, J.Т., and Tanabe, K.K. (2002) Viral Oncolysis, Oncologist 7, 106-119.
2. Kelly, E., and Russell, S.J. (2007) History of oncolytic viruses: genesis to genetic engineering, Mol. Ther 15, 651-659.
3. Nakamura, Т., and Russell, S.J. (2004) Oncolytic measles viruses for cancer therapy, Expert Opin Biol Ther 4, 1685-1692.
4. Blechacz, В., and Russell, S.J. (2008) Measles virus as an oncolytic vector platform, Curr Gene Ther 8, 162-175.
5. Galanis, E. (2010) Therapeutic potential of oncolytic measles virus: promises and challenges, Clin. Pharmacol. Ther 88, 620-625.
6. Peng, K.-W., Hadac, E.M., Anderson, B.D., Myers, R., Harvey, M., Greiner, S.M., Soeffker, D., Federspiel, M.J., and Russell, S.J. (2006) Pharmacokinetics of oncolytic measles virotherapy: eventual equilibrium between virus and tumor in an ovarian cancer xenograft model, Cancer Gene Ther 13, 732-738.
7. Dingli, D., Peng, K.-W., Harvey, M.E., Greipp, P.R., O'Connor, M.K., Cattaneo, R., Morris, J.C, and Russell, S.J. (2004) Image-guided radiovirotherapy for multiple myeloma using a recombinant measles virus expressing the thyroidal sodium iodide symporter, Blood 103, 1641-1646.
8. Phuong, L.K., Allen, C, Peng, K.-W., Giannini, C, Greiner, S., TenEyck, C.J., Mishra, P.K., Macura, S.I., Russell, S.J., and Galanis, E.C. (2003) Use of a vaccine strain of measles virus genetically engineered to produce carcinoembryonic antigen as a novel therapeutic agent against glioblastoma multiforme, Cancer Res 63, 2462-2469.
9. Studebaker, A.W., Kreofsky, C.R., Pierson, C.R., Russell, S.J., Galanis, E., and Raffel, C. (2010) Treatment of medulloblastoma with a modified measles virus, Neuro-Oncology.
10. Msaouel, P., lankov, I.D., Allen, C, Aderca, I., Federspiel, M.J., Tindall, D.J., Morris, J.C, Koutsilieris, M., Russell, S.J., and Galanis, E. (2009) Noninvasive imaging and radiovirotherapy of prostate cancer using an oncolytic measles virus expressing the sodium iodide symporter, Mol. Ther 17, 2041-2048.
11. Blechacz, В., Splinter, P.L, Greiner, S., Myers, R., Peng, K.-W., Federspiel, M.J., Russell, S.J., and LaRusso, N.F. (2006) Engineered measles virus as a novel oncolytic viral therapy system for hepatocellular carcinoma, Hepatology 44, 1465-1477.
12. McDonald, C.J., Erlichman, C, Ingle, J.N., Rosales, G.A., Allen, C, Greiner, S.M., Harvey, M.E., Zollman, P.J., Russell, S.J., and Galanis, E. (2006) A measles virus vaccine strain derivative as a novel oncolytic agent against breast cancer, Breast Cancer Res. Treat 99, 177-184.
13. lankov, I.D., Msaouel, P., Allen, C, Federspiel, M.J., Bulur, P.A., Dietz, А.В., Gastineau, D., Ikeda, Y., Ingle, J.N., Russell, S.J., and Galanis, E. (2010) Demonstration of anti-tumor activity of oncolytic measles virus strains in a malignant pleural effusion breast cancer model, Breast Cancer Res. Treat 122, 745-754.
14. Grote, D., Russell, S.J., Cornu, Т.I., Cattaneo, R., Vile, R., Poland, G.A., and Fielding, A.K. (2001) Live attenuated measles virus induces regression of human lymphoma xenografts in immunodeficient mice, Blood 97, 3746-3754.
15. Shimizu, Y., Hasumi, K., Okudaira, Y., Yamanishi, K., and Takahashi, M. (1988) Immunotherapy of advanced gynecologic cancer patients utilizing mumps virus, Cancer Detect. Prev 12, 487-495.
16. Asada, T. (1974) Treatment of human cancer with mumps virus, Cancer 34, 1907-1928.
17. Okuno, Y., Asada, Т., Yamanishi, K., Otsuka, Т., Takahashi, M., Tanioka, Т., Aoyama, H., Fukui, O., Matsumoto, K., Uemura, F., and Wada, A. (1978) Studies on the use of mumps virus for treatment of human cancer, Biken J 21, 37-49.
18. Sinkovics, J.G., and Horvath, J.C. (2000) Newcastle disease virus (NDV): brief history of its oncolytic strains, J. Clin. Virol 16, 1-15.
19. Schirrmacher, V., and Fournier, P. (2009) Newcastle disease virus: a promising vector for viral therapy, immune therapy, and gene therapy of cancer, Methods Mol. Biol 542, 565-605.
20. Emmerson, P.T. (1999) Newcastle Disease Virus (Paramyxoviridae), in Encyclopedia of Virology, pp 1020-1026. Elsevier, Oxford.
21. Capua, I., and Alexander, D.J. (2009) Avian Influenza and Newcastle Disease: A Field and Laboratory Manual 1st ed. Springer.
22. Zamarin, D., and Palese, P. (2012) Oncolytic Newcastle disease virus for cancer therapy: old challenges and new directions, Future Microbiol 7, 347-367.
23. B.B. Кешелава. (2007) Онколитический вирус болезни Ньюкасла и аутологичные опухолевые клетки в комплексной терапии рака, Эпидемиология и вакцинопрофилактика 3 (24), стр. 23-28.
24. Keshelava, V.V., Dobrovol'skaia, N.I., Chazova, N.L., Bershchanskaia, A.M., Podol'skaia, M.V., Garmarnik, Т.V., and Mel'nikova, N.V. (2009) [Neoadjuvant therapy of breast cancer using Newcastle disease virus], Vopr Onkol 55, 433-435.
25. Committee on Infectious Diseases of Mice and Rats, Institute of Laboratory Animal Resources, Commission on Life Sciences, National Research Council. (1991) Infectious Diseases of Mice and Rats. The National Academies Press, Washington, D.C.
26. Slobod, K.S., Shenep, J.L., Luján-Zilbermann, J., Allison, K., Brown, В., Scroggs, R.A., Portner, A., Coleclough, C, and Hurwitz, J.L. (2004) Safety and immunogenicity of intranasal murine parainfluenza virus type 1 (Sendai virus) in healthy human adults, Vaccine 22, 3182-3186.
27. Kinoh, H., Inoue, M., Washizawa, K., Yamamoto, Т., Fujikawa, S., Tokusumi, Y., lida, A., Nagai, Y., and Hasegawa, M. (2004) Generation of a recombinant Sendai virus that is selectively activated and lyses human tumor cells expressing matrix metalloproteinases, Gene Ther 11, 1137-1145.
28. Iwadate, Y., Inoue, M., Saegusa, Т., Tokusumi, Y., Kinoh, H., Hasegawa, M., Tagawa, M., Yamaura, A., and Shimada, H. (2005) Recombinant Sendai virus vector induces complete remission of established brain tumors through efficient interleukin-2 gene transfer in vaccinated rats, Clin. Cancer Res 11, 3821-3827.
29. Kinoh, H., and Inoue, M. (2008) New cancer therapy using genetically-engineered oncolytic Sendai virus vector. Front. Biosci 13, 2327-2334.
30. Tatsuta, K., Tanaka, S., Tajiri, Т., Shibata, S., Komaru, A., Ueda, Y., Inoue, M., Hasegawa, M., Suita, S., Sueishi, K., Taguchi, Т., and Yonemitsu, Y. (2009) Complete elimination of established neuroblastoma by synergistic action of gamma-irradiation and DCs treated with rSeV expressing interferon-beta gene, Gene Ther 16, 240-251.
31. Yonemitsu, Y., Ueda, Y., Kinoh, H., and Hasegawa, M. (2008) Immunostimulatory virotherapy using recombinant Sendai virus as a new cancer therapeutic regimen. Front. Biosci 13, 1892-1898.
32. Kurooka, M., and Kaneda, Y. (2007) Inactivated Sendai virus particles eradicate tumors by inducing immune responses through blocking regulatory T cells, Cancer Res 67, 227-236.
33. Kawano, H., Komaba, S., Kanamori, Т., and Kaneda, Y. (2007) A new therapy for highly effective tumor eradication using HVJ-E combined with chemotherapy, BMC Med 5, 28.
34. Fujihara, A., Kurooka, M., Miki, Т., and Kaneda, Y. (2008) Intratumoral injection of inactivated Sendai virus particles elicits strong antitumor activity by enhancing local CXCL10 expression and systemic NK cell activation, Cancer Immunol. Immunother 57, 73-84.
35. Kawaguchi, Y., Miyamoto, Y., Inoue, Т., and Kaneda, Y. (2009) Efficient eradication of hormone-resistant human prostate cancers by inactivated Sendai virus particle, Int. J. Cancer 124, 2478-2487.
36. WHEELOCK, E.F., and DINGLE, J.H. (1964) OBSERVATIONS ON THE REPEATED ADMINISTRATION OF VIRUSES TO A PATIENT WITH ACUTE LEUKEMIA. A PRELIMINARY REPORT, N. Engl. J. Med 271, 645-651.
37. Ebert, О., Shinozaki, K., Kournioti, С, Park, M.-S., Garcia-Sastre, A., and Woo, S.L.C. (2004) Syncytia induction enhances the oncolytic potential of vesicular stomatitis virus in virotherapy for cancer. Cancer Res 64, 3265-3270.
38. Nakamori, M., Fu, X., Meng, F., Jin, A., Tao, L, Bast, R.C, and Zhang, X. (2003) Effective Therapy of Metastatic Ovarian Cancer with an Oncolytic Herpes Simplex Virus Incorporating Two Membrane Fusion Mechanisms, Clinical Cancer Research 9, 2727-2733.
39. Altomonte, J., Marozin, S., Schmid, R.M., and Ebert, O. (2010) Engineered newcastle disease virus as an improved oncolytic agent against hepatocellular carcinoma, Mol. Ther 18, 275-284.
40. Gainey, M.D., Manuse, M.J., and Parks, G.D. (2008) A hyperfusogenic F protein enhances the oncolytic potency of a paramyxovirus simian virus 5 P/V mutant without compromising sensitivity to type I interferon, J. Virol 82, 9369-9380.
41. Bateman, A., Bullough, F., Murphy, S., Emiliusen, L, Lavillette, D., Cosset, F.-L, Cattaneo, R., Russell, S.J., and Vile, R.G. (2000) Fusogenic Membrane Glycoproteins As a Novel Class of Genes for the Local and Immune-mediated Control of Tumor Growth, Cancer Research 60, 1492-1497.
42. Lin, E.-H., Salon, C, Brambilla, E., Lavillette, D., Szecsi, J., Cosset, F.-L., and Coll, J.-L. (2010) Fusogenic membrane glycoproteins induce syncytia formation and death in vitro and in vivo: a potential therapy agent for lung cancer, Cancer Gene Ther 17, 256-265.
43. Galanis, E., Bateman, A., Johnson, K., Diaz, R.M., James, C.D., Vile, R., and Russell, S.J. (2001) Use of viral fusogenic membrane glycoproteins as novel therapeutic transgenes in gliomas. Hum. Gene Ther 12, 811-821.
44. Allen, C, McDonald, C, Giannini, C, Peng, K.W., Rosales, G., Russell, S.J., and Galanis, E. (2004) Adenoviral vectors expressing fusogenic membrane glycoproteins activated via matrix metalloproteinase cleavable linkers have significant antitumor potential in the gene therapy of gliomas, J Gene Med 6, 1216-1227.
45. Hoffmann, D., Bayer, W., and Wildner, O. (2007) Local and distant immune-mediated control of colon cancer growth with fusogenic membrane glycoproteins in combination with viral oncolysis, Hum. Gene Ther 18, 435-450.
46. Hoffmann, D., Bayer, W., and Wildner, O. (2007) In situ tumor vaccination with adenovirus vectors encoding measles virus fusogenic membrane proteins and cytokines, World J. Gastroenterol 13, 3063-3070.
47. Pearlstein, E., Salk, P.L., Yogeeswaran, G., and Karpatkin, S. (1980) Correlation between spontaneous metastatic potential, platelet-aggregating activity of cell surface extracts, and cell surface sialylation in 10 metastatic-variant derivatives of a rat renal sarcoma cell line, Proc. Natl. Acad. Sci. U.S.A 77, 4336-4339.
48. Yogeeswaran, G., and Salk, P.L. (1981) Metastatic potential is positively correlated with cell surface sialylation of cultured murine tumor cell lines, Science 212, 1514-1516.
49. Fogel, M., Altevogt, P., and Schirrmacher, V. (1983) Metastatic potential severely altered by changes in tumor cell adhesiveness and cell-surface sialylation, J. Exp. Med 157, 371-376.
50. Benedetto, A., Elia, G., Sala, A., and Belardelli, F. (1989) Hyposialylation of high-molecular-weight membrane glycoproteins parallels the loss of metastatic potential in wheat-germ agglutinin-resistant Friend leukemia cells. Int. J. Cancer 43, 126-133.
51. Collard, J.G., Schijven, J.F., Bikker, A., La Riviere, G., Bolscher, J.G., and Roos, E. (1986) Cell surface sialic acid and the invasive and metastatic potential of T-cell hybridomas, Cancer Res 46, 3521-3527.
52. Passaniti, A., and Hart, G.W. (1988) Cell surface sialylation and tumor metastasis. Metastatic potential of B16 melanoma variants correlates with their relative numbers of specific penultimate oligosaccharide structures, J. Biol. Chem 263, 7591-7603.
53. Bresalier, R.S., Rockwell, R.W., Dahiya, R., Duh, Q.Y., and Kim, Y.S. (1990) Cell surface sialoprotein alterations in metastatic murine colon cancer cell lines selected in an animal model for colon cancer metastasis, Cancer Res 50, 1299-1307.
54. Hsu, C.-C, Lin, T.-W., Chang, W.-W., Wu, C.-Y., Lo, W.-H., Wang, P.-H., and Tsai, Y.-C. (2005) Soyasaponin-I-modified invasive behavior of cancer by changing cell surface sialic acids, Gynecol. Oncol 96, 415-422.
55. Chang, W.-W., Yu, C.-Y., Lin, T.-W., Wang, P.-H., and Tsai, Y.-C. (2006) Soyasaponin I decreases the expression of alpha2,3-linked sialic acid on the cell surface and suppresses the metastatic potential of B16F10 melanoma cells, Biochem. Biophys. Res. Commun 341, 614-619.
56. Chiang, C.-H., Wang, C.-H., Chang, H.-C, More, S.V., Li, W.-S., and Hung, W.-C. (2010) A novel sialyltransferase inhibitor ALIO suppresses invasion and metastasis of lung cancer cells by inhibiting integrin-mediated signaling, J. Cell. Physiol 223, 492-499.
57. Cohen, M., Elkabets, M., Perlmutter, M., Porgador, A., Voronov, E., Apte, R.N., and Lichtenstein, R.G. (2010) Sialylation of 3-Methylcholanthrene-lnduced Fibrosarcoma Determines Antitumor Immune Responses during Immunoediting, J. Immunol 185, 5869-5878.
58. Kingsbury, D.W. (1991) The Paramyxoviruses 1st ed. Springer.
59. Samuel Baron, G.E. (1996) Paramyxoviruses. Text.
60. Powell, L.D., Whitehead, S.W., and Hart, G.W. (1987) Cell surface sialic acid influences tumor cell recognition in the mixed lymphocyte reaction, J. Immunol 139, 262-270.
61. Tyagarajan, K., Forte, J.G., and Townsend, R.R. (1996) Exoglycosidase purity and linkage specificity: assessment using oligosaccharide substrates and high-pH anion-exchange chromatography with pulsed amperometric detection, Glycobiology 6, 83-93.
62. Drzeniek, R., and Gauhe, A. (1970) Differences in substrate specificity of myxovirus neuraminidases. Biochemical and Biophysical Research Communications 38, 651-656.
63. Brostrom, M.A., Bruening, G., and Bankowski, R.A. (1971) Comparison of neuraminidases of paramyxoviruses with immunologically dissimilar hemagglutinins, Virology 46, 856-865.
64. Hua, J., Liao, M., and Rashidbaigi, A. (1996) Cytokines induced by Sendai virus in human peripheral blood leukocytes, Journal of Leukocyte Biology 60, 125-128.
65. Nyman, Т.A., Tölö, H., Parkkinen, J., and Kalkkinen, N. (1998) Identification of nine interferon-alpha subtypes produced by Sendai virus-induced human peripheral blood leucocytes, Biochem. J 329 (Pt 2), 295-302.
66. Costas, M.A., Mella, D., Criscuolo, M., Diaz, A., Finkielman, S., Nahmod, V.E., and Arzt, E. (1993) Superinduction of mitogen-stimulated interferon-gamma production and other lymphokines by Sendai virus, J. Interferon Res 13, 407-412.
67. Cantell, K., Hirvonen, S., Kauppinen, H.-L, and Myllylä, G. (1981) [4] Production of interferon in human leukocytes from normal donors with the use of Sendai virus, in Interferons Part A, pp 29-38. Academic Press.
68. Suzuki, H., Kurooka, M., Hiroaki, Y., Fujiyoshi, Y., and Kaneda, Y. (2008) Sendai virus F glycoprotein induces IL-6 production in dendritic cells in a fusion-independent manner, FEBS Lett 582, 1325-1329.
69. Borden, E.C, Sen, G.C, Uze, G., Silverman, R.H., Ransohoff, R.M., Foster, G.R., and Stark, G.R. (2007) Interferons at age 50: past, current and future impact on biomedicine, Nat Rev Drug Discov 6, 975-990.
70. Dunn, G.P., Bruce, А.Т., Sheehan, K.C.F., Shankaran, V., Uppaluri, R., Bui, J.D., Diamond, M.S., Koebel, С.M., Arthur, C, White, J.M., and Schreiber, R.D. (2005) A critical function for type I interferons in cancer immunoediting, Nat Immunol 6, 722-729.
71. Ikeda, H., Old, L.J., and Schreiber, R.D. (2002) The roles of IFN gamma in protection against tumor development and cancer immunoediting, Cytokine Growth Factor Rev 13, 95-109.
72. Jarahian, M., Watzl, C, Fournier, P., Arnold, A., Djandji, D., Zahedi, S., Cerwenka, A., Paschen, A., Schirrmacher, V., and Momburg, F. (2009) Activation of natural killer cells by newcastle disease virus hemagglutinin-neuraminidase, J. Virol 83, 8108-8121.
73. Arnon, Т.I., Lev, M., Katz, G., Chernobrov, Y., Porgador, A., and Mandelboim, O. (2001) Recognition of viral hemagglutinins by NKp44 but not by NKp30, Eur. J. Immunol 31, 2680-2689.
74. Mandelboim, O., Lieberman, N., Lev, M., Paul, L., Arnon, Т.I., Bushkin, Y., Davis, D.M., Strominger, J.L., Yewdell, J.W., and Porgador, A. (2001) Recognition of haemagglutinins on virus-infected cells by NKp46 activates lysis by human NK cells, Nature 409, 1055-1060.
75. Arnon, Т.I., Achdout, H., Lieberman, N., Gazit, R., Gonen-Gross, Т., Katz, G., Bar-Han, A., Bloushtain, N., Lev, M., Joseph, A., Kedar, E., Porgador, A., and Mandelboim, O. (2004) The mechanisms controlling the recognition of tumor- and virus-infected cells by NKp46, Blood 103, 664-672.
76. Schirrmacher, V., Haas, C, Bonifer, R., and Ertel, C. (1997) Virus potentiation of tumor vaccine T-cell stimulatory capacity requires cell surface binding but not infection, Clin. Cancer Res 3, 1135-1148.
77. Harada, Y., and Yonemitsu, Y. (2011) Dramatic improvement of DC-based immunotherapy against various malignancies, Front. Biosci 17, 2233-2242.
78. Shibata, S., Okano, S., Yonemitsu, Y., Onimaru, M., Sata, S., Nagata-Takeshita, H., Inoue, M., Zhu, Т., Hasegawa, M., Moroi, Y., Furue, M., and Sueishi, K. (2006) Induction of efficient antitumor immunity using dendritic cells activated by recombinant Sendai virus and its modulation by exogenous IFN-beta gene, J. Immunol 177, 3564-3576.
79. Okano, S., Yonemitsu, Y., Shirabe, K., Kakeji, Y., Maehara, Y., Harada, M., Yoshikai, Y., Inoue, M., Hasegawa, M., and Sueishi, K. (2011) Provision of continuous maturation signaling to dendritic cells by RIG-I-stimulating cytosolic RNA synthesis of Sendai virus, J. Immunol 186, 1828-1839.
80. Sugiyama, M., Kakeji, Y., Tsujitani, S., Harada, Y., Onimaru, M., Yoshida, K., Tanaka, S., Emi, Y., Morita, M., Morodomi, Y., Hasegawa, M., Maehara, Y., and Yonemitsu, Y. (2011) Antagonism of VEGF by genetically engineered dendritic cells is essential to induce antitumor immunity against malignant ascites, Mol. Cancer Ther 10, 540-549.
81. Yoneyama, Y., Ueda, Y., Akutsu, Y., Matsunaga, A., Shimada, H., Kato, Т., Kubota-Akizawa, M., Okano, S., Shibata, S., Sueishi, K., Hasegawa, M., Ochiai, Т., and Yonemitsu, Y. (2007) Development of immunostirrtulatory virotherapy using non-transmissible Sendai virus-activated dendritic cells, Biochem. Biophys. Res. Commun 355, 129-135.
82. Komaru, A., Ueda, Y., Furuya, A., Tanaka, S., Yoshida, K., Kato, Т., Kinoh, H., Harada, Y., Suzuki, H., Inoue, M., Hasegawa, M., Ichikawa, Т., and Yonemitsu, Y. (2009) Sustained and NK/CD4+ T cell-dependent efficient prevention of lung metastasis induced by dendritic cells harboring recombinant Sendai virus, J. Immunol 183, 4211-4219.
83. Kato, Т., Ueda, Y., Kinoh, H., Yoneyama, Y., Matsunaga, A., Komaru, A., Harada, Y., Suzuki, H., Komiya, A., Shibata, S., Hasegawa, M., Hayashi, H., Ichikawa, Т., and Yonemitsu, Y. (2010) RIG-I helicase-independent pathway in sendai virus-activated dendritic cells is critical for preventing lung metastasis of AT6.3 prostate cancer, Neoplasia 12, 906-914.
84. ZHDANOV, V.M., and BUKRINSKAYA, A.G. (1961) Autoradiographic study of the penetration of Sendai virus into tissue culture cells. I. Preparation of Sendai virus labelled with radioactive isotopes, Probl. Virol. 6, 588-593.
85. BUKRINSKAIA, A.G., ZHDANOV, V.M., and RAMENSKAIA, G.P. (1961) [Autoradiographic study of the penetration of Sendai virus into the cells of tissue culture. II. The use of virus preparations labelled with P32], Vopr. Virusol. 6, 547-552.
86. BUKRINSKAYA, A.G., and ZHDANOV, V.M. (1963) SHORTENING BY ACTINOMYCIN D OF LATENT PERIOD OF MULTIPLICATION OF SENDAI VIRUS, Nature 200, 920-921.
87. Shi, L.-Y., Li, M., Yuan, L.-J., Wang, Q., and Li, X.-M. (2008) A new paramyxovirus, Tianjin strain, isolated from common cotton-eared marmoset: genome characterization and structural protein sequence analysis. Arch. Virol. 153, 1715-1723.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ терапии метастатического рака с использованием вируса Сендай | 2017 |
|
RU2662916C1 |
| ШТАММ ВИРУСА БОЛЕЗНИ НЬЮКАСЛА ДЛЯ ИЗУЧЕНИЯ ОНКОЛИТИЧЕСКИХ СВОЙСТВ И МЕХАНИЗМОВ ОНКОЛИЗИСА ДЛЯ СОЗДАНИЯ ПРОТОТИПНОГО ПРОТИВООПУХОЛЕВОГО ПРЕПАРАТА | 2014 |
|
RU2562115C1 |
| Набор рекомбинантных плазмидных ДНК для получения рекомбинантных вирусов Сендай штамм Москва (варианты) | 2021 |
|
RU2787724C1 |
| Штамм вируса болезни Ньюкасла NDVH-2 для изучения возможности разработки на его основе вирусного онколитического препарата | 2016 |
|
RU2644676C1 |
| СПОСОБ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2008 |
|
RU2379055C1 |
| Оптимизированный штамм полиовируса 3 типа для терапии солидных опухолей | 2023 |
|
RU2836222C1 |
| Клеточная линия PSCA-CAR-YT, обладающая поверхностной экспрессией химерных антигенных рецепторов и проявляющая цитотоксическую активность по отношению к PSCA-позитивным раковым клеткам человека | 2018 |
|
RU2712901C1 |
| КОНСТРУИРОВАНИЕ ОБЛИГАТНОГО ВЕКТОРА НА ОСНОВЕ ОНКОЛИТИЧЕСКИХ ВИРУСОВ ПРОСТОГО ГЕРПЕСА (oHSV) И КОНСТРУКЦИИ ДЛЯ ТЕРАПИИ РАКА | 2016 |
|
RU2831084C2 |
| КОМПОЗИЦИЯ, ВКЛЮЧАЮЩАЯ PIC, ДЛЯ ЛЕЧЕНИЯ РАКА | 2017 |
|
RU2728175C2 |
| АТТЕНУИРОВАННЫЙ ШТАММ ВИРУСА СЕНДАЙ | 2013 |
|
RU2552487C2 |
Группа изобретений относится к области медицины, в частности к онкологии, и может быть использована для лечения пациентов, страдающих онкологическими заболеваниями. Для этого пациенту вводится композиция, содержащая изолированный, нативный, биологически активный штамм вируса Сендай, депонированный в американской коллекции клеточных культур АТСС под номером РТА-13024, и фармацевтически приемлемый носитель. Группа изобретений также относится к фармацевтической композиции, содержащей изолированный, генетически сконструированный, биологически активный штамм вируса Сендай, сделанный на основе вирусного материала, депонированного в американскую коллекцию клеточных культур АТСС под номером РТА-13024. Использование данных изобретений позволяет повысить эффективность лечения онкологических заболеваний за счет онколитического действия вируса Сендай и вирусной стимуляции противоопухолевого иммунитета. 3 н. и 18 з.п. ф-лы, 1 ил., 8 пр.
1. Способ лечения онкологических заболеваний, включающий введение пациенту, нуждающемуся в этом, композиции, содержащей фармацевтически приемлемый носитель и изолированный, нативный, биологически активный штамм вируса Сендай, депонированный в американской коллекции клеточных культур АТСС под номером РТА-13024.
2. Способ по п.1, где композицию вводят внутрь опухоли.
3. Способ по п.1, где композицию вводят внутрикожно (это наиболее желательно) или другими парентеральными способами, в частности подкожно, внутримышечно или внутривенно.
4. Способ по п.1, включающий дополнительно введение инактивированных радиацией клеток, полученных дисперсией из опухолевого материала пациента.
5. Способ по п.1, включающий дополнительно введение инактивированных радиацией клеток, полученных из иммуногенных клеточных линий.
6. Способ по п.1, включающий дополнительно введение клеток куриных эмбрионов, при этом возможна дополнительная репликация вируса в клетках куриных эмбрионов в теле пациента.
7. Способ по п.1, включающий дополнительно введение клеток куриных эмбрионов и инактивированных радиацией клеток, полученных дисперсией из опухолевого материала больного, при этом возможна дополнительная репликация вируса в клетках куриных эмбрионов в теле пациента.
8. Способ по п.1, включающий дополнительно введение клеток куриных эмбрионов и/или инактивированных радиацией клеток, полученных из иммуногенных клеточных линий. При этом возможна дополнительная репликация вируса в этих клетках в теле пациента.
9. Способ по пп.1-8, где пациенту вводят 1-12 инъекций композиции с интервалом 7-10 дней.
10. Фармацевтическая композиция для лечения онкологических заболеваний, содержащая изолированный, биологически активный штамм вируса Сендай, депонированный в американской коллекции клеточных культур АТСС под номером РТА-13024, и фармацевтически приемлемый носитель.
11. Композиция по п.10, содержащая дополнительно инактивированные радиацией клетки, полученные дисперсией из опухолевого материала пациента.
12. Композиция по п.10, содержащая дополнительно инактивированные радиацией клетки, полученные из иммуногенных клеточных линий.
13. Композиция по п.10, содержащая дополнительно клетки куриных эмбрионов, при этом возможна дополнительная репликация вируса в клетках куриных эмбрионов в теле пациента.
14. Композиция по п.10, содержащая дополнительно клетки куриных эмбрионов и инактивированные радиацией клетки, полученные дисперсией из опухолевого материала больного, при этом возможна дополнительная репликация вируса в клетках куриных эмбрионов в теле пациента.
15. Композиция по п.10, содержащая дополнительно клетки куриных эмбрионов и инактивированные радиацией клетки, полученные из иммуногенных клеточных линий, при этом возможна дополнительная репликация вируса в клетках куриных эмбрионов в теле пациента.
16. Фармацевтическая композиция для лечения онкологических заболеваний, содержащая изолированный, генетически сконструированный, биологически активный штамм вируса Сендай, сделанный на основе вирусного материала, депонированного в американскую коллекцию клеточных культур АТСС под номером РТА-13024, и фармацевтически приемлемый носитель.
17. Композиция по п.16, содержащая дополнительно инактивированные радиацией клетки, полученные дисперсией из опухолевого материала пациента.
18. Композиция по п.16, содержащая дополнительно инактивированные радиацией клетки, полученные из иммуногенных клеточных линий.
19. Композиция по п.16, содержащая дополнительно клетки куриных эмбрионов, при этом возможна дополнительная репликация вируса в клетках куриных эмбрионов в теле пациента.
20. Композиция по п.16, содержащая дополнительно клетки куриных эмбрионов и инактивированные радиацией клетки, полученные дисперсией из опухолевого материала больного, при этом возможна дополнительная репликация вируса в клетках куриных эмбрионов в теле пациента.
21. Композиция по п.16, содержащая дополнительно клетки куриных эмбрионов и/или инактивированные радиацией клетки, полученные из иммуногенных клеточных линий, при этом возможна дополнительная репликация вируса в клетках в теле пациента.
| US 7871765 В2, 18.01.2011 | |||
| Индукционный двигатель | 1928 |
|
SU15013A1 |
| US 2002098576 A1, 25.07.2002 | |||
| DEACON DH et al | |||
| The use of gamma-irradiation and ultraviolet-irradiation in the preparation of human melanoma cells for use in autologous whole-cell vaccines // BMC Cancer.,2008, Dec 4;8:360 | |||
| KUROOKA M | |||
| et al | |||
| Inactivated Sendai virus particles eradicate tumors by | |||
Авторы
Даты
2014-06-20—Публикация
2012-11-26—Подача