Изобретение относится к медицине, а именно к онкологии и иммунологии, точнее к способам комбинированной терапии онкопатологии с использованием биологических, лазерных и ядерных технологий, и может быть использовано для лечения больных с распространенным и метастатическим раком, в частности раком легкого, молочной железы, колоректальным раком, раком поджелудочной железы, почки, простаты, раком яичников, матки, желудка и т.п.
В настоящее время метастатический рак по-прежнему остается во многих случаях неизлечимым заболеванием. По официальной статистике, около трети жителей России, болеющих раком, умирают в течение года после того, как им поставили диагноз. Из этой трети 90% смертей связано с метастазированием опухолей. В целом у больных с метастазами злокачественных новообразований медиана выживаемости (время, к которому умирают 50% больных) составляет 147 дней [105].
Традиционные терапевтические схемы, основанные преимущественно на комплексном применении химио- и радиотерапии, остаются малоэффективными, особенно для больных с метастазами. В частности, в работах ряда исследователей приводятся данные, свидетельствующие о том, что лечебный эффект от химиотерапии проявляется у одного из четырех раковых больных; что химиотерапия практически не дает выраженного положительного результата при лечении, например плоскоклеточного рака легких или аденокарциномы поджелудочной железы; что эффективность химиотерапии в 5-летней выживаемости стремится к нулю при раке поджелудочной железы, яичников, мочевого пузыря, предстательной железы, почки, желудка и т.д. С другой стороны, классические виды терапии обладают целым рядом побочных эффектов, и, в первую очередь, выраженным иммунодепрессивным эффектом. Это обусловлено, тем, что принцип лечебного действия как химио-, так и радиотерапии, базируется на более высокой скорости развития опухолевой массы в сравнении с регенерирующими клетками здоровых органов и тканей, однако на практике химиопрепараты и облучение повреждают не только опухолевые клетки, но и быстро обновляющиеся клетки пищеварительного тракта, костного мозга, волосяных фолликулов и т.д., что может приводить к таким негативным последствиям как алопеция, изъязвление слизистых оболочек и т.п. [99, 100]. Отмечается также низкая эффективность классических методов терапии в плане предупреждения прогрессирования онкологических заболеваний [106].
В этой связи, в современных условиях особую актуальность приобретает создание оригинальных методов и средств, позволяющих повысить эффективность лечения онкопатологии при сокращении побочных эффектов.
Примером оригинального пути решения проблем в сфере терапии рака может служить способ позитронной терапии метаболически активного метастатического рака [24, 127], примененный в эксперименте на моделях меланомы, рака груди, рака толстой кишки. Предложенный способ предусматривает внутривенное введение пациенту позитрон-излучающего радиофармпрепарата (далее по тексту - «П-РФП») в качестве которого используют глюкозу, меченную 18F, или ее аналоги, в частности 2-фтор-[18F]-2-дезокси-D-глюкозу (18F-ФДГ), в дозе более 15 мКи, но не более 10 Ки на пациента.
18F-ФДГ традиционно применяется в качестве РФП для позитронной эмиссионной томографии (далее по тексту - «ПЭТ») при исследовании опухолей различной локализации [121, 122]. Использование 18F-ФДГ в качестве диагностического средства основано на том, что при внутривенном введении указанный П-РФП повторяет начальный этап метаболического пути глюкозы, проникая из сосудистого русла в клетки, где фосфорилируется фосфокиназами с образованием 18F-дезокси-глюкоза-6-фосфата, который не вступает в дальнейшие реакции и накапливается в клетках [24]. Соответственно, терапевтическое действие 18F-ФДГ в рассматриваемом способе-аналоге базируется на системной доставке радионуклида 18F как в первичные очаги, так и в зоны регионарного метастазирования, и взаимодействии испускаемых данным радионуклидом позитронов с окружающими тканями. Предполагается, что позитроны способны вызывать гибель раковых клеток, реализуя те же механизмы воздействия на живую клетку, что и электроны - повреждения структуры и функций ДНК, грубые нарушения свойств белков, цитоплазмы, ферментов, всех метаболических процессов, и, как следствие, индуцирование некроза/апоптоза неопластических клеток [24].
Однако известный способ-аналог не обеспечивает достижения технического результата заявленного способа. Учитывая, что 18F-ФДГ характеризуется низкой специфичностью (физиологически накапливается в ткани головного мозга и миокарде, а также в органах выделения) [24], использование в способе-аналоге доз облучения (до 370000 МБк), значительно превышающих диагностические дозы (130-550 МБк на пациента [122, 123]), существенно увеличивает вероятность развития лучевых поражений активно-функционирующих органов и тканей. Негативное влияние на эффективность лечения с использованием рассматриваемого способа-аналога может оказывать также наличие в популяции клеток опухоли (у абсолютного большинства опухолей) субпопуляции раковых стволовых клеток (далее по тексту - «РСК»), обладающих максимальной степенью независимости от внешних сигналов, мультипотентностью, самой высокой пролиферативной активностью среди всех опухолевых клеток, способностью к бесконечному самообновлению и восстановлению поврежденной ДНК. РСК чрезвычайно устойчивы ко всем известным видам лечения, в том числе к радиотерапии, в частности за счет их экстремальной устойчивости к апоптозу. Именно поэтому после, например, тяжелого ионизирующего облучения РСК не погибают, а активизируют восстановление повреждений ДНК и через какое-то время вновь приобретают способность к делению. Однако процесс репарации ДНК может сопровождаться новыми мутациями, в результате чего РСК становятся еще злокачественнее. Таким образом, субпопуляция РСК, которая обеспечивает радиорезистентность опухоли, с большой вероятностью может служить источником рецидива опухоли после облучения [123].
К числу наиболее перспективных направлений, где могут быть успешно реализованы принципиально новые подходы к решению основных проблем лечения онкопатологии, в настоящее время относят биотерапию, в частности иммунотерапию, вирусную терапию и вакцинотерапию рака.
Примером подобного подхода, названного «прорывным» в иммунотерапии, является применение моноклональных антител, блокирующих ключевые рецепторы, отвечающие, в частности, за программируемую гибель клеток. Разработка препаратов данной группы базировалась на том, что одной из стратегий ускользания рака от надзора иммунной системы является использование «тормозных» механизмов, которые в норме служат для контроля выраженности и длительности иммунного ответа, что позволяет предотвратить развитие аутоиммунной агрессии и повреждение собственных тканей. Это реализуется, в частности, благодаря существованию «Иммунологических контрольных точек» (от англ. «Immunological checkpoints))) - системы ингибиторных механизмов, которые регулируют активацию иммунного ответа, препятствуя запуску аутоиммунных процессов (далее по тексту - «ИКТ»). При прогрессии злокачественной опухоли ИКТ блокируют иммунную реакцию в отношении опухолевых клеток. В ответ на попытку иммунокомпетентной клетки уничтожить опухолевую клетку, последняя усиливает экспрессию находящихся на ее поверхности молекул-лигандов, в результате чего при взаимодействии этих лигандов с рецептором опухоль-специфического лимфоцита ингибирующие сигналы будут преобладать над ко-стимулирующими и лимфоцит не будет атаковать опухолевую клетку. Предотвращая таким образом активацию опухоль-специфических лимфоцитов, опухоль приобретет устойчивость к действию иммунной системы [2, 112, 64,].
К наиболее изученным из ИКТ относятся белок CTLA-4, белок программируемой клеточной гибели PD-1 (от англ. «Programmed cell Death 1») и белок Tim-3 (от англ. «Т cell immunoglobulin and mucin-domain-containing molecule 3»). PD-1 экспрессируется на поверхности активированных эффекторных Т-лимфоцитов и имеет два лиганда PD-L1 и PD-L2. Взаимодействие рецептора с лигандом на поверхности антиген-презентирующих клеток или клеток-мишеней является стимулом, угнетающим активность Т-лимфоцитов, вызывающим их апоптоз. Tim-3 экспресируется на поверхности активированных эффекторных Т-лимфоцитов, преимущественно в сочетании с рецептором PD-1, и имеет четыре лиганда: галектин-9 (Gal-9), HMGB-1 (амфотерин), фосфатидилсерин (PtdSer) и молекула клеточной адгезии, относящаяся к карциноэмбриональному антигену-1 (Сеасат-1) [2, 72, 56, 49, 60].
В настоящее время известны способы иммунотерапии с применением препаратов (моноклональных антител), блокирующих рецептор PD-1 (ниволюмаб /Opdivo®/, пембролизумаб /Keytruda®/) или лиганд PD-L1 (атезолизумаб); рецептор CTLA-4 (ипилимумаб), у пациентов с метастатической меланомой, немелкоклеточным раком легкого, раком почек и раком мочевого пузыря [2, 111, 112, 113, 114]. Указанные анти-PD-1 и анти-PD-L1 моноклональные антитела вводят внутривенно курсами продолжительностью до 6 мес.Эффективность лечения, оцениваемая, в частности, по частоте объективных ответов, в зависимости от вида опухоли и конкретного препарата варьировала в диапазоне 10,9-40,0%, при этом токсичность, как частота нежелательных явлений всех степеней и частота нежелательных явлений 3-4 степени (далее по тексту - «ЧНЯ3-4»), находилась в пределах 42-52 и 7,6-42,0%, соответственно. Имеются сведения, что эффективность терапии возрастала с повышением дозы препарата, однако при этом ЧНЯ3-4 превышала 50%. В частности, имеются данные, что использование ипилимумаба в сочетании с ниволюмабом обеспечивало частоту объективных ответов 40%, при этом ЧНЯ3-4 возрастала до 62%.
Использование блокаторов ИКТ не позволяет получить технический результат заявленного изобретения по следующим причинам. Вмешательство в супрессорные механизмы приводит к тому, что стимулированная иммунная система может атаковать здоровые органы - кишечник, печень, легкие, почки, надпочечники, поджелудочную железу, сердце и т.д., вызывая их аутоиммунные поражения. Предполагается, что этот эффект связан с активацией синтеза противовоспалительного цитокина интерлейкина 10 (IL-10) [5, 7, 44].
В настоящее время считается признанным, что способность к индукции иммунного ответа у опухолей различна и определяется их биологическими свойствами [117]. Это является важным фактором, определяющим эффективность иммунотерапии, в том числе основанной на применении ингибиторов ИКТ. Так, по результатам клинических наблюдений установлено, что малоиммуногенные опухоли не отвечают на указанную терапию [2]. Одной из причин неимунногенности может являться отсутствие или низкий уровень экспрессии опухоль-ассоциированных антигенов опухолевыми клетками, что определяется биологическими особенностями данных клеток [117]. В этом случае активация реактивированных Т-клонов лимфоцитов в результате введения рассматриваемых препаратов может приводить к еще большей стимуляции аутоиммунной агрессии. Кроме того, вероятность высокого содержание Т-лимфоцитов с пониженной функциональной активностью, которое может быть обусловлено индивидуальным воздействием опухоли на иммунокомпетентные клетки, будет негативно влиять на эффективность данной терапии. Также предполагается [2], что каждый конкретный препарат подобного типа, основанный на нейтрализации ингибирующего сигнала, передающегося через определенную ИКТ, может приводить к реактивации противоопухолевого иммунного ответа только в случае, если сигнальные каскады в данной ИКТ способны оказывать доминантный эффект в неоплазии данного пациента.
И наконец, имеются сведения, что блокаторы PD-1 рецепторов могут вызывать прогрессирование (гиперпрогрессию) опухолей [68, 69]. Это связывают с компенсаторной активацией Tim-3 рецепторов на поверхности Т-лимфоцитов, особенно субпопопуляции CD3+CD8+PD-1+Tim-3+, которые наиболее эффективно подавляют противоопухолевый иммунный ответ [70, 71].
Известно применение блокаторов ИКТ в сочетании с противовоспалительными препаратами, такими как блокаторы фактора некроза опухоли (TNF), интерлейкина 1 (IL-1), кортикостероиды [9, 10, 11]. На основании результатов клинических наблюдений авторами цитируемых источников информации сделан вывод, что подобная сочетанная терапия препятствует развитию серьезных аутоиммунных осложнений. Однако, по мнению авторов заявленного изобретения, введение противовоспалительных препаратов полностью исключает (особенно в случае неиммуногенных опухолей) или значимо снижает возможность достижения целевого противоопухолевого эффекта, что, соответственно, приводит к прогрессированию онкозаболевания.
Известен способ терапии опухолевых заболеваний, в частности опухолей мозга и меланомы, с применением рекомбинантного человеческого БТШ70 (далее по тексту - «рчБТШ70»), полученного с использованием штамма-продуцента Е. coli ВВ, трансформированного векторной плазмидой pMSHsp70 [3П]. Указанный препарат БТШ70 вводят в виде раствора интратуморально в однократной суточной дозе 0,5 мг белка. Лечение включает введение указанного препарата курсом из 5-8 инъекций с интервалом 1-2 дня. Интратуморальное введение БТШ70 в модели внутричерепной глиомы С6 у крыс приводило к замедлению роста опухоли, увеличению количества CD8+ лимфоцитов, специфических к клеткам опухоли, и, как следствие, увеличению продолжительности жизни животных. Технология внутриопухолевого введения препарата очищенного рчБТШ70 была использована в ограниченном исследовании на пациентах с опухолями мозга, которое показало безопасность технологии, ее пригодность и эффективность для нейроонкологических больных.
Экспериментально установлено, что терапевтический эффект таргетного введения экзогенного БТШ70 по способу-аналогу [3П] основывается на феномене транслокации внутриклеточного шаперона под влиянием экзогенного очищенного БТШ70. В рамках концепции противоопухолевого действия БТШ70, при введении в опухоль экзогенный БТШ70 проникает внутрь опухолевых клеток и вытесняет собственный эндогенный БТШ70 как на поверхность мембраны опухолевой клетки, так и в микроокружение опухоли. Мембранно-связанный БТШ70, взаимодействуя с рецептором CD94 на поверхности натуральных киллеров (NK-клеток), вызывает активацию их цитолитической функции, что свидетельствует об активации врожденного иммунного ответа. Внеклеточный БТШ70 в комплексе с опухолевыми пептидами может связываться с антиген-презентирующими клетками (ДК) с последующей презентацией опухолевых антигенов в комплексе с антигенами главного комплекса гистосовместимости класса 1 (МНС-1) и развитием специфического противоопухолевого иммунного ответа. Таким образом, опухолевые клетки уничтожают либо NK-клетки, узнавая антигены, находящиеся на поверхности опухоли, либо Т-лимфоциты по специфическому механизму (13, 124].
Однако указанный способ-аналог не позволяет получить технический результат, достигаемый при реализации заявленного способа, так как набор опухолевых антигенов, который выходит из раковых клеток с эндогенным БТШ70 представляет небольшую часть от их общего репертуара, недостаточную для получения целевого иммунного ответа. Клональная эволюция опухоли изменяет антигенный состав опухоли и ее метастазов, что приводит к снижению эффективности иммунотерапии рака (14, 15). Для ее повышения необходимо получить иммунную реакцию против расширенного спектра опухолевых антигенов с учетом его гетерогенности в опухоли и ее метастазах (50).
Известно применение белков теплового шока-70 (далее по тексту - «БТШ70»), в частности рчБТШ70), и гибридных белков на основе БТШ70, обладающих пролонгированным действием, для лечения рака, в частности меланомы в эксперименте [124, 125]. Гибридный белок на основе БТШ70 содержит молекулу БТШ70 и соединенный с ней Fc-фрагмент, идентичный нативному константному Fc-фрагменту иммуноглобулина G человека (IgG), которые дополнительно сшиты линкерным фрагментом (далее по тексту - «БТШ70-Fc»). Препараты БТШ70 и БТШ70-Fc вводили интратуморально в дозе 50 мкг/мышь на 12-й, 14-й и 16-й дни эксперимента. Установлено, что в группах животных, которым вводили указанные препараты БТШ70, значительно уменьшился (по сравнению с контролем) рост опухоли, увеличилось время выживания, снизилось количество случаев метастазирования и среднее число метастазов на одно животное. При этом снижение указанных показателей в группе мышей, получавших рчБТШ70-Fc, было существенно выше, чем у животных, получавших БТШ70.
Известно применение БТШ70 и БТШ70-Fc, меченных радиоактивными изотопами йода (1-123, 1-124, 1-125 или 1-131), для лечения рака, в частности меланомы в эксперименте [4П, 5П]. Препараты БТШ70 и БТШ70-Fc, меченные радиоактивными изотопами, были приготовлены путем йодирования в осадках тирозина и гистидина с использованием гранул радиоактивного йода. Результаты исследований биораспределения 123I-БТШ70 и 123I-БТШ70-Fc показали преимущественное накопление 123I-БТШ70-Fc в опухоли (12-ти кратное превышение по сравнению с накоплением другими исследуемыми органами). Двукратное внутривенное введение 131I-БТШР70 и 131I-БТШ70-Fc мышам двух групп (на 12 и 16 сут после введения опухолевых клеток, в дозе 2×18,5 МБк, которая обеспечивала поступление 49 Гр в опухоль) привело к значительному снижению роста опухоли, увеличению времени выживания, уменьшению количества животных с метастазами, а также числа метастазов на мышь. При этом эффективность применения меченных радиоактивным йодом БТШ70 и БТШ70-Fc превышала эффективность немеченых БТШ70 и БТШ70-Fc, а противоопухолевый эффект 131I-БТШ70-Fc был наиболее выражен в сравнении с другими препаратами.
Лечение рака с использованием гибридных белков пролонгированного действия на основе БТШ70 и Fc-фрагмента IgG позволяет получить более выраженный защитный противоопухолевый иммунный эффект в сравнении с немодифицированным БТШ70. Однако применение конъюгатов БТШ70 с радионуклидами сопряжено с относительно высоким риском поражения здоровых органов и тканей (печень, почки, миокард, головной мозг, мышцы) при неспецифическом накоплении в них этих конъюгатов.
Перспективным направлением биотерапии является вакцинотерапия, базирующаяся на использовании отдельных антигенов или их комплексов, и представляющая собой активную специфическую иммунотерапию, в основе которой лежит стимуляция иммунного ответа пациента на собственную опухоль. В настоящее время исследуются и проходят клинические испытания различные виды вакцин, в частности вакцины на основе цельных опухолевых клеток (аутологичных или аллогенных), пептидные вакцины, вакцины на основе ДК и т.п. Повышение иммуногенности вакцин может достигаться использованием адъювантов - компонентов или факторов, стимулирующих иммунный ответ на антиген и (или) модулирующих желательные иммунные реакции. Адъюванты могут быть непосредственно включены в состав вакцин, например вакцины на основе БТШ, вакцины на основе вирус-модифицированных опухолевых клеток и т.п.Адъюванты также могут представлять собой различного рода факторы, воздействующие на организм пациента в сочетании с введением вакцин, например лазерное облучение, дооперационная стимуляция организма пациента ВБН и т.п. Большинство подходов к созданию противоопухолевых вакцин направлено на предотвращение рецидивирования и метастизирования новообразований после их хирургического удаления, химио- или лучевой терапии [199, 44; 100; 101].
Так, известен способ лазерной вакцинации больных с метастатическими формами рака [122]. Согласно указанному способу-аналогу лазерную вакцинотерапию проводят после выполнения условно-радикальной хирургической операции. При этом, предварительно полученную из биопсийного материала культуру опухолевых клеток, инактивированную гамма-лучами, или лизат опухолевых клеток модифицируют излучением углекислотного лазера (CO2-лазера) или обработкой широкоапертурными импульсными электронными пучками (далее по тексту - «модифицированная излучением вакцина»). Воздействуют на 4-6 участков кожи спины пациента диаметром 5-15 мм излучением лазера на парах меди с длиной волны 510,6 и 578 нм при плотности мощности свыше 3 Вт/см2, длительности импульсов 10-20 нс и частоте следования импульсов 5-15 кГц или излучением инфракрасного лазера с длиной волны 830 нм при плотности мощности 1,5-15 Вт/см2. Через 24-48 ч после облучения в каждую из зон образования клеточного инфильтрата вводят внутрикожно модифицированную излучением вакцину (в суммарной дозе 3×106 клеток, содержащейся в 1 мл физиологического раствора). Процедуры лазерной вакцинации проводят один раз в неделю. Курс лечения 10-15 процедур. Применение у 42 больных модифицированной излучением вакцины с антигенами из операционного материала IV стадии показало отсутствие признаков прогрессирования заболевания в течение одного года у 62% больных (в группе сравнения, где применяли вакцину на основе ДК, стимулированных аутоантигенами из лизатов опухолей, - в 71% случаев), а также увеличение продолжительности жизни в 1,6 раза (по сравнению с группой сравнения), что сопровождалось развитием специфического Т-клеточного иммунного ответа.
Способ-аналог [122] основан на активации противоопухолевого иммунного ответа вследствие мобилизации эндогенных БТШ70 из клеток кожи под воздействием высокоинтенсивного импульсного лазерного излучения, активации ДК, миграции их в зону облучения (с повышенным содержанием БТШ) и захвате ДК введенных в зону клеточного инфильтрата аутологичных опухолевых антигенов с повышенной иммуногенностью с последующим представлением их иммунокомпетентным клеткам.
Невозможность достижения заявленного технического результата при реализации способа-аналога [122] обусловлена следующим. В рассматриваемом способе используется аутологичная вакцина, характерной особенностью которой является ее идентичность клеткам опухоли с соответствующими структурами, активирующими клеточный иммунный ответ. Присутствующий в такой вакцине широкий спектр опухолевых антигенов определяет возможность их использования при соответствующей опухоли без оценки экспрессии отдельных антигенных детерминант. Однако вакцина данного вида представляет собой живые аутологичные опухолевые клетки, пролиферативные способности которых ограничены гамма-излучением, либо лизирванные (многократным повтором процедур замораживания-размораживания) клетки. Подобное воздействие может изменять структуру и свойства опухолевых антигенов и, соответственно, снижать эффективность вакцины.
Вследствие фенотипической гетерогенности опухолевых клеток, а также их антигенной изменчивости, обусловленной клональной эволюцией опухоли, направленной, в первую очередь, на уничтожение клонов с более выраженной иммуногенностью и дальнейшее усиление злокачественности, антигенный профиль опухолевых клеток, полученных из разных мест (основная опухоль, метастазы, лимфоузлы), может существенно различаться. В этой связи, ограниченный набор опухолевых антигенов, представленный в конкретной аутологичной вакцине, будет составлять только незначительную часть от общего антигенного репертуара опухоли и ее метастазов, что в ряде случаев может оказаться недостаточным для получения выраженного продолжительного целевого иммунного ответа, несмотря на повышенную (с помощью лазерного воздействия) иммуногенность собственных опухолевых клеток [14, 15, 100]. Кроме того, высказано предположение [125], что часть опухолевых антигенов, из числа содержащихся в приготовленной вакцине, может быть представлена в контексте собственных МНС-антигенов, не имеющих отношения к цели вакцинации, при этом не исключается возможность их отрицательного воздействия на формирование специфического иммунного ответа. Все это обусловливает относительно низкую эффективность известного способа-аналога.
В настоящее время к числу ведущих направлений биотерапии относят терапию с использованием онколитических вирусов, которые способны вызывать специфическую гибель именно злокачественных, но не нормальных клеток (далее по тексту - «виротерапия рака»). Специфическое разрушение злокачественных клеток обусловлено способностью онколитического вируса к избирательной репликации в этих клетках и способностью воздействовать на регуляторные системы организма, ответственные за активацию противоопухолевого иммунного ответа [107]. Многопрофильность влияния вируса на клеточные процессы значимо снижает вероятность резистентности [104]. Несомненный интерес в плане клинического применения представляют непатогенные для человека, но обладающие высоким онколитическим потенциалом вакцинные штаммы парамиксовирусов (Paramyxoviridae) (далее по тексту - «ПМВ»), в частности вируса Сендай (вирус парагриппа мышей 1 типа или гемагглютинирующий японский вирус) (далее по тексту также - «СеВ»), вируса болезни Ньюкасла (далее по тексту - «ВБН»), вируса кори [103]. Виротерапию рака применяют на поздних стадиях онкологического процесса, когда возможности специализированного лечения ограничены или исчерпаны, а также для предотвращения развития метастазов и рецидивов.
В настоящее время установлено, что онколитическое действие ПМВ, в частности СеВ и ВБН, может реализоваться по нескольким потенциальным механизмам. При этом степень онколитического действия и запуск того или иного механизма зависят от ряда факторов.
Первый механизм разрушения опухолевых клеток - ПМВ могут оказывать прямое цитолитическое действие, возникающее в результате репликации вирусов в малигнизированных клетках. Это осуществляется за счет: продуцирования неопластическими клетками гликопротеинов, которые могут служить рецепторами для ПМВ; частых генетических дефектов раковых клеток в системе интерферонового и апоптозного ответов, которые создают режим благоприятствования репликации вирусов; образования многоядерных клеточных конгломератов (сцинтиев) из злокачественных клеток, что лишает клетки возможности делиться, обрекая их на коллективную гибель, а также позволяет вирусу ускользать от нейтрализующего воздействия антител. Указанные цитопатологические изменения (патология ядра и цитоплазмы), как правило, не совместимы с дальнейшим существованием этой клетки и, в конечном итоге, приводят к ее гибели.
Второй механизм - иммуномодулирующее действие ПМВ, которое заключается в их способности активировать Т-клеточное звено иммунитета, неспецифически индуцировать естественные защитные силы организма, изменять антигенные и иммуногенные характеристики опухолевых клеток, стимулировать синтез интерферонов (далее по тексту - «ИФН»), в частности ИФН-альфа и ИФН-гамма, в лейкоцитах периферической крови человека; стимулировать продукцию других цитокинов (TNF), что, в свою очередь, ведет к активации NK, макрофагов, сенсибилизированных Т-лимфоцитов, антигенпредставляющих ДК, а также подавлять опосредованную Т-лимфоцитами регуляторную иммуносупрессию путем секреции интерлейкина 6 (IL-6) зрелыми ДК [43, 104; 119].
Известно применение ВБН в комплексной терапии рака (химио- и лучевой терапии) у больных с диссеминированными солидными опухолями, в частности у пациентов с меланомой кожи, раком молочной железы, раком толстой кишки, раком шейки матки, раком яичников, с увеальной меланомой [119, С. 53-64]. Применяемый препарат ВБН изготавливали из живого вируса апатогенного штамма La Sota, выращиваемого в свободных от патогенной микрофлоры куриных эмбрионах, который очищали центрифугированнием. Препарат ВБН вводили пациентам в дозе (1-5)×107 под/внутрикожно в сочетании с человеческим рекомбинантным гранулоцитарным колониестимулирующим фактором (Г-КСФ) раз в неделю в течение 4-х недель, начиная с 4-й по 8-ю недели после операции. В последующем курс продолжали аналогичными инъекциями раз в две недели в течение одного года, далее инъекции делали с возрастающим до трех мес.интервалом на протяжении 2,5 лет. При проведении комплексного лечения с включением курсов адъювантной химиотерапии и по показаниям лучевой терапии в течение 6 мес. Препарат ВБН получили 67 больных - до 16 внутрикожных введений при 6-ти месячном курсе лечения.
Эффективность лечения (по шкале RECIST) с использованием ВБН в комплексной терапии охарактеризована следующим образом: полный ответ - у 28,3% больных (при средней продолжительности эффекта 11 мес.); частичный ответ - у 26,8% больных (средняя продолжительность эффекта 11,7 мес.); стабилизация процесса - у 23,8% больных (средняя продолжительность эффекта 14 мес.); прогрессирование процесса - у 20,8% больных.
В качестве побочных эффектов лечения было зафиксировано следующее: лихорадка I и II степени наблюдалась практически у всех больных, сопровождалась кратковременным ухудшением самочувствия, не требовала какого-либо лечения и в течение суток самостоятельно купировалась. Локальные кожные реакции в месте введения вакцины, как при первичном, так и при повторных ее введениях; гиперемия и локальный отек в месте введения стихали в течение нескольких дней после вакцинации и не требовали дополнительного лечения. По мнению авторов рассматриваемого способа-аналога, подобные симптомы, как правило, традиционно наблюдаются при вакцинации разных типов. Возможные побочные эффекты при повторных вакцинациях (через 4-5 суток после вакцинации), которые могут проявляться вследствие выработки специфических антител (лихорадка, озноб, ощущение жара, кожной сыпи и т.п.), ни в одном из случаев зарегистрированы не были [119, С. 53-64].
Достижение терапевтического эффекта способа-аналога [119, С. 53-64; 2 X1] базируется на основных механизмах разрушения опухолевых клеток -прямом цитопатическом действии на опухолевые клетки в процессе вирусной репликации и индукции противоопухолевого звена иммунитета. Однако результаты клинических наблюдений авторов заявленного способа показали, что только приблизительно у 40% пациентов в системе in vitro определяется чувствительность опухолевых клеток к ВБН, что свидетельствует об относительно низкой вероятности запуска цитопатической составляющей. Вероятность высокого содержания лимфоцитов с пониженной функциональной активностью, что может быть обусловлено индивидуальными особенностями опухоли может препятствовать реализации иммунной составляющей ВБН. Кроме того, в условиях системного введения ВБН не исключается вероятность нейтрализации вируса клетками-эффекторами врожденного иммунитета (NK-клетками, макрофагами, полиморфноядерными лимфоцитами), что препятствует целевой доставке вирусных частиц и не позволяет обеспечить присутствие этих частиц в зонах опухолевых очагов в количестве, необходимом и достаточном для запуска цитопатической и иммунной составляющих вирусспецифических механизмов гибели раковых клеток и, соответственно, развития выраженного целевого противоопухолевого эффекта. Все это оказывает негативное влияние на возможность получения положительного результата лечения.
Известно применение вирусов в сочетании с ингибиторами блокирующих противоопухолевый иммунный ответ PD-1 и Tim-3 рецепторов ИКТ (25, 26; 27), лучевой терапией (28; 29) и бактериальными ЛПС (30; 31). Однако имеются сведения, что при сочетании онколитической виротерапии с ЛПС в 40% случаев у животных возникают летальные осложнения -септический шок, развивается «цитокиновая буря» из-за многократного повышения уровня воспалительных цитокинов ИЛ-6 и TNF (31). Это препятствует внедрению данного метода в практическую медицину.
Известно применение аутологичной, облученной и модифицированной ВБН вакцины на основе лизата или культуры опухолевых клеток (далее по тексту - «ВБН-вакцина») в комплексной терапии рака (химио- и лучевая терапия) у пациентов с меланомой кожи, меланомой влагалища, увеальной меланомой, раком молочной железы, раком толстой кишки, раком яичников [119, С. 53-64; 101]. Для приготовления ВБН-вакцины использовали опухолевые клетки, выделенные непосредственно в ходе удаления опухоли, или перевиваемые опухолевые линии, полученные из операционного или биопсийного материала, инактивированные гамма-излучением, замороженные в жидком азоте и обработанные ВБН (10-100 ID50 вируса на клетку опухоли) перед введением пациентам. ВБН-вакцину вводили пациентам в дозе (1-5)×107 под/внутрикожно в сочетании с Г-КСФ раз в неделю в течение 4-х недель, начиная с 4-й по 8-ю недели после операции. В последующем курс продолжали аналогичными инъекциями раз в две недели в течение одного года, далее инъекции делали с возрастающим до трех мес.интервалом на протяжении 2,5 лет. При проведении комплексного лечения с включением курсов адъювантной химиотерапии и по показаниям лучевой терапии в течение 6 мес. ВБН-вакцину получили 36 больных - от 8 до 16 внутрикожных инъекций при 6-ти месячном курсе лечения.
Эффективность лечения (по шкале RECIST) с использованием ВБН-вакцины в комплексной терапии охарактеризована следующим образом: полный ответ - у 19,4% больных (при средней продолжительности эффекта 11 мес.); частичный ответ - у 36,1% больных (средняя продолжительность эффекта 11,7 мес.); стабилизация процесса - у 36,1% больных (средняя продолжительность эффекта 12,7 мес.); прогрессирование процесса - у 8,3% больных. Полученные результаты исследований свидетельствовали о более выраженном противоопухолевом эффекте при использовании ВБН-вакцин в сравнении с ВБН в чистом виде в комплексной терапии рака. Побочные эффекты лечения были аналогичны описанным выше для способа-аналога, касающегося применения препарата ВБН в чистом виде [119. С. 53-64].
Невозможность получения заявленного технического результата с помощью способа-аналога [119, С. 53-64; 101] вызвана следующими причинами. Вследствие гетерогенности антигенного состава опухоли и ее метастазов, а также его изменений, обусловленных клональной эволюцией опухоли, и связанных, в первую очередь, с уничтожением клонов с более выраженной иммуногенностью и дальнейшим усилением злокачественности, антигенный профиль опухолевых клеток, полученных из разных мест (основная опухоль, метастазы, лимфоузлы), может существенно различаться. В этой связи, ограниченный набор из общего репертуара опухолевых антигенов, представленный в лизате или культуре аутологичных опухолевых клеток, инактивированных гамма-излучением, в ряде случаев оказывается недостаточным для получения выраженного продолжительного целевого иммунного ответа [14, 15, 100]. Повышение иммуногенности собственных опухолевых клеток с помощью вирусной модификации [119, С. 53-64; 101] не всегда является достаточной.
Известен способ лечения онкологических заболеваний, в частности рака молочной железы, включающий применение ВБН и аутологичной вакцины, представляющей собой сочетание белков теплового шока (БТШ) в комплексе с опухолевыми антигенами, выделенными из опухолевой ткани пациента (далее по тексту - «БТШ-вакцина») [132; 119, С. 99-107]. Применяемый препарат ВБН изготавливали из живого вируса апатогенного штамма La Sota, выращиваемого в свободных от патогенной микрофлоры куриных эмбрионах, который очищали центрифугированием. Указанный способ-аналог включал следующие этапы. Перед операцией (на этапе неоадъювантной терапии) производили инъекции препарата ВБН в дозе 1×109 внутрикожно (4-6 инъекций) в область передней брюшной стенки с интервалом 7-10 дней. Осуществляли хирургическое лечение. Получали БТШ-вакцину, используя обогащенную фракцию БТШ, выделенную из опухолевой ткани пациента до операции (БТШ70-, БТШ90- и БТШ96-пептидные комплексы). Затем проводили курс лечебной вакцинотерапии: БТШ-вакцину начинали вводить спустя двое суток после операции и повторяли с интервалами 7-10 дней в течение 4-6 мес. (8-10 раз) - амбулаторно.
Эффективность применения БТШ-вакцины оценивали по повышению уровня Т-цитотоксических лимфоцитов субпопуляции CD8 (CD3+CD8+), которое свидетельствовало о формировании специфического противоопухолевого иммунитета. Стимуляция специфического иммунного ответа получена в 7 случаях из 8. [119, С. 99-107].
В качестве побочных эффектов лечения отмечены следующие. При введении ВБН и БТШ-вакцины подкожно имела место умеренная болезненность, не требующая какого-либо лечения, припухлость в месте инъекции (местная реакция), повышение температуры, ухудшение общего самочувствия, озноб. Повышение температуры тела пациента до 38°C непосредственно после вакцинации (ревакцинации) считалось показателем адекватной реакции на вакцину и не требовало медикаментозного снижения температуры. При повышении температуры тела выше 38°C и в зависимости от самочувствия пациента предусмотрена симптоматическая медикаментозная коррекция.
Создание противоопухолевых вакцин на базе БТШ основано на способности БТШ связывать пептиды опухолевой клетки и фактически нести антигенный набор тех клеток, из которых они получены. Исследования показали, что клеточные БТШ, такие как БТШ70, БТШ90, БТШ96, в клетке связаны с целым спектром пептидов, включая опухоль-специфические. При извлечении комплексов БТШ-пептид из опухолевой клетки, они будут нести часть индивидуального специфического набора опухоли и при введении их назад пациенту будут формировать специфический иммунитет против того вида опухоли, из которых эти комплексы были выделены. По мнению авторов рассматриваемого способа-аналога [132; 119, С. 99-107], эффективность лечения обусловлена формированием специфического противоопухолевого иммунного ответа широкого спектра действия за счет обогащенной БТШ аутовакцины и дополнительной стимуляции неспецифического иммунитета в сочетании с усилением цитолитической активности за счет адъюванта (ВБН). Кроме того дооперационная стимуляция организма пациента ВБН способствует повышению экспрессии БТШ в опухоли, что повышает их уровень, обеспечивая тем самым возможность получения большего количества комплексов БТШ-опухолевый пептид из того же количества опухолевой ткани.
Однако способ-аналог [132; 119 С. 99-107] не позволяет получить технический результат, обеспечиваемый предложенным способом. Несмотря на то, что обогащенная БТШ аутовакцина повышает иммуногенность представляемых иммунной системе опухолевых антигенов, ограниченный набор последних, представленный в данной аутовакцине, может оказаться недостаточным (по причинам, изложенным выше при критике способа-аналога 128) для получения выраженного продолжительного целевого иммунного ответа опухолевых клеток [14, 15, 100]. Относительно низкая вероятность запуска цитопатической составляющей вирусспецифических механизмов гибели опухолевых клеток, как это было отмечено при критике способа-аналога [119, С. 53-64; 2 X1], а также вероятность высокого содержания лимфоцитов с пониженной функциональной активностью, препятствующего запуску иммунной составляющей ВБН, снижают вероятность получения выраженного целевого противоопухолевого эффекта. Не исключается также возможность инактивации вируса противовирусными антителами. Все это значимо снижает эффективность терапии с использованием указанного способа-аналога.
Наиболее близким к заявленному способу является способ лечения онкологических заболеваний с использованием фармацевтической композиции на основе онколитического вируса Сендай [7П]. Вакцинная композиция по данному изобретению содержит СеВ и фармацевтически приемлемый носитель (например, физиологический раствор), причем в одном варианте композиции используют изолированный, нативный, биологически активный штамм СеВ (Сендай-Москва), депонированный в американской коллекции клеточных культур АТСС под номером РТА-13024, а в другом варианте - генетически сконструированный, биологически активный штамм СеВ, сделанный на основе вирусного материала, депонированного как это указано выше. СеВ может быть размножен в куриных эмбрионах либо адаптирован к размножению в клеточной культуре. Предпочтительным является введение живого вируса, возможно также введение вируса, предварительно инактивированного при помощи ультрафиолетового излучения. Вирусный материал собирается из аллантоисной жидкости или из клеточной среды и вводится в композицию в форме суспензии в аллантоисной жидкости либо лиофилизированным. Оба указанных выше варианта композиции могут дополнительно содержать: инактивированные радиацией клетки, полученные дисперсией из опухолевого материала больного либо из иммуногенных опухолевых клеточных линий; клетки куриных эмбрионов или инактивированные радиацией клетки в комбинации с клетками куриных эмбрионов. Указанную вакцинную композицию (какого-либо из указанных вариантов) вводят пациенту (предпочтительно внутрь опухоли или внутрикожно, подкожно, внутримышечно и т.п.) в эффективном количестве. Вакцинный материал вводят небольшими дозами в 10 точек кожи по 100 мкл. При введении лиофилизированного препарата вируса титр вируса составляет от 6 до 7, а при введении нативного (нелиофилизированного) варианта - от 7 до 8 эмбриональной инфекционной дозы 50% (ЭИД 50%) на мл. Курс иммунотерапии включает 12 инъекций вакцинной композиции, причем инъекции производят с интервалом 7-10 дней. Указанный курс повторяют каждые 2-3 года. Применение рассматриваемой группы изобретений обеспечивает: после радикальных операций - выживание без признаков онкозаболеваний в 92% случаев (у 11 из 12 пациентов), после туморредуктивных операций - выживание без признаков прогрессии заболевания - в 27% случаев (у 4 из 5 пациентов).
Способ-прототип [133] основан на использовании специфических онколитических свойств вируса Сендай. Однако рассматриваемый способ не позволяет обеспечить достижение технического результата заявленного изобретения по следующим причинам. С одной стороны, ему присущи все слабые стороны аутовакцин (изложенные выше), обусловленные тем, что результат зависит от индивидуальных особенностей противоопухолевого иммунитета, формирующегося под влиянием опухоли, которая, в свою очередь, характеризуется не только множественностью антигенов, но и повышенной мутационной активностью с дальнейшим усилением признаков злокачественности [117, 14, 15]. Кроме того, необходимость использования в ходе приготовления вакцин инактивированных радиацией культур собственных раковых клеток уменьшает возможности применения способа из-за сложности получения этих культур. С другой стороны, при реализации заявленного способа имеет место ряд негативных эффектов, специфических для вирусной монотерапин. Так, не исключается вероятность инактивации вируса адаптивными противовирусными антителами (исходно существующими за счет ранее имевшего место контакта пациента с вирусом парагриппа или образованными за счет противовирусного гуморального иммунного ответа), а также нейтрализации клетками-эффекторами врожденного иммунитета (NK-клетки, макрофаги, полиморфноядерные лимфоциты). В результате этого снижается вероятность доставки вирусных частиц в патологические очаги в количестве, необходимом и достаточном для запуска и стабильного функционирования цитопатической и иммунной составляющих вирусспецифических механизмов гибели раковых клеток. Высокое содержание лимфоцитов с пониженной функциональной активностью, которое может быть обусловлено индивидуальными особенностями опухоли, может препятствовать реализации иммунной составляющей вируса Сендай. Не исключается возможность гиперстимуляции противоопухолевого иммунного ответа и развития аутоиммунных реакций. Все это препятствует получению выраженного специфического противоопухолевого ответа, что, в свою очередь, обусловливает относительно низкую эффективность способа-прототипа.
Таким образом, из уровня техники следует, что основной проблемой виротерапии является относительно низкая эффективность лечения при относительно высокой вероятности возникновения непрогнозируемых побочных эффектов. К числу проблем в этой сфере относятся также возможность развития противовирусного иммунного ответа и, как следствие, необходимость разработки более эффективных методов адресной доставки вируса в опухолевые очаги [5,2,1].
Решение технической проблемы в рамках изобретения достигается созданием персонализированного способа терапии онкологических заболеваний под контролем изменений индивидуальных показателей пациента в ходе лечения, обеспечивающего повышение эффективности лечения при снижении риска возникновения побочных эффектов.
Техническим результатом является обеспечение направленного синергического воздействия на биомишени, отражающие функциональную состоятельность Т-цитотоксических лимфоцитов периферической крови пациента, в условиях активной адресной доставки обладающего индивидуальной онколитической активностью вируса, как в первичный, так и во вторичные опухолевые очаги различной локализации, обусловливающего запуск цитопатической и иммунной составляющих вирусспецифических механизмов гибели раковых клеток и их стабильное сочетанное функционирование при различных индивидуально-вариабельных сценариях как реагирования опухолевых клеток, так и противоопухолевого иммунного ответа.
Технический результат достигается тем, что в способе терапии онкологических заболеваний, включающем введение пациенту композиции, содержащей вирус Сендай и фармацевтически приемлемый носитель, согласно изобретению, лечение включает три этапа, при этом предварительно определяют у пациента размер опухоли и метаболическую активность опухолевой ткани (далее по тексту - «морфо-функциональные показатели опухоли»), определяют в биологическом образце пациента процентное содержание Т-цитотоксических лимфоцитов субпопуляции CD8 периферической крови с рецепторами программированной клеточной смерти (PD-1) по отношению к общему числу лимфоцитов указанной субпопуляции (далее по тексту - «содержание PD-1-позитивных Т-лимфоцитов», «содержание CD3+CD8+PD-l+»). При содержании PD-1-позитивных Т-лимфоцитов 40% и менее на первом этапе лечения воздействуют на поверхность кожи пациента импульсно-периодическим лазерным излучением при плотности мощности 0,5-5,0 Вт/см2, длительности импульсов 10-12 нс и частоте следования импульсов 5-20 кГц, а после завершения лазерного воздействия пациенту вводят композицию, содержащую вирус Сендай, внутрикожно в зону данного воздействия. Повторяют указанную процедуру (далее по тексту - «комплексная процедура») на 8-е сутки и через 4-5 суток после проведения второй комплексной процедуры считают первый этап лечения завершенным.
При содержании PD-1-позитивных Т-лимфоцитов более 40% пациенту на первом этапе лечения вводят препарат БТШ70 в течение семи суток.
Через 1-2 суток после завершения первого этапа лечения повторно определяют содержание PD-1-позитивных Т-лимфоцитов и при его значении 40% и менее пациенту на втором этапе лечения проводят комплексные процедуры в течение последующих четырех недель при кратности их проведения один раз в неделю.
При значении указанного показателя более 40% дополнительно определяют в цитологических препаратах, полученных из биологического образца пациента, суммарное процентное содержание опухолевых клеток, имеющих вирус-индуцированные цитопатологические изменения, специфические для вируса Сендай, по отношению к общему количеству опухолевых клеток (далее по тексту - «содержание специфически измененных опухолевых клеток»).
При содержании PD-1-позитивных Т-лимфоцитов более 40% и содержании специфически измененных опухолевых клеток более 20% пациенту на втором этапе лечения назначают терапевтическую схему, включающую комплексные процедуры и введение препарата БТШ70, и проводят терапию по указанной схеме в течение последующих четырех недель, причем кратность проведения комплексных процедур составляет один раз в неделю, а препарат БТШ70 вводят после каждой из данных процедур.
При содержании PD-1-позитивных Т-лимфоцитов более 40% и при содержании специфически измененных опухолевых клеток менее 6% пациенту на втором этапе лечения вводят препарат БТШ70 в течение последующих четырех недель.
Через 1-2 суток после завершения второго этапа лечения у пациента повторно определяют морфо-функциональные показатели опухоли и оценивают их количественное изменение в процентах по отношению к исходным показателям с учетом их направленности (далее по тексту, соответственно, - «уменьшение морфо-функциональных показателей», «увеличение морфо-функциональных показателей»), а также содержание PD-1-позитивных Т-лимфоцитов. При уменьшении размера опухоли более чем на 20% и метаболической активности опухолевой ткани более чем на 30% и при содержании PD-1-позитивных Т-лимфоцитов 40% и менее пациенту на третьем этапе лечения проводят комплексные процедуры в течение последующих шести недель при кратности их проведения один раз в неделю.
При уменьшении размера опухоли более чем на 20% и метаболической активности опухолевой ткани более чем на 30% и при содержании PD-1-позитивных Т-лимфоцитов более 40% пациенту на третьем этапе лечения назначают терапевтическую схему, включающую комплексные процедуры и введение препарата БТШ70, и проводят терапию по указанной схеме в течение последующих шести недель, при этом кратность проведения комплексных процедур составляет один раз в неделю, а препарат БТШ70 вводят после каждой из данных процедур.
При уменьшении хотя бы одного из морфо-функциональных показателей, соответственно, размера опухоли - на 20% и менее, метаболической активности опухолевой ткани - на 30% и менее или их увеличении и при содержании PD-1-позитивных Т-лимфоцитов 40% и менее пациенту на третьем этапе лечения назначают терапевтическую схему, включающую комплексные процедуры и введение препарата, содержащего позитрон-излучающий радионуклид, конъюгированный с опухоль-специфической субстанцией (далее по тексту - «опухоль-специфический позитрон-излучающий радиофармпрепарат», «ПОС-РФП»), и проводят терапию по указанной схеме в течение последующих шести недель, при этом кратность проведения комплексных процедур составляет один раз в неделю, а ПОС-РФП вводят после комплексной процедуры.
При уменьшении хотя бы одного из морфо-функциональных показателей, соответственно, размера опухоли - на 20% и менее, метаболической активности опухолевой ткани - на 30% и менее или их увеличении и при содержании PD-1-позитивных Т-лимфоцитов более 40% у пациента дополнительно определяют процентное содержание Т-цитотоксических лимфоцитов субпопуляции CD8 периферической крови с PD-1 и Tim-3 рецепторами по отношению к общему числу лимфоцитов указанной субпопуляции (далее по тексту - «содержание PD-1, Tim-3-дубль позитивных Т-лимфоцитов», «содержание CD3+CD8+PD-1+Tim-3+»), и при уменьшении хотя бы одного из морфо-функциональных показателей, соответственно, размера опухоли - на 20% и менее, метаболической активности опухолевой ткани - на 30% и менее или их увеличении, при содержании PD-1-позитивных Т-лимфоцитов более 40% и при содержании PD-1, Tim-3-дубль-позитивных Т-лимфоцитов 3% и менее пациенту на третьем этапе лечения назначают терапевтическую схему, включающую комплексные процедуры, введение препарата БТШ70 и введение ПОС-РФП в течение последующих шести недель, при этом кратность проведения комплексных процедур составляет один раз в неделю, препарат БТШ70 вводят после каждой из данных процедур, а ПОС-РФП вводят после введения препарата БТШ70, сочетанного с проведением комплексной процедуры.
При уменьшении хотя бы одного из морфо-функциональных показателей, соответственно, размера опухоли - на 20% и менее, метаболической активности опухолевой ткани - на 30% и менее или их увеличении, при содержании PD-1-позитивных Т-лимфоцитов более 40% и при содержании PD-1, Tim-3-дубль-позитивных Т-лимфоцитов более 3% пациенту на третьем этапе лечения назначают терапевтическую схему, включающую комплексные процедуры, введение препарата БТШ70 и введение фракции липополисахарида продигиозана (далее по тексту - «ЛПС продигиозан») с молекулярной массой менее 10 кДа, обладающей способностью блокировать PD-1 и Tim-3 рецепторы Т-цитотоксических лимфоцитов субпопуляции CD8 периферической крови, полученной путем электронно-лучевой обработки ЛПС продигиозана с последующим фракционированием (далее по тексту - «фракция продигиозана-блокатор иммунных контрольных точек», «ФП-БИКТ», «заявленная ФП»), и проводят терапию по указанной схеме в течение последующих шести недель, при этом кратность проведения комплексных процедур составляет один раз в неделю, препарат БТШ70 вводят после каждой из данных процедур, а ФП-БИКТ вводят после каждого введения препарата БТШ70, сочетанного с проведением комплексной процедуры.
В одном из вариантов осуществления изобретения в ходе комплексной процедуры воздействуют на поверхность кожи пациента импульсно-периодическим лазерным излучением в зеленом/желтом диапазоне, что достигается путем использования лазера на парах меди с длиной волны 510,6 и 578 нм при плотности мощности 1-5 Вт/см2 и времени экспозиции 1-5 мин.
В другом варианте заявленного способа в ходе комплексной процедуры воздействуют на поверхность кожи пациента импульсно-периодическим лазерным излучением в инфракрасном диапазоне на длинах волн 800-1500 нм, которое осуществляют с помощью полупроводникового инфракрасного лазера с длиной волны 830 нм при плотности мощности 1-4 Вт/см2 и времени экспозиции 1-4 мин.
Еще в одном варианте реализации заявленного способа в качестве биологического образца пациента, применяемого для определения содержания PD-1-позитивных Т-лимфоцитов, а также содержания PD-1, Tim-3-дублъ-позитивных Т-лимфоцитов, используют периферическую кровь пациента.
В другом варианте реализации изобретения в качестве биологического образца пациента, применяемого для получения цитологических препаратов, используют биопсийный материал. При этом, при наличии у пациента канцероматоза брюшины или/и плевры в качестве биопсийного материала используют аспирационную жидкость, полученную из брюшной или/и плевральной полостей пациента. При отсутствии указанной патологии в качестве биопсийного материала используют фрагмент солидной опухоли пациента, причем наиболее эффективным является применение пунктата, полученного при тонкоигольной аспирационной биопсии солидной опухоли пациента.
Еще в одном варианте осуществления предложенного способа содержание специфически измененных опухолевых клеток определяют в монослойных цитологических препаратах, полученных из биологического образца пациента.
В конкретном варианте выполнения заявленного способа определение в цитологических препаратах, полученных из биологического образца пациента, содержания специфически измененных опухолевых клеток включает подсчет многоядерных клеток, клеток с микроядрами, клеток с гигантскими ядрами и клеток с массивной вакуолизацией цитоплазмы с последующим суммированием их количества.
Еще в одном варианте осуществления заявленного способа в терапевтической схеме, применяемой, начиная со второго этапа лечения, и включающей комплексные процедуры и введение препарата БТШ70, пациенту вводят препарат БТШ70 через 1-1,5 ч после введения композиции, содержащей вирус Сендай.
В другом частном варианте осуществления изобретения в качестве препарата БТШ70 используют рчБТШ70 (далее по тексту - «Препарат-1 БТШ70»). При этом наиболее эффективным является применение Препарата-1 БТШ70 на первом этапе лечения в рамках терапевтической схемы, предусматривающей введение указанного препарата один раз в сутки внутривенно в дозе 0,005-0,05 мг/кг массы тела.
Еще в одном частном варианте реализации изобретения в качестве препарата БТШ70 используют производные рчБТШ70 пролонгированного действия. Наиболее эффективными является использование гибридных белков на основе рчБТШ70 и Fc-фрагмента человеческого IgG (далее по тексту - «Препарат-2 БТШ70»). При этом в терапевтических схемах, применяемых, начиная со второго этапа лечения, и включающих введение препарата БТШ70, пациенту вводят Препарат-2 БШ70 один раз в неделю внутривенно в дозе 0,005-0,05 мг/кг массы тела.
В конкретных вариантах реализации изобретения в качестве ПОС-РФП используют 11С-холин, 11С-метионин или 18F-холин (далее по тексту, соответственно, - «ПОС-РФП-1», «ПОС-РФП-2», «ПОС-РФП-3»).
В частном варианте осуществления заявленного способа в терапевтических схемах, применяемых на третьем этапе лечения и включающих введение ПОС-РФП, указанный препарат вводят пациенту внутривенно в дозе 250-500 МБк 1-2 раза в течение двух недель.
В другом частном варианте реализации изобретения в терапевтической схеме, применяемой на третьем этапе лечения и включающей комплексные процедуры и введение ПОС-РФП, указанный препарат вводят через 2-3 ч после введения композиции, содержащей вирус Сендай.
Еще в одном частном варианте осуществления заявленного способа в терапевтической схеме, применяемой на третьем этапе лечения и включающей комплексные процедуры, введение препарата БТШ70 и введение ПОС-РФП, пациенту вводят Препарат-2 БТШ70 один раз в неделю через 1-1,5 ч после введения композиции, содержащей вирус Сендай, а ПОС-РФП вводят через 1-1,5 ч после введения Препарата-2 БТШ70, сочетанного с проведением комплексной процедуры.
Также, в конкретном варианте осуществления изобретения в терапевтической схеме, применяемой на третьем этапе лечения и включающей комплексные процедуры, введение препарата БТШ70 и введение ФП-БИКТ, пациенту вводят Препарат-2 БТШ70 один раз в неделю через 1-1,5 ч после введения композиции, содержащей вирус Сендай, а ФП-БИКТ вводят после каждого введения Препарата-2 БТШ70, сочетанного с проведением комплексной процедуры.
Наиболее эффективным является использование ФП-БИКТ, в ходе получения которой электронно-лучевую обработку ЛПС продигиозана осуществляют с помощью широкоапертурных импульсных электронных пучков с энергией электронов 180-200 кэВ при поглощенной дозе 150 кГр.
В конкретном варианте реализации изобретения на третьем этапе лечения используют ФП-БИКТ, в ходе получения которой фракционирование осуществляют методом ультрафильтрации с применением мембран с порогом отсечения по молекулярной массе 10 кДа.
В частном варианте осуществления изобретения в терапевтической схеме, применяемой на третьем этапе лечения, ФП-БИКТ вводят пациенту внутривенно в дозе 0,005-0,01 мг/кг массы тела.
Выбор оптимальной тактики первого, второго и третьего этапа лечения осуществляли, базируясь на результатах предварительно проведенных авторами изобретения клинических исследований. В исследование были включены 64 пациента в возрасте 35-86 лет с распространенным и метастатическим раком
Для стимуляции противоопухолевого иммунного ответа всем пациентам проводили курсовое введение рчБТШ70, которое составляло 7 дней. По показаниям (в зависимости от результатов, полученных после завершения курса рчБТШ70) проводили дополнительную стимуляцию противоопухолевого иммунного ответа либо путем введения других лекарственных средств, либо путем пролонгирования курсового введения рчБТШ70. Все больные находились на амбулаторном лечении.
У 46 пациентов предварительно определяли содержание PD-1-позитивных опухоль-инфильтрующих Т-цитотоксических лимфоцитов (TIL) в субпопуляции CD8 (CD3+CD8+PD-1+), содержание PD-1, Tim-3-дубль-позитивных TIL в субпопуляции CD8 (CD3+CD8+PD-1+Tim-3+), содержание PD-1-позитивных Т-цитотоксических лимфоцитов в субпопуляции CD8 периферической крови (CD3+CD8+PD-1+), содержание PD-1, Tim-3-дубль-позитивных Т-цитотоксических лимфоцитов (содержание CD3+CD8+PD-1+Tim-3+), а также содержание перфорина и гранзима В (далее по тексту - «гранзим») в указанных лимфоцитах. Кроме того исследовали опухолевые клетки в опухолевом инфильтрате.
Клеточный материал - клетки асцитической жидкости и плеврального выпота от пациентов получали во время проведения терапевтических процедур по жизненным показаниям. Во время удаления асцитической жидкости и плеврального выпота часть удаляемой жидкой фракции помещали в стерильные емкости с гепарином. В лабораторных условиях отбирали надосадочную фракцию, а отстоявшуюся суспензию переносили в цитобакеты для цитоцентрифугирования. С помощью центрифуги CitoFuga (Германия) со скоростью 22g в течение 6 мин получали цитоцентрифугат на стандартном предметном стекле для цитопатологических и иммуноцитохимических исследований.
Для цитопатологических исследований препараты окрашивали азур II-эозином с одновременной фиксацией по Май-Грюнвальду для определения частоты встречаемости клеток с признаками апоптоза, метуоза и цитопатологических показателей (симпластов, многоядерных клеток, аутофагий, микронуклеации). В каждом препарате под иммерсией (увеличение 1000х, микроскоп Leica, Германия) было проанализировано по 500 клеток. Частоты встречаемости апоптоза и метуоза, а также всех видов цитопатологий выражали в процентах. Часть полученных цитоспиновых препаратов в дальнейшем были использованы для иммуноцитохимических окрашиваний.
Иммуноцитохимическое выявление рецепторов программированной смерти лимфоцитов PD-1 проводили методом ручного окрашивания в боксе-ламинаре. Фиксированные 96% этиловым спиртом, но неокрашенные цитоспиновые препараты еще раз дофиксировывали смесью спирт:ацетон в соотношении 1:1 в течение 10 мин и высушивали на воздухе.
Эндогенную пероксидазу в мазках инактивировали раствором 1% азида натрия (Merck) в течение 10 мин, затем промывали в двух сменах бидистиллированной воды и оставляли на 5 мин в Трис-NaCl буфере (pH 7,6). До нанесения свиной сыворотки (Novocastra) поле для иммуноцитохимического анализа обводили гидрофобным карандашом (DakoCytomation). По окончании инкубации с преиммунной сывороткой (30 мин при комнатной температуре) наносили моноклональные антитела к PD1 рецепторам лимфоцитов человека (Anti-PD1 antibody [NAT105], ab195885, Abeam, Англия) и инкубировали препараты в течение часа при 37°C. По завершении мечения первыми антителами препараты проводили в двух сменах буфера по 5 мин. Визуализацию PD1 проводили с помощью универсального кита ABC (Novocastra). Со вторыми антителами препараты инкубировали в течение 15 мин при комнатной температуре. Следующим этапом иммуноцитохимической процедуры, которому предшествовала отмывка препаратов в двух сменах буфера, являлось нанесение на 10 мин при комнатной температуре системы визуализации, состоящей из растворимого комплекса - авидин и биотинилированная пероксидаза хрена (DakoCytomation). В качестве субстрата для проявления иммуноцитохимической реакции использовали 3,3'-диаминобензидин (ДАБ) в формате от фирмы Novocastra. Затем препараты докрашивали гематоксилином.
Частоту встречаемости PD-1-позитивныхTIL (% от 100 клеток) определяли путем подсчета иммуноцитохимически окрашенных (включая слабо, умеренно и сильно окрашенных) лимфоцитов в ассоциациях с комплексами атипичных клеток. Ассоциированные с этими комплексами, но неокрашенные лимфоциты подсчитывались как PD-1-отрицательные.
Иммунофенотипирование лимфоцитов периферической крови проводили методом проточной лазерной цитофлуориметрии в многоцветном анализе на проточных цитофлуориметрах с использованием моноклональных антител к поверхностным дифференцировочным антигенам на клетках иммунной системы. При этом использовали моноклональные антитела к CD8-FITC клон B9.11 (Кат. №А07756, Beckman-Coulter, США), к CD3-PE клон UCHT1 (Кат. №А07747, Beckman-Coulter, США), к CD279 (PD-1)-PC5.5 клон PD1.3 (Кат. №В36123, Beckman-Coulter, США), к CD366 (Tim-3)-APC, клон F-38-2E2 (Кат. №345011, Biolegend, США), к CD45-APC-Alexa Fluor 750 клон J.33 (Кат. №А79392, Beckman-Coulter, США). Пробоподготовку образца цельной крови в количестве 50 мкл, взятой из кубитальной вены натощак в вакутейнер с добавлением К3-ЭДТА, проводили согласно инструкциям фирм-производителей антител с последующим использованием реагента Optilyse С (Кат. №А11894, Beckman-Coulter, США) для лизиса эритроцитов и однократной отмывкой фосфатно-солевым буфером. Анализ пробы и негативного контроля по изотипу проводили на приборе Navios, оснащенном двумя диодными лазерами 488 и 635 нм (Beckman-Coulter, США). Подготовку образцов периферической крови и настройку протокола для анализа методом проточной цитометрии проводили согласно рекомендациям C.B. Хайдукова и др. [4ПР]. Анализировали 10000 лимфоцитов, выделенных на основании прямого, бокового светорассеяния и экспрессии панлейкоцитарного маркера CD45. Обработку цитофлуориметрических данных проводили при помощи программы Navios Software v. 1.2. Оценивали относительное количество Т-цитотоксических лимфоцитов (CD45+CD3+CD8+), экспрессирующих целевые маркеры CD279 (PD-1) и CD366 (Tim-3).
Содержание перфорина и гранзима в лимфоцитах периферической крови определяли следующим образом. Клеточный материал для исследований лимфоцитов получали из цельной гепаринизированной крови пациента. Для этого отстоявшуюся при комнатной температуре пробирку с кровью открывали и с помощью микродозатора забирали клеточный материал на границе плазмы и осевших эритроцитов, а затем переносили на предметные стекла для последующего иммуноцитохимического окрашивания на гранзим и перфорин. Иммуноцитохимические окрашивания осуществляли автоматизированным методом в автостейнере Bond (Leica, Германия) с применением первых антител к перфорину и гранзиму. Автоматический метод окрашивания в автостейнере осуществляли с использованием готовых наборов фирмы-производителя.
Микроскопирование полученных препаратов проводили на малом увеличении с использованием иммерсионного объектива (х40), на микроскопе Leica DM 4000 В (Leica Microsystems, Германия). Результаты иммуноцитохимической реакции на окрашенные автостейнером перфорин и гранзим в мазке обследуемого оценивались полуколичественным методом с подсчетом гистохимического индекса Histochemical Score (H-Score), разработанным McCarthy и соавт. [147]. Система подсчета включала интенсивность иммуногистохимической окраски, оцениваемой по 3-балльной шкале, и долю (%) окрашенных клеток и представляла собой сумму произведений процентов, отражающих долю клеток с различной интенсивностью окраски на балл, соответствующий интенсивности реакции. Интенсивность окраски: 0 - нет окрашивания, 1 - слабое окрашивание, 2 - умеренное и 3 - сильное окрашивание. Подсчет осуществляли по формуле:
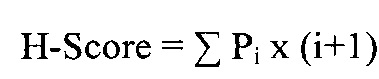 ,
,
где Pi - процент клеток, окрашенных с разной интенсивностью;
i - интенсивность окрашивания, выраженная в баллах от 0 до 3.
Подсчет проводили в трех когортах по 100 клеток в различных полях зрения. Результат HScore трактовался следующим образом: 0-10 баллов -низкий уровень перфорина (гранзима); 11-100 баллов - средний уровень перфорина (гранзима); 101-300 баллов - высокий уровень перфорина (гранзима).
Статистическую обработку данных проводили в соответствии с правилами вариационной статистики [6ПР]. Данные представляли в виде М±σ, где М - среднее арифметическое, σ - среднеквадратичное отклонение. Для оценки статистически значимых различий использовали критерий Стьюдента (t), критический уровень значимости (р) принимался меньшим или равным 0,05.
Результаты определений представлены в табл. 1-4.
Достижение обеспечиваемого изобретением технического результата обусловлено следующим.
На основании результатов многочисленных исследований доказано, что, с одной стороны, опухоль может развиваться в условиях абсолютно неизмененной иммунной системы, с другой стороны, даже на последних стадиях опухолевого процесса могут активироваться функции ряда клеток системы иммунитета, и наконец, бесспорным является факт возможности иммуностимуляции роста опухоли. Это позволило сделать вывод, что при опухолевом процессе изменения со стороны иммунологической системы во многих случаях обусловлены влиянием уже возникшей и развивающейся опухоли, т.е. вторичны [117].
Двойственную активность иммунной системы по отношению к опухоли отображает, в частности, концепция «иммунологического редактирования», согласно которой в процессе взаимодействия опухоли и организма-хозяина условно выделяют три фазы - элиминации, равновесия и уклонения. В фазе элиминации трансформированные клетки распознаются и уничтожаются с помощью клеток иммунной системы. «Дремлющее» состояние злокачественного новообразования, а также наличие длительной клинической ремиссии после проведенного лечения связывают с фазой равновесия, когда одновременно с формированием иммунной реакции происходит отбор вариантов опухолевых клеток со сниженной иммуногенностью, которым удается уклоняться от иммунного контроля, т.е. имеет место «иммунное редактирование» иммунологических свойств опухолевых клеток. На этой фазе иммунная система уже не может полностью уничтожить опухоль, но еще в состоянии эффективно ограничивать ее рост. В ходе третьей фазы опухолевые клетки, с помощью секретируемых ими продуктов, формируют благоприятное для себя клеточное микроокружение (далее по тексту - «КМ»), которое делает невозможным эффективное уничтожение аномальных клеток иммунной системой, создавая, тем самым, условия для метастазирования [107, 109].
Рассматривая гетерогенные изменения в системе иммунитета как одну из важных особенностей опухолевого процесса, предполагается [117], что на каждом этапе развития злокачественного новообразования необходимым является применение таких методов иммунологического исследования, которые отражают функциональное состояние клеток, формирующих противоопухолевую защиту.
Изобретение иллюстрируется следующими примерами.
Пример 1
Фракции ЛПС продигиозана получали следующим образом. Исходным продуктом служил ЛПС продигиозан - высокополимерный липополисахаридньш комплекс, выделяемый из микроорганизма - палочки Bacterium prodigiosum. Для целей заявленного изобретения использовали готовый препарат, поставленный ранее Производственным объединением «Мосмедпрепараты» имени Л.Я. Карпова (Россия) (далее по тексту - «препарат продигиозан»). Указанный препарат в количестве 8 мг активного вещества (во флаконе) растворяли в 8 мл 0,9%-ного раствора натрия хлорида (физраствора), после чего флакон с раствором в чашке Петри помещали в рабочую зону широкоапертурного линейного ускорителя электронов, который представлял собой экспериментальную лабораторную установку производства ФГУП «Научно-исследовательский институт электрофизической аппаратуры им. Д.В. Ефремова» / НИИЭФА им. Д.В. Ефремова/ (Россия), функционирующую в импульсном режиме, размер поля облучения 270×270, энергия электронов 180-200 кэВ и облучали при поглощенных дозах, варьировавших в диапазоне 50-250 кГр (с шагом 50 кГр). Промежуточные продукты, полученные в результате воздействия на препарат продигиозан электронных пучков при указанных поглощенных дозах, подвергали ультрафильтрации с использованием ультрафильтрационной кассетной системы Pellicon 2 Mini с мембранами Biomax® 10 (полиэфирсульфон) (Millipore, США) с получением целевых продуктов - фракций препарата продигиозана (далее по тексту -«ФП»). Выход ФП - целевого продукта при поглощенной дозе 150 кГр -составил 1,28 мг (16%).
Оптимальным считали режим электронно-лучевой обработки препарата продигиозана, обеспечивающий получение в качестве целевого продукта биологически активной ФП с выраженной биологической активностью, в частности, с наиболее выраженными защитными свойствами и сниженной токсичностью. Выбор указанного оптимального режима осуществляли с учетом данных высокоэффективной жидкостной хроматографии (ВЭЖХ), по результатам оценки токсичности различных доз ФП, а также анализа защитных свойств ФП в условиях экспериментального эндотоксического шока.
ВЭЖХ проводили с использованием Системы Dionex UltiMate® 3000 Rapid Separation LC (RSLC) (жидкостной хроматограф высокого давления), Zovbax С-18, 100×1 nm, size 1,8 μm (Thermo Scientific Dionex, США). В рамках ВЭЖХ исследовали воздействие электронного пучка при поглощенных дозах, варьировавших в диапазоне 50-250 кГр, на структуру целевых продуктов. Было установлено, что указанная электронно-лучевая обработка вызывала деградацию препарата продигиозана, приводящую к повышению содержания низкомолекулярных ФП (время удерживания менее 6 мин), которое коррелировало с увеличением поглощенной дозы, составляя, соответственно: 3,63 (препарат продигиозан); 10,8; 29,0; 43,6; 40,7; 37,5%, при поглощенных дозах: 0 (препарат продигиозан), 50, 100, 150, 200, 250 кГр.
Оценку токсичности анализируемых препаратов производили по выживаемости экспериментальных животных при введении различных доз препарата продигиозана и ФП, полученных путем воздействия на указанный препарат электронным пучком при поглощенных дозах, варьировавших в диапазоне 50-250 кГр (далее по тексту - «препараты ФП»). Предварительно определяли в эксперименте острую токсичность (в частности, по ЛД50) препарата продигиозана. При этом белым беспородным мышам массой 18-20 г вводили препарат продигиозан в физрастворе внутрибрюшинно из расчета 0,1 мл на 10 г массы тела животного. Дозы препарата продигиозана варьировали в диапазоне 1-8 мг/кг. Каждую дозу испытывали на группе из 6 животных (дозы свыше 8 мг/кг не испытывались). Выживаемость мышей определяли в течение 14 суток после введения исследуемого препарата. Затем экспериментально-расчетным путем с применением метода Литчфилда и Уилкоксона (модификация пробит-анализа) определяли ЛД50 препаратов ФП, после чего фиксировали выживаемость мышей (аналогично описанному выше для препарата продигиозана). При этом вводимые дозы препаратов ФП варьировали в диапазоне 1-80 мг/кг массы животного (при способе введения, аналогичном описанному выше для препарата продигиозана).
Результаты экспериментальных исследований выборочно представлены в табл. 14 и 15.
Из данных табл. 14 следует, что величина ЛД50, составляющая для препарата продигиозана 4 мг/кг, возрастала при его электронно-лучевой обработке, коррелируя с увеличением поглощенной дозы и достигая максимальных значений (62-64 мг/кг) для препаратов ФП, полученных при воздействии электронным пучком в дозах 150-250 кГр.
Данные, приведенные в табл.15, показывают, что полная выживаемость мышей была зарегистрирована при следующих дозах препаратов ФП (с учетом режима электронно-лучевой обработки): - 1-4 мг/кг - для фракций, полученных при использовании поглощенной дозы 50 кГр; 8-12 мг/кг - для фракций с поглощенной дозой 100 кГр; 12-16 мг/кг - для фракций с поглощенными дозами 150-200 кГр; 16-21 мг/кг - для фракций с поглощенной дозой 250 кГр.
Таким образом, анализ результатов оценки токсичности препаратов ФП с учетом данных хроматографических исследований показал, что наиболее эффективное снижение токсичности продигиозана (~ в 16 раз) имело место при его облучении электронным пучком в дозах 150-250 кГр, что коррелировало с наибольшим содержанием низкомолекулярных ФП.
Оценку защитных свойств анализируемых препаратов осуществляли с использованием модели эндотоксического шока, вызванного бактериальным эндотоксином, в качестве которого использовали ЛПС продигиозан. ЛПС продигиозан вводили мышам внутрибрюшинно в физрастворе (0,1 мл на 10 г массы тела животного) в дозе 2 ЛД50/мышь. Исследуемые препараты ФП вводили в дозе 0,1 ЛД50 за 1 ч до экспериментального эндотоксического шока. Каждую дозу испытывали на группе из 10 животных. В качестве контроля служили мыши (10 животных), которым за 1 ч до экспериментального эндотоксического шока вводили физраствор. Выживаемость мышей определяли в течение 14 суток после введения исследуемого препарата ФП.
Результаты эксперимента приведены в табл.16.
Данные табл.16 свидетельствуют о том, что ФП, полученная путем электронно-лучевой обработки препарата продигиозана при поглощенной дозе 150 кГр, обладала наиболее выраженными защитными свойствами при экспериментальном эндотоксическом шоке у мышей, вызванном бактериальным эндотоксином. ФП, полученные путем воздействия электронным пучком при меньших поглощенных дозах (100 и 50 кГр), обладали менее выраженным защитным эффектом. Это, по-видимому, связано с тем, что данные дозы облучения не позволяют обеспечить необходимое и достаточное содержание биологически активной фракции, определяющей наличие у препарата указанных свойств. Уменьшение защитных свойств ФП при увеличении дозы их электронно-лучевой обработки (200 и 250 кГр), может быть обусловлено, по мнению авторов изобретения, тем, что продукты радиохимической деградации ЛПС теряют биологическую активность, необходимую для предотвращения гибели животных при экспериментальном эндотоксическом шоке.
Сопоставление результатов оценки токсичности препаратов ФП, защитных свойств этих препаратов и данных хроматографических исследований позволяет сделать вывод, что оптимальным с точки зрения получения ФП с выраженной целевой биологической активностью является режим электронно-лучевой обработки препарата продигиозана при поглощенной дозе 150 кГр, что дает возможность считать указанную дозу оптимальной для получения заявленной ФП (ФП-БИКТ). Из этого следует также, что оптимальной дозой ФП в эксперименте является доза 12-16 мг/кг массы тела мыши.
Полученные результаты послужили основанием для проведения клинических исследований эффективности ФП, полученной с использованием оптимального режима электронно-лучевой обработки. Принимая во внимание фармакопейные дозы продигиозана (разовая доза для взрослых: 25-30 мкг, иногда до 50-100 мкг, т.е. от 0,00036-0,00043 до 0,00071-0,00143 мг/кг массы тела) и учитывая экспериментально установленный авторами изобретения коэффициент снижения (по сравнению с продигиозаном) токсичности заявленной ФП, составляющий (как было указано выше) 16, диапазон возможных терапевтических доз заявленной ФП был определен как 0,006-0,02 мг/кг массы. В клинических исследованиях на добровольцах было установлено, что предельно допустимая доза низкомолекулярной заявленной ФП составляет 0,02 мг/кг массы тела. При превышении указанной дозы в ряде случаев развивалась выраженная пирогенная реакция и коматоидное состояние. Таким образом, в качестве верхней границы диапазона терапевтических доз была принята величина 0,01 мг/кг массы тела.
Клинические исследования влияния различных доз заявленной ФП в диапазоне 0,025-0,01 мг/кг массы тела (вводили внутривенно на 250 мл физиологического раствора) на содержание CD3+CD8+PD-1+Tim-3+, проведенные у больных с распространенным и метастатическим раком, показали, что, начиная с дозы 0,05 мг/кг значение указанного показателя достоверно отличалось от исходного значения. Таким образом, в качестве диапазона терапевтических доз был принят диапазон 0,005-0,01 мг/кг массы тела.
Пример 2
Больной Н., 73 года, масса тела 58 кг. Поступил на амбулаторное лечение с диагнозом: Распространенный метастатический рак предстательной железы. Четыре года тому назад выявлена аденокарцинома простаты. Принимал антиандрогены (флутамид, андрокур). Три года назад произведена радикальная простатэктомия. После операции уровень онкомаркера ПСА (простатический специфический антиген) - 0,8 нг/мл (норма 1-4 нг/мл). Через 9 месяцев после операции: уровень ПСА вырос до 420 нг/мл; выявлен метастаз в левую подвздошную кость (по данным компьютерной томографии /КТ/), что свидетельствовало о развитии рецидива заболевания.
В этой связи пациенту была назначена терапия заявленным способом (после подписания информированного согласия). Перед началом лечения проведено комплексное обследование больного (далее по тексту - «КО»), которое наряду с общеклиническими исследованиями включало специальный комплекс инструментальных, лучевых и лабораторных методов обследования, в том числе: ПЭТ-КТ; определение уровня онкомаркеров в сыворотке крови; определение содержания цитокинов в сыворотке крови (фактор некроза опухоли /TNF/, интерлейкин 6 /IL-6/, интерлейкин 10/IL-10/); иммунофенотипирование лимфоцитов периферической крови (определение абсолютного и относительного количества лимфоцитов с различными кластерами дифференцировки - CD) с последующим определением содержания PD-1-позитивных Т-лимфоцитов (CD3+CD8+PD-1+) и PD-1, Tim-3-дубль-позитивных Т-лимфоцитов (CD3+CD8+PD-l+Tim-3+), а также содержания перфорина и гранзима в лимфоцитах периферической крови.
ПЭТ-КТ выполняли с ПОС-РФП-1 (11C-холин) (предоставлен для исследований ФГБУ «Российский научный центр радиологии и хирургических технологий» МЗ РФ /РНЦРХТ/, Россия), который вводили пациенту внутривенно в дозе 269 МБк, по методике, принципы которой изложены, например в работах [1ПР, 2ПР, 3ПР]. ПЭТ-КТ выполняли на ПЭТ-КТ-томографе «Biograph» («Siemens», Германия), состоящем из компьютерного томографа и позитронно-эмиссионного томографа, совмещенных в единый диагностический комплекс. Использовали протокол «Whole body», включающий диагностическое КТ-сканирование с последующей ПЭТ. Анализ полученных данных проводили с учетом просмотра КТ, ПЭТ и ПЭТ/КТ изображений. КТ-томограммы оценивали визуально по трем проекциям с использованием мультиплоскостных реконструкций с обязательным измерением размеров очагов. Оценку ПЭТ данных осуществляли визуально с учетом интенсивности накопления ПОС-РФП по цветовым шкалам и полуколичественным методом с определением стандартизованного показателя захвата ПОС-РФП (Standart Uptake Value, SUV), представляющего собой отношение концентрации радиоактивности ПОС-РФП в зоне интереса/ к введенной активности ПОС-РФП, поделенной на массу тела, и характеризующего интенсивность накопления (гиперфиксации) ПОС-РФП в патологическом очаге и, следовательно, метаболическую активность данного очага. Для получения ПЭТ/КТ изображений применяли прикладной программный пакет «Fusion», позволяющий проводить совмещение ПЭТ и КТ данных в различном процентном соотношении. Основные характеристики патологических очагов включали: локализацию, контуры, размеры, соотношение с соседними структурами, наличие и интенсивность гиперфиксации ПОС-РФП. По результатам ПЭТ-КТ выявлены патологические очаги в двух ребрах и левой подвздошной кости с гиперфиксацией ПОС-РФП-1 размерами 1,3-4,2 см; SUV 2,7-4,0.
Содержание цитокинов в сыворотке крови (IL-6, IL-10, TNF), а также уровень онкомаркеров определяли с помощью коммерческих тест-систем для иммуноферментного анализа (ELISA) производства «Bender-Medsystems» (Австрия) в соответствии с инструкциями производителя. Уровень ПСА составил 468 нг/мл. Содержание TNF, IL-6, IL-10 - в пределах нормы.
Иммунофенотипирование лимфоцитов периферической крови проводили методом проточной лазерной цитофлуориметрии в многоцветном анализе на проточных цитофлуориметрах с использованием моноклональных антител к поверхностным дифференцировочным антигенам на клетках иммунной системы, как это описано выше для выбора тактики лечения. Оценивали относительное количество Т-цитотоксических лимфоцитов (CD45+CD3+CD8+), экспрессирующих целевые маркеры CD279 (PD-1) и CD366 (Tim-3). По результатам проведенного анализа содержание CD3+CD8+PD-1+ составило 33,5%, а содержание CD3+CD8+PD-1+Tim-3+ - 0,7%.
Содержание перфорина и гранзима в лимфоцитах периферической крови путем иммуноцитохимического окрашивания на гранзим и перфорин, которое осуществляли автоматизированным методом в автостейнере Bond (Leica, Германия) с применением первых антител к перфорину и гранзиму, Автоматический метод окрашивания в автостейнере осуществляли с использованием готовых наборов фирмы-производителя.
Результаты иммуноцитохимической реакции на окрашенные автостейнером перфорин и гранзим в мазке обследуемого оценивались полуколичественным методом с подсчетом гистохимического индекса Histochemical Score (H-Score), разработанным McCarthy и соавт.[5ПР], как это было описано выше для выбора тактики лечения. По результатам выполненного анализа содержание перфорина и гранзима составило, соответственно, 257 и 241 (HScore).
С учетом полученного значения показателя (содержание CD3+CD8+PD-1+< 40%), являющегося определяющим для выбора тактики на первом этапе лечения заявленным способом, пациенту была назначена комплексная процедура, в ходе которой воздействовали на пять участков кожи пациента диаметром 5-10 мм лазером на парах меди «Систа-6» (НИИЭФА им. Д.В. Ефремова, Россия) (длина волны 510,6 и 578 нм, пиковые значения плотности мощности 10 кВт/см2, длительность импульсов 10-12 нс, частота следования импульсов 5-15 кГц) при плотности мощности 2 Вт/см2 и времени экспозиции лазерного излучения 3 мин.
Через 2 мин после завершения лазерного воздействия пациенту ввели вирус Сендай в составе фармацевтической композиции, в качестве которой использовали готовую фармацевтическую композицию для медицинских исследований (Charles River Laboratories Int. Inc., США) на базе штамма Сендай-Moscow (депонированного в коллекции клеточных культур АТСС, США под №РТА-13024), которая представляла собой суспензию с титром вируса 107,0-108,0 ТЦД50 (количество инфекционных единиц вируса, выраженных в тканевых цитопатогенных дозах; каждая из которых может вызвать гибель 50% клеток монослоя) в 1,0 мл аллантоисно-амниотической жидкости свободных от специфических патогенных контаминантов куриных эмбрионов (далее по тексту - «Композиция с вирусом Сендай»). 1,0 мл Композиции с вирусом Сендай разводили в 1,0 мл физраствора и вводили пациенту по 0,4 мл в каждую из пяти зон воздействия (суммарная доза вируса составила 107,0-108,0 ТЦД50). Комплексную процедуру проводили повторно через семь суток и через пять суток после проведения второй комплексной процедуры считали первый этап лечения завершенным.
Через сутки после завершения первого этапа лечения у пациента повторно определили содержание CD3+CD8+PD-1+, которое составило 31,2% (< 40%), в связи с чем на втором этапе лечения больному продолжено проведение комплексных процедур один раз в неделю в течение последующих четырех недель.
Через сутки после завершения второго этапа лечения пациенту повторно выполнена ПЭТ-КТ. В результате сопоставления размера каждого из патологических очагов и интенсивности гиперфиксации (накопления) в нем РФП-1 (SUV) с соответствующими исходными значениями выявлено уменьшение размера указанных очагов и снижение уровня их метаболической активности в среднем, соответственно, на 48,4 и 74,3% (> 20% и > 30%). Содержание CD3+CD8+PD-1+ при повторном определении - 28,5% (< 40%). На основании полученных значений указанных показателей на третьем этапе лечения (в течение последующих шести недель) продолжена терапия по схеме второго этапа.
После завершения лечения (через 12 недель) проведено контрольное комплексное обследование пациента (далее по тексту - «ККО»), включающее ПЭТ-КТ; определение уровня онкомаркеров в сыворотке крови; определение содержания цитокинов в сыворотке крови (TNF, IL-6, IL-10); определение абсолютного и относительного количества лимфоцитов периферической крови с различными кластерами дифференцировки (CD) с последующим определением содержания CD3+CD8+PD-1+ и CD3+CD8+PD-1+Tim-3+; а также содержания перфорина и гранзима в лимфоцитах периферической крови. По данным ПЭТ-КТ: выявлено исчезновение всех очагов патологического накопления РФП. Уровень ПСА снизился до 2,4 нг/мл; содержание TNF, IL-6, IL-10 - в пределах нормы; содержание CD3+CD8+PD-1+ и CD3+CD8+PD-1+Tim-3+, соответственно, - 27,4% (< 40%) и 0,4% (< 3%), содержание перфорина и гранзима, соответственно, - 263 и 244 (HScore). Результат лечения заявленным способом расценивался как «полный ответ» (CR) по шкалам RECIST и PERCIST.
ККО через 12 мес. после завершения лечения показало: очагов патологического накопления РФП-1 не выявлено (по данным ПЭТ-КТ); уровень ПСА - 0,001 нг/мл; содержание TNF, IL-6, IL-10 - в пределах нормы; содержание CD3+CD8+PD-1+ и CD3+CD8+PD-1+Tim-3+, соответственно, -24,3% (< 40%) и 0,3% (< 3%); содержание перфорина и гранзима, соответственно, - 266 и 251 (HScore). Таким образом результаты ККО свидетельствовали об отсутствии прогрессирования заболевания.
Пример 3
Больная С., 34 года, масса тела 70 кг. Поступила на амбулаторное лечение с диагнозом: Распространенный метастатический рак яичника, T3N1M1, эндометриоидная низкодифференцированная аденокарцинома, канцероматоз брюшины и плевры, раковый асцит, двухсторонний плеврит, множественные метастазы в области малого таза, брюшной полости и средостения, распространенная лимфаденопатия. Заболевание выявлено 5 месяцев назад. До начала лечения уровень онкомаркера СА 125 4200 ед./мл (норма до 35 ед./мл). Прошла 5 курсов химиотерапии (платина + таксол) в сочетании с общей и локальной гипертермией. После завершения лечения проведено расширенное КО, дополнительно включавшее МРТ (магнитно-резонансную томографию), КТ, УЗИ брюшной полости. ПЭТ-КТ проводили аналогично примеру 2, при этом в качестве ПОС-РФП использовали 18F-ФДГ (предоставлена для исследований РНЦРХТ, Россия), которую вводили пациентке внутривенно в дозе 176 МБк. По данным MPT, КТ, УЗИ брюшной полости, ПЭТ-КТ - сохраняются множественные патологические очаги в брюшной и грудной полостях, средостении; по данным ПЭТ-КТ - размеры патологических очагов с гиперфиксацией 18F-ФДГ 1,0-6,2 см; SUV 1,2-4,6; нарастание асцита и ракового плеврита. Уровень онкомаркера СА 125 - 4000 ед./мл; содержание TNF - 1011 пг/мл (норма 0-50 пг/мл); содержание IL-6, IL-10, - в пределах нормы; содержание CD3+CD8+PD-1+ и CD3+CD8+PD-l+Tim-3+, соответственно, - 28,1 и 0,9%; содержание перфорина и гранзима, соответственно, - 259 и 243 (HScore). Результаты расширенного КО свидетельствовали об отсутствии положительного эффекта проведенного лечения.
Больной назначено лечение с применением заявленного способа (после подписания информированного согласия). С учетом полученного значения содержания CD3+CD8+PD-1+ (<40%), пациентке на первом этапе проведены две комплексные процедуры аналогично примеру 2. В ходе комплексных процедур лазерное воздействие осуществляли с использованием полупроводникового инфракрасного лазера (ФГБУН «Физико-технический институт имени А.Ф. Иоффе» РАН /ФТИ им. А.Ф. Иоффе /, Россия) (длина волны 830 нм, пиковые значения плотности мощности 20 кВт/см2, длительность импульсов 10 нс, частота следования импульсов 1-20 кГц) при плотности мощности 1 Вт/см2 и времени экспозиции излучения 4 мин.
Через сутки после завершения первого этапа лечения отмечено повышение содержания CD3+CD8+PD-1+ до 68,6%, в связи с чем для выбора оптимальной для следующего этапа тактики лечения у больной дополнительно определяли in vivo в цитологических препаратах, полученных из асцитической жидкости, содержание специфически измененных опухолевых клеток, которое составило 45,2%. По результатам цитологического исследования асцитической жидкости выявлено также развитие массивного апоптоза и некроза опухолевых клеток.
На основании полученных значений показателей - содержания CD3+CD8+PD-1+ > 40% и содержания специфически измененных опухолевых клеток > 20%, - больной была назначена терапевтическая схема, включающая комплексные процедуры и введение Препарата-2 БТШ70 в течение последующих четырех недель. Комплексные процедуры выполняли аналогично примеру 2 (кратность проведения - один раз в неделю), при этом применяемый лазер и режим воздействия соответствовали лазеру и режиму на первом этапе лечения. В качестве Препарата-2 БТШ70 использовали готовый препарат для медицинских исследований (ProMab Biotechnologies, Inc., США), который представлял собой гибридный белок на основе рчБТШ70 и Fc-фрагмента IgG, в виде раствора в буфере Трис-HCl (1,2 мг белка в 1 мл раствора) (далее по тексту - «Препарат-2 БШ70-МИ»). Расчетную дозу Препарата-2 БТШ70-МИ - 1,1 мг (0,015 мг/кг массы тела) разводили в 250 мл физраствора и вводили пациентке внутривенно через 1 ч после введения Композиции с вирусом Сендай. Терапию по указанной схеме проводили в течение последующих четырех недель.
Через сутки после завершения второго этапа лечения у больной
выполнена ПЭТ-КТ аналогично примеру 2 с использованием 18F-ФДГ в дозе 176 МБк), которая выявила уменьшение размера метастатических очагов и снижение уровня их метаболической активности в среднем, соответственно, - на 58,2 и 65,4% (> 20% и > 30%). Содержание CD3+CD8+PD-1+ при повторном определении - 29,1% (< 40%), на основании чего на третьем этапе была назначена терапевтическая схема, предусматривающая проведение комплексных процедур, которые выполняли аналогично примеру 2 (применяемый лазер и режим воздействия соответствовали описанным для первого этапа лечения настоящего примера). Терапию по указанной схеме проводили в течение последующих шести недель (кратность проведения - один раз в неделю).
Результаты ККО после завершения лечения (через 12 недель) показали следующее. По данным ПЭТ-КТ выявлено уменьшение размеров метастатических очагов и снижение уровня их метаболической активности в среднем, соответственно, - на 68,4 и 75,2% (> 30% и > 50%). Уровень онкомаркера CA125 снизился до 36 ед./мл; содержание TNF - 78 пг/мл; содержание IL-6, IL-10 - в пределах нормы; содержание CD3+CD8+PD-1+ и CD3+CD8+PD-1+Tim-3+, соответственно, - 31,5% (< 40%) и 0,9% (< 3%); содержание перфорина и гранзима, соответственно, - 259 и 244 (HScore). Цитологическое исследование показало, что 82,0% опухолевых клеток в асцитической жидкости имели цитопатологические изменения (клетки с признаками апоптоза, клетки с массивной вакуолизаией цитоплазмы). Результат лечения предложенным способом расценивался как «частичный ответ» (PR) по шкалам RECIST и PERCIST.
По результатам ККО через 12 мес.после завершения лечения установлено: уменьшение размеров метастатических очагов и снижение уровня их метаболической активности в среднем, соответственно, - на 69,3 и 81,6% (> 30%); уровень СА 125 - 48 ед./мл; содержание TNF - 62 пг/мл; содержание IL-6, IL-10 - в пределах нормы; содержание CD3+CD8+PD-1+ и CD3+CD8+PD-1+Tim-3+, соответственно, - 36,5% (< 40%) и 1,7% (< 3%); содержание перфорина и гранзима, соответственно, - 253 и 238 (HScore). При цитологическом исследовании в асцитической жидкости опухолевые клетки не определялись. Таким образом, результаты ККО свидетельствовали об отсутствии прогрессирования заболевания.
Пример 4
Больной Б., 55 лет, масса тела 60 кг. Поступил на амбулаторное лечение с диагнозом: Распространенный метастатический светлоклеточный рак почки, мультифокальное вторичное поражение костных структур черепа, грудины, лопаток, плечевых костей, ребер, грудных, поясничных и крестцовых позвонков, костей таза. Патологические переломы пятого ребра справа, Th6, L3, L4 позвонков. В течение шести месяцев получал сутент и эксдживой, затем в течение пяти месяцев - ниволюмаб в сочетании с капецитабином и авастином. Затем в течение двух месяцев проведен курс лечения кометриком, после чего выявлено прогрессирование метастатических изменений в костях скелета, развитие канцероматоза плевры, левостороннего плеврита.
Больному назначено лечение заявленным способом (после подписания информированного согласия). Перед началом лечения проведено КО пациента аналогично примеру 2. ПЭТ-КТ выполняли с использованием П-РФП-4 (18F-ФДГ) (предоставлен РНЦРХТ, Россия), который вводили больному в дозе 270 МБк. По данным ПЭТ-КТ: размеры патологических очагов с гиперфиксацией П-РФП-4 (в пятом ребре справа, Th6, L3, L4 позвонках, грудине, лопатках, костях таза) - 0,8-3,5 см, SUV 1,2-3,1. Содержание TNF - 980 пг/мл, IL-6 - 158 пг/мл (норма 6-40 пг/мл), IL-10, - 1,2 пг/мл (норма -менее 9,1 пг/мл); содержание CD3+CD8+PD-1+ и CD3+CD8+PD-1+Tim-3+, соответственно, - 64,6 и 1,4%; содержание перфорина и гранзима, соответственно, - 5,2 и 3,3 (HScore).
На основании полученного значения содержания CD3+CD8+PD-1+ (> 40%) пациенту на первом этапе лечения был назначен Препарат-1 БТШ70, в качестве которого использовали готовый препарат для медицинских исследований (ProMab Biotechnologies, Inc., США), представляющий собой рчБТШ70 в виде раствора в буфере Трис-HCl (1,2 мг белка в 1 мл раствора) (далее по тексту - «Препарат-1 БТШ70-МИ»). Расчетную дозу Препарата-1 БТШ70-МИ - 1,8 мг (0,03 мг/кг массы тела) разводили в 250 мл физраствора и вводили пациенту внутривенно в течение семи суток один раз в сутки.
Через двое суток после завершения первого этапа лечения у больного сохранялся высокий уровень CD3+CD8+PD-1+- 59,3% (> 40%), в связи с чем определили содержание специфически измененных опухолевых клеток in vitro в цитологических препаратах, полученных из плевральной жидкости.
Определение содержания специфически измененных опухолевых клеток проводили культуральным методом. Использовали среду DMEM с добавлением фетальной телячьей сыворотки. Аспирационную жидкость центрифугировали при 1000 об/мин в течение 7 мин с последующим посевом в подготовленные для культивирования 6-луночные пластиковые планшеты, содержащие среду DMEM с добавлением 20%-ной фетальной сыворотки (20% от объема среды). Все планшеты выдерживали до появления роста клеток при температуре 37°C, после чего накрывали прикрепившиеся клетки покровным стеклом. Инкубировали в CO2-инкубаторе в течение 3-х-4-х сут. (до образования монослоя). Затем в растущие культуры добавляли вирус Сендай, растворенный в натрий-фосфатном буфере (PBS) (в дозе по 0,5 мл 5×1010 клеток на лунку). Через 72 ч после добавления вируса клеточный рост в культуре останавливали. Выросшие в культуре клетки (прокультивированные с вирусом) снимали с подложки планшета раствором Трипсин:Версен. Полученную клеточную суспензию, содержащую среду DMEM, центрифугировали в центрифужных пробирках в течение 10 мин при 3000 об/мин. Надосадочную жидкость сливали, после чего в центрифужные пробирки добавляли по 1,0 мл PBS. Полученную клеточную суспензию в PBS переносили в цитобакеты, заправленные предметными стеклами, и центрифугировали в цитоцентрифуге (жидкостная цитология) в течение 10 мин при 1000 об/мин. Предметные стекла вынимали из цитобакетов, высушивали на воздухе, фиксировали 96%-ным этиловым спиртом и окрашивали азур2-эозином по Романовскому-Гимзе.
Цитологическое исследование проводили в окрашенных центрифугатах под иммерсией в проходящем свете с использованием микроскопа Leika DM 4000 (фирма Leika, Германия). Было проанализировано 500 клеток. В клеточных популяциях определяли частоты встречаемости многоядерных клеток (симпластов), клеток с микроядрами, клеток с гигантскими ядрами и клеток с массивной вакуолизацией цитоплазмы. После проведенного цитологического исследования определяли суммарную частоту встречаемости клеток с указанными видами аномалий (в % от общего количества клеток). Содержание специфически измененных опухолевых клеток составило 78,1% (> 20%).
Полученные результаты обусловили назначение больному на втором этапе лечения терапевтической схемы, включающей комплексные процедуры, которые осуществлялись аналогично примеру 2, и введение Препарата-2 БТШ70-МИ. В ходе комплексных процедур лазерное воздействие осуществляли с использованием лазера на парах меди «Систа-6» (НИИЭФА им. Д.В. Ефремова, Россия) при плотности мощности 3 Вт/см2 и времени экспозиции излучения 2 мин. Препарат-2 БТШ70-МИ вводили пациенту один раз в неделю внутривенно в дозе 2,4 мг (0,04 мг/кг массы тела) через 1,5 ч после введения Композиции с вирусом Сендай. Терапию по указанной схеме проводили в течение последующих четырех недель.
Через двое суток после завершения второго этапа лечения у больного выполнена ПЭТ-КТ аналогично описанной выше в настоящем примере (в рамках КО до начала лечения), которая выявила уменьшение размера метастатических очагов и уровня их метаболической активности в среднем, соответственно, - на 38,2 и 56,7% (> 20% и > 30%). Содержание CD3+CD8+PD-1+ - 51,3% (> 40%). В этой связи на третьем этапе больному была продолжена терапия, включающая комплексные процедуры и введение Препарата-2 БТШ70-МИ в дозе 2,4 мг (0,04 мг/кг массы тела) аналогично схеме второго этапа. Терапию по указанной схеме проводили в течение последующих шести недель.
ККО через 12 недель лечения показало следующее: размер метастатических очагов и их метаболическая активность уменьшились (по данным ПЭТ-КТ), соответственно, на 55,6 и 64,8% (> 30% и > 30%); содержание TNF- 78 пг/мл, IL-6 - 34 пг/мл, IL-10 - 68 пг/мл; содержание CD3+CD8+PD-1+ и CD3+CD8+PD-1+Tim-3+ составили, соответственно, 33,2% (< 40%) и 1,2% (< 3%); содержание перфорина и гранзима, соответственно, - 253 и 240 (HScore); в плевральной жидкости опухолевые клетки не определялись (по результатам цитологического исследования). Результат лечения предложенным способом расценивался как «частичный ответ» (PR) по шкалам RECIST и PERCIST.
Через 2 мес.после завершения лечения заявленным способом по данным ККО прогрессирования заболевания не выявлено, опухолевые клетки в плевральной жидкости не определялись.
Пример 5
Больной М., 68 лет, масса тела 70 кг. Поступил на амбулаторное лечение с диагнозом: Нейроэндокринный рак верхней доли правого легкого (T1aN1M1b), метастазы в лимфатических узлах средостения, левом и правом легких, печени. Болен в течение 2,5 лет; проведено шесть курсов химиотерапии (карбоплатин + этопозид), иринотекан (6 мес.), метотрексат + эндоксан (метрономная терапия - последние 3 мес.), рефнот. По данным КТ и МРТ: прогрессирование заболевания - увеличение размеров метастазов в средостении, легких, печени и развитие ракового плеврита.
Больному назначено лечение заявленным способом (после подписания информированного согласия). Предварительно проведено КО пациента аналогично примеру 1. ПЭТ-КТ выполняли с использованием П-РФП-2 (11C-метионина) (предоставлен РНЦРХТ, Россия), который вводили пациенту в дозе 350 МБк, По данным ПЭТ-КТ выявлены множественные патологические очаги в легких, средостении, печени с гиперфиксацией П-РФП-2 размерами 2,4-4,6 см; SUV 1,8-3,9; признаки канцероматоза плевры. Уровень онкомаркера РЭА (раково-эмбриональный антиген) -48,5 пг/мл (норма - менее 6,3 пг/мл); содержание TNF - 810 пг/мл; содержание IL-6, IL-10 - в пределах нормы; содержание CD3+CD8+PD-1+ и CD3+CD8+PD-1+Tim-3+, соответственно, - 58,4 и 1,9%; содержание перфорина и гранзима, соответственно, - 7,9 и 5,1 (HScore).
Учитывая полученное значение содержания CD3+CD8+PD-1+ (>40%), на первом этапе лечения пациенту было назначено введение Препарата-1 БТШ70-МИ в дозе 1,1 мг (0,015 мг/кг массы тела), при этом продолжительность, кратность и способ введения указанного препарата были аналогичны описанным для первого этапа лечения примера 4.
Через сутки после завершения первого этапа лечения содержание CD3+CD8+PD-1+составило 50,8% (> 40%), в связи с чем дополнительно определяли аналогично примеру 4 in vitro в цитологических препаратах, полученных из плевральной жидкости больного, содержание специфически измененных опухолевых клеток, которое составило 34,2% (> 20%).
Полученные результаты обусловили назначение больному на втором этапе терапевтической схемы, включающей комплексные процедуры, которые проводились аналогично примеру 2, и введение Препарата-2 БТШ70-МИ. В ходе комплексных процедур лазерное воздействие осуществляли с использованием лазера на парах меди «Систа-6» (НИИЭФА им. Д.В. Ефремова, Россия) при плотности мощности 5 Вт/см2 и времени экспозиции излучения 1 мин. Препарат-2 БТШ70-МИ, вводили пациенту один раз в неделю внутривенно в дозе 1,8 мг (0,025 мг/кг массы тела) через 1 ч после введения Композиции с вирусом Сендай. Терапию по указанной схеме проводили в течение последующих четырех недель.
Через сутки после завершения второго этапа лечения у больного выполнена ПЭТ-КТ аналогично описанной выше в настоящем примере (в рамках КО до начала лечения), которая выявила уменьшение размера первичной опухоли и метастатических очагов и снижение уровня их метаболической активности в среднем, соответственно, на 8,4 и 12,5% (< 20% и < 30%). Содержание CD3+CD8+PD-1+- 34,2% (< 40%). В этой связи, на третьем этапе больному была назначена схема терапии, включающая комплексные процедуры и введение ПОС-РФП-2 (11C-метионина) один раз в неделю внутривенно в дозе 350 МБк через 2 ч после введения Композиции с вирусом Сендай. Терапию по указанной схеме проводили в течение последующих шести недель.
После завершения третьего этапа лечения получены следующие результаты ККО: размер первичной опухоли и метастатических очагов и их метаболическая активность уменьшились (по данным ПЭТ-КТ), соответственно, на 44,5 и 69,1% (> 30% и > 30%); уровень РЭА - 9,8 пг/мл; содержание TNF - 102 пг/мл; содержание IL-6, IL-10 - в пределах нормы; содержание CD3+CD8+PD-1+ и CD3+CD8+PD-1+Tim-3+ составили, соответственно, 28,7% (< 40%) и 0,6% (<3%); содержание перфорина и гранзима, соответственно - 261 и 242 (HScore). Результат лечения заявленным способом расценивался как «частичный ответ» (PR) по шкалам RECIST и PERCIST.
Через 3 мес. после завершения лечения предложенным способом по данным ККО прогрессирования заболевания не выявлено, опухолевые клетки в плевральной жидкости не определялись (по результатам цитологического исследования).
Пример 6
Больная С, 68 лет, масса тела 62 кг. Поступила на амбулаторное лечение с диагнозом: Смешанный гепатоцеллюлярный-холангиоцеллюлярный метастатический рак печени. Первично-распространенный рак неустановленной первичной локализации с множественными метастазами в брюшной полости и органах малого таза. Выявлен два года назад. Через два месяца после выявления произведена циторедуктивная операция - экстирпация опухоли в печени, резекция толстой кишки, удалено 11 опухолевых очагов размером до 6 см из брюшной полости и малого таза. Онкомаркер АФП (альфа-фетопротеин) при выписке - 5300 ед./мл (норма - до 7 ед./мл).
Через 1 мес.после операции больной назначено лечение заявленным способом (после подписания информированного согласия). Предварительно пациентке было проведено КО аналогично примеру 1, дополнительно включающее МРТ с гепатотропным препаратом. По данным МРТ: резидуальные очаги по большой кривизне желудка, брыжейке толстой кишки, в межпетельном пространстве, на уровне запирательной ямки справа и параректально слева размерами 0,6-1,4 см. С помощью ПЭТ-КТ, проведенной аналогично примеру 1, с использованием ПОС-РФП-1 (11C-холин) (предоставлен РНЦРХТ, Россия) в дозе 250 МБк, выявлены патологические очаги с гиперфиксацией ПОС-РФП-1 размерами 0,5-1,3 см; SUV 1,6-2,4. Уровень АФП 4850 ед./мл; содержание TNF - 840 пг/мл; содержание IL-6, IL-10 - в пределах нормы; содержание CD3+CD8+PD-1+ и CD3+CD8+PD-1+Tim-3+, соответственно, - 63,7 и 2,1%; содержание перфорина и гранзима, соответственно, - 5,3 и 3,4 (HScore).
На основании полученного значения содержания CD3+CD8+PD-1+ (> 40%), на первом этапе лечения пациентке было назначено введение Препарата-1 БТШ70-МИ в дозе 1,9 мг (0,03 мг/кг массы тела), при этом продолжительность, кратность и способ введения указанного препарата были аналогичны описанным для первого этапа лечения примера 4.
Через сутки после завершения первого этапа лечения содержание CD3+CD8+PD-1+ составило 59,5% (> 40%), в связи с чем для выбора оптимальной для следующего этапа тактики лечения было дополнительно установлено содержание специфически измененных опухолевых клеток -4,1% (< 6%), которое определяли аналогично примеру 4 in vitro в цитологических препаратах, полученных из операционного материала больной. Биопсийный материал из солидной опухоли дезагрегировали до получения клеточной суспензии стандартным методом с использованием смеси Трипсин:Версен (1:1). Полученную суспензию центрифугировали при 1000 об/мин в течение 7 мин. Полученный осадок переносили в подготовленные для культивирования 6-луночные пластиковые планшеты, содержащие среду DMEM с добавлением 20%-ной фетальной сыворотки (20% от объема среды), и жидкость центрифугировали при 1000 об/мин в течение 7 мин с последующим посевом в 6-луночные пластиковые планшеты. Дальнейший ход определения аналогичен описанному в примере 4.
На основании значений указанных показателей на втором этапе лечения пациентке было назначено введение Препарата-2 БТШ70-МИ один раз в неделю внутривенно в дозе 2,2 мг (0,035 мг/кг массы тела. Терапию по указанной схеме проводили в течение последующих четырех недель.
Через сутки после завершения второго этапа лечения у больной выполнена ПЭТ-КТ аналогично описанной выше в настоящем примере (в рамках КО до начала лечения), которая выявила уменьшение размера метастатических очагов и уровня их метаболической активности в среднем, соответственно, на 9,4% (< 20%) и 31,7% (> 30%). Содержание CD3+CD8+PD-1+- 34,2% (< 40%). В этой связи, на третьем этапе больному была назначена схема терапии, включающая комплексные процедуры и введение ПОС-РФП-2 (11C-метионина). В ходе комплексных процедур лазерное воздействие осуществляли с использованием полупроводникового инфракрасного лазера (ФТИ им. А.Ф. Иоффе, Россия) при плотности мощности 2 Вт/см2 и времени экспозиции излучения 2 мин. П-РФП-2 вводили пациентке один раз в неделю внутривенно в дозе 350 МБк через 3 ч после введения Композиции с вирусом Сендай. Терапию по указанной схеме проводили в течение последующих шести недель.
Результаты ККО после завершения лечения (через 12 недель) показали следующее: размер метастатических очагов и их метаболическая активность уменьшились (по данным ПЭТ-КТ), соответственно, на 58,0 и 70,2% (> 30%); уровень АФП 180 ед./мл; содержание TNF- 118 пг/мл, содержание IL-6, IL-10 - в пределах нормы; содержание CD3+CD8+PD-1+ и CD3+CD8+PD-1+Tim-3+, соответственно, - 29,5% (< 40%) и 0,7% (< 3%); содержание перфорина и гранзима, соответственно - 262 и 241 (HScore). Результат лечения заявленным способом расценивался как «частичный ответ» (PR) по шкалам RECIST и PERCIST.
Через 1 год 9 мес. после завершения лечения заявленным способом по результатам ККО, дополнительно включающего МРТ, прогрессирования заболевания не выявлено. По данным МРТ: размеры резидуальных очагов в брюшной полости уменьшились в 1,9-2,2 раза; признаков избыточной целлюлярности не выявлено. По данным ПЭТ-КТ: уменьшение размеров метастатических очагов и снижение уровня их метаболической активности в среднем, соответственно, - на 92,4% и 95,1%. Уровень АФП - 48 ед./мл; содержание TNF - 92 пг/мл; содержание EL-6, IL-10 - в пределах нормы; содержание CD3+CD8+PD-1+ и CD3+CD8+PD-1+Tim-3+, соответственно, - 28,1% (< 40%) и 0,3% (< 3%); содержание перфорина и гранзима, соответственно, -258 и 241 (HScore).
Пример 7
Больной К., 59 лет, масса тела 55 кг. Поступил на амбулаторное лечение с диагнозом: Гормонально-резистентный распространенный метастатический рак предстательной железы. Четыре года назад произведена радикальная простатэктомия. Через два года после операции выявлен рецидив заболевания с развитием множественных метастазов в ребра, крестец, кости таза, позвоночник. Проведено 5 курсов химиотерапии (досетаксел + маситиниб) - без эффекта. Масса тела уменьшилась на 37 кг. Не может себя обслуживать самостоятельно.
Через два месяца после завершения химиотерапии больному назначено лечение с использованием заявленного способа (после подписания информированного согласия). Перед началом лечения проведено КО пациента аналогично примеру 2. ПЭТ-КТ выполняли с использованием П-РФП-3 (18F-холин) (предоставлен ФГБУ «Российский онкологический научный центр имени Н.Н. Блохина» Минздрава РФ / РОНЦ им. Н.Н. Блохина /, Россия), который вводили больному в дозе 500 МБк. По данным ПЭТ-КТ выявлены множественные патологические очаги с гиперфиксацией П-РФП-3 в ребрах, крестце, костях таза и позвоночнике размерами 0,8-2,2 см; SUV 1,4-3,6. Уровень ПСА - 512 нг/мл; содержание TNF - 911 пг/мл; содержание IL-6, IL-10, - в пределах нормы; содержание CD3+CD8+PD-1+ и CD3+CD8+PD-1+Tim-3+, соответственно, - 78,1 и 1,9%; содержание перфорина и гранзима, соответственно, - 3,1 и 2,3 (HScore).
На основании полученного значения содержания CD3+CD8+PD-1+ (> 40%), на первом этапе лечения пациенту было назначено введение Препарата-1 БТШ70-МИ в дозе 2,2 мг (0,04 мг/кг массы тела), при этом продолжительность, кратность и способ введения указанного препарата были аналогичны описанным для первого этапа лечения примера 3.
Через двое суток после завершения первого этапа лечения содержание CD3+CD8+PD-1+ оставалось высоким - 69,0% (> 40%), в связи с чем у больного дополнительно определили (аналогично примеру 4) in vitro в цитологических препаратах, полученных из биоптата метастатического очага, содержание специфически измененных опухолевых клеток, которое составило 38,1% (> 20%).
На основании полученных результатов на втором этапе больному назначена терапевтическая схема, включающая комплексные процедуры, которые проводили аналогично примеру 2, и введение Препарата-2 БТШ70-МИ. В ходе комплексных процедур лазерное воздействие осуществляли с использованием полупроводникового ИК лазера (ФТИ им. А.Ф. Иоффе, Россия) при плотности мощности 4 Вт/см2 и времени экспозиции излучения 1 мин. Препарат-2 БТШ70-МИ, вводили пациенту один раз в неделю внутривенно в дозе 2,8 мг (0,05 мг/кг массы тела) через 1,5 ч после введения Композиции с вирусом Сендай. Терапию по указанной схеме проводили в течение последующих четырех недель.
Через двое суток после завершения второго этапа лечения у больного выполнена ПЭТ-КТ аналогично описанной выше в настоящем примере (в рамках КО до начала лечения), которая выявила уменьшение размера метастатических очагов с гиперфиксацией ПОС-РФП-3 и уровня их метаболической активности в среднем, соответственно, на 8,3 и 6,2% (< 20%). Содержание CD3+CD8+PD-1+ - 64,1% (> 40%). В этой связи, дополнительно определяли у больного содержание CD3+CD8+PD-1+Tim-3+, которое составило 0,9% (< 3%). На основании полученных результатов определения (по трем показателям) на третьем этапе больному была назначена схема терапии, включающая комплексные процедуры, которые проводили аналогично примеру 2 (применяемый лазер и режим воздействия соответствовали описанным для второго этапа лечения настоящего примера), введение Препарата-2 БТШ70-МИ и введение П-РФП-3 (18F-холина). Препарат-2 БТШ70-МИ, вводили пациенту один раз в неделю внутривенно в дозе 2,8 мг (0,05 мг/кг массы тела) через 1,5 ч после введения Композиции с вирусом Сендай. П-РФП-3 вводили один раз в две недели внутривенно в дозе 500 МБк через 1 ч после введения Препарата-2 БТШ70-МИ.
По результатам ККО после завершения лечения (через 12 недель) выявлено следующее: размер метастатических очагов и их метаболическая активность уменьшились (по данным ПЭТ-КТ с П-РФП-3) в среднем, соответственно, на 78,4 и 85,0% (> 30%); уровень ПСА снизился до 8,6 нг/мл; содержание TNF- 96 пг/мл; содержание IL-6, IL-10 - в пределах нормы; содержание CD3+CD8+PD-1+ и CD3+CD8+PD-1+Tim-3+, соответственно, 34,3% (< 40%) и 0,4% (< 3%); содержание перфорина и гранзима, соответственно - 257 и 242 (HScore). Результат лечения заявленным способом расценивался как «частичный ответ» (PR) по шкале RECIST.
Через 1 год 2 мес.после завершения лечения заявленным способом по результатам ККО прогрессирования заболевания не выявлено. По данным ПЭТ-КТ: дальнейшее уменьшение размеров метастатических очагов и снижение уровня их метаболической активности - в среднем, соответственно, на 54,2% и 65,5%. Уровень ПСА - 5,3 нг/мл; содержание TNF - 5,6 пг/мл; содержание IL-6, IL-10 - в пределах нормы; содержание CD3+CD8+PD-1+ и CD3+CD8+PD-1+Tim-3+, соответственно, - 29,4% (<40%) и 0,5% (<3%); содержание перфорина и гранзима, соответственно, - 262 и 240 (HScore). Масса тела увеличилась на 13,5 кг, может самостоятельно себя обслуживать.
Пример 8
Больная В., 67 лет, масса тела 52 кг. Поступила на амбулаторное лечение с диагнозом: Немелкоклеточный периферический рак легкого, 3В стадия, канцероматоз плевры. Опухоль выявлена 10 месяцев назад. Проведено девять курсов химиотерапии (гемцитабин/карбоплатин/алимта) - без эффекта. По результатам КТ выявлено новообразование в верхушке левого легкого диаметром 6,5 см. Наличие выраженной дыхательной недостаточности не позволило осуществить оперативное лечение. Химиотерапия прекращена из-за развития связанной с ней почечной недостаточности.
После прекращения химиотерапии у пациентки проведено КО аналогично примеру 1. ПЭТ-КТ выполняли с использованием П-РФП-4 (18F-ФДГ) (предоставлен РНЦРХТ, Россия), который вводили больной в дозе 240 МБк. По данным ПЭТ-КТ: размер патологического новообразования с гиперфиксацией П-РФП-4 8,5 см; SUV 3,6; выявлены признаки канцероматоза плевры. Уровень онкомаркера Cyfra 21-1(цитокератина 19 фрагмент) в крови 17,4 нг/мл (норма - до 3,3 нг,мл); содержание TNF -768 нг/мл; содержание IL-6, IL-10 - в пределах нормы; содержание CD3+CD8+PD-1+ и CD3+CD8+PD-1+Tim-3+, соответственно, - 67,3 и 6,4%; содержание перфорина и гранзима, соответственно, - 2,3 и 1,5 (HScore).
Больной назначено лечение заявленным способом (после подписания информированного согласия). На основании полученного значения содержания CD3+CD8+PD-1+ (> 40%) на первом этапе назначено введение Препарата-1 БТШ70-МИ в дозе 1,0 мг (0,02 мг/кг массы тела), при этом продолжительность, кратность и способ введения указанного препарата были аналогичны описанным для первого этапа лечения примера 3.
Через сутки после завершения первого этапа лечения, учитывая повышенное содержания CD3+CD8+PD-1+ 59,5% (> 40%), у больной дополнительно произведено исследование in vitro (аналогично примеру 4) цитологических препаратов, полученных из плевральной жидкости, с определением содержания специфически измененных опухолевых клеток, которое составило 4,5% (< 6%).
На основании полученных результатов определения на втором этапе лечения пациентке было назначено введение Препарата-2 БТШ70-МИ один раз в неделю внутривенно в дозе 1,6 мг (0,03 мг/кг массы тела). Терапию по указанной схеме проводили в течение последующих четырех недель.
После завершения второго этапа лечения (через сутки) у больной выполнена ПЭТ-КТ аналогично описанной выше в настоящем примере (в рамках КО до начала лечения), которая выявила уменьшение размера патологического новообразования и уровня его метаболической активности в среднем, соответственно, на 11,5 и 15,7% (< 20%) Содержание CD3+CD8+PD-1+ - 45,7% (> 40%). Полученные значения данных показателей привели к необходимости дополнительного определения содержания CD3+CD8+PD-1+Tim-3+, которое составило 8,7% (> 3%). С учетом значений трех указанных показателей на третьем этапе пациентке была назначена схема терапии, включающая комплексные процедуры (аналогично примеру 2), введение Препарата-2 БТШ70-МИ и введение ФП. В ходе комплексных процедур лазерное воздействие осуществляли с использованием лазера на парах меди «Систа-6» (НИИЭФА им. Д.В. Ефремова, Россия) при плотности мощности 1 Вт/см2 и времени экспозиции излучения 5 мин. Препарат-2 БТШ70-МИ вводили пациентке один раз в неделю внутривенно в дозе 1,6 мг (0,03 мг/кг массы тела) через 1 ч после введения Композиции с вирусом Сендай. ФП водили внутривенно в дозе 0,4 мг (0,007 мг/кг массы тела) сразу после введения Препарата-2 БТШ70-МИ. Указанная схема терапии применялась в течение последующих шести недель.
ККО, выполненное у больной через 12 недель лечения, показало следующее. Выявлено уменьшение размера патологического очага и его метаболической активности (по данным ПЭТ-КТ) в среднем, соответственно, на 78,2 и 85,7% (> 30%); уровень Cyfra 21-1 - 3,1 нг/мл; содержание TNF -45 нг/мл; содержание IL-6, IL-10 - в пределах нормы; содержание CD3+CD8+PD-1+ - 29,1% (< 40%); содержание CD3+CD8+PD-1+Tim-3+ - 1,4% (< 3%); содержание перфорина и гранзима, соответственно, - 275 и 251. В плевральной жидкости 88,6% опухолевых клеток имели цитопатологические изменения (по результатам цитологического исследования).
Через 1 год 2 мес. после завершения лечения заявленным способом по результатам ККО прогрессирования заболевания не выявлено. По данным ПЭТ-КТ: дальнейшее уменьшение размеров патологического очага и снижение уровня его метаболической активности - в среднем, соответственно, на 87,1% и 91,5%; признаков канцероматоза плевры не отмечено. Уровень Cyfra 21-1 - 2,8 нг/мл (в пределах нормы); содержание TNF, IL-6, IL-10 - в пределах нормы; содержание CD3+CD8+PD-1+ и CD3+CD8+PD-1+Tim-3+, соответственно, - 34,8% (< 40%) и 1,9% (< 3%); содержание перфорина и гранзима, соответственно, - 252 и 246 (HScore); в плевральной жидкости опухолевые клетки не определялись (по результатам цитологического исследования).
Заявленный способ был использован для лечения 42 пациентов в возрасте 33-76 лет с распространенным и метастатическим раком, в том числе: с раком простаты - 10 человек, с колоректальным раком - 7 чел., с раком почки - 4 чел., с раком шейки матки - 2 чел., с раком матки - 2 чел., с раком поджелудочной железы - 5 чел., с раком яичника - 3 чел., с раком молочной железы - 2 чел., с немелкоклеточным раком легкого - 5 чел., с раком печени - 1 чел., с раком желудка - 1 чел. Все больные находились на амбулаторном лечении. Установлено, что при использовании иммуноонкологических препаратов (в том числе и препаратов на основе вирусов) на развитие противоопухолевого ответа требуется определенное время. Более того, после начала их применения опухолевые очаги могут даже увеличиться, но, как правило, это является проявлением инфильтрации опухоли иммунокомпетентными клетками. Однако затем развивается эффект и метастазы достаточно быстро уменьшаются или исчезают совсем [115]. В этой связи, оценку эффективности заявленного способа терапии проводили не только по шкале RECIST /версия 1.1/ (с применением критериев оценки ответа основных и дополнительных очагов опухолевого поражения /роста/) но также дополнительно использовали принятую в иммунотерапии PERCIST, базовыми показателями которой являются изменение размера опухоли и метаболической активности опухолевой ткани (SUV) в сравнении с исходными (ПЭТ- критерии опухолевого ответа). В качестве дополнительных критериев эффективности противоопухолевого иммунного ответа использовали критерии шкалы i-RECIST- у пациентовопределяли содержание CD3+CD8+PD-1+, и содержание CD3+CD8+PD-1+Tim-3+»);содержание перфорина и гранзима, а также динамику уровня онкомаркеров периферической крови [62,63,64,65].
Группу сравнения составили 77 больных в возрасте 36-73 лет с распространенным и метастатическим раком, леченных по методике способа-прототипа, в том числе: с раком простаты - 11 чел., с колоректальным раком - 13 чел., с раком почки - 8 чел., с раком шейки матки - 7 чел., с раком матки - 5 чел., с раком поджелудочной железы - 6 чел., с раком молочной железы -7 чел., с немелкоклеточным раком легкого - 13 чел., с раком желудка - 7 чел. Все больные группы сравнения лечились амбулаторно. Эффективность лечения оценивали по шкале RECIST, определяли также динамику уровня онкомаркеров периферической крови. такие дополнительные критерии как содержание CD3+CD8+PD-1+ и CD3+CD8+PD-1+Tim-3+, содержание перфорина и гранзима, ПЭТ-критерии - у пациентов группы сравнения не использовались.
Результаты сравнения эффективности терапии с использованием заявленного способа и способа-прототипа приведены в табл. 18.

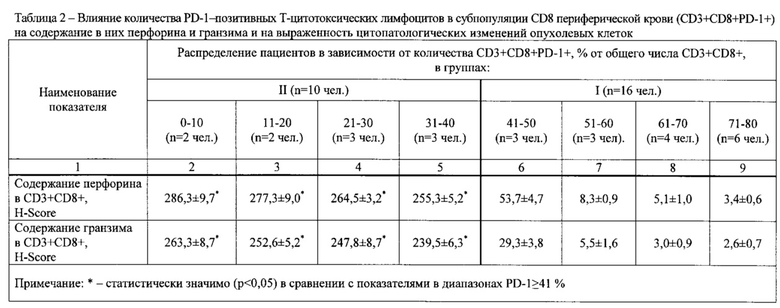
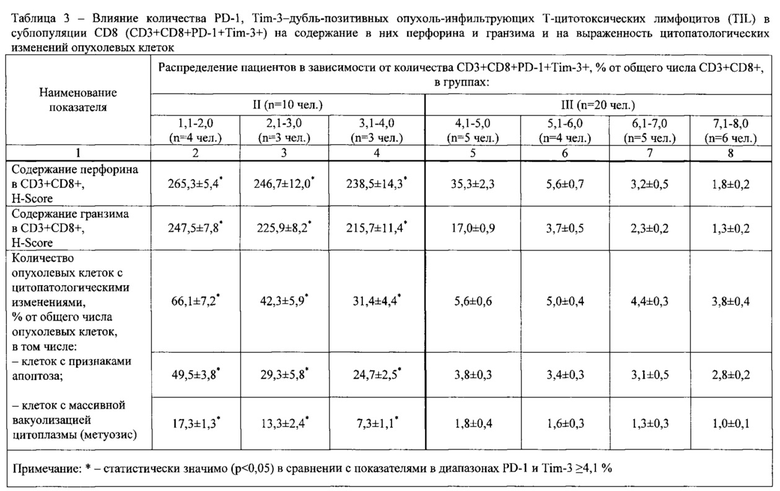
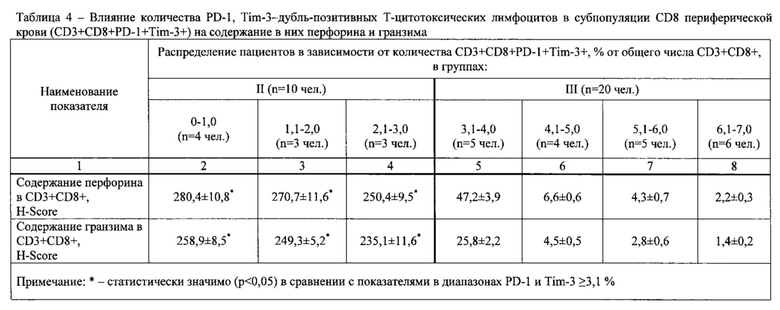
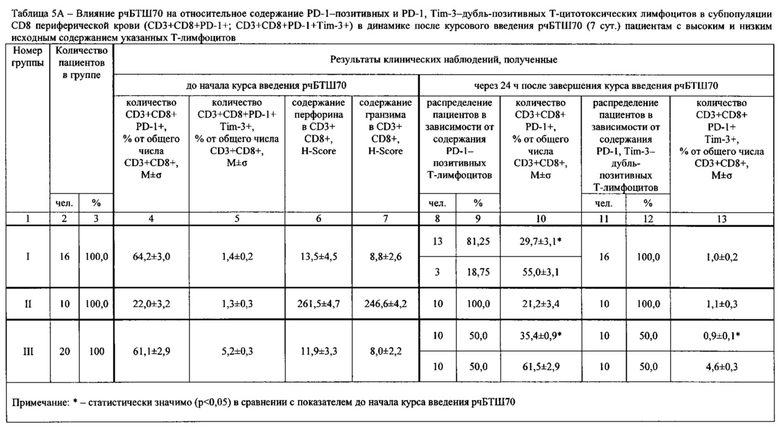
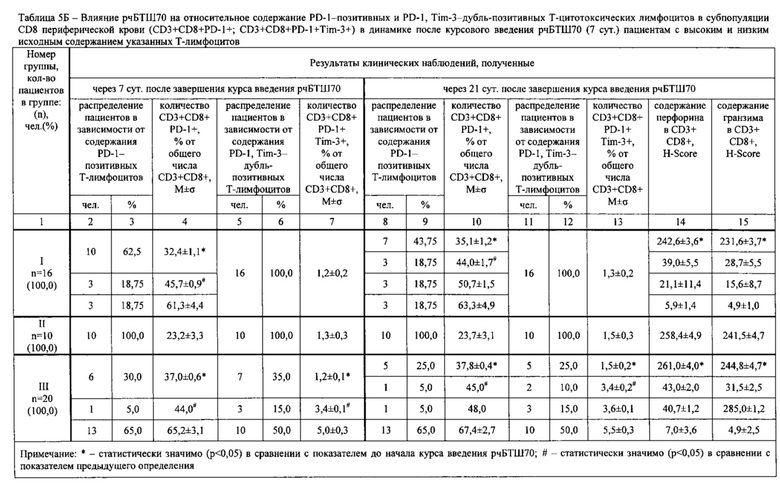
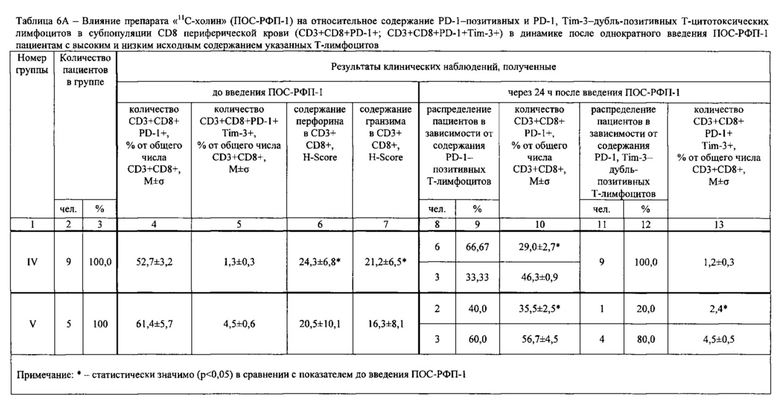
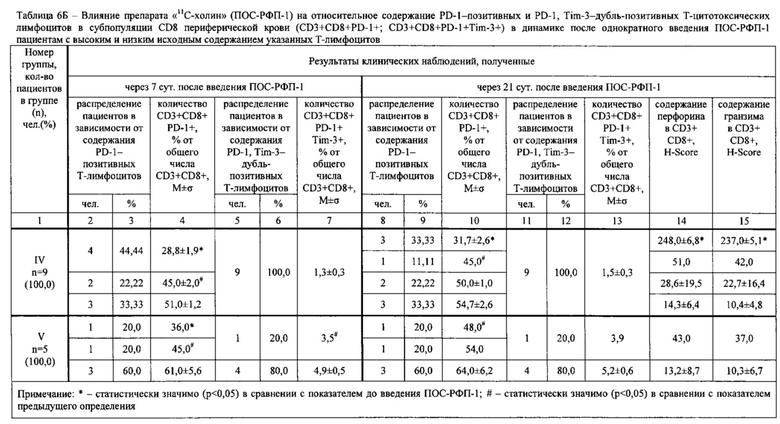
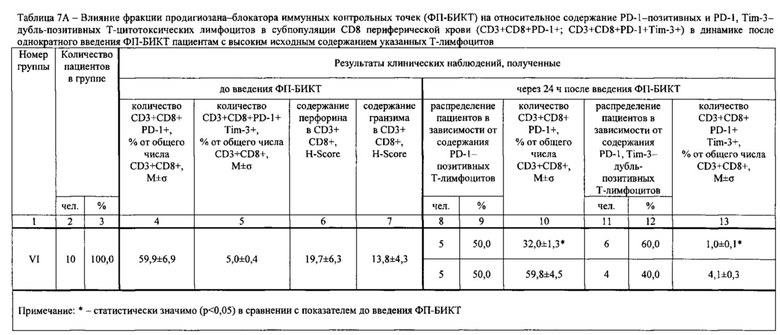
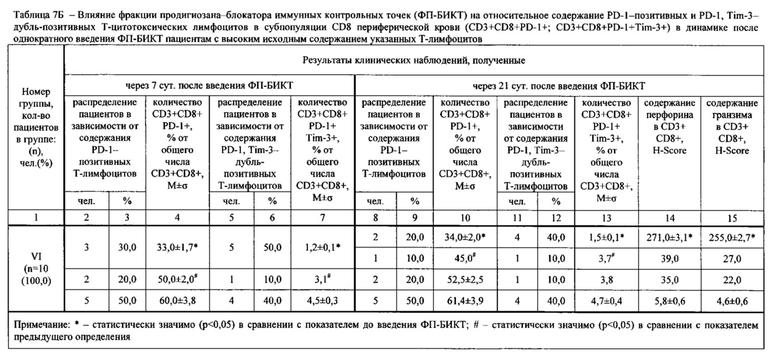
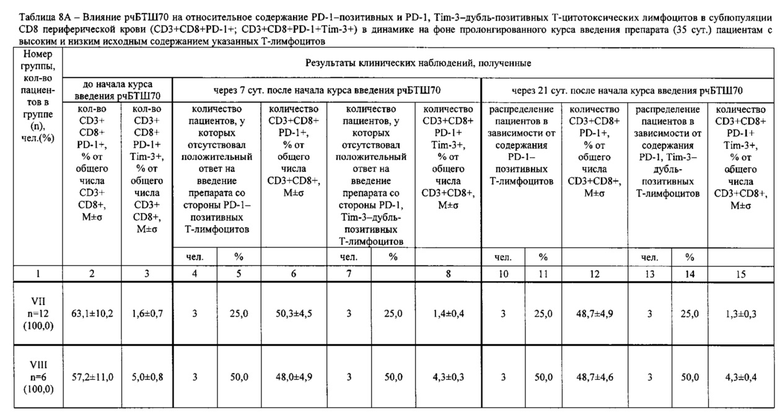
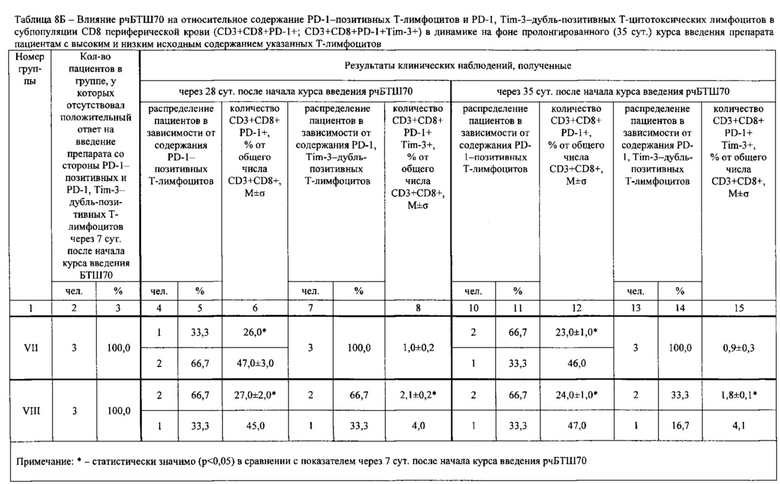
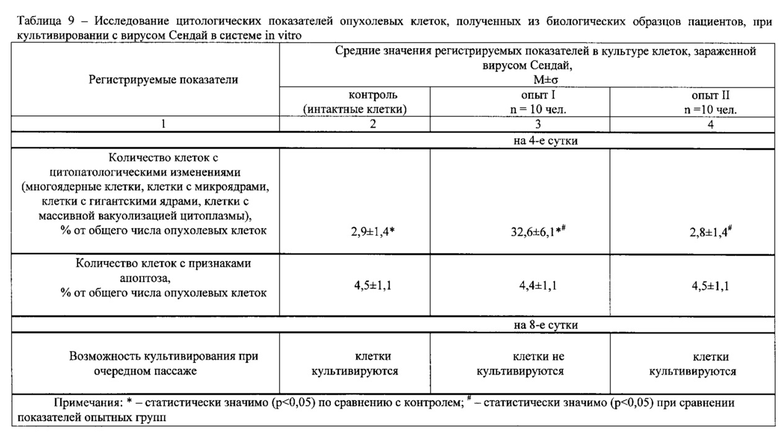
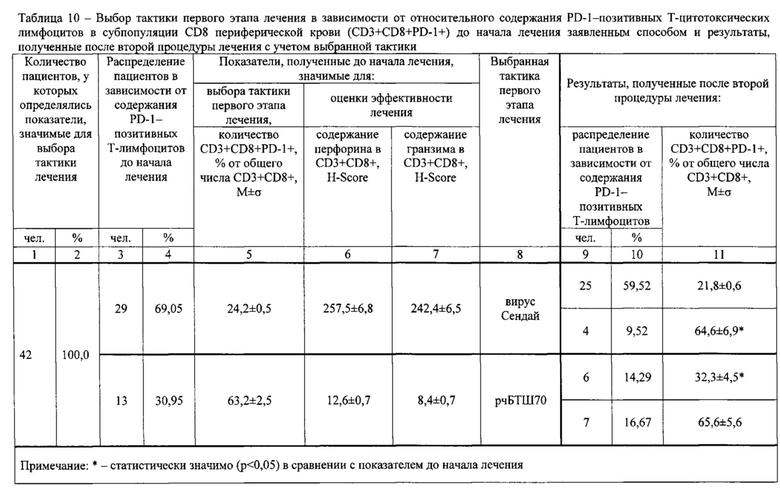
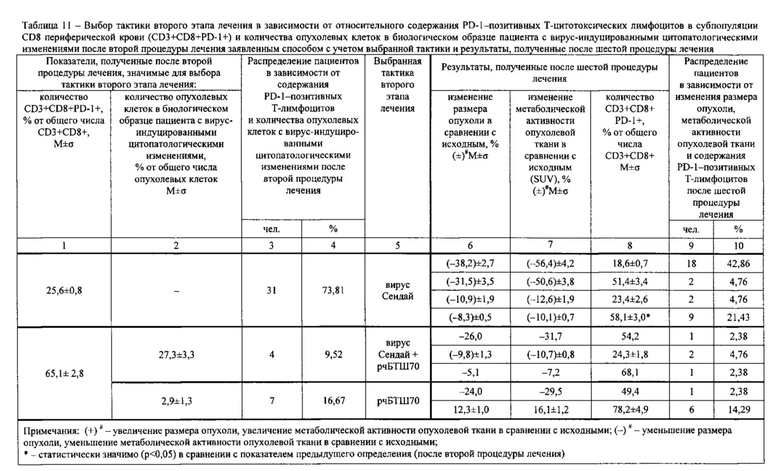
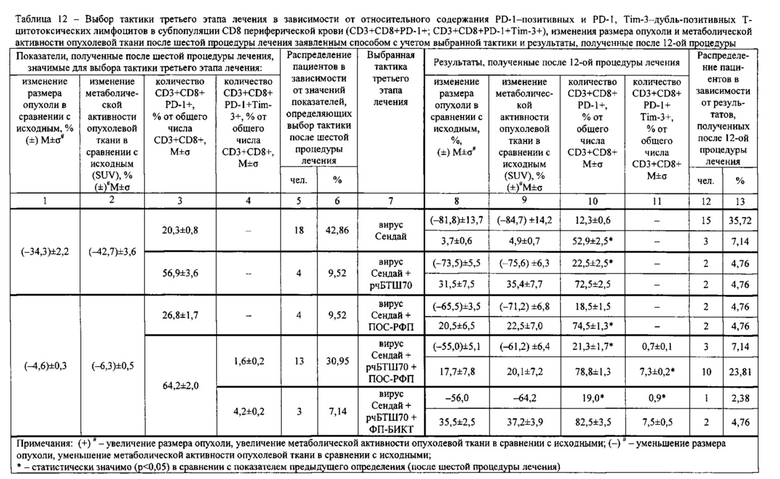
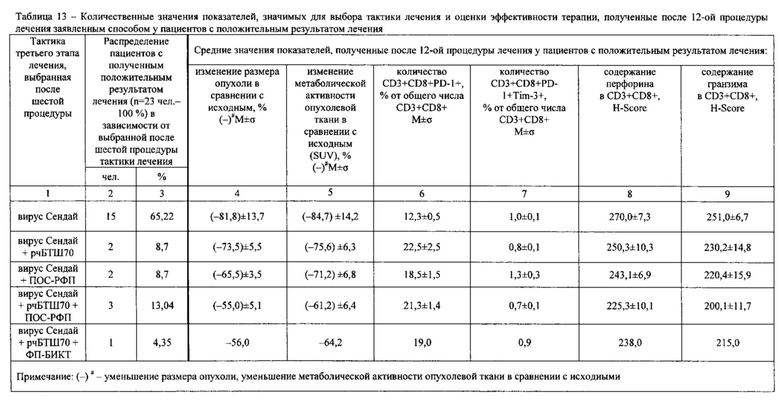
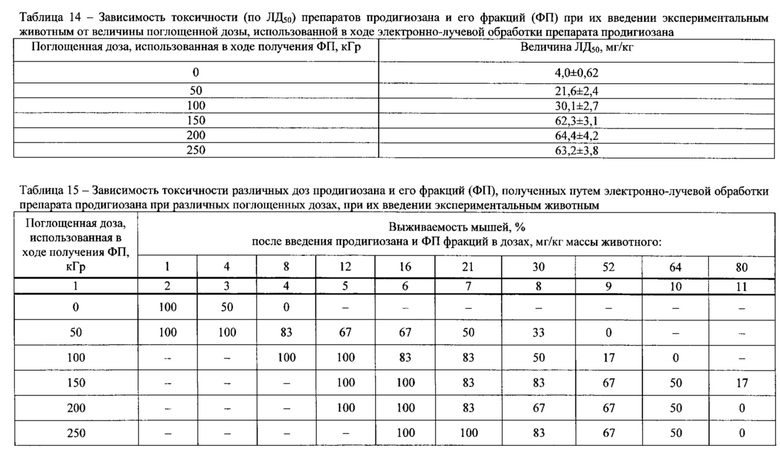
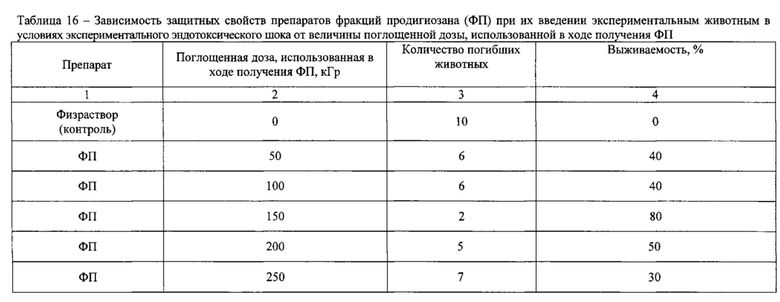
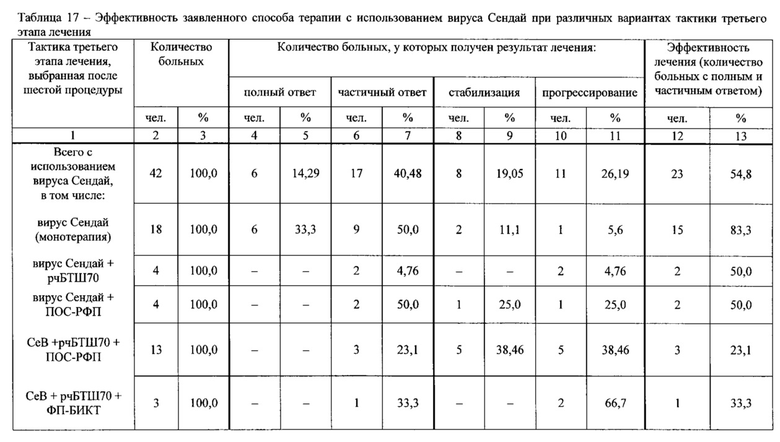
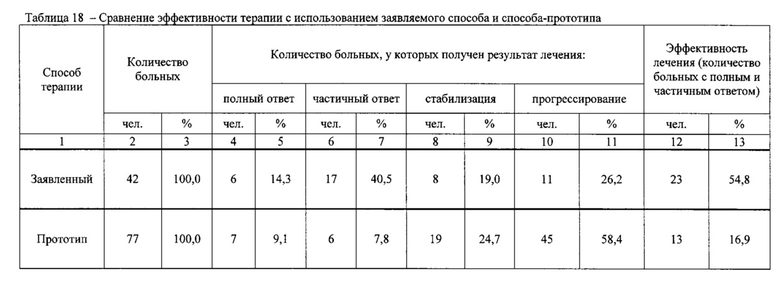
Источники информации
1. Новые возможности регуляции противоопухолевого иммунного ответа / Кадагидзе З.Г. и др. // Злокачественные опухоли. 2015. №1. С. 24-30.
2. Иммунотерапия опухолей, основанная на блокировке иммунологических контрольных «точек» («чекпойнтов») / А.В. Боголюбова и др. // Медицинская иммунология. 2015. Т. 17, №5. С. 395-406. URL: http://mimmun.ru/mimmun/article/view/919/808 (дата обращения 28.04.2017).
3. Румянцев А.А., Тюляндин С.А. Эффективность ингибиторов контрольных точек иммунного ответа в лечении солидных опухолей Практическая онкология 2016. - Т. - 17. - №2. - с. 74-89
4. Dempke W.C.M, Fenchel K., Uciechowski P., Dale S.P. Second- and third-generation drugs for immuno-oncology treatment-The more the better? // Eur. J. Cancer. 2017. - vol. 74. - P.: 55-72.
5. Romano G1, Gawlinski A2. New frontiers in oncology: Immune checkpoint inhibitors in combination therapy // Drugs Today (Barc). - 2017. - vol. 53. - №2. - p.: 103-115
6. Milano G1. Resistance to immunotherapy: clouds in a bright sky. // Invest New Drugs. 2017 Apr 12. doi: 10.1007/s10637-017-0456-x
7. Champiat S., Lambotte O., Barreau E. et al. Management of immune checkpoint blockade dysimmune toxicities: a collaborative position paper. // Ann Oncol - 2016. - vol. 27. - №4. - p.: 559-574
8. Kostine M., Chiche L., Lazaro E. et al. Opportunistic autoimmunity secondary to cancer immunotherapy (OASI): An emerging challenge. // Rev Med Interne. 2017 Feb 14. pii: S0248-8663(17)30025-5. doi: 10.1016/j.revmed.2017.01.004.
9. Liu J. et al. Assessing Immune-Related Adverse Events of Efficacious Combination Immunotherapies in Preclinical Models of Cancer. // Cancer Res. - 2016. - vol. 76. - №18. - p: 5288-53301. Lu X.et al.
10. Effective combinatorial immunotherapy for castration-resistant prostate cancer. // Nature. 2017. - vol. 543. - №7647. - p.: 728-732.
11. Kumar V. et al. Current Diagnosis and Management of Immune Related Adverse Events (irAEs) Induced by Immune Checkpoint Inhibitor Therapy. // Front Pharmacol. 2017 Feb 8;8:49. doi: 10.3389/fphar.2017.00049. eCollection 2017
12. Ryan J.M. et al. Enhancing the safety of antibody-based immunomodulatory cancer therapy without compromising therapeutic benefit: Can we have our cake and eat it too?// Expert Opin Biol Ther. - 2016.. - vol. 16.. - №5.. - p: 655-674.
13. Гужова И.В. и соавт. Рекомбинантный белок теплового шока 70 кДа как стимулятор противоопухолевого иммунитета: от клеточных моделей до кли-нических испытаний // Успехи молекул, онкол. - 2016. - Т. 3. - №4. - С. 54-55.
14. Ибрагимова М.К, Циганов М.М., Литвяков Н.В. Естественная и вызванная химиотерапией клональная эволюция опухолей // Биохимия. - 2017. - Т. 82. - №4. - С. 413-425. doi: 10.1134/S0006297917040022.
15. Fidler I.J. Biological heterogeneity of cancer: implication to therapy // Hum Vaccin Immunother. - 2012. - vol. 8. - №8. - p: 1141-1142.
16. Schmid Т.Е., Multhoff G. Radiation-induced stress proteins - the role of heat shock proteins (HSP) in antitumor responses // Curr Med Chem. - 2012. - vol. 19. - №12. - p.: 1765-1770.
17. Jing W. et al. Combined immune checkpoint protein blockade and low dose whole body irradiation as immunotherapy for myeloma. // J Immunother Cancer. - 2015. - vol. 3. - №1. - p:2-4.
18. De Ruysscher D., Reynders K., Van Limbergen E., Lambrecht M. Radiotherapy in combination with immune checkpoint inhibitors. // Curr Opin Oncol. 2017 Jan 12. doi: 10.1097/CCO.0000000000000352
19. Ebner DK et al. The Immunoregulatory Potential of Particle Radiation in Cancer Therapy. // Front Immunol. 2017 Feb 6; 8:99. doi: 10.3389 / fimmu. 2017. 00099
20. Holden C.  , electrons and cancer // Science. - 1979. - №203 (4380). - P: 522-524
, electrons and cancer // Science. - 1979. - №203 (4380). - P: 522-524
21. Chen B. et al. Targeting Negative Surface Charges of Cancer Cells by Multi-functional Nanoprobes // Theranostics. - 2016. - vol. 6. - №11. - p.: 1887-1898.
22. Carter H.B., Coffey D.S. Cell surface charge in predicting metastatic potential of aspirated cells from the Dunning rat prostatic adenocarcinoma model. // J. Urol. - 1988.. - vol. 140.. - №1.. - p.:173-175.
23. Wakabayashi N. et al. A pH-dependent charge reversal peptide for cancer targeting. // Eur Biophys J. - 2017. - vol. 46. - №2. - p: 121-127.
24. Jaini S., Dadachova E. FDG for therapy of metabolically active tumors. // Semin Nucl Med. - 2012 - vol. 42. - №3. - p.: 185-189
25. Vilgelm A.E., Johnson D.B., Richmond A. Combinatorial approach to cancer immunotherapy: strength in numbers // J. Leukoc. Biol - 2016. - vol. 100 - №2. - P.: 275-290.
26. Ilett E. Et al. Prime-boost using separate oncolytic viruses in combination with checkpoint blockade improves anti-tumour therapy // Gene Ther. - 2017. - vol. 24. - №1. - p.: 21-30.
27. Hardcastle J. Et al. Immunovirotherapy with measles virus strains in combination with anti-PD-1 antibody blockade enhances antitumor activity in glioblastoma treatment. // Neuro Oncol. - 2016 Sep 23. pii: now179
28. Liu C. et al. Combination of measles virus virotherapy and radiation therapy has synergistic activity in the treatment of glioblastoma multiforme // Clin. Cancer Res. - 2007. - vol. 13. - №23. - p.: 7155-7165.
29. Martinov Т., Fife B.T. Fractionated radiotherapy combined with PD-1 pathway blockade promotes CD8 T cell-mediated tumor clearance for the treatment of advanced malignancies // Ann Transl Med. - 2016. - vol. 4. - №4. - p.: 82.
30. Шевцов М.А., Хачатрян В.А., Оникиенко С.Б., Маргулис Б.А. Молекулярные шапероны и бактериальный полисахарид как иммуномодулирующие факторы в противоопухолевой терапии новообразований головного мозга // Нейрохирургия и неврология детского возраста - 2011. - Т.2. - №11. - С. 73-84
31. Rommelfanger D.M. et al. The efficacy versus toxicity profile of combination virotherapy and TLR immunotherapy highlights the danger of administering TLR agonists to oncolytic virus-treated mice. // Mol Ther. - 2013. - vol. 21. - №2. - p: 348-357.
32. Isambert N et al. Phase I study of ОМ-174, a lipid A analogue, with assessment of immunological response, in patients with refractory solid tumors. // BMC Cancer. 2013 Apr 2; 13: 172. doi: 10.1186/1471-2407-13-172
33. Iribarren K et al. Trial Watch: Immunostimulation with Toll-like receptor agonists in cancer therapy. // Oncoimmunology. 2015 Sep 2; 5(3): e1088631.
34. Kuo W.T., Lee T.C., Yu L.C. Eritoran Suppresses Colon Cancer by Altering a Functional Balance in Toll-like Receptors That Bind Lipopolysaccharide // Cancer Res. - 2016. - vol. 76. - №16. - p.: 4684-4695.
35. Kabeer M. Potentiating immune response against cancer // US Pat. Appl. №20170007697, Filed Sep 26, 2016; Publ. Jan 12, 2017, 18 pp.
36. Morisrishima A., Inagawa H. Clinical Effects of Orally Administered Lipopolysaccharide Derived from Pantoea agglomerans on Malignant Tumors. // Anticancer Res - 2016. - vol. 36. - №7. - p.: 3747-3751.
37. Nerkar D.P. et al Radiation induced alterations in the endotoxin of S. Typhimurium // Int. J. Radiat. Biol. Relat. Stud. Phys. Chem. Med. - 1977. - vol. 32. - №3, - p.: 259-266.
38.  L. Radio-detoxified endotoxin activates natural immunity: a review // Pathophysiology. - 2005. - vol. 12. - №2. - p.: 85-95.
L. Radio-detoxified endotoxin activates natural immunity: a review // Pathophysiology. - 2005. - vol. 12. - №2. - p.: 85-95.
39. Gowdy K.M. et al. Impaired CD8(+) T cell immunity after allogeneic bone marrow transplantation leads to persistent and severe respiratory viral infection // Transpl. Immunol. - 2015. - vol. 32. - №1. - p.: 51-60.
40. Kohlhapp F.J. et al. Non-oncogenic Acute Viral Infections Disrupt Anticancer Responses and Lead to Accelerated Cancer-Specific Host Death. // Cell. Rep. - 2016. - vol. 17 - №4. - p.: 957-965.
41. Tong Y., Qian W.. Targeting cancer stem cells with oncolytic virus // Stem Cell Investig. 2014 Nov 28; 1:20 doi: 10.3978/j.issn.2306-9759.2014. 11. 01
42. Ilett E.J. et al. Internalization of oncolytic reovirus by human dendritic cell carriers protects the virus from neutralization // Clin Cancer Res. - 2011. - vol. 17. - №9. - p.: 2767-2776.
43. Матвеева O.B. и соавт. Механизмы онколитического действия парамиксовируса Сендай // Acta Naturae - 2015. - Т.7. - №2(25). - С. 6-17.
44. Wieten L. et al. IL-10 is critically involved in mycobacterial HSP70 induced suppression of proteoglycan-induced arthritis // PLoS One. - 2009. - vol. 4. - №1: e4186. doi: 10.1371/journal.pone.0004186. Epub 2009 Jan 14.
45. Katoh H. et al. Heat Shock Protein 90 Ensures Efficient Mumps Virus Replication by Assisting with Viral Polymerase Complex Formation. // J Virol. 2017 Feb 28; 91(6). pii: e02220-16. doi: 10.1128/JVI.02220-16. Print 2017 Mar 15
46. Tang D. Et al. The antiinflammatory effects of heat shock protein 72 involve inhibition of high-mobility-group box 1 release and proinflammatory function in macrophages // J Immunol. 2007 - vol. 179. - №2. - p.: 1236-1244.
47. Hasegawa A. et al. Relationship between HMGB1 and tissue protective effects of HSP72 in a LPS-induced systemic inflammation model // J. Surg. Res. - 2011. - vol. 169. - №1. - p.: 85-91
48. Lopez V.et al. Bacterial Hsp70 (DnaK) and mammalian Hsp70 interact differently with lipid membranes // Cell Stress Chaperones. - 2016. - vol. 21. - №4. - p.: 609-616.
49. Dorfman D.M. et al. The phosphatidylserine receptors, T cell immunoglobulin mucin proteins 3 and 4, are markers of histiocytic sarcoma and other histiocytic and dendritic cell neoplasms // Hum Pathol. - 2010. - vol. 41. - №10. - p.: 1486-1494.
50. Патент РФ №2615346 Терапевтическая вакцина против рака // Хамар Б.М. и соавт. Заявл. 27.02.2012 Опубл. 04.04.2017, 15 с.
51. Suzuki М. Partners in Crime: Combining Oncolytic Viroimmunotherapy with Other Therapies // Mol Ther. - 2017. - vol. 25. - №4. - p: 836-838.
52. Chen X. Et al. A novel laser vaccine adjuvant increases the motility of antigen presenting cells. // PLoS One. - 2010. - vol. 29. - №5(10): e13776. doi: 10.1371/journal. pone. 0013776.
53. Kimizuka Y. et al., Semiconductor diode laser device adjuvanting intradermal vaccine Vaccine. - 2017. - vol. 35. - №18. - p.: 2404-2412.
54. Katoh H.et al. Heat Shock Protein 90 Ensures Efficient Mumps Virus Replication by Assisting with Viral Polymerase Complex Formation // J. Virol. - 2017. - vol. 91. - №6. - pii: e02220-16. doi: 10.1128/JVI.02220-16.
55. Huang F. et al. Oncolytic viruses against cancer stem cells: A promising approach for gastrointestinal cancer // World J. Gastroenterol. - 2016. - vol. 22. - №35. - p.: 7999-8009.
56. Tang D., Lotze M.T. Tumor immunity times out: TIM-3 and HMGB1.// Nat Immunol. -2012. - vol. 13. - №9. - p.: 808-810.
57. Huang AC et al. T-cell invigoration to tumour burden ratio associated with anti-PD-1 response. // Nature. 2017 Apr 10. doi: 10.1038 / nature22079. [
58. Jie H.B. et al. Increased PD-1+ and TIM-3+TILs during Cetuximab Therapy Inversely Correlate with Response in Head and Neck Cancer Patients // Cancer Immunol Res. 2017 Apr 13. doi: 10.1158/2326-6066.CIR-16-0333.
59. Wu T. et al. HMGB1 overexpression as a prognostic factor for survival in cancer: a meta-analysis and systematic review. // Oncotarget. - 2016. - vol. 7. - №31. - p.: 50417-50427.
60. Lea J. et al. Detection of phosphatidylserine-positive exosomes as a diagnostic marker for ovarian malignancies: a proof of concept study // Oncotarget. - 2017. - vol. 8. - №9. - p.: 14395-14407
61. Kamphorst A.O. Proliferation of PD-1+ CD8 T cells in peripheral blood after PD-1-targeted therapy in lung cancer patients. // Proc. Natl. Acad. Sci. USA.-2017. - pii: 201705327. doi: 10.1073/pnas. 1705327114.
62. Wahl R.L. et al. From RECIST to PERCIST: Evolving Considerations for PET response criteria in solid tumors.// J. Nucl. Med. 2009 May; 50 Suppl 1:122S-150S. doi: 10.2967/jnumed.108.057307
63. Wolchock J.D. et al. Guidelines for the Evaluation of Immune Therapy Activity in Solid Tumors: Immune-Related Response Criteria // Clin. Cancer Res. - 2009.- vol. 15. - №23. - p.: 7412-7420
64. Ades F., Yamaguchi N. WHO, RECIST, and immune-related response criteria: is it time to revisit pembrolizumab results? // ecancer 2015, 9:604 DOI: 10.3332 /ecancer. 2015.604
65. Braschi-Amirfarzan M. et al. Immune-Checkpoint Inhibitors in the Era of Precision Medicine: What Radiologists Should Know // Korean J. Radiol. - 2017. - vol. 18. - №1. - p.42-53
66. Hu C.Y. et al. Interleukin-2 reverses CD8(+) T cell exhaustion in clinical malignant pleural effusion of lung cancer. // Clin. Exp. Immunol. - 2016. - vol.186. - №1. - p.: 106-114.
67. Kieler M. et al. Case report: impressive response to pembrolizumab in a patient with mismatch-repair deficient metastasized colorectal cancer and bulky disease // ESMO Open. - 2016 - vol. 1. - №6: e000084. doi: 10.1136/esmoopen-2016-000084. eCollection 2016.
68. Chubachi S. et al. A Case of Non-Small Cell Lung Cancer with Possible "Disease Flare" on Nivolumab Treatment. // Case Rep Oncol Med. 2016; 2016: 1075641. doi: 10.1155/2016/1075641. Epub 2016 Dec 27.
69. Kato S. et al. Hyper-progressors after Immunotherapy: Analysis of Genomic Alterations Associated with Accelerated Growth Rate // Clin. Cancer Res. 2017 Mar 28. pii: clincanres.3133.2016. doi: 10.1158/1078-0432.CCR-16-3133.
70. Shayan S. et al. Adaptive resistance to anti-PD1 therapy by Tim-3 upregulation is mediated by the PI3K-Akt pathway in head and neck cancer.// Oncoimmunology - 2016. - vol. 6. - №1: el261779. doi: 10.1080 / 2162402Х.2016. 1261779. eCollection 2017
71. Li J. et al. Tumor-infiltrating Tim-3+ T cells proliferate avidly except when PD-1 is co-expressed: Evidence for intracellular cross talk // Oncoimmunology.- 2016. - vol.5. - №10: e1200778. eCollection 2016
72. Du W. Et al. TIM-3 as a Target for Cancer Immunotherapy and Mechanisms of Action. // Int. J. Mol. Sci - 2017 - vol. 18. - №3 - pii: E645. doi: 10.3390/ijms 18030645
73. Kim J.E. et al. Combination Therapy with Anti-PD-1, Anti-TIM-3, and Focal Radiation Results in Regression of Murine Gliomas // Clin. Cancer Res. - 2017. - vol. 23. - №1. - p.: 124-136.
74. Zhang Y. et al. TIM-3 is a potential prognostic marker for patients with solid tumors: A systematic review and meta-analysis // Oncotarget. - 2017. - doi: 10.18632/oncotarget. 15954.
75. Zhao X., Subramanian S. Intrinsic Resistance of Solid Tumors to Immune Checkpoint Blockade Therapy // Cancer Res. - 2017. - vol. 77. - №4. - p.: 817-822.
76. Son B. et al. The role of tumor microenvironment in therapeutic resistance // Oncotarget. - 2017. - vol. 8. - №3. - p.: 3933-3945.doi: 10.18632/ oncotarget. 13907.
77. Shoham J. et al. Augmentation of tumor cell immunogenicity by viruses - an approach to specific immunotherapy of cancer // Nat. Immun. Cell Growth. Regul. - 1990. - №9. - №3. - p.: 165-172.
78. Von Hoegen P1, Weber E, Schirrmacher V. Modification of tumor cells by a low dose of Newcastle disease virus. Augmentation of the tumor-specific T cell response in the absence of an anti-viral response // Eur. J. Immunol. - 1988. - vol. 18. - №8. - p.: 1159-1166.
79. Schirrmacher V. et al. Long-term survival of a breast cancer patient with extensive liver metastases upon immune and virotherapy: a case report // Immunotherapy - 2015. - vol. 7. - №8. - p.: 855-860. doi: 10.2217/imt.15.48.
80. Schirrmacher V. et. al. Long-term remission of prostate cancer with extensive bone metastases upon immuno- and virotherapy: A case report // Oncol Lett. - 2014. - vol. 8. - №6. - p.: 2403-2406.
81. Larimer BM1 et al. Granzyme В PET Imaging as a Predictive Biomarker of Immunotherapy Response // Cancer Res. - 2017. - vol. 77. - №9. - p.: 2318-2327. doi: 10.1158/0008-5472.CAN-16-3346.
82. Malinzi J., Sibanda P., Mambili-Mamboundou H. Analysis of virotherapy in solid tumor invasion // Math. Biosci. - 2015. - vol. 263. - p.: 102-110. doi: 10.1016/j.mbs.2015.01.015.
83. Takeishi S1, Nakayama KI1. To wake up cancer stem cells, or to let them sleep, that is the question // Cancer Sci. - 2016. - vol. 107. - №7. - p.: 875-881.
84. Bhatia A., Kumar Y2. Cancer stem cells and tumor immunoediting: putting two and two together // Expert Rev. Clin. Immunol. - 2016. - vol. 12. - №6. - p.: 605-607.
85. Bartosh T.J. Cancer cell cannibalism and the SASP: Ripples in the murky waters of tumor dormancy // Mol Cell Oncol. - 2016. - vol. 4. - №1. - : e1263715. doi: 10.1080/23723556.2016.1263715. eCollection 2017.
86. Mittal D1, Gubin MM2, Schreiber RD2, Smyth MJ3 // New insights into cancer immunoediting and its three component phases-elimination, equilibrium and escape // Curr Opin Immunol. 2014 Apr; 27: 16-25. doi: 10.1016/j.coi.2014.01.004. Epub 2014 Feb 14
87. Ribatti D. The concept of immune surveillance against tumors. The first theories // Oncotarget. - 2017. - vol. 8 - №4. - p.: 7175-7180
88. Desrichard A., Snyder A., Chan T.A. // Cancer Neoantigens and Applications for Immunotherapy // Clin. Cancer Res. - 2016 - vol. 22. - №4. - p.: 807-812.
89. Bartoch T.J. et al. Cancer cells enter dormancy after cannibalizing mesenchymal stem/stromal cells (MSCs).// Proc. Natl. Acad. Sci. U S A - 2016. Vol. 113. - №42. - p.: E6447-E6456.
90. Andreeva N.V. et al. Recombinant HSP70 and mild heat shock stimulate growth of aged mesenchymal stem cells.// Cell Stress Chaperones. - 2016. - vol. 21. - №4. - p.: 727-733.
91. Shaik S. et al. Inducing Heat Shock Proteins Enhances the Stermness of Frozen- Thawed Adipose Tissue-Derived Stem Cells // Stem Cells Dev. - 2017. - vol. 26. - №8. - p.: 608-616.
92. Lei F. Et al. Directed differentiation of induced pluripotent stem cells towards T lymphocytes // J. Vis. Exp. - 2012. - vol. 6.: e3986. doi: 10.3791/3986.
93. Kaneko S.. In Vitro Generation of Antigen-Specific T Cells from Induced Pluripotent Stem Cells of Antigen-Specific T Cell Origin // Methods Mol. Biol. - 2016. - №1393. - p.: 67-73. doi: 10.1007/978-1-4939-3338-9_6
94. Brauer P.M. et al. T Cell Genesis: In Vitro Veritas Est? // Trends Immunol. - 2016. - vol. 37. - №12. - p.: 889-901.
95. Janciak M. et al. Cancer immunotherapy: how low-level ionizing radiation can play a key role // Cancer Immunol. Immunother. - 2017. - doi: 10.1007/ s00262-017-1993-z.
96. Schaue D. A Century of Radiation Therapy and Adaptive Immunity // Front Immunol.- 2017. - vol. 8. - p: 431. doi: 10.33 89/fimmu.2017.00431. eCollection 2017.
97. Flowers Ch. et al. Intratumoral G100 to induce systemic immune responses and abscopal tumor regression in patients with follicular lympoma // ASCO Proc. - 2017. Abstr №7537.
98. Baig A.M., Khan N.A., Abbas F. Eukaryotic cell encystation and cancer cell dormancy: is a greater devil veiled in the details of a lesser evil?. // Cancer Biol. Med. - 2015. - vol. 12. - №1. - p.: 64-67.
99. Вирусы болезни Ньюкасла как перспективный агент для создания онколитических препаратов / Л.В. Шестопалова и др. // Вестник НГУ. Серия: Биология, клиническая медицина. 2012. Том 10, вып. 2. С. 232-242.
100. Горохов М.С., Корнеев М.Л. Основные виды противоопухолевых вакцин // электронный журнал Росмедпортал.ком / Rosmedportal.com Эпидемиология, гигиена и санитария / Профилактика 2010. Том 1. URL: http://www.rosmedportal.com/index.php?option=com_content&view=article&id=119 (дата обращения 09.10.2015).
101. Кешелава В.В. Противоопухолевые вакцины: возможности и перспективы применения / Вестник МЕДСИ. 2009. №5 (сентябрь-ноябрь). С. 16-23.
102. Онколитические вирусы: достижения и проблемы / С.В. Нетесов и др. // Медицинский алфавит. Эпидемиология и санитария. 2011. №3. С. 26-33.
103. Механизмы онколитического действия парамиксовируса Сендай / О.В. Матвеева и др. // Acta Naturae. 2015. Том 7, №2(25). С. 100-111.
104. Лэрд Г., Махони Д., Штойдль Д. Вирусы против рака / В мире науки. 2015. [01] январь. С. 102-108. URL: http://spkurdyumov.ru/uploads //2014/12/virusy-protiv-raka.pdf (дата обращения 24.08.2014).
105. Альтернативное лечение рака // сайт Лаборатория инновационных биомедицинских технологий. URL: http://www.limbt.com/page/64/ (дата обращения 28.04.2017).
106. Уразова Л. Н., Кузнецова Т. И. Онколитические вирусы в онкологии // Сибирский онкологический журнал. 2003. Выпуск №4. С. 28-35. URL: http://cyberleninka.ru/article/n/onkoliticheskie-virusy-v-onkologii (дата обращения 28.04.2017)
107. Леенман Е.Е., Мухина М.С.Клеточное микроокружение злокачественных опухолей и его значение в их прогнозе // Вопросы онкологии. 2013. Том 59, №4. С. 444-452. URL: http://www.niioncologii.ru/sites/default/files/files/20143101131816.pdf (дата обращения 28.04.2017).
108. Иммунофенотип лимфоцитов инфильтрирующих опухоль (TIL) у онкологических больных / Т.Н. Заботина и др.// Медицинская иммунология. 2015. Т. 17. Специальный выпуск. С. 159-160. URL: https://www.google.ru/url?sa=t&rct=j&q=&esrc=s&source=web&cd=2&ved=0ahUKEwjzxsbxgMnTAhWJFiwKHfS1AYsQFggnMAE&url=http%3A%2F%2Fmim mun.ru%2Fmimmun%2Farticle%2Fdownload%2F869%2F782&usg=AFQjCNHI-sFbcr-ycpySeaWlnB9q0Vf3GA (дата обращения 28.04.2017).
109. Ярилин А.А. Иммунология. М.: ГЭОТАР-Медиа. 2010. 752 с. (С. 543-553).
110. Иммунотерапия опухолей, основанная на блокировке иммунологических контрольных «точек» («чекпойнтов») / А.В. Боголюбова и др. // Медицинская иммунология. 2015. Т. 17, №5. С. 395-406. URL: http://mimmun.ru/mimmun/article/view/919/808 (дата обращения 28.04.2017).
111. Моисеенко В.М., Волков Н.М. Важнейшие события в онкологии в 2014 году: Иммунотерапия злокачественных опухолей. // Практическая онкология. 2015. Т. 16, №1. С. 6-12. URL: http://practical-oncology.ru/assets/articles/62.pdf (дата обращения 28.04.2017).
112. Тюляндин С.А. Ингибиторы контрольных точек иммунного ответа доказали свое преимущество перед доцетакселом в качестве второй линии лекарственного лечения больных немелкоклеточным раком легкого// Новости онкологии. [Интернет-портал Российского общества клинической онкологии RosOnko Web]. Дата публикации: 08.08.2016. URL: http://www.rosoncoweb.ru/news/oncology/2016/08/08-1/ (дата обращения 28.04.2017).
113. Тюляндин С.А. Пембролизумаб выигрывает соревнование у химиотерапии больных немелкоклеточным раком легкого с гиперэкспрессией PD-L1 // Новости онкологии. [Интернет-портал Российского общества клинической онкологии RosQnko Web]. Дата публикации: 03.11.2016. URL: http://www.rosoncoweb.ru/news/oncology/2016/11/03/ (дата обращения 28.04.2017).
114. Тюляндин С.А. Исследование POPLAR демонстрирует преимущество атезолизумаба перед доцетакселом у больных немелкоклеточным раком легкого// Новости онкологии. [Интернет-портал Российского общества клинической онкологии RosOnko Web]. Дата публикации: 26.08.2016. URL: http://www.rosoncoweb.ru/news/oncology/2016/08/26/ (дата обращения 28.04.2017).
115. Артамонова Е.В. Иммунотерапия - прорыв в лечении онкозаболеваний // Актуальное интервью. [Сайт: Клиническая фармация]. Дата публикации 15.01.2016. URL: http://clinical-pharmacy.ru/digest/actualoeintervu/5781-immunoterapiya-proryv-v-lechenii-onkozabolevaniy.html (дата обращения 28.04.2017).
116. Последний прорыв в онкологии: иммунотерапия // [сайт: INCORPORE Medical center]. URL: http://www.in-corpore.ch/news/%D0%BF%D0%BE%D1%81%D0%BB%D0%B5%D0%B4%D0%BD%D0%B8%D0%B9-%D0%BF%D1%80%D0%BE%D1%80%D1%8B%D0%B2-%D0%B2-%D0%BE%D0%BD%D0%BA%D0%BE%D0%BB%D0%BE%D0%B3%D0%B8%D0%B8-%D0%B8%D0%BC%D0%BC%D1%83%D0%BD%D0%BE%D1%82/ (дата обращения 28.04.2017).
117. Проблемы онкоиммунологии / Интервью с Н.М. Бережной // Онкология. [Портал Медфарм]. Дата публикации: 05.05.2017. URL: http://medafarm.ru/page/stati-doktoru/onkologiya/problemy-onkoimmunologii (дата обращения 28.04.2017).
118. Иммунотерапия в комбинации с традиционными методами лечения рака: выбор пути (01 нояб. 2015) // Фармакогенетика и фармакогеномика. Дата публикации 08.05.2017. URL: http://www.pharmacogenetics-pharmacogenomics.ru/item/immunoterapiya-v-kombinatsii-s-traditsionnymi-metodami-lecheniya-raka-vybor-puti (дата обращения 28.04.2017).
119. Кешелава В. Рак. Реалии и возможности применения вируса болезни Ньюкасла. Виротерапия: обоснование, критерии, показания применения, эффективность. Саарбрюкен: Издательский дом Palmarium Academic publishing. 2014. 131 с.
120. Jaini S„ Dadachova E. FDG for therapy of metabolically active tumors. / Semin Nucl Med. 2012. May; 42(3): 185-189. doi: 10.1053 / Xsemnuclmed. 2011.12.001.
121. Радионуклидная диагностика в Санкт-Петербурге: текущее состояние и проблемы развития / И.А. Звонова и др. // Радиационная гигиена. 2015. Т. 8, №4. С. 32-41. URL: http://www.radhyg.ru/jour/article/view/255. (дата обращения 19.05.2017).
122. Дезоксиглюкоза-фтор 18F. Инструкция по применению // [Сайт Лекарственный справочник ГЭОТАР]. Дата обновления информации: 20.03.2017. URL: http://www.lsgeotar.ru/dezoxigliukoza-ftor-18f-2895.htm1#sostav (дата обращения 19.05.2017).
123. Bao, S. Glioma stem cell promote radioresistance by preferential activation of DNA damage response / S. Bao, Q. Wu, R.E. McLendon, Y. Hao, Q. Shi, A.B. Hjelmeland, M.W. Dewhirst, D.D. Bigner, J.N. Rich // Nature - 2006. - Vol. 444, No 7120. - P. 756-760. doi: 10.1038/nature05236.
124. Шевцов M.A. Иммуномодулирующие свойства рекомбинантного белка теплового шока HSP70 в терапии опухолей головного мозга: автореф. дис. … канд. биол. наук. СПб.: 2013. - 23 с. URL: http:// www.cytspb.rssi.ru/referates/2013_02_15_shevcov_autoref.pdf (дата обращения 19.05.2017).
125. Балдуева И.А., Моисеенко В.М. Вакцинотерапия злокачественных опухолей (молекулярно-генетические аспекты) // Материалы конгрессов и конференций: IX Российский онкологический конгресс.2005. [Интернет-портал Российского общества клинической онкологии RosOnko Web]. URL: htttp://www.rosoncoweb.ru/library/congress/ru/09/02.php (дата обращения 26.05.2017).
126. Продигиозан / Медицинская энциклопедия [Сайт: Aorta.ru]. URL: http://aorta.ru/drug/drug1263.shtml (дата обращения 26.05.2017).
127. Позитронная терапия воспалений, инфекций и заболеваний US 2006018827 A1 (DADACHOVA EKATERINA, MOADEL RENEE M), 26.01.2006.
128. Способ лазерной вакцинации больных с метастатическими формами рака RU 2345788 С2 (ООО «НАУЧНО-ПРАКТИЧЕСКИЙ ЦЕНТР МЕДИКО-БИОЛОГИЧЕСКИХ ПРОБЛЕМ «ГОРМЕЗИС»), 10.02.2009.
129. Способ терапии опухолевых заболеваний RU 2597414 С2 (ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ УНИТАРНОЕ ПРЕДПРИЯТИЕ «ГОСУДАРСТВЕННЫЙ НАУЧНО-ИССЛЕДОВАТЕЛЬСКИЙ ИНСТИТУТ ОСОБО ЧИСТЫХ БИОПРЕПАРАТОВ» ФЕДЕРАЛЬНОГО МЕДИКО-БИОЛОГИЧЕСКОГО АГЕНТСТВА), 10.09.2016.
130. Гибридные белки и белковые конъюгаты на основе БТШ70 и их применение US 9217018 В2 (SERGEI В ONIKIENKO et al.), 22.12.2015.
131. Гибридные белки и белковые конъюгаты на основе белков теплового шока-70 (БТШ70) и способы их применения (варианты) RU 2014117975 А (АЛТЕРНАТИВ ИННОВЕЙТИВ ТЕКНОЛОДЖИЗ ЛЛС и др.), 10.02.2016.
132. Способ лечения онкологических заболеваний RU 2379055 С1 (КЕШЕЛАВА ВИКТОР ВЛАДИМИРОВИЧ и др.), 20.01.2010.
133. Метод иммунотерапии онкологических заболеваний и фармацевтические композиции на основе онколитического вируса Сендай RU 2519763 С9 (МАТВЕЕВА ОЛЬГА ВЯЧЕСЛАВОВНА и др.), 20.06.2014
134. Swann J.B., Smyth M.J. Immune surveillance of tumors // The Journal of Clinical Investigation. - 2007. - Vol. 117, 5. - P. 1137-1146.
135. Schirrmacher V., Feuerer M., Beckhove P., Ahlert Т., Umannsky V. T cell memory, anergy and immunotherapy in breast cancer // J. Mammary Gland Biol. Neoplasia. - 2002. - Vol. 7, 2. - P. 201-208.
136. Молчанов O.E., Гранов A.M. Прогнозирование эффективности лечения диссеминированных форм почечноклеточного рака на основе молекулярного мониторинга // Материалы XII Российского онкологического конгресса. - М., 2008. - С. 11-16.
137. Ehrke Jane М.. Immunomodulation in cancer therapeutics // International Immunopharmacology. Vol. 3., Iss.8., August 2003., P.1105-1119, Zitvogel L. et al., 2008.
138. Zitvogel L., Apetoh L., Ghiringhelli F., Kroemer. G. Immunological aspects of cancer chemotherapy // Nature Rev. Immunol. - 2008. - 8. - P. 59-73.
139. Curiel T.J. Treg and rethinking cancer immunotherapy // The Journal of Clinical Investigation. - 2007. - Vol. 117, 5. - P. 1167-1174.
140. Kelly E. History of oncolytic viruses: genesis to engineering, Mol. Ther. 15, 2007, p. 651-659.
141. Beier R., Hermiston Т., Mumberg D. Isolation of more potent oncolytic paramyxovirus by bioselection, Gene Ther., 23, 2012, p. 13.
142. Кешелава В.В. Противоопухолевые вакцины: возможности и перспективы применения / Вестник МЕДСИ. 2009. №5 (сентябрь-ноябрь). С. 16-23.
143. Анализ результатов работы первого регионального ПЭТ-центра в Российской Федерации / Важенин А.В. и др. // Вестник РНЦРР МЗ РФ 2011. №11. URL: http://vestnik.rncrr.ru/vestnik/v11/papers/vachenin_v11.htm (дата обращения 28.03.2017).
144. Рязанов В.В. Совмещенная позитронно-эмиссионная и компьютерная томография в определении морфофункциональных характеристик опухолей пищеварительного тракта автореф. дис. дмн СПб 2009. URL: http://www.dissercat.com/content/sovmeshchennaya-pozitronno-emissionnaya-i-kompyutemaya-tomografiya-v-opredelenii-morfofunkt#ixzz4cpGxXSLL (дата обращения 28.03.2017).
145. Рязанов В.В., Труфанов Г.Е. Совмещенная позитронно-эмиссионная и компьютерная томография в диагностике и стадировании опухолей толстой кишки // Трансляционная медицина. 2015. №2-3 (31-32). С. 121-127. URL: https://www.google.ru/url?sa=t&rct=j&q=&esrc=s&source=web&cd=2&ved=0ah UKEwib8anyxv7SAhUGYpoKHZmNDJ8QFgggMAE&url=http%3A%2F%2Ftra nsmed.almazovcentre.ru%2Fjour%2Farticle%2Fdownload%2F78%2F79&usg=AF QjCNHiMLtZ0QBR7aqj9G1YFFK_kU80xQ&bvm=bv.l51426398,bs.2,d.bGg (дата обращения 28.03.2017).
146. Стандартизованная технология «Исследование субпопуляционного состава лимфоцитов периферической крови с применением проточных цитофлюориметров-анализаторов» / Хайдуков С.В. и др. // Российский иммунологический журнал. 2014. т. 8(17), №4. С. 974-992. URL: http://naukams.com/standartizovannaya-tehnologiya-issledovanie-subpopulyatsionnogo-sostava-limfotsitov-perifericheskoy-krovi-s-primeneniem-p (дата обращения 28.03.2017)
147. Debra A. et al. Immunohistochemical Analyses of Estrogen Receptor in Endometrial Adenocarcinoma Using a Monoclonal Antibody // Cancer Research, 46: 5419-5425, October 1986.
148. Гланц С. Медико-биологическая статистика. М.: Практика, 1999. 459 с.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ТЕРАПИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ | 2013 |
|
RU2597414C2 |
| Способ определения качественных параметров иммуносупрессивных клеток у онкологических пациентов | 2020 |
|
RU2752973C1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ЦЕРВИКАЛЬНОЙ ИНТРАЭПИТЕЛИАЛЬНОЙ НЕОПЛАЗИИ III СТЕПЕНИ И МИКРОИНВАЗИВНОГО РАКА ШЕЙКИ МАТКИ, АССОЦИИРОВАННЫХ С ВИРУСОМ ПАПИЛЛОМЫ ЧЕЛОВЕКА | 2019 |
|
RU2735660C1 |
| Способ усиления противоопухолевого Т-клеточного иммунитета при раке легкого | 2022 |
|
RU2793914C1 |
| СПОСОБ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2018 |
|
RU2675233C1 |
| Способ оценки чувствительности опухоли к иммуноонкологическим препаратам | 2021 |
|
RU2771760C1 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ ДЛЯ ЛЕЧЕНИЯ РАКА С ПОМОЩЬЮ РЕКОМБИНАНТНОГО ПОКСВИРУСА, ЭКСПРЕССИРУЮЩЕГО ОПУХОЛЕВЫЙ АНТИГЕН, И АНТАГОНИСТА ИЛИ АГОНИСТА МОЛЕКУЛЫ ИММУННОЙ КОНТРОЛЬНОЙ ТОЧКИ | 2015 |
|
RU2724433C2 |
| Способ получения in vitro популяций активированных антигенспецифических противоопухолевых цитотоксических Т-лимфоцитов, специфичных к эпитопам опухоль-ассоциированного антигена | 2016 |
|
RU2619186C1 |
| СПОСОБ УЛУЧШЕНИЯ ФУНКЦИИ ИММУННЫХ КЛЕТОК И ОЦЕНКИ МУЛЬТИФУНКЦИОНАЛЬНОСТИ ИММУННЫХ КЛЕТОК | 2015 |
|
RU2731098C2 |
| СПОСОБ ЛЕЧЕНИЯ ТРИЖДЫ НЕГАТИВНОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2017 |
|
RU2757905C2 |
Изобретение относится к медицине, а именно к онкологии, и может быть использовано для лечения метастатического рака у пациентов. Для этого предварительно у пациента определяют процентное содержание Т-цитотоксических лимфоцитов субпопуляции CD8 периферической крови с рецепторами программированной клеточной смерти (PD-1) по отношению к общему числу лимфоцитов указанной субпопуляции (содержание PD-1-позитивных Т-лимфоцитов). Лечение осуществляют в три этапа. На первом этапе осуществляют проведение комплексной процедуры, включающей воздействие на поверхность кожи пациента импульсно-периодическим лазерным излучением и последующее введение в зону указанного воздействия композиции, содержащей вирус Сендай, либо введение рекомбинантного человеческого БТШ70 (Препарат-1 БТШ70). На втором этапе повторно назначают указанные комплексные процедуры и дополнительно вводят гибридный белок на основе рчБТШ70 и Fc-фрагмента человеческого иммуноглобулина G (Препарат-2 БТШ70). На третьем этапе в зависимости от размера опухоли, метаболической активности опухолевой ткани, содержания PD-1-позитивных Т-лимфоцитов дополнительно пациенту назначают позитрон-излучающий радионуклид, конъюгированный с опухоль-специфической субстанцией. Изобретение обеспечивает лечение метастатического рака у пациента. 22 з.п. ф-лы, 22 табл., 8 пр.
1. Способ терапии метастатического рака, включающий введение пациенту композиции, содержащей вирус Сендай и фармацевтически приемлемый носитель, отличающийся тем, что лечение включает три этапа, при этом предварительно определяют у пациента размер опухоли и метаболическую активность опухолевой ткани, именуемые в дальнейшем морфо-функциональными показателями опухоли, определяют в биологическом образце пациента процентное содержание Т-цитотоксических лимфоцитов субпопуляции CD8 периферической крови с рецепторами программированной клеточной смерти (PD-1) по отношению к общему числу лимфоцитов указанной субпопуляции, именуемое в дальнейшем содержанием PD-1-позитивных Т-лимфоцитов, и при значении указанного показателя 40% и менее на первом этапе лечения воздействуют на поверхность кожи пациента импульсно-периодическим лазерным излучением при плотности мощности 0,5-5,0 Вт/см2, длительности импульсов 10-12 нс, частоте следования импульсов 5-20 кГц и времени экспозиции 1-5 мин, после завершения лазерного воздействия пациенту вводят композицию, содержащую вирус Сендай в суммарной дозе 107,0-108,0 ТЦД50, внутрикожно в зону данного воздействия, повторяют указанную процедуру, именуемую в дальнейшем комплексной процедурой, на 8-е сутки и через 4-5 суток после проведения второй комплексной процедуры считают первый этап лечения завершенным, а при содержании PD-1-позитивных Т-лимфоцитов более 40% пациенту на первом этапе лечения вводят препарат, представляющий собой рекомбинантный человеческий БТШ70 (рчБТШ70), именуемый в дальнейшем Препаратом-1 БТШ70, внутривенно в дозе 0,005-0,05 мг/кг массы тела, один раз в сутки, в течение семи суток, через 1-2 суток после завершения первого этапа лечения повторно определяют содержание PD-1-позитивных Т-лимфоцитов и при его значении 40% и менее пациенту на втором этапе лечения проводят комплексные процедуры в течение последующих четырех недель при кратности их проведения один раз в неделю, а при значении указанного показателя более 40% дополнительно определяют в цитологических препаратах, полученных из биологического образца пациента, суммарное процентное содержание опухолевых клеток, имеющих вирус-индуцированные цитопатологические изменения, специфические для вируса Сендай, по отношению к общему количеству опухолевых клеток, именуемое в дальнейшем содержанием специфически измененных опухолевых клеток, и при содержании PD-1-позитивных Т-лимфоцитов более 40% и содержании специфически измененных опухолевых клеток более 20% пациенту на втором этапе лечения назначают терапевтическую схему, включающую комплексные процедуры и введение препарата, представляющего собой гибридный белок на основе рчБТШ70 и Fc-фрагмента человеческого иммуноглобулина G (IgG), именуемого в дальнейшем Препаратом-2 БТШ70, один раз в неделю внутривенно в дозе 0,005-0,05 мг/кг массы тела, и проводят терапию по указанной схеме в течение последующих четырех недель, при этом кратность проведения комплексных процедур составляет один раз в неделю, а Препарат-2 БТШ70 вводят после каждой из данных процедур, при содержании PD-1-позитивных Т-лимфоцитов более 40% и содержании специфически измененных опухолевых клеток менее 6% пациенту на втором этапе лечения вводят Препарат-2 БТШ70 в указанных выше дозировках и режиме в течение последующих четырех недель, через 1-2 суток после завершения второго этапа лечения у пациента повторно определяют морфо-функциональные показатели опухоли и оценивают их количественное изменение в процентах по отношению к исходным показателям с учетом их направленности, а также содержание PD-1-позитивных Т-лимфоцитов и при уменьшении размера опухоли более чем на 20% и метаболической активности опухолевой ткани более чем на 30%, и при содержании PD-1-позитивных Т-лимфоцитов 40% и менее пациенту на третьем этапе лечения проводят комплексные процедуры в течение последующих шести недель при кратности их проведения один раз в неделю, при уменьшении размера опухоли более чем на 20% и метаболической активности опухолевой ткани более чем на 30% и при содержании PD-1-позитивных Т-лимфоцитов более 40% пациенту на третьем этапе лечения назначают терапевтическую схему, включающую комплексные процедуры и введение Препарата-2 БТШ70 в указанных выше дозировках и режиме, и проводят терапию по указанной схеме в течение последующих шести недель, при этом кратность проведения комплексных процедур составляет один раз в неделю, а Препарат-2 БТШ70 вводят после каждой из данных процедур, при уменьшении хотя бы одного из морфо-функциональных показателей, соответственно, размера опухоли - на 20% и менее, метаболической активности опухолевой ткани - на 30% и менее или их увеличении и при содержании PD-1-позитивных Т-лимфоцитов 40% и менее пациенту на третьем этапе лечения назначают терапевтическую схему, включающую комплексные процедуры и введение препарата, содержащего позитрон-излучающий радионуклид, конъюгированный с опухоль-специфической субстанцией, именуемого в дальнейшем опухоль-специфическим позитрон-излучающим радиофармпрепаратом, и проводят терапию по указанной схеме в течение последующих шести недель, при этом кратность проведения комплексных процедур составляет один раз в неделю, а опухоль-специфический позитрон-излучающий радиофармпрепарат вводят после комплексной процедуры, при уменьшении хотя бы одного из морфо-функциональных показателей, соответственно, размера опухоли - на 20% и менее, метаболической активности опухолевой ткани - на 30% и менее или их увеличении и при содержании PD-1-позитивных Т-лимфоцитов более 40% у пациента дополнительно определяют процентное содержание Т-цитотоксических лимфоцитов субпопуляции CD8 периферической крови с PD-1 и Tim-3 рецепторами по отношению к общему числу лимфоцитов указанной субпопуляции, именуемое в дальнейшем содержанием PD-1, Tim-3-дубль-позитивных Т-лимфоцитов, и при уменьшении хотя бы одного из морфо-функциональных показателей, соответственно, размера опухоли - на 20% и менее, метаболической активности опухолевой ткани - на 30% и менее или их увеличении, при содержании PD-1-позитивных Т-лимфоцитов более 40% и при содержании PD-1, Tim-3-дубль-позитивных Т-лимфоцитов 3% и менее пациенту на третьем этапе лечения назначают терапевтическую схему, включающую комплексные процедуры, введение Препарата-2 БТШ70 в указанных выше дозировках и режиме и введение опухоль-специфического позитрон-излучающего радиофармпрепарата в течение последующих шести недель, при этом кратность проведения комплексных процедур составляет один раз в неделю, Препарат-2 БТШ70 вводят после каждой из данных процедур, а опухоль-специфический позитрон-излучающий радиофармпрепарат вводят после введения Препарата-2 БТШ70, сочетанного с проведением комплексной процедуры, а при уменьшении хотя бы одного из морфо-функциональных показателей, соответственно, размера опухоли - на 20% и менее, метаболической активности опухолевой ткани - на 30% и менее или их увеличении, при содержании PD-1-позитивных Т-лимфоцитов более 40% и при содержании PD-1, Tim-3-дубль-позитивных Т-лимфоцитов более 3% пациенту на третьем этапе лечения назначают терапевтическую схему, включающую комплексные процедуры, введение Препарата-2 БТШ70 в указанных выше дозировках и режиме и введение фракции липополисахарида продигиозана с молекулярной массой менее 10 кДа, обладающей способностью блокировать PD-1 и Tim-3 рецепторы Т-цитотоксических лимфоцитов субпопуляции CD8 периферической крови, полученной путем электронно-лучевой обработки указанного липополисахарида с последующим фракционированием, именуемой в дальнейшем фракцией продигиозана-блокатором иммунных контрольных точек (ИКТ), и проводят терапию по указанной схеме в течение последующих шести недель, при этом кратность проведения комплексных процедур составляет один раз в неделю, Препарат-2 БТШ70 вводят после каждой из данных процедур, а фракцию продигиозана-блокатор ИКТ вводят после каждого введения Препарата-2 БТШ70, сочетанного с проведением комплексной процедуры.
2. Способ по п. 1, отличающийся тем, что в ходе комплексной процедуры воздействуют на поверхность кожи пациента импульсно-периодическим лазерным излучением в зеленом/желтом диапазоне.
3. Способ по п. 2, отличающийся тем, что воздействие импульсно-периодическим лазерным излучением осуществляют с использованием лазера на парах меди с длиной волны 510,6 и 578 нм при плотности мощности 1-5 Вт/см2 и времени экспозиции 1-5 мин.
4. Способ по п. 1, отличающийся тем, что в ходе комплексной процедуры воздействуют на поверхность кожи пациента импульсно-периодическим лазерным излучением в инфракрасном диапазоне на длинах волн 800-1500 нм.
5. Способ по п. 4, отличающийся тем, что воздействие импульсно-периодическим лазерным излучением осуществляют с использованием полупроводникового инфракрасного лазера с длиной волны 830 нм при плотности мощности 1-4 Вт/см2 и времени экспозиции 1-4 мин.
6. Способ по п. 1, отличающийся тем, что в качестве биологического образца пациента, применяемого для определения содержания PD-1-позитивных Т-лимфоцитов, а также содержания PD-1, Tim-3-дубль-позитивных Т-лимфоцитов, используют периферическую кровь пациента.
7. Способ по п. 1, отличающийся тем, что в качестве биологического образца пациента, применяемого для получения цитологических препаратов, используют биопсийный материал.
8. Способ по п. 7, отличающийся тем, что при наличии у пациента канцероматоза брюшины или/и плевры в качестве биопсийного материала используют аспирационную жидкость, полученную из брюшной или/и плевральной полостей пациента.
9. Способ по п. 7, отличающийся тем, что в качестве биопсийного материала используют фрагмент солидной опухоли пациента.
10. Способ по п. 9, отличающийся тем, что в качестве биопсийного материала используют пунктат, полученный при тонкоигольной аспирационной биопсии солидной опухоли пациента.
11. Способ по п. 1, отличающийся тем, что содержание специфически измененных опухолевых клеток определяют в монослойных цитологических препаратах, полученных из биологического образца пациента.
12. Способ по пп. 1, 11, отличающийся тем, что определение в цитологических препаратах, полученных из биологического образца пациента, содержания специфически измененных опухолевых клеток включает подсчет многоядерных клеток, клеток с микроядрами, клеток с гигантскими ядрами и клеток с массивной вакуолизацией цитоплазмы с последующим суммированием их количества.
13. Способ по п. 1, отличающийся тем, что в терапевтической схеме, применяемой, начиная со второго этапа лечения, и включающей комплексные процедуры и введение Препарата-2 БТШ70, пациенту вводят Препарат-2 БТШ70 через 1-1,5 ч после введения композиции, содержащей вирус Сендай.
14. Способ по п. 1, отличающийся тем, что в качестве опухоль-специфического позитрон-излучающего радиофармпрепарата используют 11С-холин.
15. Способ по п. 1, отличающийся тем, что в качестве опухоль-специфического позитрон-излучающего радиофармпрепарата используют 11С-метионин.
16. Способ по п. 1, отличающийся тем, что в качестве опухоль-специфического позитрон-излучаюшего радиофармпрепарата используют 18F-холин.
17. Способ по п. 1, отличающийся тем, что в терапевтических схемах, применяемых на третьем этапе лечения и включающих введение опухоль-специфического позитрон-излучающего радиофармпрепарата, данный препарат вводят пациенту внутривенно в дозе 250-500 МБк 1-2 раза в течение двух недель.
18. Способ по п. 1, отличающийся тем, что в терапевтической схеме, применяемой на третьем этапе лечения и включающей комплексные процедуры и введение опухоль-специфического позитрон-излучающего радиофармпрепарата, данный препарат вводят через 2-3 ч после введения композиции, содержащей вирус Сендай.
19. Способ по п. 1, отличающийся тем, что в терапевтической схеме, применяемой на третьем этапе лечения и включающей комплексные процедуры, введение Препарата-2 БТШ70 и введение опухоль-специфического позитрон-излучающего радиофармпрепарата, пациенту вводят Препарат-2 БТШ70 один раз в неделю через 1-1,5 ч после введения композиции, содержащей вирус Сендай, а опухоль-специфический позитрон-излучающий радиофармпрепарат вводят через 1-1,5 ч после введения Препарата-2 БТШ70, сочетанного с проведением комплексной процедуры.
20. Способ по п. 1, отличающийся тем, что в терапевтической схеме, применяемой на третьем этапе лечения и включающей комплексные процедуры, введение Препарата-2 БТШ70 и введение фракции продигиозана-блокатора ИКТ, пациенту вводят Препарат-2 БТШ70 один раз в неделю через 1-1,5 ч после введения композиции, содержащей вирус Сендай, а фракцию продигиозана-блокатор ИКТ вводят после каждого введения Препарата-2 БТШ70, сочетанного с проведением комплексной процедуры.
21. Способ по п. 1, отличающийся тем, что используют фракцию продигиозана-блокатор ИКТ, в ходе получения которой электронно-лучевую обработку липополисахарида продигиозана осуществляют с помощью широкоапертурных импульсных электронных пучков с энергией электронов 180-200 кэВ при поглощенной дозе 150 кГр.
22. Способ по п. 1, отличающийся тем, что используют фракцию продигиозана-блокатор ИКТ, в ходе получения которой фракционирование осуществляют методом ультрафильтрации с применением мембран с порогом отсечения по молекулярной массе 10 кДа.
23. Способ по п. 1, отличающийся тем, что в терапевтической схеме, применяемой на третьем этапе лечения, фракцию продигиозана-блокатор ИКТ вводят пациенту внутривенно в дозе 0,005-0,01 мг/кг массы тела.
| МЕТОД ИММУНОТЕРАПИИ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ОСНОВЕ ОНКОЛИТИЧЕСКОГО ВИРУСА СЕНДАЙ | 2012 |
|
RU2519763C9 |
| СПОСОБ ЛАЗЕРНОЙ ВАКЦИНАЦИИ БОЛЬНЫХ С МЕТАСТАТИЧЕСКИМИ ФОРМАМИ РАКА | 2005 |
|
RU2345788C2 |
| US 2013071432 A1, 21.03.2013 | |||
| YONEMITSU Y at al., Immunostimulatory virotherapy using recombinant Sendai virus as a new cancer therapeutic regimen, Front Biosci | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
Авторы
Даты
2018-07-31—Публикация
2017-06-05—Подача