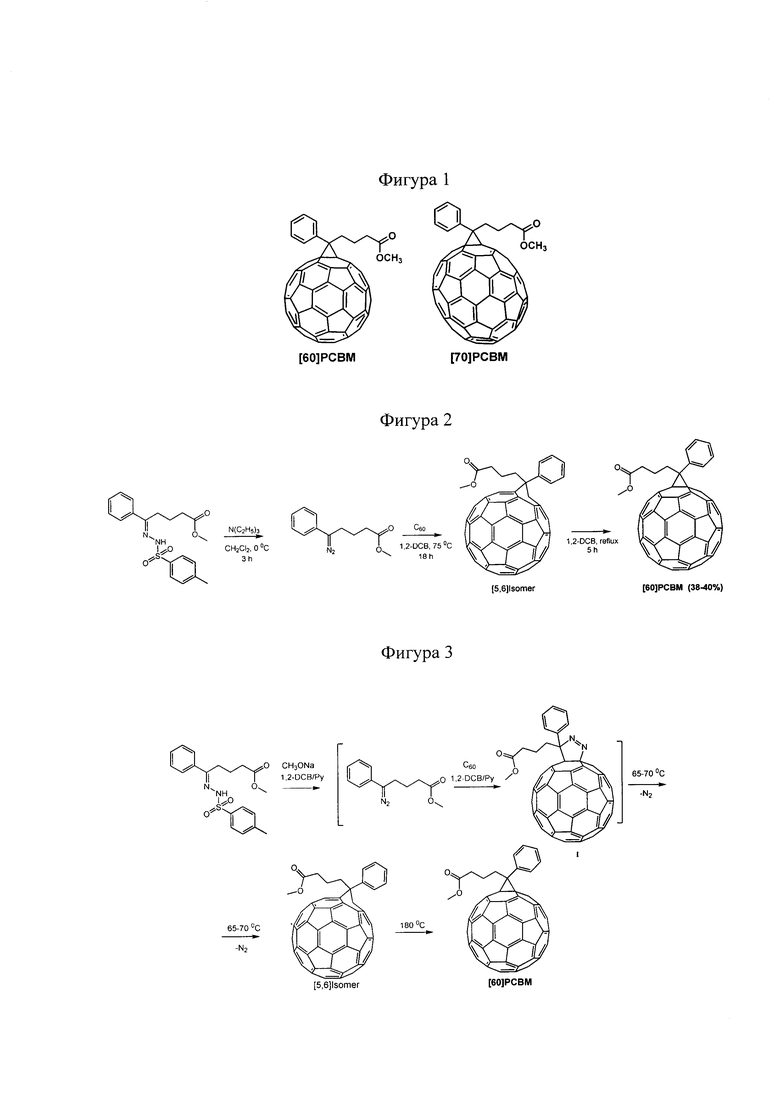
Изобретение относится к способу получения циклопропановых производных фуллеренов. Циклопропановые производные фуллеренов и, в частности, фуллеренсодержащие материалы [60]РСВМ и [70]РСВМ, представленные на фигуре 1, активно используются в качестве полупроводниковых материалов n-типа в органических солнечных батареях. Эффективности преобразования света лучших фотовольтаических устройств на основе композитов производных фуллеренов [60]РСВМ, [70]РСВМ и сопряженных полимеров достигают 10-11% [К.Н. Park, Y. An, S. Jung, H. Park and С. Yang, Energy Environ. Sci., 2016, 9, 3464-3471; Z. Wang, X. Xu, Z. Li, K. Feng, K. Li, Y. Li and Q. Peng, Advanced Electronic Materials, 2016, 2, 1600061].
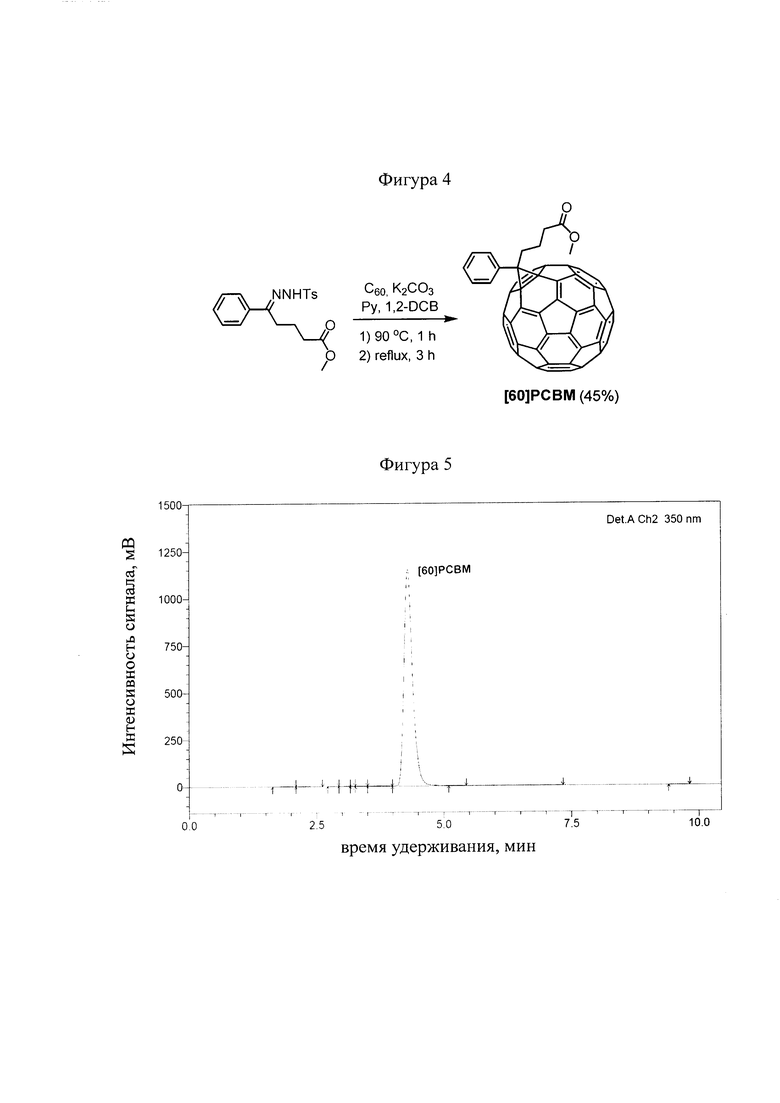
Аналогом предлагаемого способа получения циклопропановых производных фуллеренов является описанный ранее способ синтеза фуллеренсодержащего материала [60]РСВМ [R. Kumar, S. Naqvi, N. Gupta, S. Chand, RSC Advances, 2014, 4, 15675]. В работе Kumar и соавторы предложили использовать для генерации промежуточного диазосоединения триэтиламин и хлористый метилен, что позволило исключить инертную атмосферу (фигура 2).
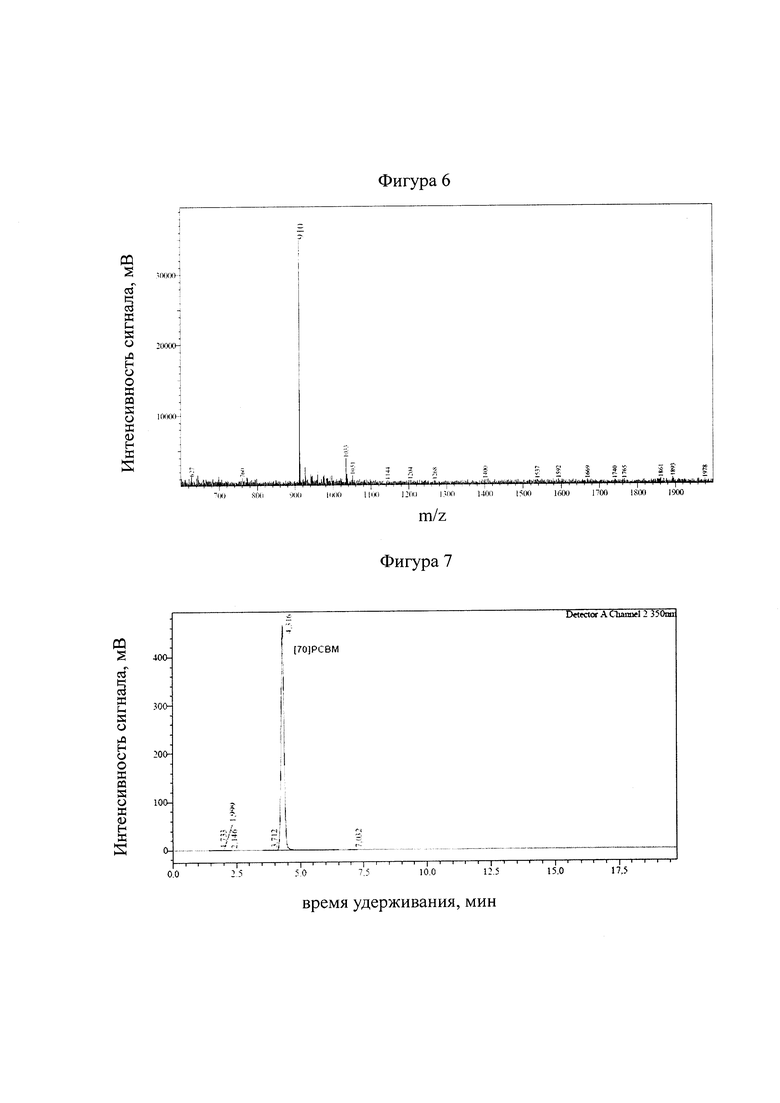
Последующее добавление раствора фуллерена C60 в 1,2-дихлорбензоле к раствору диазосоединения в хлористом метилене с триэтиламином и перемешивание при температуре 75°C в течение 18 часов приводило к образованию фуллероида, который затем при кипячении в 1,2-дихлорбензоле изомеризовался в целевой продукт. Выход продукта после очистки с помощью колоночной хроматографии составляет 38-40%. Образование побочных продуктов, относительно малый выход целевого продукта и время протекания реакции (не менее 20 часов) являются главными недостатками данного способа получения фуллеренсодержащих материалов. Прототипом изобретения является известный из литературы классический способ получения циклопропанового производного фуллерена [60]РСВМ и [70]РСВМ (реакция Хюммелена-Вудла), представленный на фигуре 3 [J.С. Hummelen, В.W. Knight, F. LePeq, F. Wudl, J. Yao, C.L. Wilkins, The Journal of Organic Chemistry, 1995, 60, 532].
Указанный способ получения фуллеренсодержащих материалов возможен в двух вариантах исполнения:
1) Предшествующее диазосоединение генерируют in situ в реакционной среде, выделяют открытую изомерную форму [60]РСВМ. Очищают с помощью колоночной хроматографии и затем подвергают изомеризации при кипячении в среде 1,2-дихлорбензола. Выход целевого продукта достигает 33-35%. Использование инертной атмосферы, образование побочных продуктов, малый выход целевого продукта и время протекания реакции (не менее 23 часов) являются главными недостатками данного исполнения классической реакции Хюммелена-Вудла.
2) Предшествующее диазосоединение получают и выделяют отдельно. Отметим, что в данном случае выход целевого диазосоединения крайне низок и составляет всего 10%. Затем полученный продукт вводят в взаимодействие с фуллереном C60 и получают фуллероид, который после очистки с помощью колоночной хроматографии подвергают термической изомеризации в среде 1,2-дихлорбензола и получают с выходом 48-50%) целевой метанофуллерен [60]РСВМ. Несмотря на повышение выхода целевого циклопропанового производного фуллерена, данное исполнение классической реакции Хюммелена-Вудла представляется неперспективным ввиду очень малого выхода исходного диазосоединения. К недостаткам способа получения также следует отнести использование инертной атмосферы, образование побочных продуктов и время протекания реакции (не менее 23-25 часов).
Таким образом, использование классической реакции Хюммелена-Вудла имеет ряд особенностей. Одна заключается в том, что исходный фуллерен обычно реагирует не полностью и остается в определенном количестве в реакционной смеси. В этом случае его можно восстановить (отделить от продуктов реакции, например, с помощью колоночной хроматографии) и снова запустить в реакцию, что увеличит итоговый выход производных фуллеренов. Другая особенность состоит в том, что неверно выбранные условия проведения реакции (температурный режим, время реакции, соотношения компонентов) могут сместить баланс образующихся соединений в сторону полиаддуктов - соединений фуллерена с двумя и более присоединенными аддендами. Дальнейшее использование этих полиаддуктов не представляет интереса. Поэтому очень важно получить в ходе реакции моноаддукт с максимальным выходом и низким содержанием побочных примесей. Также отметим чувствительность классической реакции Хюммелена-Вудла к условиям ее проведения: инертная атмосфера и обезвоженные растворители. Так, Kumar и др. показали, что реакция Хюммелена-Вудла в условиях окружающей среды даже в течение 48 часов приводит к образованию всего 2% целевого продукта [R. Kumar, S. Naqvi, N. Gupta, S. Chand, RSC Advances, 2014, 4, 15675].
Задачей изобретения является упрощение процесса, уменьшение расхода дорогостоящих реагентов, ускорение процесса при увеличении выхода целевого продукта.
Поставленные задачи решены с помощью разработанного способа получения циклопропановых производных фуллеренов, который обеспечивает относительно высокие выходы целевых продуктов при упрощении технической стороны проводимого процесса:
1) Реакция проходит в одну стадию без использования инертной атмосферы
2) В 2 раза уменьшен расход исходного реагента (тозилгидразона)
3) Значительно снижено время протекания реакции.
В качестве основания использовали карбонат калия вместо метилата натрия (фигура 4), выбор которого был обусловлен его слабой основностью, устойчивостью к воздействию окружающей среды (парам воды), малой токсичностью и меньшей стоимостью относительно стоимости метилата натрия. Подобрано оптимальное соотношение немодифицированного фуллерена и тозилгидразона (1 к 1) с целью увеличения выхода целевого компонента, что позволило уменьшить в 2 раза расход тозилгидразона по сравнению с прототипом и увеличить выход на 10-15%.
Таким образом, предлагаемый способ синтеза циклопропановых производных фуллеренов, отличается от прототипа:
1) возможностью проведения в аэробных условиях
2) использованием в качестве основания карбоната калия
3) уменьшенным в 2 раза расходом исходного тозилгидразона
4) значительно сниженным временем проведения реакции
5) увеличенным на 10-15% выходом целевого продукта
Полученные результаты позволяют с высокой степенью уверенности говорить о возможности внедрения разработанных методик для полупромышленного синтеза производных фуллеренов.
Заявленная методика иллюстрируется, но не ограничивается следующими примерами.
Пример 1.
В 3-х горлую колбу, снабженную обратным холодильником и термометром, помещали 1 экв. фуллерена, 1 экв. тозилгидразона, 1,6 экв. карбоната калия, пиридин и 1,2-дихлорбензол. Реакционную смесь перемешивали в течение 1 часа при температуре 90°C. после охлаждения смесь фильтровали через слой силикагеля и кипятили с обратным холодильником в течение 3 часов. Полученный раствор производного фуллерена концентрировали на ротационном испарителе и очищали с помощью колоночной хроматографии (неподвижная фаза - силикагель, элюент - смесь петролейного эфира и толуола). Выход целевого продукта составляет 45%. Чистота полученного производного фуллерена подтверждалась с помощью ВЭЖХ (99,5%), молекулярный состав с помощью электро-спрей масс-спектрометрии (фигуры 5, 6). На фигуре 5 присутствует только один интенсивный пик, соответствующий целевому продукту. Количество примесей (в предположении близких коэффициентов экстинкции) не превышает 0,5%.
На фигуре 6 представлен электроспрей масс-спектр производного фуллерена [60]РСВМ, на котором можно наблюдать один интенсивный сигнал с массой молекулярного иона m/z=910 [М]-, соответствующей молекулярной массе [60]РСВМ.
Спектральные данные соответствуют литературным данным [J.С. Hummelen, В.W. Knight, F. LePeq, F. Wudl, J. Yao, C.L. Wilkins, The Journal of Organic Chemistry, 1995, 60, 532].
Пример 2.
В 3-х горлую колбу, снабженную обратным холодильником и термометром, помещали 1 экв. фуллерена C60, 2 экв. тозилгидразона, 1,6 экв. карбоната калия, пиридин и 1,2-дихлорбензол. Реакционную смесь перемешивали в течение 1 часа при температуре 90°C. после охлаждения смесь фильтровали через слой силикагеля и кипятили с обратным холодильником в течение 3 часов. Полученный раствор производного фуллерена концентрировали на ротационном испарителе и очищали с помощью колоночной хроматографии (неподвижная фаза - силикагель, элюент - смесь петролейного эфира и толуола). Выход целевого продукта составляет 13%. Выход побочных продуктов полиаддуктов составил 83%.
Пример 3.
В 3-х гордую колбу, снабженную обратным холодильником и термометром, помещали 1 экв. фуллерена C60, 1,5 экв. тозилгидразона, 1,6 экв. карбоната калия, пиридин и 1,2-дихлорбензол. Реакционную смесь перемешивали в течение 1 часа при температуре 90°C. после охлаждения смесь фильтровали через слой силикагеля и кипятили с обратным холодильником в течение 3 часов. Полученный раствор производного фуллерена концентрировали на ротационном испарителе и очищали с помощью колоночной хроматографии (неподвижная фаза - силикагель, элюент - смесь петролейного эфира и толуола). Выход целевого продукта составляет 29%. Выход побочных продуктов полиаддуктов составил 62%.
Пример 4.
В 3-х горлую колбу, снабженную обратным холодильником и термометром, помещали 1 экв. фуллерена С70, 2 экв. тозилгидразона, 1,6 экв. карбоната калия, пиридин и 1,2-дихлорбензол. Реакционную смесь перемешивали в течение 1 часа при температуре 120°C. после охлаждения смесь фильтровали через слой силикагеля и кипятили с обратным холодильником в течение 3 часов. Полученный раствор производного фуллерена концентрировали на ротационном испарителе и очищали с помощью колоночной хроматографии (неподвижная фаза - силикагель, элюент - смесь петролейного эфира и толуола). Выход целевого продукта составляет 13%). Выход побочных продуктов полиаддуктов составил 83%. Чистота полученного производного фуллерена подтверждалась с помощью ВЭЖХ, молекулярный состав с помощью электро-спрей масс-спектрометрии (фигуры 7, 8).
На фигуре 7 присутствует один интенсивный сигнал соответствующий производному фуллерена [70]PCBM. Количество примесей (в предположении близких коэффициентов экстинкции) не превышает 0,9%. Электроспрей масс-спектр производного фуллерена [60]РСВМ, демонстрирует один интенсивный сигнал при m/z=1030, относящийся к молекулярному иону соединения [М]- (фигура 8). Спектральные данные соответствуют литературным данным [Wienk, М.М. et al. Angew. Chem. Int. Ed., 2003, 42, 3371].
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ЦИКЛОПРОПАНОВЫХ ПРОИЗВОДНЫХ ФУЛЛЕРЕНОВ, ПРИМЕНЕНИЕ ОРГАНИЧЕСКИХ ПРОИЗВОДНЫХ ФУЛЛЕРЕНОВ В КАЧЕСТВЕ МАТЕРИАЛОВ ДЛЯ ЭЛЕКТРОННЫХ ПОЛУПРОВОДНИКОВЫХ УСТРОЙСТВ, ОРГАНИЧЕСКОГО ПОЛЕВОГО ТРАНЗИСТОРА, ОРГАНИЧЕСКОЙ ФОТОВОЛЬТАИЧЕСКОЙ ЯЧЕЙКИ, ОРГАНИЧЕСКИЙ ПОЛЕВОЙ ТРАНЗИСТОР И ОРГАНИЧЕСКАЯ ФОТОВОЛЬТАИЧЕСКАЯ ЯЧЕЙКА | 2011 |
|
RU2519782C2 |
| СПОСОБ ПОЛУЧЕНИЯ НОРБОРНЕНЗАМЕЩЕННЫХ ЦИКЛОПРОПАНОВЫХ ПРОИЗВОДНЫХ ФУЛЛЕРЕНОВ И ПОЛИМЕРОВ НА ИХ ОСНОВЕ | 2014 |
|
RU2579148C1 |
| ВОДОРАСТВОРИМЫЕ АМИНОФУЛЛЕРЕНЫ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2005 |
|
RU2358904C2 |
| МЕТАЛЛ-НЕСОДЕРЖАЩИЙ ТОНКОПЛЕНОЧНЫЙ ФОТОКАТАЛИЗАТОР ВОССТАНОВЛЕНИЯ МОЛЕКУЛЯРНОГО КИСЛОРОДА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2018 |
|
RU2708398C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭНАНТИОМЕРНО ЧИСТЫХ (S)-АМИНОКИСЛОТ НА ОСНОВЕ КОМПЛЕКСА [(S)-BPB-GLy]Ni(II), НАПРЯМУЮ СВЯЗАННЫХ С ФУЛЛЕРЕНОВЫМ ЯДРОМ ЧЕРЕЗ α-УГЛЕРОДНЫЙ АТОМ, В ФОРМЕ ХИРАЛЬНЫХ (A) И (C) 1,4-АДДУКТОВ [60]ФУЛЛЕРЕНА | 2015 |
|
RU2614247C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЦИКЛОАЛКИЛИДЕНГОМО(C-C)[5,6]ФУЛЛЕРЕНА | 2009 |
|
RU2417980C2 |
| СПОСОБ ПОЛУЧЕНИЯ S-ПЕНТИЛКАРБОТИОЛ-1aH,2'H-[1,2]ПИРАЗОЛИНО[3',4':1,9](C-I)-[5,6]ФУЛЛЕРЕНА | 2012 |
|
RU2517169C2 |
| СПОСОБ ПОЛУЧЕНИЯ ОПТИЧЕСКИ АКТИВНЫХ СПИРО-ГОМОФУЛЛЕРЕНОВ | 2010 |
|
RU2455273C2 |
| СПОСОБ ПОЛУЧЕНИЯ ХОЛЕСТЕРИЛ ЦИКЛОПРОПА[1,9](C-I)[5,6]ФУЛЛЕРЕН-3'-КАРБОКСИЛАТА | 2010 |
|
RU2447018C2 |
| СПОСОБ ПОЛУЧЕНИЯ N-АЛКИЛ- И N-АРИЛКАРБОКСАМИДИЛ-1aH,2'H-[1,2]ПИРАЗОЛИНО[3',4':1,9](C-I)-[5,6]ФУЛЛЕРЕНОВ | 2012 |
|
RU2517170C2 |

Изобретение относится к способу получения циклопропановых производных фуллеренов. Изобретение может быть использовано в производстве полупроводниковых фуллеренсодержащих материалов. Cпособ получения метилового эфира фенил-С61-бутановой кислоты ([60]РСВМ) или метилового эфира фенил-С71-бутановой кислоты ([70]РСВМ) включает взаимодействие фуллерена (С60, С70) с тозилгидразоном метилового эфира бензоилмасляной кислоты в присутствии основания в среде органического растворителя при повышенной температуре и при перемешивании, где процесс проводят в присутствии карбоната калия, пиридина и 1,2-дихлорбензола, при эквимолярном соотношении тозилгидразона и фуллерена, с последующими охлаждением смеси, фильтрованием, кипячением с обратным холодильником, концентрированием на ротационном испарителе и очищением с помощью колоночной хроматографии. Задачей изобретения является упрощение процесса, уменьшение расхода дорогостоящих реагентов, ускорение процесса при увеличении выхода целевого продукта. 8 ил., 4 пр.
Cпособ получения метилового эфира фенил-С61-бутановой кислоты ([60]РСВМ) или метилового эфира фенил-С71-бутановой кислоты ([70]РСВМ), включающий взаимодействие фуллерена (С60, С70) с тозилгидразоном метилового эфира бензоилмасляной кислоты в присутствии основания в среде органического растворителя при повышенной температуре и при перемешивании, где процесс проводят в присутствии карбоната калия, пиридина и 1,2-дихлорбензола, при эквимолярном соотношении тозилгидразона и фуллерена, с последующими охлаждением смеси, фильтрованием, кипячением с обратным холодильником, концентрированием на ротационном испарителе и очищением с помощью колоночной хроматографии.
| JP 2014097949 A, 29.05.2014 | |||
| СПОСОБ ПОЛУЧЕНИЯ ЦИКЛОПРОПАНОВЫХ ПРОИЗВОДНЫХ ФУЛЛЕРЕНОВ, ПРИМЕНЕНИЕ ОРГАНИЧЕСКИХ ПРОИЗВОДНЫХ ФУЛЛЕРЕНОВ В КАЧЕСТВЕ МАТЕРИАЛОВ ДЛЯ ЭЛЕКТРОННЫХ ПОЛУПРОВОДНИКОВЫХ УСТРОЙСТВ, ОРГАНИЧЕСКОГО ПОЛЕВОГО ТРАНЗИСТОРА, ОРГАНИЧЕСКОЙ ФОТОВОЛЬТАИЧЕСКОЙ ЯЧЕЙКИ, ОРГАНИЧЕСКИЙ ПОЛЕВОЙ ТРАНЗИСТОР И ОРГАНИЧЕСКАЯ ФОТОВОЛЬТАИЧЕСКАЯ ЯЧЕЙКА | 2011 |
|
RU2519782C2 |
| US 20140046089 A1, 13.02.2014 | |||
| US 20140066647 A1, 06.03.2014. | |||
Авторы
Даты
2020-01-17—Публикация
2016-12-28—Подача