ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к новому производному 2-N-галоген-4-метилсульфонил-масляной кислоты, такому как 2-N-хлор-4-метилсульфонил-масляная кислота и его фармацевтически приемлемые соли. Настоящее изобретение также относится к способам применения соединения для лечения бактериальных, вирусных, грибковых заболеваний; воспаления или расстройств, относящихся к воспалению; боли; и кожных состояний.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Человеческий организм подвержен многим различным типам инфекций от разнообразных источников. Вирусная инфекция, обычно в виде простуды, поражает фактически каждого человека каждый год. В то время как кашель и чихание, ассоциированные с простудами, могут попросту раздражать, другие общие вирусные инфекции могут быть гораздо более серьезными. Грипп, например, остается главной причиной госпитализации и смертности среди американцев.
Бактериальные инфекции, такие как инфекции Staphylococcus, являются причиной многих серьезных послеоперационных осложнений. Стафилококковая инфекция является также ведущей причиной в случаях пищевого отравления и может быть ответственной за такие угрожающие жизни состояния, как синдром токсического шока (TSS), пневмония, костные инфекции (остеомиелит), мастит у кормящих матерей, эндокардит (инфекция внутри сердца) и бактериемия (кровяная инфекция). Люди, которые так или иначе являются здоровыми, обычно не заболевают в тяжелой форме от стафилококковых инфекций, но индивидуумы с ослабленной иммунной системой, включая пожилых, новорожденных и людей с хроническими заболеваниями, такими как диабет, рак, заболевание легких, заболевание почек или ВИЧ/СПИД, находятся в группе особого риска.
Индивидуумы с ослабленной иммунной системой имеют риск заболевания грибковыми инфекциями. Грибковые инфекции вызывают состояния у миллионов людей в форме синусовых инфекций, эпидермофитии стопы и дрожжевых инфекций.
Общий термин "боль", используемый в настоящем документе, представляет все категории боли, такие как травматическая боль в результате повреждения, послеоперационная боль, воспалительная боль; боль, ассоциированная с заболеванием, таким как рак, СПИД, артрит, герпес, мигрень; боль, ассоциированная с невропатией, такой как диабетическая невропатия, каузалгия, авульсия плечевого нервного сплетения, затылочная невралгия, фибромиалгия, подагра и другие формы синдромов невралгической, невропатической и идиопатической боли; боль меняющейся тяжести, т.е. мягкая, умеренная и сильная боль; острая и хроническая боль; и специфическая органная боль, такая как глазная и роговичная боль, костная боль, сердечная боль, кожная/ожоговая боль, висцеральная боль (почки, желчный пузырь и т.д.), суставная, зубная и мышечная боль.
Соединительные ткани подвержены постоянной атаке стресса и повреждения. Все острые или хронические воздействия и естественное развитие разнообразных дегенеративных заболеваний продуцируют болезненное воспаление в областях суставов, таких как шея, спина, плечи, бедра, лодыжки и стопы. Эти повреждения являются общими и часто ослабляющими.
Принятые в настоящее время терапии боли включают применение опиоидных наркотических аналгезирующих средств, таких как морфин и фентанил, нестероидных противовоспалительных лекарственных средств (NSAIDS), таких как аспирин, ибупрофен и ингибиторы циклооксигеназы, или блокаторов ионных каналов, таких как лидокаин и новокаин. Все эти терапии имеют ограничения, например они вызывают привыкание, зависимость, запор, угнетение дыхания и седативный эффект (опиоиды). NSAIDS обладают побочными эффектами на желудочно-кишечный тракт и увеличивают время кровотечения и являются неэффективными при лечении сильной боли.
Воспаление представляет собой локализованную реакцию живой ткани вследствие повреждения, которая может быть вызвана разнообразными эндогенными и экзогенными факторами. Экзогенные факторы включают физические, химические и биологические факторы. Эндогенные факторы включают воспалительные медиаторы, антигены и антитела. Эндогенные факторы часто развиваются под влиянием экзогенного повреждения. Воспалительная реакция часто сопровождается измененными структурой и проницаемостью клеточной мембраны. На уровне ткани и органа на воспаление указывают боль, опухание, покраснение, повышенная температура и потеря функции в некоторых случаях.
На воспаление оказывают влияние разнообразные экзогенные и эндогенные агенты. Эндогенные факторы, а именно медиаторы, антигены и аутогенны, определяют природу и тип воспалительной реакции, особенно ее протекание в зоне повреждения. В случае где повреждение ткани ограничивается созданием медиаторов, развивается острая форма воспаления. Если иммунологические реакции также вовлечены в процесс через взаимодействие антигенов, антител и аутоантигенов, то будет развиваться долговременный воспалительный процесс. Разнообразные экзогенные факторы, например инфекция, повреждение, облучение, также обеспечивают протекание воспалительного процесса на молекулярном уровне посредством повреждения клеточных мембран, которые инициируют биохимические реакции.
Нестероидные противовоспалительные лекарственные средства (NSAIDS), такие как аспирин, могут блокировать некоторые звенья воспалительного процесса, но эти лекарственные средства не могут стабилизировать поврежденные клеточные мембраны, что делает их влияние на воспалительный процесс ограниченным и недостаточным.
Существует потребность в композиции и способе лечения бактериальных, вирусных, грибковых заболеваний; воспаления или расстройств, относящихся к воспалению; боли; и кожных состояний. Композиция должна быть экономичной и простой для производства, а способ должен быть эффективным и не иметь значительных побочных эффектов.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к соединению 2-N-галоген-4-метилсульфонил-масляной кислоты (такому, как 2-N-хлор-4-метилсульфонил-масляная кислота, 2-N-фтор-4-метилсульфонил-масляная кислота и 2-N-бром-4-метилсульфонил-масляная кислота) или его фармацевтически приемлемой соли или сольвату. Настоящее изобретение также относится к фармацевтической композиции, содержащей производное и фармацевтически приемлемый носитель.
Настоящее изобретение также относится к способу лечения воспаления или расстройств, относящихся к воспалению, бактериальной инфекции, боли или кожных состояний. Способ включает в себя стадию введения 2-N-галоген-4-метилсульфонил-масляной кислоты субъекту, нуждающемуся в этом лечении. Композиция, содержащая активное соединение, может применяться посредством любого принятого режима введения, включая местный, пероральный и парентеральный (такой, как внутривенный, внутримышечный, подкожный или ректальный). Местное введение и пероральное введение являются предпочтительными.
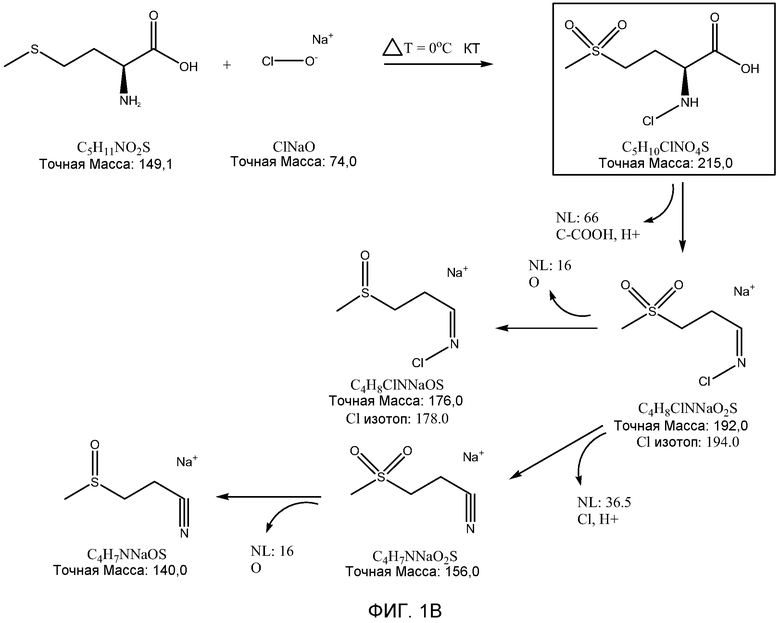
2-N-хлор-4-метилсульфонил-масляная кислота может быть получена способом, включающим стадии: (a) смешивания метионина, галогенирующего агента (такого, как гипохлорит) и не смешивающегося с водой органического растворителя и взаимодействия при температуре между 0-30°C, (b) удаления водной фазы и (c) получения соединения в органическом растворителе.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
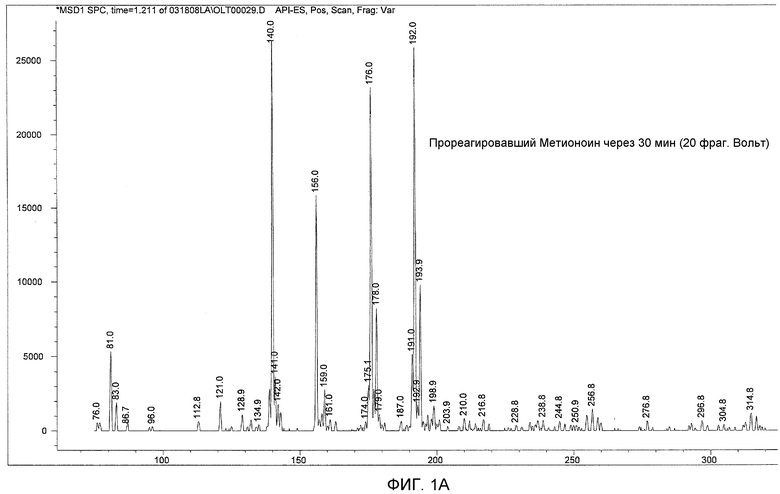
ФИГ. 1A показывает результаты анализа масс-спектров, а ФИГ. 1B показывает теоретическую фрагментацию 2-N-хлор-4-метилсульфонил-масляной кислоты.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новому производному 2-N-галоген-4-метилсульфонил-масляной кислоты:
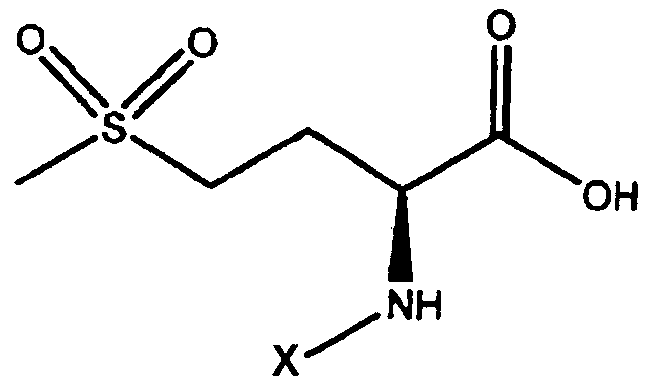
2-N-галоген-4-метилсульфонил-масляная кислота, где X=F, Cl или Br.
Настоящее изобретение также относится к фармацевтически приемлемым солям или сольватам 2-N-галоген-4-метилсульфонил-масляной кислоты.
"Фармацевтически приемлемые соли", как используют в настоящем документе, представляют собой соли, которые сохраняют желательную биологическую активность родоначального соединения и не придают нежелательных токсикологических эффектов. Фармацевтически приемлемые солевые формы включают разнообразные кристаллические полиморфы, а также аморфную форму различных солей. Фармацевтически приемлемые соли могут быть образованы с металлическими или органическими противоионами и включают, но не ограничиваются ими, соли щелочных металлов, таких как натрий или калий; соли щелочно-земельных металлов, таких как магний или кальций; и соли аммония или тетраалкиламмония, т.е. NX4+ (где X представляет собой C1-4).
"Сольваты", как используют в настоящем документе, представляют собой комплексы присоединения, в которых соединение сочетается с приемлемым сорастворителем в некоторой фиксированной пропорции. Сорастворители включают, но не ограничиваются ими, этилацетат, лауриллактат, миристиллактат, цетиллактат, изопропилмиристат, метанол, этанол, 1-пропанол, изопропанол, 1-бутанол, изобутанол, трет-бутанол, ацетон, метилэтилкетон, ацетонитрил, бензол, толуол, ксилол(ы), этиленгликоль, дихлорметан, 1,2-дихлорэтан, N-метилформамид, N,N-диметилформамид, N-метилацетамид, пиридин, диоксан и диэтиловый эфир.
2-N-галоген-4-метилсульфонил-масляная кислота может быть получена способом, включающим стадии: (a) смешивания метионина, не смешивающегося с водой органического растворителя и галогенирующего агента (такого, как гипохлорит) и взаимодействия при температуре между 0-30°C, (b) удаления водной фазы и (c) получения соединения в органическом растворителе.
Метионин может представлять собой L-метионин, D-метионин или их смесь.
Галогенирующие агенты, пригодные для данного изобретения, включают фторирующие агенты, хлорирующие агенты и бромирующие агенты. Примерами галогенирующих агентов являются гипохлорит, хлорамин T, газообразный хлор, бромид водорода, трибромид фосфора, пентабромид фосфора и 1-хлорметил-4-фтор-1,4-диазониабицикло[2.2.2]октан бис-(тетрафторборат). Предпочтительным хлорирующим агентом является гипохлорит (например, гипохлорит натрия).
Не смешивающийся с водой органический растворитель, используемый в данном изобретении, представляет собой предпочтительно полуполярный или неполярный растворитель, имеющий полярность, равную приблизительно 0,1-7,5, и протонный по природе, такой как этилацетат, минеральное масло, гексан, гептан, метиленхлорид, н-бутанол или сложный эфир жирной кислоты, такой как лауриллактат. Предпочтительными органическими растворителями являются этилацетат и лауриллактат. Реакцию стадии (a) осуществляют при температуре между 0°C и температурой окружающей среды, например 0-35°C, предпочтительно 0-30°C и более предпочтительно 0-25°C. Реакцию осуществляют при основных условиях, например, между pH 7,1-14, предпочтительно pH 7,5-7,9.
В одном варианте осуществления метионин находится в виде твердого вещества и смешивается с не смешивающимся с водой органическим растворителем и водным галогенирующим агентом. Смешивание необязательно осуществляют в атмосфере инертного газа, например аргона. Например, твердый метионин сначала смешивают с не смешивающимся с водой органическим растворителем, и водный галогенирующий агент затем добавляют к быстро перемешиваемой суспензии. Время реакции составляет, по меньшей мере, 1 минуту и обычно равно от 30 минут до 24 часов.
В еще одном варианте осуществления водный раствор галогенирующего агента добавляют к метионину (либо в твердом виде, или виде водного раствора) и тщательно перемешивают. Время реакции обычно составляет между 1 минутой до часа, например 2, 5, 10, 15, 30 минут, или любое время в этом интервале (такое как 2-30 минут). Реакцию необязательно осуществляют в атмосфере инертного газа, такого как аргон. Реакционноспособный продукт 2-N-галоген-4-метилсульфонил-масляной кислоты является нестабильным в воде вследствие гидролиза и окисления. После реакции метионина/галогенирующего агента, реакционноспособный продукт экстрагируют не смешивающимся с водой органическим растворителем.
Стадия смешивания (a) может быть проведена посредством любых средств механического смешивания, например лопастной мешалки, смешивания со сдвигом, вращательного смешивания, и т.д.
После завершения реакции стадии (a) смеси вода-органический растворитель дают возможность для осаждения. Органическую фазу отделяют от водной фазы с помощью любого средства, такого как декантирование или отбор пипеткой, и получают экстракт в органическом растворителе, содержащий реакционноспособный продукт 2-N-галоген-4-метилсульфонил-масляной кислоты. Любые нерастворимые остатки в экстракте органического растворителя необязательно удаляют фильтрацией, декантированием, центрифугированием или любым средством, известным квалифицированному специалисту. Реакционноспособный продукт является устойчивым (без существенного окисления или гидролиза) в органическом растворителе при комнатной температуре (22-28°C) в течение, по меньшей мере, месяца, предпочтительно 3 месяцев, более предпочтительно 6 месяцев или года.
В типовой реакции применяют 1-10 г метионина и 20-200 мл 3-12% (например, 6%) гипохлорита. При типовой экстракции применяют приблизительно 100-1000 мл или более не смешивающегося с водой органического растворителя. Количества указанных выше реагентов могут быть масштабированы с увеличением или масштабированы с понижением.
В одном варианте осуществления не смешивающийся с водой органический растворитель представляет собой этилацетат. После удаления водной фазы реакционноспособный продукт необязательно дополнительно очищают посредством добавления растворителя для сложного эфира лактата или растворителя для сложного эфира жирной кислоты к раствору этилацетата и смешивания, удаления этилацетатного растворителя и затем получения продукта 2-N-хлор-4-метилсульфонил-масляной кислоты в растворителе для сложного эфира лактата или растворителе для сложного эфира жирной кислоты. Растворитель для сложного эфира лактата или растворитель для сложного эфира жирной кислоты, используемый в данном изобретении, включает, но не ограничиваясь ими, лауриллактат, миристиллактат, цетиллактат или изопропилмиристат. Например, лауриллактат высокой степени чистоты добавляют к органической фазе и органическую фазу сушат в присутствии сульфата натрия. Смесь отфильтровывают для удаления сульфата натрия и смесь дополнительно перегоняют с использованием традиционных методов роторного испарения для удаления этилацетата. Полученный в результате раствор состоит из продукта 2-N-хлор-4-метилсульфонил-масляной кислоты в стабилизирующей среде лауриллактата. Идентичность 2-N-хлор-4-метансульфонил-масляной кислоты подтверждают с помощью инфузионной масс-спектроскопии, спектроскопии ядерного магнитного резонанса (ЯМР), и может дополнительно характеризоваться посредством инфракрасной спектроскопии с Фурье-преобразованием (ИК-ФП), ультрафиолетовой спектроскопии (УФ) и жидкостной хроматографии-масс-спектрометрии (ЖХ-МС).
Хлорированные углеводороды, как правило, являются неустойчивыми и имеют очень короткие периоды полураспада (Na and Olson, Environ Sci Technol. 41:3220-3225, 2007). Хлорированные альфа-аминокислоты являются неустойчивыми в воде и на воздухе и претерпевают гидролитическую и окислительную деградацию. Эти свойства неустойчивости хлорированных аминокислот очевидно распространяются на 2-N-галоген-4-метилсульфонил-масляную кислоту, что усложняет ее выделение и характеризацию. В дополнение, сульфоновая часть 2-N-галоген-4-метилсульфонил-масляной кислоты может разрушаться посредством восстановительных механизмов. Авторы изобретения продемонстрировали неустойчивость 2-N-галоген-4-метилсульфонил-масляной кислоты посредством завершения реакции в водной среде; и немедленно (т.е. <5 минут), инициируя сверхбыстрое замораживание реакционного раствора при -80°C и подвергая замороженную реакционную смесь лиофилизации. После лиофилизации материал покрывают инертным газом и герметически закупоривают. Полученный в результате продукт представлял собой белую лиофилизованную лепешку. При воздействии воды или воздуха белая лиофилизованная лепешка немедленно претерпевала окислительную деградацию, и вся лепешка приобретала кирпично-красный цвет с выделением запаха, похожего на запах серы.
Авторы изобретения обнаружили, что при включении в композицию лауриллактата 2-N-галоген-4-метилсульфонил-масляная кислота стабилизируется вследствие того, что присутствие лауриллактата защищает соединение от воздействия воды. Авторы изобретения обнаружили, что лауриллактат при приблизительно 1-15%, или приблизительно 1-5%, или приблизительно 5-10%, или приблизительно 5-15% (например, приблизительно 10% м/м) обеспечивает необходимую стабильность и растворимость 2-N-галоген-4-метилсульфонил-масляной кислоты. "Приблизительно", как используют в настоящем документе, относится к ±15% приведенного значения. Лауриллактат считается безопасным для местного введения. Лауриллактат квалифицируют для применения человеком в числе фармацевтических и косметических продуктов. Предпочтительно лауриллактат очищают до достижения >90%, предпочтительно >95% чистоты; высокая чистота смягчает последствия присутствия гидролитических и окислительных агентов. Настоящее изобретение также предоставляет фармацевтические композиции, содержащие один или более фармацевтически приемлемый носитель и 2-N-галоген-4-метилсульфонил-масляную кислоту или фармацевтически приемлемые ее соль или сольват. Производное 2-N-галоген-4-метилсульфонил-масляной кислоты в фармацевтических композициях, как правило, находится в количестве, равном 0,001-10%, или 0,01-5%, или 0,05-5%, или 0,1-2%, или 0,2-2%, или 0,1-1%, или 0,2-1%, или 0,5-2% (м/м).
Фармацевтически приемлемый носитель может быть выбран квалифицированным специалистом в данной области с использованием общепринятых критериев. Фармацевтически приемлемые носители включают, но не ограничиваются ими, растворы на неводной основе, суспензии, эмульсии, микроэмульсии, мицеллярные растворы, гели и мази. Фармацевтически приемлемые носители могут также содержать ингредиенты, которые включают, но не ограничиваются ими, солевые и водные растворы электролитов; ионные и неионные осмотические агенты, такие как хлорид натрия, хлорид калия, глицерин и декстроза; регуляторы pH и буферы, такие как соли гидроксида, гидроний, фосфат, цитрат, ацетат и борат; антиоксиданты, такие как соли, кислоты и/или основания из бисульфита, сульфита, метабисульфита, тиосульфита, аскорбиновой кислоты, ацетилцистеина, цистеина, глутатиона, бутилированного гидроксианизола, бутилированного гидрокситолуола, токоферолов и аскорбилпальмитата; поверхностно-активные вещества, такие как лецитин, фосфолипиды, включающие, но не ограничиваясь ими, фосфатидилхолин, фосфатидилэтаноламин и фосфатидилинозит; полоксамеры и полоксамины, полисорбаты, такие как полисорбат 80, полисорбат 60 и полисорбат 20, простые полиэфиры, такие как полиэтиленгликоли и полипропиленгликоли; поливинилы, такие как поливиниловый спирт и повидон; производные целлюлозы, такие как метилцеллюлоза, гидроксипропилцеллюлоза, гидроксиэтилцеллюлоза, карбоксиметилцеллюлоза и гидроксипропилметилцеллюлоза и их соли; производные нефти, такие как минеральное масло и медицинский вазелин; жиры, такие как ланолин, арахисовое масло, пальмовое масло, соевое масло; моно-, ди- и триглицериды; полимеры акриловой кислоты, такие как карбоксиполиметиленовый гель, и полисахариды, такие как декстраны и гликозамингликаны, такие как гиалуронат натрия. Такие фармацевтически приемлемые носители могут предохранять от бактериального заражения с использованием хорошо известных консервантов, которые включают, но не ограничиваются ими, хлорид бензалкония, этилендиаминтетрауксусную кислоту и ее соли, хлорид бензэтония, хлоргексидин, хлорбутанол, метилпарабен, тимеросал и фенилэтиловый спирт или могут быть составлены в виде неконсервирующей композиции для либо разового или множественного применения.
Местные композиции, включающие активный ингредиент 2-N-галоген-4-метилсульфонил-масляную кислоту, могут находиться в виде геля, крема, лосьона, жидкости, эмульсии, мази, спрея, раствора и суспензии. Неактивные ингредиенты в местных композициях, например, включают, но не ограничены ими, лауриллактат (усилитель проницаемости смягчающего средства), силиконовый эластомер (модификатор реологии/текстуры), каприловый/каприновый триглицерид (смягчающее средство), октисиликат (смягчающее средство/УФ-фильтр), силиконовую текучую среду (смягчающее средство/разбавитель), сквален (смягчающее средство), масло подсолнечника (смягчающее средство) и диоксид кремния (загуститель).
Авторы изобретения обнаружили, что 2-N-галоген-4-метилсульфонил-масляная кислота или ее фармацевтически приемлемые соль, сольват (активное соединение) являются пригодными для лечения разнообразных заболеваний или расстройств. Активное соединение может применяться как таковое или может быть введено в виде фармацевтической композиции, которая дополнительно содержит фармацевтически приемлемый носитель. В одном варианте осуществления активное соединение вводится в приемлемый носитель, включающий кремы, гели, лосьоны или другие типы суспензий, которые могут стабилизировать активное соединение и доставлять его в пораженную область посредством местных нанесений. В еще одном варианте осуществления, фармацевтическая композиция может находиться в дозированных формах, таких как таблетки, капсулы, гранулы, мелкие гранулы, порошки, сиропы, суппозитории, инъекции или т.п. Указанная выше фармацевтическая композиция может быть получена посредством общепринятых способов.
В одном варианте осуществления настоящее изобретение предоставляет способ лечения воспаления или расстройств, относящихся к воспалению. Термин "воспаление", как правило, относится к локализованной реакции ткани, характеризуемой поступлением иммунных клеток, который происходит в ответ на повреждение или инфекцию. Способ снижает или смягчает симптомы, ассоциированные с воспалением. Настоящее изобретение предпочтительно предоставляет способ для лечения локализованных проявлений воспаления, характеризуемых острым или хроническим опуханием, болью, краснотой, повышенной температурой или потерей функции в некоторых случаях. Настоящее изобретение является пригодным для лечения симптоматического воспаления суставов и мягких тканей, являющегося результатом острого повреждения или хронических воспалительных расстройств, включающих, но не ограничиваясь ими, артрит (остеоартрит и ревматоидный артрит), тендинит, бурсит, подагрический артрит, ревматическую полимиалгию и атопический и контактный дерматит.
В еще одном варианте осуществления настоящее изобретение предоставляет способ для смягчения симптомов боли независимо от причины боли. Общий термин "боль", излечиваемая посредством способа по настоящему изобретению, включает травматическую боль, невропатическую боль, органную боль и боль, ассоциированную с заболеваниями. Травматическая боль включает боль, являющуюся результатом повреждения, послеоперационную боль и воспалительную боль. Невропатическая боль включает синдромы невропатической и идиопатической боли и боль, ассоциированную с невропатией, такой как диабетическая невропатия, каузалгия, авульсия плечевого нервного сплетения, затылочная невралгия, фибромиалгия, подагра и другие формы невралгии. Органная боль включает глазную, роговичную, костную, сердечную, кожную/ожоговую, висцеральную (почки, желчный пузырь и т.д.), суставную, зубную и мышечную боль. Боль, ассоциированная с заболеваниями, включает боль, ассоциированную с раком, СПИДом, артритом, герпесом и мигренью. Настоящее изобретение снижает боль изменяющейся тяжести, т.е. мягкую, умеренную и сильную боль; острую и хроническую боль. В одном варианте осуществления настоящее изобретение является эффективным при лечении боли, являющейся результатом воспалительного артрита или дегенеративного артрита, такого как ревматоидный артрит и остеоартрит. В еще одном варианте осуществления настоящее изобретение является эффективным при лечении суставной боли, мышечной боли, боли в сухожилиях и ожоговой боли.
В еще одном варианте осуществления настоящее изобретение предоставляет способ лечения бактериального заболевания, такого как стафилококковая инфекция.
В еще одном варианте осуществления настоящее изобретение предоставляет способ лечения вирусного заболевания, такого как инфекция гриппа.
В еще одном варианте осуществления настоящее изобретение предоставляет способ лечения грибкового заболевания, такого как эпидермофития стопы, дрожжевая инфекция и синусовая инфекция, вызванная грибковой инфекцией.
В еще одном варианте осуществления настоящее изобретение предоставляет способ лечения кожного состояния, такого как повреждения кожи посредством ожогов или солнца, кожные сыпи или бородавки.
В еще одном варианте осуществления настоящее изобретение предоставляет способ лечения ран. Период половинного заживления ран улучшается посредством лечения.
Способ настоящего изобретения включает стадии идентификации субъекта, нуждающегося в лечении, и введения субъекту эффективного количества 2-N-галоген-4-метилсульфонил-масляной кислоты, такой как 2-N-хлор-4-метилсульфонил-масляная кислота или ее фармацевтически приемлемая соль. "Эффективное количество", как используют в настоящем документе, является количеством, эффективным для лечения заболевания посредством смягчения патологического состояния или снижения симптомов заболевания.
Фармацевтическая композиция по настоящему изобретению может применяться посредством любого из принятых режимов системного введения, включая местный, пероральный, парентеральный (такой, как внутривенный, внутримышечный, подкожный или ректальный), и иных системных путей введения. Активное соединение сначала достигает плазмы и затем распределяется в целевые ткани. Дозирование композиции может изменяться в зависимости от степени повреждения и индивидуального ответа каждого пациента. Местное введение и пероральное введение являются предпочтительными путями введения для настоящего изобретения. Для системного введения плазменные концентрации доставляемых активных соединений могут изменяться в соответствии с соединениями; но, как правило, составляют 1×10-10-1×10-4 моль/литр, и предпочтительно 1×10-8-1×10-5 моль/литр.
В предпочтительном варианте осуществления композицию наносят местно на пораженную область и втирают в нее. Композицию наносят местно, по меньшей мере, один или два раза в день, предпочтительно 3-4 раза в день, в зависимости от медицинской ситуации и патологии заболевания, являющегося хроническим или острым. Как правило, местная композиция содержит приблизительно 0,001-1%, предпочтительно приблизительно 0,01-1% или предпочтительно приблизительно 0,03-0,3% (м/м) или предпочтительно приблизительно 0,05-0,3% активного соединения. Например, местная композиция содержит приблизительно 0,05, 0,1 или 0,2% (м/м) активного соединения. В зависимости от пораженной области обычно 1-10 см3 местной композиции наносят индивидууму в дозе. Как правило, активное соединение наносят местно индивидууму при 0,05-50 и предпочтительно 0,1-10 мг/доза. Активное соединение проходит через кожу и доставляется к участку дискомфорта.
Квалифицированные специалисты в данной области поймут, что для настоящего изобретения также подходит широкое разнообразие механизмов доставки.
Следующие примеры дополнительно иллюстрируют настоящее изобретение. Эти примеры предназначены просто для иллюстрации настоящего изобретения и не должны считаться ограничивающими.
ПРИМЕРЫ
ПРИМЕР 1. Получение реакционноспособного продукта
DL-метионин (0,50 г) отвешивали в колбу Эрленмейера с объемом 125 мл. Воду (25 мл) добавляли к метионину с получением прозрачного раствора. Гипохлорит натрия (отбеливатель CLOROX®, 10 мл) добавляли в колбу, которую слегка вращали, затем давали отстояться при комнатной температуре. Через 30 мин раствор переносили в разделительную воронку и добавляли этилацетат (50 мл). Смесь встряхивали в течение приблизительно 15 мин, затем после разделения фаз нижнюю водную фазу сливали. В воронку добавляли CHRYSTAPHYL® (Лауриллактат, 50 мл) и полученный в результате гомогенный раствор переливали в колбу Эрленмейера, содержащую большое количество Na2SO4. После периодического вращения в течение нескольких минут растворители отфильтровывают в перегонную колбу и этилацетатный растворитель удаляли под вакуумом (Тбани<30°C). Конечный объем снижали до приблизительно 50 мл. Полученный в результате продукт представляет собой полувязкий прозрачный раствор 2-N-хлор-4-метилсульфонил-масляной кислоты в лауриллактатном растворителе. Прозрачную жидкость переносили в подходящий контейнер и хранили при комнатной температуре.
Рассчитанное количество 2-N-хлор-4-метилсульфонил-масляной кислоты в лауриллактате, полученной посредством данного примера, составляет приблизительно 10-15 мг/мл. Расчет основан на внутреннем стандарте (см. пример 2) и предполагает, что ионизационные ответы внутреннего стандарта и 2-N-хлор-4-метилсульфонил-масляной кислоты являются эквивалентными.
ПРИМЕР 2. Идентификация реакционноспособного продукта как 2-N-хлор-4-метилсульфонил-масляной кислоты
Реакционноспособный продукт примера 1 анализировали посредством инфузионной масс-спектроскопии с использованием метанола в качестве инфузионного растворителя в масс-спектрометре при использовании электрораспылительного инфузионного метода.
Оборудование и реагенты:
Метанол (категории для ВЭЖХ или эквивалентной)
Этанол (категории для ВЭЖХ или эквивалентной)
Высокоэффективный жидкостной хроматограф (Модель HP 1100) или эквивалент
Получение подвижной фазы
В бутыли для подвижной фазы добавляли 750 мл метанола и 250 мл этанола и дегазировали обработкой ультразвуком под вакуумом.
Приготовление инструментального контроля (IC)
Аликвотные части подвижной фазы во флаконах для ВЭЖХ применяли в качестве контрольных образцов.
Приготовление отрицательного контроля (NC)
Образец отрицательного контроля был получен в стеклянном флаконе посредством смешивания аликвоты 1 мл жидкого лауриллактата (CHRYSTAPHYL®) с высокой степенью чистоты с 4 мл этилацетата. Раствор тщательно смешивали и аликвоту переносили в янтарный пузырек для ВЭЖХ-анализа и герметически закупоривали.
Стандарт пригодности системы (SSS)
Стандарт пригодности системы был получен в стеклянном флаконе посредством смешивания аликвоты 1 мл 2-N-хлор-4-метилсульфонил-масляной кислоты с 4 мл этилацетата. Раствор тщательно смешивали и аликвоту переносили в янтарный флакон для ВЭЖХ-анализа и герметически закупоривали.
Исходный раствор внутреннего стандарта
Внутренний стандарт (IS=метионинсульфон) был получен в подходящей мерной стеклянной посуде при концентрации, равной 25 мкг/мл в ДМСО.
Образец для тестирования (TS)
Образец для тестирования был получен в стеклянном флаконе посредством смешивания аликвоты 1 мл полученного в результате продукта примера 1 с 4 мл этилацетата. Затем 10 мкл IS добавляли в раствор для тестирования. Раствор тщательно смешивали и аликвоту переносили в янтарный флакон для ВЭЖХ-анализа и герметически закупоривали.
Образец для тестирования анализировали посредством инфузионной масс-спектроскопии с использованием ВЭЖХ-МС-SIM, а также ВЭЖХ-МС с системой регистрации одного иона, а также параметрами сканирования общего ионного тока при следующих условиях:
Способ-идентификатор: OLTSIMNL (et al.)
Аналитическая колонка (где применялась): PHENOMENEX® Luna 5μ Silica (2) 100A
250×4,60 мм 5μ
Полные ионные спектры регистрировали в интервале от 75 до 375 АЕМ (атомных единиц массы). Результаты показаны на ФИГ. 1. X-ось показывает отношение массы к заряду (непосредственно относящееся к молекулярной массе), и Y-ось отображает интенсивность сигнала.
Масс-спектрометрический анализ образца для тестирования показывает несколько основных ионных пиков, имеющих молекулярную массу, равную 140, 192, 176 и 156, в порядке снижения интенсивности сигналов. ФИГ. 1 также показывает теоретическую фрагментацию 2-N-хлор-4-метилсульфонил-масляной кислоты (молекулярная масса равна 215,7), которая приводит к структурам, имеющим молекулярную массу, равную 192, 176, 156, и 140. Выделенная схема фрагментации является результирующей от конкретных параметров метода и фрагментации 2-N-хлор-4-метилсульфонил-масляной кислоты.
ПРИМЕР 3. Получение реакционноспособного продукта
DL-Метионин (приблизительно 1,50 г) отвешивали в колбу Эрленмейера объемом 500 мл, содержащую магнитную мешалку. 150 мл этилацетата реагентной степени чистоты добавляли в колбу и к быстро перемешиваемой суспензии добавляли 30 мл гипохлорита натрия (отбеливатель CLOROX®). Колбу закрывали пробкой и перемешивание продолжали при КТ в течение периода, равного 18 часам.
Смесь переносили в разделительную воронку, водную фазу сливали и 150 мл лауриллактата высокой степени чистоты (CHRYSTAPHYL®, Chemic Laboratories) (150 мл) добавляли к органической фазе. Полученный в результате гомогенный раствор сушили в присутствии 20-50 г сульфата натрия (Na2SO4) и после периодического вращения в течение нескольких минут растворители отфильтровывали в перегонную колбу, которую помещали на Rotavap (T Бани = 30-35°C; 14-18 торр; 2 ч) и частично концентрировали для удаления этилацетата. Остаточную прозрачную жидкость (~140 мл) переносили в подходящую контейнерную систему упаковки и хранили при комнатной температуре.
ПРИМЕР 4. Результаты ЯМР
Однородно меченный 13C Метионин (чистота 97-99%) реагировал в D8 этилацетате (EtoAC) (чистота 99,5%) с использованием методик, описанных в первом параграфе примера 3. Приблизительно 1 г d8 этилацетата, содержащего предполагаемую 0,1% u-13C 2-N-хлор-4-метилсульфонил-масляную кислоту, оценивали с использованием 1H ЯМР при 400 мГц с образцом, поддерживаемым при 25°C. Дополнительно такой же тестируемый образец оценивали, используя 13C ЯМР @ 100 мГц повторно с тестируемым образцом, поддерживаемым при 25°C.
В результате эксперимента получены следующие пики:
1H ЯМР (ETOAC-d8, 400 МГц): 1,78 (1H), 2,56 (β, 2H), 3,42 (α, 2H), 3,93 (α, 1H) 13C ЯМР (EToAC-d8, 100 МГц): δ 18,0, 39,68, 39,77, 48,7, 49,0, 59,0, 171,0.
Объединенные результаты 1H ЯМР и 13C ЯМР подтверждают сульфоновый, концевой метильный и карбоксильный фрагменты 2-N-хлор-4-метансульфонил-масляной кислоты.
ПРИМЕР 5. Противовоспалительная активность 2-N-Хлор-4-метилсульфонил-масляной кислоты
Тестируемые вещества, включающие 2-N-хлор-4-метилсульфонил-масляную кислоту (активное соединение, полученное в соответствии с примером 1), индометацин (положительный контроль), и среду (лауриллактат) оценивали на предмет противовоспалительной активности на местной индуцированной арахидоновой кислотой модели ушного аллерготеста у мышей.
В эксперименте использовали самцов мышей ICR с массой 22±2 г. Арахидоновую кислоту (2 мг в 20 мкл ацетона) наносили местно на переднюю и заднюю поверхности правого уха тестируемых животных. Активное соединение в среде или среду (лауриллактат) каждое наносили за 30 минут до и через 15 минут после стимуляции арахидоновой кислотой. Одновременно каждый из положительного контроля индометацина в среде при 3 мг/ухо или среды (лауриллактата) наносили за 30 минут до и через 15 минут после арахидоновой кислоты. Опухание уха затем измеряли с использованием модели Дайера микрометрического калибра при 60, 90 и 120 минутах после индукции арахидоновой кислотой отека уха, как показатель воспаления. Существенную активность определяли как снижение (ингибирование) индуцированного арахидоновой кислотой опухания уха на >30% относительно группы, обработанной средой. Результаты показаны в таблице 1.
На основании результатов местное введение активного соединения в лауриллактате показывало значительное снижение (33, 31 и 34%) опухания уха относительно группы, обработанной средой из лауриллактата, при временных отметках измерения, соответствующих 60, 90 и 120 минутам после стимуляции арахидоновой кислотой.
ПРИМЕР 6. Композиция геля
Следующие данные являются примером композиции геля, содержащей 2-N-хлор-4-метилсульфонил-масляную кислоту (активное соединение).
(% м/м)
Композицию геля получали посредством добавления силиконового эластомера в сосуд и затем добавления каприлового/капринового триглицерида, октисалата, активного соединения (в лауриллактате), силиконовой текучей среды, сквалена и масла подсолнечника и замешивания до гомогенного состояния. Добавляли силилат оксида кремния и загрузку замешивали снова до гомогенного состояния. Гель затем заполняли в тубы и тубы закрывали колпачками. По внешнему виду гель представлял собой вязкий гель с цветом от прозрачного до слегка желтого.
ПРИМЕР 7. Лечение инфекций
Полученный в результате продукт примера 3 или композицию геля примера 6 наносили местно от одного до трех раз в день субъектам, у которых выявлена стафилококковая инфекция. Продолжительность лечения составляла от 1 недели до 3 месяцев. Симптомы инфекции обследовали после лечения.
ПРИМЕР 8. Лечение боли
Полученный в результате продукт примера 3 или композицию геля примера 6 наносили местно различным субъектам, имеющим суставную боль, артритическую боль, боль в спине, боль в колене, боль в бедре (тазобедренном суставе), боль от укуса клопов или ожоговую боль. Субъектов оценивали на предмет немедленного облегчения боли после нанесения продукта.
ПРИМЕР 9. Лечение ран или повреждений
Полученный в результате продукт примера 3 или композицию геля примера 6 наносят местно от одного до трех раз в день субъектам, у которых проявлялись ожоги, пигментные пятна от солнца на лице, повреждения кожи от солнца или бородавки. Продолжительность лечения составляла от 3 дней до 3 месяцев. Субъектов оценивали симптоматически после нанесения продукта.
ПРИМЕР 10. Лечение ран у мышей
Самцов мышей CD-1 помещали под воздействие анестезии гексобарбиталом (90 мг/кг, ВБР), и области плеча и спины каждого животного выбривали. Прижимали острый перфоратор (ВД 12 мм) для удаления кожи, включая поверхностный слой и примыкающие ткани. Как 2-N хлор-4-метилсульфонил-масляную кислоту в лауриллактате, так и контроль среды из лауриллактата наносили местно немедленно после повреждения кожи и затем четыре раза ежедневно (при 3-часовых интервалах) в течение 10 последовательных дней. Положительный контроль митомицин при 10 мкг/мышь и контроль из среды каждый вводили местно немедленно после повреждения кожи и затем один раз ежедневно в течение 10 последовательных дней. Область раны, отпечатанную на чистых пластиковых листах, измеряли, применяя программу Image-ProPlus (Media Cybernetics, Version 4.5.29) в дни 1, 3, 5, 7, 9 и 11. Рассчитывали процент заживления раны (%) и время половинного заживления раны (CT50) анализировали с помощью линейной регрессии, применяя Graph-Prism (Программное обеспечение Graph, США).
ПРИМЕР 11. Лечение боли в колене
Цели: Исследовать эффективность геля с 2-N-хлор-4-метилсульфонил-масляной кислоты у пациентов с мягкой до умеренной болью, ассоциированной с остеоартритом, после временной отмены стандартной терапии NSAID.
Композиция: В этом примере применяли композицию геля, содержащую 2-N-хлор-4-метилсульфонил-масляную кислоту при 0,1 или 0,2% (пример 6). Плацебо содержало тот же самый гель без активного соединения.
Методология: рандомизированное, двойное слепое, плацебо-контролируемое, с параллельным лечением, многоцентровое исследование клинической активности на Фазе 2. Пациенты с болезненным остеоартритом коленного сустава, с контролем по стабильной дозе стандартной терапии NSAID, в течение, по меньшей мере, 2 месяцев, прерывали прием NSAIDs на 7 дней периода вымывания. Пациентов затем статистически распределяли в группы при соотношении 1:1:1 (0,1% активного геля, 0,2% активного геля, плацебо). Всего до 150 пациентов были зарегистрированы и подвергнуты лечению в течение 7 дней с последующим лечением в дни 8, 10, 14 и 21.
Активный гель или плацебо наносили на пораженное колено 3 раза в день в течение 7 дней с общим количеством, равным 21 лечению, даваемого каждые 4-6 часов во время пробуждения.
Пациентов лечили в течение 7 дней и продолжали лечение в течение дополнительных 14 дней. Терапию NSAIDs можно возобновить после посещения в День 10.
Критерии оценки:
Безопасность:
Неблагоприятные события (AEs) на протяжении исследования.
Медицинский осмотр при регистрации (-7 дней, начало периода вымывания NSAID), Базовый уровень (День 1, начало лечения), День 10 и День 21.
Основные показатели состояния организма при регистрации (-7 дней, начало периода вымывания NSAID), Базовый уровень (День 1, начало лечения) и Дни 2, 4, 8, 10, 14 и 21.
Клинические лабораторные анализы на Базовом уровне (День 1), День 8 и День 14.
Клиническая активность:
Параметры первичной клинической активности представляют собой результаты измерения боли в месте нанесения, в количественном выражении по шкале VAS и Western Ontario и McMaster University (WOMAC). Эффект от лечения опухания, болезненности и воспаления колена регистрируется, также регистрируется время, необходимое для снижения или устранения боли после лечения.
Конечные показатели исследования:
Конечный показатель первичной клинической активности представляет собой:
Изменение Базового уровня (от контрольной группы) (День 1) до Дня 8 показателя функциональной нетрудоспособности WOMAC:
Боль (Шкала 0-20).
Ригидность (Шкала 0-8).
Физическая функция (Шкала 0-68).
Конечные показатели вторичной клинической активности представляют собой:
Изменение Базового уровня (от контрольной группы) (День 1) до Дня 8 по шкале боли VAS (1-100).
Изменение в пределах дня по шкале боли VAS на День 2 и День 3, как измеряют по изменению от ежедневного Базового уровня (Предварительная обработка 1) до 30 минут после обработки 2.
Изменение оценки исследователем опухания, болезненности и воспаления между Базовым уровнем (День 1) и 30 минутами и 60 минутами после первого нанесения в День 1.
Изменение оценки исследователем опухания, болезненности и воспаления между Базовым уровнем (День 1) и Днем 8.
Время для снижения или устранения боли после каждого местного нанесения геля OLTl171 или плацебо-геля.
Применение средства экстренной терапии (APAP)
Изобретение, образ и процесс его создания и применения, теперь описаны в таких полных, ясных, выразительных и точных терминах, чтобы дать возможность любому квалифицированному специалисту в области, к которой оно относится, получить и применить вышеуказанное. Следует понимать, что приведенное выше описывает предпочтительные варианты осуществления настоящего изобретения и что могут быть проведены его модификации без отступления от объема притязаний настоящего изобретения, как изложено в формуле изобретения. Чтобы конкретно отметить и недвусмысленно заявить объект, рассматриваемый как изобретение, в заключение описания приводится следующая формула изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ФЕНИЛЬНЫХ ГЕТЕРОЦИКЛОВ И ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ | 1995 |
|
RU2160257C2 |
| КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ БАКТЕРИАЛЬНЫХ, ВИРУСНЫХ, ГРИБКОВЫХ ЗАБОЛЕВАНИЙ, ВОСПАЛЕНИЯ И БОЛИ | 2006 |
|
RU2403035C2 |
| ХИМИЧЕСКИЕ СОЕДИНЕНИЯ I | 2005 |
|
RU2381216C2 |
| НОВЫЕ СОЕДИНЕНИЯ, ОБЛАДАЮЩИЕ ПРОТИВОВОСПАЛИТЕЛЬНОЙ АКТИВНОСТЬЮ, И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 2001 |
|
RU2288225C2 |
| ТЕРАПЕВТИЧЕСКОЕ СРЕДСТВО ДЛЯ ЗАБОЛЕВАНИЙ НА ОСНОВЕ ИНГИБИРУЮЩЕГО ДЕЙСТВИЯ НА ФАКТОР ИНГИБИРОВАНИЯ МИГРАЦИИ МАКРОФАГОВ | 2014 |
|
RU2750540C2 |
| ДИЗАМЕЩЕННЫЕ ФУРАНОНЫ, ТИАЗОЛЫ И ПЕНТЕНОНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ЦИКЛООКСИГЕНАЗЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ | 1994 |
|
RU2131423C1 |
| ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ | 2007 |
|
RU2430921C2 |
| ПРОИЗВОДНЫЕ 5-АРИЛ-1Н-1,2,4-ТРИАЗОЛА И СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2000 |
|
RU2249588C2 |
| ПРОИЗВОДНЫЕ ФЕНОКСИУКСУСНОЙ КИСЛОТЫ | 2004 |
|
RU2360901C2 |
| 3(5)-ГЕТЕРОАРИЛЗАМЕЩЕННЫЕ ПИРАЗОЛЫ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗЫ P38 | 1998 |
|
RU2249591C2 |
Изобретение относится к производному 2-N-галоген-4-метилсульфонил-масляной кислоты или к его фармацевтически приемлемой соли
 , где X=F, Cl или Br.
, где X=F, Cl или Br.
Изобретение также относится к способу получения указанного соединения и к фармацевтической композиции для лечения воспаления, на основе указанного соединения. Технический результат - получены новое соединение и фармацевтическая композиция на его основе, которые могут найти применение в медицине для лечения воспаления или расстройств, относящихся к воспалению, бактериальной инфекции, боли или кожных состояний. 5 н. и 10 з.п. ф-лы, 2 ил., 1 табл., 11 пр.
1. Производное 2-N-галоген-4-метилсульфонил-масляной кислоты или его фармацевтически приемлемая соль

где X=F, Cl или Br
2. Производное по п.1, где X=Cl.
3. Фармацевтическая композиция для лечения воспаления, содержащая производное по п.1 и фармацевтически приемлемый носитель.
4. Фармацевтическая композиция по п.3, где фармацевтически приемлемый носитель содержит лауриллактат в количестве, равном 5-15% (м/м).
5. Фармацевтическая композиция по п.3, которая находится в форме геля и содержит производное по п.1 в количестве, равном приблизительно 0,03-0,3% (м/м).
6. Способ получения производного по п.1, включающий стадии:
(a) смешивания метионина, не смешивающегося с водой органического растворителя и галогенирующего агента, и взаимодействие при температуре между 0-30°С;
(b) удаления водной фазы; и
(c) получения соединения в органическом растворителе.
7. Способ по п.6, где указанный не смешивающийся с водой органический растворитель представляет собой этилацетат, гексан, гептан, метиленхлорид, минеральное масло или сложный эфир жирной кислоты.
8. Способ по п.6, где указанный галогенирующий агент представляет собой гипохлорит.
9. Способ по п.6, где метионин представляет собой D-метионин, L-метионин или их смесь.
10. Способ получения производного по п.2, включающий стадии:
(a) смешивания метионина, этилацетата и водного раствора гипохлорита и взаимодействие при температуре между 0-30°C;
(b) удаления водной фазы;
(c) получения соединения в этилацетате;
(d) добавления растворителя сложного эфира лактата или растворителя сложного эфира жирной кислоты к раствору этилацетата и смешивания;
(e) удаления этилацетатного растворителя; и
(f) получения соединения в растворителе сложном эфире лактата или в растворителе сложном эфире жирной кислоты.
11. Способ по п.10, где указанный растворитель сложный эфир лактата представляет собой лауриллактат, миристиллактат или цетиллактат.
12. Способ по п.10, где указанный растворитель сложный эфир жирной кислоты представляет собой изопропилмиристат.
13. Способ лечения воспаления, включающий стадии: идентификации субъекта, страдающего от воспаления, и введения субъекту производного по п.1, в количестве, эффективном для лечения воспаления.
14. Способ по п.13, где указанный способ снижает или облегчает симптомы локализованных проявлений воспаления, характеризуемых острым или хроническим опуханием, болью или краснотой.
15. Способ по п.13, где указанное воспаление представляет собой воспаление суставов или мягких тканей.
| ABO-GHALIA M | |||
| et al, International Journal of Peptide & Protein Research, vol.32, no | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Гидравлическая или пневматическая передача | 0 |
|
SU208A1 |
| US 20060247209 A1, 02.11.2006 | |||
| US 5145611 A, 08.09.1992 | |||
| СПОСОБ ПОЛУЧЕНИЯ ФОСФАТА ИЛИ СУКЦИНАТА 2-АМИНО-4-МЕТИЛТИО-(S-ОКСО-S-ИМИНО)-МАСЛЯНОЙ КИСЛОТЫ | 2003 |
|
RU2232752C1 |
Авторы
Даты
2014-06-20—Публикация
2010-03-16—Подача