Область изобретения
Данное изобретение относится к новым фенилоксазолидиноновым соединениям Формулы I, их фармацевтически приемлемым производным, таутомерным формам, стереоизомерам, включая R и S изомеры, полиморфам, пролекарствам, метаболитам, их солям или сольватам. Данное изобретение также касается способов синтеза новых соединений Формулы I или их фармацевтически приемлемых производных, таутомерных форм, стереоизомеров, включая R и S изомеры, полиморфов, пролекарств, метаболитов, их солей или сольватов. Данное изобретение также обеспечивает фармацевтические композиции, содержащие новые соединения Формулы I, и способы их применения. Соединения данного изобретения применимы как противомикробные средства, эффективные против ряда аэробных и/или анаэробных грамположительных и/или грамотрицательных патогенов, таких как устойчивые к нескольким лекарственным средствам виды Staphylococcus, Streptococcus, Enterococcus, Bacterioides, Clostridia, H. influenza, Moraxella, кислотоустойчивые организмы, такие как Mycobacterium tuberculosis, a также устойчивые к линезолиду виды Staphylococcus и Enterococcus.
Предпосылки изобретения
Микробная устойчивость опасно выросла в последние годы в результате появления бактериальных штаммов, против которых существующие противомикробные средства не эффективны. В частности, грамположительные бактерии представляют серьезную проблему лечения. Врачи во всем мире столкнулись с тем, что устойчивая к метициллину Staphylococcus aureus (MRSA), устойчивая к ванкомицину Enterococci (VRE) и устойчивая к гликопептиду Staphylococcus aureus (GRSA) больше не являются объектами научного любопытства, а являются опасными для жизни. 'Суперинфекты' никуда не исчезли, и в дополнение к ряду мер по контролю распространения устойчивости к лекарственным средствам по-прежнему необходимы скоординированные усилия в разработке новых антибиотиков для контроля опасных для жизни бактериальных инфекций. Такая возрастающая устойчивость к нескольким лекарственным средствам в последнее время вызвала интерес к поиску нового структурного класса антибиотиков, которые убивают или ингибируют рост этих бактерий. Смотри Chemical Reviews, "Antibiotic Resistance", 105 (2), February 2005.
Оксазолидиноны представляют собой класс противомикробных средств с уникальным механизмом ингибирования синтеза бактериального белка. Они ингибируют образование рибосомального инициаторного комплекса, включающего 30S и 50S рибосомы, приводя к предотвращению образования инициаторного комплекса на стадии белкового синтеза. Благодаря действию такого уникального механизма эти соединения активны против патогенов, устойчивых к другим клинически применимым антибиотикам.
Некоторые патентные публикации раскрывают оксазолидиноны как противомикробные средства. Например, РСТ публикации с номерами WO 93/09103, WO 93/023384, WO 97/030995, WO 99/064417, WO 00/29396, WO 01/94342, WO 01/081350, WO 02/81469, WO 02/81470, WO 02/02095, WO 03/072553, WO 03/006447, WO 03/07870, WO 03/08389, WO 03/97059, WO 04/045616, WO 04/056817, WO 04/056818, WO 04/14392, WO 04/009587, WO 04/018439A1, WO 05/058886, WO 05/082897, WO 05/116024, WO 05/116021, WO 05/082900, WO 05/003087, WO 06/043121 и WO 09/001192, патенты США №№6689779, 5565571, 5801246, 5756732, 5654435 и 5654428, заявка на европейский патент №1130016 и заявки на патенты Китая №№1510032 и 1749256 раскрывают оксазолидиноновые соединения, обладающие противомикробной активностью и применимые как противомикробные средства.
Некоторые последние публикации, такие как WO 07/114326, патентный документ США №07/0155798, WO 07/040326, WO 07/095784, WO 07/000432, WO 07/004037 и WO 07/093904, раскрывают фенилоксазолидиноновые производные как противомикробные средства. WO 06/109056, WO 06/035283, WO 03/072553, WO 03/064415 раскрывают гетеробициклические замещенные фенилоксазолидиноны как противомикробные средства. WO 96/35691 и WO 00/073301 раскрывают бициклические оксазолидиноны как противомикробные средства. WO 02/064547 раскрывает пиридоарилфенильные оксазолидиноны как противомикробные средства. WO 04/033451, WO 04/089943, WO 05/005422 и WO 05/005399 раскрывают бицикло[3.1.0]гексил-фенил-оксазолидиноновые производные, применимые для лечения бактериальных инфекций. РСТ публикация WO 07/082910 раскрывает дикарбонильные соединения, обладающие противомикробной активностью. Недавняя заявка на патент Китая №101434584 раскрывает фенилоксазолидиноны с глицинильными замещениями, обладающие противомикробной активностью.
Линезолид (продаваемый под товарным знаком Zyvox®), первый оксазолидинон, получивший разрешение контролирующего органа, стал важным клиническим выбором в лечении тяжелых грамположительных бактериальных инфекций, включая вызванные устойчивыми к нескольким лекарственным средствам патогенами, такими как MRSA и VRE (смотри WO 95/07272). Несмотря на высокий антибиотический потенциал и уникальный способ действия, никакая другая молекула из оксазолидинонового класса, за исключением линезолида, не может отвечать клиническим требованиям. Более того, развитие устойчивости к антибиотику является неизбежным, и линезолид не стал исключением. (Смотри, Mutnick, A.H.; Enne, V.; Jones, R.N. Ann. Pharmacother., 2003, 37, 769-774). Более того, из-за миелосупрессии линезолид не подходит для длительной терапии, хотя встречаются случаи, когда пациенты, принимающие линезолид более двух лет, не испытывают серьезных побочных эффектов. (Смотри, Hutchinson, D.K. Expert Opin. Ther. Patents 2004, 14, 1309-1328). У линезолида и его аналогов (оксазолидиноны первого поколения) обычно ограничен их противомикробный спектр только к грамположительным патогенам. Расширенный спектр и увеличенная эффективность более поздних оксазолидинонов второго поколения с активностью против грамотрицательных патогенов может расширить применимость этого класса за пределы больницы для лечения внебольничных инфекций. Таким образом, существует постоянная потребность в разработке более эффективных и безопасных соединений. Соединения данного изобретения являются новыми, ни одно из них ранее не упоминалось в уровне техники. Новые соединения Формулы I по данному изобретению обладают улучшенной эффективностью, в частности, повышенной активностью против бактериальных инфекций, заметной биодоступностью, пониженными сопутствующими побочными эффектами, хорошей растворимостью и легко могут быть выполнены в составах.
Краткое описание данного изобретения
Данное изобретение относится к новым фенилоксазолидинонам Формулы I,
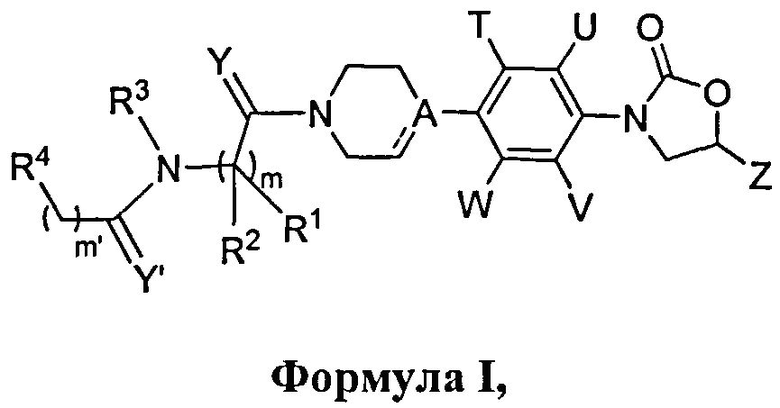
их фармацевтически приемлемым производным, таутомерным формам, стереоизомерам, включая R и S изомеры, полиморфам, пролекарствам, метаболитам, их солям или сольватам, где:
'---' представляет собой независимо одинарную связь или отсутствует;
когда '---'представляет собой одинарную связь, 'А' представляет атом углерода, и
когда '---' отсутствует, 'А' представляет собой СН или N;
Y и Y′ являются одинаковыми или различными и независимо представляют О или S;
R1 и R2 являются одинаковыми или различными и независимо представляют водород, галоген, C1-12алкил, C2-12алкенил, C2-12алкинил, C1-12галоалкил, C2-12галоалкенил, C2-12галоалкинил, C1-12алкокси, C1-12галоалкокси, C1-6алкоксиC1-С6алкил, С1-С6алкоксиС1-С6алкоксиС1-С3алкил, С3-С20циклоалкил, гетероциклил, арил, гетероарил, -(CH2)n-циклоалкил, -(CH2)n-гетероциклил, -(CH2)n-арил, -(CH2)n-гетероарил, -(CH2)nC(=Y)NR5R6, -(CH2)nC(=Y)OR5, -(CH2)nNR5R6, -(CH2)nOC(=Y)R5, -(CH2)nOC(=Y)OR5, -(CH2)nOC(=Y)NR5R6, -(CH2)nN(R5)C(=Y)OR6, -(CH2)nN(R5)C(=Y)NR5R6, -(CH2)nNR5C(=Y)R6, -(CH2)nC(=Y)R5, -(CH2)nYR5 (где каждая метиленовая группа может быть замещена одним или более атомами галогена), -C(=Y)NR5R6, -OC(=Y)R5, -OC(=Y)NR5R6, -C(=Y)OR5, -OR5, -ОС(=Y)OR5, -SR5, -NO2, -NR5R6, -N(R5)C(=Y)R6, -N(R5)-C(=Y)OR6 или -N(R5)C(=Y)NR5R6, каждый из которых может быть факультативно замещенным в любом приемлемом положении одним или более заместителями Ra; или
R1 и R2 могут вместе с атомом углерода, к которому они присоединены, образовывать 3-10-членное моноциклическое кольцо, частично ненасыщенное или насыщенное, которое может содержать от одного до трех гетероатомов, независимо выбранных из О, S или N; кольцо, таким образом образованное, может быть слитым с один или двумя кольцами, независимо выбранными из группы, содержащей арильное кольцо, циклоалкильное кольцо, гетероциклильное кольцо или моноциклическое гетероарильное кольцо; кольцо, таким образом образованное, может быть факультативно замещенным в любом приемлемом положении одним или более заместителями Ra;
R3 представляет водород, С1-12алкил, С2-12алкенил, С2-12алкинил, С1-12галоалкил, С2-12галоалкенил, С2-12галоалкинил, C1-C6алкоксиC1-C6алкил, C1-C6алкоксиC1-C6алкоксиC1-C3алкил, C3-20циклоалкил, гетероциклил, арил, гетероарил, -(CH2)n-циклоалкил, -(CH2)n-гетероциклил, -(CH2)n-арил, -(CH2)n-гетероарил, -(CH2)nYR5, -(CH2)nC(=Y)R5, -(CH2)nNR5R6, -(CH2)nC(=Y)NR5R6, -(CH2)nC(=Y)OR5, -(CH2)nOC(=Y)R5, -(CH2)nOC(=Y)OR5, -(CH2)nNR5C(=Y)R6, -(CH2)nN(R5)C(=Y)OR6, -(CH2)nN(R5)C(=Y)NR5R6, -(CH2)nOC(=Y)NR5R6 или -(CH2)nN(R5)C(=Y)NR5R6, (где каждая метиленовая группа может быть замещенной одним или более атомами галогена), каждый из которых может быть факультативно замещенным в любом приемлемом положении одним или более заместителями Ra;
R4 представляет арил, гетероарил или C(=Y)R5, каждый из которых может быть факультативно замещенным в любом приемлемом положении одним или более заместителями Ra;
при условии, что когда m равно 2 или 3, тогда R4 не может быть фенилом, замещенным заместителями, выбранными из -ОН, -OC1-4алкила, -NH2, аминоацила, -CH2-NH2 и аминоацилалкила;
Z представляет С2-12алкенил, С2-12алкинил, С2-12галоалкенил, С2-12галоалкинил, С1-12галоалкокси, C1-C6алкоксиC1-C6алкоксиC1-C3алкил, С3-20циклоалкил, гетероциклил, арил, гетероарил, -(CH2)n-циклоалкил, -(CH2)n-гетероциклил, -(CH2)n-арил, -(CH2)n-гетероарил, -(CH2)n-NCS, -C(=Y)R5, -C(=Y)OR6, -C(=Y)NR5R6, -OC(=Y)OR5, -(CH2)nOP(=O)R5R6, -(CH2)nNHP(=O)R5R6, -(CH2)nOC(=Y)R5, -(CH2)nC(=Y)R5, -(CH2)nC(=Y)NR5R6 или -(CH2)nC(=Y)OR5 (где каждая метиленовая группа может быть замещена одним или более атомами галогена), каждый из которых может быть факультативно замещенным в любом приемлемом положении одним или более заместителями Ra;
Т, U, V и W являются одинаковыми или различными, и независимо представляют водород или галоген;
R5 и R6 являются одинаковыми или различными, и независимо выбраны из водорода, C1-12алкила, C1-12алкенила, C2-12алкинила, C1-C12галоалкила, C2-12галоалкенила, C1-12галоалкинила, C3-8циклоалкила, гетероциклила, арила, гетероарила, арилокси, -(CH2)n-циклоалкила, -(CH2)n-гетероциклила, -(CH2)n-арила, -(CH2)n-гетероарила, каждый из которых может быть факультативно замещенным в любом приемлемом положении галогеном, гидроксилом, C1-12алкилом, C2-12алкенилом, C2-12алкинилом, C1-12алкокси, C1-12алкилкарбонилом, C1-12алкоксикарбонилом, C3-8циклоалкилом, C1-12галоалкилом, C1-12галоалкокси, C1-12галоалкенилом, арилом, гетероциклилом, гетероарилом, -(CH2)n-арилом, -(CH2)n-гетероциклилом, -(CH2)n-гетероарилом, -(CH2)n-циклоалкилом, -CN, -OR7, -NO2, -NR7R8, -N(R7)C(=Y)R8, -N(R7)C(=Y)OR8, -N(R7)C(=Y)NR7R8, -C(=Y)R7, -C(=Y)NR7R8, -OC(=Y)R7, -OC(=Y)NR7R8, -C(=Y)OR7, -OC(=Y)OR7, -SR7, -S(O)dR7, -SO2NR7R8, -NR7SO2R8, -OP(=O)R7R8, -NHP(=O)R7R8 или -P(=O)R7R8; или R5 и R6 могут быть соединены вместе с гетероатомом, к которому они присоединены, для образования гетероциклического или гетероарильного кольца, которое может дополнительно включать от одного до трех гетероатомов, независимо выбранных из О, S или N, причем образованное кольцо факультативно может быть замещено одним или более заместителями, выбранными из водорода, галогена, C1-12алкила, C2-12алкенила, C2-12алкинила, C1-12галоалкила, C2-12галоалкенила, C2-12галоалкинила, C1-12алкокси, C1-12галоалкокси, C1-C6алкоксиC1-C6алкила, C1-C6алкоксиC1-C6алкоксиC1-C3алкила, C3-8циклоалкила, гетероциклила, арила, гетероарила, -(CH2)n-циклоалкила, -(CH2)n-гетероциклила, -(CH2)n-арила, -(CH2)n-гетероарила, -C1-12алкилкарбонила, -C1-12алкоксикарбонила, -CN, -OR7, -CF3, -OCF3, -CH2CF3, -CF2CF3, -NO2, -NR7R8, -N(R7)C(=Y)R8, -N(R7)C(=Y)OR8, -N(R7)C(=Y)NR7R8, -C(=Y)R7, -C(=Y)NR7R8, -OC(=Y)R7, -OC(=Y)NR7R8, -OC(=Y)OR7, -C(=Y)OR7, -SR7, -S(O)dR7, -SO2NR7R8; -NR7SO2R8, -OP(=O)R7R8, -NHP(=O)R7R8 или -P(O)R7R8; кольцо, таким образом образованное, дополнительно может быть слито с 3-7-членным ненасыщенным или насыщенным кольцом, которое может содержать от одного до трех гетероатомов, независимо выбранных из О, S или N, слитое кольцо факультативно может быть замещено в любом приемлемом положении одним или более заместителями Ra;
Ra независимо выбран из водорода, галогена, C1-12алкила, C2-12алкенила, C2-12алкинила, C1-12галоалкила, C2-12галоалкенила, C2-12галоалкинила, оксо, C1-12алкокси, C1-C6алкоксиC1-C6алкила, C1-C6алкоксиC1-C6алкоксиC1-C3алкила, C1-12галоалкокси, C3-8циклоалкила, гетероциклила, арила, гетероарила, -(CH2)n-циклоалкила, -(CH2)n-гетероциклила, -(CH2)n-арила, -(CH2)n-гетероарила, -C1-12алкилкарбонила, -C1-12алкоксикарбонила, -CN, -YR7, -(CH2)nYR7, -NO2, =NOR7, -NR7R8, -N(R7)C(=Y)R8, -N(R7)C(=Y)OR8, -N(R7)C(=Y)NR7R8, -C(=Y)R7, -C(=Y)NR7R8, -OC(=Y)R7, -OC(=Y)NR7R8, -C(=Y)OR7, -OC(-Y)OR7, -SR7, -S(O)dR7, -SO2NR7R8, -OP(=O)R7R8, -NHP(=O)R7R8, -P(O)R7R8, -(CH2)nCN, -YR7, -(CH2)nYR7, -NO2, =NOR7, -(CH2)nNR7R8, -(CH2)nN(R7)C(=Y)R8, -(CH2)nN(R7)C(=Y)OR8, -(CH2)nN(R7)C(=Y)NR7R8, -(CH2)nC(=Y)R7, -(CH2)nC(=Y)NR7R8, -(CH2)nOC(=Y)R7, -(CH2)nOC(=Y)NR7R8, -(CH2)nC(=Y)OR7, -(CH2)nOC(=Y)OR7, -(CH2)nSR7, -(CH2)nS(O)dR7, - (CH2)nSO2NR7R8, -(CH2)nOP(=O)R7R8, -(CH2)nNHP(=O)R7R8 или -(CH2)nP(O)R7R8; каждый из которых факультативно может быть замещенным в любом приемлемом положении одним или более заместителями, выбранными из водорода, галогена, C1-12алкила, C2-12алкенила, C2-12алкинила, C1-12галоалкила, C2-12галоалкенила, C2-12галоалкинила, оксо, C1-C12алкокси, C1-12галоалкокси, C1-C6алкоксиC1-C6алкила, C1-C6алкоксиC1-C6алкоксиC1-C3алкила, С3-8циклоалкила, гетероциклила, арила, гетероарила, -(CH2)n-циклоалкила, -(CH2)n-гетероциклила, -(CH2)n-арила, -(CH2)n-гетероарила, -C1-C12алкилкарбонила, -C1-C12алкоксикарбонила, -CN, -OR9, -(CH2)nOR9, -CF3, -NO2, -NR9R10, -N(R9)C(=Y)R10, -N(R9)C(=Y)OR10, -N(R9)C(=Y)NR9R10, -C(=Y)R9, -C(=Y)NR9R10, -OC(=Y)R9, -OC(=Y)NR9R10, -OC(=Y)OR9, -C(=Y)OR9, -SR9, -S(O)dR9, -SO2NR9R10; -NR9SO2R10, -OP(=O)R9R10, -NHP(=O)R9R10, -P(O)R9R10, -(CH2)nCN, -OR9, -(CH2)nOR9, -CF3, -NO2, -(CH2)nNR9R10, -(CH2)nN(R9)C(=Y)Rl0, -(CH2)nN(R9)C(=Y)OR10, -(CH2)nN(R9)C(=Y)NR9R10, -(CH2)nC(=Y)R9, -(CH2)nC(=Y)NR9R10, -(CH2)nOC(=Y)R9, -(CH2)nOC(=Y)R9R10, -(CH2)nOC(=Y)OR9, -(CH2)nC(=Y)OR9, -(CH2)nSR9, -(CH2)nS(O)dR9, -(CH2)nSO2NR9R10; -(CH2)nNR9SO2Rl0, -(CH2)nOP(=O)R9R10, -(CH2)nNHP(=O)R9R10 или -(CH2)nP(O)R9R10;
R7 и R8 независимо выбраны из водорода, C1-12алкила, C2-12алкенила, C2-12алкинила, C1-12галоалкила, C2-12галоалкенила, C3-8циклоалкила, гетероциклила, арила, гетероарила, -(CH2)n-циклоалкила, -(CH2)n-гетероциклила, -(CH2)n-арила или -(CH2)n-гетероарила, каждый из которых может быть факультативно замещенным галогеном, гидроксилом или С1-6алкокси, или R7 и R8 могут быть соединены вместе с гетероатомом, к которому они присоединены, для образования гетероциклического или гетероарильного кольца, которое может содержать от одного до трех гетероатомов, независимо выбранных из О, S или N, каждый из которых может быть факультативно замещенным галогеном, гидроксилом, С1-6 алкилом или С1-6алкокси;
R9 и R10 независимо выбраны из водорода, С1-12алкила, С2-12алкенила, С2-12алкинила, С1-12галоалкила, С2-12галоалкенила, С3-8циклоалкила, гетероциклила, арила, гетероарила, -(CH2)n-циклоалкила, -(CH2)n-гетероциклила, -(CH2)n-арила или -(CH2)n-гетероарила, каждый из которых может быть факультативно замещенным галогеном, гидроксилом или C1-6алкокси, или R9 и R10 могут быть соединены вместе с гетероатомом, к которому они присоединены, для образования гетероциклического или гетероарильного кольца, которое может содержать от одного до трех гетероатомов, независимо выбранных из О, S или N, каждый из которых может быть факультативно замещенным галогеном, гидроксилом, С1-6 алкилом или С1-6алкокси;
m представляет собой 1, 2, 3 или 4;
m′ представляет собой 0, 1, 2, 3 или 4;
n представляет собой 1, 2, 3 или 4;
d представляет собой 1 или 2.
Другой аспект данного изобретения обеспечивает способы приготовления новых соединений Формулы I или их фармацевтически приемлемых производных, таутомерных форм, стереоизомеров, включая R и S изомеры, полиморфов, пролекарств, метаболитов, их солей или сольватов.
Следующий аспект данного изобретения обеспечивает фармацевтические композиции, включающие соединения Формулы I или их фармацевтически приемлемые производные, таутомерные формы, стереоизомеры, включая R и S изомеры, полиморфы, пролекарства, метаболиты, соли или сольваты их, в комбинации с одним или более фармацевтически приемлемым носителем(носителями).
Другой аспект данного изобретения заключается в обеспечении способов применения соединений Формулы I данного изобретения или композиций, содержащих соединения Формулы I, для оказания помощи, такой как профилактика, облегчение и/или лечение болезни(болезней)/ нарушения(нарушений), особенно вызванных микробными инфекциями, которые включают введение субъекту, нуждающемуся в этом, соединений Формулы I или композиций, содержащих фармацевтически эффектное количество соединений Формулы I.
Еще один аспект данного изобретения заключается в применении соединений Формулы I как противомикробных средств, эффективных против ряда аэробных и/или анаэробных грамположительных и/или грамотрицательных патогенов, таких как устойчивые к нескольким лекарственным средствам виды Staphylococcus, Streptococcus, Enterococcus, Bacterioides, Clostridia, H. influenza, Moraxella, кислотоустойчивых организмов, таких как Mycobacterium tuberculosis, а также устойчивых к линезолиду видов Staphylococcus и Enterococcus.
В другом аспекте данное изобретение обеспечивает способ для лечения грамположительных и/или грамотрицательных патогенов у млекопитающего путем введения терапевтически эффектного количества соединения Формулы I или фармацевтически приемлемой соли.
Данное изобретение также охватывает пролекарства и активные метаболиты соединений Формулы I.
Следующие аспекты данного изобретения будут изложены в следующем описании, и частично будут понятны из описания, или могут быть выяснены осуществлением данного изобретения.
Детальное описание изобретения
Данное изобретение относится к новым фенилоксазолидинонам Формулы I,
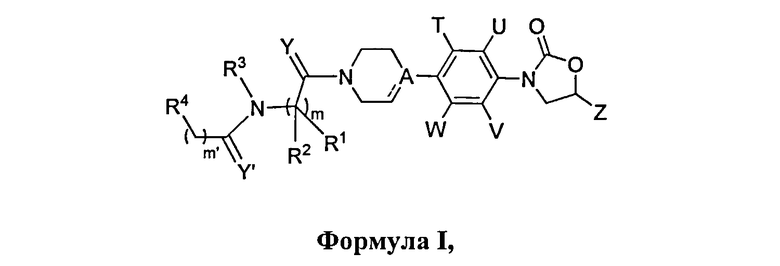
их фармацевтически приемлемым производным, таутомерным формам, стереоизомерам, включая R и S изомеры, полиморфам, пролекарствам, метаболитам, солям или сольватам их, где:
'---' представляет собой независимо одинарную связь или отсутствует;
когда '---'представляет собой одинарную связь, 'А' представляет атом углерода, и
когда '---'отсутствует, 'A' представляет собой СН или N;
Y и Y′ являются одинаковыми или различными и независимо представляют О или S;
R1 и R2 являются одинаковыми или различными, и независимо представляют водород, галоген, С1-12алкил, С2-12алкенил, С2-12алкинил, С1-12галоалкил, С2-12галоалкенил, С2-12галоалкинил, С1-12алкокси, С1-12галоалкокси, C1-C6алкоксиС1-С6алкил, C1-C6алкоксиC1-C6алкоксиC1-C3алкил, С3-20циклоалкил, гетероциклил, арил, гетероарил, -(CH2)n-циклоалкил, -(CH2)n-гетероциклил, -(CH2)n-арил, -(CH2)n-гетероарил, -(CH2)nC(=Y)NR5R6, -(CH2)nC(=Y)OR5, -(CH2)nNR5R6, -(CH2)nOC(=Y)R5, -(CH2)nOC(=Y)OR5, -(CH2)nOC(=Y)NR5R6, -(CH2)nN(R5)C(=Y)OR6, -(CH2)nN(R5)C(=Y)NR5R6, -(CH2)nNR5C(=Y)R6, -(CH2)nC(=Y)R5, -(CH2)nYR5 (где каждая метиленовая группа может быть замещенной одним или более атомами галогена), -C(=Y)NR5R6, -OC(=Y)R5, -OC(=Y)NR5R6, -C(=Y)OR5, -OR5, -OC(=Y)OR5, -SR5, -NO2, -NR5R6, -N(R5)C(=Y)R6, -N(R5)-C(=Y)OR6 или -N(R5)C(=Y)NR5R6, каждый из которых может быть факультативно замещенным в любом приемлемом положении одним или более заместителями Ra; или
R1 и R2 могут вместе с атомом углерода, к которому они присоединены, образовывать 3-10-членное моноциклическое кольцо, частично ненасыщенное или насыщенное, которое может содержать от одного до трех гетероатомов, независимо выбранных из О, S или N; причем кольцо, таким образом образованное, может быть слитое с одним или двумя кольцами, независимо выбранными из группы, включающей арильное кольцо, циклоалкильное кольцо, гетероциклильное кольцо или моноциклическое гетероарильное кольцо; кольцо, таким образом образованное, может быть факультативно замещенным в любом приемлемом положении одним или более заместителями Ra;
R3 представляет водород, С1-12алкил, С2-12алкенил, С2-12алкинил, С1-12галоалкил, С2-12галоалкенил, С2-12галоалкинил, C1-C6алкоксиC1-C6алкил, C1-C6алкоксиC1-C6 алкоксиC1-C3алкил, С3-20циклоалкил, гетероциклил, арил, гетероарил, -(СН2)n-циклоалкил, -(CH2)n-гетероциклил, -(CH2)n-арил, -(CH2)n-гетероарил, -(CH2)nYR5, -(CH2)nC(=Y)R5, -(CH2)nNR5R6, -(CH2)nC(=Y)NR5R6, -(CH2)nC(=Y)OR5, -(CH2)nOC(=Y)R5, -(CH2)nOC(=Y)OR5, -(CH2)nNR5C(=Y)R6, -(CH2)nN(R5)C(=Y)OR6, -(CH2)nN(R5)C(=Y)NR5R6, -(CH2)nOC(=Y)NR5R6 или -(CH2)nN(R5)C(=Y)NR5R6, (где каждая метиленовая группа может быть замещенной одним или более атомами галогена), каждый из которых может быть факультативно замещенным в любом приемлемом положении одним или более заместителями Ra;
R4 представляет арил, гетероарил или C(=Y)R5, каждый из которых может быть факультативно замещенным в любом приемлемом положении одним или более заместителями Ra;
при условии, что когда m равно 2 или 3, тогда R4 не может быть фенилом, замещенным заместителями, выбранными из -ОН, -ОС1-4алкила, -NH2, аминоацила, -CH2-NH2 и аминоацилалкила;
Z представляет C2-12алкенил, C2-12алкинил, C2-12галоалкенил, C2-12галоалкинил, C1-C12галоалкокси, C1-С6алкоксиC1-С6алкоксиC1-C3алкил, C3-20циклоалкил, гетероциклил, арил, гетероарил, -(CH2)n-циклоалкил, -(CH2)n-гетероциклил, -(CH2)n-арил, -(CH2)n-гетероарил, -(CH2)n-NCS, -C(=Y)R5, -C(=Y)OR6, -C(=Y)NR5R6, -OC(=Y)OR5, -(CH2)nOP(=O)R5R6, -(CH2)nNHP(=O)R5R6, -(CH2)nOC(=Y)OR5, -(CH2)nC(=Y)R5, -(CH2)nC(=Y)NR5R6 или -(CH2)nC(=Y)OR5 (где каждая метиленовая группа может быть замещена одним или более атомами галогена), каждый из которых может быть факультативно замещенным в любом приемлемом положении одним или более заместителями Ra;
Т, U, V и W являются одинаковыми или различными и независимо представляют водород или галоген;
R5 и R6 являются одинаковыми или различными, и независимо выбраны из водорода, C1-12алкила, C2-12алкенила, C2-12алкинила, C1-12галоалкила, C2-12галоалкенила, C2-12галоалкинила, С3-8циклоалкила, гетероциклила, арила, гетероарила, арилокси, -(CH2)n-циклоалкила, -(CH2)n-гетероциклила, -(CH2)n-арила, -(CH2)n-гетероарила, каждый из которых может быть факультативно замещенным в любом приемлемом положении галогеном, гидроксилом, C1-12алкилом, C2-12 алкенилом, C2-12алкинилом, C1-12алкокси, C1-12алкилкарбонилом, C1-12алкоксикарбонилом, C3-8циклоалкилом, C1-12галоалкилом, C1-12галоалкокси, C2-12галоалкенилом, арилом, гетероциклилом, гетероарилом, -(CH2)n-арилом, -(CH2)n-гетероциклилом, -(CH2)n-гетероарилом, -(CH2)n-циклоалкилом, -CN, -OR7, -NO2, -NR7R8, -N(R7)C(=Y)R8, -N(R7)C(=Y)OR8, -N(R7)C(=Y)NR7R8, -C(=Y)R7, -C(=Y)NR7R8, -OC(=Y)R7, -OC(=Y)NR7R8, -C(=Y)OR7, -OC(=Y)OR7, -SR7, -S(O)dR7, -SO2NR7R8, -NR7SO2R8, -OP(=O)R7R8, -NHP(=O)R7R8 или -P(=O)R7R8; или R5 и R6 могут быть соединены вместе с гетероатомом, к которому они присоединены, для образования гетероциклического или гетероарильного кольца, которое может дополнительно включать от одного до трех гетероатомов, независимо выбранных из О, S или N, причем образованное кольцо факультативно может быть замещено одним или более заместителями, выбранными из водорода, галогена, C1-12алкила, С2-12алкенила, C2-12алкинила, C1-12галоалкила, C2-12галоалкенила, C2-12галоалкинила, C1-С12алкокси, C1-12галоалкокси, C1-С6алкоксиC1-C6алкила, C1-С6алкоксиC1-C6алкоксиC1-C3алкила, C3-8циклоалкила, гетероциклила, арила, гетероарила, -(CH2)n-циклоалкила, -(CH2)n-гетероциклила, -(CH2)n-арила, -(CH2)n-гетероарила, -C1-12алкилкарбонила, -C1-12алкоксикарбонила, -CN, -OR7, -CF3, -OCF3 -CH2CF3, -CF2CF3, -NO2, -NR7R8, -N(R7)C(=Y)R8, -N(R7)C(=Y)OR8, -N(R7)C(=Y)NR7R8, -C(=Y)R7, -C(=Y)NR7R8, -OC(=Y)R7, -OC(=Y)NR7R8, -OC(=Y)OR7, -C(=Y)OR7, -SR7, -S(O)dR7, -SO2NR7R8; -NR7SO2R8, -OP(=O)R7R8, -NHP(=O)R7R8 или -P(O)R7R8; кольцо, таким образом образованное, дополнительно может быть слито с 3-7 членным ненасыщенным или насыщенным кольцом, которое может содержать от одного до трех гетероатомов, независимо выбранных из О, S или N, причем слитое кольцо факультативно может быть замещено в любом приемлемом положении одним или более заместителями Ra;
Ra независимо выбран из водорода, галогена, C1-12алкила, C2-12алкенила, C2-12алкинила, C1-12галоалкила, C2-12галоалкенила, C2-12галоалкинила, оксо, C1-12алкокси, C1-C6алкоксиC1-C6алкила, C1-C6алкоксиC1-C6алкоксиC1-C3алкила, C1-12галоалкокси, C3-8циклоалкила, гетероциклила, арила, гетероарила, -(CH2)n-циклоалкила, -(CH2)n-гетероциклила, -(CH2)n-арила, -(CH2)n-гетероарила, -C1-12алкилкарбонила, -C1-12алкоксикарбонила, -CN, -YR7, -(CH2)nYR7, -NO2, =NOR7, -NR7R8, -N(R7)C(=Y)R8, -N(R7)C(=Y)OR8, -N(R7)C(=Y)NR7R8, -C(=Y)R7, -C(=Y)NR7R8, -OC(=Y)R7, -OC(=Y)NR7R8, -C(=Y)OR7, -OC(=Y)OR7, -SR7, -S(O)dR7, -SO2NR7R8, -OP(=O)R7R8, -NHP(=O)R7R8, -P(O)R7R8, -(CH2)nCN, -YR7, -(CH2)nYR7, -NO2, =NOR7, -(CH2)nNR7R8, -(CH2)nN(R7)C(=Y)R8, -(CH2)nN(R7)C(=Y)OR8, -(CH2)nN(R7)C(=Y)NR7R8, -(CH2)nC(=Y)R7, -(CH2)nC(=Y)NR7R8, -(CH2)nOC(=Y)R7, -(CH2)nOC(=Y)NR7R8, -(CH2)nC(=Y)OR7, -(CH2)nOC(=Y)OR7, -(CH2)nSR7, -(CH2)nS(O)dR7, -(CH2)nSO2NR7R8, -(CH2)nOP(=O)R7R8, -(CH2)nNHP(=O)R7R8 или -(CH2)nP(O)R7R8; каждый из которых факультативно может быть замещенным в любом приемлемом положении одним или более заместителями, выбранными из водорода, галогена, C1-12алкила, C2-12алкенила, C2-12алкинила, C1-12галоалкила, C2-12галоалкенила, C2-12галоалкинила, оксо, C1-C12алкокси, C1-12галоалкокси, C1-C6алкоксиC1-С6алкила, C1-C6алкоксиC1-C6алкоксиC1-C3алкила, С3-8циклоалкила, гетероциклила, арила, гетероарила, -(CH2)n-циклоалкила, -(CH2)n-гетероциклила, -(CH2)n-арила, -(CH2)n-гетероарила, -C1-12алкилкарбонила, -C1-12алкоксикарбонила, -CN, -OR9, -(CH2)nOR9, -CF3, -NO2, -NR9R10, -N(R9)C(=Y)R10, -N(R9)C(=Y)OR10, -N(R9)C(=Y)NR9R10, -C(=Y)R9, -C(=Y)NR9R10, -OC(=Y)R9, -OC(=Y)NR9R10, -OC(=Y)OR9, -C(=Y)OR9, -SR9, -S(O)dR9, -SO2NR9R10; -NR9SO2R10, -OP(=O)R9R10, -NHP(=O)R9R10, -P(O)R9R10, -(CH2)nCN, -OR9, -(CH2)nOR9, -CF3, -NO2, -(CH2)nNR9R10, -(CH2)nN(R9)C(=Y)R10, -(CH2)nN(R9)C(=Y)OR10, -(CH2)nN(R9)C(=Y)NR9R10, -(CH2)nC(=Y)R9, -(CH2)nC(=Y)NR9R10, -(CH2)nOC(=Y)R9, -(CH2)nOC(=Y)NR9R10, -(CH2)nOC(=Y)OR9, -(CH2)nC(=Y)OR9, -(CH2)nSR9, -(CH2)nS(O)dR9, -(CH2)nSO2NR9R10; -(CH2)nNR9SO2R10, -(CH2)nOP(=O)R9R10, -(CH2)nNHP(=O)R9R10 или -(CH2)nP(O)R9R10;
R7 и R8 независимо выбраны из водорода, C1-12алкила, C2-12алкенила, C2-12алкинила, C1-12галоалкила, C2-12галоалкенила, C3-8циклоалкила, гетероциклила, арила, гетероарила, -(CH2)n-циклоалкила, -(CH2)n-гетероциклила, -(CH2)n-арила или -(CH2)n-гетероарила, каждый из которых может быть факультативно замещенным галогеном, гидроксилом или C1-6алкокси, или R7 и R8 могут быть соединены вместе с гетероатомом, к которому они присоединены, для образования гетероциклического или гетероарильного кольца, которое может содержать от одного до трех гетероатомов, независимо выбранных из О, S или N, каждый из которых может быть факультативно замещенным галогеном, гидроксилом, С1-6алкилом или С1-6алкокси;
R9 и R10 независимо выбраны из водорода, C1-12алкила, С2-12алкенила, С2-12алкинила, С1-12галоалкила, С2-12галоалкенила, С3-8циклоалкила, гетероциклила, арила, гетероарила, -(CH2)n-циклоалкила, -(CH2)n-гетероциклила, -(CH2)n-арила или -(CH2)n-гетероарила, каждый из которых может быть факультативно замещенным галогеном, гидроксилом или С1-6алкокси, или R9 и R10 могут быть соединены вместе с гетероатомом, к которому они присоединены, для образования гетероциклического или гетероарильного кольца, которое может содержать от одного до трех гетероатомов, независимо выбранных из О, S или N, каждое из которых может быть факультативно замещенным галогеном, гидроксилом, C1-6алкилом или C1-6алкокси;
m представляет собой 1, 2, 3 или 4;
m′ представляет собой 0, 1, 2, 3 или 4;
n представляет собой 1, 2, 3 или 4;
d представляет собой 1 или 2.
Один вариант осуществления данного изобретения обеспечивает соединения Формулы Ia, где
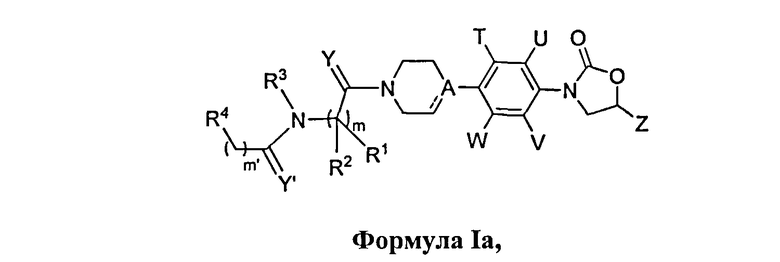
R1, R2, R3, R4, Y, Y′, A, T, U, V, W, Z, m, m′, a и a′ являются такими, как определено в данном документе;
их фармацевтически приемлемые производные, таутомерные формы, стереоизомеры, включая R и S изомеры, полиморфы, пролекарства, метаболиты, соли или сольваты их.
Другой вариант осуществления данного изобретения обеспечивает соединения Формулы Ib, где
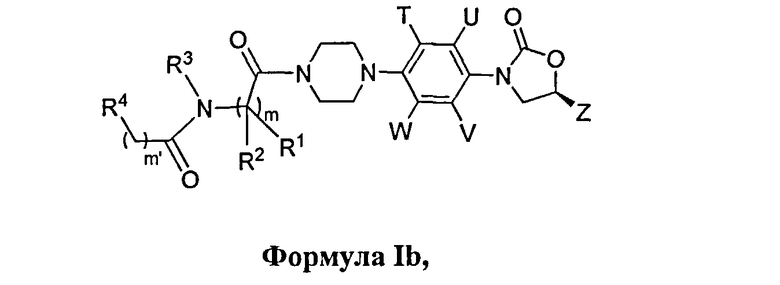
R1, R2, R3, R4, Т, U, V, W, Z, m, m′ являются такими, как определено в данном документе; их фармацевтически приемлемые производные, таутомерные формы, стереоизомеры, включая R и S изомеры, полиморфы, пролекарства, метаболиты, соли или сольваты их.
В другом варианте осуществления соединений данного изобретения R1 и R2 независимо выбраны из водорода, C1-12алкила, C2-12алкенила, C2-12алкинила, C3-8циклоалкила или арила, каждый из которых факультативно может быть замещенным в любом приемлемом положении одним или более заместителями Ra, или R1 и R2 вместе с атомом углерода, к которому они присоединены, образуют 3-10-членное моноциклическое кольцо, частично ненасыщенное или насыщенное, которое может содержать от одного до трех гетероатомов, независимо выбранных из О, S или N, причем кольцо, таким образом образованное, может быть слитое с одним или двумя кольцами, независимо выбранными из группы, содержащей арильное кольцо, циклоалкильное кольцо, гетероциклильное кольцо или моноциклическое гетероарилыюе кольцо; кольцо, таким образом образованное, может быть факультативно замещенным в любом приемлемом положении одним или более заместителями Ra.
В другом варианте осуществления соединения данного изобретения R3 выбран из водорода, C1-12алкила, С2-12алкенила или C2-12алкинила, каждый из которых может быть факультативно замещенным в любом приемлемом положении одним или более заместителями Ra.
В дополнительном варианте осуществления соединений данного изобретения предпочтительно, чтобы R4 был выбран из
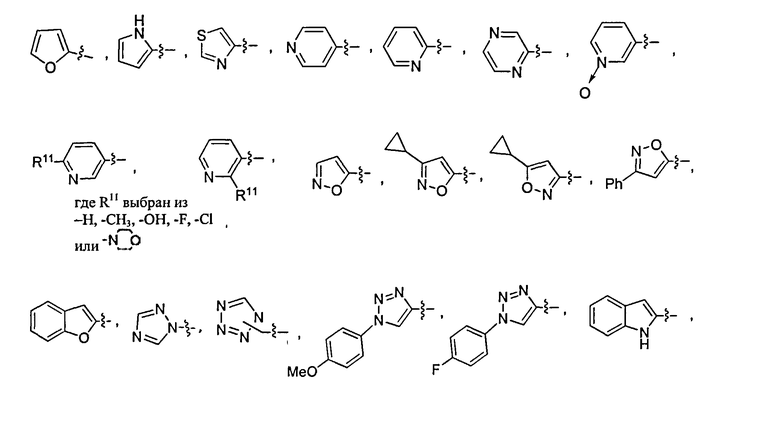
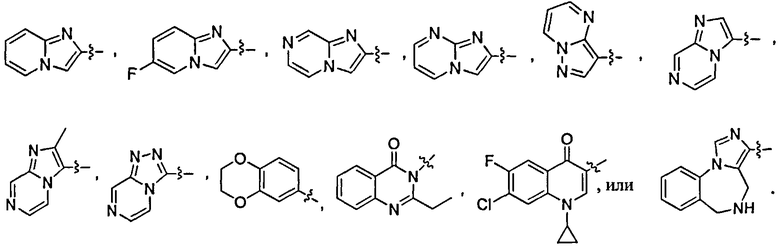
В дополнительном варианте осуществления соединений данного изобретения предпочтительно, чтобы Т и W независимо представляли фтор, a U и V оба представляли водород.
В другом варианте осуществления соединений данного изобретения m выбран из 1 или 2, и m′ представляет собой 0.
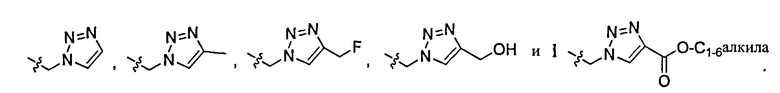
В другом варианте осуществления соединений данного изобретения Z представляет -CH2-триазол, который может быть факультативно замещенным в любом приемлемом положении одним или более заместителями Ra.
В дополнительном варианте осуществления соединений данного изобретения, предпочтительно, чтобы Z был выбран из
Определения
По отношению к вышеприведенному описанию оксазолидиноновых соединений данного изобретения применяются следующие определения.
Выражение "алкил", как используется в данном документе, относится к прямой или разветвленной углеводородной цепи, имеющей от 1 до 12 атомов углерода. Примеры алкила включают, но без ограничения, например, метил, этил, n-пропил, изопропил, n-бутил, n-пентил, t-бутил, и подобное. Эти группы далее могут быть замещены одним или более заместителями, выбранными из, но без ограничения, например, галогена, гидроксила, оксо, карбоксила, карбоксиалкила, азидо, циано, амино, нитро, алкенила, алкинила, алкокси, циклоалкила, ацил ацилокси, арила, гетероциклила и гетероарила.
Выражение "алкенил", как используется в данном документе, относится к алифатической углеводородной группе, включающей, по меньшей мере, одну углерод-углерод двойную связь, и которая может быть прямой или разветвленной углеводородной цепью, имеющей от 1 до 12 атомов углерода. Примеры алкенила включают, но без ограничения, например, этенил, 1-пропенил, 2-пропенил, изо-пропенил, 1-бутенил, 2-бутенил, и подобное. Эти группы далее могут быть замещены одним или более заместителями, выбранными из, но без ограничения, например, галогена, гидроксила, оксо, карбоксила, карбоксиалкила, азидо, циано, амино, нитро, алкенила, алкинила, алкокси, циклоалкила, ацил ацилокси, арила, гетероциклила и гетероарила.
Выражение "алкинил", как используется в данном документе, относится к прямой или разветвленной углеводородной группе, включающей, по меньшей мере, одну углерод-углерод тройную связь, и которая может быть прямой или разветвленной цепью, имеющей от 1 до 12 атомов углерода. Примеры алкинила включают, но без ограничения, например, этинил, пропинил и бутинил. Эти группы далее могут быть замещены одним или более заместителями, выбранными из, но без ограничения, например, галогена, гидроксила, оксо, карбоксила, карбоксиалкила, азидо, циано, амино, нитро, алкенила, алкинила, алкокси, циклоалкила, ацил ацилокси, арила, гетероциклила и гетероарила.
Выражение "алкокси" относится к определенной выше алкильной группе, соединенной через кислородную связь с остальной частью молекулы. Неограничивающие примеры таких групп включают -ОСН3, -OC2H5 и подобное.
"Галоген" относится к фтору, хлору, брому или йоду.
Выражение "галоалкил" относится к определенной выше "алкильной" группе, которая замещена одной или более "галогеновыми" группами, как определено в данном документе, на любом одном или более из 1-12 атомов углерода алкильной группы. Типичные примеры галоалкила включают, но без ограничения, хлорметил, фторметил, трифторметил, трихлорметил, дифторэтил, трифторэтил, дихлорэтил и подобное.
Выражение "галоалкенил" относится к определенной выше "алкенильной" группе, которая замещена одной или более "галогеновыми" группами, как определено в данном документе, на любом одном или более из атомов углерода алкенилыюй группы. Типичные примеры галоалкенила включают, но без ограничения, хлорэтенил, 2-фторэтенил, трифторбутенил и дихлорпропенил.
Выражение "галоалкинил" относится к определенной выше "алкинильной" группе, которая замещена одной или более "галогеновыми" группами, как определено в данном документе, на любом одном или более из атомов углерода алкинильной группы. Типичные примеры галоалкинила включают, но без ограничения, 2-фторэтинил, трифторбутинил и дихлорпропинил.
Выражение "галоалкокси" относится к определенной выше "галоалкильной" группе, присоединенной к исходной молекулярной части через атом кислорода.
Выражение "циклоалкил" относится к циклической алкильной группе, состоящей из 3-20 атомов углерода, имеющей отдельное циклическое кольцо или несколько конденсированных колец, например, слитые или спиро системы, если иное не заключено в определении. Такие циклоалкильные группы включают, в качестве примера, однокольцевые структуры, например, циклопропил, циклобутил, циклопентил, циклогексил, циклооктил и подобное, или многокольцевые структуры, например, адамантил и бицикло[2.2.1]гептан, или циклические алкильные группы, с которыми сливается арильная группа, например, индан и подобные. Циклоалкильные группы далее могут быть замещены одним или более заместителями, выбранными из, но без ограничения, например, галогена, гидроксила, оксо, карбокси, карбоксиалкила, азидо, алкенила, алкинила, алкокси, циклоалкила, ацил ацилокси, арила, гетероциклила, гетероарила.
Выражение "арил" в данном документе относится моно- или поли-карбоциклической ароматической группе, например, фенильное или нафтильное кольцо, и подобное, факультативно замещенной одним или более заместителями, выбранными из, но без ограничения, например, галогена, гидроксила, алкила, алкенила, алкинила, циклоалкила, алкокси, ацила, амино, арилокси, CF3, COORd (где Rd может быть водородом, алкилом, алкенилом, циклоалкилом, аралкилом, гетероциклилалкилом или гетероарилалкилом), циано, нитро, карбокси, гетероциклила, гетероарила, гетероциклилалкила или гетероарилалкила. Арильная группа факультативно может быть слита с циклоалкильной группой, гетероарильной группой, гетероциклильной группой или другой арильной группой. Слитая группа может быть далее замещена в любом приемлемом положении одним или более заместителями, выбранными из, но без ограничения, например, галогена, гидроксила, оксо, карбокси, амино, нитро, циано, карбоксиалкила, азидо, алкенила, алкинила, алкокси, циклоалкила, ацила, ацилокси, арила, гетероциклила, гетероарила.
Выражение "арилокси" относится к определенной выше арильной группе, присоединенной через кислородную связь к остальной части молекулы, например, -OPh, и подобное.
Выражение "гетероарил", если не указано иное, относится к ароматической моноциклической или полициклической кольцевой структуре, включающей от одного до четырех гетероатомов, независимо выбранных из N, О или S. Азотные гетероатомы факультативно могут быть окислены. Азотные атомы факультативно могут быть кватернизированными. "Гетероарил" также включает, но без ограничения, бициклические или трициклические кольца, где гетероарильное кольцо слито с одним или двумя кольцами, независимо выбранными из группы, включающей арильное кольцо, циклоалкильное кольцо, гетероциклильное кольцо и другое моноциклическое гетероарильное кольцо. Примеры гетероарильных групп включают, но без ограничения, оксазолил, имидазолил, пирролил, 1,2,3-триазолил, 1,2,4-триазолил, тетразолил, тиазолил, оксадиазолил, бензоимидазолил, тиадиазолил, пиридинил, пиридазинил, пиримидинил, тиенил, изоксазолил, триазинил, фуранил, бензофуранил, индолил, бензотиазолил, бензоксазолил, имидазо[1,2-α]пиримидин, имидазо[1,2-α]пиразин и подобное. Бициклические или трициклические гетероарильные кольца должны быть присоединены или через саму гетероарильную группу, или через арильную, циклоалкильную или гетероциклильную группу, с которой они слиты. Гетероарильная группа дополнительно может быть, кроме того, замещена в любом приемлемом положении одним или более заместителями, выбранными из, но без ограничения, например, галогена, гидроксила, оксо, карбокси, амино, нитро, циано, карбоксиалкила, азидо, алкенила, алкинила, алкокси, циклоалкила, циклоалкинила, ацил ацилокси, арила, гетероциклила, гетероарила.
Выражение "гетероциклил", если не указано иное, относится к неароматической моноциклической или полициклической циклоалкильной группе, полностью или частично ненасыщенной, включающей один или более гетероатомов, независимо выбранных из N, О или S. Гетероциклильное кольцо может быть слитым с другим циклоалкильным, арильным, гетероциклильным или гетер оарильным кольцом и факультативно является слитым с бензольным кольцом, или слитым гетероарилом 5-6 кольцевых членов, и/или факультативно замещенным, где заместители выбраны из, но без ограничения, галогена, гидроксила, алкила, алкенила, алкинила, циклоалкила, ацила, карбокси, арила, алкокси, аралкила, циано, нитро, амино, гетероциклила или гетероарила. Примеры гетероциклильных групп включают, но без ограничения, морфолинил, оксазолидинил, тетрагидрофуранил, дигидрофуранил, дигидропиридинил, дигидроизооксазолил, дигидробензофурил, азабициклогексил, дигидроиндонил, пиперидинил или пиперазинил. Слитая группа дополнительно может быть замещена в любом приемлемом положении одним или более заместителями, выбранными из, но без ограничения, например, галогена, гидроксила, оксо, карбокси, амино, нитро, циано, карбоксиалкила, азидо, алкенила, алкинила, алкокси, циклоалкила, ацил ацилокси, арила, гетероциклила, гетероарила. Гетероатомы азота и серы факультативно могут быть окислены. Азотные атомы факультативно могут быть кватернизированы.
"Гидрокси" или "гидроксил" относится к группе -OH.
Выражение "защитная группа" или "PG" относится к группе, которая находится в модифицированной форме для предотвращения нежелательных побочных реакций на защищенном участке. Выражение защитная группа, если не указано иное, может быть использовано для групп, например, гидроксила, амино, карбоксила, и примеры таких групп находятся в T.W. Greene. et al. "Protecting Groups in Organic Synthesis," 3rd Ed, Wiley, New York, которая включена в данный документ ссылкой. Виды используемых защитных групп для карбоксила, защитных групп для амино или защитных групп для гидроксила, не являются критическими, при условии, что дериватизированные части/часть являются/является стабильными при условиях следующих реакций и могут быть удалены без разрушения остатка молекулы. Примеры подходящих защитных групп для гидроксила и амино включают, но не ограничиваются, триметилсилил, триэтилсилил, o-нитробензилоксикарбонил, p-нитробензилоксикарбонил, t-бутилдифенилсилил, t-бутилдиметилсилил, ацетил, трифторацетил, бензилоксикарбонил (CBz), t-бутоксикарбонил (Boc), 9-фторенилэтиленоксикарбонил (Fmoc), 2,2,2-трихлорэтилоксикарбонил, аллилоксикарбонил и подобное. Примерами подходящих защитных групп для карбоксила являются бензгидрил, o-нитробензил, p-нитробензил, 2-нафтилметил, аллил, 2-хлораллил, бензил, 2,2,2-трихлорэтил, триметилсилил, t-бутилдиметилсилил, t-бутилдифенилсилил, 2-(триметилсилил)этил, фенацил, p-метокси бензил, ацетонил, p-метоксифенил, 4-пиридилметил, t-бутил и подобное.
"Субъект" включает людей, отличных от людей млекопитающих (например, собаки, кошки, кролики, крупный рогатый скот, лошади, овца и подобные) или немлекопитающих (например, птицы и подобные).
Выражение "терапевтически эффективное количество" означает количество соединения, которое при введении субъекту для лечения болезни является достаточным для эффекта такого лечения болезни. "Терапевтически эффективное количество" будет варьировать в зависимости от соединения, болезни и ее тяжести, веса, физического состояния и восприимчивости субъекта к лечению, среди других факторов.
"Фармацевтически приемлемая соль" охватывает любое соединение по данному изобретению, которое применяется в форме его соли, особенно если соль дает соединению улучшенные фармакокинетические свойства по сравнению со свободной формой соединения или формой другой соли соединения.
В соединениях данного изобретения могут существовать ассиметрические центры. Соединения Формулы I могут иметь один или более стереогенных центров, и, таким образом, может существовать оптическая изомерия. Все такие изомеры, включая энантиомеры, диастереомеры и эпимеры, включены в объем данного изобретения. Кроме того, данное изобретение включает такие соединения, как отдельные изомеры (R и/или S), и как смеси, включающие рацематы. При необходимости рацемические смеси соединения могут быть разделены так, что выделяются отдельные энантиомеры. Разделение может быть выполнено способами, хорошо известными в данном уровне техники, такими как объединение рацемической смеси соединений с энантиомерно чистым соединением для образования диастереомерной смеси с последующим разделением отдельных диастереомеров стандартными способами, такими как фракциональная кристаллизация или хроматография. Исходные материалы конкретной стереохимии могут быть либо коммерчески доступными, либо могут быть получены способами, описанными в данном документе, и разложены техниками, хорошо известными в данном уровне техники. Независимый синтез таких диастереомеров или их хроматографических разделений может быть выполнен, как известно в данном уровне техники, соответствующими модификациями.
Определенные соединения в соответствии с Формулой I могут также существовать как таутомеры, которые имеют различные точки присоединения водорода, сопровождаемые одним или боле перемещениями двойной связи. Такие таутомеры, или отдельно, или как смеси, также рассматривают в объеме данного изобретения.
Определенные соединения в соответствии с Формулой I могут также существовать как полиморфы.
Данное изобретение также охватывает геометрические изомеры соединений Формулы I и их смеси.
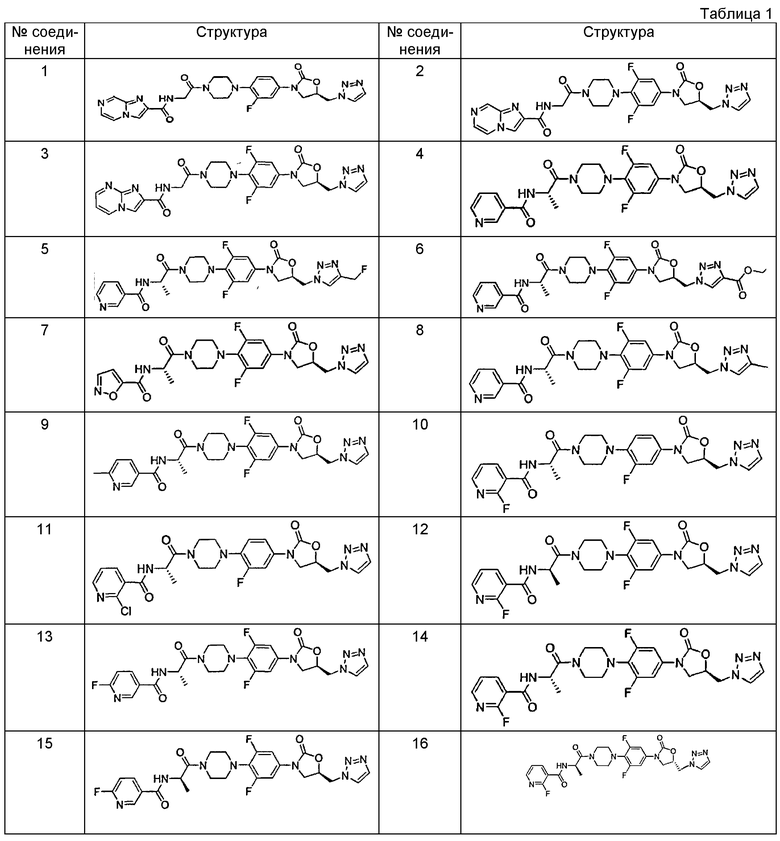
Конкретные применимые примеры данного изобретения включают, но не ограничиваются, соединения, выбранные из Таблицы 1.
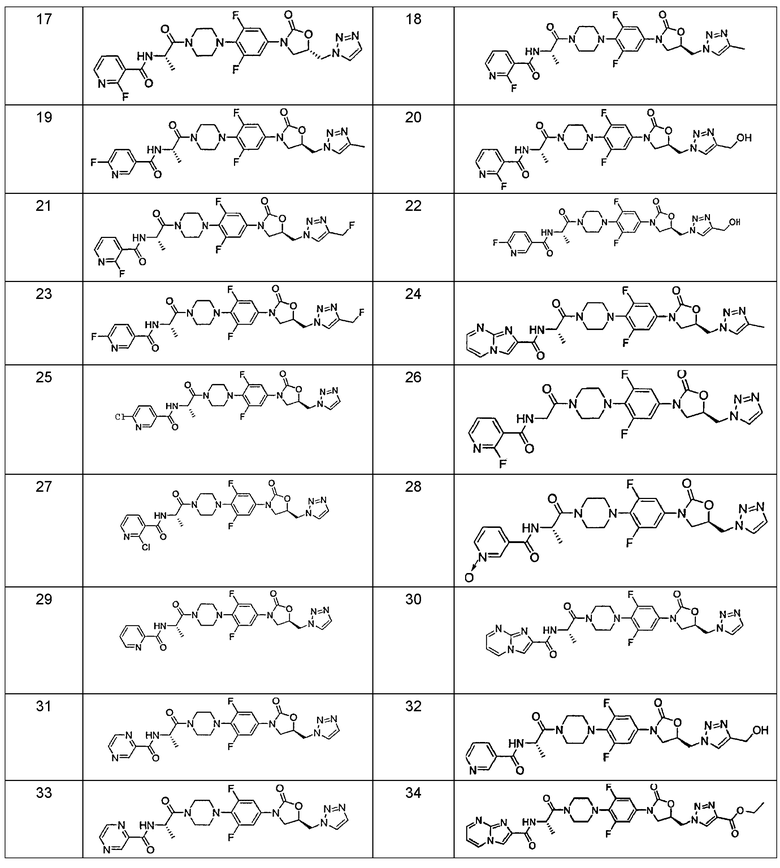
Соединения данного изобретения могут быть получены в соответствии с одной или более из Схем, обсуждаемых в данном документе. Все исходные материалы или коммерчески доступны, или могут быть получены процедурами, которые будут хорошо известны специалисту в органической химии.
"L" означает соответствующую уходящую группу, которая может варьировать по природе в зависимости от конкретных используемых условий реакции. Некоторыми типичными уходящими группами могут быть фтор, хлор, бром, йод, тозил, мезил, трифторметансульфонил и подобные, но это не должно быть истолковано как ограничение, поскольку многие другие уходящие группы также хорошо известны специалистам данной области.
Схема 1
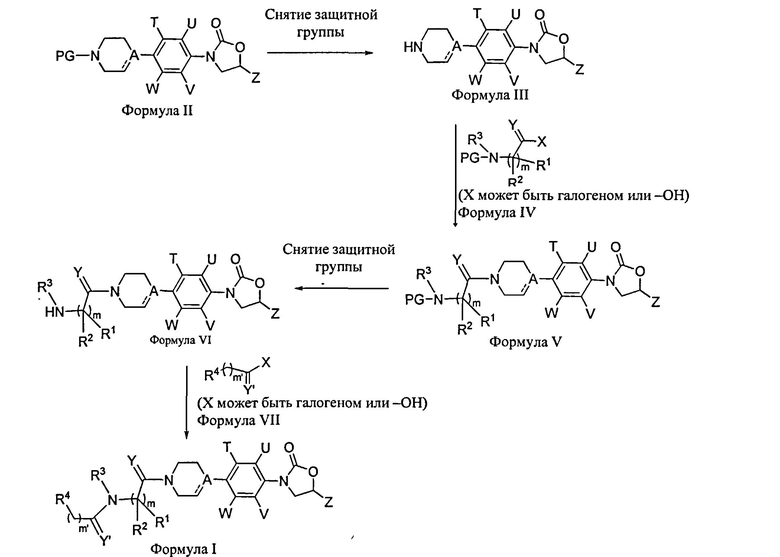
Соединения Формулы I могут быть приготовлены из соединений Формулы II по Схеме 1. Снятие аминозащитной группы в соединениях Формулы II выполняется с применением стандартных реагентов снятия защиты, например, трифторуксусная кислота, HCl (г) насыщенный раствор растворителя, такого как метанол, этилацетат, диэтиловый эфир, диоксан и подобное, гидрогенизацией с применением Pd/C в подходящем полярном растворителе или путем применения основного амина, такого как пиперидин, что дает соединения Формулы III. (Образованные в результате соединения могут быть в форме свободного амина или соли в зависимости от природы защитной группы и соответствующего использованного средства снятия защиты). Затем соединения Формулы III и Формулы IV соединяются с применением стандартных условий соединения пептидов, например, с применением EDC [1-этил-3-(3-диметиламинопропил)карбодиимид]/НОВТ (1-гидроксибензотриазол) или DCC (дициклогексилкарбодиимид), DMAP (4-диметиламинопиридин) или HATU [O-(7-азабензотриазол-ил)-N,N,N′,N′-тетраметилурониум гексафторфосфат/НОАТ (1-гидрокси-7-азабензотриазол), или способом смешанного ангидрида с применением этилхлорформиата или метилхлорформиата в подходящем растворителе, таком как DMF, DCM (дихлорметан) или THF и подобного, или их смеси, и в присутствии подходящего основания, такого как NMM (N-метилморфолин), DIPEA (N,N-диизопропилэтиламин) или триэтиламин, для образования соединений Формулы V. Защитная группа (PG) для амино затем удаляется с использованием стандартных реагентов снятия защиты, например, трифторуксусная кислота, HCl (г) насыщенный раствор растворителя, такого как метанол, этилацетат, диэтиловый эфир, диоксан и подобное, гидрогенизацией с использованием Pd/C в подходящем полярном растворителе или применением основного амина, такого как пиперидин, для получения соединений Формулы VI. Затем соединения Формулы VI реагируют с соединениями Формулы VII в присутствии EDC, HOBt и подобного, и в присутствии подходящего основания, такого как триэтиламин, пиридин, NMM, DMAP, DIPEA и подобного, и в присутствии подходящих растворителей, таких как DMF, толуол, THF, хлороформ, дихлорметан и подобного, или их, смеси, для получения соединений Формулы I.
Схема 2
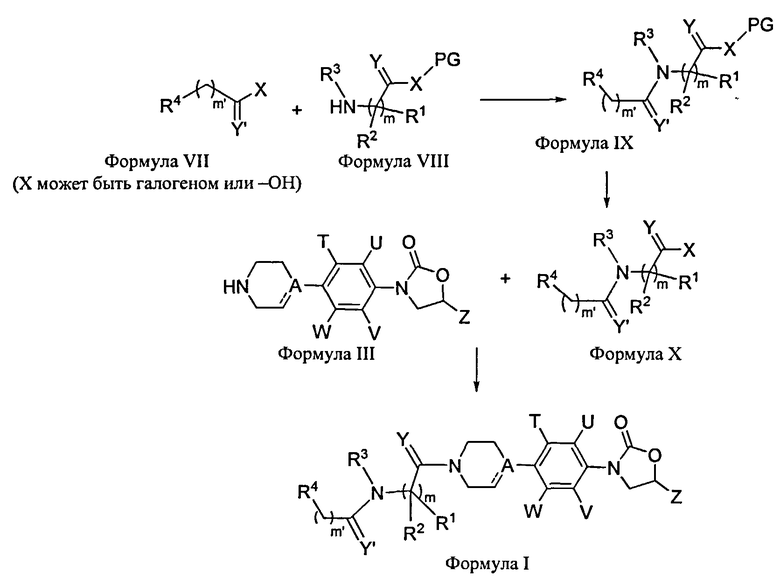
Соединения Формулы I также могут быть получены по Схеме 2. Соединения Формулы IX могут быть получены реакцией соединений Формулы VII с соединениями Формулы VIII в присутствии EDC, HOBt и подобного. Реакция может быть выполнена в присутствии подходящего основания, такого как триэтиламин, пиридин, NMM, DMAP, DIPEA и подобного, и в присутствии подходящего растворителя, такого как DMF, толуол, THF, хлороформ, дихлорметан и подобного, или их смесей. Затем соединения Формулы IX превращаются в соединение Формулы Х с применением стандартных реагентов снятия защиты, известных специалистам данной области техники. Затем соединения Формулы Х и Формулы III соединяются с использованием стандартных условий соединения пептидов, например, с применением EDC [1-этил-3-(3-диметиламинопропил)карбодиимид]/НОВТ (1-гидроксибензотриазол или DCC (дициклогексилкарбодиимид), DMAP (4-диметиламинопиридин) или HATU [O-(7-азабензотриазол-ил)-N,N,N′,N′-тетраметилурониум гексафторфосфат/НОАТ (1-гидрокси-7-азабензотриазол), или способом смешанных ангидридов с использованием этилхлорформиата или метилхлорформиата в подходящем растворителе, таком как DMF, DCM (дихлорметан) или THF, и подобного, или их смесей, и в присутствии подходящего основания, такого как NMM (N-метилморфолин), DIPEA (N,N-диизопропилэтиламин) или триэтиламин, для образования соединений Формулы I.
Соединения Формулы II легко могут быть получены специалистом в данной области. Например, соединение Формулы II (когда А является азотом, а '---' отсутствует) может быть получено по Схеме 3. Соединения Формулы II (когда А является атомом углерода, а '---' представляет собой одинарную связь, или когда А представляет собой CH, а '---' отсутствует) могут быть получены по процедуре, описанной в патенте США №6051716, или WO 2003/097640, или WO 2004/113329.
Схема 3
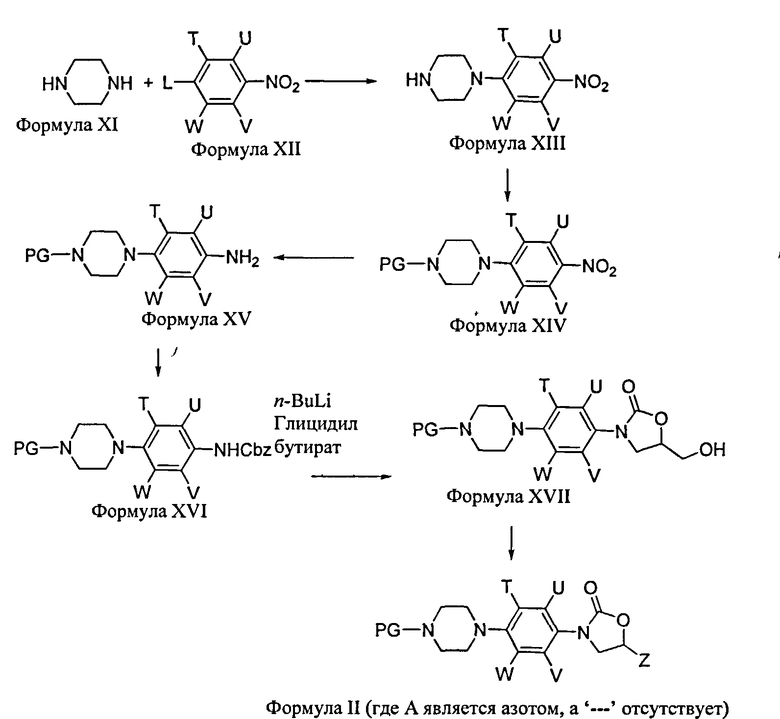
Соединения Формулы XIII могут быть получены реакцией соединений Формулы XI с замещенными нитробензольными производными Формулы XII (где Т, U, V, W являются такими, как определено ранее, a L является соответствующей уходящей группой, такой как фтор, хлор, бром, йод) в соответствующем растворителе и основании. Примеры соответствующих растворителей включают ацетонитрил, тетрагидрофуран, метилен дихлорид, дихлорэтан, DMF, DMSO и подобное или их смеси. Примеры соответствующих оснований включают триэтиламин, карбонат калия, диизопропилэтиламин, KOH и подобное. Затем соединения Формулы XIII могут быть введены в реакцию с подходящей стандартной аминозащитной группой (PG), известной специалистам данной области, для образования соединений Формулы XIV в присутствии подходящего растворителя, такого как метилендихлорид, хлороформ, THF и подобное или их смеси, и в присутствии подходящего основания, такого как триэтиламин, бикарбонат натрия, диизопропилэтиламин и подобное. Затем нитро производные Формулы XIV могут быть восстановлены до соответствующих аминосоединений Формулы XV разнообразными восстанавливающими средствами, известными специалистам данной области, такими как гидрогенизация, на соответствующем катализаторе, таком как палладий, платина или рутений на активированном угле, или химическими способами, такими как реакция с Fe/HCl, или SnCl2/HCl, или NiCl2/NaBH4, или Fe/NH4Cl. Образованные в результате амины XV затем могут быть обработаны бензилом или метилхлороформатом и бикарбонатом натрия в присутствии воды и ацетона для образования соответствующих бензильных или метилкарбаматных производных XVI, которые затем депротонируют в следующем этапе с применением основания лития, такого как n-бутиллитий, с последующим добавлением глицидила бутирата в присутствии подходящего растворителя, такого как диэтиловый эфир или тетрагидрофуран, для получения оксазолидинонов XVII. Затем гидроксильная группа (Формула XVII) может быть превращена в Z (Формула II) (где Z такой, как определено ранее). Точная природа регентов, используемых для такого превращения, зависит от точной природы желаемого Z. Например, если желательно, чтобы Z представлял собой -(CH2)n-1,2,3-триазолильную группу, гидроксильная группа сначала превращается в азидную группу, которая затем реагирует с бицикло[2.2.1]гепта-2,5-диеном в подходящем растворителе, таком как диоксан, для получения 1,2,3-триазолильной группы. Если желательно, чтобы Z представлял собой -(CH2)n-4-гидроксиметил-1,2,3-триазолильную группу, гидроксильная группа сначала превращается в азид, а затем реагирует с пропаргиловым спиртом в присутствии йодида меди, приемлемого основания и растворителя, такого как DIPEA и THF, или подобного. Соответствующие условия и реагенты для любой конкретной Z группы легко могут быть выбраны специалистом в данной области.
Понятно, что, как используется в данном документе, ссылки на соединения структурной Формулы I также предназначены включать фармацевтически приемлемые соли, а также соли, которые не являются фармацевтически приемлемыми, когда они используются как предшественники свободных соединений, или их фармацевтически приемлемых солей, или в других синтетических манипуляциях. Соединения данного изобретения могут быть введены в форме фармацевтически приемлемой соли. Выражение "фармацевтически приемлемая соль" относится к солям, приготовленным из фармацевтически приемлемых нетоксических оснований или кислот, включая неорганические или органические основания, и неорганические или органические кислоты. Соли могут быть приготовлены во время окончательного выделения и очистки соединений, или отдельно изготовлением основных или кислотно-аддитивных солей. Типичные соли основных соединений данного изобретения могут быть приготовлены реакцией формы свободного основания соединения с подходящей кислотой, включая, но без ограничения, ацетат, трифторацетат, адипат, цитрат, аспартат, бензоат, бензолсульфонат, бисульфат, безилат, бутират, камфорсульфонат, дифлуконат, гемисульфат, гептаноат, формиат, фумарат, лактат, малеат, метансульфонат, нафтилсульфонат, никотинат, оксалат, пикрат, пивалат, сукцинат, тартрат, трихлорацетат, глутамат, p-толуолсульфонат, хлористоводородную, бромистоводородную, серную, фосфорную и подобные. Типичные соли кислотных соединений данного изобретения могут быть приготовлены реакцией формы свободной кислоты соединения с подходящим основанием, включая, но без ограничения, соли аммония, кальция, магния, калия, натрия, соли первичного, вторичного и третичного аминов, замещенные амины, включая встречающиеся в природе, например, аргинин, бетаин, кофеин, холин, глюкамин, глюкозамин, гистидин, лизин, морфолин, пиперазин, пиперидин, пурин, триэтиламин, и подобное. Могут быть использованы соединения данного изобретения, которые содержат карбоновокислотную (-COOH) или спиртовую группу, их фармацевтически приемлемые сложные эфиры карбоновых кислот, такие как метиловый, этиловый и подобные, или ацильные производные спиртов, такие как ацетат, и подобные. Соединения данного изобретения, которые содержат основной атом азота, могут быть кватернизированы с алкилгалидами, алкилсульфатами и подобными. Такие соли обеспечивают приготовление соединений данного изобретения, растворимых и в воде, и в масле. Следует признать, что свободноосновные или свободнокислотные формы типично будут отличаться от их соответствующих форм солей, отчасти по физическим свойствам, таким как растворимость в полярных растворителях, но во всем остальном соли эквивалентны их соответствующим свободным формам для цели данного изобретения.
"Фармацевтически приемлемые сольваты" относятся к сольватам с водой (т.е. гидратам) или фармацевтически приемлемым растворителям, например, этанол и подобное.
Данное изобретение также охватывает "пролекарства" соединений данного изобретения, которые при введении in vivo подвергаются расщеплению метаболическими процессами перед тем, как стать активными фармакологическими веществами. В основном такие пролекарства являются производными функциональной группы соединения данного изобретения, которое является легко преобразуемым in vivo в соединение данного изобретения. Традиционные процедуры для выбора и приготовления подходящих пролекарственных производных описаны, например, в "Targeted prodrug design to optimize drug delivery", AAPS PharmaSci (2000), 2(1), E6.
Данное изобретение также охватывает активные "метаболиты" соединения данного изобретения.
Различные "полиморфы" соединения общей Формулы I, образующей часть данного изобретения, могут быть приготовлены кристаллизацией соединения Формулы I при различных условиях. Полиморфы также можно получить, например, применением различных широко используемых растворителей или их смесей для рекристаллизации; кристаллизациями при различных температурах; различными способами охлаждения, изменяющимися от очень быстрого до очень медленного охлаждения, во время кристаллизации, нагреванием или плавлением соединения с последующим постепенным или быстрым охлаждением. Присутствие полиморфов может быть определено NMR спектроскопией твердой пробы, ИК спектроскопией, дифференциальной сканирующей калориметрией, порошковой дифракцией рентгеновских лучей или другими техниками.
Данное изобретение также представляет фармацевтические композиции, содержащие соединения данного изобретения или их фармацевтически приемлемые производные, таутомерные формы, стереоизомеры, полиморфы, пролекарства, метаболиты, соли или сольваты их, факультативно в комбинации с одним или более фармацевтически приемлемыми носителями, содержащими наполнители и вспомогательные средства. Фармацевтические композиции могут быть в любой форме, известной в данном уровне техники, такой как таблетки, капсулы, порошки, сиропы, растворы, суспензии и подобное, могут содержать ароматизаторы, подсластители и т.д. в подходящих твердых или жидких носителях или разбавителях, или в подходящей стерильной среде для образования инъекционных растворов или суспензий. Такие композиции типично содержат активное соединение факультативно в комбинации с фармацевтически приемлемыми носителями, разбавителями или растворителями.
Фармацевтические композиции данного изобретения могут быть произведены способами, хорошо известными в данном уровне техники, например, посредством способов традиционного смешивания, растворения, сухой грануляции, влажной грануляции, дражирования, растирания в порошок, эмульгирования, капсулирования, улавливания, лиофилизации или сушки распылением. Соединения или фармацевтические композиции, содержащие такие соединения данного изобретения, могут быть введены в форме какого-либо фармацевтического состава. Фармацевтический состав будет зависеть от природы, активного соединения и способа его введения. Может быть использован любой способ введения, например, пероральный, буккальный, легочный, местный, парентеральный (включая подкожный, внутримышечный и внутривенный), трансдермальный, глазной (офтальмический), ингаляцией, внутриносовой, трансмукозальный, имплант или ректальное введение. Предпочтительно соединения данного изобретения вводятся перорально, парентерально или местно.
В варианте осуществления количество новых соединений, имеющих Формулу I по данному изобретению, подлежащих включению в фармацевтические композиции данного изобретения, может варьировать в широком диапазоне в зависимости от известных факторов, таких как, например, нарушение, подлежащее лечению, тяжесть нарушения, вес тела пациента, лекарственная форма, выбранный способ введения и число введений в день. Типично, количество соединения Формулы I в фармацевтических композициях данного изобретения, будет варьировать от приблизительно 0,01 мг до около 5000 мг. В варианте осуществления дневная доза композиции, содержащей новые соединения, имеющие Формулу I, находится в диапазоне от около 0,01 мг/кг до около 100 мг/кг на основе веса тела субъекта, нуждающегося в этом, причем она может быть введена как одна или несколько доз.
В варианте осуществления новые соединения, имеющие Формулу I по данному изобретению, особенно применимы для лечения болезни(болезней) или нарушения(нарушений), которые являются особенно острыми по природе и которые требуют краткосрочного, но мягкого и умеренного лечения, или даже некоторых хронических состояний, которые благоприятно отвечают или облегчаются новыми соединениями, имеющими Формулу I, или композициями, содержащими их. Композиции, содержащие новые соединения, имеющие Формулу I, применимы профилактически или терапевтически в зависимости от патологического состояния подлежащего предотвращению или лечению, соответственно.
Соединения данного изобретения эффективны против ряда аэробных и/или анаэробных грамположительных и/или грамотрицательных патогенов, таких как устойчивые к нескольким лекарственным средствам виды Staphylococcus, Streptococcus, Enterococcus, Bacterioides, Clostridia, H. influenza, Moraxella, кислотоустойчивых организмов, таких как Mycobacterium tuberculosis, а также устойчивых к линезолиду видов Staphylococcus и Enterococcus.
Таким образом, следующий вариант осуществления данного изобретения представляет собой применение соединения Формулы I для производства лекарственного препарата для профилактики, облегчения и/или лечения бактериальных инфекций у субъекта, нуждающегося в этом, предпочтительно млекопитающего, включая человека. Другой вариант осуществления данного изобретения обеспечивает способы осуществления, такие как профилактика, облегчение и/или лечение бактериальных инфекций у субъекта, нуждающегося в этом, предпочтительно млекопитающего, включая человека, которые включают введение терапевтически эффектного количества соединения Формулы I. Еще один вариант осуществления данного изобретения заключается в обеспечении применения композиций в лекарственной форме, содержащих новые соединения Формулы I, для лечения болезнь(болезни)/нарушение(нарушения), которое включает введение субъекту, нуждающемуся в этом, фармацевтически эффективного количества композиции.
Соединения данного изобретения могут быть использованы в комбинации с одним или более другими активными ингредиентами, такими как хинолоны, β-лактамы например, цефалоспорины, пенициллины, пенамы, пенемы и подобное, в профилактике, облегчении и/или лечении бактериальных инфекций, где комбинация активных ингредиентов вместе является безопасной или более эффективной, чем активный ингредиент отдельно или при включении другого активного ингредиента, что может уменьшить дозу соединения Формулы I. Противомикробная активность in vitro
Противомикробную активность in vitro соединений данного изобретения (как описано в Таблице 2) определили путем микроразведения в бульоне согласно нормам, установленным Институтом клинических и лабораторных стандартов (CLSI). Этот способ описан в документе CLSI M7-A7, Vol.26, No. 2, "Methods for Dilution Antimicrobial Susceptibility Test for Bacteria that Grow Aerobically; Approved Standart-Seventh Edition", который включен в данный документ ссылкой. Минимальная ингибиторная концентрация (MIC) определена как минимальная концентрация тестового соединения, которая ингибирует рост бактерий, заметный или видимый невооруженным глазом. Этот тест также может быть выполнен способом разведения в агаре.
Соединения данного изобретения тестировали против панели стандартных микроорганизмов, полученных из АТСС (Американская коллекция типовых культур), и устойчивого к линезолиду штамма (LRSA), т.е. РТСС 100 (коллекция типовых культур фирмы Panacea). РТСС 100 является хранилищем, которое создано фирмой Panacea Biotec Ltd. в Мохали, Индия, для хранения и поддерживания клинических, бактериальных и других изолятов собственной разработки, которые используют для тестирования тестовых соединений. Линезолид использовали как препарат сравнения во всех тестах.
В способе микроразведения в бульоне соединение растворили в диметилсульфоксиде и выполнили двукратные серийные разведения в 96 луночных микротитровальных планшетах. Инокулюм приготовили установлением мутности активно растущей в бульоне культуры и добавили в лунки для получения окончательного количества бактерий ~2-5×104 КОЕ/лунка. Микротитровальные планшеты инкубировали при 35±2°С в течение 16-20 часов, а затем считали визуально. Значения MIC (мкг/мл) некоторых из соединений Формулы 1 представлены в Таблице 2 и Таблице 3.
Разработка собственного штамма LRSA (PTCC 100)
РТСС 100 разработали процедурой, подобной цитированной в Antimicrobial Agents and Chemotherapy, 2008, 52, 1940. Самок мышей Swiss albino (18-22 г) собственного разведения инокулировали штаммом АТСС 29213 S. aureus и дозировали перорально линезолидом при 5 мг/кг/перорально, на следующий день через 20-22 часа мышей умертвили, взяли внутрибрюшинную пробу и сделали посев штрихом на чашки с агаром Мюллера-Хинтона, включающим 4 и 8 мкг/мл линезолида. Выбрали колонии, полученные на 4 мкг/мл и 8 мкг/мл, из чашек, а затем пассировали в мышей (SAM), дозированных перорально линезолидом при 7,5 мг/кг/перорально. Мышей умертвили, внутрибрюшинные пробы посеяли штрихом на чашки, содержащие более высокую концентрацию линезолида, а именно 16 и 32 мкг/мл, и способ повторили, постепенно увеличивая концентрацию линезолида до 10 мг/кг/перорально у мышей, для окончательного получения штаммов S. aureus, устойчивых к линезолиду при 64 мкг/мл. Минимальную ингибиторную концентрацию (MIC) выделенных колоний определили анализом микроразведения в бульоне, и значения MIC 64 мкг/мл для линезолида подтвердили разработку собственного штамма LRSA, РТСС 100.
Исследования эффективности in vivo
Системная модель инфекции у мышей
Выбрали самок мышей Swiss albino собственного разведения весом 19-23 г (n=6/группа). S. aureus АТСС 29213/ S. aureus РТСС 100 (LRSA) выращивали в течение ночи 18-20 часов на колумбийском кровяном агаре (Difco; BD). На следующий день приготовили бактериальный инокулюм с оптической плотностью (OD), соответствующей плотности клеток ~2×09 КОЕ/мл, и смешали с 10% желудочного муцина (Difco; BD) в соотношении 1:1 для получения окончательной концентрации муцина 5% вес/объем. Инъецировали 0,5 мл бактериального инокулюма внутрибрюшинно (i.p.) мышам. Соединения, полученные по данному изобретению, далее в данном документе называемые тестовыми соединениями, сформулировали в 0,25% карбоксиметилцеллюлозе (CMC) и Tween 80 с различными уровнями дозы, а затем ввели перорально через 1 час и 5 часов после инфицирования. В качестве стандартного контроля использовали линезолид. Солевой раствор ввели инфицированной контрольной группе, которая не получала ни тестовое соединение, ни стандартное лекарственное средство. Мышей наблюдали на протяжении 7 дней после лечения. Отметили число выживших в каждой группе, и рассчитали ED50 тестового соединения на основе 50% выживаемости с помощью регрессионного анализа.
ПРИМЕРЫ
Данное изобретение детально объясняется в следующих примерах, которые приведены исключительно с целью иллюстрации и, следовательно, не должны истолковываться как ограничивающие объем данного изобретения. Все из исходных материалов являются либо коммерчески доступными, либо могут быть приготовлены процедурами, хорошо известными специалисту органической химии. Растворители сушат перед применением, если необходимо, стандартными способами (Perrin, D.D.; Armarego, W.L.F. Purification of Laboratory Chemicals, Pergamon Press: Oxford, 1988). Масс-спектр (MS) получили ионизацией электрораспылением (ESI) эВ с использованием Applied biosystem 4000 Q TRAP. 1H NMR регистрировали на NMR спектрометре Bruker 400 МГц Avance II. Химические сдвиги регистрировали как 5 значения в частях на миллион (ppm) относительно TMS в качестве внутреннего стандарта. Все значения коэффициентов связи (J) приведены в Гц.
Аббревиатуры
Следующие аббревиатуры применяются в примерах и в любом месте данного документа:
Приготовление исходных материалов
Промежуточное соединение I: 1-(2,6-дифтор-4-нитрофенил)-пиперазин
Раствор пиперазина (24 г, 0,28 моль) и 3,4,5-трифторнитробензола (13 мл, 0,11 моль) в ацетопитриле (200 мл) взбалтывали при 60°С. За ходом реакции наблюдали с помощью TLC. В завершении, ацетонитрил выпарили при пониженном давлении. Остаток растворили в этилацетате (300 мл) и образованный раствор промыли водой (100 мл), солевым раствором (100 мл), высушили на безводном сульфате натрия и концентрировали in vacua. Остаток очистили колоночной хроматографией (силикагель, 1:9 метанол : хлороформ) для получения названного соединения (25,8 г, 92%) как оранжевого твердого вещества.
ESIMS (м/з): 244,1 (M+1)
Промежуточное соединение II: тред-бутил-4-(2,6-дифтор-4-нитрофенил)пиперазин-1-карбоксилат
К раствору 1-(2,6-дифтор-4-нитро-фенил)пиперазина (Промежуточное соединение I) (25 г, 0,1 моль) в THF (200 мл) добавили Boc ангидрид (26,2 г, 0,12 моль) при 0°С. Раствор взбалтывали при 0°С и за ходом реакции наблюдали с помощью TLC. В завершении, THF выпарили при пониженном давлении и полученное твердое вещество промыли пет. эфиром (3×100 мл). Полученное желтое твердое вещество (34 г, 96%) подвергли следующей реакции без дополнительной очистки.
ESIMS (м/з): 344,1 (M+1)
Промежуточное соединение III: тред-бутил-4-(4-амино-2,6-дифторфенил)-пиперазин-1-карбоксилат
К раствору тред-бутил-4-(2,6-дифтор-4-нитрофенил)пиперазин-1-карбоксилата (Промежуточное соединение II) (30 г, 0,09 моль) в метаноле (500 мл) в атмосфере аргона добавили 10% Pd/C (4,5 г, 15 мол.% по весу). Колбу вакуумировали и ввели водород с помощью баллона. Реакционную смесь взбалтывали под водородом и за ходом реакции наблюдали с помощью TLC. В завершении, реакционную смесь отфильтровали через целитовую прокладку с использованием метанола в качестве растворителя. Фильтрат выпарили для получения названного соединения (26 г, 95%) как бледно-желтого твердого вещества.
ESIMS (м/з): 336,7 (М+23), 314,8 (М+1)
Промежуточное соединение IV: тред-бутил-4-(4-(((бензилокси)карбонил)амино)-2,6-дифторфенил)пиперазин-1-карбоксилат
К раствору тред-бутил-4-(4-амино-2,6-дифторфенил)пиперазин-1-карбоксилата (Промежуточное соединение III) (25 г, 0,08 моль) в 1:1 ацетоне : воде (300 мл) добавили бикарбонат натрия (15,1 г, 0,18 моль). Образованный раствор охладили до 0°С и каплями добавили бензилхлороформиат (40 мл, 0,24 моля 50% раствора в толуоле). Реакционную смесь взбалтывали при к.т. и за ходом реакции наблюдали с помощью TLC. В завершении, растворитель выпарили при пониженном давлении, а остаток растворили в этилацетате (500 мл). Органический слой промыли водой (2×50 мл), солевым раствором (100 мл), высушили на безводном сульфате натрия и концентрировали in vacuo. Остаток очистили колоночной хроматографией (силикагель, 2:3 этилацетат : пет. эфир) для получения названного соединения (32 г, 90%) как грязно-белого твердого вещества.
ESIMS (м/з): 448,0 (М+1)
Промежуточное соединение V: (R)-тред-бутил-4-(2,6-дифтор-4-(5-(гидроксиметил)-2-оксооксазолидин-3-ил)фенил)пиперазин-1-карбоксилат
К раствору тред-бутил-4-(4-(((бензилокси)карбонил)амино)-2,6-дифторфенил)пиперазин-1-карбоксилата (Промежуточное соединение IV) (30 г, 0,067 моль) в сухом THF (300 мл) добавили каплями n-BuLi (75 мл, 0,12 моля, 1,6 М раствор в гексане) в атмосфере азота при -78°С. Реакционную смесь взбалтывали при той же температуре в течение одного часа, а затем добавили каплями (R)-глицидил бутират (10,4 мл, 0,074 моль) в течение 5 минут. Реакционную смесь взбалтывали при -78°С еще два часа, а затем нагрели до к.т. За ходом реакции наблюдали с помощью TLC и, в завершении, реакционную смесь погасили насыщенным раствором NH4Cl (400 мл) и экстрагировали этилацетатом (4×200 мл). Органический слой промыли солевым раствором (100 мл), высушили на безводном сульфате натрия и концентрировали in vacuo. Остаток очистили колоночной хроматографией (силикагель, 3:2 этилацетатлет эфир) для получения названного соединения (18 г, 65%) как грязно-белого твердого вещества.
ESIMS (м/з): 452,7 (М+39), 436,6 (М+23), 414,7 (М+1)
Промежуточное соединение VI: (R)-тред-бутил-4-(2,6-дифтор-4-(5-(((метилсульфонил)окси)метил)-2-оксооксазолидин-3-ил)фенил)пиперазин-1-карбоксилат
К раствору (R)-тред-бутил 4-(2,6-дифтор-4-(5-(гидроксиметил)-2-оксооксазолидин-3-ил)фенил)пиперазин-1-карбоксилата (Промежуточное соединение V) (10 г, 24,2 ммоль) в DCM (100 мл) добавили триэтиламин (10,5 мл, 73 ммоль). Реакционную смесь охладили до 0°С и добавили каплями метансульфонил хлорид (2,8 мл, 36 ммоль). Реакционную смесь взбалтывали при к.т. и за ходом реакции наблюдали с помощью TLC. В завершении, реакционную смесь разбавили DCM (100 мл). Органический слой промыли водой (25 мл), солевым раствором (25 мл), высушили на безводном сульфате натрия и концентрировали in vacuo. Получили неочищенный продукт (11,3 г, 95%) как коричневое твердое вещество и подвергли следующей реакции без какой-либо очистки.
ESIMS (м/з): 514,8 (М+23), 492,6 (М+1)
Промежуточное соединение VII: (R)-тред-бутил-4-(4-(5-(азидометил)-2-оксооксазолидин-3-ил)-2,6-дифторфенил)пиперазин-1-карбоксилат
К раствору 4(R)-тред-бутил-4-(2,6-дифтор-4-(5-(((метилсульфонил)окси)метил)-2-оксооксазолидин-3-ил)фенил)пиперазин-1-карбоксилата (Промежуточное соединение VI) (11 г, 22,4 ммоль) в DMF (50 мл) добавили азид натрия (4,37 г, 67,2 ммоль). Реакционную смесь взбалтывали при 80°С и за ходом реакции наблюдали с помощью TLC. В завершении, реакционную смесь разбавили водой (100 мл) и экстрагировали этилацетатом (2×100 мл). Органический слой промыли солевым раствором (50 мл), высушили на безводном сульфате натрия и концентрировали in vacuo. Получили неочищенный продукт (8 г, 82%) как грязно-белое твердое вещество и подвергли следующей реакции без какой-либо очистки.
ESIMS (м/з): 439,7 (М+1)
Промежуточное соединение VIII: (S)-тред-бутил-4-(4-(5-(аминометил)-2-оксооксазолидин-3-ил)-2,6-дифторфенил)пиперазин-1-карбоксилат
Смесь (R)-тред-бутил-4-(4-(5-(азидометил)-2-оксооксазолидин-3-ил)-2,6-дифторфенил)пиперазин-1-карбоксилата (Промежуточное соединение VII) (5 г, 11,4 ммоль) и трифенилфосфина (3,3 г, 12,5 ммоль) в THF (80 мл) взбалтывали при к. т.в течение 3 часов. Добавили воду (3 мл) и реакционную смесь взбалтывали при 40°С в течение 16 часов. Затем реакционную смесь разбавили водой (50 мл) и экстрагировали этилацетатом (4×50 мл). Органический слой промыли солевым раствором (50 мл), высушили на безводном сульфате натрия и концентрировали in vacuo. Остаток очистили колоночной хроматографией (силикагель, 1:9 метанол : хлороформ) для получения названного соединения (3,5 г, 74%) как грязно-белого твердого вещества.
ESIMS (м/з): 435,8 (М+23), 413,7 (М+1)
Промежуточное соединение IX: (R)-тред-бутил-4-(4-(5-((1Н-1,2,3-триазол-1-ил)метил)-2-оксооксазолидин-3-ил)-2,6-дифторфенил)пиперазин-1-карбоксилат
К раствору (R)-тред-бутил-4-(4-(5-(азидометил)-2-оксооксазолидин-3-ил)-2,6-дифторфенил)пиперазин-1-карбоксилата (Промежуточное соединение VII) (2 г, 4,6 ммоль) в диоксане (25 мл) добавили бицикло[2.2.1]гепта-2,5-диен (1,9 мл, 18,5 ммоль) и образованный раствор взбалтывали при 60°С в течение 8 часов. Растворитель выпарили и остаток очистили колоночной хроматографией (силикагель, 1:20 метанол : хлороформ) для получения названного соединения (1,47 г, 70%) как белого твердого вещества.
ESIMS (м/з): 465,7 (М+1)
Пример I: N-((S)-1-(4-(4-((R)-5-((1H-1,2,3-триазол-1-ил)метил)-2-оксооксазолидин-3-ил-2,6-дифторфенил)пиперазин-1-ил)-1-оксопропан-2-ил)никотинамид
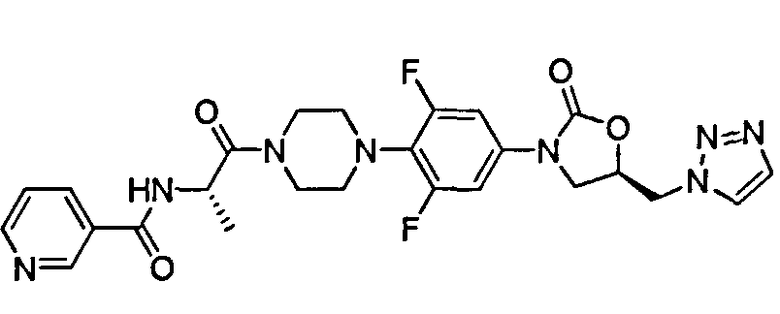
Этап 1: (R)-4-(4-(5-((1H-1,2,3-триазол-1-ил)метил)-2-оксооксазолидин-3-ил)-2,6-дифторфенил)пиперазин-1-иЙ 2,2,2-трифторацетат
К перемешанному раствору (R)-тред-бутил-4-(4-(5-((1H-1,2,3-триазол-1-ил)метил)-2-оксооксазолидин-3-ил)-2,6-дифторфенил)пиперазин-1-карбоксилата (Промежуточное соединение IX) (650 мг, 1,4 ммоль), в DCM (5 мл) при 0°С в атмосфере азота добавили TFA (4,5 мл) по каплям. Смесь перемешивали при 0°С и за ходом реакции наблюдали с помощью TLC. В завершении, избыток TFA и DCM выпарили при сниженном давлении для получения названного соединения (660 мг, 98%) в виде коричневого твердого вещества и подвергли следующей реакции без какой-либо очистки.
ESIMS (м/з): 365,6 (М+1) свободного амина.
Этап 2: тред-бутил-((S)-1-(4-(4-((R)-5-((1H-1,2,3-триазол-1-ил)метил)-2-оксооксазолидин-3-ил)-2,6-дифторфенил)пиперазин-1-ил)-1-оксопропан-2-ил)карбамат
К раствору соединения (650 мг, 1,36 ммоль), полученного на этапе 1, в DCM (30 мл), добавили (S)-N-(тред-бутоксикарбонил)аланин (309 мг, 1,63 ммоль), EDC (339 мг, 1,77 ммоль), HOBt (239 мг, 1,77 ммоль) и DIPEA (0,72 мл, 4,08 ммоль) при 0°С. Реакционную смесь перемешивали при к.т. и за ходом реакции наблюдали с помощью TLC. В завершении, реакционную смесь разбавили DCM (100 мл). Органический слой промыли водой (50 мл), рассолом (50 мл), высушили над безводным сульфатом натрия и концентрировали in vacuo. Остаток очистили колоночной хроматографией (силикагель, 3:5 этилацетат : петролейный эфир) для обеспечения названного соединения (550 мг, 76%) в виде белого твердого вещества.
ESIMS (м/з): 558,8 (М+23), 536,6 (М+1).
Этап 3: (S)-1-(4-(4-((R)-5-((1H-1,2,3-триазол-1-ил)метил)-2-оксооксазолидин-3-ил)-2,6-дифторфенил)пиперазин-1-ил)-1-оксопропан-2-аминий 2,2,2-трифторацетат:
К перемешанному раствору соединения (535 мг, 1 ммоль), полученному на этапе 2, в DCM (2 мл) при 0°С в атмосфере азота добавили TFA (3 мл) по каплям. Смесь перемешивали при 0°С и за ходом реакции наблюдали с помощью TLC. В завершении, избыток TFA и DCM выпарили при сниженном давлении для получения названного соединения (540 мг, 98%) в виде коричневого твердого вещества и подвергли следующей реакции без какой-либо очистки.
ESIMS (м/з): 458,8 (М+23), 436,6 (М+1) свободного амина.
Этап 4: N-((S)-1-(4-(4-((R)-5-((1H-1,2,3-триазол-1-ил)метил)-2-оксооксазолидин-3-ил)-2,6-дифторфенил)пиперазин-1-ил)-1-оксопропан-2-ил)никотинамид
К раствору соединения (300 мг, 0,57 ммоль), полученному на этапе 3, в DMF (10 мл), добавили никотиновую кислоту (81 мг, 0,66 ммоль), EDC (127 мг, 0,66 ммоль), HOBt (89 мг, 0,66 ммоль) и NMM (0,15 мл, 1,35 ммоль) при 0°С. Реакционную смесь перемешивали при к.т. и за ходом реакции наблюдали с помощью TLC. В завершении, DMF выпарили in vacuo и остаток растворили в хлороформе (100 мл). Органический слой промыли водой (50 мл), рассолом (50 мл), высушили над безводным сульфатом натрия и концентрировали in vacuo. Остаток очистили колоночной хроматографией (силикагель, 1:20 метанол : хлороформ) для обеспечения названного соединения (204 мг, 69%) в виде белого твердого вещества.
1H NMR (400 МГц, CDCl3, δ): 1,49 (d, J=6,8 Hz, 3H), 3,10-3,30 (m, 4H), 3,65-3,80 (m, 3H), 3,80-3,90 (m, 1H), 3,92 (dd, J=9,3 и 6,0 Hz, 1H), 4,11 (t, J=9,1 Hz, 1H), 5,00-5,20 (m, 2H), 6,99 (d, J=10,7 Hz, 2H), 7,39 (dd, J=7,9 и 4,9 Hz, 1H), 7,47 (d, J=6,8 Hz, 1H), 7,76 (d, J=8,5 Hz, 2H), 8,10-8,15 (m, 1H), 8,75 (dd, J=4,7 и 1,2 Hz, 1H), 9,06 (d, J=2,0 Hz, 1H).
ESIMS (м/з): 563,7 (M+23), 541,5 (M+1)
Пример II: N-((S)-1-(4-(2,6-дифтор-4-((R)-5-((4-(фторметил)-1H-1,2,3-триазол-1-ил)метил)-2-оксооксазолидин-3-ил)фенил)пиперазин-1-ил)-1-оксопропан-2-ил)никотинамид
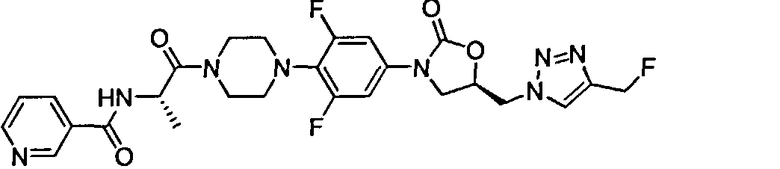
Этап 1: (R)-тред-бутил-4-(2,6-дифтор-4-(5-((4-(гидроксиметил)-1Н-1,2,3-триазол-1-ил)метил)-2-оксооксазолидин-3-ил)фенил)пиперазин-1-карбоксилат
К перемешанному раствору (R)-тред-бутил-4-(4-(5-(азидометил)-2-оксооксазолидин-3-ил)-2,6-дифторфенил)пиперазин-1-карбоксилата (Промежуточное соединение VII) (1,3 г, 2,97 ммоль) в THF (25 мл) добавили пропаргиловый спирт (0,5 мл, 8,9 ммоль), DIPEA (1,1 мл, 5,94 ммоль) и CuI (0,28 г, 1,48 ммоль) при 0°С. Реакционную смесь перемешивали при к.т. и за ходом реакции наблюдали с помощью TLC. В завершении, реакционную смесь погасили насыщенным раствором хлорида аммония в жидком аммиаке (20 мл), разбавили водой (50 мл) и экстрагировали этилацетатом (4×50 мл). Органический слой промыли рассолом (25 мл), высушили над безводным сульфатом натрия и концентрировали in vacuo. Остаток очистили колоночной хроматографией (силикагель, 1:10 метанол : хлороформ) для обеспечения названного соединения (1,24 г, 85%) в виде кремового твердого вещества.
ESIMS (м/з): 495,5 (M+1)
Этап 2: (R)-тред-бутил-4-(2,6-дифтор-4-(5-((4-(фторметил)-1H-1,2,3-триазол-1-ил)метил)-2-оксооксазолидин-3-ил)фенил)пиперазин-1-карбоксилат
К перемешанному раствору соединения (500 мг, 1,01 ммоль), полученному на этапе 1, в DCM (15 мл) добавили DAST (0,5 мл, 4,04 ммоль) при -20°С. Реакционную смесь перемешивали при к.т. и за ходом реакции наблюдали с помощью TLC. В завершении, реакционную смесь погасили насыщенным раствором бикарбоната натрия (25 мл) и экстрагировали DCM (4×50 мл). Органический слой промыли водой (50 мл), рассолом (25 мл), высушили над безводным сульфатом натрия и концентрировали in vacua. Остаток очистили колоночной хроматографией (силикагель, 1:10 метанол : хлороформ) для обеспечения названного соединения (300 мг, 60%) в виде кремового твердого вещества.
ESIMS (м/з): 497,5 (M+1)
Соединение, полученное на этапе 2 Примера II, преобразовали в N-((S)-1-(4-(2,6-дифтор-4-((R)-5-((4-(фторметил)-1H-1,2,3-триазол-1-ил)метил)-2-оксооксазолидин-3-ил)фенил)пиперазин-1-ил)-1-оксопропан-2-ил)никотинамид, следуя процедуре, описанной на этапах 1-4 в Примере I.
1H NMR (400 МГц, CDCl3, δ): 1,49 (d, J=6,8 Hz, 3Н), 3,10-3,25 (m, 4H), 3,60-3,75 (m, 3H), 3,80-3,90 (m, 1H), 3,91 (dd, J=9,4 и 6,3 Hz, 1H), 4,13 (t, J=9,1 Hz, 1H), 4,60-4,70 (m, 2H), 5,05-5,20 (m, 2H), 5,43 (s, 1H), 5,55 (s, 1H), 7,01 (d, J=10,8 Hz, 2H), 7,39 (dd, J=7,8 и 4,9 Hz, 1H), 7,48 (d, J=6,8 Hz, 1H), 7,88 (d, J=2,4 Hz, 1H), 8,10-8,15 (m, 1H), 8,74 (dd, J=4,8 и 1,6 Hz, 1H), 9,06 (d, J=2,0 Hz, 1H).
ESIMS (м/з): 595,9 (M+23), 573,6 (M+1)
Пример III: N-((S)-1-(4-(2,6-дифтор-4-((R)-5-((4-метил-1H-1,2,3-триазол-1-ил)метил)-2-оксооксазолидин-3-ил)фенил)пиперазин-1-ил)-1-оксопропан-2-ил)имидазо[1,2-a]пиримидин-2-карбоксамид
Этап 1: (R)-тред-бутил-4-(2,6-дифтор-4-(5-((4-метил-1H-1,2,3-триазол-1-ил)метил)-2-оксооксазолидин-3-ил)фенил)пиперазин-1-карбоксилат
К перемешанному раствору (S)-тред-бутил-4-(4-(5-(аминометил)-2-оксооксазолидин-3-ил)-2,6-дифторфенил)пиперазин-1-карбоксилата (Промежуточное соединение VIII) (780 мг, 1,89 ммоль) в метаноле (15 мл) добавили DIPEA (1,2 мл, 7,56 ммоль), а затем N′-(1,1-дихлорпропан-2-илиден)-4-метилбензолсульфонгидразид (680 мг, 2,2 ммоль) при 0°С. Реакционную смесь перемешивали при к.т. и за ходом реакции наблюдали с помощью TLC. В завершении, растворитель выпарили in vacuo. Остаток растворили в хлороформе (25 мл) и промыли водой (20 мл), рассолом (20 мл), высушили над безводным сульфатом натрия и концентрировали in vacua. Остаток очистили колоночной хроматографией (силикагель, 1:10 метанол : хлороформ) для обеспечения названного соединения (590 мг, 65%) виде кремового твердого вещества.
ESIMS (м/з): 479,5 (М+1)
Соединение, полученное на этапе 1 Примера III, преобразовали в N-((S)-1-(4-(2,6-дифтор-4-((R)-5-((4-метил-1H-1,2,3-триазол-1-ил)метил)-2-оксооксазолидин-3-ил)фенил)пиперазин-1-ил)-1-оксопропан-2-ил)имидазо[1,2-a]пиримидин-2-карбоксамид, следуя процедуре, описанной на этапах 1-4 в Примере I. Имидазо[1,2-a]пиримидин-2-карбоновую кислоту применяли вместо никотиновой кислоты на этапе 4.
1H NMR (400 МГц, CDCl3, δ): 1,50 (d, J=6,8 Hz, 3H), 2,35 (s, 3H), 3,10-3,25 (m, 4H), 3,65-3,80 (m, 3H), 3,80-3,90 (m, 1H), 3,91 (dd, J=9,3 и 6,3 Hz, 1H), 4,09 (t, J=9,1 Hz, 1H), 4,71 (d, J=3,94 Hz, 2H), 4,95-5,05 (m, 1H), 5,05-5,20 (m, 1H), 7,01 (d, J=10,8 Hz, 2H), 7,05 (dd, J=6,9 и 4,1 Hz, 1H), 7,39 (d, J=7,2 Hz, 1H), 7,49 (s, 1H), 8,30 (s, 1H), 8,68 (dd, J=4,1 и 2,1 Hz, 1H), 9,75 (dd, J=7,0 и 2,1 Hz, 1H).
ESIMS (м/з): 617,9 (M+23), 595,7 (M+1)
Соединения, перечисленные в Таблице 6, были получены способами, по сути описанными для Примеров I-III.
Таблица 6
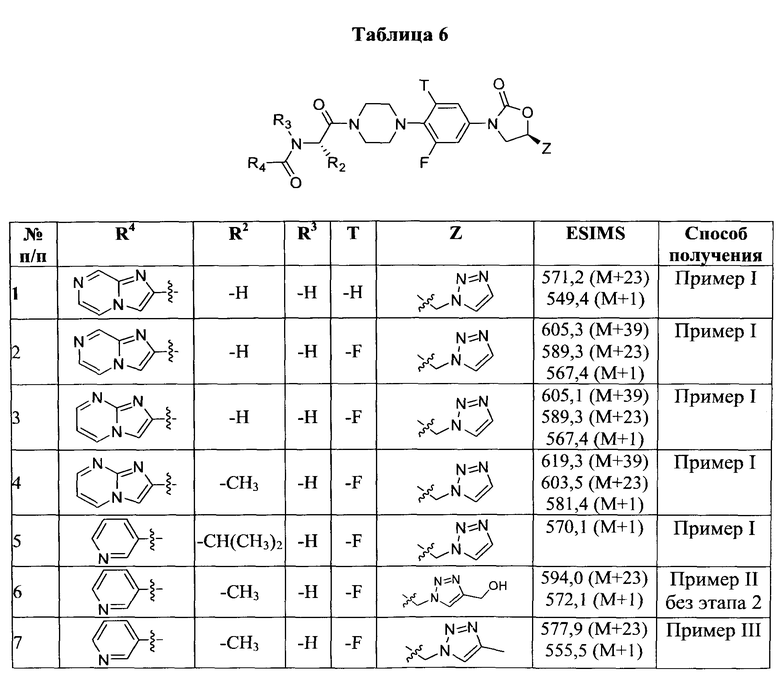
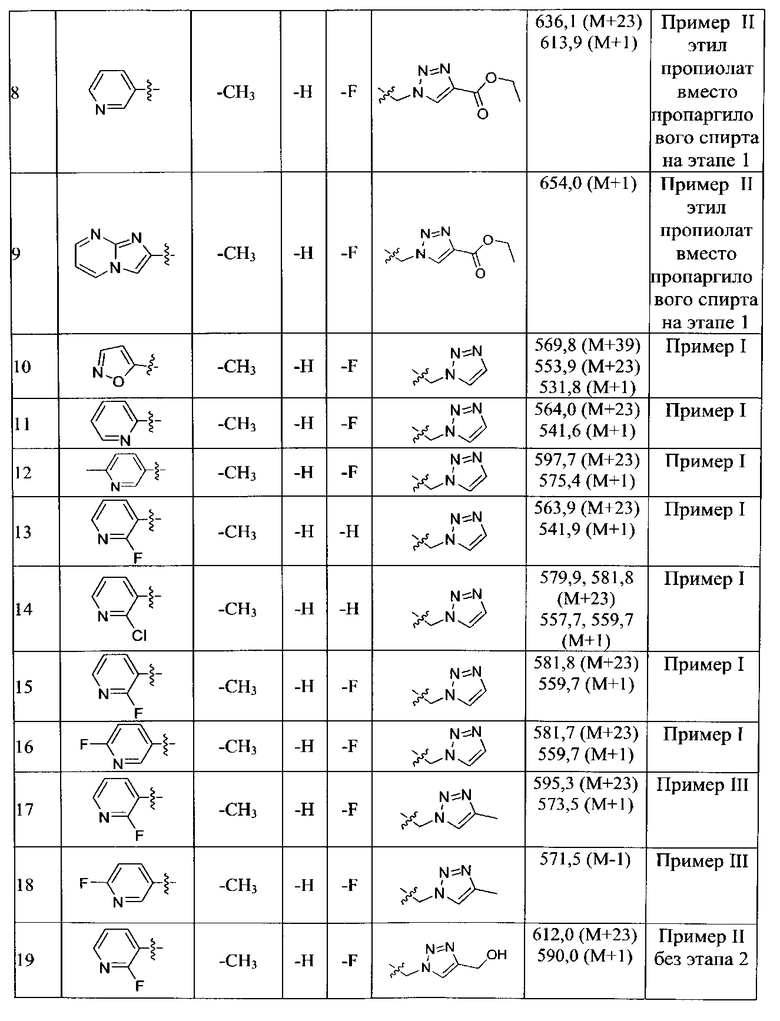
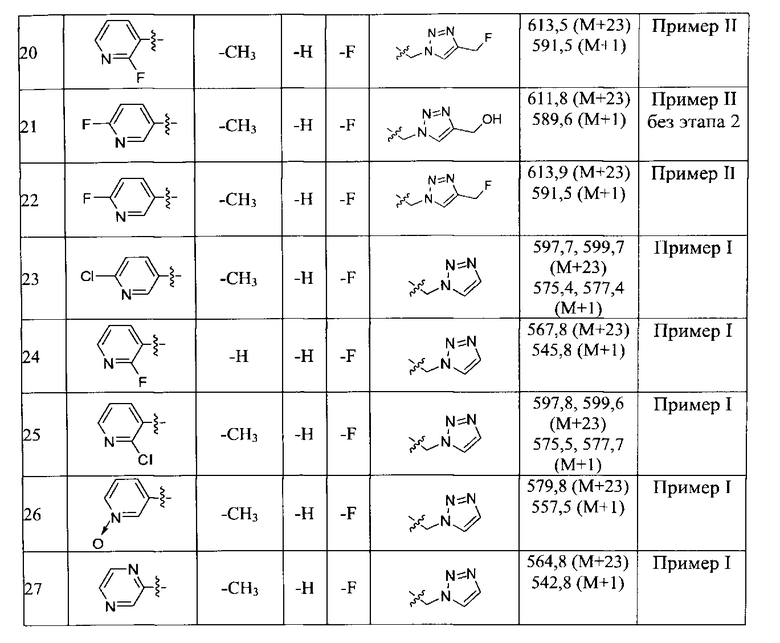
Соединения, перечисленные в Таблице 7, были получены способами, по сути описанными для Примеров I-III.
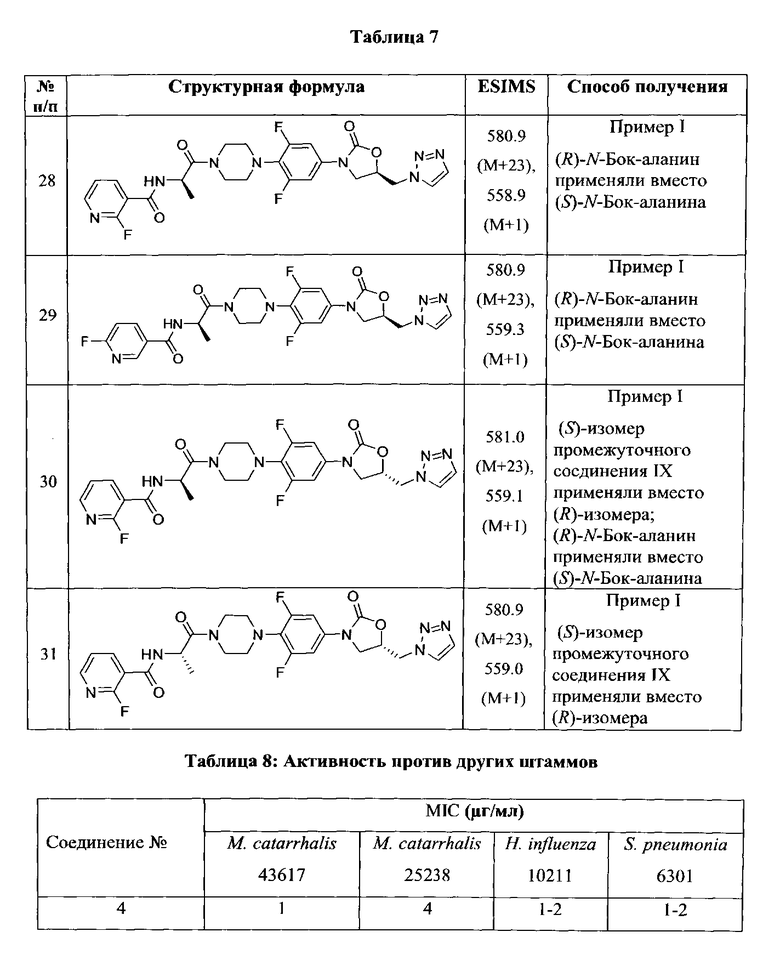
M. catarrhalis: Moraxella catarrhalis
H. influenza: Haemophilus influenza
S. pneumonia: Streptococcus pneumonia
| название | год | авторы | номер документа |
|---|---|---|---|
| ТРИЦИКЛИЧЕСКИЕ КОНДЕНСИРОВАННЫЕ ПРОИЗВОДНЫЕ ПИРИДИН-2-ОНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ BRD4 | 2016 |
|
RU2734959C2 |
| БИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ АЛЛОСТЕРИЧЕСКИХ ИНГИБИТОРОВ SHP2 | 2018 |
|
RU2776846C2 |
| КОМПОЗИЦИИ НА ОСНОВЕ ИНГИБИТОРА SHP2 И СПОСОБЫ ЛЕЧЕНИЯ РАКА | 2018 |
|
RU2805355C2 |
| НОВЫЕ ЗАМЕЩЕННЫЕ 8-ГЕТЕРОАРИЛКСАНТИНЫ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2004 |
|
RU2357969C2 |
| ИНГИБИТОРЫ ALK-КИНАЗЫ | 2013 |
|
RU2675850C2 |
| ТРИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ ИММУНОСУПРЕССИИ, ОПОСРЕДУЕМОЙ МЕТАБОЛИЗИРОВАНИЕМ ТРИПТОФАНА | 2014 |
|
RU2667509C2 |
| ИНГИБИТОР, СОДЕРЖАЩИЙ ТРИЦИКЛИЧЕСКОЕ ПРОИЗВОДНОЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ | 2019 |
|
RU2800543C2 |
| БЕНЗОТИЕПИНЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ, СПОСОБ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ ГИПЕРЛИПИДЕМИЧЕСКОГО СОСТОЯНИЯ | 1997 |
|
RU2202549C2 |
| СОЕДИНЕНИЯ, ПРИМЕНИМЫЕ ДЛЯ ЛЕЧЕНИЯ ИНФЕКЦИИ PASTEURELLA MULTOCIDA ИЛИ MANNHEIMIA HAEMOLYTICA | 2017 |
|
RU2781450C2 |
| КОМБИНАЦИЯ, ВКЛЮЧАЮЩАЯ ИНГИБИТОР ЦИКЛИНЗАВИСИМОЙ КИНАЗЫ 4 ИЛИ ЦИКЛИНЗАВИСИМОЙ КИНАЗЫ 6 (CDK4/6) И ИНГИБИТОР mTOR, ДЛЯ ЛЕЧЕНИЯ РАКА | 2011 |
|
RU2589696C2 |
Данное изобретение относится к соединению Формулы I, его стереоизомерам, включая R и S изомеры, где: ′А′ представляет собой N; Y и Y′ представляют собой О; ′---′ отсутствует; R1 и R2 являются одинаковыми или различными и независимо представляют собой водород или С1-12 алкил; R3 представляет собой водород; R4 представляет собой гетероарил, который может быть факультативно замещенным в любом приемлемом положении одним или более заместителями Ra; Z представляет собой -(CH2)n-гетероарил, который может быть факультативно замещенным в любом приемлемом положении одним или более заместителями Ra; T, U, V и W являются одинаковыми или различными, и независимо представляют водород или галоген; Ra независимо выбран из водорода, галоген, С1-12 алкила, С1-12 галоалкила, -C(=Y)OR7, -(CH2)nYR7, каждый из которых факультативно может быть замещенным в любом приемлемом положении галогеном; R7 представляет собой водород или С1-12 алкил; m представляет собой 1; m′ представляет собой 0; n представляет собой 1; где: указанный гетероарил выбран из 1,2,3-триазолила, пиридинила, 1-оксипиридинила (пиридинил-N-оксида), пиразинила, изоксазолила, имидазо[1,2-α]пиримидинила, имидазо[1,2-α]пиразинила. Соединения данного изобретения применимы для профилактики, облегчения и/или лечения бактериальных инфекций у субъекта. Бактериальная инфекция вызвана устойчивыми к нескольким лекарственным средствам вида Staphylococcus, Streptococcus, Enterococcus, Bacterioides, Clostridia, H. influenza, Moraxella, кислотоустойчивым организмам, таких как Mycobacterium tuberculosis, a также устойчивых к линезолиду видов Staphylococcus и Enterococcus. Технический результат - фенилоксазолидиноновые соединения в качестве противомикробных средств. 4 н. и 8 з.п. ф-лы, 8 табл., 3 пр.
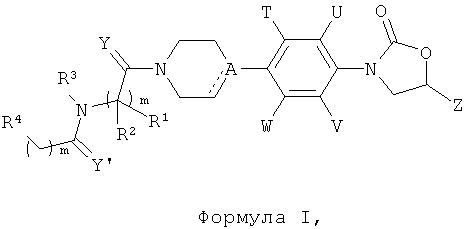
1. Соединение Формулы I,
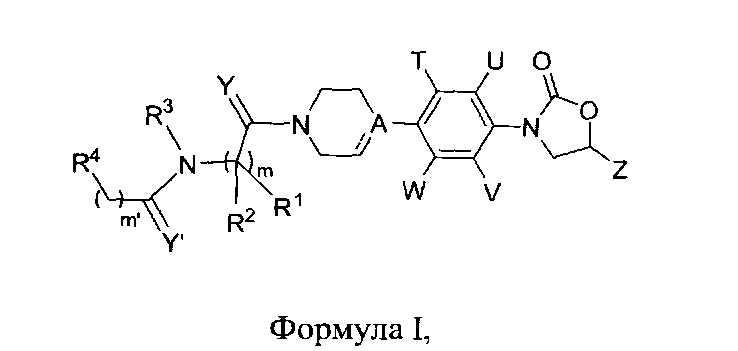
его стереоизомеры, включая R и S изомеры, где:
'А' представляет собой N;
Y и Y′ представляют собой О;
' - - -' отсутствует;
R1 и R2 являются одинаковыми или различными и независимо представляют собой водород или C1-12 алкил;
R3 представляет собой водород;
R4 представляет собой гетероарил, который может быть факультативно замещенным в любом приемлемом положении одним или более заместителями Ra;
Z представляет собой -(СН2)n-гетероарил, который может быть факультативно замещенным в любом приемлемом положении одним или более заместителями Ra;
Т, U, V и W являются одинаковыми или различными и независимо представляют водород или галоген;
Ra независимо выбран из водорода, галогена, С1-12 алкила, С1-12 галоалкила, -C(=Y)OR7, -(CH2)nYR7, каждый из которых факультативно может быть замещенным в любом приемлемом положении галогеном;
R7 представляет собой водород или С1-12 алкил;
m представляет собой 1;
m′ представляет собой 0;
n представляет собой 1;
где:
указанный гетероарил выбран из 1,2,3-триазолила, пиридинила, 1-оксипиридинила (пиридинил-N-оксида), пиразинила, изоксазолила, имидазо[1,2-a]пиримидинила, имидазо[1,2-a]пиразинила.
2. Соединение по п.1, имеющее Формулу Ia, где
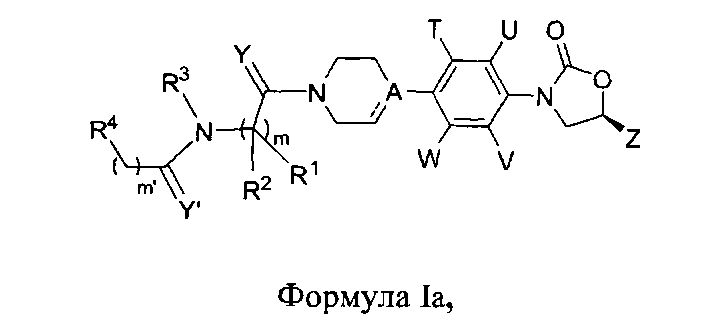
R1, R2, R3, R4, Y, Y′, A, T, U, V, W, Z, m и m′ являются такими, как определено в п.1; его стереоизомеры, включая R и S изомеры их.
3. Соединение по п.1, имеющее Формулу Ib, где
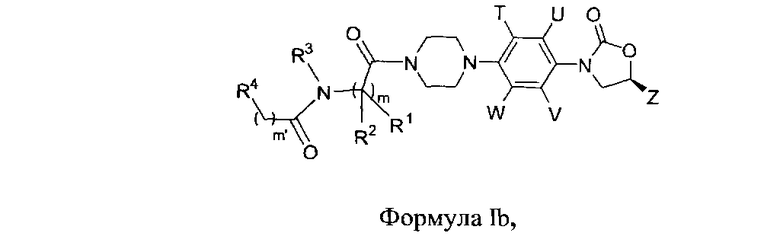
R1, R2, R3, R4, T, U, V, W, Z, m, m′ являются такими, как определено в п.1;
его стереоизомеры, включая R и S изомеры их.4. Соединение по п.1, где R4 выбран из
5. Соединение по п.1, где Т и W независимо представляют фтор, a U и V оба представляют водород.
6. Соединение по п.1, где Z представляет собой -СН2-триазол, который может быть факультативно замещен в любом приемлемом положении одним или более заместителями Ra, как определено в п.1.
7. Соединение по п.6, где Z выбран из
8. Соединение, выбранное из группы, включающей:
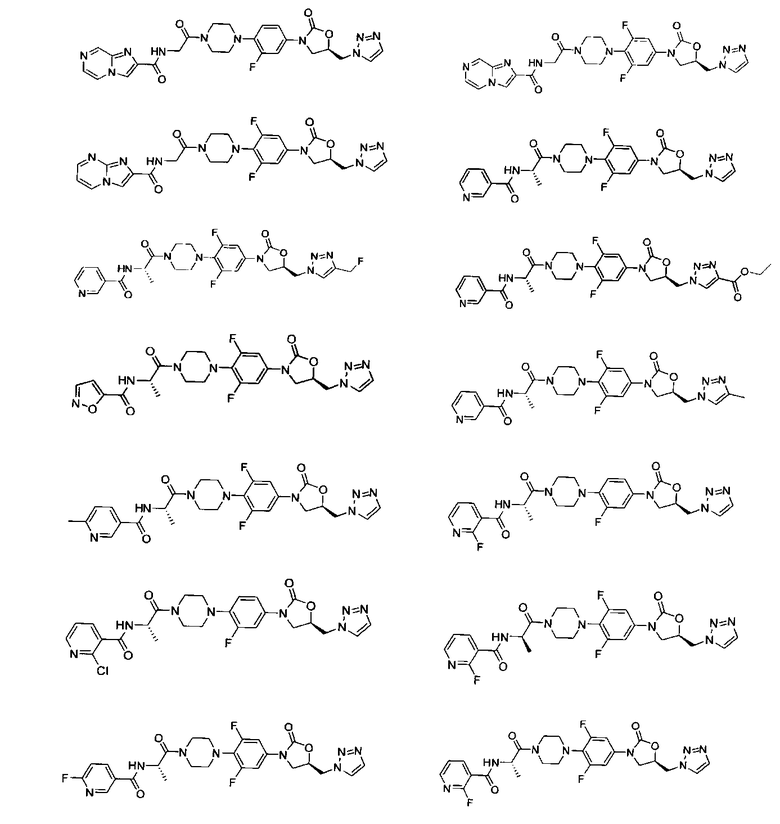
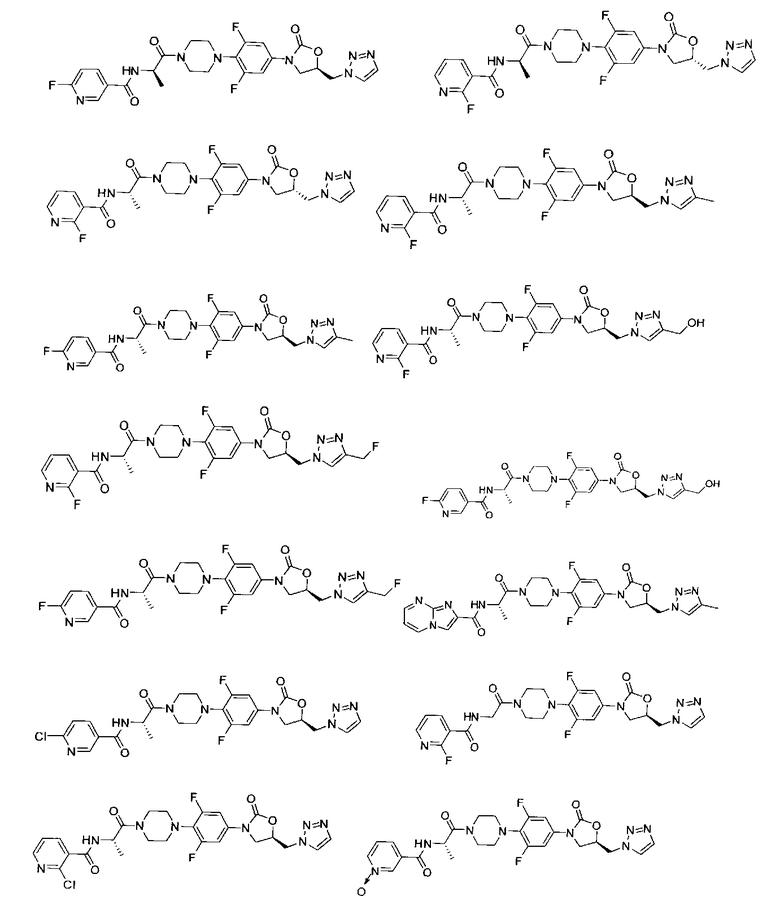
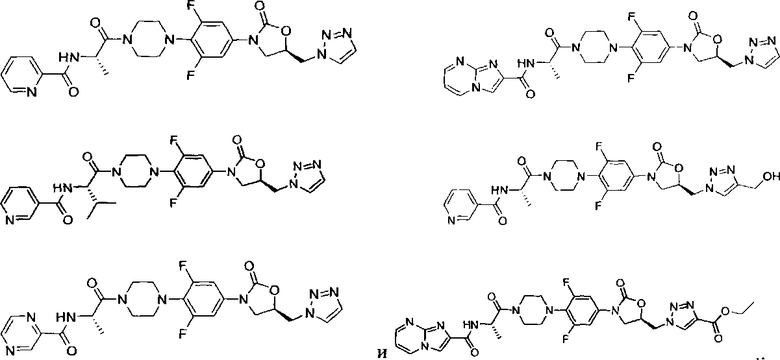
9. Способ профилактики, облегчения и/или лечения бактериальных инфекций у субъекта, нуждающегося в этом, при котором вводят терапевтически эффективное количество соединения Формулы I по п.1.
10. Способ по п.9, где бактериальная инфекция вызвана устойчивыми к нескольким лекарственным средствам видами Staphylococcus, Streptococcus, Enterococcus, Bacterioides, Clostridia, H. influenza, Moraxella, кислотоустойчивыми организмами, такими как Mycobacterium tuberculosis, а также устойчивыми к линезолиду видами Staphylococcus и Enterococcus.
11. Применение соединения Формулы I по п.1 или его стереоизомеров, включая R и S изомеры их, для производства лекарственного препарата для профилактики, облегчения и/или лечения бактериальных инфекций у субъекта, нуждающегося в этом.
12. Применение по п.11, где лекарственный препарат вводится пероральным, буккальным, пульмонарным, местным, подкожным, внутримышечным, внутривенным, трансдермальным, глазным (офтальмическим), ингаляцией, внутриназальным, чрезслизистым, имплантным или ректальным путем.
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| ПОРШЕНЬ ДЛЯ БЫСТРОХОДНЫХ ДВИГАТЕЛЕЙ ВНУТРЕННЕГО ГОРЕНИЯ | 1926 |
|
SU7490A1 |
Авторы
Даты
2014-07-20—Публикация
2009-11-18—Подача