Изобретение относится к медицинской технике и касается способа получения наноструктурированных тонкопленочных кальций-фосфатных покрытий для медицинских имплантатов, которые могут быть использованы в травматологии, ортопедии и стоматологии.
Имплантаты из титана и его сплавов широко используются в стоматологии и ортопедии [Dorozhkin S.V. Calcium orthophosphates // J.Mater. Sci. - 2007. - V.42. - P.1061-1095.]. В последнее время активно внедряются имплантаты из алюмооксидной керамики [Гайдаш А.А., Медведко О.В., Аронов A.M., Пичугин В.Ф., Беркин А.Б. и др. Структурные и физико-химические механизмы консолидации костной ткани с Al2O3-ZrO2 керамикой, покрытой методом магнетронного распыления механосинтезированным гидроксиапатитом. Труды III международной научно-практической конференции «Современные керамические материалы. Свойства. Технологии. Применение (КерамСиб-2011)», 14-16 сентября 2011, Новосибирск, Нонпарель, 2011, стр.11-19.]. Проблемы, связанные с улучшением биосовместимости вводимых в организм материалов и фиксации протеза в костной ткани, ускорением процессов заживления, увеличением срока службы имплантата, успешно решаются путем нанесения на его поверхность биоактивных резорбируемых покрытий из гидроксиапатита (ГА) (стандарт ISO 13779-2:2008 [ISO 13779-2:2008 Имплантаты для хирургии. Гидроксиапатит. Часть 2. Покрытия из гидроксиапатита http://ww.iso.org/iso/ru/iso…file:///catalogue_tc_browse.htm?.]).
Присутствие покрытия из ГА на поверхности имплантата активирует процессы остеосинтеза и приводит к интенсивному образованию костной ткани. Максимальной биологической активностью обладают поликристаллические покрытия, структура которых максимально приближена к биологическому ГА [Yang Y., Kim К.-Н., Ong J.L. A review on calcium phosphate coatings produced using a sputtering process-an alternative to plasma spraying // Biomaterials. 2005. - V.26. - N.3. P.327-337.; Y. Chou, W.Huang, J.C.Y.Dunn, T.A.Miller and В.M.Wu, "The effect of biomimetic apatite structure on osteoblast viability, proliferation, and gene expression", Biomaterials, vol. 26, pp.285-295, 2005/1].
Известен способ получения кальций-фосфатного покрытия методом ВЧ магнетронного распыления на медицинские имплантаты [К. van Dijk, H.G.Schaeken, J.C.G.Wolke, C.H.M.Maree, F.H.P.M.Habraken, J. Verhoeven, J.A.Jansen Influence of discharge power level on the properties of hydroxyapatite films deposited on Ti6A14V with RF magnetron sputtering, J. of Biomedical Materials MResearch, v.29, 269-276, 1995], который заключается в распылении керамической мишени из ГА в плазме ВЧ-разряда мощностью 200-800 Вт при рабочем давлении аргона 0.1-1 Па при температуре образцов 50-550°C.
Недостатком данного способа является зависимость состава и структуры покрытия от расположения образцов относительно мишени, мощности в разряде и температуры образцов.
Известен способ получения кальций-фосфатного покрытия для медицинских имплантатов [Xu, S., Long, J., Sim, L., Diong, C.H., Ostrikov, K., RF Plasma Sputtering Deposition of Hydroxyapatite Bioceramics: Synthesis, Performance, and Biocompatibility. Plasma Proc. Polym., 2005. 2 p.373-390], который заключается в распылении композитной мишени, содержащей гидроксиапатит - Ca10(PO4)6(OH)2(ГА) с отношением кальция к фосфору (Ca/P) 1,67 и титан в плазме высокочастотного (ВЧ) разряда мощностью 700 Вт при рабочем давлении аргона в вакуумной камере 1,2-10 Па на расстоянии 60 мм между мишенью и образцами при отрицательном смещении на подложкодержателе 0-100 В (0 В соответствует случаю заземленного подложкодержателя) в течение 15-120 минут.
Недостатком данного способа является сохраняющаяся зависимость состава и структуры покрытия от расположения образцов относительно мишени.
В качестве прототипа выбран способ получения кальций-фосфатных микро/наноструктур на образце [Патент РФ №2421245, О, МПК7: A61L 27/12 (2006.01), A61F 2/02 (2006.01) Заявка: 2010117527/15, 30.04.2010], заключающийся в распылении мишени из гидроксиапатита Ca10(PO4)6(OH)2 в плазме высокочастотного разряда в вакуумной камере в атмосфере аргона при давлении аргона от 0,1 до 1 Па в течение 15-180 мин на расстоянии от мишени до подложки в интервале от 40 до 50 мм. Отличительным признаком является то, что микро/наноструктурное покрытие формируют при отрицательном смещении на подложкодержателе с образцами при плотности мощности высокочастотного разряда от 0,1 до 0,5 Вт/см2 в атмосфере или аргона, или кислорода.
Недостатком предлагаемого способа является частичная (5-27%) и неконтролируемая степень кристаллизации покрытия, зависящая не только от отрицательного смещения на подложкодержателе, но и от расположения образцов относительно мишени, мощности в разряде и температуры образца. Указанный недостаток делает процесс не технологичным для производства, т.к. такой процесс не обеспечивает воспроизводимость результатов и создание однородного покрытия с заданной структурой на всей поверхности образца.
Задачей предлагаемого изобретения является повышение технологичности процесса получения наноструктурированного кальций-фосфатного покрытия для медицинских имплантатов.
Поставленная задача решается за счет того, что в способе получения наноструктурированного кальций-фосфатного покрытия для медицинских имплантатов, заключающегося в распылении мишени из стехиометрического ГА в плазме ВЧ магнетронного разряда в атмосфере аргона с давлением 0.1-1 Па и плотностью мощности на мишени 0.1-1 Вт/см2, в отличие от прототипа формирование наноструктуры производится после нанесения покрытия путем термического отжига при температуре 700-750 C в течение 15-30 мин.
Методы контроля процесса термического отжига хорошо отработаны. Поэтому предлагаемый способ позволяет получить на всей площади образца в контролируемых, не зависящих от параметров нанесения условиях однородное наноструктурированное покрытие, имеющее степень кристаллизации более 90%.
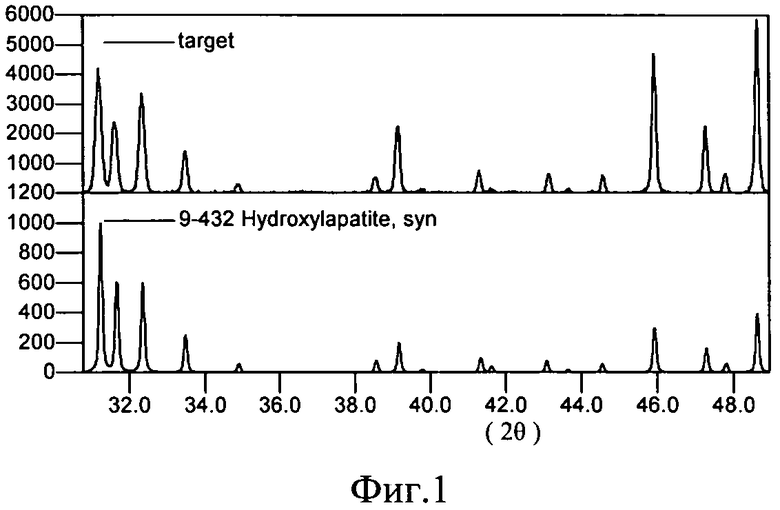
На фиг.1 приведены спектры дифракции СИ: 1 - мишень, 2 - ГА (JCPDS - 09-0432).
На фиг.2 приведены дифрактограммы покрытий на керамике (а) и кремний (б) в процессе отжига; * - пики керамической подложки.
На фиг.3 приведены дифрактограммы покрытий на различных подложках после отжига 700°C: а - кремний; б - керамика; в - чистый титан; г - оксидированный титан; д - ГА (JCPDS 09-432).
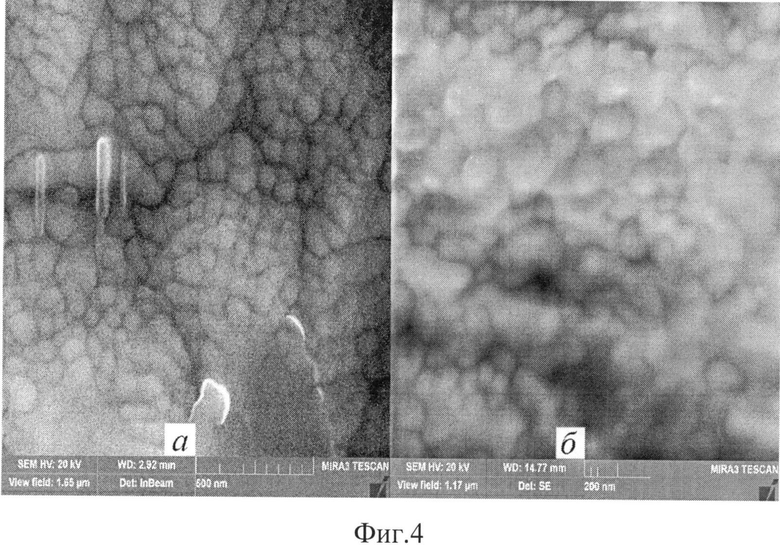
На фиг.4 приведены фотографии морфологии поверхности покрытий на керамике (а) и кремнии (б).
Заявляемый способ реализован с помощью промышленной установки высокочастотного магнетронного распыления УРМ 014. Процесс проводился при давлении аргона 0.1-0.3 Па. Частота ВЧ генератора 13.56 МГц, мощность в разряде - до 1 кВт. Скорость нанесения пленки - (5-6) нм/мин.
Мишенью служил керамический диск из прессованного при температуре 1000°C порошка стехиометрического гидроксиапатита (Ca10(PO4)6(OH)2).
В качестве подложек для исследования состава и структуры покрытий использовались пористая алюмо-циркониевая керамика, титан марки Ti6Al14V, а также и оксидированный титан марки Ti6Al14V. Отработка методики исследований и тестовые анализы проводились на полированных пластинах монокристаллического кремния.
Особенностью метода ВЧ-магнетронного распыления является большая зависимость толщины, состава и структуры кальций-фосфатного покрытия от расположения подложки относительно мишени [К. van Dijk, H.G.Schaeken, J.C.G.Wolke, C.H.M.Maree, F.H.P.M.Habraken, J. Verhoeven, J.AJansen Influence of discharge power level on the properties of hydroxyapatine films deposited on Ti6A14V with RF magnetron sputtering, J. of Biomedical Materials Research, v.29, 269-276, 1995Shuyan Xu, Jidong Long, Lina Sim, Cheong Hoong Diong, Kostya (Ken) Ostrikov RF Plasma Sputtering Deposition of Hydroxyapatite Bioceramics: Synthesis, Performance, and Biocompatibility Plasma Process. Polym. 2005, 2, 373-390. Сурменев P.A., Сурменева В.Ф., Пичугин В.Ф., Эппле М. ВЧ-магнетронные кальций-фосфатные покрытия на материалах медицинских имплантатов. Известия Томского политехнического университета. 2009. т.315. №2, стр.138-141]. Поэтому для напыления в предлагаемом способе образцы размещают во время напыления на вращающемся подложкодержателе. Скорость вращения образцов - 5-10 об/мин. Разброс по толщине и составу пленок составлял менее 5%.
Структурные исследования кальций-фосфатных покрытий выполнены в центре синхротронного излучения (СИ) ИЯФ СО РАН. Длина волны излучения составляла 1.516 нм. Толщина пленок ~ 1 мкм. Для идентификации спектров использовались данные JCPDS [The International Centre for Diffraction Data (ICDD) Diffraction Data (ICDD), (Database Joint Committee on Powder Diffraction Standards (JCPDS)). http://rapidog.com/jcpds-database-rapidshare.html].
Морфология поверхности покрытий контролировалась методом растровой электронной микроскопии на микроскопе высокого разрешения Mira 3 (Tescan) и Hitachi S-3400N с энергодисперсионным рентгеновским анализатором (EDX-spectroscopy) - INCAx-Sight модель 7940 (Oxford). Для определения элементного состава покрытий выбрана энергия анализирующего электронного пучка 10 кэВ.
Свойства формируемого покрытия определяются материалом мишени и режимом напыления. Структура и состав материала мишени (фиг.1) соответствовали составу и структуре порошка стехиометрического гидроксиапатита Ca10(PO)6(OH)2, использованного для прессования. В таблице 1 приведены результаты EDX анализа состава мишени (в скобках указан разброс измерений).
В таблице 2 приведены результаты исследования состава покрытий, полученных на различных подложках и в различных режимах напыления. При нанесении покрытий на подложку, расположенную напротив зоны эррозии мишени, состав кальция лишь незначительно превышает стехиометрический (Ca/P~1.7), а при использовании вращения отношение Ca/P увеличивается до ~ 1.9 - 2.1.
Кристаллическая структура покрытий - важный фактор, определяющий природу поведения клеток на поверхности имплантата, в частности образование и закрепление клетки на поверхности пленки, пролиферацию и дифференциацию клеток на ней. Показано, что на аморфном ГА пролиферация и дифференциация клеток не наблюдается. Хороший биологический эффект при испытаниях in vitro и in vivo наблюдался для поликристаллических кальций-фосфатных покрытий [Y. Yan, J.C.C. Wolke, A.De Ruijter, Li Yubao, J.A.jansen Growth behavior of rat bone marrow cells on RF magnetron sputtered hydroxyapatite and dicalcium pyrofosphate coatings J.of Biomedical Materials Research, part A DOI 10,1002/jbm.a - . DOI: 10,1002/jbm.a.30665].
Формирование кристаллической структуры исследовано in sito при термическом отжиге на воздухе методом дифракции синхротронного излучения.
Результаты проведенных экспериментов для имплантатов из керамики представлены на фиг.2. Для сравнения там же показана динамика кристаллизации покрытий на кремнии.
Непосредственно после напыления покрытия толщиной 1 мкм практически аморфны, степень кристаллизации не превышает 20-25%. Наблюдаются только характерные для ГА линии спектра, соответствующие отражению от кристаллографических плоскостей 2Θ=25,8 (002), 31,7 (211), 32,2 (112). Изменения в спектрах появляются при температурах ~ 400°C, а активная кристаллизация покрытия начинается при 520…530°C. При 700°C структура покрытия сформирована и в дальнейшем не изменяется. Время выдержки при температуре 700°C составляла 15-20 мин. Проявляются практически все пики, соответствующие структуре поликристаллического ГА (JCPDS-09-432) [The International Centre for Diffraction Data (ICDD) Diffraction Data (ICDD), (Database Joint Committee on Powder Diffraction Standards (JCPDS)). http://rapidog.com/jcpds-database-rapidshare.html]. Степень кристаллизации составляет более 90%. Эксперименты in vivo показывают, что наилучший биологический отклик наблюдается в покрытиях, степень кристалличности которых не менее 70…80% [Shuxin Qu, Hong Song Fan, Jiyong chen, Jiamin Feng. Effect of the crystallinity of calcium phosphate ceramics on osteoblast proliferation in vitro. // Journal of Materials Science Letters, 2001. - Vol.20. - P.331-332].
При температуре около 400°C на дифрактограмме появляется дифракционный пик (29=36.5°), который соответствует оксиду кальция (CaO). Присутствие оксида кальция, вероятно, связано с избытком кальция в пленках, по сравнению со стехиометрическим. Пики других кальций фосфатных соединений, являющихся продуктами разложения ГА, не обнаружены.
Результаты исследования структуры покрытий (после отжига при 700°C) на разных подложках (керамика, титан, кремний) приведены на фиг.3. Во всех случаях покрытие соответствует синтетическому гидроксиапатиту с гексагональным типом кристаллической решетки. Небольшие отличия в соотношении интенсивности пиков ГА для разных подложек могут быть обусловлены особенностями съемки спектров при разной морфологии поверхности.
Тонкая структура поверхность пленки исследовалась с помощью РЭМ высокого разрешения (фиг.4):
- образующиеся на начальном этапе кристаллизации из аморфной фазы микрочастицы ГА имеют размеры 20 нм в ширину и 60 нм в длину и состоят из более мелких частиц размером 10-20 нм;
- при последующем отжиге происходит рост и коалесценция частиц с образованием разветвленных агломератов с размером 200×1000 нм, состоящих из наночастиц размером 10-100 нм.
Приведенные результаты доказывают следующие общие закономерности формирования структуры покрытия ГА на различных материалах для медицинских имплантатов:
- независимо от материала и морфологии поверхности подложки (пористая керамика, титан с пористым оксидным покрытием, чистый титан) основным компонентом структуры (более 85%) кальций-фосфатного покрытия, полученного методом ВЧ магнетронного распыления, после отжига при температуре 700°C является гексогональный синтетический гидроксиапатит, соответствующий JCPDS-09-432;
- динамика структурных преобразований в покрытиях в процессе отжига практически одинакова для всех исследованных материалов подложки;
- размер зерна поликристаллов составляет 10-100 нм, что соответствует размеру кристаллов природного биоапатита костной ткани по оценкам микродифракции СИ [Rindby A., Voglis P., Engstrom P. Microdiffraction studies of bone tissues using synchrotron radiation // Biomaterials. - 1998. - V. 19. - P.2083-2090];
- по своему составу и структуре получаемые покрытия соответствуют стандарту ISO 13779-2:2008, определяющему требования к покрытиям из гидроксиапатита для медицинских имплантатов.
Таким образом, предлагаемый способ обеспечивает реализацию технологичного воспроизводимого процесса получения наноструктурированного кальций-фосфатного покрытия на всей поверхности образца, которое соответствует требованиям международного стандарта ISO 13779-2:2008, определяющего требования к покрытиям для медицинских имплантатов. Структура покрытия формируется независимо от процесса нанесения покрытия в ходе последующего контролируемого термического отжига при температуре 700-750°C в течение 15-30 мин.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ КАЛЬЦИЙ-ФОСФАТНОГО ПОКРЫТИЯ НА ОБРАЗЦЕ | 2009 |
|
RU2400423C1 |
| СПОСОБ ПОЛУЧЕНИЯ НА ПОДЛОЖКЕ КАЛЬЦИЙ-ФОСФАТНОГО ПОКРЫТИЯ | 2008 |
|
RU2372101C1 |
| СПОСОБ ПОЛУЧЕНИЯ КАЛЬЦИЙ-ФОСФАТНЫХ МИКРО/НАНОСТРУКТУР НА ОБРАЗЦЕ | 2010 |
|
RU2421245C1 |
| Способ функционализации поверхности медицинского изделия путем наклонного осаждения структурированного антибактериального покрытия на основе фосфатов кальция | 2022 |
|
RU2806506C1 |
| Способ получения кальцийфосфатного покрытия на образце | 2019 |
|
RU2715055C1 |
| СПОСОБ ПОЛУЧЕНИЯ КАЛЬЦИЙФОСФАТНОГО ПОКРЫТИЯ НА ИМПЛАНТАТЕ ИЗ БИОИНЕРТНОГО МАТЕРИАЛА (ВАРИАНТЫ) | 2012 |
|
RU2476243C1 |
| СПОСОБ МОДИФИЦИРОВАНИЯ ПОВЕРХНОСТИ ТИТАНОВЫХ ИМПЛАНТАТОВ | 2016 |
|
RU2630578C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИМПЛАНТАЦИОННОГО МАТЕРИАЛА НА ОСНОВЕ ПОРИСТОГО ПОЛИТЕТРАФТОРЭТИЛЕНА И МАТЕРИАЛ, ПОЛУЧЕННЫЙ ЭТИМ СПОСОБОМ | 2007 |
|
RU2325191C1 |
| Способ плазменного напыления биосовместимых покрытий на основе трикальцийфосфата с дополнительным легирующим элементом | 2020 |
|
RU2754129C1 |
| Способ получения антибактериального кальцийфосфатного покрытия на ортопедическом имплантате, имеющем форму тела вращения и оснастка для его осуществления (варианты) | 2020 |
|
RU2745726C1 |


Изобретение относится к медицинской технике и может быть использовано в стоматологии, травматологии и ортопедии. Описан способ получения наноструктурированнного кальций-фосфатного покрытия для медицинских имплантатов, заключающийся в распылении мишени из стехиометрического гидроксиапатита Ca10(PO4)6(OH)2 в плазме высокочастотного магнетронного разряда в атмосфере аргона при давлении 0.1-1 Па и плотностью мощности на мишени 0.1-1 Вт/см2 в течение 15-180 мин на расстоянии от мишени до подложки в интервале от 40 до 50 мм, где формирование наноструктуры производится после нанесения покрытия в ходе контролируемого термического отжига при температуре 700-750°C в течение 15-30 мин. Изобретение направлено на повышение технологичности производственного процесса нанесения покрытия. 4 ил.
Способ получения наноструктурированного кальций-фосфатного покрытия для медицинских имплантатов, заключающийся в распылении мишени из гидроксиапатита Ca10(PO4)6(OH)2 в плазме высокочастотного разряда в вакуумной камере в атмосфере аргона при давлении аргона от 0,1 до 1 Па в течение 15-180 мин на расстоянии от мишени до подложки в интервале от 40 до 50 мм, отличающийся тем, что формирование наноструктуры производят после нанесения покрытия путем термического отжига при температуре 700-750оC в течение 15-30 мин.
| СПОСОБ ПОЛУЧЕНИЯ КАЛЬЦИЙ-ФОСФАТНЫХ МИКРО/НАНОСТРУКТУР НА ОБРАЗЦЕ | 2010 |
|
RU2421245C1 |
| СПОСОБ ФОРМИРОВАНИЯ НАНОСТРУКТУРИРОВАННОГО БИОСОВМЕСТИМОГО ПОКРЫТИЯ НА ИМПЛАНТАТАХ | 2011 |
|
RU2448741C1 |
| КАЛЬЦИЙ-ФОСФАТНОЕ БИОЛОГИЧЕСКИ АКТИВНОЕ ПОКРЫТИЕ НА ИМПЛАНТАТЕ И СПОСОБ ЕГО НАНЕСЕНИЯ | 2009 |
|
RU2423150C1 |
Авторы
Даты
2014-07-20—Публикация
2013-04-09—Подача