Изобретение относится к способам нанесения кальцийфосфатных покрытий и может быть использовано в медицине при изготовлении медицинских изделий с биопокрытием. Изобретение направлено на функционализацию поверхности медицинских изделий, применяющихся в травматологии, ортопедии, протезировании, реконструктивно-восстановительной хирургии и др.
Разработанный способ функционализации поверхности медицинских изделий перспективен для улучшения характеристик медицинских изделий из биоинертных металлов или керамики, имеющих планарную форму таких как пластины для остеосинтеза, иных систем, состоящих из пластин и пинов для костей лицевого скелета.
Авторами изобретения предложен метод формирования кальцийфосфатных (КФ) биопокрытий на металлических и керамических подложках путем ВЧ магнетронного распыления мишеней на основе КФ соединений в геометрии наклонного осаждения. Такой подход позволяет управлять нанотопографией биопокрытия, что в свою очередь в значительной степени влияет на адгезию биообъектов и остеоинтеграционные процессы. Вакуумное наклонное напыление покрытий позволяет получать наноструктурированные покрытия с упорядоченным расположением структурных элементов по поверхности подложки. В основе этого подхода лежит теневой эффект, или эффект самозатенения, при котором сформированные на поверхности подложки зародыши структуры покрытия в процессе осаждения образуют за собой теневую область, где адсорбция атомов распыляемого вещества минимальна, а рост покрытия преимущественно происходит путем конденсации налетающих атомов на этих зародышах.
Из патента CA2237732, опубл. 10.01.1999 [1] известен способ получения тонких пленок вакуумным осаждением путем вращения подложки, расположенной под наклоном относительно налетающего потока частиц. Подложку вращают вокруг собственной оси, нормальной к поверхности подложки во время осаждения покрытия, а затем приостанавливают для получения столбчатой структуры тонкой пленки, ориентированной в сторону потока налетающих частиц. Полученная тонкая пленка обладает пористостью, которая не зависит от угла роста столбчатой структуры.
Недостатком данного метода является то, что данный метод не используется для нанесения биоактивных покрытий. Не учтена наношероховатость полученных слоев и ее влияние на свойства поверхности. Метод требует сложной, многоузловой системы вращения подложколержателя относительно источника частиц.
Из патента US7998539, опубл. 18.02.2010 [2] известен способ формирования тонкопленочной структуры путем наклонного осаждения. Способ включает этапы: испарения материала мишени в камере с помощью электронного луча в вакуумной камере, подачи технологического газа в камеру и регулирования угла наклона подложки, а также контроля температуры в камере во время испарения для формирования тонкой пленки на подложке путем осаждения под наклоном, и последующего отжига модифицированной подложки для формирования пористой микроструктуры. Способ отличается тем, что материалом мишени является оксид индия-олова, оксид алюминия-цинка или ZnO.
Недостатком данного способа является необходимость дополнительного этапа при изготовлении пористой структуры покрытия - отжига. Недостатком способа также является использование материала мишени непригодного к использованию в области биомедицины.
Из патента WO2015162329, опубл. 29.10.2015 [3] известен способ формирования наноструктурированной поверхности на основе титана. Нанотопографические характеристики указанных имплантатов ингибируют бактериальную адгезию и образование бактериальной биопленки на поверхности, при этом имплантаты одновременно проявляют подходящие свойства для адгезии и пролиферации костеобразующих клеток. Изобретение также относится к способу изготовления имплантата с помощью техники наклонного осаждения и его применению в костной имплантологии.
Недостатком известного метода является использование в качестве покрытия биоинертного материала - оксида титана, что не позволяет управлять скоростью заживления и остеоинтеграцией функционализированного изделия.
Известен способ формирования антимикробного покрытия из патента RU2504349, опубл. 20.01.2014 [4], технический результат которого достигается путем предварительной подготовки серебросодержащего раствора. При подготовке серебросодержащего раствора сначала помещают порошок гидроксиапатита в 0,04% раствор AgNO3. Затем осуществляют выдержку порошка на воздухе при комнатной температуре в течение времени, необходимого для качественной пропитки частиц гидроксиапатита раствором AgNO3. Формирование покрытия производят плазменным напылением сначала титанового подслоя и затем серебросодержащего порошка гидроксиапатита. При этом плазменное напыление титанового подслоя осуществляют при напряжении 35 В, силе тока 450 A, дистанции напыления 100 мм и дисперсности титанового порошка 100-120 мкм, расход аргона 55-60 л/мин. Плазменное напыление серебросодержащего порошка гидроксиапатита производят при силе тока 450 А, напряжении 35 В, дистанции 80 и 120 мм, дисперсности 70-75 мкм и расходе аргона 65-70 л/мин.
Недостатком способа является многоступенчатый процесс подготовки образца перед модификацией. Антибактериальный эффект достигается путем активности ионов серебра, без участия влияния морфологии поверхности на адгезию и жизнедеятельность биообъектов.
Известен способ получения наноструктурированного кальцийфосфатного покрытия для медицинских имплантатов из патента RU2523410, опубл. 20.07.2014 [5], заключающийся в распылении мишени из стехиометрического гидроксиапатита Ca10(PO4)6(OH)2 в плазме высокочастотного магнетронного разряда в атмосфере аргона при давлении 0.1-1 Па и плотностью мощности на мишени 0.1-1 Вт/см2 в течение 15-180 мин на расстоянии от мишени до подложки в интервале от 40 до 50 мм, где формирование наноструктуры производится после нанесения покрытия в ходе контролируемого термического отжига при температуре 700-750 °C в течение 15-30 мин.
Недостатком способа является трудоемкость процесса за счет выполнения дополнительной операции термического отжига при температуре 700-750 °C в течение 15-30 мин для формирования наноструктуры покрытия. Кроме того, способ реализуется только для одного кальцийфосфатного соединения - гидроксиапатита.
Прототипом заявленного изобретения является способ получения кальцийфосфатного покрытия на образце, известный из патента RU2715055, опубл. 25.02.2020 [6]. Способ включает распыление мишени, содержащей, по крайней мере, одно кальцийфосфатное соединение, в плазме высокочастотного разряда в вакуумной камере магнетронной распылительной системы, в атмосфере аргона на образцы, размещенные на подложке, как в зоне эрозии мишени, так и вне области эрозии мишени. При этом, по крайней мере, один образец размещают на поворотном столе вакуумной камеры на расстоянии 70-90 мм от нижней плоскости мишени, причем мишень выполнена из кальцийфосфатных соединений, выбранных из ряда: гидроксилапатит, и/или ионозамещенные гидроксиапатиты, и/или трикальцийфосфат, и/или ионозамещенный трикальцийфосфат, и/или тетракальцийфосфат, и/или биостекло. Покрытие формируют следующим образом: - откачивают вакуумную камеру до остаточного давления не выше 6,0*10-4 Па, заполняют затем аргоном и доводят до рабочего давления (5,0-12,0)*10-2 Па, проводят ионную очистку образца в течение 5-10 минут, разместив его в зоне ионного источника; - при рабочем давлении (1,3-4,0)*10-1 Па зажигают ВЧ магнетронный разряд на мощности 50 Вт с последующим ступенчатым через интервал в 50 Вт подъемом мощности до 300 Вт и выдержкой по 10 минут на каждой ступени; - проводят процесс ВЧ магнетронного распыления покрытия из мишени доведением рабочего вакуума до значения (9,0-12,0)*10-2 Па, введением образца в зону магнетрона и выдержкой в этой позиции в течение 2-10 часов. Достигается повышение эффективности, а также - ускорение и упрощение процесса.
Недостатком изобретения является расположение образцов перпендикулярно потоку налетающих частиц, а значит невозможность управления ростом структурных элементов поверхности используя эффект самозатенения.
Технической задачей настоящего изобретения является разработка способа функционализации поверхности имплантата, путем наклонного осаждения структурированного антибактериального покрытия на основе фосфатов кальция.
Техническим результатом является получение имплантата с покрытием основе гидроксиапатита с ионами цинка или меди путем наклонного осаждения на поверхность металлического или керамического имплантата, что обеспечивает создание условий для эффективного заживления костной ткани и подавления риска инфицирования патогенными микроорганизмами за счет действия антибактериальных ионов и особенностей морфологии поверхности.
Указанный технический результат достигается тем, что способ функционализации поверхности имплантата, путем наклонного осаждения структурированного антибактериального покрытия на основе фосфатов кальция включает распыление мишени из цинк- или медьсодержащего гидроксиапатита, в форме плоского диска толщиной 2-4,5 мм с диаметром, совпадающим с диаметром катода магнетрона, закрепленной на катоде магнетрона, в плазме высокочасточного (ВЧ) магнетронного разряда в атмосфере аргона, при размещении, по крайней мере, одного имплантата на держателе поворотного стола вакуумной камеры на расстоянии 37-80 мм от нижней плоскости мишени, в котором при формировании антибактериального покрытия имплантата, откачивают вакуумную камеру до остаточного давления не выше 6,0*10-4 Па, заполняют затем аргоном и доводят до рабочего давления (1,0-3,0)*10-1 Па, зажигают ВЧ магнетронный разряд на мощности 50 Вт с последующим ступенчатым, через интервал в 50 Вт, подъемом мощности до 200-300 Вт и выдержкой по 10 минут на каждой ступени, проводят процесс ВЧ магнетронного распыления антибактериального покрытия из мишени с доведением рабочего вакуума давления с введением имплантата в зону магнетрона и выдержкой в зоне магнетрона, при этом осаждение является наклонным, по крайней мере, один имплантат размещают на держателе с фиксирующими элементами, способными обеспечивать наклон поверхности имплантата в диапазоне угла от 40° до 85° относительно направления потока налетающих частиц, при формировании антибактериального покрытия, проводят процесс ВЧ магнетронного распыления антибактериального покрытия из мишени с доведением рабочего вакуума давления до значения (7,0-9,0)*10-2 Па с введением имплантата в зону магнетрона и выдержкой в зоне магнетрона в течение 4-8 часов.
Имплантату, имеющему плоскую форму и габариты, превышающие зону эрозии мишени, придают возвратно-поступательное движение в процессе проведения ВЧ магнетронного напыления.
Имплантату, имеющему плоскую форму и габариты, превышающие зону эрозии мишени, придают одновременно возвратно-поступательное движение и вращательное вокруг оси имплантата в процессе проведения ВЧ магнетронного напыления.
Имплантату, имеющему плоскую форму и габариты, превышающие зону эрозии мишени, придают одновременно возвратно-поступательное движение и вращательное вокруг оси имплантата в процессе проведения ВЧ магнетронного напыления.
При условии, если произведение давления в рабочей камере к расстоянию между имплантатом и нижней плоскости мишени составляет менее 10 Па*см, при этом отношение расстояния между мишенью и подложкой к величине окружности мишени составляет более 3,5, то используют коллиматор для выправления углового распределения потока частиц, вылетающих с поверхности мишени и усиления теневого эффекта.
Коллиматор представляет собой ячеистую решетку в форме сот, высота стенок которой не превышает 5 мм, при этом коллимация потока достигается путем пропускания атомов, преимущественно направленных перпендикулярно к поверхности подложкодержателя. При этом атомы, направленные не перпендикулярно к подложке, осаждаются на стенках коллиматора и не участвуют в процессе конденсации на имплантате.
Раскрытие сущности изобретения.
Для осуществления процесса ВЧ-магнетронного распыления используют магнетронную распылительную систему планарного типа с частотой источника 13,56 МГц. Заявленные диапазоны параметров процесса ВЧ-магнетронного распыления и последовательность технологических приемов обеспечивают контролируемые физико-механические свойства и морфологические особенности формируемых КФ покрытий на поверхности обрабатываемого имплантата. Морфологические свойства сформированных покрытий в диапазоне углов α от 40° до 85° характеризуются направленным ростом ориентированных структурных элементов в наномасштабном диапазоне, что подтверждается путем анализа поверхности в растровом электронном микроскопе. Шероховатость (Ra, Rq) поверхности после наклонного осаждения в среднем больше, чем при осаждении без наклона в 1,5-3 раза, согласно результатам атомно-силовой микроскопии.
Изобретение иллюстрирует фиг. 1, на котором приведено схематическое расположение имплантатов по отношению к магнетронной распылительной системе планетарного типа, используемой при формировании покрытий в ходе наклонного осаждения. Также на схеме приведена фотография коллиматора потока и его расположение в ходе процесса напыления.
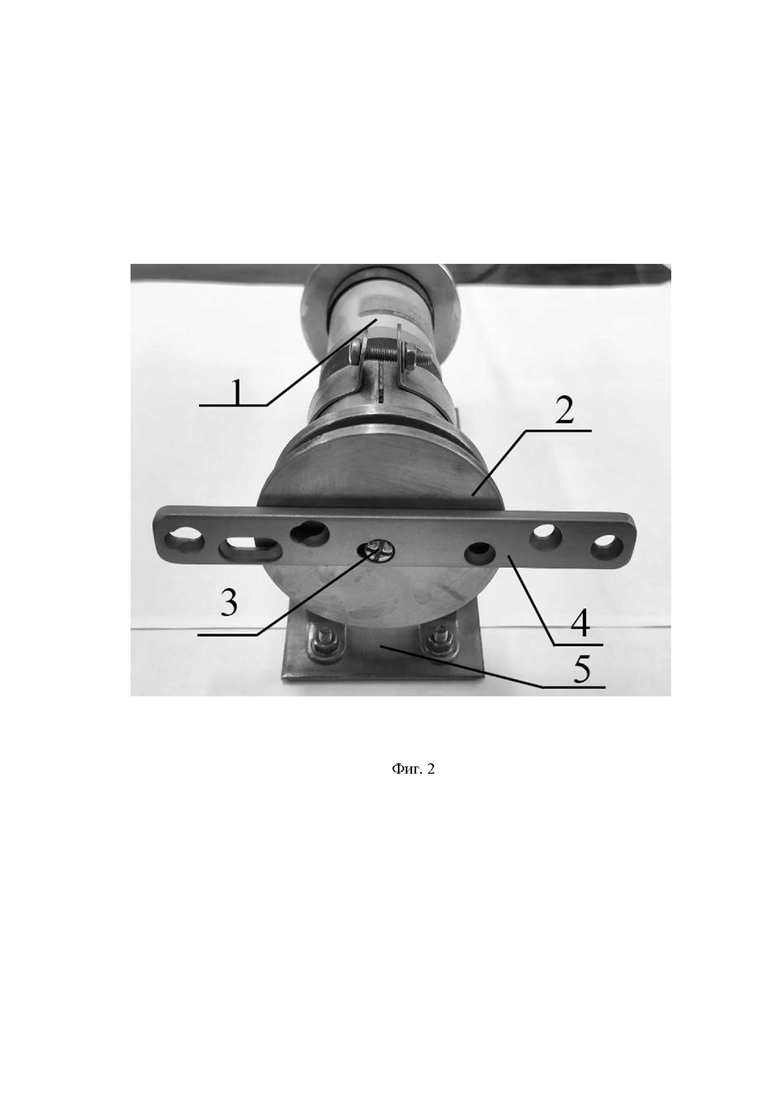
На фиг. 2 приведено расположение имплантата для остеосинтеза на держателе с электродвигателем. Имплантат, выполненный из титанового сплава ВТ1-0 (4) на держателе изделий (2), оборудованного двигателем постоянного тока (1), при этом угол наклона плоскости держателя составляет α = 80°, при этом вращение осуществляется вокруг оси (3) держателя, а описанная система фиксируется на карусельном механизме вакуумной камеры при помощи расположения базы (5) на консоли. Вращение имплантата может осуществляться с постоянной скоростью в диапазоне 1-10 об/мин или имплантат поворачивают на 180° однократно в середине цикла осаждения, с целью увеличить степень однородности покрытия по обрабатываемой площади.
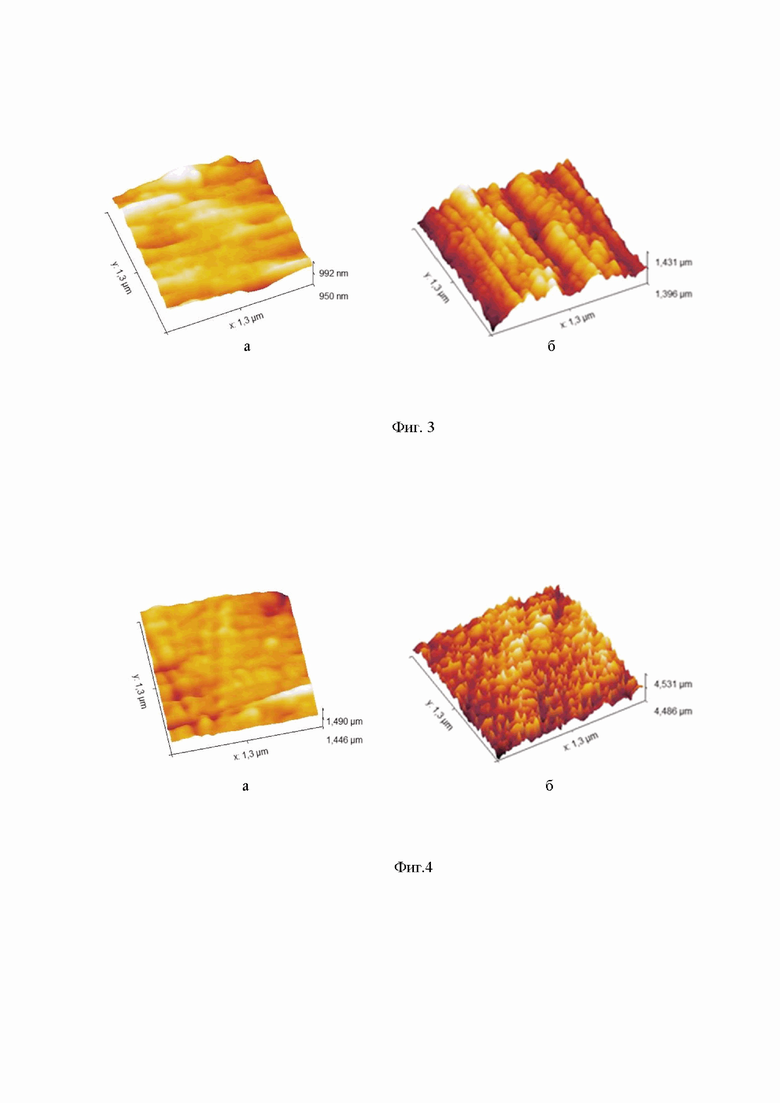
На фиг. 3 приведена морфология поверхности антибактериального покрытия, полученного на пластине из титанового сплава ВТ1-0 в классическом режиме осаждения (а) и в режиме наклонного осаждения (б).
На фиг. 4 приведена морфология поверхности антибактериального покрытия, полученного на пластине из титанового сплава ВТ1-0 в классическом режиме осаждения (а) и в режиме наклонного осаждения (б).
На фиг. 5 приведена морфология поверхности антибактериального покрытия, полученного на титановой пластине для остеосинтеза в режиме наклонного осаждения.
На фиг. 6 приведена морфология поверхности антибактериального покрытия, полученного на поликоровой пластине в режиме наклонного осаждения.
Примеры реализации изобретения.
Пример 1.
В качестве имплантата использовали пластину размерами 50х50 мм из титана марки ВТ1-0 с исходной шероховатостью Ra=1,93 нм, определенной путем исследования на атомно-силовом микроскопе на участке анализа 1,3×1,3 мкм. В качестве мишени использовали цинк-замещенный гидроксиапатит, доля замещения составляла 0,4 моль.
Имплантат размещали в вакуумной камере под углом α = 0° и α = 80° на стационарном держателе. Расстояние от нижней плоскости мишени до поверхности имплантата составляло 50 мм. В ходе осаждения покрытий имплантат не перемещали. Производили откачку вакуумной камеры до остаточного давления не выше 6,0*10-4 Па, затем заполняли аргоном и доводили до давления рабочего газа (1,3-4,0)*10-1 Па зажигали ВЧ магнетронный разряд установив значение мощности 50 Вт с последующим ступенчатым через интервал в 50 Вт подъемом мощности до 200 Вт и выдержкой по 10 минут на каждой ступени. Проводят процесс ВЧ магнетронного распыления из мишени доведением рабочего давления до значения (7,0-9,0)*10-2 Па, введением имплантата в зону магнетрона и выдержкой в зоне магнетрона в течение 4 часов.
Толщина цинксодержащего кальцийфосфатного покрытия на имплантате составляла 760±30 нм. Среднеквадратичная шероховатость (Rq) поверхности имплантата без наклона составляла 0,99 нм, в случае поверхности имплантата, расположенного под углом α = 80°, составляла 3,03 нм. Трехмерные изображения области сканирования в ходе исследования на атомно-силовом микроскопе представлены на фиг. 3. Антибактериальное покрытие по примеру 1 обладает повышенной биосовместимостью и антибактериальными свойствами за счет морфологических особенностей и состава поверхности.
Пример 2.
В качестве имплантата использовали пластину размерами 100х100 мм из титана марки ВТ1-0 с исходной шероховатостью Ra=2,93 нм, определенной путем исследования на атомно-силовом микроскопе на участке анализа 1,3×1,3 мкм. В качестве мишени использовали медь-замещенный гидроксиапатит, доля замещения составляла 0,2 моль.
Имплантат размещали в вакуумной камере под углом α = 0° и α = 85° на держателе с двигателем, совершающем возвратно-поступательное движение. Расстояние от нижней плоскости мишени до поверхности имплантата составляло 60 мм. В ходе осаждения покрытий имплантат не перемещали. Производили откачку вакуумной камеры до остаточного давления не выше 6,0*10-4 Па, При давлении рабочего газа (1,3-4,0)*10-1 Па зажигали ВЧ магнетронный разряд установив значение мощности 50 Вт с последующим ступенчатым через интервал в 50 Вт подъемом мощности до 300 Вт и выдержкой по 10 минут на каждой ступени. Проводят процесс ВЧ магнетронного распыления покрытия из мишени доведением рабочего давления до значения (7,0-9,0)*10-2 Па, введением имплантата в зону магнетрона и выдержкой в зоне магнетрона в течение 4 часов. После чего при помощи электродвигателя изделию придавали возвратно-поступательное движение и продолжали осаждение в течение 4 часов.
Толщина медьсодержащего кальцийфосфатного покрытия на имплантате составляла 890±45 нм. Среднеквадратичная шероховатость (Rq) поверхности имплантата без наклона составляла 1,71 нм, в случае поверхности имплантата, расположенного под углом α = 85°, составляла 5,53 нм. Трехмерные изображения области сканирования в ходе исследования на атомно-силовом микроскопе представлены на фиг. 4. Антибактериальное покрытие по примеру 2 обладает повышенной биосовместимостью и антибактериальными свойствами за счет морфологических особенностей и состава поверхности.
Пример 3.
В качестве имплантата использовали пластину для остеосинтеза 100х100 мм из титана марки ВТ1-0 с исходной шероховатостью Ra=0,3 мкм. В качестве мишени использовали медь-замещенный гидроксиапатит, доля замещения составляла 0,2 моль.
Имплантат размещали в вакуумной камере под углом α = 0° и α = 85° на держателе с электродвигателем. Расстояние от нижней плоскости мишени до поверхности имплантата составляло 70 мм. Производили откачку вакуумной камеры до остаточного давления не выше 6,0*10-4 Па, затем заполняли аргоном и доводили до давления рабочего газа (1,3-4,0)*10-1 Па зажигали ВЧ магнетронный разряд установив значение мощности 50 Вт с последующим ступенчатым через интервал в 50 Вт подъемом мощности до 250 Вт и выдержкой по 10 минут на каждой ступени. Проводят процесс ВЧ магнетронного распыления покрытия из мишени доведением рабочего давления до значения (7,0-9,0)*10-2 Па, введением имплантата в зону магнетрона и выдержкой в зоне магнетрона в течение 3 часов. После чего при помощи электродвигателя имплантат вращали вокруг оси на 180° и продолжали осаждение в течение 3 часов.
Толщина медьсодержащего кальцийфосфатного покрытия на имплантате составляла 1630±120 нм. Средняя шероховатость (Rа) поверхности имплантата составляла 0,4 мкм. При этом морфология поверхности в значительной степени изменилась. На фиг. 5 представлен пример вида поверхности имплантата после напыления. Антибактериальное покрытие по примеру 3 обладает повышенной биосовместимостью и антибактериальными свойствами за счет морфологических особенностей и состава поверхности.
Пример 4.
В качестве имплантата использовали пластину из поликора размерами 10х10 мм с исходной шероховатостью Ra= 0,1 мкм. В качестве мишени использовали цинк-замещенный гидроксиапатит, доля замещения составляла 0,4 моль.
Имплантат размещали в вакуумной камере под углом α = 60° на стационарном держателе. Расстояние от нижней плоскости мишени до поверхности имплантата составляло 37 мм, при этом между поверхностью имплантата и нижней плоскости мишени устанавливали коллиматор. Производили откачку вакуумной камеры до остаточного давления не выше 6,0*10-4 Па, затем заполняли аргоном и доводили до давления рабочего газа (1,3-4,0)*10-1 Па зажигали ВЧ магнетронный разряд установив значение мощности 50 Вт с последующим ступенчатым через интервал в 50 Вт подъемом мощности до 250 Вт и выдержкой по 10 минут на каждой ступени. Проводят процесс ВЧ магнетронного распыления покрытия из мишени доведением рабочего давления до значения (7,0-9,0)*10-2 Па, введением имплантата в зону магнетрона и выдержкой в зоне магнетрона в течение 5 часов.
Толщина медьсодержащего кальцийфосфатного покрытия на имплантате составляла 926±53 нм. Средняя шероховатость (Rа) поверхности имплантата составляла 0,2 мкм. При этом морфология поверхности имплантата в значительной степени изменилась. На фиг. 6 представлен пример вида поверхности имплантата после напыления. Антибактериальное покрытие по примеру 4 обладает повышенной биосовместимостью и антибактериальными свойствами за счет морфологических особенностей и состава поверхности.
Пример 5.
В качестве имплантата использовали пластину размерами 100х100 мм из титана марки ВТ1-0 с исходной шероховатостью Ra=3,56 нм, определенной путем исследования на атомно-силовом микроскопе на участке анализа 1,3х1,3 мкм. В качестве мишени использовали медь-замещенный гидроксиапатит, доля замещения составляла 0,2 моль.
Имплантат размещали в вакуумной камере под углом α = 40° на держателе, позволяющим реализовать возвратно-поступательное движение. Расстояние от нижней плоскости мишени до поверхности имплантата составляло 80 мм. В ходе осаждения покрытий с имплантатом совершали вращательное движение вокруг своей оси со скоростью 10 об/мин. Производили откачку вакуумной камеры до остаточного давления не выше 6,0*10-4 Па, При давлении рабочего газа (1,3-4,0)*10-1 Па зажигали ВЧ магнетронный разряд установив значение мощности 50 Вт с последующим ступенчатым через интервал в 50 Вт подъемом мощности до 300 Вт и выдержкой по 10 минут на каждой ступени. Проводят процесс ВЧ магнетронного распыления покрытия из мишени доведением рабочего давления до значения (7,0-9,0)*10-2 Па, введением имплантата в зону магнетрона и выдержкой в зоне магнетрона в течение 6 часов. На протяжении всего времени осаждения покрытия, имплантат подвергалось одновременно возвратно-поступательному движению и вращению вокруг своей оси со скоростью 10 об/мин.
Толщина медьсодержащего кальцийфосфатного покрытия на имплантате составляла 1490±78 нм. Среднеквадратичная шероховатость (Rq) поверхности имплантата, расположенного под углом α =40°, составляла 4,48 нм. Антибактериальное покрытие по примеру 5 обладает повышенной биосовместимостью и антибактериальными свойствами за счет морфологических особенностей и состава поверхности.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения кальцийфосфатного покрытия на образце | 2019 |
|
RU2715055C1 |
| Способ получения антибактериального кальцийфосфатного покрытия на ортопедическом имплантате, имеющем форму тела вращения и оснастка для его осуществления (варианты) | 2020 |
|
RU2745726C1 |
| СПОСОБ ПОЛУЧЕНИЯ КАЛЬЦИЙФОСФАТНОГО ПОКРЫТИЯ НА ИМПЛАНТАТЕ ИЗ БИОИНЕРТНОГО МАТЕРИАЛА (ВАРИАНТЫ) | 2012 |
|
RU2476243C1 |
| Способ плазменного напыления биосовместимых покрытий на основе трикальцийфосфата с дополнительным легирующим элементом | 2020 |
|
RU2754129C1 |
| СПОСОБ ПОЛУЧЕНИЯ КАЛЬЦИЙ-ФОСФАТНЫХ МИКРО/НАНОСТРУКТУР НА ОБРАЗЦЕ | 2010 |
|
RU2421245C1 |
| СПОСОБ ПОЛУЧЕНИЯ КАЛЬЦИЙ-ФОСФАТНОГО ПОКРЫТИЯ НА ОБРАЗЦЕ | 2009 |
|
RU2400423C1 |
| СПОСОБ ПОЛУЧЕНИЯ НА ПОДЛОЖКЕ КАЛЬЦИЙ-ФОСФАТНОГО ПОКРЫТИЯ | 2008 |
|
RU2372101C1 |
| СПОСОБ ПОЛУЧЕНИЯ НАНОСТРУКТУРИРОВАННОГО КАЛЬЦИЙ-ФОСФАТНОГО ПОКРЫТИЯ ДЛЯ МЕДИЦИНСКИХ ИМПЛАНТАТОВ | 2013 |
|
RU2523410C1 |
| Способ нанесения антиадгезивного антибактериального покрытия на ортопедические имплантаты из титана и нержавеющей стали | 2016 |
|
RU2632706C1 |
| Способ модификации поверхности изделий из титана или его сплавов | 2019 |
|
RU2729807C1 |



Изобретение относится к медицинской технике, а именно к способу функционализации поверхности имплантата путем осаждения структурированного антибактериального покрытия на основе фосфатов кальция. Способ включает распыление мишени из цинк- или медьсодержащего гидроксиапатита в форме плоского диска толщиной 2-4,5 мм с диаметром, совпадающим с диаметром катода магнетрона, закрепленной на катоде магнетрона, в плазме высокочасточного (ВЧ) магнетронного разряда в атмосфере аргона при размещении имплантата на держателе поворотного стола вакуумной камеры на расстоянии 37-80 мм от нижней плоскости мишени. При формировании антибактериального покрытия имплантата откачивают вакуумную камеру до остаточного давления не выше 6,0*10-4 Па, заполняют затем аргоном и доводят до рабочего давления (1,0-3,0)*10-1 Па, зажигают ВЧ магнетронный разряд на мощности 50 Вт с последующим ступенчатым, через интервал в 50 Вт, подъемом мощности до 200-300 Вт и выдержкой по 10 минут на каждой ступени, проводят процесс ВЧ магнетронного распыления антибактериального покрытия из мишени с доведением рабочего вакуума давления с введением имплантата в зону магнетрона и выдержкой в зоне магнетрона. Осаждение является наклонным, имплантат размещают на держателе с фиксирующими элементами, способными обеспечивать наклон поверхности имплантата в диапазоне угла от 40° до 85° относительно направления потока налетающих частиц, при формировании антибактериального покрытия. Проводят процесс ВЧ магнетронного распыления антибактериального покрытия из мишени с доведением рабочего вакуума давления до значения (7,0-9,0)*10-2 Па, с введением имплантата в зону магнетрона и выдержкой в зоне магнетрона в течение 4-8 часов. Техническим результатом является получение имплантата с покрытием на основе гидроксиапатита с ионами цинка или меди путем наклонного осаждения на поверхность металлического или керамического имплантата, что обеспечивает создание условий для эффективного заживления костной ткани и подавления риска инфицирования патогенными микроорганизмами за счет действия антибактериальных ионов и особенностей морфологии поверхности. 2 з.п. ф-лы, 6 ил.
1. Способ функционализации поверхности имплантата путем осаждения структурированного антибактериального покрытия на основе фосфатов кальция, включающий распыление мишени из цинк- или медьсодержащего гидроксиапатита, в форме плоского диска толщиной 2-4,5 мм с диаметром, совпадающим с диаметром катода магнетрона, закрепленной на катоде магнетрона, в плазме высокочасточного (ВЧ) магнетронного разряда в атмосфере аргона при размещении по крайней мере одного имплантата на держателе поворотного стола вакуумной камеры на расстоянии 37-80 мм от нижней плоскости мишени, в котором при формировании антибактериального покрытия имплантата откачивают вакуумную камеру до остаточного давления не выше 6,0*10-4 Па, заполняют затем аргоном и доводят до рабочего давления (1,0-3,0)*10-1 Па, зажигают ВЧ магнетронный разряд на мощности 50 Вт с последующим ступенчатым, через интервал в 50 Вт, подъемом мощности до 200-300 Вт и выдержкой по 10 минут на каждой ступени, проводят процесс ВЧ магнетронного распыления антибактериального покрытия из мишени с доведением рабочего вакуума давления с введением имплантата в зону магнетрона и выдержкой в зоне магнетрона, отличающийся тем, что осаждение является наклонным, по крайней мере один имплантат размещают на держателе с фиксирующими элементами, способными обеспечивать наклон поверхности имплантата в диапазоне угла от 40° до 85° относительно направления потока налетающих частиц, при формировании антибактериального покрытия, проводят процесс ВЧ магнетронного распыления антибактериального покрытия из мишени с доведением рабочего вакуума давления до значения (7,0-9,0)*10-2 Па, с введением имплантата в зону магнетрона и выдержкой в зоне магнетрона в течение 4-8 часов.
2. Способ по п. 1, отличающийся тем, что имплантату, имеющему плоскую форму и габариты, превышающие зону эрозии мишени, придают возвратно-поступательное движение в процессе проведения ВЧ магнетронного напыления.
3. Способ по п. 1, отличающийся тем, что имплантату, имеющему плоскую форму и габариты, превышающие зону эрозии мишени, придают одновременно возвратно-поступательное движение и вращательное вокруг оси имплантата в процессе проведения ВЧ магнетронного напыления.
| Способ получения кальцийфосфатного покрытия на образце | 2019 |
|
RU2715055C1 |
| US 2010040859 A1, 18.02.2010 | |||
| СПОСОБ ПОЛУЧЕНИЯ КАЛЬЦИЙФОСФАТНОГО ПОКРЫТИЯ НА ИМПЛАНТАТЕ ИЗ БИОИНЕРТНОГО МАТЕРИАЛА (ВАРИАНТЫ) | 2012 |
|
RU2476243C1 |
| Способ получения антибактериального кальцийфосфатного покрытия на ортопедическом имплантате, имеющем форму тела вращения и оснастка для его осуществления (варианты) | 2020 |
|
RU2745726C1 |
| СПОСОБ ПОЛУЧЕНИЯ НАНОСТРУКТУРИРОВАННОГО КАЛЬЦИЙ-ФОСФАТНОГО ПОКРЫТИЯ ДЛЯ МЕДИЦИНСКИХ ИМПЛАНТАТОВ | 2013 |
|
RU2523410C1 |
| СПОСОБ ПОЛУЧЕНИЯ КАЛЬЦИЙ-ФОСФАТНОГО ПОКРЫТИЯ НА ОБРАЗЦЕ | 2009 |
|
RU2400423C1 |
| СПОСОБ ПОЛУЧЕНИЯ КАЛЬЦИЙ-ФОСФАТНЫХ МИКРО/НАНОСТРУКТУР НА ОБРАЗЦЕ | 2010 |
|
RU2421245C1 |
| Способ формирования серебросодержащего биосовместимого покрытия на имплантатах из титановых сплавов | 2021 |
|
RU2760453C1 |
| Способ плазменного напыления биосовместимых покрытий на основе трикальцийфосфата с дополнительным легирующим элементом | 2020 |
|
RU2754129C1 |
Авторы
Даты
2023-11-01—Публикация
2022-12-23—Подача