Изобретение относится к экспериментальной медицине и биотехнологии и предназначено для стимуляции регенерации мышечной ткани в эксперименте.
Известно, что процесс регенерации мышечной ткани стимулируют несколькими способами: посредством внутриклеточной регенерации (гипертрофии при усилении функциональной нагрузки); посредством митотического деления миоцитов при их повреждении (репаративная регенерация); посредством дифференцировки из камбиальных элементов - малодифференцированных полипатентных клеток фибробластического ряда и миофибробластов (структурная регенерация). Миобласты размножаются и формируют многоядерный симпласт, в котором синтезируются миофибриллы и дифференцируются поперечно-полосатые мышечные волокна. Пересадка мышечной ткани, несмотря на ее денервацию, часто приводит к необратимой утрате мышечной структуры трансплантата и заканчивается его фиброзированием (Lesault P.F. Macrophages improve survival, proliferation and migration of engrafted myogenic precursor cell into MDX skeletal muscle / P.F. Lesault, M. Theret, M. Magnan et al. // PLoS One. - 2012. - V.7, №10. - P. 46698.). Получены положительные результаты при использовании гидрогелей для усиления регенерации тканей при плохо заживающих ранах (Чернецкая, Ю.Г. Аппликационная лекарственная форма гидрогелевой матрицы для лечения ран и ожогов // Человек и лекарство: Тез. докл. XI Рос. нац. конгр. - М., 2004. - С. 848).
Механизм действия клеточного аутотрансплантата связан со способностью стволовых, мезенхимальных и других незрелых клеток проявлять пролиферативную активность в направлении поврежденных тканей, а также индуцировать пролиферативную активность камбиальных клеток в зоне повреждения. Сферо®ГЕЛЬ относится к классу биополимерных имплантатов и предназначен для восполнения объемов мягких тканей за счет стимуляции жизнеспособных клеток (в том числе камбиальных) синтезировать собственный внеклеточный матрикс, содержащий «медиаторы регенерации». Сферо®Гель может быть также использован как депо, способное удерживать биологические активные вещества, клеточные комплексы.
Существующие техники коррекции дефектов мышечной ткани (мышечная аутопластика, аллопластика, ксенопластика, генная терапия) являются трудоемкими, травматичными и сопряжены с осложнениями (Булякова Н.В. Морфофункциональные особенности тимуса и мышечных регенератов при воздействии лазерного излучения и аллопластики мышечной ткани взрослого животного в область мышечной травмы / Н.В. Булякова, B.C. Азарова // Известия РАН. Серия биологическая. - 2009. - №1. - С. 18-26).
Известен способ хирургического лечения длительно незаживающих ран и трофических язв (патент РФ 2388418, опубл.: 10.05.2010 г., бюл. №56). Применяют инъекции диспергированного биоматериала Аллоплант для инфильтрирования полости раны, причем инъекции осуществляют в 5-15 точек по 2-3 мл в каждую, помещают в обработанную раневую полость обезжиренный и предварительно импрегнированный в физиологическом растворе с антибиотиком биоматериал Аллоплант. Фиксируют биоматериал Аллоплант на коже по краю раны аллосухожильными нитями с дополнительными подузловыми подкладками. Метод сложен в применении, многокомпанентен, применим только для ран с некротическими массами. Наличие антибиотика в комплексе повышает риск иммунных реакций на введение комплексного препарата и снижение местной иммунобиологической резистентности ткани.
Известен способ стимуляции репаративного остеогенеза при замещении дефектов кости, возникших в результате травмы или после резекции кости. Способ включает инъекционную имплантацию в зону костного повреждения культивированных аутологичных костно-мозговых стромальных клеток-предшественников. При этом имплантацию клеток проводят в период завершения воспаления в зоне костного повреждения и начала естественного остеогенеза, 3-5 раз с интервалом в 2-3 дня (патент РФ №2373883, опубл.: 27.11.2009 г., бюл. №33). Недостатками данного способа является сложность технологии приготовления взвеси аутологичных костно-мозговых стромальных клеток-предшественников, что требует дополнительных затрат в связи с необходимостью использования соответствующего оборудования и дорогостоящих сред.
Достаточно близким по технической сущности к предлагаемому изобретению является способ восстановления запирательного аппарата прямой кишки (патент РФ №2405573, опубл.: 10.12.2010 г., бюл. №34). Для коррекции поврежденых мышечных структур запирательного аппарата прямой кишки клеточную массу аутологичного костно-мозгового пунктата вводят в виде инъекций в мягкие ткани параанальной области и вокруг прямой кишки, затем после каждого введения воздействуют на эти области двуполярным симметричным флюктуирующим током курсом из 10 ежедневных процедур. Способ малотравматичен, исключает иммунные реакции и прост в исполнении, однако не обеспечивает длительного нахождения в зоне поврежденных мышечных структур аутологичных костно-мозговых стромальных клеток-предшественников, а следовательно, и их индукционного воздействия на «спящие» стволовые клетки.
Наиболее близким к предлагаемому способу является способ стимуляции регенерации хрящевой, костной, а также мышечной тканей (патент РФ №2527701, опубл. 10.09.2014, Бюл. №25), осуществляемый в эксперименте. Лабораторному животному осуществляют введение в область раневого дефекта средства, стимулирующего регенерацию в том числе и мышечной ткани. Средство представляет собой смесь водных растворов рекомбинантного интерферона бета и полиэтиленгликоля с молекулярной массой 6000 в соотношении 1:4 соответственно. Средство позволяет повысить эффективность лечения при травмах опорно-двигательного аппарата, восстановить ткани области травмы (в том числе и мышечную), снизить частоту гнойно-воспалительных осложнений. Недостатками способа являются сложность приготовления смеси препаратов и высокая стоимость интерферона бета.
Таким образом, существует потребность в способе стимуляции регенерации мышечной ткани, лишенном всех вышеуказанных недостатков.
Техническим результатом настоящего изобретения является простота, повышение эффективности лечения при травматическом поражении мышечной ткани, повышение эффективности аутомиелотерапии, снижение травматичности метода и вероятности иммунной реакции на введение препаратов.
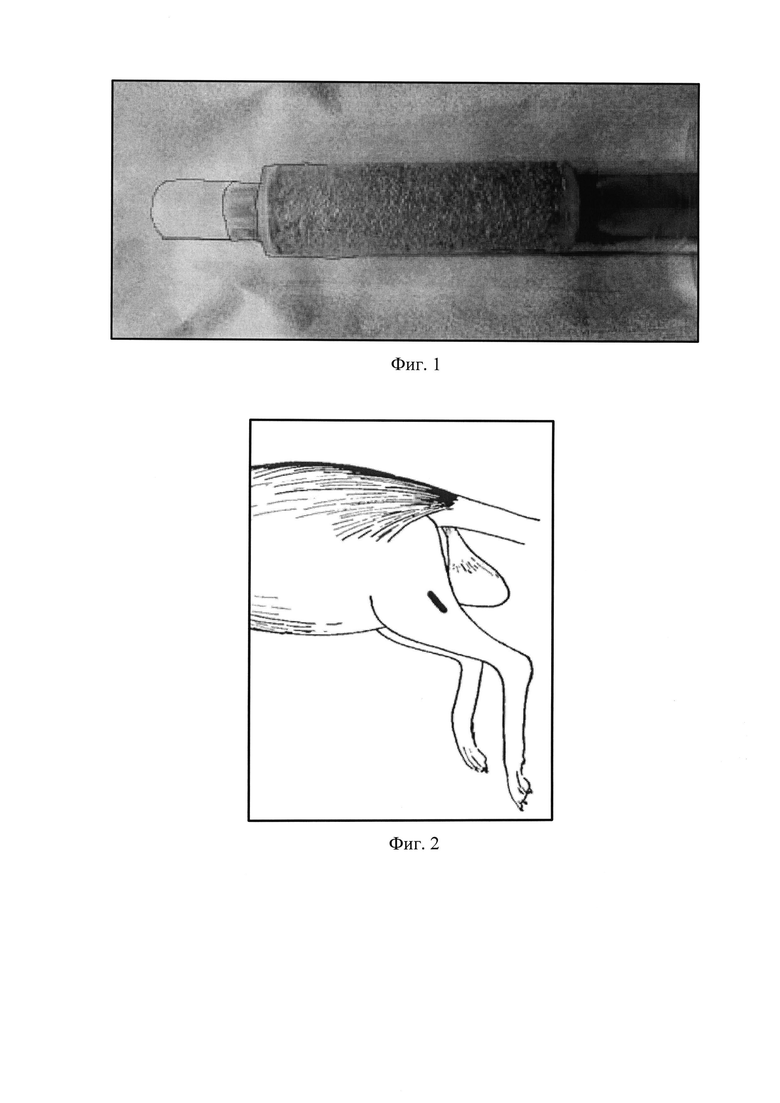
Этот технический результат достигается тем, что в предлагаемом способе стимуляции регенерации мышечной ткани в эксперименте, включающем введение лабораторному животному в область раневого дефекта мышечной ткани средства, стимулирующего регенерацию мышечной ткани, используют средство, представляющее собой клеточно-гелевый комплекс (Фиг. 1), состоящий из клеточной массы костного мозга и биодеградируемого гетерогенного гидрогеля Сферо®ГЕЛЬ медиум, причем соотношение объема вносимой клеточной массы и объема гидрогеля Сферо®ГЕЛЬ составляет 1:1.
Способ осуществляют следующим образом.
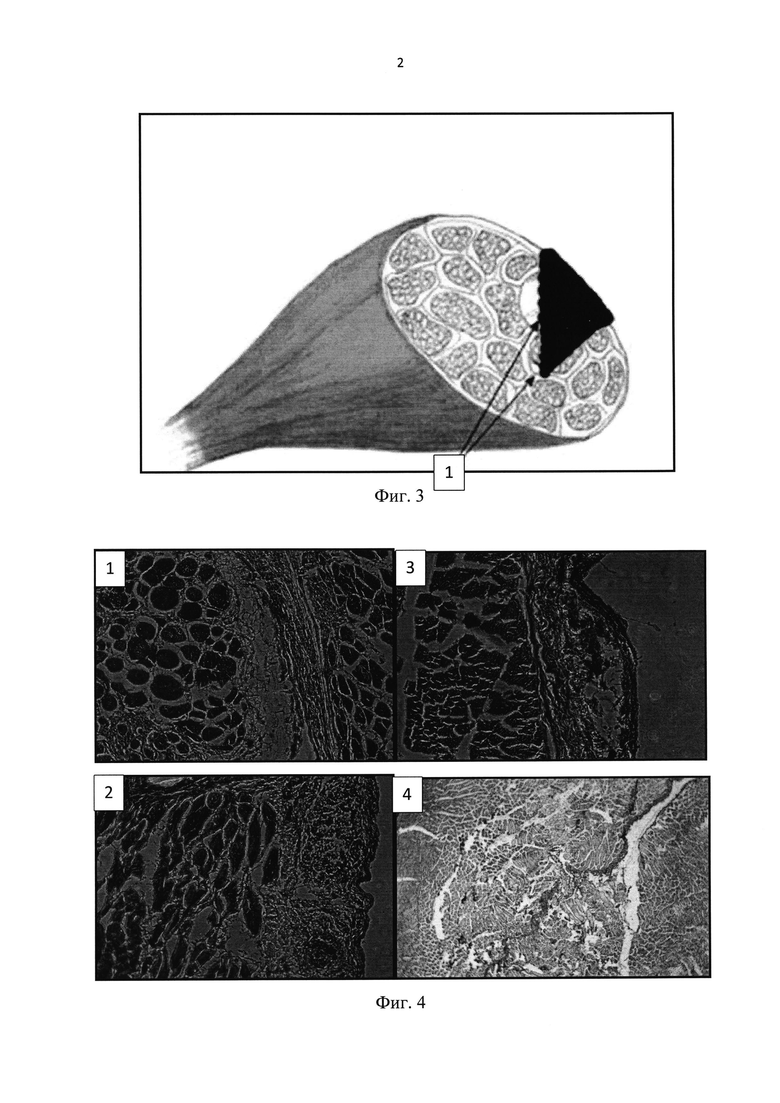
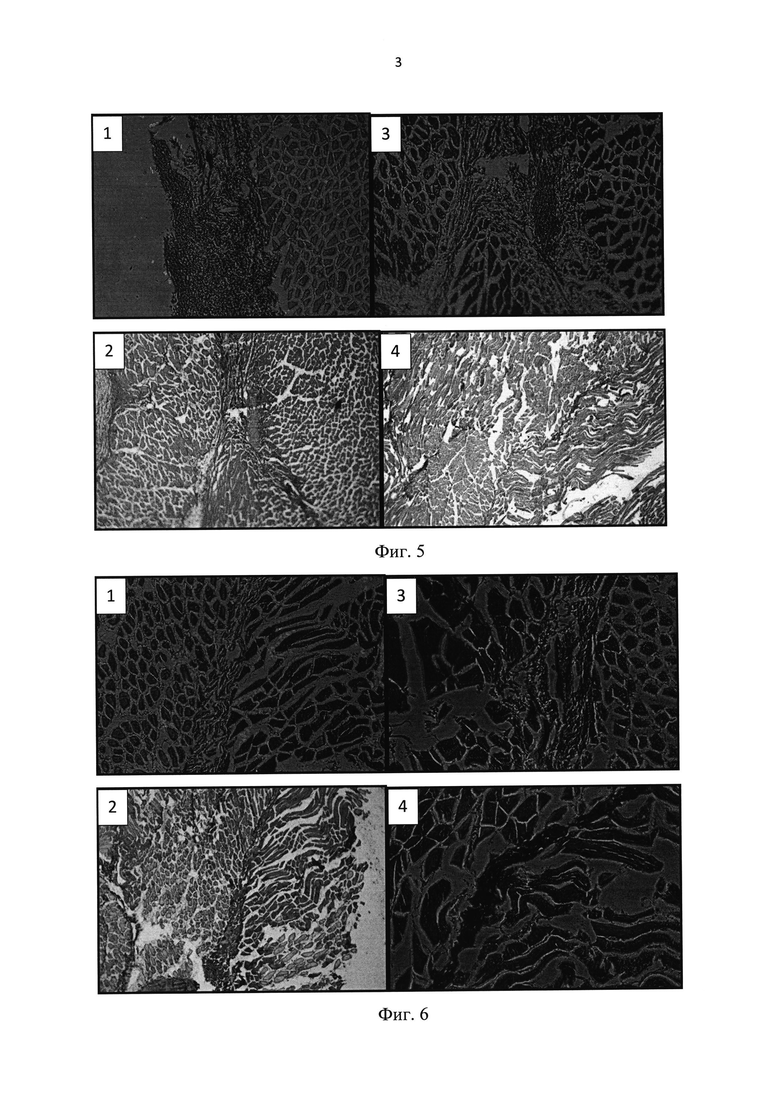
В решении поставленной задачи использовали половозрелых крыс линии Вистар массой 200-220 г. После разреза кожных покровов на заднебоковой поверхности бедра производили линейный разрез кожи 6-7 мм, выделялась задняя группа мышц бедра (Фиг. 2). Затем на брюшко мышцы в средней трети наносили дефект длиной 4-5 мм и глубиной 5 мм (Фиг. 3). Биодеградируемый гетерогенный имплантируемый гидрогель Сферо®ГЕЛЪ медиум, предварительно импрегнированный клетками костного мозга, помещали в дефект мышцы. Экспериментальным путем нами были получены данные о наиболее эффективном соотношении объема клеточной массы костного мозга к объему гидрогеля Сферо®ГЕЛЬ - оно составляет 1:1. При меньших объемах костного мозга регенеративные процессы проходили медленнее, при больших - не происходило адекватной адгезии клеток костного мозга на гранулах Сферо®ГЕЛЬ и часть клеток погибала. Также экспериментально был выбран из всей линейки Сферо®ГЕЛЬ гидрогель Сферо®ГЕЛЬ медиум, плотность и свойства гранул которого оптимальны для клеточной адгезии.
Костный мозг получали от крыс той же линии, насыщение гранул Сферо®ГЕЛЬ проводили неотцентрифугированной массой костного мозга в стерильных условиях в течение 30 минут. Объем клеточно-гелевого комплекса соответствовал объему дефекта. Затем рану укрывали мышечной фасцией с целью избежать дислокации трансплантата.
Так, нами приведены сравнительные микрофотографии гистологических срезов дефекта через 3 недели (Фиг. 4), 6 недель (Фиг. 5) и 12 недель (Фиг. 6) после нанесения дефекта у животных, которым вводили клеточно-гелевый комплекс, состоящий из клеточной массы костного мозга и биодеградируемого гетерогенного гидрогеля Сферо®ГЕЛЬ медиум (1, 2), и контрольной группы животных (3, 4).
Гистологические исследования показали высокий уровень процессов регенерации, сопровождающийся полным восстановлением мышечной ткани со всеми ее компонентами и минимальным развитием соединительнотканных изменений как в близкие, так и в отдаленные сроки. Таким образом, предлагаемый способ прост, высокоэффективен при лечении травматического поражения мышечной ткани, позволяет повысить эффективность аутомиелотерапии, снизить травматичность лечения и вероятность иммунной реакции на введение препаратов.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ВОССТАНОВЛЕНИЯ ЗАПИРАТЕЛЬНОГО АППАРАТА ПРЯМОЙ КИШКИ | 2015 |
|
RU2600851C1 |
| Способ лечения первичного мужского гипогонадизма в эксперименте | 2016 |
|
RU2618197C1 |
| Способ парциальной пластики наружного анального сфинктера у детей | 2023 |
|
RU2820000C1 |
| ИМПЛАНТИРУЕМАЯ НЕЙРОЭНДОПРОТЕЗНАЯ СИСТЕМА, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И СПОСОБ ПРОВЕДЕНИЯ РЕКОНСТРУКТИВНОЙ НЕЙРОХИРУРГИЧЕСКОЙ ОПЕРАЦИИ | 2008 |
|
RU2394593C2 |
| СПОСОБ И КОМПОЗИЦИЯ ДЛЯ РЕГЕНЕРАЦИИ ТКАНЕЙ С ПОМОЩЬЮ СТВОЛОВЫХ ИЛИ КОСТНОМОЗГОВЫХ КЛЕТОК | 2009 |
|
RU2491076C2 |
| Трансплантат - тканеинженерная надхрящница для восстановления хряща субъекта | 2023 |
|
RU2822238C1 |
| Способ замещения дефектов хрящевой ткани | 2016 |
|
RU2637103C2 |
| Способ получения тканеинженерной надкостницы из клеточных сфероидов для восстановления костных дефектов пациентов | 2023 |
|
RU2818176C1 |
| СПОСОБ ВОССТАНОВЛЕНИЯ ЦЕЛОСТНОСТИ ТОНКОЙ КИШКИ | 2013 |
|
RU2559921C2 |
| Способ получения тканеинженерной надкостницы из клеточных сфероидов для восстановления костных дефектов субъекта | 2022 |
|
RU2819284C2 |
Изобретение относится к экспериментальной медицине и биотехнологии и может быть использовано для стимуляции регенерации мышечной ткани в эксперименте. Для этого лабораторному животному в область раневого дефекта мышечной ткани вводят клеточно-гелевый комплекс, состоящий из клеточной массы костного мозга и биодеградируемого гетерогенного гидрогеля Сферо®ГЕЛЬ медиум. Соотношение объема вносимой клеточной массы и объема гидрогеля Сферо®ГЕЛЬ составляет 1:1. Способ позволяет повысить эффективность лечения при травматическом поражении мышечной ткани, снизить травматичность метода и вероятность иммунной реакции на введение препаратов при его простоте. 6 ил.
Способ стимуляции регенерации мышечной ткани в эксперименте, включающий введение лабораторному животному в область раневого дефекта мышечной ткани средства, стимулирующего регенерацию мышечной ткани, отличающийся тем, что средство представляет собой клеточно-гелевый комплекс, состоящий из клеточной массы костного мозга и биодеградируемого гетерогенного гидрогеля Сферо®ГЕЛЬ медиум, причем соотношение объема вносимой клеточной массы и объема гидрогеля Сферо®ГЕЛЬ составляет 1:1.
| СПОСОБ ВОССТАНОВЛЕНИЯ ЗАПИРАТЕЛЬНОГО АППАРАТА ПРЯМОЙ КИШКИ | 2009 |
|
RU2405573C2 |
| US 2015104431 A1,16.04.2015 | |||
| МУСИНА Р.А | |||
| и др | |||
| Стволовые клетки: свойства и перспективы использования в медицине | |||
| - Молекулярная биология, 2004, т.38, No 4, с.563-577 | |||
| DE MORI R | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
Авторы
Даты
2016-09-20—Публикация
2015-07-22—Подача