Изобретение относится к биохимии и микробиологии, конкретно к биологически активным пептидам, обладающим антибактериальным действием, которые могут найти применение в биотехнологии, медицине, ветеринарии пищевой промышленности, а также в научных исследованиях.
Известно, что микроорганизмы способны продуцировать антимикробные соединения пептидной природы - бактериоцины. Бактериоцины выделены из различных грамположительных и грамотрицательных бактерий. В связи со стремительным возрастанием числа антибиотико-резистентных микроорганизмов, пептидные бактериоцидные и бактериостатическне соединения в настоящее время рассматриваются в качестве природных антибиотиков, перспективных для борьбы с возбудителями инфекционных заболеваний человека и животных (Nascimento et al. Bacteriocins as alternative agents for control of muiltiresistant staphylococcal strains. Letters in Applied Microbiology. 2006, V.42, P.215-221).
Наибольшее количество низкомолекулярных катионных пептидных бактериоцинов выделено из грамположительных бактерий. Синтезируемые этими микроорганизмами пептиды обладают широким спектром антибактериального действия. Способность к образованию таких соединений и их секреции в окружающую среду наиболее распространена среди представителей родов Enterococcus, Lactobacillus, Lactococcus и Streptococcus. В значительно меньшей степени этот признак описан у бактерий рода Staphylococcus.
Известен антибактериальный пептид хоминицин, синтезируемый штаммом Staphylococcus hominis MBBL2-9, являющийся низкомолекулярным термостабильным пептидом с мол. массой 2038,4 Да. Этот пептид обладает выраженной антибактериальной активностью в отношении чувствительных и антибиотикорезистентных штаммов бактерий рода Staphylococcus (Kim et al. Characterization and structure identification of an antimicrobial peptide hominicin, produced by Staphylococcus hominis MBBL 2-9 // BBRC. 2010, V.399. P.133-138). Однако антибактериального действия хоминицина на представителей других видов микроорганизмов не обнаружено.
Наиболее близким аналогом изобретению является низкомолекулярный антибактериальный катионный пептид нукацин, синтезируемый бактериями штамма Staphylococcus hominis KQU-131. Пептид имеет мол. массу 3003,97 Да, содержит в составе молекулы катионные и гидрофобные аминокислотные остатки, а также лантионин. Однако спектр антибактериальной активности пептида ограничивается микроорганизмами группы молочнокислых бактерий, а также представителями родов Bacillus и Micrococcus (Wilaipun et al. Identification of the nukacin KQU-131, a new type-A(II) lantibiotic produced by Staphylococciis hominis KQU-131 isolated from thai fermented fish product (Pla-ra) // Biosci. Biotechnol. Biochem. V.72, N8. 2008. 2232-2235).
Таким образом, пептиды, выделенные из различных штаммов вида Staphylococcus hominis, обладают сравнительно узким спектром антибактериальной активности.
Соответственно, технической задачей настоящего изобретения является выявление нового эффективного вещества природного происхождения, обладающего широким спектром антибактериальной активности.
Для достижения вышеупомянутой задачи были проведены исследования, в результате которых из культуральной среды специального штамма Slaphylococcus hominis KLP-1 (Патент РФ №2428470) выделено соединение, обладающее антибактериальной активностью против широкого спектра бактерий. В соответствии с видовой принадлежностью штамма-продуцента антибактериальное соединение названо хоминин KLP-1.
Заявляемый пептид хоминин KLP-1 представляет собой катионное соединение с молекулярной массой 2985 Да, имеющее в составе молекулы значительную долю катионных аминокислот (51,1%) и лантионин - необычную тиоэфирную аминокислоту. Наличие лантионина приводит к образованию в молекулах пептида кольцевых структур за счет формирования тиоэфирных связей, обладающих высокой прочностью и обуславливающих стабильность молекулы при нагревании, устойчивость к действию кислот, щелочей и других неблагоприятных факторов, что было подтверждено экспериментальным путем.
Пептидная природа антибактериального соединения была установлена ферментативной обработкой супернатантов среды культивирования Staphylococcus hominis KLP-1, поскольку при воздействии ДНК-азы и РНК-азы антибактериальная активность супернатанта не снижалась, а обработка пепсином и трипсином при использованных временных (2 ч) интервалах приводила к существенному снижению антибактериальной активности. Полное подавление антибактериальной активности супернатанта достигается при действии протеиназы К, что подтверждает пептидную природу антибактериального соединения, продуцируемого Staphylococcus hominis KLP-1.
Для получения антибактериального пептида хоминина KLP-1 бактерии Staphylococcus hominis KLP-1, культивируют в подходящей для роста и продукции антибактериального пептида среде (Патент РФ №2274654) с соблюдением благоприятных условий, позволяющих получить культуру, содержащую 109-1010 бактерий на миллилитр, после чего посредством центрифугирования получают супернатант, содержащий пептид, который используют для дальнейших стадий получения препарата хоминина KLP-1. Процедура выделения включает аффинную хроматографию (SP-Toyopearl 650M) с градиентом Nad (0-0,5 М), обессоливание, высушивание (Univapo 100Н). С целью получения высокоочищенного препарата хоминина KLP-1 использовали обратнофазовую хроматографию (колонка С-18, градиенты ацетонитрила (0-70%)) и лиофилизацию (предварительное замораживание при -196°С, установка Alpha-2) с последующим хранением в рефрижераторе при -18°С. Полученный препарат использовали для анализа состава аминокислот и молекулярной массы пептида хоминина KLP-1. Детекция антибактериальной активности проводилась микрометодом двукратных серийных разведений в иммунологических планшетах на всех этапах получения очищенного хоминина KLP-1.
Выделенный из среды культивирования Staphylococcus hominis KLP-1 пептид хоминин KLP-1 обладает высокой термостабильностью, что установлено при инкубировании его растворов на кипящей водяной бане в течение 5, 10, 30 и 60 мин, а также автоклавировании при 1,0 атм (121°С) в течение 15 мин с последующей оценкой антибактериальной активности препаратов титрованием в микропланшетах. В результате тепловой обработки при кипячении раствора хоминина KLP-1 на водяной бане антибактериальная активность сохраняется в полной мере, но снижается в 2 раза при 15-минутной обработке при температуре 121°С, достигаемой при автоклавировании.
Антибактериальная активность хоминина KLP-1 полностью сохраняется после его инкубации в средах при значениях рН в интервале от 6 до 9, но снижается в 2 раза при более кислых рН и в 4 раза при повышении щелочности среды до 10.
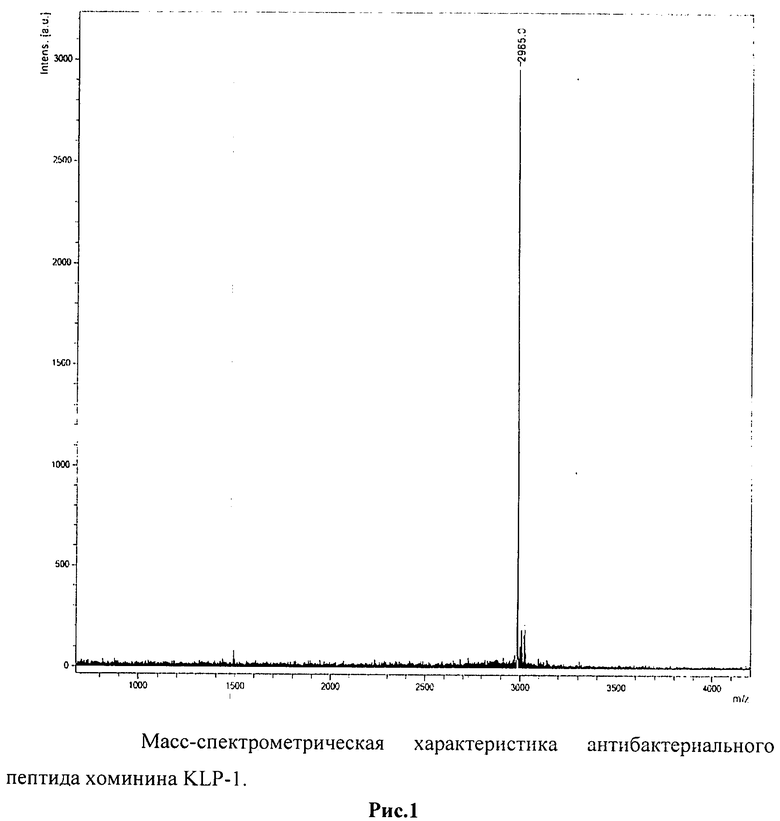
Масс-спектрометрический анализ образцов хоминина KLP-1, полученных в процессе обратнофазовой хроматографии, проведенный на приборе Voyager-DE STR Biospectrometry Workstation («PerSeptive Biosystems», США) показал, что молекулярная масса пептида составляет 2985 Да (Рис.1).
Пример 1.
Получение антибактериального пептида хоминина KLP-1 из культуральной жидкости Staphylococcus hominis KLP-1 осуществляется по этапам:
1. Культивирование продуцента Staphylococcus hominis KLP-1 на жидкой питательной среде до перехода развития культуры в стационарную стадию (Патент РФ №2428470).
2. Сбор супернатанта центрифугированием полученной культуры при 5000 об/мин в течение 20 мин с последующей его стерилизацией прогреванием на кипящей водяной бане в течение 20 мин.
3. Аффинная хроматография. Нанесение супернатанта на хроматографическую колонку, содержащую смолу SP-Toyopearl 650 M, уравновешенную 10 мМ фосфатным буфером с рН 6. Промывка колонки от несвязавшихся компонентов супернатанта указанным выше буфером в объеме, равном объему нанесенного супернатанта. Элюирование пептида линейным градиентом NaCl (0-0,5 М) в том же буфере с тестированием фракций элюата на проявление в них антибактериальной активности, которая выявляется диффузионным методом, нанесением аликвот (5 мкл) каждой собранной фракции на плотную питательную среду, содержащую клетки индикаторной культуры S.epidermidis 33.
4. Обессоливание. Фракции элюата, содержащие антибактериальную активность, объединяются и подвергаются обессоливанию с использованием диализных мембран Spectra/Por MWCO 2000. Раствор обессоленного пептида хоминина KLP-1 высушивается на концентраторе Univapo 100 H. Полученный препарат хоминина KLP-1 используется для изучения его антибактериальных свойств.
Пример 2.
Спектр антибактериальной активности хоминина KLP-1 определяли на бактериях различных видов, в том числе патогенных, условно патогенных, антибиотико-резистентных и представителях рода Mycobacterium - штаммы, которые используются в моделях экспериментальной туберкулезной инфекции. С этой целью бактериальные культуры выращивали на богатых жидких питательных средах до логарифмической фазы роста и готовили суспензии клеток на среде Muller-Hinton, предназначенной для определения антибактериальной активности с содержанием бактерий 106 клеток/мл. В лунки микропланшета помещали по 100 мкл среды Muller-Hinton и готовили ряд последовательных двукратных разведении раствора хоминина KLP-1, после чего в каждую ячейку добавляли 10 мкл суспензии исследуемых бактерий 106 КОЕ/мл. Планшеты инкубировали в термостате в течение 16-18 ч при температурах, оптимальных для роста каждого тестируемого вида бактерий. За условную единицу антибактериальной активности (ЕА) принимали обратную величину максимального разведения препарата антибактериального пептида, при которой наблюдалась видимая задержка роста клеток индикаторной культуры. В таблице 1 представлены данные по чувствительности исследованных штаммов бактерий к антибактериальному пептиду хоминину KLP-1.
Пример 3.
Определение аминокислотного состава хоминина KLP-1
Для определения аминокислотного состава образцы высоко очищенного пептида хоминина K.LP-1 (0,5-0,7 мг), полученного после обратнофазовой хроматографии, гидролизовали 6 М HCl в запаянных ампулах в атмосфере азота при 60°С, а затем анализировали на приборе Amino Acid Analyser 420 A («Applied Biosystems», США) в автоматическом режиме, включавшем обработку гидролизата фенилизотиоционатом и последующее разделение фенилтиокарбомонльных производных аминокислот в обращенной фазе на C18-колонках. Для калибровки всей процедуры использовали 29 пмоль (500 нг) стандарта - миоглобина лошади (стадия гидролиза) и набор аминокислот Standart Н («Pierce», США), содержащий 250 пмоль каждой аминокислоты с норлейцином в качестве внутреннего стандарта (стадия дериватизации).
Аминокислотный анализ гидролизатов гомогенного препарата пептида выявил в нем различные аминокислоты, среди которых преобладали лизин, аргинин, глицин, лейцин. Важным фактом явилось обнаружение редкой аминокислоты лантионина, придающей молекуле пептида высокую устойчивость к нагреванию и закисленню среды. Наличие лантионина позволило отнести пептид хоминин KLP-1 к группе лантибиотиков. Установлено, что в составе хоминина KLP-1 на долю катионных аминокислотных остатков приходится 51,1%, а на долю гидрофобных - 31,7% от всех аминокислот. Суммарный положительный заряд позволяет пептидным молекулам связываться с анионными группировками клеточных оболочек бактерий. Избыток анионных зон на внутренней поверхности цитоплазматических мембран способствует дальнейшему продвижению пептида - сорбции на внешней стороне мембран и внедрению в липидный матрикс мембран с формированием нерегулируемых каналов и пор, что в итоге приводит к гибели атакованных клеток. Содержание различных аминокислотных остатков в составе молекулы хоминина KLP-1 представлено в таблице 2.
Таким образом, продемонстрирована возможность получения антибактериального пептида хоминина, обладающего высокой ингибирующей активностью в отношении условно-патогенных и патогенных бактериальных штаммов, включая Streptococcus pyogenes Stuphylococus aureus. Stuphylococcus epidermidis и его ванкомицин устойчивый вариант, Propionibacterium acne - возбудитель угревой сыпи, а также в отношении штаммов микобактерий, родственных возбудителям туберкулезной инфекции человека и животных.
Антибактериальный пептид хоминин KLP-1 широкого спектра действия
Антибактериальный пептид хоминин KLP-1 широкого спектра действия
| название | год | авторы | номер документа |
|---|---|---|---|
| ШТАММ STAPHYLOCOCCUS HOMINIS KLP-1 - ПРОДУЦЕНТ НИЗКОМОЛЕКУЛЯРНЫХ ПЕПТИДНЫХ СОЕДИНЕНИЙ, ИНГИБИРУЮЩИХ РАЗВИТИЕ ГРАМПОЛОЖИТЕЛЬНЫХ БАКТЕРИЙ | 2010 |
|
RU2428470C1 |
| ПЕПТИД LanA2, ВЫДЕЛЕННЫЙ ИЗ БАКТЕРИИ BACILLUS LICHENIFORMIS VK21, ОБЛАДАЮЩИЙ АНТИМИКРОБНЫМ ДЕЙСТВИЕМ | 2009 |
|
RU2408604C1 |
| ПЕПТИД LanA1, ВЫДЕЛЕННЫЙ ИЗ БАКТЕРИИ Bacillus licheniformis VK21, ОБЛАДАЮЩИЙ АНТИМИКРОБНЫМ ДЕЙСТВИЕМ | 2009 |
|
RU2408732C1 |
| АНТИБАКТЕРИАЛЬНАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ СТАФИЛОКОККОВЫХ ИНФЕКЦИЙ АНТИБАКТЕРИАЛЬНОЙ КОМПОЗИЦИЕЙ | 2017 |
|
RU2729934C2 |
| АНТИБАКТЕРИАЛЬНАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ СТАФИЛОКОККОВЫХ ИНФЕКЦИЙ АНТИБАКТЕРИАЛЬНОЙ КОМПОЗИЦИЕЙ | 2017 |
|
RU2707738C1 |
| СПОСОБ МИКРОРАЗБАВЛЕНИЯ В ЖИДКОЙ СРЕДЕ ДЛЯ ОЦЕНКИ И ОПРЕДЕЛЕНИЯ МИНИМАЛЬНОЙ ИНГИБИРУЮЩЕЙ КОНЦЕНТРАЦИИ АНТИБАКТЕРИАЛЬНЫХ ПОЛИПЕПТИДОВ | 2017 |
|
RU2754667C2 |
| ШТАММ ENTEROCOCCUS FAECIUM LVP1073, ПРОДУЦЕНТ БАКТЕРИОЦИНА ПРОТИВ БАКТЕРИАЛЬНЫХ ПАТОГЕНОВ, БАКТЕРИОЦИН E1073 ПРОТИВ БАКТЕРИАЛЬНЫХ ПАТОГЕНОВ, ШТАММ LACTOBACILLUS PLANTARUM 1 LVP7 - ИНДУКТОР СИНТЕЗА БАКТЕРИОЦИНА E1073, СИГНАЛЬНЫЙ ПЕПТИД СП1073 - РЕГУЛЯТОР СИНТЕЗА БАКТЕРИОЦИНА E1073, СПОСОБ ПОЛУЧЕНИЯ БАКТЕРИОЦИНА E1073 | 2009 |
|
RU2409661C2 |
| ЛИОФИЛИЗИРОВАННЫЕ КОМПОЗИЦИИ АНТИБАКТЕРИАЛЬНОГО БЕЛКА | 2017 |
|
RU2708393C1 |
| ПЕПТИДЫ И ИХ ПРИМЕНЕНИЕ | 2011 |
|
RU2590706C2 |
| ПРОТИВОМИКРОБНЫЕ ПЕПТИДЫ, СОДЕРЖАЩИЕ АРГИНИН- И ЛИЗИНСОДЕРЖАЩИЙ МОТИВ | 2005 |
|
RU2396273C2 |
Изобретение относится к области биохимии и микробиологии и касается биологически активного пептида. Охарактеризованный пептид хоминин KLP-1, продуцируется штаммом Staphylococcus hominis KLP-1 и проявляет антибактериальную активность против представителей следующих родов бактерий: Arthrobacter, Bacillus, Corynebacterium, Enterococcus, Lactobacillus, Micrococcus, Mycobacterium, Propionibacterium, Rhodococcus, Staphylococcus, Streptococcus, имеет молекулярную массу 2985 Да, чувствителен к протеазам, обладает высокой термостабильностью и имеет следующий аминокислотный: 51,1% катионных и 31,7% гидрофобных аминокислот, а также специфическую аминокислоту - лантионин. Пептид характеризуется высокой устойчивостью к нагреванию, щелочным условиям, а так же ферментам ДНК-азе и РНК-азе. Антибактериальная активность пептида значительно снижается или исчезает в кислой среде и при действии ферментов пепсина, трипсина и протеиназы К. Представленное изобретение может найти применение в биотехнологии, медицине, ветеринарии пищевой промышленности, а также в научных исследованиях. 1 ил., 2 табл., 3 пр.
Антибактериальный пептид хоминин KLP-1, продуцируемый штаммом Staphylococcus hominis KLP-1, проявляющий антибактериальную активность против представителей следующих родов бактерий: Arthrobacter, Bacillus, Corynebacterium, Enterococcus, Lactobacillus, Micrococcus, Mycobacterium, Propionibacterium, Rhodococcus, Staphylococcus, Streptococcus, имеющий молекулярную массу 2985 Да, чувствительный к протеазам, обладающий высокой термостабильностью и имеющий аминокислотный состав, представленный в таблице 2.
| ШТАММ STAPHYLOCOCCUS HOMINIS KLP-1 - ПРОДУЦЕНТ НИЗКОМОЛЕКУЛЯРНЫХ ПЕПТИДНЫХ СОЕДИНЕНИЙ, ИНГИБИРУЮЩИХ РАЗВИТИЕ ГРАМПОЛОЖИТЕЛЬНЫХ БАКТЕРИЙ | 2010 |
|
RU2428470C1 |
| Wilaipun P et al., Identification of the nukacin KQU-131, a new type-A(II) lantibiotic produced by Staphylococcus hominis KQU-131 isolated from Thai fermented fish product (Pla-ra), Biosci Biotechnol Biochem.,2008 Aug, Vol.72, No:8, p.p.2232-5 | |||
Авторы
Даты
2014-09-10—Публикация
2012-06-19—Подача