Настоящая заявка испрашивает приоритет на основании 35 U.S.С. §119(е) в отношении USSN 61/016793, поданной 26 декабря, 2007; USSN 61/031353, поданной 25 февраля, 2008; USSN 61/046353, поданной 18 апреля, 2008; USSN 61/050172, поданной 2 мая, 2008; USSN 61/079779, поданной 10 июля, 2008; и USSN 61/099178, поданной 22 сентября, 2008; и представляет собой частичное продолжение USSN 11/932151, поданной 31 октября, 2007, которая представляет собой частичное продолжение USSN 11/436266, поданной 17 мая, 2006, которая испрашивала приоритет на основании 35 U.S.С. §119(е) в отношении USSN 60/951536, поданной 24 июля, 2007, и представляет собой частичное продолжение USSN 11/274065, поданной 14 ноября, 2005, которая испрашивала приоритет на основании 35 U.S.C. §119(е) в отношении USSN 60/627763, поданной 12 ноября, 2004; USSN 60/642886, поданной 11 января, 2005; USSN 60/649508, поданной 2 февраля, 2005; USSN 60/662468, поданной 15 марта, 2005; USSN 60/669311, поданной 6 апреля, 2005; USSN 60/681607, поданной 16 мая, 2005; USSN 60/690200, поданной 13 июня, 2005; USSN 60/696609, поданной 5 июля, 2005; USSN 60/703018, поданной 27 июля, 2005; и USSN 60/726453, поданной 12 октября, 2005, полное содержание которых включено в настоящее описание посредством ссылки.
Область техники
Настоящая заявка относится к оптимизированным вариантам иммуноглобулина IgG, способам их получения и их применению, в частности в терапевтических целях.
Уровень техники
Антитела представляют собой иммунологические белки, каждый из которых связывается с конкретным антигеном. У большинства млекопитающих, включая людей и мышей, антитела образуются из парных тяжелых и легких полипептидных цепей. Каждая цепь состоит из индивидуальных доменов иммуноглобулина (Ig) и поэтому для таких белков используют общий термин «иммуноглобулин». Каждая цепь состоит из двух отдельных областей, называемых «вариабельными» и «константными» областями. Вариабельные области легкой и тяжелой цепи демонстрируют существенное различие последовательностей для антител и являются ответственными за связывание с антигеном-мишенью. Константные области демонстрируют меньшее различие последовательностей и являются ответственными за связывание с рядом природных белков для стимулирования важных биохимических реакций. У человека существует пять различных классов антител, включая IgA (который включает подклассы IgA1 и IgA2), IgD, IgE, IgG (который включает подклассы IgG1, IgG2, IgG3 и IgG4) и IgM. Отличительным признаком данных классов антител являются их константные области, несмотря на то что тонкие различия могут существовать в V-области. Антитела IgG представляют собой тетрамерные белки, состоящие из двух тяжелых цепей и двух легких цепей. Тяжелая цепь IgG состоит из четырех доменов иммуноглобулина, связанных от N- к С-терминалу в порядке VH-CH1-СН2-СН3 относительно вариабельного домена тяжелой цепи, константный домен 1 тяжелой цепи, константный домен 2 тяжелой цепи и константный домен 3 тяжелой цепи соответственно (также обозначаемая VH-Cγ1-Cy2-Cy3 относительно вариабельного домена тяжелой цепи, константный домен гамма 1, константный домен гамма 2 и константный домен гамма 3 соответственно). Легкая цепь IgG состоит из двух доменов иммуноглобулина, связанных от N- к С-терминалу в порядке VL-CL относительно вариабельного домена легкой цепи и константного домена легкой цепи соответственно.
В IgG участок Fc между доменами Сγ2 и Сγ3 опосредует взаимодействие с неонатальным рецептором FcRn. Связывание с FcRn возвращает подвергшееся эндоцитозу антитело из эндосомы обратно в кровоток (Raghavan et al., 1996, Annu Rev Cell Dev Biol 12:181-220; Ghetie et al., 2000, Annu Rev Immunol 18:739-766, оба полностью включенные в настоящее описание посредством ссылки). Данный процесс, сопряженный с нарушением фильтрации почек вследствие большого объема полноразмерной молекулы, приводит к подходящему времени полужизни антител в сыворотке в диапазоне от одной до трех недель. Связывание Fc с FcRn также играет ключевую роль в переносе антитела. Центр (сайт) связывания в области Fc для FcRn также представляет собой участок, на котором связываются бактериальные белки А и G. Прочное связывание данными белками, как правило, используют в качестве способа очистки антител путем применения аффинной хроматографии с белком А или белком G в ходе очистки белка. Таким образом, специфичность данного участка Fc имеет важное значение как для клинических свойств антител, так и для их очистки. Имеющиеся структуры комплекса Fc/FcRn крысы (см. публикации Burmeister et al., 1994, Nature, 372:379-383; Martin et al., 2001, Mol Cell 7:867-877, обе полностью включены в настоящее описание посредством ссылки) и комплексов Fc с белками А и G (Deisenhofer, 1981, Biochemistry 20:2361-2370; Sauer-Eriksson et al., 1995, Structure 3:265-278; Tashiro et al., 1995, Curr Opin Struct Biol 5:471-481, все полностью включены в настоящее описание посредством ссылки), дают представление о взаимодействии Fc с указанными белками. Рецептор FcRn также ответственен за перенос IgG в кишечник новорожденных и в полость эпителия кишечника у взрослых (Ghetie and Ward, Annu. Rev. Immunol., 2000, 18:739-766; Yoshida et al., Immunity, 2004, 20(6):769-783, оба полностью включенные в настоящее описание посредством ссылки).
Исследования доменов Fc крысы и человека продемонстрировали важное значение некоторых остатков Fc для связывания FcRn. Последовательности крысы и человека обладают примерно 64% идентичности последовательностей в областях Fc (остатки 237-443 согласно нумерации индекса EU). См. фиг. 3, 4 и 5 на предмет выравниваний Fc крыса/человек, тяжелая цепь FcRn и легкая цепь FcRn (бета-2-микроглобулин). Была создана модель комплекса Fc/FcRn человека исходя из имеющейся структуры комплекса Fc/FcRn крысы (Martin et al., 2001, Mol Cell 7:867-877, полностью включенный в настоящее описание посредством ссылки). Последовательности крысы и человека содержат некоторые общие остатки, имеющие ключевое значение для связывания FcRn, например Н310 и Н435 (Medesan et al., 1997 J. Immunol. 158(5):221-7; Shields et al., 2001, J. Biol. Chem. 276(9):6591-6604, оба полностью включенные в настоящее описание посредством ссылки). Однако во многих положениях белки человека и крысы содержат разные аминокислоты, обеспечивающие указанным остаткам в последовательности человека различное окружение и возможно отличную идентичность, чем в последовательности крысы. Указанная вариабельность ограничивает способность передавать особенности одного гомолога другому гомологу.
В Fc мышей случайная мутация и выбор фагового отображения на участках Т252, Т254 и Т256 приводит к тройному мутанту T252L/T254S/T256F, обладающему 3.5-кратным повышением аффинности к FcRn и 1.5-кратным увеличением времени полужизни в сыворотке (Ghetie et al., 1997, Nat. Biotech. 15(7): 637-640, полностью включенный в настоящее описание посредством ссылки). Нарушение взаимодействия Fc/FcRn посредством мутаций в положениях 253, 310 и 435 также приводит к уменьшению времени полужизни in vivo (Medesan et al. J. Immunol. 1997 158(5):2211-7, полностью включенный в настоящее описание посредством ссылки).
Были проведены исследования мутаций в Fey человека в некоторых остатках, имеющих важное значение для связывания с FcRn, и данные исследования продемонстрировали увеличенное время полужизни в сыворотке. В Fcγ1 человека Hinton et al. индивидуально подвергли мутации три остатка в другие 19 обычных аминокислот. Hinton et al. обнаружили, что некоторые мутанты, двойной мутант, повышали аффинность к связыванию FcRn (Hinton et al., 2004, J. Biol. Chem. 279(8): 6213-6216. Hinton et al. Journal of Immunology 2006, 176:346-356, оба полностью включенные в настоящее описание посредством ссылки). Две мутации обладали увеличенным временем полужизни у обезьян. Shields et al. подвергли мутации остатки практически исключительно в Ala и исследовали их связывание с FcRn и FcγR's (Shields et al., 2001, J. Biol. Chem., 276(9):6591-6604, полностью включенный в настоящее описание посредством ссылки).
Dall'Acqua et al. использовали фаговое отображение для выбора мутаций Fc, которые связывали FcRn с повышенной аффинностью (Dall'Acqua et al. 2002, J. Immunol. 169:5171-5180, полностью включенный в настоящее описание посредством ссылки). Выбранные последовательности ДНК преимущественно представляли собой двойные и тройные мутанты. Dall'Acqua et al. экспрессировали белки, кодируемые многими выбранными последовательностями, и были обнаружены некоторые из них, которые связывались с FcRn более прочно, чем в случае Fc дикого типа.
Для введения антител и гибридных белков Fc в качестве лекарственных средств необходимы инъекции с заданной частотой относительно клиренса и параметров времени полужизни белка. Более продолжительное время полужизни in vivo позволяет реже осуществлять инъекции или уменьшать дозу, что очевидно является благоприятным. Несмотря на то что проведенные мутации в домене Fc привели к получению некоторых белков, обладающих повышенной аффинностью к связыванию FcRn и увеличенным временем полужизни in vivo, данные мутации не определили оптимальные мутации и увеличенное время полужизни in vivo.
Одним из признаков области Fc является консервативное N-связанное гликозилирование, происходящее в N297. Данный углевод или олигосахарид, как его иногда называют, играет ключевую структурную и функциональную роль для антитела и представляет собой одну из основных причин, по которой антитела должны быть получены с использованием систем экспрессии млекопитающих (Umaña et al., 1999, Nat Biotechnol 17:176-180; Davies et al., 2001, Biotechnol Bioeng 74:288-294; Mimura et al., 2001, J Biol Chem 276:45539-45547; Radaev et al., 2001, J Biol Chem 276:16478-16483; Shields et al., 2001, J Biol Chem 276:6591-6604; Shields et al., 2002, J Biol Chem 277:26733-26740; Simmons et al., 2002, J Immunol Methods 263:133-147; Radaev et al., 2001, J Biol Chem 276:16469-16477; и Krapp et at, 2003, J Mol Biol 325:979-989, все полностью включенные в настоящее описание посредством ссылки).
Известно создание антител для терапевтического применения. Такие способы терапии описаны, например, в публикациях Chamow et al., 1996, Trends Biotechnol 14:52-60; Ashkenazi et al., 1997, Curr Opin Immunol 9:195-200, Cragg et al., 1999, Curr Opin Immunol 11:541-547; Glennie et al., 2000, Immunol Today 21:403-410, McLaughlin et al., 1998, J din Oncol 16:2825-2833 и Cobleigh et al., 1999, J Clin Oncol 17:2639-2648, каждая из которых полностью включена в настоящее описание посредством ссылки. В настоящее время в противораковой терапии любое небольшое снижение в уровне смертности считается успехом. Некоторые варианты IgG, указанные в настоящем описании, увеличивают способность антител ограничивать дальнейший рост или разрушать, по меньшей мере, частично целевые раковые клетки.
Противоопухолевая активность антител реализуется посредством увеличения их способности опосредовать цитотоксические эффекторные функции, такие как ADCC, ADCP и CDC. См., например, публикации Clynes et al., 1998, Proc Natl Acad Sci USA 95:652-656; Clynes et al., 2000, Nat Med 6:443-446 и Cartron et al., 2002, Blood 99:754-758, обе из которых полностью включены в настоящее описание посредством ссылки.
IgG1 человека представляет собой чаще всего используемое в терапевтических целях антитело, и в связи с этим было проведено большинство поисковых исследований. Однако различные изотипы класса IgG, включая IgG1, IgG2, IgG3 и IgG4, обладают уникальными физическими, биологическими и клиническими свойствами. В данной области техники существует необходимость создания улучшенных вариантов IgG1, IgG2, IgG3 и IgG4. Также существует необходимость создания указанных вариантов для улучшения связывания с FcRn и/или увеличения времени полужизни in vivo, no сравнению с нативными полипептидами IgG. Кроме того, существует необходимость комбинирования вариантов, обладающих улучшенными фармакокинетическими свойствами, с вариантами, содержащими модификации, для улучшения эффективности посредством измененного связывания FсгаммаR. Настоящая заявка соответствует этим и другим потребностям.
Краткое описание изобретения
Настоящая заявка относится к вариантам Fc исходного полипептида, содержащим, по меньшей мере, одну модификацию в области Fc указанного полипептида. В различных вариантах реализации вариантные полипептиды демонстрируют измененное связывание с FcRn по сравнению с исходным полипептидом. В некоторых вариантах модификация может быть выбрана из группы, включающей: 428L, 434М и 434S, где нумерация приведена согласно Индексу EU у Kabat et al.
В другом варианте реализации вариант Fc содержит, по меньшей мере, две модификации, выбранные из группы, включающей: 252Y/428L, 428L/434H, 428L/434F, 428L/434Y, 428L/434A, 428L/434M и 428L/434S.
В другом варианте реализации вариант Fc содержит, по меньшей мере, одну модификацию, выбранную из группы, включающей: M428L/N434S, V308F/M428L/N434S.
В другом варианте реализации вариант Fc содержит, по меньшей мере, одну модификацию, выбранную из группы, включающей: 259I/434S, 308F/434S, 308F/428L/434S, 259I/308F/434S, 307Q/308F/434S, 250I/308F/434S и 308F/319L/434S.
В другом варианте реализации вариант Fc содержит, по меньшей мере, одну модификацию, выбранную из группы, включающей:
В другом варианте реализации настоящее изобретение включает способ лечения пациента, нуждающегося в таком лечении, включающий введение эффективного количества варианта Fc, указанного в настоящем описании.
В другом варианте реализации настоящее изобретение включает способ увеличения времени полужизни антитела или иммуноадгезина путем модификации Fc согласно модификациям, указанным в настоящем описании
В другом варианте реализации настоящее изобретение включает вариант Fc, обладающий усиленным связыванием FcRn с дополнительными вариантами Fc, модулирующими эффекторную функцию.
Краткое описание фигур
Фиг.1. Выравнивания последовательностей константных тяжелых цепей IgG человека. Серым показаны отличия от IgG1, а заключенные в квадрат остатки показывают общие аллотипические вариации в популяции человека.
Фиг.2. (SEQ ID NO: 1-6). Аминокислотные последовательности константных областей, используемых согласно настоящему изобретению.
Фиг.3. (SEQ ID NO: 7-12). Аминокислотные последовательности константных областей типичных вариантов.
Фиг.4. (SEQ ID NO: 13-22). Аминокислотные последовательности вариабельных областей VH и VL, используемых согласно настоящему изобретению.
Фиг.5. (SEQ ID NO: 23-29). Аминокислотные последовательности типичных вариантных антител.
Фиг.6. Относительное связывание VEGF диким типом и выбранными вариантными антителами IgG1 анти-VEGF. На графике показаны единицы реакции (RU) Biacore в конце фазы ассоциации для связывания антитела-аналита с иммобилизированным антигеном VEGF. Антитело IgG1 анти-Her2 использовали в качестве отрицательного контроля.
Фиг.7. Сенсограммы Biacore антител IgG1 дикого типа и вариантных антител IgG1 к иммобилизированному FcRn человека при низком (6.0) и высоком (7.4) значении pH.
Фиг.8. Аффинности к связыванию FcRn антител IgG1 дикого типа и выбранных вариантных антител IgG1 в отношении FcRn человека при pH 6.0, как определено Biacore. На графике показана константа псевдоаффинности (Ка*) на логарифмической шкале.
Фиг.9. Относительное связывание вариантных антител IgG1 анти-VEGF с FcRn человека, как определено Biacore. В таблице показана кратность Ка* каждого варианта относительно IgG1 человека дикого типа (нативного). n показывает, сколько раз тестировали каждый вариант, «Среднее» и «SD» означают среднее и стандартное отклонение соответственно для каждого варианта в n экспериментах по связыванию. Кратность FcRn рассчитывали для всех вариантов относительно IgGI дикого типа в рамках каждого соответствующего эксперимента по связыванию. «NB» означает, что связывание не было обнаружено. «ND» означает, что связывание не было определено для данного конкретного варианта. «NF» означает, что соответствие было невозможно исходя из данных связывания.
Фиг.10. Относительное связывание вариантных антител IgG2 и IgG1/2 анти-VEGF с FcRn человека, как определено Biacore. Таблица является такой, как описано на фиг.9.
Фиг.11. Анализ аддитивных и синергических комбинаций замещения. На фиг.11а показан график зависимости экспериментально определенного кратного связывания каждого варианта с FcRn человека от предполагаемого кратного связывания FcRn, как определено результатом отдельных вариантов. Отмечены базовые точки вариантов, при этом линия отображает абсолютную аддитивность. На фиг.11b показано отличие между экспериментальной и предполагаемой кратностью для каждого комбинированного варианта. На фиг.11с показана синергия каждой комбинации вариантов. % синергии рассчитывают как 100х[(экспериментальная кратность/предполагаемая кратность) - 1)].
Фиг.12. Относительное связывание вариантных антител анти-TNF, -CD25, -EGFR и -IgE с FcRn человека, как определено Biacore. Таблица является такой, как описано на фиг.9.
Фиг.13. Фармакокинетические характеристики in vivo антител дикого типа и вариантных антител у мышей mFcRn-/- hFcRn+. На графиках изображена зависимость сывороточной концентрации антитела от времени после введения одной дозы внутривенно. На фиг. 13а показаны данные одного из четырех исследований, проведенных с использованием антител IgG1 (Исследование 3), а на фиг. 13b показаны данные исследования, проведенного с использованием антител IgG2 (Исследование 5).
Фиг.14. Подобранные ФК параметры всех ФК исследований in vivo, выполненных у мышей mFcRn-/- hFcRn+ с использованием вариантных антител и антител дикого типа. n означает число мышей в группе с данными среднего и стандартного отклонения (SD), предусмотренными ФК параметрами. «Время полужизни (время полувыведения)» представляет собой бета-фазу, характеризующую выведение антитела из сыворотки. Cmax представляет собой максимальную наблюдаемую сывороточную концентрацию, ППК представляет собой площадь под кривой «концентрация-время», а «клиренс» представляет собой клиренс антитела из сыворотки. Кратное время полужизни рассчитывают как время полужизни вариантного антитела относительно времени полужизни исходного IgG1 или IgG2 дикого типа в рамках каждого исследования.
Фиг.15. Корреляция между временем полужизни вариантных антител IgG1 (фиг.15а) и IgG2 (фиг.15b) у мышей mFcRn-/-hFcRn+ и кратное связывание FcRn относительное IgG1 дикого типа. Данные на оси-Y взяты с фиг.14, а данные на оси-Х взяты с фиг.9 и 10. Выбранные варианты отмечены, а данные вариантов повторных экспериментов обведены в кружок. На фиг. 15с показаны как данные корреляции IgG1, так и данные корреляции IgG2, при этом черные и серые линии представляют соответствие данных IgG1 and IgG2 соответственно.
Фиг.16 (SEQ ID NO: 30-35). Аминокислотные последовательности вариантных и исходных иммуноадгезинов Fc анти-TNF, используемых согласно настоящему изобретению.
Фиг.17. Связывание иммуноадгезинов анти-TNF с антигеном TNF, как определено Biacore.
Фиг.18. Относительное связывание вариантных иммуноадгезинов Fc с FcRn человека, как определено Biacore. В таблице показана кратность Ка* каждого варианта относительно IgG1 человека дикого типа (нативного). n показывает, сколько раз тестировали каждый вариант, а «Среднее» и «SD» означают среднее и стандартное отклонение соответственно для каждого варианта в n экспериментах по связыванию. Кратность FcRn рассчитывали для всех вариантов относительно соответствующего исходного IgG1 в рамках каждого соответствующего эксперимента по связыванию.
Фиг.19. Фармакокинетические характеристики in vivo исходных и вариантных иммуноадгезинов Fc у мышей mFcRn-/- hFcRn+. На графиках изображена зависимость сывороточной концентрации гибрида Fc от времени после введения одной дозы внутривенно.
Фиг.20. Подобранные ФК параметры гибрида Fc, полученные в результате ФК исследования in vivo у мышей mFcRn-/- hFcRn+. Параметры являются такими, как описано на фиг.14. % увеличения времени полужизни рассчитывают как умноженное на 100 время полужизни вариантного гибрида Fc относительно времени полужизни исходного IgG1 или IgG2 дикого типа.
Фиг.21. Относительное связывание вариантных антител IgG1 анти-VEGF с FcRn яванской макаки и человека, как определено Biacore. На фиг. 21а представлены данные в форме таблицы. Описание указанной фигуры соответствует описанию на фиг.9, а данные связывания с FcRn человека взяты с фиг.9. На фиг.21b представлен график указанных данных.
Фиг.22. Фармакокинетические характеристики in vivo антител дикого типа и вариантных антител у яванских макак. На графиках изображена зависимость сывороточной концентрации антитела от времени после введения одной дозы внутривенно.
Фиг.23. Подобранные ФК параметры, полученные в результате ФК исследования in vivo у яванских макак с использованием вариантных антител и антител дикого типа. Параметры являются такими, как описано на фиг.14.
Подробное описание изобретения
Согласно настоящему изобретению описано получение новых вариантов доменов Fc, включая варианты, содержащиеся в антителах, гибридах Fc и иммуноадгезинах, которые обладают увеличенным связыванием с рецептором FcRn. Как указано в настоящем описании, связывание с FcRn приводит к более продолжительному удерживанию в сыворотке in vivo.
Для того чтобы увеличить удерживание белков Fc in vivo повышение аффинности к связыванию должно происходить при значении pH около 6, тогда как поддержание более низкой аффинности - при значении pH около 7.4. Несмотря на продолжающиеся исследования, считают, что области Fc обладают более продолжительным временем полужизни in vivo, т.к. связывание с FcRn при pH 6 в эндосоме секвестирует Fc (Ghetie and Ward, 1997 Immunol Today. 18(12); 592-598, полностью включенный в настоящее описание посредством ссылки). Затем эндосомальный компартмент возвращает Fc на поверхность клетки. Как только компартмент открывает внеклеточное пространство, более высокое значение pH, ~7.4, индуцирует высвобождение Fc обратно в кровь. У мышей Dall' Acqua et al. показали, что мутанты Fc, обладающие увеличенным связыванием FcRn при pH 6 и pH 7.4, в действительности уменьшали сывороточные концентрации и время полужизни, как и Fc дикого типа (Dall' Acqua et al. 2002, J. Immunol. 169:5171-5180, полностью включенный в настоящее описание посредством ссылки). Считают, что повышенная аффинность Fc к FcRn при pH 7.4 не позволяет высвобождать Fc обратно в кровь. Следовательно, мутации Fc, которые увеличат время полужизни Fc in vivo в идеальном случае увеличат связывание FcRn при более низком значении pH, в то же время, позволяя высвобождать Fc при более высоком значении pH. Аминокислота гистидин меняет свое заряженное состояние в диапазоне pH 6.0-7.4. Следовательно, неудивительно, что остатки His расположены в комплексе Fc/FcRn (фиг. 6) в положениях, имеющих важное значение.
Дополнительный аспект настоящего изобретения представляет собой увеличение связывания FcRn по сравнению с диким типом, в частности при более низком значении pH, pH около 6.0, для облегчения связывания Fc/FcRn в эндосоме. Также описаны варианты Fc, обладающие измененным связыванием FcRn и измененным связыванием с другим классом рецепторов Fc, FcγR's (иногда пишут PcraMMaR's), т.к. было показано, что дифференцированное связывание с FcγRs, в частности увеличенное связывание с FcγRIIIb и уменьшенное связывание с FcγRIIb, приводит к повышенной эффективности.
Определения
Для более полного понимания настоящей заявки ниже приведены некоторые определения. Подразумевается, что указанные определения включают грамматические эквиваленты.
В настоящем описании термин «ADCC» или «антителозависимая клеточноопосредованная цитотоксичность» означает опосредуемую клетками реакцию, в которой неспецифические цитотоксические клетки, экспрессирующие FcγRs, распознают связанное антитело на клетке-мишени и затем вызывают лизис данной клетки-мишени.
В настоящем описании термин «ADCP» или «антителозависимый клеточноопосредованный фагоцитоз» означает опосредуемую клетками реакцию, в которой неспецифические цитотоксические клетки, экспрессирующие FcγRs, распознают связанное антитело на клетке-мишени и затем вызывают фагоцитоз данной клетки-мишени.
В настоящем описании термин «модификация» означает замещение, встраивание и/или делецию аминокислот в полипептидной последовательности или преобразование во фрагмент, химически связанный с белком. Например, модификация может представлять собой измененную структуру углевода или PEG, присоединенную к белку. В настоящем описании термин «модификация аминокислот» означает замещение, встраивание и/или делецию аминокислот в полипептидной последовательности.
В настоящем описании термин «замещение аминокислот» или «замещение» означает замену аминокислоты в конкретном положении в исходном полипептиде на другую аминокислоту. Например, замещение E272Y относится к вариантному полипептиду, в данном случае варианту Fc, в котором глутаминовая кислота в положении 272 заменена на тирозин.
В настоящем описании термин «встраивание аминокислот» или «встраивание» означает добавление аминокислотной последовательности в конкретное положение в исходной полипептидной последовательности. Например -233Е или ^233Е означает встраивание глутаминовой кислоты после положения 233 и перед положением 234. Кроме того, -233ADE или ^33ADE означает встраивание AlaAspGlu после положения 233 и перед положением 234.
В настоящем описании термин «деления аминокислот» или «деления» означает удаление аминокислотной последовательности в конкретном положении в исходной полипептидной последовательности. Например, Е233- или Е233# означает делецию глутаминовой кислоты в положении 233. Кроме того, EDA233- или EDA233# означает делецию последовательности GluAspAla, начинающуюся в положении 233.
В настоящем описании термин «вариантный белок» или «вариант белка», или «вариант» означает белок, отличающийся от исходного белка наличием, по меньшей мере, одной модификации аминокислоты. Термин «вариант белка» может относиться к самому белку, композиции, содержащей указанный белок, или аминокислотной последовательности, кодирующей его. Предпочтительно вариант белка содержит, по меньшей мере, одну модификацию аминокислот по сравнению с исходным белком, например, от примерно одной до примерно семидесяти модификаций аминокислот, и предпочтительно от примерно одной до примерно пяти модификаций аминокислот по сравнению с исходным белком. В настоящем описании последовательность варианта белка предпочтительно будет обладать, по меньшей мере, около 80% гомологии с последовательностью исходного белка и более предпочтительно, по меньшей мере, около 90% гомологии, наиболее более предпочтительно, по меньшей мере, около 95% гомологии. Термин «вариантный белок» может относиться к самому вариантному белку, композициям, содержащим указанный вариант белка, или последовательности ДНК, кодирующей его. Соответственно, в настоящем описании термин «вариант антитела» или «вариантное антитело» означает антитело, отличающееся от исходного антитела наличием, по меньшей мере, одной модификации аминокислоты, термин «вариант IgG» или «вариантный IgG» означает антитело, отличающееся от исходного IgG наличием, по меньшей мере, одной модификации аминокислоты и термин «вариант иммуногдобулина» или «вариантный иммуноглобулин» означает последовательность иммуноглобулина, отличающуюся от исходной последовательности иммуноглобулина наличием по меньшей мере одной модификации аминокислоты. В настоящем описании термин «вариант Fc» или «вариантный Fc» означает белок, содержащий модификацию в домене Fc. Варианты Fc согласно настоящему изобретению определены в соответствии с модификациями аминокислот, которые они содержат. Таким образом, например, N434S или 434S представляет собой вариант Fc, содержащий замещение, серии, в положении 434 относительно исходного полипептида Fc, при этом нумерация приведена согласно индексу EU. Аналогичным образом, M428L/N434S определяет вариант Fc, содержащий замещения M428L и N434S относительно исходного полипептида Fc. Идентичность аминокислоты дикого типа может быть не определена и в этом случае вышеуказанный вариант обозначается 428L/434S. Отмечают, что порядок, в котором предложены замещения, является произвольным, т.е., например, 428L/434S представляет собой тот же вариант Fc, что и M428L/N434S и т.д. Для всех положений, описанных согласно настоящему изобретению, нумерация приведена согласно индексу EU. Термин «индекс EU» или «индекс EU согласно Kabat», или «схема нумерации EU» относится к нумерации антитела EU (Edelman et al., 1969, Proc Natl Acad Sci USA 63:78-85, тем самым полностью включенный в настоящее описание посредством ссылки). Модификация может представлять собой добавление, делецию или замещение. Замещения могут включать встречающиеся в природе аминокислоты и не встречающиеся в природе аминокислоты. Варианты могут содержать неприродные аминокислоты. Примеры включают US 6586207; WO 98/48032; WO 03/073238; US 2004-0214988 A1; WO 05/35727 A2; WO 05/74524 A2; J.W.Chin et al., (2002), Journal of the American Chemical Society 124:9026-9027; J.W.Chin, & P.G.Schultz, (2002), ChemBioChem 11:1135-1137; J.W.Chin, et al., (2002), PICAS United States of America 99:11020-11024; and, L.Wang, & P.G.Schultz, (2002), Chem. 1-10, все из которых полностью включены в настоящее описание посредством ссылки.
В настоящем описании термин «белок» означает, по меньшей мере, две ковалентно присоединенные аминокислоты, при этом указанный термин включает белки, полипептиды, олигопептиды и пептиды. Пептидильная группа может содержать встречающиеся в природе аминокислоты и пептидные связи или синтетические пептидомиметические структуры, т.е. «аналоги», такие как пептоиды (см. Simon et al., PNAS USA 89(20):9367 (1992), который полностью включен в настоящее описание посредством ссылки). Аминокислоты могут быть либо встречающимися в природе, либо не встречающимися в природе, что очевидно для специалистов в данной области техники. Например, гомофенилаланин, цитруллин и норлейцин считаются аминокислотами для целей настоящего изобретения и могут быть использованы аминокислоты как D-, так и L-(R или S) конфигураций. Варианты согласно настоящему изобретению могут содержать модификации, включающие использование неприродных аминокислот с использованием, например, технологий, разработанных Schultz и коллегами, включая, без ограничения, способы, описанные Cropp & Shultz, 2004, Trends Genet. 20(12):625-30, Anderson et al., 2004, Proc Natl Acad Sci USA 101(2):7566-71, Zhang et al., 2003, 303(5656):371-3 и Chin et al., 2003, Science 301(5635):964-7, все из которых полностью включены в настоящее описание посредством ссылки. Кроме того, полипептиды могут включать синтетическую дериватизацию одной или нескольких боковых цепей или терминалов, гликозилирование, пегилирование (PEGylation), циклическую перестановку, циклизацию, линкеры для соединения с другими молекулами, гибридизацию в белки или домены белков и добавление пептидных тегов или меток.
В настоящем описании термин «остаток» означает положение в белке и связанную аминокислотную идентичность. Например, Аспарагин 297 (также обозначаемый Asn297 или N297) представляет собой остаток в положении 297 в антителе IgG1 человека.
В настоящем описании термин «Fab» или «область Fab» означает полипептид, содержащий домены VH, CH1, VL и CL иммуноглобулина. Термин «Fab» может относится к данной области отдельно или в контексте полноразмерного антитела, фрагмента антитела или гибридного белка Fab. В настоящем описании термин «Fv» или «фрагмент_Fv», или «область_Fv» означает полипептид, содержащий домены VL и VH одного антитела.
В настоящем описании термин «модификация подкласса IgG» означает модификацию аминокислот, превращающую одну аминокислоту одного изотипа IgG в соответствующую аминокислоту другого, выровненного изотипа IgG. Например, т.к. IgG1 содержит тирозин, a IgG2 содержит фенилаланин в положении EU 296, замещение F296Y в IgG2 считают модификацией подкласса IgG.
В настоящем описании термин «не встречающаяся в природе модификация» означает модификацию аминокислот, которая не является изотипической. Например, т.к. ни один из IgGs не содержит серин в положении 434, замещение 434S в IgG1, IgG2, IgG3 или IgG4 считают не встречающейся в природе модификацией.
В настоящем описании термины «аминокислота» и «аминокислотная идентичность» означают одну из 20 встречающихся в природе аминокислот или любые неприродные аналоги, которые могут присутствовать в конкретном, определенном положении.
В настоящем описании термин «эффекторная функция» означает биохимическую реакцию, являющуюся следствием взаимодействия области Fc антитела с рецептором или лигандом Fc. Эффекторные функции включают без ограничения ADCC, ADCP и CDC.
В настоящем описании термин «лиганд Fc IgG» означает молекулу, предпочтительно полипептид, происходящую из любого организма, которая связывается с областью Fc антитела IgG с образованием комплекса Fc/лиганд Fc. Лиганды Fc включают без ограничения FcγRs, FcγRs, FcγRs, FcRn, C1q, С3, маннан-связывающий лектин, маннозный рецептор, стафилококковый белок А, стрептококковый белок G и вирусный FcγR. Лиганды Fc также включают гомологи рецептора Fc (FcRH), которые представляют собой семейство рецепторов Fc, гомологичных FcγRs (Davis et al., 2002, Immunological Reviews 190:123-136, полностью включенный в настоящее описание посредством ссылки). Лиганды Fc могут включать неисследованные молекулы, связывающие Fc. Конкретные лиганды Fc IgG представляют собой FcRn и гамма рецепторы Fc. В настоящем описании термин «лиганд Fc» означает молекулу, предпочтительно полипептид, происходящую из любого организма, которая связывается с областью Fc антитела с образованием комплекса Fc/лиганд Fc.
В настоящем описании термин «гамма рецептор Fc», «FcγR» или «FcгаммаR» означает любой член семейства белков, который связывается с областью Fc антитела IgG и кодируется геном FcγR. У людей данное семейство включает без ограничения FcyRI (CD64), включая изоформы FcγRIa, FcγRIb и FcγRIc; FcγRII (CD32), включая изоформы FcγRIIa (включая аллотипы H131 и R131), FcγRIIb (включая FcγRIIb-1 и FcγRIIb-2) и FcγRIIc; и FcγRIII (CD16), включая изоформы FcγRIIIa (включая аллотипы V158 и F158) и FcγRIIIb (включая аллотипы FcγRIIIb-NA1 и FcγRIIIb-NA2) (Jefferis et al., 2002, Immunol Lett 82:57-65, полностью включенный в настоящее описание посредством ссылки), а также любые неисследованные изоформы FcγRs или FcγR или аллотипы человека. FcγR может происходить из любого организма, включая без ограничения людей, мышей, крыс, кроликов и обезьян. FcyRs мыши включают без ограничения FcγRI (CD64), FcγRII (CD32), FcγRIII (CD16) и FcγRIII-2 (CD16-2), а также любые неисследованные изоформы FcγRs или FcγR или аллотипы мыши.
В настоящем описании термин «FcRn» или «неонатальный рецептор Fc» означает белок, который связывается с областью Fc антитела IgG и, по меньшей мере, частично кодируется геном FcRn. FcRn может происходить из любого организма, включая без ограничения людей, мышей, крыс, кроликов и обезьян. Как известно в данной области техники, функциональный белок FcRn содержит два полипептида, часто называющихся «тяжелой цепью» и «легкой цепью». Легкая цепь представляет собой бета-2-микроглобулин, а тяжелая цепь кодируется геном FcRn. Если в настоящем описании не указано иное, термин «FcRn» или «белок FcRn» относится к комплексу тяжелой цепи FcRn с бета-2-микроглобулином. Последовательности FcRn, в частности людей, представляющие особый интерес, показаны на фигурах.
В настоящем описании термин «исходный полипептид» означает немодифицированный пептид, который затем модифицируют с получением варианта. Исходный полипептид может представлять собой встречающийся в природе полипептид или вариант, или созданную версию встречающегося в природе полипептида. Термин «исходный полипептид» может относиться к самому полипептиду, композициям, содержащим указанный исходный полипептид, или аминокислотной последовательности, кодирующей его. Соответственно, в настоящем описании термин «исходный иммуноглобудин» означает немодифицированный пептид иммуноглобулина, который модифицируют с получением варианта, а термин «исходное антитело» означает немодифицированное антитело, которое модифицируют с получением вариантного антитела. Следует отметить, что термин «исходное антитело» включает известные коммерчески доступные, полученные рекомбинантными способами антитела, как указано ниже.
В настоящем описании термин «положение» означает место в последовательности белка. Положения могут быть пронумерованы по порядку или в соответствии с установленной схемой, например, индексом EU для нумерации антитела.
В настоящем описании термин «антиген-мишень» означает молекулу, специфически связанную вариабельной областью указанного антитела. Антиген-мишень может представлять собой белок, углевод, липид или другое химическое соединение.
В настоящем описании термин «клетка-мишень» означает клетку, экспрессирующую антиген-мишень.
В настоящем описании термин «вариабельная область» означает область иммуноглобулина, которая содержит один или несколько доменов иммуноглобулина, по существу кодируемых любым из генов Vκ, Vλ и/или VH, составляющих каппа, лямбда локусы и генетические локусы тяжелых цепей иммуноглобулина соответственно.
В настоящем описании термин «дикий тип или WT» означает аминокислотную последовательность или нуклеотидную последовательность, которая встречается в природе, включая аллельные вариации. Белок дикого типа содержит аминокислотную последовательность или нуклеотидную последовательность, которую целенаправленно не модифицировали.
Настоящее изобретение относится к антителам, демонстрирующим увеличенное связывание с FcRn по сравнению с антителом дикого типа. Например, в ряде случаев увеличенное связывание приводит к клеточной рециркуляции антитела, и, следовательно, к увеличенному времени полужизни. Кроме того, антитела, демонстрирующие увеличенное связывание с FcRn и измененное связывание с другими рецепторами Fc, например FcγRs, находят применение согласно настоящему изобретению.
Антитела
Настоящее изобретение относится к антителам, которые содержат модификации аминокислот, модулирующие связывание с FcRn. Особый интерес представляют антитела, минимально содержащие область Fc или ее функциональный вариант, демонстрирующий повышенную аффинность к связыванию с FcRn при пониженном значении pH и по существу не демонстрирующий измененное связывание при более высоком значении pH.
Традиционные структурные единицы антитела, как правило, содержат тетрамер. Каждый тетрамер, как правило, состоит из двух идентичных пар полипептидных цепей, при этом каждая пара содержит одну «легкую» (как правило, имеющую молекулярную массу примерно 25 кДа) и одну «тяжелую» цепь (как правило, имеющую молекулярную массу примерно 50-70 кДа). Легкие цепи человека делят на каппа и лямбда легкие цепи. Тяжелые цепи делят на мю, дельта, гамма, альфа или эпсилон и они определяют изотип антитела IgM, IgD, IgG, IgA и IgE соответственно. IgG имеет несколько подклассов, включая без ограничения IgG1, IgG2, IgG3 и IgG4. IgM имеет подклассы, включая без ограничения IgM1 и IgM2. Таким образом, в настоящем описании термин «изотип» означает любой из подклассов иммуноглобулинов, определяемый химическими и антигенными свойствами своих константных областей. Известные изотипы иммуноглобулина человека представляют собой IgG1, IgG2, IgG3, IgG4, IgA1, IgA2, IgM1, IgM2, IgD и IgE.
N-конец каждой цепи содержит вариабельную область, состоящую из примерно 100-110 или более аминокислот, главным образом ответственную за распознавание антигена. В вариабельной области три петли соединены для каждого из V-доменов тяжелой цепи и легкой цепи с образованием антигенсвязывающего центра. Каждая из петель называется «определяющей комплементарность областью» (гипервариабельным участком) (далее обозначаемая «CDR»), в которой вариация аминокислотной последовательности имеет наибольшее значение.
С-конец каждой цепи определяет константную область, главным образом ответственную за эффекторную функцию. Kabat et al. получили многочисленные первичные последовательности вариабельных областей тяжелых цепей и легких цепей. Исходя из степени консервативности указанных последовательностей, они разделили индивидуальные первичные последовательности на CDR и каркасные области и составили их список (см. SEQUENCES OF IMMUNOLOGICAL INTEREST, 5th edition, NIH publication. No. 91-3242, E.A.Kabat et al., который полностью включен в настоящее описание посредством ссылки).
В подклассе IgG иммуноглобулинов существуют несколько доменов иммуноглобулина в тяжелой цепи. В настоящем описании термин «домен иммуноглобулина (Ig)» означает область иммуноглобулина, имеющую отличающуюся третичную структуру. Согласно настоящему изобретению интерес представляют домены тяжелых цепей, включая константные тяжелые (СН) домены и шарнирные домены. В контексте антител IgG каждый изотип IgG содержит три области СН. Соответственно, домены «СН» в контексте IgG являются следующими: «СН1» относится к положениям 118-220 согласно индексу EU, как у Kabat. «CH2» относится к положениям 237-340 согласно индексу EU, как у Kabat и «СН3» относится к положениям 341-447 согласно индексу EU, как у Kabat.
Другой тип домена Ig тяжелой цепи представляет собой шарнирную область. В настоящем описании термин «шарнир» или «шарнирная область», или «шарнирная область антитела», или «шарнирная область иммуноглобулина» означает гибкий полипептид, содержащий аминокислоты между первым и вторым константным доменом антитела. Структурно, домен СН1 IgG заканчивается в положении EU 220, а домен CH2 IgG начинается положении EU остатка 237. Таким образом, для IgG шарнир антитела в настоящем описании включает положения 221 (D221 в IgGI) - 236 (G236 в IgGI), при этом нумерация приведена согласно индексу EU, как у Kabat. В некоторых вариантах реализации, например в контексте области Fc, включен низший шарнир, при этом термин «низший шарнир» в целом относится к положениям 226 или 230.
Особый интерес согласно настоящему изобретению представляют области Fc. В настоящем описании термин «Fc» или «область Fc» означает полипептид, содержащий константную область антитела за исключением первого иммуноглобулинового домена константной области, и в некоторых случаях часть шарнира. Таким образом, термин «Fc» относится к последним двум иммуноглобулиновым доменам IgA, IgD и IgG константной области, последним трем иммуноглобулиновым доменам IgE и IgM константной области и гибкому шарниру, N-терминальному по отношению к указанным доменам. Для IgA и IgM, Fc может содержать цепь J. Для IgG, как изображено на фиг. 1, Fc содержит домены иммуноглобулина Сгамма2 и Сгамма3 (Cg2 и Cg3) и низшую шарнирную область между Сгамма1 (Cg1) и Сгамма2 (Cg2). Несмотря на то что границы области Fc могут варьироваться, область Fc тяжелой цепи IgG человека, как правило, включает остатки С226 или Р230 относительно карбоксильного терминала, при этом нумерация приведена согласно индексу EU, как у Kabat. Термин «Fc» может относиться к данной области отдельно или в контексте полипептида Fc, как описано ниже. В настоящем описании термин «полипептид Fc» означает полипептид, содержащий всю область Fc или ее часть. Полипептиды Fc включают антитела, гибриды Fc, выделенные области Fc и фрагменты Fc.
В некоторых вариантах реализации антитела являются полноразмерными. В настоящем описании термин «полноразмерное антитело» означает структуру, которая формирует природную биологическую форму антитела, включая вариабельные и константные области, содержащие одну или несколько модификаций, как указано в настоящем описании.
В качестве альтернативы, антитела могут представлять собой множество структур, включая без ограничения фрагменты антител, моноклональные антитела, биспецифические антитела, миниантитела, доменные антитела, синтетические антитела (иногда называющиеся в настоящем описании «миметиками антител»), химерные антитела, гуманизированные антитела, гибриды антител (иногда называющиеся в настоящем описании «конъюгатами антител») и фрагменты каждого из указанных соответственно.
Фрагменты антител
В одном из вариантов реализации антитело представляет собой фрагмент антитела. Особый интерес представляют антитела, содержащие области Fc, гибриды Fc и константную область тяжелой цепи (СН1-шарнир-СН2-СН3), также включая гибриды константной области тяжелой цепи.
Конкретные фрагменты антитела включают без ограничения (i) фрагмент Fab, содержащий домены VL, VH, CL и СН1, (ii) фрагмент Fd, содержащий домены VH и СН1, (iii) фрагмент Fv, содержащий домены VL и VH одного антитела; (iv) фрагмент dAb (Ward et al., 1989, Nature 341:544-546, полностью включенный в настоящее описание посредством ссылки), содержащий одну вариабельную область, (v) выделенные области CDR, (vi) фрагменты F(ab')2, двухвалентный фрагмент, содержащий два связанных фрагмента Fab (vii) одноцепочечные молекулы Fv (scFv), в которых домен VH и домен VL связаны пептидным линкером, позволяющим двум указанным доменам ассоциироваться с образованием антигенсвязывающего центра (Bird et al., 1988, Science 242:423-426, Huston et al., 1988, Proc. Natl. Acad. Sci. U.S.A. 85:5879-5883, полностью включенные в настоящее описание посредством ссылки), (viii) биспецифический одноцепочечный Fv (WO 03/11161, тем самым полностью включенный в настоящее описание посредством ссылки) и (ix) «диатела» или «триатела», поливалентные или полиспецифические фрагменты, полученные путем слияния генов (Tomlinson et. al., 2000, Methods Enzymol. 326:461-479; WO 94/13804; Holhger et al., 1993, Proc. Natl. Acad. Sci. U.S.A. 90:6444-6448, все полностью включенные в настоящее описание посредством ссылки). Фрагменты антитела могут быть модифицированы. Например, молекулы могут быть стабилизированы путем введения дисульфидных мостиков, связывающих домены VH и VL (Reiter et al., 1996, Nature Biotech. 14:1239-1245, полностью включенный в настоящее описание посредством ссылки).
Химерные и гуманизированные антитела
В некоторых вариантах реализации каркасные компоненты могут представлять собой смесь разных видов. Поэтому, если белок представляет собой антитело, такое антитело может представлять собой химерное антитело и/или гуманизированное антитело. В целом, термин как «химерные антитела», так и «гуманизированные антитела» относится к антителам, содержащим комбинированные области более чем одного вида. Например, «химерные антитела» традиционно содержат вариабельную область (области) мыши (или крысы в некоторых случаях) и константную область (области) человека. Термин «гуманизированные антитела» в целом относится к антителам нечеловеческого происхождения, содержащим каркасные области вариабельного домена, замененные на последовательности, встречающиеся в антителах человека. В целом, в гуманизированном антителе антитело полностью, за исключением CDRs, кодируется полинуклеотидом человеческого происхождения или является идентичным такому антителу, за исключением CDRs. Области CDR, некоторые или все из которых кодируются нуклеиновыми кислотами, происходящими из нечеловеческого организма, трансплантируют в каркас бета-складчатого слоя вариабельной области антитела человека с получением антитела, специфичность которого определяется внедренными CDRs. Получение таких антител описано, например, в WO 92/11018, Jones, 1986, Nature 321:522-525, Verhoeyen et al., 1988, Science 239:1534-1536, все из которых полностью включены в настоящее описание посредством ссылки. «Обратная мутация» выбранных акцепторных остатков каркаса в соответствующие донорные остатки часто необходима для восстановления аффинности, утраченной в исходной трансплантированной конструкции (US 5530101; US 5585089; US 5693761; US 5693762; US 6180370; US 5859205; US 5821337; US 6054297; US 6407213, все полностью включенные в настоящее описание посредством ссылки). В оптимальном варианте гуманизированное антитело также будет содержать, по меньшей мере, часть константной области иммуноглобулина, как правило, иммуноглобулина человека, и таким образом будет содержать область Fc человека. Гуманизированные антитела также могут быть получены с использованием мышей с иммунной системой, созданной методами генной инженерии. Roque et al., 2004, Biotechnol. Prog. 20:639-654, полностью включенный в настоящее описание посредством ссылки. Множество технологий и способов гуманизации и реконструирования антител нечеловеческого происхождения хорошо известны в данной области техники (См. Tsurushita & Vasquez, 2004, Humanization of Monoclonal Antibodies, Molecular Biology of В Cells, 533-545, Elsevier Science (USA) и приведенные там ссылки, все из которых полностью включены в настоящее описание посредством ссылки). Способы гуманизации включают без ограничения способы, описанные в Jones et al., 1986, Nature 321:522-525; Riechmann et al., 1988; Nature 332:323-329; Verhoeyen et al., 1988, Science, 239:1534-1536; Queen et al., 1989, Proc Nati Acad Sci, USA 86:10029-33; He et al., 1998, J. Immimol. 160: 1029-1035; Carter et al., 1992, Proc Natl Acad Sci USA 89:4285-9, Presta et al., 1997, Cancer Res.57(20):4593-9; Gorman et al., 1991, Proc. Natl. Acad. Sci. USA 88:4181-4185; O'Connor et al., 1998, Protein Eng 11:321-8, все из которых полностью включены в настоящее описание посредством ссылки. Гуманизация или другие способы снижения иммуногенности вариабельных областей антител нечеловеческого происхождения могут включать способы восстановления поверхности, например, как описано в Roguska et al., 1994, Proc. Nati. Acad. Sci. USA 91:969-973, который полностью включен в настоящее описание посредством ссылки. В одном из вариантов реализации исходное антитело подвергали созреванию аффинности, как известно в данной области техники. Способы, основанные на структуре, могут быть использованы для гуманизации и созревания аффинности, например, как описано в USSN 11/004590. Способы, основанные на выборе, могут быть использованы для гуманизации и/или созревания аффинности вариабельных областей антитела, включая без ограничения способы, описанные в Wu et al., 1999, J. Mol. Biol. 294:151-162; Baca et al., 1997, J. Biol. Chem. 272(16):10678-10684; Rosok et al., 1996, J. Biol. Chem. 271(37): 22611-22618; Rader et al., 1998, Proc. Nati. Acad. Sci. USA 95: 8910-8915; Krauss et al., 2003, Protein Engineering 16(10):753-759, все из которых полностью включены в настоящее описание посредством ссылки. Другие способы гуманизации могут включать трансплантацию только частей CDRs, включая без ограничения способы, описанные в USSN 09/810510; Tan et al., 2002, J. Immunol. 169:1119-1125; De Pascalis et al., 2002, J. Immunol. 169:3076-3084, все из которых полностью включены в настоящее описание посредством ссылки.
Биспецифические антитела
В одном из вариантов реализации антитела согласно настоящему изобретению включают полиспецифическое антитело и в частности биспецифическое антитело, также иногда называющееся «диателом». Указанные антитела представляют собой антитела, связывающиеся с двумя (или более) различными антигенами. Диатела могут быть получены множеством способов, известных в данной области техники (Holliger and Winter, 1993, Current Opinion Biotechnol. 4:446-449, полностью включенный в настоящее описание посредством ссылки), например, получены химически или из межвидовых гибридом.
Миниантитела
В одном из вариантов реализации антитело представляет собой миниантитело. Миниантитела представляют собой минимизированные подобные антителам белки, содержащие scFv, соединенный с доменом СН3. Нu et al., 1996, Cancer Res. 56:3055-3061, полностью включенный в настоящее описание посредством ссылки. В некоторых случаях scFv может быть связан с областью Fc и может включать некоторую часть или всю шарнирную область.
Гибриды антител
В одном из вариантов реализации антитела согласно настоящему изобретению представляют собой гибридные белки антител (иногда называющиеся в настоящем описании «конъюгатами антител»). Один из видов гибридов антител содержит гибриды Fc, которые соединяют область Fc с «партнером» по конъюгации. В настоящем описании термин «гибрид Fc» означает белок, в котором один или несколько полипептидов функционально связаны с областью Fc. В настоящем описании термин «гибрид Fc» является синонимом терминов «иммуноадгезин», «гибрид Ig», «химера Ig» и «рецепторный глобулин» (иногда с примесями), используемых в известном уровне техники (Chamow et al., 1996, Trends Biotechnol 14:52-60; Ashkenazi et al., 1997, Curr Opin Immunol 9:195-200, оба полностью включенные в настоящее описание посредством ссылки). Гибрид Fc объединяет область Fc иммуноглобулина с «партнером» по слиянию, который в целом может представлять собой любой белок или небольшую молекулу. В действительности любой белок или небольшая молекула может быть связана с Fc с получением гибрида Fc. Белковые «партнеры» по слиянию могут включать без ограничения вариабельную область любого антитела, область рецептора для связывания с мишенью, адгезивную молекулу, лиганд, фермент, цитокин, хемокин или некоторый другой белок или домен белка. «Партнеры» по слиянию, представляющие небольшие молекулы, могут включать любой терапевтический агент, который направляет гибрид Fc к мишени для терапевтического воздействия. Такие мишени могут представлять собой любую молекулу, предпочтительно внеклеточный рецептор, которая вовлечена в заболевание. Таким образом, варианты IgG могут быть соединены с одним или несколькими «партнерами» по слиянию. В одном из альтернативных вариантов реализации вариант IgG конъюгируют или функционально связывают с другим терапевтическим соединением. Терапевтическое соединение может представлять собой цитотоксический агент, химиотерапевтический агент, токсин, радиоизотоп, цитокин или другой терапевтически активный агент. IgG может быть связан с одним из множества небелковых полимеров, например, полиэтиленгликолем, полипропиленгликолем, полиоксиалкиленами или сополимерами полиэтиленгликоля и полипропиленгликоля.
Помимо гибридов Fc гибриды антител включают гибрид константной области тяжелой цепи с одним или несколькими «партнерами» по слиянию (включая вариабельную область любого антитела), в то время как другие гибриды антител представляют собой по существу или полностью полноразмерные антитела с «партнерами» по слиянию. В одном из вариантов реализации роль «партнера» по слиянию заключается в опосредовании связывания с мишенью и таким образом он является функционально аналогичным вариабельным областям антитела (и фактически может быть). В действительности любой белок или небольшая молекула может быть соединена с Fc с получением гибрида Fc (или гибрида антитела). Белковые «партнеры» по слиянию могут включать без ограничения область рецептора для связывания с мишенью, адгезивную молекулу, лиганд, фермент, цитокин, хемокин или некоторый другой белок или домен белка. «Партнеры» по слиянию, представляющие небольшие молекулы, могут включать любой терапевтический агент, который направляет гибрид Fc к мишени для терапевтического воздействия. Такие мишени могут представлять собой любую молекулу, предпочтительно внеклеточный рецептор, которая вовлечена в заболевание.
«Партнер» по конъюгации может быть белковым или небелковым; последний обычно получают с использованием функциональных групп антитела и «партнера» по конъюгации. Например, линкеры известны в данной области техники; например, гомо- или гетеробифункциональные линкеры хорошо известны (см. 1994 каталог Pierce Chemical Company, раздел техники, посвященный линкерам, страницы 155-200, который включен в настоящее описание посредством ссылки).
Подходящие конъюгаты включают без ограничения метки, как описано ниже, лекарственные средства и цитотоксические агенты, включая без ограничения цитотоксические лекарственные средства (например, химиотерапевтические агенты) или токсины, или активные фрагменты указанных токсинов. Подходящие токсины и их соответствующие фрагменты включают цепь А дифтерии, цепь А экзотоксина, цепь А рицина, цепь А абрина, курцин, кротин, феномицин, эномицин и т.п. Цитотоксические агенты также включают радиохимические вещества, получаемые путем конъюгирования радиоизотопов с антителами или путем связывания радионуклида с хелатирующим агентом, который был ковалентно присоединен к антителу. В дополнительных вариантах реализации используют калихимицин, ауристатин, гелданамицин, майтансин и дуокармицин и аналоги; на предмет последнего см. U.S. 2003/0050331 А1, который полностью включен в настоящее описание посредством ссылки.
Ковалентные модификации антител
Ковалентные модификации антител включены в объем настоящего изобретения и обычно, но не всегда, их осуществляют посттрансляционно. Например, некоторые виды ковалентных модификаций антитела вводят в молекулу путем осуществления взаимодействия конкретных аминокислотных остатков антитела с органическим дериватизирующим агентом, который может реагировать с выбранными боковыми цепями или N- или С-концевыми остатками.
Цистеинильные остатки чаще всего подвергают взаимодействию с α-галогенацетатами (и соответствующими аминами), такими как хлоруксусная кислота или хлорацетамид с получением карбоксиметильных или карбоксиамидометильных производных. Цистеинильные остатки также могут быть дериватизированы посредством реакции с бромтрифторацетоном, α-бром-β-(5-имидозоил)пропионовой кислотой, хлорацетилфосфатом, N-алкилмалеимидами, 3-нитро-2-пиридилдисульфидом, метил-2-пиридилдисульфидом, п-хлормеркурбензоатом, 2-хлормеркур-4-нитрофенолом или хлор-7-нитробензо-2-окса-1,3-диазолом и т.п.
Гистидильные остатки дериватизируют посредством реакции с диэтилпирокарбонатом при pH 5.5-7.0, т.к. данный агент обладает относительной специфичностью в отношении боковой цепи гистидила. Также подходит пара-бромфенацилбромид; указанную реакцию предпочтительно проводят в 0.1 М какодилате натрия при pH 6.0.
Лизинильные и аминоконцевые остатки подвергают взаимодействию с ангидридами янтарной кислоты или других карбоновых кислот. Дериватизация указанными агентами приводит к изменению заряда лизинильных остатков. Другие подходящие реагенты для дериватизации остатков, содержащих альфа-аминогруппу, включают имидоэфиры, такие как метилпиколинимидат; пиридоксальфосфат; пиридоксаль; хлорборгидрид; тринитробензолсульфоновая кислота; O-метилизомочевина; 2,4-пентандион и реакцию с глиоксилатом, катализируемую трансаминазой.
Аргинильные остатки модифицируют посредством реакции с одним или несколькими стандартными реагентами, среди которых находится фенилглиоксаль, 2,3-бутандион, 1,2-циклогександион и нингидрин. Для дериватизации остатков аргинина необходимо осуществлять реакцию в щелочной среде из-за высокого значения рКа гуанидиновой функциональной группы. Кроме того, данные реагенты могут взаимодействовать с группами лизина, а также эпсилон-аминогруппой аргинина.
Специфическая модификация тирозильных остатков может быть с особым интересом осуществлена при введении спектральных меток в тирозильные остатки по реакции с ароматическими соединениями диазония или тетранитрометаном. Чаще всего используют N-ацетилимидазол и тетранитрометан с образованием O-ацетилтирозильных соединений и 3-нитропроизводных соответственно. Тирозильные остатки иодируют с применением 1251 или 1311 с получением меченых белков для использования в радиоиммуноанализе, при этом вышеописанный хлораминовый метод является подходящим.
Боковые карбоксильные группы (аспартила или глутамила) селективно модифицируют посредством реакции с карбодиимидами (R'-N=C=N-R'), где R и R' возможно представляют собой разные алкильные группы, такие как 1-циклогексил-3-(2-морфолинил-(4-этил) карбодиимид или 1-этил-3-(4-азония-4,4-диметилпентил) карбодиимид. Кроме того, аспартильные и глутамильные остатки превращают в аспарагинильные и глутаминильные остатки посредством реакции с ионами аммония.
Дериватизация с помощью бифункциональных агентов подходит для сшивания антител с водонерастворимой вспомогательной матрицей или поверхностью для применения во множестве способов помимо способов, описанных ниже. Широко применяемые сшивающие агенты включают, например, 1,1-бис(диазоацетил)-2-фенилэтан, глутаральдегид, N-гидроксисукцинимидные эфиры, например, эфиры 4-азидосалициловой кислоты, гомобифункциональные имидоэфиры, включая дисукцинимидильные эфиры, такие как 3,3'-дитиобис(сукцинимидилпропионат), и бифункциональные малеимиды, такие как бис-N-малеимидо-1,8-окстан. Дериватизирующие агенты, такие как метил-3-[(п-азидофенил)дитио]пропиоимидат, образуют фотоактивируемые интермедиаты, которые могут образовывать поперечные связи в присутствии света. В качестве альтернативы, реакционноспособные водонерастворимые матрицы, такие как бромциан-активированные углеводы и реакционноспособные субстраты, описанные в патентах США 3969287; 3691016; 4195128; 4247642; 4229537 и 4330440, все из которых полностью включены в настоящее описание посредством ссылки, применяют для иммобилизации белков.
Глутаминильные и аспарагинильные остатки многократно дезамидируют с образованием соответствующих глутамильных и аспартильных остатков соответственно. В качестве альтернативы, данные остатки дезамидируют в умеренно кислой среде. Любая форма указанных остатков входит в объем настоящего изобретения. Другие модификации включают гидроксилирование пролина и лизина, фосфорилирование гидроксильных групп серильных или треонильных остатков, метилирование α-аминогрупп боковых цепей лизина, аргинина и гистидина (Т.Е.Creighton, Proteins: Structure and Molecular Properties, W.H.Freeman & Co., San Francisco, pp.79-86 [1983], полностью включенный в настоящее описание посредством ссылки), ацетилирование N-терминального амина и амидирование любой С-терминальной карбоксильной группы.
Гликозилирование
Другой вид ковалентной модификации представляет собой гликозилирование. В другом варианте реализации варианты IgG, указанные в настоящем описании, могут быть модифицированы и в результате содержать одну или несколько созданных гликоформ. В настоящем описании термин «созданная гликоформа» означает углеводную композицию, ковалентно присоединенную к IgG, при этом указанная углеводная композиция химически отличается от композиции исходного IgG. Созданные гликоформы могут подходить для решения множества задач, включая без ограничения усиление или ослабление эффекторной функции. Созданные гликоформы могут быть получены множеством способов, известных в данной области техники (Umana et al., 1999, Nat Biotechnol 17:176-180; Davies et al., 2001, Biotechnol Bioeng 74:288-294; Shields et al., 2002, J Biol Chem 277:26733-26740; Shinkawa et al., 2003, J Biol Chem 278:3466-3473; US 6602684; USSN 10/277370; USSN 10/113929; PCT WO 00/61739 A1; PCT WO 01/29246 A1; PCT WO 02/31140 A1; PCT WO 02/30954 A1, все полностью включенные в настоящее описание посредством ссылки (технология Potelligent® [Biowa, Inc., Princeton, NJ]; инженерная технология гликозилирования GlycoMAb® [Glycart Biotechnology AG, Zurich, Switzerland]). Многие из данных технологий основаны на контроле уровня фукозилированных и/или делящихся олигосахаридов, ковалентно присоединенных к области Fc, например, путем экспрессии IgG в различных организмах или линиях клеток, созданных или иначе полученных (например, клетки СНО Lee-13 или клетки YB2/0 гибридомы крысы), путем регуляции ферментов, включенных в путь гликозилирования (например, FUT8 [а1,6-фукозилтрансферазы] и/или β1-4-N-ацетилглюкозаминилтрансферазы III [GnTIII]), или путем модификации углевода (углеводов) после экспрессии IgG. Термин «созданная гликоформа», как правило, относится к другому углеводу или олигосахариду; таким образом, вариант IgG, например, антитело или гибрид Fc, может содержать созданную гликоформу. В качестве альтернативы, термин «созданная гликоформа» может относиться к варианту IgG, содержащему другой углевод или олигосахарид. Как известно в данной области техники, паттерны гликозилирования могут зависеть как от последовательности белка (например, присутствия или отсутствия конкретных аминокислотных остатков гликозилирования, указанных ниже), так и от клетки-хозяина или организма, в котором образуется белок. Конкретные системы экспрессии указаны ниже.
Гликозилирование пептидов, как правило, является либо N-связанным, либо O-связанным. N-связанное относится к присоединению углеводного фрагмента к боковой цепи остатка аспарагина. Трипептидные последовательности аспарагин-Х-серин и аспарагин-Х-треонин, где X представляет собой любую аминокислоту за исключением пролина, представляют собой последовательности узнавания ферментативного присоединения углеводного фрагмента к боковой цепи аспарагина. Таким образом, присутствие любой из данных трипептидных последовательностей в полипептиде создает возможный центр гликозилирования. O-связанное гликозилирование относится к присоединению одного из сахаров, N-ацетилгалактозамина, галактозы или ксилозы, к гидроксиаминоки слоте, наиболее часто серину или треонину, хотя 5-гидроксипролин или 5-гидроксилизин также могут быть использованы.
Добавление центров гликозилирования к антителу удобным способом осуществляют путем изменения аминокислотной последовательности, таким образом чтобы она содержала одну или несколько вышеописанных трипептидных последовательностей (для N-связанных центров гликозилирования). Указанное изменение также может быть осуществлено путем добавления или замены одного или нескольких остатков серина или треонина к исходной последовательности (для O-связанных центров гликозилирования). Для удобства аминокислотную последовательность антитела предпочтительно изменяют посредством изменений на уровне ДНК, в частности путем мутации ДНК, кодирующей целевой полипептид, в предварительно выбранных основаниях, таким образом чтобы образовывались кодоны, которые будут транслироваться в необходимые аминокислоты.
Другой способ увеличения числа углеводных фрагментов антитела представляет собой химическое или ферментативное соединение гликозидов с белком. Данные процедуры обладают преимуществом в том, что они не требуют образования белка в клетке-хозяине, которая способна к гликозилированию в отношении N- и O-связанного гликозилирования. В зависимости от используемого способа соединения, сахар (сахара) может быть присоединен к (а) аргинину и гистидину, (b) свободным карбоксильным группам, (с) свободным сульфгидрильным группам, таким как группы цистеина, (d) свободным гидроксильным группам, таким как группы серина, треонина или гидроксипролина, (е) ароматическим остаткам, таким как остатки фенилаланина, тирозина или триптофана, или (f) амидной группе глутамина. Указанные способы описаны в WO 87/05330 и в Aplin and Wriston, 1981, CRC Crit. Rev. Biochem., pp. 259-306, оба из которых полностью включены в настоящее описание посредством ссылки.
Удаление углеводных фрагментов, присутствующих в исходном антителе, может быть осуществлено химически или ферментативно. Для химического дегликозилирования необходимо подвергать белок воздействию соединения, трифторметансульфоновой кислоты или эквивалентного соединения. Данное воздействие приводит к распаду большинства или всех Сахаров за исключением связывающего сахара (N-ацетилглюкозамина или N-ацетилгалактозамина), в то время как полипептид остается нетронутым. Химическое дегликозилирование описано Hakimuddin et al., 1987, Arch. Biochem. Biophys. 259:52 и Edge et al., 1981, Anal. Biochem. 118:131, оба из которых полностью включены в настоящее описание посредством ссылки. Ферментативное расщепление углеводных фрагментов в полипептидах может быть осуществлено путем использования множества эндо- и экзогликозидаз, как описано Thotakura et al., 1987, Meth. Enzymol. 138:350, который полностью включен в настоящее описание посредством ссылки. Гликозилирование в возможных центрах гликозилирования может быть предотвращено путем использования соединения, туникамицина, как описано Duskin et al., 1982, J. Biol. Chem. 257:3105, который полностью включен в настоящее описание посредством ссылки. Туникамицин блокирует образование белок-N-гликозидных связей.
Другой вид ковалентной модификации антитела включает связывание антитела с различными небелковыми полимерами, включая без ограничения различные полиолы, такие как полиэтиленгликоль, полипропиленгликоль или полиоксиалкилены, способом, описанным, например, в 2005-2006 Каталоге PEG Nektar Therapeutics (доступном на web-сайте Nektar), патентах США 4640835; 4496689; 4301144; 4670417; 4791192 или 4179337, все из которых полностью включены в настоящее описание посредством ссылки. Кроме того, как известно в данной области техники, замещения аминокислот могут быть осуществлены в различных положениях в пределах антитела для облегчения добавления полимеров, таких как PEG. См., например, публикацию США 2005/011403 7 А1, которая полностью включена в настоящее описание посредством ссылки.
Меченые антитела
В некоторых вариантах реализации ковалентная модификация антител согласно настоящему изобретению включает добавление одной или нескольких меток. В некоторых случаях они рассматриваются как гибриды антител. Термин «группа для мечения» означает любую обнаруживаемую метку. В некоторых вариантах реализации группу для мечения соединяют с антителом посредством спейсерных групп различной длины с уменьшением возможного стерического несоответствия. Различные способы мечения белков известны в данной области техники и они могут быть использованы при осуществлении настоящего изобретения.
В целом, метки относятся к множеству классов в зависимости от анализа, в котором они должны быть обнаружены: а) изотопные метки, которые могут представлять собой радиоактивные или тяжелые изотопы; b) магнитные метки (например, магнитные частицы); с) редокс-активные фрагменты; d) оптические красители; ферментные группы (например, пероксидаза хрена, β-галактозидаза, люцифераза, щелочная фосфатаза); е) биотинилированные группы; и f) заранее определенные полипептидные эпитопы, распознаваемые вторичным репортером (например, парные последовательности лейциновой «молнии», центры связывания для вторичных антител, домены связывания с металлом, эпитопные метки и т.д.). В некоторых вариантах реализации группу для мечения соединяют с антителом посредством спейсерных групп различной длины с уменьшением возможного стерического несоответствия. Различные способы мечения белков известны в данной области техники, и они могут быть использованы при осуществлении настоящего изобретения.
Специфические метки включают оптические красители, включая без ограничения хромофоры, фосфоры и флуорофоры, при этом последние являются специфическими во многих случаях. Флуорофоры могут представлять собой либо флуоресцирующие агенты, представляющие «небольшие молекулы», либо белковые флуоресцирующие агенты.
Термин «флуоресцентная метка» означает любую молекулу, которая может быть обнаружена посредством присущих ей флуоресцентных свойств. Подходящие флуоресцентные метки включают без ограничения флуоресцеин, родамин, тетраметилродамин, эозин, эритрозин, кумарин, метилкумарины, пирен, малахитовый зелёный, стильбен, Люцифер желтый, Cascade Blue, Техасский красный, IAEDANS, EDANS, BODIPY FL, LC Red 640, Су 5, Су 5.5, LC Red 705, Oregon green, красители Alexa-Fluor (Alexa Fluor 350, Alexa Fluor 430, Alexa Fluor 488, Alexa Fluor 546, Alexa Fluor 568, Alexa Fluor 594, Alexa Fluor 633, Alexa Fluor 660, Alexa Fluor 680), Cascade Blue, Cascade Yellow и R-фикоэритрин (РЕ) (Molecular Probes, Eugene, OR), FITC, Родамин и Техасский красный (Pierce, Rockford, IL), Су5, Су5.5, Су7 (Amersham Life Science, Pittsburgh, PA). Подходящие оптические красители, включая флуорофоры, описаны в Molecular Probes Handbook Richard P.Haugland, который полностью включен в настоящее описание посредством ссылки.
Подходящие белковые флуоресцентные метки также включают без ограничения зеленый флуоресцентный белок, включая разновидности зеленого флуоресцентного белка Renilla, Ptilosarcus или Aequorea (Chalfie et al., 1994, Science 263:802-805), EGFP (Clontech Laboratories, Inc., номер доступа в Genbank U55762), синий флуоресцентный белок (BFP, Quantum Biotechnologies, Inc. 1801 de Maisonneuve Blvd. West, 8th Floor, Montreal, Quebec, Canada H3H 1J9; Stauber, 1998, Biotechniques 24:462-471; Heim et al., 1996, Curr. Biol. 6:178-182), «усиленный» желтый флуоресцентный белок (EYFP, Clontech Laboratories, Inc.), люциферазу (Ichiki et al., 1993, J. Immunol. 150:5408-5417), (3-галактозидазу (Nolan et al., 1988, Proc. Natl. Acad. Sci. U.S.A. 85:2603-2607) и Renilla (WO 92/15673, WO 95/07463, WO 98/14605, WO 98/26277, WO 99/49019, Патенты США 5292658, 5418155, 5683888, 5741668, 5777079, 5804387, 5874304, 5876995, 5925558). Все вышеуказанные источники в данном абзаце явным образом включены в настоящее описание посредством ссылки.
Варианты IgG
В одном из вариантов реализации настоящего изобретения предложены вариантные белки IgG. Варианты IgG по меньшей мере включают фрагмент антитела, содержащий область СН2-СН3 тяжелой цепи. Кроме того, подходящие варианты IgG включают домены Рс (например, включая низшую шарнирную область), а также варианты IgG, содержащие константную область тяжелой цепи (СН1-шарнир-СН2-СН3), также являющиеся подходящими согласно настоящему изобретению, все из которых могут быть слиты с «партнерами» по слиянию.
Вариант IgG содержит одну или несколько модификаций аминокислот по сравнению с исходным полипептидом IgG, в некоторых случаях по сравнению с IgG дикого типа. Вариант IgG может обладать одним или несколькими оптимизированными свойствами. Вариант IgG отличается по своей аминокислотной последовательности от исходного IgG наличием по меньшей мере одной модификации аминокислот. Таким образом, варианты IgG содержат по меньшей мере одну модификацию аминокислот по сравнению с исходным IgG. В качестве альтернативы, варианты IgG могут содержать несколько модификаций аминокислот по сравнению с исходным IgG, например, от примерно одной до пятидесяти модификаций аминокислот, предпочтительно от примерно одной до десяти модификаций аминокислот и наиболее предпочтительно от примерно одной до примерно пяти модификаций аминокислот по сравнению с исходным IgG.
Таким образом, последовательности вариантов IgG и последовательности исходного полипептида Fc по существу являются гомологичными. Например, вариантные последовательности варианта Fc в настоящем описании будут обладать примерно 80% гомологии с вариантной последовательностью исходного IgG, предпочтительно по меньшей мере примерно 90% гомологии и наиболее предпочтительно по меньшей мере примерно 95% гомологии. Модификации могут быть получены методами генной инженерии с использованием молекулярной биологии или могут быть получены ферментативно или химически.
Антигены-мишени для антител
В действительности, на любой антиген можно прицельно воздействовать вариантами IgG, включая без ограничении белки, субъединицы, домены, мотивы и/или эпитопы, относящиеся к следующему перечню антигенов-мишеней, который включает как растворимые факторы, такие как цитокины, так и мембраносвязанные факторы, включая трансмембранные рецепторы: 17-IA, 4-1ВВ, 4Dc, 6-кето-PGF1a, 8-изо-РСР2а, 8-оксо-dG, Аденозиновый рецептор Al, А33, АСЕ, АСЕ-2, Активин, Активин А, Активин АВ, Активин В, Активин С, Активин RIA, Активин RIA ALK-2, Активин RIB ALK-4, Активин RIIA, Активин RIIB, ADAM, ADAM10, ADAM12, ADAM15, ADAM17/TACE, ADAM8, ADAM9, ADAMTS, ADAMTS4, ADAMTS5. Addressins, aFGF, ALCAM, ALK, ALK-1, ALK-7, альфа-1-антитрипсин, альфа-V/бета-1 антагонист, ANG, Ang, APAF-1, APE, APJ, АРР, APRIL, AR, ARC, ART, Артемин, анти-Id, ASPARTIC, предсердный натрийуретический фактор, интегрин av/b3, Ax1, b2M, B7-1, B7-2, B7-H, стимулятор В-лимфоцитов (BlyS), ВАСЕ, ВАСЕ-1, Bad, BAFF, BAFF-R, Bag-1, ВАК, Bax, BCA-1, BCAM, Bcl, BCMA, BDNF, b-ECGF, bFGF, BID, Bik, BIM, BLC, BL-CAM, BLK, BMP, BMP-2 BMP-2a, остеогенин BMP-3, BMP-4 BMP-2b, BMP-5, BMP-6 Vgr-1, BMP-7 (OP-1), BMP-8 (BMP-8a, OP-2), BMPR, BMPR-IA (ALK-3), BMPR-IB (ALK-6), BRK-2, RPK-1, BMPR-II (BRK-3), BMPs, b-NGF, BOK, Бомбезин, нейтрофический фактор костей, BPDE, BPDE-ДНК, ВТС, комплементарный фактор 3 (С3), С3а, С4, С5, С5а, С10, СА125, CAD-8, Кальцитонин, цАМФ, карциноэмбриональный антиген (СЕА), карциномный антиген, Катепсин А, Катепсин В, Катепсин C/DPPI, Катепсин D, Катепсин Е, Катепсин И, Катепсин L, Катепсин О, Катепсин S, Катепсин V, Катепсин X/Z/P, CBL, CCI, CCK2, CCL, CCL1, CCL11, CCL12, CCL13, CCL14, CCL15, CCL16, CCL17, CCL18, CCL19, CCL2, CCL20, CCL21, CCL22, CCL23, CCL24, CCL25, CCL26, CCL27, CCL28, CCL3, CCL4, CCL5, CCL6, CCL7, CCL8, CCL9/10, CCR, CCR1, CCR10, CCR10, CCR2, CCR3, CCR4, CCR5. CCR6, CCR7, CCR8, CCR9, CD1, CD2, CD3, CD3E, CD4, CD5, CD6, CD7, CD8, CD10, CD11a, CD11b, CD11c, CD13, CD14, CD15, CD16, CD18, CD19, CD20, CD21, CD22, CD23, CD25, CD27L, CD28, CD29, CD30, CD30L, CD32, CD33 (белки р67), CD34, CD38, CD40, CD40L, CD44, CD45, CD46, CD49a, CD52, CD54, CD55, CD56, CD61, CD64, CD66e, CD74, CD80 (B7-1), CD89, CD95, CD123, CD137, CD138, CD140a, CD146, CD147, CD148, CD152, CD164, CEACAM5, CFTR, цГМФ, CINC, ботулинический токсин клостридии (Clostridium botulinum), токсин энтеритной клостридии (Clostridium perfringens), CKb8-1, CLC, CMV, CMV UL, CNTF, CNTN-1, COX, C-Ret, CRG-2, CT-1, CTACK, CTGF, CTLA-4, CX3CL1, CX3CR1, CXCL, CXCL1, CXCL2, CXCL3, CXCL4, CXCL5, CXCL6, CXCL7, CXCL8, CXCL9, CXCL10, CXCL11, CXCL12, CXCL13, CXCL14, CXCL15, CXCL16, CXCR, CXCR1, CXCR2, CXCR3, CXCR4, CXCR5, CXCR6, опухолеассоциированный антиген цитокератина, DAN, DCC, DcR3, DC-SIGN, фактор ускорения распада, des(1-3)-IGF-I (IGF-1 головного мозга), Dhh, дигоксин, DNAM-1, ДНКаза, Dpp, DPPIV/CD26, Dtk, ECAD, EDA, EDA-A1, EDA-A2, EDAR, EGF, EGFR (ErbB-1), EMA, EMMPRIN, ENA, эндотелиновый рецептор, Энкефалиназа, eNOS, Eot, эотаксин1, ЕрСАМ, Эфрин В2/EphB4, EPO, ERCC, Е-селектин, ET-1, Фактор На, Фактор VII, Фактор VIIIc, Фактор IX, белок-активатор фибробластов (FAP), Fas, FcR1, FEN-1, Ферритин, FGF, FGF-19, FGF-2, FGF3, FGF-8, FGFR, FGFR-3, Фибрин, FL, FLIP, Flt-3, Flt-4, фолликулостимулирующий гормон, Фракталкин, FZD1, FZD2, FZD3, FZD4, FZD5, FZD6, FZD7, FZD8, FZD9, FZD10, G250, Gas 6, GCP-2, GCSF, GD2, GD3, GDF, GDF-1, GDF-3 (Vgr-2), GDF-5 (BMP-14, CDMP-1), GDF-6 (BMP-13, CDMP-2), GDF-7 (BMP-12, CDMP-3), GDF-8 (Миостатин), GDF-9, GDF-15 (MIC-1), GDNF, GDNF, GFAP, GFRa-1, GFR-альфа1, GFR-альфа2, GFR-альфа3, GITR, Глюкагон, Глют 4, гликопротеин Hb/IIIa (GP Hb/IIIa), GM-CSF, gp130, gp72, GRO, фактор, высвобождающий гормон роста, Гаптен (NP-cap или NIP-cap), HB-EGF, НСС, гликопротеин gB оболочки HCMV, гликопротеин gH оболочки HCMV, HCMV UL, гемопоэтический фактор роста (HGF), Hep В gpl20, гепараназа, Her2, Her2/neu (ErbB-2), Неr3 (ErbB-3), Her4 (ErbB-4), гликопротеин gB вируса простого герпеса (HSV), гликопротеин gD HSV, HGFA, высокомолекулярный меланома-ассоциированный антиген (HMW-MAA), HIV gp120, V3 петля gp 120 HIV IIIB, HLA, HLA-DR, HM1.24, HMFG РЕМ, HRG, Hrk, кардиальный миозин человека, цитомегаловирус человека (HCMV), гормон роста человека (HGH), HVEM, 1-309, IAP, ICAM, ICAM-1, ICAM-3, ICE, ICOS, IFNg, Ig, рецептор IgA, IgE, IGF, связывающие белки IGF, IGF-1R, IGFBP, IGF-I, IGF-II, IL, IL-1, IL-1R, IL-2, IL-2R, IL-4, IL-4R, IL-5, IL-5R, IL-6, IL-6R, IL-8, IL-9, IL-10, IL-12, IL-13, IL-15, IL-18, IL-18R, IL-23, интерферон (INF)-альфа, INF-бета, INF-гамма, Ингибин, iNOS, A-цепь инсулина, В-цепь инсулина, инсулиноподобный фактор роста 1, интегрин альфа2, интегрин альфа3, интегрин альфа4, интегрин альфа4/бета, интегрин альфа4/бета7, интегрин альфа5 (альфаV), интегрин альфа5/бета1, интегрин альфа5/бета3, интегрин альфа6, интегрин бета1, интегрин бета2, интерферон гамма, IP-10, I-TAC, JE, Калликреин 2, Калликреин 5, Калликреин 6, Калликреин 11, Калликреин 12, Калликреин 14, Калликреин 15, Калликреин L1, Калликреин L2, Калликреин L3, Калликреин L4, КС, KDR, кератиноцитарный фактор роста (KGF), ламинин 5, LAMP, LAP, LAP (TGF-1), Латентный TGF-1, Латентный TGF-1 bp1, LBP, LDGF, LECT2, Lefty, антиген Льюиса-Y, родственный антиген Льюиса-Y, LFA-1, LFA-3, Lfo, LIF, LIGHT, липопротеины, LIX, LKN, Lptn, L-Селектин, LT-a, LT-b, LTB4, LTBP-1, сурфактант легких, лютеинизирующий гормон, рецептор лимфотоксина-бета, Mac-1, MAdCAM, MAG, MAP2, MARC, MCAM, МСАМ, МСК-2, МСР, M-CSF, MDC, Mer, металлопротеазы, рецептор MGDF, MGMT, МНС (HLA-DR), MIF, MIG, MIP, MIP-1-альфа, МК, ММАС1, ММР, ММР-1, ММР-10, ММР-11, ММР-12, ММР-13, ММР-14, ММР-15, ММР-2, ММР-24, ММР-3, ММР-7, ММР-8, ММР-9, MPIF, Mpo, MSK, MSP, муцин (Mud), MUC18, ингибирующее вещество Мюллера, Mug, MuSK, NAIP, NAP, NCAD, N-Кадгерин, NCA 90, NCAM, NCAM, Неприлизин, Нейротрофин-3,-4 или -6, Нейротурин, фактор роста нервов (NGF), NGFR, NGF-бета, nNOS, NO, NOS, Npn, NRG-3, NT, NTN, OB, OGG1, OPG, OPN, OSM, OX40L, OX40R, p150, p95, PADPr, Паратиреоидный гормон, PARC, PARP, PBR, PBSF, PCAD, P-Кадгерин, PCNA, PDGF, PDGF, PDK-1, PECAM, PEM, PF4, PGE, PGF, PGI2, PGJ2, PIN, PLA2, плацентарная щелочная фосфатаза (FLAP), P1GF, PLP, PP14, Проинсулин, Прорелаксин, Белок С, PS, PSA, PSCA, простат-специфический мембранный антиген (PSMA), PTEN, PTHrp, Ptk, PTN, R51, RANK, RANKL, RANTES, RANTES, А-цепь Релаксина, В-цепь Релаксина, ренин, респираторно-синцитиальный вирус (RSV) F, RSV Fgp, Ret, Ревматоидные факторы, RLIP76, RPA2, RSK, S100, SCF/KL, SDF-1, СЕРИН, Сывороточный альбумин, sFRP-3, Shh, SIGIRR, SK-1, SLAM, SLPI, SMAC, SMDF, SMOH, SOD, SPARC, Stat, STEAP, STEAP-II, TACE, TACI, TAG-72 (опухоль-ассоциированный гликопротеин-72), TARC, TCA-3, рецепторы Т-клеток (например, рецептор альфа/бета Т-клеток), TdT, ТЕСК, ТЕМ1, ТЕМ5, ТЕМ7, ТЕМ8, TERT, тестикулярная PLAP-подобная щелочная фосфатаза, TfR, TGF, TGF-альфа, TGF-бета, полиспецифический TGF-бета, TGF-бета RI (ALK-5), TGF-бета RII, TGF-бета RIIb, TGF-бета RIII, TGF-бета, TGF-бета 2, TGF-бета3, TGF-бета4, TGF-бета5, Тромбин, Тимусный Ck-1, Тиреостимулирующий гормон, Tie, TIMP, TIQ, Тканевый фактор, TMEFF2, Tmpo, TMPRSS2, TNF, TNF-альфа, TNF-альфа бета, TNF-бета2, TNFc, TNF-RI, TNF-RII, TNFRSF10A (TRAIL R1 Apo-2, DR4), TNFRSF10B (TRAIL R2 DR5, KILLER, TRICK-2A, TRICK-B), TNFRSF10C (TRAIL R3 DcRl, LIT, TRID), TNFRSF10D (TRAIL R4 DcR2, TRUNDD), TNFRSF11A (RANK ODF R, TRANCE R), TNFRSF11B (OPG OCIF, TR1), TNFRSF12 (TWEAK R FN14), TNFRSF13B (TACI), TNFRSF13C (BAFF R), TNFRSF14 (HVEM ATAR, HveA, LIGHT R, TR2), TNFRSF16 (NGFR p75NTR), TNFRSF17 (BCMA), TNFRSF18 (GITR AITR), TNFRSF19 (TROY TAJ, TRADE), TNFRSF19L (RELT), TNFRSF1A (TNF RI CD120a, p55-60), TNFRSF1B (TNF RII CD120b, p75-80), TNFRSF26 (TNFRH3), TNFRSF3 (LTbR TNF RIII, TNFC R), TNFRSF4 (OX40 ACT35, TXGP1 R), TNFRSF5 (CD40 p50), TNFRSF6 (Fas Apo-1, APT1, CD95), TNFRSF6B (DcR3 M68, TR6), TNFRSF7 (CD27), TNFRSF8 (CD30), TNFRSF9 (4-1BB CD137, ILA), TNFRSF21 (DR6), TNFRSF22 (DcTRAIL R2 TNFRH2), TNFRST23 (DcTRAIL R1 TNFRH1), TNFRSF25 (DR3 Apo-3, LARD, TR-3, TRAMP, WSL-1), TNFSF10 (TRAIL Apo-2 Лиганд, TL2), TNFSF11 (TRANCE/RANK Лиганд ODF, OPG Лиганд), TNFSF12 (TWEAK Apo-3 Лиганд, DR3 Лиганд), TNFSF13 (APRIL TALL2), TNFSF13B (BAFF BLYS, TALL1, THANK, TNFSF20), TNFSF14 (LIGHT HVEM Лиганд, LTg), TNFSF15 (TL1A/VEGI), TNFSF18 (GITR Лиганд AITR Лиганд, TL6), TNFSF1A (TNF-a Conectin, DIF, TNFSF2), TNFSF1B (TNF-b LTa, TNFSF1), TNFSF3 (LTb TNFC, p33), TNFSF4 (OX40 Лиганд gp34, TXGP1), TNFSF5 (CD40 Лиганд CD154, gp39, HIGM1, IMD3, TRAP), TNFSF6 (Fas Лиганд Аро-1 Лиганд, АРТ1 Лиганд), TNFSF7 (CD27 Лиганд CD70), TNFSF8 (CD30 Лиганд CD153), TNFSF9 (4-1ВВ Лиганд CD137 Лиганд), ТР-1, t-РА, Тро, TRAIL, TRAIL R, TRAIL-R1, TRAIL-R2, TRANCE, рецептор трансферрина, TRF, Trk, TROP-2, TSG, TSLP, опухолеассоциированный антиген СА 125, опухолеассоциированный антиген, экспрессирующий родственный Льюс-Y углевод, TWEAK, ТХВ2, Ung, uPAR, uPAR-1, Урокиназа, VCAM, VCAM-1, VECAD, VE-Кадгерин, УЕ-кадгерин-2, VEFGR-1 (flt-1), VEGF, VEGFR, VEGFR-3 (flt-4), VEGI, VIM, Вирусные антигены, VLA, VLA-1, VLA-4, интегрин VNR, фактор фон Виллебранда, WIF-1, WNT1, WNT2, WNT2B/13, WNT3, WNT3A, WNT4, WNT5A, WNT5B, WNT6, WNT7A, WNT7B, WNT8A, WNT8B, WNT9A, WNT9A, WNT9B, WNT10A, WNT10B, WNT11, WNT16, XCL1, XCL2, XCR1, XCR1, XEDAR, XIAP, XPD и рецепторы гормонов и факторов роста.
Для специалиста в данной области техники очевидно, что вышеуказанный перечень мишеней относится не только к конкретным белкам и биомолекулам, но и к биохимическому пути или путям, включающим их. Например, при ссылке на CTLA-4 как на антиген-мишень предполагают, что лиганды и рецепторы, которые составляют ко-стимулирующий путь Т-клеток, включая CTLA-4, В7-1, В7-2, CD28 и любые другие неисследованные лиганды или рецепторы, связывающиеся с данными белками, также представляют собой мишени. Таким образом, в настоящем описании термин «мишень» относится не только к конкретной биомолекуле, но и к набору белков, взаимодействующих с указанной мишенью и к участникам биохимического пути, к которому относится указанная мишень. Для специалиста в данной области техники также очевидно, что любой их вышеуказанных антигенов-мишеней, лигандов или рецепторов, которые с ними связываются, или других участников соответствующего биохимического пути может быть функционально связан с вариантами Fc согласно настоящему изобретению с образованием гибрида Fc. Таким образом, например, гибрид Fc, прицельно воздействующий на EGFR (рецептор эпидермального фактора роста), может быть создан путем функционального связывания варианта Fc с EGF, TGF-b или любым другим лигандом, исследованным или неисследованным, который связывается с EGFR. Соответственно, вариант Fc согласно настоящему изобретению может быть функционально связан с EGFR с образованием гибрида Fc, связывающегося с EGF, TGF-b или любым другим лигандом, исследованным или неисследованным, который связывается с EGFR. Таким образом, в действительности любой полипептид, как лиганд, рецептор, так и некоторый другой белок или домен белка, включая без ограничения вышеуказанные мишени и белки, составляющие соответствующие биохимические пути, могут быть функционально связаны с вариантами Fc согласно настоящему изобретению с образованием гибрида Fc.
Выбор подходящего антигена зависит от необходимого применения. Для противоракового лечения необходима мишень, экспрессия которой ограничена раковыми клетками. Некоторые мишени, которые как доказано особенно поддаются терапии антителами, представляют собой мишени, обладающие сигнальными функциями. Другие терапевтические антитела оказывают свое действие путем блокирования передачи сигнала рецептором посредством ингибирования связывания между рецептором и родственным ему лигандом. Другой механизм действия терапевтических антител заключается в том, что они вызывают понижающую (отрицательную) регуляцию рецептора. Другие антитела действуют не путем передачи сигнала посредством их антигена-мишени. В некоторых случаях используют антитела, направленные против возбудителей инфекционных заболеваний.
В одном из вариантов реализации варианты Fc согласно настоящему изобретению включены в антитело к цитокину. В качестве альтернативы, варианты Fc подвергают слиянию или конъюгируют с цитокином. В настоящем описании термин «цитокин» представляет собой общий термин для белков, высвобождаемых одной клеточной популяцией, которые действуют на другую клетку в качестве межклеточных медиаторов. Например, как описано в Penichet et al., 2001, J Immunol Methods 248:91-101, который явным образом включен в настоящее описание посредством ссылки, цитокины могут быть соединены с антителом с получением ряда необходимых свойств. Примерами таких цитокинов являются лимфокины, монокины и обычные полипептидные гормоны. Цитокины включают гормон роста, такой как гормон роста человека; N-метионил гормон роста человека и бычий гормон роста; паратиреоидный гормон; тироксин, инсулин; проинсулин; релаксин; прорелаксин; гликопротеиновые гормоны, такие как фолликулостимулирующий гормон (ФСГ), тиреостимулирующий гормон (TSH) и лютеинизирующий гормон (LH); печеночный фактор роста; фактор роста фибробластов; пролактин; плацентарный лактоген; фактор-альфа и -бета некроза опухолей; ингибирующее вещество Мюллера; гонадотропин-ассоциированный пептид мыши; ингибин; активин; фактор роста эндотелия сосудов; интегрин; тромбопоэтин (ТРО); факторы роста нервов, такие как NGF-бета; фактор роста тромбоцитов; трансформирующие факторы роста (TGF), такие как TGF-альфа и TGF-бета; инсулиноподобный фактор роста-I и -II; эритропоэтин (ЕРО); остеоиндуктивные факторы; интерфероны, такие как интерферон-альфа, -бета и -гамма; колониестимулирующие факторы (CSF), такие как макрофагальный CSF (M-CSF); гранулоцитарно-макрофагальный CSF (GM-CSF) и гранулоцитарный-CSF (G-CSF); интерлейкины (IL), такие как IL-1, IL-1альфа, IL-2, IL-g, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-11, IL-12, IL-15; фактор некроза опухолей, такой как TNF-альфа или TNF-бета; С5а; и другие полипептидные факторы, включая LIF и kit-лиганд (KL). В настоящем описании термин «цитокин» включает белки из природных источников или из культуры рекомбинантных клеток и биологически активные эквиваленты цитокинов, содержащих нативные последовательности.
Цитокины и растворимые мишени, такие как члены суперсемейства TNF, представляют собой предпочтительные мишени для использования совместно с вариантами согласно настоящему изобретению. Например, антитела анти-VEGF, анти-CTLA-4 и анти-TNF или фрагменты указанных антител представляют собой антитела, которые особенно подходят для использования вариантов Fc, увеличивающих связывание FcRn. Лекарственные средства против данных мишеней часто используют в лечении аутоиммунных заболеваний, при этом необходимы многочисленные инъекции в течение длительных периодов времени. Следовательно, более продолжительное время полужизни в сыворотке и менее частые курсы лечения, обусловленные вариантами согласно настоящему изобретению, являются наиболее предпочтительными.
Варианты Fc согласно настоящему изобретению могут быть полезны для ряда антител и гибридов Fc, разрешенных для применения, в клинических исследованиях или в разработке. В настоящем описании указанные антитела и гибриды Fc называются «клиническими продуктами и кандидатами». Таким образом, в предпочтительном варианте реализации полипептиды Fc согласно настоящему изобретению могут найти применение в ряде клинических продуктов и кандидатов. Например, полипептиды Fc согласно настоящему изобретению могут быть полезны для ряда антител, прицельно воздействующих на CD20. Например, полипептиды Fc согласно настоящему изобретению могут найти применение в антителе, которое по существу сходно с ритуксимабом (Ритуксан®, IDEC/Genentech/Roche) (см., например, US 5736137), химерном антителом анти-CD20, разрешенным для лечения неходжкинской лимфомы; HuMax-CD20, анти-CD20, разрабатываемом в настоящее время Genmab, антителе анти-СВ20, описанным в US 5500362, АМЕ-133 (Applied Molecular Evolution), hA20 (Immunomedics, Inc.), HumaLYM (Intracel) и PR070769 (PCT/US2003/040426, под названием "Immunoglobulin Variants and Uses Thereof"). Полипептиды Fc согласно настоящему изобретению могут быть полезны для ряда антител, прицельно воздействующих на членов семейства рецепторов эпидермального фактора роста, включая EGFR (ErbB-1), Her2/neu (ErbB-2), Her3 (ErbB-3), Her4 (ErbB-4). Например, полипептиды Fc согласно настоящему изобретению могут найти применение в антителе, которое по существу сходно с трастузумабом (trastuzumab) (Герцептин® (Herceptin®), Genentech) (см., например, US 5677171), гуманизированном антителом анти-Her2/neu, разрешенным для лечения рака груди; пертузумабе (pertuzumab) (rhuMab-2C4, Omnitarg™), разрабатываемом в настоящее время Genmab; антителе анти-Her2, описанным в US 4753894; цетуксимабе (cetuximab) (Эрбитукс® (Erbitux®), Imclone) (US 4943533; PCT WO 96/40210), химерном антителе анти-EGFR в клинических исследованиях для множества раковых опухолей, ABX-EGF (US 6235883), разрабатываемом в настоящее время Abgenix-Immunex-Amgen; HuMax-EGFr (USSN 10/172317), разрабатываемом в настоящее время Genmab; 425, EMD55900, EMD62000 и EMD72000 (Merck KGaA) (US 5558864; Murthy et al. 1987, Arch Biochem Biophys. 252(2):549-60; Rodeck et al., 1987, J Cell Biochem. 35(4):315-20; Kettleborough et al., 1991, Protein Eng. 4(7):773-83); ICR62 (Институт исследования рака (Institute of Cancer Research)) (PCT WO 95/20045; Modjtahedi et al., 1993, J. Cell Biophys. 1993, 22(1-3): 129-46; Modjtahedi et al., 1993, Br J Cancer. 1993, 67(2):247-53; Modjtahedi et al, 1996, Br J Cancer, 73(2):228-35; Modjtahedi et al, 2003, Int J Cancer, 105(2):273-80); TheraCIM hR3 (YM Biosciences, Canada and Centro de Immunologia Molecular, Cuba (US 5891996; US 6506883; Mateo et al, 1997, Immunotechnology, 3(1):71-81); mAb-806 (Институт исследования рака Людвига, Мемориальный центр Слоуна-Кеттеринга (Ludwig Institue for Cancer Research, Memorial Sloan-Kettering)) (Jungbluth et al. 2003, Proc Nati Acad Sci USA. 100(2):639-44); KSB-102 (KS Biomedix); MR1-1 (IVAX, Национальный институт рака (National Cancer Institute)) (PCT WO 0162931A2); и SC100 (Scancell) (PCT WO 01/88138). В другом предпочтительном варианте реализации полипептиды Fc согласно настоящему изобретению могут найти применение в алемтузумабе (Кэмпас® (Campath®), Millenium), гуманизированном моноклональном антителе, в настоящее время разрешенном для лечения В-клеточного хронического лимфолейкоза. Полипептиды Fc согласно настоящему изобретению могут найти применение во множестве антител или гибридов Fc, которые по существу сходны с другими клиническими продуктами и кандидатами, включая без ограничения муромонаб-СОЗ (muromonab-CD3) (Orthoclone OKT3®), антитело анти-CD3, разработанное Ortho Biotech/Johnson & Johnson, ибритумомаб тиуксетан (Зевалин®) (ibritumomab tiuxetan, Zevalin®), антитело анти-CD20, разработанное IDEC/Schering AG, гемтузумаб озогамицин (Милотарг®) (gemtuzumab ozogamicin, Mylotarg®), антитело анти-CDC33 (белок р67), разработанное Celltech/Wyeth, алефацепт (Амевив®) (alefacept, Amevive®), гибрид Fc анти-LFA-3, разработанный Biogen, абциксимаб (РеоПро®) (abciximab, ReoPro®), разработанный Centocor/Lilly, базиликсимаб (Симулект®) (basiliximab, Simulect®), разработанный Novartis, паливизумаб (Синагис®) (palivizumab, Synagis®), разработанный Medlmmune, инфликсимаб (Ремикейд®) (infliximab, Remicade®), антитело анти-ТКРальфа, разработанное Centocor, адалимумаб (Хумира®) (adalimumab, Humira®), антитело анти-ТМРальфа, разработанное Abbott, Humicade™, антитело анти-TNFальфа, разработанное Celltech, этанерцепт (Энбрел®) (etanercept, Enbrel®), гибрид Fc анти-TNFальфа, разработанный Immunex/Amgen, ABX-CBL, антитело анти-CD147, разрабатываемое Abgenix, ABX-IL8, антитело анти-ILS, разрабатываемое Abgenix, ABX-MA1, антитело анти-MUC18, разрабатываемое Abgenix, Пемтумомаб (Pemtumomab) (R1549, 90Y-muHMFG1), анти-MUC1, разрабатываемое Antisoma, Therex (R1550), антитело анти-MUCl, разрабатываемое Antisoma, AngioMab (AS1405), разрабатываемый Antisoma, HuBC-1, разрабатываемый Antisoma, Тиоплатин (Thioplatin) (AS 1407), разрабатываемый Antisoma, Antegren® (натализумаб) (Антегрен®, natalizumab), антитело анти-альфа-4-бета-1 (VLA-4) и альфа-4-бета-7, разрабатываемое Biogen, VLA-1 mAb, антитело анти-VLA-1 интегрин, разрабатываемое Biogen, LTBR mAb, антитело анти-лимфотоксин бета рецептор (LTBR), разрабатываемое Biogen, CAT-152, антитело анти-ТОР-р2, разрабатываемое Cambridge Antibody Technology, J695, антитело анти-IL-12, разрабатываемое Cambridge Antibody Technology и Abbott, CAT-192, антитело анти-TGFβ1, разрабатываемое Cambridge Antibody Technology и Genzyme, CAT-213, антитело анти-Eotaxin1, разрабатываемое Cambridge Antibody Technology, антитело анти-Blys LymphoStat-B™, разрабатываемое Cambridge Antibody Technology и Human Genome Sciences Inc., TRAIL-R1mAb, антитело анти-TRAIL-R1, разрабатываемое Cambridge Antibody Technology и Human Genome Sciences, Inc., Авастин™ (бевацизумаб) (Avastin™, bevacizumab, rhuMAb-VEGF), антитело анти-VEGF, разрабатываемое Genentech, антитело семейства анти-HER рецептора, разрабатываемое Genentech, анти-тканевый фактор (ATF), антитело анти-тканевый фактор, разрабатываемое Genentech, Ксолар™ (Омализумаб) (Xolair™, Omalizumab), антитело анти-IgE, разрабатываемое Genentech, Раптива™ (Эфализумаб) (Raptiva™, Efalizumab), антитело анти-CD11a, разрабатываемое Genentech и Xoma, антитело MLN-02 (ранее LDP-02), разрабатываемое Genentech and Millenium Pharmaceuticals, HuMax CD4, антитело анти-CD4, разрабатываемое Genmab, HuMax-IL15, антитело анти-IL15, разрабатываемое Genmab и Amgen, HuMax-Inflam, разрабатываемый Genmab и Medarex, HuMax-Cancer, антитело анти-гепараназа I, разрабатываемое Genmab и Medarex и Oxford GcoSciences, HuMax-Lymphoma, разрабатываемый Genmab и Amgen, HuMax-TAC, разрабатываемый Genmab, IDEC-131 и антитело анти-CD40L, разрабатываемое IDEC Pharmaceuticals, IDEC-151 (Кленоликсимаб (Clenoliximab)), антитело анти-CD4, разрабатываемое IDEC Pharmaceuticals, IDEC-114, антитело анти-CD80, разрабатываемое IDEC Pharmaceuticals, IDEC-152, анти-CD23, разрабатываемое IDEC Pharmaceuticals антитела к фактору миграции макрофагов (MIF), разрабатываемые IDEC Pharmaceuticals, ВЕС2, антиидиотипическое антитело, разрабатываемое Imclone, IMC-1C11, антитело анти-KDR, разрабатываемое Imclone, DC101, антитело анти-flk-l, разрабатываемое Imclone, антитела анти-VE кадгерин, разрабатываемые Imclone, CEA-Cide™ (лабетузумаб (labetuzumab)), антитело к карциноэмбриональному антигену (СЕА), разрабатываемое Immunomedics, LymphoCide™ (Эпратузумаб (Epratuzumab)), антитело анти-CD22, разрабатываемое Immunomedics, AFP-Cide, разрабатываемый Immunomedics, MyelomaCide, разрабатываемый Immunomedics, LkoCide, разрабатываемый Immunomedics, ProstaCide, разрабатываемый Immunomedics, MDX-010, антитело анти-CTLA4, разрабатываемое Medarex, MDX-060, антитело анти-CD30, разрабатываемое Medarex, MDX-070, разрабатываемый Medarex, MDX-018, разрабатываемый Medarex, Osidem™ (IDM-1) и антитело анти-Неr2, разрабатываемое Medarex и Immuno-Designed Molecules, HuMax™-CD4, антитело анти-CD4, разрабатываемое Medarex и Genmab, HuMax-IL15, антитело анти-IL5, разрабатываемое Medarex и Genmab, CNTO 148, антитело анти-TNFα, разрабатываемое Medarex и Centocor/J&J, CNTO 1275, антитело анти-цитокин, разрабатываемое Centocor/J&J, MOR101 и MOR102, антитела (CD54) к молекулам межклеточной адгезии-1 (ICAM-1), разрабатываемые MorphoSys, MOR201, антитело к рецептору фактора роста фибробластов 3 (FGFR-3), разрабатываемое MorphoSys, Нувион® (визилизумаб) (Nuvion®, visilizumab), антитело анти-CD3, разрабатываемое Protein Design Labs, HuZAF™, антитело анти-гамма интерферон, разрабатываемое Protein Design Labs, Анти-а5р1 Интегрин, разрабатываемый Protein Design Labs, aHTH-IL-12, разрабатываемое Protein Design Labs, ING-1, антитело анти-Ер-CAM, разрабатываемое Хота, и MLN01, антитело анти-Бета2 интегрин, разрабатываемое Хота; все вышеуказанные источники в данном абзаце явным образом включены в настоящее описание посредством ссылки.
Полипептиды Fc согласно настоящему изобретению могут быть включены в вышеуказанные клинические кандидаты и продукты или антитела и гибриды Fc, по существу сходные с ними. Полипептиды Fc согласно настоящему изобретению могут быть включены в варианты вышеуказанных клинических кандидатов и продуктов, гуманизированные, подвергнутые созреванию аффинности, созданные или модифицированные каким-либо другим способом.
В одном из вариантов реализации полипептиды Fc согласно настоящему изобретению используют для лечения аутоиммунных симптомов, симптомов воспаления или при трансплантации. Антигены-мишени и клинические продукты, и кандидаты подходящие для лечения указанных заболеваний, включают без ограничения антитела анти-α4β7 интегрин, такие как LDP-02, антитела анти-бета2 интегрин, такие как LDP-01, антитела анти-комплемент (С5), такие как 5G1.1, антитела анти-CD2, такие как BTI-322, MEDI-507, антитела анти-CD3, такие как ОКТ3, SMART анти-CD3, антитела анти-CD4, такие как IDEC-151, MDX-CD4, ОКТ4А, антитела анти-CD11a, антитела анти-CD14, такие как IC14, антитела анти-CD18, антитела анти-CD23, такие как IDEC 152, антитела анти-CD25, такие как Zenapax, антитела анти-CD40L, такие как 5с8, Antova, IDEC-131, антитела анти-CD64, такие как MDX-33, антитела анти-CD80, такие как IDEC-114, антитела анти-CD147, такие как ABX-CBL, антитела анти-Е-селектин, такие как CDP850, антитела анти-gpIIb/IIIa, такие как РеоПро/Абциксимаб, антитела анти-ICAM-3, такие как ICM3, антитела анти-ICE, такие как VX-740, антитела анти-FcR1, такие как MDX-33, антитела анти-IgE, такие как rhuMab-E25, антитела анти-IL-4, такие как SB-240683, антитела анти-IL-5, такие как SB-240563, SCH55700, антитела анти-IL-8, такие как АВХ-IL8, антитела анти-интерферон гамма, антитела анти-TNF (TNF, TNFa, TNFa, TNF-альфа), такие как CDP571, CDP870, D2E7, Инфликсимаб, MAK-195F и антитела анти-VLA-4, такие как Антегрен (Antegren).
Варианты Fc согласно настоящему изобретению, такие как варианты, обладающие увеличенным связыванием с FcRn, могут быть использованы в молекулах ингибиторов TNF с получением улучшенных свойств. Подходящие молекулы ингибиторов TNF включают любую молекулу, ингибирующую действие TNF-альфа у млекопитающего. Подходящие варианты включают гибрид Fc Энбрел® (этанерцепт) и антитела Хумира® (адалимумаб) и Ремикейд® (инфликсимаб). Моноклональные антитела (такие как Ремикейд и Хумира), созданные с использованием вариантов Fc согласно настоящему изобретению с увеличением связывания FcFn, могут приводить к большей эффективности посредством увеличенного времени полужизни.
В некоторых вариантах реализации используют антитела к инфекционным заболеваниям. Антитела к эукариотическим клеткам включают антитела, прицельно воздействующие на дрожжевые клетки, включая без ограничения Saccharomyces cerevisiae, Hansenula polymorpha, Kluyveromyces fragilis и K. lactis, Pichia guillerimondii и P. pastoris, Schizosaccharomycespombe, plasmodium falciparium и Yarrowia lipolytica.
Также подходят антитела к клеткам грибков, включая антигены-мишени, связанные со штаммами Candida, включая среди прочих Candida glabrata, Candida albicans, С. krusei, С. lusitaniae и С. maltosa, а также разновидности Aspergillus, Cryptococcus, Histoplasma, Coccidioides, Blastomyces и Penicillium.
Антитела, направленные против антигенов-мишеней, связанных с простейшими, включают без ограничения антитела, связанные с Trypanosoma, разновидностями Leishmania, включая Leishmania donovanii, Plasmodium spp., Pneumocystis carinii, Cryptosporidium parvum, Giardia lamblia, Entamoeba histolytica и Cyclospora cayetanensis.
Также подходят антитела к прокариотическим антигенам, включая антитела к подходящим бактериям, таким как патогенные и непатогенные прокариоты, включая без ограничения Бациллу, включая Bacillus anthracis; Вибрион, например, V. cholerae; Эшерихию, например, Энтеротоксигенная Е. coli, Шигеллы, например, S. dysenteriae; Сальмонеллу, например, S. typhi; Микробактерии, например, М. tuberculosis, M. leprae; Клостридий, например, С. botulinum, С. tetani, С. difficile, C. perfringens; Коринебактерии, например, С. diphtheriae; Стрептококк, S. pyogenes, S. pneumoniae; Стафилококк, например, S. aureus; Гемофильные бактерии, например, Н. influenzae; Нейссерию, например, N. meningitidis, N. gonorrhoeae; Иерсинии, например, Y. lamblia, Y. pestis, палочки Pseudomonas, например, Р. aeruginosa, P. putida, Хламидию, например, С. trachomatis; Бордетеллы, например, В. pertussis; Трепонему, например, Т. palladium; В. anthracis, Y. pestis, Brucella spp., F. tularensis, B. mallei, B. pseudomallei, B. mallei, B.pseudomallei , C. botulinum. Salmonella spp., SEB V. cholerae toxin B, Е. coli 0157:H7, Listeria spp., Trichosporon beigelii, Rhodotorula species, Hansenula anomala, Enterobacter sp., Klebsiella sp., Listeria sp., Mycoplasma sp. и т.п.
Согласно некоторым аспектам, антитела направлены против вирусных инфекций; данные вирусы включают без ограничения ортомиксовирусы (например, вирус гриппа), парамиксовирусы (например, респираторно-синцитиальный вирус, вирус свинки, вирус кори), аденовирусы, риновирусы, коронавирусы, реовирусы, тогавирусы (например, вирус краснухи), парвовирусы, поксвирусы (например, вирус натуральной оспы, вирус осповакцины), энтеровирусы (например, полиовирус, вирус Коксаки), вирусы гепатита (включая А, В и С), герпесвирусы (например, вирус простого герпеса, вирус ветряной оспы, цитомегаловирус, вирус Эпштейна-Барр), ротавирусы, норовирусы, хантавирусы, аренавирусы, рабдовирусы (например, вирус бешенства), ретровирусы (включая ВИЧ, HTLV-I и -II), паповавирусы (например, папилломавирусы), полиомавирусы и пикорнавирусы и т.п.
Оптимизированные свойства вариантов IgG
Согласно настоящей заявке также предложены варианты IgG, оптимизированные для множества терапевтически важных свойств. В настоящем описании вариант IgG, который создают или предполагают для демонстрации одного или нескольких оптимизированных свойств, называется «оптимизированным вариантом IgG». Наиболее предпочтительные свойства, которые могут быть оптимизированы, включают без ограничения повышенную или пониженную аффинность к FcRn и увеличенное или уменьшенное время полужизни in vivo. Подходящие варианты реализации включают антитела, демонстрирующие повышенную аффинность к связыванию с FcRn при пониженном pH, таком как pH, связанный с эндосомами, например, pH 6.0, в то же время поддерживающие пониженную аффинность при более высоком значении pH, таком как 7.4, чтобы допустить увеличенное поглощение эндосомами, но обычные скорости высвобождения. Аналогичным образом данные антитела с модулированным связыванием FcRn могут обладать другими необходимыми свойствами, такими как модулированное связывание FcγR, как, например, указано в U.S.S.N.s U.S.S.N.s 11/174287, 11/124640, 10/822231, 10/672280, 10/379392 и заявке на патент 11/256060 под названием «Варианты иммуноглобулина IgG, обладающие оптимизированной эффекторной функцией», поданной 21 октября 2005. Т.е. оптимизированные свойства также включают без ограничения повышенную или пониженную аффинность к FcγR. В одном из возможных вариантов реализации варианты IgG оптимизируют, в результате чего они обладают повышенной аффинностью к активирующему FcyR человека, предпочтительно FcγRIIIa, помимо характеристики связывания FcRn. В еще одном возможном альтернативном варианте реализации варианты IgG оптимизируют, в результате чего они обладают пониженной аффинностью к ингибирующему рецептору FcγRIIb человека. Т.е. конкретные варианты реализации включают использование антител, демонстрирующих увеличенное связывание с FcRn и увеличенное связывание с FcγRIIIa. В других вариантах реализации используют антитела, демонстрирующие увеличенное связывание с FcRn и увеличенное связывание с FcγRIIIa. Предполагают, что согласно указанным вариантам реализации предложены полипептиды IgG, обладающие улучшенными терапевтическими свойствами у людей, например, усиленной эффекторной функцией и более высокой противораковой активностью. В альтернативном варианте реализации варианты IgG оптимизируют, в результате чего они обладают повышенной или пониженной аффинностью к FcRn и повышенной или пониженной аффинностью к FcγR человека, включая без ограничения FcγRI, FcγRIIa, FcγRIIb, FcγRIIc, FcγRIIIa и FcγRIIIb, включая их аллельные варианты. Предполагают, что согласно данным вариантам реализации предложены полипептиды IgG, обладающие улучшенными терапевтическими свойствами у людей, например, увеличенным временем полужизни и пониженной эффекторной функцией. В других вариантах реализации варианты IgG обеспечивают повышенную аффинность к FcRn и повышенную аффинность к одному или нескольким FcyR, но пониженную аффинность к одному или нескольким другим FcyR. Например, вариант IgG может обладать увеличенным связыванием с FcRn и FcyRIIIa, но уменьшенным связыванием с FcγRIIb. В качестве альтернативы, вариант IgG может обладать уменьшенным связыванием с FcRn и FcγR's. В другом варианте реализации вариант IgG может обладать пониженной аффинностью к FcRn и повышенной аффинностью к FcγRIIb, но пониженной аффинностью к одному или нескольким FcγR. В еще одном варианте реализации вариант IgG может обладать увеличенным временем полужизни и пониженными эффекторными функциями.
Предпочтительные варианты реализации включают оптимизацию связывания с FcRn и FcγR человека, однако в альтернативных вариантах реализации варианты IgG обладают повышенной или пониженной аффинностью к FcRn и FcγR не относящихся к человеку организмов, включая без ограничения грызунов и низших приматов. Варианты IgG, которые оптимизируют для связывания с FcRn не человеческого происхождения, могут найти применение в проведении исследований. Например, доступны модели мышей для множества заболеваний, позволяющие тестировать свойства, такие как эффективность, токсичность и фармакокинетические характеристики для указанного потенциального лекарственного средства. Как известно в данной области техники, раковые клетки могут быть трансплантированы или введены путем инъекции мышам для имитации рака человека, способ под названием «ксенотрансплантация». В результате тестирования вариантов IgG, включающих варианты IgG, оптимизированные в отношении FcRn, моно получить полезную информацию относительно характеристик клиренса белка, его механизма клиренса и т.п. Варианты IgG также могут быть оптимизированы в отношении увеличенной функциональности и/или свойств раствора в дегликозилированной форме. Лиганды Fc включают без ограничения FcRn, FcγRs, C1q и белки А и G, и могут происходить из любого источника, включая без ограничения человека, мышь, крысу, кролика или обезьяну, предпочтительно человека. В альтернативном предпочтительном варианте реализации варианты IgG оптимизируют, в результате чего они становятся более стабильными и/или более растворимыми по сравнению с дегликозилированной формой исходного варианта IgG
Варианты IgG могут содержать модификации, модулирующие взаимодействие с лигандами Fc, кроме FcRn и FcγRs, включая без ограничения белки комплемента и гомологи рецептора Fc (FcRHs). FcRHs включают без ограничения FcRH1, FcRH2, FcRH3, FcRH4, FcRH5 и FcRH6 (Davis et al., 2002, Immunol. Reviews 190:123-136, полностью включенный в настоящее описание посредством ссылки).
Предпочтительно специфичность варианта IgG к лиганду Fc будет определять его терапевтическую полезность. Полезность указанного варианта IgG для терапевтических целей будет зависеть от эпитопа и формы антигена-мишени, и заболевания или симптома, подвергаемого лечению. Для большинства мишеней и симптомов увеличенное связывание FcRn может являться предпочтительным, т.к. увеличенное связывание FcRn может приводить к увеличенному времени полужизни в сыворотке. Более продолжительное время полужизни в сыворотке позволяет менее часто или в более низкой дозе вводить лекарственное средство. Это является наиболее предпочтительным, когда лечебное средство вводят в ответ на симптом, требующий повторного введения. Для некоторых мишеней и симптомов уменьшенное связывание FcRn может являться предпочтительным. Это может являться наиболее предпочтительным, когда необходим вариант Fc с увеличенным клиренсом и уменьшенным временем полужизни в сыворотке, например, в полипептидах Fc, используемых в качестве радиофармацевтических средств или радиотерапевтических средств.
Могут быть использованы варианты IgG, включающие варианты IgG, обеспечивающие повышенную аффинность к FcRn с повышенными активирующими FcγRs, и/или пониженную аффинность к ингибиторным FcγRs. Для некоторых мишеней и симптомов также может являться полезным использование вариантов IgG, обеспечивающих дифференцированную селективность в отношении различных активирующих FcγRs; например, в некоторых случаях может быть необходимо увеличенное связывание с FcγRIIa и FcγRIIIa, но не с FcγRI, тогда как в других случаях увеличенное связывание только с FcγRIIa может являться предпочтительным. Для некоторых мишеней и симптомов может быть предпочтительным использование вариантов IgG, изменяющих связывание FcRn и усиливающих как FcγR-опосредуемые, так и комплемент-опосредуемые эффекторные функции, тогда как в других случаях может являться полезным использование вариантов IgG, увеличивающих связывание FcRn или время полужизни в сыворотке и либо FcγR-опосредуемые, либо комплемент-опосредуемые эффекторные функции. Для некоторых мишеней или симптомов рака может являться полезным ослабление или удаление одной или нескольких эффекторных функций, например путем 'выключения' связывания с C1q, одним или несколькими FcγR, FcRn или одни или несколькими другими лигандами Fc. Для других мишеней и симптомов может быть предпочтительным использование вариантов IgG, обеспечивающих увеличенное связывание с ингибирующим FcγRIIb, но уровня дикого типа, уменьшенное или удаленное связывание с активирующим FcγRs. В частности, это может являться подходящим, например, в случае, когда задача варианта IgG заключается в ингибировании воспаления или аутоиммунного заболевания или модулировании иммунной системы некоторым образом. Т.к. аутоиммунные заболевания в целом являются продолжительными и лечение осуществляют с повторными введениями доз, их лечение вариантами Fc, обладающими увеличенным временем полужизни, благодаря увеличенному FcRn, является наиболее предпочтительным.
Может быть осуществлена модификация для улучшения стабильности, растворимости, функции или клинического применения IgG. В предпочтительном варианте реализации варианты IgG могут содержать модификации для снижения иммуногенности у людей. В наиболее предпочтительном варианте реализации иммуногенность варианта IgG снижают с применением способа, описанного в USSN 11/004590, который полностью включен в настоящее описание посредством ссылки. В альтернативных вариантах реализации варианты IgG гуманизируют (dark, 2000, Immunol Today 21:397-402, полностью включенный в настоящее описание посредством ссылки.
Варианты IgG могут содержать модификации, снижающие иммуногенность. Модификации для снижения иммуногенности могут включать модификации, уменьшающие связывание обработанных полипептидов, полученных из исходной последовательности, с белками МНС. Например, модификации аминокислот могут быть осуществлены таким образом, чтобы не было или было минимальное количество иммунных эпитопов, которые, как предполагают, связываются с высокой аффинностью с любыми преобладающими аллелями МНС. Некоторые способы идентификации связывающихся с МНС эпитопов в последовательностях белков известны в данной области техники и могут быть использованы для подсчета эпитопов в варианте IgG. См., например, WO 98/52976; WO 02/079232; WO 00/3317; USSN 09/903,378; USSN 10/039,170; USSN 60/222,697; USSN 10/754,296; PCT WO 01/21823; и РСТ WO 02/00165; Mallios, 1999, Bioinformatics 15: 432-439; Mallios, 2001, Bioinformatics 17: 942-948; Stumiolo et al., 1999, Nature Biotech. 17: 555-561; WO 98/59244; WO 02/069232; WO 02/77187; Marshall et al., 1995, J. Immunol. 154: 5927-5933; и Hammer et al., 1994, J. Exp. Med. 180: 2353-2358, все из которых полностью включены в настоящее описание посредством ссылки. Основанная на последовательностях информация может быть использована для определения результата связывания для взаимодействия указанный пептид-МНС (см., например, Mallios, 1999, Bioinformatics 15: 432-439; Mallios, 2001, Bioinformatics 17: p942-948; Stumiolo et. al., 1999, Nature Biotech. 17: 555-561, все из которых полностью включены в настоящее описание посредством ссылки).
Создание вариантов IgG
Варианты согласно настоящему изобретению могут быть получены различными способами. Варианты, указанные в настоящем описании, могут представлять собой встраивания, делеции, замещения, другие модификации или комбинации этих и других изменений. В частности, новым вариантом реализации настоящего изобретения является создание встраиваний и делеций, которые либо увеличивают, либо уменьшают связывание полипептида Fc с лигандом Fc. Как указано в настоящем описании, могут быть осуществлены встраивания или делеции, которые повышают или понижают аффинность полипептида Fc к FcRn. Встраивания и делеции могут быть получены с помощью рациональных подходов или подходов, включающих использование случайных компонентов, например произвольное и полупроизвольное создание библиотек или скрининг. В альтернативном варианте реализации описаны замещения, повышающие или понижающие аффинность полипептида Fc к FcRn.
Модификации остова: встраивания и делеции
Вариантные полипептиды Fc могут быть получены путем замещения вариантной аминокислоты в месте исходной аминокислоты в положении в полипептиде Fc. Путем замещения одной или нескольких аминокислот на вариантные аминокислоты в полипептиде Fc изменяют боковые цепи в этих положениях. Наиболее подходящие замещения модифицируют свойства Fc путем изменения боковых цепей Fc. Замещенные боковые цепи могут взаимодействовать напрямую или опосредованно с партнером по связыванию Fc, который связан с функцией или свойством Fc. По меньшей мере одно замещение изменяет ковалентную структуру одной или нескольких боковых цепей исходного полипептида Fc.
В качестве альтернативы, могут быть получены вариантные полипептиды Fc, меняющие ковалентную структуру остова исходного полипептида Fc. В белках атомы остова представляют собой пептидный азот, альфа-углерод, карбонильный или пептидный углерод и карбонильный кислород. Изменение ковалентной структуры остова предоставляет дополнительные способы изменения свойств полипептидов Fc. Ковалентная структура остова Fc может быть изменена путем добавления атомов в остов, например, путем встраивания одной или нескольких аминокислот, или путем удаления атомов из остова, например путем делеций одной или нескольких аминокислот. Ковалентная структура остова также может быть изменена путем замены индивидуальных атомов остова на другие атомы (Deechongkit et al., J Am Chem Soc. 2004. 126(51):16762-71, полностью включенный в настоящее описание посредством ссылки). Как известно в данной области техники и проиллюстрировано в настоящем описании, встраивания или делеции аминокислот в полипептидах Fc могут быть осуществлены путем встраивания или делеций соответствующих нуклеотидов в ДНК, кодирующей указанный полипептид Fc. В качестве альтернативы, как известно в данной области техники, встраивания или делеции аминокислот могут быть осуществлены в ходе синтеза полипептидов Fc.
Создание встраиваний или делеций аминокислот, которые изменяют взаимодействие полипептида Fc с одним или несколькими партнерами по связыванию (например, FcraMMaR's, FcRn, C1q), могут быть осуществлены путем рассмотрения структуры комплекса полипептида Fc и его партнера по связыванию. В менее предпочтительном варианте реализации создание может быть осуществлено путем рассмотрения структуры полипептида Fc и информации об области Fc, участвующей в связывании с партнером по связыванию. Указанная информация может быть получена путем проведения экспериментов по мутагенезу, экспериментов по фаговому отображению, путем сравнения гомологии, компьютерного моделирования или другими способами.
Предпочтительными положениями в аминокислотной последовательности для встраиваний или делеций, влияющих на связывающие взаимодействия Fc, но не влияющих на общую структуру, стабильность, экспрессию или применение полипептида Fc, являются петли, участвующие во взаимодействиях Fc/партнер по связыванию Fc. Для изменения связывания FcRn с полипептидом Fc положения 244-257, 279-284, 307-317, 383-390 и 428-435 представляют собой предпочтительные расположения петель для встраиваний или делеций (нумерация согласно индексу EU Kabat et al., Burmeister et al., 1994, Nature, 372:379-383; Martin et al., 2001, Mol Cell 7:867-877, все полностью включенные в настоящее описание посредством ссылки). Для изменения связывания Fc-гамма рецептора с полипептидом Fc положения 229-239, 266-273, 294-299 и 324-331 представляют собой предпочтительные расположения петель для встраиваний или делеций (нумерация согласно индексу EU Kabat et al., код в PDB 1E4K.pdb Sondermann et al. Nature. 2000 406:267, все из которых полностью включены в настоящее описание посредством ссылки). Петли представляют собой области полипептида, не включенные в альфа-спиральную структуру или структуру бета-складчатого слоя. Положения петель представляют собой положения, не включенные ни в альфа-спиральную структуру, ни в структуру бета-складчатого слоя (van Holde, Johnson and Ho. Principles of Physical Biochemistry. Prentice Hall, New Jersey 1998, Chapter 1 рр2-67, полностью включенный в настоящее описание посредством ссылки). Положения петель являются предпочтительными, т.к. атомы остова, как правило, являются более гибкими и с меньшей вероятностью вовлечены в образование водородных связей по сравнению с атомами остова альфа-спиралей и бета-складчатых слоев. Следовательно, удлинение или укорочение петли за счет встраивания или делеций одной или нескольких аминокислот с меньшей вероятностью приводит к значительным, разрушительным изменениям полипептида Fc, включая стабильность, экспрессию или другие трудности.
Встраивания и делеции могут быть использованы для изменения длины полипептида. Например, в областях петли изменение длины петли приводит к измененной гибкости и конформационной энтропии указанной петли. Встраивания в петле в целом увеличат конформационную энтропию петли, которая может быть определена как константа Больцмана, умноженная на натуральный логарифм числа возможных конформаций (van Holde, Johnson and Ho. Principles of Physical Biochemistry. Prentice Hall, New Jersey 1998, pp78, полностью включенный в настоящее описание посредством ссылки). Путем встраивания по меньшей мере одной аминокислоты в полипептид увеличивается общее число конформаций полипептида. Указанные дополнительные конформации могут быть полезны для образования подходящих взаимодействий Fc/партнер по связыванию Fc, т.к. в связывании Fc-связывающего белка может быть использована одна из дополнительных конформаций полипептида Fc. В данном случае встраивание может привести к более сильным взаимодействиям Fc/партнер по связыванию Fc. В случае, если дополнительные конформации не используются в области связывания, указанное встраивание может привести к более слабым взаимодействиям Fc/партнер по связыванию Fc, т.к. дополнительные конформации будут конкурировать с конформацией, способной к связыванию. Аналогичным образом делеция полипептидного сегмента может также привести либо к более сильным, либо к более слабым взаимодействиям Fc/партнер по связыванию Fc. В случае, если делеция сегмента, уменьшающая возможное число конформаций остова, исключает конформацию, способную к связыванию, указанная делеция может привести к более слабым взаимодействиям Fc/партнер по связыванию Fc. В случае, если делеция не исключает конформацию, способную к связыванию, делеция может привести к более сильным взаимодействиям Fc/партнер по связыванию Fc, т.к. указанная делеция может исключить конформации, конкурирующие с конформацией, способной к связыванию.
Встраивания и делеции могут быть использованы для изменения положений и ориентации аминокислот в полипептиде Fc. Т.к. встраивания и делеции вызывают изменение ковалентной структуры остова, они неизбежно вызывают изменение положений атомов остова. На фиг. 7 сравнены положения остова в некоторых сегментах петли, обозначенных LI-L4, в трех различных остовах. Эталонная структура остова содержит четыре сегмента петли, тогда как остов с делецией не содержит сегмент L1, a сегмент встраивания содержит дополнительный сегмент перед (т.е. N-терминальный), сегментом L1. Делеции и встраивания вызывают наибольшее изменение в структуре остова рядом с участком встраивания или делеции. Путем делеции сегмента, расположенного рядом с N-терминальной областью петли, например сегмента L1, петля укорачивается, и оставшиеся сегменты перемещают свое положение ближе к N-терминалу петли. Это вызывает смещение сегмента L2 к прежнему расположению сегмента L1 и к N-терминалу петли. Данное изменение в положении сегмента L2 по направлению к сегменту L1 может усилить связывание комплекса Fc/партнер по связыванию Fc и является предпочтительным в случае, когда есть предварительная информация о том, что аминокислота или аминокислоты, расположенные в L2, осуществляют подходящие взаимодействия с партнером по связыванию Fc, при расположении в L1. Например, если L2 содержит аланин и тирозин, и замещение двух аминокислот сегмента L1 на аланин и тирозин уже приводит к варианту Fc, обладающему увеличенным связыванием, то в результате делеции L1 можно получить вариант Fc, обладающий повышенной аффинностью к партнеру по связыванию Fc.
Аналогичным образом встраивание полипептидного сегмента в полипептид Fc в N-терминальной области петли вызывает смещение положений сегментов петли к С-терминальному участку петли. На фиг. 7 встраивание одной или нескольких аминокислот перед (т.е. N-терминально) сегментом L1 изменяет конформацию остова, включая смещение сегмента L1 к С-терминальной области петли. Данный вид встраивания является предпочтительным, когда известно, что расположенные в сегменте L1 аминокислоты осуществляют подходящие взаимодействия при расположении в положениях L2, т.к. указанное встраивание может привести к более сильным взаимодействиям Fc/партнер по связыванию Fc. В случае, если необходимы более слабые взаимодействия Fc/партнер по связыванию Fc, может быть использовано встраивание для смещения неподходящей аминокислоты в другое положение. Встроенные, удаленные и эталонные сегменты (L1-L4 на фиг. 7) могут представлять собой одну или несколько аминокислот в полипептиде Fc.
В качестве альтернативы встраивания или делеции могут быть использованы в С-терминальной области петель способом, аналогичным встраиваниям или делециям в N-терминальной области петель. Встраивания в С-терминале петли могут приводить к смещению положений, N-терминальных по отношению к встраиванию, к N-терминалу петли. Делеции в С-терминале петли могут приводить к смещению положений, N-терминальных по отношению к делеции, к С-терминалу петли. Выбор использования встраивания или делеции в N-терминальной или С-терминальной области петли осуществляют, исходя из аминокислот, расположенных в петле, необходимости повышенной или пониженной аффинности Fc/партнер по связыванию Fc и необходимого смещения положений.
Встраивания или делеции могут быть использованы в любой области полипептида Fc, включая петли, альфа-спиральные области и области бета-складчатых слоев. Предпочтительные участки для встраиваний и делеций включают области петель, которые представляют собой области, которые не являются альфа-спиральными или областями бета-складчатых слоев. Петли являются предпочтительными, т.к. они в целом принимают изменения остова лучше, чем альфа-спирали или бета-складчатые слои. Наиболее предпочтительные участки для встраиваний или делеций, приводящих к более сильным взаимодействиям белок/белок, расположены на N-терминальных или С-терминальных участках петли. Если боковые цепи петли вовлечены во взаимодействия Ре/партнер по связыванию Fc, встраивания или делеции на указанных участках с меньшей вероятностью приведут к сильно разрушительным изменениям в связывающих взаимодействиях. В результате делеций в пределах точного центра петли более вероятно удаление важных остатков на границе Fc/партнер по связыванию Fc, а в результате встраиваний в пределах точного центра петли более вероятно появление неподходящих взаимодействий на границе Fc/партнер по связыванию Fc. Количество удаляемых или встраиваемых остатков может быть определено объемом необходимого изменения остова, при этом предпочтительными являются встраивания или делеции 15 или менее остатков, более предпочтительными являются встраивания или делеции 10 или менее остатков и наиболее предпочтительными являются встраивания или делеции 5 или менее остатков.
После получения положения и размера варианта делеций Fc полностью определяют всю полипептидную последовательность, и полипептид может быть получен способами, известными в данной области техники.
Однако варианты встраивания Fc включают дополнительный этап создания последовательности, содержащей поменьше мере одну встроенную аминокислоту. Встраивания полярных остатков, включая Ser, Thr, Asn, Gln, Ala, Gly, His, являются предпочтительными в положениях, которые, как предполагается, будут подвержены воздействию в полипептиде Fc. Меньшие аминокислоты, включая Ser, Thr и Ala, являются наиболее предпочтительными, т.к. небольшой размер с меньшей вероятностью стерически препятствует взаимодействиям Fc/партнер по связыванию Fc. Ser и Thr также могут образовывать водородные связи с атомами партнера по связыванию Fc.
Встраивания также обладают дополнительной гибкостью, в результате чего встроенный полипептид может быть получен таким образом, чтобы образовывать подходящие взаимодействия с партнером по связыванию Fc, что необходимо в случае, когда требуется более сильное связывание Fc/партнер по связыванию Fc. Длина встраивания в остове может быть определена путем моделирования вариантного остова со встроенной простой типичной последовательностью. Например, встраивания полисерина, полиглицина или полиаланина различной длины могут быть «сконструированы» и смоделированы. Моделирование может быть осуществлено множеством способов, включая гомологичное моделирование на основе известных трехмерных структур гомологов, содержащих указанное встраивание, и путем компьютерного моделирования, включая MODELLER (M.A.Marti-Renom et al. Annu. Rev. Biophys. Biomol. Struct. 29, 291-325, 2000) и ROSETTA (Kuhlman et al. (2003). Science 302, 1364-8), оба полностью включенные в настоящее описание посредством ссылки. Как правило, сначала получают различные конформации остова, и конечная структура остова может быть определена после установления идентичности боковой цепи. Боковые цепи могут быть созданы с помощью алгоритмов PDA® (US 6188965; 6269312; 6403312; 6801861; 6804611; 6792356, 6950754 и USSN 09/782004; 09/927790; 10/101499; 10/666307; 10/666311; 10/218102, все полностью включенные в настоящее описание посредством ссылки).
Могут быть произведены встраивания или делеции для изменения связывания полипептидов Fc с FсгаммаR аналогично описанному способу изменения свойств связывания FcRn. Домены Fc связываются с FcгаммаR в положении, указанном на фиг.1. Структуры комплекса Fc/FcгаммаR, включая коды в PDB 1T89 и 1IIS (Radaev S et al. J. Biol. Chem. v276, p.16469-16477, полностью включенный в настоящее описание посредством ссылки), демонстрируют взаимодействующие остатки и петли между двумя структурами. Все результаты мутагенеза, такие как приведены в US 11/124620 и US 6737056 (оба из которых полностью включены в настоящее описание посредством ссылки), полезны в определенных подходящих смещениях положений остова.
Встраивания или делеции могут быть произведены в любом полипептиде, помимо полипептидов Fc, способами, указанными в настоящем описании. Например, встраивания или делеции в члене суперсемейства TNF, APRIL, могут быть произведены с помощью трехмерной структуры (код в PDB IXU1.pdb, Hymowitz, et al. (2005) J. Biol. Chem. 280:7218, полностью включенный в настоящее описание посредством ссылки). Встраивания или делеции могут быть произведены для увеличения связывания APRIL со своим рецептором TACI. Остатки петель, предпочтительные в качестве центров встраивания или делеции, представляют собой остатки Ser118-Val124, Asp164-Phe167, Pro192-Ala198, Pro221-Lys226. Данные петли взаимодействуют с TACI в комплексе APRIL/TACI и опосредуют связывание.
Полипептиды, включающие варианты
Варианты IgG могут быть основаны на последовательностях IgG человека и таким образом последовательности IgG человека используют в качестве «базовых» последовательностей, с которыми сравнивают другие последовательности, включая без ограничения последовательности других организмов, например, последовательности грызунов и приматов. Варианты также IgG могут содержать последовательности других классов иммуноглобулина, таких как IgA, IgE, IgD, IgM и т.п. Предполагается, что несмотря на то что варианты IgG создают в контексте одного исходного IgG, варианты могут быть созданы в контексте другого, второго исходного IgG или «перенесены» к нему. Это осуществляют путем определения «эквивалентных» или «соответствующих» остатков и замещений между первым и вторым IgG, как правило, исходя из гомологии последовательности или структурной гомологии между последовательностями IgG. Для установления гомологии аминокислотную последовательность первого указанного IgG напрямую сравнивают с последовательностью второго IgG. После выравнивания последовательностей с использованием одной или нескольких программ выравнивания гомологии, известных в данной области техники (например, с использованием консервативных остатков в качестве промежуточных видов), предусматривая необходимые встраивания и делеции для поддержания выравнивания (т.е. избегая удаления консервативных остатков путем произвольной делеции и встраивания), определяют остатки, эквивалентные конкретным аминокислотам в первичной последовательности первого варианта IgG. Выравнивание консервативных остатков предпочтительно должно сохранять 100% таких остатков. Однако выравнивание более 75% или до 50% консервативных остатков также подходит для определения эквивалентных остатков. Эквивалентные остатки также могут быть определены путем установления структурной гомологии между первым и вторым IgG, т.е. на уровне третичной структуры для IgGs, структуры которых были определены. В данном случае эквивалентные остатки определяют как остатки, для которых атомные координаты двух или более атомов основной цепи конкретного аминокислотного остатка родоначальника или предшественника (N на N, СА на СА, С на С и О на О) находятся в пределах 0.13 нм и предпочтительно 0.1 нм после выравнивания. Выравнивание осуществляют после ориентации и расположения лучшей модели с получением максимального совпадения атомных координат неводородных белковых атомов белков. Независимо от того, как определяют эквивалентные или соответствующие остатки и независимо от идентичности исходного IgG, в котором создают IgGs, неизменным остается то, что исследованные варианты IgG могут быть созданы во втором исходном IgG, обладающим значительной гомологией последовательностей или структурной гомологией с вариантом IgG. Таким образом, например, если получают вариантное антитело, в котором исходное антитело представляет собой IgG1 человека, путем использования вышеописанных способов или других способов определения эквивалентных остатков вариантное антитело может быть создано в другом исходном антителе IgG1, которое связывается с другим антигеном, исходном антителе IgG2 человека, исходном антителе IgA человека, исходном антителе IgG2a или IgG2b мыши и т.п. Снова, как описано выше, контекст исходного варианта IgG не влияет на способность переносить варианты IgG в другие исходные IgGs.
Предложены способы создания, получения и скрининга вариантов IgG. Описанные способы не ограничивают любое конкретное применение или методику применения. Предпочтительно предложенные способы в целом иллюстрируют, что один или несколько вариантов IgG могут быть созданы, получены и экспериментально подвергнуты скринингу для получения вариантов IgG, обладающих оптимизированной эффекторной функцией. Описано множество способов создания, получения и тестирования вариантов антитела и белка в USSN 10/754296 и USSN 10/672280, оба из которых полностью включены в настоящее описание посредством ссылки.
Множество способов создания белка может быть использовано для создания вариантов IgG, обладающих оптимизированной эффекторной функцией. В одном из вариантов реализации может быть использован основанный на структуре способ создания, в котором имеющуюся структурную информацию используют для управления замещениями, встраиваниями или делециями. В предпочтительном варианте реализации может быть использован компьютерный способ скрининга, в котором замещения производят на основе их энергетического соответствия в компьютерных расчетах. См., например, USSN 10/754296 и USSN 10/672280 и указанные в них источники, все из которых полностью включены в настоящее описание посредством ссылки.
Выравнивание последовательностей может быть использовано для управления замещениями в идентифицированных положениях. Для специалиста в данной области техники очевидно, что использование информации о последовательностях может ограничивать введение замещений, которые являются потенциально разрушительными для структуры белка. Источник последовательностей может широко варьироваться и включать одну или несколько известных баз данных, включая без ограничения базу данных Kabat (Северо-Западный Университет (Northwestern University)); Johnson & Wu, 2001, Nucleic Acids Res. 29:205-206; Johnson & Wu, 2000, Nucleic Acids Res. 28:214-218), базу данных IMGT (IMGT, the international ImMunoGeneTics information system®; Lefranc et al., 1999, Nucleic Acids Res. 27:209-212; Ruiz et al., 2000 Nucleic Acids Res. 28:219-221; Lefranc et al., 2001, Nucleic Acids Res. 29:207-209; Lefranc et al., 2003, Nucleic Acids Res. 31:307-310) и VBASE, все из которых полностью включены в настоящее описание посредством ссылки. Информация о последовательностях антитела может быть приобретена, скомпилирована и/или получена в результате выравниваний гаметических последовательностей или последовательностей, встречающихся в природе антител любого организма, включая без ограничения млекопитающих. Для специалиста в данной области техники очевидно, что использование последовательностей человеческого или по существу человеческого происхождения также может обладать преимуществом, которое заключается в том, что они менее иммуногенные при введении человеку. Другие базы данных, которые представляют собой более общие базы данных нуклеиновых кислот или белков, т.е. не конкретно антител, включают без ограничения SwissProt, GenBank Entrez и базу данных нуклеотидных последовательностей EMBL. Выровненные последовательности могут включать последовательности VH, VL, СН и/или CL. Существуют многочисленные основанные на последовательности программы выравнивания и способы, известные в данной области техники, и все они находят применение в формировании выравниваний последовательностей.
В качестве альтернативы способы случайного или полуслучайного мутагенеза могут быть использованы для создания аминокислотных модификаций в необходимых положениях. В данных случаях положения выбирают произвольно или аминокислотные изменения осуществляют по упрощенным правилам. Например, все остатки могут быть подвергнуты мутации с получением аланина, мутагенез под названием «сканирующий аланином». Указанные способы могут быть комбинированы с более сложными инженерными подходами, в которых применяют способы отбора для скрининга более высоких уровней отличия последовательностей. Как хорошо известно в данной области техники, существует множество технологий отбора, которые могут быть использованы для указанных подходов, включая, например, технологии отображения, такие как фаговое отображение (дисплей), рибосомный дисплей, отображение клеточной поверхности и т.п., как описано ниже.
Способы получения и скрининга вариантов IgG хорошо известны в данной области техники. Общие способы молекулярной биологии антитела, экспрессии, очистки и скрининга описаны в Antibody Engineering, под редакцией Duebel & Kontermann, Sprmger-Verlag, Heidelberg, 2001; и Hayhurst & Georgiou, 2001, Curr Opin Chem Biol 5:683-689; Maynard & Georgiou, 2000, Annu Rev Biomed Eng 2:339-76. Также см. способы, описанные в USSN 10/754296; USSN 10/672280; и USSN 10/822231; и 11/124620, все из которых полностью включены в настоящее описание посредством ссылки.
Предпочтительные варианты согласно настоящему изобретению включают варианты, приведенные на фиг.8. В качестве альтернативы, предпочтительные варианты согласно настоящему изобретению включают варианты, приведенные на фиг.9. Дополнительно в качестве альтернативы, предпочтительные варианты согласно настоящему изобретению включают варианты, приведенные на фиг.10. Данные варианты продемонстрировали увеличенное связывание с рецептором Fc, FcRn, как проиллюстрировано в примерах.
Создание вариантов IgG
Варианты IgG могут быть созданы любым способом, известным в данной области техники. В одном из вариантов реализации последовательности вариантов IgG используют для получения нуклеиновых кислот, которые кодируют последовательности членов и которые затем могут быть клонированы в клетках-хозяевах, экспрессированны и анализированы при необходимости. Данные технологии осуществляют с использованием хорошо известных процедур и множество способов, которые могут найти в них применение, описаны в Molecular Cloning - A Laboratory Manual, 3rd Ed. (Maniatis, Cold Spring Harbor Laboratory Press, New York, 2001) и Current Protocols in Molecular Biology (John Wiley & Sons), оба из которых полностью включены в настоящее описание посредством ссылки. Нуклеиновые кислоты, кодирующие варианты IgG, могут быть включены в вектор экспрессии для экспрессии белка. Векторы экспрессии, как правило, содержат белок, функционально связанный, т.е. находящийся в функциональной зависимости, с контрольными или регуляторными последовательностями, селектируемыми маркерами, любыми партнерами по слиянию и/или дополнительными элементами. Варианты IgG могут быть получены путем выращивания клетки-хозяина, трансформированной нуклеиновой кислотой, предпочтительно вектором экспрессии, содержащим нуклеиновую кислоту, кодирующую варианты IgG, в подходящих условиях для индуцирования или вызова экспрессии белка. Может быть использован широкий спектр подходящих клеток-хозяев, включая без ограничения клетки млекопитающих, бактерии, клетки насекомых и дрожжи. Например, множество линий клеток, которые могут найти применение, описаны в каталоге линий клеток АТСС, доступном из американской коллекции типовых культур (American Type Culture Collection), полностью включенном в настоящее описание посредством ссылки. Способы введения экзогенной нуклеиновой кислоты в клетки-хозяева хорошо известны в данной области техники и будут варьироваться в зависимости от используемой клетки-хозяина.
В предпочтительном варианте реализации варианты IgG очищают или выделяют после экспрессии. Антитела могут быть выделены или очищены множеством способов, известных специалистам в данной области техники. Стандартные способы очистки включают методы хроматографии, методы электрофореза, иммунологические методы методы осаждения, диализа, фильтрации, концентрирования и методы хроматофокусирования. Как хорошо известно в данной области техники, множество природных белков связывают антитела, например бактериальные белки A, G и L, и данные белки могут найти применение в очистке. Часто очистке может способствовать конкретный партнер по слиянию. Например, белки могут быть очищены с использованием глутатионовой смолы в случае, если используют гибрид GST, Ni+2-аффинной хроматографии в случае, если используют His-метку, или иммобилизированного антитела анти-flag в случае, если используют flag-метку. Для общего руководства относительно подходящих способов очистки см. Antibody Purification: Principles and Practice, 3rd Ed., Scopes, Springer-Verlag, NY, 1994, который полностью включен в настоящее описание посредством ссылки.
Скрининг вариантов IgG
Варианты Fc могут быть подвергнуты скринингу с использованием множества способов, включая без ограничения способы, в которых используют анализы in vitro, анализы in vivo и анализы на основе клеток и способы отбора. Технологии автоматического скрининга и скрининга высокой производительности могут быть использованы в процедурах скрининга. В скрининге могут использовать партнера по слиянию или метку, например, иммунную метку, изотопную метку или метку, представляющую небольшую молекулу, такую как флуоресцентный или колориметрический краситель.
В предпочтительном варианте реализации функциональные и/или биофизические свойства вариантов Fc подвергают скринингу в анализе in vitro. В предпочтительном варианте реализации белок подвергают скринингу на предмет функциональности, например, его способности катализировать реакцию или его аффинности к связыванию в отношении мишени.
Как известно в данной области техники, подгруппами способов скрининга являются те, которые отбирают подходящих членов библиотеки. В настоящем описании указанные способы называются «способами отбора», и данные способы находят применение в настоящем изобретении в скрининге вариантов Fc. Когда белковые библиотеки подвергают скринингу с использованием способа отбора, только те члены библиотеки, которые подходят, т.е. которые отвечают критериям отбора, пропускают, выделяют и/или наблюдают. Множество способов отбора известны в данной области техники, и они могут найти применение в настоящем изобретении для скрининга белковых библиотек. Другие способы отбора, которые могут найти применение в настоящем изобретении, включают способы, которые не основываются на отображении, такие как способы in vivo. Подгруппа способов отбора, называющихся способами «направленного развития», представляет собой способы, включающие соединение или «панировку» подходящих последовательностей в ходе отбора, иногда с включением новых мутаций.
В предпочтительном варианте реализации варианты Fc подвергают скринингу с использованием одного или нескольких основанных на клетках анализов или анализов in vivo. Для указанных анализов очищенные и неочищенные белки, как правило, добавляют извне таким образом, что клетки подвергают воздействию индивидуальных вариантов или пулов вариантов, относящихся к библиотеке. Данные анализы, как правило, но не всегда основаны на функции полипептида Fc; т.е. способности полипептида Fc связываться с мишенью и опосредовать некоторую биохимическую реакцию, например, эффекторную функцию, ингибирование связывания лиганд/рецептор, апоптоз и т.п. Указанные анализы часто включают мониторинг реакции клеток на IgG, например, выживания клеток, гибели клеток, изменения клеточной морфологии или транскрипционной активации, такой как клеточная экспрессия природного гена или гена-репортера. Например, указанные анализы могут измерять способность вариантов Fc вызывать ADCC, ADCP или CDC. Для некоторых анализов может быть необходимо добавление дополнительных клеток или компонентов, т.е. в дополнение к клеткам-мишеням, например, сывороточного комплемента или эффекторных клеток, таких как моноциты периферической крови (PBMCs), макрофаги, естественные киллерные клетки и т.п. Указанные дополнительные клетки могут происходить из любого организма, предпочтительно людей, мышей, крысы, кролика и обезьяны. Антитела могут вызывать апоптоз некоторых линий клеток, экспрессирующих мишень, или могут опосредовать атаку клеток-мишеней иммунными клетками, добавленными к анализу. Способы мониторинга гибели или жизнеспособности клеток известны в данной области техники и включают применение красителей, иммунохимических, цитохимических и радиоактивных реагентов. Транскрипционная активация может служить в качестве способа анализа функции в анализах на основе клеток. В качестве альтернативы, скрининги на основе клеток осуществляют с использованием клеток, трансформированных или трансфицированных нуклеиновыми кислотами, кодирующими варианты. Т.е. варианты Fc не добавляют извне к клеткам.
Биологические свойства вариантов IgG могут быть охарактеризованы, исходя из данных экспериментов с участием клеток, тканей и всего организма. Как известно в данной области техники, лекарственные средства часто тестируют на животных, включая без ограничения, мышей, крыс, кроликов, собак, кошек, свиней и обезьян, для того, чтобы измерить эффективность лекарственного средства в отношении лечения заболевания или модели заболевания или для измерения фармакокинетических характеристик, токсичности и других свойств лекарственного средства. Указанные животные могут рассматриваться как модели заболеваний. Лекарственные средства часто тестируют на мышах, включая без ограничения мышей линии nude, мышей SCID, мышей с ксенотрансплантатами и трансгенных мышей (включая knockins (с «включенным» геном) и knockouts (с «выключенным» геном). В результате проведения указанных исследований можно получить важные данные для определения потенциала белка, который будет использоваться в качестве лекарственного средства. Для тестирования может быть использован любой организм, предпочтительно млекопитающие. Например, обезьяны из-за их генетического сходства с людьми могут представлять собой подходящие модели для лечения и, таким образом, могут быть использованы для тестирования эффективности, токсичности, фармакокинетических характеристик или другого свойства IgGs. В конечном счете, необходимо проведение тестов на людях для разрешения использования в качестве лекарственных средств и, следовательно, данные эксперименты обязательно предполагаются. Таким образом, IgGs могут быть протестированы на людях для определения их терапевтической эффективности, токсичности, иммуногенности, фармакокинетических характеристик и/или других клинических свойств.
Способы использования вариантов IgG
Варианты IgG могут найти применение в широком диапазоне продуктов. В одном из вариантов реализации вариант IgG представляет собой терапевтический, диагностический или экспериментальный реагент, предпочтительно терапевтический. Вариант IgG может найти применение в композиции антител, являющейся моноклональной или поликлональной. В предпочтительном варианте реализации варианты IgG используют для разрушения клеток-мишеней, которые порождают антиген-мишень, например, раковых клеток. В альтернативном варианте реализации варианты IgG используют для блокирования, вызова антагонизма или агонизма к антигену-мишени, например для вызова антагонизма к цитокину или рецептору цитокина. В альтернативном предпочтительном варианте реализации варианты IgG используют для блокирования, вызова антагонизма или агонизма к антигену-мишени и разрушения клеток-мишеней, порождающих антиген-мишень.
Варианты IgG могут быть использованы для различных терапевтических целей. В предпочтительном варианте реализации антитело, содержащее вариант IgG, вводят пациенту для лечения расстройства, связанного с антителом. Для данных целей термин «пациент» включает людей и других животных, предпочтительно млекопитающих и наиболее предпочтительно людей. В настоящем описании термин «расстройство, связанное с антителом» или «расстройство, восприимчивое к антителу», или «состояние», или «заболевание» означает расстройство, которое можно облегчить путем введения фармацевтической композиции, содержащей вариант IgG. Расстройства, связанные с антителом, включают без ограничения аутоиммунные заболевания, иммунологические заболевания, инфекционные заболевания, воспалительные заболевания, неврологические заболевания и онкологические, и неопластические заболевания, включая рак. В настоящем описании термины «рак» и «раковый» описывают или относятся к физиологическому состоянию у млекопитающих, которое, как правило, характеризуется нерегулируемым ростом клеток. Примеры рака включают без ограничения карциному, лимфому, бластому, саркому (включая липосаркому), нейроэндокринные опухоли, мезотелиому, шванному, менингиому, аденокарциному, меланому, лейкоз и лимфолейкозы.
В одном из вариантов реализации вариант IgG представляет собой единственный терапевтически активный агент, вводимый пациенту. В качестве альтернативы, вариант IgG вводят в комбинации с одним или несколькими терапевтическими агентами, включая без ограничения цитотоксические агенты, химиотерапевтические агенты, цитокины, ингибиторы роста, антигормональные агенты, ингибиторы киназы, антиангиогенные агенты, кардиопротекторы или другие терапевтические агенты. Варианты IgG могут быть введены одновременно с использованием одной или нескольких схем лечения. Например, вариант IgG может быть введен пациенту наряду с химеотерапией, лучевой терапией или как химиотерапией, так и лучевой терапией. В одном из вариантов реализации вариант IgG может быть введен совместно с одним или несколькими антителами, которые могут или не могут представлять собой вариант IgG. Согласно другому варианту реализации, вариант IgG и один или несколько других видов противораковой терапии используют для лечения раковых клеток ex vivo. Предполагается, что указанное лечение ex vivo может быть подходящим в трансплантации костного мозга и, в частности, аутогенной трансплантации костного мозга. Обязательно предполагается, что варианты IgG могут быть использованы в комбинации еще с другими терапевтическими методами, такими как хирургия.
Множество других терапевтических агентов может быть введено с вариантами IgG. В одном из вариантов реализации IgG вводят совместно с антиангиогенным агентом. В настоящем описании термин «антиангиогенный агент» означает соединение, блокирующее или в некоторой степени препятствующее росту кровеносных сосудов. Антиангиогенный фактор может, например, представлять собой небольшую молекулу или белок, например, антитело, гибрид Fc или цитокин, связывающийся с фактором роста или рецептором фактора роста, вовлеченным в стимулирование ангиогенеза. В настоящем описании предпочтительный антиангиогенный фактор, представляет собой антитело, связывающееся с фактором роста эндотелия сосудов (VEGF). В альтернативном варианте реализации IgG вводят совместно с терапевтическим агентом, индуцирующим или усиливающим адаптивный иммунный ответ, например, антителом, которое прицельно воздействует на CTLA-4. В альтернативном варианте реализации IgG вводят совместно с ингибитором тирозинкиназы. В настоящем описании термин «ингибитор тирозинкиназы» означает молекулу, в некоторой степени ингибирующую тирозинкиназную активность тирозинкиназы. В альтернативном варианте реализации варианты IgG вводят совместно с цитокином.
Фармацевтические композиции предполагаются в случае, когда получают вариант IgG и один или несколько терапевтически активных агентов. Составы вариантов IgG получают для хранения путем смешивания IgG необходимой степени чистоты с возможными фармацевтически приемлемыми носителями, наполнителями или стабилизаторами (Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed., 1980, полностью включенный в настоящее описание посредством ссылки) в форме лиофилизированных составов или водных растворов. Указанные составы для применения для введения in vivo предпочтительно являются стерильными. Это легко осуществляют путем фильтрации через мембраны для стерилизующей фильтрации или другими способами. Варианты IgG и другие терапевтически активные агенты, указанные в настоящем описании, также могут быть получены в виде иммунолипосом и/или заключены в микрокапсулы.
Концентрация терапевтически активного варианта IgG в составе может варьироваться от примерно 0.1 до 100% масс. В предпочтительном варианте реализации концентрация IgG находится в диапазоне 0.003-1.0 моль. Для лечения пациента может быть введена терапевтически эффективная доза варианта IgG. В настоящем описании термин «терапевтически эффективная доза» означает дозу, обеспечивающую необходимые эффекты. Точная доза будет зависеть от цели лечения и будет определена специалистом в данной области техники с использованием известных способов. Дозы могут находиться в диапазоне от 0.01 до 100 мг/кг массы тела или выше, например 0.01, 0.1, 1.0, 10 или 50 мг/кг массы тела, при этом доза 1-10 мг/кг является предпочтительной. Как известно в данной области техники, могут быть необходимы поправки на разрушение белков, системную или локализованную доставку, и скорость синтеза новых протеаз, а также возраст, массу тела, общее состояния здоровья, пол, диету, продолжительность введения, взаимодействие лекарственных средств и тяжесть состояния, которые могут быть определены специалистом в данной области техники с помощью стандартного исследования.
Введение фармацевтической композиции, содержащей вариант IgG, предпочтительно в форме стерильного водного раствора может быть осуществлено множеством способов, например, без ограничения перорально, подкожно, внутривенно, парентерально, интраназально, в ухо, внутрь глаза, ректально, вагинально, трансдермально, местно (например, гели, мази, лосьоны, кремы и т.д.), интраперитонеально, внутримышечно, внутрилегочно (например, система для ингалиции AERx®, выпускаемая Aradigm, или система доставки в легкие Inhance®, выпускаемая Nektar Therapeutics, и т.д.). Лекарственное средство, указанное в настоящем описании, может быть введено одновременно с другими лекарственными средствами, т.е. лекарственные средства, указанные в настоящем описании, могут быть назначены совместно с другими видами терапии или лекарственными средствами, включая, например, небольшие молекулы, другие биологические препараты, лучевую терапию, хирургию и т.д.
Сведения, подтверждающие возможность осуществления изобретения
Ниже приведены примеры для иллюстрации настоящего изобретения. Данные примеры не ограничивают настоящее изобретение каким-либо конкретным применением или методикой применения. Для всех положений, описанных согласно настоящему изобретению, нумерация приведена согласно индексу EU, как у Kabat (Rabat et al., 1991, Sequences of Proteins of Immunological Interest, 5th Ed., United States Public Health Service, National Institutes of Health, Bethesda, полностью включенный в настоящее описание посредством ссылки). Для специалистов в области техники, касающейся антител, очевидно, что данное соглашение состоит из непоследовательной нумерации в конкретных областях последовательности иммуноглобулина, предоставляя стандартизированную ссылку на консервативные положения в семействах иммуноглобулина. Соответственно, положения любого указанного иммуноглобулина, определенные индексом EU, не будут обязательно соответствовать его порядковой последовательности.
ПРИМЕР 1. Создание ДНК, экспрессия и очистка вариантов Fc
Создавали модификации аминокислот в области Fc антител IgG с повышением их аффинности к неонатальному Fc рецептору FcRn. Варианты подвергали скринингу в случае ряда константных цепей различных IgG человека (фиг.2), включая последовательности IgG1, IgG2 и гибридного IgG, содержащие СН1 и верхний шарнир IgGI и область Fc IgG2. Для специалистов в данной области техники очевидно, что из-за различных взаимодействий области Fc IgG1 и IgG2 с FcyRs и комплементом, данные различные исходные области Fc будут обладать различными опосредуемыми FcyR и комплементом свойствами эффекторных функций. Типичные последовательности вариантов Fc в случае данных константных цепей исходного IgG показаны на фиг. 3.
Варианты Fc создавали в случае антитела, прицельно воздействующего на фактор роста эндотелия сосудов (VEGF). Вариабельные области (VH и VL) тяжелых и легких цепей представляют собой области гуманизированного варианта антитела А4.6.1, также называющегося бевацизумабом (Авастин®), которое разрешено для лечения множества раковых опухолей. Аминокислотные последовательности областей VH и VL данного антитела показаны на фиг.4.
Гены, кодирующие тяжелые и легкие цепи антител анти-VEGF, создавали в векторе экспрессии рТТ5 млекопитающего. Гены константных цепей IgG1 и IgG2 человека получали из клонов IMAGE и субклонировали в вектор рТТ5. Ген IgG1/2 создавали с использованием мутагенеза с помощью ПЦР. Гены VH и VL, кодирующие антитела анти-VEGF, синтезировали в промышленном масштабе (Blue Heron Biotechnologies, Bothell WA) и субклонировали в векторы, кодирующие подходящие константные цепи CL, IgG1, IgG2 и IgG1/2. Модификации аминокислот создавали путем сайт-направленного мутагенеза с использованием способов сайт-направленного мутагенеза QuikChange® (Stratagene, La Jolla CA). Секвенировали последовательности всех ДНК и в результате подтверждали правильность последовательностей.
Плазмиды, содержащие ген тяжелой цепи (VH-Cγ1-Cγ2-Cγ3), совместно трансфицировали с плазмидой, содержащей ген легкой цепи (VL-Сκ), в клетки 293Е с использованием липофектамина (lipofectamine) (Invitrogen, Carlsbad CA) и выращивали в средах FreeStyle 293 (Invitrogen, Carlsbad CA). После 5 дней роста антитела очищали от надосадочной жидкости культур путем аффинной хроматографии с белком А с использованием смолы MabSelect (GE Healthcare). Концентрации антител определяли путем анализа с использованием бицинхониновой кислоты (ВСА) (Pierce).
ПРИМЕР 2. Вариантные антитела Fc сохраняют связывание с антигеном
Правильность экспрессированных вариантных антител подтверждали путем демонстрации того, что они сохраняют специфичность в отношении антигена. Связывание VEGF контролировали путем поверхностного плазменного резонанса (ППР, Biacore), проводимого с использованием прибора Biacore 3000. Рекомбинантный VEGF (VEGF-165, PeproTech, Rocky Hill, NJ) присоединяли к поверхности чипа СМ5 путем соединения с N-гидроксисукцинимид/N'-этил-N-(-3-диметиламинопропил)карбодиимидом (NHS/EDC) с использованием стандартных способов. Антитела дикого типа и вариантные антитела вводили в качестве аналитов и получали реакцию, измеряемую в единицах резонанса (RU). Фаза диссоциации была слишком медленной для того, чтобы измерить истинные константы равновесия, и поэтому относительное связывание определяли путем измерения RU в конце фазы ассоциации, которые должны быть пропорциональны концентрации белка (которую поддерживают постоянной в данном эксперименте) и константе скорости ассоциации. Полученные данные (фиг.6) демонстрируют, что вариантные антитела анти-VEGF сохраняют связывание с антигеном в отличие от антитела отрицательного контроля анти-Нег2, которое не связывает VEGF.
ПРИМЕР 3. Измерение связывания с FcRn человека
Связывание вариантных антител с FcRn человека измеряли при pH 6.0, pH, при котором он в естественных условиях связан в эндосомах. Векторы, кодирующие бета-2-микроглобулин и меченые His гены альфа-цепей FcRn, создавали, совместно трансфицировали в клетки 293Т и очищали путем хроматографии с использованием никеля. Аффинность антитела к FcRn человека (hFcRn) при pH 6.0 измеряли на приборе Biacore 3000 путем присоединения FcRn человека к поверхности чипа СМ5 с использованием стандартной химии NHS/EDC. Антитела дикого типа и вариантные антитела использовали в подвижной фазе в 25-100 нМ концентрации и реакцию измеряли в единицах резонанса. Достигали фаз ассоциации и диссоциации при pH 6.0 с последующим введением буфера pH 7.4 с измерением высвобождения антитела от рецептора при более высоком значении pH. Цикл с антителом и буфером обеспечивал базовую линию анализа, которую вычитали из сенсограммы каждого образца.
На фиг.7 показаны сенсограммы Biacore связывания нативного IgG1 и выбранных вариантных антител Fc с FcRn человека при двух соответствующих значениях pH. Указанные данные показывают, что антитела дикого типа и вариантные антитела легко связываются с чипом FcRn при pH 6.0 и медленно диссоциируют при этом pH, также как они диссоциировали бы в эндосоме, в то время как они быстро высвобождаются при pH 7.4, как при рециркуляции эндосомы к мембране и воздействии более высокого значения pH сыворотки.
Кривые ассоциации/диссоциации FcRn не соответствовали простой модели Ленгмюра, возможно вследствие поливалентности антитела и рецептора или гетерогенности чипа. Значения псевдо-Ка (обозначаемой Ка*) определяли путем подгонки к модели конформационного изменения с изменением показателя преломления (RI), зафиксированным при 0 RU. Данные значения для выбранных вариантных антител изображены на графике на фиг.8. Относительную аффинность каждого варианта по сравнению с исходным IgG рассчитывали согласно уравнению Кратность = (Ка* дикого типа/Ка* варианта). Данные относительного связывания для всех вариантов Fc в области Fc IgG1 представлены на фиг. 9, а данные связывания для вариантов в антителах с областью Fc IgG2 (константные цепи IgG1 и IgG1/2) представлены на фиг.10. Для многих вариантов эксперимент по связыванию повторяли многократно (n-раз), для эксперимента кратности рассчитывали относительно исходного IgG дикого типа в рамках каждого конкретного эксперимента по связыванию. В результате усреднения этих данных получали среднее и стандартное отклонение, как представлено на фиг.9 и 10.
На фиг.9 и 10 показано, что ряд созданных вариантов связывается с большей аффинностью к связыванию FcRn человека при pH 6.0 по сравнению с IgG1 дикого типа. Улучшения в значительной степени зависели от идентичности замещения в определенном положении. Например, с использованием 2-кратности в качестве критериев улучшенного связывания, ряд мутаций в положении 434 в IgG2 повышал аффинность (A, S, Y, F и W), некоторые были нейтральными (в пределах 2-кратности IgG2 дикого типа) (G, Н, М и Т) и ряд замещений понижал аффинность (кратность < 0.5) (D, Е, К, Р, R и V). Большее связывание в случае IgGI не обязательно приводило к большему связыванию в IgG2 (например, 434Т обладал улучшенным связыванием в IgG1, но не IgG2). Кроме того, улучшения, обусловленные отдельными вариантами, не всегда были аддитивными при комбинации. На фиг.11а это продемонстрировано графически путем построения зависимости экспериментального кратного связывания FcRn выбранными двойными вариантами замещения от результата кратного связывания FcRn индивидуальными отдельными вариантами, составляющими их. Прямая линия отображает абсолютную аддитивность, т.е. значение, которое ожидают или предполагают, исходя из результата отдельных замещений. Ряд двойных вариантов ложится на данную прямую или располагается рядом с ней (2591/3191, 259I/428L, 319I/428L и 308F/428L). Некоторые варианты обладают меньшей аддитивностью (319I/308F, 252Y/428L и 428L/434M). Для данных вариантов, в частности в случае последних двух (252Y/428L и 428L/434M), повышения аффинности одиночных замещений могли бы оказаться несовместимыми друг с другом при комбинировании. Являлось неожиданным, что повышения аффинности вариантов 259I/308F и 428L/434S к FcRn были значительнее, чем можно было ожидать, исходя из значений аффинности их соответствующих одиночных замещений. Данные конкретные одиночные замещения обладали неожидаемыми синергичными повышениями при комбинировании. Различия между экспериментальными значениями аффинности и значениями аффинности, предполагаемыми, исходя из значений аффинности одиночных вариантов, изображены на графике на фиг.11b, при этом варианты сгруппированы согласно составным одиночным вариантам (2591, 308F и 319I - с левой стороны, а комбинации, содержащие 482L - с правой стороны). Синергия может быть количественно определена путем расчета кратности экспериментального значения относительно предполагаемого значения с последующей стандартизацией до 1 и переводом в процент (% синергии = 100×[(экспериментальная кратность/предполагаемая кратность) - 1)]. Данный анализ изображен на графике на фиг.11b, при этом варианты сгруппированы согласно составным одиночным вариантам. Данный график снова указывает на синергию некоторых вариантов, в частности 259I/308F и 428L/434S. Фиг.11b и 11с также подчеркивают непредсказуемый характер комбинирования многих лучших одиночных замещений скрининга. Например, тогда как комбинация 428L с 434S и 2591 приводила к синергичным улучшениям связывания, 252Y или 434М обладал отрицательным результатом при комбинировании с 428L. Существенное отличие между комбинацией 428L с 434S от комбинации с 434М также указывает на важность конкретной аминокислотной идентичности замещения в определенном положении.
ПРИМЕР 4. Тестирование вариантов в случаях других антител
Выбранные варианты создавали в случае антител, прицельно воздействующих на другие антигены, включая TNF (TNFa), CD25 (ТАС), EGFR и IgE. На фиг. 4 предложены аминокислотные последовательности областей VH и VL антител, прицельно воздействующих на данные антигены, которые использовали согласно настоящему изобретению. Антитела анти-TNF дикого типа и вариантные Fc антитела анти-TNF содержат вариабельную область антитела полностью человеческого происхождения, адалимумаба (Хумира®), в настоящее время разрешенного для лечения ревматоидного артрита (РА), ювенильного идиопатического артрита (ЮИА), псориатического артрита (ПА), анкилозирующего спондилоартрита (АС) и болезни Крона (БК). Антитела анти-CD25 дикого типа и вариантные Fc антитела анти-CD25 представляют собой гуманизированные варианты антитела анти-ТАС (Junghans et al., 1990, Cancer Research 50:1495-1502), обозначаемые H1.8/L1 анти-ТАС. Антитела анти-EGFR дикого типа и вариантные Fc антитела анти-EGFR представляют собой гуманизированные варианты антитела мыши, С225, обозначаемые H4.42/L3.32 С225. Наконец, антитела анти-IgE дикого типа и вариантные Fc антитела анти-IgE содержат вариабельную область гуманизированного антитела омализумаба (Ксолар®), разрешенного для лечения аллергической астмы.
Антитела дикого типа и вариантные антитела создавали, экспрессировали и очищали, как описано выше. Антитела тестировали на предмет связывания с FcRn человека при pH 6.0 с использованием Biacore, как описано выше. Данные относительного связывания вариантных антител анти-TNF, -CD25, -EGFR и -IgE с FcRn человека приведены на фиг.12. Как можно видеть, указанные варианты повышают аффинность к FcRn в случае антител, прицельно воздействующих на множество антигенов.
ПРИМЕР 5. Фармакокинетические эксперименты у мышей с «включенным» (knock-in) FcRn человека
Для тестирования способности выбранных вариантов увеличивать время полужизни in vivo, фармакокинетические эксперименты проводили у мышей В6, являющихся гомозиготными «выключениями» (knock-outs) в отношении FcRn мыши и гетерозиготными «включениями» (knock-ins) в отношении FcRn человека (mFcRn-/-, hFcRn+) (Petkova et al., 2006, Int Immunol 18(12): 1759-69, полностью включенный в настоящее описание посредством ссылки), в настоящем описании называющихся «мышами hFcRn или hFcRt+»). Группам 4-7 самок мышей, рандомизированных по массе тела (диапазон 20-30 г), делали одну внутривенную инъекцию антитела анти-VEGF (2 мг/кг) в хвостовую вену. Кровь (~50 мкл) забирали из орбитального сплетения в определенный момент времени, преобразовывали в сыворотку и хранили при -80°С до анализа. Продолжительность исследований составляла 28 или 49 дней. Во время данных исследований животные не пострадали.
Концентрации антител определяли с использованием двух иммуноферментных анализов (ELISA). В первых двух исследованиях (обозначаемых Исследование 1 и Исследование 2) античеловеческое антитело Fc козы (Jackson Immuno research) присоединяли к планшету, лунки промывали PBST (фосфатным буферным физиологическим раствором с 0.05% Tween) и блокировали 3% BSA в PBST. Затем добавляли сывороточные или калибровочные эталоны с последующим промыванием PBST, добавлением меченого европием античеловеческого IgG (Perkin Elmer) и последующим промыванием PBST. Получали сигнал флуоресценции с временным разрешением. Для Исследований 3-5 концентрацию в сыворотке обнаруживали с использованием аналогичного иммуноферментного анализа (ELISA), но рекомбинантный VEGF (VEGF-165, PeproTech, Rocky Hill, NJ) использовали в качестве связывающего реагента и обнаружение осуществляли с помощью биотинилированного античеловеческого каппа-антитела и меченого европием стрептавидина. ФК параметры определяли для индивидуальных мышей с помощью некомпартментной модели с использованием WinNonLin (Pharsight Inc, Mountain View CA). Номинальное время и дозу использовали с одинаковым сравнением моментов времени. Используемые моменты времени (лямбда Z диапазоны) составляли от 4 дней до конца исследования, несмотря на то, что все моменты времени использовали для более быстрого выведения мутантов, P257N и P257L.
Проводили пять ФК исследований антител у мышей mFcRn-/- hFcRn+. На фиг.13 показаны данные сывороточной концентрации для дикого типа и вариантных антител IgG1 (Исследование 3) и IgG2 (Исследование 5) соответственно. Подобранные ФК параметры всех ФК исследований in vivo, проведенных у мышей mFcRn-/- hFcRn+, приведены на фиг.14. ФК данные включают время полужизни, которое представляет собой бета-фазу, характеризующую выведение антитела из сыворотки, Cmax, которая представляет собой максимальную наблюдаемую сывороточную концентрацию, ППК, которая представляет собой площадь под кривой «концентрация-время», и клиренс, который представляет собой клиренс антитела из сыворотки. Также для каждого варианта приведено рассчитанное кратное увеличение или уменьшение времени полужизни относительно исходного антитела IgG1 или IgG2 [кратное время полужизни = время полужизни (вариант) / время полужизни (дикий тип)].
Эти данные показывают, что ряд созданных вариантных Рс антител, обладающих повышенной аффинностью к FcRn при pH 6.0, увеличивает время полужизни in vivo. На фиг.15а показан график зависимости времени полужизни in vivo от кратного связывания FcRn для антител IgG1 с выбранными мечеными вариантами. Результаты повторных экспериментов (обведены в кружок на фигуре) показывают, что данные модели in vivo являются воспроизводимыми. Лучшие одиночные варианты включают 308F и 434S, лучшие двойные варианты включают 259I/308F, 308F/428L, 308F/434S и 428L/434S и лучший тройной вариант представляет собой 259I/308F/428L. Существует общая корреляция между аффинностью к FcRn и временем полужизни in vivo, но она не является полностью предсказуемой. В частности, варианты 257L и 257N, которые увеличивали связывание FcRn 3.4- и 3.5-кратно соответственно, уменьшали время полужизни in vivo в 0.6 и 0.3 соответственно. График также снова подчеркивает важность аминокислотной идентичности в определенном положении - в то время как 308F/434S приводил к существенному увеличению времени полужизни, 308F/434M был лишь немного лучше по сравнению с IgG1 дикого типа.
На фиг.15b показан график зависимости времени полужизни in vivo от кратного связывания FcRn для вариантных антител IgG2 с мечеными вариантами. Когда данные IgG2 in vivo сравнивали с данными IgG1 in vivo (фиг.15с), наблюдали неожиданный результат. Варианты приводили по существу к более значительному увеличению времени полужизни in vivo в случае области Fc IgG2, чем в области Fc IgG1. Самое продолжительное время полужизни одиночных и двойных вариантов всех антител во всех 5 исследованиях составляло 12.2 и 16.5, обусловленное 434S IgG2 и 428L/434S IgG2 соответственно. Резкие увеличения времени полужизни для вариантов IgG2 по сравнению с IgG1 происходили несмотря на то, что кратные увеличения вариантами в IgG2 были сопоставимы или даже ниже, чем в IgGI (кратность 434S IgGI = 3.8, кратность 434S IgG2 = 4.9, кратность 428L/434S IgG1 = 17.3, кратность 428L/434S IgG2 = 14.8). Таким образом, неожиданно антитело IgG2 может представлять собой лучшее применение для вариантов Fc для увеличения времени полужизни in vivo у млекопитающих.
ПРИМЕР 6. Вариантные иммуноадгезины
Варианты Fc согласно настоящему изобретению также оценивали на предмет их способности увеличивать время полужизни иммуноадгезинов (также называющихся «гибридами Fc»). Выбранные варианты Fc создавали в иммуноадгезине анти-TNF, этанерцепте (Энбрел®). Этанерцепт представляет собой гибрид рецептора 2 TNF человека (TNF RII) и области Fc IgG1 человека, и является клинически разрешенным для лечения ревматоидного артрита, ювенильного идиопатического артрита, анкилозирующего спондилоартрита, псориатического артрита и псориаза. Также создавали вариант области Fc IgG2 данного гибрида Fc и в связи с этим также создавали выбранные варианты Fc. Аминокислотные последовательности иммуноадгезинов анти-TNF, охарактеризованных согласно настоящему изобретению, приведены на фиг.16. Гены создавали с использование рекурсивной ПЦР и субклонировали в вектор рТТ5, а варианты Fc создавали с использованием способов мутагенеза QuikChange®. Иммуноадгезины экспрессировали в клетках 293Е и очищали, как описано выше.
Специфичность к связыванию очищенных иммуноадгезинов подтверждали путем тестирования связывания с рекомбинантным TNF с помощью Biacore. Иммуноадгезины фиксировали на биосенсорном чипе СМ5 (Biacore) с иммобилизированным белком A/G (Pierce), полученном с использованием стандартного сочетания первичных аминов. Иммуноадгезины иимобилизировали на поверхности Белка A/G и рекомбинантный TNF в серийных разведениях вводили на связанную с антителом поверхность с последующей фазой диссоциации. После каждого цикла поверхность регенерировали буфером. Данные обрабатывали путем обнуления времени и реакции перед введением рецептора и путем вычитания из базовых данных для объяснения изменений, вызванных введениями. Кинетические данные подгоняли к 1:1 модели связывания (Ленгмюр). Равновесные константы ассоциации (Ка), полученные в результате данных подборов, приведены на фиг.17. Данные результаты показывают, что вариантные иммуноадгезины сохраняли аффинность к TNF, сопоставимую с коммерчески доступным энбрелом.
Вариантные иммуноадгезины тестировали на предмет связывания с FcRn человека при pH 6.0 с использованием Biacore, как описано выше. Результаты (фиг.18) показывают, что также, как и в случае антител, указанные варианты улучшают связывание с FcRn по сравнению с их исходными белками иммуноадгезина IgG1 и IgG2.
Время полужизни вариантных иммуноадгезинов тестировали у мышей mFcRn-/- hFcRn+, как описано выше. 12 мышам на группу вводили путем инъекции 2 мг/кг вариантного и исходного иммуноадгезина IgG1. Сывороточную концентрацию определяли с использованием иммуноферментного анализа (ELISA), аналогичного описанному выше, за исключением того, что античеловеческое антитело анти-TNF RII козы использовали в качестве связывающего реагента; обнаружение осуществляли с помощью биотинилированного античеловеческого каппа-антитела и меченого европием стрептавидина. На фиг.19 показаны данные сывороточной концентрации для Fc IgG1 дикого типа и вариантных Fc иммуноадгезинов. Подобранные ФК параметры, как описано выше, полученные в результате ФК исследования, приведены на фиг.20. Также для каждого варианта приведен рассчитанный % увеличения времени полужизни, рассчитанный как умноженное на 100 время полужизни вариантного гибрида Fc относительно времени полужизни исходного Fc IgG1 дикого типа. Данные результаты показывают, что варианты увеличивают время полужизни in vivo в случае иммуноадгезина.
ПРИМЕР 7. Фармакокинетический эксперимент на низших приматах ФК свойства биопрепаратов у низших приматов точно установлены, в результате чего они являются предсказуемыми у людей. ФК исследование выполняли на яванских макаках (macaca fascicularis) для оценки способности вариантных антител анти-VEGF увеличивать время полужизни в сыворотке у низших приматов.
При подготовке к ФК исследованию у яванских макак измеряли связывание вариантных антител с FcRn яванских макак (cyno) (cFcRn) при pH 6.0. cFcRn создавали, экспрессировали и очищали, как описано выше для FcRn человека. Связывание вариантных антител анти-VEGF с cFcRn измеряли с использованием Biacore, как описано выше. Данные представлены на фиг.21. Данные результаты показывают, что варианты повышают аффинность к cyno FcRn аналогичным образом, что и к FcRn человека. Диссоциация при более высоком значении pH (7.4) также происходила очень быстро (данные не показаны), аналогично наблюдаемой для связывания с FcRn человека. Данные результаты не являются неожиданными, приведена высокая гомология последовательностей рецепторов человека и супо-рецепторов (альфа цепь FcRn 96%, бета-2-микроглобулин 91%).
Фармакокинетические характеристики вариантов исследовали у низших приматов in vivo. Самцов яванских макак (macaca fascicularis, также называющихся «макаками-крабоедами» массой 2.3-5.1 кг) рандомизировали по массе и делили на 5 групп по 3 обезьяны на группу. Обезьянам делали одну инфузию 4 мг/кг антитела длительностью один час в периферийную вену. Образцы крови (1 мл) забирали из другой вены через 5 минут-90 дней после завершения инфузии, преобразовывали в сыворотку и хранили при -70°С. Во время данных исследований животные не пострадали.
Концентрации антител определяли с использованием способа «захвата» (фиксации) VEGF, как описано выше. ФК параметры определяли путем подгонки зависимости «концентрации-время» к некомпартментной модели, как осуществляли в ФК исследованиях мышей. Однако моменты времени день 10-день 90 использовали для определений ФК параметров. ФК результаты изображены на графике на фиг.22, а подобранные параметры приведены на фиг.23. Данные результаты показывают, что варианты увеличивали время полужизни антитела in vivo до 3.2 раз. В лучшем случае (вариант 428L/434S) время полужизни увеличивали от 9.7 дней до 31.1 дней. ФК результаты, полученные у яванских макак, сопоставимы с результатами, полученными у мышей mFcRn-/- hFcRn+, что обосновывает модель мыши hFcRn в качестве системы для определения ФК свойств вариантов in vivo и подтверждает результаты указанных исследований.
В то время как конкретные варианты реализации настоящего изобретения были описаны выше для иллюстрации, для специалистов в данной области техники очевидно, что могут быть осуществлены многочисленные вариации в объеме настоящего изобретения, который определяется прилагаемой формулой изобретения. Содержание всех указанных источников полностью включено в настоящее описание.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВАРИАНТЫ Fc С ИЗМЕНЕННЫМ СВЯЗЫВАНИЕМ С FcRn | 2014 |
|
RU2700882C2 |
| ВАРИАНТЫ Fc С ИЗМЕНЕННЫМ СВЯЗЫВАНИЕМ С FcRn | 2021 |
|
RU2833597C2 |
| Fc-ВАРИАНТЫ С ИЗМЕНЕННЫМ СВЯЗЫВАНИЕМ С FcRn | 2008 |
|
RU2517621C2 |
| СКОНСТРУИРОВАННЫЕ СЛИТЫЕ БЕЛКИ ИЛ-2-FC | 2018 |
|
RU2812283C2 |
| Fc-ВАРИАНТЫ С ИЗМЕНЕННЫМ СВЯЗЫВАНИЕМ С FcRn | 2005 |
|
RU2412200C2 |
| ВАРИАНТЫ ИММУНОГЛОБУЛИНА И ИХ ПРИМЕНЕНИЯ | 2009 |
|
RU2536937C2 |
| КОМПОЗИЦИИ ДЛЯ УВЕЛИЧЕНИЯ ПЕРИОДА ПОЛУЖИЗНИ ТЕРАПЕВТИЧЕСКОГО СРЕДСТВА У СОБАК И СПОСОБЫ ПРИМЕНЕНИЯ | 2020 |
|
RU2828219C2 |
| ПОЛИПЕПТИДНЫЕ ВАРИАНТЫ С ИЗМЕНЕННОЙ ЭФФЕКТОРНОЙ ФУНКЦИЕЙ | 2005 |
|
RU2367667C2 |
| МОДИФИЦИРОВАННЫЕ АСИММЕТРИЧНЫЕ АНТИТЕЛА, СВЯЗЫВАЮЩИЕ Fc-РЕЦЕПТОР, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2014 |
|
RU2687043C2 |
| ВАРИАНТЫ С FC-ФРАГМЕНТОМ, ОБЛАДАЮЩИЕ ПОВЫШЕННОЙ АФФИННОСТЬЮ К FCRN И ПОВЫШЕННОЙ АФФИННОСТЬЮ ПО МЕНЬШЕЙ МЕРЕ К ОДНОМУ РЕЦЕПТОРУ FC-ФРАГМЕНТА | 2018 |
|
RU2820162C2 |



















































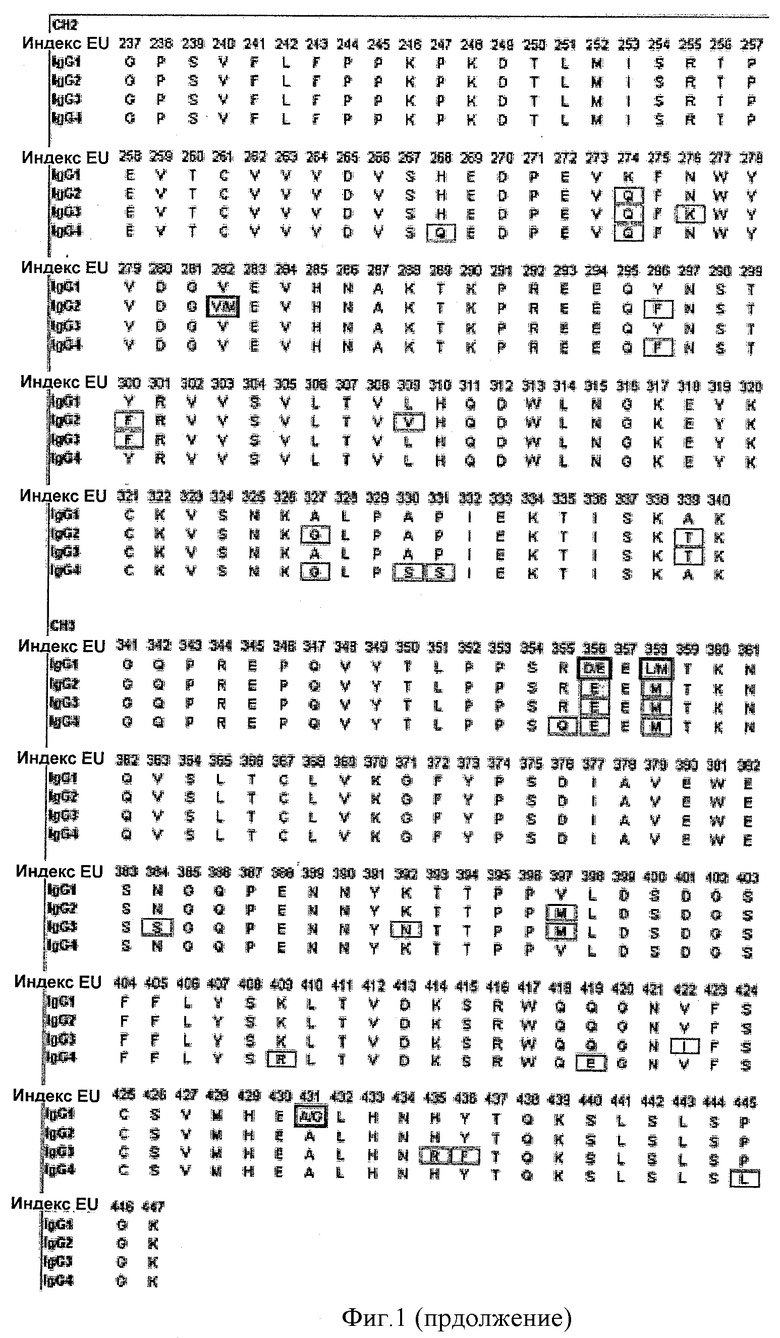






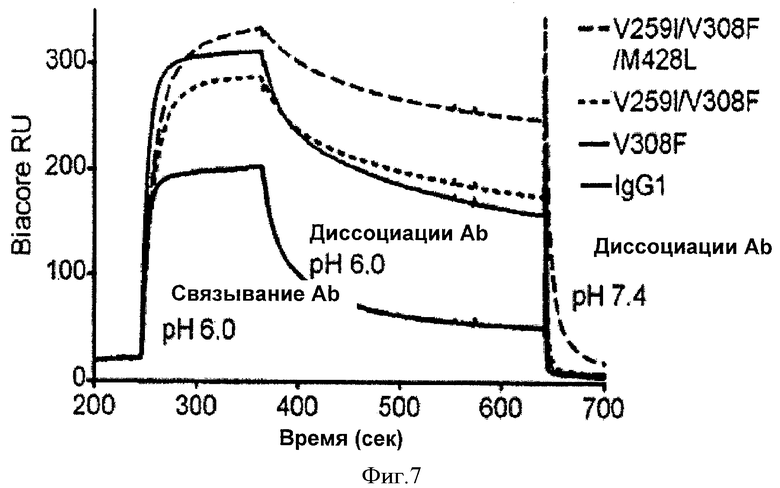
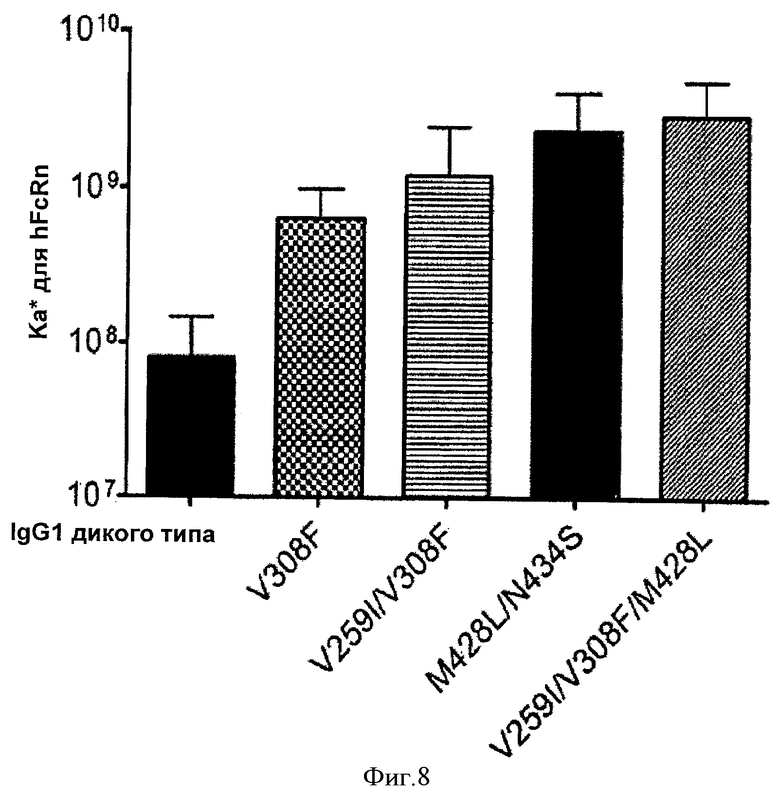
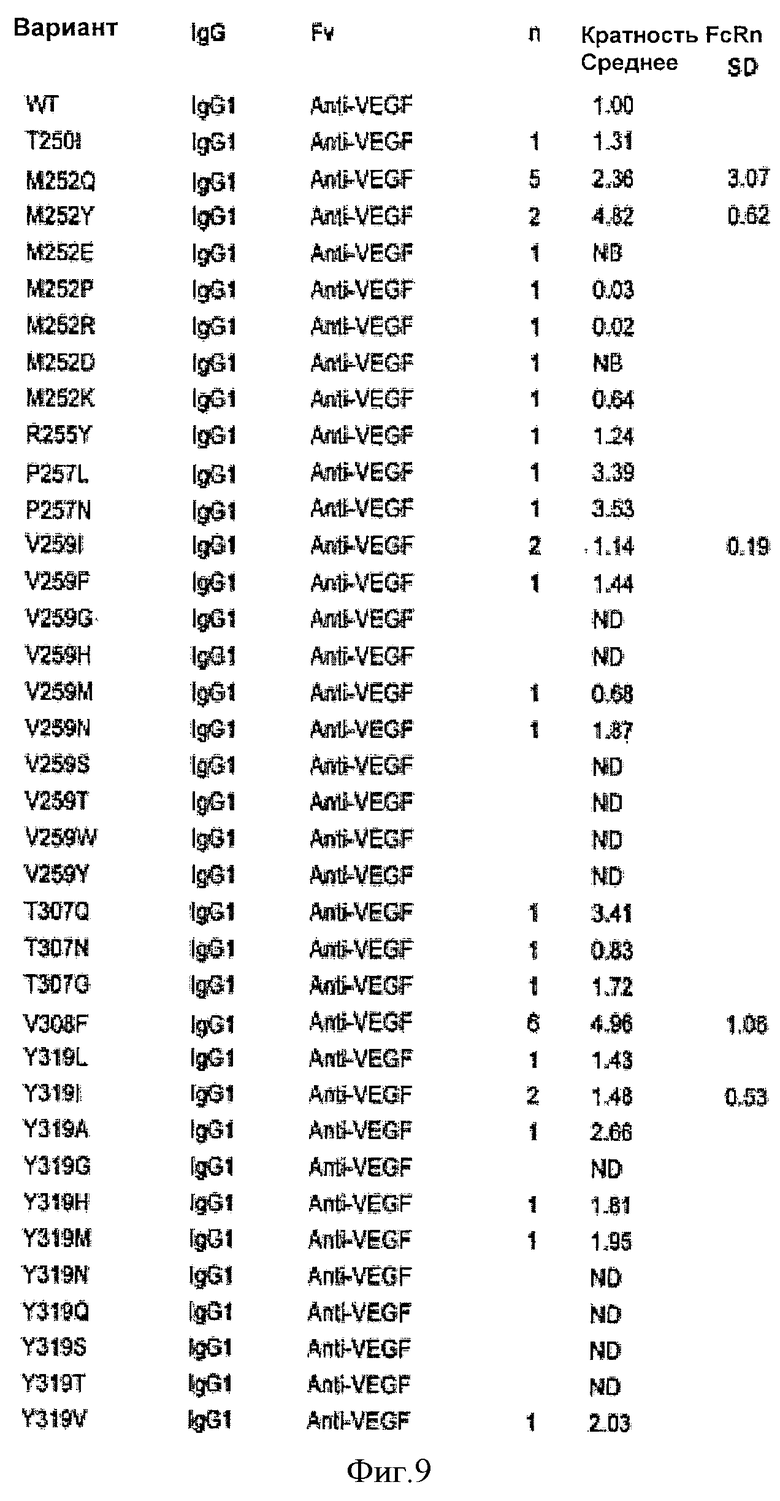
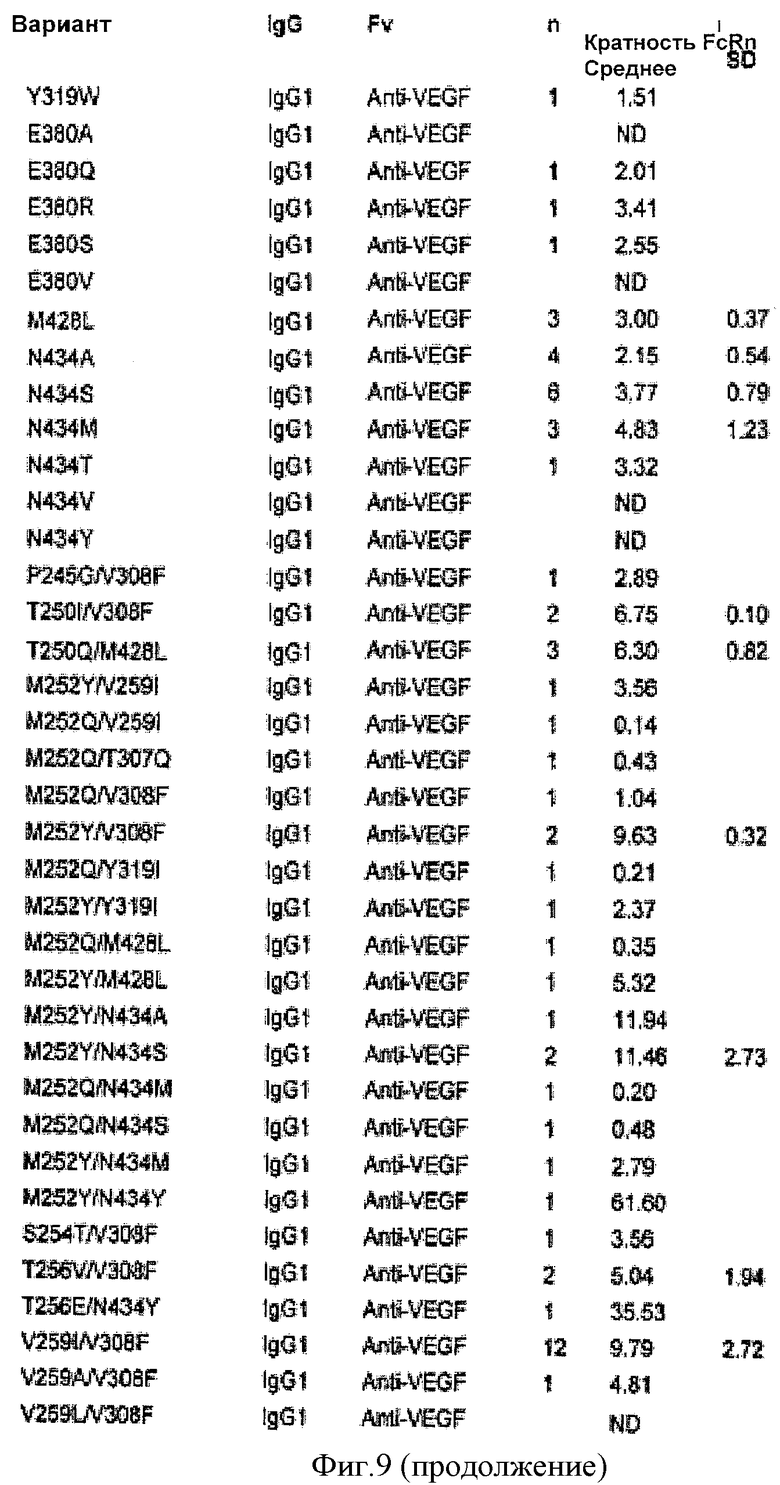
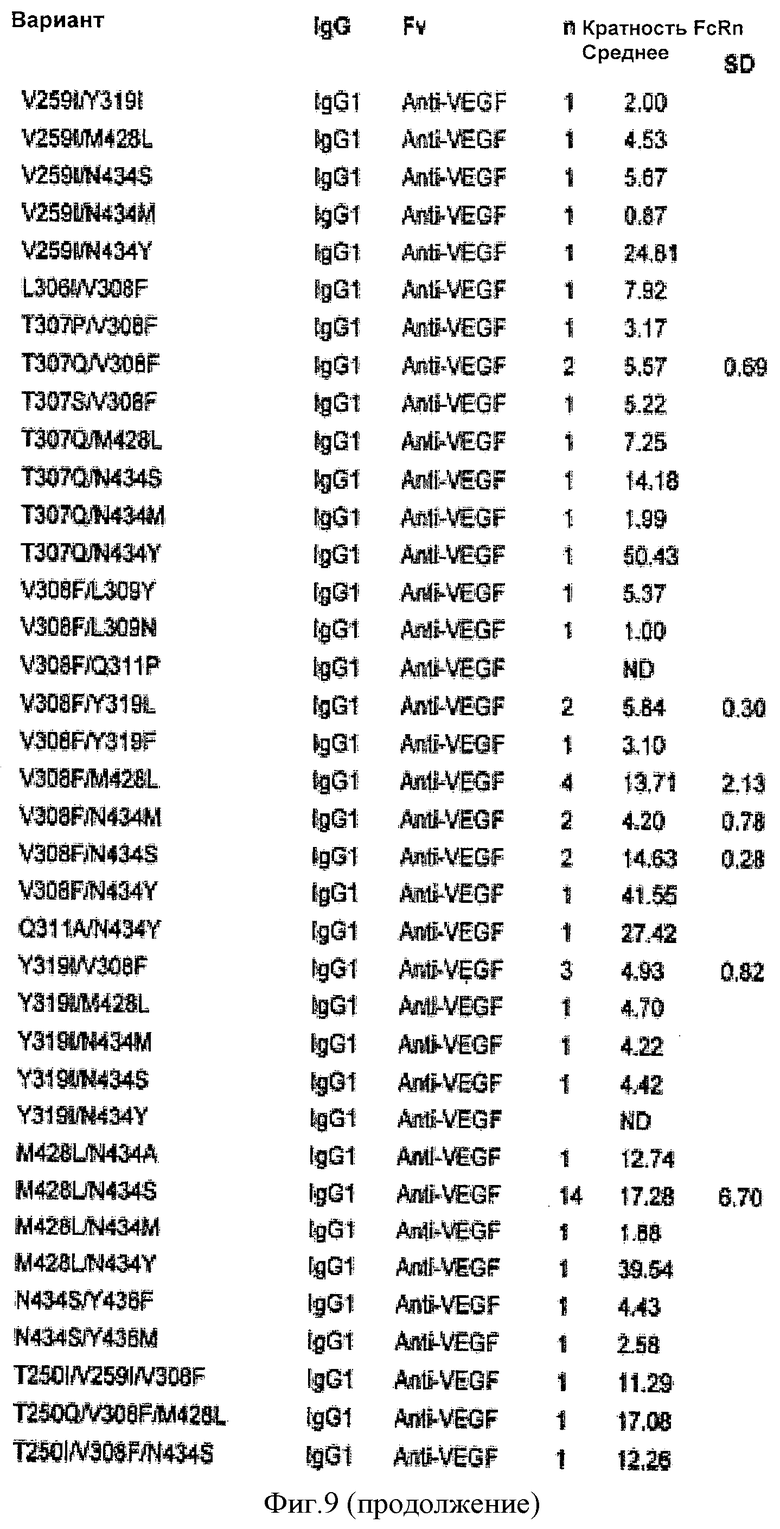

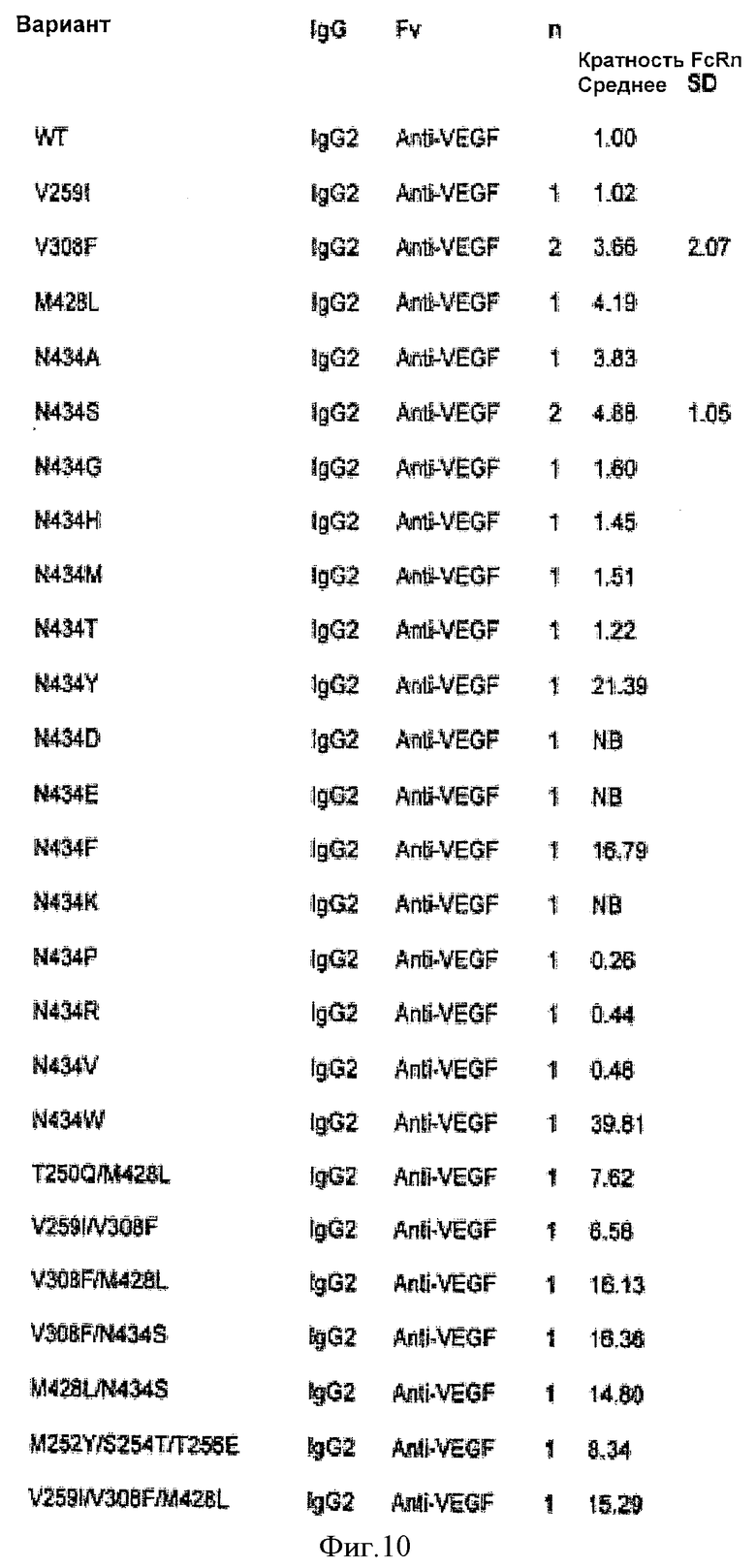



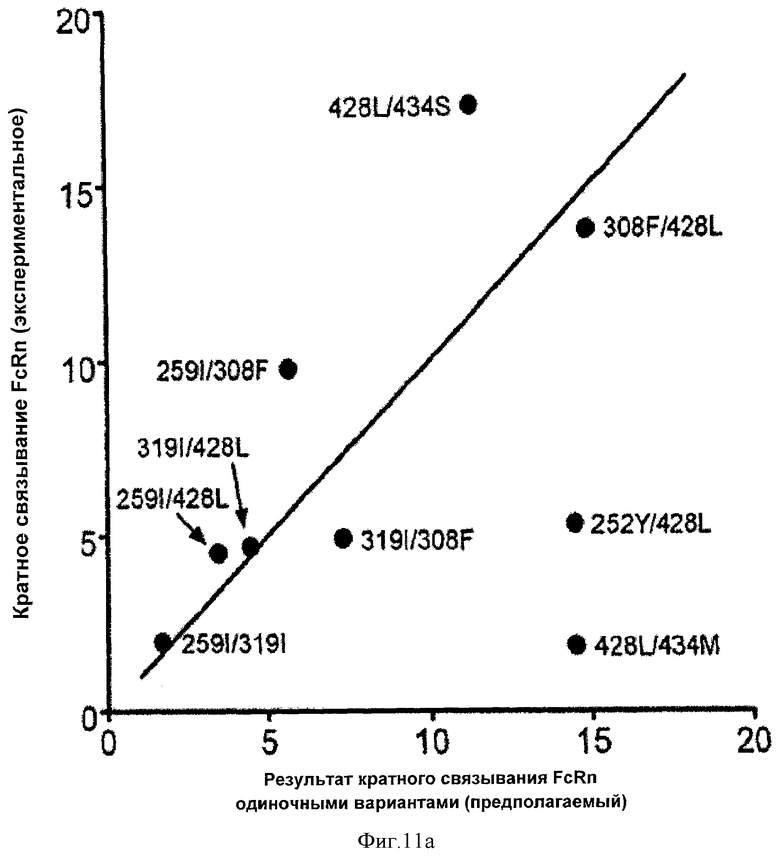
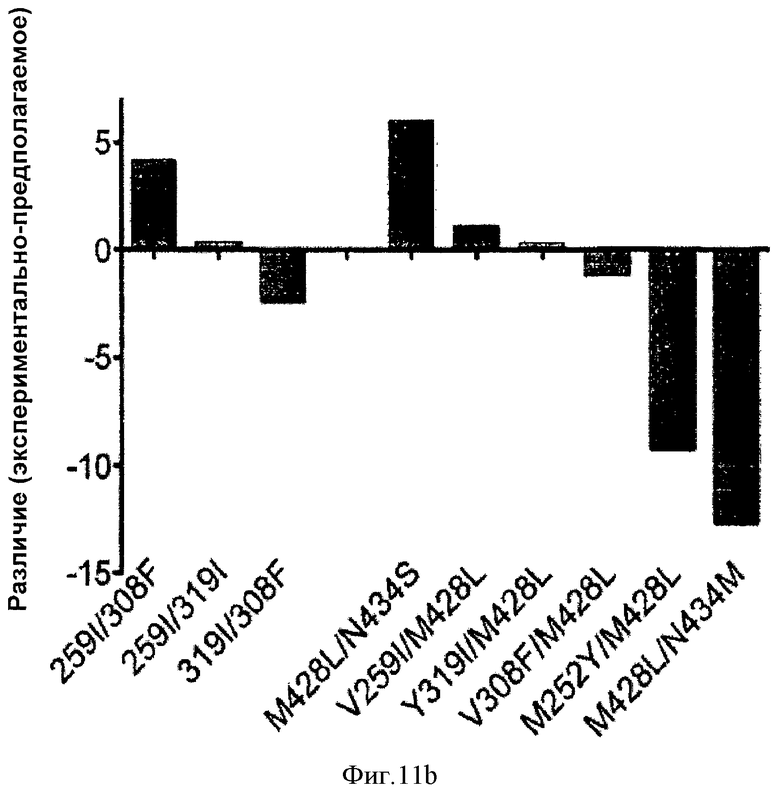

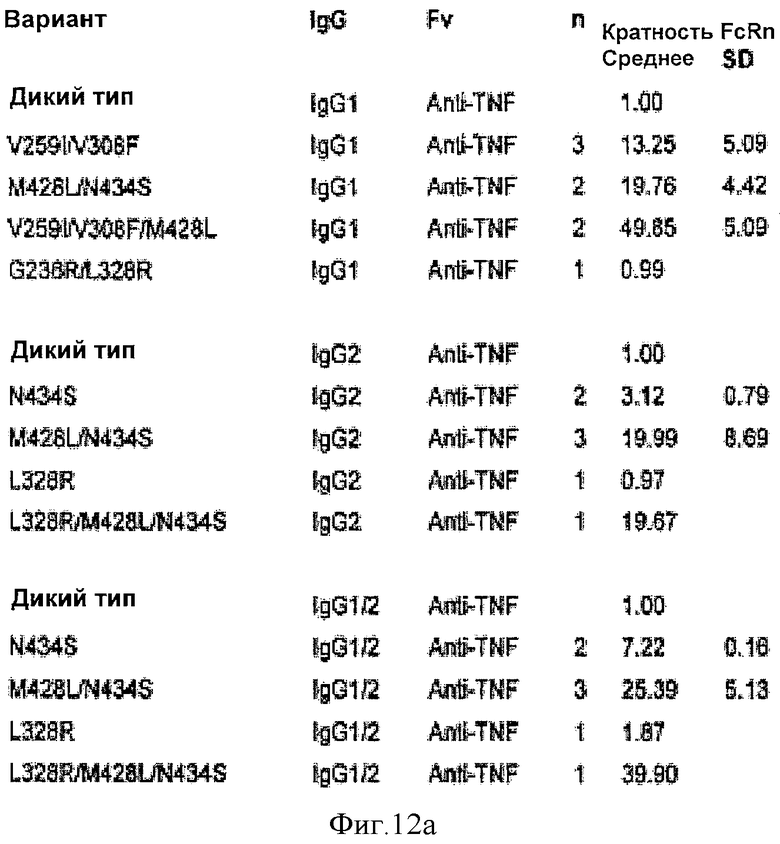


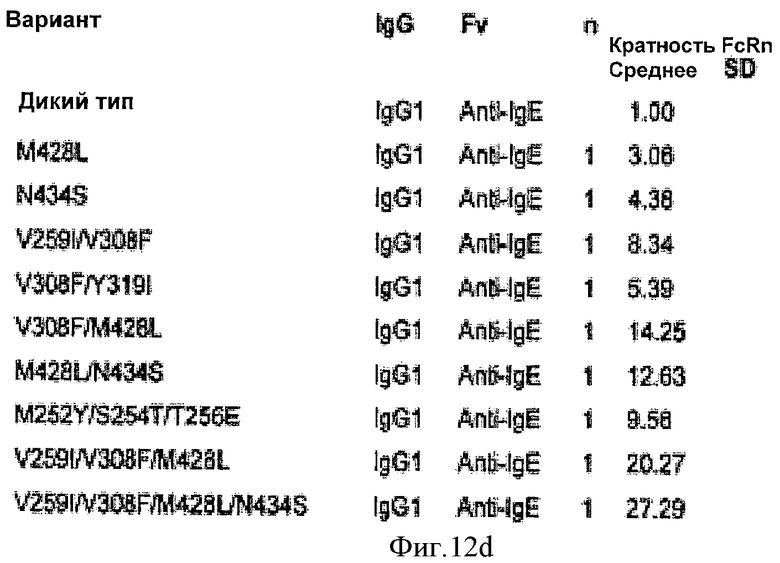
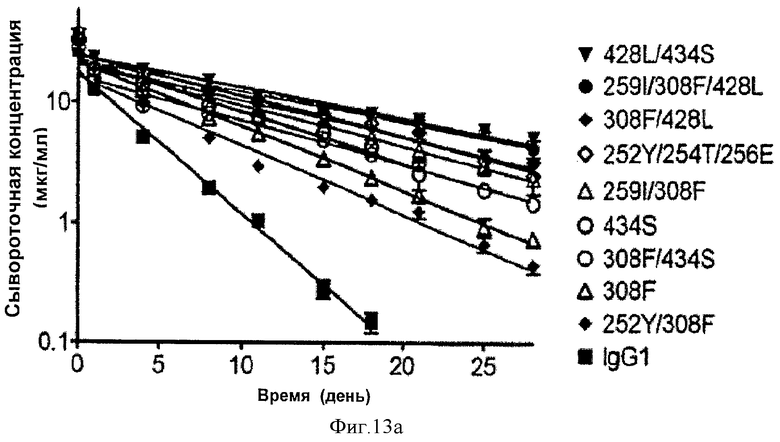
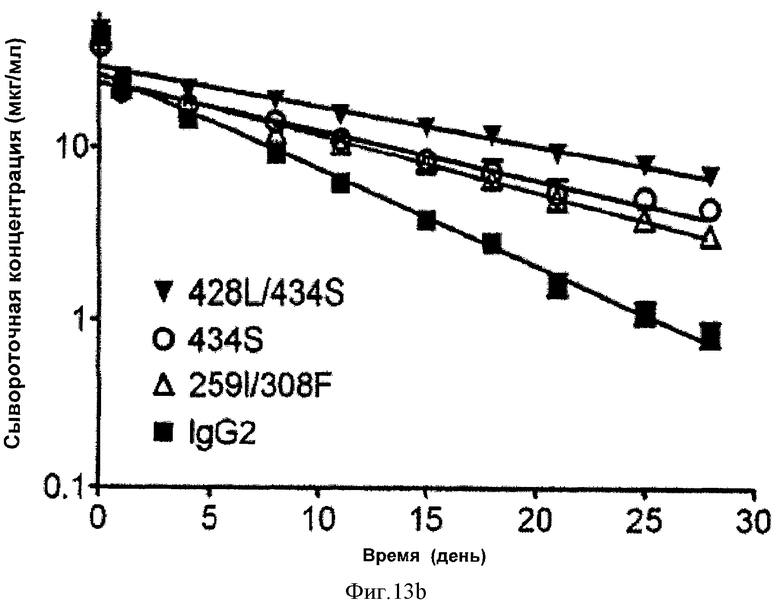

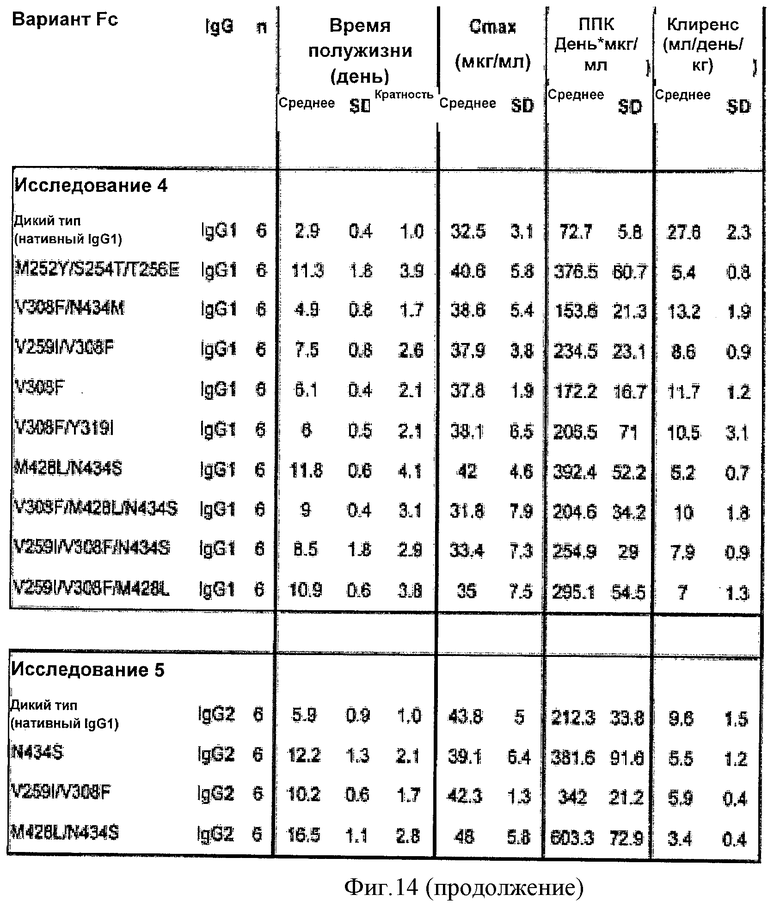
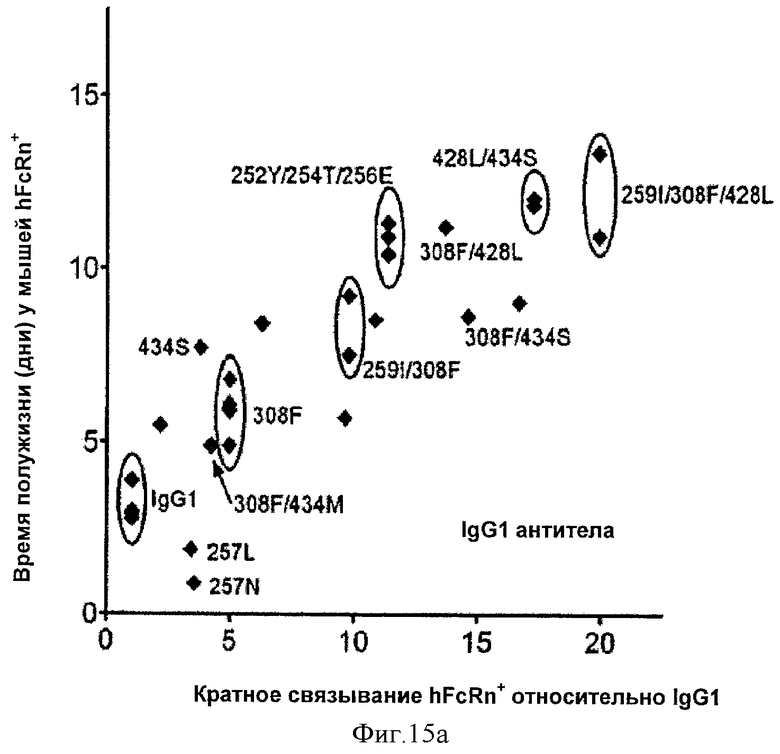

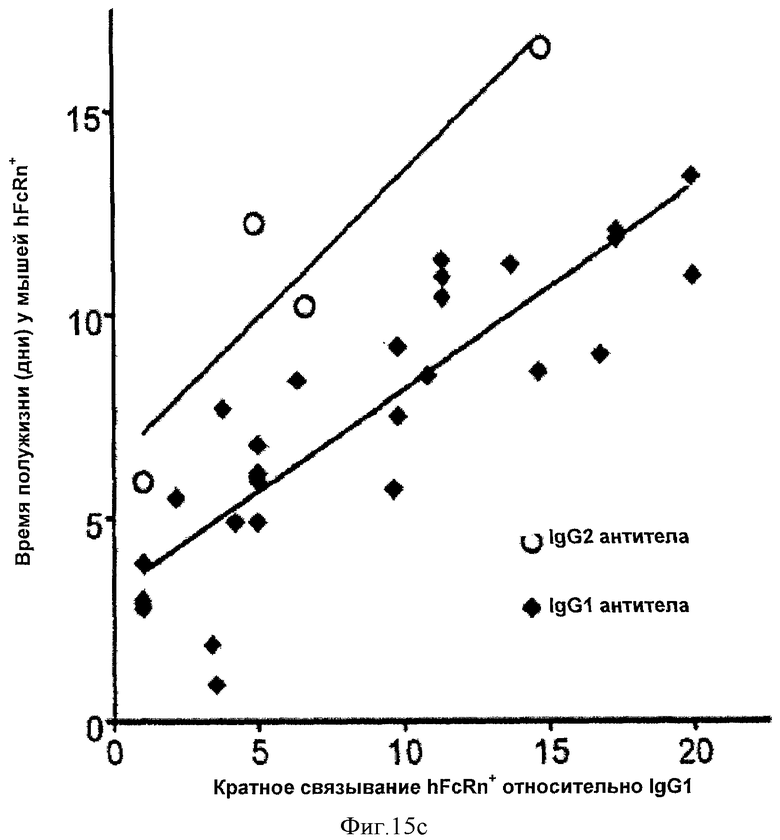


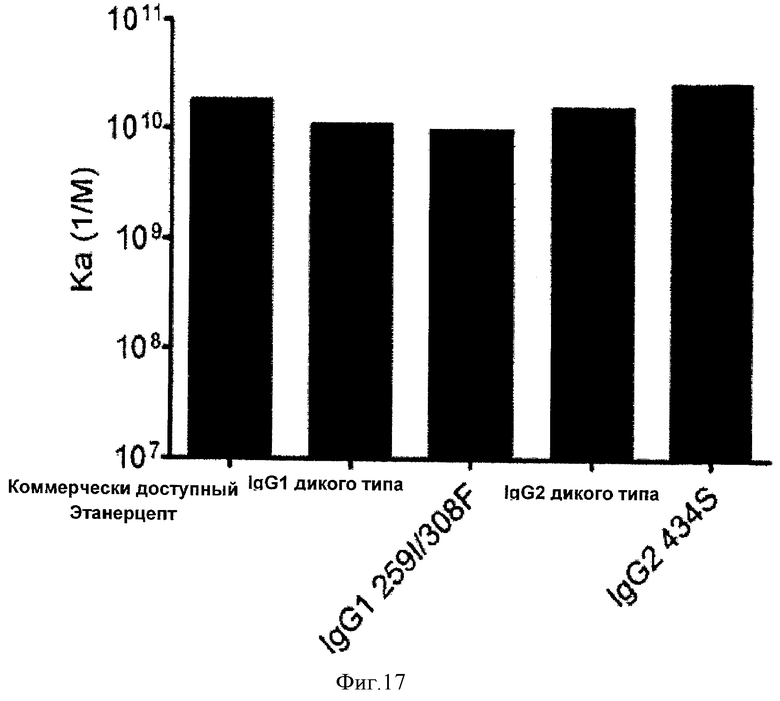

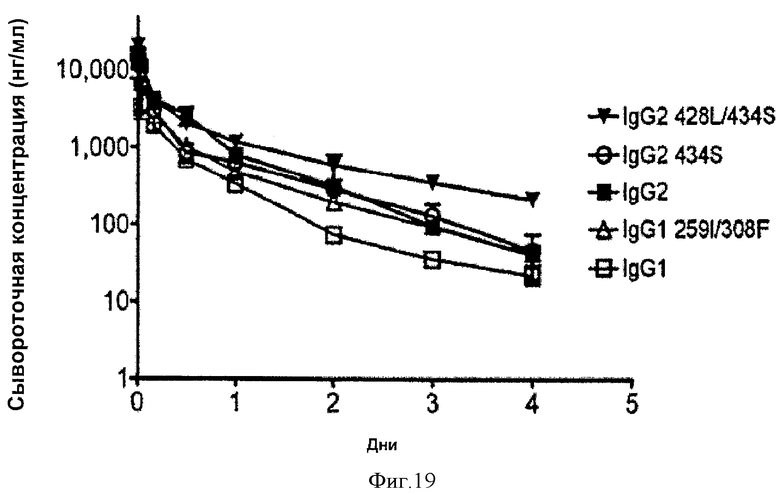

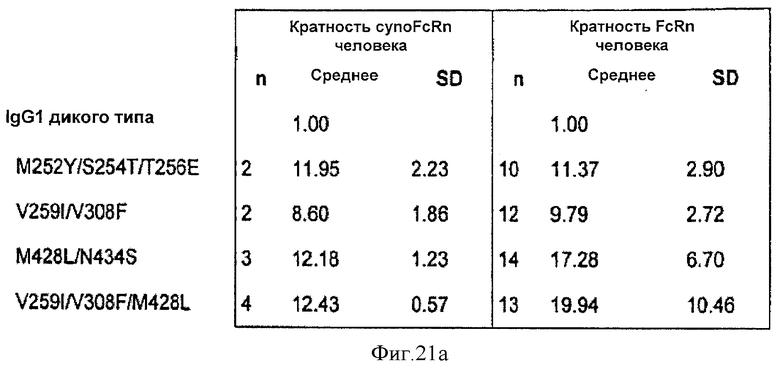
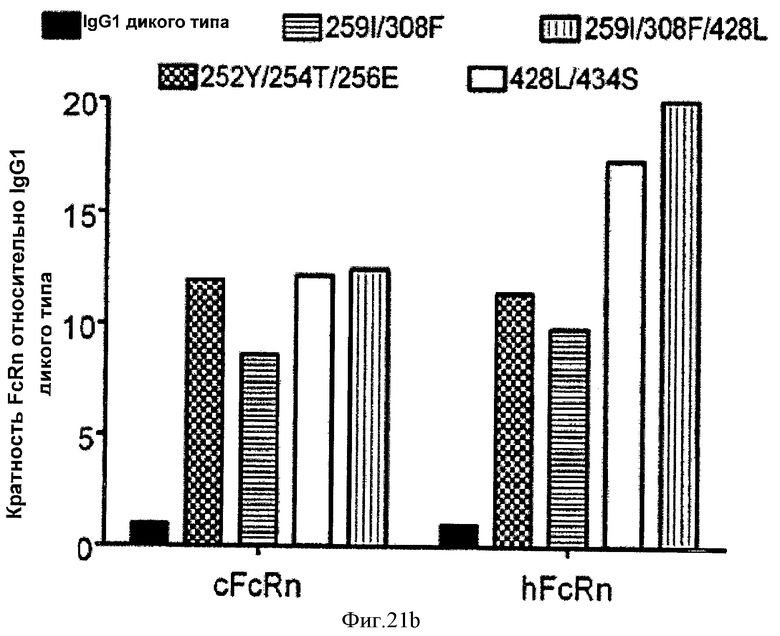
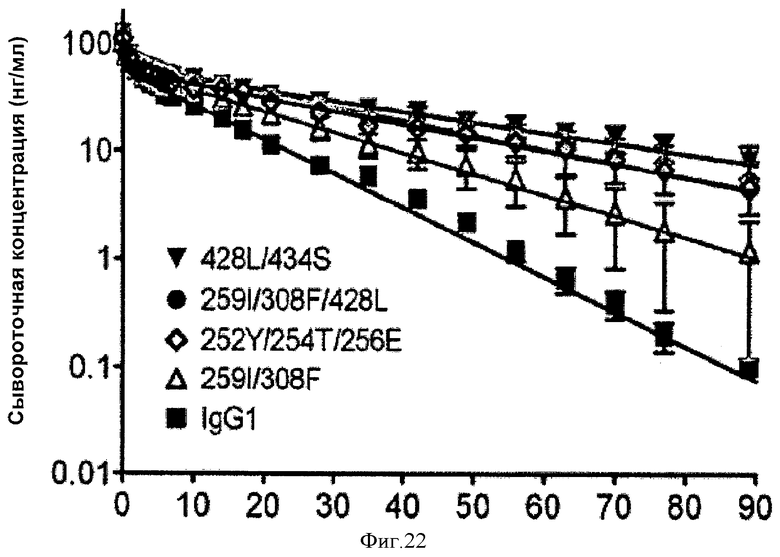
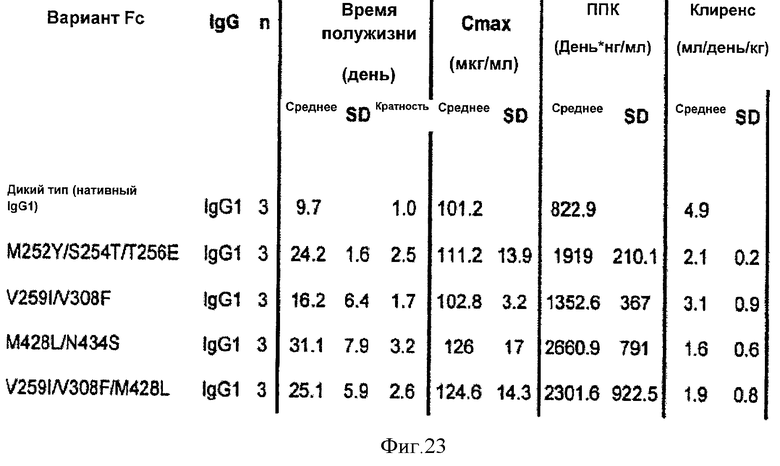
Изобретение относится к иммунологии и биотехнологии. Предложено применение Fc области с мутацией 434S и 428L для увеличения периода полужизни in vivo полипептида, содержащего указанную область. Использование изобретения обеспечивает увеличение времени полужизни антитела с такой Fc областью, что может найти применение в медицине для получения различных конструкций антител с пролонгированным временем удержания в сыворотке крови in vivo. 1 н. и 1 з.п. ф-лы, 22 ил., 7 пр.
1. Применение Fc области с мутацией 434S и 428L для увеличения периода полужизни in vivo полипептида, содержащего указанную Fc область.
2. Применение по п.1, согласно которому указанная Fc область используется для получения антитела с увеличенным периодом полужизни in vivo, предназначенного для лечения рака или воспалительных заболеваний.
| WO2006053301 A2, 18.05.2006 | |||
| HINTON et al Engineered Human IgG Antibodies with Longer Serum Half-lives in Primates, The Journal of biological chemistry, Vol | |||
| АППАРАТ ДЛЯ ОБОГАЩЕНИЯ РУД ПО МЕТОДУ ВСПЛЫВАНИЯ | 1915 |
|
SU279A1 |
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| ПРИСПОСОБЛЕНИЕ К ТОКАРНОМУ СТАНКУ ДЛЯ ПРАВКИ КОНЦОВ ТРУБОК | 1927 |
|
SU6213A1 |
| DALL' ACQUA et al.,Increasing the Affinity of a Human IgG1 for the Neonatal Fc Receptor: Biological Consequences, The Journal of Immunology, 2002, 169: | |||
Авторы
Даты
2014-10-10—Публикация
2008-12-22—Подача