Область изобретения
Настоящее изобретение относится к способам применения этексилата дабигатрана, необязательно в форме его фармацевтически приемлемой соли, которые обеспечивают преимущества по сравнению со стандартным лечением варфарином или другими антагонистами витамина К.
Предпосылки создания настоящего изобретения
Мерцательная аритмия (МА) представляет собой распространенную сердечную аритмию, повышающую риск развития инсульта, других эмболических событий и смертельных исходов. От МА страдают 2,2 миллиона человек в США и 4,5 миллиона человек в Европе. МА является наиболее распространенным нарушением сердечного ритма и основным фактором риска инсульта. Заболеваемость МА увеличивается с возрастом и около 6% людей старше 65 лет страдают МА. Пациенты, страдающие от МА, подвержены риску образования тромбов за счет быстрого аритмичного биения сердца. МА увеличивает шанс инсульта в 5 раз. Поскольку следствием инсульта может являться истощение, то первой целью лечения является снижение риска образования артериальных тромбов и тромбоэмболии. Пациентам, страдающим от МА и с риском (от среднего до высокого уровня) инсульта, рекомендовано длительное антикоагуляционное лечение антагонистами витамина К (АВК или кумадины), таким как варфарин. Факторы риска инсульта, тромбоза или эмболии включают возраст старше 65 лет, ранее перенесенный инсульт или временную ишемическую атаку, гипертензию, диабет или сердечную недостаточность. Другие факторы риска развития инсульта известны врачам-терапевтам, а также описаны ниже.
АВК, такие как варфарин, снижают риск инсульта на 64% по сравнению с контролем, но повышают риск кровоизлияний (см., например, статью Hart R.G., Pearce L.A. и Aguilar M.I., Meta-analysis: Antithrombotic therapy to prevent stroke in patients who have nonvalvular atrial fibrillation, Ann of Intern Med., т.146, cc. 857-867 (2007). По сравнению с плацебо варфарин также снижает смертность. Таким образом, варфарин рекомендуют пациентам с мерцательной аритмией и риском инсульта (см. статью Fuster V. и др., ACC/AHA/ESC 2006 guidelines for the management of patients with atrial fibrillation - executive summary: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines (Writing Committee to Revise the 2001 Guidelines for the Management of patients Patient with Arial Fibrillation), J. Am. Coll. Cardiol., т.48, cc.854-906 (2006).
Лечение с использованием АВК, такого как варфарин, является обременительным в связи с многочисленными взаимодействиями диеты и лекарственных средств, а также в связи с необходимостью проводить частые лабораторные исследования. Таким образом, АВК часто не используют; и в большинстве случаев пациенты прерывают лечение (см., например, статьи Birman-Deych Е, Radford MJ, Nilasena DS, Gage BF, Use and Effectiveness of Warfarin in Medicare Beneficiaries with Atrial Fibrillation, Stroke, т.37, cc. 1070-1074 (2006), Hylek E.M., Evans-Molina C, Shea C, Henault L.E., Regan S., Major Hemorrhage and Tolerability of Warfarin in the First Year of Therapy Among Elderly Patients with Atrial Fibrillation, Circulation, т.115, cc. 2689-2696 (2007). Кроме того, у многих пациентов, даже принимающих варфарин, наблюдается аномальная антикоагуляция (см. Connolly S.J., Pogue J., Eikelboom J., Flaker G., Commerford P., Franzosi M.G., Healey J.S., Yusuf S., ACTIVE W Investigators, Benefit of oral anticoagulant over antiplatelet therapy in atrial fibrillation depends on the quality of international normalized ratio control achieved by centers and countries as measured by time in therapeutic range, Circulation, т.118, №20, cc. 2029-2037 (2008). Таким образом, несмотря на то, что варфарин снижает риск инсульта при мерцательной аритмии, он повышает риск кровоизлияния, а его применение затруднительно. Таким образом, несмотря на то, что антикоагуляционная терапия варфарином приводит к значительному снижению риска развития инсульта, только половина пациентов, которые соответствуют критериям для участия в испытаниях, проходили курс лечения из-за различных бюрократических проблем и ограничения применения АВК. Следовательно, существует необходимость в новых эффективных, безопасных и более простых в применении антикоагулянтов.
Всецитированные в данном контексте патенты, заявки на выдачу патента и документы полностью включены в настоящее изобретение в качестве ссылок.
Краткое описание настоящего изобретения
В настоящем изобретении предлагаются способы профилактики или лечения тромбоза у пациентов, нуждающихся в указанном лечении, одновременно с профилактикой нежелательных кровотечений. Способы включают введение эффективного количества этексилата дабигатрана, необязательно в форме его фармацевтически приемлемой соли, пациенту, который не подвергался хирургическому вмешательству в течение 10 суток, 42 суток, 50 суток или 90 суток. Указанные композиции при введении согласно способам по настоящему изобретению проявляют эффективность при профилактике или лечении тромбоза. В то же время способы по настоящему изобретению обеспечивают преимущество по сравнению с используемыми в настоящее время способами, которое заключается в профилактике нежелательных кровотечений у пациентов.
В другом варианте осуществления настоящего изобретения способы можно использовать для профилактики инсульта у пациентов, страдающих от мерцательной аритмии. Способы включают введение пациенту эффективного количества этексилата дабигатрана, например дозы от более 150 мг 2 раза в сутки до 300 мг 2 раза в сутки, необязательно в форме его фармацевтически приемлемой соли. Риск нежелательных кровотечений у указанного пациента снижается прежде всего по сравнению с лечением варфарином. Факторы риска инсульта известны врачам-терапевтам и также описаны в настоящем контексте ниже.
Способы по настоящему изобретению включают введение фармацевтических композиций, включающих терапевтически эффективное количество этексилата дабигатрана, необязательно в форме его фармацевтически приемлемой соли. Кроме того, фармацевтические композиции могут включать фармацевтически приемлемый носитель. В основном, суточная доза от 100 мг до 600 мг этексилата дабигатрана, необязательно в форме его фармацевтически приемлемой соли, обеспечивает оптимальный баланс между ослаблением тромбоэмболии и низкой степенью кровотечений. Прежде всего, введение этексилата дабигатрана в дозе от 100 до 200 мг 2 раза в сутки обеспечивает оптимальный баланс между ослаблением тромбоэмболии и низкой степенью кровотечений.
Авторами неожиданно было установлено, что оптимальный баланс между ослаблением тромбоэмболии и низкой степенью кровотечений у пациентов без дополнительных факторов риска случаев массивных кровотечений обеспечивается введением этексилата дабигатрана в дозе от 140 до 160 мг, предпочтительно 150 мг, или от 210 до 230 мг, предпочтительно 220 мг 2 раза в сутки.
Более подробно, настоящее изобретение относится к способу профилактики инсульта у пациента, страдающего от мерцательной аритмии, причем у пациента отсутствуют факторы риска случаев массивных кровотечений, и указанный способ заключается во введении пациенту от более 150 мг до 300 мг этексилата дабигатрана 2 раза в сутки, необязательно в форме его фармацевтически приемлемой соли.
Другой объект настоящего изобретения относится к применению этексилата дабигатрана, необязательно в форме его фармацевтически приемлемой соли, для получения лекарственного средства, предназначенного для профилактики инсульта у пациентов, страдающих от мерцательной аритмии, причем у пациента отсутствуют факторы риска случаев массивных кровотечений, при этом указанное применение заключается во введении пациенту от более 150 мг до 300 мг этексилата дабигатрана 2 раза в сутки, необязательно в форме его фармацевтически приемлемой соли.
Аналогичным образом настоящее изобретение относится к лекарственному средству, предназначенному для профилактики инсульта у пациента, страдающего от мерцательной аритмии, причем у пациента отсутствуют факторы риска случаев массивных кровотечений, при этом лекарственное средство включает от более 150 мг до 300 мг этексилата дабигатрана, необязательно в форме его фармацевтически приемлемой соли, и указанное лекарственное средство прежде всего предназначено для введения 2 раза в сутки.
В еще одном варианте осуществления настоящего изобретения предлагается способ профилактикиили лечения тромбоза у пациента, нуждающегося в указанном лечении, а также способ снижения риска случаев массивного кровотечения, геморрагического инсульта, внутричерепного инсульта или смертности случаев по сравнению со стандартным лечением варфарином, при этом указанный способ заключается во введении пациенту от более 150 мг до 300 мг этексилата дабигатрана 2 раза в сутки, необязательно в форме его фармацевтически приемлемой соли, при этом пациент не подвергался хирургическому вмешательству в течение 10 суток, 42 суток, 50 суток или 90 суток. Кроме того, указанный способ можно использовать для пациента, клиренс креатинина у которого составляет более 30 мл/мин. Напротив, важно отметить, что может прервать введение этексилата дабигатрана или его соли, если клиренс креатинина пациента составляет 30 мл/мин или менее.
В одном варианте указанного выше способа случай массивного кровотечения представляет собой кровотечение с угрозой жизни. В другом варианте указанный способ можно использовать для пациента с повышенным риском кровотечения по сравнению с основной популяцией, или для пациента, у которого присутствует по крайней мере один фактор риска случаев массивных кровотечений, или у которого отсутствуют факторы риска случаев кровотечений. Описанные выше способы могут, кроме того, включать обследование пациента на наличие случаев кровотечений, которое включает: (а) введение пациенту от более 150 мг до 300 мг этексилата дабигатрана 2 раза в сутки, необязательно в форме его фармацевтически приемлемой соли, (б) обследование пациента на наличие кровотечений и (в) введение пациенту 110 мг этексилата дабигатрана 2 раза в сутки, необязательно в форме его фармацевтически приемлемой соли, если в ходе обследования у пациента выявлен случай кровотечения. Стадию обследования можно проводить в течение по крайней мере 3 месяцев, по крайней мере 6 месяцев или по крайней мере в течение 1 года.
Настоящее изобретение относится также к способу профилактики инсульта у пациента, у которого присутствует по крайней мере один фактор риска инсульта, тромбоза или эмболии, и к способу снижения риска случаев массивного кровотечения или смертности по сравнению со стандартным лечением варфарином, при этом указанный способ заключается во введении пациенту от более 150 мг до 300 мг этексилата дабигатрана 2 раза в сутки, необязательно в форме его фармацевтически приемлемой соли. Факторы риска инсульта, тромбоза или эмболии выбирают из группы, включающей: (а) возраст по крайней мере 75 лет, (б) ранее перенесенный инсульт, (в) ранее перенесенное преходящее ишемическое нарушение мозгового кровообращения, (г) перенесенное тромбоэмболическое осложнение, (д) дисфункция левого желудочка, (е) возраст по крайней мере 65 лет и высокое кровяное давление, (ж) возраст по крайней мере 65 лет и наличие диабета, (з) возраст по крайней мере 65 лет и ишемическая болезнь сердца и (к) возраст по крайней мере 65 лет и заболевание периферических артерий. В одном варианте указанного выше способа случай массивного кровотечения представляет собой кровотечение с угрозой жизни. В другом варианте указанного способа пациент страдает от мерцательной аритмии. Указанные способы могут, кроме того, включать обследование пациента на наличие случаев кровотечения, которое включает: (а) введение пациенту от более 150 мг до 300 мг этексилата дабигатрана 2 раза в сутки, необязательно в форме его фармацевтически приемлемой соли, (б) обследование пациента на наличие случаев кровотечений и (в) введение пациенту более 110 мг этексилата дабигатрана 2 раза в сутки, необязательно в форме его фармацевтически приемлемой соли, если в ходе обследования у пациента выявлен риск случая массивного кровотечения. Стадию обследования можно проводить в течение по крайней мере 3 месяцев, по крайней мере 6 месяцев или по крайней мере в течение 1 года.
В настоящем изобретении предлагается также способ профилактики или лечения тромбоза у пациента, нуждающегося в указанном лечении, при этом указанный способ заключается во введении пациенту от более 150 мг до 300 мг этексилата дабигатрана 2 раза в сутки, необязательно в форме его фармацевтически приемлемой соли, а состояние пациента не соответствует условиям, необходимым для стандартного лечения варфарином, или если пациенту противопоказано лечение варфарином.
Согласно одному из любых способов, описанных выше, этексилат дабигатрана, необязательно в форме его фармацевтически приемлемой соли, можно вводить в течение по крайней мере 3 месяцев, по крайней мере 6 месяцев, по крайней мере 9 месяцев, по крайней мере 12 месяцев или по крайней мере 48 месяцев.
Другой вариант осуществления настоящего изобретения относится к способу снижения риска нежелательного эффекта у пациента, который находится в состоянии после курса лечения варфарином, при этом указанный способ включает: (а) прерывание введения варфарина пациенту и (б) введение пациенту от более 150 мг до 300 мг этексилата дабигатрана 2 раза в сутки, необязательно в форме его фармацевтически приемлемой соли. В одном варианте состоянием является профилактика инсульта при мерцательной аритмии (ПИМА). В другом варианте нежелательным эффектом является кровотечение.
Настоящее изобретение относится также к способу профилактики инсульта у пациента, страдающего от мерцательной аритмии, при этом указанный способ заключается во введении пациенту от более 150 мг до 300 мг этексилата дабигатрана 2 раза в сутки, необязательно в форме его фармацевтически приемлемой соли, и изменении дозы при необходимости обеспечения уровня дабигатрана в плазме пациента в интервале приблизительно от 20 нг/мл приблизительно до 180 нг/мл, при этом пациент подвергается сниженному риску случаев массивных кровотечений по сравнению со стандартным лечением варфарином. Уровни дабигатрана в плазме могут составлять приблизительно от 43 нг/мл приблизительно до 143 нг/мл, приблизительно от 50 нг/мл приблизительно до 120 нг/мл, приблизительно от 50 нг/мл приблизительно до 70 нг/мл или приблизительно от 60 нг/мл приблизительно до 100 нг/мл, а уровни дабигатрана в плазме можно определять по методике с использованием стандартизированного лиофилизированного дабигатрана. В другом варианте этого способа случай массивного кровотечения является угрожающим жизни случаем кровоизлияния.
В настоящем изобретении предлагается также способ профилактики или лечения тромбоза, а также способ профилактики случаев массивного кровотечения, геморрагического инсульта, внутричерепного инсульта или смертность у пациента, нуждающегося в указанном лечении, при этом указанный способ заключается во введении пациенту от более 150 мг до 300 мг этексилата дабигатрана 2 раза в сутки, необязательно в форме его фармацевтически приемлемой соли, и изменении дозы при необходимости обеспечения уровня дабигатрана в плазме в интервале приблизительно от 20 нг/мл приблизительно до 180 нг/мл, при этом пациент подвергается сниженному риску массивных кровотечений по сравнению со стандартным лечением варфарином, и пациент не подвергался хирургическому вмешательству в течение 10 суток, 42 суток, 50 суток или 90 суток. Уровни дабигатрана в плазме могут составлять приблизительно от 43 нг/мл приблизительно до 143 нг/мл, приблизительно от 50 нг/мл приблизительно до 120 нг/мл, приблизительно от 50 нг/мл приблизительно до 70 нг/мл или приблизительно от 60 нг/мл приблизительно до 100 нг/мл, а уровни дабигатрана в плазме можно определять по методике с использованием стандартизированного лиофилизированного дабигатрана. В одном варианте указанного способа случай массивного кровотечения представляет собой угрозу жизни.
Другой объект настоящего изобретения относится к применению этексилата дабигатрана или его фармацевтически приемлемой соли для получения лекарственного средства, предназначенного для лечения мерцательной аритмии, при этом этексилат дабигатрана вводят в дозе от более 150 мг до 300 мг 2 раза в сутки, необязательно в форме его фармацевтически приемлемой соли. Согласно указанному способу этексилат дабигатрана, необязательно в форме его фармацевтически приемлемой соли, можно вводить в течение по крайней мере 3 месяцев, по крайней мере 6 месяцев, по крайней мере 9 месяцев, по крайней мере 12 месяцев, по крайней мере 24 месяца, по крайней мере 48 месяцев или 10 лет.
В другом варианте настоящего изобретения предлагается лекарственная форма, содержащая от более 150 мг до 300 мг этексилата дабигатрана, необязательно в форме его фармацевтически приемлемой соли, для лечения мерцательной аритмии. Настоящее изобретение относится также к лекарственному средству для лечения мерцательной аритмии, биоэквивалентность которого составляет от 80 до 125% указанной лекарственной формы при лечении 2 раза в сутки.
Настоящее изобретение включает также набор, включающий: (а) лекарственное средство, предназначенное для лечения мерцательной аритмии, содержащее твердые лекарственные формы, содержащие от более 150 мг до 300 мг этексилата дабигатрана, необязательно в форме его фармацевтически приемлемой соли, и (б) инструкции по применению одной твердой лекарственной формы 2 раза в сутки.
В одном варианте настоящего изобретения предлагается лекарственное средство для профилактики инсульта у пациентов с мерцательной аритмией и риском развития инсульта, включающее фиксированные дозы дабигатрана, эквивалентные дозе от более 150 мг до 300 мг этексилата дабигатрана 2 раза в сутки, при этом величина первичного параметра случаев инсульта или системной эмболии не ниже эффективности демаскированного скорректированного лечения варфарином в течение среднего периода обследования после инсульта или системной эмболии в течение 2 лет и не ниже эффективности стандартного лечения варфарином.
В другом варианте настоящего изобретения предлагается лекарственное средство для лечения инсульта у пациентов с мерцательной аритмией и риском инсульта, включающее фиксированные дозы дабигатрана, эквивалентные дозе от более 150 мг до 300 мг этексилата дабигатрана, 2 раза в сутки, со сниженным первичным параметром массивных кровотечений по сравнению с параметром демаскированного скорректированного лечения варфарином в течение среднего периода обследования пациента в течение 2,0 лет.
В еще одном варианте настоящего изобретения предлагается лекарственное средство для лечения мерцательной аритмии у пациентов с риском инсульта, включающее фиксированные дозы дабигатрана, эквивалентные дозе от более 150 мг до 300 мг этексилата дабигатрана 2 раза в сутки, со сниженным первичным параметром смертности, по сравнению с параметром демаскированного скорректированного лечения варфарином в течение среднего периода обследования в течение 2,0 лет.
Настоящее изобретение включает также указанные выше лекарственные средства, включающие пролекарство дабигатрана, биоэквивалентность которого находится в интервале от 80 до 125% в отношении этексилата дабигатрана в дозе от более 150 мг до 300 мг 2 раза в сутки, или пролекарство дабигатрана, биоэквивалентность которого находится в интервале от 80 до 125%, а количество метансульфоната этексилата дабигатрана соответствует от более 150 мг до 300 мг этексилата дабигатрана при лечении 2 раза в сутки.
В настоящем изобретении предлагаются также указанные выше способы, согласно которым этексилат дабигатрана, необязательно в форме его фармацевтически приемлемой соли, вводят в комбинации с антитромбоцитарным агентом, например антитромбоцитарным агентом является аспирин, в количестве, меньшем или равном 100 мг в сутки. Предпочтительным антитромбоцитарным агентом является аспирин, дипиридамол, клопидогрел, абциксимаб, эптифибатид, тирофибан, эпопростенол, стрептокиназа или активатор плазминогена.
В настоящем изобретении предлагаются также указанные выше способы, согласно которым этексилат дабигатрана, необязательно в форме его фармацевтически приемлемой соли, вводят в комбинации с антиаритмическим агентом, например, антиаритмическим агентом является блокатор калиевых каналов, блокатор натриевых каналов, β-блокатор или блокатор кальциевых каналов. Предпочтительными антиаритмическими агентами являются хинидин, прокаинамид, дизопирамид, лидокаин, мексилетин, токаинид, фенитоин, флекаинид, энкаинид, пропафенон, морацизин, пропранолол, эсмолол, метопролол, тимолол, атенолол, миодарон, соталол, дофетилид, ибутилид, эрапамил, дилтиазем, амиодарон, бретилий, верапамил, аденозин или дигоксин.
В другом варианте осуществления настоящего изобретения предлагается также способ профилактики или лечения тромбоза у пациента, нуждающегося в таком лечении, а также способ снижения риска случаев смертельного исхода от сердечно-сосудистых заболеваний по сравнению со стандартным лечением варфарином, при этом указанный способ заключается во введении пациенту от более 150 мг до 300 мг этексилата дабигатрана 2 раза в сутки, необязательно в форме его фармацевтически приемлемой соли. Аналогичным образом настоящее изобретение относится также к способу профилактики или лечения тромбоза у пациента, нуждающегося в указанном лечении, а также к способу снижения риска случаев смертельного исхода от сосудистых заболеваний по сравнению со стандартным лечением варфарином, при этом указанный способ заключается во введении пациенту от более 150 мг до 300 мг этексилата дабигатрана 2 раза в сутки, необязательно в форме его фармацевтически приемлемой соли. Настоящее изобретение относится также к способу профилактики или лечения тромбоза у пациента, нуждающегося в таком лечении, а также к способу снижения риска случаев смертельного исхода от любых причин по сравнению со стандартным лечением варфарином, при этом указанный способ заключается во введении пациенту от более 150 мг до 300 мг этексилата дабигатрана 2 раза в сутки, необязательно в форме его фармацевтически приемлемой соли.
Все способы, описанные в настоящем контексте, можно использовать также для лечения тромбоза, а также тромбоэмболии, системной тромбоэмболии или системной эмболии и т.п.
Краткое описание чертежей
Фиг.1. Случаи тромбоэмболии и массивного кровотечения в клинических испытаниях PETRO и PETRO-Ex. Субъект - возраст = сумма (дата завершения испытаний - дата рандомизации +1) все рандомизированные субъекты/365,25.
Фиг.2. Кумулятивный риск инсульта или системной эмболии при введении дабигатрана в дозах 110 мг и 150 мг 2 раза в сутки и варфарина (W обозначает варфарин, D110 обозначает дабигатран в дозе 110 мг 2 раза в сутки, D150 обозначает дабигатран в дозе 150 мг 2 раза в сутки) и
Фиг.3. Влияние дабигатрана на первичный параметр, по сравнению с варфарином в соответствии с важными подгруппами пациентов.
Подробное описание вариантов осуществления настоящего изобретения
Этексилат дабигатрана представляет собой соединение формулы (I)
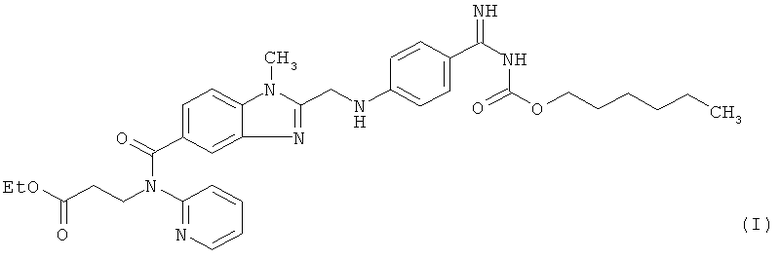
и является прямым пероральным ингибитором тромбина, пригодным для профилактики тромбоэмболии у пациентов, перенесших полную замену колена или бедра, а также пригодным для профилактики инсульта, прежде всего у пациентов, страдающих от мерцательной аритмии. Существуют также другие показания, см., например, опубликованные заявки US №№2008/0015176, 2008/0039391 и 2008/0200514. Соединение формулы (I) описано в заявке WO 98/37075, соответствующей патентам US №№6087380, 6469039, 6414008 и 6710055, в которых описаны соединения с ингибирующей тромбин и пролонгирующей тромбиновое время активностью, N-(2-пиридил)-N-(2-этоксикарбонилэтил)амиды 1-метил-2-[N-[4-(N-н-гексилоксикарбониламидино)фенил]аминометил]бензимидазол-5-илкарбоновой кислоты. Этексилат дабигатрана представляет собой двойное пролекарство дабигатрана, соединения формулы (II)
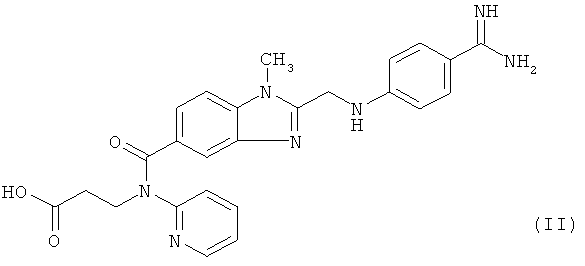
т.е. этексилат дабигатрана превращается в активное соединение - дабигатран только в организме. Этексилат дабигатрана предпочтительно вводят в форме его метансульфоната, хотя в объем настоящего изобретения включены также и другие его соли фармацевтически приемлемых кислот (см., например, заявку US №2006/0183779).
Дабигатран является новым прямым пероральным ингибитором тромбина, характеризующимся преимуществами по сравнению с варфарином и другими АВК. Этексилат дабигатрана представляет собой пероральное пролекарство, быстро превращающееся под действием сывороточной эстеразы в дабигатран, высокоэффективный прямой конкурентный ингибитор тромбина. Период полураспада его в сыворотке составляет от 12 до 17 ч и при этом не требуется проводить периодический анализ состояния пациента (см. Stangier J, Clinical pharmacokinetics and pharmacodynamics of the oral direct thrombin inhibitor dabigatran etexilate, Clin. Pharmacokinet, т.47, cc. 285-295 (2008)). Дабигатран оценивали во время пилотных испытаний с участием пациентов с мерцательной аритмией, а также оценивали эффективность профилактики венозной тромбоэмболии после ортопедического хирургического вмешательства, при этом рекомендуются дозы 150 мг 2 раза в сут. и 220 мг 1 раз в сут. (см. статьи Ezekowitz M.D. и др., Dabigatran with or without concomitant aspirin compared with warfarin alone in patients with nonvalvular atrial fibrillation (PETRO study), Am. J. Cardiol., т.100, cc. 1419-1426 (2007), Eriksson B.I. и др., Dabigatran etexilate versus enoxaparin for prevention of venous thromboembolism after total hip replacement: a randomized, double-blind; non-inferiority trial*,"Lancet, т.370, cc. 949-956 (2007)). Испытания PETRO описаны ниже. Клинические испытания RELY, описанные ниже, представляют собой крупномасштабное рандомизированное испытание при сравнении введения дабигатрана в дозе 110 мг 2 раза в сутки и варфарина в дозе 150 мг 2 раза в сут.
Как описано выше, курс лечения варфарином яляется сложным, а невозможность адекватного анализа состояния пациентов связана с риском. Варфарин характеризуется узким терапевтическим окном, медленным началом и завершением действия, а также связан с непредсказуемой ответной реакцией на величину дозы. Он также взаимодействует с большинством распространенных продуктов питания, лекарственных средств и алкоголем, что приводит к изменению его терапевтического действия, подвергая пациентов риску случаев кровотечения или тромбоза. Таким образом, при лечении варфарином необходимой является точная индивидуальная дозировка и частый анализ. В связи со значительными ограничениями применения АКБ существует необходимость в пероральном антикоагулянте с быстрым началом действия, минимальным взаимодействием с лекарственными средствами и предсказуемым антикоагуляционным действием, не требующим анализа. Прямой пероральный ингибитор тромбина, этексилат дабигатрана, удовлетворяет указанным требованиям. Начало антикоагуляционного действия наблюдается через 1 ч после введения дабигатрана, который вводят 1 или 2 раза в сутки без анализа состояния пациента.
Этексилат дабигатрана не взаимодействует с пищевыми продуктами. Пероральная биодоступность является низкой и составляет в среднем 6,5%. В ходе метаболизма этексилат дабигатрана под действием эстераз тканей превращается в активное соединение дабигатран. Максимальные уровни наблюдаются через 2-3 ч после перорального введения. Период полураспада в плазме составляет от 12 до 17 ч после введения нескольких доз. Дабигатран характеризуется низкой степенью взаимодействия с другими лекарственными средствами, так как данное пролекарство не подвергается метаболизму, не индуцирует и не ингибирует ферменты цитохрома Р-450, участвующие в метаболизме лекарственного средства. Дабигатран в средней степени связывается с белками плазмы (25-35%). Равновесное состояние достигается через 2-3 суток при введении 2 раза в сутки. Приблизительно 80% дабигатрана выводится почками в неизмененном виде. Остальная часть подвергается конъюгации с глюкуроновой кислотой с образованием ацилглюкуронидов, которые выводятся в основном с желчью.
Дабигатран напрямую и обратимо связывается с тромбином с его активным участком и предотвращает расщепление фибриногена до фибрина, при этом блокируется конечная стадия коагуляционного каскада и образования тромба. Дабигатран, в отличие от гепарина, также ингибирует тромбин, связанный с фибирином или продуктами деградации фибрина. Дабигатран характеризуется дозозависимым пролонгированием активированного частичного тромбопластинового времени (аРТТ), времени свертывания экарйна и времени свертывания тромбина. Антикоагулант одновременно влияет на концентрации в плазме. Как и в случае других прямых ингибиторов тромбина, корреляция между аРТТ и концентрациями дабигатрана в плазме является нелинейной со значительной вариабельностью и сглаженной ответной реакцией на высокие концентрации в плазме. Время свертывания экарина и время свертывания тромбина характеризуются более крутыми линейными корреляциями с концентрациями дабигатрана и меньшей вариабельностью.
Дабигатран рекомендован в Европе для профилактики тромбоэмболии после хирургических операций на бедре и колене. В указанных случаях этексилат дабигатрана вводят в течение ограниченного периода времени, в течение которого пациент подвержен риску развития тромбоэмболии, после чего введение прекращают. Указанные интервалы лечения ограничены и в основном составляют от 10 суток до максимально 42 суток.
Вследствие безопасности и эффективности дабигатрана он, прежде всего, является пригодным для профилактики или исключения нежелательных случаев кровотечений. В одном варианте настоящего изобретения предлагается способ профилактики или лечения тромбоза у пациентов, нуждающихся в указанном лечении, при этом пациент не подвергался хирургическому вмешательству, прежде всего, операциям на бедре и колене, в течение по крайней мере приблизительно 50 суток, в течение по крайней мере приблизительно 60 суток, в течение по крайней мере приблизительно 70 суток или более. Способ включает введение этексилата дабигатрана или его фармацевтически приемлемой соли в суточной дозе от 100 мг до 600 мг.
В других вариантах способы можно использовать для профилактики тромбоза, эмболии или инсульта у пациентов, страдающих от мерцательной аритмии (МА). Способ включает введение суточной дозы эффективного количества этексилата дабигатрана, необязательно в форме его фармацевтически приемлемой соли, пациенту, при этом у пациента снижается риск случаев нежелательного кровотечения, прежде всего по сравнению с лечением пациента варфарином.
До публикации результатов клинических испытаний PETRO в данной области техники были описаны различные варианты дозировок и величины доз, необходимые для профилактики инсульта у пациентов, страдающих от МА. Однако врачебный опыт лечения конкретного пациента, страдающего от МА, не позволяет выбрать соответствующую дозировку. Такое решение, прежде всего, является затруднительным в случае, когда врачу приходится выбирать соответствующий способ лечения пациента, страдающего от МА и у которого присутствует по крайней мере один фактор риска случаев нежелательных кровотечений, как описано ниже.
Таким образом, важным объектом настоящего изобретения является разработка способа профилактики инсульта у пациента, страдающего от мерцательной аритмии, при этом, кроме того, у пациента присутствует по крайней мере один фактор риска случаев массивного кровотечения.
Пациенты, страдающие от МА, характеризуются наличием дополнительных факторов риска тромбоза, эмболии и инсульта. Факторы риска инсульта, тромбоза или эмболии включают ранее перенесенный инсульт, ранее перенесенное преходящее ишемическое нарушение мозгового кровообращения, перенесенное тромбоэмболическое осложнение, дисфункцию левого желудочка, возраст по крайней мере 65 лет и высокое кровяное давление, возраст по крайней мере 65 лет и наличие диабета, возраст по крайней мере 65 лет и ишемическая болезнь сердца и возраст по крайней мере 65 лет и заболевание периферических артерий.
Однако способ по настоящему изобретению в основном относится к профилактике тромбоза, эмболии или инсульта, предпочтительно инсульта, у пациентов, которые характеризуются наличием факторов риска случаев массивных кровотечений. Одним важным фактором риска случаев массивных кровотечений является возраст по крайней мере 75 лет. Другим фактором риска случаев массивных кровотечений являются перенесенные ранее случаи кровотечения и т.п. Кроме того, дополнительным фактором риска случаев массивных кровотечений является сниженный клиренс креатинина менее 80 мл/мин, предпочтительно менее 50 мл/мин, наиболее предпочтительно менее 30 мл/мин. Другие факторы риска случаев массивных кровотечений известны врачам и описаны ниже.
Способ включает введение пациенту эффективного количества этексилата дабигатрана, необязательно в форме его фармацевтически приемлемой соли.
Лечение указанных пациентов группы риска случаев массивных кровотечений является прежде всего пригодным, т.к. риск случаев массивных кровотечений у такого пациента снижается по сравнению с лечением варфарином.
МА является хроническим состоянием, которое в настоящее время не поддается лечению, но интенсивность симптомов, которого можно снизить. Пациенты, страдающие от МА, нуждаются в лечении этексилатом дабигатрана в течение всей жизни. Таким образом, существует необходимость в определении интервала доз, пригодных для длительного лечения этексилатом дабигатрана пациентов, страдающих от МА. Кроме того, существует необходимость в определении интервала доз и курса лечения (позологии), которые позволят оптимизировать профилактику тромбоэмболии и свести к минимуму факторы риска, прежде всего случаев кровотечений, прежде всего у пациентов с установленным фактором риска случаев массивных кровотечений. При лечении МА пригодность пациента с факторами риска, например инсульта и случаев кровотечений, для лечения определяет опытный терапевт. В одном варианте терапевт определяет возможность лечения этексилатом дабигатрана пациента, страдающего от МА и характеризующегося наличием дополнительного фактора риска.
Фармацевтически эффективное количество или терапевтически эффективное количество для способов и применений, описанных в данном контексте, включая профилактику тромбоза, эмболии или инсульта у пациента, страдающего от МА (характеризующегося отсутствием или наличием факторов риска случаев массивных кровотечений) и/или не подвергавшегося хирургическому вмешательству в течение определенного периода времени, в основном в течение 10 суток, 42 суток, 50 суток или 90 суток, представляет собой суточную дозу от 100 до 600 мг, включая 150 мг, 160 мг, 170 мг, 180 мг, 190 мг, 200 мг, 210 мг, 220 мг, 230 мг, 240 мг, 250 мг, 260 мг, 270 мг, 280 мг, 290 мг, 300 мг, 310 мг, 320 мг, 330 мг, 340 мг, 350 мг, 375 мг, 390 мг, 400 мг, 425 мг, 450 мг, 475 мг, 500 мг, 525 мг, 550 мг, 575 мг и 600 мг этексилата дабигатрана, необязательно в форме его фармацевтически приемлемой соли. В предпочтительных вариантах этексилат дабигатрана, необязательно в форме его фармацевтически приемлемой соли, вводят в суточной дозе от 75 мг 2 раза в сутки до 300 мг 2 раза в сутки, включая суточную дозу 100 мг 2 раза в сутки, 110 мг 2 раза в сутки, 115 мг 2 раза в сутки, 120 мг 2 раза в сутки, 125 мг 2 раза в сутки, 130 мг 2 раза в сутки, 135 мг 2 раза в сутки, 140 мг 2 раза в сутки, 145 мг 2 раза в сутки, 150 мг 2 раза в сутки, 155 мг 2 раза в сутки, 160 мг 2 раза в сутки, 170 мг 2 раза в сутки, 180 мг 2 раза в сутки, 190 мг 2 раза в сутки, 200 мг 2 раза в сутки, 210 мг 2 раза в сутки, 220 мг 2 раза в сутки, 230 мг 2 раза в сутки, и в любой указанной дозе от 75 мг 2 раза в сутки до 300 мг 2 раза в сутки. В одном предпочтительном варианте этексилат дабигатрана, необязательно в форме его фармацевтически приемлемой соли, вводят в суточной дозе 150 мг 2 раза в сутки или 220 мг 2 раза в сутки.
Другим объектом настоящего изобретения является курс лечения этексилатом дабигатрана, который удовлетворяет указанным выше требованиям и является пригодным для лечения в течение 3 месяцев и более. Вследствие хронической природы заболевания продолжительность периодов лечения увеличивается в еще большей степени. Еще одним объектом настоящего изобретения является разработка такого курса лечения, который является пригодным для пациентов различного возраста, пола, массы тела и физического состояния.
Дабигатран можно переработать в фармацевтические композиции, см., например, опубликованные заявки US №№2005/0038077, 2005/0095293, 2005/0107438, 2006/0183779 и 2008/0069873. Кроме того, дабигатран можно вводить в комбинации с другими активными ингредиентами, см., например, опубликованные заявки US №№2006/0222640, 2009/0048173 и 2009/0075949.
Определение использованных терминов и условных обозначений
Термины, специальным образом не определенные в настоящем контексте, имеют значения, известные специалистам в данной области техники с точки зрения предмета и контекста настоящего изобретения. Однако использованные в описании и прилагаемых пунктах формулы изобретения, если не указано иное, термины и условные обозначения имеют следующие значения.
Термины «слабое кровоизлияние» и «случай слабого кровотечения» обозначают кровотечения, которые не соответствуют критериям массивного кровотечения.
Термины «массивное кровоизлияние» и «случай массивного кровотечения» обозначают снижение уровня гемоглобина по крайней мере на 2,0 г/л или переливание по крайней мере двух единиц крови или симптоматическое кровотечение в критическом отделе или органе.
Термин «угрожающее жизни кровотечение» или «случай угрожающего жизни кровотечения» обозначает подгруппу случаев массивных кровотечений, включающих смертельное кровотечение, симптоматическое внутричерепное кровотечение, кровотечение, приводящее к снижению гемоглобина на более 5,0 г/или требующее переливания более 4 единиц крови или требующее инотропных агентов или хирургического вмешательства.
Термин «варфарин» обозначает антикоагулянт, действующий в качестве ингибитора витамин-К зависимых факторов коагуляции и который выпускается под торговыми названиями Coumadin, Jantoven, Marevan и Waran. Варфарин представляет собой рацемическую смесь R- и S-энантиомеров 3-(α-ацетонилбензил)-4-гидроксикумарина. Варфарин является синтетическим производным кумарина, природным соединением в большинстве растений. Варфарин снижает коагуляцию крови за счет ингибирования эпоксидредуктазы витамина К, фермента, который превращает окисленный витамин К в его восстановленную форму.
Термин «стандартное лечение варфарином» обозначает количество вводимого пациенту варфарина согласно инструкциям ACC/AHA/ESC Practice Guidelines (Fuster и др., JACC, т.48, №4, сс. 854-906 (15 августа 2006), см., например, с.859, рекомендация класса 1, пункты 3 и 4), включенным в настоящее описание'в качестве ссылки. В клинических испытаниях RELY стандартное лечение варфарином используют в качестве препарата сравнения.
Термин «этексилат дабигатрана» обозначает соединение формулы (I), включая его фармацевтически приемлемые соли. Величина однократной дозы этексилата дабигатрана в форме любой соли в мг относится к свободному основанию, т.е. свободному основанию формулы (I). Величину дозы пролекарства этексилата дабигатрана определяют в расчете на массу его свободного основания.
Термин «дабигатран» обозначает соединение формулы (II) в форме свободного основания.
Термин «МА» обозначает мерцательную аритмию сердца.
Термин «ПИМА» обозначает профилактику инсульта при мерцательной аритмии.
Термин «неклапанная фибрилляция предсердий» обозначает МА в отсутствии ревматического стеноза митрального клапана или искусственного клапана сердца.
Термины «случаи тромбоза» или «случаи тромбоэмболии» обозначают тромбоэмболию или инсульт. Термин «тромбоз» обозначает образование кровяного сгустка (тромба) внутри кровеносного сосуда, препятствующего прохождению потока крови через систему кровообращения. При отрыве сгустка от стенки сосуда образуется эмбол. Термин «тромбоэмболия» обозначает образование в кровеносном сосуде сгустка, который отрывается от стенки сосуда и переносится потоком крови с возможностью закупорки другого сосуда. Сгусток может закупорить сосуд в легких (легочная эмболия), мозге (инсульт), желудочно-кишечном тракте, почках или ноге.
Термин «системная эмболия, не относящаяся к ЦНС» или «СЭ», обозначает, что кусочек сгустка крови, оторвавшийся от основного сгустка, часто в левом отделе предсердия, переносится потоком крови и блокирует участок кровообращения в отличие от мозга (при блокировании им мозгового кровообращения развивается инсульт).
Термин «гемморагический инсульт» обозначает кровоизлияние в мозг.
Термин «субарахноидальное кровоизлияние» или «субарахноидальное кровотечение» обозначает кровоизлияние в подпаутинное пространство мозга, в область между паутинной мембраной и мягкой мозговой оболочкой, окружающей мозг.
Термин «субдуральное кровоизлияние» или «субдуральное кровотечение» обозначает кровоизлияние во внутренний менингеальный слой твердой мозговой оболочки, внешнего защитного покрытия мозга, окружающего мозг.
Термин «внутричерепное кровоизлияние» или «ВЧК» обозначает гемморагический инсульт, включающий субдуральное кровотечение и субарахноидальное кровотечение. Геморагический инсульт представляет собой кровотечение внутри мозга и субдуральное кровотечение и субарахноидальное кровотечение на поверхности мозга, но вне его, а ВЧК включает все три указанных различных типа кровотечения.
Термин «международное нормированное соотношение» или «МНС» обозначает соотношение протромбинового времени (ПВ) пациента к нормальному (контрольному) образцу, возведенное в степень величины международного индекса чувствительности тромбопластина (ISI) для ISI использованной аналитической системы: МНС=(ПВиссл/ПВнорм)ISI. Протромбиновое время обозначает время, которое требуется для образования сгустка в плазме после добавления тканевого фактора (выделенного из организма животного). Данная величина является мерой качества внешнего пути (а также и общего пути) коагуляции. Скорость внешнего пути в значительной степени зависит от уровней фактора VII в организме. Фактор VII характеризуется коротким временем полураспада и для его синтеза необходим витамин К. Протромбиновое время увеличивается в результате недостатка витамина К, что может быть связано с варфарином, нарушением абсорбции или недостатком колонизации бактерий в кишечнике (как у новорожденных). Кроме того, ПВ увеличивается при недостаточном синтезе фактора VII (при заболевании печени) или при повышенном потреблении (при синдроме диссеминированной внутрисосудистой коагуляции). Высокий уровень МНС, такой как МНС=5, указывает на высокий риск кровотечения, в то время как МНС=0,5 указывает на высокий риск образования сгустка. Нормальный уровень для здоровых людей составляет 0,9-1,3 и для пациентов, принимающих варфарин, составляет 2,0-3,0, хотя требуемая величина МНС может превышать указанные величины в определенных ситуациях, таких как искусственный сердечный клапан или комбинированное лечение варфарином с низкомолекулярным гепарином (таким как эноксапарин) в режиме интраоперационного лечения.
Термин «смертность от любых причин» обозначает смерть от любых причин, включая смерть от сосудистых заболеваний и смерть от других причин в отличие от сосудистых заболеваний.
Термин «смертельный исход от других причин в отличие от сосудистых заболеваний» обозначает смерть от рака, травмы, нарушения дыхания, инфекционного заболевания, других причин, не связанных с сосудистой системой.
Термин «смертельный исход от сосудистых заболеваний» включает, но не ограничиваясь только ими, смерть от сердечно-сосудистых заболеваний, смерть от инсульта, легочной эмболии, периферической эмболии, кровотечения и неизвестных причин, классифицируемых как сосудистые заболевания.
Термин «смертельный исход от сердечно-сосудистых заболеваний» включает одну подгруппу смертельных исходов от сосудистых заболеваний и включает внезапную смерть/смерть от аритмии (например, зарегистрированная остановка средца, зарегистрированное трепетание желудочков/аритмия, перенесенный инфаркт миокарда или другие) или смерть в результате недостаточности нагнетательной функции сердца (например, сердечная недостаточность/острая сердечная слабость, тампонада сердца, перенесенный инфаркт миокарда или другие).
Термин «факторы риска инсульта, тромбоза или эмболии» обозначает факторы риска, статистически повышающие риск развития инсульта, тромбоза или эмболии. Указанные факторы включают МА, ранее перенесенный инсульт, ранее перенесенное преходящее ишемическое нарушение мозгового кровообращения, перенесенное тромбоэмболическое осложнение, дисфункция левого желудочка, возраст по крайней мере 65 лет и высокое кровяное давление, возраст по крайней мере 65 лет и наличие диабета, возраст по крайней мере 65 лет и коронарная болезнь сердца, и возраст по крайней мере 65 лет и заболевание периферических артерий. Соответственно, факторы риска инсульта, тромбоза и эмболии включают возраст, наследственность, пол, ранее перенесенный инсульт, ранее перенесенное преходящее ишемическое нарушение мозгового кровообращения, перенесенный сердечный приступ, высокое кровяное давление, курение, сахарный диабет, заболевания сонной или другой артерии, фибрилляцию предсердий или другое заболевание сердца, серповидно-клеточную анемию, повышенный уровень холестерина в крови, потребление пищи с высоким содержанием насыщенных жиров, гидрированных жиров, холестерина и натрия, физическую неактивность и ожирение.
Национальная ассоциация по изучению инсульта (США) свидетельствует о том, что пациент подвержен «высокому риску инсульта», если у него присутствует по крайней мере 3 следующих фактора риска: кровяное давление 140/90 или более, уровень холестерина 240 или более, диабет, курение, фибрилляция предсердий, избыточная масса тела, отсутствие физических упражнений, перенесенных инсультов у членов семьи.
Национальная ассоциация по изучению инсульта (США) свидетельствует о том, что пациент подвержен «среднему риску инсульта», если у него присутствует 4-6 следующих факторов: кровяное давление 120-139/80-89, уровень холестерина 200-239, предельные показатели для диабета, попытки бросить курение, отсутствие нарушения сердцебиения, незначительно избыточная масса тела, наличие редких физических упражнений, вероятное отсутствие перенесенных инсультов у членов семьи.
Национальная ассоциация по изучению инсульта (США) свидетельствует о том, что пациент подвержен «низкому риску инсульта», если у него присутствует по крайней мере 6-8 следующих фактора: кровяное давление 120/80 или менее, уровень холестерина 200 или менее, отсутствие диабета, отсутствие курения, отсутствие нарушения сердцебиения, нормальная масса тела, регулярные физические упражнения, отсутствие перенесенных инсультов у членов семьи.
Термин «факторы риска массивных кровотечений» обозначает различные факторы риска, которые статистически повышают у пациента риск случая массивного кровотечения. Факторы риска случаев массивных кровотечений известны терапевту в данной области медицины. В целях безопасности терапевту необходимо выявить факторы риска случаев массивных кровотечений для каждого пациента. Например, факторы риска случаев массивных кровотечений можно группировать по демографическому принципу (возраст, пол и пребывание в учреждении сестринского ухода). Например, возраст пациента 75 лет и более является фактором риска случаев массивных кровотечений. Указанные факторы риска включают также
алкогольную/наркотическую зависимость, сопутствующие заболевания (анемия, рак, инсульт, преходящая ишемическая атака, инфаркт миокарда, гипертензия, сердечная недостаточность/кардиомиопатия, ишемическая болезнь сердца, диабет, печеночная недостаточность или язвенная болезнь) и сопутствующие риски повреждений (риск падений, нарушения когнитивной функции или хирургическое вмешательство в процессе учетной госпитализации). Факторы риска случаев массивных кровотечений присутствуют также у пациентов с перенесенными ранее массивными кровотечениями или со сниженным клиренсом креатинина, например менее 80 мл/мин, менее 50 мл/мин или менее 30 мл/мин.
Термин «2 раза в сутки» обозначает введение суточной дозы в виде 2 отдельных доз, разделенных по времени по крайней мере на 4 ч, предпочтительно по крайней мере на 6 ч и более предпочтительно по крайней мере на 8 ч. Таким образом, доза 150 мг 2 раза в сутки обозначает суточную дозу 300 мг, которую вводят 2 раза в сутки в виде однократной дозы 150 мг.
Дозы, упомянутые в настоящем контексте, рассчитаны на количество свободного основания этексилата дабигатрана (т.е. соединения формулы (I)). Если этексилат дабигатрана вводят в форме одной из его фармацевтически приемлемых солей, то количество используемой соли следует рассчитать из указанной дозы. Например, если этексилат дабигатрана вводят в форме метансульфоната, то доза 110 мг соответствует 172,95 мг метансульфоната этексилата дабигатрана.
Термин «фармацевтически приемлемая соль» обозначает соль соединения по настоящему изобретению, которая по мнению специалиста в области медицины, является пригодной для контактирования с тканями человека и низших животных и не вызывает нежелательную токсичность, раздражение, аллергическую реакцию и т.п., характеризуется соответствующим соотношением польза/риск, в основном является растворимой или диспергируемой в воде или масле, а также проявляет эффективность при использовании по назначению. Указанный термин включает фармацевтически приемлемые кислотно-аддитивные соли и фармацевтически приемлемые основно-аддитивные соли. Так как соединение по настоящему изобретению можно использовать как в форме свободного основания, так и в солевой форме, то на практике применение в солевой форме обозначает применение в форме свободного основания. Перечень пригодных солей приведен, например, в статье S.M. Birge и др., J. Pharm. Sci., т.66, cc.1-19 (1977), которая полностью включена в настоящее описание в качестве ссылки. Наиболее предпочтительной кислотно-аддитивной солью по настоящему изобретению является соль метансульфоновой кислоты и этексилата дабигатрана, которую в данном контексте называют также метансульфонатом этексилата дабигатрана.
Термин «профилактика» обозначает предотвращение возникновения или развития и относится к статистическому снижению риска возникновения события. Термин «профилактика» является синонимом термина «снижение риска» или «наличие низкой заболеваемости». Термины «снижение риска» или «наличие низкой заболеваемости» обозначают статистическое снижение или уменьшение частоты события по крайней мере на 1% или более. Предпочтительно указанное снижение составляет 7% или более, 10% или более, 20% или более, 26% или более, 34% или более, 50% или более, 64% или более и 74% или более. Указанные снижения включают доверительный интервал более 50%, более 75%, более 80%, более 90%, более 95%, более 98% и более 99%. Предпочтительным является доверительный интервал более 95%.
Способы по настоящему изобретению обеспечивают безопасное и терапевтически эффективное количество этексилата дабигатрана, необязательно в форме его фармацевтически приемлемой соли. Термин «безопасное и терапевтически эффективное количество» обозначает количество этексилата дабигатрана, необязательно в форме его фармацевтически приемлемой соли, введение которого согласно настоящему изобретению не вызывает серьезных осложнений, таких как случай массивного кровотечения, которое нельзя остановить медикаментными способами, и указанное количество обеспечивает значительное улучшение состояния пациентов за счет профилактики или лечения тромбоза. Установлено, что терапевтически эффективное количество может изменяться от пациента к пациенту в зависимости от его возраста, массы тела, тяжести симптомов, общего состояния здоровья, физического состояния и т.п. Обычно терапевтически эффективное количество этексилата дабигатрана, необязательно в форме его фармацевтически приемлемой соли, составляет суточную дозу приблизительно от 100 мг до приблизительно 600 мг, более предпочтительно терапевтически эффективное количество этексилата дабигатрана, необязательно в форме его фармацевтически приемлемой соли, составляет пероральную дозу 2 раза в сут от 75 мг до приблизительно 200 мг, и наиболее предпочтительно терапевтически эффективное количество этексилата дабигатрана, необязательно в форме его фармацевтически приемлемой соли, составляет пероральную дозу 110 мг или 150 мг 2 раза в сутки. Пациентам, характеризующимся наличием по крайней мере одного фактора риска случая массивного кровотечения, такого как описано и определено в данном контексте, предпочтительно вводить дозу 110 мг 2 раза в сутки этексилата дабигатрана, возможно в форме фармацевтически приемлемых кислотно-аддитивных солей.
Терапевтически эффективное количество можно также определить по уровню дабигатрана в плазме крови пациента, необязательно в форме его фармацевтически приемлемой соли. Обычно уровень в плазме составляет приблизительно от 20 нг/мл до приблизительно 180 нг/мл, приблизительно от 43 нг/мл до приблизительно 143 нг/мл, приблизительно от 50 нг/мл до приблизительно 120 нг/мл, приблизительно от 50 нг/мл до приблизительно 70 нг/мл или приблизительно от 60 нг/мл до приблизительно 100 нг/мл.
За счет двойной природы пролекарства термин «биоэквивалентное терапевтически эффективное количество этексилата дабигатрана» обозначает любой состав этексилата дабигатрана в форме свободного основания или его фармацевтически приемлемых солей или любого производного пролекарства дабигатрана формулы (III), как указано в данном контексте, в форме свободного основания или его фармацевтически приемлемых солей, который обеспечивает уровни дабигатрана в плазме, сопоставимые с уровнем, который достигается при введении этексилата дабигатрана в качестве препарата сравнения. В зависимости от национальных или региональных регулятивных норм биоэквивалентность устанавливается при соответствии уровней исследуемого лекарственного средства или состава в плазме определенному интервалу в процентах. Согласно инструкциям управления по контролю за пищевыми продуктами и лекарственными средствами США и Европейского агентства лекарственных средств биоэквивалентность соответствует интервалу от 80 до 125% и утверждается в инструкциях соответствующих агентств.
Определение уровней дабигатрана в плазме
Несмотря на то, что обычно не требуется клинический анализ дабигатрана, можно использовать надежный лабораторный способ лабораторного анализа фармакодинамических эффектов дабигатрана для некоторых способов по настоящему изобретению. Указанный способ анализа определения уровней дабигатрана в плазме можно использовать для исследования не только кинетики активности лекарственного средства в организме, но и для оптимизации дозы и позологии лекарственного средства, которые можно использовать, чтобы исключить передозировку и анализ фармакодинамических эффектов этексилата дабигатрана.
Один указанный способ включает лиофилизированную форму дабигатрана, которую можно использовать в качестве препарата сравнения при определении фармакодинамических эффектов этексилата дабигатрана, прежде всего в способе количественного определения дабигатрана в образцах крови. Способ заключается в определении времени образования сгустков крови, которые инициируются очищенным тромбином человека. Таким образом, для измерения концентрации дабигатрана в плазме аликвотную часть исследуемого образца плазмы разбавляют физиологическим солевым раствором, затем инициируют коагуляцию при добавлении постоянного количества тромбина человека высокой степени очистки в α-форме, и измеренное время коагуляции прямо пропорционально изменяется в зависимости от концентрации дабигатрана в исследуемом образце. В настоящей заявке указанный способ называется «способом с использованием стандартизированного лиофилизированного дабигатрана».
Для определения концентрации дабигатрана в исследуемом образце крови согласно указанному способу следует получить калибровочную кривую, т.е. зависимость времени коагуляции от концентрации дабигатрана в стандартных образцах: при получении указанной калибровочной кривой используют различные стандарты дабигатрана или препараты сравнения с определенной концентрацией. Указанные стандарты дабигатрана являются стабильными, т.е. количество дабигатрана не изменяется при его хранении при -20°С или более и их можно использовать в способе для получения надежной калибровочной кривой.
Этексилат дабигатрана способен кристаллизоваться и образовывать различные полиморфные формы, является гигроскопичным (т.е. образуются различные гидратированные формы) и плохо растворим в воде. Таким образом, лиофилизированную форму дабигатрана формулы (II) используют в качестве калибровочного вещества для дабигатрана. Для получения лиофилизированной формы дабигатрана определенное количество лекарственного средства на основе дабигатрана растворяют в водном растворе кислоты, разбавляют водой и полученный раствор используют в качестве концентрированного раствора для получения различных образцов препарата сравнения дабигатрана. Соответствующие аликвотные части концентрированного раствора дабигатрана добавляют в антикоагулированную плазму человека, полученную у здоровых добровольцев (пул плазмы человека) согласно способам, известным в данной области техники, при этом получают растворы с различными концентрациями дабигатрана. Определенные объемы указанных различных растворов переносят в пригодные пробирки и лиофилизируют досуха в специальной установке для лиофилизации, при этом получают стабильные лиофилизированные формы дабигатрана с известными концентрациями, пригодные для получения калибровочной кривой. Указанный лиофилизированный дабигатран быстро растворяется и таким образом его можно использовать в качестве препарата сравнения для определения концентрации дабигатрана в образцах крови с неизвестными концентрациями по времени коагуляции, которое измеряют после добавления равного количества тромбина человека высокой степени чистоты в α-форме в образец с неизвестной концентрацией. Указанные стандартные образцы лиофилизиронного дабигатрана и тромбина человека высокой степени чистоты в α-форме можно упаковывать в наборы. Контроль точности анализа можно определить при периодическом анализе образца с использованием известного количества дабигатрана.
pH Водного раствора кислоты, используемого для растворения дабигатрана, предпочтительно составляет ≤3, более предпочтительно ≤2. Несмотря на то, что можно использовать множество различных кислот, предпочтительными кислотами являются хлористоводородная кислота, бромистоводородная кислота, фосфорная кислота, метансульфоновая кислота, уксусная кислота, фумаровая кислота, лимонная кислота, винная кислота или малеиновая кислота, предпочтительно хлористоводородная кислота. Антикоагулированную плазму человека можно получить согласно любым стандартным способам и ей предпочтительно является антикоагулированная плазма человека, содержащая цитрат, или антикоагулированная плазма человека, содержащая EDTA.
Пример анализа приведен ниже. Хронометрический анализ коагуляции проводили с использованием двух шаровых коагулометров Behnk CL4 (Behnk Elektronik, Германия) согласно инструкциям по эксплуатации. Использовали метод анализа Hemoclot Thrombin Inhibitor (HYPHEN BioMed, Франция). Из набора использовали 2 следующих реагента: (1) лиофилизированной нормальной плазмы, содержащей цитрат (реагент 1) и (2) лиофилизированный тромбин человека высокой степени чистоты в α-форме со стабилизирующими добавками (реагент 2).
Эффективность коагуляционного анализа образцов плазмы с дабигатранаом оценивали с использованием программы "Analyse-it" для приложения Excel, версия 2.09, программное обеспечение Analyse-it, Ltd. РО Box 103, Лидс LS27 7WZ Англия, Великобритания.
Стадия А
Получение препаратов сравнения лиофилизированного дабигатрана 5,55 мг Дабигатрана формулы (II) растворяли в 200 мкл 1М НСl и разбавляли в сверхчистой воде до конечного объема 50 мл. Полученный концентрированный раствор дабигатрана с концентраций 111 мг/мл хранили при 4°С. Для получения препаратов сравнения дабигатрана использовали плазму человека, содержащую цитрат и полученную у здоровых добровольцев (пул плазмы человека). Аликвотные части концентрированного раствора дабигатрана разбавляли плазмой человека, содержащей цитрат, при этом получали растворы с различными конечными концентрациями дабигатарана 100, 500, 1500 и 2000 нМ. Аликвотные части плазмы человека объемом 500 мкл с концентрациями дабигатрана 100, 500, 1500 или 2000 нМ переносили в полипропиленовые пробирки и лиофилизировали на вакуумной установке с центрифугой Christ Alpha RVC, Тур СМС-2 досуха в течение пиблизительно 8 ч (давление 8 мбар). Лиофилизированные образцы дабигатрана хранили при -20°С.
Стадия Б
Получение стандартов (для калибровочной кривой)
В каждый флакон, содержащий препараты сравнения дабигатрана при концентрации 0 (контроль), 100, 500, 1500 и 2000 нМ, полученные на стадии А, добавляли по 0,5 мл сверхчистой воды, осторожно перемешивали и выдерживали при комнатной температуре в течение 15 мин. Препарат сравнения в плазме разбавляли в соотношении 1:8, например, 100 мкл стандарта и 700 мкл физиологического раствора NaCl. В кюветы коагулометра добавляли по 50 мкл образца препарата сравнения (определение в двойном повторе). Измерение каждого препарата сравнения описано на стадии Д.
Стадия В
Получение реагентов
Рассчитывали необходимый объем реагентов для числа образцов, которые необходимо анализировать в течение 1 дня. Растворяли содержимое каждого флакона с реагентом 1 и реагентом 2 в 1 мл сверхчистой воды, осторожно перемешивали и выдерживали при комнатной температуре в течение 15 мин. Ниже приведена стабильность полученных реагентов: реагент 1: от +18°С до +25°С (24 ч), от +2°С до +8°С (48 ч) и -20°С (2 месяца) и реагент 2: от +18°С до +25°С (24 ч), от +2°С до +8°С (48 ч) и -20°С (2 месяца).
Стадия Г
Сбор и подготовка образцов плазмы
В образец крови добавляли 0,109 М антикоагулянт, цитрат, тринатриевую соль лимонной кислоты, соотношение кровь/цитрат 9:1. После центрифугирования в течение 20 мин при 2,5 г супернатант плазмы отделяли декантацией. Ниже приведена стабильность плазмы: от +18°С до +25°С (8 ч), от 2°С до +8°С (24 ч), ≤-20°С (до 6 месяцев). Образцы оттаивали при +37°С в течение не более 45 мин. Хранили оттаянные образцы при комнатной температуре. Образец плазмы необходимо разбавить в соотношении 1:8, например, 100 мкл стандарта и 700 мкл физиологического раствора NaCl.
Стадия Д
Методика анализа
Приведенную ниже методику анализа проводили сначала с использованием образцов препаратов сравнения, полученных на стадии Б. После получения калибровочной кривой соответствующим образом анализировали образцы плазмы крови, полученные на стадии Г.
Образцы (препарат сравнения или плазму) осторожно перемешивали при встряхивании. Переносили по 50 мкл каждого образца плазмы (полученных на стадии Б или Г) в 2 кюветы (каждый образец измеряли в двух повторах). В кювету добавляли 100 мкл реагента 1 (предварительного инкубированного при 37°С). Одновременно включали таймер для инкубации в течение 1 мин. После завершения инкубационного периода в кювету добавляли 100 мкл реагента 2 (предварительного инкубированного при 37°С). Включали секундомер и измеряли время до остановки вращения шара коагулометра Behnk CL4 (время образования сгустков крови, с). Программное обеспечение прибора рассчитывает среднее время образования сгустков крови (с) в двойном повторе. Результат обоих измерений и среднее время образования сгустков крови распечатывали на принтере.
Стадия Е
Получение калибровочной кривой
Времена коагуляции, полученные при анализе образцов препаратов сравнения при концентрации 0 (контроль), 100, 500, 1500 и 2000 нМ (можно использовать более широкий интервал концентраций и дополнительные концентрации, например, 250 нМ), наносили на график зависимости от концентрации стандартного дабигатрана в виде диаграммы разброса данных с использованием программы электронных таблиц (программы MS Excel или аналогичные программы). Калибровочную кривую получали методом простой линейной регрессии. При определении времени коагуляции соответствующую концентрацию дабигатрана в образце плазмы можно определить непосредственно с использованием калибровочной кривой. Можно использовать качественную контрольную систему с использованием лиофилизированных образцов дабигатрана при определенных концентрациях, например, 100, 500 и 1500 нМ. Использование качественной контрольной системы для измерения времени коагуляции и последующее определение соответствующей концентрации дабигатрана с использованием калибровочной кривой позволяет оценивать точность анализа. Точность анализа оценивали при сравнении контрольного образца с известной требуемой концентрацией дабигатрана и с рассчитанной концентрацией по данным качественного контроля с использованием времени коагуляции и калибровочной кривой.
Фармацевтические композиции по настоящему изобретению, содержащие этексилат дабигатрана, необязательно в форме его фармацевтически приемлемой соли, доставляются в организм в течение времени, достаточного для обеспечения требуемого физиологического эффекта, т.е. профилактики или лечения тромбоза. Обычно фармацевтические композиции вводят в виде пероральной композиции 2 раза в сутки. Композиции можно вводить в определенное время или в неограниченные периоды времени.
При введении способом по настоящему изобретению этексилат дабигатрана, необязательно в форме его фармацевтически приемлемой соли, обеспечивает для пациента безопасный и терапевтически эффективный способ профилактики или лечения тромбоза. Этексилат дабигатрана, необязательно в форме его фармацевтически приемлемой соли, может предотвращать развитие тромбоза и при этом не наблюдаются случаи нежелательных кровотечений.
Дабигатран можно перерабатывать в фармацевтические составы, например, см. опубликованные заявки US №№2005/0038077, 2005/0095293, 2005/0107438, 2006/0183779 и 2008/0069873. Кроме того, дабигатран можно вводить в комбинации с другими активными ингредиентами, например, см. опубликованные заявки US №№2006/0222640, 2009/0048173 и 2009/0075949. Стандартный фармацевтически приемлемый носитель или разбавитель можно использовать для обеспечения условий хранения, введения и/или обеспечения требуемого эффекта терапевтических ингредиентов. Пригодный носитель должен проявлять стабильность, т.е. не должен взаимодействовать с другими ингредиентами в составе. Такие носители известны в данной области техники. Подробное описание состава и выбор фармацевтически приемлемых носителей, стабилизаторов и т.п. приведен в книге Remington's Pharmaceutical Sciences (18ое изд., Mack Pub. Co.: Итон, Пенсильвания, 1990), включенной в настоящее описание в виде ссылки.
Кроме того, было установлено, что этексилат дабигатрана или его фармацевтически приемлемую соль можно вводить совместно с антитромбоцитарным агентом. Антитромбоцитарные агенты включают ингибиторы циклооксигеназы, такие как аспирин, ингибиторы рецептора аденозиндифосфата (АДФ), ингибиторы фосфодиэстеразы, ингибиторы гликопротеина ПВ/IIIА, ингибиторы повторного захвата аденозина и т.п. В одном варианте антитромбоцитарным агентом является аспирин, который вводят в дозе 100 мг в сутки или менее.
Приведенные ниже примеры представлены для иллюстрации и никоим образом не ограничивают сущность и объем изобретения.
Экспериментальная часть
Результаты испытаний PETRO и PETRO-ex
Эффективность и безопасность этексилата дабигатрана для пациентов с мерцательной аритмией оценивали в ходе клинических испытаний фазы 2 «Профилактики случаев эмболии и тромбоза у пациентов с персистирующей мерцательной аритмией» (PETRO). Данные испытания представляет собой 12-недельное лечение этексилатом дабигатрана, в отдельности или в комбинации с аспирином (ASA) по сравнению со стандартным антикоагуляционным курсом лечения варфарином в отсутствии аспирина пациентов с хронической мерцательной аритмией. В данном испытании 502 пациента рандомизировали в группы лечения варфарином (международное нормированное соотношение (МНС) составляет 2-3) или этексилатом дабигатрана (50 мг 2 раза в сутки, 150 мг 2 раза в сутки и 300 мг 2 раза в сутки) и тремя дозами аспирина (0, 81 мг или 325 мг 1 раз в сутки). Первичными конечными параметрами являлись случаи кровотечения и изменения D-димера. В ходе испытаний наблюдалось 2 случая системной тромбоэмболии, оба в группе пациентов, которым вводили этексилат дабигатрана в дозе 50 мг 2 раза в сутки. 4 случая (6%) массивных кровотечений зарегистрировано в группе пациентов, которым вводили этексилат дабигатрана в дозе 300 мг 2 раза в сутки и аспирин ASA. Незначительные кровотечения зависели от величины дозы. Повышенный уровень трансаминаз (более чем в три раза верхнего предела нормы (ВПН)) наблюдали у 0,9% (у 4 из 432) пациентов, которым вводили этексилат дабигатрана. Изменение уровней D-димера у пациентов, которым вводили этексилат дабигатрана, оказалось сравнимым с изменением у пациентов, которым вводили варфарин.
Для определения долгосрочной безопасности этексилата дабигатрана пациентам, которых рандомизировали в группу лечения этексилатом дабигатрана в ходе испытаний PETRO и которые завершили испытания без осложнений, предлагали принять участие в расширенных испытаниях, испытании PETRO-Ex, результаты которого представлены ниже.
Способы
Клинические испытания PETRO-Ex проводили в 52 центрах в США, Дании, Нидерландах и Швеции. Протокол был разработан в координационном комитете. Управление данными и статистический анализ проводили на фирме Boehringer Ingelheim. План статистического анализа был разработан координационным комитетом. Все авторы пришли к согласию в оценке результатов.
Главной целью была оценка долгосрочной безопасности и эффективности дабигартана у пациентов с мерцательной аритмией, определенных по частоте случаев массивного кровотечения, системной тромбоэмболии и нарушений функции печени.
PETRO-Ex представляет собой долгосрочное, расширенное рандомизированное испытание с участием пациентов, которые прошли испытания PETRO при лечении дабигатраном и завершили испытания согласно протоколу. В отличие от испытаний PETRO, которые проводили двойным слепым методом в отношении дозировки этексилата дабигатрана, испытания PETRO-Ex проводили с открытой этикеткой. Испытания PETRO-Ex начинали в то время, когда еще продолжались испытания PETRO и исследователи еще не были ознакомлены с курсом лечения пациентов до завершения испытаний PETRO. После этого с результатами можно было ознакомиться.
Данные суммировали описательно, гипотезы не использовали. Случаи анализировали на основании лечения после проявления симптомов. Частоту случаев регистрировали в виде числа пациентов, у которых проявлялись симптомы случаев, а также нормировали на 100 пациенто-лет в соответствующей группе лечения. Риски событий сравнивали в различных группах по соотношению рисков с доверительным интервалом 95% (двухфакторный анализ).
Пациентов включали в испытания, если они удовлетворяли всем перечисленным ниже критериям: возраст >18 лет, предшествующее лечение дабигатраном в ходе испытаний PETRO без преждевременного прерывания лечения, пароксизмальная, персистирующая или перманентная (хроническая) мерцательная аритмия неревматического происхождения, зарегистрированная на электрокардиограмме до включения в испытания PETRO, по крайней мере один дополнительный фактор риска инсульта: гипертензия, диабет, сердечная недостаточность или дисфункция левого желудочка, ишемический инсульт в анамнезе или преходящее нарушение мозгового кровообращения, возраст более 75 лет и коронарная болезнь сердца в анамнезе (т.е. перенесенный инфаркт миокарда, стенокардия, положительный тест на стресс, перенесенная операция на коронарной артерии, шунтирование или атеросклеротическое повреждение(я), диагностированные методом коронографии). Информированное письменное согласие было получено от всех пациентов.
Пациентов исключали из испытаний, если у них диагностирован порок сердца, предполагающий значительное увеличение риска тромбоэмболитического осложнения (например, клинически значимый стеноз митрального клапана или искусственные клапаны сердца), кардиостимуляция, запланированная на период участия пациента в испытаниях, противопоказания к антикоагуляционной терапии (внутричерепное кровотечение в анамнезе, кровотечение в желудочно-кишечном тракте в течение предыдущих 3 месяцев, перенесенное тяжелое кровотечение при лечении варфарином с терапевтическим международным нормализованным соотношением (МНС), регулярный прием нестероидных противовоспалительных средств, геморрагический диатез), а также другие массивные кровотечения в течение последних 6 месяцев (кроме кровотечений в желудочно-кишечном тракте) и тяжелая почечная недостаточность со скоростью клубочковой фильтрации<30 мл/мин.
Пациентов, завершивших испытания PETRO, которым вводили дозу 50 мг дважды в сутки, включали в группу с дозой 150 мг в сутки в ходе испытаний PETRO-Ex (N=93 пациента). Всем остальным пациентам сначала вводили такую же дозу этексилата дабигатрана, которую они получали в ходе испытаний PETRO. Пациенты, дозу которых уменьшали до 50 мг в сутки на основании скорости клубочковой фильтрации<50 мл/мин в ходе испытаний PETRO, исключали из долгосрочных испытаний, пациентам, дозу которых снижали до другого уровня, продолжали вводить указанную дозу один раз в сутки.
Результаты
Из 432 пациентов, участвовавших в испытаниях PETRO, которым вводили дабигатран, 396 завершили испытания согласно протоколу, из них 361 пациент (91%) был включен в испытания PETRO-Ex. Пациентов из группы лечения варфарином в ходе испытаний PETRO исключали из испытаний PETRO-Ex. В начале испытаний PETRO-Ex средний возраст пациентов составлял 69,7±8,2 года, 16,3% пациентов составляли женщины, средняя продолжительность мерцательной аритмии у пациентов составляла 4,2 года, у пациентов присутствовало в среднем 2 фактора риска инсульта. Аспирин в ходе испытаний PETRO-Ex использовали на основании мнения исследователя.
Из-за высокой частоты массивных кровотечений в группе пациентов, которым вводили 300 мг лекарственного средства дважды в сутки (N=162), через несколько месяцев расширенных испытаний с введением аспирина или без него, Независимый комитет по анализу данных и безопасности субъектов испытаний (DSMB) рекомендовал, а управляющий комитет утвердил перевод всех пациентов, которым вводили 300 мг лекарственного средства дважды в сутки, на курс лечения 300 мг в сутки или 150 мг дважды в сутки. Аналогичным образом из-за повышенной частоты тромбоэмболических осложнений в группе пациентов, которым вводили дозы менее 300 мг/сутки (N=103), по рекомендации DSMB указанных пациентов рекомендовали перевести на курс лечения с увеличением дозы: 300 мг в сутки или 150 мг дважды в сутки. Управляющий комитет утвердил данную рекомендацию. Большинству пациентов вводили этексилат дабигартана в дозе 150 мг дважды в сутки (683,9 пациенто-лет), а затем 300 мг в сутки (198,7 пациенто-лет), 300 мг дважды в сутки (82,0 пациенто-лет), 150 мг в стуки (58,5 пациенто-лет) и 50 мг дважды в сутки (23,5 пациенто-лет). Суммарное воздействие отражает оба испытания вместе, PETRO и PETRO-Ex.
Случаи тромбоэмболии и инсультов в значительной степени снижались в группе, в которой вводили этексилат дабигартана в дозе 150 мг дважды в сутки (1% в год) и 300 мг дважды в сутки (1,2% в год). В ходе лечения в дозе ≤150 мг/сутки этексилата дабигатрана годовая частота тромбоэмболических осложнений составляет более 5,0 на 100 пациенто-лет.
Частота случаев массивных кровотечений значительно увеличивалась в группе, в которой вводили этексилат дабигатрана в дозе 300 мг дважды в стуки, по сравнению с группами, в которых вводили лекарственное средство в дозе 150 мг дважды в сутки и 300 мг один раз в сутки (12,2 по сравнению с 4,2 и по сравнению с 2,5% в год). Три случая массивных кровотечений наблюдались в группе, в которой вводили дозу 150 мг в сутки. Вместе с данными по группе, в которой вводили 50 мг дважды в сутки, частота событий массивных кровотечений в группе, в которой вводили лекарственное средство в дозах ≤150 мг/сутки, составляла 3,7% в год (фиг.1). Частота событий кровотечений значительно повышалась при совместном введении аспирина (8,5% по сравнению с 3,2% в год, соотношение рисков 2,70, доверительный интервал 1,49-4,86). Пять случаев массивных кровотечений привели к смертельному исходу, 4 случая при введении дозы 150 мг дважды в стуки и 1 случай при введении дозы 300 мг в сутки. Три из указанных фатальных случаев составляли внутричерепное кровотечение, один случай кровотечения в желудочно-кишечном тракте и один случай расслоения аорты. Зарегистрирован также один случай внутричерепного кровотечения, не приведший к смертельному исходу.
Данные, представленные в таблице 1, иллюстрируются на фиг.1.
В ходе испытаний у 18 пациентов (1,7% в год) наблюдался повышенный уровень печеночных трансаминаз, ACT или АЛТ>3х ВПН, из них у 11 пациентов (1,1% в год) наблюдался уровень трансаминаз (ACT или АЛТ) >5×ВПН. У четырех пациентов (0,4% в год) наблюдалось сопутствующее повышение билирубина >2×ВПН и трансаминазы >3×ВПН в течение 30 дней. Все описанные случаи наблюдались из-за других клинических причин.
Во всех 9 из 18 случаев АЛТ или ACT>3×ВПН после обследования был поставлен объяснительный клинический диагноз. В 10 из 16 случаев лечения нарушения функции печени были связаны с продолжением введения дабигатрана, а в 5 случаях нарушения наблюдались после прекращения введения дабигатрана, один пациент с нарушенной функцией печени во время лечения умер от сердечной недостаточности и сепсиса, что было связано с нарушениями функции печени. Второй пациент с неизвестным исходом был исключен из испытаний дабигатрана (из-за кровотечения) за три недели до развития нарушений функций печени (после завершения лечения). Подробное описание индивидуальных пациентов с нарушениями функции печени и другими гепатобилиарными нарушениями, показаны в таблице 2.
АЛТ - аланинтрансаминаза, ACT - аспартаттрансаминаза, билирубин - общий билирубин, Ж - женщина, М - мужчина, ВПН - верхний предел нормы
Серьезные побочные действия зарегистрированы у 184 пациентов (51%), включая случаи кровотечения и тромбоза. Наиболее частым видом зарегистрированных побочных эффектов являются нарушения сердечной деятельности (80 пациентов, 22%) с последующими инфекциями (34 пациента, 9,4%), расстройства нервной системы (33 пациента, 9,1%) и расстройства желудочно-кишечного тракта (28 пациентов, 7,8%). Других случаев побочных эффектов кроме случаев кровотечений и тромбов не наблюдалось.
Случаи массивных кровотечений
Частота случаев кровотечения увеличивалась пропорционально вводимой дозе. Случаи массивных кровотечений наиболее часто наблюдались у пациентов, которым вводили 150 мг или более этексилата дабигатрана дважды в сутки, самая высокая частота кровотечений наблюдалась у пациентов, которым вводили 300 мг этексилата дабигатрана дважды в сутки. Дозы 300 мг дважды в сутки являются непереносимыми. При введении дозы в 150 мг дважды в сутки случаи массивных кровотечений незначительно повышались по сравнению с предыдущими испытаниями антикоагулянтов у пациентов с мерцательной аритмией (таблица 3). Все пять случаев кровотечений с летальным исходом при введении дабигатрана (0,5% в год) зарегистрированы при введении 150 мг дважды в сутки (4 пациента) или при введении 300 мг в сутки (1 пациент). Частота случаев внутричерепного кровотечения 0,4% в год находится в пределах интервала от 0,1% до 0,6% по сравнению с опубликованными величинами в результате других антитромбоэмболических испытаний. Наблюдался также повышенный риск кровотечения при совместном введении аспирина. В клинических испытаниях RELY, описанных подробно ниже, дозы аспирина более 100 мг в сутки не допускались.
го средства или воздействия
раном
но м
нию с варфари
ном
рин ASA 75 мг/сут по сравнению с варфа
рином
ран) 1,4% (варфарин)
рин)
го средства или воздействия
ном
ном
ном
ран 36 мг дважды в сутки) 1,2% (варфарин)
ACTIVE W: испытания при лечении МА клопидрогелем совместно с ирбесартаном для профилактики сосудистых осложнений, BAFTA испытания в Бирмингеме при лечении МА у пожилых пациентов, PETRO Ex - расширенные испытания профилактики случаев эмболии и тромболии у пациентов с персистентной МА, SPORTIF - испытания профилактики инсульта при пероральном введении ингибитора тромбина у пациентов с МА, ВПН - верхний предел нормы
Эффективность при профилактике тромбоэмболии
Некоторые данные свидетельствуют о том, что этексилат дабигатрана может проявлять эффективность при профилактике инсульта. В двух наибольших дозах частота инсульта и системной тромбоэмболии составляет приблизительно 1% в год, что является наилучшим опубликованным результатом для пациентов с мерцательной аритмией с риском инсульта от умеренной до высокой степени. Эти данные являются аналогичными или улучшенными по сравнению с результатами, полученными в результате стандартной пероральной терапии варфарином. В настоящий момент проводятся крупномасштабные испытания в третьей фазе с использованием указанной дозы. Интересно отметить, что частота инсультов при введении дозы в 300 мг один раз в сутки выше по сравнению с введением дозы в 150 мг дважды в сутки, хотя эти различия не являются статистически значимыми.
Риск-польза
Данные указанных длительных испытаний с открытой этикеткой с использованием нескольких доз этексилата дабигатрана позволяют оценивать пределы как эффективности, так и безопасности. Дозы 150 мг в сутки или менее приводят к недопустимо высокой частоте осложнений тромбоэмболии с низкой частотой кровотечений, в то время как дозы 600 мг в сутки приводят к недопустимо высокой частоте кровотечений, но низкому риску инсульта. Соотношение риск-польза в случае дозы 150 мг дважды в сутки улучшается по сравнению с введением дозы 300 мг один раз в сутки с более низкой частотой инсультов, но более высоким риском кровотечения. При фармакокинетических исследованиях разделенной дозы наблюдается пик соотношения концентрации в плазме 2:1 по сравнению с соотношением 6:1 в случае равной общей дозы, введенной один раз в сутки, что является возможным объяснением наблюдаемых различий. При введении в дозе 150 мг дважды в сутки наблюдается наилучший баланс частоты тромбоэмболии и кровотечения у пациентов, у которых отсутствуют дополнительные факторы риска массивных кровотечений.
Из данных, представленных в таблице 1 и на фиг.1 видно, что введение этексилата дабигатрана дважды в сутки является предпочтительным. Из-за достаточно низкой пероральной биодоступности этексилата дабигатрана с одной стороны и относительно высокого клиренса дабигатрана с другой стороны, схема введения дважды в сутки обеспечивает более постоянный уровень концентрации дабигатрана в плазме.
Как показано при прямом сравнении курсов введения 300 мг один раз в сутки и 150 мг дважды в сутки, общее число тромбоэмболических осложнений снижается при введении дважды в сутки при введении одной и той же суточной дозы. Таким образом, введение дважды в сутки является предпочтительным по сравнению с введением один раз в сутки для сопоставимых суточных доз.
Данные, представленные в таблице 1 и на фиг.1, позволяют сравнить различные дозы этексилата дабигатрана в отношении частоты случаев тромбоэмболии и риска массивных кровотечений. Первый параметр представлен в виде числа осложнений тромбоэмболии на 100 лет, а второй параметр - в виде числа случаев кровотечений на 100 лет. «Год» или «пациенто-год» представляет собой сумму (дата последнего введения лекарственного средства - дата первого введения лекарственного средства +1) для всех пациентов, участвующих в испытаниях/365,25.
При сравнении данных было установлено, что при введении этексилата дабигатрана в дозе 50 мг дважды в сутки наблюдается более 12 случаев на 100 лет, что недостаточно для достижения удовлетворительного снижения случаев тромбоэмболии.
Кроме того, введение этексилата дабигатрана в дозе 300 мг дважды в сутки, хотя и снижает частоту случаев тромбоэмболии (приблизительно 1 случай на 100 лет), но при этом наблюдается достаточно высокая частота случаев кровотечений (более 12 на 100 лет), что является менее пригодным для данной дозы в ходе долговременного курса лечения.
С другой стороны, введение дозы 150 мг один раз в стуки и 300 мг один раз в сутки снижает защиту от случаев тромбоэмболии (приблизительно 5 случаев для дозы 150 мг один раз в сутки и более 2 случаев для дозы 300 мг один раз в сутки), а число случаев кровотечения сохраняется приблизительно на том же уровне по сравнению с дозой 150 мг дважды в сутки.
В случае введения этексилата дабигатрана в дозе 150 мг, дважды в сутки, с одной стороны, обеспечивается улучшенная защита от случаев тромбоэмболии по сравнению с дозой 150 мг в сутки и 300 мг в сутки, а с другой стороны, обеспечивается улучшенная защита от кровотечений по сравнению с введением 300 мг дважды в сутки при сохранении того же уровня защиты от тромбоэмболии, что и при введении 300 мг дважды в сутки. Таким образом, у пациентов, у которых отсутствует дополнительный фактор риска массивного кровотечения, как описано в данном контексте, описанная выше предпочтительная доза от 140 мг дважды в сутки до 160 мг дважды в сутки, предпочтительно 150 мг дважды в сутки, является пригодной для лечения мерцательной аритмии у человека в течение 3 месяцев, предпочтительно в течение 6 месяцев, более предпочтительно в течение 9 месяцев, еще более предпочтительно в течение 12 месяцев, наиболее предпочтительно в течение 24 месяцев, более предпочтительно 48 месяцев и более предпочтительно в течение 10 или более лет.
В связи с природой пролекарства, курс введения по настоящему изобретению можно использовать в случае других сложных эфиров дабигатрана или солей формулы (III)
где R обозначает любой остаток сложного эфира с молекулярной массой до 300, предпочтительно формулы -С(O)-O-(С1-С8)алкил или -С(O)-O-(С3-С8)циклоалкил, причем алкил необязательно содержит разветвленную или неразветвленную цепь, и алкил и циклоалкил необязательно содержат заместитель R', обозначающий -(С1-С8)алкил или -(С3-С8)циклоалкил, где алкил содержит разветвленную или неразветвленную цепь, и алкил и циклоалкил необязательно замещены.
Любая композиция или модификация соединения формулы (I) или (III) с установленной биодоступностью от 80% до 125%, предпочтительно от 80% до 120%, оцененная при введении этексилата дабигатрана по настоящему изобретению, может обеспечивать такие же или сравнимые благоприятные свойства. «Биодоступность» обозначает результаты анализа для оценки биоэквивалентности, рекомендованного Управлением по контролю за пищевыми продуктами и лекарственными средствами США или Европейского агентства лекарственных средств, для оценки и отнесения к классу непатентованных продуктов со ссылкой на уже зарегистрированный (утвержденный) исходный продукт.
Настоящее изобретение также включает стандартную лекарственную форму этексилата дабигатрана, включающую от 140 мг до 160 мг, предпочтительно 150 мг, а также от 210 до 230 мг, предпочтительно 220 мг, для лечения мерцательной аритмии (МА). В предпочтительном варианте стандартная лекарственная форма представляет собой твердую форму, такую как таблетка, капсула, гранулят, порошок и т.п. Например, указанные композиции описаны ниже в разделе Композиции. В наиболее предпочтительном варианте настоящего изобретения твердая форма представляет собой капсулу, содержащую этексилат дабигатрана, нанесенный на изолированные пеллеты ядер из винной кислоты. Наиболее предпочтительный вариант настоящего изобретения описан ниже в разделе Композиции.
Более 300 субъектов полностью завершили испытания PETRO и PETRO-Ex. Указанные субъекты являлись представителями различных возрастных групп и пола и имели различную массу тела и состояние здоровья. Однако было установлено, что результаты, описанные выше, в одинаковой степени относятся ко всем субъектам.
Результаты клинических испытаний RELY
Испытания RELY (The Randomized Evaluation of Long-term Anticoagulation Therapy) представляли собой долгосрочные рандомизированные антикоагуляционные испытания, в ходе которых проводили сравнение двух доз дабигатрана с варфарином у пациентов с МА, у которых присутствовал повышенный риск инсульта. План данных испытаний был опубликован в статье Ezekowitz M.D., Connolly S.J., Parekh A., Reilly P.A., Varrone J., Wang S., Oldgren J., Themeles E., Wallentin L. и Yusuf S., Rationale and design of the RE-LY: Randomized evaluation of long-term anticoagulant therapy, warfarin, compared to dabigatran, Am. Heart J., 157, cc.805-810 (2009), включенной в данное описание в качестве ссылки.
В ходе испытаний на неменьшую эффективность 18113 пациентов, страдающих от мерцательной аритмии, с присутствием риска инсульта, рандомизировали и вслепую вводили фиксированные дозы дабигатрана 110 мг или 150 мг дважды в сутки, для сравнения использовали группу, в которой в слепую вводили варфарин. Средняя продолжительность обследования пациентов составляла 2,0 года, а в качестве первичного параметра оценивали случаи инсульта или системной эмболии. Частота первичного параметра составляла 1,70% в год при введении варфарина и по сравнению с 1,55% в год при введении дабигатрана 110 мг (относительный риск 0,91, доверительный интервал 95% в интервале 0,75-1,12, р [неменьшая эффективность]<0,001) и 1,11% в год при введении дабигатрана в дозе 150 мг (относительный риск 0,66, доверительный интервал 95% в интервале 0,53-0,82, р [преимущество]<0,001. Частота кровотечений составляла 3,46% в год при введении варфарина и по сравнению с 2,74% в год при введении дабигатрана в дозе 110 мг (р=0,002) и 3,22% в год при введении дабигатрана в дозе 150 мг (р=0,32). Частота геморрагического инсульта составляла 0,38% в год при введении варфарина и по сравнению с 0,12% в год при введении дабигатрана в дозе 110 мг (р<0,001) и 0,10% в год при введении дабигатрана в дозе 150 мг (0,14-0,49, р<0,001). Уровень смертности составлял 4,13% в год при введении варфарина и по сравнению с 3,74% в год при введении дабигатрана в дозе 110 мг (р<0,12) и 3,63% в год при введении дабигатрана в дозе 150 мг (р<0,047).
Таким образом, у пациентов, страдающих от МА, при введении дабигатрана в дозе 110 мг наблюдались аналогичные частоты случаев инсульта и системной эмболии, как и при введении варфарина, но при этом наблюдалось снижение частоты массивных кровотечений. Введение дабигатрана в дозе 150 мг связано с более низкой частотой случаев инсультов и системной эмболии по сравнению с введением варфарина, но с аналогичной частотой случаев кровотечений. Соответственно, дабигатран в дозе 110 мг характеризуется повышенным профилем безопасности по сравнению с варфарином, а дабигатран в дозе 150 мг характеризуется повышенной эффективностью по сравнению с варфарином.
Подробое описание испытаний RELY
Способы
Пациентов включали в испытания из 951 клинического центра в 44 странах. В основном пациентов включали в испытания, если у них наблюдалась мерцательная аритмия, зарегистрированная на электрокардиограмме в момент обследования или в течение 6 месяцев, и по крайней мере одно из следующих нарушений: перенесенный инсульт или преходящее нарушение мозгового кровообращения, фракция выброса левого желудочка менее 40%, симптомы сердечной недостаточности класса 2 или выше по классификации Нью-Йоркской кардиологической ассоциации в течение 6 месяцев, возраст по крайней мере 75 лет или возраст по крайней мере 65 лет при наличии сахарного диабета, гипертензии или коронарной болезни сердца. Причины исключения пациента из испытаний включают тяжелое поражение сердечного клапана, инсульт в течение 14 дней или тяжелый инсульт в течение 6 месяцев, состояние с повышенным риском кровотечения, клиренс креатинина менее 30 мл/мин, заболевание печени в активной форме или беременность.
После получения информированного письменного согласия всех участников испытания рандомизировали в группы, в которых вводили одну из двух доз дабигатрана или варфарина, с использованием центральной интерактивной автоматизированной телефонной системы. Дабигатран выдавали слепым методом в немаркированных капсулах, содержащих 110 мг или 150 мг лекарственного средства, которые принимали два раза в сутки. Варфарин выдавали в упаковках таблеток с открытой этикеткой, содержащих по 1 мг, 3 мг или 5 мг, и дозу устанавливали в соответствии с местным МНС от 2,0 до 3,0 и по крайней мере с одним анализом МНС в месяц. Время в терапевтическом интервале рассчитывали по методу Розендааля (Rosendaal F.R. и др., A method to determine the optimal intensity of oral anticoagulant therapy, Thromb. Haemost, 69, cc.236-239 (1993)), за исключением данных МНС в течение первой недели и после прекращения испытаний. Данные передавали в центры вместе с рекомендациями по оптимальному контролю МНС. Допускалось совместное введение аспирина (менее 100 мг/сутки) или других антитромбоцитарных агентов. Хинидин запрещен в течение 2 лет после начала испытаний из-за возможности его взаимодействия с дабигатраном.
Пациентов обследовали через 14 дней после рандомизации, через 1 и 3 месяца, каждый 3-ий месяц в течение первого года, а затем каждый 4 месяц до завершения испытаний. Функцию печени оценивали каждый месяц в течение первого года обследования. В соответствии с предварительно установленной оценкой функции печени для 6000 пациентов, которым вводили дабигатран, и обследовали в течение 6 месяцев и более, комитет по мониторингу данных рекомендовал снизить частоту анализа функции печени до регулярных визитов к врачу.
В качестве первичных параметров при испытаниях использовали случаи инсульта и системной эмболии. Первичным параметром безопасности являлось массивное кровотечение. В качестве вторичного параметра использовали инсульт, системную эмболию и смертельный случай. Другие параметры включали инфаркт миокарда, легочную эмболию, преходящее ишемическое нарушение мозгового кровообращения и госпитализацию. Набор первичных параметров преимущество-польза включал комбинацию инсульта, системной эмболии, легочной эмболии, инфаркта миокарда, смертельного случая или массивного кровотечения. Инсульт определяли как внезапный случай очагового неврологического дефицита, затрагивающий основную мозговую артерию и классифицирующийся как ишемический, геморрагический или неопределенный случай. Геморрагическая трансформация ишемического инсульта не рассматривается как геморрагический инсульт. Внутричерепное кровотечение включает геморрагический инсульт и субдуральное или субарахноидальное кровотечение. Системная эмболия представляет собой острую закупорку сосудов конечности или органа, что подтверждено визуализацией, хирургическим методом или в результате аутопсии. Массивное кровотечение определяли как снижение уровня гемоглобина по крайней мере на 2,0 г/л или переливание крови по крайней мере 2 ед. крови или симптоматическое кровотечение в важном отделе или органе. Опасное для жизни кровотечение представляет собой последовательность массивных кровотечений, включая фатальное кровотечение, симптоматическое внутричерепное кровотечение, кровотечение со снижением уровня гемоглобина более чем на 5,0 г/л или требующее переливание более 4 ед. крови или требующее введения инотропных агентов или срочного хирургического вмешательства. Все остальные виды кровотечений рассматривались как незначительные.
Все первичные и вторичные параметры анализировали двойным слепым методом. Международный совет экспертов рассматривал документы на языке оригинала после обеспечения анонимности данных или документы переводила группа независимых переводчиков, документы маскировали и рассматривали все случаи преходящего ишемического нарушения мозгового кровообращения для того, чтобы оценить возможность развития инсульта у пациента. Для выявления возможных незарегистрированных осложнений пациентам регулярно раздавали анкеты для описания симптомов, а побочные явления и отчеты о госпитализации оценивали в отношении незарегистрированных первичных и вторичных симптомов.
Статистический анализ
Первичный анализ проводили для оценки не меньшей эффективности любой дозы дабигатрана в отношении варфарина с использованием модели пропорциональных рисков Кокса. Для того чтобы исследуемое средство соответствовало условию не меньшей эффективности, верхний предел одностороннего доверительного интервала относительного риска 97,5% (дабигатран/варфарин) должен составлять менее 1,46. Указанный предел не меньшей эффективности был определен методом мета-анализа испытаний с использованием антагонистов витамина К при мерцательной аритмии по сравнению с контролем с использованием нижнего предела доверительного интервала относительного риска 95% (варфарин/контроль). Предельное значение 1,46 гарантирует, что наблюдается 50% преимущество антагонистов витамина К по сравнению с контролем в отношении снижения случаев инсульта или системной эмболии. Для оценки обеих доз дабигатрана по сравнению с варфарином планировали проверить, составляет ли максимум двух значений р менее 0,025 по данным однофакторного анализа, в этом случае обе гипотезы исключались. Если при однофакторном анализе максимум двух значений р более 0,025, минимум двух значений р составляет менее 0,0125, то подтверждается статистическая значимость. Все анализы проводили с использованием данных о пациентах из популяции ITT (с учетом назначенного лечения). Планировали включить в испытания 15000 пациентов, что по оценкам обеспечило бы 84% мощность анализа при оценке не меньшей эффективности каждой дозы дабигатрана. Два изменения протокола были проведены Группой контроля в ходе включения пациентов в испытания без учета ожидаемых результатов лечения. Указанные изменения включали требования сбалансированного числа пациентов, которым не вводили варфарин (введение варфарина в течение периода менее 61 дня), и пациентов, которым вводили варфарин в течение длительного времени, и увеличение числа пациентов до 18000 для увеличения мощности статистического анализа при сравнении каждой дозы дабигатрана по сравнению с варфарином. Независимый комитет по мониторингу данных оценивал открытые данные и проводил два промежуточных анализа эффективности с целью рекомендовать завершение испытаний в случае, если преимущество дабигатрана превышало 3 стандартных отклонения, и повторный анализ через 3 месяца.
Характеристики пациентов и их обследование
В испытаниях принимали участие 18113 пациентов, испытания проводили с 22 декабря 2005 г. по 15 декабря 2007 г. Группы пациентов приводили в соответствие по базовой линии (таблица 4). Средний возраст составлял 71 год, мужчины составляли 64%. Половине пациентов ранее вводили варфарин. Средняя оценка CHADS2 (оценка риска инсульта) составляла 2,1.
Последние визиты пациентов для обследования состоялись в период от 15 декабря 2008 г. до 15 марта 2009 г. Среднее время обследований составляло 2,0 года и обследования завершены на 99,9%, 20 пациентов не посещали врача. Процент прерывания испытаний с введением дабигатрана в дозе 110 мг, дабигатрана в дозе 150 мг и варфарина составлял 14%, 15% и 10% за один год и 23%, 25% и 19% за 2,5 года соответственно. Непрерывное введение аспирина в ходе испытаний проводили в 23,5%, 21,6% и 23,1% случаев у пациентов, которым вводили дабигатран 110 мг, дабигатран в дозе 150 мг и варфарин соответственно. Среднее время терапевтического диапазона для пациентов, которым вводили варфарин, составляло 64%.
ангиотензинконвертитрующего фермента I
** оценка CHADS2 обозначает оценку общего риска в баллах по шкале: по 1 баллу - застойная сердечная недостаточность, гипертония, возраст >75, сахарный диабет и 2 балла - инсульт или преходящее ишемическое нарушение мозгового кровообращения в анамнезе (16)
Статин - ингибиторы HMG-CoA редуктазы
Первичный параметр
Инсульт или системная эмболия наблюдались у 182 пациента, которым вводили дабигатран в дозе 110 мг (1,55% в год), у 133 пациентов, которым вводили дабигатран в дозе 150 мг (1,11% в год) и у 198 пациентов, которым вводили варфарин (1,70% в год) (таблица 5 и фиг.2). Обе дозы дабигатрана характеризуются не меньшей эффективностью по сравнению с варфарином (р<0,001). Дабигатран в дозе 150 мг оказался более эффективным по сравнению с варфарином (относительный риск (ОР) 0,66, доверительный интервал 95% (ДИ) от 0,53 до 0,82, р<0,001), однако, дабигатран в дозе 110 мг характеризуется меньшей эффективностью (ОР 0,91, 95% ДИ от 0,75 до 1,12, р=0,37). Частота геморрагического инсульта составляет 0,38% в год при введении варфарина по сравнению с 0,12% в год при введении дабигатрана в дозе 110 мг (ОР 0,31, 95% ДИ от 0,17 до 0,56, р<0,001) и 0,10% в год при введении дабигатрана в дозе 150 мг (ОР 0,26, 95% ДИ от 0,14 до 0,49, р<0,001).
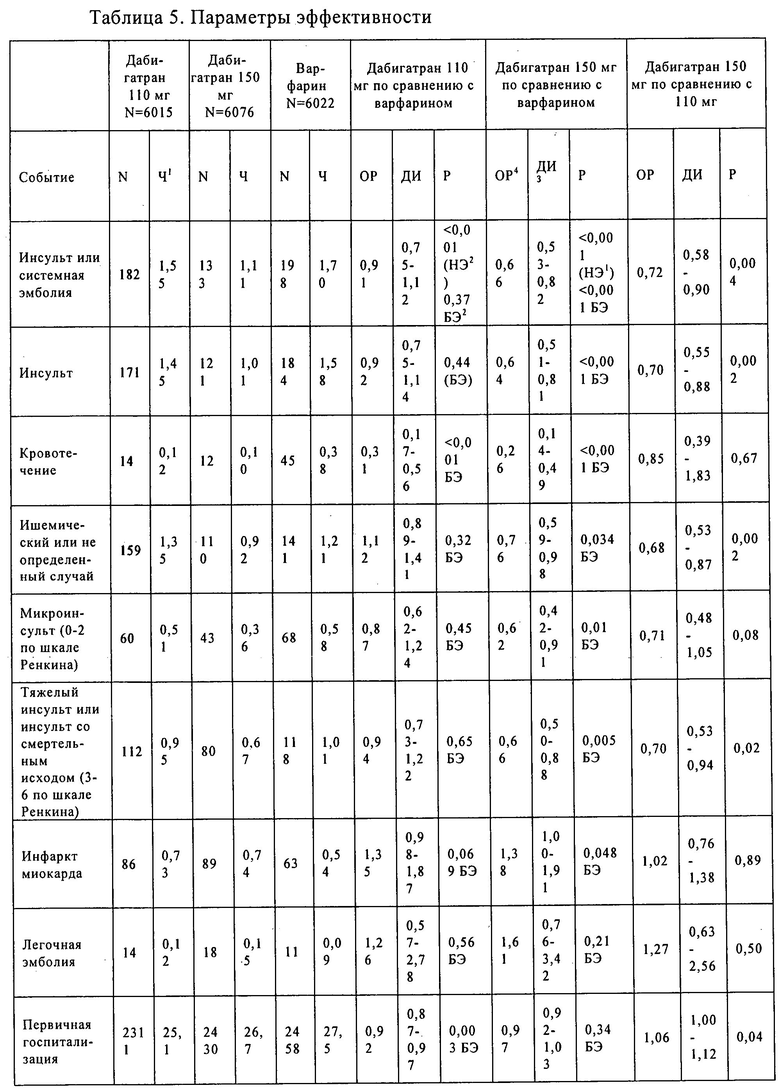
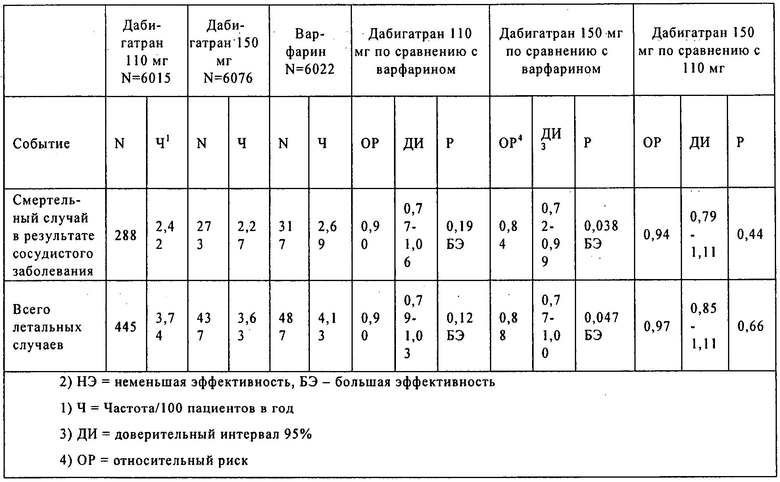
Другие параметры
Частота летальных исходов в каждом случае составляла 4,13% в год при введении варфарина по сравнению с 3,74% в год при введении дабигатрана в дозе 110 мг (ОР 0,90, 95% ДИ от 0,79 до 1,03, р=0,12) и 3,63% в год при введении дабигатрана в дозе 150 мг (ОР 0,88, 95% ДИ от 0,77 до 1,00, р=0,047). Частота инфаркта миокарда составляла 0,54% в год при введении варфарина и повышалась при введении дабигатрана, 0,73% в год при введении в дозе 110 мг (ОР 1,35, 95% ДИ от 0,98 до 1,87, р=0,069) и 0,74% в год при введении в дозе 150 мг (ОР 1,38, 95% ДИ от 1,00 до 1,91, р=0,048).
Кровотечение
Частота массивных кровотечений составила 3,46% в год при введении варфарина по сравнению с 2,74% в год при введении дабигатрана в дозе 110 мг (ОР 0,79, 95% ДИ от 0,68 до 0,92, р=0,002) и 3,22% в год при введении дабигатрана в дозе 150 мг (ОР 0,93, 95% ДИ от 0,81 до 1,07, р=0,32) (таблица 6). Частота представляющих угрозу для жизни кровотечений, внутричерепных кровотечений и общих кровотечений повышается при введении варфарина по сравнению с введением дабигатрана в любой дозе. При введении дабигатрана в дозе 150 мг частота кровотечений в желудочно-кишечном тракте повышается по сравнению с введением варфарина.

Все значения р свидетельствуют о более высокой эффективности. Гемморагический инсульт обозначает инсульт в таблице 5 и массивное/представляющее угрозу жизни кровотечение и часть внутричерепного кровотечения в таблице 6.
Параметр польза-риск включает значительные сосудистые нарушения, массивные кровотечения и смертельные случаи. Частота указанного конечного параметра составляет 7,99% в год при введении варфарина по сравнению с 7,37% в год при введении дабигатрана в дозе 110 мг (ОР 0,92, 95% ДИ от 0,84 до 1,01, р=0,097) и 7,22% в год при введении дабигатрана в дозе 150 мг (ОР 0,90, 95% ДИ от 0,82 до 0,99, р=0,04).
Сравнение доз дабигатрана
По сравнению с дозой 110 мг дабигатран в дозе 150 мг снижает риск инсульта или системной эмболии (р=0,004). Указанное различие определяется в большей степени снижением числа инсультов ишемической или неопределенной этиологии, а частота геморрагических инсультов приблизительно равна в обеих группах. Для двух доз не наблюдалось различий в числе смертельных исходов от сердечно-сосудистых заболеваний или общей смертности. С другой стороны, по сравнению с 110 мг, дабигатран в дозе 150 мг увеличивает риск массивного кровотечения (р=0,04) и также увеличивает число случаев кровотечений в желудочно-кишечном тракте, минорных и общих кровотечений. Клинические преимущества приблизительно равны для двух доз.
Побочные эффекты и анализ функции печени
При введении дабигатрана наблюдалось увеличение побочных эффектов в виде диспепсии (таблица 7). Увеличение уровня аспартат - или аланинаминотрансферазы в сыворотке более чем в 3 раза по сравнению с верхним пределом нормы (ВПН) при введении любой дозы дабигатрана наблюдалось не чаще, чем при введении варфарина.
* Включая отрицательные эффекты, зарегистрированные у более 5% всей популяции.
На основании отчетов по проведению испытаний
** Наблюдается менее часто при введении варфарина, чем при введении любой дозы дабигатрана (р<0,001).
АЛТ - аланинаминотрансфераза, ACT - аспартатаминотрансфераза, ОЭ - отрицательный эффект, СОЭ - серьезный отрицательный эффект, ВПН - верхний предел нормы.
¶ Клиническая и/или биохимическая дисфункция печени, требующая госпитализации.
£ Желтуха, тошнота и рвота, боли в отделе брюшной полости, зуд, сонливость и усталость.
Важные подгруппы
Для большинства описанных подгрупп не наблюдалось значительного взаимодействия с лечением дабигатраном в любой дозе (фиг.3). Не наблюдалось значительного взаимодействия эффективности лечения дабигатраном с предшествующим лечением варфарином. Хотя 80% дабигатрана выводится через почки, не наблюдалось взаимодействия с исходным рассчитанным клиренсом креатинина.
Обсуждение результатов
В ходе испытаний RELY два слепых курса лечения фиксированной дозой дабигатрана (110 мг дважды в сутки и 150 мг дважды в сутки) сравнивали с оптимизированной дозой варфарина у пациентов с мерцательной аритмией и риском инсульта. Обе дозы дабигатрана характеризуются не меньшей эффективностью по сравнению с варфарином в отношении первичного параметра эффективности: инсульта или системной эмболии. Кроме того, более высокая доза характеризуется большей эффективностью в отношении инсульта или системной эмболии, а более низкая доза характеризуется большей эффективностью в отношении массивных кровотечений. Более того, более высокая доза дабигатрана характеризуется снижением числа общих летальных исходов и летальных исходов в результате сосудистых заболеваний по сравнению с варфарином.
Все проводимые ранее исследования с целью разработки безопасного и эффективного альтернативного варфарину способа лечения пациентов с мерцательной аритмией характеризовались различными ограничениями. Комбинация клопидрогеля и аспирина характеризовалась большей эффективностью по сравнению с аспирином в отдельности, см. The ACTIVE Investigators, Effect of Clopidogrel Added to Aspirin in Patients with Atrial Fibrillation, N. Engl. J. Med. 360 (2009), но меньшей эффективностью по сравнению с варфарином, см. ACTIVE Writing Group of the ACTIVE Investigators, Clopidogrel plus aspirin versus oral anticoagulation for atrial fibrillation in the Atrial Fibrillation Clopidogrel Trial with Irbesartan for Prevention of Vascular Events (ACTIVE W): a randomized controlled trial, Lancet, 367, cc.1903-1912 (2005). Подкожное введение идрапаринукса характеризовалось большей эффективностью по сравнению с варфарином, однако со значительно более высоким риском кровотечения, см. Amadeus Investigators и др., Comparison of idraparinux with vitamin К antagonists for prevention of thromboembolism in patients with atrial fibrillation: a randomized, open-label, non-inferiority trial, Lancet, 371(9609), cc.315-321, 26 января (2008). Ксимелагатран, который является более ранним прямым ингибитором тромбина, характеризуется аналогичной эффективностью и безопасностью по сравнению с варфарином, но, как было установлено, является гепатотоксичным, см. Deiner НС, Executive Steering Committee Stroke Prevention Using the Oral Direct Thrombin Inhibitor Ximelagatran in Patients with Non-Valvular Atrial Fibrillation Pooled Analysis from the SPORTIF III and V Studies, Cerebrovasc. Dis., 21, cc.279-293 (2006). Напротив, в случае дабигатрана, серийный анализ показателей функции печени не выявил признаков гепатотоксичности.
Наиболее серьезным осложнением при лечении варфарином является внутричерепное кровотечение, прежде всего, геморрагический инсульт. По сравнению с аспирином при введении варфарина риск внутричерепного кровотечения удваивается (Hart R.G., см. выше). Таким образом, важным преимуществом обеих доз дабигатрана является снижение частоты указанных осложнений по сравнению с варфарином более в 2/3 раза, без влияния на эффективность в отношении ишемического инсульта. Частота массивных кровотечений при введении варфарина в указанных испытаниях повышается по сравнению с некоторыми предшествующими испытаниями (Deiner Н.С., см. выше, The ACTIVE Investigators, см. выше; ACTIVE Writing Group of the ACTIVE Investigators, см. выше). Данный факт частично объясняется более широким определением массивного кровотечения в указанных испытаниях. При введении более высокой дозы дабигатрана наблюдалось увеличение частоты кровотечений в желудочно-кишечном тракте, несмотря на общее снижение частоты кровотечений в других отделах организма. Для увеличения абсорбции дабигатрана требуется более низкое значение pH. Поэтому капсулы дабигатрана содержат покрытые дабигатраном пелеты с ядром из винной кислоты. С такой кислотностью может быть связано увеличение частоты случаев симптомов диспепсии при введении обеих доз дабигатрана и повышенный риск кровотечений в желудочно-кишечном тракте при введении в дозе 150 мг.
Преимущество дабигатрана можно частично объяснить введением дозы дважды в сутки, что при полупериоде выведения от 12 до 17 ч снижает изменчивость антикоагуляционного действия, прежде всего, по сравнению с варфарином, который трудно поддается контролю. Варфарин ингибирует коагуляцию в широких пределах (ингибирует факторы II, VII, IX, X, белки С и S). Селективно ингибируя только тромбин, дабигатран может обеспечивать антитромботическую эффективность при сохранении некоторых других гемостатических механизмов в коагуляционной системе для уменьшения потенциальных кровотечений.
Ограничением испытаний являлось использование варфарина с открытой этикеткой, что могло вносить сомнения в отчеты или оценку событий, а также относительно короткий срок периода обследования. Решение не маскировать рекомендуемые дозы варфарина связано с целью обеспечить наиболее реалистичные дозировки варфарина, и на том, что отмена маскирования варфарина часто происходила во время развития осложнений. Контроль антикоагуляции при введении варфарина сопоставим с предшествующими масштабными клиническими испытаниями (время терапевтического диапазона 64%), даже несмотря на то, что половине пациентов варфарин ранее не вводился, т.е. в этой группе удовлетворительный контроль является наименее вероятным (Rosendaal F.R. и др., см. выше, The ACTIVE Investigators, см. выше).
Суммарная оценка результатов в отношении общего преимущества и риска сравнима для двух доз дабигатрана. Однако эта общая характеристика обусловлена тем, что более низкий риск ишемической болезни при введении дабигатрана в дозе 150 мг уравновешивается более низким риском кровотечений при введении дабигатрана в дозе 110 мг. Указанные данные позволяют предположить, что дозу дабигатрана в принципе можно оптимизировать в соответствии с риском для каждого конкретного пациента, хотя данная концепция специально не проверялась в ходе проводимых нами испытаний. Результаты клинических испытаний свидетельствуют о том, что введение этексилата дабигатрана в дозе 150 мг дважды в сутки, возможно в форме его фармацевтически приемлемой кислотно-аддитивной соли, прежде всего предпочтительно для пациентов, у которых отсутствуют дополнительные факторы риска массивного кровотечения, как описано в данном контексте.
Таким образом, проведено сравнение двух доз дабигатрана с варфарином при введении пациентам, страдающим от мерцательной аритмии с риском инсульта. Дабигатран в дозе 110 мг характеризуется аналогичной частотой инсульта и системной эмболии и более низкой частотой массивных кровотечений по сравнению с варфарином. Дабигатран в дозе 150 мг характеризуется более низкой частотой инсульта и системной эмболии и аналогичной частотой массивного кровотечения.
Противопоказания, специальные предостережения и меры предосторожности
Существует несколько противопоказаний для лечения дабигатраном, к которым относятся известная гиперчувствительность к дабигатрану, этексилату дабигатрана или одному из эксципиентов продукта, пациенты с тяжелой почечной недостаточностью (клиренс креатинина<30 мл/мин), проявление кровотечения, активные кровотечения, пациенты с гемморагическим диатезом или спонтанным или фармакологическим нарушением гемостаза, повреждения органов с риском клинически значимого кровотечения, включая гемморагический инсульт в течение последних 6 месяцев, пациенты с постоянным спинальным или эпидуральным катетером в течение первого часа после удаления и одновременная терапия хинидином, верапамилом и т.п.или другими совместными ингибиторами P-gp.
Нарушения функции печени: пациентов, страдающих от нарушения функции печени средней и тяжелой степени (В и С по шкале Чайлд-Пью), или от заболевания печени, у которых ожидается нарушение жизненных функций, включая, но не ограничиваясь только ими, устойчивое повышение уровня ферментов печени >2 верхнего предела нормы (ВПН) или гепатиты А, В или С, или другие нарушения жизненных функций, исключали из испытаний. Таким образом, использование этексилата дабигатрана в основном не рекомендовано в данной популяции.
Риск кровотечения: из-за фармакологического способа действия применение этексилата дабигатрана может в принципе привести к повышению риска осложнений кровотечения. Кроме того, известно, что такие факторы, как функция почек или одновременное введение сильных ингибиторов P-gp, повышают уровень дабигатрана в плазме в различной степени. Как было установлено в различных клинических испытаниях, повышение уровня дабигатрана в плазме не всегда приводит к повышению риска кровотечения. В тех случаях, когда известно, что эти факторы повышают риск кровотечения и превышают клиническое преимущество, следует выдавать соответствующие рекомендации. Если различные многовариантные факторы могут привести к риску неизвестного кровотечения, рекомендуется тщательно обследовать пациента на наличие симптомов осложнений кровотечения.
Настоящее изобретение предпочтительно относится к способу лечения пациентов, у которых отсутствует повышенный риск осложнений кровотечения. Для указанных пациентов рекомендуемая доза для предотвращения инсульта составляет 150 мг дважды в сутки.
Подробное обследование (выявление симптомов кровотечения или анемии) обычно требуется в следующих ситуациях, в которых может повыситься риск кровотечения: (а) недавняя биопсия, крупная травма или недавняя операция на мозге, позвоночнике или офтальмологическая операция, (б) лечение, повышающее риск кровотечения, так как одновременное лечение этексилатом дабигатрана и лечение, влияющее на гемостаз или коагуляцию, может увеличить риск кровотечения, (в) бактериальный эндокардит, наследственное или приобретенное нарушение, связанное с кровотечением, активная стадия язвенной болезни и ангиодиспластическое заболевание желудочно-кишечного тракта и геморрагический инсульт (6 месяцев).
Кроме того, увеличение риска кровотечения может происходить вследствие специфического фармакокинетического или фармакодинамического взаимодействия с некоторыми совместно вводимыми лекарственными средствами, и совместно с введением этексилата дабигатрана не следует вводить следующие лекарственные средства: нефракционированные гепарины и производные гепарина, низкомолекулярные гепарины (НМГ), фондапаринукс, дезирудин, тромболитические агенты, антагонисты рецепторов GPIIb/IIIa, декстран, сульфинпиразон, ривароксабан, празугрел и антагонисты витамина К. Следует отметить, что нефракционированный гепарин можно вводить в дозе, необходимой для поддержания пациента с венозным или артериальным катетером. Известно, что пероральное введение сильных ингибиторов P-gp, таких как верапамил, хинидин или амиодарон, совместно с этексилатом дабигатрана повышает концентрацию дабигатрана в плазме, что также может повысить риск кровотечения.
Композиции
Этексилат дабигатрана предпочтительно перерабатывают в форме метансульфоната (WO 03/074056). Приведенные ниже примеры представлены для иллюстрации стандартных лекарственных форм по настоящему изобретению и способов их получения, которые использовали в клинических исследованиях, описанных в данном контексте.
Способ получения фармацевтических композиций, использованных в описанных клинических испытаниях, включает ряд стадий. Во-первых, получали ядро 1 из фармацевтически приемлемой органической кислоты. В настоящем изобретении для получения ядра 1 использовали винную кислоту. Из полученных ядер 1 затем получали так называемые изолированные ядра из винной кислоты 3, при распылении изолирующей суспензии 2. Суспензию дабигатрана 4, полученную соответствующим образом, распыляли на указанные ядра с покрытием 3 в одну или более стадий, используя метод нанесения покрытия. Наконец, полученные таким образом пеллеты активного соединения 5 упаковывали в пригодные капсулы.
Определение размеров частиц винной кислоты методом воздушно-струйного просеивания
Устройства для измерения и параметры
Устройство для измерения: воздушно-струйная система просеивания, например, Alpine А 200 LS
Сита с необходимым размером ячеек
Используемая масса: 10 г/сито
Продолжительность: 1 мин/сито, затем 1 мин для каждого сита до максимальной потери массы в 0,1 г
Подготовка образцов/получение продукта
Вещество переносили в ступку и все комочки разрушали при интенсивном растирании. Сито с резиновой прокладкой устанавливали на весы, значение массы обнуляли и на сите взвешивали 10,0 г порошкообразного вещества. Сито вместе с содержимым, резиновой прокладкой и крышкой устанавливали в прибор. Таймер устанавливали на 1 мин, и материал обрабатывали в воздушно-струйной ситовой системе в течение указанного времени. Затем остаток взвешивали и результат регистрировали. Указанную процедуру повторяли до уменьшения массы остатка после воздушно-струйного просеивания <0,1 г.
Пример 1
Получение исходных пеллет
480 кг Воды нагревали до 50°С и при перемешивании добавляли 120 кг аравийской камеди в стандартном сосуде для смешивания с выпуклым дном и перемешивающим стержнем. Перемешивание продолжали при постоянной температуре до образования прозрачного раствора. После образования прозрачного раствора (обычно через 1-2 ч), при перемешивании добавляли 600 кг винной кислоты. Винную кислоту добавляли при постоянной температуре при непрерывном перемешивании. После завершения добавления смесь продолжали перемешивать в течение еще приблизительно 5-6 ч.
1000 кг Винной кислоты загружали в медленно вращающийся (3 оборота в минуту) неперфорированный горизонтальный поддон с устройством для распыления и нанесения порошка (например, Driamat 2000/2.5). Перед началом распыления отбирали образец кислоты для анализа в воздушно-струйной системе просеивания. Указанная кислота представляет собой частицы винной кислоты размером в интервале от 0,4 до 0,6 мм. Полученный как описано выше раствор кислоты и камеди распыляли на частицы винной кислоты. Во время "распыления поток воздуха составлял 1000 м3/ч, а температура - 35-75°С. Давление составляло 2 мбар, скорость вращения поддона - 9 оборотов в минуту. Форсунки следует располагать на расстоянии 350-450 мм от содержимого.
Раствор кислоты и камеди распыляли поочередно на следующих стадиях. После распыления приблизительно 4,8 кг раствора кислоты и камеди на частицы винной кислоты размером 0,4-0,6 мм и распределения раствора, приблизительно 3,2 кг порошкообразной винной кислоты наносили на влажные частицы винной кислоты. Указанная порошкообразная винная кислота состоит из тонкодисперсных частиц винной кислоты размером <50 мкм. В общей сложности требуется 800 кг порошкообразной винной кислоты. После нанесения и распределения порошкообразной винной кислоты материал сушили до достижения температуры продукта приблизительно 40°С. Затем распыляли раствор кислоты и камеди.
Описанный цикл повторяли до полного потребления всего раствора кислоты и камеди. После завершения процесса пеллеты кислоты сушили в поддоне при вращении 3 оборота в минуту в течение 240 мин. Для предотвращения образования комков после завершения сушки включали режим периодического вращения при скорости 3 об/мин в течение 3 мин через каждый 1 ч, т.е. поддон вращали со скоростью 3 об/мин в течение 3 мин с интервалом в 1 час и затем вращение отключали. Пеллеты кислоты затем переносили в сушилку и сушили при 60°С в течение 48 ч. Затем определяли распределение частиц по размерам ситовым анализом. Частицы с диаметром 0,6-0,8 мм соответствовали требуемому продукту. Указанная фракция должна составлять >85%.
Пример 2
Выделение исходных пеллет
Для получения изолирующей суспензии этанол (666,1 кг) загружали в смеситель и при перемешивании добавляли гидроксипропилметилцеллюлозу (33,1 кг), скорость вращения составляла приблизительно 600 об/мин, до образования раствора. Затем в тех же условиях добавляли 0,6 кг диметикона. Перед применением при перемешивании добавляли тальк (33,1 кг) и получали суспензию.
Пеллеты кислоты и камеди массой 1200 кг высыпали в аппарат для нанесения покрытия (например, GS-Coater, модель 600/1200) и на них во вращающемся поддоне наносили изолирующую суспензию, описанную выше, в непрерывном режиме в течение нескольких часов при скорости 32 кг/ч в случае 1200 кг смеси или 21 кг/ч в случае 600 кг смеси. Пеллеты сушили в непрерывном режиме в потоке воздуха при 70°С.
После полного потребления содержимого аппарата GS-Coater изолированные исходные пеллеты фракционировали при просеивании. Фракцию продукта с диаметром частиц <1,0 мм хранили и использовали на следующей стадии.
Пример 3
Получение суспензии этексилата дабигатрана
Гидроксипропилцеллюлозу (26,5 кг) загружали в изопропанол (720 кг) в емкость для смешивания объемом 1200 л, снабженную мешалкой пропеллерного типа, и перемешивали до полного растворения (приблизительно 12-60 ч, при приблизительно 500 об/мин). После образования прозрачного раствора при перемешивании (400 об/мин) добавляли этексилат дабигатрана (132,3 кг) в виде метансульфоната (полиморфная форма I) и смесь перемешивали в течение еще 20-30 мин. Затем при постоянном перемешивании добавляли тальк (21,15 кг) и перемешивание продолжали при той же скорости в течение еще приблизительно 10-15 мин. Описанные выше стадии предпочтительно проводили в атмосфере азота.
Образование комков предотвращали при гомогенизации с использованием мешалки UltraTurrax в течение 60-200 мин. Температура суспензии не должна превышать 30°С в течение всего процесса получения.
Суспензию перемешивали до готовности к дальнейшей переработке, чтобы исключить седиментацию (приблизительно при 400 об/мин).
Если суспензию хранили при температуре ниже 30°С, ее можно использовать на следующей стадии в течение не более 48 ч. Если, например, суспензию получали и хранили при 22°С, ее можно использовать на следующей стадии в течение не более 60 ч. Если суспензию хранили, например, при 35°С, ее можно использовать на следующей стадии в течение не более 24 ч.
Пример 4
Получение пеллет, содержащих активное вещество этексилат дабигатрана
Использовали горизонтальный поддон с неперфорированным контейнером (GS Coater, модель 600). В отличие от способа в псевдоожиженном слое, суспензию распыляли на псевдоожиженный слой пеллет во вращающемся поддоне методом «распыления сверху». Состав распыляли через форсунки диаметром 1,4 мм. Сухой воздух пропускали через слой пеллет через так называемые погруженные лопасти и выпускали через отверстия в задней стенке контейнера.
В горизонтальный поддон загружали пеллеты из винной кислоты (320 кг), полученные как описано в примере 2, и слой пеллет нагревали. После достижения температуры 43°С начинали распыление. Полученную как описано в примере 3 суспензию (900 кг) распыляли сначала в течение 2 ч при скорости распыления 20 кг/ч, затем при скорости 24 кг/ч и давлении 0,8 бар. Суспензию перемешивали в непрерывном режиме. Температура подаваемого воздуха составляла по крайней мере 75°С. Поток подаваемого воздуха составлял приблизительно 1900 м3/ч.
Затем пеллеты сушили в горизонтальном поддоне (5 об/мин), температура потока воздуха составляла по крайней мере 30°С, не более 50°С, поток подаваемого воздуха составлял 500 м3/ч в течение приблизительно 1-2 ч.
Полученные пеллеты (325 кг) затем снова загружали в горизонтальный поддон и нагревали до 43°С. Суспензию, полученную ранее (900 кг), как описано в примере 3, распыляли сначала в течение 2 ч со скоростью 20 кг/ч, а затем со скоростью 24 кг/ч при давлении 0,8 бар. Суспензию непрерывно перемешивали. Температура подаваемого воздуха составляла не более 75°С. Поток подаваемого воздуха составлял приблизительно 1900 м3/ч.
Затем пеллеты сушили в горизонтальном поддоне (5 об/мин) при температуре воздушного потока по крайней мере 30°С, но не более 50°С, поток подаваемого воздуха составлял 500 м3/ч в течение приблизительно 1-2 ч.
Сухие пеллеты затем пропускали через вибрационное сито с размером ячеек 1,6 мм и хранили в контейнерах с осушителем до дальнейшего использования.
(2) масса капсулы приблизительно 90 мг
Прежде всего, предпочтительный вариант осуществления настоящего изобретения, описанный выше, в общем случае описан ниже. Настоящее изобретение относится к способу профилактики инсульта у пациентов, страдающих от мерцательной аритмии, причем у пациента отсутствуют факторы риска массивного кровотечения, и указанный способ включает введение пациенту этексилата дабигатрана в дозе от >150 мг дважды в сутки до 300 мг дважды в сутки, предпочтительно 220 мг дважды в сутки, необязательно в форме его фармацевтически приемлемой соли. Прежде всего, способ включает введение этексилата дабигатрана в дозе от >150 мг дважды в сутки до 300 мг дважды в сутки, предпочтительно 220 мг дважды в сутки, в форме фармацевтической композиции, описанной в данном контексте выше в качестве примера.
Настоящее изобретение также относится к применению этексилата дабигатрана, необязательно в форме его фармацевтически приемлемой соли, для получения лекарственного средства, предназначенного для профилактики инсульта у пациентов, страдающих от мерцательной аритмии, причем у пациента отсутствуют факторы риска массивного кровотечения, и указанное применение включает введение этексилата дабигатрана в дозе от >150 мг дважды в сутки до 300 мг дважды в сутки, предпочтительно 220 мг дважды в сутки, необязательно в форме его фармацевтически приемлемой соли. Прежде всего, предпочтительное применение включает введение этексилата дабигатрана в дозе от >150 мг дважды в сутки до 300 мг дважды в сутки, предпочтительно 220 мг дважды в сутки, в форме фармацевтической композиции, описанной в данном контексте в качестве примера.
Настоящее изобретение также относится к лекарственному средству для профилактики инсульта у пациентов, страдающих от мерцательной аритмии, причем у пациента отсутствуют факторы риска массивного кровотечения, и указанное лекарственное средство включает от >150 мг до 300 мг этексилата дабигатрана, предпочтительно 220 мг этексилата дабигатрана, необязательно в форме его фармацевтически приемлемой соли. Прежде всего предпочтительное лекарственное средство предназначено для введения дважды в сутки. Прежде всего предпочтительное лекарственное средство представляет собой этексилат дабигатрана в дозе от >150 мг до 300 мг этексилата дабигатрана, предпочтительно 220 мг этексилата дабигатрана, который вводят дважды в сутки в форме фармацевтической композиции, описанной в данном контексте в качестве примера.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПЕРОРАЛЬНЫЕ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДАБИГАТРАНА ЭТЕКСИЛАТА | 2013 |
|
RU2633482C2 |
| Антикоагулянтное лекарственное средство, представляющее собой синтетический дипептид Ac-Trp-Arg-Pip ⋅HCl, фармацевтическая композиция, включающая это антикоагулянтное лекарственное средство | 2019 |
|
RU2712194C1 |
| Способ антикоагулянтной терапии и профилактики тромботических осложнений у пациентов с тяжелым повреждением головного мозга в хроническом критическом состоянии | 2021 |
|
RU2762945C1 |
| ЛЕЧЕНИЕ ГИПЕРТЕНЗИИ И/ИЛИ ПРЕДОТВРАЩЕНИЕ И ЛЕЧЕНИЕ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ У МЛЕКОПИТАЮЩЕГО, ПОЛУЧАЮЩЕГО ТЕРАПИЮ АНТИКОАГУЛЯНТАМИ | 2011 |
|
RU2564941C2 |
| СПОСОБ ЛЕЧЕНИЯ ИЛИ ПРОФИЛАКТИКИ АТЕРОТРОМБОТИЧЕСКИХ ЯВЛЕНИЙ У ПАЦИЕНТОВ С ИНФАРКТОМ МИОКАРДА В АНАМНЕЗЕ | 2016 |
|
RU2707959C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ИЛИ ПРОФИЛАКТИКИ ТРОМБООБРАЗОВАНИЯ ИЛИ ЭМБОЛИИ | 2011 |
|
RU2611662C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ВОСПАЛЕНИЯ И ИШЕМИЧЕСКОГО ПОРАЖЕНИЯ | 2012 |
|
RU2638807C2 |
| СПОСОБ ЛЕЧЕНИЯ ТРОМБОТИЧЕСКИХ НАРУШЕНИЙ С ПРИМЕНЕНИЕМ КОМПОЗИЦИЙ, СОДЕРЖАЩИХ КВЕРЦЕТИН | 2012 |
|
RU2642983C2 |
| Способ оценки риска развития кровотечений во время и после стоматологических вмешательств у пациентов, принимающих пероральные антикоагулянты | 2023 |
|
RU2813439C1 |
| СПОСОБ ПРОФИЛАКТИЧЕСКОГО ЛЕЧЕНИЯ ИНСУЛЬТА | 2006 |
|
RU2324481C1 |
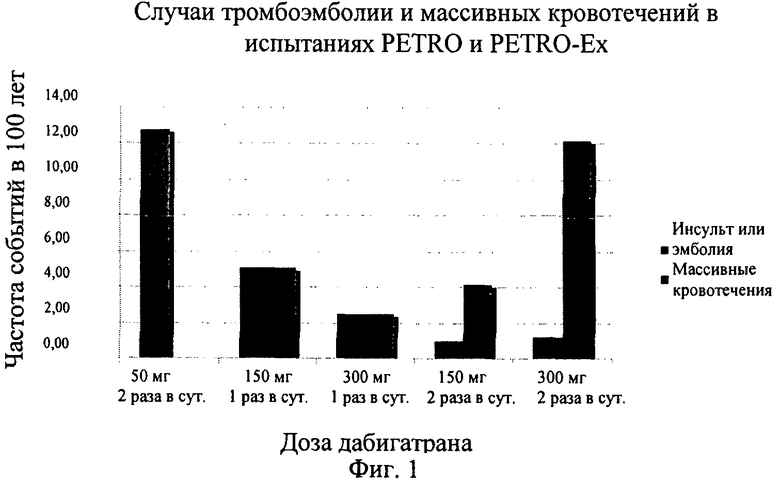
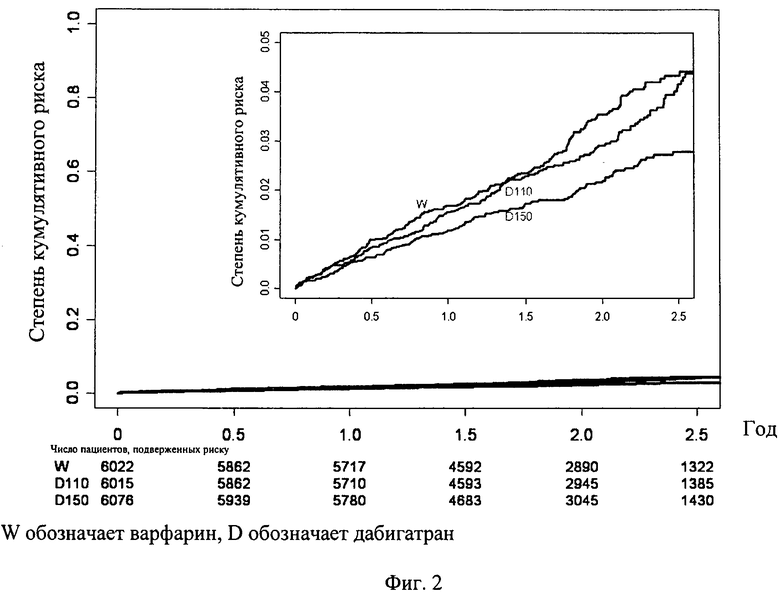
Изобретение относится к медицине, а именно к неврологии и кардиологии, и касается лечения или профилактики тромбоза. Для этого осуществляют введение этексилата дабигатрана в дозе от 150 до 300 мг дважды в сутки. Это обеспечивает профилактику тромбоэмболических осложнений и развития инсульта у пациентов, страдающих мерцательной аритмией, имеющих клиренс креатинина менее 80 мл/мин при отсутствии дополнительных факторов риска массивного кровотечения. 6 з.п. ф-лы, 7 табл., 4 пр., 3 ил.
1. Применение этексилата дабигатрана, необязательно в форме фармацевтически приемлемой соли, для профилактики инсульта у пациента, страдающего от мерцательной аритмии, причем введение этексилата дабигатрана в дозе от >150 мг до 300 мг дважды в сутки, необязательно в форме фармацевтически приемлемой соли, осуществляется пациенту, у которого клиренс креатинина составляет менее 80 мл/мин и отсутствуют дополнительные факторы риска массивного кровотечения.
2. Применение этексилата дабигатрана, необязательно в форме фармацевтически приемлемой соли. по п.1, причем клиренс креатинина у пациента составляет более 50 мл/мин.
3. Применение этексилата дабигатрана, необязательно в форме фармацевтически приемлемой соли, для профилактики инсульта у пациента с мерцательной аритмией по п.1 или 2, причем введение при необходимости корректируется для поддержания уровня дабигатрана в плазме у пациента от приблизительно 20 нг/мл до приблизительно 180 нг/мл.
4. Применение этексилата дабигатрана, необязательно в форме фармацевтически приемлемой соли, для профилактики инсульта у пациента с мерцательной аритмией по п.п.1, 2 или 3, причем уровень дабигатрана в плазме составляет от приблизительно 43 нг/мл до приблизительно 143 нг/мл.
5. Применение этексилата дабигатрана, необязательно в форме фармацевтически приемлемой соли, для профилактики инсульта у пациента с мерцательной аритмией по одному из пп.1-4, причем уровень дабигатрана в плазме составляет от приблизительно 50 нг/мл до приблизительно 120 нг/мл.
6. Применение этексилата дабигатрана, необязательно в форме фармацевтически приемлемой соли, для профилактики инсульта у пациента с мерцательной аритмией по одному из пп.1-5, причем уровень дабигатрана в плазме составляет от приблизительно 50 нг/мл до приблизительно 70 нг/мл.
7. Применение этексилата дабигатрана, необязательно в форме фармацевтически приемлемой соли, для профилактики инсульта у пациента с мерцательной аритмией по одному из пп.1-4, причем уровень дабигатрана в плазме составляет от приблизительно 60 нг/мл до приблизительно 100 нг/мл.
| RU 2005136383 A 10.06.2007 | |||
| US2008039391 A1 14.02.2008 | |||
| EZEKOWITZ NM | |||
| Et al | |||
| “Dabigatran with or without concomitant aspirin compared with warfarin alone in patients with nonvalvular atrial fibrillation (PETRO study) American Journal of Cardiology, 2007, Vol.100, N 9, p.p.1419-1426, [найдено 01.10.2013] найдено из Интернет: |
Авторы
Даты
2014-10-10—Публикация
2009-11-10—Подача