Область техники
Настоящее изобретение относится к области клеточной биологии, клеточной трансплантологии и тканевой инженерии и может быть использовано для восстановления тканей, поврежденных в результате травм и развития патологии, связанной с ишемией. Предлагается способ усиления регенеративной способности стромальных клеток жировой ткани при их введении в область поврежденной ткани, путем прекондиционирования этих клеток в присутствии провоспалительного агента, фактора некроза опухолей-альфа.
Уровень техники
Одно из интенсивно развивающихся направлений современной медицины связано с использованием стволовых и мезенхимальных клеток для частичного или полного восстановления морфологической и функциональной целостности тканей организма, поврежденных вследствие травмы или развития патологического процесса (например, ишемии).
В настоящее время все большее развитие для целей клеточной терапии приобретает введение в поврежденную область стромальных клеток жировой ткани.
Применение для этих целей стромальных клеток жировой ткани связано с рядом преимуществ ввиду относительной простоты их выделения и легкой доступности источника, - жировой ткани (Madonna et al., Adipose tissue-derived stem cells: characterization and potential for cardiovascular repair. Arterioscler Thromb Vasc Biol. 2009; 29(11): 1723-1729).
Клеточный материал, используемый в регенеративной медицине для введения в пораженную область, должен удовлетворять ряду требований:
1. Легкая приживаемость, отсутствие реакции отторжения.
2. Способность к миграции в поврежденную область и пролиферация.
3. Способность к дифференцировке в клетки, аналогичные клеточной популяции поврежденной ткани.
4. Способность к секреции факторов, способствующих ранозаживлению, в т.ч. ангиогенных факторов.
Наличие или отсутствие отторжения организмом хозяина во многом определяется иммуномодулирующими свойствами стромальных клеток. В настоящее время известно, что стромальные клетки имеют ряд механизмов, позволяющих им, по крайней мере, локально подавлять функцию иммунных и иммунокомпетентных клеток (Shi et al., Mesenchymal stem cells: a new strategy for immunosuppression and tissue repair. Cell Res. 2010; 20(5): 510-518).
Способность стромальных клеток к миграции определяется градиентом концентрации хемокина, секретируемого клетками поврежденной ткани, а также наличием специфических рецепторов к хемокинам на поверхности мигрирующих клеток (Ponte et al., The in vitro migration capacity of human bone marrow mesenchymal stem cells: comparison of chemokine and growth factor chemotactic activities. Stem Cells. 2007; 25(7): 1737-1745). Стромальные клетки жировой ткани имеют на своей поверхности рецепторы к некоторым ростовым факторами хемокинам, что определяет специфический характер их миграции (Amos et al., Functional binding of human adipose-derived stromal cells: effects of extraction method and hypoxia pretreatment. Ann Plast Surg. 2008; 60(4): 437-444). Кроме того, для осуществления миграции необходима адгезия (прикрепление) клеток к субстрату, роль которого играют белковые компоненты внеклеточного матрикса.
Исследования, проведенные на культуре стромальных клеток, показали, что они способны дифференцироваться в адипогенном, остеогенном и хондрогенном направлениях (Balwierz et al., Human adipose tissue stromal vascular fraction cells differentiate depending on distinct types of media. Cell Prolif. 2008; 41(3): 441-459). Вместе с тем способность к дифференцировке в условиях введения в область повреждения имеет ограниченный характер и не всегда определяет регенеративный потенциал стромальных клеток.
Очень важную роль в ранозаживлении играет способность стромальных клеток к секреции ряда трофных агентов, в особенности регуляторов ангиогенеза (Rehman et al., Secretion of angiogenic and antiapoptotic factors by human adipose stromal cells. Circulation. 2004; 109(10): 1292-1298). Это связано с формированием новых сосудов (реваскуляризацией) поврежденной ткани. Образование капилляров и более крупных сосудов способствует доставке в ткань кислорода и питательных веществ и в немалой степени стимулируется развитием гипоксии, неизбежной при повреждении ткани и являющейся важным регулятором процессов ее последующего восстановления (Amos et al., The role of human adipose-derived stromal cells in inflammatory microvascular remodeling and evidence of a perivascular phenotype. Stem Cells. 2008; 26(10): 2682-2690).
Первичной реакцией на повреждение является развитие процесса воспаления (Costa et al., Angiogenesis and chronic inflammation: cause or consequence? Angiogenesis. 2007; 10(3): 149-166), связанное с привлечением в ткань воспалительных клеток, секрецией ими провоспалительных цитокинов - фактора некроза опухолей-альфа (ФНО-альфа) и вырабатываемых под влиянием этого цитокина ИЛ-1-бета, ИЛ-6 и некоторых других (Jackson et al., The codependence of angiogenesis and chronic inflammation. FASEB J. 1997; 11(6): 457-65; Smolen et al., Pro-inflammatory cytokines in rheumatoid arthritis: pathogenetic and therapeutic aspects. Clin Rev Allergy Immunol 28: 239-248).
Секретируемый воспалительными клетками ФНО-альфа, обладающий множественным воздействием на клеточную физиологию, способен, среди прочих активностей, оказывать ангиогенное действие, способствуя формированию новых сосудов в ткани (Sainson et al., TNF primes endothelial cells for angiogenic sprouting by inducing a tip cell phenotype. Blood. 2008; 111(10): 4997-5007). Имеются также сведения о том, что ФНО-альфа усиливает миграцию мезенхимальных клеток и стромальных клеток костного мозга (Fu et al., Migration of bone marrow-derived mesenchymal stem cells induced by tumor necrosis factor-alpha and its possible role in wound healing. Wound Repair Regen. 2009; 17(2): 185-191; Ponte et al., The in vitro migration capacity of human bone marrow mesenchimal stem cells: comparison of chemokine and growth factor chemotactic activities. Stem Cells 2007; 25: 1737-1745).
Стромальные клетки жировой ткани представляют собой популяцию, сходную по своему фенотипу и экспрессионному профилю с мезенхимальными клетками костного мозга (Gronthos et al., Surface protein characterization of human adipose tissue-derived stromal cells. J Cell Physiol, 2001; 189(1): 54-63). Наличие на поверхности стромальных клеток рецепторов к некоторым факторам роста (PDGF-ВВ, EGF и ряда других) сближает их с перицитами - клетками сосудистой стенки и позволяет предположить, что они обладают способностью мигрировать по градиенту концентрации этих факторов, а также некоторых хемокинов, рецепторы которых обнаруживаются на поверхности мезенхимальных клеток (Fu et al., Migration of bone marrow-derived mesenchymal stem cells induced by tumor necrosis factor-alpha and its possible role in wound healing. Wound Repair Regen. 2009; 17(2): 185-191; Ponte et al., The in vitro migration capacity of human bone marrow mesenchimal stem cells: comparison of chemokine and growth factor chemotactic activities. Stem Cells 2007; 25: 1737-1745). Кроме того, стромальные клетки жировой ткани способны секретировать факторы, препятствующие клеточному апоптозу и способствующие повышению жизнеспособности клеток (Hong et al., Therapeutic potential of adipose-derived stem cells in vascular growth and tissue repair. Curr Opin Organ Transplant. 2010; 15(1): 86-91). Сходство с перицитами позволяет надеяться на способность стромальных клеток жировой ткани к образованию контактов с эндотелием, способствующему формированию сосудов (Merfeld-Clauss et al., Adipose tissue progenitor cells directly interact with endothelial cells to induce vascular network formation. Tissue Eng Part A. 2010; 16(9): 2953-2966).
Одним из основных процессов, способствующих репарации поврежденных тканей, является воспаление. Привлекаемые в область повреждения воспалительные клетки и секретируемые ими цитокины являются важным фактором, способствующим ранозаживлению. Наиболее мощным цитокином, секретируемым лейкоцитами, является фактор некроза опухолей-альфа (ФНО-альфа), многие эффекты которого опосредуются активацией провоспалительного фактора транскрипции, NFkB (Schütze et al., Mechanisms of tumor necrosis factor action. Semin Oncol. 1992; 19(2 Suppl 4): 16-24). В связи с этим представляется перспективным усиление миграционной и секреторной активности стромальных клеток жировой ткани путем их предобработки (прекондиционирования) в присутствии ФНО-альфа с последующим их использованием в качестве материала для внесения в поврежденную ткань.
Раскрытие изобретения
Задачей, решаемой авторами настоящего изобретения, является разработка способа повышения ангиогенной активности стромальных клеток с целью ускорения восстановления функции ишемизированной ткани в процессе клеточной терапии.
Поставленная задача решается тем, что стромальные клетки жировой ткани культивируют в присутствии ФНО-альфа в количестве 5 и 100 нг/мл в течение 24 и 72 часов. Предлагаемый способ обеспечивает усиление ангиогенной активности стромальных клеток жировой ткани за счет повышения их миграционной, секреторной и инвазивной активности.
Также поставленная задача решается тем, что при культивировании стромальных клеток жировой ткани в присутствии ФНО-альфа используют среду, дополнительно содержащую тромбоцитарный фактор роста PDGF-BB в количестве 10 нг/мл и/или фактор стромальных клеток SDF-1 в количестве 150 нг/мл, и/или урокиназу uPA в количестве 2,5 нг/мл.
Частным вариантом настоящего изобретения является способ, согласно которому в качестве среды культивирования используют среду DMEM-F12, содержащую FBS в количестве 10-15% (об.%), пенициллин в количестве 100 Ед/мл и стрептомицин в количестве 10 мкг/мл.
Настоящее изобретение также предоставляет способ усиления кровотока в ишемизированной области ткани организма, включающий введение эффективного количества клеток, полученных описанным выше способом, и предварительно отмытых фосфатно-солевым буфером.
Частным вариантом настоящего изобретения является описанный выше способ, характеризующийся тем, что для введения в ишемизированную область ткани используются клетки в концентрации 100000/100 мкл, вводимые в количестве 100000-20000000.
В связи с тем, что в настоящее время нет достаточно полных сведений о миграционной способности стромальных клеток жировой ткани на различные хемокины, их способности к секреции ангиогенных и инвазивных факторов, а также регуляции этих процессов факторами воспаления, авторами настоящего изобретения было проведено изучение этих процессов с целью выяснения характера регуляции миграции, экспрессии и секреции рецепторов факторов роста, молекул адгезии, протеолитических ферментов под действием фактора некроза опухолей-альфа.
Миграция стромальных клеток по градиенту концентрации хемоаттрактанта является необходимым компонентом хоуминга, обеспечивающим их доставку в пораженный участок ткани. Этот процесс обусловлен наличием на мигрирующих клетках рецепторов, избирательно взаимодействующих с цитокинами и/или хемокинами, вырабатываемыми клетками поврежденной ткани.
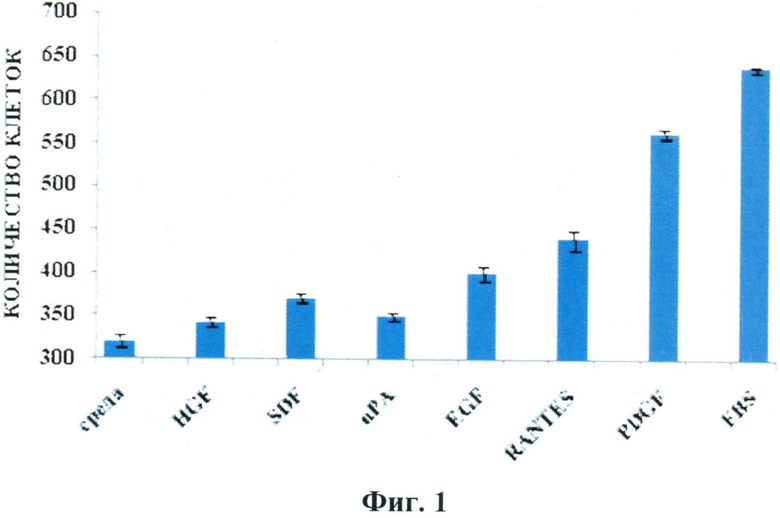
Авторы настоящего изобретения обнаружили, что способность СКЖТ к миграции в камере Бойдена существенно зависит от природы используемого хемоаттрактанта (см. Фиг.1) Наиболее сильными стимуляторами миграции клеток являются PDGF, RANTES и EGF, что свидетельствует о наличии рецепторов к этим белкам на поверхности СКЖТ. Миграция СКЖТ на SDF, HGF, uPA выражена в несколько меньшей степени, что может свидетельствовать о меньшем содержании клеточных рецепторов к этим агентам или наличии каких-либо факторов, препятствующих полному проявлению миграционного ответа.
На основании этих данных можно выстроить вышеуказанные хемоаттрактанты в следующий ряд по степени стимуляции ими миграции СКЖТ:
PDGF≥EGF≥RANTES>HGF≥SDF≥uPA
Поскольку процесс миграции обусловлен специфичным взаимодействием хемоаттрактантов со своими рецепторами на клеточной поверхности, представляет интерес изучение присутствия рецепторов к факторам роста, а также молекул адгезии, являющихся ключевыми в процессе миграции. Для этого исследования авторами был выбран метод цитофлюориметрии в потоке, позволяющий количественно оценить уровень экспрессии каждого конкретного рецептора, а также выявить клеточные субпопуляции, различающиеся по уровню его экспрессии.
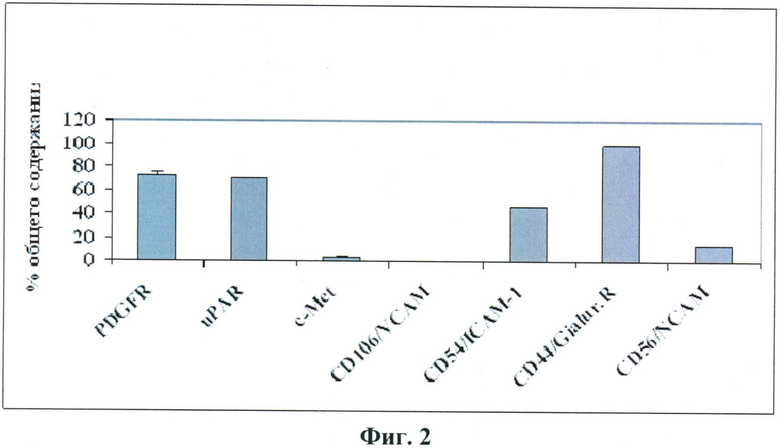
По полученным авторами настоящего изобретения данным, представленным на Фиг.2, наиболее высокий уровень экспрессии в СКЖТ характерен для PDGFR, uPAR, гиалуронанового рецептора и ICAM-1. Рецептор фактора роста гепатоцитов (c-Met), VCAM и NCAM экспрессируются этими клетками в значительно меньшей степени.
Поскольку рецептор PDGF характерен для перицитов, можно полагать, что значительная часть СКЖТ представлена перицитоподобными клетками. Наличие рецептора урокиназы в составе СКЖТ свидетельствует о высокой миграционной способности этих клеток (Montuori et al., Soluble and cleaved forms of the urokinase receptor: degradation products or active molecules? Thomb. Haemost 2005; 93: 192-198), а рецептор гиалуроновой кислоты играет важную роль в процессах хоуминга, обеспечивая первичное взаимодействие клеток в кровяном русле с эндотелием.
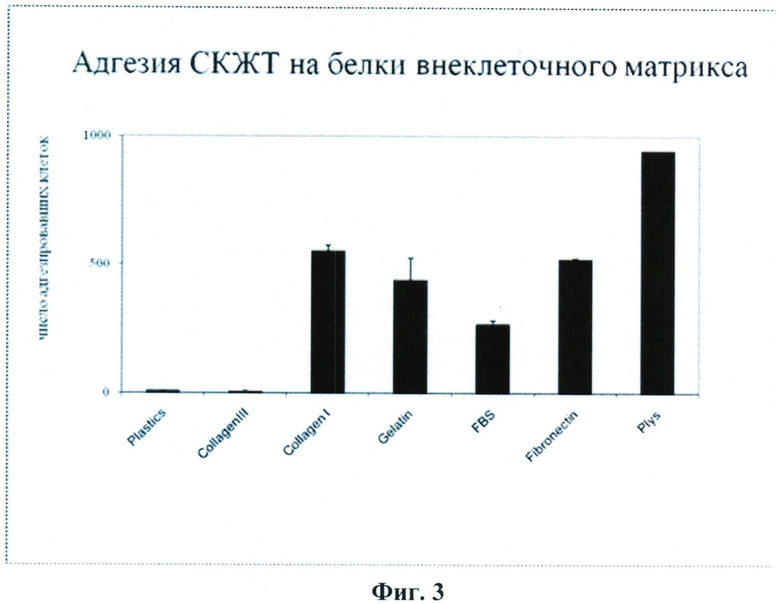
По полученным авторами настоящего изобретения данным, представленным на Фиг.3, СКЖТ адгезируют на коллагене I типа, фибронектине, характерных для сосудистого внеклеточного матрикса, и не способны к адгезии на компоненте внеклеточного матрикса миокарда - коллагене III типа. Адгезия СКЖТ на эмбриональную сыворотку, по-видимому, обусловлена присутствием в ней витронектина.
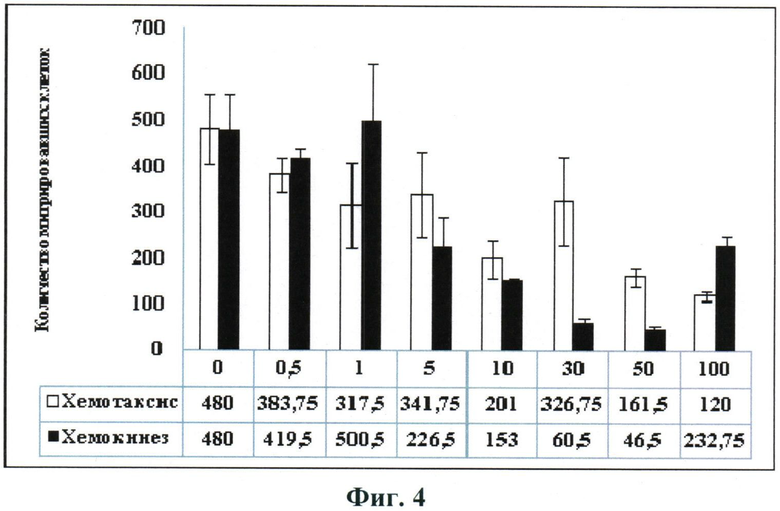
Авторами настоящего изобретения был впервые осуществлен анализ влияния фактора некроза опухолей-альфа на способность стромальных клеток жировой ткани к миграции на отдельные хемокины. Наше исследование, результаты которого представлены на Фиг.4, показало, что сам по себе ФНО-альфа не является хемоаттрактантом для этих клеток. Более того, в высокой концентрации он снижает скорость миграции до уровня ниже контрольного.
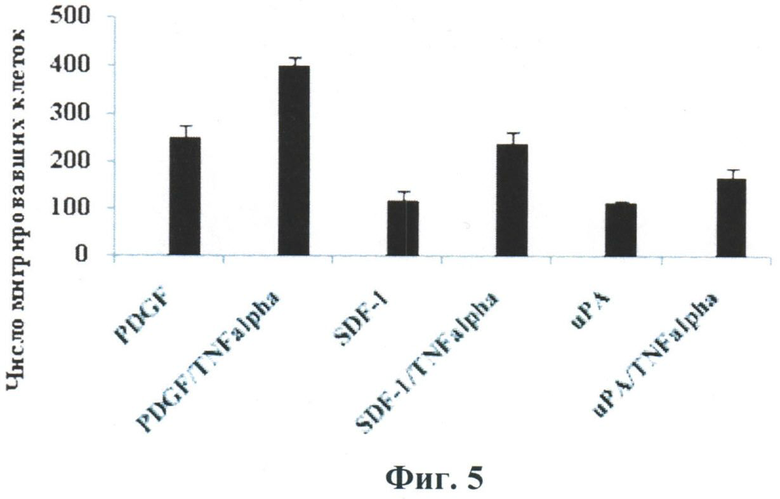
В то же время, как видно из данных, представленных на Фиг.5, преинкубация СКЖТ в присутствии ФНО-альфа усиливает миграцию на другие хемокины.
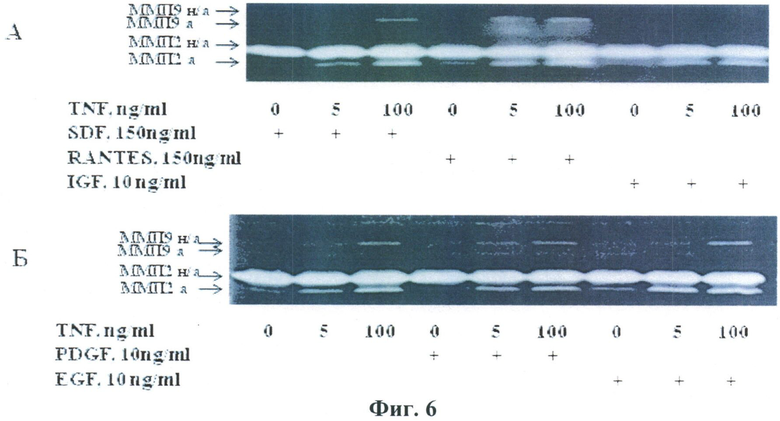
Изучение возможности образования внеклеточных протеаз стромальными клетками жировой ткани, стимулированными действием ФНО-альфа, а также его сочетанием с цитокинами: фактором стволовых клеток (SDF-1), фактором, экспрессируемым нормальными Т-клетками (RANTES), инсулиноподобным фактором роста (IGF), тромбоцитарным фактором роста (PDGF), и эпидермальным фактором роста (EGF) показало, что ФНО-альфа в процессе инкубации способен вызывать образование стромальными клетками жировой ткани матриксной металлопротеиназы-9, имеющей мол. вес 92 кДа, а также активацию матриксной металлопотеиназы-2 (72 кДа) с образованием низкомолекулярной активной формы фермента. Эти данные представлены на Фиг.6.
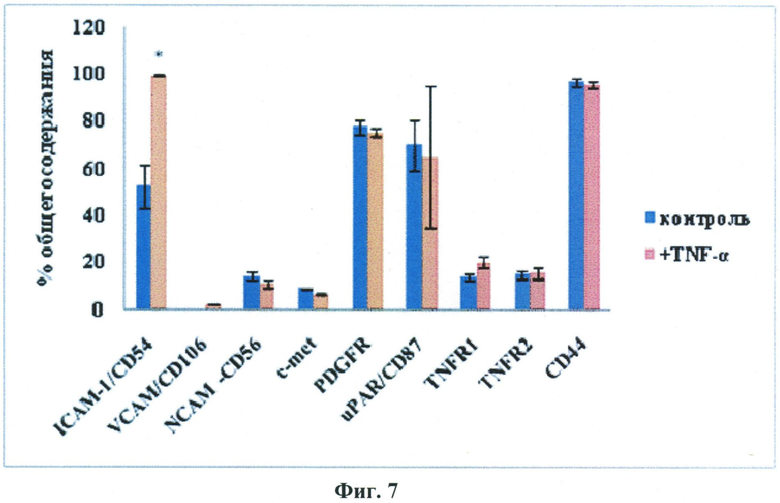
Проведенная авторами настоящего изобретения оценка воздействия фактора некроза опухолей на экспрессию стромальными клетками жировой ткани молекул адгезии, а также рецепторов хемокинов и ростовых факторов выявила 2-кратное усиление экспрессии межклеточной молекулы адгезии (ICAM-1), экспрессия других факторов после предобработки клеток ФНО-альфа существенно не менялась (Данные приведены на Фиг.7).
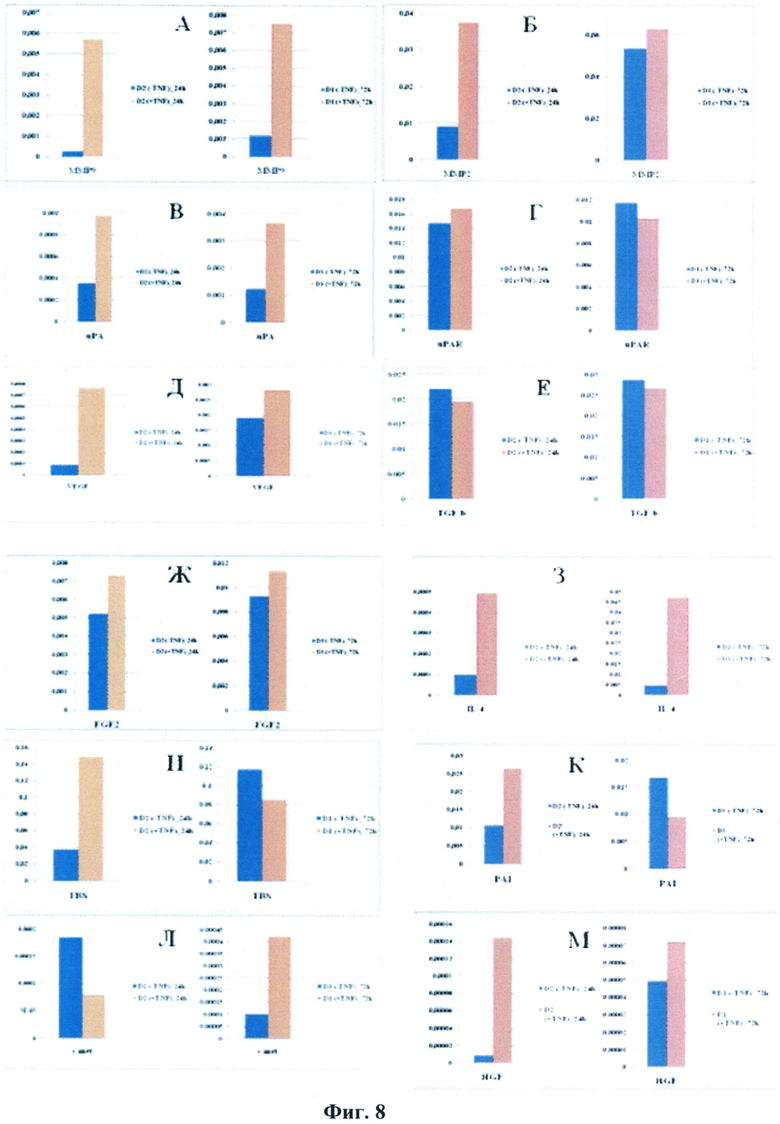
В дополнение к вышеописанному авторами настоящего изобретения проведена оценка влияния ФНО-альфа на образование факторов роста, результаты которой представлены на Фиг.8. СКЖТ культивировали в присутствии 5 нг/мл ФНО-альфа в течение 24 или 72 часов. Проведенный анализ показал, что в первые 24 часа инкубации в присутствии фактора некроза опухолей наблюдается усиление транскрипции ММП9, ММП2, урокиназы, VEGF, интерлейкина-4, TBS-1, PAI-1 и HGF. Это усиление было стойким и сохранялось в течение 72 час. в случае ММП9, uPA, IL-4.
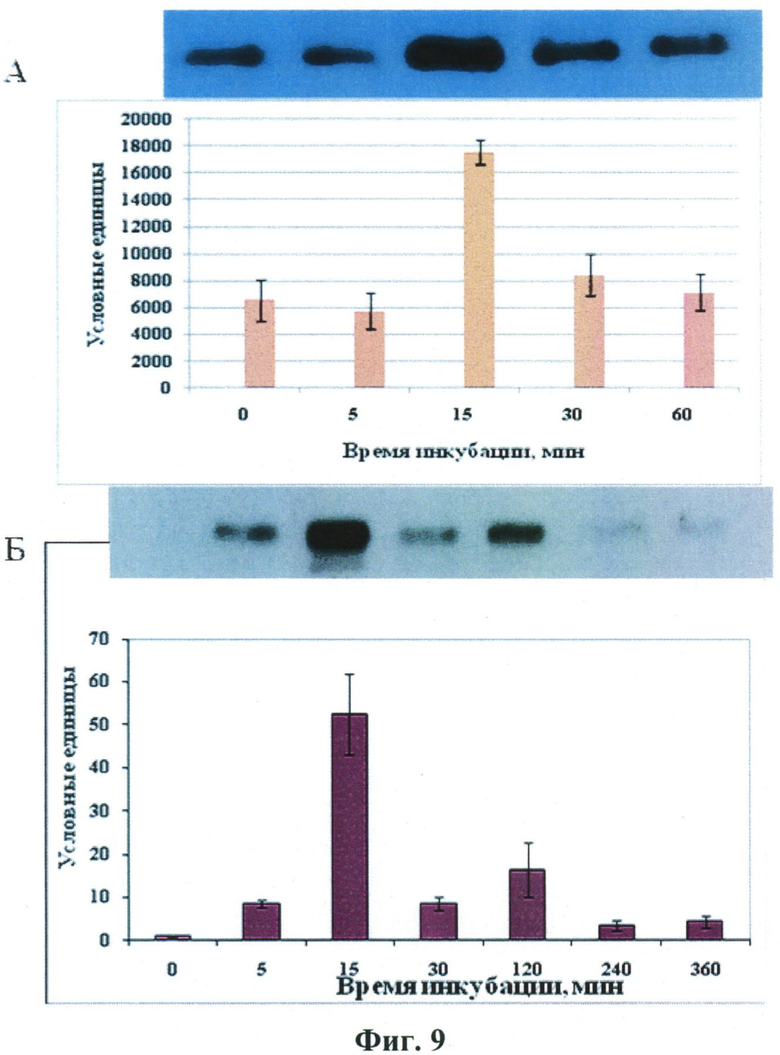
Авторами настоящего изобретения проведено изучение регуляции механизмов передачи клеточного сигнала, опосредующих миграцию стромальных клеток жировой ткани фактором некроза опухолей. Результаты представлены на Фиг.9. Проведенные эксперименты показали, что фактор некроза опухолей вызывает активацию р38 МАР-киназы, киназы ERK1, 2, а также ингибиторной субъединицы фактора транскрипции NFkB (IkB), обусловливая тем самым активацию самого фактора транскрипции.
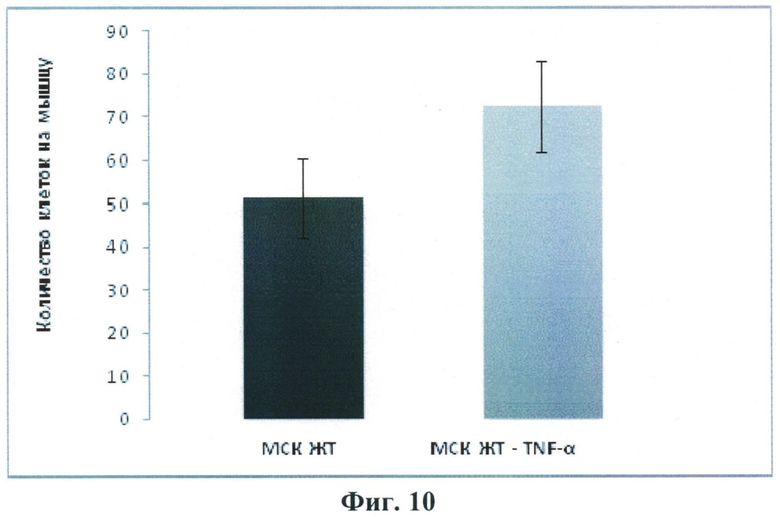
Основываясь на данных, полученных на культурах стромальных клеток жировой ткани, авторы настоящего изобретения провели изучение влияния прекондиционирования (праймирования) клеток в присутствии ФНО-альфа на их количество, обнаруживаемое после введения экспериментальным животным. Авторы обнаружили, что культивирование СКЖТ мыши перед трансплантацией в присутствии ФНО-альфа способствует увеличению их хоуминга в ишемизированные мышцы задней конечности мыши. Эти данные представлены на Фиг.10.
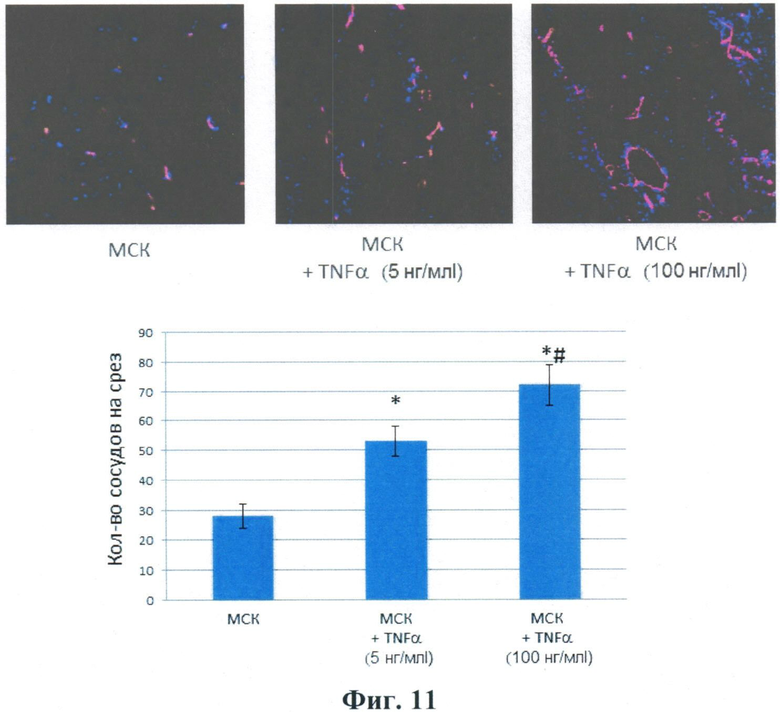
Авторами также показано, что введение мышам подкожного имплантата Матригеля, содержащего СКЖТ, предкультивированные в присутствии ФНО-альфа (+TNFα) в концентрации 5 и 100 нг/мл, усиливает васкуляризацию (прорастание сосудов). Эти данные представлены на Фиг.11.
Краткое описание фигур
Фиг.1.
Миграция СКЖТ в камере Бойдена на хемоаттрактанты SDF, HGF, PDGF, RANTES, uPA, EGF и эмбриональную телячью сыворотку (FBS). В качестве отрицательного контроля использовали культуральную среду, не содержавшую сыворотки и хемоаттрактантов.
Фиг.2.
Измерение уровня экспрессии рецепторов факторов роста (PDGF, c-Met, uPAR) и молекул адгезии (VCAM-1, ICAM-1, гиалуронановый рецептор, NCAM) методом цитофлюориметрии в потоке.
Фиг.3.
Адгезия СКЖТ на основные белковые компоненты внеклеточного матрикса: Коллаген I и III типов, желатин и фибронектин. В качестве отрицательного контроля использовалась адгезия клеток на пластик, покрытый БСА, в качестве позитивного контроля - адгезия на поли-D-лизине.
Фиг.4.
Зависимость скорости миграции чСКЖТ в системе Transwell от концентрации ФНО-альфа в условиях стимуляции хемотаксиса (наличие градиента концентрации цитокина) и хемокинеза (отсутствие градиента концентрации цитокина).
Фиг.5.
Влияние ФНО-альфа на хемотаксис стромальных клеток жировой ткани (СКЖТ) по градиенту концентраций хемоаттрактантов. Перед измерением миграции СКЖТ депривировали в течение ночи, затем преинкубировали (примировали) в течение 24 часов в присутствии 5 нг/мл ФНО-альфа. Измерение миграции проводили в системе Transwell (BD Falcon Bedford, США), представляющей собой 24-луночную плашку со вставками, оборудованными пористым полиэтилентерефталатным фильтром с диаметром пор 8 мкм. СКЖТ снимали с культуральных чашек раствором 2 мМ ЭДТА/PBS и центрифугировали при 200g 10 мин, затем ресуспендировали в среде для хемотаксиса (DMEM/0,25% BSA) в концентрации 120 тыс клеток/мл. Пористые фильтры покрывали раствором коллагена I типа 100 мкг/мл (ИМТЕК) на 37°C в течение часа, затем промывали PBS, высушивали и затем заполняли верхние камеры клеточной суспензией, после чего переносили в планшет, заполненный средой для хемотаксиса с добавлением хемоаттрактантов. Инкубацию проводили в течение 20 часов в CO2-инкубаторе при 37°C. Затем непромигрировавшие клетки счищали с верхней поверхности фильтра, а клетки на нижней поверхности фиксировали в метаноле и окрашивали красителем Diff-Quick, количество промигрировавших клеток в каждой лунке подсчитывали с помощью светового микроскопа (×400) в 6 случайно выбранных секторах. В качестве хемоаттрактантов использовали тромбоцитарный фактор роста PDGF-BB (10 нг/мл), фактор стромальных клеток SDF-1 (150 нг/мл), урокиназу uPA (2,5 нг/мл), человеческий сывороточный альбумин HSA (50 мкг/мл) и фетальную сыворотку теленка FCS (15%), вносимые в нижнюю камеру системы Transwell непосредственно перед началом измерения миграции клеток.
Фиг.6.
Образование матриксных металлопротеиназ стромальными клетками жировой ткани при стимуляции ФНО-альфа в комбинации с хемокинами, а также урокиназой и ее рекомбинантными формами. А-ФНО-альфа добавляли к клеткам в сочетании с хемокинами SDF-1, RANTES, IGF в указанных концентрациях, с последующей инкубацией культуры в CO2-инкубаторе в течение 24 час. Б-клетки инкубировали в присутствии ФНО-альфа в сочетании с PDGF-BB или EGF в тех же условиях.
Фиг.7.
Влияние фактора некроза опухолей-альфа на экспрессию молекул адгезии и рецепторов хемокинов и ростовых факторов стромальными клетками жировой ткани.
Фиг.8.
Влияние ФНО-альфа на продукцию факторов роста стромальными клетками жировой ткани. СКЖТ культивировали в отсутствие ФНО-альфа (-TNF-α) или в присутствии 5 нг/мл фактора (+TNF-α) в течение 24 или 72 часов. Затем клетки лизировали, выделяли РНК и оценивали образование транскриптов ММП9 (А), ММП2 (Б), урокиназы (uPA, В), урокиназного рецептора (uPAR, Г), VEGF (Д), TGF-β (Е), FGF-2 (Ж), интерлейкина-4 (IL-4, З), TBS-1 (И), PAI-1 (К), c-met (Л) и HGF (М) методом ПЦР в реальном времени, используя специфические праймеры, методом ПЦР в реальном времени (RT-PCR), как описано в тексте.
Фиг.9.
Протеинкиназные компоненты внутриклеточного сигналинга, активируемые фактором некроза опухолей и стромальных клетках жировой ткани. А-фосфорилирование р38-МАР-киназы, Б-фосфорилирование и деградация ингибирующей субъединицы фактора транскрипции NFkB (IkB), выявляемые методом Вестерн-блоттинга с использованием антител, специфических к фосфоформам этих белков.
Фиг.10.
Результаты подсчета количества стромальных клеток на срезах мышц экспериментальных животных. МСК ЖТ-TNF-α - клетки, предстимулированные TNF-α (5 нг/мл) в течение 24 часов 4 МСК ЖТ - клетки, культивируемые в обычной среде (достоверность различия - p<0,05).
Фиг.11 Васкуляризация подкожного имплантата Матригеля у мыши, содержащего МСК ЖТ, предкультивированные в присутствии ФНО-альфа (+TNFα) в концентрации 5 и 100 нг/мл. Верхняя панель - репрезентативные фотографии сосудов на срезах подкожного имплантата Матригеля у мыши. Сосуды визуализированы окраской антителами к маркеру эндотелия мыши CD31 (красная флуоресценция). Нижняя панель - результаты подсчета плотности сосудов на срезах имплантата Матригеля. * - достоверность различия между контрольной группой (МСК) и опытными группами (MCK/TNFα) - p<0,01; # - достоверность различия между двумя опытными группами p=0,05.
Осуществление изобретения
Получение первичной культуры СКЖТ человека.
Для получения первичной культуры клеток СКЖТ использовали материал подкожного жира человека, полученного в результате удаления интактного жирового отложения при проведении хирургических операций. Выделение клеток из полученного в результате операции материала осуществляли в стерильных условиях ламинарного бокса. Ткань измельчали сосудистыми ножницами до консистенции суспензии мелких (размером не более нескольких кубических миллиметров) кусочков и смешивали с раствором ферментов коллагеназы I типа (200 ед/мл, Worthington Biochemical, США) и диспазы (25 ед/мл Invitrogen Corporation, Германия) при соотношении объема ткани (в мл) к объему ферментативного раствора (в мл) 1:2. Образец инкубировали при 37°C в течение 45-60 мин при постоянном покачивании; по окончании инкубации к нему добавляли равный объем среды DMEM (Gibco)/10% фетальная сыворотка быка (HyClone) и центрифугировали при 200g в течение 10 мин.
Белесый поверхностный слой, представленный зрелыми адипоцитами и кусочками ферментативно необработанной ткани, удаляли, а осадок, состоящий из стромальных клеток жировой ткани (СКЖТ), а также остатков соединительной ткани и клеток крови суспендировали в лизирующем буфере для эритроцитов. Полученную смесь инкубировали 2-3 минуты в 37°C при перемешивании, после чего к образцу добавляли равный объем среды DMEM/10% ФСБ и фильтровали через нейлоновые мембраны (BD Falcon Cell Stainer) с размером пор 40 микрон. Для очищения популяции стромальных клеток от клеток крови и клеточного дебриса на конечном этапе суспензию центрифугировали при 200g оборотах 5 мин. Супернатант удаляли, а осадок ресуспендировали в среде DMEM F-12 (Hyclone)/100 Ед/мл пенициллин/10 мкг/мл стрептомицин (GIBCO BRL). Затем высаживали клетки на чашки Петри (Corning) диаметром 100 мм и культивировали в среде DMEM-F12/10% FBS /100 Ед/мл пенициллина/10 мкг/мл стрептомицина (10 мл) в CO2-инкубаторе (5% CO2) при 37°C. На следующий день удаляли среду культивирования, проводили лизис эритроцитов, добавляя стерильную воду на 30 секунд, затем дебрис и оставшиеся неприкрепившиеся клетки отмывали фосфатно-солевым буфером. После этого к клеткам добавляли свежую среду DMEM-F12/10% FBS /100 Ед/мл пенициллина/10 мкг/мл стрептомицина. В дальнейшем смену среды проводили каждые 2-3 дня; при достижении монослоя клетки пассировали с использованием раствора Версена-трипсина (1:1). Для проведения экспериментов по изучению миграции использовали клетки не старше 2-го пассажа.
Выделение и культивирование СКЖТ мыши.
Стромальные клетки жировой ткани мыши выделяли из подкожной жировой клетчатки мышей линий C57black в возрасте 8-12 недель. Выделение ткани проводилось в асептических условиях. Для выделения клеток у мыши забирали подкожное жировое отложение, располагающееся по бокам в нижней части туловища.
Жировую ткань помещали в одноразовую пробирку со средой DMEM (Sigma)/100 ед/мл пенициллина (Gibco), 100 ед/мл стрептомицина (Gibco), 100 ед/мл фунгизона (Gibco). В стерильных условиях культурального бокса жировую ткань фрагментировали до однородной массы, используя стерильные инструменты, после чего подвергали ферментативной обработке в растворе, содержащем DMEM/100 ед/мл пеницилина о), 100 ед/мл стрептомицина (Gibco), 25 ед/мл диспазы (Worthington Biochemical) и 200 ед/мл коллагеназы I типа (Worthington Biochemical) при 37°C в течение одного часа. По окончании инкубации образец центрифугировали в течение 10 мин при 200g и удаляли супернатант, после чего ресуспендировали в среде культивирования Advance Stem Cell Basal Medium, HyClone) +10% смеси факторов роста (Advance Stem Cell Growth Supplement, HyClone)/100 ед/мл пенициллина, 100 ед/мл стрептомицина (Gibco) и 50% среды MyeloCult (Stemcell Technologies) и фильтровали через одноразовые нейлоновые мембраны с размером пор 40 мкм (BD Falcon) и высаживали на стерильные чашки Петри. На следующий день удаляли среду культивирования, добавляли свежую среду роста.
Выделенные клетки культивировали в среде роста на чашках Петри в стерильных условиях инкубатора при 37°C и при 5%-ной концентрации CO2. При достижении конфлюэнтного монослоя клетки пассировали. Для этого монослой клеток обрабатывали стерильным раствором Трипсина-Версена 1:1 (ПанЭко). Суспензию открепившихся от подложки клеток рассаживали в соотношении 1:3. Для проведения экспериментов использовали клетки не старше 2-го пассажа.
Направленная миграция клеток в камере Бойдена
Способность СКЖТ к миграции по градиенту хемоаттрактанта оценивали, используя камеру Бойдена (Neuroprobe, Cabin John, США).
Для подготовки к использованию поликарбонатный пористый фильтр с диаметром пор 12 мкм (Neuroprobe) покрывали раствором коллагена I типа 100 мкг/мл (ИМТЕК) в вакууме в течение часа. Затем фильтр сушили на воздухе 15 мин.
Клетки 2-го пассажа, с 70% конфлюента отмывали PBS от культуральной среды и оставляли на ночь в бессывороточной среде DMEM (Gibco). На другой день клетки снимали с культуральных чашек раствором 2 мМ ЭДТА/PBS и центрифугировали при 200g 10 мин, затем ресуспендировали в среде для хемотаксиса (DMEM/0,25% BSA) в концентрации 450 тыс клеток/мл. Этой суспензией заполняли верхние лунки камеры Бойдена (50 мкл на лунку). Предварительно в нижние лунки добавляли среду для хемотаксиса с различными хемоаттрактантами. Клеточная суспензия и раствор хемоаттрактанта в камере Бойдена разделялись покрытым коллагеном пористым фильтром. Клетки инкубировали в CO2-инкубаторе при 37°C в течение 20 часов. Затем непромигрировавшие клетки счищали с верхней поверхности фильтра, а клетки на нижней поверхности фиксировали в метаноле и окрашивали красителем Diff-Quick. Далее подсчитывали количество промигрировавших клеток в каждой лунке с помощью светового микроскопа (×400) в 4 случайно выбранных секторах.
Направленная миграция клеток в системе Transwell
В данном методе для изучения способности СКЖТ к миграции по градиенту хемоаттрактанта используется система вставок (BD Falcon Bedford, США), в которой верхняя камера отделена от нижней пористым полиэтилентерефталатным фильтром с диаметром пор 8 мкм. Для изучения хемотаксиса клетки СКЖТ человека предварительно депривировали в течение ночи, после чего снимали с культуральных чашек раствором 2 мМ ЭДТА/PBS и центрифугировали при 200g 10 мин, затем ресуспендировали в среде для хемотаксиса (DMEM/0,25% BSA) в концентрации 120 тыс клеток/мл. Пористые фильтры покрывали раствором коллагена I типа 100 мкг/мл (ИМТЕК) на 37°C в течение часа, затем промывали PBS, высушивали и затем заполняли верхние камеры клеточной суспензией, после чего переносили в планшет, заполненный средой для хемотаксиса с добавлением хемоаттрактантов. Инкубацию проводили в течение 20 часов в CO2-инкубаторе при 37°C. Затем непромигрировавшие клетки счищали с верхней поверхности фильтра, а клетки на нижней поверхности фиксировали в метаноле и окрашивали красителем Diff-Quick, количество промигрировавших клеток в каждой лунке подсчитывали с помощью светового микроскопа (×400) в 6 случайно выбранных секторах.
Анализ экспрессии антигенов на поверхности клеток методом цитофлюориметрии в потоке.
1. Метод прямого окрашивания.
Анализ экспрессии антигенов на поверхности клеток проводили на СКЖТ второго или третьего пассажа. Для открепления клеток от поверхности культурального пластика их обрабатывали раствором 2 мМ ЭДТА/PBS в течение 5 мин при 37°C. Затем клеточную суспензию переносили в центрифужные пробирки, добавляли среду DMEM в соотношении 1:10 и центрифугировали при 200g 10 мин. После чего клетки ресуспендировали в 1 мл PBS и определяли их концентрацию с помощью гемоцитометрической камеры Горяева. Для оценки жизнеспособности клетки окрашивали красителем «Трипановый синий» (Диа-М), средняя жизнеспособность составляла 90-98%.
Далее 100 мкл суспензии СКЖТ в концентрации 1×106 клеток/мл PBS вносили в микроцентрифужные пробирки и добавляли соответствующие флуоресцентно-меченые моноклональные антитела против человеческих антигенов в конечной концентрации 10 мкг/мл.
Образцы инкубировали 30 мин во льду, после чего для отмывки от излишка антител добавляли 1 мл раствора PBS/1% BSA и центрифугировали 5 мин при 400 g на 4°C. Отмывку повторяли 2 раза, затем осадок клеток ресуспендировали в 100-200 мкл PBS/1% BSA и сразу же проводили измерения или фиксировали в 1% растворе формальдегида (Tousimis). Процент клеток, экспрессирующих соответствующие антигены на клеточных мембранах, оценивали на проточном флуориметре Calibur (Becton-Dickinson).
2. Метод двойного окрашивания.
При подготовке клеток и окрашивании антителами процедуры проводятся аналогично методике прямого окрашивания, за исключением того, что в качестве первых антител используются антитела без флуоресцентной метки и вместо фиксации после отмывки от излишка первых антител проводят окраску вторыми антителами, конъюгированными с флуоресцентной меткой, 30 мин, в темноте, во льду. Далее отмывали излишек вторых антител, добавляя 1 мл раствора PBS/1% BSA и центрифугировали 5 мин при 400 g на 4°C. Отмывку повторяли 2 раза, затем осадок клеток ресуспендировали в 100-200 мкл PBS/1% BSA и сразу же проводили измерения или фиксировали в 1% растворе формальдегида (Tousimis). Процент клеток, экспрессирующих соответствующие антигены на клеточных мембранах, оценивали на проточном флуориметре Calibur (Becton-Dickinson, San Jose, США).
Адгезия СКЖТ на различные матриксы
Для изучения адгезионных свойств СКЖТ 96-луночный планшет (Corning-Costar) инкубировали в течение 18 часов на +4°C с растворами матриксных белков. Далее белковые растворы аспирировали и для уменьшения неспецифического взаимодействия добавляли 1% p-p BSA, инкубировали 1 час на 37°C. Затем лунки промывали PBS 3 раза. Для приготовления клеточной суспензии монослой обрабатывали 2 мМ раствором ЭДТА, центрифугировали 200g 10 мин, затем ресуспендировали в уравновешенной в CO2 инкубаторе среде для адгезии (DMEM) в концентрации 500 тыс. клеток/мл и оставляли в CO2 инкубаторе с открытой крышкой на 10 минут. Далее в каждую лунку планшета вносили по 50 мкл PBS, а затем по 50 мкл клеточной суспензии и инкубировали 40 мин на 37°C, 5% CO2. Затем в ряде лунок клетки фиксировали, добавляя к ним 100 мкл 10% формальдегида, а остальные осторожно промывали PBS 2-3 раза, используя пипетку со срезанным наконечником. После чего клетки фиксировали 10% раствором формальдегида 30 минут, промывали 3 раза водой, высушивали и окрашивали 0,1 раствором кристаллического фиолетового (ДИА-М). Адгезионную способность определяли по интенсивности поглощения при 570 нм на планшетном спектрофотометре Multiscan Ascent (Labsystems).
Метод зимографии
Образцы кондиционированных сред клеток СКЖТ (10-20 мкл) смешивали с буфером для образцов (0,0625 М Tris-HCl, pH 6,8, 2% SDS, 10% глицерин, 0,001% бромфенола синий), не содержавшим β-меркаптоэтанол, и подвергали электрофорезу в присутствии додецилсульфата натрия в 7,5% полиакриламидном геле, содержащем 0,2% желатин, при 4°C и 150 В. Молекулярные массы белков определяли с помощью белковых стандартов (Bio Rad). После электрофореза гели промывали в 2,5% Тритон Х-100 в течение 1,5 ч с последующей 18 час инкубации гелей в буфере, содержащем 50 мМ Tris-HCl (pH 8,0), 50 мМ NaCl, 0,05% Brij 35, и 10 мМ CaCl2. После инкубации гели окрашивали 0,25% кумассидом бриллиантовым синим G-250 в 40% (по объему) метаноле и 10% (по объему) уксусной кислоте с последующей отмывкой от избытка красителя смесью 40% метанола и 10% (по объему) уксусной кислоты. Протеолитическую активность оценивали путем измерения интенсивности неокрашенных полос на фоне желатина, окрашенного кумассидом.
ПЦР в реальном времени
Выделение РНК из клеток проводили с помощью набора колонок и реагентов RNeasy (Qiagen) согласно рекомендации производителя.
Для анализа экспрессии генов проводили ПЦР в реальном времени с интеркалирующим красителем Sybr Green («Синтол», Россия) в амплификаторе «iCycler iQ5. Multicolor Real-time PCR detection system» («Bio-Rad», США). В качестве праймеров использовали уникальные комплементарные пары олигодезоксинуклеотидов к анализируемым генам:

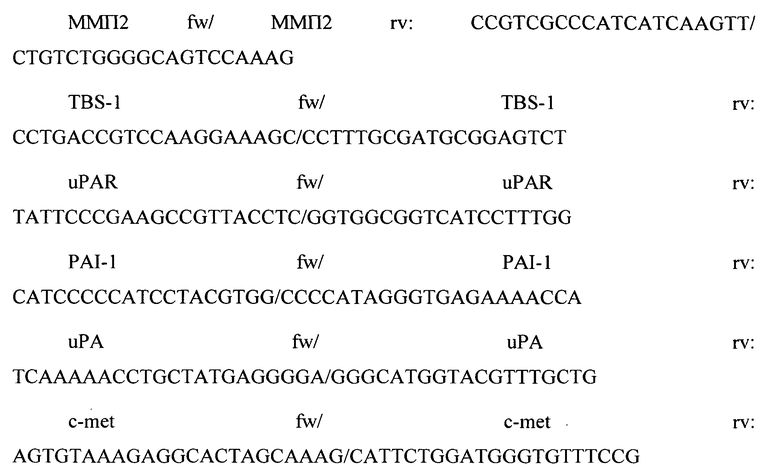
Реакцию проводили в смеси объемом 25 мкл, содержащей 1-5 нг кДНК, 10 пмоль каждого праймера в соответствии со стандартным протоколом фирмы «Синтол». Реакция проводилась с использованием градиента температур. Для дополнительного контроля чистоты реактивов и работы проводили контрольную реакцию, в которой присутствовали все компоненты, кроме матрицы. После начальной стадии денатурации (95°C, 3 мин), для всех праймеров проводилось 40 последовательных циклов амплификации, включавших в себя денатурацию (95°C, 10 сек), «отжиг» (61°C, 30 сек.) и элонгацию (70°C, 30 сек).
Для анализа специфичности амплификации по окончании ПЦР-РВ проводили плавление продуктов с постоянным анализом флуоресценции для построения кривых плавления, а также проводили электрофорез ампликонов в 1% агарозном геле в 1х буфере трис-ацетат-ЭДТА.
Вестерн-блот
Оценку активности МАР-киназ методом Вестерн-блоттинга проводили, стимулируя СКЖТ в присутствии ФНО-альфа (100 нг/мл).
Затем клетки снимали с подложки и лизировали в 100 мкл 2х SDS-бефера для образцов (20 мМ дитиотреитола, 6% SDS, 0,25 М трис, pH 6,8, 10% глицерина, 10 мМ NaF и бромфеноловый синий). Экстракты нагревали в кипящей водяной бане в течение 5 минут, затем обрабатывали ультразвуком с зондом 3-4 раза по 5-10 сек. Образцы разбавляли 1х SDS-буфером для образцов до нужной коцентрации, подвергали SDS-электрофорезу в полиакриамидном геле. Затем белки электрофоретически переносили на поливинилиден-дифторидную (PVDF) мембрану (Millipore, Bedford, MA). После блокирования 2% сухого молока в TBST (20 мМ Трис-HCl, pH 7,6, 150 мМ NaCl, 0,1% твин-20) в течение 1 часа при комнатной температуре, мембрану инкубировали в течение ночи при 4°C с первичными антителами. Затем блоты промывали и инкубировали с вторичными поликлональными антителами, конъюгированными с пероксидазой хрена (HRP), в течение 1 часа при комнатной температуре. Далее оценивали светимость образцов с помощью набора ECL Advance Western Blotting Kit (Amersham Biosciencesa) в соответствии с инструкцией производителя.
Праймирование стромальных клеток жировой ткани мыши фактором некроза опухолей
Для праймирования клеток перед трансплантацией с помощью культивирования в присутствии ФНО-альфа использовались стромальные клетки жировой ткани 2 пассажа, достигшие 70% конфлюента. Среда культивирования Advance Stem Cell Basal Medium, HyClone) +10% смеси факторов роста (Advance Stem Cell Growth Supplement, HyClone)/100 ед/мл пенициллина, 100 ед/мл стрептомицина (Gibco) и 50% среды MyeloCult (Stemcell Technologies) заменялась на свежую, содержащую 5 нг/мл рекомбинантного мышиного ФНО-альфа (R&D Systems) и клетки инкубировались в течение 18 часов, после чего их снимали раствором Трипсина-Версена 1:1 (ПанЭко), метили мембранным флуоресцентным красителем РКН (Sigma) по протоколу производителя и вводили мышам линии C57black.
Модель односторонней ишемии задней конечности мыши
Для создания тяжелой острой ишемии использовали самцов мышей линии С57/В16 весом 25-30 г (8-10 недель), для которых характерно хорошее развитие коллатерального кровотока, позволяющее наличие большого количества ремоделирующихся мелких сосудов, по которым возможен приход циркулирующих клеток в зону ишемии. Животных наркотизировали внутрибрюшинным введением 2,5% раствора авертина. После этого под бинокулярным микроскопом производился разрез кожи ножницами в области проекции a. femoralis, на сосуд накладывались шелковые лигатуры нитью 6-0, затем рана ушивалась атравматической иглой с шелковой нитью 4-0.
1) Модель тяжелой ишемии
2) Модель умеренной ишемии
3) Ишемия/реперфузия с продолжительностью ишемической фазы в 1 ч.
Для создания тяжелой ишемии производился продольный разрез кожи левого бедра мыши от области паховой связки до коленной области. Бедренная артерия выделялась целиком от начала (бифуркации а. Iliaca externa) до ее разделения на a. poplitae и a. saphenous и ее ветви, включая a. epigastrica inferior, а. femoralis profunda, a. circumflexa lateralis, перевязывались и отсекались. Таким образом, кровоснабжение дистальной части конечности оказывалось нарушенным на протяжении.
Умеренная ишемия индуцировалась путем лигирования без иссечения а. femoralis над ее дистальной бифуркацией с сохранением n. ischiadicus и v. femoralis. В данном случае лигирование позволяло нарушить кровоснабжение нижележащих тканей с относительно сохранными крупными коллатералями, отходящими от вышележащей части a. femoralis.
Модель ишемии/реперфузии состояла в следующем: a. femoralis лигировалась шелковой нитью с подложенным под нее полиэтиленовым катетером, защищающим стенку сосуда от травмы. Нарушение кровотока регистрировалось методом лазер-допплеровского сканирования. Через 60 минут лигатура снималась, кожа ушивалась, а остаточная ишемия вновь регистрировалась на лазерном допплеровском сканере.
Для оценки кровотока использовали лазер-допплеровский сканер (Laser Doppler Imaging System, Moor, Великобритания). Измерения кровотока проводили после операции и перед введением клеточной суспензии. Животное анестезировали в камере с помощью изофлюрана, после чего поддерживали глубину наркоза с помощью дыхательной маски, в которую подавалась смесь кислорода и 1-2% изофлюрана. Перед началом сканирования в течение 10-15 минут выдерживали на матрасе с температурой около 37°C. В обработку включались данные, полученные при условии, что разница в результатах двух последовательных измерений, проведенных с интервалом в 5 минуты, не превышала 10%. Для снижения возможного разброса результатов измерений при переходе от одного животного к другому, а также для исключения влияния внешних факторов (свет, глубина наркоза, температура в лаборатории и т.д.) данные обрабатывали в виде отношения кровотока в ишемизированной конечности (левая лапа) к кровотоку в интактной лапе.
Через 72 часа после операции животных наркотизировали и системно выполнялось введение 1 миллиона меченых СКЖТ, ресуспендированных в 200 мкл фосфатно-солевого буфера без магния и кальция.
После введения клеток животных забивали через 15 минут, 12 часов, 1 сутки и от них забирались образцы тканей легкого, сердца, m. tibialis anterior, которые замораживались в среде Tissue tek в парах жидкого азота. Образцы хранились при температуре -70°C. С каждого замороженного фрагмента на криостате при температуре -70°C были получены серийные замороженные срезы толщиной 6 мкм с шагом 500 мкм. Стекла со срезами хранились при температуре -20°C. Для выделения РНК образцы замораживали с помощью быстрого погружения в жидкий азот. До анализа образцы ткани хранились при температуре -70°C.
Праймирование стромальных клеток жировой ткани мыши фактором некроза опухолей перед введением в Матригель
МСК ЖТ мышей C57Black культивировали в среде для недифференцированных мезенхимальных клеток (НМКЧ, Basal medium for human undifferentiated mesenchymal stem cells, HyClone, США), содержащей 10% ростовой добавки (РД, stem cell growth supplement, HyClone, США), 100 ед/мл пенициллина, 100 ед/мл стрептомицина. Перед внесением в Матригель клетки преинкубировали в течение 18 часов в свежей среде Basal medium for human undifferentiated mesenchymal stem cells, содержащей 10% ростовой добавки, в присутствии 5 или 100 нг/мл фактора некроза опухолей-альфа. Затем клетки промывали раствором Версена (0,02% раствор ЭДТА) и обрабатывая HQtase (HyClone, США), реагентом для более мягкого, чем при использовании 0,25% раствора трипсина, открепления клеток от пластика.
Имплантация клеток в матригеле
Для проведения эксперимента мышам линии С57 подкожно в область паха проводили инъекцию 400 мкл Матригеля (Matrigel, BD Biosciences, США), смешанного с 200 мкл клеточной суспензии в фосфатно-солевом буфере без магния и кальция (1000000 клеток). Через 14 дней после начала эксперимента извлекали имплантанты матригелей, помещали в кюветы со средой О.С.Т. Tissue-Tek (Sakura, Япония) и замораживали в жидком азоте.
Подготовка тканей
Образцы имплантантов матригелей замораживали в жидком азоте в среде О.С.Т. Tissue-Tek (Sakura, Япония). Образцы хранили при температуре -70°C. Гистологический анализ проводили на замороженных срезах толщиной 7-10 мкм. Стекла со срезами тканей фиксировали в течение 2 минут в ацетоне, охлажденном до -20°C.
Иммунофлуоресцентное окрашивание образцов матригелей
Перед окрашиванием антителами срезы матригеля фиксировали раствором 4% формальдегида в течение 10 минут. Далее срезы промывали три раза буфером ФСБ. Для снижения неспецифического связывания антител срезы помещали в блокирующий раствор (2% БСА/5% кроличьей сыворотки/ФСБ) и инкубировали 30 минут. После этого срезы отмывали от избытка блокирующего раствора при помощи ФСБ и окрашивали антителами. Срезы окрашивали, используя немеченые крысиные антитела против CD31 мыши (анти-CD31, 1:100, BD Biosciences, США). Растворы антител готовили на 1% БСА/ФСБ. В качестве контрольных антител использовали аналогичное опытному (анти-CD31) разведение IgG2a,k крысы (BD Biosciences, США). После отмывки от избытка блокирующего раствора срезы на 60 минут помещали в раствор указанных антител, инкубацию проводили в темноте при комнатной температуре. После этого срезы 3 раза отмывали в ФСБ. Далее срезы на 60 минут помещали в раствор вторичных антител (кроличьи анти IgG крысы, Alexa Fluor 594, 1:2000, Invitrogen, США). Затем ядра клеток окрашивали при помощи ядерного красителя DAPI в течение 10 мин, после чего срезы промывали буфером ФСБ, заключали в среду Aqua polymount и накрывали предметными стеклами.
Микроскопические данные анализировали при помощи микроскопа Axiovert 200М («Zeiss», Германия). Документирование изображений производили с помощью цифровой видеокамеры Axiocam HRC («Zeiss», Германия), а последующую их обработку - в программах Axiovision 3.1 («Zeiss», Германия), MetaMorph 7.1.0.0 (Universal Imaging Corporation).
Для каждого среза матригеля с помощью цифровой фотокамеры получали серию снимков, охватывающих более 80% поверхности среза.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПОПУЛЯЦИИ СТРОМАЛЬНЫХ КЛЕТОК ЖИРОВОЙ ТКАНИ, ИНДУЦИРОВАННЫХ К НЕЙРАЛЬНОЙ ДИФФЕРЕНЦИРОВКЕ | 2008 |
|
RU2396345C1 |
| СПОСОБ ПОЛУЧЕНИЯ КУЛЬТУРЫ КЛЕТОК С ИНДУЦИРОВАННЫМ АНГИОГЕННЫМ ФЕНОТИПОМ, ПРЕДНАЗНАЧЕННОЙ ДЛЯ ТКАНЕВОЙ ИНЖЕНЕРИИ В ЗОНЕ ИШЕМИИ | 2007 |
|
RU2334793C1 |
| СПОСОБ ИНДУКЦИИ МИГРАЦИИ СТВОЛОВЫХ КЛЕТОК ЖИРОВОЙ ТКАНИ | 2010 |
|
RU2527182C2 |
| СПОСОБ ОЦЕНКИ АНГИОГЕННОГО ПОТЕНЦИАЛА ПРОГЕНИТОРНЫХ КЛЕТОК У БОЛЬНЫХ СЕРДЕЧНО-СОСУДИСТЫМИ ЗАБОЛЕВАНИЯМИ | 2011 |
|
RU2548801C2 |
| СПОСОБ СТИМУЛЯЦИИ РЕГЕНЕРАТИВНЫХ ПРОЦЕССОВ В ИШЕМИЗИРОВАННЫХ ТКАНЯХ | 2011 |
|
RU2497529C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЭНДОТЕЛИАЛЬНЫХ КЛЕТОК ИЗ ЭМБРИОНАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК ЧЕЛОВЕКА (ВАРИАНТЫ) | 2008 |
|
RU2359030C1 |
| КОСМЕТИЧЕСКОЕ СРЕДСТВО НА ОСНОВЕ ПРОДУКТОВ СЕКРЕЦИИ МЕЗЕНХИМНЫХ СТВОЛОВЫХ/СТРОМАЛЬНЫХ КЛЕТОК ЖИРОВОЙ ТКАНИ ЧЕЛОВЕКА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2016 |
|
RU2620342C1 |
| СПОСОБ ПОВЫШЕНИЯ ИММУНОСУПРЕССИВНЫХ СВОЙСТВ МЕЗЕНХИМАЛЬНЫХ СТРОМАЛЬНЫХ КЛЕТОК ЖИРОВОЙ ТКАНИ | 2012 |
|
RU2526575C2 |
| СРЕДА КУЛЬТИВИРОВАНИЯ МУЛЬТИПОТЕНТНЫХ СТРОМАЛЬНЫХ КЛЕТОК ИЗ ЖИРОВОЙ ТКАНИ ЧЕЛОВЕКА И СПОСОБ КУЛЬТИВИРОВАНИЯ ЭТИХ КЛЕТОК С ЕЕ ИСПОЛЬЗОВАНИЕМ | 2010 |
|
RU2418855C1 |
| СПОСОБ ЭКСПАНСИИ КЛЕТОК, СПОСОБ ПОЛУЧЕНИЯ КОНДИЦИОННОЙ СРЕДЫ, ПОПУЛЯЦИЯ АДГЕЗИВНЫХ МЕЗЕНХИМАЛЬНЫХ СТРОМАЛЬНЫХ КЛЕТОК ПЛАЦЕНТЫ ИЛИ ЖИРОВОЙ ТКАНИ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРИМЕНЕНИЕ АДГЕЗИВНЫХ МЕЗЕНХИМАЛЬНЫХ СТРОМАЛЬНЫХ КЛЕТОК ПЛАЦЕНТЫ ИЛИ ЖИРОВОЙ ТКАНИ В ТРАНСПЛАНТАЦИИ | 2007 |
|
RU2433177C2 |
Изобретение относится к области клеточной биологии, клеточной трансплантологии и тканевой инженерии. Способ повышения ангиогенной активности стромальных клеток жировой ткани в тканях и органах включает выделение стромальных клеток жировой ткани, культивирование выделенных клеток в присутствии фактора некроза опухолей-альфа в количествах 5 или 100 нг/мл в течение 24-72 часов с последующим трансплантированием в ткани или органы. Изобретение может быть использовано для восстановления тканей, поврежденных в результате травм, и остановки развития патологии, связанной с ишемией. 2 з.п. ф-лы, 11 ил.
1. Способ повышения ангиогенной активности стромальных клеток жировой ткани в тканях и органах при трансплантации, включающий выделение стромальных клеток жировой ткани, культивирование выделенных клеток с использованием прекондиционирования в присутствии ФНО-альфа, который используют в количестве 5 или 100 нг/мл в течение 24-72 часов, с последующим трансплантированием прекондиционированных клеток в ткани или органы.
2. Способ по п.1, характеризующийся тем, что в качестве среды культивирования используют среду DMEM-F12, содержащую FBS в количестве 10-15% (об.%), пенициллин в количестве 100 Ед/мл и стрептомицин в количестве 10 мкг/мл.
3. Способ по п.1, характеризующийся тем, что в качестве среды культивирования используют среду, содержащую тромбоцитарный фактор роста PDGF-BB в количестве 10 нг/мл, и/или фактор стромальных клеток SDF-1 в количестве 150 нг/мл, и/или урокиназу uPA в количестве 2,5 нг/мл.
| СПОСОБЫ И КОМПОЗИЦИИ, ПРИГОДНЫЕ ДЛЯ ИНГИБИРОВАНИЯ АНГИОГЕНЕЗА | 1995 |
|
RU2162712C2 |
| US 0007217788 B2, 15.05.2007 | |||
| US 20050148034 A1, 07.07.2005 | |||
Авторы
Даты
2014-10-20—Публикация
2011-08-09—Подача