Область техники, к которой относится изобретение
Группа изобретений относится к области косметологии и космецевтики и может быть использована для стимуляции процессов регенерации в различных слоях кожи, тем самым оказывая косметический эффект. Также группа изобретений относится к способу ингибирования старения кожи, предотвращения и/или исправления косметических дефектов. Использование данной группы изобретений позволяет стимулировать обновление клеток кожи за счет регенеративного действия сбалансированного комплекса биоактивных факторов, секретируемых мезенхимными стволовыми/стромальными клетками (МСК) человека.
Уровень техники
Из уровня техники известна композиция для стимулирования роста и регенерации клеток, а также способы ее получения (RU 2341270 C1). Композиция содержит разрушенные клетки лейкоцитов периферической крови и стволовые и/или прогениторные клетки в кондиционированной среде их культивирования. Способ получения данной композиции для стимуляции роста и регенерации клеток предусматривает получение кондиционированной культуральной среды, полученной при культивировании лейкоцитов периферической крови и стволовых и/или прогениторных клеток, их разрушение в кондиционированной среде и объединение указанной композиции с фармацевтически приемлемым носителем. Таким образом, кондиционированная среда не проходит процедуру очистки и содержит большое количество балластных веществ, которые могут оказывать негативное воздействие на ткани. Также следует отметить, что композиция, приготовленная данным способом, содержит разрушенные клетки, которые могут быть потенциально опасны и не рекомендуются для включения в состав косметических средств.
Из уровня техники известна композиция, усиливающая рост волос, основным компонентом которой является среда, полученная путем кондиционирования стволовых клеток амниотической жидкости человека (WO 2010107287 А2). Заявлено, что данная композиция обладает высокой эффективностью, однако состав амниотической жидкости значительно варьирует в зависимости от патологического состояния, кроме того, процедура получения нужного количества амниотической жидкости сопряжена со определенными рисками, как для матери (инфекционные осложнения, сенсибилизация, эмболия околоплодными водами и др.), так и для плода (травмы, вплоть до гибели в редких случаях).
Кроме того, из уровня техники также известна композиция, предназначенная для регенерации кожи и слизистых оболочек, содержащая культуральную питательную среду, включающую биологически активные соединения на основе низкомолекулярных пептидов и цитокинов, используемая для культивирования in vitro эукариотических клеток и содержащая продукты жизнедеятельности и ростовые факторы эукариотических клеток, выделяемые ими в питательную среду в процессе культивирования (RU 2455354 C1). В состав композиции входят мезенхимальные стромальные клетки человека в количестве, по меньшей мере, 105 клеток/мл. Питательная среда - составная часть композиции содержит бычью сыворотку - ксеногенный компонент.
Эмбриональную бычью сыворотку содержит также и композиция для предотвращения или лечения кожных дефектов, и способ, включающий нанесение на кожный дефект композиции, содержащей МСК костного мозга или кондиционную среду, полученную от МСК, или их комбинацию (WO 2008155659 А2). Композиция может быть использована для лечения таких кожных дефектов, как морщины, рубец, возрастное пятно, порез или язва. Недостатком указанных композиций является то, что не определен набор веществ, непосредственно обеспечивающих действие композиции. Включение в состав композиции клеток человека усложняет процессы ее производства, стандартизации, контроля качества и снижает стабильность композиции ввиду ограниченной жизнеспособности клеток.
Из уровня техники также известен экстракт кондиционированной культуральной среды, предназначенный для наружного применения для усиления роста волос и омоложения кожи (WO 2010038232 А1). При этом используют МСК, культивируемые в среде, содержащей сыворотку (эмбриональную бычью или полученную из крови человека), а перед получением экстракта к ней добавляют ростовые факторы. Однако добавление ростовых факторов извне может нарушить сбалансированный состав композиции и увеличить потенциальный риск для здоровья и жизни потребителя, а также увеличивает стоимость композиции.
Наиболее близким к заявляемому изобретению является средство для изменения скорости роста или репродукции клеток и для замедления старения кожи, полученное при культивировании эукариотических клеток в трех измерениях, и способ его получения (RU 2280459 С1). Клеточные культуры могут представлять собой различные типы клеток, в том числе нейрональные, эмбриональные и мезенхимальные стволовые клетки, а также фибробласты, отличительной особенностью является культивирование в трех измерениях. Удаление клеточного компонента предусмотрено способом получения композиции. Достаточно подробно описан качественный состав, акцент сделан на секреции коллагена как структурного белка кожи, однако количественные данные приведены в основном для отдельных цитокинов (IL-8, G-SCF) и некоторых факторов роста (VEGF, KGF, TGFb). Кроме того, в описании не указано количественное содержание других факторов, что не позволяет оценить достоверность представленных данных по эффективности. Кроме того, не раскрыты способы очистки продукта, не оценена степень сохранения активности после проведения лиофилизации и последующего восстановления.
Раскрытие изобретения
Задачей изобретения является создание косметического средства для нанесения на неповрежденную кожу, способного многофункционально воздействовать на кожу с признаками старения - усиливать процессы регенерации, повышать упругость и улучшать внешний вид.
Техническим результатом, на достижение которого направлено заявленное изобретение, является получение косметического средства, эффективно стимулирующего обновление и регенерацию тканей кожи за счет комплексного сбалансированного действия факторов роста и других биологически активных молекул, секретируемых мезенхимными стволовыми/стромальными клетками (МСК) человека в среду культивирования, не содержащую ксеногенных компонентов. Эффективность средства обеспечивается за счет подобранного содержания ключевых биологически активных молекул, составляющих основной действующий компонент и обеспечивающих реализацию действия косметического средства. Качественный и количественный состав заявляемого средства определяется тестированием полученных при кондиционировании МСК человека образцов среды, содержащих продукты секреции клеток, по способности стимулировать миграцию дермальных фибробластов человека на модели клеточной раны in vitro и по наличию комплекса биоактивных факторов, участвующих в процессах регенерации кожи. В состав активного комплекса средства входят структурные белки кожи, ферменты и регуляторы метаболизма структурных белков, а также факторы, стимулирующие трофику и процессы регенерации кожи. Синергетическое действие данного комплекса обеспечивает многофункциональность предлагаемого средства. Кондиционированные среды, которые по итогам тестирования не отвечают заявленным требованиям, отбраковываются.
Поставленная задача решается тем, что косметическое средство для стимуляции регенерации тканей кожи включает в качестве основного компонента культуральную среду, кондиционированную мезенхимными стромальными клетками (МСК) человека, содержащую продукты секреции, включающие VEGF в концентрации не менее 4 нг/млн клеток, FGF basic в концентрации не менее 5.8 пкг/млн клеток, PEDF в концентрации не менее 10 нг/млн клеток, PAI-1 в концентрации не менее 35 нг/млн клеток, а также комплекс из по крайней мере 20 белков, представленных в таблице 1, при этом концентрация указанных компонентов представлена на 10 мл среды.
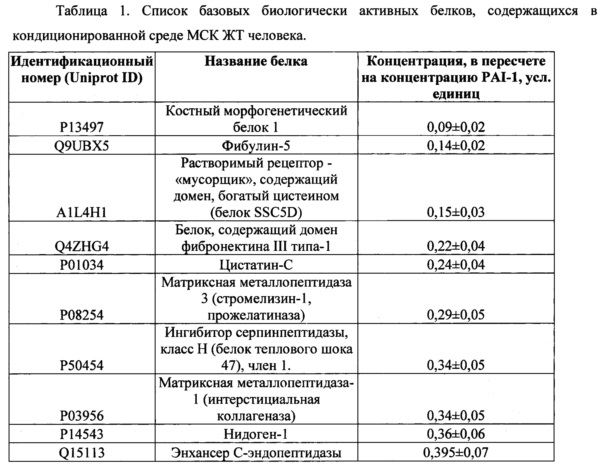
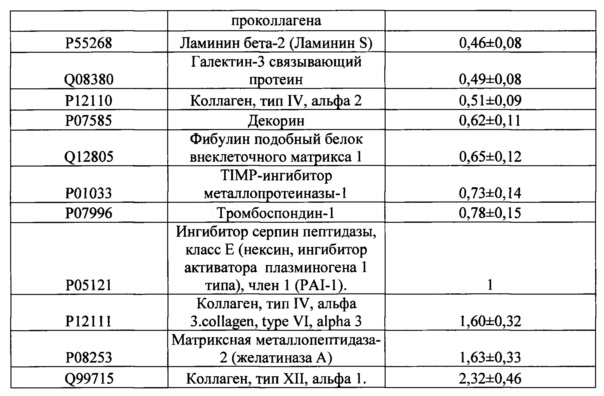
Относительное количественное содержание белков в Таблице 1 представлено с учетом допустимой величины погрешности.
Кроме того, лучший результат достигается при использовании средства, которое включает в качестве основного компонента культуральную среду, кондиционированную МСК человека, содержащую продукты секреции, дополнительно включающие комплекс из, по крайней мере, одного из перечисленных в таблице 2 белков.

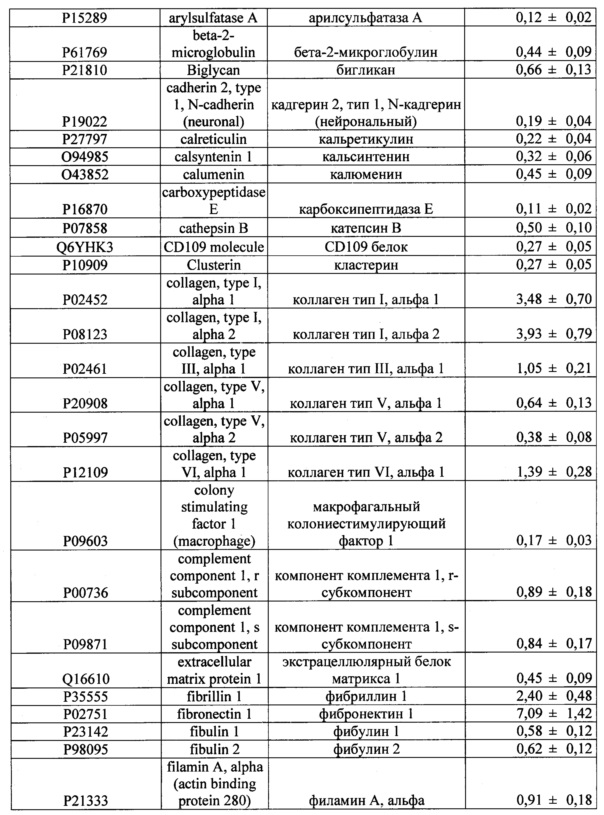
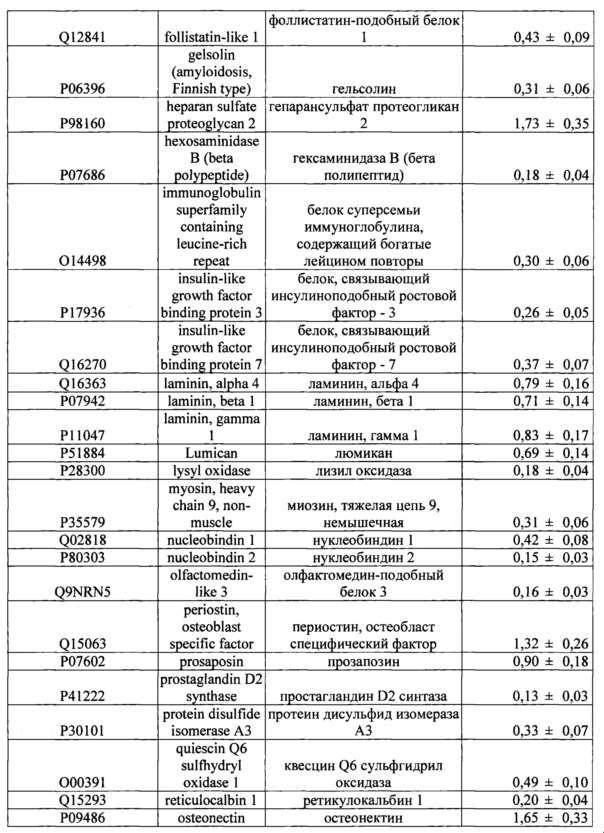

Косметическое средство может быть представлено в виде лиофилизата кондиционированной среды, которое дополнительно может содержать энхансеры трансдермального проникновения, при этом лиофилизат восстанавливают в водном растворе энхансеров. В качестве энхансеров предлагается использовать диметилизосорбид в количестве не менее 1,5% по отношению к массе готового косметического средства, и/или гиалуроновая кислота или ее производные в количестве не менее 1% по отношению к массе готового косметического средства, и/или липосомы различного состава. В качестве производных гиалуроновой кислоты может быть использован гиалуронат натрия, различные природные и химические модификации гиалуроновой кислоты. В качестве липосом различного состава используют липосомы на основе фосфолипидов сои или любых других подходящих фосфолипидов. Продукты секреции МСК человека, содержащиеся в кондиционированной среде, могут быть частично или полностью включены в состав липосом, при этом средство представлено в виде раствора или лиофилизата. Липосомы получают методом продавливания, или удаления детергента. Включение компонентов среды в липосомы может быть реализовано путем лиофилизации.
При получении средства в виде лиофилизата оно может дополнительно содержать фармацевтически совместимое с лиофилизатом и растворимое в воде полимерное вещество (например, метилцеллюлозу), образующее при растворении в водном растворе энхансеров трансдермального проникновения гелеобразную субстанцию - в соотношении по массе не более 1:100 (на 1 часть лиофилизата берут не более 100 частей полимерного вещества), с обеспечением формирования устойчивой гелеобразной субстанции, при этом комбинация лиофилизата с полимером и водный раствор энхансеров смешивают между собой сразу перед нанесением на кожу. В качестве энхансеров в данном продукте также могут быть использованы перечисленные выше компоненты. Гиалуронат натрия и диметилизосорбид может быть использован в виде 1%-ого водного раствора. Кроме того, лиофилизат также может содержать липосомы на основе фосфолипидов сои.
Поставленная задача решается также тем, что способ получения косметического средства на основе кондиционированной среды, содержащей продукты секреции МСК человека, включающий культивирование МСК ЖТ человека до 4 - 5 пассажа в среде, поддерживающей рост недифференцированных мезенхимных клеток человека, отмывку клеток буферным раствором, кондиционирование МСК в бессывороточной и лишенной продуктов животного происхождения среде роста, поддерживающей жизнеспособность клеток не менее 70% и пригодной для терапевтического применения, отбор среды культивирования, содержащей продукты секреции МСК человека, с удалением из нее остатков клеток, предварительное тестирование кондиционированной среды и отбор образцов для получения косметического средства, очистку отобранных образцов от низкомолекулярных компонентов с получением средства, содержащего продукты секреции МСК человека, включающие VEGF в концентрации не менее 4 нг/млн клеток (не менее 200 пкг/мл), FGF basic в концентрации не менее 5.8 пкг/млн клеток (не менее 0,3 пкг/мл), PEDF в концентрации не менее 10 нг/млн клеток (не менее 500 пкг/мл), PAI-1 в концентрации не менее 35 нг/млн клеток (не менее 2 нг/мл), определяемые методом иммуноферментного анализа при восстановлении лиофилизата в 10 мл стерильного буфера с физиологической осмолярностью, а также комплекс из 20 белков, представленных в таблице 1, определяемых методом протеомного анализа.
В одном из вариантов осуществления способа для получения средства отобранные очищенные образцы лиофилизируют.
В наилучшем варианте осуществления изобретения среда, поддерживающая рост недифференцированных мезенхимных клеток человека, представляет собой раствор, содержащий базовую среду - AdvanceSTEM Cell Culture Media, и добавку - AdvanceSTEM Stem Cell Growth Supplement (HyClone, США), при этом добавку берут в объеме 9-11% на 100% объема базовой среды. Кондиционирование осуществляют в культуральных флаконах или чашках Петри (фирмы Corning или аналогичные), при этом МСК ЖТ человека размещают на плоской подложке плотностью 5-15*103/см2 в среде для кондиционирования в объеме 0,1-0,2 мл/см2, затем культуральные емкости с клетками помещают на 6-8 дней в CO2 инкубатор при 37±1°C, 5%-ом содержании CO2 и относительной влажности ≥95%. В качестве буферного раствора для отмывки клеток от компонентов среды роста используют раствор Хэнкса (фирмы ПанЭко или аналогичный), при этом отмывку клеток осуществляют трех-пятикратным размещением клеток в упомянутый раствор из расчета 0,1-0,2 мл раствора на см клеток на 5-10 минут. В качестве среды для кондиционирования используют DMEM с низким содержанием глюкозы (HyClone, США) или другую среду роста, поддерживающую жизнеспособность МСК человека в течение всего срока кондиционирования. Удаление из среды культивирования остатков клеток осуществляют центрифугированием. Предварительное тестирование образцов кондиционированной среды осуществляют по способности стимулировать миграцию фибробластов кожи человека не менее чем на 50% выше по сравнению с отрицательным контролем, в качестве которого выступает базовая среда роста, использованная для кондиционирования МСК человека. Для оценки миграции фибробластов кожи человека используют модель клеточной раны. Очистку среды культивирования осуществляют посредством ее ультрафильтрации с удалением низкомолекулярных соединений массой менее 5 кДа. После очистки среды культивирования от низкомолекулярных соединений дополнительно осуществляют микрофильтрацию полученной среды через фильтры с диаметром пор 0,22 мкм. Лиофилизацию осуществляют в 8-14 стадий при давлении 0,013-0,027 кПа, температуре от -40°C до -5°C, время лиофилизации не более 36 часов при максимальной загрузке лиофильной сушки. Центрифугирование осуществляют при 300±5 g, температуре 6±2°C в течение 10 минут для очистки от клеточного дебриса. Очистку от низкомолекулярных компонентов осуществляют с использованием системы фильтрации в тангенциальном потоке Minim II (Life Sciences, США) или аналогичной.
Краткое описание чертежей
Изобретение поясняется чертежами, где на фигурах представлены:
Фигура 1. Скорость миграции фибробластов кожи человека. График иллюстрирует скорости миграции фибробластов кожи человека в мкм/ч, в условиях in vitro при стимуляции клеток различными растворами: базовой средой DMEM с низким содержанием глюкозы (DMEM neg, отрицательный контроль; n=11), базовой средой DMEM с низким содержанием глюкозы, кондиционированной МСК (заявленного состава) (DMEM 7d, испытуемый образец; n=18), базовой средой DMEM с низким содержанием глюкозы с добавлением 10 об. % эмбриональной бычьей сывороткой (DMEM pos, положительный контроль; n=12). Миграцию фибробластов наблюдали под микроскопом с системой жизнеобеспечения в течение 24 часов, положение клеток фиксировали с помощью автоматической камеры каждые 15 минут. Базовая среда DMEM с низким содержанием глюкозы, кондиционированная МСК (испытуемые образцы), значимо (р<0,01) стимулирует скорость миграции фибробластов кожи человека выше не менее чем на 50% по сравнению с раствором отрицательного контроля. Скорость миграции фибробластов кожи человека, стимулированных раствором положительного контроля, также значимо различается по сравнению с раствором отрицательного контроля (р<0,01); сравнение групп испытуемого образца и положительного контроля не проводили. Статистическую обработку результатов проводили с помощью критерия Краскела-Уоллиса, с использованием критерия Данна в вариации сравнения значений с контрольной группой. В качестве контрольной группы использовали раствор отрицательного контроля.
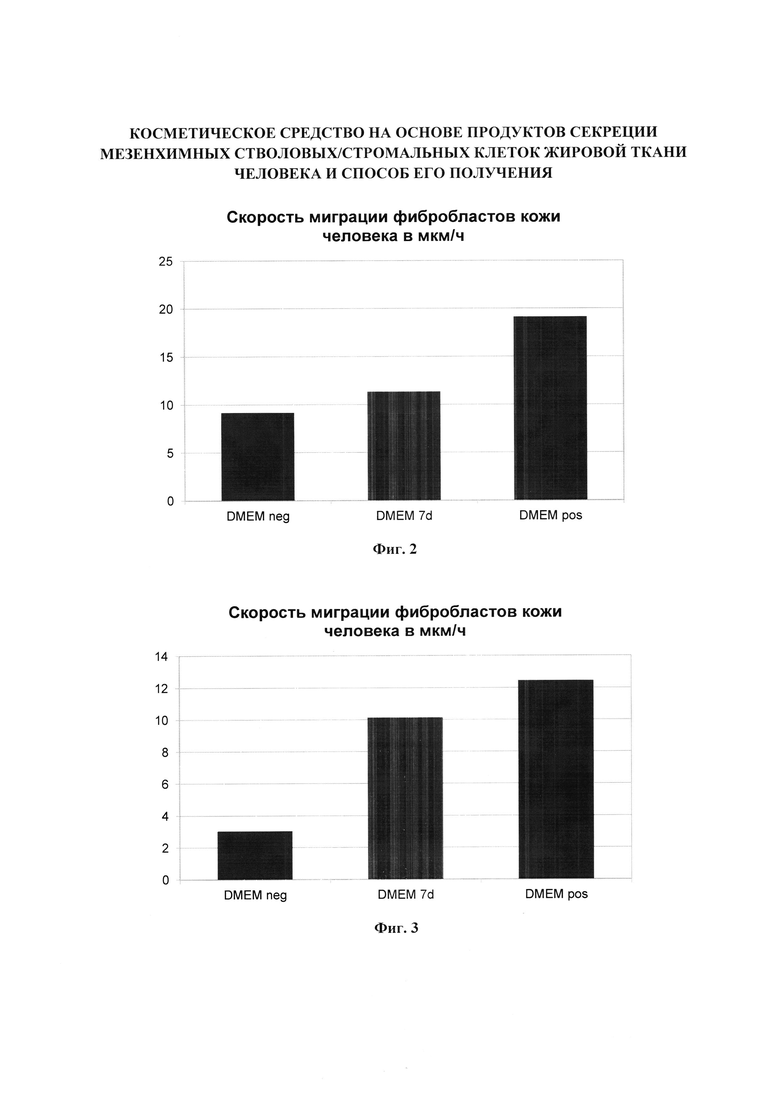
Фигура 2. Скорость миграции фибробластов кожи человека. График иллюстрирует скорость миграции фибробластов кожи человека в мкм/ч, в условиях in vitro при стимуляции клеток различными растворами: базовой средой DMEM с низким содержанием глюкозы (DMEM neg, отрицательный контроль), базовой средой DMEM с низким содержанием глюкозы, кондиционированной МСК (DMEM 7d, испытуемый образец), базовой средой DMEM с низким содержанием глюкозы с добавлением 10 об. % эмбриональной бычьей сывороткой (DMEM pos, положительный контроль). Миграцию фибробластов наблюдали под микроскопом с системой жизнеобеспечения в течение 24 часов, положение клеток фиксировали с помощью автоматической камеры каждые 15 минут. Испытуемый образец стимулирует скорость миграции фибробластов кожи человека, однако менее чем на 50% по сравнению с раствором отрицательного контроля, поэтому отбраковывается по итогам предварительного тестирования.
Фигура 3. Скорость миграции фибробластов кожи человека. График иллюстрирует скорость миграции фибробластов кожи человека в мкм/ч, в условиях in vitro при стимуляции клеток различными растворами: базовой средой DMEM с низким содержанием глюкозы (DMEM neg, отрицательный контроль), базовой средой DMEM с низким содержанием глюкозы, кондиционированной МСК, очищенной, лиофилизированной и затем восстановленной в стерильном физиологическом растворе (DMEM 7d, испытуемый образец), базовой средой DMEM с низким содержанием глюкозы с добавлением 10 об. % эмбриональной бычьей сывороткой (DMEM pos, положительный контроль). Миграцию фибробластов наблюдали под микроскопом с системой жизнеобеспечения в течение 24 часов, положение клеток фиксировали с помощью автоматической камеры каждые 15 минут. Испытуемый образец стимулирует скорость миграции фибробластов кожи человека более чем на 50% по сравнению с раствором отрицательного контроля.
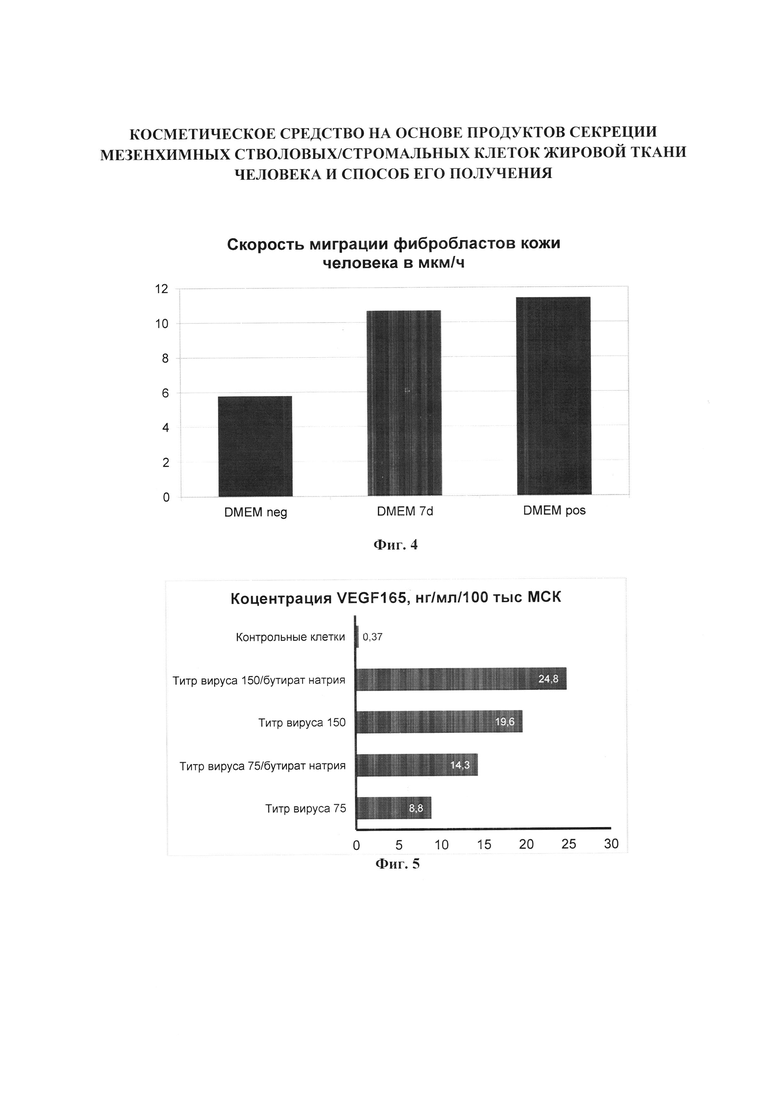
Фигура 4. Скорость миграции фибробластов кожи человека. График иллюстрирует скорость миграции фибробластов кожи человека в мкм/ч, в условиях in vitro при стимуляции клеток различными растворами: базовой средой DMEM с низким содержанием глюкозы (DMEM neg, отрицательный контроль), базовой средой DMEM с низким содержанием глюкозы, кондиционированной МСК, очищенной, лиофилизированной, восстановленной в 1% раствор гиалуроната натрия с диметилизосорбидом (DMEM 7d, испытуемый образец), базовой средой DMEM с низким содержанием глюкозы с добавлением 10 об. % эмбриональной бычьей сывороткой (DMEM pos, положительный контроль). Миграцию фибробластов наблюдали под микроскопом с системой жизнеобеспечения в течение 24 часов, положение клеток фиксировали с помощью автоматической камеры каждые 15 минут. Испытуемый образец стимулирует скорость миграции фибробластов кожи человека более чем на 50% по сравнению с раствором отрицательного контроля.
Фигура 5. Результаты определения концентрации VEGF 165 методом иммуноферментного анализа в кондиционированной среде (72 ч), собранной с культур МСК жировой ткани человека после генетической модификации с помощью бакуловирусного вектора. Приведены данные для контрольных (необработанных) МСК жировой ткани человека после кондиционирования в течение 72 ч, а также результаты после обработки вирусом с титром 75 или 100 частиц/клетку. Концентрация бутирата натрия для стимуляции экспрессии VEGF 165 составляла 5 мМ в течение 15 ч инкубации клеток после удаления р-ра бакуловируса.
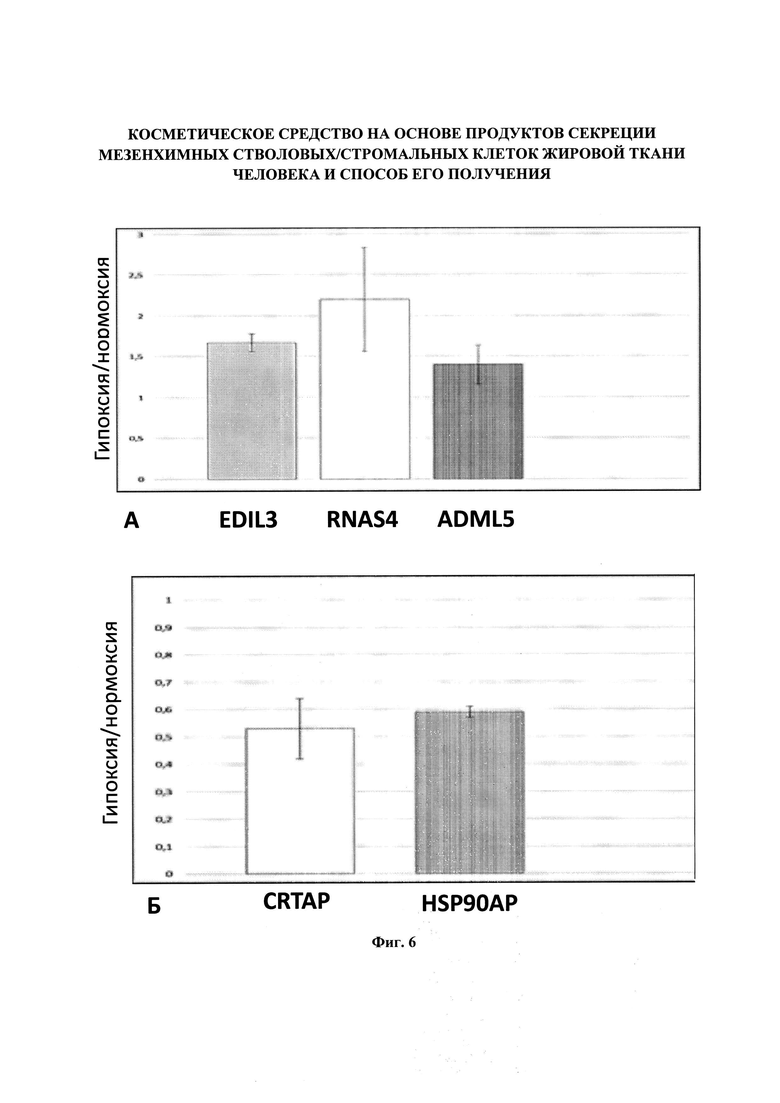
Фигура 6. Индуцированные гипоксией изменения экспрессии белков в МСК человека. МСК ЖТ (n=10) культивировали при 1% содержании кислорода (гипоксия) или в стандартных условиях (нормоксия) в течение 48 часов. Анализировали уровень мРНК белков, представленных во всех образцах клеток, методом ПЦР в реальном времени. А - Содержание мРНК белков, кодирующих некоторые белки, секретируемые преимущественно при гипоксии. Б - Содержание мРНК белков, кодирующих некоторые белки, секретируемые преимущественно при нормоксии.
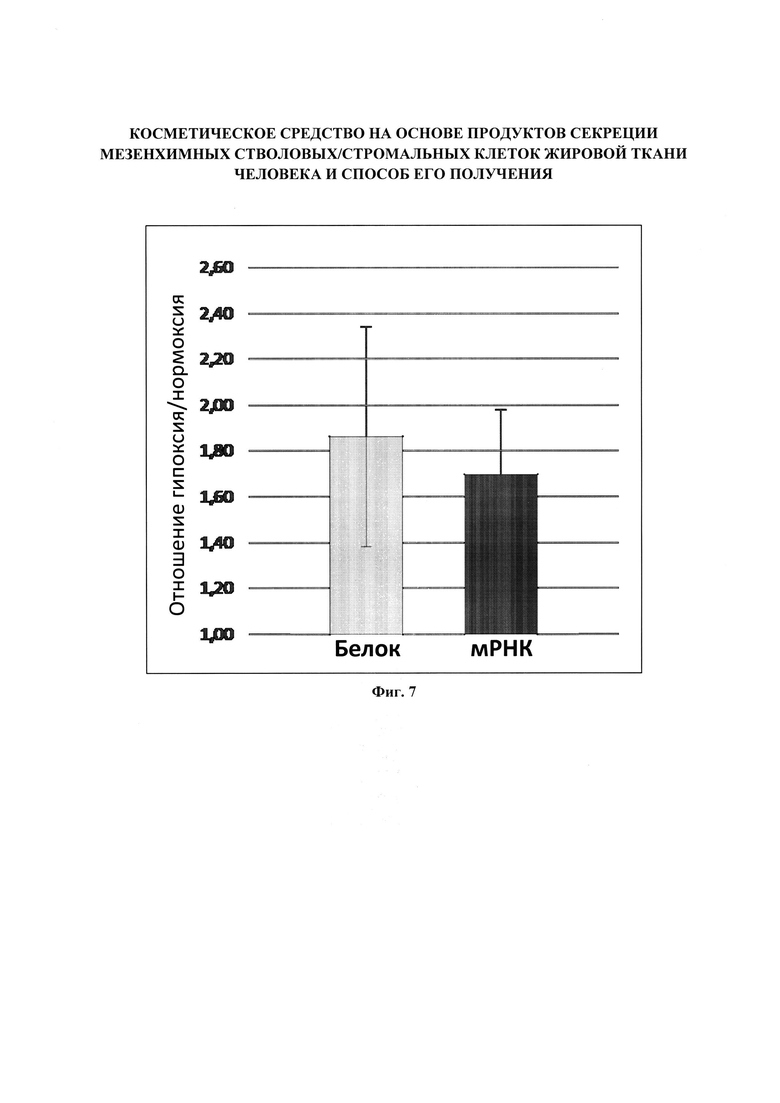
Фигура 7. Изменения экспрессии G-CSF МСК ЖТ человека при культивировании клеток в гипоксических условиях. МСК ЖТ (n=10) культивировали при 1% содержании кислорода (гипоксия) или в стандартных условиях (нормоксия) в течение 48 часов. Представлены изменения содержания мРНК, оцененные методом ПЦР в реальном времени, и секретируемого белка в кондиционированной среде (методом ELISA).
Осуществление изобретения
Получение косметического средства для нанесения на кожу включает культивирование мезенхимных стромальных клеток жировой ткани (МСК ЖТ) человека 4-5 пассажей в бессывороточной и лишенной продуктов животного происхождения среде культивирования, поддерживающей жизнеспособность клеток не менее 70% и пригодной для терапевтического применения с последующим забором среды культивирования, содержащей продукты секреции МСК ЖТ человека, и удалением из нее остатков клеток. С целью определения пригодности кондиционированной среды для производства косметического средства проводят тестирование полученных образцов на модели миграции фибробластов кожи человека in vitro. Отобранные образцы среды далее очищают от низкомолекулярных компонентов методом ультрафильтрации с последующей лиофилизацией для получения основного активного компонента косметического средства, содержащего продукты секреции МСК человека, включающие ключевые факторы роста: VEGF в концентрации не менее 4 нг/млн клеток, FGF basic в концентрации не менее 5.8 пкг/млн клеток, PEDF в концентрации не менее 10 нг/млн клеток, PAI-1 в концентрации не менее 35 нг/млн клеток, определяемые методом иммуноферментного анализа при восстановлении лиофилизата в стерильном буфере с физиологической осмолярностью, а также комплекс из 20 белков (см. Таблицу 1), определяемые методом протеомного анализа, обеспечивающих эффект косметического средства.
При этом МСК ЖТ наращивают в коммерческой среде, поддерживающей рост недифференцированных мезенхимных клеток человека (AdvanceSTEM Cell Culture Media), содержащей 9-11% добавки к среде роста (AdvanceSTEM Stem Cell Growth Supplement, оба реактива - HyClone, США), но перед получением кондиционированной среды клетки тщательно отмывают от компонентов среды раствором Хэнкса (ПанЭко, Россия) и помещают в бессывороточную и лишенную продуктов животного происхождения среду роста, в качестве последней используют DMEM с низким содержанием глюкозы (HyClone, США) или другую среду роста, поддерживающую жизнеспособность МСК человека (не ниже 70%) в течение всего срока кондиционирования и пригодную для терапевтического применения. Среда не должна содержать запрещенных для использования в составе косметических средств веществ.
Культивирование может быть осуществлено в культуральных флаконах или чашках Петри (например, фирмы Corning или аналогичные), при этом клетки выращивают на плоской подложке с плотностью 5-15*103/см2 в среде роста в объеме 0,1-0,2 мл/см2 в условиях CO2 инкубатора при 37±1°C, с 5% CO2 и относительной влажности ≥95% в течение 7±1 дней. Удаление из среды культивирования остатков клеток (клеточного дебриса) может быть реализовано центрифугированием, например, при 300±5 g, температуре 6±2°C в течение 10 минут. Очистку среды культивирования осуществляют посредством ее ультрафильтрации с удалением низкомолекулярных соединений массой менее 5 кДа, при этом для получения стерильного продукта дополнительно осуществляют микрофильтрацию полученного раствора через фильтры с диаметром пор 0,22 мкм. Очистка может быть осуществлена с использованием системы фильтрации в тангенциальном потоке Minim II (Life Sciences, США) или аналогичной. Лиофилизация может быть осуществлена в 8-14 стадий при давлении 0,013 кПа, температуре от -40°C до -5°C, время лиофилизации не более 36 часов при максимальной загрузке лиофильной сушки. Для лиофилизации используют стеклянные флаконы с неадгезивным покрытием Adelphi Heakthcare, США, кат. № VA 100-20 C или аналогичные.
Лиофилизация кондиционированной среды может проводиться совместно с другими компонентами средства по протоколу, обеспечивающему фармацевтическую стабильность средства.
В одном из вариантов осуществления изобретения косметическое средство представляет собой раствор - среду культивирования, кондиционированную МСК ЖТ, в другом - кондиционированную среду в виде лиофилизата, полученного по способу, описанному выше, который содержит ключевые биологически активные факторы: VEGF в концентрации не менее 4 нг/млн клеток (не менее 200 пкг/мл), FGF basic в концентрации не менее 5.8 пкг/млн клеток (не менее 0,3 пкг/мл), PEDF в концентрации не менее 10 нг/млн клеток (не менее 500 пкг/мл), PAI-1 в концентрации не менее 35 нг/млн клеток (не менее 2 нг/мл), определяемые методом иммуноферментного анализа при восстановлении 0,1±0,005 г лиофилизата в 10 мл стерильного буфера с физиологической осмолярностью, а также ряд ключевых белков, представленных в таблице 1.
Компоненты косметического средства могут быть включены в состав липосом в концентрации не менее 1% мас. (к массе готового косметического средства). Липосомы являются популярным способом доставки фармакологически активных веществ к месту реализации их терапевтических эффектов, обеспечивающие лучшее сохранение содержания и биологической активности доставляемых веществ. Кроме того, липосомы могут сами по себе являться энхансерами трансдермального проникновения, способствующими улучшению проникновения активных компонентов средства во внутренние слои кожи. Липосомы могут быть получены различными методами, включая методы продавливания, удаления детергента и другие, хорошо известные специалистам (Brunner J. Single bilayer vesicles prepared without sonication: physico chemical properties / J. Brunner, P. Skrabal, H. Hauser // Biochimica et Biophysica Acta. - 1976. - V. 455, №2. - P. 322-331; Dua J.S., Rana A.C., Bhandari A.K. Liposome: methods of preparation and applications // Int J Pharm Stud Res. - 2012. - Т. 3. - C. 14-20; Akbarzadeh A. et al. Liposome: classification, preparation, and applications // Nanoscale Res Lett. - 2013. - T. 8. - №.1. - C. 102; Wagner A., Vorauer-Uhl K. Liposome technology for industrial purposes // Journal of drug delivery. - 2010. - T. 2011; Uhumwangho M.U., Okor R.S. Current trends in the production and biomedical applications of liposomes: a review. - 2005).
Косметическое средство может содержать диметилизосорбид в концентрации не менее 1,5% мас. (к массе готового косметического средства), гиалуроновую кислоту и ее модификации в концентрации не менее 1% мас. (к массе готового косметического средства) и другие транедермальные энхансеры, усиливающие проникновение активных компонентов в кожные покровы, а также оказывающие в ряде случаев собственный положительный косметический эффект на состояние кожи.
Таким образом, технический результат достигается за счет того, что основной активный компонент косметического средства для накожного нанесения получают при культивировании МСК ЖТ человека в бессывороточной среде, лишенной ксеногенных компонентов, т.е. с безопасным для применения потребителем составом, поддерживающей жизнеспособность клеток в течение подобранного срока кондиционирования, путем сбора кондиционированной среды, содержащей биологически активные компоненты, секретируемые клетками в среду культивирования, предварительного тестирования среды и отбора образцов, удовлетворяющих заданным требованиям, очистки отобранных образцов среды с помощью ультрафильтрации и стабилизации путем лиофилизации.
Эффективность разрабатываемого средства предполагает наличие целого комплекса воздействий, направленных на стимулирование пролиферации и миграции специализированных клеток, участвующих в процессах репарации и регенерации (эндотелиальные клетки, фибробласты и др). Использование среды культивирования, кондиционированной с МСК ЖТ человека, позволит обеспечить комплексное решение проблем, как медицинского, так и эстетического характера, возникающих при старении кожных покровов. Предполагается, что увлажнение и питание наружных слоев кожи будет осуществляться за счет действия дополнительных активных ингредиентов (витаминов и питательных веществ), которые могут быть выбраны специалистами в зависимости от целей применения, а омолаживание и стимуляция обновления кожи, в том числе за счет усиления синтеза и обновления коллагена, кератина и других структурных белков кожи, может быть осуществлено с помощью бессывороточной среды, содержащей комбинацию факторов роста и других биологически активных компонентов, секретированных МСК человека, способствующих регенерации кожи. Данное решение позволяет получить сочетание белковых факторов, секретированных МСК ЖТ человека и, соответственно, прошедших необходимые модификации и растворенных в среде, не содержащей белков животного происхождения и бактериальных фрагментов.
Для получения кондиционированной среды предлагается использовать мультипотентные мезенхимные стволовые/стромальные клетки (МСК) человека, отвечающие за репарацию и регенерацию тканей. Одним из наиболее доступных источников МСК у человека является подкожная жировая ткань; содержащиеся в ней МСК могут быть легко выделены в результате ферментативной обработки образцов жировой ткани, полученной в результате косметической липосакции или в ходе хирургического удаления жирового отложения. Культивирование выделенных МСК ЖТ приводит к получению относительно гомогенной популяции мультипотентных стромальных фибробластоподобных клеток.
В заявляемом изобретении могут быть использованы МСК, полученные самостоятельно по любому известному из уровня техники способу, так и в виде коммерческих препаратов МСК, имеющих сертификат качества и предназначенных, в том числе, для клинического применения, например, такие как продукт АТСС (АТСС® PCS-500-011), представляющий собой МСК человека, выделенные из липоаспирата, культивированные до 2 пассажа и подвергнутые криоконсервации, или аналогичные.
Ранее на моделях ишемии конечности и инфаркта миокарда и подкожно имплантированного матригеля у животных авторами изобретения было показано, что локальное и системное введение МСК ЖТ способствует увеличению количества сосудов в тканях с нарушенным кровоснабжением, приводит к улучшению кровотока в этих тканях и уменьшению или исчезновению симптомов ишемии. Кроме того, было выявлено, что введение МСК ЖТ способствует прорастанию нервных окончаний в подкожно имплантированный матригель и улучшает восстановление периферических нервов после травматического повреждения. Согласно данным исследований авторов настоящего изобретения и работ других научных коллективов, основным механизмом, лежащим в основе регенеративного эффекта МСК ЖТ, является продукция этими клетками широкого спектра биологически активных цитокинов и факторов роста, ускоряющих процессы заживления и восстановления тканей после повреждения. Качественный и количественный состав секретируемых МСК компонентов значительно варьирует между донорами, и на него могут оказывать существенное влияние различные факторы, такие как возраст, пол донора, наличие у него хронических заболеваний. Предлагаемый в данном изобретении способ получения средства на основе секретируемых продуктов МСК позволяет добиться определенного качественного и количественного состава компонентов, обеспечивающих косметический эффект. Полученный состав можно корректировать в случае несоответствия заявляемым параметрам, а также для повышения эффективности средства с использованием известных из уровня техники методов. Так, могут быть добавлены отдельные компоненты непосредственно в кондиционированную среду, клетки могут быть предобработаны перед и/или во время кондиционирования (используемые способы включают, но не ограничиваются культивирование клеток в условиях гипоксии, в присутствии биологически отдельных веществ, в составе различных матриксов и на трехмерных носителях, генетическую модификацию клеток и другие способы). Кроме того, кондиционированная среда, помимо предлагаемого в изобретении метода очистки, может быть также обработана с целью удаления нежелательных или избыточных компонентов. Используемые методы очистки кондиционированной среды, которые позволяют сохранить оптимальную активность, хорошо известные специалистам, включают гель-хроматографию (с использованием матриц, таких как сефадекс), ионообменную хроматографию, аффинную хроматографию на хелате металла с нерастворимой матрицей, ВЭЖХ-очистку, но не ограничиваются ими. В зависимости от целей применения кондиционированной среды и/или полученных из нее продуктов при необходимости следует обеспечить поддержание стерильности конечного продукта.
В большинстве протоколов выделения и культивирования МСК ЖТ используется среда с добавлением эмбриональной телячьей сыворотки (ЭТС) или фетальной бычьей сыворотки (ФБС). Эти сыворотки содержат необходимый коктейль факторов роста, гормонов и витаминов, стимулирующих клеточную адгезию и пролиферацию в условиях культивирования in vitro. В то же время накапливается все больше сведений о том, что клетки, выращенные с использованием сывороток животных, потенциально небезопасны, в частности, существует риск заражения прионами или вирусами культуры клеток при культивировании с использованием сывороток животных, а также возможность иммунной реакции со стороны организма реципиента. Кроме того, было показано, что длительное культивирование в присутствии ФБС значительно изменяет свойства клеток различного происхождения. Так, мезенхимные клетки костного мозга, культивированные в присутствии ФБС, характеризуются нестабильностью транскриптома, включая изменение экспрессии генов, ответственных за регуляцию клеточного цикла, апоптоз и клеточную адгезию.
Отличительной особенностью данного изобретения является использование для культивирования МСК ЖТ специализированной среды, поддерживающей рост и функциональные свойства недифференцированных МСК человека, на этапах, предшествующих кондиционированию МСК: AdvanceSTEM Cell Culture Media (HyClone, США) с добавлением раствора антибиотиков Penicillin-Streptomycin (HyClone, США) и добавки к среде роста AdvanceSTEM Stem Cell Growth Supplement (HyClone, США), которые берут при следующем соотношении компонентов, об. %:
- AdvanceSTEM Cell Culture Media - 89-90;
- Раствор антибиотиков Penicillin-Streptomycin - 0,95-1,05;
- Добавки к среде роста AdvanceSTEM Stem Cell Growth Supplement - 9,0-10,0.
МСК выделяют из подкожной жировой ткани человека и культивируют в приготовленной по указанной выше схеме среде роста до 4-5 пассажа. Затем клетки тщательно отмывают от компонентов среды роста раствором Хэнкса (фирмы ПанЭко или аналогичным) и помещают в бессывороточную и лишенную продуктов животного происхождения среду роста, в качестве последней используют DMEM с низким (1000 мг/л) содержанием глюкозы (HyClone, США) или другую среду роста, поддерживающую жизнеспособность МСК человека (не ниже 70%) в течение всего срока кондиционирования и пригодную для терапевтического применения. Указанную среду для кондиционирования клеткам добавляют в объеме 0,1-0,2 мл/см2 и культивируют в условиях CO2 инкубатора при 37+1°C, 5%-ом содержании CO2 и относительной влажности ≥95% в течение 7±1 дней. Кондиционированную среду, содержащую все продукты секреции МСК человека, собирают в стерильные емкости для центрифугирования, удаляют путем центрифугирования остатки клеток, тестируют на модели стимуляции миграции фибробластов кожи человека и в случае получения положительных результатов теста полученный супернатант подвергают очистке с помощью процедуры ультрафильтрации, удаляя все низкомолекулярные соединения массой менее 5 кДа. На этапе ультрафильтрации при использовании соответствующего оборудования и соблюдении асептических условий можно получить стерильный продукт. Если невозможно обеспечить стерильность продукта при процедуре ультрафильтрации, то добавляют этап микрофильтрации. Для этого концентрированную среду фильтруют через одноразовые стерильные фильтры с диаметром пор 0,22 мкм, достаточным для очистки от потенциально содержащихся в продукте микроорганизмов, а затем подвергают процедуре лиофилизации для получения итогового продукта (лиофилизат кондиционированной среды, содержащей продукты секреции МСК человека), содержащего в том числе ключевые биологически активные факторы, по которым проводится стандартизация конечного продукта. Так, при восстановлении 0,1±0,005 г лиофилизата в 10 мл стерильного раствора с физиологической осмолярностью методом иммуноферментного анализа в растворе должны определяться VEGF в концентрации не менее 4 нг/млн клеток (не менее 200 пкг/мл), FGF basic в концентрации не менее 5.8 пкг/млн клеток (не менее 0,3 пкг/мл), PEDF в концентрации не менее 10 нг/млн клеток (не менее 500 пкг/мл), PAI-1 в концентрации не менее 35 нг/млн клеток (не менее 2 нг/мл), а также комплекс из, по крайней мере, 20 белков, представленных в таблице 1, определяемых методом протеомного анализа.
Особенностью данного изобретения является проведение предварительного тестирования полученных при кондиционировании МСК жировой ткани образцов среды, содержащих продукты секреции клеток, по способности стимулировать миграцию дермальных фибробластов человека на модели клеточной раны in vitro с целью определения пригодности для производства косметического средства.
Другой особенностью данного изобретения является возможность очищать, а при необходимости и одновременно концентрировать кондиционированную среду с использованием системы фильтрации в тангенциальном потоке Minim II (Life Sciences, США) или аналогичной, что позволяет значительно ускорить процесс очистки и/или концентрирования и способствует лучшему сохранению биологически активных веществ в кондиционированной среде.
В результате осуществления данного изобретения получают косметическое средство на основе продуктов секреции МСК человека, которое может быть использовано для стимуляции регенерации кожи, повышения ее упругости и улучшения эстетических характеристик.
Стерильный обогащенный биологически активными факторами раствор кондиционированной среды представляет собой биологически сконструированный косметический продукт, который может быть легко получен в больших объемах и может быть использован как отдельно, так и в качестве добавки к различным продуктам для ухода за кожей, к косметическим и дерматологическим продуктам, в целях пополнения уровней факторов роста и матриксных белков в коже, волосах и ногтях человека. Заявляемое средство может содержать жидкий смазывающий агент, например глицерин, гликоген, мальтоза и т.п. В качестве смазывающих агентов могут быть также использованы органические полимерные материалы-основы, такие как полиэтиленгликоль и гиалуроновая кислота, а также различные формы коллагена.
Средство по настоящему изобретению может быть использовано в виде растворов или лиофилизата в составе различных форм косметических средств, таких как кремы, гели, маски, средства для волос, в том числе для микроинъекций в виде раствора, в составе гидрогелей и др., и введено пациенту различными способами с использованием стандартных процедур, хорошо известных специалистам. Композиции кондиционированных сред могут быть приготовлены в виде препарата для местного применения с использованием энхансеров трансдермального проникновения, облегчающих проникновение данного соединения в кожу, и нанесены в виде местной аппликации. Кроме того, заявляемое средство может быть изготовлено с учетом регулируемого пролонгированного высвобождения активных компонентов.
Ниже представлено подробное описание изобретения на примерах конкретного выполнения, которые демонстрируют практическую осуществимость изобретения, но не ограничивают возможность осуществления изобретения с помощью иных средств и методов.
Пример 1. Получение МСК жировой ткани человека.
МСК выделяют из подкожного жирового отложения здоровых доноров обоих полов. Клетки выделяют из материала, полученного при проведении малого хирургического вмешательства под местной анестезией или в ходе плановых хирургических операций. Хирургический материал (10-15 г жировой ткани, взятой из околопупочной области или другой области локализации подкожного жира) помещают в одноразовую пробирку с буфером HBSS (HyClone) содержащим 5-ти кратную концентрацию антибиотика 500 ед/мл (HyClone).
В стерильных условиях культурального бокса биоптат фрагментируют до однородной массы, используя стерильные инструменты, после чего подвергают его ферментативной обработке в растворе, содержащем среду AdvanceSTEM™ (HyClone) /500 ед/мл антибиотика (HyClone), 200 ед/мл коллагеназы I типа и диспазы (40 ед/ml) (Worthington Biochemical) (соотношение объема ферментов и жира должно быть 1:1:1), при 37°C в течение 30-45 минут при постоянном помешивании. По окончании инкубации к образцу добавляют равный объем среды с сывороткой и фильтруют через нейлоновые мембраны с размером пор 100 мкм (BD). Профильтрованную суспензию центрифугируют в течение 5 мин при 200 g, после чего супернатант полностью удаляют. Осадок клеток подвергают обработке буфером для лизиса эритроцитов (BD) до покраснения раствора, после чего центрифугируют в течение 5 мин при 200g. Супернатант полностью удаляют, а осажденные клетки ресуспендируют в среде роста МСК. Для культивирования мезенхимных клеток используют среду AdvanceSTEM™ support expansion and maintenance of undifferentiated human MSCs (HyClone) в сочетании с добавлением 10% раствора добавок AdvanceSTEM™ Stem Cell Growth Supplement (HyClone) и 100 ед/мл антибиотика (HyClone). Эта среда была разработана фирмой-производителем (HyClone) для культивирования недифференцированных МСК, в частности клеток, происходящих из жировой ткани, без добавления сыворотки (http://www.thermo.com).
Выделенные МСК высевают в концентрации 200 тыс. в мл в чашках Петри и культивируют в среде роста в инкубаторе при 37°C и при 5%-ой концентрации CO2. При достижении 80% монослоя МСК ЖТ (0 пассаж) замораживают в жидком азоте и хранят в мастер-банке для дальнейшего использования с целью наработки среды.
Для наработки среды МСК ЖТ масштабируют. Перед снятием с поверхности культурального пластика клетки трехкратно промывают раствором Версена. Затем наносят в каждую чашку по 1 мл реагента для диссоциации клеток HyQTase (HyClone). При приобретении клетками округлой формы и откреплении их от подложки в каждую культуральную емкость вносят по 9 мл среды роста и интенсивно пипетируют клеточную суспензию. Затем клетки рассевают в соотношении 1:4.
Пример 2. Получение кондиционированной среды, содержащей продукты секреции МСК жировой ткани человека.
Для получения кондиционированной среды МСК ЖТ наращивают до 2-5 пассажа. МСК ЖТ человека добавляют в количестве 5-15*103/см2 в культуральные емкости для выращивания эукариотических клеток, после прикрепления промывают культуральные сосуды с клетками солевым раствором Хэнкса (Панэко, Россия) (в количестве 0,1-0,2 мл/см2 трижды по 10 минут) и заполняют их свежей средой роста для кондиционирования в количестве 0,1-0,2 мл/см2. В качестве последней используют неспецифическую универсальную среду роста для разных типов клеток DMEM with Low Glucose (HyClone, USA) или специфическую среду роста для поддержания роста МСК человека MSC NutriStem® XF Basal Medium (Biological Industries, Israel), с добавлением раствора антибиотиков Penicillin-Streptomycin (HyClone, USA) (1,00±0,05 мл на 100±5 мл среды). Затем клетки культивируют в условиях CO2 инкубатора при 37+1°C, 5%-ом содержании CO2 и относительной влажности ≥95% в течение 7 суток.
В качестве культуральных емкостей для выращивания эукариотических клеток используют культуральные флаконы или чашки Петри (фирмы Corning или аналогичные), при этом клетки выращивают на плоской подложке плотностью 5-15*103/см2.
Пример 3. Предварительное тестирование кондиционированной среды МСК жировой ткани человека на модели in vitro с целью определения пригодности для производства косметического средства.
Для оценки способности разрабатываемого средства эффективно стимулировать регенерацию кожи используют первичные дермальные фибробласты человека 4-5 пассажа, полученные от здоровых доноров. Исследуют влияние полученных образцов кондиционированной среды, содержащей продукты секреции МСК жировой ткани разных доноров, на скорость миграции фибробластов кожи в модели клеточной раны.
Фибробласты кожи человека культивируют в среде DMEM с низким содержанием глюкозы с добавлением 10% эмбриональной телячьей сыворотки. Для моделирования условий зарастания раны используют модель клеточной раны (scratch assay). Для этого фибробласты высаживают на 12-луночные планшеты в концентрации 10 тыс. кл./мл и культивируют в стандартных условиях до достижения субконфлюентного монослоя. Затем клетки депривируют 24 часа.
Стерильным наконечником 200 мкл на монослое клеток наносят стандартную по ширине царапину и заливают клетки кондиционированной средой, содержащей продукты секреции МСК ЖТ человека. В качестве отрицательного контроля используют базовую среду DMEM с низким содержанием глюкозы. В качестве положительного контроля используют базовую среду DMEM с низким содержанием глюкозы с добавлением 10% эмбриональной телячьей сыворотки.
Планшет с фибробластами помещают в CO2-камеру автоматического инвертированного микроскопа Nikon Ti для прижизненных наблюдений, используют режим съемки в фазовом контрасте с помощью объектива 5х в течение 24 часов с шагом съемки 15 минут. Получившиеся серии изображений анализируют с помощью программного обеспечения ImajeJ, подсчитывая скорость миграции 50 случайных клеток в каждом поле зрения в мкм/час. Тест считают положительным, если уровень активности образцов кондиционированной среды превышает соответствующее значение для отрицательного контроля не менее чем на 50% (Фигура 1). Не прошедшие тест образцы выбраковывают (Фигура 2), и клетки, с помощью которых они были произведены, в дальнейшем не используют. Отобранные образцы кондиционированной среды должны продемонстрировать значимую специфическую активность (Фигура 1) и могут быть использованы для дальнейших этапов технологического процесса.
Пример 4. Очистка кондиционированной среды, содержащей продукты секреции МСК жировой ткани человека, методом ультрафильтрации.
Отобранные образцы кондиционированной среды, содержащей все продукты секреции МСК ЖТ человека, собирают в стерильные емкости для центрифугирования, центрифугируют при (5000±10) об/мин, температуре (6±2)°C, в течение 10 минут для очистки удаления от клеточного дебриса. Полученный супернатант отбирают в новые стерильные емкости объемом 250-500 мл.
Дополнительную очистку среды от низкомолекулярных компонентов проводят с помощью системы фильтрации в тангенциальном потоке Minim II (Life Sciences), используя ультрафильтрационные кассеты (Minimate TFF capsule, PALL, 5 кДа) или аналогичные. Для этого питающий резервуар заполняют 100 мл кондиционированной среды. Производительность насоса устанавливают на уровне 90-120 мл/мин, давление не более 2 атмосфер, скорость потока фильтрата не более 20-30 мл/мин. Проводят 5-6 раундов очистки, восполняя объем добавлением раствора Хэнкса в питающий резервуар. После этого выключают насос, переносят возвращающий шланг в сосуд для сбора очищенного раствора, включают насос и дожидаются осушения питающего резервуара. Для вытеснения остатков очищенной среды в питающий резервуар добавляют раствор Хэнкса, включают насос и под визуальным контролем собирают очищенную среду до момента выхода из системы всего раствора. При необходимости данные метод используют для концентрирования образцов.
При невозможности соблюсти стерильность при проведении ультрафильтрации очищенную среду подвергают микрофильтрации. Фильтрацию очищенной среды осуществляют через одноразовые стерильные фильтры с диаметром пор 0,22 мкм, обеспечивающие стерилизацию продукта. Среду подают на фильтры перистальтическим насосом. Фильтрат собирают в стерильную полипропиленовую емкость.
Пример 5. Лиофилизация очищенной кондиционированной среды, содержащей продукты секреции МСК жировой ткани человека.
Очищенную фильтрованную среду подвергают процедуре лиофилизации для получения итогового продукта (лиофилизат кондиционированной среды, содержащей продукты секреции МСК человека). Для этого разливают очищенную фильтрованную среду по (10,0±0,1) мл в стерильные стеклянные флаконы емкостью 100 мл. Флаконы укупоривают бутиловыми резиновыми пробками для лиофилизации. Затем флаконы помещают в лиофильную сушку. Охлаждают до -45°C с контролем по температуре продукта, затем 1 час выдерживают при указанной температуре. После этого включают конденсор, охлаждают его до -45°C, включают вакуумный насос и доводят давление до 0,027 кПа. Проводят следующие шаги:
1) Ступенчатое охлаждение до 10°C за 20 минут при давлении 66,6 кПа;
2) Плавное охлаждение до -15°C за 25 минут при давлении 66,6 кПа;
3) Выдерживание на -15°C за 120 минут при давлении 66,6 кПа;
4) Плавное охлаждение до -40°C за 25 минут при давлении 66,6 кПа;
5) Выдерживание на -40°C за 150 минут при давлении 0,013 кПа;
6) Плавный нагрев до -30°C за 150 минут при давлении 0,013 кПа;
7) Плавный нагрев до -20°C за 150 минут при давлении 0,013 кПа;
8) Плавный нагрев до -10°C за 150 минут при давлении 0,013 кПа;
9) Плавный нагрев до -5°C за 150 минут при давлении 0,013 кПа;
10) Выдерживание на -5°C (в течение 20 часов до отключения оператором) при давлении 0,066 кПа;
11) Девакуумирование до 66,6 кПа;
12) Полная автоматическая укупорка резиновыми пробками;
13) Сброс вакуума;
14) Выгрузка флаконов.
Общая продолжительность процедуры лиофилизации не превышает 36 часов при полной загрузке лиофильной сушки.
Пример 7. Метод оценки концентрации ключевых факторов, опосредующих косметические эффекты среды, кондиционированной МСК жировой ткани человека.
Оценку содержания VEGF, FGF basic (FGFb), PEDF и PAI-1 в восстановленном в 10 мл стерильного физиологического раствора лиофилизате кондиционированной среды, содержащей продукты секреции МСК ЖТ человека, проводят методом иммуноферментного анализа (ELISA). В растворе должны определяться VEGF в концентрации не менее 4 нг/млн клеток (не менее 200 пкг/мл), FGF basic в концентрации не менее 5.8 пкг/млн клеток (не менее 0,3 пкг/мл), PEDF в концентрации не менее 10 нг/млн клеток (не менее 500 пкг/мл), PAI-1 в концентрации не менее 35 нг/млн клеток (не менее 2 нг/мл).
Оценка содержания FGFb с использованием набора фирмы R&D Systems Human FGF basic Quantikine ELISA Kit.
Для определения концентрации FGFb методом ELISA используют коммерческий набор фирмы R&D Systems (Human FGF basic Quantikine ELISA Kit, cat#DFB50) или аналогичный.
Используя стандартизированный раствор FGFb, готовят калибровочные пробы известной концентрации так, чтобы проба №1 содержала 500 пг/мл FGFb, каждая последующая содержала FGFb в 2 раза меньше. Проба №0 должна содержать только раствор Sample Diluent. Исследуемые образцы в количестве 100 мкл, а также стандартизированные образцы раствора FGFb троекратно наносят в лунки 96-ти луночный планшет и инкубируют на шейкере в течение 12 часов при 4°C. Планшет отмывают буфером Wash Buffer, и в каждую из лунок добавляют по 100 мкл биотинилированных мышиных моноклональных антител против FGFb человека. Через 3 часа инкубации планшет отмывают, как описано выше. В каждую лунку наносят по 100 мкл раствора комплекса стрептавидин-пероксидаза хрена. Через 1 час планшет тщательно промывают и вносят в каждую лунку по 100 мкл прилагаемого к набору раствора субстрата ТМВ/Е. Планшет инкубируют при комнатной температуре в течение 15 минут, затем в каждую из лунок добавляют по 100 мкл стоп-буфера, и оценивают реакцию на спектрофотометре ELISA READER MICROPLATE READER Spectro при длине волны 450 нм. В качестве референсного используют уровень оптической плотности при длине волны 570 нм. Работу на аппарате осуществляют в соответствии с инструкцией.
Оценка содержания PEDF с использованием набора фирмы Cusabio Human PEDF ELISA Kit.
Для определения концентрации PEDF методом ELISA используют коммерческий набор фирмы Cusabio (Human PEDF ELISA Kit) или аналогичный.
Готовят серийные разведения стандарта PEDF, согласно инструкции, приложенной к набору. Готовят раствор биотинилированных антител к человеческому PEDF и 1х раствор пероксидазы хрена, конъюгированной с авидином. Наносят на каждую лунку микропланшета по 100 мкл стандартного раствора или образца. Накрывают клейкой пленкой и оставляют при 37°C на 2 часа. После двух часов инкубации аккуратно отклеивают липкую пленку и удаляют жидкость из всех лунок без промывания. К каждой лунке добавляют 100 мкл 1х раствора биотинилированных антител. Накрывают липкой пленкой и оставляют микропланшет на 1 час при 37°C. После повторной инкубации убирают все содержимое из лунок. 4-кратно промывают лунки путем добавления к каждой из них 200 мкл буфера для промывки. Оставляют буфер для промывки в лунке в течение двух минут и тщательно отбирают жидкость после каждого этапа промывки. В конце промывки переворачивают микропланшет вверх дном и промакивают листом фильтровальной бумаги. Добавляют к лункам 100 мкл 1х раствора пероксидазы хрена, конъюгированной с авидином. Накрывают микропланшет клейкой лентой и оставляют на инкубацию на 1 час при 37°C. После инкубации шестикратно промывают лунки по описанной ранее процедуре. Добавляют 90 мкл субстрата «ТМВ Substrate» к каждой лунке. Инкубируют лунки при 37°C в течение 15-30 мин. Добавляют к лункам 50 мкл раствора «Stop Solution)), хорошо перемешивают содержимое каждой лунки. Не позднее 5 мин после добавления раствора «Stop Solution)) определяют оптическую плотность раствора в каждой лунке при длине волны 450 нм. В качестве референсного используют уровень оптической плотности при длине волны 540 нм.
Остальные ключевые белки оценивают аналогично по методикам, приведенным в инструкциях к наборам для ELISA анализа.
Пример 8. Оценка содержания комплекса активных белков в кондционированной среде МСК жировой ткани человека методом протеомного анализа.
Протеомный анализ проводят на масс-спектрометре TripleTOF 5600+ с ионным источником NanoSpray III (ABSciex, Concord, Онтарио, Канада), объединенном с NanoLC Ultra 2D+нано-ВЭЖХ системой (Eksigent, Concord, Ontario, Canada) или аналогичном. Для загрузки образцов используют буфер А (смесь 98.9% воды, 1% метанола, 0.1% муравьиной кислоты (v/v)) и буфер В (99.9% ацетонитрила, 0.1% муравьиной кислоты (v/v)). Колонку-ловушку кондиционируют теми же растворами (А и В) в течение 25 минут со скоростью потока 300 нл/мин. Образцы загружают в колонку Chrom ХР С18 3 microm 120  350 microm*0.5 mm (Eksigent, Dublin, CA, USA) при скорости потока 3 мкл/мин и элюируют сквозь разделяющую колонку со скоростью 300 нл/мин. Градиент буфера Б в буфере А варьируют от 5 до 40% в течение 120 минут.
350 microm*0.5 mm (Eksigent, Dublin, CA, USA) при скорости потока 3 мкл/мин и элюируют сквозь разделяющую колонку со скоростью 300 нл/мин. Градиент буфера Б в буфере А варьируют от 5 до 40% в течение 120 минут.
Масс-спектр получают в режиме положительных ионов, разброс m/z может составить 300-1250, время накопления сигнала - 250 мс. Для проведения идентификации белков, файл типа. wiff анализируют в программе ProteinPilot 4.5 revision 1656 (ABSciex) с помощью поискового алгоритма Paragon 4.5.0.0 revision 1654 (ABSciex) с набором стандартных настроек для поиска в базе данных или аналогичным методом анализа.
Используют следующие параметры: алкилирование цистеина-иодоацетамид, плавление трипсина, настройки оборудования TripleTOF 5600, дополнительный FDR анализ. Идентификацию пептидов проводят с использованием стандартных настроек с помощью программного пакета ProteinPilot или аналогичным. Такой подход позволяет идентифицировать и оценить содержание всех белков, представленных в таблице 1. По наличию этих белков отбирают образцы среды для получения косметического средства.
Пример 9. Оценка содержания дополнительных активных белков в кондиционированной среде МСК жировой ткани человека методом протеомного анализа.
Отобранные образцы кондиционированной среды дополнительно проверяют на наличие биологически активных факторов, секретируемых МСК человека, методом протеомного анализа, как описано в примере 8. В результате определяют дополнительный комплекс из 47 белков в составе косметического средства (Таблица 2).
Пример 10. Пример получения косметического средства на основе продуктов секреции МСК жировой ткани человека.
Отобранные образцы кондиционированной среды, содержащей комплекс продуктов секреции МСК ЖТ человека используют в качестве косметического средства в виде раствора или для включения в другие формы косметических средств (кремы, гели, маски и т.д.). Для оценки способности полученного средства эффективно стимулировать регенерацию кожи исследуют влияние образцов на скорость миграции фибробластов кожи человека на модели клеточной раны (Фигура 3) или других релевантных моделях in vitro. В качестве отрицательного контроля используют базовую среду DMEM с низким содержанием глюкозы. В качестве положительного контроля используют базовую среду DMEM с низким содержанием глюкозы с добавлением 10% эмбриональной телячьей сыворотки.
Для стимуляции проникновения средства в кожу и усиления косметического эффекта к средству в виде лиофилизата добавляют 1% раствор гиалуроната натрия с диметилизосорбидом. Специфическую активность средства оценивают на модели миграции фибробластов кожи человека (Фигура 4) или других релевантных моделях in vitro.
Пример 11. Получение косметического средства на основе продуктов секреции МСК жировой ткани человека, модифицированные генетически для увеличения продукции фактора роста эндотелия сосудов (VEGF165)
Для получения кондиционированной среды с увеличенным содержанием одного из ключевых действующих веществ, используют культуру МСК жировой ткани человека, которые перед началом процедуры кондиционирования обрабатывают вирусным вектором, с геном фактора роста эндотелия сосудов (VEGF 165), т.е. подвергают транзиторной генетической модификации.
Для этого используют МСК жировой ткани в 60-75% конфлюэнтности, которые отмывают от ростовой среды фосфатно-солевым буфером, после чего на культуру наносят раствор Хэнкса, содержащий рекомбинантный бакуловирус геном VEGF 165 человека в титре 75-150 вирусных частиц на 1 клетку. Затем чашку накрывают фольгой для защиты фоточувствительного бакуловируса и оставляют на 6 ч при комнатной температуре при медленном (50 об/мин) перемешивании на орбитальном шейкере. По окончании инкубации раствор вируса отбирают, клетки дважды отмывают фосфатно-солевым буфером и на культуру наносят ростовую среду, к которой на 15 ч добавляют бутират натрия в концентрации 5 мМ для увеличения продукции VEGF 165. По окончании инкубации среду, содержащую бутират натрия удаляют, клетки дважды отмывают фосфатно-солевым буфером, после чего инкубируют в течение 24-48 ч в ростовой среде. Полученная таким образом культура используется для получения кондиционированной среды по способам, изложенным в заявке. При использовании генетически модифицированных МСК жировой ткани человека происходит резкое увеличение содержания VEGF 165 (Фигура 5), являющегося одним из ключевых белковых активных компонентов кондиционированной среды (приведены данные для кондиционирования в течение 72 ч).
Пример 12. Получение косметического средства на основе продуктов секреции МСК жировой ткани человека, культивированных в условиях пониженного содержания кислорода
В качестве одного из способов коррекции состава секреторных компонентов МСК человека может быть использован метод культивирования клеток в условиях гипоксии. МСК ЖТ (n=10) 4-5 пассажа культивировали при 1% содержании кислорода (гипоксия) или в стандартных условиях (нормоксия) в течение 48 часов, затем проводили сбор кондиционированной среды. Данный метод позволяет повысить продукцию одних белков и уменьшить продукцию других (Фигуры 6, 7) и может быть применен в зависимости от назначения косметического средства.
Пример 13. Получение комбинированного косметического средства на основе продуктов секреции МСК жировой ткани человека, готового к применению.
На первом этапе получают лиофилизат липосом кондиционированной среды, для этого липосомы на основе фосфолипидов сои (средний размер не менее 500 нм) смешивают в соотношении 1:25 с очищенной кондиционированной средой, прошедшей предварительное тестирование, после чего проводят лиофилизацию, как описано в примере 5. Для получения косметического средства лиофилизат кондиционированной среды или лиофилизат липосом кондиционированной среды смешивают с гранулами карбоксиметилцеллюлозы (размер частиц - не более 0,1 мм) в соотношении 1:2 по массе в барабанном смесителе до получения однородной порошкообразной субстанции - далее - твердофазный компонент. Параллельно смешивают 1% раствор гиалуроната натрия с диметилизосорбидом в соотношении по массе 50:1 - далее - жидкофазный компонент. Готовое средство получают смешиванием твердофазного и жидкофазного компонентов в соотношении по массе 1:20 при интенсивном перемешивании и, если необходимо, нагревании.
Таким образом, заявляемая композиция представляет собой продукты секреции МСК человека, образующие биологически активный комплекс со следующими положительными функциями/характеристиками:
- отсутствие ксеногенных компонентов и стабильность - широкий и подробно охарактеризованный состав, включающий факторы роста, биологически активные пептиды, хемоаттрактанты, протеолитические ферменты и молекулы, регулирующие активность регенеративных процессов;
- способность вызывать регенерацию кожных покровов;
- способность активировать функцию фибробластов, оказывая таким образом благоприятное влияние на механические и функциональные свойства кожных покровов
- возможность широкого применения в составе различных космецевтических формуляций для разнообразного применения, а также создания комбинированных косметических средств (включающих энхансеры трансдермального проникновения, липосомы и др.).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА ДЛЯ СТИМУЛЯЦИИ РЕГЕНЕРАЦИИ НА ОСНОВЕ ПРОДУКТОВ СЕКРЕЦИИ МУЛЬТИПОТЕНТНЫХ МЕЗЕНХИМНЫХ СТРОМАЛЬНЫХ КЛЕТОК ЧЕЛОВЕКА | 2015 |
|
RU2620167C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ОЖОГОВ И РАН НА ОСНОВЕ ЦИТОКИНОВ И ФАКТОРОВ РОСТА, СЕКРЕТИРУЕМЫХ МЕЗЕНХИМНЫМИ КЛЕТКАМИ ЧЕЛОВЕКА, СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА И СПОСОБ ЛЕЧЕНИЯ ОЖОГОВ И РАН | 2014 |
|
RU2574017C1 |
| СПОСОБ СТИМУЛЯЦИИ РЕГЕНЕРАТИВНЫХ ПРОЦЕССОВ В ИШЕМИЗИРОВАННЫХ ТКАНЯХ | 2011 |
|
RU2497529C2 |
| СПОСОБ СТИМУЛЯЦИИ СПЕРМАТОГЕНЕЗА | 2016 |
|
RU2652902C1 |
| Бесклеточные терапевтические средства для регенеративной медицины и способы их получения | 2018 |
|
RU2742034C2 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ФИБРОЗА ТКАНЕЙ НА ОСНОВЕ КОМПОНЕНТОВ СЕКРЕТОМА МЕЗЕНХИМНЫХ СТРОМАЛЬНЫХ КЛЕТОК, СПОСОБ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ СРЕДСТВА | 2020 |
|
RU2766707C1 |
| СРЕДСТВО ДЛЯ КОРРЕКЦИИ ВОЗРАСТНЫХ ИЗМЕНЕНИЙ КОЖИ | 2019 |
|
RU2803093C2 |
| СПОСОБ ОЦЕНКИ АНГИОГЕННОГО ПОТЕНЦИАЛА ПРОГЕНИТОРНЫХ КЛЕТОК У БОЛЬНЫХ СЕРДЕЧНО-СОСУДИСТЫМИ ЗАБОЛЕВАНИЯМИ | 2011 |
|
RU2548801C2 |
| СПОСОБ СТИМУЛЯЦИИ СПЕРМАТОГЕНЕЗА | 2016 |
|
RU2653779C1 |
| КОМПОЗИЦИЯ ДЛЯ НЕЙРОПРОТЕКЦИИ И СТИМУЛЯЦИИ НЕЙРОРЕГЕНЕРАЦИИ ГОЛОВНОГО МОЗГА ПОСЛЕ ПОВРЕЖДЕНИЯ, СРЕДСТВО НА ЕЕ ОСНОВЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2022 |
|
RU2803286C1 |

Группа изобретений относится к области косметологии и космецевтики и представляет собой косметическое средство для стимуляции регенерации тканей кожи, включающее в качестве основного компонента культуральную среду, кондиционированную мезенхимными стромальными клетками жировой ткани человека, содержащую продукты секреции, включающие VEGF в концентрации не менее 4 нг/млн клеток, FGF basic в концентрации не менее 5.8 пкг/млн клеток, PEDF в концентрации не менее 10 нг/млн клеток, PAI-1 в концентрации не менее 35 нг/млн клеток, а также комплекс из по крайней мере 20 белков, представленных в таблице 1, при этом концентрация указанных компонентов представлена на 10 мл среды. Изобретение обеспечивает стимуляцию регенерации кожи, повышение упругости кожи и улучшение ее эстетических характеристик. 2 н. и 27 з.п. ф-лы, 7 ил., 2 табл., 13 пр.
1. Косметическое средство для стимуляции регенерации тканей кожи, включающее в качестве основного компонента культуральную среду, кондиционированную мезенхимными стромальными клетками жировой ткани человека, содержащую продукты секреции, включающие VEGF в концентрации не менее 4 нг/млн клеток, FGF basic в концентрации не менее 5.8 пкг/млн клеток, PEDF в концентрации не менее 10 нг/млн клеток, PAI-1 в концентрации не менее 35 нг/млн клеток, а также комплекс из по крайней мере 20 белков, представленных в таблице 1, при этом концентрация указанных компонентов представлена на 10 мл среды.
2. Средство по п. 1, характеризующееся тем, что косметическое средство представлено в виде лиофилизата кондиционированной среды.
3. Средство по п. 2, характеризующееся тем, что дополнительно содержит энхансеры трансдермального проникновения, при этом лиофилизат восстанавливают в водном растворе энхансеров.
4. Средство по п. 3, характеризующееся тем, что в качестве энхансеров использованы диметилизосорбид в количестве не менее 1,5% по отношению к массе готового косметического средства, и/или гиалуроновая кислота или ее производные в количестве не менее 1% по отношению к массе готового косметического средства, и/или липосом различного состава.
5. Средство по п. 4, характеризующееся тем, что в качестве производных гиалуроновой кислоты используют гиалуронат натрия.
6. Средство по п. 4, характеризующееся тем, что в качестве липосом различного состава используют липосомы на основе фосфолипидов сои.
7. Средство по п. 1, характеризующееся тем, что продукты секреции мезенхимных стромальных клеток жировой ткани человека, содержащиеся в кондиционированной среде, частично или полностью включены в состав липосом, при этом средство представлено в виде раствора или лиофилизата.
8. Средство по п. 7, характеризующееся тем, что липосомы получают методом продавливания.
9. Средство по п. 7, характеризующееся тем, что липосомы получают методом удаления детергента.
10. Средство по п. 7, характеризующееся тем, что включение компонентов среды в липосомы проводят путем лиофилизации.
11. Средство по п. 2, характеризующееся тем, что оно дополнительно содержит совместимое с лиофилизатом и растворимое в воде полимерное вещество, образующее при растворении в водном растворе энхансеров трансдермального проникновения гелеобразную субстанцию - в соотношении по массе не более 1:100, с обеспечением формирования устойчивой гелеобразной субстанции, при этом комбинацию лиофилизата с полимером и водный раствор энхансеров смешивают между собой сразу перед нанесением на кожу.
12. Средство по п. 11, характеризующееся тем, что лиофилизат содержит липосомы, в качестве которых используют липосомы на основе фосфолипидов сои.
13. Средство по п. 11, в котором совместимое полимерное вещество, образующее при растворении в воде гелеобразную субстанцию, представляет собой метилцеллюлозу.
14. Средство по п. 11, характеризующееся тем, что в качестве энхансеров трансдермального проникновения используют гиалуронат натрия в концентрации не менее 1% мас. к массе готового косметического средства и диметилизосорбид в концентрации не менее 1,5% мас. к массе готового косметического средства.
15. Средство по п. 14, характеризующееся тем, что гиалуронат натрия и диметилизосорбид используют в виде 1%-ного водного раствора.
16. Способ получения косметического средства по п. 1 на основе кондиционированной среды, содержащей продукты секреции мезенхимальных стромальных клеток жировой ткани человека, включающий культивирование мезенхимных стромальных клеток жировой ткани человека до 4-5 пассажей в среде, поддерживающей их рост, отмывку клеток буферным раствором, их кондиционирование в бессывороточной и лишенной продуктов животного происхождения среде роста, поддерживающей жизнеспособность клеток не менее 70% и пригодной для терапевтического применения, отбор среды культивирования, содержащей продукты секреции мезенхимальных стромальных клеток жировой ткани человека, с удалением из нее остатков клеток, предварительное тестирование кондиционированной среды и отбор образцов для получения косметического средства, очистку отобранных образцов от низкомолекулярных компонентов с получением средства, содержащего продукты секреции мезенхимальных стромальных клеток жировой ткани человека, включающие VEGF в концентрации не менее 4 нг/млн клеток, FGF basic в концентрации не менее 5.8 пкг/млн клеток, PEDF в концентрации не менее 10 нг/млн клеток, PAI-1 в концентрации не менее 35 нг/млн клеток, определяемые методом иммуноферментного анализа при восстановлении лиофилизата в стерильном буфере с физиологической осмолярностью, а также комплекс из 20 белков, представленных в таблице 1, определяемых методом протеомного анализа.
17. Способ по п. 16, характеризующийся тем, что для получения средства по п. 2 отобранные очищенные образцы лиофилизируют.
18. Способ по п. 16, характеризующийся тем, что среда, поддерживающая рост мезенхимных клеток человека, представляет собой раствор, содержащий базовую среду - AdvanceSTEM Cell Culture Media, и добавку - AdvanceSTEM Stem Cell Growth Supplement, при этом добавку берут в объеме 9-11% на 100% объема базовой среды.
19. Способ по п. 16, характеризующийся тем, что кондиционирование осуществляют в культуральных флаконах или чашках Петри, при этом мезенхимальные стромальные клетки жировой ткани человека размещают на плоской подложке плотностью 5-15*103/см2 в среде для кондиционирования в объеме 0,1-0,2 мл/см2, затем культуральные емкости с клетками помещают на 6-8 дней в СО2 инкубатор при 37±1°С, 5%-ном содержании СО2 и относительной влажности ≥95%.
20. Способ по п. 16, характеризующийся тем, что в качестве буферного раствора для отмывки клеток от компонентов среды роста используют раствор Хэнкса, при этом отмывку клеток осуществляют трех-пятикратным размещением клеток в упомянутый раствор из расчета 0,1-0,2 мл раствора на см2 клеток на 5-10 минут.
21. Способ по п. 16, характеризующийся тем, что в качестве среды для кондиционирования используют DMEM с низким содержанием глюкозы или другую среду роста, поддерживающую жизнеспособность мезенхимальных стромальных клеток жировой ткани человека в течение всего срока кондиционирования.
22. Способ по п. 16, характеризующийся тем, что удаление из среды культивирования остатков клеток осуществляют центрифугированием.
23. Способ по п. 16, характеризующийся тем, что предварительное тестирование образцов кондиционированной среды осуществляют по способности стимулировать миграцию фибробластов кожи человека не менее чем на 50% выше по сравнению с отрицательным контролем, в качестве которого выступает базовая среда роста, использованная для кондиционирования мезенхимальных стромальных клеток жировой ткани человека.
24. Способ по п. 23, характеризующийся тем, что для оценки миграции фибробластов кожи человека используют модель клеточной раны.
25. Способ по п. 16, характеризующийся тем, что очистку среды культивирования осуществляют посредством ее ультрафильтрации с удалением низкомолекулярных соединений массой менее 5 кДа.
26. Способ по п. 16, характеризующийся тем, что после очистки среды культивирования от низкомолекулярных соединений дополнительно осуществляют микрофильтрацию полученной среды через фильтры с диаметром пор 0,22 мкм.
27. Способ по п. 17, характеризующийся тем, что лиофилизацию осуществляют в 8-14 стадий при давлении 0,013-0,027 кПа, температуре от -40°С до -5°С, время лиофилизации не более 36 часов при максимальной загрузке лиофильной сушки.
28. Способ по п. 22, характеризующийся тем, что центрифугирование осуществляют при 300±5 g, температуре 6±2°С в течение 10 минут для очистки от клеточного дебриса.
29. Способ по п. 26, характеризующийся тем, что очистку от низкомолекулярных компонентов осуществляют с использованием системы фильтрации в тангенциальном потоке Minim II.
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ОЖОГОВ И РАН НА ОСНОВЕ ЦИТОКИНОВ И ФАКТОРОВ РОСТА, СЕКРЕТИРУЕМЫХ МЕЗЕНХИМНЫМИ КЛЕТКАМИ ЧЕЛОВЕКА, СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА И СПОСОБ ЛЕЧЕНИЯ ОЖОГОВ И РАН | 2014 |
|
RU2574017C1 |
| КОМПОЗИЦИЯ ДЛЯ СТИМУЛИРОВАНИЯ РОСТА И РЕГЕНЕРАЦИИ КЛЕТОК, А ТАКЖЕ СПОСОБЫ ЕЕ ПОЛУЧЕНИЯ | 2006 |
|
RU2341270C2 |
| КОМПОЗИЦИЯ ДЛЯ РЕГЕНЕРАЦИИ КЛЕТОК КОЖИ И СЛИЗИСТЫХ ОБОЛОЧЕК | 2010 |
|
RU2455354C1 |
| Масляная система для двигателей внутреннего сгорания | 1949 |
|
SU86816A1 |
| Способ электрической стыковой сварки | 1943 |
|
SU69449A1 |
Авторы
Даты
2017-05-24—Публикация
2016-05-11—Подача