Родственные заявки
В настоящей заявке испрашивается приоритет и преимущество предварительной заявки на патент США серийный № 61/179307, поданной 18 мая 2009; предварительной заявки на патент США серийный № 61/178009, поданной 13 мая 2009, и предварительной заявки на патент США серийный № 61/117102, поданной 22 ноября 2008, содержание которых вводится в настоящее описание посредством ссылки.
Область, к которой относится изобретение
В общих чертах, настоящее изобретение относится к лечению заболеваний и патологических состояний у человека. Более конкретно, настоящее изобретение относится к антиангиогенной терапии, которая может быть проведена отдельно или в комбинации с другой противораковой терапией, применяемой для лечения рака молочной железы.
Предшествующий уровень техники
Рак является одним из самых опасных заболеваний, угрожающих здоровью человека. Только в США каждый год раком заболевает почти 1,3 миллиона человек, и, по причинам смертности, раковые заболевания занимают второе место после сердечно-сосудистых заболеваний, то есть они являются причиной приблизительно 1 из 4 летальных исходов. Рак молочной железы является второй из наиболее распространенных форм рака и занимает второе место по смертности среди американских женщин. Были также высказаны предположения, что в последующие 5 лет рак может опережать сердечно-сосудистые заболевания по числу летальных исходов. За большинство летальных исходов ответственны солидные опухоли. Хотя в настоящее время наблюдается значительный прогресс в консервативном лечении некоторых видов рака, однако продолжительность жизни для пациентов с любым видом рака обычно составляет 5 лет, а за последние 20 лет, она была увеличена лишь примерно на 10%. Рак или злокачественные опухоли метастазируют и обнаруживают быстрый и неконтролируемый рост, что крайне затрудняет их своевременную диагностику и лечение.
Рак молочной железы является заболеванием, от которого в Соединенных Штатах каждый год умирает много женщин. По оценкам Американского Общества по изучению рака в 2008 году от этого заболевания умерло приблизительно 40000 человек. Ежегодно диагностируется свыше 180000 новых случаев заболевания рака молочной железы, и по оценкам специалистов рак молочной железы развивается у одной из восьми женщин. Полученные результаты показали, что, на сегодняшний день, рак молочной железы является одним из самых опасных заболеваний у женщин.
Обычно метастазирующий рак молочной железы не поддается лечению, и лишь небольшому числу пациентов удается продлить жизнь после проведения стандартной химиотерапии. Greenberg et al., J. Clin. Oncol. 14:2197-2205 (1996).
За последние три десятилетия знания в области фундаментальной биологии рака молочной железы экпоненциально возрастают, и некоторые из них могут найти свое применение в терапии. В многонациональных испытаниях фазы II с открытой меткой, проводимые с участием 222 женщин с HER2-сверхэкспрессирующим метастазирующим раком молочной железы, был получен показатель отклика 15%, причем в шести случаях, где было использовано рекомбинантное гуманизованное моноклональное антитело (трастузумаб, также известный как Herceptin®, Genentech, South San Francisco), направленное против HER2 (Cobleigh et al., Proc. Am. Soc. Clin. Oncol. 17:97 (1998)), был подтвержден полный ответ. Рандомизированное испытание фазы III указывало на безопасность и эффективность добавления герцептина (Herceptin) в химиотерапию первого ряда, проводимую с использованием либо паклитаксела, либо комбинации доксорубицина и циклофосфамида. Общий показатель отклика и время до прогрессирования заболевания значительно увеличивались при проведении химиотерапии с добавлением герцептина по сравнению с указанными параметрами, полученными при проведении только одной химиотерапии (Slamon et al., Proc. Am. Soc. Clin. Oncol. 17:98 (1998)). Еще более важно отметить, что добавление герцептина приводит к увеличению общей продолжительности жизни (Norton et al., Proc. Am. Soc. Clin. Oncol. 18: 127a (1999)).
Хотя трастузумаб представляет собой первое новое биологическое терапевтическое средство, разрешенное для лечения подгруппы пациентов с раком молочной железы, имеющих HER2-сверхэкспрессирующие раковые опухоли, однако были продемонстрированы и другие перспективные подходы, и такие подходы были применены в клинической практике. По оценкам специалистов, 75 процентов женщин, у которых был впервые диагностирован рак молочной железы, являются HER2-негативными. Соединения, ингибирующие ангиогенез, представляют особый интерес с точки зрения их применения для лечения других групп пациентов с раком молочной железы, и такие соединения были и являются объектом клинических испытаний в США и в других странах.
Ангиогенез представляет собой важное событие, при котором происходит пролиферация, аномальное сокращение и реорганизация васкулярных эндотелиальных клеток с образованием новых сосудов из уже существующей сосудистой сети. Существуют неопровержимые данные, указывающие на то, что развитие сосудистой сети является главным событием в нормальных и патологических пролиферативных процессах (Folkman and Klagsbrun Science 235:442-447(1987)). Доставка кислорода и питательных веществ, а также удаление продуктов катаболизма, представляет собой скорость-ограничивающие стадии в большинстве процессов роста опухоли, наблюдающихся у многоклеточных организмов.
Хотя считается, что индуцирование образования новых кровеносных сосудов является доминирующим механизмом опухолевого ангиогенеза, однако последние данные показали, что некоторые опухоли могут расти благодаря кооптации уже существующих кровеносных сосудов хозяина. Затем такая кооптированная сосудистая сеть разрушается, что приводит к регрессии опухоли, которая, в конечном счете, возвращается к своему прежнему состоянию благодаря индуцированному гипоксией ангиогенезу в пограничном участке опухоли. Holash et al. Science 284:1994-1998 (1999).
Одним из ключевых позитивных регуляторов нормального и аномального ангиогенеза является васкулярный эндотелиальный фактор роста (VEGF)-A. VEGF-A является членом семейства генов, включающего VEGF-B, VEGF-C, VEGF-D, VEGF-E, VEGF-F и PlGF. VEGF-A связывается, главным образом, с двумя высокоаффинными тирозинкиназными рецепторами, VEGFR-1 (Flt-1) и VEGFR-2 (Flk-1/KDR), причем последний рецептор является основным передатчиком митотических сигналов VEGF-A в васкулярные эндотелиальные клетки. Кроме того, нейропилин-1 был идентифицирован как рецептор для связывающихся с гепарином изоформ VEGF-A и может играть определенную роль в развитии сосудов.
VEGF, помимо того, что он является ангиогенным фактором, участвующим в ангиогенезе и образовании новых сосудов, также представляет собой плейотропный фактор роста, обладающий множеством биологических свойств в других физиологических процессах, таких как выживание эндотелиальных клеток, сосудистая проницаемость и вазодилатация, хемотаксис моноцитов и приток кальция. Ferrara and Davis-Smyth (1997), см. выше. Кроме того, проводимые исследования выявили митогенное действие VEGF на некоторые неэндотелиальные клетки, такие как пигментные эпителиальные клетки сетчатки, клетки протоков поджелудочной железы и шванновские клетки. Guerrin et al. J. Cell Physiol. 164:385-394 (1995); Oberg-Welsh et al. Mol. Cell. Endocrinol. 126:125-132 (1997); Sondell et al. J. Neurosci. 19:5731-5740 (1999).
Идентификация VEGF как первичного регулятора ангиогенеза при патологических состояниях послужила стимулом для множества попыток блокировать активность VEGF при состояниях, в которых участвует патологический ангиогенез. Экспрессия VEGF активируется при многих злокачественных заболеваниях, а сверхэкспрессия VEGF коррелирует с более запущенной стадией заболевания или с более плохим прогнозом многих солидных опухолей. Поэтому молекулы, ингибирующие пути передачи сигнала VEGF, были использованы для лечения относительно запущенных солидных опухолей, при которых наблюдается патологический ангиогенез.
Поскольку рак является одним из самых опасных смертельных заболеваний, необходимо разработать дополнительные способы лечения рака у пациентов. В частности, лечение пациентов с раком молочной железы (РМЖ) необходимо для повышения контроля над заболеванием в целях предупреждения симптомов данного заболевания при минимальной токсичности. Настоящее изобретение направлено на решение указанных и других проблем, которые будут очевидны из нижеследующего описания.
Описание сущности изобретения
Настоящее изобретение относится к применению анти-VEGF антитела для эффективного лечения пациентов с раком молочной железы, которые ранее не подвергались лечению метастазирующего рака молочной железы. В частности, настоящее изобретение относится к рандомизированному клиническому испытанию фазы III, проводимому с использованием бевацизумаба (AVASTIN®) в комбинации со схемой химиотерапии с участием индивидуумов с метастазирующим раком молочной железы, а именно людей, у которых это заболевание ранее не подвергалось лечению. Такими схемами химиотерапии являются терапия таксаном (например, частицами, связанными с белком доцетакселом или паклитакселом (например, Abraxane®)), терапия антрациклином (например, доксорубицином, эпирубиксином или их комбинациями) или терапия капецитабином. В некоторых вариантах изобретения такое лечение применяется в качестве терапии первого ряда для лечения локально рецидивирующего рака молочной железы или метастазирующего рака молочной железы, ранее не подвергаемого лечению. Успешно проведенное испытание показало, что добавление анти-VEGF антитела к стандартной химиотерапии дает статистически значимые и клинически значимые эффекты в лечении пациентов с раком молочной железы. Кроме того, результаты предварительных испытаний, проводимых с использованием бевацизумаба, показали, что такое лечение является безопасным.
Результаты клинических исследований, проводимых с использованием бевацизумаба у человека, имеющего метастазирующую раковую опухоль молочной железы, показали, что эффективность, оцениваемая по выживаемости без прогрессирования заболевания (PFS), была, в основном, позитивной по сравнению с PFS-данными, полученными с использованием только химиотерапевтических средств. У индивидуумов, участвующих в клинических испытаниях, которые проводили с использованием бевацизумаба в комбинации с терапией таксаном (например, частицами, связанными с белком доцетакселом или паклитакселом (например, Abraxane®))/терапией антрациклином (например, доксорубицином, эпирубицином или их комбинациями), наблюдалось увеличение продолжительности жизни без прогрессирования заболевания по сравнению с индивидуумами, проходящими только терапию таксаном (например, частицами, связанными с белком доцетакселом или паклитакселом (например, Abraxane®))/терапию антрациклином (например, доксорубицином, эпирубицином или их комбинациями). У индивидуумов, участвующих в клинических испытаниях, проводимых с использованием бевацизумаба в комбинации с терапией капецитабином, описанной ниже, наблюдалось увеличение продолжительности жизни без прогрессирования заболевания по сравнению с индивидуумами, прошедшими только терапию капецитабином. Такое различие было статистически значимым.
В соответствии с этим, настоящее изобретение относится к способам лечения индивидуума, у которого был диагностирован ранее не подвергаемый лечению метастазирующий рак молочной железы, где указанные способы включают проведение у данного индивидуума схемы лечения, включающей введение эффективного количества по меньшей мере одного химиотерапевтического средства и анти-VEGF антитела, где указанному индивидууму не вводили какое-либо химиотерапевтическое средство для лечения локально рецидивирующего рака молочной железы или метастазирующего рака молочной железы. Такой индивидуум является, но необязательно, HER2-негативным. В некоторых вариантах изобретения, такой индивидуум является HER2-позитивным. Указанный индивидуум не подвергался, но необязательно, предварительной вспомогательной химиотерапии при рецидиве в течение 12 месяцев или менее после введения последней дозы. Комбинированная схема лечения, включающая химиотерапию и введение анти-VEGF антитела, увеличивала продолжительность жизни индивидуума без прогрессирования заболевания (PFS). В некоторых вариантах изобретения, комбинированная схема лечения, включающая химиотерапию и введение анти-VEGF антитела, имела профиль безопасности, соответствующий профилю безопасности, наблюдаемому при проведении предварительных испытаний с использованием бевацизумаба.
Настоящее изобретение также относится к применению анти-VEGF антитела вместе по меньшей мере с одним химиотерапевтическим средством в целях приготовления лекарственного средства для лечения пациента с метастазирующим раком молочной железы, который ранее не подвергался какому-либо лечению, где указанному индивидууму не вводили какое-либо химиотерапевтическое средство для лечения локально рецидивирующего рака молочной железы или метастазирующего рака молочной железы. Такой индивидуум является, но необязательно, HER2-негативным. В некоторых вариантах изобретения, такой индивидуум является HER2-позитивным. Указанный индивидуум не подвергался, но необязательно, предварительной вспомогательной химиотерапии при рецидиве в течение 12 месяцев или менее после введения последней дозы. Применение анти-VEGF антитела и химиотерапевтического средства приводило к увеличению продолжительности жизни индивидуума без прогрессирования заболевания (PFS). В некоторых вариантах изобретения, применение химиотерапевтического средства и анти-VEGF антитела давало профиль безопасности, соответствующий профилю безопасности, наблюдаемому при проведении предварительных испытаний с использованием бевацизумаба.
Настоящее изобретение также относится к анти-VEGF антителам, применяемым в способе лечения локально рецидивирующего рака молочной железы или метастазирующего рака молочной железы у индивидуума, где указанный способ включает проведение данному индивидууму схемы лечения, включающей введение эффективного количества химиотерапевтического средства и анти-VEGF антитела, где указанному индивидууму не вводили какого-либо химиотерапевтического средства для лечения локально рецидивирующего рака молочной железы или метастазирующего рака молочной железы. Указанный индивидуум является, но необязательно, HER2-негативным. В некоторых вариантах изобретения, такой индивидуум является HER2-позитивным. Указанный индивидуум не подвергался, но необязательно, предварительной вспомогательной химиотерапии по поводу рецидива в течение 12 месяцев или менее после введения последней дозы. Комбинированная схема лечения, включающая химиотерапию и введение анти-VEGF антитела, увеличивала продолжительность жизни индивидуума без прогрессирования заболевания (PFS). В некоторых вариантах изобретения комбинированная схема лечения, включающая химиотерапию и введение анти-VEGF антитела, имела профиль безопасности, соответствующий профилю безопасности, наблюдаемому при проведении предварительных испытаний с использованием бевацизумаба.
В некоторых вариантах любых описанных здесь способов, применений и композиций, PFS увеличивается примерно на 1 месяц, 1,2 месяца, 2 месяца, 2,4 месяца, 2,9 месяца, 3 месяца, 3,5 месяца, 4 месяца, 6 месяцев, 7 месяцев, 8 месяцев, 9 месяцев, 1 год, примерно 2 года, примерно 3 года и т.п. В одном из вариантов изобретения, PFS увеличивается примерно на 2,9 месяца - 3,5 месяца (например, при использовании капецитабина). В одном из вариантов изобретения, PFS увеличивается примерно на 1,2 месяца - 2,4 месяца (например, при использовании таксана/антрациклина).
В любых описанных здесь способах, применениях и композициях может быть использовано любое химиотерапевтическое средство, обладающее противораковой активностью. В некоторых вариантах изобретения, химиотерапевтическое средство выбрано из группы, состоящей из алкилирующих агентов, антиметаболитов, аналогов фолиевой кислоты, аналогов пиримидина, аналогов пурина и родственных ингибиторов, винкаалкалоидов, эпиподофиллотоксинов, антибиотиков, L-аспарагиназы, ингибитора топоизомеразы, интерферонов, координационных комплексов платины, мочевины, замещенной антрацендионом, производных метилгидразина, адренокортикальных суппрессоров, адренокортикостероидов, прогестинов, эстрогенов, антиэстрогена, андрогенов, антиандрогена и аналога гонадотропин-высвобождающего гормона. В некоторых вариантах изобретения химиотерапевтическими средствами являются, например, капецитабин, таксан, антрациклин, паклитаксел, доцетаксел, частицы, связанные с белком паклитакселом (например, Abraxane®), доксорубицин, эпирубицин, 5-фторурацил, циклофосфамид или их комбинации. Могут быть использованы два или более химиотерапевтических средств (например, в виде коктейля), вводимых в комбинации с анти-VEGF антителом.
Клинические эффекты, достигаемые путем применения любых описанных здесь способов и композиций согласно изобретению, могут быть определены, например, по продолжительности жизни без прогрессирования заболевания (PFS), времени, прошедшего до тех пор, пока лечение не будет признано безуспешным, по объективному показателю отклика и по продолжительности ответа.
В соответствии с этим, настоящее изобретение относится к способу информирования пациента, страдающего, например, раком молочной железы, путем его инструктирования относительно проведения лечения с использованием анти-VEGF антитела в целях увеличения продолжительности жизни индивидуума без прогрессирования заболевания, для снижения риска рецидива рака у данного индивидуума или для увеличения вероятности выздоровления данного индивидуума. В некоторых вариантах изобретения указанный способ также включает инструктирование пациента относительно приема по меньшей мере одного химиотерапевтического средства. Лечение анти-VEGF антителом может быть проведено одновременно с лечением химиотерапевтическим средством, либо оно может быть проведено после такого лечения. В некоторых вариантах изобретения данный индивидуум проходит лечение в соответствии с инструкциями, полученными указанным способом.
Настоящее изобретение также относится к способу стимулирования, включающему содействие или помощь по введению анти-VEGF антитела для лечения, например, рака молочной железы у человека. В некоторых вариантах изобретения указанный способ также включает содействие или помощь по введению по меньшей мере одного химиотерапевтического средства. Введение анти-VEGF антитела может быть осуществлено одновременно с введением химиотерапевтического средства или после введения указанного средства. Такая помощь может быть осуществлена любыми доступными способами. В некоторых вариантах изобретения такая помощь осуществляется путем включения вкладыша в промышленную упаковку, содержащую анти-VEGF антитело. Такая помощь может быть также осуществлена путем включения вкладыша в промышленную упаковку, содержащую химиотерапевтическое средство. Такая помощь может быть осуществлена путем письменного или устного общения с врачом или со специалистом, оказывающим медицинские услуги. В некоторых вариантах изобретения, такая помощь может быть осуществлена путем включения вкладыша в упаковку, где в указанном вкладыше имеются инструкции по лечению анти-VEGF антителом. В некоторых вариантах изобретения, после такой информационной поддержки осуществляют лечение индивидуума анти-VEGF антителом в присутствии или в отсутствие химиотерапевтического средства.
Настоящее изобретение относится к способу проведения коммерческих операций, включающему реализацию анти-VEGF антитела для лечения, например, рака молочной железы у индивидуума в целях увеличения продолжительности жизни индивидуума без прогрессирования заболевания, снижения вероятности рецидива рака у данного индивидуума или увеличения вероятности выздоровления данного индивидуума. В некоторых вариантах изобретения указанный способ также включает реализацию химиотерапевтического средства, применяемого в комбинации с анти-VEGF антителом. В некоторых вариантах изобретения после такой реализации осуществляют лечение индивидуума анти-VEGF антителом в присутствии или в отсутствие химиотерапевтического средства.
Настоящее изобретение также относится к способу проведения коммерческих операций, включающему реализацию химиотерапевтического средства, используемого в комбинации с анти-VEGF антителом для лечения, например, рака молочной железы у индивидуума в целях увеличения его продолжительности жизни без прогрессирования заболевания, снижения вероятности рецидива рака у данного индивидуума или увеличения вероятности выздоровления данного индивидуума. В некоторых вариантах изобретения после такой реализации осуществляют лечение индивидуума комбинацией химиотерапевтического средства с анти-VEGF антителом.
В любых из описанных здесь способов, применений и композиций, анти-VEGF антитело может быть заменено VEGF-специфическим антагонистом, например молекулой рецептора VEGF или молекулой химерного рецептора VEGF, описанными в настоящей заявке. В некоторых вариантах описанных здесь способов, применений и композиций, анти-VEGF антителом является бевацизумаб. Анти-VEGF антителом или его антигенсвязывающим фрагментом может быть моноклональное антитело, химерное антитело, полностью человеческое антитело или гуманизованное антитело. Примерами антител, используемых в способах согласно изобретению, являются бевацизумаб (AVASTIN®), антитело G6, антитело B20 и их фрагменты. В некоторых вариантах изобретения анти-VEGF антитело имеет вариабельную область тяжелой цепи, содержащую нижеследующую аминокислотную последовательность:
EVQLVESGGG LVQPGGSLRL SCAASGYTFT NYGMNWVRQA PGKGLEWVGW
INTYTGEPTY AADFKRRFTF SLDTSKSTAY LQMNSLRAED TAVYYCAKYP
HYYGSSHWYF DVWGQGTLVT VSS (SEQ ID NO: 1)
и вариабельную область легкой цепи, содержащую нижеследующую аминокислотную последовательность:
DIQMTQSPSS LSASVGDRVT ITCSASQDIS NYLNWYQQKP GKAPKVLIYF
TSSLHSGVPS RFSGSGSGTD FTLTISSLQP EDFATYYCQQ YSTVPWTFGQ
GTKVEIKR (SEQ ID NO: 2).
Антителом или его антигенсвязывающим фрагментом может быть также антитело, не содержащее Fc-части, F(ab')2-, Fab- или Fv-структуры.
В одном из вариантов описанных здесь способов, применений и композиций, указанное лечение осуществляют с использованием комбинации VEGF-специфического антагониста, например анти-VEGF антитела, и по меньшей мере одного химиотерапевтического средства. В других вариантах описанных здесь способов, применений и композиций, указанным VEGF-специфическим антагонистом является средство для монотерапии.
Все описанные здесь способы, применения и композиции могут относиться к лечению рака, включая, но не ограничиваясь ими, карциному, лимфому, бластому, саркому и лейкоз. Более конкретными примерами таких раковых заболеваний являются рак молочной железы, плоскоклеточный рак легких, мелкоклеточный рак легких, немелкоклеточный рак легких, аденокарцинома легких, плоскоклеточная карцинома легких, рак брюшины, гепатоцеллюлярный рак, рак желудочно-кишечного тракта, рак поджелудочной железы, глиобластома, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, гепатома, рак толстой кишки, рак прямой и ободочной кишки, карцинома эндометрия или матки, карцинома слюнных желез, рак почек, рак печени, рак предстательной железы, рак почек, рак вульвы, рак щитовидной железы, карцинома печени, рак желудка, меланома и рак головы и шеи различных типов. В некоторых вариантах способов согласно изобретению, указанный индивидуум страдает метастазирующим раком молочной железы. В некоторых вариантах описанных здесь способов, применений и композиций, указанный индивидуум страдает метастазирующим раком молочной железы, ранее не подвергавшимся лечению. В некоторых вариантах изобретения указанный индивидуум страдает HER2-негативным метастазирующим раком молочной железы.
Каждый из вышеуказанных аспектов может дополнительно включать обследование индивидуума на рецидив рака. Обследование может быть осуществлено, например, путем оценки продолжительности жизни без прогрессирования заболевания (PFS) или общей продолжительности жизни (OS) или объективного показателя отклика (ORR). В одном из вариантов изобретения, PFS, или OS, или ORR оценивают после начала проведения лечения.
В зависимости от типа и тяжести заболевания, предпочтительные дозы анти-VEGF антитела, например бевацизумаба, описаны в настоящей заявке и могут составлять примерно от l мкг/кг до 50 мг/кг, а наиболее предпочтительно примерно от 5 мг/кг до 15 мг/кг, включая, но не ограничиваясь ими, дозы 5 мг/кг, 7,5 мг/кг, 10 мг/кг или 15 мг/кг. Частота введения варьируется в зависимости от типа и тяжести указанного заболевания. В случае повторного введения в течение нескольких дней или более, в зависимости от состояния, лечение продолжают до полного исчезновения раковой опухоли или до достижения желаемого терапевтического эффекта, как было определено методами, описанными в настоящей заявке или известными специалистам. В одном из примеров, анти-VEGF антитело вводят один раз в неделю, раз в две недели или раз в три недели в дозе, составляющей примерно от 5 мг/кг до 15 мг/кг, включая, но не ограничиваясь ими, 5 мг/кг, 7,5 мг/кг, 10 мг/кг или 15 мг/кг. Однако могут быть применены и другие схемы введения доз. Мониторинг успеха лечения в соответствии с настоящим изобретением может быть легко проведен с применением стандартных методов и анализов.
В дополнительных вариантах каждого из вышеуказанных аспектов, VEGF-специфический антагонист, например анти-VEGF антитело, вводят местно или системно (например, перорально или внутривенно). В других вариантах изобретения в одном из аспектов лечения, VEGF-специфический антагонист используется в монотерапии или в монотерапии в течение длительного периода лечения VEGF-специфическим антагонистом, например, в более продолжительной фазе лечения или при поддерживающей терапии, в соответствии с оценкой врача-клинициста или описанным здесь методом.
В других вариантах описанных здесь способов, применений и композиций, такое лечение VEGF-специфическим антагонистом, его применение или композиции, содержащие такой антагонист, представляют собой комбинацию с дополнительной противораковой терапией, включая, но не ограничиваясь ею, хирургическую операцию, лучевую терапию, химиотерапию, дифференцирующую терапию, биотерапию, иммунотерапию, терапию ингибитором ангиогенеза, цитотоксическим средством и/или антипролиферативным соединением. Лечение VEGF-специфическим антагонистом, его применение и композиция, содержащая такой антагонист, могут также включать любую комбинацию схем лечения вышеуказанных типов. В некоторых вариантах изобретения химиотерапевтическое средство и VEGF-специфический антагонист вводят одновременно.
В некоторых вариантах описанных здесь способов, применений и композиций, которые включают дополнительную противораковую терапию, указанный индивидуум может быть также подвергнут лечению путем проведения дополнительной противораковой терапии до, во время (например, одновременно с введением VEGF-специфического антагониста) или после введения VEGF-специфического антагониста. В одном из вариантов изобретения VEGF-специфический антагонист, вводимый отдельно или в комбинации с противораковой терапией, может быть использован в качестве средства для поддерживающей терапии.
Другие отличительные признаки и преимущества настоящего изобретения будут очевидны из нижеследующего подробного описания изобретения, из описания графического материала и из формулы изобретения.
Краткое описание графического материала
На фигуре 1 представлен протокол исследований, в которых проводили испытания по лечению метастазирующего рака молочной железы с использованием бевацизумаба (BV) или плацебо (PL) в комбинации с различными химиотерапевтическими средствами.
На фигуре 2 представлены кривые продолжительности жизни без прогрессирования заболевания (PFS), построенные по данным, полученным в ветви испытания с использованием капецитабина. Аббревиатура INV (исследователь) означает исследование по продолжительности жизни без прогрессирования заболевания (PFS), проводимое исследователем, а аббревиатура IRC означает PFS, оцениваемую независимой экспертной комиссией (IRC), где плацебо обозначено PL, а бевацизумаб обозначен BV.
На фигуре 3 представлены кривые PFS, построенные по данным, полученным в ветви испытания с использованием таксана/антрациклина. Аббревиатура INV означает исследование PFS, проводимое исследователем, а аббревиатура IRC означает PFS, оцениваемую независимой экспертной комиссией (IRC), где плацебо обозначено PL, а бевацизумаб обозначен BV.
На фигуре 4 проиллюстрированы анализы PFS у подгрупп индивидуумов, участвующих в испытаниях в группах, которым вводили капецитабин и таксан/антрациклин.
На фигуре 5 проиллюстрированы объективные показатели отклика для групп, которым вводили капецитабин (Cape) и таксан/антрациклин (T/Antra).
На фигуре 6 проиллюстрированы анализы PFS у подгрупп индивидуумов в группах, которым вводили таксан/антрациклин (T/Anthra).
Подробное описание изобретения
1. Определения
Используемые здесь термины «VEGF» или «VEGF-A» означают человеческий фактор роста васкулярных эндотелиальных клеток, состоящий из 165 аминокислот, и родственные человеческие факторы роста васкулярных эндотелиальных клеток, состоящие из 121, 145, 189 и 206 аминокислот, как описано в публикациях Leung et al. Science, 246:1306 (1989), и Houck et al. Mol. Endocrin., 5:1806 (1991), а также их природные аллельные и процессированные формы. VEGF-A представляет собой член генного семейства, включающего VEGF-B, VEGF-C, VEGF-D, VEGF-E, VEGF-F и PlGF. VEGF-A, главным образом, связывается с двумя высокоаффинными тирозинкиназными рецепторами, VEGFR-1 (Flt-1) и VEGFR-2 (Flk-1/KDR), где последний рецептор представляет собой главный медиатор передачи митогенных VEGF-A-сигналов в васкулярных эндотелиальных клетках. Кроме того, нейропилин-1 был идентифицирован как рецептор для изоформ связывающегося с гепарином VEGF-A, и было обнаружено, что он может играть определенную роль в развитии сосудов. Термины «VEGF» или «VEGF-A» также означают VEGF, происходящие от животных, не являющихся человеком, таких как мыши, крысы или приматы. Иногда VEGF, происходящий от животных конкретных видов, обозначают hVEGF, для человеческого VEGF, или mVEGF, для мышиного VEGF. Обычно VEGF означает человеческий VEGF. Используемый здесь термин «VEGF» также означает усеченные формы или фрагменты полипептида, содержащего аминокислоты 8-109 или 1-109 человеческого фактора роста васкулярных эндотелиальных клеток, состоящего из 165 аминокислот. В настоящей заявке ссылка на любую из таких форм VEGF может означать, например, «VEGF (8-109)», «VEGF (1-109)» или «VEGF165». Положения аминокислот для «усеченного» нативного VEGF пронумерованы, как указывается в нативной последовательности VEGF. Так, например, положение аминокислоты 17 (метионина) в усеченном нативном VEGF также соответствует положению 17 (метионина) в нативном VEGF. Усеченный нативный VEGF обладает аффинностью связывания с рецепторами KDR и Flt-1, сравнимой с аффинностью связывания нативного VEGF.
«Анти-VEGF антитело» представляет собой антитело, которое связывается с VEGF с достаточной аффинностью и специфичностью. Выбранное антитело обычно обладает достаточно высокой аффинностью связывания с VEGF, например, антитело может связываться с hVEGF с величиной Kd, составляющей 100 нМ - 1 пМ. Аффинности антител могут быть определены, например, с помощью анализа методом поверхностного плазмонного резонанса (такого как анализ BIAcore, описанный в публикации заявки PCT № WO 2005/012359); твердофазного иммуноферментного анализа (ELISA); и анализов на конкурентное связывание (например, РИА). В некоторых вариантах изобретения анти-VEGF антитело согласно изобретению может быть использовано в качестве терапевтического средства для нацеливания на пораженный участок и подавления симптомов заболеваний или состояний, ассоциированных с активностью VEGF. Кроме того, указанное антитело может быть проанализировано с помощью других анализов на биологическую активность, например, для оценки его эффективности в качестве терапевтического средства. Такие анализы известны специалистам, и их выбор зависит от антигена-мишени и цели применения данного антитела. Примерами таких анализов являются анализ на ингибирование HUVEC; анализы на ингибирование роста опухолевых клеток (описанные, например, в WO 89/06692); анализы на антитело-зависимую клеточную цитотоксичность (ADCC) и комплемент-опосредуемую цитотоксичность (CDC) (патент США 5500362); и анализы на агонистическую активность или на гемопоэз (см. WO 95/27062). Анти-VEGF антитело обычно не связывается с другими гомологами VEGF, такими как VEGF-B или VEGF-C, а также с другими факторами роста, такими как PlGF, PDGF или bFGF.
Термин «антагонист VEGF» означает молекулу, обладающую способностью нейтрализовать, блокировать, ингибировать, элиминировать, снижать или подавлять активность VEGF, включая его связывание с одним или несколькими рецепторами VEGF. Антагонистами VEGF являются анти-VEGF антитела и их антигенсвязывающие фрагменты, молекулы рецепторов и производные, которые специфически связываются с VEGF, с последующей секвестрацией их связывания с одним или несколькими рецепторами; антитела против рецепторов VEGF и антагонисты рецепторов VEGF, такие как небольшие молекулы-ингибиторы тирозинкиназных VEGFR.
Полипептид с «нативной последовательностью» включает полипептид, имеющий такую же аминокислотную последовательность, как и последовательность природного полипептида. Таким образом, полипептид с нативной последовательностью может иметь аминокислотную последовательность природного полипептида, происходящую от любого млекопитающего. Такой полипептид с нативной последовательностью может быть выделен из природного источника, либо он может быть продуцирован рекомбинантными методами или методами синтеза. Термин полипептид с «нативной последовательностью», в частности, включает природные усеченные или секретированные формы полипептида (например, последовательность внеклеточного домена), природные модифицированные формы (например, альтернативно сплайсированные формы) и природные аллельные варианты полипептида.
Термин «вариант» полипептида означает биологически активный полипептид, аминокислотная последовательность которого по меньшей мере примерно на 80% идентична аминокислотой последовательности полипептида с нативной последовательностью. Такими вариантами являются, например, полипептиды, в которых у их N- или C-конца добавлены или делетированы один или несколько аминокислотных остатков. Обычно вариант может иметь аминокислотную последовательность, которая по меньшей мере примерно на 80%, более предпочтительно по меньшей мере примерно на 90%, а еще более предпочтительно по меньшей мере примерно на 95% идентична аминокислотой последовательности полипептида с нативной последовательностью.
Используемый здесь термин «антитело» применяется в самом широком смысле, а в частности охватывает моноклональные антитела (включая полноразмерные или интактные моноклональные антитела), поликлональные антитела, поливалентные антитела, мультиспецифические антитела (например, биспецифические антитела) и фрагменты антител (см. ниже), при условии, что они обладают нужной биологической активностью.
Во всем описании настоящего изобретения и в формуле изобретения, нумерация остатков в тяжелой цепи иммуноглобулина соответствует Европейской системе нумерации, описанной Кэбатом в публикации Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991), точное описание которой вводится в настоящую заявку посредством ссылки. Термин “EU-нумерация по Кэбату” означает Европейскую систему нумерации остатков человеческого антитела IgG1.
В одном из вариантов изобретения, «Kd» или «величину Kd» согласно изобретению определяют с помощью анализа на связывание с радиоактивно меченным VEGF (РИА), осуществляемого с использованием Fab-варианта антитела и молекулы VEGF, описанных в нижеследующем анализе, где указанный анализ позволяет измерять аффинность связывания Fab с VEGF в растворе путем уравновешивания Fab с минимальной концентрацией 125I-меченного VEGF(109) в присутствии титрационного набора немеченного VEGF, с последующей иммобилизацией связанного VEGF на планшете, сенсибилизированном анти-Fab антителом (Chen et al. (1999) J. Mol. Biol. 293:865-881). В одном из примеров, в целях создания соответствующих условий для анализа, микротитрационные планшеты (Dynex) сенсибилизируют в течение ночи 5 мкг/мл захватывающего анти-Fab антитела (Cappel Labs) в 50 мМ карбонате натрия (рН 9,6), а затем блокируют 2% (масс./об.) альбумином бычьей сыворотки в PBS в течение 2-5 часов при комнатной температуре (приблизительно при 23°С). В неадсорбирующем планшете (Nunc # 269620), 100 пМ или 26 пМ 125I-VEGF(109) смешивают с серийными разведениями представляющего интерес Fab, например Fab-12 (Presta et al. (1997) Cancer Res. 57:4593-4599). Затем представляющий интерес Fab инкубируют в течение ночи, однако, для гарантии достижения равновесия, инкубирование может быть проведено в течение 65 часов. После этого смеси переносят в планшет для иммобилизации и инкубируют при комнатной температуре в течение одного часа. Затем раствор удаляют, и планшет восемь раз промывают 0,1% Твином-20 в PBS. После сушки планшетов добавляют 150 мкл/лунку сцинтилляционной жидкости (MicroScintTM-20; Packard), и планшеты подсчитывают на гамма-счетчике Topcount (Packard) в течение десяти минут. Концентрации каждого Fab, которые составляют 20% или менее от максимального уровня связывания, отбирают для их использования в анализах на конкурентное связывание. В соответствии с другим вариантом изобретения, Kd или величину Kd измеряют в анализе методом поверхностного плазмонного резонанса с использованием BIAcoreTM-2000 или BIAcoreTM-3000 (BIAcore, Inc., Piscataway, NJ) при 25°С с использованием чипов СМ5 с иммобилизованным на них hVEGF (8-109) при величине единицы отклика (RU), составляющей ~10. Вкратце, биосенсорные чипы с карбоксиметилированным декстраном (CM5, BIAcore Inc.) активируют гидрохлоридом N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимидом (NHS) в соответствии с инструкциями поставщиков. Человеческий VEGF разводят 10 мМ ацетатом натрия, рН 4,8, до 5 мкг/мл (~0,2 мкМ), а затем инъецируют при скорости потока 5 мкл/минуту для достижения величины единиц отклика (RU) связанного белка, составляющей ~10. После инъекции человеческого VEGF для блокирования непрореагировавших групп вводят 1М этаноламин. Для измерения кинетики реакции вводят инъекции двухкратных серийных разведений Fab (0,78 нМ - 500 нМ) в PBS, содержащем 0,05% твина® 20 (PBST) при 25°С и при скорости потока приблизительно 25 мкл/мин. Скорость ассоциации (kon) и скорость диссоциации (koff) вычисляют с использованием простой лангмюровской модели связывания 1:1 (BIAcore Evaluation Software version 3.2) при одновременном построении сенсорограмм ассоциации и диссоциации. Константу равновесной диссоциации (Kd) вычисляют как отношение koff/kon. См., например, Chen, Y., et al. (1999) J. Mol. Biol. 293:865-881. Если скорость ассоциации превышает 106 М-1·с-1, как было определено выше методом поверхностного плазмонного резонанса, то такая скорость ассоциации может быть определена методом гашения флуоресценции, который позволяет измерять увеличение или уменьшение интенсивности флуоресцентного излучения (возбуждение = 295 нм; излучение = 340 нм, полоса пропускания 16 нм) при 25°С для 20 нМ анти-VEGF антитела (в Fab-форме) в PBS, рН 7,2, в присутствии возрастающих концентраций усеченной формы человеческого VEGF(8-109) или мышиного VEGF, как было измерено на спектрометре, таком как спектрофотометр, снабженный ограничителем потока (Aviv Instrumtnts), или на спектрофотометре SLM-Aminco серии 8000 (ThermoSpectronic), снабженном кюветой для перемешивания.
«Блокирующим антителом» или «антителом-антагонистом» является антитело, которое ингибирует или снижает биологическую активность антигена, связывающегося с этим антителом. Так, например, VEGF-специфическое антитело-антагонист связывается с VEGF и ингибирует способность VEGF индуцировать ангиогенез, пролиферацию васкулярных эндотелиальных клеток или сосудистую проницаемость. В некоторых вариантах изобретения, блокирующие антитела или антитела-антагонисты полностью ингибируют биологическую активность антигена.
Используемый в настоящей заявке термин «мультивалентное антитело», если это не оговорено особо, означает антитело, содержащее три или более антигенсвязывающих сайтов. Так, например, мультивалентное антитело, предпочтительно, конструируют так, чтобы оно содержало три или более антигенсвязывающих сайтов и, по существу, не являлось антителом IgM или IgA с нативной последовательностью.
«Фрагменты антител» содержат только часть интактного антитела, в основном, включая антигенсвязывающий сайт интактного антитела, и тем самым сохраняют способность связываться с антигеном. Примерами фрагментов антител, входящих в объем настоящего изобретения, являются (i) Fab-фрагмент, имеющий домены VL, CL, VH и CH1; (ii) Fab'-фрагмент, который представляет собой Fab-фрагмент, имеющий один или несколько цистеиновых остатков у C-конца домена CH1; (iii) Fd-фрагмент, имеющий домены VH и CH1; (iv) Fd'-фрагмент, имеющий домены VH и CH1 и один или несколько цистеиновых остатков у C-конца домена CH1; (v) Fv-фрагмент, имеющий домены VL и VH на одной ветви антитела; (vi) dAb-фрагмент (Ward et al., Nature 341, 544-546 (1989)), который состоит из VH-домена; (vii) выделенные области CDR; (viii) F(ab')2-фрагменты, двухвалентный фрагмент, включающий два Fab'-фрагмента, связанные дисульфидной мостиковой связью в шарнирной области; (ix) молекулы одноцепочечного антитела (например, одноцепочечный Fv; scFv) (Bird et al., Science 242:423-426 (1988); and Huston et al., PNAS (USA) 85:5879-5883 (1988)); (x) «диантитела» с двумя антигенсвязывающими сайтами, содержащими вариабельный домен тяжелой цепи (VH), соединенный с вариабельным доменом легкой цепи (VL) в одной и той же полипептидной цепи (см., например, EP 404097; WO 93/11161; и Hollinger et al., Proc. Natl. Acad. Sci USA, 90:6444-6448 (1993)); (xi) «линейные антитела», содержащие пару тандемных Fd-сегментов (VH-CH1-VH-CH1), которые, вместе с комплементарными полипептидами легкой цепи, образуют пару антигенсвязывающих областей (Zapata et al. Protein Eng. 8(10):1057-1062 (1995); и патент США № 5641870).
Используемый здесь термин «моноклональное антитело» означает антитело, полученное от популяции, в основном, гомогенных антител, то есть отдельных антител, составляющих данную популяцию, которые являются идентичными, за исключением возможных природных мутаций, которые могут присутствовать в небольших количествах. Моноклональные антитела являются в высокой степени специфическими, то есть они направлены против одного антигена. Кроме того, в отличие от препаратов поликлональных антител, которыми обычно являются различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене. Термин «моноклональный» не означает, что это антитело должно быть продуцировано каким-либо конкретным методом. Так, например, моноклональные антитела, используемые в соответствии с настоящим изобретением, могут быть получены гибридомным методом, впервые описанным Kohler et al., Nature, 256:495 (1975); либо они могут быть получены методами рекомбинантных ДНК (см., например, патент США № 4816567). «Моноклональные антитела» могут быть также выделены из фаговых библиотек антител методами, описанными, например, Clackson et al., Nature, 352:624-628 (1991) или Marks et al., J. Mol. Biol., 222:581-597 (1991).
«Fv» представляет собой фрагмент антитела, содержащий полноразмерный антиген-распознающий сайт и антигенсвязывающий сайт. Эта область состоит из димера одного вариабельного домена тяжелой цепи и одного вариабельного домена легкой цепи, жестко связанных друг с другом связью, которая, по своей природе, может быть ковалентной, например, в scFv. Эта область имеет такую конфигурацию, при которой три CDR каждого вариабельного домена взаимодействуют друг с другом таким образом, что они образуют антигенсвязывающий сайт на поверхности димера VH-VL. В целом, шесть CDR или их субпопуляция сообщают антителу специфичность связывания с антигеном. Однако даже один вариабельный домен (или половина Fv, содержащая только три CDR, специфичных к антигену), обладает способностью распознавать антиген и связываться с ним, хотя и с меньшей аффинностью, чем весь сайт связывания.
Используемый здесь термин «вариабельный домен антитела» означает части легкой и тяжелой цепей молекулы антитела, которые включают аминокислотные последовательности гипервариабельных областей (CDR; то есть CDR1, CDR2 и CDR3) и каркасных областей (FR). VH означает вариабельный домен тяжелой цепи. VL означает вариабельный домен легкой цепи. В соответствии со способами, применяемыми в настоящем изобретении, положения аминокислот в CDR и FR могут быть определены по Кэбату (Sequences of Proteins of Immunological Interest (National Institutes of Health, Bethesda, Md., 1987 and 1991)). Нумерация аминокислот антител или антигенсвязывающих фрагментов также приводится по Кэбату.
Используемый здесь термин «гипервариабельные области» (комплементарность-определяющие области (CDR); то есть CDR1, CDR2 и CDR3) означает аминокислотные остатки вариабельного домена антитела, которые необходимы для связывания с антигеном. Каждый вариабельный домен обычно имеет три области CDR, идентифицированные как CDR1, CDR2 и CDR3. Каждая гипервариабельная область может содержать аминокислотные остатки, происходящие от «гипервариабельной области», определенной по Кэбату (то есть примерно остатки 24-34 (L1), 50-56 (L2) и 89-97 (L3) в вариабельном домене легкой цепи, и 31-35 (Н1), 50-65 (Н2) и 95-102 (Н3) в вариабельном домене тяжелой цепи; Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)) и/или остатки, происходящие от «гипервариабельной петли» (то есть остатки примерно 26-32 (L1), 50-52 (L2) и 91-96 (L3) в вариабельном домене легкой цепи, и 26-32 (Н1), 53-55 (Н2) и 96-101 (Н3) в вариабельном домене тяжелой цепи; Chothia & Lesk J. Mol. Biol., 196:901-917 (1987)). В некоторых случаях, гипервариабельная область может включать аминокислоты, происходящие от области CDR, определенные по Кэбату, и гипервариабельной петли. Так, например, CDRH1 тяжелой цепи антитела 4D5 включает аминокислоты 26-35.
«Каркасные области» (далее обозначаемые «FR») представляют собой остатки вариабельного домена, не являющиеся остатками CDR. Каждый вариабельный домен обычно имеет четыре FR, идентифицированные как FR1, FR2, FR3 и FR4. Если CDR определены по Кэбату, то остатки FR легкой цепи находятся в положениях примерно 1-23 (LCFR1), 35-49 (LCFR2), 57-88 (LCFR3) и 98-107 (LCFR4), а остатки FR тяжелой цепи находятся в положениях примерно 1-30 (HCFR1), 36-49 (HCFR2), 66-94 (HCFR3) и 103-113 (HCFR4). Если CDR содержат аминокислотые остатки гипервариабельных петель, то остатки FR легкой цепи находятся в положениях примерно 1-25 (LCFR1), 33-49 (LCFR2), 53-90 (LCFR3) и 97-107 (LCFR4), а остатки FR тяжелой цепи находятся в положениях примерно 1-25 (HCFR1), 33-52 (HCFR2), 56-95 (HCFR3) и 102-113 (HCFR4). В некоторых случаях, если CDR содержит аминокислоты, происходящие от CDR, определенной по Кэбату, и от гипервариабельной петли, то остатки FR могут быть соответствующим образом скорректированы. Так, например, если CDRH1 включает аминокислоты H26-H35, то остатки FR1 тяжелой цепи находятся в положениях 1-25, а остатки FR2 находятся в положениях 36-49.
«Fab»-фрагмент содержит вариабельный и константный домены легкой цепи, а также вариабельный домен и первый константный домен (СН1) тяжелой цепи. F(ab')2-фрагменты антитела содержат пару Fab-фрагментов, которые обычно ковалентно связаны друг с другом у карбокси-конца посредством шарнирных цистеинов, расположенных между ними. Специалистам также известны и другие химические связи между фрагментами антител.
«Одноцепочечный Fv-фрагмент» или «scFv-фрагмент» антител включает домены VH и VL антитела, где указанные домены присутствуют в одной полипептидной цепи. Обычно полипептид Fv дополнительно содержит полипептидный линкер между доменами VH и VL, который обеспечивает образование scFv со структурой, необходимой для связывания с антигеном. Описание scFv можно найти в работе Pluckthun The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg & Moore eds., Springer-Verlag, New York, pp.269-315 (1994).
Термин «диантитела» означает небольшие фрагменты антител с двумя антигенсвязывающими сайтами, где указанные фрагменты включают вариабельный домен тяжелой цепи (VH), соединенный с вариабельным доменом легкой цепи (VL) в одной и той же полипептидной цепи (VH-VL). Если используется линкер, который является слишком коротким для образования пары между двумя доменами на одной и той же цепи, то домены вынуждены спариваться с комплементарными доменами другой цепи и образовывать два антигенсвязывающих сайта. Диантитела более подробно описаны, например, в ЕР 404097; в WO 93/11161 и в работе Hollinger et al. Proc. Natl. Acad. Sci., USA, 90:6444-6448 (1993).
Термин «линейные антитела» означает антитела, описанные Zapata et al., Protein Eng., 8(10):1057-1062 (1995). Вкратце, такие антитела включают пару тандемных Fd-сегментов (VH-CH1-VH-CH1), которые, вместе с комплементарными полипептидами легкой цепи, образуют пару антигенсвязывающих областей. Линейные антитела могут быть биспецифическими или моноспецифическими.
Описанными здесь моноклональными антителами являются, в частности, «химерные» антитела (иммуноглобулины), в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям антител, происходящих от конкретного вида или принадлежащих к конкретному классу или подклассу антител, а остальная(ые) цепь(и) идентична(ы) или гомологична(ы) соответствующим последовательностям антител, происходящих от другого вида или принадлежащих к другому классу или подклассу антител; а также фрагменты таких антител, при условии, что они обладают нужной биологической активностью (см., например, патент США № 4816567 и Morrison et al. Proc. Natl. Acad. Sci., USA, 81:6851-6855 (1984)).
«Гуманизованные формы» нечеловеческих антител (например, мышиных антител) представляют собой химерные антитела, которые содержат минимальную последовательность, происходящую от нечеловеческого иммуноглобулина. По большей части, гуманизованные антитела представляют собой человеческие иммуноглобулины (антитело реципиента), в которых остатки, происходящие от гипервариабельной области данного реципиента, заменены остатками, происходящими от гипервариабельной области нечеловеческого антитела (донорного антитела), такого как мышиное антитело, крысиное антитело, кроличье антитело или антитело приматов, не являющихся человеком, где указанные антитела обладают нужной специфичностью, аффинностью и связывающей способностью. В некоторых случаях, остатки каркасной области (FR) Fv человеческого иммуноглобулина заменены соответствующими нечеловеческими остатками. Кроме того, гуманизованные антитела могут содержать остатки, не обнаруживаемые в антителе реципиента или в антителе донора. Такие модификации вводят для улучшения свойств антитела. В общих чертах, гуманизованное антитело может содержать, в основном, все или по меньшей мере один, а обычно два вариабельных домена, в которых все или почти все гипервариабельные петли соответствуют гипервариабельным петлям нечеловеческого иммуноглобулина, и все или почти все области FR представляют собой FR с человеческой иммуноглобулиновой последовательностью. Гуманизованное антитело также содержит, но необязательно, по меньшей мере, часть константной области иммуноглобулина (Fc), обычно области человеческого иммуноглобулина. Более подробное описание см. в работах Jones et al. Nature, 321:522-525 (1986); Riechmann et al. Nature 332:323-329 (1998) и Presta, Curr. Op. Struct. Biol. 2:593-596 (1992).
«Человеческое антитело» представляет собой антитело, имеющее аминокислотную последовательность, соответствующую последовательности антитела, продуцируемого у человека, и/или антитело, полученное любыми описанными здесь методами продуцирования человеческих антител. Такое определение человеческого антитела, в частности, исключает гуманизованное антитело, содержащее нечеловеческие антигенсвязывающие остатки. Человеческие антитела могут быть продуцированы различными методами, известными специалистам. В одном из вариантов изобретения человеческое антитело выбирают из фаговой библиотеки, экспрессирующей человеческие антитела (Vaughan et al. Nature Biotechnology, 14:309-314 (1996): Sheets et al. PNAS, (USA) 95:6157-6162 (1998)); Hoogenboom and Winter, J. Mol. Biol., 227:381 (1991); Marks et al., J. Mol. Biol., 222:581 (1991)). Человеческие антитела могут быть также получены путем введения локусов человеческого иммуноглобулина трансгенным животным, например мышам, у которых эндогенные гены иммуноглобулина были частично или полностью инактивированы. После такого введения наблюдается продуцирование человеческих антител, которые по всем параметрам имеют очень большое сходство с антителами, наблюдаемыми у человека, включая реаранжировку и сборку генов, и репертуар антител. Этот метод описан, например, в патентах США №№ 5545807, 5545806; 5569825; 5625126; 5633425; 5661016 и в нижеследующих научных публикациях: Marks et al., Bio/Technology, 10: 779-783 (1992); Lonberg et al., Nature, 368: 856-859 (1994); Morrison, Nature, 368:812-13 (1994); Fishwild et al., Nature Biotechnology, 14: 845-51 (1996); Neuberger, Nature Biotechnology, 14: 826 (1996); Lonberg and Huszar, Intern. Rev. Immunol., 13:65-93 (1995). Альтернативно, человеческое антитело может быть получено путем иммортализации человеческих В-лимфоцитов, продуцирующих антитело, направленное против антигена-мишени (такие В-лимфоциты могут быть выделены у индивидуума, либо они могут быть введены путем иммунизации in vitro). См., например, Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p. 77 (1985); Boerner et al., J. Immunol., 147 (1):86- 95 (1991); и патент США № 5750373.
«Аффинно зрелое» антитело представляет собой антитело, имеющее одну или несколько модификаций в одной или нескольких CDR, что позволяет повышать аффинность данного антитела к антигену, по сравнению с родительским антителом, не имеющим такой(их) модификации(й). Предпочтительные аффинно зрелые антитела имеют наномолярные или даже пикомолярные аффинности по отношению к антигену-мишени. Аффинно зрелые антитела получают известными методами. В публикации Marks и др. (Bio/Technology 10:779-783 (1992)) описано созревание аффинности в результате перестановки доменов VH и VL. Неспецифический мутагенез CDR и/или каркасных остатков описан в публикациях Barbas et al., Proc. Natl. Acad. Sci., USA, 91:3809-3813 (1994); Schier et al., Gene 169:147-155 (1995); Yelton et al., J. Immunol. 155:1994-2004 (1995); Jackson et al., J. Immunol. 154(7):3310-9 (1995) и Hawkins et al., J. Mol. Biol. 226:889-896 (1992).
«Функциональный антигенсвязывающий сайт» антитела представляет собой сайт, обладающий способностью связываться с антигеном-мишенью. Аффинность связывания антигенсвязывающего сайта с антигеном не имеет решающего значения и необязательно должна быть такой же, как аффинность родительского антитела, от которого происходит данный антигенсвязывающий сайт, но его способность связываться с антигеном должна быть такой, чтобы ее можно было измерить любым методом, обычно применяемым для оценки связывания антитела с антигеном. Кроме того, аффинности связывания каждого антигенсвязывающего сайта описанного здесь поливалентного антитела с антигеном необязательно должны быть численно равными. Что касается описанных здесь мультимерных антител, то число функциональных антигенсвязывающих сайтов может быть оценено с помощью анализа методом ультрацентрифугирования, описанного в примере 2 публикации заявки на патент США № 20050186208. В соответствии с этим методом анализа, различные отношения количеств антигена-мишени к количествам мультимерного антитела объединяют и вычисляют среднюю молекулярную массу комплексов, принимая во внимание различия в числе функциональных сайтов связывания. Эти теоретические величины сравнивают с фактическими экспериментальными величинами, полученными для оценки числа функциональных сайтов связывания.
Антитело, имеющее «биологические свойства» сконструированного антитела, представляет собой антитело, которое обладает одним или несколькими биологическими свойствами антитела, отличающегося от других антител, связывающихся с тем же самым антигеном.
Для скрининга антител, которые связываются с эпитопом на данном антигене, связанным с представляющим интерес антителом, может быть проведен рутинный анализ на перекрестное блокирование, например, описанный в публикации Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory, Ed Harlow and David Lane (1988).
«Видоспецифическое антитело» представляет собой антитело, которое имеет более высокую аффинность связывания с антигеном от млекопитающего первого вида, чем аффинность связывания с гомологом антигена от млекопитающего второго вида. Обычно видоспецифическое антитело «специфически связывается» с человеческим антигеном (то есть имеет величину аффинности связывания (Kd) не более чем примерно 1×10-7 M, предпочтительно не более чем примерно 1×10-8 M, а наиболее предпочтительно не более чем примерно 1×10-9 M), а аффинность связывания с гомологом антигена от млекопитающего второго вида, не являющегося человеком, по меньшей мере примерно в 50 раз, или по меньшей мере примерно в 500 раз, или по меньшей мере примерно в 1000 раз ниже, чем аффинность связывания с человеческим антигеном. Видоспецифическое антитело может представлять собой антитело любого из различных типов, определенных выше, но обычно таким антителом является гуманизованное или человеческое антитело.
Используемый здесь термин «антитело-мутант» или «вариант антитела» означает вариант аминокислотной последовательности видоспецифического антитела, в которой были модифицированы один или несколько аминокислотных остатков видоспецифического антитела. Такие мутанты должны иметь последовательность, которая менее чем на 100% идентична или аналогична последовательности видоспецифического антитела. В одном из вариантов изобретения антитело-мутант имеет аминокислотную последовательность, которая по меньшей мере на 75%, более предпочтительно по меньшей мере на 80%, еще более предпочтительно на 85%, еще более предпочтительно на 90%, а наиболее предпочтительно по меньшей мере на 95% идентична или аналогична аминокислотной последовательности вариабельного домена тяжелой или легкой цепи видоспецифического антитела. Идентичность или сходство этих последовательностей определены здесь как процент аминокислотных остатков в последовательности-кандидате, которые идентичны (то есть те же самые остатки) или аналогичны (то есть аминокислотные остатки, принадлежащие к одной и той же группе по общим свойствам боковых цепей, см. ниже) остаткам видоспецифического антитела, как было установлено после выравнивания последовательностей и введения пробелов, если это необходимо, для достижения максимального процента идентичности последовательностей. Любые N-концевые, С-концевые или внутренние удлинения, делеции или вставки в последовательности антитела, находящиеся за пределами вариабельного домена, не будут влиять на идентичность или сходство последовательностей.
Для увеличения времени полужизни антител или полипептида, содержащего аминокислотные последовательности согласно изобретению, к указанному антителу (а в частности, к фрагменту антитела) может быть присоединен эпитоп, связывающийся с рецептором «спасения», как описано, например, в патенте США 5739277. Так, например, молекула нуклеиновой кислоты, кодирующая эпитоп, связывающийся с рецептором «спасения», может быть присоединена, с сохранением рамки считывания, к нуклеиновой кислоте, кодирующей полипептидную последовательность согласно изобретению, так, чтобы гибридный белок, экспрессируемый сконструированной молекулой нуклеиновой кислоты, содержал эпитоп, связывающийся с рецептором «спасения», и полипептидную последовательность согласно изобретению. Используемый здесь термин «эпитоп, связывающийся с рецептором «спасения»», означает эпитоп Fc-области молекулы IgG (например, IgG1, IgG2, IgG3 или IgG4), ответственный за увеличение времени полужизни молекул IgG в сыворотке in vivo (например, Ghetie et al., Ann. Rev. Immunol. 18:739-766 (2000), таблица 1). Антитела, имеющие замены в Fc-области и увеличенное время полужизни в сыворотке, также описаны в WO 00/42072, WO 02/060919; Shields et al., J. Biol. Chem. 276:6591-6604 (2001); Hinton, J. Biol. Chem. 279:6213-6216 (2004)). В другом варианте изобретения время полужизни в сыворотке может быть также увеличено, например, путем присоединения других полипептидных последовательностей. Так, например, антитела или другие полипептиды, используемые в способах согласно изобретению, могут быть присоединены к сывороточному альбумину или к части сывороточного альбумина, который связывается с рецептором FcRn или с пептидом, связывающимся с сывороточным альбумином, так, чтобы сывороточный альбумин связывался с антителом или полипептидом, например с указанными полипептидными последовательностями, описанными в WO 01/45746. В одном из вариантов изобретения присоединенный пептид сывороточного альбумина содержит аминокислотную последовательность DICLPRWGCLW. В другом варианте изобретения время полужизни Fab было увеличено с применением указанных методов. Описание последовательностей пептида, связывающегося с сывороточным альбумином, можно также найти в публикации Dennis et al., J. Biol. Chem. 277:35035-35043 (2002).
«Химерный белок рецептора VEGF» представляет собой молекулу рецептора VEGF, имеющую аминокислотные последовательности, происходящие по меньшей мере от двух различных белков, по меньшей мере один из которых представляет собой белок рецептора VEGF. В некоторых вариантах изобретения химерный белок рецептора VEGF обладает способностью связываться с VEGF и ингибировать биологическую активность VEGF.
«Выделенное» антитело представляет собой антитело, которое было идентифицировано и выделено и/или очищено от компонентов его природного окружения. Контаминирующими компонентами его природного окружения являются материалы, негативно влияющие на диагностическую или терапевтическую эффективность антитела, и такими компонентами могут быть ферменты, гормоны и другие белковые или небелковые растворенные вещества. В предпочтительных вариантах изобретения указанное антитело может быть очищено (1) на более чем 95% по массе антитела, как может быть определено методом Лаури, а более предпочтительно более чем на 99% по массе антитела, (2) до степени, достаточной для введения, по меньшей мере, 15 остатков у N-концевой или внутренней части аминокислотной последовательности, с использованием секвенатора, снабженного центрифужным сосудом, или (3) до гомогенности, что может быть подтверждено с помощью электрофореза в ДСН-ПААГ в восстанавливающих или в невосстанавливающих условиях с окрашиванием кумасси синим или, предпочтительно, серебром. Термин “выделенное антитело” включает антитело in situ в рекомбинантных клетках, если отсутствует по меньшей мере один природный компонент этого антитела. Однако обычно выделенное антитело может быть получено, по меньшей мере, в одной стадии очистки.
Термин «фрагмент» означает часть полипептида или молекулы нуклеиновой кислоты, которая составляет, предпочтительно, по меньшей мере 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или более от всей длины сравниваемой молекулы нуклеиновой кислоты или полипептида. Фрагмент может содержать 10, 20, 30, 40, 50, 60, 70, 80, 90 или 100, 200, 300, 400, 500, 600 или более нуклеотидов, или 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 120, 140, 160, 180, 190, 200 аминокислот или более.
Термины «антиангиогенный агент» или «ингибитор ангиогенеза» означают вещество с небольшой молекулярной массой, полинуклеотид, полипептид, выделенный белок, рекомбинантный белок, антитело или их конъюгаты или гибридные белки, которые прямо или опосредованно ингибируют ангиогенез, васкулогенез или нежелательную проницаемость сосудов. Следует отметить, что антиангиогенными агентами являются агенты, которые связываются с ангиогенным фактором или его рецептором и блокируют их ангиогенную активность. Так, например, антиангиогенным агентом является антитело или другой антагонист, направленный против определенного выше ангиогенного агента, как определено в описании настоящего изобретения или как известно специалистам, и такими агентами являются, но не ограничиваются ими, антитела против VEGF-A или рецептора VEGF-А (например, против рецептора KDR или рецептора Flt-1), VEGF-ловушка и ингибиторы PDGFR, такие как GLEEVEC® (мезилат иматиниба). Антиангиогенными агентами также являются нативные ингибиторы ангиогенеза, например ангиостатин, эндостатин и т.п. См., например, Klagsbrun and D'Amore, Annu. Rev. Physiol, 53:217-39 (1991); Streit and Detmar, Oncogene, 22:3172-3179 (2003) (см., например, таблицу 3, где перечислены типы антиангиогенной терапии злокачественной меланомы); Ferrara & Alitalo, Nature Medicine 5:1359-1364 (1999); Tonini et al., Oncogene, 22:6549-6556 (2003) (см., например, таблицу 2, где перечислены известные антиангиогенные факторы); и Sato. Int. J. Clin. Oncol., 8:200-206 (2003) (см., например, таблицу 1, где перечислены антиангиогенные агенты, используемые в клинических испытаниях).
Используемый здесь термин «поддерживающая» доза означает одну или несколько доз терапевтического средства, вводимого индивидууму во время или после лечения. Обычно поддерживающие дозы вводят во время лечения через определенные интервалы времени, например, приблизительно через неделю, приблизительно через каждые 2 недели, приблизительно через каждые 3 недели или приблизительно через каждые 4 недели.
Термин «выживаемость» означает продолжительность жизни индивидуума и включает продолжительность жизни без прогрессирования заболевания (PFS) и общую продолжительность жизни (OS). Продолжительность жизни может быть оценена методом Каплана-Мейера, а любые отклонения в продолжительности жизни могут быть определены по стратифицированному логранговому критерию.
Термин ««продолжительность жизни без прогрессирования заболевания» (PFS)» означает время жизни пациента от начала его лечения (или его рандомизации) до момента прогрессирования заболевания или до его смерти. Так, например, этот термин означает время жизни индивидуума без рецидива рака, определенное, например, как период времени примерно в 1 месяц, 1,2 месяца, 2 месяца, 2,4 месяца, 2,9 месяца, 3 месяца, 3,5 месяца, 4 месяца, 6 месяцев, 7 месяцев, 8 месяцев, 9 месяцев, 1 год, примерно 2 года, примерно 3 года и т.п. от начала лечения или от первого установления диагноза. В одном из вариантов изобретения, PFS составляет примерно от 2,9 месяца до 3,5 месяца (например, при лечении капецитабином). В одном из вариантов изобретения, PFS составляет примерно от 1,2 месяца до 2,4 месяца (например, при лечении таксаном/антрациклином). В одном из аспектов изобретения, PFS может быть определено по критерию оценки ответа при солидных опухолях (RECIST).
Термин «общая продолжительность жизни» означает время жизни индивидуума, определенное, например, как период времени примерно в 1 месяц, примерно 2 месяца, примерно 3 года, примерно 4 года, примерно 5 лет, примерно 10 лет и т.п. от начала лечения или от первого установления диагноза. В исследованиях согласно изобретению конечным событием в анализе по определению продолжительности жизни является смерть индивидуума по любой причине.
Термин «увеличение продолжительности жизни» или «увеличение вероятности выживания» означает увеличение PFS и/или OS у индивидуума, подвергаемого лечению по сравнению с индивидуумом, не подвергаемым лечению (то есть по сравнению с индивидуумом, не подвергаемым лечению VEGF-специфическим антагонистом, например анти-VEGF антителом) или по сравнению с индивидуумом контрольной группы, который был подвергнут лечению только химиотерапевтическим средством, таким как средство, применяемое при стандартном лечении рака молочной железы, например капецитабин, таксан, антрациклин, паклитаксел, дицетаксел, частицы, связанные с белком паклитакселом (например, Abraxane®), доксорубицин, эпирубицин, 5-фторурацил, циклофосфамид или их комбинации. Мониторинг продолжительности жизни осуществляют по меньшей мере в течение примерно одного месяца, двух месяцев, четырех месяцев, шести месяцев, девяти месяцев или по меньшей мере в течение примерно 1 года, по меньшей мере примерно 2 лет, по меньшей мере примерно 3 лет, по меньшей мере примерно 4 лет или по меньшей мере примерно 5 лет или по меньшей мере примерно 10 лет и т.п. после начала лечения или первого установления диагноза.
Степень риска (HR) представляет собой статистическое определение вероятности событий. В соответствии с настоящим изобретением степень риска определена как вероятность события у экспериментальной группы, деленная на вероятность события у контрольной группы в любой конкретный период времени. Термин «степень риска» в анализе на продолжительность жизни без прогрессирования заболевания означает суммарную разность двумя кривыми выживаемости без прогрессирования заболевания, представляющими снижение риска летального исхода после лечения по сравнению с контролем в течение периода обследования.
Используемый здесь термин «одновременное введение» означает введение двух или более терапевтических средств, где по меньшей мере часть вводимых средств вводят в одно и то же время. В соответствии с этим, одновременное введение включает схему введения доз, в которой введение одного или нескольких средств продолжается после прекращения введения одного или нескольких других средств.
Термин «монотерапия» означает схему терапии, которая включает введение только одного терапевтического средства в определенный период времени лечения рака или опухоли. Термин «монотерапия с использованием VEGF-специфического антагониста» означает введение VEGF-специфического антагониста без проведения дополнительной противораковой терапии во время лечения.
Термин «поддерживающая терапия» означает схему терапии, проводимой в целях снижения вероятности рецидива или прогрессирования заболевания. Поддерживающая терапия может быть проведена в течение определенного периода времени, включая более длительные периоды времени, которые могут продолжаться на протяжении всей жизни индивидуума. Поддерживающая терапия может быть проведена после начальной терапии или вместе с проведением начальной или дополнительной терапии. Дозы, используемые для поддерживающей терапии, могут варьироваться и могут быть ниже доз, используемых в терапии других типов. См. также определение термина «поддерживающая» доза.
Термины «рак» и «раковый» означают или описывают физиологическое состояние у млекопитающих, которое обычно характеризуется нерегулируемым клеточным ростом. Это определение включает доброкачественные и злокачественные раковые опухоли, а также «дремлющие» опухоли или микрометастазы. Примерами раковых заболеваний являются, но не ограничиваются ими, карцинома, лимфома, бластома, саркома и лейкоз. Более конкретными примерами таких раковых заболеваний являются рак молочной железы, плоскоклеточный рак, рак легких (включая мелкоклеточный рак легких, немелкоклеточный рак легких, аденокарциному легких и плоскоклеточную карциному легких), рак брюшной полости, гепатоцеллюлярный рак, рак кишечника или желудка (включая рак желудочно-кишечного тракта), рак поджелудочной железы, глиобластома, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, гепатома, рак толстой кишки, рак прямой и ободочной кишки, карцинома эндометрия или матки, карциномы слюнных желез, рак почек, рак печени, рак предстательной железы, рак вульвы, рак щитовидной железы, карцинома печени и рак головы и шеи различных типов, а также В-клеточная лимфома (включая низкозлокачественную/фолликулярную неходжкинскую лимфому (НХЛ); мелкоклеточную лимфоцитарную (МЛ) НХЛ; НХЛ средней стадии дифференцировки/фолликулярную НХЛ; диффузную НХЛ средней стадии дифференцировки; высокозлокачественную иммунобластную НХЛ; высокозлокачественную лимфобластную НХЛ; высокозлокачественную мелкоклеточную недифференцированную НХЛ; генерализованную НХЛ; лимфому клеток коры головного мозга; лимфому, ассоциированную со СПИДом и макроглобулинемию Вальденстрема); хронический лимфоцитарный лейкоз (ХЛЛ); острый лимфобластный лейкоз (ОЛЛ); злокачественный ретикулоэндотелиоз; хронический миелобластный лейкоз и посттрансплантационное лимфопролиферативное расстройство (ПТЛР), а также аномальная пролиферация сосудов, ассоциированная с факоматозом, отек (такой как отек, ассоциированный с опухолями головного мозга) и синдром Мейгса.
Термин «метастазы» означает распространение раковой опухоли из участка первичной опухоли в другие участки организма. Раковые клетки могут отрываться от первичной опухоли, проникать в лимфатические и кровеносные сосуды, циркулировать в кровотоке и размножаться (метастазировать) в периферических очагах нормальных тканей, еще присутствующих в организме. Метастазы могут быть локальными или периферическими. Образование метастазов представляет собой непрерывный процесс, при котором определенная часть опухолевых клеток отрывается от первичной опухоли, проходит по кровотоку и оседает в отдаленном участке. В этом новом участке обеспечивается кровоснабжение указанных клеток, и они могут размножаться с образованием клеточной массы, представляющей угрозу для жизни. Такое поведение опухолевых клеток регулируется стимулирующими и ингибирующими молекулярными механизмами, действующими внутри клетки, и, кроме того, важное значение также имеют взаимодействия между опухолевыми клетками и клетками-хозяевами.
Термин «индивид» означает млекопитающее, включая, но не ограничиваясь ими, млекопитающих, таких как человек, или млекопитающих, не являющихся человеком, таких как коровы, лошади, собаки, овцы или кошки. Предпочтительным индивидуумом является человек. Термин «индивидуум» также включает описанных здесь пациентов.
В способах согласно изобретению термин «информирование» индивидуума означает указания по проведению аппликационной лучевой терапии, консервативной терапии, лечения, схем лечения и т.п. любыми способами, а предпочтительно эти указания представлены в текстовой форме, например, в форме вкладыша в упаковку, или в форме другого текстового рекламного материала.
В способах согласно изобретению термин «стимулирование» означает предложение, рекламу, продажу или описание конкретного лекарственного средства, комбинации лекарственных средств или способа лечения с применением любых средств, включая текстовое описание, например в форме вкладышей в упаковку. Используемый здесь термин «стимулирование» означает рекламу терапевтического средства, такого как антагонист VEGF, например анти-VEGF антитело или химиотерапевтическое средство для лечения такого заболевания, как рак молочной железы, где указанное стимулирование осуществляется Департаментом по контролю за качеством пищевых продуктов, медикаментов и косметических средств (FDA), а указанное средство, как было продемонстрировано, обладает статистически значимой терапевтической эффективностью и соответствующей безопасностью для группы индивидуумов.
Используемый здесь термин «маркетинг» употребляется для описания содействия по внедрению, продаже или распространению продукта (например, лекарственного средства). Маркетинг, в частности, включает упаковку, рекламу и любую предпринимательскую деятельность по коммерциализации продукта.
Термин «группа» индивидуумов означает группу индивидуумов, страдающих раковым заболеванием, например, участвующих в клиническом испытании или обследуемых врачом-онкологом после получения разрешения FDA для лечения конкретного заболевания, такого как рак молочной железы. В одном из вариантов изобретения указанная группа включает по меньшей мере примерно 1200 индивидуумов.
Термин «противораковая терапия» означает терапию, применяемую для лечения рака. Примерами противораковых терапевтических средств являются, но не ограничиваются ими, например, хирургическая операция, химиотерапевтические средства, рост-ингибирующие средства, цитотоксические средства, средства, применяемые в лучевой терапии, антиангиогенные средства, апоптотические средства, антитубулиновые средства и другие средства, применяемые для лечения рака, такие как анти-HER-2 антитела (например, Herceptin®), анти-CD20 антитела, антагонист рецептора эпидермального фактора роста (EGFR) (например, ингибитор тирозинкиназы), ингибитор HER1/EGFR (например, эрлотиниб (Tarceva®)), ингибиторы тромбоцитарного фактора роста (например, Gleevec™ (мезилат иматиниба)), ингибитор COX-2 (например, целекоксиб), интерфероны, цитокины, антагонисты (например, нейтрализующие антитела), которые связываются с одной или несколькими нижеследующими мишенями: ErbB2, ErbB3, ErbB4, PDGFR-бета, BlyS, APRIL, BCMA или рецептор(ы) VEGF, TRAIL/Apo2, и другие биологически активные и органические химические вещества и т.п. В настоящее изобретение также входят комбинации вышеуказанных средств.
Используемый здесь термин «цитотоксическое средство» означает вещество, которое ингибирует или предотвращает функционирование клеток и/или вызывает деструкцию клеток. Этот термин включает радиоактивные изотопы (например, 211At, 131I, 125I, 90Y, 186Re, 188Re, 153Sm, 212Bi, 32Р и радиоактивные изотопы Lu), химиотерапевтические средства и токсины, такие как небольшие молекулы токсинов или ферментативно активные токсины, происходящие от бактерий, грибов, растений или животных, включая их фрагменты и/или варианты.
«Химиотерапевтическое средство» представляет собой химическое соединение, которое может быть использовано для лечения рака. Примерами химиотерапевтических средств являются химические соединения, которые могут быть использованы для лечения рака. Примерами химиотерапевтических средств являются алкилирующие агенты, такие как тиотепа и циклофосфамид CYTOXAN®; алкисульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включая альтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилолмеламин; ацетогенины (в частности, буллатацин и буллатацинон); камптотецин (включая синтетический аналог топотекан); бриостатин; каллистатин; СС-1065 (включая его адозелизиновые, карзелезиновые и бизелезиновые синтетические аналоги); криптофицины (в частности, криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая его синтетические аналоги, KW-2189 и СВ1-ТМ1); элеутеробин; панкратистатин; саркодиктиин; спонгистатин; азотные аналоги горчичного газа, такие как хлорамбуцил, хлорнафазин, хлорофосфамид, экстрамустин, ифосфамид, мехлоретамин, гидрохлорид оксида мехлоретамина, мелфалан, новембицин, фенестерин, преднимустин, трофосфамид, урациловый аналог горчичного газа; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин и ранимнустин; антибиотики, такие как энедииновые антибиотики (например, калихеамицин, а в частности, калихеамицин гамма II и калихеамицин омега II (см., например, Agnew, Chem. Intl. Ed. Engl., 33: 183-186 (1994)); динемицин, включая динемицин А; бисфосфонаты, такие как клодронат; эсперамицин, а также неокарзиностатиновый хромофор и родственные хромопротеиновые энедииновые антибиотики-хромофоры), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицины, карабицин, карминомицин, карзинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин ADRIAMYCIN® (включая морфолинодоксорубицин, цианоморфолинодоксорубицин, 2-пирролино-доксорубицин и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин С, микофеноловая кислота, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, келамицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин и зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин и триметрексат; пуриновые аналоги, такие как флударабин, 6-меркаптопурин, тиамиприн и тиогуанин; пиримидиновые аналоги, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин и флоксуридин; андрогены, такие как калустерон, пропионат дромостанолона, эпитиостанол, мепитиостан и тестолактон; антиадренергические средства, такие как аминоглютетимид, митотан и трилостан; средство, восполняющее недостаток фолиевой кислоты, такое как фролиновая кислота; ацеглатон; гликозид альдофосфамида; аминолевулиновая кислота; энилурацил; амсакрин; бестрабуцил; бизантрен; эдатраксат; дефофамин; демекольцин; диазиквон; эльфорнитин; ацетат эллиптиния; эпотилон; этоглюцид; нитрат галлия; гидроксимочевина; лентинан; лонидаинин; майтанзиноиды, такие как майтанзин и анзамитоцины; митогуазон; митоксантрон; мопиданмол; нитраэрин; пентостатин; фенамет; пирарубицин; лозоксантрон; подофиллиновая кислота; 2-этилгидразид; прокарбазин; полисахаридный комплекс PSK® (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофиран; спирогерманий; тенаузоновая кислота; триазихон; 2,2',2”-трихлортриэтиламин; трихотецены (в частности, токсин Т-2, верракурин А, роридин А и ангуидин); уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид (“Ara-C”); циклофосфамид; тиотепа; таксоиды, например паклитаксел TAXOL® (Bristol-Myers Squibb Oncology, Princenton, N.J.), ABRAXANETM, не содержащий кремофора препарат паклитаксела из наночастиц, полученный на основе альбумина (American Pharmaceutical Partners, Schaumberg, Illinois) и доцетаксел TAXOTERE® (Rhone-Poulenc Rorer, Antony, France); хлоранбуцил; гемцитабин GEMZAR®; 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин, платина; этопозид (VP-16); ифосфамид; митоксантрон; винкристин; винорелбин NAVELBINE®; новантрон; тенипозид; эдатрексат; дауномицин; аминоптерин; кселода; ибандронат; иринотекан (камптозар, СРТ-11) (включая схему лечения иринотеканом в комбинации с 5-FU и лейковорином); ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота; капецитабин; комбретастатин; лейковорин (LV); оксалиплатин, включая схему лечения оксалиплатином (FOLFOX); ингибиторы PKC-альфа, Raf, H-Ras, EGFR (например, эрлотиниб (Tarceva™)) и VEGF-A, которые снижают уровень пролиферации клеток, и фармацевтически приемлемые соли, кислоты или производные всех вышеуказанных соединений.
В определение этого термина также входят: антигормональные средства, регулирующие или ингибирующие действие гормонов на опухоли, такие как антиэстрогены и селективные модуляторы рецептора эстрогена (SERM), включая, например, тамоксифен (включая тамоксифен NOLVADEX®), ралоксифен, дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен FARESTON®; ингибиторы ароматазы, которые ингибируют фермент ароматазу и регулируют продуцирование эстрогенов в коре надпочечника, такие как, например, 4(5)-имидазолы, аминоглутетимид, ацетат мегестрола MEGASE®, эксеместан AROMASIN®, форместанин, фадрозол, ворозол RIVISOR®, летрозол FEMARA® и анастрозол ARIMIDEX®; антиандрогены, такие как флутамид, нилутамид, бикалутамид, лейпролид и гозерелин; а также троксацитабин (нуклеозидный цитозиновый аналог 1,3-диоксолана); антисмысловые олигонуклеотиды, а в частности, олигонуклеотиды, ингибирующие экспрессию генов путей передачи сигнала, участвующих в пролиферации нежелательных клеток, такие как, например, PKC-альфа, Ralf и H-Ras; рибозимы, такие как ингибитор экспрессии VEGF (например, рибозим ANGIOZYME®) и ингибитор экспрессии HER2; вакцины, такие как вакцины для генотерапии, например вакцина ALLOVECTIN®, вакцина LEUVECTIN® и вакцина VAXID®; rIL-2 PROLEUKIN®; ингибитор топоизомеразы 1 LURTOTECAN®; rmRH ABARELIX®; и фармацевтически приемлемые соли, кислоты или производные всех вышеперечисленных соединений.
Термин “цитокин” является общим термином, относящимся к белкам, которые высвобождаются одной клеточной популяцией и действуют на другие клетки как межклеточные медиаторы. Примерами таких цитокинов являются лимфокины, монокины и стандартные полипептидные гормоны. Помимо вышеуказанных определений, понятие “цитокины” также включает гормоны роста, такие как человеческий гормон роста, N-метионильный человеческий гормон роста и бычий гормон роста; паратиреоидный гормон; тироксин; инсулин; проинсулин; релаксин; прорелаксин; гликопротеиновые гормоны, такие как фолликулостимулирующий гормон (FSH), тиреоид-стимулирующий гормон (TSH) и лютеинизирующий гормон (LH); эпидермальный фактор роста; фактор роста гепатоцитов, фактор роста фибробластов; пролактин; плацентарный лактоген; фактор некроза опухоли-α и -β; мюллеровский ингибирующий фактор; пептид, ассоциированный с мышиным гонадотропином; ингибин; активин; васкулярный эндотелиальный фактор роста; интегрин; тромбопоэтин (ТРО); факторы роста нервных тканей, такие как NGF-альфа; тромбоцитарный фактор роста; трансформирующие факторы роста (TGF), такие как TGF-альфа и TGF-бета; инсулиноподобный фактор роста-I и -II; эритропоэтин (EPO); факторы, индуцирующие остеогенез; интерфероны, такие как интерферон-α, -β и -γ; колониестимулирующие факторы (CSF), такие как макрофагальный CSF (M-CSF); гранулоцитарный-макрофагальный CSF (GM-CSF); и гранулоцитарный CSF (G-CSF); интерлейкины (IL), такие как IL-1, IL-1α, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12; фактор некроза опухоли, такой как TNF-альфа или TNF-бета; и другие полипептидные факторы, включая LIF и лиганд kit (KL). Используемый здесь термин “цитокин” включает белки, происходящие от природных источников или от рекомбинантной клеточной культуры, и биологически активные эквиваленты цитокинов с нативной последовательностью.
Используемый здесь термин “рост-ингибирующее средство” означает соединение или композицию, ингибирующие рост клеток in vitro и/или in vivo. Таким образом, средством, ингибирующим рост клеток, может быть средство, значительно снижающее процент клеток в фазе S. Примерами средств, ингибирующих рост клеток, являются средства, блокирующие прохождение клеточного цикла (в другой фазе, кроме фазы S), такие как средства, индуцирующие блокирование фазы G1 и фазы М. Классическими средствами, блокирующими фазу М, являются винкаалкалоиды (винкристин и винбластин), таксол® и ингибиторы топоизомеразы II, такие как доксорубицин, эпирубицин, даунорубицин, этопозид и блеомицин. Средствами, блокирующими фазу G1, а также блокирующими переход в фазу S, являются, например, ДНК-алкилирующие агенты, такие как тамоксифен, преднизон, дакарбазин, мехлоретамин, цисплатин, метотрексат, 5-фторурацил и ara-C. Дополнительную информацию можно найти в публикации “The Molecular Basis of Cancer”, Mendelsohn & Israel, eds., в главе 1, озаглавленной “Cell cycle regulation, oncogenes and antineoplastic drugs”, Murakami et al. (WB Saunders: Philadelphia, 1995), а в частности, на стр.13.
Используемый в данной заявке термин “пролекарство” означает предшественник или производное фармацевтически активного вещества, которые, по сравнению с родительским лекарственным средством, являются менее цитотоксичными по отношению к раковым клеткам и способны ферментативно активироваться или превращаться в более активную зрелую форму. См., например, Wilman, “Prodrugs in Cancer Chemotherapy” Biochemical Society Transactions, 14, pp.375-382, 615th Meeting Belfast (1986) и Stella et al. “Prodrugs: A Chemical Approach to Targeted Drug Delivery”, Directed Drug Delivery, Borchardt et al., (ed.), pp.247-267, Humana Press (1985). Пролекарствами согласно изобретению являются, но не ограничиваются ими, фосфат-содержащие пролекарства, тиофосфат-содержащие пролекарства, сульфат-содержащие пролекарства, пептид-содержащие пролекарства, пролекарства, модифицированные D-аминокислотой, гликозилированные пролекарства, β-лактам-содержащие пролекарства; пролекарства, содержащие необязательно замещенный феноксиацетамид, или пролекарства, содержащие необязательно замещенный фенилацетамид; 5-фторцитозиновые и другие 5-фторуридиновые пролекарства, которые могут быть превращены в более активное цитотоксическое свободное лекарственное средство. Примерами цитотоксических лекарственных средств, которые могут быть дериватизированы с получением пролекарственной формы для ее использования в настоящем изобретении, являются, но не ограничиваются ими, химиотерапевтические агенты, описанные ниже.
Термин «лучевая терапия» означает применение направленного гамма-излучения или бета-излучения для индуцирования повреждения клеток, достаточного для ограничения их способности к нормальному функционированию, или для их полного разрушения. Совершенно очевидно, что для определения дозы и продолжительности лечения существует множество методов, известных специалистам. Типичными методами лечения является однократное облучение, а типичными дозами являются дозы, составляющие в пределах от 10 до 200 единиц (Грей) в день.
Термин «снижение или ингибирование» означает способность вызывать общее снижение, предпочтительно на 20% или более, более предпочтительно на 50% или более, а наиболее предпочтительно, на 75%, 80%, 85%, 90%, 95% или более. Термин «снижение или ингибирование» может относиться к симптомам расстройства, подвергаемого лечению, к присутствию метастазов или микрометастазов или к их размерам, к размеру первичной опухоли, к присутствию или размерам «дремлющей» опухоли, либо к размерам или числу кровеносных сосудов при ангиогенных расстройствах.
Термин «внутривенное вливание» означает введение лекарственного средства в вену животного или человека в течение периода времени более чем приблизительно 5 минут, а предпочтительно приблизительно 30-90 минут, хотя в соответствии с настоящим изобретением, внутривенное вливание альтернативно может быть осуществлено в течение 10 часов или менее.
Термины «внутривенная большая доза» или «внутривенная ударная доза» относятся к введению лекарственного средства в вену животного или человека, так, чтобы лекарственное средство поступало в организм в течение периода времени приблизительно 15 минут или менее, а предпочтительно в течение 5 минут или менее.
Термин «подкожное введение» означает введение лекарственного средства под кожу животного или человека, предпочтительно в «карман» между кожей и подлежащей тканью, путем относительно медленного пролонгированного высвобождения этого лекарственного средства из ампулы. Указанный карман может быть создан путем забирания кожи щипком или вытягивания и оттягивания кожи от подлежащей ткани.
Термин «подкожное вливание» означает введение лекарственного средства под кожу животного или человека, предпочтительно в «карман» между кожей и подлежащей тканью, путем относительно медленного пролонгированного высвобождения этого лекарственного средства из ампулы в течение определенных периодов времени, включая, но не ограничиваясь ими, 30 минут или менее или 90 минут или менее. Такое вливание может быть осуществлено, но необязательно, путем подкожной имплантации насоса для доставки лекарственного средства под кожу животного или человека, где указанный насос позволяет доставлять предварительно определенное количество лекарственного средства в течение предварительно определенного периода времени, например, 30 минут, 90 минут или в течение всего времени лечения.
Термин «подкожная ударная доза» означает введение лекарственного средства под кожу животного или человека, где доставку ударной дозы лекарственного средства осуществляют, предпочтительно, в течение менее чем приблизительно 15 минут, более предпочтительно менее чем 5 минут, а наиболее предпочтительно менее чем 60 секунд. Введение предпочтительно осуществляют в «карман» между кожей и подлежащей тканью, где указанный карман может быть создан путем забирания кожи щипком или вытягивания и оттягивания кожи от подлежащей ткани.
Термин «расстройство» означает любое состояние, которое является восприимчивым к лечению антителом. Этот термин охватывает хронические и острые расстройства или заболевания, включая патологические состояния, которые создают у данного млекопитающего предрасположенность к рассматриваемому расстройству. Неограничивающими примерами описанных здесь расстройств, подвергаемых лечению, являются рак; доброкачественные и злокачественные опухоли; лейкоз и лимфоидные злокачественные заболевания; расстройства, ассоциированные с нарушением функций нервных клеток, глиальных клеток, астроцитов, гипоталамуса и других гландулярных клеток, макрофагов, эпителиальных клеток, стромальных клеток и бластоцеля; и воспалительные, ангиогенные и иммунные расстройства.
Термин “терапевтически эффективное количество” означает количество лекарственного средства, эффективное для лечения заболевания или расстройства у млекопитающего. В случае рака, терапевтически эффективное количество указанного лекарственного средства может снижать число раковых клеток; уменьшать размер опухоли; ингибировать (т.е. снижать до определенной степени, а предпочтительно прекращать) инфильтрацию раковых клеток в периферические органы; ингибировать (т.е. снижать до определенной степени, а предпочтительно прекращать) развитие метастазов опухоли; ингибировать, до некоторой степени, рост опухоли, и/или ослаблять, до некоторой степени, один или несколько симптомов, ассоциированных с указанным заболеванием. Лекарственное средство, до той степени, в которой оно может предупреждать рост раковых клеток и/или уничтожать имеющиеся раковые клетки, может быть цитостатическим и/или цитотоксическим. Для противораковой терапии эффективность in vivo может быть, например, измерена путем оценки продолжительности жизни, продолжительности жизни без прогрессирования заболевания (PFS), показателя отклика (RR), продолжительности ответа и/или качества жизни.
Термин «лечение» означает терапевтическое лечение и профилактические или превентивные меры. Индивидуумами, нуждающимися в лечении, являются индивидуумы, у которых уже диагностировано такое расстройство, а также индивидуумы, которые нуждаются в предупреждении такого расстройства.
Используемый здесь термин «метка» означает детектируемое соединение или детектируемую композицию, которые прямо или опосредованно конъюгируются с полипептидом. Сама метка может быть детектируемой (например, радиоизотопная метка или флуоресцентная метка), или, в случае ферментативной метки, такая метка может катализировать изменение химического состава соединения субстрата или композиции, которые являются детектируемыми.
II. АНТИ-VEGF АНТИТЕЛА И АНТАГОНИСТЫ VEGF
(i) Антиген VEGF
Антигеном VEGF, используемым для продуцирования антител, может быть, например, молекула VEGF165, а также другие изоформы VEGF или их фрагменты, содержащие нужный эпитоп. Другие формы VEGF, используемые для получения анти-VEGF антител согласно изобретению, известны специалистам в данной области.
Человеческий VEGF был получен путем предварительного скрининга библиотеки кДНК, выделенной из человеческих клеток, с использованием кДНК коровьего VEGF в качестве гибридизационного зонда. Leung et al. (1989) Science, 246:1306. Одна идентифицированная таким образом кДНК кодирует белок из 165 аминокислот, который более чем на 95% гомологичен коровьему VEGF; причем такой белок из 165 аминокислот обычно называют человеческим VEGF (hVEGF) или VEGF165. Митогенная активность человеческого VEGF была подтверждена путем экспрессии кДНК человеческого VEGF в клетках-хозяевах млекопитающих. Среды, кондиционированные клетками, трансфицированными кДНК человеческого VEGF, стимулировали пролиферацию капиллярных эндотелиальных клеток, тогда как контрольные клетки не выполняли такую функцию. Leung et al. (1989) Science, см. выше. Были предприняты дополнительные попытки клонировать и экспрессировать VEGF методами рекомбинантных ДНК (См., например, публикацию Ferrara, Laboratory Investigation 72:615-618 (1995), и цитируемые там работы).
VEGF экспрессируется в различных тканях в виде мультимерных гомодимерных форм (121, 145, 165, 189 и 206 аминокислот на мономер) в результате альтернативного сплайсинга РНК. VEGF121 представляет собой растворимый митоген, который не связывается с гепарином, при этом более длинные формы VEGF связываются с гепарином с прогрессивно увеличивающейся аффинностью. Гепарин-связывающие формы VEGF могут расщепляться у карбокси-конца плазмином с высвобождением диффузной(ых) формы(форм) VEGF. Секвенирование аминокислот карбоки-концевого пептида показало, что этот пептид образуется после расщепления плазмином в сайте Arg110-Ala111. Амино-концевой «коровий» белок VEGF (1-110), выделенный как гомодимер, связывается с нейтрализующими моноклональными антителами (такие как антитела, обозначенные 4.6.1 и 3.2E3.1.1) и с растворимыми формами рецепторов VEGF с аффинностью, аналогичной аффинности связывания с интактным гомодимером VEGF165.
Недавно было также идентифицировано несколько молекул, которые являются структурно родственными VEGF, включая плацентарный фактор роста (PIGF), VEGF-B, VEGF-C, VEGF-D и VEGF-E. Ferrara and Davis-Smyth (1987) Endocr. Rev., см. выше; Ogawa et al. J. Biological Chem. 273:31273-31281(1998); Meyer et al. EMBO. J., 18:363-374(1999). Тирозинкиназный рецептор, Flt-4 (VEGFR-3), был идентифицирован как рецептор для VEGF-C и VEGF-D. Joukov et al. EMBO. J. 15:1751(1996); Lee et al. Proc. Natl. Acad. Sci. USA 93:1988-1992(1996); Achen et al. (1998) Proc. Natl. Acad. Sci. USA 95:548-553. Было показано, что VEGF-C участвует в регуляции лимфатического ангиогенеза. Jeltsch et al. Science 276: 1423-1425(1997).
Были идентифицированы два рецептора VEGF, Flt-1 (также обозначаемый VEGFR-1) и KDR (также обозначаемый VEGFR-2). Shibuya et al. (1990) Oncogene 8:519-527; de Vries et al. (1992) Science 255:989-991; Terman et al. (1992) Biochem. Biophys. Res. Commun. 187:1579-1586. Было показано, что нейропилин-1 является селективным рецептором VEGF, обладающим способностью связываться с гепарин-связывающими изоформами VEGF (Soker et al. (1998) Cell 92:735-45).
(ii) Анти-VEGF антитела
Анти-VEGF антителами, которые могут быть использованы в способах согласно изобретению, являются любые антитела или их антигенсвязывающие фрагменты, которые связываются с VEGF с достаточной степенью аффинности и специфичности и могут снижать или ингибировать биологическую активность VEGF. Анти-VEGF антитело обычно не связывается с другими гомологами VEGF, такими как VEGF-B или VEGF-C, и с другими факторами роста, такими как PlGF, PDGF или bFGF.
В некоторых вариантах изобретения, анти-VEGF антителами являются, но не ограничиваются ими, моноклональное антитело, которое связывается с таким же эпитопом, с которым связывается моноклональное анти-VEGF антитело A4.6.1, продуцируемое гибридомой ATCC HB 10709; и рекомбинантное гуманизованное моноклональное анти-VEGF антитело, полученное, как описано в публикации Presta et al., (1997) Cancer Res. 57:4593-4599. В одном из вариантов изобретения анти-VEGF антителом является «бевацизумаб (BV)», также известный как «rhuMAb VEGF» или «AVASTIN®». Такое антитело содержит мутированные человеческие каркасные области IgG1 и антигенсвязывающие гипервариабельные области (комплементарность-определяющие области), происходящие от мышиного моноклонального анти-hVEGF антитела A.4.6.1, которое блокирует связывание человеческого VEGF с его рецепторами. Приблизительно 93% аминокислотой последовательности бевацизумаба, включая большинство каркасных областей, происходит от человеческого IgG1, и только приблизительно 7% этой последовательности происходит от мышиного антитела A4.6.1.
Бевацизумаб (AVASTIN®) был первым терапевтическим средством против ангиогенеза, разрешенным FDA к применению для лечения метастазирующего рака прямой и ободочной кишки (как терапевтическое средство первого и второго ряда в комбинации с внутривенной химиотерапией на основе 5-FU), запущенного неплоскоклеточного немелкоклеточного рака легких (NSCLC) (как терапевтическое средство первого ряда для лечения неоперабельного, локально прогрессирующего, рецидивирующего или метастазирующего NSCLC в комбинации с карбоплатином и паклитакселом) и метастазирующего HER2-негативного рака молочной железы (не подвергаемого ранее лечению метастазирующего HER2-негативного рака молочной железы, в комбинации с паклитакселом).
Бевацизумаб и другие гуманизованные анти-VEGF антитела также описаны в патенте США № 6884879, выданном 26 февраля, 2005. Дополнительными антителами являются антитела серии G6 или B20 (например, G6-31, B20-4.1), как описано в публикации PCT № WO 2005/012359, в публикации PCT № WO 2005/044853 и в заявке на патент США 60/991302, содержание которых во всей своей полноте вводится в описание настоящего изобретения посредством ссылки. Описание дополнительных антител можно найти в патентах США №№ 7060269, 6582959, 6703020; 6054297; в WO 98/45332; WO 96/30046; WO94/10202; EP 0666868B1; в публикациях заявок на патент США 2006009360, 20050186208, 20030206899, 20030190317, 20030203409 и 20050112126; и в публикациях Popkov et al., Journal of Immunological Methods 288:149-164 (2004). Другими антителами являются антитела, которые связываются с функциональным эпитопом на человеческом VEGF, содержащем остатки F17, M18, D19, Y21, Y25, Q89, I91, K101, E103 и C104 или, альтернативно, содержащем остатки F17, Y21, Q22, Y25, D63, I83 и Q89.
В одном из вариантов изобретения анти-VEGF антитело имеет вариабельную область тяжелой цепи, содержащую нижеследующую аминокислотную последовательность:
EVQLVESGGG LVQPGGSLRL SCAASGYTFT NYGMNWVRQA PGKGLEWVGW
INTYTGEPTY AADFKRRFTF SLDTSKSTAY LQMNSLRAED TAVYYCAKYP
HYYGSSHWYF DVWGQGTLVT VSS (SEQ ID NO: 1)
и вариабельную область легкой цепи, содержащую нижеследующию аминокислотную последовательность:
DIQMTQSPSS LSASVGDRVT ITCSASQDIS NYLNWYQQKP GKAPKVLIYF
TSSLHSGVPS RFSGSGSGTD FTLTISSLQP EDFATYYCQQ YSTVPWTFGQ
GTKVEIKR (SEQ ID NO: 2).
«Антитело серии G6» согласно изобретению представляет собой анти-VEGF антитело, которое было получено из последовательности антитела G6 или из последовательности антитела, происходящего от G6, представленных на одной из фигур 7, 24-26, и 34-35 публикации заявки PCT № WO 2005/012359, полное описание которой во всей своей полноте вводится в настоящее описание посредством ссылки. См. также публикацию заявки PCT № WO 2005/044853, описание которой во всей своей полноте вводится в настоящее описание посредством ссылки. В одном из вариантов изобретения антитело серии G6 связывается с функциональным эпитопом на человеческом VEGF, содержащем остатки F17, Y21, Q22, Y25, D63, I83 и Q89.
«Антитело серии B20» согласно изобретению представляет собой анти-VEGF антитело, которое было получено из последовательности антитела В20 или из последовательности антитела, происходящего от В20, представленных на одной из фигур 27-29 публикации заявки PCT № WO 2005/012359, полное описание которой во всей своей полноте вводится в настоящее описание посредством ссылки. См. также публикацию заявки PCT № WO 2005/044853 и заявку на патент США 60/991302, описание которой во всей своей полноте вводится в настоящее описание посредством ссылки. В одном из вариантов изобретения антитело серии B20 связывается с функциональным эпитопом на человеческом VEGF, содержащем остатки F17, M18, D19, Y21, Y25, Q89, I91, K101, E103 и C104.
«Функциональный эпитоп» согласно изобретению представляет собой аминокислотые остатки антигена, которые вносят свой энергетический вклад в связывание с антителом. Мутация в любом одном из энергетически активных остатков данного антигена (например, аланиновая мутация или гомологичная мутация VEGF дикого типа) будет предотвращать связывание антитела так, что, в результате этого, отношение аффинностей (IC50 мутантного VEGF/IC50 VEGF дикого типа) данного антитела будет составлять более чем 5 (см. пример 2 WO 2005/012359). В одном из вариантов изобретения указанное отношение аффинностей определяют с помощью ELISA-анализа на связывание в растворе, проводимого методом фагового представления. Вкратце, 96-луночные планшеты Maxisorp (NUNC) сенсибилизируют в течение ночи при 4°C Fab-фрагментом тестируемого антитела в концентрации 2 мкг/мл в PBS и блокируют PBS, 0,5% BSA и 0,05% твином 20 (PBT) в течение 2 часов при комнатной температуре. Серийные разведения аланиновых точковых мутантов hVEGF, представленных на фаге (вариант с остатками 8-109), или hVEGF дикого типа (8-109), в PBT сначала инкубируют на Fab-сенсибилизированных планшетах в течение 15 минут при комнатной температуре, а затем планшеты промывают PBS, 0,05% твином 20 (PBST). Связанный фаг детектируют с использованием моноклонального анти-М13 антитела, конъюгированного с пероксидазой хрена (Amersham Pharmacia) и разведенного 1:5000 в PBT, а затем проявляют с использованием субстрата 3,3',5,5'-тетраметилбензидина (TMB, Kirkegaard & Perry Labs, Gaithersburg, MD) приблизительно в течение 5 минут, после чего реакцию гасят 1,0M H3PO4, и спектры регистрируют на спектрофотометре на 450 нм. Отношение величин IC50 (IC50, ala/IC50, дикого типа) представляет собой кратность снижения аффинности связывания (относительная аффинность связывания).
(iii) Молекулы рецептора VEGF
Двумя наиболее хорошо охарактеризованными рецепторами VEGF являются VEGFR1 (также известный как Flt-1) и VEGFR2 (также известный как KDR и FLK-1 для мышиного гомолога). Специфичность каждого рецептора для каждого члена семейства VEGF варьируется, но VEGF-A связывается как с Flt-1, так и с KDR. Flt-1 и KDR принадлежат к семейству тирозинкиназных рецепторов (RTK). RTK принадлежат к большому семейству трансмембранных рецепторов с различными биологическими активностями. Было идентифицировано по меньшей мере девятнадцать (19) различных подсемейств RTK. Семейство тирозинкиназных рецепторов (RTK) включает рецепторы, которые играют важную роль в росте и дифференцировке клеток различных типов (Yarden and Ullrich (1988) Ann. Rev. Biochem. 57:433-478; Ullrich and Schlessinger (1990) Cell 61:243-254). Природная функция RTK активируется после связывания с лигандом, что приводит к фосфорилированию рецептора и многих клеточных субстратов, и тем самым к продуцированию ряда клеточных ответов (Ullrich & Schlessinger (1990) Cell 61:203-212). Таким образом, передача сигнала, опосредуемая тирозинкиназным рецептором, инициируется в результате внеклеточного взаимодействия со специфическим фактором роста (лигандом), обычно с последующей димеризацией рецептора, стимуляцией природной протеинтирозинкиназной активности и трансфосфорилированием рецептора. В результате этого образуются сайты связывания для внутриклеточных молекул передачи сигнала, что приводит к образованию комплексов со спектром цитоплазматических молекул передачи сигнала, которые облегчают вырабатывание соответствующего клеточного ответа (например, деления клеток, дифференцировки клеток, метаболических эффектов, изменений во внеклеточном микроокружении), см. Schlessinger and Ullrich (1992) Neuron 9:1-20. Flt-1 и KDR, по своей структуре, имеют семь иммуноглобулин-подобных доменов во внеклеточном домене, одну трансмембранную область и консенсусную тирозинкиназную последовательность, которая прерывается доменом «киназа-вставка». Matthews et al. (1991) Proc. Natl. Acad. Sci. USA 88:9026-9030; Terman et al. (1991) Oncogene 6:1677-1683. Внеклеточный домен участвует в связывании с VEGF, а внутриклеточный домен участвует в передаче сигнала.
Молекулы рецепторов VEGF или их фрагменты, которые специфически связываются с VEGF, могут быть использованы в способах согласно изобретению для связывания и секвестрации белка VEGF и, тем самым, для предотвращения передачи его сигнала. В некоторых вариантах изобретения молекула рецептора VEGF или ее VEGF-связывающий фрагмент присутствуют в растворимой форме, такой как sFlt-1. Растворимая форма рецептора оказывает ингибирующее действие на биологическую активность белка VEGF благодаря связыванию с VEGF, что приводит к предотвращению его связывания с природными рецепторами, присутствующими на поверхности клеток-мишеней. В настоящем изобретении также рассматриваются гибридные белки рецептора VEGF, примеры которых описаны ниже.
Химерным белком рецептора VEGF является молекула рецептора, имеющая аминокислотные последовательности, происходящие по меньшей мере от двух различных белков, по меньшей мере одним из которых является белок рецептора VEGF (например, рецептора flt-1 или KDR), обладающий способностью связываться с VEGF и ингибировать биологическую активность VEGF. В некоторых вариантах изобретения химерные белки рецептора VEGF согласно изобретению состоят из аминокислотных последовательностей, происходящих только от двух различных молекул рецептора VEGF, однако аминокислотные последовательности, содержащие один, два, три, четыре, пять, шесть или все семь Ig-подобных доменов, происходящих от внеклеточной лиганд-связывающей области рецептора flt-1 и/или KDR, могут связываться с аминокислотными последовательностями, происходящими от других неродственных белков, например последовательностей иммуноглобулина. Другие аминокислотные последовательности, с которыми могут быть объединены Ig-подобные домены, хорошо известны среднему специалисту в данной области. Примерами химерных белков рецептора VEGF являются, например, растворимый Flt-1/Fc, KDR/Fc или Flt-1/KDR/Fc (также известный как VEGF Trap). (См., например, публикацию заявки PCT № WO 97/44453).
Растворимый белок рецептора VEGF или химерные белки рецептора VEGF согласно изобретению включают белки рецептора VEGF, которые не связаны с клеточной поверхностью посредством трансмембранного домена. Такие растворимые формы рецептора VEGF, включая химерные белки рецепторов, обладают способностью связываться с VEGF и инактивировать VEGF, а также не содержат трансмембранного домена, а поэтому они, по существу, не ассоциируются с клеточными мембранами клеток, в которых происходит экспрессия данной молекулы.
III. Терапевтическое применение и композиции анти-VEGF антител
Настоящее изобретение охватывает антиангиогенную терапию, новую стратегию лечения рака, целью которой является ингибирование развития опухолевых кровеносных сосудов, необходимых для подачи питательных веществ, требуемых для поддержания роста опухоли. Поскольку ангиогенез участвует в росте первичной опухоли и в развитии метастазов, то ангиогенная терапия согласно изобретению позволяет ингибировать рост опухоли на участке ее первичного развития, а также предотвращать возникновение метастазов опухоли во вторичных участках, а следовательно, подавлять рост опухоли с помощью других терапевтических средств.
Более конкретно, настоящее изобретение относится к способу лечения индивидуума, у которого был диагностирован метастизирующий рак молочной железы, ранее не подвергавшийся лечению, где указанный способ включает проведение курса комбинированного лечения данного индивидуума путем введения эффективного количества по меньшей мере одного химиотерапевтического средства и анти-VEGF антитела, где указанный пациент ранее не подвергался каком-либо лечению по поводу местного рецидива или метастазов рака молочной железы. Указанный индивидуум, но необязательно, не проходил предварительной вспомогательной химиотерапии при рецидиве в течение 12 месяцев или менее после введения последней дозы. Комбинированная схема лечения, включающая химиотерапию и введение анти-VEGF антитела, увеличивала продолжительность жизни индивидуума без прогрессирования заболевания (PFS). Настоящее изобретение также относится к применению анти-VEGF антитела вместе по меньшей мере с одним химиотерапевтическим агентом в целях приготовления лекарственного средства для лечения пациента с метастазирующим раком молочной железы, не проходившего какого-либо лечения, где указанному индивидууму не вводили какое-либо химиотерапевтическое средство для лечения локально рецидивирующего рака молочной железы или метастазирующего рака молочной железы. Указанный индивидуум, но необязательно, не проходил предварительной вспомогательной химиотерапии при рецидиве в течение 12 месяцев или менее после введения последней дозы. Применение анти-VEGF антитела и химиотерапевтического агента приводило к увеличению продолжительности жизни индивидуума без прогрессирования заболевания (PFS). Настоящее изобретение также относится к анти-VEGF антителам, применяемым в способе лечения локально рецидивирующего рака молочной железы или метастазирующего рака молочной железы у индивидуума, где указанный способ включают назначение данному индивидууму схемы лечения, включающей введение эффективного количества химиотерапевтического средства и анти-VEGF антитела, где указанному индивидууму не вводили какого-либо химиотерапевтического средства для лечения локально рецидивирующего рака молочной железы или метастазирующего рака молочной железы. Указанный индивидуум, но необязательно, не проходил предварительной вспомогательной химиотерапии при рецидиве в течение 12 месяцев или менее после введения последней дозы. Применение анти-VEGF антитела и химиотерапевтического агента приводило к увеличению продолжительности жизни индивидуума без прогрессирования заболевания (PFS). В некоторых вариантах любого из способов, применений и композициях согласно изобретению, введение химиотерапевтических средств и анти-VEGF антитела имело профиль безопасности, соответствующий профилю безопасности, наблюдаемому при проведении предварительных испытаний с использованием бевацизумаба (см., например, вкладыш к препарату бевацизумаба).
В некоторых вариантах изобретения такой индивидуум является, но необязательно, HER2-негативным. В некоторых вариантах изобретения такой индивидуум является HER2-позитивным. Известно, что HER2 представляет собой важный предсказательный и прогностический фактор при некоторых видах рака молочной железы. См., например, Slamon D.J., et al. Science. 1989; 244:707-712; и Sjogren S, et al. J Clin Oncol. 1998; 16:462-469. Амплификация гена HER2 представляет собой перманентную генетическую модификацию, которая приводит к непрерывной сверхэкспрессии рецептора HER2 (белка HER2). См., например, Simon R., et al. J. Natl. Cancer Inst. 2001; 93:l 141-11465; и Sliwkowski MX, et al. Semin Oncol. 1999; 26(suppl 12):60-70. Некоторые исследования показали, что сверхэкспрессия HER2 (либо дополнительного числа копий самого гена, либо избыточное количество белкового генного продукта) ассоциируется с более низкой общей продолжительностью жизни. См., например, Slamon D.J., et al. Science. 1987; 235:177-182; и, Paik S, et al. J. Clin. Oncol. 1990; 8:103-112. Для определения HER2-статуса существует несколько крупномасштабных анализов, например HercepTest® and Pathway™ для белка и PathVysion® и HER2 FISH pharmDx™ для альтераций гена.
Комбинированная терапия
Настоящее изобретение также относится к применению композиций и комбинации по меньшей мере одного VEGF-специфического антагониста с одним или несколькими дополнительными противораковыми терапевтическими средствами. Примерами противораковой терапии, но не ограничиваясь ими, являются хирургическая операция, лучевая терапия (радиотерапия) биотерапия, иммунотерапия, химиотерапия или их комбинация. В комбинации с VEGF-специфическим антагонистом могут быть также использованы антиангиогенные и антипролиферативные агенты.
В некоторых аспектах любого из методов и применений согласно изобретению, настоящее изобретение относится к лечению рака молочной железы путем введения эффективного количества анти-VEGF антитела и одного или нескольких химиотерапевтических средств индивидууму, который является восприимчивым к данному средству, или индивидууму, который имеет диагностированный, но ранее не подвергавшийся лечению локально рецидивирующий или метастазирующий рак. В комбинированных способах лечения и в их применениях согласно изобретению может быть использован ряд химиотерапевтических средств. Репрезентативный и неограничивающий список химиотерапевтических средств, которые могут быть использованы в настоящем изобретении, приводится в настоящем описании в разделе «Определения».
В одном из примеров своего осуществления настоящее изобретение относится к способу получения и применения VEGF-специфического антагониста вместе с одним или несколькими химиотерапевтическими средствами (например, в виде смеси) или с любой их комбинацией. В некоторых вариантах изобретения таким химиотерапевтическим средством является, например, капецитабин, таксан, антрациклин, паклитаксел, доцетаксел, частицы, связанные с белком паклитакселом (например, Abraxane®), доксорубицин, эпирубицин, 5-фторурацил, циклофосфамид или их комбинации. В некоторых вариантах изобретения антагонист VEGF (например, анти-VEGF антитело) объединяют с лапатинибом (Tykerb®). Указанное комбинированное введение включает одновременное введение с использованием отдельных фармацевтических препаратов или отдельного фармацевтического препарата, и последовательное введение в любом порядке, а предпочтительно, чтобы два (или все) одновременно вводимые активные агенты сохраняли свою биологическую активность. Препараты и схемы введения доз таких химиотерапевтических средств могут быть применены в соответствии с инструкциями производителей или выбраны самим специалистом в соответствии с его опытом. Препараты и схемы введения доз для химиотерапии также описаны в руководстве Chemotherapy Service Ed., M. C. Perry, Williams & Wilkins, Baltimore, Md. (1992). Химиотерапевтическое средство может быть введено до или после введения VEGF-специфического антагониста, либо они могут быть введены одновременно.
В некоторых других аспектах любого из способов и применений, другими терапевтическими средствами, которые могут быть использованы в комбинированной противоопухолевой терапии вместе с антителом согласно изобретению, являются антагонисты других факторов, участвующих в опухолевом росте, например, такие как EGFR, ErbB2 (также обозначаемый Her2), ErbB3, ErbB4 или TNF. Иногда может также оказаться предпочтительным введение индивидууму одного или нескольких цитокинов. В одном из вариантов изобретения анти-VEGF антитело вводят вместе с рост-ингибирующим агентом. Так, например, такой рост-ингибирующий агент может быть введен до или после введения анти-VEGF антитела. Однако рассматривается также вариант, в котором предусматривается его одновременное введение с анти-VEGF антителом, либо вариант, в котором сначала вводят анти-VEGF антитело. Подходящими дозами рост-ингибирующего агента являются дозы, которые обычно используются в настоящее время, и эти дозы могут быть уменьшены, что обусловлено комбинированным (синергическим) действием рост-ингибирующего агента и анти-VEGF антитела.
Препарат согласно изобретению может также содержать более чем одно активное соединение, необходимое для конкретного показания, а предпочтительно, такие соединения, которые по своей активности дополняют друг друга и не обладают негативным воздействием друг на друга. Так, например, может оказаться желательным использовать в одном препарате дополнительные антитела, которые связываются с EGFR, VEGF (например, антитела, которые связываются с различными эпитопами или с одним и тем же эпитопом на VEGF), VEGFR или ErbB2 (например, Herceptin®). Альтернативно или дополнительно, указанная композиция может содержать цитотоксический агент, цитокин, рост-ингибирующий агент и/или антагонист VEGFR. При этом предпочтительно, чтобы такие молекулы присутствовали в комбинации в количествах, которые являются эффективными для их применения в этих целях.
В некоторых аспектах любого из методов и применений согласно изобретению, другими терапевтическими средствами, используемыми в комбинированной противораковой терапии вместе с антителом согласно изобретению, являются другие антиангиогенные агенты. Были идентифицированы многие антиангиогенные агенты, и эти агенты известны специалистам, включая агенты, перечисленные в публикации Carmeliet & Jain (2000). В одном из вариантов изобретения анти-VEGF антитело согласно изобретению используется в комбинации с другим антагонистом VEGF или антагонистом рецептора VEGF, таким как варианты VEGF, растворимые фрагменты рецепторов VEGF, аптамеры, способные блокировать VEGF или VEGFR, нейтрализующие анти-VEGFR антитела низкомолекулярные ингибиторы тирозинкиназных VEGFR и любые их комбинации. Альтернативно или дополнительно, индивидууму могут быть введены два или более анти-VEGF антитела.
Доза VEGF-специфического антагониста, подходящая для предупреждения или лечения заболевания, зависит от типа заболевания, подвергаемого лечению и определенного выше, тяжести и течения данного заболевания, от цели введения VEGF-специфического антагониста, то есть, вводится ли он в профилактических или терапевтических целях, от проведенной ранее терапии, от истории болезни данного пациента и его восприимчивости к VEGF-специфическому антагонисту, и от назначения лечащего врача. VEGF-специфический антагонист, предпочтительно, вводят индивидууму сразу или на протяжении всего курса лечения. В комбинированной схеме терапии анти-VEGF антагонист и одно или несколько противораковых терапевтических средств согласно изобретению вводят в терапевтически эффективном или синергическом количестве. Используемый здесь термин «терапевтически эффективное количество» представляет собой количество, которое, при его введении вместе с VEGF-специфическим антагонистом и одним или несколькими другими терапевтическими средствами, или при его введении в композиции согласно изобретению, приводит к ослаблению или подавлению симптомов рака, как описано выше. Терапевтически синергическое количество означает такое количество VEGF-специфического антагониста и одного или нескольких других терапевтических агентов, которое необходимо для синергического или значительного ослабления тяжести или устранения симптомов, ассоциированных с конкретным заболеванием.
VEGF-специфический антагонист и одно или несколько терапевтических агентов могут быть введены одновременно или последовательно в определенном количестве и в определенный промежуток времени, достаточные для снижения вероятности или предотвращения возникновения или рецидива опухоли, «дремлющей» опухоли или микрометастазов. VEGF-специфический антагонист и одно или несколько терапевтических агентов могут быть введены в качестве поддерживающей терапии для предупреждения или снижения вероятности рецидива опухоли.
Как очевидно для среднего специалиста в данной области, соответствующие дозы химиотерапевтических средств или других противораковых агентов будут составлять в пределах значений, обычно используемых в клинической терапии, например, в случаях, когда эти химиотерапевтические средства вводят отдельно или в комбинации с другими химиотерапевтическими средствами. Дозы могут варьироваться в зависимости от состояния, подвергаемого лечению. Лечащий врач, проводящий лечение, может самостоятельно определить соответствующую дозу для конкретного индивидуума.
Помимо вышеуказанных схем терапевтического лечения пациент может быть подвергнут лучевой терапии.
В некоторых вариантах любого из способов, применений и композиций, вводимым антителом является интактное «оголенное» антитело. Однако анти-VEGF антитело может быть конъюгировано с цитотоксическим средством. В некоторых вариантах любого из способов и применений, конъюгированное антитело и/или антиген, с которым оно связывается, интернализуется в клетках, что приводит к повышению терапевтической эффективности конъюгата в отношении уничтожения раковых клеток, с которым они связываются. В одном из вариантов изобретения цитотоксическое средство нацелено на нуклеиновую кислоту в раковой клетке или ингибирует ее функцию. Примерами таких цитотоксических средств являются майтанзиноиды, калихеамицины, рибонуклеазы и ДНК-эндонуклеазы.
Настоящее изобретение также относится к способу информирования индивидуума, страдающего раком молочной железы, или специалиста, оказывающего медицинскую помощь, путем его инструктирования относительно лечения с использованием анти-VEGF антитела для увеличения продолжительности жизни индивидуума без прогрессирования заболевания, для снижения риска рецидива рака у данного индивидуума или для увеличения вероятности выздоровления данного индивидуума. В некоторых вариантах изобретения указанный способ также включает информирование пациента относительно приема по меньшей мере одного химиотерапевтического средства. Лечение анти-VEGF антителом может быть проведено одновременно с лечением химиотерапевтическим средством, либо оно может быть проведено после такого лечения. В некоторых вариантах изобретения данный индивидуум проходит лечение в соответствии с инструкциями, полученными указанным способом. Лечение рака молочной железы путем введения анти-VEGF антитела вместе с химиотерапией или без химиотерапии может быть продолжено до возникновения рецидивов рака или до летального исхода.
Настоящее изобретение также относится к способу содействия по введению анти-VEGF антитела, включающему содействие по введению указанного антитела для лечения, например, рака молочной железы у человека. В некоторых вариантах изобретения указанный способ также включает содействие по введению по меньшей мере одного химиотерапевтического средства. Введение анти-VEGF антитела может быть осуществлено одновременно с введением химиотерапевтического средства или после введения указанного средства. Такое содействие может быть осуществлено любыми доступными способами. В некоторых вариантах изобретения такое содействие осуществляется путем включения вкладыша в промышленную упаковку, содержащую анти-VEGF антитело. Такое содействие может быть также осуществлено путем включения вкладыша в промышленную упаковку, содержащую химиотерапевтическое средство. Такое содействие может быть осуществлено путем письменного или устного общения с врачом или со специалистом, оказывающим медицинские услуги. В некоторых вариантах изобретения такое содействие может быть осуществлено путем включения вкладыша в упаковку, где в указанном вкладыше имеются инструкции по лечению рака молочной железы анти-VEGF антителом. В другом варианте изобретения такой вкладыш в упаковку включает некоторые или все результаты, полученные, как описано в примере 1. В некоторых вариантах изобретения после такой информационной поддержки осуществляют лечение индивидуума анти-VEGF антителом в присутствии или в отсутствие химиотерапевтического средства.
Настоящее изобретение относится к способу проведения коммерческих операций, включающему реализацию анти-VEGF антитела в целях лечения, например, рака молочной железы у индивидуума для увеличения продолжительности жизни индивидуума без прогрессирования заболевания; снижения вероятности рецидива рака у данного индивидуума; или увеличения вероятности выживания данного индивидуума. В некоторых вариантах изобретения указанный способ также включает реализацию химиотерапевтического средства, применяемого в комбинации с анти-VEGF антителом. В некоторых вариантах изобретения после такой реализации осуществляют лечение индивидуума анти-VEGF антителом в присутствии или в отсутствии химиотерапевтического средства.
Настоящее изобретение также относится к способу проведения коммерческих операций, включающему реализацию химиотерапевтического средства, используемого в комбинации с анти-VEGF антителом для лечения, например, рака молочной железы у индивидуума в целях увеличения продолжительности жизни индивидуума без прогрессирования заболевания, снижения вероятности рецидива рака у данного индивидуума или увеличения вероятности выживания данного индивидуума. В некоторых вариантах изобретения после такой реализации осуществляют лечение индивидуума комбинацией химиотерапевтического средства с анти-VEGF антителом.
IV. Дозы и продолжительность введения
Композиция VEGF-специфического антагониста может быть приготовлена, разделена на дозы и введена в соответствии с общепринятой фармацевтической практикой. Рассматриваемые в этой связи процессы зависят от таких факторов, как конкретное расстройство, подвергаемое лечению; конкретный индивидуум, подвергаемый лечению: клиническое состояние указанного индивидуума; причина возникновения заболевания; область доставки данного средства; способ введения; схема введения и другие факторы, известные практикующему врачу. «Терапевтически эффективное количество» VEGF-специфического антагониста вводят с учетом вышеуказанных факторов, и такое количество представляет собой минимальное количество, необходимое для предупреждения, ослабления симптомов, лечения или стабилизации ракового заболевания; для увеличения времени до прогрессирования заболевания (продолжительности жизни без прогрессирования заболевания); для лечения первичных или рецидивирующих опухолей, «дремлющих» опухолей или микрометастазов, или для предупреждения возникновения указанных опухолей. VEGF-специфический антагонист может быть, но необязательно, приготовлен в комбинации с одним или несколькими средствами, используемыми в настоящее время для предупреждения или лечения рака, или для предупреждения риска развития рака. Эффективное количество таких других средств зависит от количества VEGF-специфического антагониста, присутствующего в данной композиции, типа расстройства или схемы лечения, и других факторов, обсуждаемых выше. Такие другие средства обычно используют в тех же самых дозах и вводят в соответствии со схемами введения, описанными ранее, или такие дозы составляют примерно от 1 до 99% от вышеупомянутых доз.
В зависимости от типа и тяжести заболевания, дозы в интервале примерно 1 мкг/кг - 100 мг/кг (например, 0,1-20 мг/кг) VEGF-специфического антагониста представляют собой исходные дозы-кандидаты для введения индивидууму, независимо от того, осуществляют ли одно или несколько отдельных введений или непрерывное вливание. Типичная ежедневная доза может составлять примерно от 1 мкг/кг до 100 мг/кг или более, в зависимости от вышеупомянутых факторов. Особенно предпочтительными дозами являются, например, дозы 5 мг/кг, 7,5 мг/кг, 10 мг/кг и 15 мг/кг. В случае повторного введения в течение нескольких дней или более, в зависимости от состояния, лечение продолжают до полного исчезновения раковой опухоли, как было определено методами, описанными в настоящей заявке или известными специалистам. Однако могут быть применены и другие схемы введения доз. В одном из примеров, если VEGF-специфическим антагонистом является антитело, то антитело согласно изобретению вводят один раз в неделю, раз в две недели или раз в три недели в дозе, составляющей примерно от 5 мг/кг до 15 мг/кг, включая, но не ограничиваясь ими, 5 мг/кг, 7,5 мг/кг, 10 мг/кг или 15 мг/кг. Мониторинг успеха лечения в соответствии с настоящим изобретением может быть легко проведен с применением стандартных методов и анализов. В других вариантах изобретения такую схему введения доз осуществляют в комбинации со схемой химиотерапии первого выбора, проводимой в целях лечения локально рецидивирующего или метастазирующего рака молочной железы. Дополнительная информация о подходящих дозах приводится ниже в примерах.
Терапия может проводиться в соответствии с медицинскими показаниями или до достижения желаемого терапевтического эффекта (например, эффекта, описанного в настоящей заявке). В некоторых вариантах изобретения терапию VEGF-специфическим антагонистом осуществляют в течение 1 месяца, 2 месяцев, 4 месяцев, 6 месяцев, 8 месяцев, 10 месяцев, 1 года, 2 лет, 3 лет, 4 лет, 5 лет, либо в течение нескольких лет, или на протяжении всей жизни.
VEGF-специфические антагонисты согласно изобретению вводят индивидууму, например человеку, в соответствии с известными методами, такими как внутривенное введение в виде ударной дозы или непрерывное вливание в течение определенного периода времени, а также внутримышечное введение, внутрибрюшинное введение, введение в цереброспинальную жидкость, подкожное введение, внутрисуставное введение, введение в синовиальную жидкость, интратекальное введение, пероральное введение, местное введение или введение путем ингаляции. Местное введение является особенно желательным в том случае, если при использовании антагониста VEGF возникают серьезные побочные эффекты или токсичность. Стратегия ex vivo может быть также применена в терапевтических целях. Стратегии ex vivo включают трансфекцию или трансдукцию клеток, взятых у индивидуума, полинуклеотидом, кодирующим антагонист VEGF. Затем трансфицированные или трансдуцированные клетки возвращают обратно индивидууму. Такими клетками могут быть клетки широкого ряда, включая, но не ограничиваясь ими, гемопоэтические клетки (например, клетки костного мозга, макрофаги, моноциты, дендритные клетки, Т-клетки или В-клетки), фибробласты, эпителиальные клетки, эндотелиальные клетки, кератиноциты или мышечные клетки.
Так, например, если VEGF-специфическим антагонистом является антитело, то такое антитело вводят любым подходящим способом, включая парентеральное, подкожное, внутрибрюшинное, внутрилегочное и интраназальное введение, а для местного иммуносупрессорного лечения желательно введение вовнутрь пораженного участка. Парентеральное вливание осуществляют путем внутримышечного, внутривенного, внутриартериального, внутрибрюшинного или подкожного введения. Кроме того, антитело может быть введено путем периодического вливания, а в частности, со снижением доз антитела. Дозы, предпочтительно, вводят путем инъекции, а наиболее предпочтительно путем внутривенных или подкожных инъекций, отчасти в зависимости от того, является ли такое введение одноразовым или постоянным.
В другом примере соединение VEGF-специфического антагониста вводят местно, например, путем прямых инъекций, если это позволяет тип или локализация опухоли, и такие инъекции могут быть введены периодически. VEGF-специфический антагонист может быть также введен индивидууму системно или непосредственно в опухолевые клетки, например в опухоль или в ложе опухоли после ее хирургического иссечения в целях предупреждения или снижения вероятности возникновения локальных рецидивов или метастазов, например, в случае «дремлющей» опухоли или микрометастазов.
Альтернативно, в соответствующие клетки индивидуума могут быть введены ингибирующая молекула нуклеиновой кислоты или полинуклеотид, содержащие последовательность нуклеиновой кислоты, кодирующую VEGF-специфический антагонист. В некоторых вариантах изобретения, нуклеиновая кислота может быть нацелена на саму опухоль.
Нуклеиновая кислота может быть введена в клетки любыми методами, подходящими для используемого вектора. Многие такие методы хорошо известны специалистам (Sambrook et al., см. выше, и Watson et al., Recombinant DNA, Chapter 12, 2d edition, Scientific American Books, 1992). Примерами методов доставки генов являются опосредуемая липосомами трансфекция, электропорация; методы, проводимые с использованием фосфата кальция/DEAE-декстрана; метод «выстреливания» генов и микроинжекция.
V. Фармацевтические препараты
Терапевтические составы средств (например, антитела), используемых в соответствии с настоящим изобретением, получают путем смешивания антитела, имеющего нужную степень чистоты, с необязательными фармацевтически приемлемыми носителями, наполнителями или стабилизаторами (Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980)) в форме лиофилизованных препаратов или водных растворов, пригодных для хранения. Приемлемые носители, наполнители или стабилизаторы являются нетоксичными для реципиентов в используемых здесь дозах и концентрациях, и ими являются буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония; хлорид бензетония; фенол; бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропил-парабен; катехол; резорцин; циклогексанол; 3-пентанол и м-крезол); низкомолекулярные полипептиды (состоящие из менее чем примерно 10 остатков); белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатообразующие агенты, такие как EDTA; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например, комплексы Zn-белок) и/или неионогенные поверхностно-активные вещества, такие как ТвинТМ, ПлюроникТМ или полиэтиленгликоль (ПЭГ). Лиофилизованные препараты анти-VEGF антител описаны в заявке WO 97/04801, которая точно вводится в настоящее описание посредством ссылки.
Указанные препараты, необязательно, но предпочтительно, содержат фармацевтически приемлемую соль, обычно, например, хлорид натрия, предпочтительно в концентрациях, близких к физиологическим. Композиции согласно изобретению могут содержать, но необязательно, фармацевтически приемлемый консервант. В некоторых вариантах изобретения концентрация консерванта составляет в пределах от 0,1 до 2,0%, обычно по объему. Подходящими консервантами являются консерванты, известные специалистам-фармацевтам. Примерами консервантов являются бензиловый спирт, фенол, м-крезол, метилпарабен и пропилпарабен. Композиции согласно изобретению могут включать, но необязательно, фармацевтически приемлемое поверхностно-активное вещество в концентрации 0,005-0,02%.
Обычно бевацизумаб поставляется для терапевтического применения в дозах по 100 мг и 400 мг без консервантов в одноразовых сосудах, предназначенных для доставки 4 мл или 16 мл бевацизумаба (25 мг/мл). 100 мг продукта приготавливают в 240 мг дегидрата α,α-трегалозы, 23,2 мг фосфата натрия (одноосновного, моногидрата), 4,8 мг фосфата натрия (двухосновного, безводного), 1,6 мг полисорбата 20 и в воде для инъекций, USP. 400 мг продукта приготавливают в 960 мг дегидрата α,α-трегалозы, 92,8 мг фосфата натрия (одноосновного, моногидрата), 19,2 мг фосфата натрия (двухосновного, безводного), 6,4 мг полисорбата 20 и в воде для инъекций, USP. См. также инструкцию к применению бевацизумаба.
Описанный здесь препарат может также содержать более чем одно активное соединение, необходимое для конкретного показания, а предпочтительно, такие соединения, которые по своей активности дополняют друг друга и не оказывают негативное воздействие друг на друга. Так, например, может оказаться желательным использовать в одном препарате дополнительные антитела, которые связываются с EGFR, VEGF (например, антитела, которые связываются с другим эпитопом на VEGF), VEGFR или ErbB2 (например, Herceptin®). Альтернативно или дополнительно, указанная композиция может содержать цитотоксический агент, цитокин, рост-ингибирующий агент и/или антагонист VEGFR. При этом предпочтительно, чтобы такие молекулы присутствовали в комбинации в количествах, которые являются эффективными для применения в этих целях.
Активные ингредиенты могут быть также включены в микрокапсулы, полученные, например, методами коацервации или межфазной полимеризации, например, в гидроксиметилцеллюлозные или желатиновые микрокапсулы и полиметилметакрилатные микрокапсулы, соответственно, в коллоидные системы, включающие лекарственные средства для доставки (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы), или в макроэмульсии. Такие методы описаны в руководстве Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980).
Могут быть получены препараты пролонгированного высвобождения. Подходящими примерами препаратов пролонгированного высвобождения являются полупроницаемые матрицы, состоящие из твердых гидрофобных полимеров, содержащих антитело, где указанные матрицы получают в виде сформованных изделий, например в виде пленок или микрокапсул. Примерами матриц пролонгированного высвобождения являются полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поливиниловый спирт)), полилактиды (патент США № 3773919), сополимеры L-глутаминовой кислоты и γ-этил-L-глутамата, неразлагаемый этиленвинилацетат, разлагаемые сополимеры молочной кислоты - гликолевой кислоты, такие как LUPRON DEPOTTM (микросферы для инъекций, состоящие из сополимера молочной кислоты - гликолевой кислоты и ацетата лейпролида) и поли-D-(-)-3-гидроксимасляная кислота. Хотя полимеры, такие как сополимер этилена-винилацетата и молочной кислоты - гликолевой кислоты, обладают способностью высвобождать молекулы в течение 100 дней, однако некоторые гидрогели способны высвобождать белки в течение более коротких периодов времени. Если инкапсулированные антитела сохраняются в организме в течение длительного периода времени, то они могут денатурироваться или образовывать агрегат под действием влаги при 37°C, что приводит к потере биологической активности и к возможным изменениям иммуногенности. Рациональные стратегии по стабилизации могут быть разработаны в зависимости от действующих механизмов. Так, например, если обнаружится, что механизмом агрегации является образование межмолекулярной S-S-связи посредством тиодисульфидного обмена, то стабилизация может быть достигнута путем модификации сульфгидрильных остатков, лиофилизации из кислотных растворов, регуляции содержания влаги, введения соответствующих добавок и создания специфических полимерных матричных композиций.
Препараты, используемые для введения in vivo, могут быть стерильными. Такая стерилизация может быть легко проведена путем фильтрации через мембраны для стерильной фильтрации.
VI. Эффективность лечения
Главным преимуществом любых описанных здесь способов, применений и композиций является такая способность продуцирования заметных противораковых эффектов у человека без вырабатывания значительной токсичности или серьезных побочных эффектов, при которой у данного индивидуума наблюдается благоприятный эффект от лечения в целом. В одном из вариантов любых способов, применений и композиций, профиль безопасности сравним с профилем, наблюдаемым при проведении предварительных исследований фазы III с использованием бевацизумаба. Эффективность лечения согласно изобретению может быть определена по различным конечным параметрам, обычно используемым для оценки лечения рака, включая, но не ограничиваясь ими, регрессию опухоли, размер опухоли или степень уменьшения ее размера, время до прогрессирования заболевания, продолжительность жизни, продолжительность жизни без прогрессирования опухоли, общий показатель отклика, длительность ответа и качество жизни. Поскольку антиангиогенные средства согласно изобретению нацелены на сосудистую систему опухоли, и необязательно на сами опухолевые клетки, то такие средства представляют собой уникальный класс противораковых лекарственных средств, а поэтому могут потребоваться уникальные критерии и способы определения клинических ответов на действие лекарственных средств. Так, например, сокращение размера опухоли, более чем на 50% в 2-мерном анализе представляет собой стандартный показатель, свидетельствующий о продуцировании ответа. Однако анти-VEGF антитело согласно изобретению может ингибировать распространение метастазов без сокращения размера первичной опухоли, либо оно может давать лишь онкостатический эффект. А поэтому должны быть разработаны новые подходы для определения эффективности антиангиогенной терапии, включая, например, измерение уровня маркеров ангиогенеза в плазме или в моче и измерение ответа посредством радиологической визуализации.
В другом своем варианте настоящее изобретение относится к способам увеличения продолжительности жизни индивидуума без прогрессирования заболевания, где указанный индивидуум имеет предрасположенность к развитию рака или у указанного индивидуума был диагностирован рак. Время до прогрессирования заболевания определяют как время от введения лекарственного средства до прогрессирования заболевания или летального исхода. В предпочтительном варианте изобретения комбинированное лечение согласно изобретению, проводимое с использованием анти-VEGF антитела и одного или нескольких химиотерапевтических средств, приводит к значительному увеличению продолжительности жизни без прогрессирования заболевания по меньшей мере примерно на 1 месяц, 1,2 месяца, 2 месяца, 2,4 месяца, 2,9 месяца, 3,5 месяца, а предпочтительно примерно 1-5 месяцев, по сравнению с лечением, проводимым с применением только химиотерапии. В одном из вариантов изобретения у индивидуумов, подвергаемых лечению бевацизумабом и таксаном (например, частицами, связанными с белком доцетакселом или паклитакселом (например, Abraxane®))/антрациклином (например, доксорубицином, эпирубицином или их комбинациями), средняя PFS (месяцы) (95% CI) составляет 9,2 месяца (8,6, 10,1), а у индивидуумов, подвергаемых лечению таксаном/антрациклином без бевацизумаба, PFS составляет 8,0 месяца (6,7, 8,4), где HR (95% CI) составляет 0,644 (0,522, 0,795), а p-величина (логранговый критерий) составляет менее чем 0,0001. В одном из вариантов изобретения у индивидуумов, подвергаемых лечению бевацизумабом и таксаном/антрациклином, PFS составляет 10,7 месяца, а у индивидуумов, подвергаемых лечению плацебо и таксаном/антрациклином, PFS составляет 8,3 месяца. В одном из вариантов изобретения у индивидуумов, подвергаемых лечению бевацизумабом и капецитабином, средняя PFS (месяцы) (95% CI) составляет 8,6 месяца (8,1, 9,5), а у индивидуумов, подвергаемых лечению капецитабином без бевацизумаба, PFS составляет 5,7 месяца (4,3, 6,2), где HR (95% CI) составляет 0,688 (0,564, 0,840), а p-величина (логранговый критерий) составляет 0,0002. В одном из вариантов изобретения у индивидуумов, подвергаемых лечению бевацизумабом и капецитабином, PFS составляет 9,7 месяца, а у индивидуумов, подвергаемых лечению плацебо и капецитабином, PFS составляет 6,2 месяца.
В другом варианте изобретения лечение согласно изобретению приводит к значительному увеличению показателя отклика у индивидуумов, предрасположенных к развитию рака, или у индивидуумов с диагностированным раком, которые подвергались лечению различными терапевтическими средствами. Показатель отклика определяют как процент индивидуумов, прошедших курс лечения, у которых наблюдался ответ на такое лечение. В одном из аспектов изобретения комбинированная терапия согласно изобретению, проводимая с использованием анти-VEGF антитела и одного или нескольких химиотерапевтических средств, приводит к значительному увеличению показателя отклика у группы индивидуумов, подвергаемых лечению, по сравнению с показателем отклика у группы индивидуумов, прошедших только химиотерапию.
В одном из своих аспектов настоящее изобретение относится к способам увеличения продолжительности ответа у индивидуума (человека) или у группы индивидуумов, у которых наблюдалась предрасположенность к развитию рака, или у индивидуумов, у которых был диагностирован рак. Продолжительность ответа определяют как время от начального ответа до прогрессирования заболевания.
В одном из своих вариантов настоящее изобретение относится к увеличению продолжительности жизни человека, у которого наблюдалась предрасположенность к развитию рака или у которого был диагностирован рак.
VII. Продуцирование антител
(i) Поликлональные антитела
Поликлональные антитела, предпочтительно, вырабатываются у животных после множества подкожных (s.c.) или внутрибрюшинных (i.p.) инъекций соответствующего антигена и адъюванта. Они могут быть использованы для конъюгирования соответствующего антигена с белком, который является иммуногенным для видов, подвергаемых иммунизации, например гемоцианином лимфы улитки, сывороточным альбумином, бычьим тироглобулином или соевым ингибитором трипсина, с использованием бифункционального или дериватизирующего агента, например, малеимидобензоилсульфосукцинимидоэфира (конъюгированного посредством цистеиновых остатков), N-гидроксисукцинимида (посредством лизиновых остатков), глутаральдегида, ангидрида янтарной кислоты, SOCl2 или R1N=C=NR, где R и R1 представляют собой различные алкильные группы.
Животных иммунизируют антигеном, иммуногенными конъюгатами или дериватами путем объединения, например, 100 мкг или 5 мкг белка или конъюгата (для кроликов или мышей, соответственно) с 3 объемами полного адъюванта Фрейнда и путем подкожной инъекции раствора во множество участков. Через месяц животных повторно иммунизируют во множество участков путем подкожной инъекции 1/5-1/10 от первоначального количества пептида или конъюгата в полном адъюванте Фрейнда. Через 7-14 дней у животных берут кровь и анализируют сыворотку на титр антител. Затем животных повторно иммунизируют до достижения плато титра. Повторную иммунизацию животных, предпочтительно, осуществляют путем инъекции конъюгата того же самого антигена, но конъюгированного с другим белком и/или посредством другого перекрестно-сшивающего реагента. Конъюгаты могут быть также получены в рекомбинантной клеточной культуре в виде гибридных белков. Кроме того, для усиления иммунного ответа могут быть также использованы агрегирующие агенты, такие как квасцы.
(ii) Моноклональные антитела
Описанные здесь моноклональные антитела получают различными методами, известными специалистам. Так, например, моноклональные антитела могут быть получены с применением гибридомной технологии, впервые описанной Kohler et al. Nature, 256:495 (1975), либо они могут быть получены методами рекомбинантных ДНК (патент США № 4816567).
В гибридомном методе мышь или другое подходящее животное-хозяин, такое как хомячок или макак, иммунизируют, как описано выше, для вырабатывания у них лимфоцитов, продуцирующих или способных продуцировать антитела, специфически связывающиеся с белком, используемым для иммунизации. Альтернативно, лимфоциты могут быть иммунизированы in vitro. Затем лимфоциты подвергают слиянию с миеломными клетками с использованием подходящего агента для слияния, такого как полиэтиленгликоль, в результате чего образуются гибридомные клетки (Goding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)).
Полученные таким образом гибридомные клетки высевают и культивируют в подходящей культуральной среде, которая, предпочтительно, содержит одно или несколько веществ, ингибирующих рост или выживание неслитых родительских миеломных клеток. Так, например, если родительские миеломные клетки не содержат фермента гипоксантин-гуанин-фосфорибозилтрансферазы (HGPRT или HPRT), то культуральная среда для получения гибридом обычно включает гипоксантин, аминоптерин и тимидин (среда НАТ), то есть вещества, предупреждающие рост HGPRT-дефицитных клеток.
Предпочтительными миеломными клетками являются клетки, которые способны подвергаться эффективному слиянию, поддерживать стабильное продуцирование высоких уровней антител выбранными антитело-продуцирующими клетками и являются чувствительными к среде, такой как среда НАТ. Из этих клеток предпочтительными миеломными клеточными линиями являются мышиные миеломные линии, такие как клеточные линии, происходящие от клеток мышиных опухолей МОРС-21 и МРС-11, имеющихся в институте Salk Institute Cell Distribution Center, San Diego, California USA, и клетки SP-2 или Х63-Ag8-653, имеющиеся в Американской коллекции типовых культур, Rockville, Maryland USA. Для продуцирования человеческих моноклональных антител также используются человеческие миеломные клеточные линии и гетеромиеломные клеточные линии “мышь-человек” (Kozbor J. Immunol., 133:3001 (1984) & Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp.51-63 (Marcel Dekker, Inc., New York, 1987)).
Культуральную среду для роста гибридомных клеток анализируют на продуцирование моноклональных антител против антигена. Специфичность связывания моноклональных антител, продуцируемых гибридомными клетками, определяют, предпочтительно, путем иммунопреципитации или путем проведения in vitro анализа на связывание, такого как радиоиммуноанализ (РИА) или твердофазный иммунноферментный анализ (ELISA).
После идентификации гибридомных клеток, которые продуцируют антитела с нужной специфичностью, аффинностью и/или активностью, клоны могут быть субклонированы путем проведения процедур лимитирующего разведения и культивированы стандартными методами (Goding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)). Подходящими культуральными средами, предназначенными для достижения данной цели, являются, например, среда D-MEM или RPMI-1640. Кроме того, гибридомные клетки могут быть выращены in vivo в качестве асцитных опухолей у животных.
Моноклональные антитела, секретированные субклонами, соответствующим образом выделяют из культуральной среды, асцитной жидкости или сыворотки путем проведения стандартных процедур очистки иммуноглобулинов, таких как, например, хроматография на белке А-сефарозе, хроматография на гидроксиапатитах, гель-электрофорез, диализ или аффинная хроматография.
ДНК, кодирующая моноклональные антитела, может быть легко выделена и секвенирована в соответствии со стандартными процедурами (например, с использованием олигонуклеотидных зондов, которые способны специфически связываться с генами, кодирующими тяжелые и легкие цепи моноклональных антител). Предпочтительным источником такой ДНК служат гибридомные клетки. После выделения, эта ДНК может быть встроена в экспрессионные векторы, которые затем трансфицируют в клетки-хозяева, такие как клетки E.coli, обезьяньи клетки COS, клетки яичника китайского хомячка (СНО) или миеломные клетки, которые, в иных случаях, не продуцируют белок антитела, в результате чего в этих рекомбинантных клетках-хозяевах синтезируются моноклональные антитела. Обсуждение рекомбинантного продуцирования антител более подробно приводится ниже.
В другом варианте изобретения моноклональные антитела или фрагменты антител могут быть выделены из фаговых библиотек антител, созданных методами, описанными McCafferty et al., Nature, 348:552-554 (1990). В работе Clackson et al. Nature, 352:624-628 (1991) и Marks et al., J. Mol. Biol. 222:581-597 (1991) описано выделение мышиных и человеческих антител, соответственно, с использованием фаговых библиотек. В более поздних публикациях описано продуцирование высокоаффинных (порядка нМ) человеческих антител посредством перестановки генов цепей антитела (Marks et al. Bio/Technology, 10:779-783 (1992)), а также путем комбинированного инфицирования и рекомбинации in vivo, применяемой в качестве стратегии для конструирования очень больших фаговых библиотек (Waterhouse et al. Nuc. Acids. Res. 21:2265-2266 (1993)). Таким образом, эти методы являются приемлемой альтернативой традиционной гибридомной технологии, применяемой для выделения моноклональных антител.
ДНК может быть также модифицирована, например, путем замены последовательности, кодирующей константные домены тяжелой цепи и легкой цепи человеческого антитела, гомологичными последовательностями мышиных антител (патент США № 4816567 и Morrison et al. (1984) Proc. Natl. Acad. Sci. USA 81:6851), или путем ковалентного присоединения к кодирующей последовательности для иммуноглобулина всей или части кодирующей последовательности для неиммуноглобулинового полипептида.
Обычно такие неиммуноглобулиновые полипептиды используют для замены константных доменов антитела, либо их используют для замены вариабельных доменов одного антигенсвязывающего сайта антитела в целях создания химерного двухвалентного антитела, содержащего один антигенсвязывающий сайт, обладающий специфичностью к одному антигену, и другой антигенсвязывающий сайт, обладающий специфичностью к другому антигену.
(iii) Гуманизованные и человеческие антитела
Гуманизованное антитело имеет один или несколько введенных в него аминокислотных остатков, происходящих от источника, не являющегося человеком. Эти нечеловеческие аминокислотные остатки часто называют «импортными» остатками, которые обычно берут из «импортного» вариабельного домена. Гуманизация может быть осуществлена, в основном, методом Винтера (Winter) и сотрудников (Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature, 332:323-327 (1988); Verhoyen et al., Science 239:1534-1536 (1988)), путем замены соответствующих последовательностей CDR грызунов соответствующими последовательностями CDR человеческого антитела. В соответствии с этим, такие «гуманизованными» антитела представляют собой химерные антитела (патент США № 4816567), в которых, в основном, меньшая часть, по сравнению с вариабельным доменом интактного человеческого антитела, заменена соответствующей последовательностью нечеловеческого антитела. Фактически, гуманизованные антитела обычно представляют собой человеческие антитела, в которых некоторые остатки CDR и, возможно, некоторые остатки FR заменены остатками, происходящими от аналогичных сайтов антител грызунов.
Для снижения антигенности при создании гуманизованных антител очень важно выбрать вариабельные домены как легкой, так и тяжелой цепи человеческого антитела. В соответствии с так называемым методом «подгонки», последовательность вариабельного домена антитела грызуна скринируют по всей библиотеке известных последовательностей вариабельных доменов человеческого антитела. Затем человеческую последовательность, которая является наиболее схожей с последовательностью грызунов, берут в качестве человеческой каркасной области (FR) для создания гуманизованного антитела (Sims et al., J. Immunol. 151:2296 (1993); Chothia et al., J. Mol. Biol. 196:901 (1987)). В другом методе используют конкретную каркасную область, происходящую от консенсусной последовательности всех человеческих антител конкретной подгруппы легких и тяжелых цепей. Та же самая каркасная область может быть использована для нескольких различных гуманизованных антител (Carter et al., Proc. Natl. Acad. Sci., USA, 89:4285 (1992); Presta et al., J. Immunol, 151:2623 (1993)).
Кроме того, важно, чтобы антитела были гуманизованы с сохранением высокой аффинности по отношению к данному антигену и других благоприятных биологических свойств. В предпочтительном способе, для достижения этой цели, гуманизованные антитела могут быть получены путем анализа исходных последовательностей и различных концептуальных гуманизованных продуктов с использованием трехмерных моделей родительских и гуманизованных последовательностей. Трехмерные иммуноглобулиновые модели являются общедоступными и хорошо известны специалистам. Существуют компьютерные программы, которые иллюстрируют и представляют вероятные трехмерные конформационные структуры отобранных последовательностей-кандидатов иммуноглобулинов. Исследование этих представлений позволяет проанализировать вероятную роль данных остатков в функционировании последовательностей иммуноглобулина-кандидата, то есть остатков, которые влияют на способность иммуноглобулина-кандидата связываться с его антигеном. Таким образом, остатки FR могут быть выбраны из реципиентных и «импортных» последовательностей и объединены, в результате чего может быть получено желаемое антитело с нужными свойствами, такими как повышенная аффинность по отношению к антигену(ам) - мишени(ям). В общих чертах, остатки CDR непосредственно влияют на связывание с антигеном, а в основном, участвуют в таком связывании.
Гуманизованные анти-VEGF антитела и их аффинно зрелые варианты описаны, например, в патенте США № 6884879, выданном 26 февраля 2005.
Так, например, в настоящее время могут быть получены трансгенные животные (например, мыши), которые будут способны после иммунизации продуцировать полный репертуар человеческих антител без продуцирования эндогенного иммуноглобулина. Так, например, сообщалось, что гомозиготная делеция гена области стыка в тяжелой цепи (JH) антитела у химерных и мутантных мышей зародышевой линии приводит к полному ингибированию продуцирования эндогенного антитела. Перенос набора генов иммуноглобулина человеческой зародышевой линии таким мутантным мышам зародышевой линии может приводить к продуцированию человеческих антител после стимуляции антигеном. См., например, Jakobovits et al., Proc. Natl. Acad. Sci., USA, 90:2551 (1993); Jakobovits et al., Nature 362:255-258 (1993); Bruggerman et al., Year in Immuno, 7:33 (1993) и Duchosal et al. Nature 355:258 (1992).
Альтернативно, для продуцирования человеческих антител и фрагментов антител in vitro из набора генов вариабельного домена (V) иммуноглобулина, происходящего от неиммунизованных доноров, может быть применена технология фагового представления (McCafferty et al. Nature 348:552-553 (1990)). В соответствии с этой технологией, гены домена V антитела клонируют с сохранением рамки считывания в ген основного или минорного белка оболочки нитчатого бактериофага, такого как М13 или fd, и представляют в качестве функциональных фрагментов антитела на поверхности фаговой частицы. Поскольку нитеобразная частица содержит копию одноцепочечной ДНК фагового генома, то отбор на основе функциональных свойств антитела также позволяет проводить отбор гена, кодирующего антитело, обладающее этими свойствами. Таким образом, фаг имитирует некоторые свойства В-клеток. Фаговое представление может быть осуществлено в различных форматах; см., например, обзор в работе Johnson, Kevin S. и Chiswell, David J., Current Opinion in Structural Biology 3:564-571 (1993). Для осуществления фагового представления может быть использовано несколько источников V-генных сегментов. Clackson et al., Nature, 352:624-628 (1991) выделили другой набор разнообразных антител против оксазолона из небольшой рандомизированной комбинаторной библиотеки генов V, происходящих из селезенки иммунизованных мышей. При этом, может быть сконструирован набор генов V от неиммунизованных людей-доноров, а затем могут быть выделены антитела против набора различных антигенов (включая аутоантигены), в основном, в соответствии с методами, описанными Marks et al., J. Mol. Biol. 222:581-597 (1991) или Griffith et al., EMBO J. 12:725-734 (1993). См. также патенты США №№ 5565332 и 5573905.
Как обсуждалось выше, человеческие антитела могут также продуцироваться in vitro активированными В-клетками (см. патенты США №№ 5567610 и 5229275).
Человеческие моноклональные анти-VEGF антитела описаны в патенте США № 5730977, выданном 24 марта 1998.
(iv) Фрагменты антител
Для получения фрагментов антител были разработаны различные методы. Традиционно, эти фрагменты образуются в результате протеолитического расщепления интактных антител (см., например, Morimoto et al., Journal of Biochemical and Biophysical Methods 24:107-117 (1992) и Brennan et al., Science, 229:81 (1985)). Однако эти фрагменты могут продуцироваться непосредственно рекомбинантными клетками-хозяевами. Так, например, фрагменты антител могут быть выделены из фаговых библиотек антител, обсуждаемых выше. Альтернативно, Fab'-SH-фрагменты могут быть непосредственно выделены из E.coli и химически связаны с образованием F(ab')2-фрагментов (Carter et al., Bio/Technology 10:163-167 (1992)). В соответствии с другим подходом, F(ab')2-фрагменты могут быть выделены непосредственно из культуры рекомбинантной клетки-хозяина. Специалистам известны и другие методы получения фрагментов антител. В других вариантах изобретения, выбранным антителом является одноцепочечный Fv-фрагмент (scFv). См. WO 93/16185.
(v) Другие модификации аминокислотных последовательностей
В настоящей заявке рассматриваются модификации аминокислотных последовательностей антител. Так, например, может оказаться желательным повышение аффинности связывания и/или других биологических свойств данного антитела. Варианты аминокислотных последовательностей таких антител получают путем введения соответствующих нуклеотидных замен в нуклеиновую кислоту антитела или путем пептидного синтеза. Такие модификации включают, например, делеции, и/или инсерции, и/или замены остатков в аминокислотных последовательностях антитела. При этом в конечной конструкции могут присутствовать любые комбинации делеций, инсерций и замен, при условии, что эта конечная конструкция будет обладать нужными свойствами. Аминокислотные замены также могут влиять на посттрансляционные процессы антитела, такие как изменение числа или положения сайтов гликозилирования.
Метод, который применяется для идентификации некоторых остатков или областей антитела и который позволяет определять локализацию мутагенеза, называется «аланин-сканирующим мутагенезом» и описан Cunningham & Wells, Science 244:1081-1085 (1989). В этом методе остаток или группу нужных остатков идентифицируют (например, заряженные остатки, такие как Arg, Asp, His, Lys и Glu) и заменяют нейтральной или отрицательно заряженной аминокислотой (наиболее предпочтительно, аланином или полиаланином) для осуществления взаимодействия этих аминокислот с антигеном. Затем локализацию аминокислот, проявляющих функциональную чувствительность к таким заменам, уточняют путем введения дополнительных или других вариантов у данного положения замены или вместо данной замены. Так, например, место введения аминокислотной замены может быть определено заранее, тогда как природа мутации per se необязательно должна быть определена заранее. Например, для анализа эффективности мутации в данном сайте, Ala-сканирующий или неспецифический мутагенез проводят в нужном кодоне или в нужной области, и варианты экспрессированного антитела скринируют на нужную активность.
Вставками в аминокислотные последовательности являются вставки у амино- и/или карбокси-концов, образующие гибриды, имеющие длину от одного остатка до полипептидов, содержащих сто или более остатков, а также вставки внутри последовательности, состоящие из одного или множества аминокислотных остатков. Примерами концевых инсерций являются антитело с N-концевым метионильным остатком или антитело, присоединенное к цитотоксическому полипептиду. Другими инсерционными вариантами молекулы антитела являются гибриды N- или С-концов антитела с ферментом (например, для ADEPT) или с полипептидом, который способствует увеличению времени полужизни данного антитела в сыворотке.
Вариантом другого типа является вариант замены аминокислоты. Эти варианты имеют, по крайней мере, один аминокислотный остаток в молекуле антитела, замененный другим остатком. Сайтами, представляющими наибольший интерес для мутагенеза, проводимого путем замены, являются гипервариабельные области, но могут также рассматриваться и замены в FR.
Значительные изменения биологических свойств антитела могут быть достигнуты путем выбора замен, которые оказывают значительное влияние на (а) сохранение структуры полипептидного остова в области замены, например, складчатой и спиральной конформации, (b) заряд или гидрофобность молекулы в нужном сайте, или (с) объем боковой цепи. Аминокислоты могут подразделяться на нижеследующие группы по общим свойствам их боковых цепей (как описано в публикации A. L. Lehninger, Biochemistry, second ed., pp. 73-75, Worth Publishers, New York (1975)):
(1) неполярные: Ala (A), Val (V), Leu (L), Ile (I), Pro (P), Phe (F), Trp (W), Met (M)
(2) незаряженные полярные: Gly (G), Ser (S), Thr (T), Cys (C), Tyr (Y), Asn (N), Gln (Q)
(3) кислотные: Asp (D), Glu (E)
(4) основные: Lys (K), Arg (R), His (H)
Альтернативно, природные остатки могут подразделяться на нижеследующие группы по общим свойствам их боковых цепей:
(1) гидрофобные остатки: норлейцин, Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные остатки: Cys, Ser, Thr;
(3) кислотные остатки: Asp, Glu;
(4) основные остатки: His, Lys, Arg;
(5) остатки, которые влияют на ориентацию цепи: Gly; Pro; и
(6) ароматические остатки: Trp, Tyr, Phe.
Неконсервативные замены приводят к заменам члена одного из этих классов членом другого класса.
Любой цистеиновый остаток, который не участвует в поддержании соответствующей конформации антитела, может быть также заменен, в основном, серином, в целях повышения устойчивости молекулы к окислению и предупреждения нежелательного перекрестного связывания. И наоборот, цистеиновая(ые) связь(и) может (могут) быть добавлена(ы) к указанному антителу в целях повышения его стабильности (в частности, если указанным антителом является фрагмент антитела, такой как Fv-фрагмент).
Особенно предпочтительным типом варианта замены является замена одного или нескольких остатков гипервариабельной области родительского антитела (например, гуманизованного или человеческого антитела). В общих чертах, полученный(ые) вариант(ы), выбранный(е) для дальнейшей разработки, будет способствовать улучшению биологических свойств по сравнению с родительским антителом, от которого он(они) происходит(ят). Стандартный способ создания таких вариантов с заменами осуществляют в целях созревания аффинности посредством фагового представления. Для этого несколько положений гипервариабельной области (например, 6-7 положений) подвергают мутации для внесения всех возможных аминокислотных замен в каждом сайте. Созданные таким образом варианты антитела будут представлены как моновалентные молекулы на частицах нитчатого фага в виде гибридов с продуктом гена III, упакованных в каждой частице фага М13. Затем варианты, представленные на фаге, скринируют на их биологическую активность (например, аффинность связывания), как описано в настоящей заявке. Для идентификации сайтов гипервариабельной области, являющихся кандидатами на модификацию, может быть осуществлен аланин-сканирующий мутагенез, который позволяет идентифицировать остатки гипервариабельной области, играющие существенную роль в связывании с антигеном. Альтернативно или дополнительно, может оказаться полезным проанализировать кристаллическую структуру комплекса «антиген-антитело» для идентификации контактных участков между антителом и человеческим VEGF. Такие контактные остатки и соседние остатки являются кандидатами на замену, осуществляемую в соответствии с разработанным здесь способом. После генерирования таких вариантов, панель этих вариантов подвергают скринингу, описанному в настоящей заявке, и антитела, обнаруживающие превосходные свойства в одном или нескольких релевантных анализах, могут быть выбраны для дальнейшего исследования.
Аминокислотный вариант антитела другого типа изменяет исходный характер гликозилирования антитела. Термин «изменение» означает делецию одной или нескольких углеводных молекул, присутствующих в антителе, и/или добавление одного или нескольких сайтов гликозилирования, отсутствующих в антителе.
Гликозилирование антител обычно является либо N-связанным, либо О-связанным. N-связанное гликозилирование означает присоединение углеводной группы к боковой цепи аспарагинового остатка. Трипептидные последовательности «аспарагин-Х-серин» и «аспарагин-Х-треонин», где Х означает любую аминокислоту, за исключением пролина, представляют собой последовательности распознавания для ферментативного присоединения углеводной части к боковой цепи аспарагина. Таким образом, присутствие любой из этих трипептидных последовательностей в полипептиде способствует созданию потенциального сайта гликозилирования. О-связанное гликозилирование означает присоединение одного из сахаров, таких как N-ацетилгалактозамин, галактоза или ксилоза, к гидроксиаминокислоте, главным образом, к серину или треонину, хотя ими могут быть также 5-гидроксипролин или 5-гидроксилизин.
Присоединение сайтов гликозилирования к антителу обычно осуществляют путем такой модификации аминокислотной последовательности, в результате которой эта аминокислотная последовательность будет содержать одну или несколько вышеописанных трипептидных последовательностей (для сайтов N-связанного гликозилирования). Такая модификация может быть также осуществлена путем добавления одного или нескольких сериновых или треониновых остатков к последовательности или их замены в последовательности исходного антитела (для сайтов О-связанного гликозилирования).
Если антитело содержит Fc-область, то углевод, присоединенный к Fc-области, может быть модифицированным. Так, например, антитела, имеющие углевод со зрелой структурой, в котором отсутствует фукоза и который присоединен к Fc-области антитела, описаны в заявке на патент США № 2003/0157108 А1, Presta, L. См. также US 2004/0093621 A1 (Kyowa Hakko Kogyo Co., Ltd). Антитела, содержащие в своем углеводе N-ацетилглюкозамин (GlcNAc), разделяющий молекулу антитела пополам, где указанный углевод присоединен к Fc-области антитела, описаны в WO 03/011878, Jean-Mairet et al., и в патенте США № 6602684, Umana et al. Антитела, имеющие по меньшей мере один галактозный остаток в олигосахариде, присоединенном к Fc-области антитела, описаны в WO 1997/30087, Patel et al. См. также заявки WO 98/58964 (Raju, S.) и WO 99/22764 (Raju, S.), которые относятся к антителам с модифицированным углеводом, присоединенным к Fc-области антитела.
При этом может оказаться желательным модифицировать антитело согласно изобретению в отношении его эффекторной функции, например, для усиления антиген-зависимой клеточно-опосредованной цитотоксичности (ADCC) и/или комплемент-зависимой цитотоксичности (CDC) антитела. Это может быть достигнуто путем введения одной или нескольких аминокислотных замен в Fc-область антитела. Альтернативно или дополнительно, в эту Fc-область может(могут) быть введен(ы) цистеиновый(е) остаток(остатки), что будет способствовать образованию межцепьевой дисульфидной связи в этой области. Генерированное таким образом гомодимерное антитело может обладать повышенной способностью к интернализации и/или повышенной способностью к комплемент-опосредованному уничтожению клеток, а также антитело-зависимой клеточной цитотоксичностью (ADCC). См. Caron et al. J. Exp. Med. 176:1191-1195 (1992) и Shopes, B. J. Immunol. 148:2918-2922 (1992). Гомодимерные антитела с повышенной противоопухолевой активностью могут быть также получены с использованием гетеробифункциональных перекрестно-сшивающих агентов, описанных Wolff et al. Cancer Research 53:2560-2565 (1993). Альтернативно, может быть сконструировано антитело, которое имеет две Fc-области, а поэтому может обладать повышенной способностью к комплемент-зависимому лизису и ADCC. См. Stevenson et al. Anti-Cancer Drug Design 3:219-230 (1989).
В WO 00/42072 (Presta, L.) описаны антитела с улучшенной ADCC-функцией в присутствии человеческих эффекторных клеток, где указанные антитела содержат аминокислотные замены в Fc-области. При этом предпочтительно, чтобы антитела с улучшенной ADCC-функцией содержали замены в положениях 298, 333 и/или 334 Fc-области (Европейская нумерация остатков). Предпочтительной модифицированной Fc-областью является Fc-область человеческого IgG1, содержащая замены в одном, двух или трех таких положениях или состоящая из указанных замен. Такие замены объединяют, но необязательно, с заменой(ами), способствующей(ими) повышению уровня связывания с C1q и/или улучшению CDC-функции.
Антитела с модифицированным связыванием с C1q и/или с повышенной комплемент-зависимой цитотоксичностью (CDC) описаны в WO 99/51642, в патенте США № 6194551Bl, в патенте США № 6242195B1, в патенте США № 6528624B1 и в патенте США № 6538124 (Idusogie et al). Эти антитела содержат аминокислотную замену в одном или нескольких положениях аминокислот 270, 322, 326, 327, 329, 313, 333 и/или 334 Fc-области (Европейская нумерация остатков).
Для увеличения полужизни антитела в сыворотке, в данное антитело (а в частности, фрагмент антитела) может быть введен эпитоп, связывающийся с рецептором «спасения», как описано, например, в патенте США № 5739277. Используемый здесь термин «эпитоп, связывающийся с рецептором спасения» означает эпитоп Fc-области молекулы IgG (например, IgG1, IgG2, IgG3 или IgG4), которая ответственна за увеличение времени полужизни молекулы IgG в сыворотке in vivo.
Антитела с повышенным уровнем связывания с неонатальным Fc-рецептором (FcRn) и с увеличенным временем полужизни описаны в WO 00/42072 (Presta, L.) и US 2005/0014934A1 (Hinton et al.). Эти антитела содержат Fc-область с одной или несколькими заменами, повышающими уровень связывания Fc-области с FcRn. Так, например, Fc-область может иметь замены в одном или нескольких положениях 238, 250, 256, 265, 272, 286, 303, 305, 307, 311, 312, 314, 317, 340, 356, 360, 362, 376, 378, 380, 382, 413, 424, 428 или 434 (Европейская нумерация остатков). Предпочтительный вариант антитела, содержащий Fc-область с повышенным уровнем FcRn-связывания, содержит аминокислотные замены в одном, двух или трех положениях 307, 380 и 434 Fc-области (Европейская нумерация остатков). В одном из вариантов изобретения указанное антитело имеет мутации в положениях 307/434.
Также рассматриваются сконструированные антитела с тремя или более (предпочтительно, с четырьмя) функциональными антигенсвязывающими сайтами (заявка США № US 2002/0004587 A1, Miller et al.).
Молекулы нуклеиновой кислоты, кодирующие варианты аминокислотных последовательностей антитела, получают различными методами, известными специалистам. Такими методами являются, но не ограничиваясь ими, выделение из природного источника (в случае природных вариантов аминокислотных последовательностей) или получение с помощью опосредуемого олигонуклеотидом (или сайт-направленного) мутагенеза, ПЦР-мутагенеза и кластерного мутагенеза ранее полученного варианта или немодифицированного варианта антитела.
(vi) Иммуноконъюгаты
Настоящее изобретение также относится к иммуноконъюгатам, включающим описанное здесь антитело, конъюгированное с цитотоксическим агентом, таким как химиотерапевтическое средство, токсин (например, ферментативно активный токсин бактериального, грибкового, растительного или животного происхождения или его фрагменты) или радиоактивный изотоп (то есть радиоактивный конъюгат).
Химиотерапевтические средства, используемые для получения таких иммуноконъюгатов, описаны выше. Ферментативно активными токсинами и их фрагментами, которые могут быть использованы для этих целей, являются А-цепь дифтерийного токсина, несвязывающиеся активные фрагменты дифтерийного токсина, А-цепь экзотоксина (от Pseudomonas aeruginosa), А-цепь рицина, А-цепь абрина, А-цепь модецина, альфа-сарцин, белки Aleurites fordii, белка диантина, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор Momordica charantia, курцин, кротин, ингибитор Sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трикотецены. Для получения радиоактивно конъюгированных антител могут быть использованы различные радионуклиды. Примерами таких радионуклидов являются 212Bi, 131I, 131In, 90Y и 186Re.
Конъюгаты антитела и цитотоксического средства получают с использованием различных бифункциональных белок-связывающих агентов, таких как N-сукцинимидил-3-(2-пиридилтиол)пропионат (SPDP), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат-HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидосоединения (такие как бис(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Так, например, иммунотоксин рицин может быть получен, как описано в публикации Vitetta et al. Science, 238:1098 (1987). 14С-меченная 1-изотиоцианатобензил-3-метилдиэтилентриаминопентауксусная кислота (МХ-DTPA) является репрезентативным хелатообразующим агентом для конъюгирования радионуклеотида с антителом. См. WO 94/11026.
В другом варианте изобретения указанное антитело может быть конъюгировано с «рецептором» (таким как стрептавидин) для его предварительного нацеливания на опухоль, где указанный конъюгат «антитело-рецептор» вводят индивидууму с последующим удалением несвязанного конъюгата из кровотока с использованием агента для клиренса, а затем вводят «лиганд» (например, авидин), конъюгированный с цитотоксическим средством (например, радионуклеотидом).
(vii) Иммунолипосомы
Описанное здесь антитело может быть также приготовлено в виде иммунолипосом. Липосомы, содержащие такое антитело, получают методами, известными специалистам, например методами, описанными в публикациях Epstein et al., Proc. Natl. Acad. Sci. USA, 82:3688 (1985); Hwang et al., Proc. Natl Acad. Sci. USA, 77:4030 (1980); и в патентах США №№ 4485045 и 4544545. Липосомы с увеличенным временем циркуляции в кровотоке описаны в патенте США № 5013556.
Особенно подходящие липосомы могут быть получены методом выпаривания с обращенной фазой с использованием липидной композиции, содержащей фосфотидилхолин, холестерин и ПЭГ-дериватизированный фосфатидилэтаноламин (ПЭГ-ФЭ). Липосомы подвергают экструзии через фильтры с определенным размером пор с получением липосом нужного диаметра. Fab'-фрагменты антитела согласно изобретению могут быть конъюгированы с липосомами, описанными в публикации Martin et al. J. Biol. Chem. 257: 286-288 (1982), посредством реакции дисульфидного обмена. Липосома может содержать, но необязательно, химиотерапевтическое средство. См. Gabizon et al. J. National Cancer Inst. 81(19)1484 (1989).
VIII. Промышленные изделия и наборы
В другом своем варианте настоящее изобретение относится к промышленному изделию, содержащему материалы, используемые для лечения описанных выше расстройств. Такое промышленное изделие содержит контейнер, этикетку и вкладыш, вложенный в упаковку. Подходящими контейнерами являются, например, бутыли, флаконы, шприцы и т.п. Такие контейнеры могут быть изготовлены из различных материалов, таких как стекло или пластик. Указанный контейнер содержит композицию, которая является эффективной для лечения указанного состояния и может иметь стерильное входное отверстие (например, таким контейнером может быть пакет для внутривенного введения раствора или сосуд, имеющий пробку, протыкаемую иглой для подкожных инъекций). По меньшей мере одним активным агентом в указанной композиции является анти-VEGF антитело. На этикетке или на вкладыше, вложенном в упаковку, должно быть указано, что такая композиция используется для лечения данного состояния. Промышленное изделие может также включать второй контейнер, содержащий фармацевтически приемлемый буфер, такой как забуференный фосфатом физиологический раствор, раствор Рингера и раствор декстрозы. Такой контейнер может также включать и другие материалы, необходимые с точки зрения промышленного производства и потребителя, включая другие буферы, разбавители, фильтры, иглы и шприцы. Кроме того, указанное промышленное изделие содержит вкладыши в упаковку, на которых имеются инструкции по применению, включая, например, инструкции по применению данной композиции для введения композиции анти-VEGF антитела и химиотерапевтического средства индивидууму, например капецитабина, таксана, антрациклина, паклитаксела, доцетаксела, частиц, связанных с белком паклитакселом (например, Abraxane®), доксорубицина, эпирубицина, 5-фторурацила, циклофосфамида или их комбинаций. Вкладыш в упаковку может содержать, но необязательно, некоторые или все данные, полученные, как описано в примере 1.
VEGF-специфический антагонист может быть упакован отдельно или в комбинации с другими противораковыми терапевтическими соединениями в виде набора. Указанный набор может включать необязательные компоненты, стимулирующие введение унифицированной дозы индивидуумам, такие как флаконы для разведения порошкообразных форм, шприцы для инъекций, специально приготовленные системы для i.v.-доставки, ингаляторы и т.п. Кроме того, указанный набор с унифицированной дозой может содержать инструкции по получению и введению композиций. В некоторых вариантах изобретения такие инструкции включают, например, инструкции по применению данной композиции для введения анти-VEGF антитела и химиотерапевтического средства индивидууму, например капецитабина, таксана, антрациклина, паклитаксела, доцетаксела, частиц, связанных с белком паклитакселом (например, Abraxane®), доксорубицина, эпирубицина, 5-фторурацила, циклофосфамида или их комбинаций. Вкладыш в упаковку может содержать, но необязательно, некоторые или все данные, полученные, как описано в примере 1. Указанный набор может быть изготовлен в виде унифицированной дозы для одноразового введения одному индивидууму, или для многократного введения конкретному индивидууму (постоянной дозы или дозы, в которой отдельные соединения могут варьироваться в зависимости от успеха лечения); либо этот набор может содержать множество доз, которые могут быть введены нескольким индивидуумам («объемная упаковка»). Компоненты этого набора могут содержаться в картонной упаковке, в блистерной упаковке, во флаконах, в тюбиках и т.п.
Депонирование материалов
Указанная ниже гибридомная клеточная линия была депонирована в соответствии с Будапештстким договором о депонировании микроорганизмов в Американской коллекции типовых культур (АТСС), Manassas, VA, USA:
Нижеследующий пример приводится лишь в целях иллюстрации способа осуществления настоящего изобретения и не должен рассматриваться как ограничение его объема. Описание всей патентной и научной литературы, цитируемой в настоящей заявке, во всей своей полноте вводится в ее описание посредством ссылки.
Пример
Пример 1. Использование бевацизумаба в комбинации со схемами химиотерапии для лечения индивидуумов, страдающих метастазирующим раком молочной железы, ранее не подвергаемым лечению
Метастазирующий рак молочной железы (МРМЖ) представляет собой неизлечимое заболевание, от которого большинство пациентов умирает через 2 года после установления диагноза (Greenberg, et al., 1996, J. Clin. Oncol. 14:2197-205; Dawood, et al., 2008, J. Clin. Oncol . 26:4891-8; и Chia et al., Cancer. 2007, 110:973-9). Приблизительно у 60% из всех пациентов с МРМЖ ранее было диагностировано рецидивирующее локализованное заболевание, а приблизительно у 40% пациентов было обнаружено метастазирующее заболевание de novo.
Два ранее проведенных рандомизированных испытания фазы III с участием пациентов с МРМЖ продемонстрировали благоприятный эффект при добавлении бевацизумаба к исходной химиотерапии таксаном. В пилотном испытании фазы III E2100 продолжительность жизни без прогрессирования заболевания (PFS) у пациентов, которым еженедельно вводили паклитаксел + бевацизумаб, значительно увеличивалась по сравнению с пациентами, которым вводили только паклитаксел (Miller at al., N. Engl J. Med., 2007, 357:2666-76). Аналогичным образом, в испытании AVADO, в котором исследовали комбинацию бевацизумаба (в дозе 7,5 и 15 мг/кг, вводимой через каждые 3 недели (q3w)) с доцетакселом, было обнаружено, что пациенты, которым вводили доцетаксел + бевацизумаб, продолжительность жизни без прогрессирования заболевания (PFS) была выше, чем у пациентов, которым вводили только доцетаксел (Miles et al., 2008 ASCO Annual Meeting Chicago, IL). Предварительно проведенное рандомизированное испытание фазы III (AVF2119g) с участием пациентов с МРМЖ, ранее проходивших лечение с использованием комбинации бевацизумаба и капецитабина, продемонстрировало, что общий показатель отклика (ORR) был выше у пациентов, которым вводили капецитабин + бевацизумаб, чем у пациентов, которым вводили только капецитабин, однако такое лечение не достигало своей главной цели увеличения PFS (Miller et al., J. Clin. Oncol. 2005, 23:792-9).
В этом примере описан анализ результатов, полученных для индивидуумов с метастазирующим раком молочной железы, ранее не подвергаемом лечению, где указанные индивидуумы участвовали в клиническом испытании RIBBON 1, проводимом с использованием таксана и химиотерапии, не включающей таксан. Главной целью исследования является определение клинического эффекта от добавления бевацизумаба к стандартной схеме химиотерапии метастазирующего рака молочной железы, ранее не подвергаемого лечению, как было определено по PFS, исходя из оценки опухоли исследователем. См., например, O'Shaughnessy and Brufsky, (2008), Clinical Breast Cancer, 8(4): 370-373. Это испытание включало две экспериментальных группы, у которых оценивали действие AVASTIN® вместе с химиотерапией различных типов, проводимой для женщин, которые ранее не проходили химиотерапию по поводу запущенного HER2-негативного рака молочной железы. В первой экспериментальной группе женщины проходили лечение препаратом AVASTIN или плацебо в комбинации с химиотерапией на основе таксана или антрациклина. Во второй экспериментальной группе, женщинам вводили либо AVASTIN, либо плацебо в комбинации с химиотерапией капецитабином. Анализ, описанный в этом примере, проводили с информированного согласия 1237 пациентов. В этих испытаниях оценивали эффективность бевацизумаба (AVASTIN®), используемого в качестве терапевтического средства для лечения пациентов с метастазирующим раком молочной железы, ранее не подвергаемого лечению.
Протокол исследования
Протокол исследования RIBBON1 представлен на фигуре 1.
Исследование RIBBON1 проводили в соответствии с нижеследующим протоколом:
Ветвь A: 15 мг/кг бевацизумаба, i.v. на день 1 каждого 21-дневного цикла, проводимого для группы 1, группы 2 или группы 3;
Ветвь В: плацебо i.v. на день 1 каждого 21-дневного цикла, проводимого для группы 1, группы 2 или группы 3;
Группа 1: Через каждые 3 недели вводили любой из нижеследующих таксанов
75-100 мг/м2 доцетаксела, i.v.
260 мг/м2 частиц, связанных с белком паклитакселом (Abraxane®), i.v.
Группа 2: через каждые 3 недели проводили любой из описанных ниже курсов комбинированной химиотерапии на основе антрациклина для индивидуумов, которые ранее не проходили лечение антрациклинами;
FEC: 5-фторурацил, 500 мг/м2, i.v., эпирубицин, 90-100 мг/м2, i.v., и циклофосфамид, 500 мг/м2, i.v., на день 1
FAC: 5-фторурацил, 500 мг/м2, i.v., доксорубицин, 50 мг/м2, i.v., и циклофосфамид, 500 мг/м2, i.v., на день 1
AC: доксорубицин, 50-60 мг/м2, i.v., и циклофосфамид, 500-600 мг/м2, i.v., на день 1
EC: эпирубицин, 90-100 мг/м2, i.v., и циклофосфамид, 500-600 мг/м2, i.v., на день 1
Группа 3: Капецитабин, 1000 мг/м2, перорально, два раза в день на дни 1-14 каждого 3-недельного цикла.
Кроме того, после проведения фазы лечения слепым методом, некоторым индивидуумам вводили бевацизумаб в дозе 15 мг/кг i.v. через каждые три недели или в дозе 10 мг/мл i.v. через каждые 2 недели одновременно с химиотерапией.
Бевацизумаб (AVASTIN®) поставляется в виде прозрачного или слегка мутноватого бесцветного или светло-коричневого стерильного жидкого концентрата для получения раствора для i.v.-вливания. Бевацизумаб поставляется в 5-миллилитровых (100 мг) или 20-миллилитровых (400 мг) стеклянных сосудах, содержащих 4 мл или 16 мл бевацизумаба, соответственно (25 мг/мл для любого сосуда). Сосуды содержат бевацизумаб вместе с фосфатом, трегалозой, полисорбатом 20 и стерильной водой для инъекций (SWFI), USP. Сосуды не содержат консервантов. Перед непрерывным внутривенным введением, AVASTIN® разводят в 0,9% хлорида натрия для инъекций, USP, до общего объема 100 мл.
Методы
Индивидуумы/пациенты могут быть включены в испытание по следующим ключевым критериям: возраст индивидуумов >18 лет, электрокортикограмма (ЭКОГ) 0 или 1 (шкала оценок эффективности по ЭКОГ), индивидуумы ранее не проходили курс химиотерапии по поводу локального рецидивирующего или метастазирующего рака молочной железы; индивидуумы являются негативными по Her2 (то есть если они не являются Her2-позитивными и имеют противопоказания к трастузумабу, или отсутствует разрешение на его применение) и/или проходили предварительную вспомогательную химиотерапию в случае, если рецидив наблюдался более чем через (или точно через) 12 месяцев после введения последней дозы. У всех индивидуумов была гистологически или цитологически подтверждена аденокарцинома молочной железы, и эти индивидуумы могут иметь либо измеримое (по критериям оценки ответа при солидных опухолях) (RECIST)), либо неизмеримое локально рецидивирующее или метастазирующее заболевание. Локально рецидивирующее заболевание не подлежит хирургической операции, применяемой в качестве лечебной терапии.
Индивидуумы могли ранее проходить гормональную терапию на стадии вспомогательной терапии или на стадии метастазов в случае, если она была прекращена более чем за 1 неделю или точно за 1 неделю до дня 0, или вспомогательную химиотерапию, если она была прекращена более чем за 12 месяцев или точно за 12 месяцев до дня 0.
Критериями исключения индивидуумов из испытания являются: HER2-позитивный статус (за исключением случая, когда терапия трастузумабом для пациента была успешной, или если терапия трастузумабом имеет противопоказания, или отсутствует разрешение на ее применение); прохождение пациентом предварительной вспомогательной химиотерапии или новой вспомогательной химиотерапии в течение 12 месяцев; диагностированные метастазы в центральную нервную систему; кровяное давление >150/100 мм рт.ст.; нестабильная стенокардия; застойная сердечная недостаточность (ЗСН) степени II или выше по шкале оценок, предложенной Нью-Йоркской Ассоциацией по изучению болезней сердца; инфаркт миокарда в истории болезни за 6 месяцев до испытания; инсульт или преходящий приступ ишемии в истории болезни за 6 месяцев до начала испытания; клиническое проявление заболевания периферических сосудов; документально подтвержденные геморрагический диатез или коагулопатия; в истории болезни: свищи в брюшной полости, перфорация желудочно-кишечного тракта (ЖКТ) или внутрибрюшинный абсцесс за 6 месяцев до испытания; не контролируемая премедикацией анафилактическая реакция на терапию моноклональным антителом в истории болезни; серьезные незаживающие раны; нарушение функции органов; локально рецидивирующее заболевание, подлежащее хирургической операции, применяемой в качестве лечебной терапии; другие злокачественные заболевания в истории болезни за 5 лет до испытания. Если в качестве химиотерапии был выбран антрациклин, то также необходимо, чтобы фракция выброса крови левым желудочком составляла ≥50%, и чтобы в истории болезни данного пациента отсутствовало ранее проведенное лечение антрациклином.
Испытания проводили во всем мире (по меньшей мере в 22 странах), и в них участвовало 1237 индивидуумов/пациентов (таксан (T): 307; антрациклин (Anthra): 315; и капецитабин (Cap): 615).
Основной целью проведения данного исследования является продолжительность жизни без прогрессирования заболевания (PFS), определенная как время, прошедшее от рандомизации до прогрессирования заболевания или до летального исхода, как было установлено исследователем. Для оценки средней PFS в каждой «ветви» лечения может быть применена методика Каплана-Мейера. В некоторых вариантах изобретения степень риска для PFS может быть оценена с применением стратифицированной регрессионной модели Кокса, в которой используются те же самые факторы стратификации, которые были использованы в стратифицированном логранговом критерии. Анализы по PFS в каждой группе осуществляли с использованием двустороннего критерия α=0,05. Данные по времени до начала развития заболевания сравнивали для двух «ветвей» лечения с использованием стратифицированного логрангового критерия. Для оценки данных по времени до начала развития заболевания был применен метод Каплана-Мейера. 95%-ные доверительные интервалы для усредненного времени до начала развития заболевания вычисляли с помощью компьютерной программы с применением метода Брукмейера-Кроули. HR для данных по времени до начала развития заболевания оценивали с применением стратифицированной регрессионной модели Кокса.
Вторыми конечными параметрами являются объективный показатель отклика (ORR), выживание в течение одного года, общая продолжительность жизни (OS), PFS, определяемая исходя из оценки по IRC, и безопасность. OS определяют как время, прошедшее от рандомизации до смерти пациента по любой причине. ORR определяют как процент пациентов, у которых наблюдался полный или частичный ответ, подтвержденный через ≥28 дней после первоначально зарегистрированного ответа. Выживание в течение одного года оценивали в интервалах между проведением «ветвей» лечения с применением метода аппроксимации нормальным распределением. ORR у пациентов с исходным детектируемым заболеванием сравнивали с применением стратифицированного χ2-критерия Мантеля-Хенцеля. Случайные коэффициенты стратификации были включены во все стратифицированные анализы.
Результаты
Испытание RIBBON1 представляет собой Международное многоцентровое рандомизированное плацебо-контролируемое клиническое испытание, проводимое двойным слепым методом, в котором участвовало 1237 индивидуумов/пациентов с локально рецидивирующим или метастазирующим HER2-негативным раком молочной железы, где указанные пациценты не подвергались химиотерапии по поводу метастазирующего заболевания. См. таблицу 1, в которой приводятся характеристики индивидуумов/пациентов, участвующих в таком испытании. Главными конечными параметрами этих испытаний является продолжительность жизни без прогрессирования заболевания (PFS), определяемая как время, прошедшее от рандомизации до прогрессирования заболевания или до летального исхода, как было установлено исследователем. Результаты этих исследований показали, что AVASTIN® в комбинации с нижеследующими химиотерапевтическими средствами первого ряда, применяемыми для лечения метастазирующего HER2-негативного рака молочной железы у женщин, способствовал увеличению продолжительности их жизни без прогрессирования заболевания, как было определено по основным параметрам, таким как продолжительность жизни без прогрессирования заболевания (PFS), по сравнению с продолжительностью жизни женщин, прошедших только химиотерапию.
Результаты данного исследования фазы III позволяют непосредственно подтвердить возможность применения антиангиогенных агентов в качестве терапевтических средств первого ряда для лечения пациентов с раком молочной железы, ранее не подвергаемого лечению. Добавление бевацизумаба, анти-VEGF антитела, к таксановой терапии (например, доцетакселом или частицами, связанными с белком паклитакселом (например, Abraxane®))/антрациклиновой терапии (например, доксорубицином, эпирубицином или их комбинациями) или терапии капецитабином приводило к клинически эффективному и статистически значимому улучшению состояния здоровья пациентов с раком молочной железы, как было определено, например, по продолжительности жизни без прогрессирования заболевания. У пациентов, подвергаемых лечению бевацизумабом и таксаном (например, частицами, связанными с белком доцетакселом или паклитакселом (например, Abraxane®))/антрациклином (например, доксорубицином, эпирубицином или их комбинациями), средняя PFS (месяцы) (95% CI) составляла 9,2 месяца (8,6, 10,1), а у индивидуумов, подвергаемых лечению таксаном/антрациклином без бевацизумаба, PFS составляла 8,0 месяца (6,7, 8,4), где HR (95% CI) составляла 0,644 (0,522, 0,795), а p-величина (логранговый критерий) составляла менее чем 0,0001. См. таблицу 2. На фигуре 3 приводятся величины для PFS, оцененные исследователем (INV), и величины для PFS, оцененные независимой экспертной комиссией (IRC). У пациентов, подвергаемых лечению бевацизумабом и капецитабином, средняя PFS (95% CI) составляла 8,6 месяца (8,1, 9,5), а у пациентов, подвергаемых лечению капецитабином без бевацизумаба, PFS составляла 5,7 месяца (4,3, 6,2), где HR (95% CI) составляла 0,688 (0,564, 0,840), а p-величина (логранговый критерий) составляла 0,0002. См. таблицу 2. На фигуре 2 приводятся величины для PFS, оцененные исследователем (INV), и величины для PFS, оцененные независимой экспертной комиссией (IRC). См. таблицу 3 для вторых конечных параметров, где величину PFS делили на число подгрупп, прошедших химиотерапию. См. фигуры 4 и 6, где указаны результаты анализов PFS для подгрупп различных групп пациентов, например, подвергнутых лечению капецитабином и Т/антрациклином, как показано на фигуре 4, и Т/антрациклином, как показано на фигуре 6. См. фигуру 5, где указаны объективные показатели отклика (ORR), и таблицу 2. Из всех респондеров, средняя продолжительность объективного ответа была выше у пациентов обеих групп, относящихся к ветви испытания с применением бевацизумаба: группа капецитабина - 9,2 месяца (95% CI: 8,5-10,4) и 7,2 месяца (95% CI: 5,1-9,3); и группа таксана/антрациклина, 8,3 месяца (95% CI: 7,2-10,7) и 7,1 месяца (95% CI: 6,2-8,8). См. таблицу 4, где приводятся подробные данные по общей продолжительности жизни. Каких-либо неожиданностей относительно фактора безопасности не наблюдалось. Безопасность соответствовала результатам предварительных исследований с применением бевацизумаба. См. таблицу 5, где систематизированы данные по безопасности. Такая положительная динамика была клинически эффективной.
(0,522, 0,795)
(0,564, 0,840)
(0,774, 1,376)
(0,631, 1,138)
Систематизированные данные по безопасности
** Кроме AE, связанных с прогрессированием метастазирующего рака молочной железы
SAE - серьезные побочные эффекты
Добавление бевацизумаба к схемам химиотерапии на основе капецитабина, таксана или антрациклина, применяемым при лечении метастазирующего рака молочной железы в качестве терапии 1-го ряда, приводило к статистически значимому увеличению PFS с профилем безопасности, сравнимым с профилем безопасности, наблюдаемым в предварительных исследованиях фазы III.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИАНГИОГЕННАЯ ТЕРАПИЯ ДЛЯ ЛЕЧЕНИЯ РАНЕЕ ПОДВЕРГАВШЕГОСЯ ЛЕЧЕНИЮ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2010 |
|
RU2576027C2 |
| АНТИТЕЛА ПРОТИВ PD-1 ДЛЯ ЛЕЧЕНИЯ РАКА ЛЕГКИХ | 2018 |
|
RU2771759C2 |
| КОМБИНАЦИИ И СПОСОБЫ ВВЕДЕНИЯ ТЕРАПЕВТИЧЕСКИХ АГЕНТОВ И КОМБИНИРОВАННАЯ ТЕРАПИЯ | 2013 |
|
RU2673805C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ И ДИАГНОСТИКИ РЕЗИСТЕНТНОГО К ХИМИОТЕРАПИИ РАКА | 2015 |
|
RU2710735C2 |
| VEGF ПОЛИМОРФИЗМ И АНТИАНГИОГЕНЕЗНАЯ ТЕРАПИЯ | 2013 |
|
RU2635525C2 |
| ЛЕЧЕНИЕ АНТИТЕЛАМИ ПРОТИВ VEGF | 2004 |
|
RU2519669C2 |
| СПОСОБЫ ДИАГНОСТИКИ И КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ РАКА | 2013 |
|
RU2666627C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ ДЛЯ ЛЕЧЕНИЯ ГЛИОБЛАСТОМЫ | 2014 |
|
RU2692075C2 |
| VEGF ПОЛИМОРФИЗМ И АНТИ-АНГИОГЕНЕЗНАЯ ТЕРАПИЯ | 2008 |
|
RU2482491C2 |
| БИОЛОГИЧЕСКИЕ МАРКЕРЫ ДЛЯ ИДЕНТИФИКАЦИИ ПАЦИЕНТОВ ДЛЯ ЛЕЧЕНИЯ АНТАГОНИСТАМИ VEGF | 2013 |
|
RU2659173C2 |

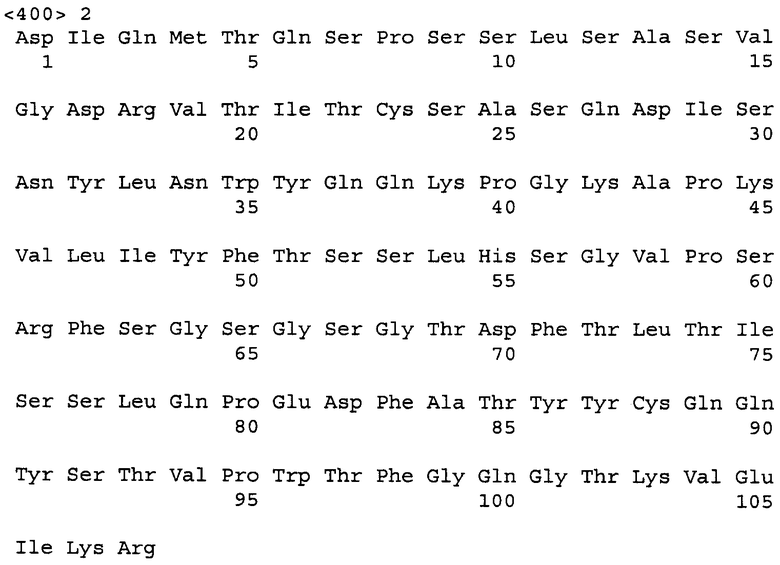
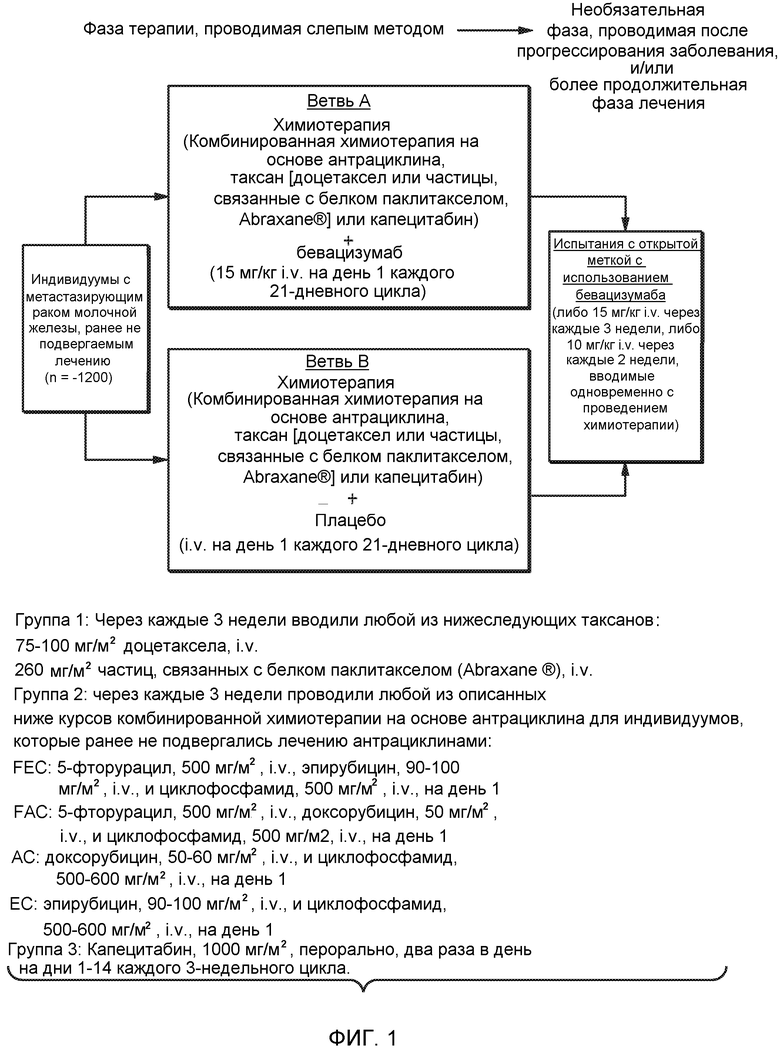
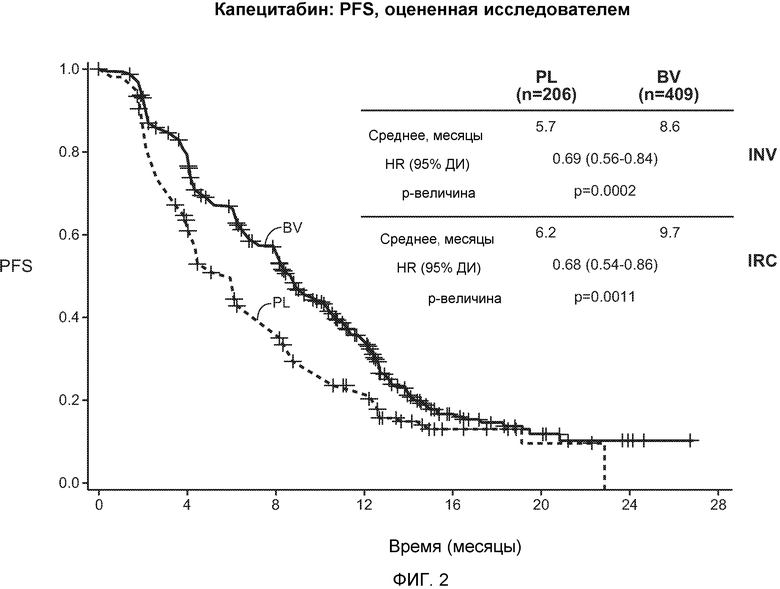
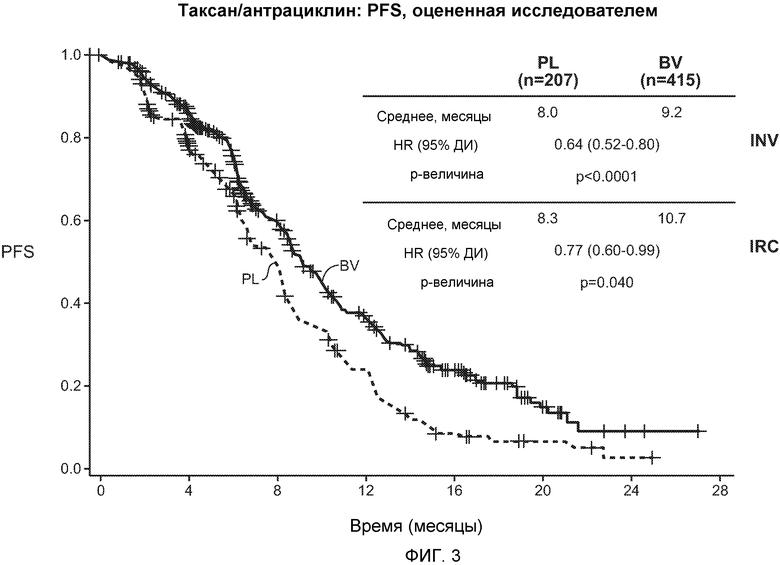
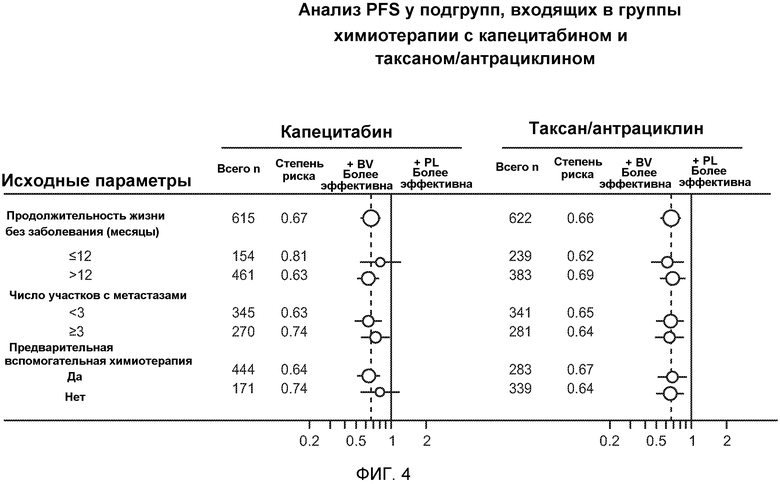
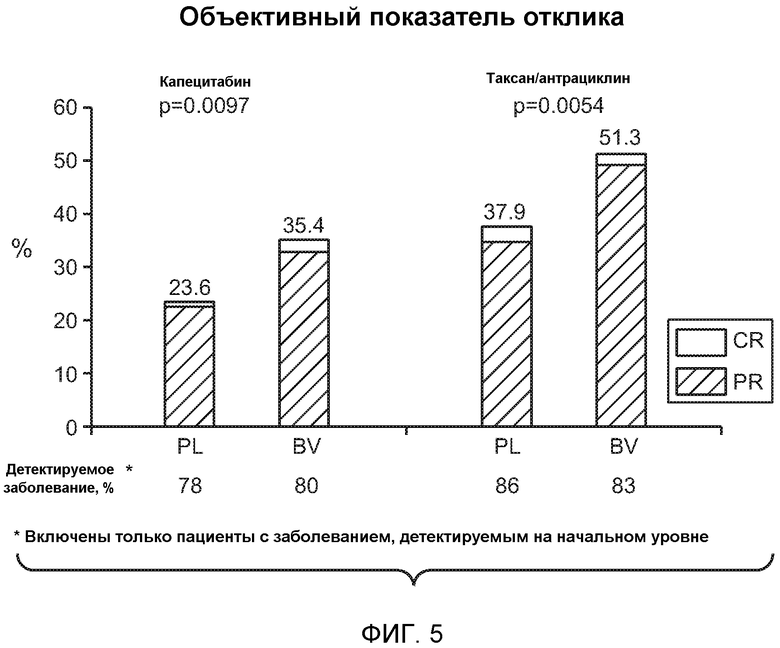
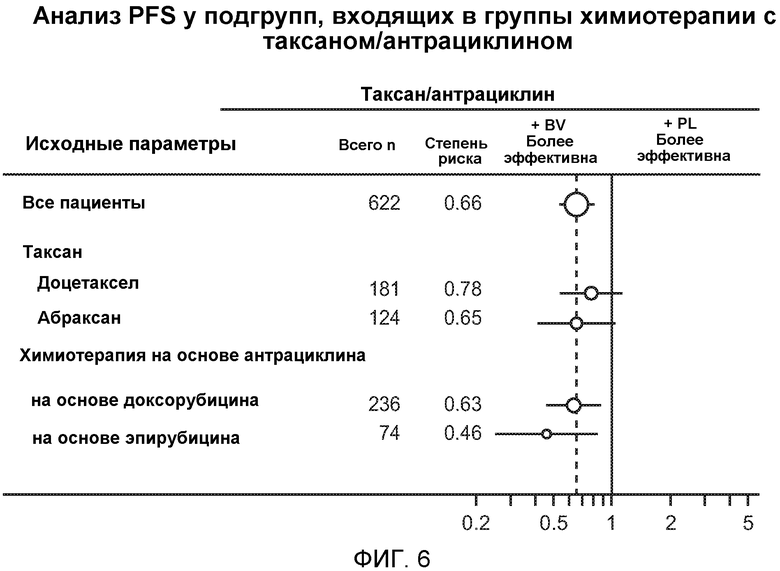
Группа изобретений относится к способу лечения индивидуума, у которого был диагностирован локально рецидивирующий или метастазирующий рак молочной железы. Для этого индивидууму вводят эффективное количество химиотерапевтического средства и анти-VEGF антитела (бевацизумаб), где химиотерапевтическое средство представляет собой или (а) капецитабин, (b) доцетаксел или Abraxane, (с) или антрациклин, и где анти-VEGF антитело вводится при 15 мг/кг. При этом указанному индивидууму не вводили какое-либо химиотерапевтическое средство для лечения локально рецидивирующего или метастазирующего рака молочной железы, и/или указанный индивидуум не проходил предварительную вспомогательную химиотерапию при рецидиве в течение 12 месяцев или менее после введения последней дозы. Также предложены анти-VEGF антитело, применение анти-VEGF антитела и наборы, содержащие анти-VEGF антитело в комбинации с химиотерапевтическим средством для лечения метастазирующего рака молочной железы. Группа изобретений обеспечивает увеличение продолжительности жизни индивидуума без прогрессирования заболевания. 5 н. и 35 з.п. ф-лы, 6 ил., 5 табл., 1 пр.
1. Способ лечения индивидуума, у которого был диагностирован локально рецидивирующий или метастазирующий рак молочной железы, где указанный способ включает проведение указанному индивидууму схемы лечения, включающей введение эффективного количества по меньшей мере одного химиотерапевтического средства и анти-VEGF антитела, где по меньшей мере одно химиотерапевтическое средство представляет собой или (а) капецитабин, (b) доцетаксел или Abraxane, (с) или антрациклин, и где анти-VEGF антитело вводится при 15 мг/кг, и где указанному индивидууму не вводили какое-либо химиотерапевтическое средство для лечения локально рецидивирующего или метастазирующего рака молочной железы, и/или указанный индивидуум не проходил предварительную вспомогательную химиотерапию при рецидиве в течение 12 месяцев или менее после введения последней дозы, и где указанная схема лечения эффективно способствовала увеличению продолжительности жизни индивидуума без прогрессирования заболевания.
2. Способ по п.1, где указанным химиотерапевтическим средством являются капецитабин, таксан, антрациклин, паклитаксел, доцетаксел, частицы, связанные с белком паклитакселом, доксорубицин, эпирубицин, 5-фторурацил, циклофосфамид или их комбинации.
3. Способ по п.1, где указанная схема лечения с использованием химиотерапевтического средства включает введение FEC: 5-фторурацила, эпирубицина и циклофосфамида, или FAC: 5-фторурацила, доксорубицина и циклофосфамида, или АС: доксорубицина и циклофосфамида, или ЕС: эпирубицина и циклофосфамида.
4. Способ по п.1, где указанное анти-VEGF антитело связывается с тем же самым эпитопом, с которым связывается анти-VEGF антитело А4.6.1, продуцируемое гибридомой АТСС НВ 10709.
5. Способ по п.1, где указанным анти-VEGF антителом является гуманизованное антитело.
6. Способ по п.1, где указанный индивидуум является HER2-негативным.
7. Способ по п.1, где указанным анти-VEGF антителом является бевацизумаб.
8. Способ по п.1, где указанным анти-VEGF антителом является бевацизумаб, а химиотерапевтическим средством является капецитабин.
9. Способ по п.8, где капецитабин вводят перорально в дозе 1000 мг/м2 два раза в день на дни 1-14 каждого 3-недельного цикла, а бевацизумаб вводят внутривенно в дозе 15 мг/кг на день 1 каждого 21-дневного цикла.
10. Способ по п.7, где бевацизумаб вводят внутривенно в дозе 15 мг/кг на день 1 каждого 21-дневного цикла, и где химиотерапевтическими средствами являются доцетаксел, который вводят внутривенно в дозе 75-100 мг/м2, или частицы, связанные с белком паклитакселом, которые вводят внутривенно в дозе 260 мг/м2 через каждые 3 недели, или FEC: 5-фторурацил, который вводят внутривенно в дозе 500 мг/м2, эпирубицин, который вводят внутривенно в дозе 90-100 мг/м2, и циклофосфамид, который вводят внутривенно в дозе 500 мг/м2 на день 1, или FAC: 5-фторурацил, который вводят внутривенно в дозе 500 мг/м2, доксорубицин, который вводят внутривенно в дозе 50 мг/м2, и циклофосфамид, который вводят внутривенно в дозе 500 мг/м2 на день 1, или АС: доксорубицин, который вводят внутривенно в дозе 50-60 мг/м2, и циклофосфамид, который вводят внутривенно в дозе 500-600 мг/м2 на день 1, или ЕС: эпирубицин, который вводят внутривенно в дозе 90-100 мг/м2, и циклофосфамид, который вводят внутривенно в дозе 500-600 мг/м2 на день 1, через каждые три недели.
11. Способ по п.1, где продолжительность жизни индивидуума без прогрессирования заболевания увеличивается по меньшей мере примерно на 1 месяц или более по сравнению с продолжительностью жизни другого индивидуума, прошедшего только химиотерапию.
12. Способ по п.1, где продолжительность жизни индивидуума без прогрессирования заболевания увеличивается по меньшей мере примерно на 2,9 месяца по сравнению с продолжительностью жизни другого индивидуума, прошедшего только химиотерапию.
13. Способ по п.1, где указанное анти-VEGF антитело имеет вариабельную область тяжелой цепи, содержащую нижеследующую аминокислотную последовательность:
EVQLVESGGG LVQPGGSLRL SCAASGYTFT NYGMNWVRQA PGKGLEWVGW
INTYTGEPTY AADFKRRFTF SLDTSKSTAY LQMNSLRAED
TAVYYCAKYP HYYGSSHWYF DVWGQGTLVT VSS (SEQ ID NO:1)
и вариабельную область легкой цепи, содержащую нижеследующую
аминокислотную последовательность:
DIQMTQSPSS LSASVGDRVT ITCSASQDIS NYLNWYQQKP GKAPKVLIYF
TSSLHSGVPS RFSGSGSGTD FTLTISSLQP EDFATYYCQQ YSTVPWTFGQ
GTKVEIKR (SEQ ID NO:2).
14. Набор для лечения метастазирующего рака молочной железы у человека, включающий упаковку, содержащую композицию анти-VEGF антитела и инструкции по применению композиции анти-VEGF антитела при 15 мг/кг в комбинации с или (а) терапией доцетакселом или Abraxane, или (b) терапией антрациклином в качестве терапии первого ряда.
15. Набор для лечения метастазирующего рака молочной железы у человека, включающий упаковку, содержащую композицию анти-VEGF антитела и инструкции по применению композиции анти-VEGF антитела при 15 мг/кг в комбинации с терапией капецитабином в качестве терапии первого ряда.
16. Набор по п.14 или 15, где анти-VEGF антителом является бевацизумаб.
17. Набор по любому из п.п.14 или 15, где указанный индивидуум ранее не проходил лечение.
18. Набор по п.14 или 15, где указанный индивидуум является HER2-негативным.
19. Применение анти-VEGF антитела для для лечения локально рецидивирующего или метастазирующего рака молочной железы у индивидуума путем введения эффективного количества по меньшей мере одного химиотерапевтического средства и анти-VEGF антитела, где по меньшей мере одно химиотерапевтическое средство представляет собой или (а) капецитабин, (b) доцетаксел или Abraxane, (с) или антрациклин, и где анти-VEGF антитело вводится при 15 мг/кг, где указанный индивидуум не проходил какую-либо химиотерапию по поводу локально рецидивирующего или метастазирующего рака молочной железы, и/или указанный индивидуум не проходил предварительную вспомогательную химиотерапию при рецидиве в течение 12 месяцев или менее после введения последней дозы, и где указанное применение эффективно способствует увеличению продолжительности жизни индивидуума без прогрессирования заболевания, а указанное лекарственное средство также включает по меньшей мере одно химиотерапевтическое средство.
20. Применение по п.19, где указанным химиотерапевтическим средством являются капецитабин; таксан; антрациклин; паклитаксел; доцетаксел; частицы, связанные с белком паклитакселом; доксорубицин; эпирубицин; 5-фторурацил; циклофосфамид; или их комбинации.
21. Применение по п.19, где указанными химиотерапевтическими средствами являются: FEC: 5-фторурацил, эпирубицин и циклофосфамид, или FAC: 5-фторурацил, доксорубицин и циклофосфамид, или АС: доксорубицин и циклофосфамид, или ЕС: эпирубицин и циклофосфамид.
22. Применение по п.19, где указанным анти-VEGF антителом является гуманизованное антитело.
23. Применение по п.19, где указанным анти-VEGF антителом является бевацизумаб.
24. Применение по п.19, где указанный индивидуум является HER2-негативным.
25. Применение по п.19, где указанным анти-VEGF антителом является бевацизумаб, а химиотерапевтическим средством является капецитабин.
26. Применение по п.25, где капецитабин вводят перорально в дозе 1000 мг/м2 два раза в день на дни 1-14 каждого 3-недельного цикла, а бевацизумаб вводят внутривенно в дозе 15 мг/кг на день 1 каждого 21-дневного цикла.
27. Применение по п.23, где бевацизумаб вводят внутривенно в дозе 15 мг/кг на день 1 каждого 21-дневного цикла, и где химиотерапевтическими средствами являются доцетаксел, который вводят внутривенно в дозе 75-100 мг/м2, или частицы, связанные с белком паклитакселом, которые день вводят внутривенно в дозе 260 мг/м2 через каждые 3 недели, или FEC: 5-фторурацил, который вводят внутривенно в дозе 500 мг/м2, эпирубицин, который вводят внутривенно в дозе 90-100 мг/м2, и циклофосфамид, который вводят внутривенно в дозе 500 мг/м2 на день 1, или FAC: 5-фторурацил, который вводят внутривенно в дозе 500 мг/м2, доксорубицин, который вводят внутривенно в дозе 50 мг/м2, и циклофосфамид, который вводят внутривенно в дозе 500 мг/м2 на день 1, или АС: доксорубицин, который вводят внутривенно в дозе 50-60 мг/м2, и циклофосфамид, который вводят внутривенно в дозе 500-600 мг/м2 на день 1, или ЕС: эпирубицин, который вводят внутривенно в дозе 90-100 мг/м2, и циклофосфамид, который вводят внутривенно в дозе 500-600 мг/м2 на день 1, через каждые три недели.
28. Применение по п.19, где продолжительность жизни индивидуума без прогрессирования заболевания увеличивается по меньшей мере примерно на 1 месяц или более по сравнению с продолжительностью жизни другого индивидуума, прошедшего только химиотерапию.
29. Применение по п.19, где продолжительность жизни индивидуума без прогрессирования заболевания увеличивается по меньшей мере примерно на 2,9 месяца по сравнению с продолжительностью жизни другого индивидуума, прошедшего только химиотерапию.
30. Анти-VEGF антитело, используемое в способе лечения локально рецидивирующего или метастазирующего рака молочной железы у индивидуума, где указанный способ включает проведение указанному индивидууму схемы лечения, включающей введение эффективного количества по меньшей мере одного химиотерапевтического средства и анти-VEGF антитела, где по меньшей мере одно химиотерапевтическое средство представляет собой или (а) капецитабин, (b) доцетаксел или Abraxane, (с) или антрациклин, и где анти-VEGF антитело вводится при 15 мг/кг, и где указанный индивидуум не проходил какую-либо химиотерапию по поводу локально рецидивирующего или метастазирующего рака молочной железы и/или какую-либо предварительную вспомогательную химиотерапию при рецидиве в течение 12 месяцев или менее после введения последней дозы, и где указанная схема лечения является эффективной в отношении увеличения продолжительности жизни индивидуума без прогрессирования заболевания.
31. Анти-VEGF антитело по п.30, где указанным химиотерапевтическим средством является капецитабин; таксан; антрациклин; паклитаксел; доцетаксел; частицы, связанные с белком паклитакселом; доксорубицин; эпирубицин; 5-фторурацил; циклофосфамид; или их комбинации.
32. Анти-VEGF антитело по п.30, где указанными химиотерапевтическими средствами, применяемыми в схеме лечения, являются: FEC: 5-фторурацил, эпирубицин и циклофосфамид, или FAC: 5-фторурацил, доксорубицин и циклофосфамид, или АС: доксорубицин и циклофосфамид, или ЕС: эпирубицин и циклофосфамид.
33. Анти-VEGF антитело по п.30, где указанным анти-VEGF антителом является гуманизованное антитело.
34. Анти-VEGF антитело по п.30, где указанным анти-VEGF антителом является бевацизумаб.
35. Анти-VEGF антитело по п.30, где указанный индивидуум является HER2-негативным.
36. Анти-VEGF антитело по п.30, где указанным анти-VEGF антителом является бевацизумаб, а химиотерапевтическим средством является капецитабин.
37. Анти-VEGF антитело по п.36, где капецитабин вводят перорально в дозе 1000 мг/м2 два раза в день на дни 1-14 каждого 3-недельного цикла, а бевацизумаб вводят внутривенно в дозе 15 мг/кг на день 1 каждого 21-дневного цикла.
38. Анти-VEGF антитело по п.34, где бевацизумаб вводят внутривенно в дозе 15 мг/кг на день 1 каждого 21-дневного цикла, и где химиотерапевтическими средствами являются доцетаксел, который вводят внутривенно в дозе 75-100 мг/м2, или частицы, связанные с белком паклитакселом, которые вводят внутривенно в дозе 260 мг/м2 через каждые 3 недели, или FEC: 5-фторурацил, который вводят внутривенно в дозе 500 мг/м2, эпирубицин, который вводят внутривенно в дозе 90-100 мг/м2, и циклофосфамид, который вводят внутривенно в дозе 500 мг/м2 на день 1, или FAC: 5-фторурацил, который вводят внутривенно в дозе 500 мг/м2, доксорубицин, который вводят внутривенно в дозе 50 мг/м2, и циклофосфамид, который вводят внутривенно в дозе 500 мг/м2 на день 1, или АС: доксорубицин, который вводят внутривенно в дозе 50-60 мг/м2, и циклофосфамид, который вводят внутривенно в дозе 500-600 мг/м2 на день 1, или ЕС: эпирубицин, который вводят внутривенно в дозе 90-100 мг/м2, и циклофосфамид, который вводят внутривенно в дозе 500-600 мг/м2 на день 1 через каждые три недели.
39. Анти-VEGF антитело по п.30, где продолжительность жизни индивидуума без прогрессирования заболевания увеличивается по меньшей мере примерно на 1 месяц или более по сравнению с продолжительностью жизни другого индивидуума, прошедшего только химиотерапию.
40. Анти-VEGF антитело по п.30, где продолжительность жизни индивидуума без прогрессирования заболевания увеличивается по меньшей мере примерно на 2,9 месяца по сравнению с продолжительностью жизни другого индивидуума, прошедшего только химиотерапию.
| WO 2008094969 A2, 07.08.2008 | |||
| US 20050186208 A1, 25.08.2005 | |||
| CAMERON D., Bevacizumab in the first-line treatment of metastatic breast cancer, EJC Supplements 2008, Issue 6, N 6, P.21-28 |
Авторы
Даты
2014-10-27—Публикация
2009-11-20—Подача