Область техники, к которой относится изобретение
Изобретение относится к гуманизированным антителам против альфа-интерферона человека (IFN-α) и их применению для лечения и профилактики разных заболеваний и нарушений у человека.
Уровень техники
На основании разных исследований установлено, что альфа-интерферон (IFN-α) является цитокином, опосредующим целый ряд аутоиммунных заболеваний. Несмотря на то что у субъектов, страдающих системной красной волчанкой (SLE), в сыворотке часто отсутствует IFN-α на измеряемом уровне, у них, по-видимому, четко выражено присутствие гена IFN-α. Кроме того, индукция созревания дендритных клеток (DC) в сыворотке субъекта, страдающего SLE, может быть ингибирована антителом против IFN-α. Установлено, что удаление рецептора IFN-α/β у новозеландских черных мышей (NZB) с фенотипом SLE позволяет получить почти нормальный фенотип (Santiago-Raber et al., J. Exp. Med. 2003; 197(6):777-88).
Поэтому было предложено использовать антитела против IFN-α отдельно или в комбинации в качестве средства нейтрализации активности данного цитокина с целью лечения таких аутоиммунных заболеваний. Были созданы и исследованы специфические мышиные антитела (АСО-1 - АСО-6), узнающие разные подтипы IFN-α, которые описаны в публикации международной заявки на патент WO20060086586. Однако мышиные антитела из-за своей иммуногенности не могут быть использованы для лечения человека, поэтому желательно создать гуманизированные антитела, в которых мышиные области, определяющие комплементарность, (CDR), присоединены к остову антитела человека. Однако гуманизированные антитела часто характеризуются функциональной недостаточностью по сравнению с исходным мышиным антителом, например более низким сродством связывания, и/или устойчивостью, и/или нежелательной иммуногенностью. Такая недостаточность гуманизированных антител в некоторых случаях может быть компенсирована путем выполнения одной или более обратных точковых мутаций. Обычно желательно, чтобы обратные точковые мутации отсутствовали или присутствовали в незначительном количестве, так как наличие слишком большого количества обратных мутаций вызывает нежелательную низкую устойчивость и/или нежелательную степень иммуногенности. Таким образом, необходимо безопасное и устойчивое гуманизированное антитело против IFN-α, обладающее требуемыми биологическими свойствами, такими как, например, сохранение сродства связывания и активности гуманизированного антитела против IFN-α в отношении большого числа подтипов IFN-α.
Таким образом, в данной области существует потребность в гуманизированных антителах против IFN-α, обладающих требуемыми свойствами, такими как, например, устойчивость, специфичность, безопасность, иммуногенность и т.д. Кроме того, в данной области существует потребность в эффективных методах получения таких антител.
Сущность изобретения
Первым объектом настоящего изобретения является гуманизированное антитело, специфически связывающееся с α-интерфероном (IFN-α) человека, или его антигенсвязывающий фрагмент, причем указанное антитело представляет собой гуманизированный вариант мышиного антитела АСО-1 или АСО-2 либо их комбинации, включающий меньше донорских аминокислотных остатков, чем мышиные области, определяющие комплементарность, (CDR) по Кабату.
Другим объектом настоящего изобретения далее является гуманизированное антитело, специфически связывающееся с IFN-α, или его антигенсвязывающий фрагмент, в частности, указанное антитело может связываться с подтипами IFN-α А, 2, В2, С, F, G, H2, I, J1, K, 4a, 4b и WA, но не связывается с подтипами 1 или D, при этом указанное антитело содержит меньше донорских аминокислотных остатков, чем CDR-области, отличные от человеческих, по Кабату.
Настоящее изобретение далее относится к способам получения таких антител, а также к применению указанных антител для терапевтических целей и композициям, включающим такие антитела.
Антитела по настоящему изобретению могут быть пригодны для лечения разных воспалительных заболеваний.
Краткое описание чертежей
На фиг.1 показан анализ последовательностей VH-области (A) и VL-области (B) мышиного антитела АСО-1 с целью гуманизации (hz = гуманизированное антитело), где маска заштрихована, CDR-области Кабата показаны жирным шрифтом, различия между мышиной последовательностью и последовательностью зародышевых клеток человека подчеркнуты, возможные соматические сверхмутированные остатки показаны жирным подчеркнутым шрифтом, и возможные остатки с обратными мутациями заштрихованы и подчеркнуты. VH-область АСО-1 = SEQ ID NO:1; VH1_46/JH4 зародышевых клеток человека = SEQ ID NO:2; VH-область hzACO-1 = SEQ ID NO:3; VL-область АСО-1 = SEQ ID NO:4; VKIII_L6/JK2 зародышевых клеток человека = SEQ ID NO:5; VL-область hzACO-1 = SEQ ID NO:6.
На фиг.2 показан сравнительный анализ последовательностей VH-области (A) и VL-области (B) АСО-1 и АСО-2, а также соответствующих последовательностей зародышевых клеток мыши. VH-область ACO-2 = SEQ ID NO:7; J558.33/D_/JH3_1 зародышевых клеток мыши = SEQ ID NO:8; VL-область АСО-2 = SEQ ID NO:9; ae4/JK_1 зародышевых клеток мыши = SEQ ID NO:10.
На фиг.3 показано расположение остатков АСО-2, выбранных для введения в антитело hzACO-1.
На фиг.4 показано ингибирование антителом hzACO-1 защитного действия всех испытанных подтипов интерферона за исключением IFN-αD и IFN-α1 при выполнении анализа СРЕ.
На фиг.5 показано ингибирование антителом hzACO-1 12 видов IFN-α при выполнении анализа с использованием гена-репортера. Значения для каждой концентрации антитела были нормализованы, при этом было вычислено среднее значение для четырех испытаний. Данные представлены в виде среднего значения ± стандартные ошибки. Сигмоидальные кривые реакции с наилучшим приближением вычисляли при помощи программного обеспечения Prism. Значения R2 для всех приведенных выше наборов данных были равны 0,98 (за исключением IFN-αD, для которого подбор кривой по точкам не производили).
На фиг.6 показано сравнение результатов анализа с использованием гена-репортера (RG) антитела hzACO-1 с вариантами hzACO-1, содержащими единичную мутацию A93V из АСО-2, при использовании IFN-αА (А) или IFN-αF (B). Данные вычисляли так же, как на фиг.5.
На фиг.7 показаны температуры перехода для антитела hzACO-1 и вариантов при рН 3,5 (А), 4,5 (В) и 5,5 (С) без использования добавок.
На фиг.8 показана структура цепей (H, L) Fab-фрагмента антитела hzACO-1, связанных с IFN-α8, определенная при помощи рентгеновской кристаллографии.
На фиг.9 показаны эпитопы связывания IFN-α8 для IFNAR1 и IFNAR2 (Quadt-Akabayov S.R. et al., Protein Sci. 15, 2656-2668, 2006, Roisman L.C. et al., J. Mol. Biol. 353, 271-281, 2005), изображенные цветными рамками под последовательностью IFN-α8. Остатки, отмеченные рамками серого цвета, сохранены частично во всех подтипах IFN-α, в то время как остатки, отмеченные рамками черного цвета, сохранены полностью. Эпитоп связывания антитела hzACO-1 с отсечкой длины 4 Å на IFN-α8 отмечен символом "*" над аминокислотной последовательностью IFN-α8.
На фиг.10 показано сравнение моноклонального антитела (mAb) АСО-1 с антителом hzACO-1 и его двумя вариантами при выполнении анализа с использованием гена-репортера (RG). Один вариант является гуманизированным антителом АСО-1, содержащим всю последовательность CDRH2 (обозначение hzACO-1-CDRH2 Кабата), в то время как антитело hzACO-1 было создано с использованием более короткой последовательности CDRH2, описанной в примере 2. Кроме того, на данной фигуре показано другое мутированное антитело hzACO-1, которое было рационально оптимизировано для взаимодействия с IFN-α (hzACO-1 Y32E, T30R). Как показано, четыре указанных варианта рекомбинантного mAb сравнивали в отношении ингибирования пяти разных типичных подтипов IFN-α.
На фиг.11 показано исследование устойчивости белка hzACO-1, экспрессированного с изотипами IgG1, IgG2 и IgG4 человека. Агрегацию определяли методом ВЭЖХ после инкубации в гистидиновом буфере в течение 5 недель.
На фиг.12 показан анализ высвобождения 51Cr, иллюстрирующий отсутствие антителозависимой клеточно-опосредованной цитотоксичности (ADCC) у hzACO-1 IgG4, IFN-α и их разных комбинаций при различных соотношениях эффектора:клетки-мишени (Е:Т). Анализ с использованием клеток + только РВМС без IFN-α в присутствии hzACO-1 определяет фоновый лизис, и анализ с использованием Тритона-Х 100 иллюстрирует максимальный лизис. Ритуксан, использованный в качестве положительного контрольного образца, индуцирует обнаруживаемый лизис клеток при всех соотношениях Е:Т.
На фиг.13 показано исследование связывания комплемента методом ELISA. Антитело hzACO-1, экспрессированное в виде IgG4, не могло фиксировать комплемент при связывании с IFN-α. Антитело hzACO-1 в качестве положительного контрольного образца было перекрестно связано с поликлональным антителом (pAb) против IgG4, при этом было обнаружено связывание С4 с антителом против IgG4 в зависимости от дозы.
Подробное описание изобретения
Настоящее изобретение частично относится к антителам против IFN-α, обладающим свойствами, пригодными для лечения людей, страдающих IFN-α-обусловленным состоянием или заболеванием, таким как, например, волчанка, или нарушением, таким как, например, SLE, реакция "трансплантат против хозяина", диабет 1-го типа, СПИД, аутоиммунный тиреоидит, псориаз, юношеский дерматомиозит и синдром Шегрена. Указанные антитела обычно созданы на основе гуманизированных вариантов мышиных антител АСО-1 и/или АСО-2.
Было установлено, что антитела АСО-1 и АСО-2 могут блокировать биологическую активность тринадцати подтипов рекомбинантного IFN-α, а также двух комплексных смесей IFN, образующихся в результате вирусной инфекции (см. WO2006086586). Антитела АСО-1 и АСО-2 также согласованно блокировали биологическую активность сыворотки, полученной у субъектов, страдающих SLE, у которых были обнаружены признаки IFN-α при помощи микроматричного анализа. Антитела АСО-1 и АСО-2 не оказывали значительного нейтрализующего действия на биологическую активность белка IFN-α подтипов D и 1, но нейтрализовали биологическую активность IFN-α в сыворотке субъектов, страдающих SLE. Не ограничиваясь теорией, можно предположить, что подтипы D и 1 не участвуют в значительной степени в этиологии SLE.
Как описано в примерах, структурное моделирование вариабельных областей показало, что можно гуманизировать антитела АСО-1 и АСО-2, используя меньше донорских (мышиных) остатков, чем в CDR-областях Кабата, благодаря чему уменьшается риск вредного иммунного ответа у человека. Указанный анализ позволил также выявить благоприятные сайты для обратных мутаций. Кроме того, было установлено, что, вероятно, благодаря высокому сходству последовательностей вариабельных областей АСО-1 и АСО-2 (отличия обнаружены только в 13 сайтах) определенные аминокислотные остатки в последовательности гуманизированного антитела АСО-1 (hzACO-1) могут быть заменены остатками АСО-2 в соответствующем положении. В CDR-областях мутации обычно выполняют таким образом, чтобы длина последовательности антитела не была меньше, чем в человеческом антителе. В результате процесса гуманизации образуется гуманизированное антитело с улучшенными функциональными свойствами, такими как сродство связывания, устойчивость, уровень экспрессии и активность ингибирования IFN-α.
В гуманизированном антителе АСО-1 типичные мутации в VH-области антитела hzACO-1 (SEQ ID NO:3) включают V5Q, T28S, M69L, R71V, T73K, S76I, S76N, T77I, V78A, Y79F и A93V, а также любую их комбинацию при использовании нумерации Кабата. Типичные мутации в VL-области антитела hzACO-1 (SEQ ID NO:6) включают E1Q, D29G, L33F, L47W, S50G, I58V и F71Y, а также любую их комбинацию. В одном варианте осуществления изобретения VH-область антитела hzACO-1 включает мутацию, выбираемую из T28S, N31S и A93V. В другом варианте осуществления изобретения VH-область антитела hzACO-1 включает мутацию, выбираемую из T28S, N31S и A93V, и любую их комбинацию, такую как, например, T28S и N31S, T28S и A93V, N31S и A93V. В другом варианте осуществления изобретения VH-область антитела hzACO-1 включает мутацию, выбираемую из T28S, N31S и A93V, или их комбинацию, такую как, например, T28S и N31S, T28S и A93V или N31S и A93V, и по меньшей мере одну дополнительную мутацию.
Определения терминов
Для облечения понимания настоящего изобретения ниже дано определение ряда терминов.
"Антитела АСО-1 и АСО-2" исследованы и описаны в публикации WO20060086586. Антитело АСО-1 депонировано в АТСС под № доступа РТА-6557 (WO2006086586), и антитело АСО-2 депонировано в АТСС под № доступа РТА-7778 (WO2008021976). Антитела по настоящему изобретению являются гуманизированными вариантами антител АСО-1 и АСО-2. Однако гуманизированные варианты антител АСО-1 и АСО-2 по настоящему изобретению не включают непроцессированные мышиные последовательности Кабата. В предпочтительном варианте осуществления изобретения по меньшей мере одна из последовательностей CDR усечена примерно на 3-10 аминокислот, предпочтительно на 3-8, еще предпочтительнее на 4-7 аминокислот. Указанное антитело предпочтительно усечено в CDR H2, причем указанная область CDR H2 усечена на 3-10, предпочтительно на 3-8, еще предпочтительнее на 4-7 и наиболее предпочтительно на 6 аминокислот. Кроме того, в одну или более последовательностей CDR, а также в остов антитела человека могут быть введены отдельные точковые мутации. В определение термина "антитела АСО-1 и АСО-2" далее может входить любое антитело против IFN-α, способное связываться с подтипами IFN-α А, 2, В2, С, F, G, H2, I, J1, K, 4a, 4b и WA, но не связывающееся с подтипами 1 или D. Однако следует отметить, что антитела АСО-1 и АСО-2 можно рассматривать как одно антитело, так как их последовательности CDR отличаются только несколькими аминокислотами. Вполне вероятно, что антитела АСО-1 и АСО-2 представляют собой две стадии соматической сверхмутации in vivo одного антитела. Таким образом, антитело АСО-1/АСО-2 по настоящему изобретению является гуманизированным антителом, включающим последовательности CDR, которые по меньшей мере на 90% идентичны последовательностям CDR антител АСО-1 и АСО-2, более предпочтительно по меньшей мере на 92% и наиболее предпочтительно по меньшей мере на 95%.
Термины "усечение CDR", "прямая мутация" и "укорачивание CDR" имеют взаимозаменяемые значения в настоящем описании изобретения. В связи с настоящим изобретением такие термины обычно служат для определения того, что усечение CDR может быть выполнено в виде нескольких прямых мутаций в ряду, из чего следует, что укороченный мышиный фрагмент CDR может быть соединен с человеческим остовом. Неудивительно, что присоединение более коротких CDR-областей позволяет получить антитела с меньшей степенью иммуногенности, удивительным является то, что при этом сохраняются благоприятные свойства гуманизированного антитела, такие как, например, устойчивость, специфичность и т.д. Термин "обратные мутации" всегда означает мутации в остове (то есть не в CDR-областях), при этом обратные мутации обычно представляют собой введение в выбранные сайты одного или более "мышиных" аминокислотных остатков, например, для стабилизации структуры антитела.
Термин "альфа-интерферон" (IFN-α) в использованном здесь значении означает семейство белков, включающих некоторые из основных эффекторов врожденного иммунитета. Существует по меньшей мере 15 известных подтипов IFN-α человека. Названия подтипов белка IFN-α и соответствующих кодирующих генов приведены в нижеследующей таблице 1.
Подтипы белка IFN-α и гены
См. публикацию Pestka et al. (1997) "Interferon Standardization and Designations". J. Interferon Cytokin Res. 17: Supplement 1, S9-S14. IFN-αВ2 иногда также определяется как IFN-αВ, не следует путать с IFN-β. Природный IFN-α из лейкоцитов (IFN- лейкоцитов), а также рекомбинантные подтипы белка IFN-α человека можно приобрести в компании PBK Biomedical Labs, Piscataway, NJ (interferonsource.com). Природный IFN-α представляет собой комплексную смесь подтипов IFN-α. В данной области известны методы обнаружения и количественного определения указанных интерферонов, такие как ELISA и RIA.
Термин "антитело" использован в настоящем описании изобретения в самом широком смысле и означает непроцессированные моноклональные антитела, поликлональные антитела и, за исключением особо оговоренных или противоречащих контексту случаев, антигенсвязывающие фрагменты, варианты антител и их полиспецифические молекулы, если они обладают требуемой биологической активностью. Как правило, непроцессированное антитело является гликопротеином, включающим по меньшей мере две тяжелые (Н) цепи и две легкие (L) цепи, соединенные дисульфидными связями, или его антигенсвязывающей частью. Каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (сокращенно определяемой как VH) и константной области тяжелой цепи. Константная область тяжелой цепи состоит из трех доменов, СН1, СН2 и СН3. Каждая легкая цепь состоит из вариабельной области легкой цепи (сокращенно определяемой как VL) и константной области легкой цепи. Константная область легкой цепи состоит из одного домена, CL. VH- и VL-области далее могут быть подразделены на гипервариабельные участки, именуемые областями, определяющими комплементарность (CDR), между которыми расположены более консервативные области, именуемые остовными областями (FR). Все VH- и VL-области состоят из трех CDR и четырех FR, расположенных в направлении от аминоконца к карбоксиконцу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные области тяжелых и легких цепей содержат связывающий домен, который взаимодействует с антигеном.
"Антигенсвязывающий фрагмент" антитела является молекулой, которая включает часть непроцессированного антитела, способную связываться в антигеном с возможностью обнаружения. Антигенсвязывающие фрагменты представляют собой поливалентные молекулы, содержащие одну, две, три или больше антигенсвязывающих частей антитела, и одноцепочечные конструкции, в которых VL- и VH-области или их выбранные части связаны синтетическими линкерами или методами рекомбинантных ДНК с образованием функциональной антигенсвязывающей молекулы.
Термины "производное антитело" и "иммуноконъюгат" имеют взаимозаменяемые значения и означают молекулы, включающие непроцесированное антитело или его антигенсвязывающий фрагмент, в котором одна или более аминокислот химически модифицированы, например, путем алкилироваания, пегилирования, ацилирования, образования сложного эфира или амида или подобным образом, например, для связывания данного антитела с другой молекулой. Типичные модификации включают пегилирование, цистеин-пегилирование, биотинилирование, мечение радиоактивным изотопом и конъюгирование с другим агентом, таким как обнаруживаемый или цитотоксический агент.
"Полиспецифическая молекула" представляет собой антитело или его антигенсвязывающий фрагмент, которое ассоциировано или связано по меньшей мере с одной другой функциональной молекулой (например, с другим пептидом или белком, таким как другое антитело или лиганд для рецептора) с образованием молекулы, которая связывается по меньшей мере с двумя разными сайтами связывания или молекулами-мишенями. Типичные полиспецифические молекулы включают биспецифические антитела и антитела, связанные с растворимыми фрагментами рецептора или лигандами.
"Гуманизированное" антитело является человеческим/отличным от человеческого химерным антителом, содержащим минимальную последовательность (CDR-области), выделенную из иммуноглобулина, отличного от человеческого. Таким образом, гуманизированные антитела являются иммуноглобулинами человека (реципиентное антитело), в котором остатки из гипервариабельного участка реципиента заменены остатками из гипервариабельного участка вида, отличного от человека (донорское антитело), такого как мышь, крыса, кролик или примат кроме человека, обладающими требуемой специфичностью, сродством связывания и соответствующей способностью. В некоторых случаях остатки FR иммуноглобулина человека заменяют соответствующими остатками, отличными от человеческих. Кроме того, гуманизированные антитела могут включать остатки, которые не обнаружены в реципиентном антителе или в донорском антителе. Указанные модификации производят для дальнейшего улучшения характеристик антитела. Как правило, гуманизированное антитело включает по существу все, за исключением по меньшей мере одного, обычно двух вариабельных доменов, в которых все или по существу все гипервариабельные петли соответствуют петлям иммуноглобулина, отличного от человеческого, и все или по существу все остатки FR являются остатками последовательности иммуноглобулина человека. Гуманизированное антитело может также необязательно включать по меньшей мере часть константной области (Fc) иммуноглобулина, обычно иммуноглобулина человека.
Термин "гипервариабельный участок" в использованном здесь значении означает аминокислотные остатки антитела, отвечающие за связывание антигена. Гипервариабельный участок обычно включает аминокислотные остатки из "области, определяющей комплементарность" или "CDR" (остатки 24-34 (L1), 50-56 (L2) и 89-97 (L3) в вариабельном домене легкой цепи и 31-35 (Н1), 50-65 (Н2) и 95-102 (Н3) в вариабельном домене тяжелой цепи; Kabat et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health an Human Services, NIH Puplication No. 91-3242) и/или остатки из "гипервариабельной петли" (остатки 26-32 (L1), 50-52 (L2) и 91-96 (L3) в вариабельном домене легкой цепи и 26-32 (Н1), 53-55 (Н2) и 96-101 (Н3) в вариабельном домене тяжелой цепи; Chothia and Lesk, J. Mol. Biol. 1987; 196:901-917). Нумерация аминокислотных остатков в данной области выполняется методом, описанным в публикации Kabat et al., см. выше. Такие фразы, как "положение Кабата", "остаток Кабата" и "по Кабату", в настоящем описании изобретения относятся к указанной системе нумерации для вариабельных доменов тяжелой цепи или вариабельных доменов легкой цепи. При использовании системы нумерации Кабата фактическая линейная аминокислотная последовательность пептида может содержать меньше аминокислот или дополнительные аминокислоты, соответствующие укорачиванию или введению в FR или CDR вариабельного домена. Например, вариабельный домен тяжелой цепи может включать вставки аминокислот (остаток 52а, 52b и 52с по Кабату) после остатка 52 CDR H2 и вставленные остатки (например, остатки 82а, 82b, 82с и т.д. по Кабату) после остатка 82 остовной области тяжелой цепи. Нумерация остатков Кабата может быть определена для данного антитела путем совмещения гомологичных областей последовательности антитела со "стандартной" пронумерованной последовательностью Кабата.
Остатки "остовной области" или "FR" являются остатками VH- или VL-области, отличными от CDR в соответствии с определением, приведенным в настоящем описании изобретения.
"Соответствующие" положения аминокислот в двух по существу идентичных аминокислотных последовательностях представляют собой положения, совмещенные при помощи любого программного обеспечения анализа белков, обычно с использованием параметров по умолчанию.
"Выделенная" молекула является основной молекулой в составе молекул по отношению к классу молекул, к которому она принадлежит (то есть составляет по меньшей мере примерно 50% молекул данного типа и обычно составляет по меньшей мере примерно 70%, по меньшей мере примерно 80%, по меньшей мере примерно 85%, по меньшей мере примерно 90%, по меньшей мере примерно 95% или более молекул данного вида, например пептида). Состав молекул антитела обычно является гомогенным на 98% или 99% относительно всех присутствующих видов пептидов в составе или по меньшей мере относительно по существу активных видов пептидов в зависимости от предлагаемого использования.
Термины "избирательно нейтрализует" и "избирательно нейтрализующий" в использованном здесь значении означают выделенное и очищенное антитело (такое как моноклональное антитело, но не ограничивающееся им) или его антигенсвязывающий фрагмент, которое избирательно нейтрализует по меньшей мере примерно 40%, по меньшей мере примерно 50% или по меньшей мере примерно 60% биологической активности одного или более подтипов белка IFN-α, но при этом существенно не нейтрализует по меньшей мере одну биологическую активность другого подтипа белка IFN-α, при этом биологическая активность может представлять собой, например, активацию промотора МхА и/или антивирусную активность.
В контексте настоящего изобретения термин "лечение" означает предотвращение, ослабление, контролирование, исцеление или уменьшение проявления одного или более симптомов или клинических проявлений заболевания или нарушения, за исключением обратного, следующего из контекста. Например, "лечение" субъекта, у которого не обнаружено симптомов или клинических проявлений заболевания или нарушения, является превентивной или профилактической терапией, в то время как "лечение" субъекта, у которого выявлены симптомы или клинические проявления заболевания или нарушения, обычно не является превентивной или профилактической терапией.
Фраза "IFN-α-обусловленное состояние или заболевание" в использованном здесь значении означает аномальное состояние, заболевание или доклиническое развитие заболевания, которое связано с повышенными уровнями IFN-α в сыворотке субъекта. Примеры таких заболеваний включают, не ограничиваясь ими, обыкновенную волчанку или нарушения, такие как SLE, реакцию "трансплантат против хозяина" (GVHD), диабет 1-го типа, СПИД (вызванных вирусом иммунодефицита человека (ВИЧ)), аутоиммунный тиреоидит и псориаз. В данной области известны методы определения уровня IFN-α.
Гуманизированные антитела против IFN-α
Антитела по настоящему изобретению являются гуманизированными вариантами мышиных антител АСО-1 или АСО-2 против IFN-α и/или их антигенсвязывающими фрагментами, которые характеризуются определенными функциональными и/или структурными особенностями или свойствами. Рекомбинантные антитела могут быть получены в приемлемых линиях клеток-хозяев стандартными методами и исследованы в результате выполнения разных анализов для оценки их функциональных активностей, описанных ниже. Фактически установлено, что антитела против IFN-альфа по настоящему изобретению могут быть получены со значительно более высоким выходом по сравнению с антителами против IFN-альфа, которые были гуманизированы традиционным способом.
В соответствии с так называемым методом "наилучшего приближения" последовательность вариабельного домена антитела грызуна исследуют с использованием библиотеки известных последовательностей вариабельного домена человека или библиотек последовательностей зародышевых клеток человека. Последовательность человека, которая ближе всего соответствует последовательности грызуна, затем может быть выбрана в качестве остовной области человека для гуманизированного антитела (Sims et al., J. Immunol. 1993; 151: 2296 et seq.: Chothia et al., Chothia and Lesk, J. Mol. Biol. 1987; 196:901-917). В соответствии с другим методом используют конкретную остовную область, выделенную из консенсусной последовательности всех человеческих антител определенной подгруппы легких или тяжелых цепей. Одна и та же остовная область может быть использована для нескольких разных гуманизированных антител.
Предпочтительными последовательностями остовной области, предназначенными для использования в антителах по настоящему изобретению, являются последовательности, которые в структурном отношении подобны последовательностям остовной области в АСО-1 или АСО-2. Таким образом, в одном варианте осуществления изобретения получают гуманизированное антитело АСО-1 или АСО-2, включающее остатки остовной области VH-области, выделенные из гена VH1_46 человека и гена JH4 человека, остатки остовной области VL-области, выделенные из гена VKIII_L6 человека и гена JK2 человека, которое специфически связывается с IFN-α человека.
В приведенном ниже примере 1 описано создание типичного гуманизированного антитела АСО-1, hzACO-1, включающего такие последовательности остовной области.
Функциональные свойства
Гуманизированные антитела по настоящему изобретению специфически связываются с подтипами IFN-α А, 2, В2, С, F, G, H2, I, J1, K, 4a, 4b и WA (таблица 2). В одном варианте осуществления изобретения гуманизированное антитело АСО-1 или АСО-2 по настоящему изобретению связывается с высоким сродством с таким подтипом белка IFN-α, как IFN-αА, например, при значении KD около 10-7 М или меньше, KD около 10-8 М или меньше, KD около 5×10-9 М или меньше, KD около 2×10-9 М или меньше. В одном варианте осуществления изобретения гуманизированное антитело является вариантом антитела hzACO-1, связывающимся с IFN-αА, IFN-αF и/или другими подтипами белка IFN-α со сродством, которое сравнимо или больше аналогичного показателя у hzACO-1.
Кинетические параметры антитела hzACO-1 для различных подтипов IFN-α человека
Например, соотношение KD варианта hzACO-1 и KD антитела hzACO-1 по отношению к подтипу белка IFN-αА может быть равно примерно 1,0, примерно 0,8, примерно 0,7 или примерно 0,6. В другом варианте осуществления изобретения гуманизированное антитело является вариантом hzACO-1, связывающимся с IFN-αА, IFN-αF и/или другим подтипом белка IFN-α со сродством связывания, которое сравнимо или больше аналогичного показателя у антитела АСО-1, полученного методами рекомбинантных ДНК. В другом варианте осуществления изобретения гуманизированное антитело является вариантом hzACO-1, связывающимся с IFN-αА, IFN-αF и/или другими подтипами белка IFN-α со сродством связывания, которое сравнимо или больше аналогичного показателя у антитела АСО-1, полученного методом гибридом.
Кроме того, гуманизированные антитела по настоящему изобретению могут избирательно нейтрализовать биологическую активность одного или более подтипов белка IFN-α. Например, гуманизированный вариант АСО-1 или АСО-2 может избирательно нейтрализовать по меньшей мере примерно 40%, по меньшей мере примерно 50% или по меньшей мере примерно 60% биологической активности подтипов белка IFN-α А, 2, В2, С, F, G, H2, I, J1, K, 4a, 4b или WA или любой их комбинации по сравнению с контрольным образцом. В конкретном варианте осуществления изобретения гуманизированное антитело существенно не нейтрализует биологическую активность подтипов IFN-α D и/или 1. Типичные биологические активности включают, не ограничиваясь ими, активацию промотора МхА, антивирусную активность либо обе вместе. Способность гуманизированного антитела нейтрализовать такую биологическую активность IFN-α можно определить, используя, например, ген-репортер (RG) при выполнении цитопатических анализов ингибирования (СРЕ), рассмотренных в настоящем описании изобретения. В одном варианте осуществления изобретения гуманизированное антитело является вариантом hzACO-1, у которого значение IC50 сравнимо или меньше значения IC50 антитела hzACO-1 при определении с помощью анализа с использованием гена-репортера. В конкретном варианте осуществления изобретения у варианта hzACO-1 значение IC50 меньше, чем у антитела hzACO-1, при определении с помощью анализа с использованием гена-репортера (RG).
В одном варианте осуществления изобретения гуманизированные антитела по настоящему изобретению конкурируют за связывание и/или связываются с тем же эпитопом подтипа белка IFN-α, что и АСО-1 и/или АСО-2. Такие антитела могут быть идентифицированы на основании их способности перекрестно конкурировать с АСО-1 и/или АСО-2 при выполнении стандартных анализов связывания IFN-α, рассмотренных в настоящем описании изобретения. Способность испытуемого гуманизированного антитела ингибировать связывание антитела АСО-1 или АСО-2 с одним или более подтипами белка IFN-α показывает, что испытуемое антитело может конкурировать с АСО-1 или АСО-2 за связывание с IFN-α и, таким образом, может связываться с тем же эпитопом подтипа белка IFN-α, что и антитела АСО-1 и/или АСО-2 (WO20066649 и WO2005059106). В конкретном варианте осуществления изобретения гуманизированное антитело связывается не с тем эпитопом IFN-α человека, с которым связываются мышиные моноклональные антитела 9F3 и ММНА-1, -2, -3, -6, -8, -9, -11, -13 и -17 (PBL Biomedical Laboratories, NJ, USA) и/или человеческие моноклональные антитела 13Н5, 13Н7 и 7Н9, и в большей степени перекрестно конкурирует с АСО-1 или АСО-2, чем с одним или более перечисленными мышиными и человеческими моноклональными антителами.
В одном варианте осуществления изобретения hzACO-1, hzACO-2, варианты hzACO-1 или варианты hzACO-2 по настоящему изобретению обладают иммуногенностью, которая сравнима или меньше, чем у гуманизированного антитела АСО-1 или АСО-2, включающего мышиные CDR-области по Кабату (АСО-1 Кабата). Иммуногенность гуманизированного антитела можно определить, например, одним или более методами, описанными в публикации Wadwha et al., Dev. Biol. (Basel) 2005; 122:155-70, которая полностью включена в настоящее описание изобретения в качестве ссылки.
Другим объектом изобретения являются гуманизированные антитела по настоящему изобретению, сохраняющие устойчивость в препарате, пригодном для введения человеку. В одном варианте осуществления изобретения гуманизированное антитело АСО-1 или АСО-2 по настоящему изобретению является по меньшей мере таким же устойчивым, как антитела против IFN-альфа, гуманизированные традиционным способом, включающим использование непроцессированных мышиных последовательностей Кабата. Устойчивость антитела можно определить методами, известными в данной области, которые включают термофлуоресцентные анализы, описанные в примере 11.
Предпочтительные гуманизированные антитела по настоящему изобретению обладают по меньшей мере одним, более предпочтительно двумя, тремя, четырьмя, пятью или большим числом следующих свойств: (а) специфически связываются с подтипами IFN-α А, 2, В2, С, F, G, H2, I, J1, K, 4a, 4b или WA; (b) избирательно нейтрализуют одну или более биологических активностей подтипов белка IFN-α А, 2, В2, С, F, G, H2, I, J1, K, 4a, 4b или WA, любую их комбинацию или все вместе; (с) существенно не нейтрализуют биологическую активность IFN-α1 или D; (d) конкурируют за связывание и/или связываются с тем же эпитопом подтипа белка IFN-α, что и АСО-1 и/или АСО-2; (е) в большей степени конкурируют с АСО-1 или АСО-2, чем с любым из антител 9F3, 13H5, 13H7 и 7Н9; (f) в меньшей степени вызывают иммунный ответ, чем антитело hzACO-1 или hzACO-2, включающее мышиные CDR-области по Кабату; (g) являются устойчивыми в фармацевтических препаратах; и (h) связываются по меньшей мере с одним из подтипов белка IFN-α А, 2, В2, С, F, G, H2, I, J1, K, 4a, 4b или WA со значением KD 10-8 М или меньше.
Структурные свойства
Предпочтительные антитела по настоящему изобретению являются гуманизированными вариантами мышиных моноклональных антител АСО-1 и АСО-2. Такие антитела могут быть продуцированы, выделены и исследованы в структурном и функциональном отношении в соответствии с описанием, приведенным в примерах. Непроцессированные последовательности вариабельной области и CDR-областей Кабата антител АСО-1, hzACO-1 и АСО-2 приведены в таблице 3 и показаны на фиг.1-3.
Нумерация последовательностей для затравок, белка и антител
Последовательности CDR H1, H3, L1, L2 и L3 антитела hzACO-1 идентичны соответствующим последовательностям АСО-1. CDR H3 и L3 АСО-2 идентичны соответствующим последовательностям CDR АСО-1. Аминокислоты, выделенные курсивом в последовательности CDR_H2 антитела hzACO-1, соответствуют последовательности остовной области человека; в традиционно гуманизированных антителах непроцессированная последовательность Кабата соответствует последовательности CDR_H2 антитела АСО-1, где все аминокислоты выделены из мышиного антитела.
Одним объектом настоящего изобретения являются гуманизированные варианты мышиных антител АСО-1 и АСО-2, содержащие меньше донорских остатков, чем CDR-области Кабата, то есть меньше мышиных остатков, чем гуманизированное антитело АСО-1 или АСО-2, полученное путем присоединения CDR-областей Кабата.
В одном варианте осуществления изобретения гуманизированное антитело специфически связывается с IFN-α человека и является гуманизированным вариантом мышиного антитела АСО-1 или АСО-2 или их комбинации, содержащим меньше донорских аминокислотных остатков, чем мышиные области, определяющие комплементарность, (CDR) по Кабату. Последовательность CDR H2, например, может содержать меньше донорских аминокислотных остатков по сравнению с остатками 50-65, 50-64, 50-63, 50-62, 50-61 или 50-60 Кабата. Донорские остатки CDR H2 могут включать остатки 50-59 Кабата. Дополнительно или альтернативно, донорские аминокислотные остатки CDR H2 могут быть остатками 50-59 Кабата. Остатки 50-59 Кабата соответствуют остаткам 1-11 SEQ ID NO:16, 21 и 23. В одном варианте осуществления изобретения остальные CDR-области VH-области могут включать CDR-области Кабата или состоять из них (см. фиг.1-3), то есть могут включать последовательность CDR H1, содержащую донорские аминокислотные остатки, соответствующие остаткам 31-35 Кабата, и последовательность CDR H3, содержащую донорские аминокислотные остатки, соответствующие остаткам 95-102 Кабата.
В одном варианте осуществления изобретения гуманизированное антитело АСО-1 или АСО-2 может включать CDR L1, содержащую донорские аминокислотные остатки, соответствующие остаткам 24-34 Кабата вариабельной области легкой цепи (VL) АСО-1, CDR L2, содержащую донорские аминокислотные остатки, соответствующие остаткам 50-56 Кабата VL-области АСО-1, и CDR L3, содержащую донорские аминокислотные остатки, соответствующие остаткам 89-97 Кабата VL-области АСО-1 (SEQ ID NO:4) или VL-области АСО-2 (SEQ ID NO:9). Дополнительно или альтернативно, антитело может включать донорские аминокислотные остатки CDR L1, состоящие из остатков 24-34 Кабата, донорские остатки CDR L2, состоящие из остатков 50-56 Кабата, и донорские аминокислотные остатки CDR L3, состоящие из остатков 89-97 Кабата. Соответствующие аминокислотные последовательности представлены в таблице 3.
Одним объектом настоящего изобретения являются специфические гуманизированные антитела АСО-1. Гуманизированное антитело АСО-1 специфически связывается с IFN-α человека и включает последовательности CDR VH-области, которые по существу идентичны последовательностям остатков 31-35, 50-65 и 95-102 Кабата SEQ ID NO:3 при наличии необязательной мутации N31S. Антитело может, например, содержать последовательность CDR H1, включающую SEQ ID NO:15; последовательность CDR H2, включающую SEQ ID NO:21, и последовательность CDF H3, включающую SEQ ID NO:17. Дополнительно или альтернативно, антитело может содержать последовательность CDR H1, состоящую из SEQ ID NO:15; последовательность CDR H2, состоящую из SEQ ID NO:21, и последовательность CDR H3, состоящую из SEQ ID NO:17. В одном варианте осуществления изобретения гуманизированное антитело АСО-1 включает остатки остовной области VH-области, выделенные из гена VH1_46 человека и/или гена JH4 человека, предпочтительно из обоих генов. В конкретном варианте осуществления изобретения гуманизированное антитело включает последовательность VH-области, соответствующую SEQ ID NO:3.
Гуманизированное антитело АСО-1 может далее включать последовательности CDR VL-области, которые по существу идентичны последовательностям остатков 24-34, 50-56 и 89-97 Кабата SEQ ID NO:6. Антитело, например, может содержать последовательность CDR_L1, включающую SEQ ID NO:18; последовательность CDR_L2, включающую SEQ ID NO:19, и последовательность CDR_L3, включающую SEQ ID NO:20. Дополнительно или альтернативно, антитело может включать последовательность CDR_L1, состоящую из SEQ ID NO:18; последовательность CDR_L2, состоящую из SEQ ID NO:19, и последовательность CDR_L3, состоящую из SEQ ID NO:20. В одном варианте осуществления изобретения гуманизированное антитело АСО-1 включает остатки остовной области VL-области, выделенные из гена VKIII_L6 человека и/или гена JK2 человека, предпочтительно из обоих генов. В конкретном варианте осуществления изобретения гуманизированное антитело включает последовательность VL-области, соответствующую SEQ ID NO:6.
Одним объектом настоящего изобретения является антитело, включающее последовательности CDR антитела АСО-2. Указанное антитело специфически связывается с IFN-α человека и включает последовательности CDR VH-области, которые по существу идентичны последовательностям остатков 31-35, 50-59 и 95-102 Кабата SEQ ID NO:7. В одном варианте осуществления изобретения антитело содержит последовательность CDR_H1, включающую SEQ ID NO:22; последовательность CDR_H2, включающую SEQ ID NO:23, и последовательность CDR_H3, включающую SEQ ID NO:17. В дополнительном или альтернативном варианте осуществления изобретения антитело содержит последовательность CDR_H1, состоящую из SEQ ID NO:22; последовательность CDR_H2, состоящую из SEQ ID NO:23, и последовательность CDR_H3, состоящую из SEQ ID NO:17. Данное антитело может дополнительно включать последовательности CDR VL-области, которые по существу идентичны последовательностям остатков 24-34, 50-56 и 89-97 Кабата SEQ ID NO:9. В одном варианте осуществления изобретения антитело содержит последовательность CDR_L1, включающую SEQ ID NO:24; последовательность CDR_L2, включающую SEQ ID NO:25, и последовательность CDR_L3, включающую SEQ ID NO:20. Дополнительно или альтернативно, антитело содержит последовательность CDR_L1, состоящую из SEQ ID NO:24; последовательность CDR_L2, состоящую из SEQ ID NO:25, и последовательность CDR_L3, состоящую из SEQ ID NO:20. В соответствии с одним объектом изобретения антитело может быть гуманизированным антителом АСО-2.
Гуманизированное антитело АСО-1 или АСО-2 может дополнительно включать по меньшей мере часть Fc-области человека (за исключением тех случаев, когда антитело является антигенсвязывающим фрагментом, не содержащим части Fc-области). Как правило, величину Fc-области выбирают с возможностью достижения требуемых фармакокинетических свойств антитела; чем больше часть Fc-области, тем медленнее клиренс. В одном варианте осуществления изобретения гуманизированное антитело является непроцессированным антителом, предпочтительно включающим Fc-область изотипа IgG4. В конкретном варианте осуществления изобретения Fc-область IgG4 включает мутацию S241P при нумерации по Кабату, которая соответствует остатку 228 по европейской системе нумерации (Edelman G.M. et al., Proc. Natl. Acad. USA 63, 78-85 (1969)).
С учетом того, что антитела АСО-1 и АСО-2 могут связываться с IFN-α и подобны друг другу, гуманизированные последовательности VH- и VL-областей могут быть "смешаны и совмещены" с целью создания молекул, связывающихся с IFN-α, по настоящему изобретению. Связывание IFN-α такими "смешанными и совмещенными" антителами можно испытать при помощи анализов связывания, рассмотренных в настоящем описании изобретения (таких как проточная цитометрия, Biacore, ELISA), и/или при помощи одного или более функциональных анализов, рассмотренных в настоящем описании изобретения. Когда цепи VH- и VL-областей смешаны и совмещены, последовательность VH-области, образованную в результате определенного спаривания VH/VL, предпочтительно заменяют последовательностью VH-области, подобной в структурном отношении. Аналогичным образом последовательность VL-области, образованную в результате определенного спаривания VH/VL, предпочтительно заменяют последовательностью VL-области, подобной в структурном отношении.
Таким образом, одним объектом настоящего изобретения является гуманизированное моноклональное антитело или его антигенсвязывающий фрагмент, содержащее: (а) VH-область, включающую CDR VH-области антитела АСО-1 или АСО-2, и (b) VL-область, включающую CDR VL-области антитела АСО-1 или АСО-2; при этом данное антитело специфически связывается с IFN-α. Предпочтительные комбинации тяжелой и легкой цепей включают: (а) VH-область, включающую SEQ ID NO:15-17, в которой необязательно отсутствуют некоторые или все 5 С-концевых аминокислот SEQ ID NO:16, и (b) вариабельную область легкой цепи, включающую SEQ ID NO:18-20; (а) VH-область, включающую SEQ ID NO:15-17, в которой необязательно отсутствуют некоторые или все 5 С-концевых аминокислот SEQ ID NO:16, и (b) вариабельную область легкой цепи, включающую SEQ ID NO:24, 25 и 20; (а) VH-область, включающую SEQ ID NO:22, 23 и 17, в которой необязательно отсутствуют некоторые или все 5 С-концевых аминокислот SEQ ID NO:23, и (b) вариабельную область легкой цепи, включающую SEQ ID NO:18-20; и (а) VH-область, включающую SEQ ID NO:22, 23 и 17, в которой необязательно отсутствуют некоторые или все 5 С-концевых аминокислот SEQ ID NO:23, и (b) вариабельную область легкой цепи, включающую SEQ ID NO:24, 25 и 20. Другие предпочтительные комбинации тяжелой и легкой цепей включают (а) VH-область, включающую последовательность SEQ ID NO:3, и (b) VL-область, включающую аминокислотную последовательность SEQ ID NO:4; (а) VH-область, включающую SEQ ID NO:15, 21 и 17, и (b) VL-область, включающую SEQ ID NO:18-20; и (а) VH-область, включающую SEQ ID NO:15, 21 и 17, и (b) VL-область, включающую, SEQ ID NO:24, 25 и 20.
Другим объектом настоящего изобретения являются антитела, включающие CDR1, CDR2 и/или CDR3 тяжелой цепи и легкой цепи антитела АСО-1 или АСО-2 или их комбинаций. С учетом того, что все указанные антитела могут связываться с IFN-α и антигенсвязывающая специфичность присуща главным образом областях CDR1, 2 и 3, последовательности CDR H1, H2 и Н3 и последовательности CDR L1, L2 и L3 могут быть "смешаны и совмещены" (то есть CDR-области из разных антител могут быть смешаны и совмещены, хотя каждое антитело может содержать CDR H1, H2 и Н3 и CDR L1, L2 и L3) с целью создания других молекул, связывающихся с IFN-α, по настоящему изобретению. Связывание IFN-α такими "смешанными и совмещенными" антителами можно испытать при помощи анализов связывания, рассмотренных ниже и в примерах (например, таких как проточная цитометрия, Biacore или ELISA). Когда последовательности CDR VH-области смешаны и совмещены, последовательность CDR H1, H2 и/или Н3, образованную из определенной последовательности VH-области, предпочтительно заменяют последовательностью CDR, подобной в структурном отношении. Аналогичным образом, когда последовательности CDR VL-области смешаны и совмещены, последовательность CDR L1, L2 и/или L3, образованную из определенной последовательности VL-области, заменяют последовательностью CDR, подобной в структурном отношении. Например, CDR-области антител АСО-1 и АСО-2 по существу подобны в структурном отношении и поэтому могут быть смешаны и совмещены.
Другим объектом настоящего изобретения является гуманизированное моноклональное антитело или его антигенсвязывающая часть, содержащее: (а) CDR H1, включающую аминокислотную последовательность, выбираемую из группы, состоящей из SEQ ID NO:15 и 22; (b) CDR H2, включающую аминокислотную последовательность, выбираемую из группы, состоящей по меньшей мере из остатков 1-12 SEQ ID NO:16 и 23; (с) CDR H3, включающую SEQ ID NO:17; (d) CDR L1, включающую аминокислотную последовательность, выбираемую из группы, состоящей из SEQ ID NO:18 и 24; (е) CDR L2, включающую аминокислотную последовательность, выбираемую из группы, состоящей из SEQ ID NO:19 и 25; и (f) CDR L3, включающую SEQ ID NO:20; при этом данное антитело специфически связывается с IFN-α.
В предпочтительном варианте осуществления изобретения антитело содержит: (а) CDR H1, включающую SEQ ID NO:15; (b) CDR H2, включающую по меньшей мере остатки 1-12 SEQ ID NO:16; (с) CDR H3, включающую SEQ ID NO:17; (d) CDR L1, включающую SEQ ID NO:18; (е) CDR L2, включающую SEQ ID NO:19; и (f) CDR L3, включающую SEQ ID NO:20.
В другом предпочтительном варианте осуществления изобретения антитело содержит: (а) CDR H1, включающую SEQ ID NO:22; (b) CDR H2, включающую по меньшей мере остатки 1-12 SEQ ID NO:23; (с) CDR H3, включающую SEQ ID NO:17; (d) CDR L1, включающую SEQ ID NO:24; (е) CDR L2, включающую SEQ ID NO:25; и (f) CDR L3, включающую SEQ ID NO:20.
В предпочтительном варианте осуществления изобретения антитело содержит: (а) CDR H1, включающую SEQ ID NO:15; (b) CDR H2, включающую SEQ ID NO:21; (с) CDR H3, включающую SEQ ID NO:17; (d) CDR L1, включающую SEQ ID NO:18; (е) CDR L2, включающую SEQ ID NO:19; и (f) CDR L3, включающую SEQ ID NO:20.
В предпочтительном варианте осуществления изобретения антитело содержит: (а) CDR H1, включающую SEQ ID NO:22; (b) CDR H2, включающую по меньшей мере остатки 1-12 SEQ ID NO:16; (с) CDR H3, включающую SEQ ID NO:17; (d) CDR L1, включающую SEQ ID NO:18; (е) CDR L2, включающую SEQ ID NO:19; и (f) CDR L3, включающую SEQ ID NO:20.
В предпочтительном варианте осуществления изобретения антитело содержит: (а) CDR H1, включающую SEQ ID NO:15; (b) CDR H2, включающую по меньшей мере остатки 1-12 SEQ ID NO:16; (с) CDR H3, включающую SEQ ID NO:17; (d) CDR L1, включающую SEQ ID NO:24; (е) CDR L2, включающую SEQ ID NO:19; и (f) CDR L3, включающую SEQ ID NO:20.
В предпочтительном варианте осуществления изобретения антитело содержит: (а) CDR H1, включающую SEQ ID NO:15; (b) CDR H2, включающую по меньшей мере остатки 1-12 SEQ ID NO:16; (с) CDR H3, включающую SEQ ID NO:17; (d) CDR L1, включающую SEQ ID NO:18; (е) CDR L2, включающую SEQ ID NO:25; и (f) CDR L3, включающую SEQ ID NO:20.
Варианты гуманизированного антитела против IFN-α
Хотя в варианте или производном антитела обычно изменено по меньшей мере одно свойство по сравнению с исходным антителом, варианты или производные антитела могут сохранять одно, некоторые, большинство или все функциональные свойства исходного антитела против IFN-α, которые включают, не ограничиваясь ими, способность: (а) специфически связываться с подтипами IFN-α А, 2, В2, С, F, G, H2, I, J1, K, 4a, 4b и WA; (b) избирательно нейтрализовать одну или более биологических активностей подтипов белка IFN-α А, 2, В2, С, F, G, H2, I, J1, K, 4a, 4b и WA, любой их комбинации или всех; (с) незначительно нейтрализовать биологическую активность IFN-α1 или D; (d) конкурировать за связывание и/или связываться с тем же эпитопом подтипа белка IFN-α, что и антитела АСО-1 и/или АСО-2; (е) в большей степени конкурировать с АСО-1 или АСО-2, чем с любым антителом 9F3, 13H5, 13H7 и 7Н9; (f) с меньшей степенью вероятности вызывать иммунный ответ по сравнению с антителом hzACO-1 или hzACO-2, включающим мышиные CDR-области по Кабату; (g) сохранять устойчивость в фармацевтических препаратах; и (h) связываться по меньшей мере с одним подтипом белка IFN-α А, 2, В2, С, F, G, H2, I, J1, K, 4a, 4b и WA со значением KD 10-8 М или меньше. Антитело по настоящему изобретению может обладать любой комбинацией вышеуказанных функциональных признаков и/или функциональными признаками, описанными в примерах.
В определенных вариантах осуществления изобретения гуманизированное антитело по настоящему изобретению содержит VH-область, включающую последовательности CDR H1-H3, и VL-область, включающую последовательности CDR L1-L3, при этом одна или более указанных последовательностей CDR включают специфические аминокислотные последовательности, созданные на основе предпочтительных антител по настоящему изобретению, АСО-1 и АСО-2 или их консервативных модификаций, и, кроме того, указанные антитела сохраняют или улучшают требуемые функциональные свойства антител против IFN-α по настоящему изобретению. Таким образом, настоящее изобретение относится к выделенному моноклональному антителу или его антигенсвязывающему фрагменту, содержащему вариабельную область тяжелой цепи, включающую последовательности CDR H1, CDR H2 и CDR H3, и вариабельную область легкой цепи, включающую последовательности CDR L1, CDR L2 и CDR L3, где: (а) CDR H1 включает аминокислотную последовательность, выбираемую из группы, состоящей из SEQ ID NO:15 и 22 и их консервативных модификаций; (b) CDR H2 включает аминокислотную последовательность, выбираемую из группы, состоящей по крайней мере из остатков 1-12 SEQ ID NO:16 и 23 и их консервативных модификаций; (с) CDR H3 включает SEQ ID NO:17 и ее консервативные модификации; (d) CDR L1 включает аминокислотную последовательность, выбираемую из группы, состоящей из SEQ ID NO:18 и 24 и их консервативных модификаций; (е) CDR L2 включает аминокислотную последовательность, выбираемую из группы, состоящей из SEQ ID NO:19 и 25 и их консервативных модификаций; и (f) CDR L3 выключает SEQ ID NO:20 и ее консервативные модификации; при этом данное антитело специфически связывается с IFN-α.
Таким образом, один или более аминокислотных остатков в областях CDR или FR антитела по настоящему изобретению могут быть заменены другими аминокислотными остатками из того же семейства боковых цепей, и измененное антитело может быть испытано в отношении сохраненной функции (то есть функций, указанных в приведенных выше пунктах (с), (d) и (е)) при помощи функциональных анализов, рассмотренных в настоящем описании изобретения.
Функциональные свойства вариантов антитела могут быть исследованы при помощи стандартных анализов, известных в данной области и/или рассмотренных в настоящем описании изобретения. Например, способность антитела связываться с IFN-α можно определить при помощи стандартных анализов связывания и биологических эффектов (например, с использованием гена-репортера), описанных в примерах (например, Biacore или ELISA).
Модификации вариабельных областей
Одним объектом настоящего изобретения является гуманизированное антитело АСО-1 или АСО-2 с мутациями в CDR-области или остовной области.
Специфические типичные мутации в гуманизированном антителе АСО-1 и их идентификация описаны в примерах 2 и 3 (см. также фиг.1 и 3). Указанные мутации включают обратные мутации, введение остатков антитела АСО-1 в гуманизированное антитело АСО-1, а также мутации, в соответствии с которыми остатки, выделенные из антитела АСО-2, вводят в гуманизированное антитело АСО-1. Типичные обратные мутации в VH-области hzACO-1 (SEQ ID NO:3) включают V5Q, M69L, R71V, T73K, S76I и V78A, а также любую их комбинацию при использовании нумерации Кабата. Типичные обратные мутации в VL-области hzACO-1 (SEQ ID NO:6) включают E1Q, L47W, I58V и F71Y, а также любую их комбинацию. Типичные мутации из антитела АСО-2 в VH-области hzACO-1 (SEQ ID NO:3) включают T28S, N31S, I58S, S76N, T77I и A93V, а также любую их комбинацию. Типичные мутации из антитела АСО-2 в VL-области hzACO-1 (SEQ ID NO:6) включают D29G, L33F и S50G, а также любую их комбинацию.
Кроме того, разные вариантные последовательности VH- и VL-областей hzACO-1 могут быть "смешаны и совмещены" с вариантными или исходными последовательностями с целью создания библиотеки вариантов hzACO-1 по настоящему изобретению. Связывание IFN-α такими антителами со "смешанными и совмещенными" последовательностями можно испытать при помощи анализов связывания, рассмотренных в настоящем описании изобретения (например, Biacore, ELISA) и/или при помощи одного или более функциональных анализов, рассмотренных в настоящем описании изобретения.
Один вариант осуществления изобретения относится к гуманизированному антителу, которое специфически связывается с IFN-α человека и содержит вариабельный домен антитела человека, в который введены аминокислоты из донорского антитела, отличного от человеческого, которое связывается с IFN-α человека и содержит аминокислотный остаток донорского антитела на одном или более сайтах, выбираемых из 5, 28, 31, 58, 69, 71, 73, 76, 78, 79 и 93 в вариабельном домене тяжелой цепи.
Один вариант осуществления изобретения относится к гуманизированному антителу, которое специфически связывается с IFN-α человека и содержит вариабельный домен антитела человека, в который введены аминокислоты из донорского антитела, отличного от человеческого, которое связывается с IFN-α человека и содержит аминокислотный остаток донорского антитела на одном или более сайтах, выбираемых из 1, 29, 33, 47, 50, 58 и 71 в вариабельном домене легкой цепи.
Один вариант осуществления изобретения относится к гуманизированному антителу АСО-1, которое специфически связывается с IFN-α человека и содержит вариабельный домен антитела человека, в который введены последовательности CDR из антитела АСО-1, связывающиеся с IFN-α человека, и который далее включает аминокислотные остатки антитела АСО-2 на одном или более сайтах, выбираемых из 28, 31, 58, 76, 77, 78, 79 и 93 в вариабельном домене тяжелой цепи. В конкретном варианте осуществления изобретения аминокислотные остатки АСО-2 находятся на одном или более сайтах, выбираемых из 28, 31 и 93.
Один вариант осуществления изобретения относится к гуманизированному антителу АСО-1, которое специфически связывается с IFN-α человека и содержит вариабельный домен антитела человека, в который введены последовательности CDR из антитела АСО-1, связывающиеся с IFN-α человека, и который далее включает аминокислотные остатки антитела АСО-2 на одном или более сайтах, выбираемых из 29, 33 и 50 в вариабельном домене легкой цепи.
Один вариант осуществления изобретения относится к варианту hzACO-1, который специфически связывается с IFN-α человека и включает последовательности CDR VH-области, по существу идентичные последовательностям остатков 31-35, 50-65 и 95-102 Кабата SEQ ID NO:3, с мутацией N31S. Указанное антитело может, например, содержать последовательность CDR H1, включающую SEQ ID NO:15, с мутацией N31S; последовательность CDR H2, включающую SEQ ID NO:21; и последовательность CDR H3, включающую SEQ ID NO:17. Дополнительно или альтернативно, антитело может включать последовательность CDR H1, состоящую из SEQ ID NO:15, с мутацией N31S; последовательность CDR H2, состоящую из SEQ ID NO:21; и последовательность CDR H3, состоящую из SEQ ID NO:17. В одном варианте осуществления изобретения гуманизированное антитело АСО-1 включает остатки остовной области VH-области, выделенные из гена VH1_46 человека и/или гена JH4 человека, предпочтительно из обоих генов. В конкретном варианте осуществления изобретения гуманизированное антитело включает последовательность VH-области, соответствующую SEQ ID NO:3, с мутацией в виде замены N на S в положении 31 Кабата. Как показано в примерах, мутация N31S в антителе hzACO-1 увеличивает сродство связывания с IFN-α до уровней, сравнимых с уровнями антитела АСО-1, и повышает устойчивость при рН 3,5 и 4,5. Кроме того, поскольку остаток 31 находится в "донорском" остатке CDR, указанная мутация не позволяет ввести еще один мышиный остаток в последовательность антитела hzACO-1, благодаря чему не возрастает риск иммунного ответа против антитела при введении человеку. Другие мутации CDR с тем же преимуществом включают D29G и S50G в VL-области антитела hzACO-1.
Один вариант осуществления изобретения относится к варианту hzACO-1, который специфически связывается с IFN-α человека и включает последовательности CDR VH-области, по существу идентичные последовательностям остатков 31-35, 50-65 и 95-102 Кабата SEQ ID NO:3, с мутацией T28S. Указанное антитело, например, может содержать последовательность CDR H1, включающую SEQ ID NO:15; последовательность CDR H2, включающую SEQ ID NO:21; и последовательность CDR H3, включающую SEQ ID NO:17. Дополнительно или альтернативно указанное антитело может включать последовательность CDR H1, состоящую из SEQ ID NO:15; последовательность CDR H2, состоящую из SEQ ID NO:21; и последовательность CDR H3, состоящую из SEQ ID NO:17. В одном варианте осуществления изобретения гуманизированное антитело АСО-1 содержит остатки остовной области VH-области, выделенные из гена VH1_46 человека, и дополнительно включает мутацию T28S. В конкретном варианте осуществления изобретения гуманизированное антитело включает последовательность VH-области, соответствующую SEQ ID NO:3, с мутацией в виде замены Т на S в положении 28 Кабата. Как показано в примерах, мутация T28S в антителе hzACO-1 повысила сродство связывания с IFN-αА до уровней, сравнимых с АСО-1, и увеличила устойчивость при рН 3,5 и 4,5.
Один вариант осуществления изобретения относится к варианту hzACO-1, который специфически связывается с IFN-α человека и включает последовательности CDR VH-области, по существу идентичные последовательностям остатков 31-35, 50-65 и 95-102 Кабата SEQ ID NO:3, с мутацией A93V. Указанное антитело, например, может содержать последовательность CDR H1, включающую SEQ ID NO:15; последовательность CDR H2, включающую SEQ ID NO:21; и последовательность CDR H3, включающую SEQ ID NO:17. Дополнительно или альтернативно, указанное антитело может включать последовательность CDR H1, состоящую из SEQ ID NO:15; последовательность CDR H2, состоящую из SEQ ID NO:21; и последовательность CDR H3, состоящую из SEQ ID NO:17. В одном варианте осуществления изобретения гуманизированное антитело АСО-1 содержит остатки остовной области VH-области, выделенные из гена VH1_46 человека и гена JH4 человека, и дополнительно включает мутацию A93V. В конкретном варианте осуществления изобретения гуманизированное антитело включает последовательность VH-области, соответствующую SEQ ID NO:3, с мутацией в виде замены А на V в положении 93 Кабата. Как показано в примерах, мутация A93V в антителе hzACO-1 повысила сродство связывания с IFN-α до уровней, сравнимых с АСО-1, увеличила активность ингибирования IFN-α, измеренную при помощи анализа с использованием гена-репортера (RG), и увеличила устойчивость при рН 3,5 и 4,5.
Один вариант осуществления изобретения относится к варианту hzACO-1, который специфически связывается с IFN-α человека, содержит последовательности CDR VH-области, по существу идентичные последовательностям остатков 31-35, 50-65 и 95-102 Кабата SEQ ID NO:3, и включает мутацию в одной из последовательностей CDR VH-области, которая не находится в остатке 58 Кабата. Указанное антитело, например, может содержать CDR VH-области, состоящие из остатков 31-35, 50-65 и 95-102 Кабата SEQ ID NO:3, и дополнительно может включать мутацию в одной из последовательностей CDR VH-области, в которой остаток 58 Кабата является I. В одном варианте осуществления изобретения гуманизированное антитело АСО-1 содержит остатки остовной области VH-области, выделенные из гена VH1_46 человека и гена JH4 человека. Как показано в примерах, мутация I58S в hzACO-1 значительно снижает сродство связывания с IFN-αА и уменьшает активность ингибирования IFN-α, измеренную при помощи анализа с использованием гена-репортера (RG).
Модификация остовной области другого типа включает мутацию одного или более остатков в остовной области или даже в одной или более CDR-областях для удаления Т-клеточных эпитопов, в результате чего уменьшается потенциальная иммуногенность антитела. Такой подход именуется также "деиммунизацией" и подробно описан в патентной публикации США № 20030153043, выданной Carr et al.
Модификации Fc-области
Дополнительно или альтернативно модификациям в остовной области или CDR-областях, антитела по настоящему изобретению могут включать модификации в Fc-области, которые обычно изменяют одно или более функциональных свойств антитела, таких как время полужизни в кровяном русле, фиксация комплемента, связывание с Fc-рецептором, устойчивость белка и/или антигензависимая клеточно-опосредованная цитотоксичность, или вызывают их отсутствие. Кроме того, антитело по настоящему изобретению может быть модифицировано в химическом отношении (например, к антителу может быть присоединена одна или более химических частей) или модифицировано с целью изменения гликозилирования или с целью изменения одного или более функциональных свойств антитела. Все указанные варианты осуществления изобретения более подробно описаны ниже. Остатки в Fc-области пронумерованы по системе Кабата.
При желании класс антитела может быть изменен известными методами. Такие методы включают, например, прямые методы рекомбинантных ДНК (см., например, патент США № 4816397) и методы гибридизации клеток (см., например, патент США № 5916771). Например, антитело, которое первоначально было получено в виде молекулы IgM, может быть переведено в класс антитела IgG. Методы изменения класса могут быть также использованы для превращения одного подкласса IgG в другой, например IgG1 в IgG2. Таким образом, эффекторная функция антител по настоящему изобретению может быть изменена путем изменения изотипа, например, на антитело IgG1, IgG2, IgG3, IgG4, IgD, IgA, IgE или IgM, для разных терапевтических применений. Типичные последовательности кДНК для константных областей могут быть приобретены, например, в GenBank и в качестве ссылки полностью приведены ниже:
константная область тяжелой цепи IgG1 человека: № доступа в GenBank: J00228;
константная область тяжелой цепи IgG2 человека: № доступа в GenBank: J00230;
константная область тяжелой цепи IgG3 человека: № доступа в GenBank: Х04646;
константная область тяжелой цепи IgG4 человека: № доступа в GenBank: К01316; и
константная область легкой каппа-цепи человека: № доступа в GenBank: J00241.
В одном варианте осуществления изобретения шарнирная область СН1 модифицирована с изменением числа остатков цистеина в шарнирной области, которое, например, увеличено или уменьшено. Такой подход описан в патенте США № 5677425, выданном Bodmer et al. Число остатков цистеина в шарнирной области СН1 изменяют, например, для облегчения сборки легкой и тяжелой цепей или для увеличения или уменьшения устойчивости антитела.
В другом варианте осуществления изобретения шарнирная область Fc-области антитела мутирована для сокращения биологического времени полужизни антитела. В частности, в область на границе раздела доменов СН2-СН3 Fc-фрагмента шарнирной области вводят одну или более аминокислотных мутаций, чтобы указанное антитело хуже связывалось с белком А Staphylococcyl (SpA) по сравнению с шарнирным доменом Fc-области нативного SpA. Данный подход более подробно описан в патенте США № 6165745, выданном Ward et al. В другом варианте осуществления изобретения указанное антитело модифицировано для увеличения биологического времени полужизни. Возможны разные подходы. Например, можно ввести одну или более нижеследующих мутаций: T252L, T254S, T256F, описанных в патенте США № 6277375, выданном Ward. Альтернативно для увеличения биологического времени полужизни может быть изменена СН1 или CL область антитела с введением эпитопа связывания утилизирующего рецептора, взятого из двух петель СН2-домена Fc-области IgG, как описано в патентах США №№ 5869046 и 6121022, выданных Presta et al. В других вариантах осуществления изобретения Fc-область изменена путем замены по меньшей мере одного аминокислотного остатка другим аминокислотным остатком с целью изменения эффекторных функций антитела. Например, одна или более аминокислот, выбираемых из аминокислотных остатков 234, 235, 236, 237, 297, 318, 320 и 322, могут быть заменены другим аминокислотным остатком, в результате чего антитело приобретает другое сродство связывания с эффекторным лигандом, но сохраняет антигенсвязывающую способность исходного антитела. Эффекторный лиганд, в отношении которого изменено сродство связывания, может быть, например, Fc-рецептором или С1-компонентом комплемента. Данный подход более подробно описан в патентах США №№ 5624821 и 5648260, выданных Winter et al. В другом примере одна или более аминокислот, выбираемых из аминокислотных остатков 329, 331 и 322, могут быть заменены другим аминокислотным остатком, в результате чего антитело приобретает другое сродство связывания с C1q и/или у него уменьшается или устраняется комплементзависимая цитотоксичность (CDC). Данный подход более подробно описан в патентах США №№ 6194551, выданных Idusogie et al. В другом примере один или более аминокислотных остатков в положениях аминокислот 231 и 239 изменяют с целью изменения способности антитела фиксировать комплемент. Данный подход более подробно описан в публикации PCT WO 94/29351 Bodmer et al. В еще одном примере Fc-область модифицируют с целью увеличения способности антитела опосредовать антителозависимую клеточно-опосредованную цитотоксичность (ADCC) и/или увеличения сродства связывания антитела в отношении Fcy-рецептора путем изменения одной или более аминокислот в следующих положениях: 238, 239, 248, 249, 252, 254, 255, 256, 258, 265, 267, 268, 269, 270, 272, 276, 278, 280, 283, 285, 286, 289, 290, 292, 293, 294, 295, 296, 298, 301, 303, 305, 307, 309, 312, 315, 320, 322, 324, 326, 327, 329, 330, 331, 333, 334, 335, 337, 338, 340, 360, 373, 376, 378, 382, 388, 389, 398, 414, 416, 419, 430, 434, 435, 437, 438 или 439. Данный подход более подробно описан в публикации РСТ WO 00/42072 Presta. Кроме того, были картированы сайты связывания на IgG1 человека для FcyRI, FcyRII, FcyRIII и FcRn и описаны варианты с улучшенным связыванием (см. публикацию Shields, R.L. et al. (2001) J. Biol. Chem. 276:6591-6604). Установлено, что специфические мутации в положениях 256, 290, 298, 333, 334 и 339 улучшают связывание с FcRIII. Кроме того, установлено, что следующие комбинированные мутанты улучшают связывание с FcyRIII: T256A/S298A, S298A/E333A, S298A/K224A и S298A/E333A/K334A.
Константная область может быть далее модифицирована с целью стабилизации антитела, например, для уменьшения риска разделения двухвалентного антитела на два моновалентных фрагмента VH-VL. Например, в константной области IgG4 остаток S241 может быть мутирован в остаток пролина (Р) с возможностью образования дисульфидного мостика в шарнирной области (см., например, публикацию Angal et al., Mol. Immunol. 1993; 30:105-8).
Модификации гликозилирования
В другом варианте осуществления изобретения модифицировано гликозилирование антитела. Например, может быть получено агликозилированное антитело (то есть антитело, лишенное гликозилирования). Гликозилирование может быть изменено, например, с целью увеличения сродства связывания антитела с антигеном. Такие углеводные модификации могут быть выполнены, например, путем изменения одного или более сайтов гликозилирования в последовательности антитела.
Антигенсвязывающие фрагменты
Антитела против IFN-α по настоящему изобретению могут быть получены в виде непроцессированных антител или их антигенсвязывающих фрагментов. Примеры антигенсвязывающих фрагментов включают Fab, Fab', F(ab)2, F(ab')2, F(ab)3, Fv (обычно VL- и VH-домены одного плеча антитела), одноцепочечный Fv (scFv; см., например, публикации Bird et al., Science 1988; 242:423-426; и Huston et al. PNAS 1988; 85:5879-5883), dsFv, Fd (обычно VH- и СН1-домен) и dAb (обычно VH-домен); VH, VL, VhH и V-NAR домены; одновалентные молекулы, включающие одиночную цепь VH-области и одиночную цепь VL-области; мини-тела, диатела, триатела, тетратела и каппа-тела (см., например, публикацию Ill et al., Protein Eng. 1997; 10:949-57); верблюжий IgG; IgNAR; а также одну или более выделенных CDR-областей или функциональный паратоп, при этом выделенные CDR-области, антигенсвязывающие остатки или полипептиды могут быть ассоциированы или связаны вместе с образованием функционального фрагмента антитела. Разные типы фрагментов антитела описаны или рассмотрены, например, в публикации Holliger and Hudson, Nat. Biotechnol. 2005; 23:1126-1136; WO2005040219 и в опубликованных заявках на патент США 20050238646 и 20020161201.
Фрагменты антитела могут быть получены обычными методами рекомбинантных ДНК или методами создания белков и исследованы в отношении связывания с антигеном или другой функции аналогично интактным антителам.
Были разработаны разные методы создания фрагментов антитела. Указанные фрагменты традиционно получают путем протеолитического гидролиза непроцессированных антител (см., например, публикации Morinoto et al., Journal of Biochemical and Biophysical Methods, 24:107-117 (1992); и Brennan et al., Science, 229:81 (1985)). Однако указанные фрагменты могут быть продуцированы непосредственно рекомбинантными клетками-хозяевами. Альтернативно, Fab'-SH- фрагменты могут быть выделены из E. coli и химически связаны с образованием F(ab')2-фрагментов (Carter et al., Bio/Technology, 10:163-167 (1992)). В соответствии с другим подходом F(ab')2-фрагменты могут быть выделены непосредственно из культуры рекомбинантных клеток-хозяев. В других вариантах осуществления изобретения выбранное антитело является одноцепочечным Fv-фрагментом (scFv). См. WO1993/16185; патент США № 5571894 и патент США № 5587458. Фрагмент антитела также может быть "линейным антителом", например, описанным в патенте США № 5641870. Такие фрагменты линейного антитела могут быть моноспецифическими или биспецифическими.
Полиспецифические молекулы
Другим объектом настоящего изобретения являются полиспецифические молекулы, включающие антитело против IFN-α или его антигенсвязывающий фрагмент по настоящему изобретению. Такие полиспецифические молекулы включают биспецифические молекулы, обладающие по меньшей мере одной первой специфичностью связывания с IFN-α и второй специфичностью связывания со вторым эпитопом-мишенью.
Одним типом биспецифических молекул являются биспецифические антитела. Биспецифические антитела являются антителами, которые обладают специфичностью связывания по меньшей мере с двумя разными эпитопами. В данной области известны методы создания биспецифических антител, и традиционные методы получения непроцессированных биспецифических антител обычно основаны на коэкспрессии двух пар тяжелых и легких цепей иммуноглобулина, где две цепи обладают разными специфичностями (Millstein et al., Nature, 305: 537-539 (1983)). Биспецифические антитела могут быть получены в виде непроцессированных антител или фрагментов антител (например, F(ab')2-фрагментов биспецифических антител) либо любых других антигенсвязывающих фрагментов, рассмотренных в настоящем описании изобретения.
Другие полиспецифические молекулы включают молекулы, полученные в результате гибридизации части IFN-α-связывающего антитела с одним или более другими белками, не являющимися антителами. В данной области описаны такие полиспецифические белки и методы их создания. См., например, публикацию Dreier et al. (Bioconjug. Chem. 9(4): 482-489 (1998)); патент США № 6046310; патентную публикацию США № 20030103984; заявку на европейский патент 1413316; патентную публикацию США № 20040038339; публикацию von Strandmann et al., Blood (2006; 107:1955-1962), и WO 2004056873.
В объем настоящего изобретения также входят полиспецифические молекулы с более чем двумя валентностями. Например, могут быть получены триспецифические антитела. Tutt et al., J. Immunol., 147:60 (1991).
Полиспецифические молекулы по настоящему изобретению могут быть получены путем конъюгирования составляющих специфичностей связывания методами, известными в данной области. Например, все специфичности связывания полиспецифической молекулы могут быть созданы отдельно и затем конъюгированы друг с другом. Когда специфичности связывания принадлежат белкам или пептидам, для ковалентного конъюгирования могут быть использованы разные связывающие или перекрестносшивающие агенты. Примеры перекрестносшивающих агентов включают белок А, карбодиимид, N-сукцинимидил-S-ацетилтиоацетат (SATA), 5,5'-дитиобис(2-нитробензойную кислоту) (DTNB), о-фенилендималеимид (oPDM), N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP) и сульфосукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (сульфо-SMCC) (см., например, публикацию Karpovsky et al. (1984) J. Exp. Med. 160:1686; Liu, M.A. et al. (1985) Proc. Natl. Acad. Sci. USA 82:8648). Другими методами являются методы, описанные в публикациях Paulus (1985) Behring Ins. Mitt. No. 78, 118-132; Brennan et al. (1985) Science 229:81-83, и Glennie et al. (1987) J. Immunol. 139:2367-2375. Предпочтительными конъюгирующими агентами являются SATA и сульфо-SMCC, которые можно приобрести в компании Pierce Chemical Co. (Rockford, IL).
Специфичности связывания, являющиеся антителами, могут быть конъюгированы путем связывания сульфгидрильной связью С-концевых шарнирных областей двух тяжелых цепей. В особенно предпочтительном варианте осуществления изобретения шарнирная область модифицирована с обеспечением до конъюгирования нечетного числа сульфгидрильных остатков, предпочтительно одного.
Альтернативно, обе специфичности связывания могут быть кодированы в одном векторе, экспрессированы и собраны в одной клетке-хозяине. Указанный метод особенно пригоден в том случае, когда биспецифическая молекула является гибридным белком mAb × mAb, mAb × Fab, Fab × F(ab')2 или лиганд × Fab. Биспецифическая молекула по настоящему изобретению может быть одноцепочечной молекулой, включающей одно одноцепочечное антитело и детерминанту связывания, или одноцепочечной биспецифической молекулой, включающей две детерминанты связывания. Биспецифические молекулы могут включать по меньшей мере две одноцепочечные молекулы. Методы получения биспецифических молекул описаны или рассмотрены, например, в патенте США № 5260203, патенте США № 5455030, патенте США № 4881175, патенте США № 5132405, патенте США № 5091513, патенте США № 5476786, патенте США № 5013653, патенте США № 5258498, патенте США № 5482858, публикации заявки на патент США 20030078385, публикациях Kontermann et al., (2005) Acta Pharmacological Sinica 26(1):1-9; Kostelny et al., (1992) J. Immunol. 148(5):1547-1553; Hollinger et al., (1993) PNAS (USA) 90:6444-6448; и Gruber et al., (1994) J. Immunol. 152:5368.
Производные антител
Производные антител (или иммуноконъюгаты), входящие в объем настоящего изобретения, включают антитела против IFN-α, конъюгированные или ковалентно связанные со вторым агентом.
Например, одним объектом настоящего изобретения являются иммуноконъюгаты, включающие антитело, конъюгированное или ковалентно связанное с цитотоксическим агентом, который может быть выбран из терапевтических радиоактивных изотопов, токсических белков, токсических малых молекул, таких как лекарственные средства, токсины, иммуномодуляторы, гормоны, антагонисты гормонов, ферменты, олигонуклеотиды, ингибиторы ферментов, терапевтические радиоизотопы, ингибиторы развития кровеносных сосудов, химиотерапевтические средства, алкалоиды барвинка, антрациклины, эпидофиллотоксины, таксаны, антиметаболиты, алкилирующие агенты, антибиотики, ингибиторы СОХ-2, SN-38, антимитотические агенты, агенты, препятствующие развитию кровеносных сосудов и вызывающие апоптоз, в частности доксорубицин, метотрексат, таксол, СРТ-11, каптотеканы, азотистый иприт, гемцитабин, алкилсульфонаты, нитрозомочевины, триазены, аналоги фолиевой кислоты, аналоги пиримидина, аналоги пурина, координационные комплексы платины, экзотоксин Pseudomonas, рицин, абрин, 5-фторуридин, рибонуклеаза (РНКаза), ДНКаза I, стафилококковый энтеротоксин-А, антивирусный белок фитолакки американской, гелонин, дифтерийный токсин, экзотоксин Pseudomonas, эндотоксин Pseudomonas и другие (см., например, публикации Remington's Pharmaceutical Sciences, 19th Ed. (Mack Publishing Co. 1995); Goodman and Gilman's The Pharmacological Basis of Therapeutics (McGraw Hill, 2001); Pastan et al., (1986) Cell 47:641; Goldenberg (1994) Cancer Journal for Clinicians 44:43; патент США № 6077499, которые полностью включены в настоящее описание изобретения в качестве ссылки). Следует отметить, что токсин может иметь животное, растительное, грибное или микробное происхождение или может быть создан de novo путем химического синтеза.
В другом варианте осуществления изобретения производное антитела получают с использованием радиоактивного изотопа, такого как терапевтический радиоизотоп или радиоизотоп, пригодный для обнаружения. Может быть использовано любое число приемлемых радиоактивных изотопов, которые включают, но не ограничиваясь ими, I-131, индий-111, лютеций-171, висмут-212, висмут-213, астатин-211, медь-62, медь-64, медь-67, иттрий-90, иод-125, иод-131, фосфор-32, фосфор-33, скандий-47, серебро-111, галлий-67, празеодим-142, самарий-153, тербий-161, диспрозий-166, гольмий-166, рений-186, рений-188, рений-189, свинец-212, радий-223, актиний-225, железо-59, селен-75, мышьяк-77, стронций-89, молибден-99, родий-105, палладий-109, празеодим-143, прометий-149, эрбий-169, иридий-194, золото-198, золото-199 и свинец-211. Как правило, радиоизотоп предпочтительно обладает затухающей энергией в диапазоне от 20 до 6000 кэВ, предпочтительно в диапазоне 60-200 кэВ для излучателя Аугена, 100-2500 кэВ для излучателя бета-частиц и 4000-6000 кэВ для излучателя альфа-частиц. Кроме того, предпочтительны радиоизотопы, затухание которых происходит с образованием альфа-частиц.
Конъюгаты антител по настоящему изобретению могут быть использованы для модификации данной биологической реакции в тех случаях, когда лекарственная часть не ограничена классическими химическими лекарственными средствами. Например, лекарственная часть может быть белком или полипептидом, обладающим требуемой биологической активностью. Такие белки могут включать, например, ферментативно активный токсин или его активный фрагмент, такой как абрин, рицин А, экзотоксин Pseudomonas или дифтерийный токсин; белок, такой как фактор некроза опухолей или γ-интерферон; или модификаторы биологических реакций, такие как, например, лимфокины, интерлейкин-1 ("IL-1"), интерлейкин-2 ("IL-2"), интерлейкин-6 ("IL-6"), колониестимулирующий фактор макрофагов гранулоцитов ("GM-CSF"), колониестимулирующий фактор гранулоцитов ("G-CSF") и другие факторы роста.
Второй агент может быть прямо или косвенно связан с антителом при помощи любого метода из большого числа существующих методов. Например, агент может быть присоединен к шарнирной области восстановленного компонента антитела путем образования дисульфидной связи при помощи кросс-линкеров, таких как N-сукцинил-3-(2-пиридилдитио)пропионат (SPDP), или углеводной части в Fc-области антитела (см., например, Yu et al. (1994) Int. J. Cancer 56: 244; Wong, Chemistry of Protein Conjugation and Cross-linking (CRC Press 1991); Upeslacis et al., "Modification of Antibodies by Chemical Methods," in Monoclonal antibodies: principles and applications, Birch et al. (eds.), pages 187-230 (Wiley-Liss, Inc. 1995); Price, "Production and Characterization of Synthetic Peptide-Derived Antibodies," in Monoclonal antibodies: Production, engineering and clinical application, Ritter et al. (eds.), pages 60-84 (Cambridge University Press 1995), Cattel et al. (1989) Chemistry today 7:51-58, Delprino et al. (1993) J. Pharm. Sci 82:699-704; Arpicco et al. (1997) Bioconjugate Chemistry 8:3; Reisfeld et al. (1989) Antibody, Immunicon. Radiopharm. 2:217; которые полностью включены в настоящее описание изобретения в качестве ссылки). См. также публикации Arnon et al., "Monoclonal Antibodies For Immunotargeting Of Drugs In Cancer Therapy", in Monoclonal Antibodies And Cancer Therapy, Reisfeld et al. (eds.), pp. 243-56 (Alan R. Liss, Inc. 1985); Hellstrom et al., "Antibodies For Drug Delivery", in Controlled Drug Delivery (2nd Ed.), Robinson et al. (eds.), pp. 623-53 (Marcel Dekker, Inc. 1987); Thorpe, "Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review", in Monoclonal Antibodies '84: Biological And Clinical Applications, Pinchera et al. (eds.), pp. 475-506 (1985); "Analysis, Results, And Future Prospective Of The Therapeutic Use Of Radiolabeled Antibody In Cancer Therapy", in Monoclonal Antibodies For Cancer Detection And Therapy, Baldwin et al, (eds.), pp. 303-16 (Academic Press 1985), and Thorpe et al., "The Preparation And Cytotoxic Properties Of Antibody-Toxin Conjugates", Immunol. Rev., 62:119-58 (1982).
Для дальнейшего рассмотрения цитотоксинов, линкеров разных типов и методов конъюгирования лекарственных средств с антителами, см. также Saito, G. et al. (2003) Adv. Drug Deliv. Rev. 55:199-215; Trail, P.A. et al. (2003) Cancer Immunol. Immunother. 52:328-337; Payne, G. (2003) Cancer Cell 3:207-212; Allen, T.M. (2002) Nat. Rev. Cancer 2:750-763; Pastan, I. and Kreitman, R. J. (2002) Curr. Opin. Investig. Drugs 3:1089-1091; Senter, P.O. and Springer, C.J. (2001) Adv. Drug Deliv. Rev. 53:247-264.
В других вариантах осуществления изобретения второй агент является детектируемой частью, которая может быть любой молекулой, пригодной для количественного или качественного определения или измерения. Примерами детектируемых маркеров, пригодных для использования в конъюгированных антителах по настоящему изобретению, могут быть радиоактивные изотопы, флуоресцентные красители или член комплементарно связывающейся пары, например член любой пары: антиген/антитело (отличное от антитела против IFN-α), лектин/углевод, авидин/биотин, рецептор/лиганд или молекулярно фиксированный полимер/системы фиксации молекул.
Второй агент также или альтернативно может быть полимером, предназначенным, например, для увеличения времени полужизни антитела в кровотоке. Типичные полимеры и методы присоединения таких полимеров к пептидам представлены, например, в патентах США №№ 4766106, 4179337, 4495285 и 4609546. Дополнительные иллюстративные полимеры включают полиоксиэтилированные полиолы и полиэтиленгликоль (PEG). В использованном здесь значении термин "полиэтиленгликоль" означает любые формы PEG, использованные для получения производных других белков, такие как моно(С1-С10)алкокси- или арилоксиполиэтиленгликоль или полиэтиленгликоль-малеимид. Например, непроцессированное антитело или фрагмент антитела может быть конъюгирован с одной или более молекулами полэтиленгликоля (PEG) с молекулярной массой от около 1000 до около 40000, в частности от около 2000 до около 20000, например около 3000-12000. Антитело или его фрагмент, подлежащее пегилированию, обычно подвергают взаимодействию с полиэтиленгликолем (PEG), таким как реакционноспособный сложный эфир или альдегид полиэтиленгликоля, в условиях, в которых одна или более групп полиэтиленгликоля присоединяются к указанному антителу или фрагменту антитела. Пегилирование предпочтительно выполняют путем ацилирования или алкилирования с использованием реакционноспособной молекулы PEG (или аналогичного реакционноспособного водорастворимого полимера). В определенных вариантах осуществления изобретения подлежащее пегилированию антитело является агликозилированным антителом. Методы пегилирования белков известны в данной области и могут быть использованы для пегилирования антител по настоящему изобретению. См., например, европейский патент 0154316, выданный Nishimura et al., и европейский патент 0401384, выданный Ishikawa et al.
Исследование антитела
После получения или очистки антитела либо в виде части процедуры скрининга или отбора могут быть исследованы функциональные характеристики антитела против IFN-α по настоящему изобретению.
Ниже дано краткое описание типичных анализов, применяемых для исследования антитела. Некоторые анализы далее описаны в других разделах и/или в примерах.
Анализы связывания
Настоящее изобретение относится к антителам, их антигенсвязывающим фрагментам и иммуноконъюгатам, связывающимся с IFN-α. Для оценки связывания антитела с IFN-α могут быть использованы любые анализы из большого числа анализов. Анализы ELISA, радиоиммуноанализы, вестерн-блоттинг, BIACORE и конкурентно-связывающие анализы хорошо известны в данной области и могут быть использованы для анализа антител.
Например, могут быть использованы простые анализы связывания, в которых испытуемое антитело инкубируют в присутствии белка или эпитопа-мишени (например, белка IFN-α подтипа, выбираемого из А, 2, В2, С, F, G, H2, I, J1, K, 4a, 4b, WA, 1 и D, их части или любой комбинации), несвязанные антитела вымывают и наличие связанных антител определяют при помощи таких анализов, как, например, RIA, ELISA и т.д. Такие методы хорошо известны специалистам в данной области. Любая величина связывания, которая выше величины связывания с контрольным, неспецифическим антителом, свидетельствует о том, что антитело специфически связывается с данной мишенью.
При выполнении таких анализов способность испытуемого антитела связываться с IFN-α человека можно сравнить со способностью (отрицательного) контрольного белка, например антитела против структурно неродственного антигена, пептида или белка, отличного от Ig, связываться с той же мишенью. Считается, что антитела или фрагменты, которые при выполнении любого приемлемого анализа связываются с IFN-α со сродством связывания, которое на 25%, 50%, 100%, 200%, 1000% или более превышает сродство связывания с контрольным белком, "специфически связываются" или "специфически взаимодействуют" с мишенью и могут быть предпочтительно использованы в описанных ниже терапевтических методах. Кроме того, можно определить способность испытуемого антитела влиять на связывание (положительного) контрольного антитела против IFN-α, например гуманизированного антитела против АСО-1 или АСО-2.
Одним объектом настоящего изобретения являются гуманизированные антитела против IFN-α, у которых биологические характеристики и/или последовательность VH- и/или VL-области по существу идентичны гуманизированным антителам АСО-1 или АСО-2. Одной типичной биологической характеристикой является связывание с эпитопом антитела АСО-1 или АСО-2, то есть с соответствующими областями во внеклеточном домене белка IFN-α определенных подтипов, с которыми связываются антитела АСО-1 и АСО-2. Для исследования антител, которые связываются с эпитопом антитела АСО-1 или АСО-2, может быть использован стандартный перекрестно-блокирующий анализ, аналогичный описанному в публикации Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory, Ed Harlow and David Lane (1988).
В типичном перекрестно-блокирующем или конкурентно-связывающем анализе (контрольное) антитело АСО-1 или АСО-2 и испытуемое антитело смешивают (или предварительно адсорбируют) и наносят на образец, содержащий IFN-α. В некоторых вариантах осуществления изобретения контрольные антитела предварительно смешивают с испытуемым антителом в разных количествах (например, 1:10 или 1:100) в течение определенного периода времени до нанесения на образец, содержащий IFN-α. В других вариантах осуществления изобретения контрольное антитело и испытуемое антитело в разных количествах можно просто смешать во время воздействия на антиген/образец-мишень. Если можно отличить связанные антитела от свободных антител (например, при помощи методов разделения или промывки для удаления несвязанных антител) и контрольное антитело от испытуемого антитела (например, при использовании видо- или изотипспецифических вторичных антител, путем специфического мечения контрольного антитела детектируемой меткой или при помощи физических методов, таких как масс-спектрометрия, позволяющих различать разные соединения), можно определить способность испытуемого антитела уменьшать связывание контрольного антитела с антигеном, из чего следует, что испытуемое антитело узнает по существу тот же эпитоп, что и контрольное антитело. При выполнении данного анализа связывание (меченого) контрольного антитела в присутствии полностью неродственного антитела является высоким контрольным значением. Низкое контрольное значение может быть получено при инкубировании меченого (положительного) контрольного антитела с немеченным контрольным антителом, когда возникает конкуренция, уменьшающая связывание меченого антитела.
При выполнении лабораторного анализа значительное уменьшение реактивности меченого антитела в присутствии испытуемого антитела является показателем того, что испытуемое антитело узнает тот же эпитоп, то есть "перекрестно взаимодействует" с меченым контрольным антителом. Любое испытуемое антитело или соединение, которое уменьшает связывание меченого контрольного антитела с антигеном/мишенью по меньшей мере на 50% или более предпочтительно на 70% при любом соотношении контрольного антитела:испытуемого антитела или соединения от около 1:10 до около 1:100, считается антителом или соединением, которое связывается по существу с тем же эпитопом или детерминантой, что и контрольное антитело. Такое испытуемое антитело или соединение предпочтительно уменьшает связывание контрольного антитела с антигеном/мишенью по меньшей мере на 90%. Тем не менее, любое соединение или антитело, которое уменьшает связывание контрольного антитела или соединения в любой измеряемой степени, может быть использовано в настоящем изобретении.
Биологическая активность
Дифференцировка моноцитов. Образование активированных Т- и В-лимфоцитов требует рекрутинга и созревания антигенпредставляющих клеток ("АРС"). Указанные АРС включают В-клетки, моноциты/макрофаги и дендритные клетки. В сыворотке субъектов, страдающих SLE, содержится IFN-α, который может активировать дендритные клетки (DC), при этом активированная активность может быть блокирована препаратами на основе гуманизированных антител по настоящему изобретению. В научной и патентной литературе описаны методы обнаружения и количественного определения данной активности (см., например, абзацы 0136-0150 патентной публикации US20040067232A1, соответствующие части которой включены в настоящее описание изобретения в качестве ссылки).
Активация промотора МхА. Способность IFN-α активировать промотор МхА и способность моноклональных антител против IFN-α по настоящему изобретению блокировать указанную активацию можно измерить при помощи анализов с использованием гена-репортера (RG), в которых промотор МхА гибридизируют с геном-репортером, таким как хлорамфеникол-ацетилтрансфераза (САТ) или люцифераза (luc), предпочтительно с люциферазой. Специалистам в данной области известны анализы с использованием САТ и люциферазы. Активность промотора МхА предпочтительно измеряют в клетках А549, устойчиво трансформированных гибридной конструкцией промотор МхА/ген-репортер. Клетки А549 представляют собой линию клеток рака легкого, которую можно приобрести в АТСС (номер продукта СС1-185). Промотор МхА (известный также под названием MxI) может быть человеческим, мышиным или крысиным. Последовательность и структура промотора МхА человека представлена под номером доступа Genbank Х55639 в публикациях Chang et al. (1991) Arch Virol. 117:1-15; и Ronni et al. (1998) J. Interferon Cytokine Res. 18: 773-781. Гибридные конструкции промотор МхА человека/люцифераза и анализы с использованием люциферазы описаны в патентной публикации US20040209800 и публикации Rosmorduc et al. (1999) J. of Gen. Virol. 80:1253-1262. Гибридные конструкции промотор МхА человека/САТ и анализы с использованием САТ описаны в публикации Fernandez et al. (2003) J. Gen. Virol. 84:2073-2082, и Fray et al. (2001) J. Immunol. Methods 249:235-244. Мышиный промотор МхА (MxI) представлен под номером доступа Genbank M21104 и описан в публикациях Hug et al. (1988) Mol. Cell. Biol. 8:3065-3079; и Lleonart et al. (1990) Biotechnology 8:1263-1267. Гибридная конструкция мышиный промотор МхА/люцифераза и анализы с использованием люциферазы описаны в публикации Canosi et al. (1996) J. Immunol. Methods 199:69-67.
Анализы ингибирования цитопатического эффекта (СРЕ). Анализы СРЕ основаны на антивирусной активности интерферона. Приемлемую линию клеток обычно инфицируют вирусом в присутствии интерферона и производят количественное определение ингибирующей активности интерферона в отношении размножения или репликации вируса. Результаты данного анализа могут быть выражены в уменьшении урожая вирусов, снижении цитопатического эффекта вируса, сокращении синтеза вирусного белка синтеза РНК, уменьшении образования вирусных бляшек. Анализ цитопатического эффекта может быть использован для определения нейтрализующего действия антител на активность интерферона. Типичные анализы СРЕ описаны в публикации Meager, A. 1987. Количественное определение интерферонов при помощи антивирусных анализов и их стандартизация описаны в публикациях Clemens, M.J., Morris, A.G., Gearing, A.J.H. (Eds), Lymphokines and interferons: A Practical Approach. IRL, Press, Oxford, p.129, Grossberg and Sedmak, 1984. Assays of interferons In: Billiau, A. (Ed) Interferon, vol.1: General and Applied Aspects. Elsevier, Amsterdam, p.189, и в Примере 6, абзацы 157-164, и показаны на фиг.1 публикации РСТ WO2006086586.
Фармацевтические препараты
Другим объектом настоящего изобретения является получение фармацевтического препарата, включающего [белковое] соединение, присутствующее в концентрации 10-500 мг/мл, такой как, например, 20-300 мг/мл, предпочтительно 30-100 мг/мл и наиболее предпочтительно 50-100 мг/мл, при этом указанный препарат имеет значение рН от 2,0 до 10,0. Указанный препарат может далее содержать буферную систему, консерванты, усилители тонуса, хелатообразователи, стабилизаторы и поверхностно-активные вещества. В одном варианте осуществления изобретения фармацевтический препарат является водным препаратом, то есть препаратом, содержащим воду. Такой препарат обычно является раствором или суспензией. В другом варианте осуществления изобретения фармацевтический препарат является водным раствором. Термин "водный препарат" означает препарат, включающий по меньшей мере 50% мас./мас. воды. Аналогичным образом термин "водный раствор" означает раствор, включающий по меньшей мере 50% мас./мас. воды, и термин "водная суспензия" означает суспензию, включающую по меньшей мере 50% мас./мас. воды.
В другом варианте осуществления изобретения фармацевтический препарат является лиофилизованным препаратом, в который лечащий врач или субъект перед употреблением добавляет растворители и/или разбавители.
В другом варианте осуществления изобретения фармацевтический препарат является сухим препаратом (например, лиофилизованным или высушенным распылением), готовым к употреблению без предварительного растворения.
Диагностические применения
Антитела против IFN-α по настоящему изобретению также могут быть использованы в нетерапевтических целях. Например, антитела против IFN-α могут быть также использованы при выполнении диагностических анализов белка IFN-α, например, для обнаружения его экспрессии в специфических клетках, тканях или сыворотке. Например, антитела против IFN-α могут быть использованы в анализах по отбору субъектов, подлежащих лечению против IFN-α. Антитела против IFN-α могут быть использованы для анализа присутствия IFN-α в сыворотке или образцах ткани. Антитело, используемое для диагностических применений, обычно метят детектируемой частью.
Терапевтические применения
Настоящее изобретение относится к способам лечения субъекта с использованием гуманизированного антитела против IFN-α, рассмотренного в настоящем описании изобретения. Один вариант осуществления изобретения относится к использованию описанного гуманизированного антитела для получения фармацевтической композиции, предназначенной для введения человеку. Субъект, нуждающийся в таком лечении, обычно страдает или подвержен риску возникновения аутоиммунного или воспалительного заболевания или нарушения, ассоциированного с аномальной экспрессией по меньшей мере одного подтипа IFN-α, выбираемого из группы, состоящей из подтипов А, 2, В2, С, F, G, H2, I, J1, K, 4a, 4b и WA.
Типичные состояния или нарушения, подлежащие лечению антителами по настоящему изобретению, включают, но не ограничиваясь ими, волчанку (например, системную красную волчанку (SLE)), ревматоидный артрит, юношеский хронический артрит, остеоартрит, спондилоартропатию, системный склероз (склеродерму), идиопатические воспалительные миопатии (дерматомиозит, полимиозит), синдром Шегрена, васкулит, системный васкулит, саркоидоз, аутоиммунную гемолитическую анемию (иммунную панцитопению, ночную пароксизмальную гемоглобинурию), аутоиммунную тромбоцитопению (идиопатическую тромботическую пурпуру, иммунную тромбоцитопению), тиреоидит (болезнь Грейвса, тиреоидит Хашимото, юношеский лимфоцитарный тиреоидит, атрофический тиреоидит), сахарный диабет, иммунное заболевание почек (гломерулонефрит, тубулоинтерстициальный нефрит), демиелинизирующие заболевания центральной и периферической нервной системы, такие как рассеянный склероз, идиопатическую демиелинизирующую полиневропатию или болезнь Гийена-Барре и хроническую воспалительную демиелинизирующую полиневропатию, желчно-почечные заболевания, такие как инфекционный гепатит (гепатит А, В, С, D, Е и другие негепатотропные вирусы), аутоиммунный хронический активный гепатит, первичный билиарный цирроз печени, грануломатозный гепатит и склерозирующий холангит, воспалительное заболеванпе кишечника (неспецифический язвенный колит, болезнь Крона), глютеновую болезнь, глютензависимую энтеропатию, болезнь Уиппла, аутоиммунные или иммунные кожные заболевания, включающие буллезные кожные заболевания, полиморфную эритему и контактный дерматит, псориаз, аллергические заболевания, такие как астма, аллергический ринит, атопический дерматит, аллергия на продукты питания и крапивница, иммунные заболевания легкого, такие как эозинофильная пнемнония, идиопатический фиброз легких и аллергическая пневмония, заболевания, обусловленные трансплантацией, включающие отторжение трансплантата и реакцию "трансплантат против хозяина". В конкретном варианте осуществления изобретения заболевание, состояние или нарушение выбирают из волчанки, синдрома Шегрена, псориаза, сахарного диабета, ревматоидного артрита и юношеского дерматомиотоза. В другом конкретном варианте осуществления изобретения заболевание, состояние или нарушение является SLE. Например, в соответствии с одним объектом изобретения антитело против IFN-α используют в комбинации с одним или более другими противовоспалительными средствами, которые включают, но не ограничиваясь ими, анальгетики, иммунодепрессанты, кортикостероиды, средства против TNFα или другие средства против цитокинов или рецепторов цитокинов и средства, препятствующие развитию кровеносных сосудов. Конкретные примеры таких средств включают метотрексат, TSG-6, Rituxan® и гибридные белки CTLA4-Fc. Ниже приведены другие примеры комбинированной терапии.
Изделия
Другой вариант осуществления изобретения относится к изделию, содержащему вещества, пригодные для лечения вышеописанных нарушений. Например, в комплект изделия может входить емкость, содержащая гуманизированное антитело против IFN-α по настоящему изобретению вместе с инструкциями, позволяющими пользователю лечить такое нарушение, как аутоиммунное или воспалительное заболевание или нарушение у человека, при помощи указанного антитела, используемого в эффективном количестве. В комплект изделия обычно входит емкость и упаковка с наклеенной этикеткой или вложенной инструкцией. Приемлемыми емкостями являются, например, бутылки, ампулы, шприцы и т.д. Указанные емкости могут быть изготовлены из разных материалов, таких как стекло или пластик. В емкости со стерильным входным отверстием (например, емкость может быть мешком с раствором для внутривенного вливания или ампулой с пробкой, проницаемой для иглы для подкожных инъекций) находится композиция, позволяющая эффективно лечить указанное заболевание. По меньшей мере одним активным агентом в композиции является гуманизированное антитело против IFN-α, его антигенсвязывающий фрагмент или производное антитела (например, иммуноконъюгат), включающее такое антитело. На этикетке или вложенной инструкции указано, что данная композиции предназначена для лечения выбранного заболевания, такого как, например, SLE.
Кроме того, данное изделие молжет включать (а) первую емкость с композицией, включающей человеческое или гуманизированное антитело, и (b) вторую емкость с композицией, включающей терапевтическое средство, отличное от человеческого или гуманизированного антитела. Изделие по данному варианту осуществления изобретения может далее включать вложенную инструкцию с указанием того, что первая и вторая композиции могут быть использованы в комбинации для лечения аутоиммунного или воспалительного заболевания или нарушения. Такие терапевтические средства могут быть любыми средствами для дополнительных лечебных мероприятий, описанных в предыдущем разделе. Альтернативно или дополнительно, указанное изделие может далее включать вторую (или третью) емкость, содержащую фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекций (BWFI), физиологический раствор с фосфатным буфером, раствор Рингера и раствор декстрозы. Изделие может далее содержать другие вещества, желательные с коммерческой точки зрения и необходимые для пользователя, которые включают другие буферы, разбавители, фильтры, иглы и шприцы.
Первым объектом настоящего изобретения являются гуманизированное антитело, которое специфически связывается с α-интерфероном (IFN-α) человека, или его антигенсвязывающий фрагмент, при этом гуманизированное антитело является гуманизированным вариантом мышиного антитела АСО-1 или АСО-2 или их комбинации, включающим меньше донорских аминокислотных остатков, чем мышиные области, определяющие комплементарность, (CDR) по Кабату.
Вторым объектом настоящего изобретения, таким образом, является гуманизированное антитело, которое специфически связывается с IFN-α, или его антигенсвязывающий фрагмент, причем указанное антитело может связываться с подтипами IFN-α А, 2, В2, С, F, G, H2, I, J1, K, 4a, 4b и WA, но не связывается с подтипами 1 или D и включает меньше донорских аминокислотных остатков, чем CDR-области, отличные от человеческих, по Кабату.
В соответствии с одним вариантом осуществления изобретения донорские остатки CDR H2 включают остатки 50-59 Кабата. В другом варианте осуществления изобретения указанное антитело конкурирует за связывание и/или связывается с тем же эпитопом подтипа IFN-α, что и антитело АСО-1 и/или АСО-2.
В соответствии с предпочтительным вариантом осуществления изобретения антитело является подтипом IgG4. В предпочтительном варианте осуществления изобретения антитело включает последовательность CDR H2, соответствующую SEQ ID NO:21.
Третьим объектом настоящего изобретения является способ получения антитела по настоящему изобретению, который включает инкубацию клетки-хозяина, кодирующей указанное антитело, в соответствующих условиях и последующее выделение указанного антитела. Настоящее изобретение далее относится к антителам, полученным или получаемым такими способами.
Четвертым объектом настоящего изобретения является композиция, включающая антитело по настоящему изобретению. Изобретение далее относится к способу получения композиции по настоящему изобретению, который включает смешивание антитела или его фрагмента с наполнителями. Настоящее изобретение далее относится к композициям, полученным или получаемым такими способами.
Пятым объектом настоящего изобретения является способ предотвращения, контролирования, лечения или уменьшения интенсивности симптомов обусловленного IFN-α воспалительного заболевания или нарушения, который включает введение нуждающемуся в этом субъекту профилактически или терапевтически эффективного количества антитела по настоящему изобретению.
И наконец, настоящее изобретение относится к использованию антитела по настоящему изобретению для получения лекарственного средства, предназначенного для лечения воспалительного заболевания.
Примеры
Настоящее изобретение более подробно проиллюстрировано нижеследующими примерами, не ограничивающими объем изобретения.
Пример 1. Секвенирование мышиных антител АСО-1 и АСО-2
В данном примере рассмотрено секвенирование и рекомбинантная экспрессия мышиных антител АСО-1 и АСО-2, описанных в публикации WO20060086586, а также исследование последовательностей VH- и VL-областей антитела АСО-2 при помощи программы BLAST.
Клонирование и секвенирование антитела
Полную РНК экстрагировали из гибридом (АСО-1.5.2 и АСО-2.2.1), используя РНКазу (№ 634914) компании Qiagen. кДНК синтезировали из 1 мкг полной РНК, используя набор для амплификации кДНК SMART-RACE компании Clonetech. Взаимодействие осуществляли при 42°С в течение 1,5 часа, после чего образцы разводили в 75 мкл трицин-EDTA. Мишень амплифицировали при помощи ПЦР в 50 мкл реакционных смесях, используя 5 мкл кДНК в качестве матрицы. В качестве верхнего праймера для тяжелой и легкой цепи использовали универсальную смесь праймеров (UPM), которая входила в набор SMART RACE. Нижний праймер для тяжелой цепи (НС) антитела АСО-1 имел последовательность:
5'-CTGGGCCAGGTGCTGGAGG (SEQ ID NO:11),
и нижний праймер для легкой цепи (LC) антитела АСО-1 имел последовательность:
5'-CTAACACTCATTCCTGTTGAAGCTC (SEQ ID NO:12).
Нижний праймер для тяжелой цепи (НС) антитела АСО-2 имел последовательность:
5'-CTAGCTAGCTCATTTACCCGGAGACCGGGAGATGG (SEQ ID NO:26),
и нижний праймер для легкой цепи (LC) антитела АСО-2 имел последовательность:
5'-GCTCTAACACTCATTCCTGTTGAAGCTCTTG (SEQ ID NO:27).
Реакции ПЦР выполняли, используя набор для ПЦР Advantage HF компании Clonetech и программу для ПЦР, которая включала одну стадию денатурации при 94°С/2 мин с последующими 24 циклами: 94°С/30 сек; 55°С/30 сек; 72°С/1,5 мин. Конечную стадию удлинения цепи выполняли при 72°С/10 мин. Продукты ПЦР идентифицировали на 1% агарозном геле, содержащем бромид этидия. Продукты ПЦР очищали от геля, используя набор для очистки GFX компании GE Healthcare, клонировали в наборе для клонирования при выполнении ПЦР Zero Blunt TOPO (№ К2875-450) и переносили в клетки E. coli TOP10 компании Invitrogen.
ДНК экстрагировали из колоний E. coli, используя набор Miniprep (№ 27106) компании Qiagen. Плазмиды секвенировали в компании MWG Biotech, Matinsried, Germany, используя праймеры для секвенирования М13 rev (-29) и М13 uni (-21). Тяжелую цепь (HC) и легкую цепь (LC) проверяли в идентифицированных последовательностях, используя VectorNTI. Все комплекты использовали в соответствии с инструкциями производителей.
Из клеток гибридомы АСО-1.5.2 клонировали одну легкую каппа-цепь и одну тяжелую цепь IGg2a, имеющие следующую последовательность нуклеиновой кислоты и аминокислотную последовательность.
Последовательность VH-области антитела АСО-1 (SEQ ID NO:13 (с сигнальным пептидом)):

Последовательность VL-области антитела АСО-1 (SEQ ID NO:14 (с сигнальным пептидом)):

VH-область антитела АСО-1 (SEQ ID NO:1 (без сигнального пептида)):

VL-область антитела АСО-1 (SEQ ID NO:4 (без сигнального пептида)):

Из клеток гибридомы АСО-2.2.1 клонировали одну легкую каппа-цепь АСО-2 и одну тяжелую цепь АСО-2 IGg2b, имеющие следующую последовательность нуклеиновой кислоты и аминокислотную последовательность.
Последовательность VH-области антитела АСО-2 (SEQ ID NO:28 (с сигнальным пептидом)):

Последовательность VL-области антитела АСО-2 (SEQ ID NO:29 (с сигнальным пептидом)):

Последовательность VH-области антитела АСО-2 (SEQ ID NO:7 (без сигнального пептида)):

Последовательность VL-области антитела АСО-2 (SEQ ID NO:9 (без сигнального пептида)):

Было установлено, что CDR-области антитела АСО-2 имели следующие последовательности в соответствии с определениями Кабата:

Пример 2. Создание гуманизированного антитела АСО-1 и идентификация потенциальных остатков с обратной мутацией
Идентификация и исследование CDR-областей мышиного антитела АСО-1
Было установлено, что CDR-области антитела АСО-1 имели следующие последовательности в соответствии с определениями Кабата:

Идентификация зародышевых клеток человека
Трехмерная модель структуры белка была создана при помощи МОЕ (молекулярная операционная среда; доступна на сайте www.chemcomp.com) со структурной матрицей, полученной из банка базы данных белков (PDB): 1Z3G. PDB описан в публикации Berman et al. (Nucl. Acids Res. 2000; 28:235-242) и доступен на сайте www.rcsb.org/pdb. На основании анализа комплексов антиген-антитело в базе данных PDB было установлено, что наиболее вероятными остатками в паратопе являются остатки 23-35, 49-58, 93-102 VH-области антитела АСО-1 и 24-34, 49-56, 89-97 VL-области антитела АСО-1. При помощи МОЕ были идентифицированы остатки (гидрофобные, образующие водородную связь, взаимодействующие с заряженными остатками), взаимодействующие с паратопом, и объединенная совокупность остатков (паратоп + взаимодействующие остатки) была принята в качестве так называемой маски антитела АСО-1, показанной на фиг.1.
В результате поиска в базах данных зародышевых клеток с использованием VH-области АСО-1 и VL-области АСО-1 были обнаружены следующие матрицы потенциальной остовной области (Е-значение, указанное в скобках):
VH-область: VH1_46 (3e-038), VH1_f (6e-037), VH1_02 (6e-037), VH1_03 (1e-036), VH1_24 (2e-034);
VL-область: VKIII_L6 (9e-035), VKIII_A11 (4e-034), VKIII_A27 (8e-034), VKIII_L25 (1e-033), VKI_L8 (1e-033).
В результате поиска в базах данных зародышевых клеток с использованием маски были обнаружены следующие матрицы потенциальной остовной области (Е-значение, указанное в скобках):
VH-область: VH1_46 (3e-011), VH1_02 (6e-011), VH1_f (1e-010), VH5-a (4e-010), VH1_03 (4e-010);
VL-область: VKIII_A11 (5e-009), VKIII_L6 (7e-009), VKIII_A27 (9e-009), VKIII_L25 (3e-008), VKI_L9 (6e-008).
После выполненной вручную проверки совмещений и совпадений в качестве человеческих остовов были выбраны VH1_46 и VKIII_L6. Другие матрицы могли быть выбраны для изменения или оптимизации, например, физико-химических свойств гуманизированного антитела. JH4 и JK2 были выбраны в качестве J-сегментов зародышевых клеток (соответственно SEQ ID NO:2 и 5).
Создание оптимального гуманизированного антитела АСО-1
Гуманизацию выполняли в соответствии со следующими правилами:
- остатки снаружи маски были человеческими;
- остатки внутри маски и внутри CDR Кабата были мышиными;
- остатки внутри маски и снаружи CDR Кабата с согласованностью мышиных остатков/остатков зародышевых клеток были приняты в качестве консенсусной последовательности;
- остатки внутри маски и снаружи CDR Кабата с согласованностью мышиных остатков/остатков зародышевых клеток были приняты в качестве последовательности зародышевых клеток, но отличающиеся мышиные остатки были подвергнуты потенциальным обратным мутациям.
CDR-области полученного оптимального антитела hzACO-1 представляли собой (в соответствии с определениями Кабата):

Маска остатков, созданная с помощью вышеуказанного метода гуманизации, предположительно образует паратоп на основе трехмерной модели hzACO-1 и IFN-αА в отличие от простого присоединения CDR. Было получено антитело hzACO-1 с меньшим числом мышиных остатков, так как пептид, включающий 5 С-концевых аминокислот последовательности CDR H2 оптимизированного антитела hzACO-1 (выделены выше жирным шрифтом), был идентичен соответствующей последовательности остовной области человека, в то время как соответствующий пептид в последовательности CDR H2 антитела АСО-1 в соответствии с определениями Кабата имел мышиное происхождение. Кроме того, последовательность CDR H1 гуманизированного антитела АСО-1, идентифицированная при выполнении данного анализа, была короче последовательности, описанной в публикации WO2006/086586. Таким образом, можно получить оптимизированное антитело hzACO-1 или его антигенсвязывающий фрагмент, включающее по меньшей мере часть последовательности VH-области антитела hzACO-1, которое снижает риск возникновения у субъекта реакции на антитело человека против мыши (НАМА). Кроме того, введение последовательности AQK вместо NEN в положение 60-62 тяжелой цепи позволяет устранить два остатка аспарагина, которые подвержены деамидированию.
Идентификация потенциальных обратных мутаций
Анализ последовательностей VH- и VL-областей антитела АСО-1 показан на фиг.1. На фиг.1 представлены человеческие последовательности VH-области (SEQ ID NO:3) и VL-области (SEQ ID NO:6) гуманизированного антитела АСО-1 (hzACO-1) с остатками, имеющими потенциальные обратные мутации, то есть без любых обратных мутаций. Были идентифицированы следующие варианты с обратными мутациями в остовных областях, необходимые для получения одного или более оптимизированных антител hzACO-1, которые часто требуются для сохранения сродства связывания исходного мышиного антитела:
- VH-область антитела hzACO-1: дикого типа (то есть без обратной мутации), V5Q, M69L, R71V, T73K, S76I, V78A и любая их комбинация;
- VL-область антитела hzACO-1: дикого типа, E1Q, L47W, I58V, F71Y и любая их комбинация;
- в разных комбинациях тяжелой и легкой цепей.
Пример 3. Создание вариантов hzACO-1 на основе антитела АСО-1 для созревания аффинности hzACO-1
Как показано на фиг.2, сравнительный анализ аминокислотных последовательностей VH- и VL-областей антител АСО-1 и АСО-2 выявил высокую идентичность последовательностей соответствующих легкой и тяжелой цепей. Не ограничиваясь теорией, можно предположить, что указанные антитела выделены из одной и той же клетки-предшественника, так как они имели одинаковую полную реаранжировку (V-D-J) иммуноглобулиновых генов и содержали 3 одинаковых мутации по сравнению с последовательностью зародышевых клеток. Кроме того, указанные антитела отличались 13-ю аминокислотными остатками, возможно, вследствие последующих соматических сверхмутаций.
Из 13 неидентичных аминокислотных остатков в VH- и VL-доменах антител АСО-1 и АСО-2 9 остатков были выбраны для анализа мутаций с целью улучшения сродства связывания гуманизированного антитела АСО-1 (фиг.3). Единичные добавления сверхмутаций, выделенных из АСО-2, позволяют потенциально идентифицировать вредные и благоприятные аминокислотные остатки, и введение только благоприятных аминокислот улучшает сродство связывания по сравнению с исходными антителами АСО-1 и АСО-2. Остатки-мишени были выбраны с учетом их положения в одной из CDR-областей легкой или тяжелой цепи (в соответствии с определением Кабата) или с учетом их положения в областях, определяемых как потенциальные антигенвзаимодействующие области на основании трехмерного моделирования взаимодействия антиген-антитело.
Были идентифицированы следующие варианты для получения одного или более оптимизированных антител hzACO-1:
- VH-область антитела hzACO-1: дикого типа, T28S, N31S, I58S, S76N, T77I, A93V и любая комбинация по меньшей мере двух мутаций, выбираемых из T28S, N31S, I58S, S76N, T77I и A93V;
- VL-область антитела hzACO-1: дикого типа, D29G, L33F, S50G и любая комбинация по меньшей мере двух мутаций, выбираемых из D29G, L33F и S50G;
- в разных комбинациях тяжелой и легкой цепей.
Остатки были мутированы отдельно из последовательности АСО-1 в последовательность АСО-2 в конструкциях легкой и тяжелой цепей антитела hzACO-1 с целью оценки индивидуального вклада каждого остатка в связывание с антигеном. Был создан также целый ряд комбинированных мутантов.
Пример 4. Клонирование АСО-1, АСО-2, hzACO-1 и сайтнаправленный мутагенез
Антитела АСО-1, АСО-2 и hzACO-1
Последовательности VH- и VL-областей были перенесены в экспрессирующие векторы на основе промотора CMV (векторы рТТ), пригодные для временной экспрессии в экспрессирующей системе HEK293-EBNA (НЕК293-6Е), описанной в публикации Durocher et al. (Nucleic Acids Res. 2002; 30(2):E9). Помимо промотора CMV векторы содержат ориджин репликации pMB1, ориджин репликации EBV и ген AmpR. VH-область антител АСО-1 и АСО-2 клонировали в векторе на основе CMV, содержащем константную область соответственно для IgG2a и IgG2b мыши. Непроцессированную легкую цепь (LC) переносили в пустой вектор на основе CMV для антител АСО-1 и АСО-2. Последовательности ДНК для вариабельных областей антитела hzACO-1 были заказаны в компании Geneart, Regensburg, Germany. Полученную последовательность для VH-области антитела hzACO-1 переносили в экспрессирующий вектор, содержащий константную область для IgG4 человека (S241P) (содержащую мутацию S241P в шарнирной области). Полученную последовательность VL-области антитела hzACO-1 переносили в вектор, содержащий константную область для легкой каппа-цепи человека.
Создание вариантов антитела hzACO-1 с обратными мутациями
10 потенциальных обратных мутаций, идентифицированных в примере 2, отдельно вводили в конструкции тяжелой и легкой цепей антитела hzACO-1 для оценки индивидуального вклада каждого остатка в связывание с антигеном. Включали также несколько комбинаций. С помощью сайтнаправленного мутагенеза был создан также вариант hzACO-1 с удлиненной областью CDR H2 (hzACO-1-CDRH2 Кабата), эквивалентной определению Кабата CDR H2 мыши (SEQ ID NO:16).
Сайтнаправленный мутагенез выполняли на векторах экспрессии легкой и тяжелой цепей антитела hzACO-1. Для создания единичных мутантов использовали набор для сайтнаправленного мутагенеза QuickChange® компании Stratagene (№ по каталогу 200518) в соответствии с инструкциями производителей. Введение требуемых мутаций проверяли путем секвенирования препаратов плазмидной ДНК (MWG Biotech, Matinsried, Germany) для каждого мутанта.
Конструкции мутированной легкой цепи (LC) объединяли с тяжелой цепью (НС) антитела hzACO-1 для экспрессии антитела и конструкции мутированной тяжелой цепи объединяли с легкой цепью антитела hzACO-1 для экспрессии антитела.
Варианты легкой цепи с обратными мутациями:

Варианты тяжелой цепи с обратными мутациями:

Создание вариантов антитела hzACO-1 на основе АСО-2
Векторы экспрессии легкой и тяжелой цепей антитела hzACO-1 подвергали сайтнаправленному мутагенезу для введения определенных остатков АСО-2 в антитело hzACO-1 для улучшения сродства связывания, как описано в примере 3. Для создания единичных мутантов использовали набор для сайтнаправленного мутагенеза QuickChange компании Stratagene (№ по каталогу 200518) в соответствии с инструкциями производителей. Комбинированные мутанты были созданы с использованием наборов для сайтнаправленного мутагенеза QuickChange® и QuickChange® Multi в соответствии с инструкциями производителей (№ по каталогу 200513).
Введение требуемых мутаций проверяли путем секвенирования препаратов плазмидной ДНК (MWG Biotech, Matinsried, Germany) для каждого мутанта.
Конструкции мутированной легкой цепи (LC) объединяли с тяжелой цепью (НС) антитела hzACO-1 для экспрессии антитела и конструкции мутированной тяжелой цепи объединяли с конструкциями легкой цепи антитела hzACO-1 для экспрессии антитела.
Варианты легкой цепи с мутациями из антитела АСО-2:

Варианты тяжелой цепи с мутациями из АСО-2:


Пример 5. Экспрессия рекомбинантных антител, выделенных из АСО
Антитела АСО-1, АСО-2, hzACO-1 и варианты антитела hzACO-1 экспрессировали во временно трансфицированных клетках НЕК293 в соответствии с общей процедурой экспрессии антител. Ниже описана процедура трансфекции для адаптированных в суспензии клеток НЕК293.
Сохранение клеток: Адаптированные в суспензии клетки НЕК293 выращивали в среде для экспрессии клеток 293 GIBCO® FreeStyle™ (№ по каталогу компании Invitrogen 12338-026), содержащей 25 мкг/мл генетицина® (№ по каталогу компании Invitrogen 10131-019), 0,1% об./об. поверхностно-активного вещества плюроник® F-68 (№ по каталогу компании Invitrogen 12347-019) и 1% об./об. пенициллина-стрептомицина (необязательно) (№ по каталогу компании Invitrogen 15140-122). Клетки находились в колбах для шейкера Erlenmeyer с плотностью 0,2-2 × 106 клеток/мл, которые помещали в шейкер инкубатора при 37°С, 8% СО2 и скорости вращения 125 оборотов/мин.
Трансфекция ДНК: Плотность клеток в культурах, используемых для трансфекции, была равна 0,8-1,5 × 106 клеток/мл. На каждый мл культуры клеток добавляли 0,5 мкг ДНК вектора легкой цепи + 0,5 мкг ДНК вектора тяжелой цепи. 293фектин™ (№ по каталогу компании Invitrogen 12347-019) использовали в качестве трансфицирующего реагента при концентрации 1 мкл реагента на 1 мкг трансфицированной ДНК. 293фектин™ разводили в 30-кратном объеме Opti-MEM® (№ по каталогу компании Invitrogen 51985-034), смешивали и выдерживали при комнатной температуре (23-25°С) в течение 5 минут. ДНК разводили в 30 мкл Opti-MEM® на 1 мкг полной ДНК, смешивали и выдерживали при комнатной температуре (23-25°С) в течение 5 минут. Разведенные ДНК и трансфицирующий реагент смешивали в отношении 1:1 и выдерживали при комнатной температуре (23-25°С) в течение 25 минут. Смесь ДНК-293фектин™ вводили непосредственно в культуру клеток. Трансфицированную культуру клеток переносили в шейкер инкубатора при 37°С, 8% СО2 и скорости вращения 125 оборотов/мин. Через 4-7 дней супернатанты культуры клеток собирали центрифугированием и фильтровали через 0,22 мкм фильтр PES (№ по каталогу компании Corning 431098). Антитела анализировали в супернатантах или очищали стандартными методами очистки с использованием белка А.
Сравнение уровней экспрессии hzACO-1 и hzACO-1-CDRH2 Кабата
Уровни временной экспрессии hzACO-1 и hzACO-1-CDRH2 Кабата в клетках НЕК293-6Е сравнивали с целью определения воздействия дистальных остатков CDR H2 на способность клеток экспрессировать любой из двух вариантов антитела.
Клетки НЕК293-6Е трансфицировали в соответствии с приведенным выше описанием экспрессирующими векторами на основе рТТ для легкой цепи hzACO-1 и тяжелых цепей hzACO-1 или hzACO-1-CDRH2 Кабата. Трансфекцию производили в трех копиях. Для каждого варианта антитела трансфицировали три культуры (25 мл), используя основную смесь ДНК-293фектин для минимизации неточности пипетирования. Трансфицированные культуры инкубировали в инкубаторе с шейкером в течение 4 дней, как было описано выше. На 4-й день из культур отбирали образцы для измерения жизнеспособности и плотности клеток и супернатанты остальных культур клеток собирали центрифугированием. Количественный анализ продуцирования антител выполняли при помощи интерферометрии биослоя непосредственно на очищенных супернатантах культур клеток, используя систему ForteBio Octet и биосенсоры белка А. Плотность и жизнеспособность культур клеток измеряли в автоматическом анализаторе культур клеток Cedex HiRes. Результаты представлены в приведенной ниже таблице 4.

Результаты, приведенные в таблице 4, весьма неожиданно свидетельствуют о значительном различии уровней временной экспрессии hzACO-1 (гуманизированное антитело против IFN-альфа по настоящему изобретению) и hzACO-1-CDRH2 Кабата (антитело против IFN-альфа, гуманизированное стандартными методами и, следовательно, содержащее непроцессированные последовательности Кабата). В культурах клеток, трансфицированных любым из двух вариантов hzACO-1, не наблюдалось различий в жизнеспособности или плотности клеток. Уровень экспрессии hzACO-1 был примерно в 2 раза выше по сравнению с уровнем экспрессии варианта антитела hzACO-1-CDRH2 Кабата.
Уровни экспрессии антитела значительно увеличивались при присоединении более короткого варианта CDR H2 по сравнению с CDRH2 по определению Кабата.
Не ограничиваясь теорией, можно предположить, что остатки в hzACO-1, выделенные из зародышевых клеток человека, по сравнению с вариантом антитела hzACO-1-CDRH2 Кабата, несущим удлиненную последовательность CDR H2 (SEQ ID NO:16), влияют на укладку тяжелой цепи и потенциально на взаимодействие LC-HC, что вызывает лучшую устойчивость белка и, следовательно, более высокий выход экспрессии.
Такой более высокий уровень экспрессии белка вследствие лучшей устойчивости белка, выражающейся в уровнях временной экспрессии, находит отражение в устойчивых продуцирующих линиях клеток на основе СНО. Поэтому возможно создание высокопродуктивной устойчивой линии продуцирующих клеток при присоединении короткого варианта CDRH2 (SEQ ID NO:21).
Сравнение уровней экспрессии вариантов IgG4, 1 и 2 антитела hzACO-1
Уровни временной экспрессии в клетках НЕК293-6Е основного варианта IgG4(S241P) антитела hzACO-1 сравнивали с hzACO-1 (IgG1) и hzACO-1 (IgG2) с целью определения эффекта изменения подкласса тяжелой цепи на уровни экспрессии антитела.
Эксперимент выполняли аналогично вышеописанному анализу экспрессии, но при внесении следующих изменений. Эксперимент дублировали, идентично выполняя в 2-х 5 мл культурах. Культуры инкубировали в 50 мл фальконовых пробирках с крышкой в виде фильтра в инкубаторе с шейкером при 37°С, 8% СО2 и скорости вращения 250 оборотов/мин.
Средние уровни экспрессии hzACO-1(IgG1) и hzACO-1(IgG2) составляли примерно 65% от уровня экспрессии hzACO-1 (IgG4). На основании наблюдаемого уменьшения экспрессии белка (~35%) можно сделать вывод о том, что комбинация вариабельных доменов hzACO-1 и константного домена IgG4 является более эффективной, чем комбинации с другими подклассами цепей, и создание данной молекулы значительно облегчает получение устойчивой линии продуцирующих клеток.
Пример 6. Кристаллическая структура комплекса IFN-α8 с антителом hzACO-1-Fab
Кристаллическая структура комплекса IFN-α8 с Fab-фрагментом антитела hzSACO-1 была определена и скорректирована до разрешения 3,3 Å при помощи рентгеновской кристаллографии (фиг.8).
Материалы и методы
IFN-α8 (аминокислота 1-166 SEQ ID NO:30) и Fab-фрагмент антитела hzACO-1 (с последовательностью легкой цепи SEQ ID NO:32 и последовательностью тяжелой цепи, состоящей из остатков 1-221 SEQ ID NO:31) смешивали с небольшим избытком IFN-α8 и полученный комплекс очищали на колонке для гель-фильтрации. Белковый комплекс hzACO-1-Fab/IFN-α8 вводили в 25 мМ буфера HEPES, рН 7,5 с 235 мМ NaCl и концентрировали до 5 мг/мл. Комплекс кристаллизовали в осаждающем растворе, включающем 100 мМ буфера HEPES, рН 7,5, 15% PEG с молекулярной массой 10000 и 15% этиленгликоля. До получения данных дифракции кристалл быстро замораживали в жидком N2. Кристалл сначала переносили в криораствор, который представлял собой смесь 25% об./об. 99% глицерина и 75% осаждающего раствора. Данные дифракции были получены при излучении BLI911-3, MAX-Lab, Lung, Sweden. Данные дифракции индексировали и интегрировали при помощи пакета программ XDS (Kabsch, J. Appl. Crystallogr. 1993; 26:795-800).
Трехмерную структуру определяли методом молекулярного обмена (MR) с использованием программы PHASER (Read, 2001, Acta Crystallogr. Sect. D-Biol. Crystallogr. 57, 1373-1382) из пакета программ ССР4 (Baily, 1994, Acta Crystallogr. Sect. D-Biol. Crystallogr. 50, 760-763). Кристаллическая структура Fab-фрагмента hzACO-1, не входящего в комплекс, ранее была определена до разрешения 1,52 Å (значение R и свободного R равны соответственно 0,18 и 0,21), данные не представлены. Указанные трехмерные координаты затем использовали при вычислении MR для комплекса hzAco-1/IFN-α8. Модели поиска были разделены на три части: 1) вариабельный домен Fab-фрамента hzACO-1; 2) константный домен Fab-фрагмента hzACO-1 и 3) модель IFNtau из банка данных белков (PDB) (Berman et al., 2000, Nucleic Acids Res. 28, 235-241), код доступа 1B5L (Radhakrishnan et al., 1999, J. Mol. Biol., v. 286, pp. 151), мутированная в соответствии с программой СООТ для получения последовательности IFN-α8, SEQ ID NO:30. Конечную пространственную группу определяли при помощи программы PHASER. Наивысшие оценки были получены для пространственной группы Р4 при наличии пиков функции вращения, RZ, равных соответственно 10,7, 4,4 и 2,6 σ, пиков трансляции, TZ, равных соответственно 24,1, 26,4 и 8,0 σ, приращений логарифмической вероятности, LLG, равных соответственно 383, 918 и 1134, при отсутствии перекрываний определяющих симметрию молекул.
Вслед за молекулярным обменом была произведена некоторая корректировка модели в программе молекулярной графики СООТ, после чего был дважды выполнен имитированный отжиг со спиральным закручиванием до 2000 К без уточнения отдельных температурных показателей. Первоначальные значения R и свободного R были равны соответственно 0,416 и 0,439, и конечные значения после имитированного отжига были равны соответственно 0,314 и 0,427. Затем модель вручную изменяли в программе СООТ и вносили уточнения при помощи программы REFMAC5 (Murshudov et al., 1997, Acta Crystallogr. Sect. D-Biol. Crystallogr. 53, 240-255), в результате чего были получены значения R и свободного R, равные соответственно 0,216 и 0,348. Указанная модель включала остатки 1-21, при этом остатки 22-23 были признаны остатками Ala, 28-101 и 114-164 IFN-α8, 1-215 легкой цепи антитела hzACO-1 и 1-219 тяжелой цепи антитела hzACO-1.
Относительно большая разница между значениями R и свободного R, имевшая место при уточнении, возникла вследствие ограниченного разрешения данных, 3,3 Å, и из-за наличия значительных участков в рентгеновской модели IFN-α8, которые полностью отсутствуют на карте электронной плотности. На картах электронной плотности четко выражены остатки на стабилизированной границе раздела между IFN-α8 и hzACO-1-Fab, в то время как детали рентгеновской модели структуры IFN-α8 на расстоянии от центра антитела менее выражены и поэтому менее точно определены.
Результаты
Контакты были идентифицированы при помощи компьютерной программы CONTACT пакета ССР4 с использованием расстояния отсечки между молекулами Fab и IFN-α8, равного 4,0 Å. Было установлено, что эпитоп, полученный для человеческого антитела hzACO-1, содержит следующие остатки IFN-α8 (SEQ ID NO:30): Ser 55, His 58, Glu 59, Gln 62, Gln 63, Asn 66, Glu 97, Leu 118, Arg 121, Lys 122, Phe 124, Gln 125, Arg 126, Thr 128, Leu 129, Thr 132. Остатки антитела hzACO-1, определяющие взаимодействие с IFN-α8, паратоп, включали Ser 32, Tyr 33, Tyr 35, Tyr 50, Ser 51, Trp 92, Ser 93, Tyr 95 и Phe 97 легкой (L) цепи hzACO-1 (нумерация в соответствии с SEQ ID NO:32, не по Кабату) и Thr 30, Asn 31, Tyr 32, Trp 33, His 35, Glu 50, Asn 52, Ser 54, His 55, Arg 57, Leu 101, Gly 102, Trp 105 тяжелой (Н) цепи, таблица 9 (нумерация в соответствии с SEQ ID NO:31, не по Кабату).
SEQ ID NO:30
>IFN_a8

SEQ ID NO:32
Легкая цепь (LC) антитела hzACO-1

SEQ ID NO:31
Тяжелая цепь Fab-фрагмента антитела hzACO-1

Как показано на фиг.9, эпитоп взаимодействия с hzACO-1 на IFN-α8 частично перекрывает эпитоп связывания с IFNAR1, в то время как эпитоп связывания с IFNAR2 расположен на расстоянии от эпитопа связывания с hzACO-1. Из вышеизложенного следует, что антитело hzACO-1 нейтрализует IFN-α путем нейтрализации связывания IFN-α с IFNAR1, а не с IFNAR2. Таким образом, можно предположить, что антитело hzACO-1 связывается с комплексом IFN-α/IFNAR2, но ингибирует образование тройного комплекса рецепторов IFN-α/IFNAR1/IFNAR2, отвечающих за передачу сигналов между клетками.
Параметры кристаллического комплекса IFN-α8:hzACO-1-Fab, используемые для определения структуры
112,74
112,74
60,55
Статистические данные рентгеновской кристаллографии, полученные с помощью программы XSCALE пакета XDS
Статистические данные, полученные в результате последнего цикла уточнения структуры IFN-α8:hzACO-1-Fab в программе REFMAC
Взаимодействия IFN-α8 - легкой цепи Fab-фрагмента антитела hzACO-1
Данные отсекали при 4,0 Å. Контакты идентифицировали при помощи компьютерной программы CONTACT пакета ССР4. В последнем столбце тремя звездочками "***" отмечена высокая вероятность водородной связи в данном контакте (расстояние <3,3 Å), вычисленная программой CONTACT, одной звездочкой "*" отмечена низкая вероятность (расстояние >3,3 Å). Незаполненное поле указывает на вероятное отсутствие водородной связи по прогнозу программы.
Взаимодействия IFN-α8 - тяжелой цепи Fab-фрагмента антитела hzACO-1
Данные отсекали при 4,0 Å. Контакты идентифицировали при помощи компьютерной программы CONTACT пакета ССР4. В последнем столбце тремя звездочками "***" отмечена высокая вероятность водородной связи в данном контакте (расстояние <3,3 Å), вычисленная программой CONTACT, одной звездочкой "*" отмечена низкая вероятность (расстояние >3,3 Å). Незаполненное поле указывает на вероятное отсутствие водородной связи по прогнозу программы.
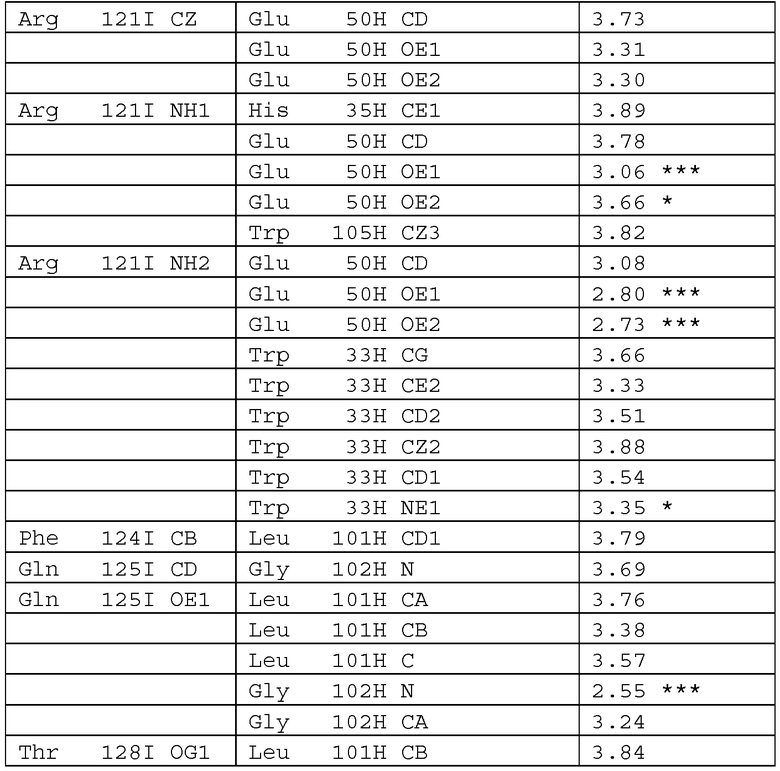
Пример 7. Создание структурных мутаций для созревания аффинности антитела hzACO-1
Если эпитоп и паратоп комплекса антитело/антиген неизвестны, большое число возможных аминокислотных остатков можно подвергнуть мутациям для улучшения сродства связывания антитела и, кроме того, указанные аминокислотные остатки могут быть превращены в любые из 20 оставшихся аминокислотных остатков для идентификации оптимального остатка в конкретном положении. CDR-область содержит примерно 54 остатка, которые могут быть мутированы. Таким образом, для улучшения сродства взаимодействия только в CDR-областях можно создать 54×20=1080 аналогов. Кроме того, для улучшения сродства связывания могут быть произведены мутации вне CDR-областей.
Однако когда структура комплекса антитело/антиген известна, на основании прогнозов структуры можно предсказать и исследовать более ограниченное количество уточненных мутаций, улучшающих сродство связывания. Таким образом, на основании кристаллической структуры комплекса IFN-α8 с Fab-фрагментом антитела hzACO-1, описанного в примере 6, были идентифицированы три мутации, улучшающие сродство связывания hzACO-1 со всеми подтипами IFN-α. Тремя мутантами являются hzACO-1 HC T30R, hzACO-1 LC Y32E и комбинированный мутант hzACO-1 Y32E, T30R (нумерация остатков по Кабату). Ниже описана идентификация мутантов.
Мутация Y32E легкой цепи (LC): как видно, плотность электронов остатка Lys 122 IFN-α8, который является частью эпитопа связывания с hzACO-1, свидетельствует о достаточно высокой подвижности. Кроме того, атом Оη остатка Tyr32 (обозначение Кабата) легкой цепи hzACO-1 расположен в направлении атомов Сβ и Сγ боковой цепи Lys 122. Указанное взаимодействие не является оптимальным взаимодействием между остатками. Мутация Tyr 32 легкой цепи в отрицательно заряженный остаток, такой как Glu или Asp, позволяет создать сильную ионную связь между остатком Tyr 32 легкой цепи антитела и положительно заряженным остатком Lys 122 IFN-α8. По этой причине остаток Y заменяют остатком E для улучшения сродства связывания антитела hzACO-1.
Мутация T30R тяжелой цепи (HC): для каждого остатка hzACO-1, близкого к IFN-α8 в рентгеновской структуре, были вычислены следующие свойства: число центральных атомов в боковой цепи (core), число периферических атомов в боковой цепи (peri), число взаимодействий заряженных остатков (char), число водородных связей (hyvo) и число взаимодействий гидрофобных остатков (hyph), представленные ниже:
Свойства аминокислот моноклонального антитела hzACO-1
Число центральных и периферических атомов вычисляли путем наложения рентгеновской структуры на сетку 101×101×101 и вычисления для каждой точки сетки числа атомов <2,5 Å (Nex) и атомов <3,5 Å (Nin) в узле. Центральные узлы имеют значение Nex>0, охватывая атомы из обоих hzACO-1 и IFN-8. Периферические узлы имеют значение Nex=0 и Nin>0, охватывая атомы из антитела hzACO-1 и IFN-α8. Центральные атомы боковой цепи являются атомами <2,5 Å из любого узла. Периферические атомы боковой цепи являются атомами ≥2,5 Å и <3,5 Å из любого узла.
Периферические остатки определяются как остатки только с периферическими атомами, не участвующие в взаимодействиях, поэтому указанные остатки могут быть модифицированы для достижения связывания. Были идентифицированы остатки S92 легкой цепи, Т28 тяжелой цепи, Т30 тяжелой цепи, Р52 тяжелой цепи, Q64 тяжелой цепи и Р99 тяжелой цепи. Сфокусировав внимание на остатках тяжелой цепи, не являющихся пролинами, можно отметить в результате визуального исследования, что мутация T28R тяжелой цепи делает возможным взаимодействие с остатком D90, мутация T30R тяжелой цепи делает возможным взаимодействие с остатками D90 и Е97 и мутация Q64R делает возможным взаимодействие с остатком Е114, при этом могут быть произведены другие подобные мутации. Так как только остаток Е97 сохраняется во всех альфа-интерферонах, можно предположить, что мутация T30R тяжелой цепи может обеспечить лучшее связывание с таким же профилем, что и у hzACO-1.
Специфическая мутация T30R тяжелой цепи выполнена для достижения взаимодействия между зарядами в периферической части сайта связывания для улучшения сродства связывания антитела hzACO-1.
Кроме того, был создан и исследован двойной мутант, содержащий мутации Y32E легкой цепи и T30R тяжелой цепи, именуемый hzACO-1 Y32E, T30R, для определения возможности аддитивных эффектов двух мутаций.
Пример 8. Определение кинетических параметров взаимодействия между hzACO-1, вариантами hzACO-1 и подтипами рекомбинантного IFN-α человека
Взаимодействия белков можно контролировать в реальном времени при помощи анализа резонанса поверхностных плазмонов (SPR). Анализ SRP выполняли в устройствах Biacore 3000 и Biacore T100 для исследования моноклонального антитела hzACO-1 против IFNα и его вариантов с целью выявления сродства связывания с разными подтипами рекомбинантного альфа-интерферона (IFN-α) человека.
Исследования сродства связывания выполняли методом прямого связывания, в соответствии с которым моноклональное антитело ковалентно связывали при помощи свободных аминогрупп с мембраной из карбоксиметилированного декстрана (СМ5) на поверхности сенсорного чипа. Подтипы рекомбинантного IFN-α (PBL Biomedical Laboratories, NJ, USA) вводили в разных концентрациях с последующим периодом диссоциации при постоянной скорости потока буфера по поверхности сенсорного чипа. В данном эксперименте связывание IFN-α с иммобилизованным моноклональным антителом можно рассматривать как связывание в отношении 1:1, при котором одна молекула IFN-α связывается с одним сайтом связывания антитела. Кинетические параметры взаимодействия могут быть вычислены при помощи модели согласования взаимодействий 1:1 Лангмуира.
Очищенные моноклональные антитела иммобилизовали в отдельных проточных ячейках на сенсорном чипе типа СМ5. Иммобилизацию выполняли стандартным методом связывания амином с достижением уровня иммобилизации, равного 1000 резонансных единиц (RU).
HBS-EP, рН 7,4 (10 мМ HEPES, 150 мМ NaCl, 3 мМ EDTA и 0,005% полисорбата Р20) использовали в качестве рабочего буфера и разбавителя для рекомбинантных IFN-α. Период ассоциации (введение) был равен 4 мин, и последующий период диссоциации составлял от 12 до 30 мин. Скорость потока была равна 50 мкл/мин. Эксперименты выполняли при 25°С. Производили одновременное обнаружение во всех проточных ячейках. В проточной ячейке № 1 отсутствовало иммобилизованное антитело, и данную ячейку использовали для вычитания фона и объема.
Кинетические параметры вычисляли путем общего согласования данных для данной комбинации антитело-антиген с использованием модели связывания 1:1 Лангмуира. Данные проверяли в отношении ограничений переноса массы до вычисления кинетических параметров.
Эксперименты выполняли в устройствах Biacore 3000 и Т100. Данные оценивали при помощи программного обеспечения Biaeval 4.1 и Biacore T100.
Полученные кинетические параметры являются действительными только в использованном буфере и с рекомбинантной формой антигена.
Результаты
Для получения гуманизированного антитела АСО-1, сохраняющего сродство связывания, при помощи разных методов был создан ряд гуманизированных вариантов, описанных в примерах 2, 3 и 7. Кинетические параметры взаимодействия между подтипами рекомбинантного IFN-α человека и вариантами hzACO-1 были получены в результате выполнения анализа SPR. Как показано в таблице 11, несмотря на то что антитело hzACO-1, созданное в соответствии с описанием, приведенным в примере 2, содержит усеченную последовательность CDR H2 при отсутствии обратных мутаций, сродство связывания антитела hzACO-1 было сохранено по сравнению с мышиным антителом АСО-1, о чем свидетельствует значение KD антитела hzACO-1, которое в два раза выше, чем у мышиного антитела. Таким образом, для гуманизации не нужно вносить дальнейшие обратные мутации в остовные области из человеческого в мышиное антитело АСО-1, как описано в примере 2. Кроме того, был сохранен профиль подтипа IFN-α в антителе hzACO-1, как показано в таблице 2.
Кинетические параметры взаимодействия рекомбинантного IFN-αА с антителом АСО-1 и вариантами антитела hzACO-1
KD означает константу равновесия диссоциации, ka означает константу скорости ассоциации, и kd означает константу скорости диссоциации
В таблице 12 приведены кинетические параметры взаимодействия антитела hzACO-1 с рекомбинантным IFN-α человека по сравнению с молекулой гуманизированного антитела АСО-1, полученного традиционным методом присоединения CDR и поэтому содержащего большую последовательность CDR H2 мышиного антитела (обозначаемого как hzACO-1-CDRH2 Кабата). Как показано в нижеследующей таблице, сродство связывания молекулы антитела hzACO-1, гуманизированного в соответствии с примером 2 и содержащего более короткую последовательность CDR H2, чем молекула антитела hzACO-1-CDRH2 Кабата, было одинаковым, из чего следует, что процесс гуманизации, описанный в примере 2, позволяет получить гуманизированный вариант с такими же хорошими характеристиками, что и антитело, полученное путем простого присоединения CDR, несмотря на наличие более длинной последовательности человека.
Кинетические параметры взаимодействия рекомбинантного IFN-αА с hzACO-1 и hzACO-1-CDRH2 Кабата
KD означает константу равновесия диссоциации, ka означает константу скорости ассоциации, и kd означает константу скорости диссоциации
Кроме того, для исследования наличия у hzACO-1 и hzACO-1-CDRH2 Кабата сравнимых кинетических параметров связывания с разными подтипами IFN-α человека выполняли эксперимент по сравнению диссоциации с использованием выбранных подтипов IFN-α человека (таблица 13). В нижеследующей таблице показано, что сродство связывания hzACO-1 сохраняется по сравнению с hzACO-1-CDRH2 Кабата со всеми испытанными подтипами, несмотря на наличие более короткой мышиной последовательности CDR H2.
Сравнение констант скорости диссоциации (kd) при взаимодействии разных подтипов рекомбинантного IFN-αА человека с hzACO-1 и hzACO-1-CDRH2 Кабата, соответственно
Для улучшения сродства связывания антитела hzACO-1 по сравнению с антителом АСО-1 измеряли кинетику параметров при взаимодействии IFN-αА с разными вариантами hzACO-1, содержащими мутации на основе последовательности АСО-2 (таблица 11). Для корреляции параметров, полученных в отдельно выполненных экспериментах, значение KD каждого отдельного антитела нормализовали в отношении hzACO-1 в том же эксперименте, при этом отношение значения KD отдельного моноклонального антитела (mAb) к значению KD hzACO-1 в том же эксперименте показано в столбце "KD mAb по сравнению с KD hzACO-1".
Определение сродства связывания дополнительно показало, что значения KD всех вариантов антитела hzACO-1 на основе АСО-2 (за исключением hzACO-1-I58S) находятся в более низком диапазоне нМ. Незначительные изменения значений KD связаны главным образом с различиями в kd. Единичные замены аминокислот N31S, A93V или T28S и их комбинации в антителе hzACO-1 немного увеличивали сродство связывания до уровня, аналогичного АСО-1. Мутация hzACO-1-I58S оказывала выраженное отрицательное воздействие на значение kd, что свидетельствует о важности данной аминокислоты для обеспечения устойчивости комплекса hzACO-1/IFN-αА.
На основании кристаллической структуры hzACO-1-Fab/IFN-α8 был произведен ряд замен аминокислот в антителе hzACO-1 с целью еще большего увеличения сродства связывания (см. пример 7). Из вышеуказанных замен две единичные замены, Y32E легкой цепи и T30R тяжелой цепи, оказали значительное положительное воздействие на сродство связывания с IFN-αА (таблица 14), которое увеличилось соответственно примерно в 2 и 6 раз. Следует отметить, что при объединении двух указанных мутаций в конструкции антитела hzACO-1, содержащей Y32E и T30R, сродство связывания с IFN-αА увеличилось примерно в 10 раз (таблица 15).
Кинетические параметры взаимодействия рекомбинантного IFN-αА соответственно с hzACO-1 и вариантами hzACO-1
KD означает константу равновесия диссоциации, ka означает константу скорости ассоциации, и kd означает константу скорости диссоциации
Кинетические параметры взаимодействия рекомбинантного IFN-αА соответственно с hzACO-1 и hzASCO-1 Y32E, T30R
KD означает константу равновесия диссоциации, ka означает константу скорости ассоциации, и kd означает константу скорости диссоциации
Кинетические данные, приведенные в таблице 16, показывают, что рационально созданная конструкция hzACO-1 Y32E, T30R сохранила профиль подтипа IFN-α, так как данная конструкция не связывается с IFN-α1, но связывается с остальными испытанными подтипами. Для проверки того, что влияние, оказываемое мутациями Y32E, T30R на кинетические параметры, находит отражение в связывании с разными подтипами IFN-α человека, выполняли эксперимент по сравнению диссоциации с использованием выбранных подтипов IFN-α человека (таблица 16). Хотя предложенные мутации в конструкции двойного мутанта hzACo-1 были созданы на основе структуры IFN-α8, улучшенные показатели наблюдались для всех испытанных подтипов IFN-α человека при увеличении в 6-64 раза.
Сравнение констант скорости диссоциации (kd) при взаимодействии разных подтипов рекомбинантного IFN-α человека соответственно с hzACO-1 и hzACO-1 Y32E, T30R
Пример 9. Анализ конструкций hzACO-1 при выполнении анализа СРЕ
В данном примере показано, что hzACO-1 может ингибировать защитное действие всех испытанных подтипов IFN-α, за исключением IFN-α1 и IFN-αD, на которые антитело hzACO-1 не влияет.
Материалы и методы
Данный анализ нейтрализации IFN-α основан на литическом воздействии вируса ЕМС на клетки А549. Все подтипы IFN-α могут ингибировать репликацию вируса ЕМС в клетках А549, что способствует выживанию клеток, которое может быть измерено путем окрашивания клеточной ДНК. Нейтрализующее воздействие антитела против IFN-α на разные подтипы IFN-α можно определить благодаря меньшему окрашиванию клеточной ДНК, что соответствует более высокому лизису клеток.
Данный анализ выполняли на 96-луночных планшетах (Nunc, № по каталогу 167008), где каждая лунка содержала образец в конечном объеме, равном 200 мкл. Все препараты IFN-α были приобретены в компании PBL Biomedical Laboratories, NJ, USA.
В каждую лунку добавляли четыре раствора (IFN-α, hzACO-1, клетки и вирус) по 50 мкл каждого. Все растворы были получены в среде F12 Кайна (Gibco, № по каталогу 21127) с 10% FCS. Удельная концентрация всех подтипов IFN-α (приведенных в нижеследующей таблице 17) была выведена из предыдущих исследований. Концентрации антитела, использованные в данном анализе, были выбраны на основании существующих данных, полученных при использовании, например, мышиных антител АСО-1.5.2 и АСО-2.2.
IFN-α каждого подтипа предварительно инкубировали с hzACO-1 в течение 2 часов при 37°С, 5% СО2. Антитело против интерферона разводили в соответствии с данными, приведенными в нижеследующей таблице 17. После предварительной инкубации антитела с IFN-α добавляли 50 мкл раствора клеток (300000 клеток/мл) до достижения 15000 клеток/лунку. После инкубации в течение 4,5 часа при 37°С, 5% СО2, добавляли 50 мкл вируса ЕМС в концентрации 10^3,5 TCID50 и инкубировали в течение 48 часов при 37°С, 5% СО2.
Супернатант осторожно удаляли и добавляли 50 мкл раствора кристаллического фиолетового (0,5% кристаллического фиолетового, 25% метанола). После инкубации в течение 15 минут при комнатной температуре лунки промывали в воде и сушили в течение ночи.
На высушенные планшеты добавляли 200 мкл/лунку чистого метанола и оставляли на 15 минут для экстракции кристаллического фиолетового из клеток. После экстракции 100 мкл супернатанта осторожно переносили на новый 96-луночный планшет (Nunc, № по каталогу 256510) и в каждую лунку добавляли 100 мкл воды Milli-Q. Затем планшет считывали при помощи спектрометра для ELISA при 590 нм.
Исходные данные, полученные на основании показаний спектрометра для ELISA, были скорректированы в отношении метанола и фона планшета до выполнения анализа.
Параметры анализа СРЕ
Результаты и их рассмотрение
При выполнении данного исследования на всех планшетах были использованы шесть разных контрольных образцов (клетки, клетки+антитело, клетки+IFN-α, клетки+антитело+IFN-α, клетки+вирус и клетки+IFN-α+вирус) для гарантии того, что цитопатический эффект, наблюдаемый в данном анализе, не был вызван цитотоксичностью антитела и/или IFN-α и что любое отсутствие защиты клеток от вируса со стороны IFN-α вызывало цитопатический эффект. В указанных анализах не был выявлен значительный цитотоксический эффект, и при отсутствии интерферона в контрольных образцах присутствовали признаки цитопатического эффекта.
Как видно на фиг.4, анализ СРЕ показал, что защитное действие почти всех подтипов интерферона могло быть ингибировано антителом hzACO-1. Однако антитело hzACO-1 не ингибировало защитное действие IFN-αD и IFN-α1 даже при концентрациях антитела 50000 нг/мл. Таким образом, в конструкции антитела hzACO-1 была сохранена специфичность мышиного антитела АСО-1.
Пример 10. Анализ антител, полученных на основе АСО, при выполнении биоанализа с использованием гена-репортера (RG)
Анализ с использованием гена-репортера на основе люциферазы выполняли для определения способности вариантов антитела hzACO-1 нейтрализовать биологическую активность подтипов рекомбинантного IFN-α.
Материалы
Полная среда Игла, модифицированная по способу Дульбекко: DMEM включала феноловый красный + 10% FCS + 2 мМ L-глутамина + пенициллин + стрептомицин + 2-me, 96-луночный планшет Nunc с оптическим основанием, обработанная культура черной ткани, PBS, включающий 1 мМ Са2+ и 1 мМ Mg2+, аналитическая система с использованием люциферазы Steady-Glo (Promega).
Линия клеток 93D7 была получена в результате устойчивой трансфекции линии клеток А549 (CLL-185, ATCC) IFN-индуцибельной конструкцией, содержащей промотор Мх, активирующий ген-репортер люциферазы. Промотор Мх состоит из фрагмента BamHI длиной 1,6 т.п.о., содержащего мышиный промотор МхА и элементы реакции на IFN, вырезанные из pSP64-Mxp(Pstl-Pvull)rβglo (Lleonart et al. (1990) Biotechnology 8: 1263-1267).
Использованные подтипы IFN-α (приобретенные в компании PBL Biomedical Laboratories, NJ, USA) представлены на фиг.5.
Методы
Анализы с использованием RG выполняли в четырех копиях на непрозрачных 96-луночных планшетах с оптическим основанием. В каждом анализе был использован положительный контрольный образец IFNα, а также отрицательные контрольные образцы, включающие нестимулированные клетки и клетки, обработанные антителом без стимуляции IFNα.
Адгезивные клетки 93D7 получали в колбах, для чего удаляли культуральную среду, один раз промывали PBS и обрабатывали трипсином. Обработку трипсином прекращали, используя полную среду DMEM. Клетки подсчитывали и доводили до 600000/мл в полной среде DMEM.
Очищенные моноклональные антитела против IFN-α предварительно инкубировали с разными подтипами рекомбинантного IFN в течение 1 часа в 100 мкл полной среды DMEM при 37°С + 5% СО2. После инкубации антитела с IFN добавляли 50 мкл клеток 93D7 и инкубировали в течение 5 часов при 37°С + 5% СО2.
Для анализа индукции МхА-активируемой люциферазы разными подтипами рекомбинантного IFN концентрацию IFN, вводимого в каждую лунку, доводили до 100 мкл. 100 мкл IFN вводили в четыре одинаковые лунки и инкубировали в течение 1 часа при 37°С + 5% СО2. Затем добавляли 50 мкл клеток и продолжали инкубацию в течение еще 5 часов.
Для анализа ингибирования индукции МхА-активируемой люциферазы разными подтипами рекомбинантного IFN при помощи очищенных моноклональных антител в каждую лунку добавляли 50 мкл рекомбинантного IFN, разведенного соответствующим образом. В лунки добавляли 50 мкл антитела, разведенного в полной среде DMEM, и инкубировали в течение 1 часа при 37°С + 5% СО2. Затем добавляли клетки и инкубацию продолжали в течение еще 5 часов.
После 5-часовой инкубации среду осторожно удаляли из клеток при помощи многоканальной пипетки. Затем к основанию 96-луночного планшета прикрепляли адгезивный черный блокатор. В каждую лунку добавляли 100 мкл PBS с ионами Са2+ и Mg2+. Затем в каждую лунку добавляли 100 мкл восстановленного реагента Steady-Glo так, чтобы содержимое каждой лунки было тщательно перемешано. Планшеты закрывали прозрачной липкой полосой. Планшеты инкубировали в темноте в течение 5 минут при комнатной температуре и считывали показания люминесценции при помощи счетчика люминесценции Topcount (Perkin Elmer).
Степень ингибирования антителом IFN-индуцированной (стимулируемой промотором МхА) активности люциферазы вычисляли при сравнении ингибирования антителом разных подтипов IFN-α, нормализованных до уровней активности при отсутствии антитела, значение которых было принято равным 100%. Данные ингибирования вариантом антитела отдельных IFN-α представлены для сравнения в виде необработанных данных активности люциферазы. IFN сначала титровали при отсутствии антитела для определения ЕС50 и концентрации IFN, при которой достигался горизонтальный участок графика при выполнении данного анализа. При исследовании ингибирования антителом интерферон (IFN) обычно использовали при 80% максимальных уровнях стимулирования для гарантии устойчивой индукции люциферазы, а также для выполнения анализа при уровне ниже насыщения. Для вычисления и отображения данных было использовано программное обеспечение Prism (GraphPad Software, Inc., San Diego).
Результаты и их рассмотрение
Конструкции гуманизированного антитела АСО-1 оценивали в отношении их способности ингибировать разные подтипы IFN-α человека при выполнении анализа с использованием гена-репортера. На фиг.5 показаны нормализованные данные ингибирования антителом hzACO-1 12 подтипов IFN-α. Стимуляция IFN-α при отсутствии антитела была задана равной 100%, в то время как стимуляция псевдообработанных клеток (к которым добавляли только среду) была задана равной 0%. Точки на графике показаны со стандартной ошибкой. Кривые вычисляли по методу наилучшего приближения сигмоидальных кривых реакции при помощи программного обеспечения Prism. Антитело hzACO-1 ингибировало все испытанные подтипы IFN-α за исключением IFN-αD и в процессе гуманизации сохранило специфичность исходного мышиного антитела АСО-1. Ингибирование было полным в том отношении, что при высоких концентрациях антитела активность IFN-α уменьшалась до фоновых уровней. Значение IC50 ингибирования разных подтипов IFN-α в данном исследовании находилось в пределах от 28 нг/мл до 314 нг/мл. Антитело hzACO-1 не ингибировало IFN-αD даже при более высоких концентрациях.
На фиг.10 показано сравнение мышиного антитела АСО-1 с гуманизированным антителом АСО-1 (hzACO-1), а также с двумя его вариантами при выполнении анализа с использованием гена-репортера. Один вариант является гуманизированным антителом АСО-1, содержащим всю последовательность CDRH2 (антитело, определяемое как hzACO-1-CDRH2 Кабата), в то время как антитело hzACO-1 было создано с использованием более короткой последовательности CDRH2, описанной в примере 2. Кроме того, на данной фигуре показано другое мутированное антитело hzACO-1, которое было рационально оптимизировано для взаимодействия с IFN-α (определяемое как hzACO-1 Y32E, T30R) в соответствии с описанием, приведенным в примере 7. Указанные четыре варианта рекомбинантного моноклонального антитела сравнивали в отношении ингибирования пяти разных типичных подтипов IFN-α при выполнении анализа с использованием гена-репортера.
Антитело hzACO-1 имело такие же значения IC50 для всех пяти подтипов IFN, что и мышиное антитело АСО-1, при этом в количественном отношении значения IC50 были в два раза меньше (см. таблицу 18 для ознакомления с относительными значениями IC50) с учетом значений KD, приведенных в примере 8. Таким образом, гуманизацию выполняли с потерей сродства связывания при функциональном ингибировании, которое было в два раза меньше, чем у исходного антитела АСО-1. В заключение следует отметить, что в результате гуманизации моноклонального антитела АСО-1 было получено антитело, сохранившее сродство связывания с IFN-α. Таким образом, в антителе hzACO-1 были сохранены сродство связывания и активность, присущие исходному мышиному антителу АСО-1 при отсутствии обратных мутаций.
Как описано в примере 2, в результате гуманизации антитела АСО-1 было получено антитело с относительно большим числом человеческих аминокислот в CDR H2 по сравнению с обычной гуманизацией путем простого присоединения CDR. Хотя можно было ожидать уменьшения активности гуманизированного антитела АСО-1 в отношении нейтрализации подтипов IFN-α, представленных на фиг.10 и в таблице 18, этого не произошло, так как антитела hzACO-1 и hzACO-1-CDRH2 Кабата одинаково активно воздействуют на все подтипы IFN-α. Данный результат соответствует сродству связывания, указанному для двух вариантов АСО-1, описанных в примере 8.
Значения IC50 для ингибирования подтипов IFN-α вариантами антитела hzACO-1
Нормализованные данные. Значения IC50 были нормализованы для всех подтипов IFN-α в отношении hzACO-1. Поэтому значение меньше единицы соответствует более активному ингибированию активности IFN-α антителом hzACO-1 и значения больше единицы означают менее активное ингибирование
Для определения активности вариантов hzACO-1, полученных из антитела АСО-2, которые были описаны в примере 3, указанные варианты сравнивали с hzACO-1 при выполнении анализа с использованием гена-репортера. Сравнение производили, используя два подтипа IFN-α (IFN-αF и IFN-αА). Были испытаны четыре разны замены единичных аминокислот: T28S (то есть треонин в положении 28 (по Кабату) был заменен серином), I58S, N31S и A93V.
Вариант I58S ингибировал действие IFN менее активно и, возможно, с меньшей эффективностью (IFN-αА), варианты T28S и N31S обладали такой же активностью, что и hzACO-1. Однако вариант с заменой A93V обладал более высокой активностью ингибирования действия IFN, измеренной при помощи анализа с использованием гена-репортера (фиг.6). Хотя разные замены по-разному воздействуют на разные подтипы IFN-α, тенденция была одинаковой для обеих форм во всех четырех случаях.
Благодаря рациональному подходу к использованию кристаллической структуры в примере 6 был создан мутант с заменой двух аминокислот T30R тяжелой цепи, Y32E легкой цепи антитела hzACO-1 (определяемого как АСО-1 Y32E, T30R), описанного в примере 7, для улучшения связывания с IFN-α. Несмотря на то что мутации были основаны на структуре IFN-α8, как показано на фиг.10 (А-Е), данный мутант обладает более высокой активностью ингибирования всех испытанных подтипов IFN-α. Кроме того, в таблице 18 показано, что хотя увеличение активности зависит от конкретного подтипа, активность выросла в 16-50 раз.
Из вышеизложенного следует, что информация об эпитопе, полученная на основании кристаллической структуры в примере 6, может быть использована для создания других вариантов антитела с улучшенным сродством связывания с данным эпитопом. В объем настоящего изобретения входят такие варианты гуманизированного антитела по настоящему изобретению.
Пример 11. Исследования белка гуманизированных антител, полученных из антитела АСО
В данном примере рассмотрена теплостойкость антитела hzACO-1 и разных вариантов.
Материалы
Антитела
hzACO-1, экспрессированное в виде изотипов IgG1, IgG2 и IgG4 человека
hzACO-1-T28S
hzACO-1-N31S
hzACO-1-A93V
hzACO-1-T28S-N31S
Ниже приведен перечень буферов (100 мМ) и их значений рН, использованных в данном исследовании: лимонная кислота/цитрат натрия, рН 3,0, 3,5; ацетат натрия, рН 4,0, 4,5 и 5,0; гистидин, рН 6,0, 6,5; имидазол, рН 7,0; глицин-глицин, рН 8,0, 9,0, 10,0.
Ниже приведен перечень добавок и их концентраций, использованных в данном исследовании: NaCl, 100 мМ; сахароза 0,25 М, 0,50 М; фенол, 0,5%; твин 80, 0,01%; глицерин, 10%.
Термофлуоресцентные измерения устойчивости
В лунки 96-луночного планшета для ПЦР (Biorad) вводили растворы 10 мкл 5000-кратного концентрата оранжевого гелевого красителя для окраски на белок 400Х SYPRO в ДМСО (Invitrogen Molecular Probes), 25 мкл буфера и 10 мкл белка (10 мкМ). Планшеты заклеивали при помощи приспособления для заклеивания планшетов Microseal B Adhesive MSB-1001 (Biorad) и нагревали в одноцветной системе обнаружения ПЦР в реальном времени MyiQ при температуре от 25 до 95°С с пошаговым приращением температуры на 0,5°С. Изменения флуоресценции в лунках планшета одновременно контролировали камерой устройства с зарядовой связью (CCD). Длины волн возбуждения и эмиссии были соответственно равны 490 и 575 нм. Среднюю температуру развертывания белка определяли в виде первого производного максимума интенсивности флуоресценции в зависимости от температуры.
На графиках термофлуоресценции антитела hzACO-1 и его вариантов видны два ожидаемых температурных перехода для белков IgG, отражающих два основных домена, Fc и Fab. Белки характеризовались более низким значением Tm при более низком значении рН. При значении рН выше 5,5 средняя температура перехода была достаточно постоянной.
Влияние добавок было одинаковым для разных антител. Как правило, сахароза в количестве 0,5 М оказывала наиболее сильное стабилизирующее действие, в то время как добавление NaCl, фенола и твина-80, по-видимому, оказывало дестабилизирующее действие.
При более низком значении рН (рН 3,5) наблюдалось различие в устойчивости антитела hzACO-1 и разных вариантов (фиг.7А). Двойной мутант hzACO-1-T28S-N31S и единичный мутант hzACO-1-A93V характеризовались наибольшей устойчивостью при данном значении рН. Такой показатель может быть важен для очистки терапевтического антитела, так как инактивацию вируса часто производят при рН 3,5-4,0. При более высоких значениях рН (рН 4,5, 5,5; фиг.7В и 7С, соответственно) различие в устойчивости уменьшается.
Исследование устойчивости раствора
Растворы hzACO-1-IgG4, hzACO-1-IgG1 и hzACO-1-IgG2 в 15 мМ гистидина (рН 6,5), 20 мг/мл сахарозы и 0,01% Твина-80 инкубировали при 40°С и образцы отбирали для анализа в начале инкубации и через 5 недель. Распределение интактного белка, растворимого агрегата и/или фрагментов hzACO-1 определяли при помощи вытеснительной хроматографии (SEC-ВЭЖХ). Систему для высокоэффективной жидкостной хроматографии (ВЭЖХ) модели 1100 или систему для жидкостной хроматографии 1200 (Agilent Technologies, Palo Alto, CA) использовали вместе с колонкой BIOSEP SEC 3000 (Phenomenex) при скорости потока 0,8 мл/мин со значением рН 7,2 и физиологическим раствором с фосфатным буфером (PBS) в качестве подвижной фазы. Белок обнаруживали, контролируя оптическую плотность (OD) при 215 нм. Вычисляли процентное значение каждого пика во всей области белка.
Количество образовавшихся высокомолекулярных форм изотипов hzACO-1 показано на фиг.11, где ясно видно, что в конструкции с IgG4 не наблюдалось образования агрегатов во время инкубации, в то время как изотипы IgG1 и IgG2 образовывали высокомолекулярные варианты.
Кроме того, вариант hzACO-1-IgG1 содержал низкомолекулярный фрагмент после инкубации. Указанный фрагмент составлял 1,3%.
Таким образом, с точки зрения устойчивости hzACO-1-IgG4 является наиболее привлекательной терапевтической молекулой по сравнению с соответствующими антителами IgG2 и IgG1.
Пример 12. Анализ антителозависимой клеточно-опосредованной цитотоксичности (ADCC)
Как описано в примере 6, моноклональное антитело АСО-1 и его гуманизированные варианты могут блокировать активность IFN-α, ингибируя связывание IFN-α с субъединицей 1 рецептора альфа-интерферона типа I (IFNAR1). Таким образом гуманизированное терапевтическое моноклональное антитело АСО-1 может связываться с поверхностью клетки с образованием комплекса, состоящего из антитела, IFN-α и IFNAR2. В результате этого возникает риск индуцирования антителом АСО-1 антителозависимой клеточно-опосредованной цитотоксичности (ADCC).
В данной связи был выполнен эксперимент по исследованию ADCC антитела hzACO-1, экспрессированного в виде подтипа IgG4 в присутствии IFN-α2А.
Материалы и методы
В качестве клеток-мишеней использовали Raja-клетки (линия В-клеток человека (АТСС № CCL-86)). Raja-клетки культивировали в среде RPMI 1640, содержащей 10% фетальной телячьей сыворотки, 10 мМ HEPES, 1 мМ пирувата натрия, 1 мМ глутамина, 2,5 г/л глюкозы и 1% пенициллина/стрептомицина. Для анализа использовали хорошо очищенный интерферон-α2А. Перед использованием белок исследовали в отношении биологической активности при помощи анализа с использованием гена-репортера. При использовании Raja-клеток, представляющих собой линию В-клеток, экспрессирующую антиген CD-20 на поверхности В-клеток, в качестве положительного контрольного образца в отношении ADCC использовали ритуксан® (Nomeco A/S, Denmark).
Клетки-мишени собирали и подсчитывали в гемоцитометре. 1,5×106 клеток переносили в 15 мл пробирку и центрифугировали. Супернатант полностью удаляли и клеточный дебрис ресуспендировали в 100 мкСi 51Cr (хром-51) на 106 клеток (объем определяли по таблице распада). В течение 1-го часа инкубации при 37°С с IFN-α из пробирки удаляли жидкость через каждые 15 минут. Затем клетки дважды промывали в среде (RPMI 1640, 10% FCS) и ресуспендировали в 2 мл аналитической среды. 5000 клеток, меченных 51Cr, культивировали в 50 мкл объеме на 96-луночных планшетах (с плоским основанием). Все образцы анализировали в трех копиях. Максимальное и минимальное высвобождение определяли в лунках без эффекторных клеток. Максимальное высвобождение: 5000 клеток-мишеней/лунку + 1% Тритона Х-100. Минимальное высвобождение: 5000 клеток-мишеней/лунку. Эффекторные клетки очищали от "лейкоцитарной пленки" путем центрифугирования в градиенте плотности фиколла стандартными методами. В каждую лунку вводили только что выделенных РВМС человека в разных количествах. Были использованы следующие соотношения эффекторных клеток и клеток-мишеней (Е:Т): 10, 20, 40 и 80. Во всех экспериментах антитело hzACO-1 испытывали при концентрации насыщения, равной 10 мкг/мл (66 нМ). IFN-α2А испытывали при 0,5, 2,5, 5 и 10 нМ. Конечный анализируемый объем был равен 200 мкл. После инкубации в течение 4 часов при 37°С 30 мкл супернатанта переносили в Luma-Plate™ и подвергали воздушной сушке в течение ночи. Радиоактивность определяли в устройстве TopCount NXT (Perkin Elmer, USA). Данные вводили в программу GraphPrism® и вычисляли среднее число импульсов в минуту для трех копий и соответствующее стандартное отклонение.
Результаты
Как показано на фиг.12, для молекулы hzACO-1, экспрессированной в виде IgG4 в присутствии или в отсутствие IFN-α, не была отмечена индукция выше фоновой (клетки или клетки с IFN-α). В отличие от этого, ритуксумаб, использованный в качестве положительного контрольного образца, вызывал лизис клеток при разных соотношениях эффекторных клеток и клеток-мишеней (Е:Т).
Пример 13. Анализ связывания комплемента методом ELISA
Как описано в примере 6, моноклональное антитело АСО-1 и его гуманизированные варианты могут блокировать активность IFN-α, ингибируя связывание IFN-α с субъединицей 1 рецептора альфа-интерферона типа I (IFNAR1). Таким образом, гуманизированное терапевтическое моноклональное антитело АСО-1 может связываться с поверхностью клетки, образуя комплекс, состоящий из антитела, IFN-α и IFNAR2. В результате этого возникает риск активации системы комплемента и индуцирования комплементзависимой цитотоксичности (CDC).
Целью настоящего эксперимента по связыванию комплемента было исследование возможности активации классического пути активации комплемента в тех случаях, когда hzACO-1, экспрессированный в виде изотипа IgG4 человека, связывается с соответствующим эпитопом на hIFN-α и образует комплекс. Данное исследование выполняли методом ELISA, позволяющим измерить связывание антител с С4. Связывание с С4 показывает, что происходит изменение С1 и активируется путь активации комплемента. После связывания С4 в свою очередь активируются другие компоненты комплемента из плазмы, которые связываются и ферментативно расщепляют следующие компоненты пути активации комплемента.
Материалы и методы
В качестве планшетов для выполнения анализа методом ELISA использовали титрационные микропланшеты, сенсибилизированные стрептавидином (236001, NUNC). Биотинилированное антитело hIFN-α2А использовали в качестве источника антигена и планшеты сенсибилизировали 0,25 мкг/мл белка, разведенного в промывочном буфере до 100 мкл/лунку (10 мМ Na3PO4 + 145 мМ NaCl + 0,05% твина-20). Было установлено, что данная концентрация hIFN-α является оптимальной сенсибилизирующей концентрацией при выполнении анализа ELISA. Планшеты инкубировали в течение 60 минут при комнатной температуре и осторожном встряхивании, затем пять раз промывали в промывочном буфере, оставляя буфер после последней промывки на планшетах на 30 минут для блокирования возможных оставшихся сайтов связывания. Буфер сливали с планшетов и на планшеты добавляли 100 мкл моноклонального антитела hzACO-1 в концентрации 1 мкг/мл, разведенного в промывочном буфере. Планшеты инкубировали в течение 60 минут при комнатной температуре и осторожном встряхивании. Планшеты пять раз промывали в промывочном буфере. Поликлональное антитело против IgG использовали в качестве положительного контрольного образца, перекрестно связывающегося с моноклональным антителом hzACO-1 IgG4. Поликлональное антитело против IgG4 разводили в промывочном буфере и наносили на планшеты в виде последовательных разведений от 32 мкг/мл до 32 нг/мл в количестве 100 мкл/лунку. Производили две разные очистки поликлонального антитела против IgG4, одну очистку при помощи аффинной хроматографии и одну очистку белком А. Планшеты инкубировали в течение 60 минут при комнатной температуре и осторожном встряхивании. Планшеты пять раз промывали в промывочном буфере. Человеческую плазму, разведенную в отношении 1:200 в буфере для плазмы (PBS с 0,3 мМ Са2+, 1 мМ Mg2+), добавляли в количестве 100 мкл/лунку. Планшеты инкубировали в течение 60 минут при 37°С и осторожном встряхивании. Планшеты пять раз промывали и добавляли мышиное антитело против С4 человека (HYB162-02 + HYB162-04, SSI), разведенное в отношении 1:20000 в промывочном буфере, в количестве 100 мкл/лунку. Планшеты инкубировали в течение 60 минут при комнатной температуре и осторожном встряхивании. Планшеты пять раз промывали в промывочном буфере и добавляли 100 мкл/лунку антитела HRP кролика против IgG мыши (DAKO P0260), разведенное в отношении 1:1000 в промывочном буфере. Планшеты промывали пять раз и во все лунки добавляли 100 мкл субстрата ТМВ. После инкубации в течение примерно 6 минут во все лунки добавляли 100 мкл 4 М раствора Н3РО4 для прекращения ферментативной реакции. Производили спектрофотометрическое измерение цвета при помощи спектрофотометра для прочтения планшетов Victor (Wallac).
Результаты
Антитело hzACO-1, экспрессированное в виде изотипа IgG4 человека, исследовали методом ELISA в отношении способности связывать компоненты комплемента, используя планшеты, сенсибилизированные IFN-α. Содержимое лунок визуализировали, обнаруживая связывание с С4, который является одним из компонентов классического пути активации комплемента. Как показано на фиг.13, антитело hzACO-1 IgG4 было неспособно фиксировать комплемент. В качестве положительного контрольного образца использовали поликлональное антитело против IgG4 для индукции связывания путем перекрестного связывания с антителом hzACO-1 IgG4. При перекрестном связывании антитела hzACO-1 с поликлональным антителом против IgG4 было обнаружено связывание С4 с антителом против IgG4 в четко выраженной зависимости от дозы.
Пример 14. Выбор изотипа антитела
В случае экспрессии гуманизированного моноклонального антитела необходимо выбрать изотип человеческого антитела для экспрессии непроцессированного человеческого антитела. При создании нейтрализующего антитела против IFN-α не требуются Fc-опосредованные эффекторные функции.
Кроме того, хотя антитела, полученные из АСО-1, способны нейтрализовать активность IFN-α (пример 9 и пример 10), эпитоп связывания вариантов антитела АСО-1, описанных в примере 6, может одновременно связываться с субъединицей рецептора IFNAR2 и IFN-α. Таким образом, несмотря на то что терапевтическое моноклональное антитело hzACO-1 связывается с растворимым цитокином IFN-α, моноклональное антитело фактически может связываться с поверхностями клеток благодаря комплексу IFN-α/IFNAR2, вызывающему цитотоксичность в результате рекрутинга Fc-опосредованных эффекторных функций. Помимо этого, для антител против IFN типа I (IFN-α и IFN-β) особое значение имеет выбор изотипа антитела, поскольку, как было показано, Fc-часть моноклональных антител против IFN вызывает нежелательные биологические эффекты, ведущие к усилению активности IFN вместо его нейтрализации в клетках определенных типов, описанных ниже (Moll H.Р. et al., J. Immunol. 180, 1594-604, 2008).
В присутствии IFN типа I антитела против IFN-α или IFN-β человека, которые обычно нейтрализуют активность IFN в клетках других типов, в данном случае индуцируют активность IFN в эндотелиальных клетках человека и РМВС в присутствии IFN-α или IFN-β. Антитела, используемые в указанных исследованиях, относятся к изотипу IgG1 мыши и, как известно, перекрестно связываются с Fc-рецепторами человека. Индукция активности IFN наблюдается только для интактных антител, но не для Fab- или Fab2-фрагментов тех же антител, которая, по-видимому, ингибируется блокадой Fc-рецепторов контрольным в отношении изотипа моноклональным антителом. Таким образом, хотя молекулярный механизм данного явления неизвестен, по-видимому, необходимо, чтобы указанные моноклональные антитела связывались с рецепторами на поверхности клеток при помощи Fc-части. Кроме того, данное явление, по-видимому, является специфичным для IFN типа I и антител против IFN типа II, IFN-γ, так как подобное явление не наблюдается для антител против рецептора IFN типа I, IFNAR (Moll H.P. et al., J. Immunol. 180, 1594-604, 2008).
Коротко говоря, при создании терапевтического моноклонального антитела против IFN для нейтрализации IFN-α не требуются Fc-опосредованные эффекторные функции, которые фактически могут вызывать нежелательные биологические эффекты, ведущие к цитотоксичности или усилению активности IFN в клетках определенных типов у субъектов, подвергнутых лечению моноклональным антителом против IFN. Поэтому создание гуманизированного моноклонального антитела, которое не способно индуцировать эффекторные функции, может иметь важное значение.
Существуют четыре разных изотипа человеческого антитела, то есть IgG1, IgG2, IgG3 и IgG4. Из вышеуказанных изотипов IgG1 и IgG3 наиболее эффективно связываются с Fc-рецепторами и комплементом и, следовательно, активируют Fc-опосредованные эффекторные функции, такие как антителозависимая клеточно-опосредованная цитотоксичность (ADCC) и комплементзависимая цитотоксичность (CDC) (Salfeld J.G., Biotechnol 25, 1369-1372, 2007). В научной литературе описаны мутации, которые блокируют связывание разных Fc-рецепторов и C1q (Hezareh M. et al., J. Virol. 75, 12161-12168, 2001. Idusogie E.E. et al., J. Immunol. 164, 4178-4184, 2000, Lund J. et al., J. Immunol. 147:2657-6, 1991, & Chappel et al. 1991, Canfiels M.S. et al., J. Exp. Med.173:1483-91, 1991). Однако выбор, например, изотипа IgG1 и включение нескольких мутаций потенциально может привести к иммуногенности и вызвать иммунный ответ против Fc-части у человека, так как модифицированная Fc-область у человека отсутствует.
По этой причине моноклональное антитело hzACO-1 против IFN-α было экспрессировано с изотипами IgG2 и IgG4, которые использованы в ряде терапевтических антител (Salfeld J.G., Biotechnol. 25, 1369-1372, 2007). Весьма неожиданно уровни экспрессии конструкции с IgG4 оказались значительно выше, чем у варианта hzACO-1 IgG2 (пример 5), что существенно увеличило выход продукта. Кроме того, молекула hzACO-1 IgG2 в отличие от варианта с IgG4 была подвержена агрегации (пример 11). Агрегация считается серьезной проблемой при создании лекарственных средств, так как вследствие агрегации уменьшается выход продукта, сокращается срок хранения и снижается активность в организме субъектов из-за повышенной иммуногенности.
Таким образом, для дальнейшего исследования с помощью анализа ADCC в присутствии IFN-α и анализа фиксации комплемента методом ELISA, описанных соответственно в примерах 12 и 13, была выбрана конструкция hzACO-1 IgG4. Полученные данные подтверждают, что молекула hzACO-1 IgG4 действительно не вызывает нежелательную цитотоксичность. Ожидаемое отсутствие усиления активности IFN-α также можно подтвердить в клетках РВМС и ЕС, как описано в публикации Moll et al., 2008.
Таким образом, молекула hzACO-1 IgG4, по-видимому, является особенно приемлемой терапевтической молекулой, способной нейтрализовать IFN-α без нежелательных побочных эффектов, вызываемых Fc-опосредованными эффекторными функциями, включающими цитотоксичность и усиление активности IFN, и то, что данная молекула является устойчивой и хорошо экспрессированной молекулой, делает ее пригодной для производства и введения субъектам.
Пример 15. Анализ Т-клеточных эпитопов
На основании стандартных методов прогнозирования иммуногенности (De Groot, A.S. and Moise, L. Curr. Opin. Drug Discov. Devel. 10, 332-340, 2007) для прогнозирования линейных Т-клеточных эпитопов в 51 аллеле HLA-DRB был использован простой метод профилирования (Sturniolo, T. et al., Nat. Biotechnol. 17, 555-561, 1999), усовершенствованный с помощью программы ProPred (Singh, H. & Raghava, G.P. ProPred. BiolFNormatics. 17, 1236-1237, 2001). В соответствии с данным методом вычисляют число аллелей, с которыми может связываться данный пептид, состоящий из 9 остатков, в рассматриваемом белке. Пептид, отличный от человеческого, который связывается со многими аллелями, может быть использован в качестве непрямой меры иммуногенности. В случае человеческого пептида не ожидается иммунного ответа вследствие раннего отрицательного отбора соответствующих Т-клеток.
Целью данного примера является сравнение прогнозируемой иммуногенности метода гуманизации с использованием непроцессированного антитела hzACO-1-CDRH2 Кабата с действительной процедурой гуманизации, используемой для создания антитела hzACO-1.
В качестве исходных последовательностей для алгоритма ProPred была использована непроцессированная область CDR_H2 антитела ACO-1 с добавлением 10 + 10 остатков вокруг hzACO-1-CDRH2 Кабата: APGQGLEWMG/EINPSHGRTIYNENFKS/RVTMTRDTST (CDR_H2_Full) вместе со сравниваемой последовательностью hzACO-1 APGQGLEWMG/EINPSHGRTIYAQKFQG/RVTMTRDTST (CDR_Н2_Human) в той же области.
Исследование CDR_H2_Full в устройстве, прогнозирующем Т-клеточные эпитопы, позволило получить 3 следующих эпитопа: WMGEINPSH (связывание с 4% аллелей HLA-DRB), INPSHGRTI (6%) и FKSRVTMTR (24%). Для CDR_H2_Human два первых второстепенных эпитопа являются идентичными, в то время как последний главный эпитоп превращен в FQGRVTMTR (27%). Даже если указанный эпитоп все еще является Т-клеточным эпитопом, теперь он стал полностью человеческой последовательностью, и исходя из предположения, что аутореактивные Т-клетки удалены в результате отрицательного отбора в тимусе, данный потенциально главный эпитоп в CDR_H2_Full удален последовательностью CDR_H2_Human.
Таким образом, следует ожидать, что антитело hzACO-1 является менее иммуногенным, чем традиционно гуманизированное антитело АСО-1 с присоединенной CDR-областью.
Пример 16. Усечение CDR-области
Как описано в примере 2, мышиное антитело АСО-1 было гуманизировано нетрадиционным методом. Данный метод включает создание маски остатков, которые в соответствии с прогнозом образуют паратоп, на основании трехмерной модели hzACO-1 и IFN-αА. В результате применения указанного метода гуманизации было получено антитело hzACO-1 с меньшим числом мышиных остатков по сравнению с антителом, гуманизированным путем простого присоединения CDR, так как пептид, включающий 5 С-концевых аминокислот оптимизированной последовательности CDR H2 антитела hzACO-1, был идентичен соответствующей последовательности остовной области человека. В отличие от этого соответствующая пептидная последовательность в традиционно гуманизированном антителе с присоединенной CDR-областью (hzACO-1-CDRH2 Кабата) имела мышиное происхождение. Таким образом, в результате выполнения данной процедуры гуманизации было получено гуманизированное антитело с более человеческой последовательностью, которое с меньшей степенью вероятности вызывает иммуногенность у субъектов. Анализ последовательностей CDR H2 показал, что в результате уменьшения мышиных аминокислотных остатков в антителе hzACO-1 Т-клеточный эпитоп класса II MHC, содержащий мышиные аминокислоты, удаляется и заменяется полностью человеческим эпитопом, к которому субъекты должны быть толерантны. Полученные данные подтверждают, что антитело hzACO-1 является менее иммуногенным, чем традиционно гуманизированное антитело АСО-1 с присоединенной CDR-областью.
Антитело hzACO-1 сохраняет сродство связывания, которое в два раза выше, чем у мышиного антитела АСО-1, как показано в примере 8. При этом не требуются дополнительные обратные мутации мышиного антитела. Кроме того, сохраняется профиль подтипа IFN-α антитела, связывание и нейтрализация всех подтипов IFN-α за исключением IFN-α1/D, как описано в примерах 8, 9 и 10. Несмотря на наличие меньшего числа мышиных аминокислот в CDR H2, сродство связывания антитела hzACO-1 идентично сродству связывания и активности антитела hzACO-1-CDRH2 Кабата, содержащего непроцессированную последовательность CDR H2 мышиного антитела АСО-1 (примеры 8 и 9, соответственно).
Кроме того, введение последовательности AQK вместо NEN в положение 60-62 тяжелой цепи при помощи описанного метода гуманизации позволяет избежать двух остатков аспарагина, которые могут быть подвергнуты деамидированию. Деамидирование изменяет суммарный заряд белков, что может влиять на устойчивость и/или специфичность. При наличии последовательности AQK лучше сохраняется гомогенность антитела hzACO-1. Сравнение антитела hzACO-1 с вариантом hzACO-1-CDRH2 Кабата, содержащим традиционно присоединенную CDR-область, показало, что антитело hzACO-1 является высокоустойчивым белком, в то время как антитело hzACO-1-CDRH2 Кабата имеет тенденцию к агрегации (пример 11). Агрегация считается серьезной проблемой при создании лекарственных средств, так как вследствие агрегации уменьшается выход продукта, сокращается срок хранения и снижается активность в организме субъектов из-за повышенной иммуногенности. Кроме того, уровни экспрессии конструкции hzACO-1 были в два раза выше, чем у варианта hzACO-1-CDRH2 Кабата (пример 5).
Суммируя вышеизложенное, можно отметить, что антитело hzACO-1 IgG4 было гуманизировано новым методом, в результате чего было получено терапевтическое антитело с меньшим числом мышиных аминокислот, которое с меньшей степенью вероятности вызывает иммуногенность у субъектов. Несмотря на наличие меньшего числа аминокислот из исходного мышиного моноклонального антитела, данное гуманизированное антитело обладает сравнимым сродством связывания, активностью и профилем подтипа IFN-α с мышиным антителом и гуманизированным вариантом, созданным путем традиционного присоединения CDR-области. Кроме того, антитело hzACO-1 меньше подвержено деамидированию и характеризуется более высоким уровнем экспрессии. Таким образом, антитело hzACO-1 является устойчивой и хорошо экспрессированной молекулой, пригодной для производства и введения субъектам.
| название | год | авторы | номер документа |
|---|---|---|---|
| Гуманизированное нейтрализующее антитело к интерферону-бета человека | 2019 |
|
RU2737466C1 |
| АНТИТЕЛА ПРОТИВ ИНТЕРФЕРОНА-АЛЬФА | 2002 |
|
RU2314317C2 |
| АНТИТЕЛА К NKG2A И ИХ ПРИМЕНЕНИЯ | 2007 |
|
RU2499001C2 |
| АНТИТЕЛА РЕЦЕПТОРА 1 ИНТЕРФЕРОНА АЛЬФА И ИХ ПРИМЕНЕНИЕ | 2005 |
|
RU2600884C2 |
| АНТИТЕЛА РЕЦЕПТОРА 1 ИНТЕРФЕРОНА АЛЬФА И ИХ ПРИМЕНЕНИЕ | 2005 |
|
RU2412202C2 |
| АНТИТЕЛА К ТЕОФИЛЛИНУ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2630664C2 |
| АНТИ-ICOS АНТИТЕЛА | 2017 |
|
RU2764548C2 |
| АНТИТЕЛО, БЛОКИРУЮЩЕЕ AGR2, И ЕГО ПРИМЕНЕНИЕ | 2012 |
|
RU2610665C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА, КОТОРЫЕ РАСПОЗНАЮТ АЛЬФА-СИНУКЛЕИН | 2013 |
|
RU2642262C2 |
| УЛУЧШЕННЫЕ АНТИТЕЛА-АНТАГОНИСТЫ ПРОТИВ GDF-8 И ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2630634C2 |

















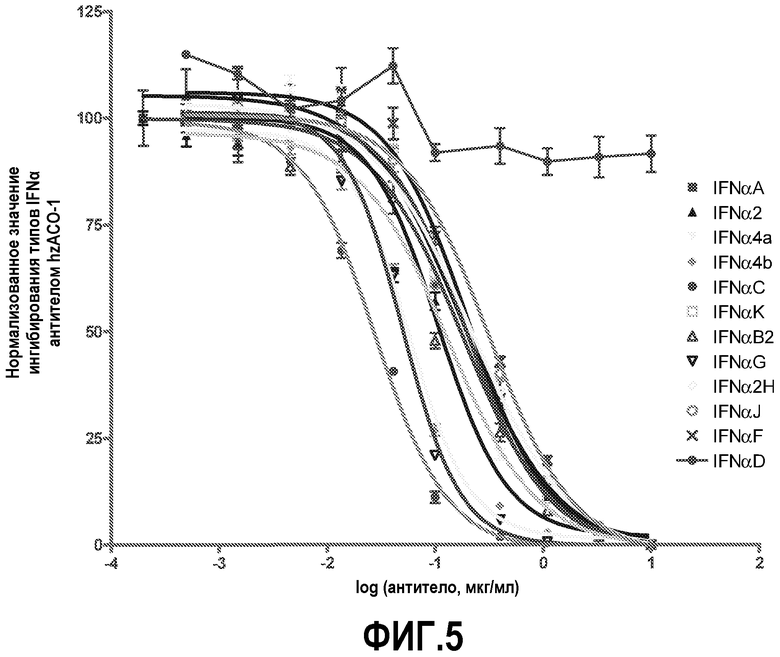







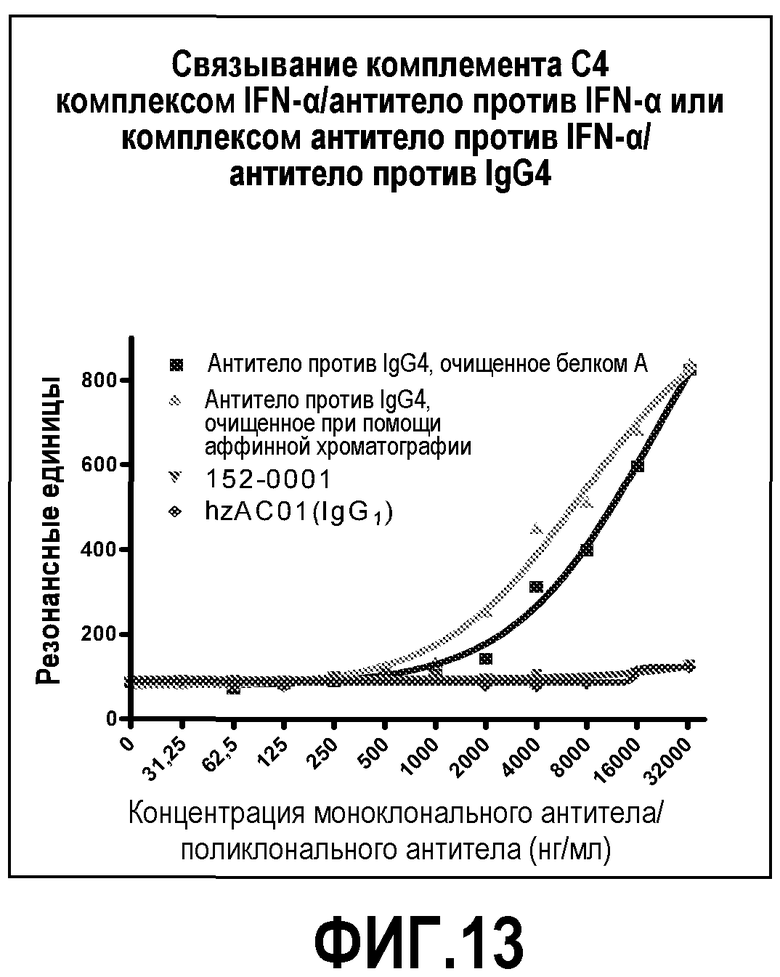
Изобретение относится к области иммунологии. Предложено гуманизированное антитело против IFN-α человека, полученное на основе мышиного антитела АСО-1. Также рассмотрена терапевтическая композиция и способ предотвращения, лечения или ослабления интенсивности симптомов аутоиммунного или воспалительного заболевания или нарушения. Данное изобретение может найти дальнейшее применение в терапии обусловленных IFN-α заболеваний. 3 н. и 10 з.п. ф-лы, 13 ил., 18 табл., 16 пр.
1. Гуманизированное антитело к α-интерферону (INF-α) или его антигенсвязывающий фрагмент, которые включают последовательность VH, выбранную из:
(а) последовательности VH, приведенной в SEQ ID NO:3;
(b) последовательности VH, включающей мутацию Т28S в последовательности, приведенной в SEQ ID NO:3;
(c) последовательности VH, включающей мутацию T30R в последовательности, приведенной в SEQ ID NO:3;
(d) последовательности VH, включающей мутацию N31S в последовательности, приведенной в SEQ ID NO:3;
(е) последовательности VH, включающей мутацию А93V в последовательности, приведенной в SEQ ID NO:3;
и дополнительно включают последовательность VL, выбранную из:
(f) последовательности VL, приведенной в SEQ ID NO:6;
(g) последовательности VL, включающей мутацию D29G в последовательности, приведенной в SEQ ID NO:6;
(h) последовательности VL, включающей мутацию Y32E в последовательности, приведенной в SEQ ID NO:6;
(i) последовательности VL, включающей мутацию L33F в последовательности, приведенной в SEQ ID NO:6;
(j) последовательности VL, включающей мутацию S50G в последовательности, приведенной в SEQ ID NO:6.
2. Антитело или его антигенсвязывающий фрагмент по п.1, которые конкурируют за связывание и/или связываются с тем же эпитопом подтипа IFN-α, что и антитело АСО-1 и/или АСO-2.
3. Антитело или его антигенсвязывающий фрагмент по п.1, которые являются подтипом IgG4.
4. Антитело или его антигенсвязывающий фрагмент по п.1, которые включают последовательность VH, приведенную в SEQ ID NO:3.
5. Антитело или его антигенсвязывающий фрагмент по п.1, которые включают последовательность VL, приведенную в SEQ ID NO:6.
6. Антитело или его антигенсвязывающий фрагмент по п.1, которые содержат последовательность VH, приведенную в SEQ ID NO:3, и последовательность VL, приведенную в SEQ ID NO:6.
7. Антитело или его антигенсвязывающий фрагмент по п.1, которые включают последовательность VH, содержащую мутацию T30R в последовательности, приведенной в SEQ ID NO:3.
8. Антитело или его антигенсвязывающий фрагмент по п.7, которые включают последовательность VL, содержащую мутацию Y32E в последовательности, приведенной в SEQ ID NO:6.
9. Терапевтическая композиция для предотвращения, лечения или ослабления интенсивности симптомов обусловленного INF-α аутоиммунного или воспалительного заболевания или нарушения, включающая профилактически или терапевтически эффективное количество антитела по любому из пп.1-8.
10. Способ предотвращения, лечения или ослабления интенсивности симптомов обусловленного INF-α аутоиммунного или воспалительного заболевания или нарушения, который включает введение нуждающемуся в этом субъекту профилактически или терапевтически эффективного количества антитела по любому из пп.1-8.
11. Способ по п.10, в котором заболевание или нарушение выбрано из группы, состоящей из SLE, ревматоидного артрита и псориаза.
12. Антитело или его антигенсвязывающий фрагмент по п.6, которые относятся к подтипу IgG4.
13. Антитело или его антигенсвязывающий фрагмент по п.8, которые относятся к подтипу IgG4.
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| KNAPPIK A | |||
| et al | |||
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
| LAZAR G.A | |||
| et al | |||
| "A molecular immunology | |||
Авторы
Даты
2014-11-10—Публикация
2009-05-06—Подача