Изобретение относится к биотехнологии, а именно к генетической инженерии, и может быть использовано в ветеринарной вирусологии для выявления РНК вируса блютанга генетической группы (нуклеотип А), объединяющей 4, 10, 11, 17, 20 и 24 серотипы.
Блютанг - трансмиссивное, неконтагиозное вирусное заболевание домашних и диких жвачных животных, протекает чаще в субклинической форме с инфицированием большого поголовья животных, в клинической же симптомы зависят от вида и породы животного [5]. Заболевание вызывает вирус блютанга (ВБ), входящий в состав рода Orbivirus семейства Reoviridae [1, 10]. Генетически ВБ высокогетерогенен, по данным на 2012 г. выделяют 25 (1-24, 26) серотипов и один генетический вариант, так называемый «25 серотип» - Toggenburg orbivirus [3]. Десять линейных дцРНК сегментов генома ВБ варьируют по размеру от 3944 п.о. до 822 п.о. (пример для ВБ 8 серотипа) [14]. Они обозначены как сегменты 1-10, в соответствии с уменьшением молекулярной массы. Геном ВБ кодирует 10 белков вируса, каждый белок - одним из сегментов дцРНК [9]. Семь белков (VP1-VP7) являются структурными компонентами вирусной частицы, остальные три (NS1, NS2 и NS3) являются неструктурными белками, которые синтезируются во время репликации вируса в инфицированных клетках [11, 12]. С помощью исследования перекрестной гибридизации [8] и сравнения нуклеотидных последовательностей были установлены изменения в нуклеотидных последовательностях сегментов генома ВБ и структуре белков, которые они кодируют. Белки капсида, расположенные на поверхности вирусной частицы более вариабельны, чем белковые компоненты кора вируса или неструктурные белки [13].
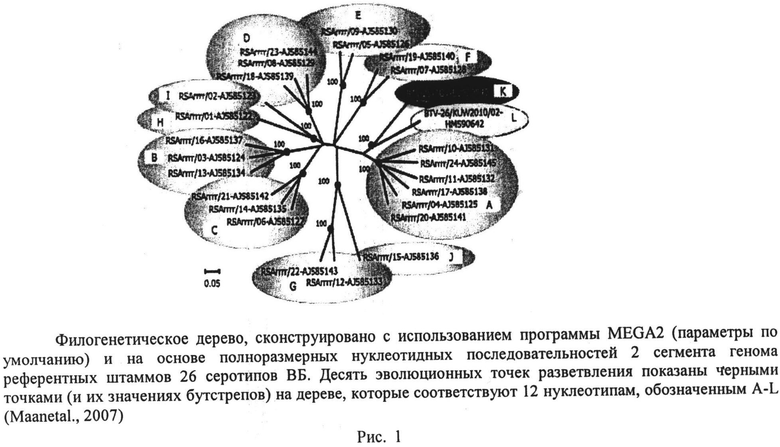
Внешний капсид частицы вируса ВБ состоит из двух белков VP2 и VP5, они являются наименее консервативными, их кодируют 2 и 6 сегменты соответственно. Изменения в этих компонентах наружного капсида отражают адаптационные процессы вируса к хозяину и вектору, продиктованные необходимыми условиями для прикрепления и проникновения вируса в клетки разных видов/тканей и ответа на воздействие антител хозяев-позвоночных. В основном VP2 белок детерминирует серотип, он содержит большинство нейтрализующих эпитопов вируса [1]. Исследования реассортантных вариантов ВБ показали, что оба белка внешнего капсида VP2 и VP5 ВБ влияют на специфичность взаимодействий между вирусной частицей и нейтрализующими антителами [4]. Однако VP2 поверхностный белок капсида ВБ представляет главную антигенную мишень для связывания нейтрализующими антителами [11]. Анализ нуклеотидных последовательностей 2-го сегмента референтных штаммов 26 серотипов ВБ также подтвердил, что он представляет собой наименее консервативный участок генома ВБ (рис.1) и имеет от 29% до 59% нуклеотидных изменений между серотипами [1].
Филогенетический анализ 2 сегмента более 300 изолятов ВБ подтвердил их разделение на 26 групп или кладов, точно отражая серотип вируса, с менее 33% нуклеотидных изменений в последовательности внутри каждого серотипа и от 29% до 59% замен между серотипами [1]. Однако некоторые серотипы ВБ наиболее близко генетически связаны, чем другие, что позволяет сгруппировать их в 12 различных генетических групп - нуклеотипов, стандартно они обозначаются буквами A, B, C, D, E, F, G, H, I, J, K, L и имеют от 29% до 33% нуклеотидных различий между вирусами, принадлежащими к разным серотипам, но одному и тому же нуклеотипу по 2 сегменту (рис.1). Это является очевидной предпосылкой для разработки методов выявления целой группы серотипов ВБ с помощью ПЦР. Способы, основанные на ПЦР, необходимы в диагностике блютанга для экспресс-типирования новых изолятов вируса.
С 2010 г. по 2012 г. (данные сайтов http://eubtnet.org и базы данных WAHID) были зарегистрированы вспышки блютанга 1, 2, 4, 5, 8, 9, 14, 16 и 24 серотипов. Так, в Алжире, Тунисе, Франции, Италии, Португалии и Испании за этот период зарегистрировали 157 вспышек блютанга 1 серотипа; на Кипре, в Греции, Италии и Испании - 19 вспышек 4 серотипа; в Италии и Испании - 7 вспышек 8 серотипа и на Кипре и в Греции - 28 вспышек 16-го. По генотипу изоляты ВБ данных серотипов относились к европейским линиям/группам и соответствовали: 1, 4 и 8 серотип - западному топотипу и 16 серотип - восточному.
Для РФ проблема контроля блютанга обозначилась в 2006 г., когда российскими внешнеторговыми организациями и холдинговыми компаниями был начат (и продолжается в настоящее время) импорт стельных нетелей крупного рогатого скота (КРС) из различных стран ЕС, в том числе и из неблагополучных по блютангу - Германии и Голландии. Всего за период с 2006 по 2011 гг. было ввезено примерно 172 тыс. гол. животных в фермы, расположенные на всей территории европейской части РФ, на Урале и незначительное количество в Алтайский край.
С 2009 г. за рубежом для идентификации серотипа ВБ широко применяют средства, основанные на ОТ-ПЦР, что в случае вспышки заболевания позволяет быстро и в каждом конкретном случае дифференцировать серотип [2, 5, 7].
Поэтому целью данного изобретения является разработка специфической системы олигонуклеотидных праймеров для идентификации вируса блютанга генетической группы (нуклеотип A), объединяющей 4, 10, 11, 17, 20 и 24 серотипы.
Изобретение - олигонуклеотидные праймеры для выявления РНК вируса блютанга нуклеотипа A, а именно участка нуклеотидной последовательности 2 сегмента генома вируса блютанга 4, 10, 11, 17, 20 и 24 серотипов методом ОТ-ПЦР с электрофоретической детекцией продуктов амплификации. Процедура анализа включает следующие этапы: денатурация дцРНК вируса блютанга, обратная транскрипция - синтез кДНК, ПЦР, электрофоретическая детекция продуктов амплификации.
Денатурацию дцРНК осуществляют при температуре 95°C в течение 5 минут в реакционной смеси с нуклеотипспецифической парой олигонуклеотидных праймеров, фиксируют денатурированную РНК путем замораживания. Синтез кДНК осуществляют при температуре 42°C в течение 30 минут в реакционной смеси для обратной транскрипции, включающей дезоксирибонуклеотидтрифосфаты (ДНТФ), буфер для обратной транскрипции и фермент ревертазу (обратную транскриптазу). Затем реакцию терминируют при 88°C в течение 5-ти минут. Полученную кДНК используют для проведения полимеразной цепной реакции. Готовят стандартную смесь для ПЦР, включающую буфер для ПЦР, ДНТФ, пару олигонуклеотидных нуклеотипспецифических праймеров, и фермент ДНК-полимеразу. Используют следующий профиль реакции: удержание температуры - 95°C - 3 мин; циклирование: 95°C - 15 с, 58°C - 15 с, 72°C - 15 с. Цикл повторить 45 раз. Анализ результатов ПЦР проводят методом электрофореза в агарозном геле. Готовят 2% ТАЕ-гель с добавлением бромистого этидия - 0,5 мкг/мл. Электрофорез проводят при не более 8 В/см в течение 20 мин. Результаты электрофореза учитывают с помощью трансиллюминатора в ультрафиолетовом свете с длиной волны 254 нм. Амплифицированные фрагменты ДНК выявляются в виде светящихся оранжевых полос, на уровне 663 п.о. относительно маркера молекулярного веса. Для сохранения результатов реакции используются гельдокументирующие системы.
Выбор и анализ нуклеотипспецифических праймеров (табл.1) проводили при помощи пакета прикладных программ «BioEdit 7.0.8», «Oligo 6.0» на основании анализа нуклеотидных последовательностей 2-го сегмента референтных штаммов и изолятов 26 (1-26) серотипов вируса, опубликованных в GenBank.
Техническим результатом изобретения является возможность определения генетической группы - нуклеотипа A вируса блютанга с помощью ОТ-ПЦР, что позволит существенно сократить материальные затраты и время проведения работ по определению серотипа вируса в образцах исследуемого биологического материала.
Сущность изобретения состоит в том, что при помощи указанных нуклеотипспецифических олигонуклеотидных праймеров проводят ОТ-ПЦР, позволяющую выявить РНК вируса блютанга нуклеотипа A (4, 10, 11, 17, 20 и 24 серотипы).
Выявление РНК вируса блютанга нуклеотипа A (4, 10, 11, 17, 20 и 24 серотипы) проводили в образцах биологического материала: кровь от инфицированных вирусом блютанга животных, культуральный материал вируса, лиофилизированный культуральный материал вируса из музея штаммов микроорганизмов ГНУ ВНИИВВиМ Россельхозакадемии, а также в образцы интактных культур клеток, кровь от интактных животных и культуральный материал гетерологичных вирусов.
Из представленных образцов с использованием реагента Тризол (Invitrogen) и согласно инструкции производителя были выделены нуклеиновые кислоты. Далее препараты нуклеиновых кислот использовали в реакции: 8 мкл образца добавляли к реакционной смеси для денатурации дцРНК. В пробирку с денатурированной РНК добавляли смесь для реакции обратной транскрипции. Препарат кДНК в количестве 10 мкл использовали для постановки собственно ПЦР (результаты представлены в таблице 2).
Проведение реакции обратной транскрипции
В подготовленные пробирки вносят по 7 мкл смеси для денатурации дцРНК, сверху наслаивают 40 мкл минерального масла. Под масло вносят 8 мкл препарата выделенных нуклеиновых кислот. Реакцию денатурации проводят при температуре 95°C в течение 5 минут. Далее необходимо поместить пробирки в условия с отрицательной температурой, для этого используют штатив с хладагентом. Готовят смесь для обратной транскрипции, для этого на одну пробу в отдельной пробирке смешивают 9,8 мкл смеси для обратной транскрипции и 0,2 мкл MMLV-ревертазы, смесь перемешивают. В пробирки с денатурированной РНК вносят по 10 мкл смеси для обратной транскрипции с ферментом. Обратную транскрипцию проводят при температуре 42°C в течение 40 минут. После окончания реакции к ДНК используют для постановки ПЦР.
Проведение ПЦР
В отдельной пробирке готовят общую реакционную смесь на необходимое количество образцов, для этого на одну пробу добавляют 13 мкл смеси для ПЦР, 2 мкл смеси праймеров и 0,2 мкл Taq-полимеразы. Смесь перемешивают, избегая образования пены, и раскапывают по 15 мкл в пробирки объемом 0,6 или 0,2 см3, на поверхность смеси вносят воск в объеме 25 мкл. В подготовленные для ПЦР пробирки на воск вносят по 10 мкл кДНК. Профиль реакции: удержание температуры 94°C - 3 мин; циклирование 40 повторов 94°C - 20 с, 58°C - 20 с, 72°C - 20 с; хранение при 4°С.
Анализ продуктов амплификации ПЦР методом электрофореза
Приготовление геля агарозы: взвешивают 2,0 г агарозы, помещают в стеклянную посуду, заливают 100 мл рабочего 1ХТАЕ - буфера и доводят до кипения в микроволновой печи для полного растворения агарозы. Охлаждают раствор агарозы до температуры примерно 60-65°C и заливают в специальную форму с гребенкой, дают гелю затвердеть. После этого гребенку осторожно вынимают и форму с агарозным гелем переносят в камеру для горизонтального электрофореза. Заливают в камеру рабочий 1XTAE-буфер так, чтобы он покрывал гель на 5-10 мм.
Проведение электрофореза: из пробирок с исследуемыми образцами после завершения ПЦР отбирают из-под масла по 12 мкл реакционной смеси и вносят в лунки агарозного геля, в последнюю лунку вносят 5 мкл маркера молекулярной массы. Электрофорез проводят при не более 8 В/см в течение 30 мин. Направление движения образцов в геле от "-" к "+". Длину амплифицированного фрагмента определяют в соответствии с маркером молекулярной массы (100-1000 пар оснований) и положительным контролем.
Результаты электрофореза учитывают на трансиллюминаторе в ультрафиолетовом свете с длиной волны 254 нм. Амплифицированные фрагменты ДНК выявляются в виде светящихся оранжевых полос. Для сохранения результатов реакции используются гельдокументирующие системы. Положительными считаются пробы, полосы в которых располагаются в геле на таком же расстоянии от старта, что и полоса положительного контроля. Размеры фрагментов, синтезируемых в ПЦР, составляют 663 п.о. Исследуемые пробы считаются отрицательными, если в дорожках не выявлено никаких полос или полосы не соответствуют по размеру фрагмента в контрольной пробе (т.е. располагаются на другом расстоянии от старта). Результаты ОТ-ПЦР с использованием нуклеотипспецифической системы олигонуклеотидов представлены в таблице 2.
Таким образом, разработана система олигонуклеотидных праймеров, позволяющая с помощью классической ОТ-ПЦР выявить РНК вируса блютанга нуклеотипа А (4, 10, 11, 17, 20 и 24 серотипы). Основными преимуществами заявляемого изобретения являются: специфичность и чувствительность способа выявления РНК вируса блютанга нуклеотипа А (4, 10, 11, 17, 20 и 24 серотипы) с помощью ОТ-ПЦР, благодаря избирательному выявлению уникальной нуклеотидной последовательности 2-го сегмента генома вируса блютанга группы серотипов; простота выполнения методики, исключающая необходимость привлечения высококвалифицированного персонала; относительная дешевизна метода, благодаря использованию ОТ-ПЦР для идентификации целой генетической группы.
Источники информации
1. Analysis and phylogenetic comparisons of full-length VP2 genes of the 24 bluetongue virus serotypes / S. Maan, N.S. Maan, A.R. Samuel, S. Rao, H. Attoui, P.P.C. Mertens // J Gen Virol. - 2007. - Vol.88. - P.621-630.
2. Bluetongue virus detection by two real-time RT-qPCRs targeting two differ-ent genomic segments / J.F. Toussaint, C. Sailleau, E. Breard, S. Zientara, K. De Clercq // J. Virol. Methods. - 2007. - Vol.140. - P.115-123.
3. Complete genome characterisation of a novel 26th bluetongue virus serotype from Kuwait / Maan S, Maan NS, Nomikou K, Veronesi E, Bachanek-Bankowska K, et http://dX.ll PLoS One. - 2011. - 6:e26147.
4. Cowley, J.A. Cross-neutralization of genetic reassortants of bluetongue virus serotypes 20 and 21 / J.A. Cowley and B.M. Gorman // Vet. Microbiol. - 1989. - Vol.19. - P.37-51.
5. Development and initial evaluation of a real-time RT-PCR assay to detect bluetongue virus genome segment 1 / A.E. Shaw, P. Monaghan, H.O. Alpar, S. Anthony, K.E. Darpel, C.A. Batten, A. Guercio, G. Alimena, M. Vitale, K. Bankowska, S. Carpenter, H. Jones, C.A.L. Oura, D.P. King, H. Elliott, P.S. Mellor, P.P.C. Mertens // Journal of Virological Methods. - 2007. - Vol.145. - P.115-126.
6. Emergence of Bluetongue Serotypes in Europe, Part 1: Description and Validation of Four Real-Time RT-PCR Assays for the Serotyping of Bluetongue Viruses BTV-1, BTV-6, BTV-8 and BTV-11 / F. Vandenbussche, I. De Leeuw, E. Vandemeulebroucke and K. De Clercq // TransboundEmerg Dis. - 2009. - Vol.56 (9-10). - P.346-54.
7. Hoffmann, B. Real-Time Quantitative Reverse Transcription-PCR Assays Specifically Detecting Bluetongue Virus Serotypes 1, 6, and 8 / B. Hoffmann, M. Eschbaumer, and M. Beer // Journal of Clinical Microbiology. - 2009. - Vol.47. - P.2992-2994.
8. Huismans, H. A comparison of an Australian bluetongue virus isolate (CSIRO 19) with other bluetongue virus serotypes by cross-hybridization and cross-immune precipitation / H. Huismans and C.W. Bremer // Onderstepoort J. Vet. Res. - 1981. - Vol.48. - P.59-67.
9. Mertens, P.P.C. Assignment of the genome segments of Bluetongue Virus Type-1 to the proteins which they encode / P. P. C. Mertens, F. Brown, D.V. Sangar // Virology. - 1984. - Vol.135. - P.207-217.
10. Mertens, P.P.C. ThedsRNA viruses / P.P.C. Mertens // Virus Res. - 2004. - Vol.101. - P.3-13.
11. Roy, P. Structure of the bluetongue virus genome and its encoded proteins / P. Roy, J.J.A. Marshall and T.J. French // Current Topics in Microbiology and Immunology: Bluetongue Viruses. - Springer-Verlag, Germany. - 1990. - Vol.162. - P.43-87.
12. Roy, P. Bluetongue virus assembly and morphogenesis / P. Roy, R. Noad // Curr Top Microbiollmmunol. - 2006. - Vol.309. - P.87-116.
13. Sequence analysis of bluetongue virus serotype 8 from the Netherlands 2006 and comparison to other European strains / S. Maan, N.S. Maan, N. Ross-smith, C.A. Batten, A.E. Shaw, S.J. Anthony, A.R. Samuel, K.E. Darpel, E. Veronesi, C. A. L. Oura, K.P. Singh, K. Nomikou, A.C. Potgieter, H. Attoui, E. van Rooij, P. van Rijn, K.D. Clercq, F. Vandenbussche, S. Zientara, E. Bre'ard, C. Sailleau, M. Beer, B. Hoffman, P.S. Mellor and P. P. C. Mertens // Virology. - 2008. - Vol.377. - P.308-18.
Изобретение относится к биотехнологии, генетической инженерии и ветеринарной вирусологии. Предложены синтетические олигонуклеотидные праймеры, комплементарные участкам вариабельного 2-го сегмента генома вируса блютанга серотипов, входящих в состав нуклеотипа А (4, 10, 11, 17, 20 и 24 серотипы) для выявления РНК вируса блютанга нуклеотипа А, имеющие следующий нуклеотидный состав (5′-3′): прямой TATTGGCATAGRCAGTGG; обратный GTAAGYGTAAGAGGCCA. Праймеры позволяют одновременно идентифцировать 4, 10, 11, 17, 20 и 24 серотипы вируса блютанга нуклеотипа A методом ОТ-ПЦР, что позволяет ускорить процедуру выявления различных серотипов вируса блютанга А в образце. 2 табл., 1 ил.
Синтетические олигонуклеотидные праймеры, комплементарные участкам вариабельного 2-го сегмента генома вируса блютанга серотипов, входящих в состав нуклеотипа А (4, 10, 11, 17, 20 и 24 серотипы) для идентификации вируса блютанга нуклеотипа А, используемые для выявления РНК вируса блютанга нуклеотипа А, имеющие следующий нуклеотидный состав (5′-3′):
| US 20130236493 A1, 12.09.2013 | |||
| ОЛИГОНУКЛЕОТИДНЫЕ ПРАЙМЕРЫ, СПОСОБ И ТЕСТ-СИСТЕМА ДЛЯ ВЫЯВЛЕНИЯ ГЕНОМА ВИРУСА БЛЮТАНГА МЕТОДОМ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ В ФОРМАТЕ ЭЛЕКТРОФОРЕТИЧЕСКОЙ ДЕТЕКЦИИ ПРОДУКТОВ АМПЛИФИКАЦИИ | 2007 |
|
RU2385943C2 |
| СИНТЕТИЧЕСКИЕ ОЛИГОНУКЛЕОТИДНЫЕ ПРАЙМЕРЫ - ЗОНД И СПОСОБ ДЛЯ ВЫЯВЛЕНИЯ ГЕНОМОВ 1-ГО, 4-ГО, 16-ГО СЕРОТИПОВ ВИРУСА БЛЮТАНГА МЕТОДОМ ОТ-ПЦР В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ | 2011 |
|
RU2481404C1 |
| ТЕСТ-СИСТЕМА ДЛЯ ОБНАРУЖЕНИЯ РНК ВИРУСА БЛЮТАНГА 14-ГО СЕРОТИПА МЕТОДОМ ОТ-ПЦР В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ | 2012 |
|
RU2499054C1 |
Авторы
Даты
2014-11-27—Публикация
2013-07-25—Подача