Изобретение относится к органической химии гетероциклических соединений, в частности к макроциклическим алкиламмониевым производных 6-метилурацила формулы (1), которые обладают свойством ингибировать активность холинэстераз и могут найти применение в медицине и ветеринарии.
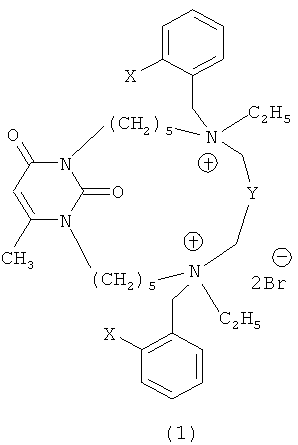
где X=NO2, Y=(CH2)4 (1a);
X=CN, Y=(CH2)4 (1b);
X=NO2, Y=C6H4 (1c);
X=CN, Y=C6H4 (1d).
Ингибиторы холинэстераз широко используются в медицинской практике для фармакологической коррекции синаптических дефектов, лежащих в основе болезни Альцгеймера, миастении Гравис и других форм патологической мышечной слабости. Показана их эффективность и при лечении глаукомы, атонии кишечника, травматических повреждений мозга, алкоголизма, маниакально-депрессивных психозов, шизофрении, старческого слабоумия, аутизма, расстройств сна и др. Фармацевтическая промышленность выпускает множество антихолинэстеразных препаратов: Аминостигмин, Дезоксипеганин, Стефаглабрин, Дистигмин, Хинолитин, Оксазил, Пиридостигминабромид, Прозерин, Галантамин, Физостигмин. В зависимости от химической структуры и физико-химических свойств антихолинэстеразные препараты различаются между собой, например третичные амины (физостигмин, галантомин и др.) проникают через биологические мембраны, в том числе через гематоэнцефалический барьер, и оказывают выраженное влияние на ЦНС. Начиная с середины 90-х годов прошлого века ингибиторы ацетилхолинэстеразы как вещества, улучшающие когнитивные функции, начали применяться при лечении больных с легкой или умеренной степенью выраженности болезни Альцгеймера. Четвертичные аммониевые производные (прозерин, пиридостигмина бромид, оксазил и др.) трудно проникают через гематоэнцефалический барьер и используются, таким образом, для коррекции дефектов синаптической передачи в периферических синапсах (преимущественно при терапии миастении Гравис и других форм патологической мышечной слабости).
Недостатком большинства известных антихолинэстеразных препаратов, применяемых при терапии мышечной слабости, является отсутствие избирательности в отношении ферментов ацетилхолинэстеразы и бутирилхолнинэстеразы. Бутирилхолинэстераза преимущественно присутствует в крови и ее ингибирование не оказывает положительного эффекта при терапии дефектов синаптической передачи возбуждения ингибиторами холинэстераз. Поскольку целевой эффект оказывает ингибирование ацетилхолинэстеразы, то подавлять функцию бутирилхолинэстеразы в этом случае нет никакой необходимости. Однако применяемые на сегодняшний день при терапии миастенических синдромов ингибитора холинэстеразы (калимин и неостигмин) не избирательны в отношении этих двух ферментов.
Исследования, проведенные авторами, выявили новый класс ингибиторов холинэстераз - тетраалкиламмониевые производные 6-метилурацила, обладающие способностью высокоизбирательно блокировать ацетилхолинэстеразу млекопитающих [Доклады РАН. - 1998. - Т.362, №1. С.68-70: Доклады РАН. - 2001. - Т.376, №6. - С.818-822; Совр. проблемы токсикол. - 2004. - №3. - С.25-33; Доклады РАН. - 2005. - Т.401, №1. - С.120-123; Хим. фарм. ж. - 2005. - Т.39, №5. - С.15-19; Совр. вопросы токсикол. - 2006. - №2. - С.13-22].
Известно, что 6-метилурацил и его производные являются физиологически активными веществами и широко применяются в лечебной практике. Например, препараты Метилурацил и Пентоксил обладают анаболической активностью. Эти препараты ускоряют процессы клеточной регенерации; способствуют заживлению ран, стимулируют клеточные и гуморальные факторы иммунитета. У лекарственных средств, созданных на основе метилурацил и пентоксила, помимо способности стимулировать лейкопоэз и эритропоэз были выявлены и другие свойства - повышать фагоцитоз, резистентность к инфекции, поствакцинальный иммунитет, стимулировать репаративные процессы, оказывать противовоспалительное действие, вызывать анаболический и антикатаболический эффект, иммуностимулирующий эффект и др. Обнаружены также антитоксические и антиоксидантные, мембраностабилизирующие свойства.
Наиболее структурно близкими к заявляемым соединениям формулы (1) являются пиримидинофаны (макроциклические производные пиримидина) формулы (4) и (5), содержащие в своем составе 6-метилурациловые фрагменты и алкиламмониевые группировки.
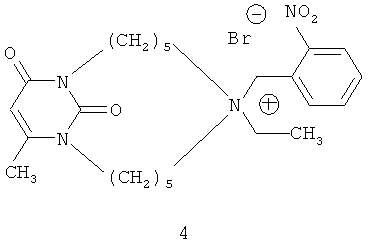
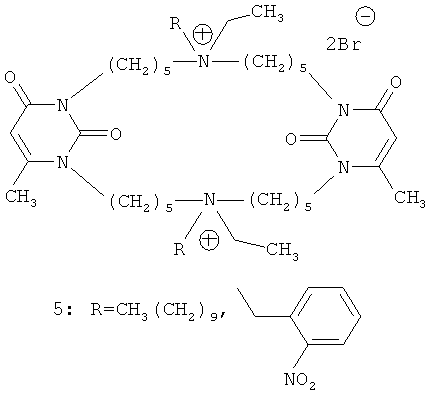
Эти соединения проявляют антимикробную активность и обладают холинолитическими свойствами, способность же к ингибированию ацетилхолинэстеразы у них отсутствует [Современные проблемы токсикологии. - 2006. - N 2. - С.13-22; Eur. J. Med. Chem. - 2006. - Vol.41. - N 9. - P.1093-1101]. Среди известных из уровня производных 6-метилурацила, содержащих алкиламмониевые группировки, антихолинэстеразными свойствами обладают только соединения ациклического строения [Chemico-biological interactions. - 2008. - Vol.175. - Nos 1-3. - P.286-292].
Расширение ассортимента антихолинэстеразных средств на основе тетраалкиламмониевых производных 6-метилурацила является задачей изобретения.
Техническим результатом, на решение которого направлено изобретение, являются новые ингибиторы холинэстераз - макроциклические алкиламмониевые производные 6-метилурацила формулы (1):
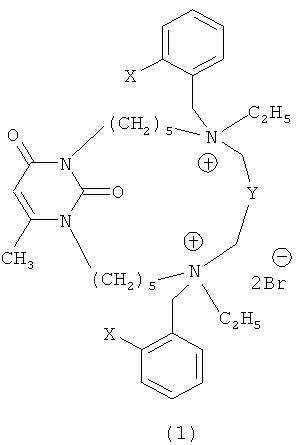
где X=NO2, Y=(CH2)4 (1a);
X=CN, Y=(CH2)4 (1b);
X=NO2, Y=C6H4 (1c);
X=CN, Y=C6H4 (ld).
Следует отметить, что три заявляемых соединения (пиримидинофана) являются новыми, а именно 1(a), 1(b) и 1(d). Соединение (1c), где Х=NO2, Y=C6H4 описано, однако не как ингибитор холинэстераз [Николаев А.Е. Синтез и особенности структуры пиримидинофанов, содержащих атомы азота или серы в соединительных мостиках. / Дисс. на соискание ученой степени канд. хим. наук. - 2008].
Заявляемые соединения получены из пиримидинофанов формулы (3), которые синтезированы циклизацией 1,3-бис(5-аминоэтилпентил-1)-6-метилурацила (2) 1,6-дибромгексаном или пара-дибромксилиленом согласно приведенной схеме. Соединение (2) и способ его получения описаны [Р.Х. Гиниятуллин, А.С. Михайлов, В.Э. Семенов и др. / Изв. АН. Сер. хим. - 2003. - Т.52. - №7. - С.1511-1515]. Целевые соединения (1) получены взаимодействием пиримидинофанов (3) с орто-нитробензилбромидом или орто-цианбензилбромидом в ацетонитриле.
Схема - Синтез соединений (пиримидинофанов) формулы (1)
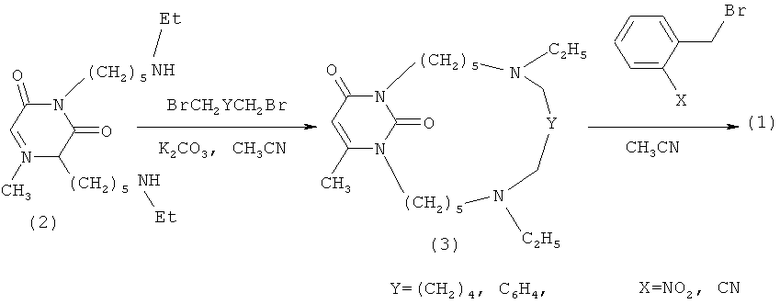
Пример 1. Синтез 7,14-Диаза-7,14-диэтил-12,14-диоксо-16-метил-1(3,1)-пиримидинациклононадекафана (3) Y=(CH2)4
К перемешиваемой при 50-55°C суспензии 2.50 г (18.1 ммоль) K2CO3 в 100 мл CH3CN в течение 1 ч по каплям одновременно добавляют растворы 2.30 г (6.5 ммоль) соединения (2) в 25 мл CH3CN и 1.78 г (7.2 ммоль) 1,6-дибромгексана в 25 мл CH3CN. По окончании прикапывания реакционную массу перемешивают при температуре 50-55°C в течение 8 ч, после чего упаривают в вакууме и к остатку добавляют 100 мл CHCl3. Образовавшийся осадок отфильтровывают, фильтрат концентрируют и хроматографируют через колонку с SiO2. Колонку промывают последовательно петролейным эфиром, этилацетатом, смесью этилацетат-диэтиламин (10:1). После упаривания последнего элюата получают 0.27 г (10%) пиримидинофана (3), где Y=(CH2)4 в виде масла.
Спектр ЯМР 1H (600 МГц) в CDCl3, δ, м.д.: 1.00-1.02 (м., 6Н), 1.32-1.38 (м., 8Н), 1.44-1.52 (м., 8Н), 1.64-1.66 (м., 4H), 2.22 (с., 3H), 2.39-2.41 (м, 8H), 2.48-2.50 (м, 4H), 3.83 (т., 2H, J=7.3 Гц), 3.94 (т., 2H, J=7.0 Гц), 5.55 (с., 1H).
Масс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 435 (10), 434 [M]+ (31), 419 [M-15]+ (25), 405 [M-29]+ (100), 140 (21), 99 (30);
ИК-спектр (масло), ν, см-1: 2932 с., 2858 сл., 2798 сл., 1701 с., 1662 о.с., 1467 с., 1431 с., 1399 сл., 1365 сл., 1207 сл., 1156 с., 1071 сл., 1018 сл., 815 сл., 768 сл.
Брутто-формула C25H46N4O2. Вычислено, %: C 69.08, H 10.67, N 12.89.
Найдено, %: C 69.00, H 10.75, N 12.85.
Найдено: m/z 434.3621 [M]+. C25H46N4O2. Вычислено: M=434.36209.
Пример 2. Синтез 7,14-Диазоний-7,14-диэтил-7,14-ди-орто-нитробензил-12,14-диоксо-16-метил-1(3,1)-пиримидинациклононадекафандибромида (1а)
К раствору 0.15 г (0.70 ммоль) орто-нитробензилбромида в 40 мл CH3CN добавляют 0.15 г (0.35 ммоль) пиримидинофана (3), где Y=(CH2)4 и перемешивают при температуре 50-60°C в течение 10 ч. Растворитель упаривают. Остаток тщательно растирают в безводном диэтиловом эфире, эфир декантируют. Процедуру повторяют несколько раз до получения кристаллического вещества, которое далее сушат в вакууме (0.1 мм рт.ст.).
Получено 0.27 г (90%) целевого соединения (1a), которое представляет собой желтоватое кристаллическое вещество, т.пл. 120°C.
Спектр ЯМР 1H (400 МГц) в CDCl3, δ, м.д.: 1.18-1.22 (м., 6H), 1.36-1.85 (м., 20H), 2.25 (с., 3H), 3.27-3.50 (м., 12H), 3.78-3.80 (м., 2H), 3.95-3.97 (м., 2H), 4.84 (уш. с., 4H), 5.58 (с., 1H), 7.49-8.05 (м., 8H);
ИК-спектр (KBr), ν, см-1: 2945 с., 2864 сл., 1694 с., 1655 о.с., 1528 о.сл., 1470 с., 1432 с., 1350 с., 1204 сл., 1144 сл., 1078 сл., 1037 сл., 923 сл., 858 сл., 768 сл., 726 с.
Брутто-формула C39H58Br2N6O6. Вычислено, %: C 54.04, H 6.75, N 9.70, Br 18.44. Найдено, %: C 54.10, H 6.82, N 9.81, Br 18.54.
Масс-спектр MALDI-TOF: вычислено для C39H58Br2N6O6 [M-2Br]+, [M-2Br-C7H6NO2]+ 706.4, 570.4, соответственно. Найдено: 706.6, 570.4.
Пример 3. Синтез 7,14-Диазоний-7,14-диэтил-7,14-ди-орто-цианбензил-12,14-диоксо-16-метил-1(3,1)-пиримидинациклононадекафандибромида (1b) проводят аналогично примеру 2 из 1.12 г (0.28 ммоль) пиримидинофана (3), где Y=(CH2)4 и 0.14 г (0.71 ммоль) орто-цианбензилбромида. Получено 0.22 г (88%) целевого соединения (1b), которое представляет собой желтоватое кристаллическое вещество, т.пл. 110°C.
Спектр ЯМР 1H (400 МГц) в CDCl3, δ, м.д.: 1.17-1.20 (м., 6H), 1.44-1.90 (м., 20H), 2.26 (с., 3H), 3.38-3.68 (м, 12H), 3.78-3.80 (м., 2H), 3.95-3.97 (м., 2H), 4.64 (уш. с., 4H), 5.58 (с., 1H), 7.42-7.82 (м., 8H);
ИК-спектр (KBr), ν, см-1: 2946 с., 2862 сл., 2226 ср., 1694 с., 1655 о.с., 1467 с., 1432 с., 1401 сл., 1213 сл., 1161 сл., 1034 сл., 770 с.
Брутто-формула C41H58Br2N6O2. Вычислено, %: C 59.56, H 7.07, N 10.17, Br 19.33. Найдено, %: C 59.70, H 7.12, N 10.08, Br 19.40.
Масс-спектр MALDI-TOF: вычислено для C41H58Br2N6O2 [M-Br]+, [M-2Br-C8H6N]+ 746.9, 550.4, соответственно. Найдено: 746.6, 550.3.
Пример 4. Синтез 7,11-Диаза-7,11-диэтил-12,14-диоксо-16-метил-1(3,1)-пиримидина-9(1,4)-бензинациклогексадекафана (3) Y=C6H4
К раствору 2.07 г (5.88 ммоль) соединения (2) в 100 мл CH3CN добавляют 1.62 г (11.76 ммоль) K2CO3 и 1.67 г (6.33 ммоль) пара-дибромксилилена. Реакционную массу перемешивают 10 ч при температуре 70°C. Реакционную смесь охлаждают, растворитель отгоняют и к остатку добавляют 100 мл CHCl3. Образовавшийся осадок отфильтровывают, фильтрат концентрируют и хроматографируют через колонку с Al2O3. Колонку промывают последовательно диэтиловым эфиром и смесью диэтиловый эфир-этилацетат-диэтиламин (10:10:1). После упаривания последнего элюата получают 0.60 г (22%) пиримидинофана (3), где Y=C6H4 в виде масла.
Спектр ЯМР 1H (600 МГц) в CDCl3, δ, м.д.: 1.06-1.10 (м., 6H), 1.22-1.27 (м., 4H), 1.38-1.41 (м., 4H), 1.48-1.55 (м., 4H), 2.20 (с., 3H), 2.25-2.28 (м, 4H), 2.56-2.59 (м, 4H), 3.52 (с., 2H), 3.54 (с., 2H), 3.75 (т., 2Н, J=7.3 Гц), 3.89 (т., 2Н, J=6.8 Гц), 5.53 (с., 1Н), 7.22-7.26 (м., 4Н);
Масс-спектр (ЭУ, 70эВ), m/z (Iотн (%)): 455 [M+1]+ (8), 454 [M]+ (36), 439 [M-15]+ (25), 426 (45), 425 [M-29]+ (100), 382 (13), 349 (27), 162 (16), 148 (18), 145 (40), 132 (14), 112 (14), 109 (20), 105 (34), 104 (87);
ИК-спектр (масло), ν, см-1: 2964 сл., 2932 с., 2859 сл., 2798 сл., 1702 с., 1662 о.с., 1467 с., 1431 с., 1399 сл., 1365 сл., 1207 сл., 1156 с., 1071 сл., 1019 сл., 849 сл., 815 сл., 765 сл. Найдено, %: C 71.47, H 9.22, N 12.21.
Брутто-формула C27H42N4O2. Вычислено, %: C 71.33, H 9.31, N 12.32.
Найдено: m/z 454.3307 [M]+. C27H42N4O2. Вычислено: M=454.33078.
Пример 5. Синтез 7,11-Диазоний-7,11-диэтил-7,11-ди-орто-нитро-бензил-12,14-диоксо-16-метил-1(3,1)-пиримидина-9(1,4)-бензинацикло-гексадекафандибромида (1c) проводят аналогично примеру 2 из 0.40 г (0.88 ммоль) пиримидинофана (3), где Y=C6H4 и 0.42 г (1.94 ммоль) орто-нитробензилбромида в 60 мл CH3CN.
Получено 0.57 г (74%) целевого соединения (1c), которое представляет собой желтоватое кристаллическое вещество, т.пл. 250-251°C.
Спектр ЯМР 1H (600 МГц) в CDCN3, δ, м.д.: 1.14-1.11 (м, 6H), 1.20-1.80 (м, 12H), 2.21 (с, 3H), 2.94-3.21 (м., 8H), 3.70-3.90 (м., 4H), 4.44-4.86 (м., 8H), 5.48 (с, 1H), 7.56-7.78 (м., 8H).
Брутто-формула C41H54Br2N6O6. Вычислено, %: C 55.53, H 6.14, Br 18.02, N 9.48. Найдено, %: C 55.45, H 6.06, Br 18.11, N 9.46.
Масс-спектр MALDI-TOF: вычислено для C41H54Br2N6O6 [M-Br]+, [M-2Br-C7H6NO2]+ 805.3, 590.4, соответственно. Найдено: 805.2, 590.3.
Пример 6. Синтез 7,11-Диазоний-7,11-диэтил-7,11-ди-орто-циан-бензил-12,14-диоксо-16-метил-1(3,1)-пиримидина-9(1,4)-бензинацикло-гексадекафандибромида (1d) проводят аналогично примеру 2 из 0.28 г (0.62 ммоль) пиримидинофана (3), где Y=C6H4 и 0.25 г (1.28 ммоль) орто-цианбензилбромида. Получено 0.36 г (70%) целевого соединения (1d), которое представляет собой желтоватое кристаллическое вещество, т.пл. 143-145°C.
Спектр ЯМР 1H (600 МГц) в ДМСО-d6, δ, м.д.: 1.11-1.141 (м, 6Н), 1.24-1.75 (м, 12H), 2.28 (с, 3H), 3.00-3.30 (м., 8Н), 3.70-3.90 (м., 4H), 4.60-4.96 (м., 8H), 5.58 с (с., 1H), 7.65-8.05 (м., 8H).
Брутто-формула C43H54Br2N6O2. Вычислено, %: C 60.99, H 6.43, Br 18.87, N 9.93. Найдено, %: C 60.90, H 6.46, Br 18.93, N 10.00.
Масс-спектр MALDI-TOF: вычислено для C43H54Br2N6O2 [M-Br]+, [M-2Br-C8H6N]+ 765.3, 570.4, соответственно. Найдено: 765.3, 570.2.
Заявляемые алкиламмониевые производные 6-метилурацила формулы (1) представляют собой желтоватые кристаллические вещества, растворимые в воде, диметилсульфоксиде, ацетонитриле, хлороформе.
Биологическая активность
Пример 7. Определение антихолинэстеразной активности пиримидинофанов формулы (1)
Регистрацию ферментативной реакции осуществляли согласно методу Элмана [Ellman G.L., Courtney K.D., Andres V. Jr., Feather-Stone R.M. A new and rapid colorimetric determination of acetylcholinesterase activity. Biochem Pharmacol 1961, №7, C.88-95]. Анализ зависимости активности холинэстеразы от концентрации ингибитора проводили уравнением Хилла (Hill) с вычислением среднеэффективной концентрации - IC50. Ацетилхолинэстераза и бутирилхолинэстераза человека были куплены в Sigma-Aldrich. Результаты ингибиторной активности заявляемых соединений приведены в таблице 1, которые свидетельствуют о том, что все соединения проявляли высокую антихолинэстеразную активность, показывая большую эффективность в отношении ацетилхолинэстеразы (АХЭ) по сравнению с бутирилхолинэстеразой (БуХЭ). Соединение 1(c) является лидером в исследуемой группе алкиламмониевых производных 6-метилурацила формулы (1), т.к. его ингибирующая АХЭ концентрация (IC50) на порядок ниже, чем у соединений 1(a), 1(b) или 1(d).
Пример 8. Изучение общетоксического действия заявляемых соединений проводили согласно «Методическим указаниям по изучению общетоксического действия фармакологических веществ» (М., Медицина. 2005. Под ред. Р.У. Хабриева) на беспородных белых мышах обоего пола массой 19,0±2,0 г, содержавшихся на стандартном рационе питания в условиях природного режима освещения помещения при комнатной температуре. Данные токсикологической оценки соединений приведены в таблице 1. Для сравнения, ЛД50 Пиридостигмина бромида (антихолинэстеразное средство) для мышей при пероральном применении составляет 12-15 мг/кг, а при внутрибрюшинном введении составляет 3 мг/кг массы тела. [http://www.mosmed.ru/medic/preparats/astamedica/kalimin/kaliminl1.htm]
Таким образом, заявляемые алкиламмониевые производные 6-метилурацила (1) обладает высокой антихолинэстеразной активностью при токсичности, соизмеримой с Пиридостигмином.
Пример 9. Терапия симптомов мышечной слабости в условиях экспериментальной аутоиммунной модели миастении Гравис
Соединение 1(с), проявляющее наибольшую антихолинэстеразную активность in vitro, было протестировано нами in vivo на способность купировать признаки мышечной слабости у животных с экспериментальной миастенией Гравис. Экспериментальную аутоиммунную модель миастении Гравис (ЭАМГ) создавали по методике, описанной в статье [Baggi F, Annoni A, Ubiali F, Milani M, Longhi R, Scaioli W, Cornelio F, Mantegazza R, Antozzi C. Breakdown of tolerance to a self-peptide of acetylcholine receptor alpha-subunit induces experimental myasthenia gravis in rats. J Immunol. 2004 Feb 15; 172(4):2697-703].
Развитие мышечной слабости диагностировалось по наличию выраженного декремента амплитуды интегрального потенциала действия (ПД) мышцы задних конечностей крысы при высокочастотной стимуляции седалищного нерва (40 Гц, 200 стимулов). Стимуляцию седалищного нерва проводили игольчатыми электродами. Интегральные ПД мышц регистрировали накожными электродами с поверхности задних конечностей крыс.
После диагностики ЭАМГ трем группам крыс внутрибрюшинно вводился или водный раствор соединения 1(с) , или пиридостигмина бромид (Sigma-Aldrich) - действующее вещество препаратов «Калимин» и «Местинон», или эквивалентный объем только воды для инъекций (ОАО Мосхимфармпрепараты им. Семашко).
В опытах на животных с экспериментальной миастенией Гравис была подобрана доза соединения 1(c), восстанавливающая значение декремента амплитуды интегрального мышечного ПД до показателей здоровых животных. Эта доза составляла 0.3 мг/кг при внутрибрюшинном введении. Аналогичный эффект достигался инъекцией Пиридостигмина в дозе 0.1 мг/кг (таблица 2). Этот факт делает соединение 1(c) перспективным кандидатом в качестве средства лечения синдромов патологической мышечной слабости.
Предложены новые эффективные ингибиторы фермента ацетилхолинэстеразы, которые могут найти применение в ветеринарии и медицине, например для лечения миастении Гравис и других форм патологической мышечной слабости.
| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДСТВО НА ОСНОВЕ ПРОИЗВОДНОГО УРАЦИЛА ДЛЯ ТЕРАПИИ БОЛЕЗНИ АЛЬЦГЕЙМЕРА | 2014 |
|
RU2565756C1 |
| ПРОИЗВОДНЫЕ ПИРИДОКСИНА С АНТИХОЛИНЭСТЕРАЗНОЙ АКТИВНОСТЬЮ | 2014 |
|
RU2550080C1 |
| ПРОИЗВОДНЫЕ 1,2,3,4-ТЕТРАГИДРОПИРИДО[4,3-b]ИНДОЛСОДЕРЖАЩИХ ФЕНОТИАЗИНОВ В КАЧЕСТВЕ ИНГИБИТОРОВ ХОЛИНЭСТЕРАЗ И БЛОКАТОРОВ СЕРОТОНИНОВЫХ РЕЦЕПТОРОВ 5-HT, СПОСОБЫ ПОЛУЧЕНИЯ ИХ ХЛОРГИДРАТОВ И ФАРМАКОЛОГИЧЕСКОЕ СРЕДСТВО НА ИХ ОСНОВЕ | 2013 |
|
RU2530881C1 |
| СПОСОБ ПОЛУЧЕНИЯ МЕТИЛ 3-АЦИЛ-4-ЦИАНО-5-(ДИЦИАНОМЕТИЛЕН)-2-ГИДРОКСИ-2,5-ДИГИДРО-1H-ПИРРОЛ-2-КАРБОКСИЛАТОВ | 2018 |
|
RU2700928C2 |
| НИТРОКСИСОЕДИНЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ, ИМЕЮЩИЕ ПРОТИВОВОСПАЛИТЕЛЬНУЮ, АНАЛЬГЕТИЧЕСКУЮ И АНТИТРОМБОЦИТАРНУЮ АКТИВНОСТИ | 1995 |
|
RU2145595C1 |
| СОЕДИНЕНИЯ ДЛЯ РАЗДЕЛЕНИЯ РЕДКОЗЕМЕЛЬНЫХ ЭЛЕМЕНТОВ И S-, P-, D-МЕТАЛЛОВ, СПОСОБЫ РАЗДЕЛЕНИЯ И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2783526C2 |
| Мультифункциональные конъюгаты такрина и его аналогов с производными 1,2,4-тиадиазола, способ их синтеза и применение для лечения нейродегенеративных заболеваний | 2017 |
|
RU2675794C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 1,4-ДИФЕНИЛАЗЕТИДИНОНА | 2005 |
|
RU2380361C2 |
| НОВЫЕ НИТРОФЕНИЛИПРИТНЫЕ И НИТРОФЕНИЛАЗИРИДИНОВЫЕ СПИРТЫ И ИХ СООТВЕТСТВУЮЩИЕ ФОСФАТЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ НАЦЕЛЕННЫХ ЦИТОТОКСИЧЕСКИХ СРЕДСТВ | 2004 |
|
RU2372324C2 |
| Способ получения производных 1,4-дигидропиридина | 1987 |
|
SU1607687A3 |
Изобретение относится к новым макроциклическим алкиламмониевым производных 6-метилурацила формулы (1). Соединения обладают антихолинэстеразной активностью и могут найти применение для фармакологической коррекции синаптических дефектов, лежащих в основе болезни Альцгеймера, миастении Гравис и других форм патологической мышечной слабости. Соединения также могут найти применение при лечении глаукомы, атонии кишечника, алкоголизма, шизофрении, маниакально-депрессивных психозов, травматических повреждений мозга, расстройств сна и др. В формуле (1)
 (1)
(1)
X=NO2,Y=(CH2)4(1a);X=CN,Y=(CH2)4(1b);X=NO2,Y=C6H4(1c);X=CN,Y=C6H4(1d).
2 н.п. ф-лы, 2 табл., 9 пр.
1. Макроциклические алкиламмониевые производные 6-метилурацила общей формулы:
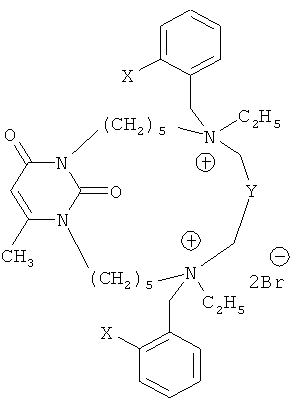
где X=NO2, Y=(CH2)4;
X=CN, Y=(CH2)4;
X=CN, Y=C6H4.
2. Макроциклические алкиламмониевые производные 6-метилурацила общей формулы:

где Х=NO2, Y=(CH2)4;
X=CN, Y=(CH2)4;
X=NO2, Y=C6H4;
X=CN, Y=C6H4,
обладающие антихолинэстеразной активностью.
| V.E.SEMENOV et al.,Antibacterial and antifungin activity of acyclic and macrocyclic uracyl derivatives with quaternized nitrogen atoms in spacers, European Journal of Medicinal Chemistry, 2006,1093-1101 | |||
| K.A | |||
| ANIKIENCO et al.,Compounds with the dioxopyrimidine cycle inhibit cholinesterases, Chemico-Biological Interaction 175, 2008,286-272 | |||
| RU |
Авторы
Даты
2014-12-10—Публикация
2013-07-15—Подача