Изобретение относится к синтезу конъюгатов такрина и его аналогов с производными 1,2,4-тиадиазола, обладающих одновременно способностью эффективно ингибировать ацетилхолинэстеразу и бутирилхолинэстеразу, связываться с периферическим анионным сайтом ацетилхолинэстеразы, связывать свободные радикалы и блокировать NMDA-рецепторы, содержащим их фармацевтическим средствам и к их применению в медицине для лечения нейродегенеративных заболеваний.
Нейродегенеративные заболевания (НДЗ) - это большая группа заболеваний преимущественно позднего возраста, для которых характерна медленно прогрессирующая гибель определенных групп нервных клеток, приводящая к разрыву связей между отделами центральной нервной системы (ЦНС), а также дисбалансу в синтезе и выделении соответствующих нейромедиаторов и, как следствие, вызывающая нарушения памяти, координации движения, мыслительных способностей человека. Наиболее известными представителями этого класса заболеваний являются болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз (БАС), хорея Гентингтона, фронто-темпоральная деменция и другие. Поскольку в мире наблюдается неуклонное старение населения, общая частота НДЗ имеет четкую тенденцию к увеличению. Достаточно сказать, что у людей старше 70 лет распространенность этих заболеваний составляет около 5%, а среди лиц старше 80 лет - уже 10-15%. При этом следует помнить, что указанные страдания затрагивают как психику человека, так и его способности двигаться и обслуживать себя. Таким образом, социальная значимость данной проблемы очевидна.
К сожалению, для большинства НДЗ отсутствуют радикальные методы лечения, которые позволили бы полностью остановить патологический процесс и тем более обратить его вспять. Возможности симптоматической помощи таким пациентам ограниченны, причем в поздних стадиях лечение особенно затруднено и нередко сопровождаются многочисленными осложнениями.
Болезнь Альцгеймера (БА) является самым распространенным нейродегенеративным заболеванием, которое характеризуется прогрессирующим снижением памяти и высших корковых функций, что приводит к полной деградации умственной и интеллектуальной деятельности [Huang Y., Mucke L. Cell, 2012, 148, 1204-1222; Gandy S., DeKosky S.T. Annu. Rev. Med., 2013, 64, 367-383]. По прогнозу экспертов [Alzheimer’s & Dementia 11 (2015) 332-384] число людей с деменцией в мире возрастет с 36 млн в 2010 г. до 66 млн в 2030 г. и до 115 млн к 2050 г.
В настоящее время общепризнанным фактом является мультифакторная природа БА [Carreiras M.C. et al. Curr. Top. Med. Chem. 2013, 13, 1745-1770; Bachurin S.O. et al. Med. Res. Rev. 2017, 37(5), 1186-1225]. К основным факторам, характеризующим ее патогенез, можно отнести нарушение работы нейромедиаторных систем (холинэргической и глутаматэргической), отложение аберрантных белков (бета-амилоида и тау-белка), окислительный стресс [Huang Y. & Mucke L. Cell. 2012, 148, 1204-1222].
Поиск препаратов, способных компенсировать утраченные функции холинэргической и глутаматэргической нейромедиаторных систем изначально рассматривался как наиболее очевидная стратегия создания лекарств терапии БА. Ингибиторы холинэстераз (преимущественно ацетилхолинэстеразы) донепезил (Арисепт), ривастигмин (Экселон), галантамин, а также низкоаффинный неконкурентный антагонист NMDA-рецепторов - мемантин являются до настоящего времени основными терапевтическими средствами для лечения этого заболевания [Klafki H.W., et al. Brain. 2006, 129, 2840-2855; Mangialasche F., et al. Lancet Neurol. 2010, 9, 702-716].
Однако перечисленные препараты являются преимущественно симптоматическими, в частности, действие ингибиторов холинэстераз направлено на компенсацию дефицита нейромедиатора ацетилхолина [Martines & Castro. Expert Opin. Investig., 2006, 15, 1-12]. Следует отметить, что в здоровом мозге ацетилхолин преимущественно (на 80%) гидролизуется ацетилхолиэстеразой (АХЭ, КФ 3.1.1.7), тогда как бутирилхолинэстераза (БХЭ, КФ 3.1.1.8) играет вспомогательную роль. Однако по мере прогрессии БА активность АХЭ снижается, в то время как активность БХЭ постепенно увеличивается. В связи с этим возрастает роль БХЭ как терапевтической мишени для снижения наблюдаемого при БА холинергического дефицита [Furukawa-Hibi Y. et al. Behav. Brain Res., 2011, 225, 222-229; Wang L. et al. Eur. J. Med. Chem., 2014, 80, 543-561; Kamal M.A. et al. Neurochem. Res., 2008, 33, 745-753]. Полагают, что соединения, ингибирующие обе холинэстеразы - АХЭ и БХЭ, повышают эффективность лечения [Lane R.M. et al. Int. J. Neuropsychopharmacol., 2006, 9, 101-124; Greig N. et al. Proc. Natl. Acad. Sci. U.S.A., 2005, 102, 17213-17218].
Важное место в работе глутаматергической системы занимают ионотропные глутаматные рецепторы, непосредственно связанные с ионными каналами, в частности NMDA-подтип глутаматных рецепторов. Соединения, блокирующие NMDA-рецепторы, представляют интерес в качестве потенциальных средств терапии нейродегенеративных заболеваний. Используемый в качестве лекарственного препарата для улучшения памяти и когнитивных функций при БА блокатор NMDA-рецепторов мемантин [Lipton S.A. Nat Rev Drug Discov. 2006, 5(2), 160-170] взаимодействует только с внутриканальным участком связывания NMDA-рецептора [Limapichat W., et al. ACS Chem Neurosci. 2013, 4, 255-260]. Внутриканальные блокаторы NMDA-рецепторов, действующие подобно мемантину на весь пул NMDA-рецепторов, обладают когнитивно-стимулирующим и нейропротекторным действием.
При этом не менее важным представляется способность соединений блокировать NMDA-рецепторы, содержащие NR2B cубъединицы, примером которых является ифенпродил [Borza I., Domány G. Curr. Top. Med. Chem. 2006, 6(7), 687-695; Layton M.E., et al. Curr. Top. Med. Chem. 2006, 6(7), 697-709]. Хорошо доказано, что соединения, блокирующие такие рецепторы, способны улучшать память экспериментальных животных и не вызывают побочных эффектов, характерных для антагонистов NMDA-рецепторов широкого спектра [Paoletti P., et al. Nat. Rev. Neurosci. 2013, 14, 383-400].
Агрегация и отложение пептидов бета-амилоида в мозге играет ключевую роль в возникновении и прогрессии БА [Hsiao K. et al, Science 1996, 274, 99-102; Hardy J. et al, J. Intern. Med. 2014, 275, 296-303]. Амилоидные бляшки или, более вероятно, их растворимые олигомеры, являются нейротоксичными, оказывая свое действие путем нарушения функции митохондрий, индукции апоптоза, а также стимуляции стресс-активированной протеинкиназы [Tumiatti V. et al. Curr. Med. Chem. 2010, 17, 1825-1838]. Полагают, что препараты, снижающие уровень бета-амилоида в головном мозге путем снижения скорости его образования или увеличения его клиренса, могут остановить или даже обратить вспять прогрессирование заболевания.
Известно, что АХЭ помимо классической функции гидролиза ацетилхолина обладает проагрегантными свойствами в отношении бета-амилоида [Morán M.A. et al. Acta Neuropathol. 1994, 87(3), 284-292]. АХЭ играет важную роль в процессинге бета-амилоида через участие периферического анионного сайта (PAS), который взаимодействует с растворимыми пептидами бета-амилоида, промотируя их агрегацию [Inestrosa N.C. et al. Mol. Psychiatry. 1996, 1(5), 359-361; De Ferrari G.V. et al. Biochemistry. 2001, 40(35), 10447-10457; Bartolini M. et al. Biochem. Pharmacol. 2003, 65(3), 407-416]. Эти факты привели к интенсивному исследованию соединений, проявляющих двойственную активность: как ингибиторы АХЭ и как ингибиторы агрегации бета-амилоида, т.е. такого рода соединения способны одновременно улучшать когнитивные функции и проявлять нейропротекторные свойства [Arce M.P. et al. J. Med. Chem. 2009, 52(22), 7249-7257; de Los Ríos C. et al. J. Med. Chem. 2010, 53(14), 5129-5143; Camps P. et al. Chem. Biol. Interact. 2010, 187(1-3), 411-415; Rouleau J. et al. Eur. J. Med. Chem. 2011, 46(6), 2193-2205].
Одним из важных факторов, отрицательно воздействующих на жизнедеятельность нейронов головного мозга, является окислительный стресс, характеризующийся дисбалансом между образованием свободных форм кислорода и их удалением с помощью различных механизмов антиоксидантной системы. Следует отметить, что по сравнению с другими тканями мозг более чувствителен к повреждению свободными радикалами. Эффективность работы антиоксидантной системы в мозге постепенно снижается в процессе старения, причем в мозге больных БА это снижение происходит еще более резко. Все это обусловливает целесообразность использования антиоксидантов в терапии БА [Chakrabarti S. et al, Curr. Med. Chem., 2013, 37, 4648-4664] и создание ингибиторов холинэстераз с дополнительными антиоксидантными свойствами [Rosini M. et al. Eur. J. Med. Chem., 2011, 46(11), 5435-5442].
Принимая во внимание множественность биологических систем, вовлеченных в патогенез и прогрессию БА, крайне перспективным подходом в разработке препаратов для лечения БА представляется концепция создания мультифункциональных, мультитаргетных препаратов, оказывающих комплексное воздействие на ряд биологических мишеней, ответственных за патогенез заболевания [Rosini M. et al. Neurochem. Res. 2014, 39, 1914-1923; Agis-Torres A. et al. Curr. Neuropharmacol. 2014, 12, 2-36; Dias K.S. & Viegas C. Jr. Curr. Neuropharmacol. 2014, 12, 239-255; Makhaeva G.F. et al. Sci. Rep. 2015, 5, 13164; Bachurin S.O. et al. Sci. Rep., 2017, 7, 45627]. Создание единой химической молекулы, способной одновременно влиять на множественные патогенетические звенья заболевания, имеет дополнительные преимущества по сравнению с комбинациями лекарственных средств как с точки зрения оптимального ADMET-профиля, так и в плане снижения риска нежелательных эффектов от взаимодействий отдельных лекарственных компонентов.
Одним из известных препаратов для лечения БА является такрин - мощный ингибитор АХЭ и БХЭ. Такрин был первым препаратом для лечения БА, но его применение было ограниченным в связи с обнаруженной гепатотоксичностью. Однако позднее было показано, что гепатотоксичность такрина можно снизить путем создания на его основе мультифункциональных препаратов, наделенных дополнительными антиоксидантными свойствами [Tumiatti V. et al. Curr. Med. Chem. 2010, 17, 1825-1838; Bolognesi M.L. et al, Curr. Pharm. Des. 2009, 15(6), 601-613; Fernández-Bachiller M.I. et al. ChemMedChem. 2009, 4, 828-841; Fernández-Bachiller M.I. et al. J. Med. Chem. 2010, 53, 4927-4937].
Анализ литературы показал, что имеется достаточное количество публикаций по мультифункциональным конъюгатам такрина с различными фармакофорами - в частности, с липокрином, с мелатонином, с 8-гидроксихинолином, с тролоксом, с флавоноидами, с карбазолом, с кумарином, с донепезилом и др. [Singh M. et al. Mol Divers. 2016, 20(1), 271-97; Spilovska K. et al. Curr. Top. Med. Chem. 2017, 17(9), 1006-1026; Panek D. et al. Future Med. Chem. 2017, 9(15), 1835-1854; Wu W.Y. et al. J Enzyme Inhib. Med. Chem. 2017,32(1), 572-587; Ismaili L. et al. Prog. Neurobiol. 2017, 151, 4-34].
Также в настоящее время рассматривается достаточное количество поданных заявок на патенты по мультифункциональным конъюгатам такрина с различными фармакофорами, обладающими полезными фармакологическими свойствами для терапии НДЗ. Наиболее близкими к данному изобретению являются следующие. В поданных заявках [«Tacrine-coumarin derivative containing triazole and application of derivative», CN20151880694 от 04.12.2015; «Tacrine-8-hydroxyl(amine)quinoline derivative and application thereof», CN20151880590 от 04.12.2015; «Amino thiazole derivative and preparation method and medical purpose thereof», CN20111216344 от 29.07.2011] заявленные соединения проявляют способность эффективно ингибировать АХЭ или АХЭ и БХЭ одновременно, а также свойством связываться с периферическим анионным сайтом АХЭ и ингибировать АХЭ-индуцируемую агрегацию бета-амилоида. В заявках [«Tacrine-dimethylamino flavone hybrid compounds and preparation method and application thereof», CN2016129038 от 15.01.2016; «Tacrine-caffeic acid hetero-blends, their preparation method and medicinal сompositions», CN20111359965 от 14.11.2011] к перечисленным выше фармакологическим свойствам, добавляется антиоксидантная активность. В поданной заявке [«Heterodimers and methods of using them», PCT/US2008/051717 от 22.01.2008] заявленные структуры одновременно эффективно ингибируют АХЭ и проявляют свойство блокировать NMDA-рецепторы. В патенте [Патент РФ № 2325379 «Ингибиторы двух сайтов связывания ацетилхолинэстеразы для лечения болезни Альцгеймера», от 07.10.2003] соединения проявляют способность эффективно ингибировать АХЭ, а также свойством связываться с периферическим анионным сайтом АХЭ и ингибировать АХЭ-индуцируемую агрегацию бета-амилоида.
Однако по совокупности фармакологических свойств, характерных для заявляемых авторами мультифункциональных соединений, а именно по способности одновременно эффективно ингибировать ацетилхолинэстеразу и бутирилхолинэстеразу, связываться с периферическим анионным сайтом ацетилхолинэстеразы, связывать свободные радикалы и блокировать NMDA-рецепторы, публикаций не найдено
Задачей настоящего изобретения является расширение арсенала средств, которые могут быть использованы в качестве новых мультифункциональных соединений, обладающих способностью одновременно высокоэффективно ингибировать ацетилхолинэстеразу и бутирилхолинэстеразу, связываться с периферическим анионным сайтом ацетилхолинэстеразы, связывать свободные радикалы и блокировать NMDA-рецепторы, и содержащим их фармацевтическим средствам, для лечения нейродегенеративных заболеваний.
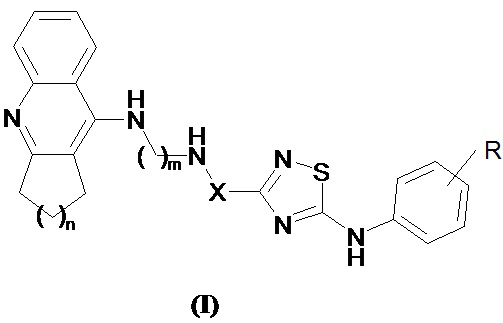
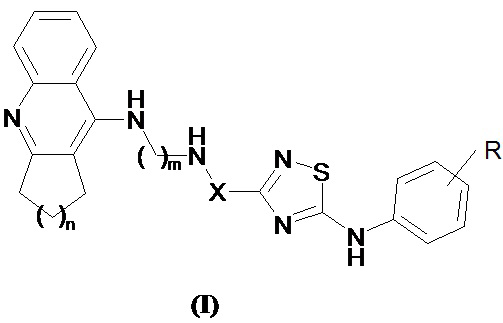
Поставленная задача решается синтезом новых конъюгатов такрина и его аналогов с производными 1,2,4-тиадиазола общей формулы I
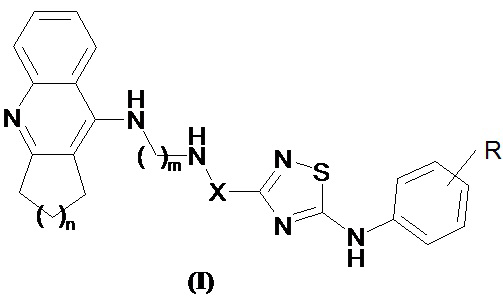
где R могут быть галогены (например, фтор, хлор и аналогичные), низшие алкильные группы (например, метил, этил и аналогичные), низшие алкоксигруппы (например, метокси, этокси и аналогичные), циано, тригалогенметильные (например, трифторметил и аналогичные), необязательно замещенные аминогруппы (например, амино, диметиламино, ацетиламино и аналогичные), ацильные группы (например, формил, ацетил, бензоил и аналогичные);
X представляет собой -(CH3)C=CH- или -(CH3)CHCH2-;
n = 1-4;
m = 2-7,
и обнаружением и использованием новых их свойств - способности одновременно ингибировать ацетилхолинэстеразу и бутирилхолинэстеразу, связываться с периферическим анионным сайтом ацетилхолинэстеразы, связывать свободные радикалы и блокировать NMDA-рецепторы.
Главным аспектом настоящего изобретения является синтез новых физиологически активных соединений, объединяющих в одной молекуле два активных фармакофора.
В данном изобретении наряду с такрином в качестве базового фармакофора использовали оригинальные структуры - 3-замещенные 5-анилино-1,2,4-тиадиазолы [Прошин А.Н., Бачурин С.О. Патент РФ № 2449997, "5-Амино-3-(2-аминопропил)-[1,2,4]тиадиазолы", от 10.05.2012]. Для ряда соединений этого класса показано наличие умеренной ингибиторной активности и селективности в отношении БХЭ и антиоксидантной активности [Махаева Г.Ф., Прошин А.Н. и др. Известия АН, Серия химическая. 2016, №6, 1586-1591], а также способности блокировать NMDA-рецепторы [Григорьев В.В., Махаева Г.Ф., Прошин А.Н. и др. Известия АН, Серия химическая, 2017, №7, 1308-1313].
Таким образом, в отличие от имеющихся запатентованных изобретений по мультифункциональным конъюгатам такрина, авторы настоящего изобретения предлагают новые мультифункциональные соединения, которые с одной стороны, содержат оригинальный фармакофор - 3-замещенные 5-анилино-1,2,4-тиадиазолы, с другой, обладают расширенным спектром фармакологической активности. Предложенные в данном изобретении структуры проявляют способность одновременно действовать на четыре биологические мишени, ответственные за патогенез заболевания, а именно обладают способностью эффективно ингибировать АХЭ и БХЭ, связываться с периферическим анионным сайтом ацетилхолинэстеразы, блокировать NMDA-рецепторы, а также связывать свободные радикалы.
Коньюгаты такрина и его аналогов с производными 1,2,4-тиадиазола общей формулы I (соединения C и D) были получены по следующей схеме:
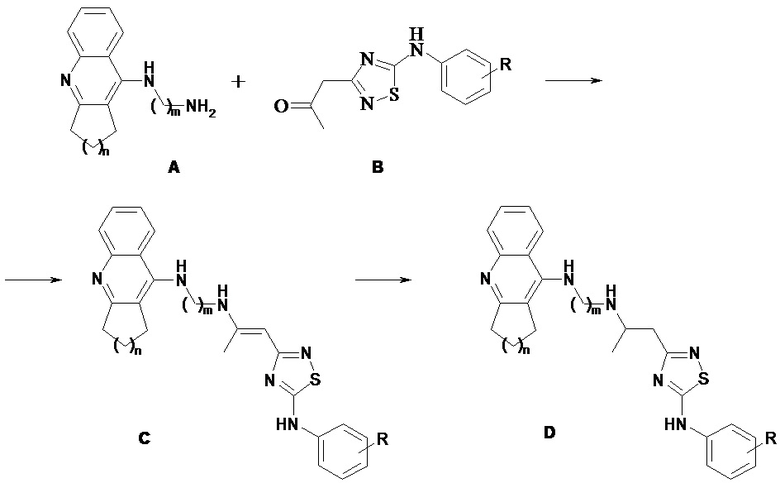
Общая методика синтеза соединений общей формулы I.
Раствор производного такрина А (0.01 М) в 5 мл метанола прибавляли к раствору 5-амино-3-(2-оксопропил)-[1,2,4]-тиадиазола В (0.01 М), полученного взаимодействием 3-амино-5-метилизоксазола и соответствующего изотиоцианата [Серков И.В., Прошин А.Н. и др. Доклады Академии наук, Химия, 2010, 435, 4, 479-481], в 10 мл метанола и оставляли при 25°С до выпадения осадка. Образовавшийся осадок конъюгата С отфильтровывали, суспендировали в 30 мл метанола, нагревали до 50°С и при интенсивном перемешивании прибавляли порциями боргидрид натрия (0.01 М). Полученную реакционную смесь перемешивали до полного растворения суспензии. По окончании реакции метанол упаривали, прибавляли 50 мл хлористого метилена и промывали водой (2 х 50 мл), насыщенным водным раствором хлористого натрия, сушили над сульфатом натрия. Осушитель отфильтровывали, фильтрат упаривали и получали коньюгат D.
Ниже приведены примеры синтезов, которые иллюстрируют, но не ограничивают данное изобретение.
Пример 1. 2-[5-(4-Метил-фениламино)-[1,2,4]тиадиазол-3-ил]-1-метил-винил-N'-(1,2,3,4-тетрагидро-акридин-9-ил)-пентан-1,5-диамин (1). (Соединение формулы I, где n = 2, m = 5, X = -(CH3)C=CH-, R = 4-CH3). Светло-желтые кристаллы, Т.пл. 138-140°С. ПМР (CDCl3, δ, м.д., J/Гц): 1.65 (м, 6H, (CH2)3), 1.93 (м, 4H, (CH2)2), 2.01 (с, 3H, =СCH3), 2.37 (с, 3H, ArCH3), 2.73 (м, 2H, CH2), 3.09 (м, 2H, CH2), 3.27 (кв, J = 5.9 Гц, 2H, CH2N), 3.54 (кв, J = 5.9 Гц, 2H, CH2N), 4.00 (уш. с., 1H, NH), 5.13 (с, 1Н, =СН), 7.18 (м, 4H, Harom), 7.37 (м, 1H, Harom), 7.58 (м, 1H, Harom), 7.93 (д, J = 8.9 Гц, 1H, Harom), 7.99 (д, J = 8.8 Гц, 1H, Harom), 8.32 (т, J = 5.9 Гц, 1H, NН), 9.03 (уш. с, 1Н, NН).
Пример 2. 2-[5-(4-Трифторметил-фениламино)-[1,2,4]тиадиазол-3-ил]-1-метил-винил-N'-(1,2,3,4-тетрагидро-акридин-9-ил)-пентан-1,5-диамин (2). (Соединение формулы I, где n = 2, m = 5, X = -(CH3)C=CH-, R = 4-CF3). Светло-желтые кристаллы, Т.пл. 142-144°С. ПМР (CDCl3, δ, м.д., J/Гц): 1.65 (м, 6H, (CH2)3), 1.89 (м, 4H, (CH2)2), 2.07 (с, 3H, =СCH3), 2.75 (м, 2H, CH2), 3.11 (м, 2H, CH2), 3.30 (кв, J = 6.0 Гц, 2H, CH2N), 3.54 (кв, J = 5.9 Гц, 2H, CH2N), 4.00 (уш. с., 1H, NH), 5.12 (с, 1Н, =СН), 7.37 (м, 1H, Harom), 7.43 (д, J = 8.9 Гц, 2H, Harom), 7.57 (м, 1H, Harom), 7.60 (д, J = 8.6 Гц, 2H, Harom), 7.90 (д, J = 8.9 Гц, 1H, Harom), 7.97 (д, J = 8.6 Гц, 1H, Harom), 8.33 (т, J = 5.9 Гц, 1H, NН), 9.40 (уш. с, 1Н, NН).
Пример 3. 2-[5-(4-Трифторметил-фениламино)-[1,2,4]тиадиазол-3-ил]-1-метил-винил-N'-(2,3-дигидро-1Н-циклопента[b]хинолин-9-ил)-пропан-1,3-диамин (3). (n = 1, m = 3, X = -(CH3)C=CH-, R = CF3). Светло-желтые кристаллы, Т.пл. 133-135°С. ПМР (CD3CN, δ, м.д., J/Гц): 1.72 (м, 2H, CH2CH2CH2), 2.10 (с, 3H, =СCH3), 2.15 (м, 2H, CH2CH2CH2), 3.04 (т, J = 7.8 Гц, 2H, CH2CH2CH2), 3.25 (кв, J = 6.5 Гц, 2H, CH2N), 3.32 (т, J = 7.8 Гц, 2H, CH2CH2CH2), 3.63 (кв, J = 6.5 Гц, 2H, CH2N), 5.03 (уш. с., 1H, NH), 5.13 (с, 1Н, =СН), 7.38 (м, 1H, Harom), 7.58 (м, 1H, Harom), 7.68 (д, J = 8.6 Гц, 2H, Harom), 7.80 (м, 2H, Harom), 8.00 (д, J = 8.6 Гц, 2H, Harom), 8.22 (м, 1H, NН), 8.82 (уш. с, 1Н, NН).
Пример 4. 2-[5-(4-Хлор-фениламино)-[1,2,4]тиадиазол-3-ил]-1-метил-винил-N'-(1,2,3,4-тетрагидро-акридин-9-ил)-пентан-1,5-диамин (4). (Соединение формулы I, где n = 2, m = 5, X = -(CH3)C=CH-, R = 4-Cl). Светло-желтые кристаллы, Т.пл. 148-150 °С. ПМР (CDCl3, δ, м.д., J/Гц): 1.65 (м, 6H, (CH2)3), 1.93 (м, 4H, (CH2)2), 2.01 (с, 3H, =СCH3), 2.73 (м, 2H, CH2), 3.09 (м, 2H, CH2), 3.27 (кв, J = 5.9 Гц, 2H, CH2N), 3.53 (кв, J = 5.9 Гц, 2H, CH2N), 4.02 (уш. с., 1H, NH), 5.15 (с, 1Н, =СН), 7.31 (м, 5H, Harom), 7.57 (м, 1H, Harom), 7.92 (д, J = 8.9 Гц, 1H, Harom), 7.99 (д, J = 8.9 Гц, 1H, Harom), 8.30 (т, J = 5.9 Гц, 1H, NН), 9.36 (уш. с, 1Н, NН).
Пример 5. 2-[5-(4-Фтор-фениламино)-[1,2,4]тиадиазол-3-ил]-1-метил-винил-N'-(1,2,3,4-тетрагидро-акридин-9-ил)-пентан-1,5-диамин (5). (Соединение формулы I, где n = 2, m = 5, X = -(CH3)C=CH-, R = 4-F). Светло-желтые кристаллы, Т.пл. 144-146°С. ПМР (CDCl3, δ, м.д., J/Гц): 1.65 (м, 6H, (CH2)3), 1.93 (м, 4H, (CH2)2), 2.01 (с, 3H, =СCH3), 2.73 (м, 2H, CH2), 3.09 (м, 2H, CH2), 3.27 (кв, J = 5.9 Гц, 2H, CH2N), 3.54 (кв, J = 5.9 Гц, 2H, CH2N), 4.01 (уш. с., 1H, NH), 5.11 (с, 1Н, =СН), 7.08 (м, 2H, Harom), 7.25 (м, 2H, Harom), 7.36 (м, 1H, Harom), 7.58 (м, 1H, Harom), 7.92 (д, J = 8.9 Гц, 1H, Harom), 7.97 (д, J = 8.9 Гц, 1H, Harom), 8.31 (т, J = 6.0 Гц, 1H, NН), 9.16 (уш. с, 1Н, NН).
Пример 6. 2-[5-(4-Метокси-фениламино)-[1,2,4]тиадиазол-3-ил]-1-метил-винил-N'-(1,2,3,4-тетрагидро-акридин-9-ил)-пентан-1,5-диамин (6). (Соединение формулы I, где n = 2, m = 5, X = -(CH3)C=CH-, R = 4-OCH3). Светло-желтые кристаллы, Т.пл. 123-125°С ПМР (CDCl3, δ, м.д., J/Гц): 1.68 (м, 6H, (CH2)3), 1.93 (м, 4H, (CH2)2), 2.01 (с, 3H, =СCH3), 2.73 (м, 2H, CH2), 3.09 (м, 2H, CH2), 3.27 (кв, J = 5.9 Гц, 2H, CH2N), 3.54 (c, 3H, OCH3), 3.56 (м, 2H, CH2N), 4.02 (уш. с., 1H, NH), 5.14 (с, 1Н, =СН), 7.30 (м, 5H, Harom), 7.57 (м, 1H, Harom), 7.96 (м, 2H, Harom), 8.30 (т, J = 6.1 Гц, 1H, NН), 9.63 (уш. с, 1Н, NН).
Пример 7. 2-[5-(4-Ацетил-фениламино)-[1,2,4]тиадиазол-3-ил]-1-метил-винил-N'-(1,2,3,4-тетрагидро-акридин-9-ил)-пентан-1,5-диамин (7). (Соединение формулы I, где n = 2, m = 5, X = -(CH3)C=CH-, R = 4-Ac). Светло-желтые кристаллы, Т.пл. 125-127°С. ПМР (CDCl3, δ, м.д., J/Гц): 1.68 (м, 6H, (CH2)3), 1.98 (м, 4H, (CH2)2), 2.07 (с, 3H, =СCH3), 2.54 (с, 3Н, СН3), 2.73 (м, 2H, CH2), 3.06 (м, 2H, CH2), 3.27 (кв, J = 6.0 Гц, 2H, CH2N), 3.54 (кв, J = 6.0 Гц, 2H, CH2N), 4.05 (уш. с., 1H, NH), 5.17 (с, 1Н, =СН), 7.32 (м, 1H, Harom), 7.54 (м, 1H, Harom), 7.63 (д, J = 8.4 Гц, 2H, Harom), 7.93 (д, J = 8.4 Гц, 2H, Harom), 7.97 (м, 2H, Harom), 8.38 (т, J = 5.9 Гц, 1H, NН), 9.49 (уш. с, 1Н, NН).
Пример 8. 2-[5-(4-Изопропил-фениламино)-[1,2,4]тиадиазол-3-ил]-1-метил-винил-N'-(1,2,3,4-тетрагидро-акридин-9-ил)-пентан-1,5-диамин (8). (Соединение формулы I, где n = 2, m = 5, X = -(CH3)C=CH-, R = 4-i-Pr). Светло-желтые кристаллы, Т.пл. 111-113°С. ПМР (CDCl3, δ, м.д., J/Гц): 1.26 (д, J = 6.5 Гц, 6H, (CH3)2), 1.70 (м, 6H, (CH2)3), 1.94 (м, 4H, (CH2)2), 2.11 (с, 3H, =СCH3), 2.69 (м, 2H, CH2), 2.89 (м, 1Н, СН(CH3)2), 3.03 (м, 2H, CH2), 3.27 (м, 2H, CH2N), 3.56 (м, 2H, CH2N), 4.10 (уш. с., 1H, NH), 5.12 (с, 1Н, =СН), 7.17 (д, J = 8.4 Гц, 2H, Harom), 7.32 (м, 1H, Harom), 7.38 (д, J = 8.4 Гц, 2H, Harom), 7.56 (м, 1H, Harom), 7.92 (м, 2H, Harom), 8.40 (м, 1H, NН), 9.28 (уш. с, 1Н, NН).
Пример 9. 2-[5-(3-Хлор-фениламино)-[1,2,4]тиадиазол-3-ил]-1-метил-винил-N'-(1,2,3,4-тетрагидро-акридин-9-ил)-пентан-1,5-диамин (9). (Соединение формулы I, где n = 2, m = 5, X = -(CH3)C=CH-, R = 3-Cl). Светло-желтые кристаллы, Т.пл. 105-107°С. ПМР (CDCl3, δ, м.д., J/Гц): 1.71 (м, 6H, (CH2)3), 1.91 (м, 4H, (CH2)2), 2.16 (с, 3H, =СCH3), 2.67 (м, 2H, CH2), 3.11 (м, 2H, CH2), 3.28 (м, 2H, CH2N), 3.59 (м, 2H, CH2N), 4.15 (уш. с., 1H, NH), 5.14 (с, 1Н, =СН), 7.11 (м, 1H, Harom), 7.15 (м, 1H, Harom), 7.27 (м, 1H, Harom), 7.34 (м, 1H, Harom), 7.38 (м, 1H, Harom), 7.59 (м, 1H, Harom), 7.98 (м, 2H, Harom), 8.44 (м, 1H, NН), 9.22 (уш. с, 1Н, NН).
Пример 10. 2-[5-(4-Хлор-фениламино)-[1,2,4]тиадиазол-3-ил]-1-метил-винил-N'-(2,3-дигидро-1Н-циклопента[b]хинолин-9-ил)-пропан-1,3-диамин (10). (Соединение формулы I, где n = 1, m = 3, X = -(CH3)C=CH-, R = Cl). Светло-желтые кристаллы, Т.пл. 122-124°С. ПМР (CD3CN, δ, м.д., J/Гц): 1.70 (м, 2H, CH2CH2CH2), 2.11 (с, 3H, =СCH3), 2.14 (м, 2H, CH2CH2CH2), 3.00 (т, J = 7.8 Гц, 2H, CH2CH2CH2), 3.23 (кв, J = 6.5 Гц, 2H, CH2N), 3.28 (т, J = 7.8 Гц, 2H, CH2CH2CH2), 3.60 (кв, J = 6.5 Гц, 2H, CH2N), 5.00 (уш. с., 1H, NH), 5.12 (с, 1Н, =СН), 7.28 (д, J = 8.8 Гц, 2H, Harom), 7.36 (м, 1H, Harom), 7.40 (д, J = 8.8 Гц, 2H, Harom), 7.56 (м, 1H, Harom), 7.80 (м, 2H, Harom), 8.25 (м, 1H, NН), 8.88 (уш. с, 1Н, NН).
Пример 11. 2-[5-(4-Трифторметил-фениламино)-[1,2,4]тиадиазол-3-ил]-1-метил-винил-N'-(6,7,8,9,10,11-гексагидро-циклоокта[b]хинолин-12-ил)-этан-1,2-диамин диамин (11). (Соединение формулы I, где n = 4, m = 2, X = -(CH3)C=CH-, R = CF3). Светло-желтые кристаллы, Т.пл. 102-104°С. ПМР (CDCl3, δ, м.д., J/Гц): 1.65 (м, 4H, CH2CH2CH2CH2CH2CH2), 1.89 (м, 4Н, CH2CH2CH2CH2CH2CH2), 1.95 (с, 3H, =СCH3), 2.69 (м, 2H, CH2CH2CH2CH2CH2CH2), 3.04 (м, 2H, CH2CH2CH2CH2CH2CH2), 3.24 (кв, J = 6.5 Гц, 2H, NCH2CH2N), 3.49 (м, 2H, NCH2CH2N), 3.97 (уш. с, 1H, NH), 5.06 (с, 1Н, =СН), 7.38 (м, 1H, Harom), 7.58 (м, 1H, Harom), 7.68 (д, J = 8.6 Гц, 2H, Harom), 7.80 (м, 2H, Harom), 8.00 (д, J = 8.6 Гц, 2H, Harom), 8.22 (м, 1H, NН), 9.32 (уш. с, 1Н, NН).
Пример 12. 2-[5-(4-Хлор-фениламино)-[1,2,4]тиадиазол-3-ил]-1-метил-винил-N'-(6,7,8,9,10,11-гексагидро-циклоокта[b]хинолин-12-ил)-этан-1,2-диамин (12). (Соединение формулы I, где n = 4, m = 2, X = -(CH3)C=CH-, R = Cl). Светло-желтые кристаллы, Т.пл. 106-108°С. ПМР (ДМСО-d6, δ, м.д., J/Гц): 1.30 (м, 2H, CH2CH2CH2CH2CH2CH2), 1.45 (м, 2H, CH2CH2CH2CH2CH2CH2), 1.66 (м, 2Н, CH2CH2CH2CH2CH2CH2), 1.78 (м, 4H, CH2CH2CH2CH2CH2CH2), 2.00 (с, 3H, =СCH3), 3.04 (м, 4H, CH2CH2CH2CH2CH2CH2), 3.49 (м, 4H, NCH2CH2N), 4.88 (уш. с., 1H, NH), 5.07 (с, 1Н, =СН), 7.01 (м, 2H, Harom), 7.26 (м, 1H, Harom), 7.52 (м, 5H, Harom), 7.54 (д, J = 8.5 Гц, 1H, Harom), 8.03 (д, J = 8.5 Гц, 1H, Harom), 8.46 (м, 1H, NН), 10.46 (уш. с, 1Н, NН).
Пример 13. N-(2,3-Дигидро-1Н-циклопента[b]хинолин-9-ил-N'-{1-метил-2-[5-(4-трифторметил-фениламино)-[1,2,4]тиадиазол-3-ил]-винил}-пентан-1,5-диамин (13). (Соединение формулы I, где n = 1, m = 5, X = -(CH3)C=CH-, R = CF3). Светло-желтые кристаллы, Т.пл. 210-212°С. ПМР (ДМСО-d6, δ, м.д., J/Гц): 1.68 (м, 6H, N(CH2)3), 2.04 (с, 3H, =СCH3), 2.12 (м, 2H, CH2CH2CH2), 3.05 (кв, J = 7.8 Гц, 2H, CH2), 3.21 (кв, J = 7.3 Гц, CH2), 3.29 (кв, J = 6.5 Гц, 2H, CH2N), 3.66 (кв, J = 6.5 Гц, 2H, CH2N), 4.93 (уш. с., 1H, NH), 5.22 (с, 1Н, =СН), 7.35 (м, 1H, Harom), 7.50 (м, 1H, Harom), 7.53 (д, J = 8.6 Гц, 2H, Harom), 7.62 (д, J = 8.6 Гц, 2H, Harom), 7.73 (д, J = 8.3 Гц, 1H, Harom), 7.92 (д, J = 8.3 Гц, 1H, Harom), 8.35 (т, J = 5.5 Гц, 1H, NН), 10.10 (уш. с, 1Н, NН).
Пример 14. N-(2,3-Дигидро-1Н-циклопента[b]хинолин-9-ил-N'-{1-метил-2-[5-(4-хлор-фениламино)-[1,2,4]тиадиазол-3-ил]-винил}-пентан-1,5-диамин (14). (Соединение формулы I, где n = 1, m = 5, X = -(CH3)C=CH-, R = Cl). Светло-желтые кристаллы, Т.пл. 210-212°С. ПМР (ДМСО-d6, δ, м.д., J/Гц): 1.66 (м, 6H, N(CH2)3), 2.06 (с, 3H, =СCH3), 2.12 (м, 2H, CH2CH2CH2), 3.00 (кв, J = 7.8 Гц, 2H, CH2), 3.23 (м, 4H, CH2, CH2N), 3.61 (кв, J = 6.5 Гц, 2H, CH2N), 4.99 (уш. с., 1H, NH), 5.12 (с, 1Н, =СН), 7.28 (д, J = 8.6 Гц, 2H, Harom), 7.34 (м, 1H, Harom), 74 (д, J = 8.6 Гц, 2H, Harom), 7.52 (м, 1H, Harom), 7.73 (м, 1H, Harom), 7.80 (м, 2H, NН), 8.25 (уш. с, 1Н, NН).
Пример 15. N-{2-[5-(4-Метил-фениламино)-[1,2,4]тиадиазол-3-ил]-1-метил-этил}-N'-(1,2,3,4-тетрагидро-акридин-9-ил)-пентан-1,5-диамин (15). (Соединение формулы I, где n = 2, m = 5, X = -(CH3)C-CH-, R = CH3). Кристаллизующееся масло. ПМР (CDCl3, δ, м.д., J/Гц): 1.11 (д, J = 6.7 Гц, 3H, CH3), 1.39 (м, 4H, CH2CH2CH2CH2CH2), 1.65 (м, 2H, CH2CH2CH2CH2CH2), 1.91 (м, 4H, СН2CH2), 2.37 (с, 3H, ArCH3), 2.71 (м, 4H, 2хCH2N), 2.88 (м, 2H, СНCH2), 3.03 (м, 1H, NH), 3.12 (м, 2H, CH2), 3.17 (м, 1H, СНCH2), 3.54 (м, 2H, CH2), 4.31 (уш. с, 1H, NH), 7.12 (м, 4H, Harom), 7.39 (м, 1H, Harom), 7.61 (м, 1H, Harom), 7.95 (д, J = 8.8 Гц, 1H, Harom), 8.08 (д, J = 8.8 Гц, 1H, Harom), 8.39 (уш. с, 1H, NН), 9.13 (уш. с, 1Н, NН).
Пример 16. N-{2-[5-(4-Трифторметил-фениламино)-[1,2,4]тиадиазол-3-ил]-1-метил-этил}-N'-(1,2,3,4-тетрагидро-акридин-9-ил)-пентан-1,5-диамин (16). (Соединение формулы I, где n = 2, m = 5, X = -(CH3)C-CH-, R = CF3). Кристаллизующееся масло. ПМР (CDCl3, δ, м.д., J/Гц): 1.13 (д, J = 6.7 Гц, 3H, CH3), 1.45 (м, 4H, CH2CH2CH2CH2CH2), 1.69 (м, 2H, CH2CH2CH2CH2CH2), 1.89 (м, 4H, СН2CH2), 2.65 (м, 4H, 2хCH2N), 2.87 (м, 2H, СНCH2), 3.03 (м, 1H, NH), 3.10 (м, 2H, CH2), 3.15 (м, 1H, СНCH2), 3.56 (м, 2H, CH2), 4.30 (уш. с, 1H, NH), 7.30 (м, 5H, Harom), 7.53 (м, 1H, Harom), 7.95 (м, 2H, Harom).
Пример 17. N-(2,3-Дигидро-1Н-циклопента[b]хинолин-9-ил-N'-{1-метил-2-[5-(4-трифторметил-фениламино)-[1,2,4]тиадиазол-3-ил]-этил}-пропан-1,5-диамин (17). (Соединение формулы I, где n = 1, m = 3, X = -(CH3)C-CH-, R = CF3). Кристаллизующееся масло. ПМР (CDCl3, δ, м.д., J/Гц): 1.15 (д, J = 6.4 Гц, 3H, CH3), 1.75 (м, 2H, CH2CH2CH2), 2.05 (м, 2H, СН2CH2CH2), 2.66 (м, 2H, СНCH2), 3.14 (м, 2H, CH2), 3.17 (м, 1H, СНCH2), 3.24 (кв, J = 6.5 Гц, 2H, CH2N), 3.64 (кв, J = 6.5 Гц, 2H, CH2N), 4.74 (уш. с, 1H, NH), 7.37 (м, 1H, Harom), 7.46 (м, 1H, Harom), 7.56 (д, J = 8.6 Гц, 2H, Harom), 7.66 (д, J = 8.6 Гц, 2H, Harom), 7.70 (м, 1H, Harom), 7.824 (д, J = 7.8 Гц, 1H, Harom).
Пример 18. N-{2-[5-(4-Хлор-фениламино)-[1,2,4]тиадиазол-3-ил]-1-метил-этил}-N'-(1,2,3,4-тетрагидро-акридин-9-ил)-пентан-1,5-диамин (18). (Соединение формулы I, где n = 2, m = 5, X = -(CH3)C-CH-, R = Cl). Кристаллизующееся масло. ПМР (CDCl3, δ, м.д., J/Гц): 1.08 (д, J = 6.0 Гц, 3H, СН3), 1.55 (м, 6H, CH2CH2CH2CH2CH2), 1.90 (м, 4H, СН2CH2), 2.71 (м, 4H, 2хCH2N), 2.88 (м, 2H, СНCH2), 3.07 (м, 1H, NH), 3.13 (м, 1H, СНCH2), 3.56 (м, 2H, CH2), 4.30 (уш. с, 1H, NH), 7.30 (м, 5H, Harom), 7.57 (м, 1H, Harom), 7.92 (м, 2H, Harom), 9.36 (уш. с, 1H, NH).
Пример 19. N-{2-[5-(4-Метокси-фениламино)-[1,2,4]тиадиазол-3-ил]-1-метил-этил}-N'-(1,2,3,4-тетрагидро-акридин-9-ил)-пентан-1,5-диамин (19). (Соединение формулы I, где n = 2, m = 5, X = -(CH3)C-CH-, R = OCH3). Кристаллизующееся масло. ПМР (CDCl3, δ, м.д., J/Гц): 1.08 (д, J = 6.1 Гц, 3H, CH3), 1.48 (м, 4H, CH2CH2CH2CH2CH2), 1.66 (м, 2H, CH2CH2CH2CH2CH2), 1.90 (м, 4H, СН2CH2), 2.60 (м, 2H, CH2N), 2.72 (м, 2H, CH2N), 2.78 (м, 2H, СНCH2), 3.02 (м, 1H, NH), 3.08 (м, 2H, CH2), 3.10 (м, 1H, СНCH2), 3.47 (м, 2H, CH2), 3.79 (с, 3Н, ОСН3), 3.90 (уш. с, 1H, NH), 6.85 (д, J = 6.1 Гц, 2Н, Harom), 7.18 (д, J = 6.1 Гц, 2Н, Harom), 7.30 (м, 1H, Harom), 7.51 (м, 1H, Harom), 7.88 (м, 2H, Harom).
Пример 20. N-(2,3-Дигидро-1Н-циклопента[b]хинолин-9-ил-N'-{1-метил-2-[5-(4-трифторметил-фениламино)-[1,2,4]тиадиазол-3-ил]-этил}-пентан-1,5-диамин (20). (Соединение формулы I, где n = 1, m = 5, X = -(CH3)C-CH-, R = CF3). Кристаллизующееся масло. ПМР (CDCl3, δ, м.д., J/Гц): 1.16 (д, J = 6.4 Гц, 3H, CH3), 1.50 (м, 4H, NCH2CH2CH2CH2CH2), 1.63 (м, 2H, NCH2CH2CH2CH2CH2), 2.06 (м, 2H, СН2CH2CH2), 2.69 (м, 2H, СНCH2), 2.96 (м, 2H, CH2N), 3.12 (м, 2H, CH2), 3.17 (м, 1H, СНCH2), 3.56 (кв, J = 6.8 Гц, 2H, CH2N), 4.76 (уш. с, 1H, NH), 7.37 (м, 1H, Harom), 7.48 (м, 1H, Harom), 7.55 (д, J = 8.6 Гц, 2H, Harom), 7.65 (д, J = 8.6 Гц, 2H, Harom), 7.70 (м, 1H, Harom), 7.84 (д, J = 7.8 Гц, 1H, Harom).
Другим важным аспектом изобретения является изучение биологической активности синтезированных соединений общей формулы I.
1. Определение ингибиторной активности соединений общей формулы I в отношении ацетилхолинэстеразы, бутирилхолинэстеразы и карбоксилэстеразы. Для кинетических исследований использовали коммерческие препараты («Sigma», США) ацетилхолинэстеразы эритроцитов человека (АХЭ, КФ 3.1.1.7), бутирилхолинэстеразы сыворотки лошади (БХЭ, КФ 3.1.1.8) и карбоксилэстеразы печени свиньи (КЭ, КФ 3.1.1.1). КЭ гидролизует многие терапевтически важные препараты, содержащие сложноэфирные группы [Imai T. Drug Metab. Pharmacokinet. 2006, 21, 173-185; Laizure S.C. et al. Pharmacotherapy. 2013, 33, 210-222], в связи с чем способность антихолинэстеразных соединений, применяемых в терапии БА, ингибировать КЭ может приводить к нежелательным лекарственным взаимодействиям [Tsurkan L.G., et al. Chem. Biol. Interact. 2013, 203, 226-230].
Определение активности ферментов. Активность АХЭ и БХЭ определяли методом Эллмана (λ 412 нм) [Ellman G.L. et al. Biochem. Pharmacol. 1961, 7, 88-95] с использованием в качестве субстрата ацетилтиохолина (1мM) и бутирилтиохолина (1мM), соответственно; условия определения: 0.1 М K,Na фосфатный буфер рН 7.5, 25оС. Активность КЭ определяли спектрофотометрически по выделению 4-нитрофенола (λ 405 нм), субстрат - 4-нитрофенилацетат (1мM); условия определения: 0.1 М K,Na фосфатный буфер рН 8.0, 25оС [Sterri S.H. et al. Biochem. Pharmacol. 1985, 34(15), 2779-2785]. Измерения проводили на микропланшетном ридере FLUOStar Optima (LabTech, Germany).
Определение величин IC50 для ингибирования АХЭ, БХЭ и КЭ. Ингибиторную активность соединений характеризовали величиной IC50 - концентрацией ингибитора, которая требуется для снижения активности фермента на 50%. Для определения IC50 ингибирования АХЭ, БХЭ и КЭ образец соответствующего фермента инкубировали с исследуемым соединением (концентрация ДМСО 2 об. %) в течение 10 минут, затем определяли остаточную активность фермента. Диапазон концентраций исследуемого соединения составлял 1х10-12 - 1х10-4М. Каждый эксперимент проводили в трипликате. Измерения проводили на микропланшетном ридере FLUOStar Optima (LabTech, Germany). Вычисление IC50 проводили с использованием программы Origin 6.1.
Определение механизма ингибирования АХЭ и БХЭ соединениями общей формулы I и расчет кинетических констант ингибирования. Для выяснения механизма ингибирования определяли зависимость остаточной активности АХЭ и БХЭ от концентрации ингибитора при различных концентрациях субстрата. Каждый эксперимент проводили в трипликате. Данные анализировали в двойных обратных координатах Лайнуивера-Берка. Механизм ингибирования определяли из анализа зависимостей 1/V = f(1/S), полученных для трех возрастающих концентраций ингибитора. Вычисление кинетических констант ингибирования Ki (конкурентная составляющая) и αKi (неконкурентная составляющая) проводили с использованием программы Origin 6.1.
2. Определение степени вытеснения пропидия иодида из периферического анионного сайта ацетилхолинэстеразы Electrophorus electricus соединениями общей формулы I
Способность соединений общей формулы I конкурентно вытеснять пропидий иодид - селективный лиганд периферического анионного сайта АХЭ, оценивали флуресцентным методом [Taylor P. et al. Mol. Pharmacol. 1974, 10, 703-708; Taylor P., Lappi S. Biochemistry. 1975, 14, 1989-1997]. В качестве источника фермента использовали АХЭ из Electrophorus electricus (ЕеАХЭ, фракция VI-S, Sigma-Aldrich) как высокоактивный и более дешевый фермент по сравнению с АХЭ человека, характеризующийся высокой степенью очистки. Интенсивность флуоресценции пропидия иодида в связанном состоянии с АХЭ возрастает в несколько раз. Снижение интенсивности флуоресценции в присутствии исследуемых соединений показывает их способность связываться с периферическим анионным сайтом АХЭ, и, соответственно, блокировать агрегацию бета-амилоида.
Для определения степени вытеснения пропидия иодида из периферического анионного сайта АХЭ проводили инкубацию ЕеАХЭ (7 мкМ раствор) с исследуемым соединением в концентрации 20 мкМ в 1 мM трис-HCl буфере pH 8.0, 250С в течение 15 минут. Затем добавляли раствор пропидия иодида (конечная концентрация 8 мкМ), инкубировали 15 минут и снимали спектр флуоресценции (530 нм (возб.) и 600 нм (эмис.)). Донепезил и такрин использовали как референсные соединения. Бланк содержал пропидий иодид той же концентрации в 1 мM трис-HCl буфере pH 8.0. Измерения проводили в трипликате на микропланшетном ридере FluoSTAR Optima (BMG LabTech, Германия).
Степень вытеснения пропидия иодида из периферического анионного сайта АХЭ (% вытеснения) рассчитывали по формуле:
% вытеснения = 100 - (IFАХЭ+Пропидий+ингибитор /IFАХЭ+Пропидий) x100,
где IFАХЭ+Пропидий - интенсивность флуоресценции связанного с ЕеАХЭ пропидия в отсутствие исследуемого соединения (принимается за 100%), IFАХЭ+Пропидий+ингибитор - интенсивность флуоресценции связанного с ЕеАХЭ пропидия в присутствии исследуемого соединения.
3. Определение антиоксидантной активности соединений общей формулы I
Антиоксидантную активность соединений оценивали по их способности связывать свободные радикалы в АБТС-тесте [Re R. et al. Free Radic. Biol. Med. 1999, 26, 1231-1237]. Метод основан на генерации устойчивого окрашенного катион-радикала АБТС·+ темно-зеленого цвета при инкубации АБТС (2,2′-азино-бис(3-этилбензтиазолино-6-сульфоновая кислота)) c персульфатом калия. Последующее взаимодействие АБТС·+ с соединением, обладающим антиоксидантными свойствами, приводит к уменьшению светопоглощения радикала при длине волны 734 нм.
Реакцию исследуемых соединений с АБТС·+- радикалом проводили при 30°С в темноте, время инкубации 1 час. Вещества тестировали в диапазоне концентраций 1×10-6 - 2×10-4 М. В качестве стандартных антиоксидантов использовали тролокс и аскорбиновую кислоту. Степень обесцвечивания раствора АБТС·+- радикала определяли при длине волны 734 нм на микропланшетном ридере xMark (BioRad, Japan). Все измерения проводили в трипликате.
Антиоксидантную активность соединений представляли в единицах TEAC (trolox equivalent antioxidant capacity - антиоксидантная способность, выраженная в тролокс-эквивалентах) как отношение тангенсов углов наклона для зависимостей снижения концентрации (светопоглощения) АБТС·+-радикала от концентрации исследуемого соединения и тролокса.
4. Определение связывания соединений общей формулы I с NMDA-рецепторами
Изучение связывания представителей соединений общей формулы I с NMDA-подтипом глутаматных рецепторов проводили методом радиолигандного связывания согласно методу [Zhou L.M. et al. J. Pharmacol. Exp. Ther. 1997, 280, 422-427] с небольшими модификациями. Использовали два радиоактивных лиганда: [3H]MK-801 (дизоцилпин) с удельной активностью 210 Ки/моль, связывающийся со всеми выделенными NMDА-рецепторами, и [3H]ифенпродил с удельной активностью 79 Ки/моль, связывающийся только с NMDА-рецепторами, содержащими NR2B субъединицы [Coughenour L.L., Barr B.M. J. Pharmacol. Exp. Ther. 2001, 296, 150-159; Dana C. et al. Neurosci. Let. 1991, 125, 45-48].
Мембранный препарат для радиолигандного анализа готовили по описанному методу [Nowak G. et al. J. Pharmacol. Exp. Ther. 1993, 265, 1380-1386]. Ткань гиппокампа измельчали в гомогенизаторе Поттера («тефлон-стекло») в буфере № 1 (5 мМ HEPES/4.5 мМ Трис буфера, рН 7.6), содержащего 0.32 М сахарозы, в соотношении 1 г ткани: 10 мл буфера. Гомогенат разбавляли буфером для исследования № 2 (5 мМ HEPES/4.5 мМ Трис буфера, рН 7.6) в соотношении 1:50 и центрифугировали 10 мин при 1000g. Затем отбирали супернатант и вновь центрифугировали 20 мин при 25000g. Осадок гомогенизировали в буфере № 2 в соотношении 1:50 и центрифугировали 20 мин при 8000g. Супернатант и его мягкий, зыбкий надосадочный слой отбирали и центрифугировали 20 мин при 25000g. Полученный осадок суспендировали в буфере № 3 (5 мМ HEPES/ 4.5 мМ Трис буфера, (рН 7.61), содержащем 1 мМ Na4EDTA), и суспензию вновь центрифугировали. Такую процедуру отмывки проводили четыре раза, при последней отмывке Na4EDTA исключали из состава. Конечный осадок ресуспендировали в буфере № 2 в соотношении 1:5 и хранили в жидком азоте.
Определение связывания. Реакционная смесь (конечный объем 0.5 мл) содержала 200 мкл буфера № 2, 50 мкл 50 нМ раствора меченого лиганда и 250 мкл белковой суспензии. Неспецифическое связывание определяли в присутствии 50 мкл 100 мкМ немеченого лиганда. Реакционную смесь инкубировали при комнатной температуре в течение 2 ч. По окончании инкубации пробы фильтровали через стекловолокнистые фильтры GF/B (Whatman), предварительно смоченные в 0.3% полиэтиленамине в течение 2 часов при 4°С. Каждую пробирку промывали один раз холодным буфером № 2, затем фильтры промывали три раза тем же объемом буфера. Фильтры сушили на воздухе до полного высыхания и переносили в сцинтилляционные флаконы, в которые добавляли по 5 мл сцинтилляционной жидкости, содержащей 4 г дифенилоксазола (РРО), 0.2 г дифенилоксазоилбензола (РОРОР) и 1 л толуола. Радиоактивность определяли на сцинтилляционном счетчике TriCarb2800 TR (PerkinElmer, Packard, США) с эффективностью счета около 65%.
Исследование влияния изучаемых соединений на связывание [3H]MK-801 или [3H]ифенпродила с мембранами гиппокампа крысы проводили при добавлении в инкубационную среду 50 мкл исследуемых соединений в диапазоне концентраций 10-8 -10-3 М.
По результатам ингибирования рассчитывали IC50 для изученных соединений с помощью программы GraphPadPrism 4 Demo.
В таблицах 1-4 приведены примеры биологических испытаний соединений общей формулы I, которые иллюстрируют, но не исчерпывают настоящее изобретение.
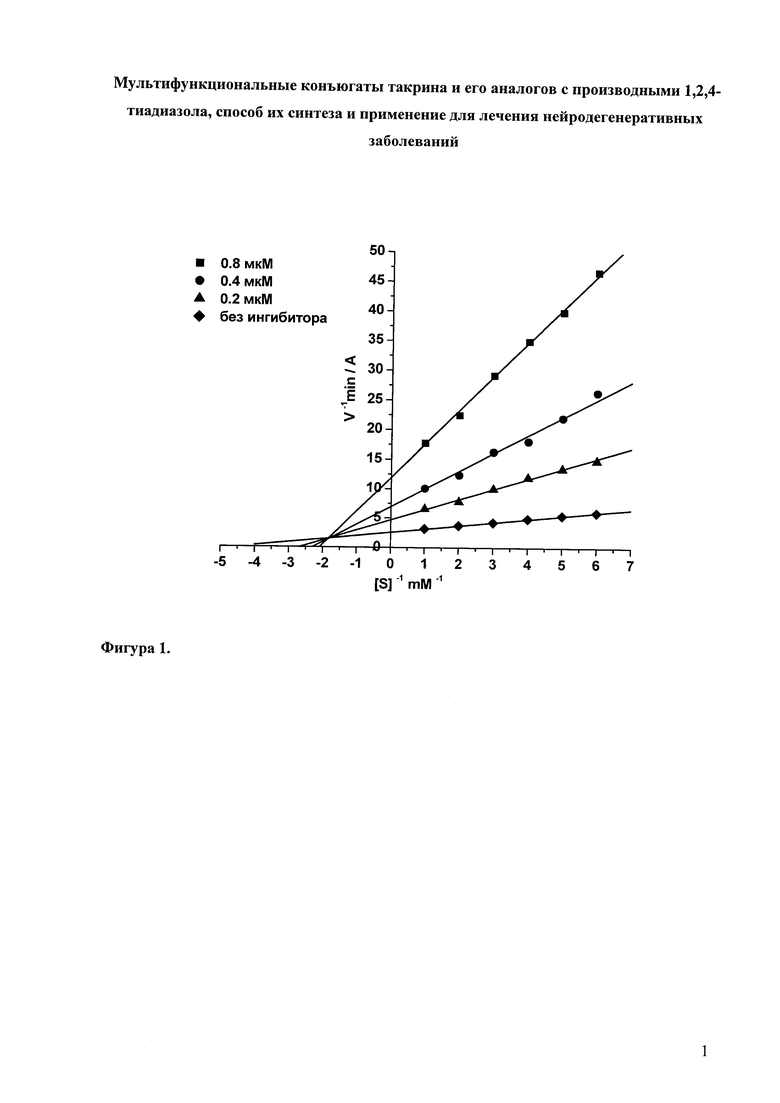
В таблице 1 приведены примеры определения ингибиторной активности представителей соединений общей формулы I в отношении АХЭ и БХЭ, а также структурно близкого холинэстеразам фермента КЭ. Результаты биологических испытаний показывают, что соединения формулы I проявляют высокую ингибиторную активность в отношении холинэстераз (АХЭ и БХЭ) и в меньшей степени ингибируют КЭ. Максимальную активность в отношении БХЭ проявляют соединения 16 и 17, которые ингибируют БХЭ в наномолярном диапазоне. Максимальную степень ингибирования в отношении АХЭ проявляют соединения 15 и 16, которые ингибируют АХЭ с величинами IC50 в субмикромолярной области. Антихолинэстеразная активность соединений формулы I сопоставима или превышает активность такрина. Невысокая ингибиторная активность большинства соединений в отношении КЭ, свидетельствует об отсутствии потенциальных нежелательных лекарственных взаимодействий.
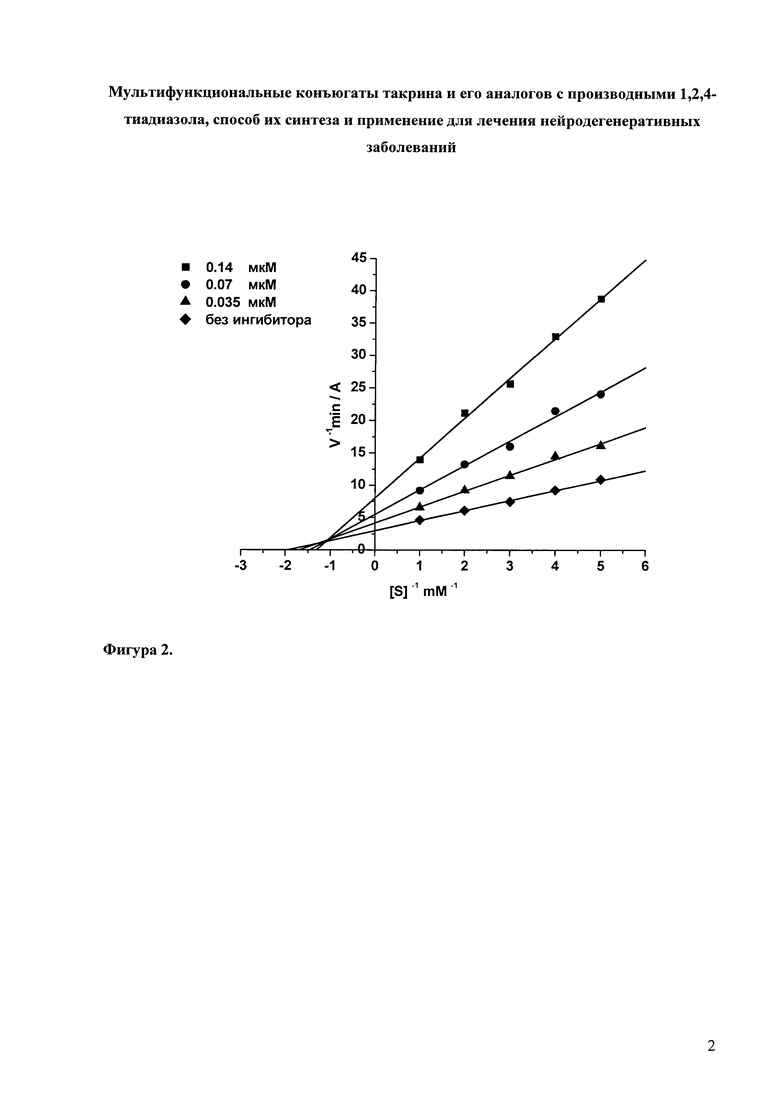
Для соединения 1 дополнительно исследован механизм ингибирования АХЭ и БХЭ. Данные анализировались в двойных обратных координатах Лайнуивера-Берка. Графический анализ кинетических данных по ингибированию АХЭ и БХЭ соединением 1 представлен на Фиг. 1 и Фиг. 2, соответственно.
Краткое описание чертежей.
На Фиг. 1 приведена кинетика ингибирования АХЭ 2-[5-(4-Метил-фениламино)-[1,2,4]тиадиазол-3-ил]-1-метил-винил-N'-(1,2,3,4-тетрагидро-акридин-9-ил)-пентан-1,5-диамином (соединение 1).
На Фиг. 2 приведена кинетика ингибирования БХЭ 2-[5-(4-метил-фениламино)-[1,2,4]тиадиазол-3-ил]-1-метил-винил-N'-(1,2,3,4-тетрагидро-акридин-9-ил)-пентан-1,5-диамином (соединение 1).
Видно, что при связывании соединения 1 как с АХЭ, так и с БХЭ изменяются Vmax и Km, что характерно для смешанного типа ингибирования. Конкурентная (Ki) и неконкурентная (αKi) компоненты константы ингибирования АХЭ соединением 1 составляют 0.078 ± 0.007 мкМ и 0.210 ± 0.023 мкМ, соответственно; для БХЭ 0.045 ± 0.004 мкМ и 0.073 ± 0.008 мкМ, соответственно. Соединения 2, 3, 15 - 17 ингибируют АХЭ и БХЭ по аналогичному (смешанному) механизму.
В таблице 2 приведены примеры определения степени вытеснения пропидия иодида из периферического анионного сайта ЕеАХЭ (% вытеснения) представителями соединений общей формулы I. Примеры подтверждают, что заявляемые соединения в концентрации 20 мкМ снижают интенсивность флуоресценции на 21-35%. При этом данные соединения более эффективно вытесняют пропидий из периферического анионного центра АХЭ, чем референсные соединения донепезил и такрин.
Методом молекулярного докинга с использованием Ламарковского генетического алгоритма (ЛГА) [Morris G.M. et al. J. Comput. Chem. 1998, 19, 1639-1662] в программе Autodock 4.2.6 [Morris G.M. et al. J. Comput. Chem. 2009, 30, 2785-2791] исследовано взаимодействие соединений 1 - 20 с АХЭ. Для молекулярного докинга использовали кристаллографическую структуру АХЭ человека PDB ID 4EY7 [J. Cheung M.J. et al J. Med. Chem. 2012, 55, 10282-10286]. Показано, что соединения 1 - 20 связываются как с каталитическим сайтом АХЭ, так и с периферическим анионным сайтом (PAS).
Полученные результаты по вытеснению пропидия из периферического анионного сайта АХЭ наряду со смешанным механизмом ингибирования АХЭ и результатами молекулярного докинга, свидетельствуют о том, что представители соединений общей формулы I связываются с периферическим анионным сайтом АХЭ и, следовательно, способны блокировать АХЭ-индуцируемую агрегацию бета-амилоида.
В таблице 3 приведены примеры определения антиоксидантной активности представителей соединений общей формулы I по их способности связывать свободные радикалы в АБТС-тесте. Примеры подтверждают, что заявляемые соединения проявляют достаточно высокую радикал-связывающую активность, которая превышает либо несколько ниже активности стандартных антиоксидантов тролокса и аскорбиновой кислоты.
В таблице 4 приведены примеры определения связывания представителей соединений общей формулы I с различными участками NMDA-рецептора по вытеснению меченых лигандов [3H]MK-801 и [3H]ифенпродила. Результаты показывают, что заявляемые соединения блокируют оба сайта NMDA-рецептора: внутриканальный сайт связывания МК-801 и сайт связывания ифенпродила, расположенный на NR2B субъединице NMDA-рецептора. Референсные соединения такрин и применяемый в клинической практике мемантин, в отличие от представителей соединений общей формулы I, обладают способностью блокировать только внутриканальный сайт связывания МК-801 NMDA-рецептора.
Следует отметить, что синтезированные соединения общей формулы I значительно превосходят по своим фармакологическим свойствам базовые фармакофоры - такрин и 3-замещенные 5-анилино-1,2,4-тиадиазолы.
Обнаружение у конъюгатов такрина и его аналогов с производными 1,2,4-тиадиазола общей формулы I ранее не известной совокупности свойств, а именно способности одновременно эффективно ингибировать ацетилхолинэстеразу и бутирилхолинэстеразу, связываться с периферическим анионным сайтом ацетилхолинэстеразы, связывать свободные радикалы и блокировать NMDA-рецепторы дает основания для применения этих соединений в медицинской практике как мультифункциональных препаратов для лечения нейродегенеративных заболеваний.
Применение конъюгатов такрина и его аналогов с производными 1,2,4-тиадиазола общей формулы I возможно в качестве эффективных ингибиторов ацетилхолинэстеразы и бутирилхолинэстеразы человека.
Применение конъюгатов такрина и его аналогов с производными 1,2,4-тиадиазола общей формулы I возможно в качестве соединений, связывающихся с периферическим анионным сайтом ацетилхолинэстеразы как потенциальных блокаторов АХЭ-индуцируемой агрегации бета-амилоида.
Применение конъюгатов такрина и его аналогов с производными 1,2,4-тиадиазола общей формулы I возможно в качестве соединений, способных связывать свободные радикалы.
Применение конъюгатов такрина и его аналогов с производными 1,2,4-тиадиазола общей формулы I возможно в качестве блокаторов NMDA-рецепторов.
Следующим аспектом изобретения является фармакологическое средство на основе конъюгатов такрина и его аналогов с производными 1,2,4-тиадиазола общей формулы I, обладающее совокупностью перечисленных выше свойств, содержащее терапевтически эффективное количество соединения формулы I, применяемое в медицине для лечения нейродегенеративных заболеваний, в том числе болезни Альцгеймера. Заявляемое фармакологическое средство содержит активное начало и фармацевтически приемлемый носитель, новизна которого заключается в том, что в качестве активного начала используется эффективное количество соединения формулы I.
Понятие «фармакологическое средство» подразумевает использование любой лекарственной формы, содержащей соединение формулы I, которое могло бы найти профилактическое или лечебное применение в медицине в качестве средства для лечения нейродегенеративных заболеваний, в том числе болезни Альцгеймера.
Понятие «эффективное количество», используемое в данной заявке, подразумевает использование того количества соединения формулы I, которое в сочетании с его показателями активности и токсичности, а также на основании знаний специалиста, должно быть эффективным в данной лекарственной форме.
Для получения фармакологического средства одно или несколько соединений формулы I смешивают как активный ингредиент с фармацевтически приемлемым носителем, известным в медицине, согласно принятым в фармацевтике способам. В зависимости от лекарственной формы препарата могут быть использованы различные носители.
Таблица 1. Ингибиторная активность представителей соединений общей формулы I в отношении АХЭ, БХЭ и КЭ.
соединения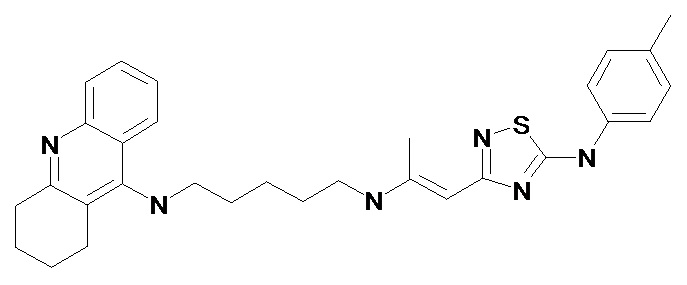
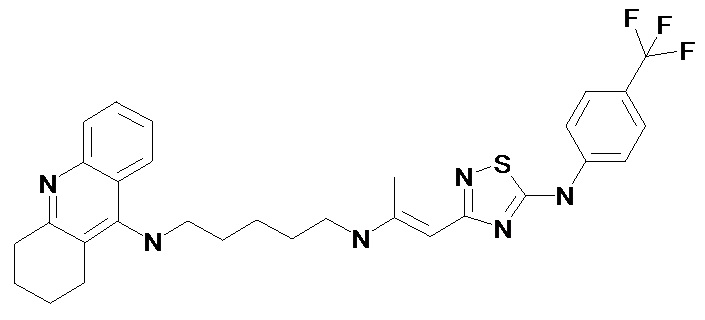
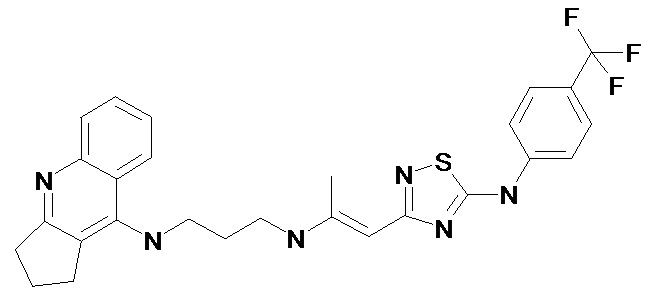

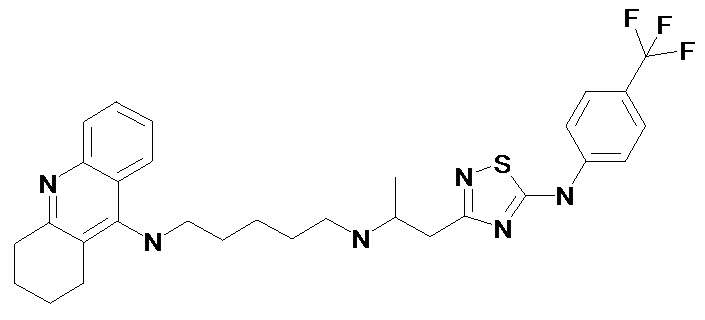
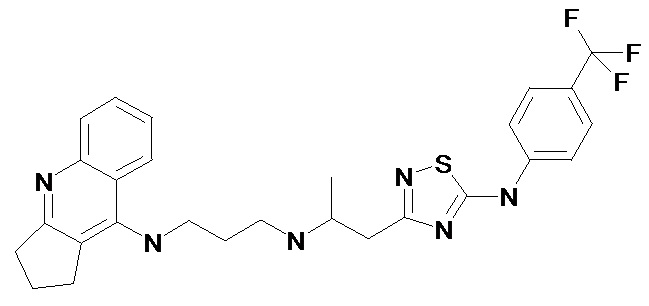
Таблица 2. Способность представителей соединений общей формулы I вытеснять пропидий из периферического анионного сайта E.eel АХЭ.
соеди-
нения





Таблица 3. Способность представителей соединений общей формулы I связывать свободные радикалы в АБТС-тесте.
соеди-
нения
TEAC*





*TEAC (trolox equivalent antioxidant tcapacity - антиоксидантная способность, выраженная в тролокс-эквивалентах), определена как отношение тангенсов углов наклона для зависимостей снижения концентрации АБТС•+-радикала от концентрации исследуемого соединения и Тролокса. Тролокс IC50=19.8 ± 0.6 (n=8), Аскорбиновая кислота IC50=21.4 ± 2.25 (n=7)
Таблица 4. Влияние представителей соединений общей формулы I на связывание меченых лигандов [3H]MK-801 и [3H]ифенпродила с различными участками NMDA-рецептора.
соеди-
нения





| название | год | авторы | номер документа |
|---|---|---|---|
| Мультифункциональные конъюгаты ипидакрина с 2-замещенными фенолами, способ их получения и применение для лечения нейродегенеративных заболеваний | 2023 |
|
RU2836319C1 |
| ПРОИЗВОДНЫЕ 1,2,3,4-ТЕТРАГИДРОПИРИДО[4,3-b]ИНДОЛСОДЕРЖАЩИХ ФЕНОТИАЗИНОВ В КАЧЕСТВЕ ИНГИБИТОРОВ ХОЛИНЭСТЕРАЗ И БЛОКАТОРОВ СЕРОТОНИНОВЫХ РЕЦЕПТОРОВ 5-HT, СПОСОБЫ ПОЛУЧЕНИЯ ИХ ХЛОРГИДРАТОВ И ФАРМАКОЛОГИЧЕСКОЕ СРЕДСТВО НА ИХ ОСНОВЕ | 2013 |
|
RU2530881C1 |
| ПРИМЕНЕНИЕ АДАМАНТАНСОДЕРЖАЩИХ ИНДОЛОВ И ИХ ГИДРОХЛОРИДОВ В КАЧЕСТВЕ ИНГИБИТОРОВ ХОЛИНЭСТЕРАЗ И БЛОКАТОРОВ NMDA-РЕЦЕПТОРОВ | 2016 |
|
RU2621348C1 |
| 5-АМИНО-3-(2-АМИНОПРОПИЛ)-[1,2,4]ТИАДИАЗОЛЫ | 2011 |
|
RU2449997C1 |
| ДИАМИНОТРИАЗОЛЫ, ПРИГОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗ | 2003 |
|
RU2350606C2 |
| ИНГИБИТОРЫ ТИРОЗИНФОСФАТАЗЫ БЕЛКА ЧЕЛОВЕКА И СПОСОБЫ ПРИМЕНЕНИЯ | 2007 |
|
RU2435763C2 |
| Соединения фторхинолонового ряда на основе производных пиридоксина, обладающие антибактериальными свойствами | 2019 |
|
RU2713932C1 |
| ПРОИЗВОДНЫЕ ТАКРИНА В КАЧЕСТВЕ ИНГИБИТОРОВ АЦЕТИЛХОЛИНЭСТЕРАЗЫ | 2004 |
|
RU2402545C2 |
| СЕЛЕКТИВНЫЕ ИНГИБИТОРЫ КАРБОКСИЛЭСТЕРАЗЫ, ПРЕДСТАВЛЯЮЩИЕ СОБОЙ АЛКИЛ-2-АРИЛГИДРАЗИНИЛИДЕН-3-ОКСО-3-ПОЛИФТОРАЛКИЛПРОПИОНАТЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 2014 |
|
RU2574291C1 |
| КОМПОЗИЦИИ, СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ ИНГИБИТОРОВ ХОЛИНЭСТЕРАЗЫ НА ОСНОВЕ ИНДАНОНА | 2007 |
|
RU2478619C2 |
Изобретение относится к мультифункциональным конъюгатам такрина и его аналогам с производными 1,2,4-тиадиазола общей формулы I, где R могут быть галогены, низшие алкильные группы, низшие алкоксигруппы, тригалогенметильные, ацильные группы; X представляет -(CH3)C=CH- или -(CH3)CHCH2-; n = 1-4; m = 2-7. Соединения формулы I получают путем конденсации 3-(2-оксопропил)-5-анилино-1,2,4-тиадиазола и аминоалкильных производных такрина и его аналогов с последующим, в случае необходимости, восстановлением двойной связи енаминового фрагмента под действием боргидрида натрия при нагревании. Соединения по изобретению предназначены для применения в медицине для лечения нейродегенеративных заболеваний. Соединения представляют собой эффективные ингибиторы ацетилхолинэстеразы и бутирилхолинэстеразы человека, способны связываться с периферическим анионным сайтом ацетилхолинэстеразы, связывать свободные радикалы, также в качестве блокаторов NMDA-рецепторов. 4 н. и 4 з.п. ф-лы, 4 табл., 2 ил., 20 пр.
1. Мультифункциональные конъюгаты такрина и его аналогов с производными 1,2,4-тиадиазола общей формулы I
 ,
,
где R могут быть галогены, низшие алкильные группы, низшие алкоксигруппы, тригалогенметильные, ацильные группы;
X представляет -(CH3)C=CH- или -(CH3)CHCH2-;
n = 1-4;
m = 2-7.
2. Способ синтеза соединений общей формулы I по п.1, заключающийся в конденсации 3-(2-оксопропил)-5-анилино-1,2,4-тиадиазола и аминоалкильных производных такрина и его аналогов с последующим, в случае необходимости, восстановлением двойной связи енаминового фрагмента под действием боргидрида натрия при нагревании.
3. Применение соединений общей формулы I по п.1 в медицине для лечения нейродегенеративных заболеваний.
4. Применение соединений общей формулы I по п.3 в качестве эффективных ингибиторов ацетилхолинэстеразы и бутирилхолинэстеразы человека.
5. Применение соединений общей формулы I по п.3 в качестве соединений, связывающихся с периферическим анионным сайтом ацетилхолинэстеразы.
6. Применение соединений общей формулы I по п.3 в качестве соединений, способных связывать свободные радикалы.
7. Применение соединений общей формулы I по п.3 в качестве блокаторов NMDA-рецепторов.
8. Фармакологическое средство для лечения нейродегенеративных заболеваний, содержащее терапевтически эффективное количество соединения формулы I по п.1 и фармацевтически приемлемый носитель.
| ИНГИБИТОРЫ ДВУХ САЙТОВ СВЯЗЫВАНИЯ АЦЕТИЛХОЛИНЭСТЕРАЗЫ ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ АЛЬЦГЕЙМЕРА | 2003 |
|
RU2325379C2 |
| 5-АМИНО-3-(2-АМИНОПРОПИЛ)-[1,2,4]ТИАДИАЗОЛЫ | 2011 |
|
RU2449997C1 |
| CN 105503840 A, 20.04.2016 | |||
| CN 105367553 A, 02.03.2016 | |||
| CN102351854 A, 04.06.2014. | |||
Авторы
Даты
2018-12-25—Публикация
2017-11-01—Подача