Изобретение относится к области органической химии, а именно к способам получения метил 3-ацил-4-циано-5-(дицианометилен)-2-гидрокси-2,5-дигидро-1H-пиррол-2-карбоксилатов общей формулы (А), которые могут быть использованы в качестве биологически активных соединений, оптических материалов и в качестве реагентов для органического синтеза.
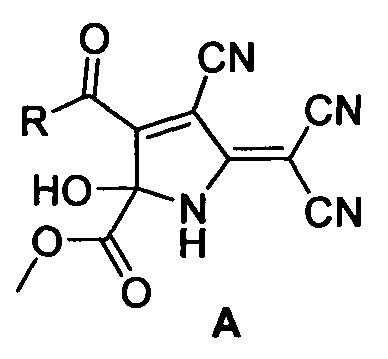
где R=2-фурил (А1), 2-тиофенил (А2), 3,4-(МеО)2-С6Н3 (A3), 3-NO2-C6H4 (А4), 4-Br-C6H4 (А5), стирил (А6).
Метил 3-ацил-4-циано-5-(дицианометилен)-2-гидрокси-2,5-дигидро-1H-пиррол-2-карбокслиты структурно подобны известным TCF (tricyanofuran) и TCP (tricyanopyrrole) акцепторам различных донорно-акцепторных хромофоров. Производные TCF и TCP используются как органические нелинейные оптические материалы, в солнечных батареях и как люминесцентные метки сенсоров [(a) Cho, М.J.; Seo, J.; Oh, Н.S.; Jee, H.; Kim, W.J.; Kim, K.H.; Hoang, M.H.; Choi, D.H.; Prasad, P.N. Sol. Energy Mater. Sol. Cells. 2012, 98, 71. (b) Malytskyi, V.; Simon, J.-J.; Patrone, L.; Raimundo, J.-M. RSC Adv. 2015, 5, 354. (c)  , H.; Kronenberg, N.M.; Meerholz, K.;
, H.; Kronenberg, N.M.; Meerholz, K.;  , F. Org. Lett. 2010, 12, 3666. (d) Liua, J.; Gaob, W.; Kitykc, I.V.; Liua, X.; Zhena, Z. Dyes Pigm. 2015, 122, 74. (e) Huang, H.; Liu, J.; Zhen, Z.; Qiu, L.; Liu, X.; Lakshminarayana, Deng, G.; Huang, H.; Si, P.; Xu, H.; Liu, J.; Bo, S.; Liu, X.; Zhen, Z.; Qiu, L. Polymer. 2013, 54, 6349. (g) Wu, J.; Xiao, H.; Qiu, L.; Zhen, Z.; Liu, X.; Bo, S. RSC Adv. 2014, 4, 497371. (h) Chen, Т.; Zheng, Y.; Xu, Z.; Zhao, M.; Xu, Y.; Cui, J. Tetrahedron Lett. 2013, 54, 2980. (i) Lu, Z.; Liu, N.; Lord, S.J.; Bunge, S.D.; Moerner, W.E.; Twieg, R.J. Chem. Mater. 2009, 21, 797. (j) Kim, S.-H.; Lee, S.-Y.; Gwon, S.-Y.; Bae, J.-S.; Son, Y.-A. J. Photochem. Photobiol. A: Chem. 2011, 217, 224.].
, F. Org. Lett. 2010, 12, 3666. (d) Liua, J.; Gaob, W.; Kitykc, I.V.; Liua, X.; Zhena, Z. Dyes Pigm. 2015, 122, 74. (e) Huang, H.; Liu, J.; Zhen, Z.; Qiu, L.; Liu, X.; Lakshminarayana, Deng, G.; Huang, H.; Si, P.; Xu, H.; Liu, J.; Bo, S.; Liu, X.; Zhen, Z.; Qiu, L. Polymer. 2013, 54, 6349. (g) Wu, J.; Xiao, H.; Qiu, L.; Zhen, Z.; Liu, X.; Bo, S. RSC Adv. 2014, 4, 497371. (h) Chen, Т.; Zheng, Y.; Xu, Z.; Zhao, M.; Xu, Y.; Cui, J. Tetrahedron Lett. 2013, 54, 2980. (i) Lu, Z.; Liu, N.; Lord, S.J.; Bunge, S.D.; Moerner, W.E.; Twieg, R.J. Chem. Mater. 2009, 21, 797. (j) Kim, S.-H.; Lee, S.-Y.; Gwon, S.-Y.; Bae, J.-S.; Son, Y.-A. J. Photochem. Photobiol. A: Chem. 2011, 217, 224.].
Известен способ получения 2-[4-арил-3-циано-5-гидрокси-5-метил-1H-пиррол-2-(5H)-илиден]малононитрилов путем взаимодействия димера малононитрила с 1-арилпропан-1.2-дионами в присутствии пиперидина (Федосеев С.В., Беликов М.Ю., Ершов О.В., Бардасов И.Н., Тафеенко В.А. Журн. органич. хим., 2016, т. 52, №10, с. 1450).
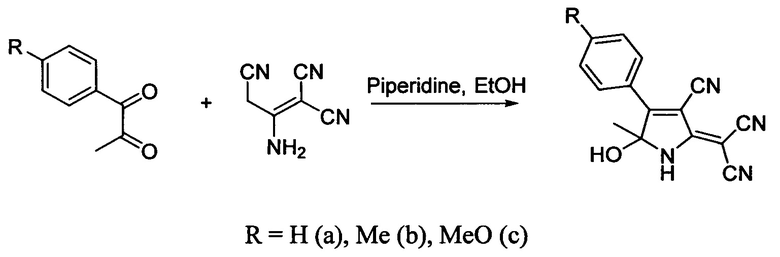
К недостаткам такого способа следует отнести экстрагирование продуктов реакции, необходимость их двойной очистки путем колоночной хроматографии с использованием в качестве элюента этилацетата и перекристаллизации из смеси пропан-2-ол - вода (3:1). Получаемые дицианометилендигидропирролы в воде не растворимы.
Также известен способ получения 2-(3-циано-7а-гидрокси-5,6,7,7а-тетрагидро-1H-индол-2(4H)илиден) малононитрилов. (Belikov, М. Yu.; Fedoseev, S.V.; Ershov, О.V.; Ievlev, M.Yu.; Tafeenko V.A. Tetrahedron Lett. 2016, 57, 4101).
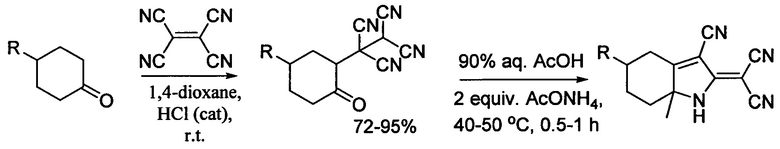
Заключительная стадия получения 2-[4-арил-3-циано-5-гидрокси-5-метил-1Н-пиррол-2-(5Н)-илиден]малононитрилов состоит в следующем: к раствору AcONH4 (0,15 г, 2 ммоль) и D-глюкозы (0,18 г, 1 ммоль) в 90%-ном водном растворе уксусной кислоты (4 г), добавляют соответствующий 4-оксоалкан-1,1,2,2-тетракарбонитрил 5 (1 ммоль). Реакционную смесь перемешивают при 40-50°С до завершения реакции (ТСХ). Выпавший осадок фильтруют и промывают водой, затем сушат в вакуумном эксикаторе над кальция хлоридом(II).
К недостаткам способа относятся трудоемкость (многостадийность, использование труднодоступных 4-замещенных циклогексанонов) и затратность (значительный расход реактивов и растворителей: 1,4-диоксан, уксусная кислота, соляная кислота, ацетат аммония, глюкоза). 4-R-циклогексаноны авторы использовали в реакции с тетрацианоэтиленом в присутствии катализатора и затем полученные 1-(5-R-2-оксоциклогексил)этан-1,1,2,2-тетракарбонитрилы нагревали в уксусной кислоте в присутствии ацетата аммония и глюкозы, роль которой в реакциях полностью не изучена.
Наиболее близким аналогом или прототипом настоящего изобретения является получение 3-ацил-4-циано-5-(дицианометилен)-2-гидрокси-2,5-дигидро-1Н-пиррол-2-карбоксилатов. (Давыдова В.В., Марьясов М.А., Шевердов В.П., Еремкин А.В., Казанцева М.И., Насакин О.Е. Вестник ПГФА, 2016, 18, с. 84-86)
При проведении реакции в качестве растворителя используется бензол для получения водорастворимых пирролов и возможности их выделения. Метил 3-ацил-4-циано-5-(дицианометилен)-2-гидрокси-2,5-дигидро-1Н-пиррол-2-карбоксилаты при этом образуются при комнатной температуре в течении 24-36 ч с выходами 70-90%.
Недостатком данного метода является осложнение реакции процессами образования побочных продуктов, что требует дополнительной операции очистки методом перекристаллизации. Задачей данного изобретения является разработка препаративного способа получения функционально замещенных дицианометилендигидропирролов с более высокими выходами.
Техническим результатом заявляемого изобретения является получение метил 3-ацил-4-циано-5-(дицианометилен)-2-гидрокси-2,5-дигидро-1Н-пиррол-2-карбокслитов общей формулы А в одну стадию без последующей очистки перекристаллизацией.
Технический результат достигается тем, что метил 3-ацил-4-циано-5-(дицианометилен)-2-гидрокси-2,5-дигидро-1H-пиррол-2-карбоксилатов общей формулы (А)
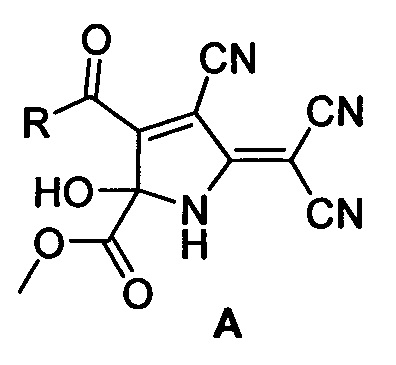
где R=2-фурил (А1), 2-тиофенил (А2), 3,4-(МеО)2-С6Н3 (A3), 3-NO2-C6H4 (А4), 4-Br-С6Н4 (А5), стирил (А6) получают путем добавления к суспензии тетрацианоэтилена в смеси бензол - диэтиловый эфир (4:1) метил 2,4-диоксо-4-R-бутаноата, перемешивания при комнатной температуре до полного растворения, выдерживания при температуре 0-5°С 30-40 ч., отфильтровывания осадка и промывания его охлажденным диэтиловым эфиром.
Сопоставительный анализ заявляемого решения с известными показывает, что способы получения метил 3-ацил-4-циано-5-(дицианометилен)-2-гидрокси-2,5-дигидро-1H-пиррол-2-карбоксилатов общей формулы (А)
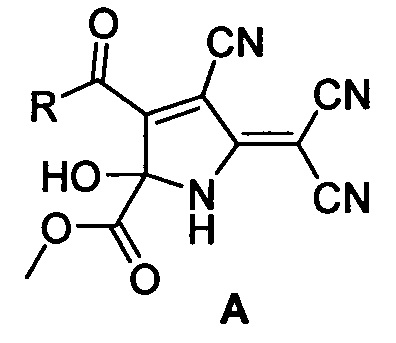
где R=2-фурил (А1), 2-тиофенил (А2), 3,4-(МеО)2-С6Н3 (A3), 3-NO2-C6H4 (А4), 4-Br-С6Н4 (А5), стирил (А6) по приведенной методике при температуре 0-5°C с использованием в качестве среды смеси бензол - диэтиловый эфир в литературе не описаны. Использование в качестве среды для суспензии смеси бензол-диэтиловый эфир (4:1) позволяет проводить процесс в одну стадию без последующей очистки перекристаллизацией, что приводит к увеличению выходов конечных продуктов на 3-14% по сравнению с прототипом, а также к уменьшению расхода растворителя. Важно отметить, что в заявляемом способе используются дешевые и доступные реагенты, способ является более экономичным, характеризуется простотой исполнения, отсутствием специальных требований.
В сравнении с известными методами синтеза в заявляемом способе метил 3-ацил-4-циано-5-(дицианометилен)-2-гидрокси-2,5-дигидро-1H-пиррол-2-карбоксилаты образуются без использования катализаторов. Продукты реакции выделяются без использования дополнительных операций (экстрагирование, разбавление, высаживание) и нет необходимости в их очистке хроматографированием и (или) перекристаллизацией.
Способ осуществляется по следующей схеме реакции:

где R=2-фурил (А1), 2-тиофенил (А2), 3,4-(МеО)2-С6Н3 (A3), 3-NO2-C6H4 (А4), 4-Br-C6H4 (А5), стирил (А6).
Структуры соединений А1-6 определены методами ЯМР 1Н, ЯМР 13С, ИК-, масс - спектроскопии и рентгеноструктурного анализа для A1 (Cambridge Crystallographic Data Center, CCDC 1506201)
Способ получения метил 3-ацил-4-циано-5-(дицианометилен)-2-гидрокси-2,5-дигидро-1H-пиррол-2-карбоксилатов общей формулы (А) осуществляют следующим образом: к суспензии 4 ммоль тетрацианоэтилена (510 мг) в 20 мл смеси бензол - диэтиловый эфир (4:1) добавляют 3 ммоль соответствующего метил 2,4-диоксо-4-R-бутаноата, при этом реакционная смесь темнеет, и перемешивают при комнатной температуре до полного растворения. Смесь охлаждают и выдерживают при температуре 0-5°С. Через 30-40 ч (контроль методом тонкослойной хроматографии) осадок отфильтровывают, промывают 10 мл охлажденного диэтилового эфира.
Пример 1. Способ получения метил 4-циано-5-(дицианометилен)-3-(фуран-2-карбонил)-2-гидрокси-2,5-дигидро-1H-пиррол-2-карбоксилата (А1). Получали аналогично описанному способу с использованием метил 4-(фуран-2-ил)-2,4-диоксобутаноата (1а). Выход 680 мг (75%). Желтые кристаллы, т. пл. 152°С. ИК спектр, ν, см-1: 3441 (О-Н), 3266 (N-H), 2227 (C≡N), 1759, 1637 (С=O), 1618, 1584 (С=С). Спектр ЯМР 1Н (500 МГц, ДМСО-d6), δ, м.д. (J, Гц): 11.45 (1H, с,, NH), 8.32 (1H, с, ОН), 7.96 (1H, д, J=3.4, C4H3O), 7.36 (1Н, с, C4H3O), 6.95-6.94 (1Н, м, С4Н3О); 3.88 (3Н, с, ОСН3). Спектр ЯМР 13С (125 МГц, ДМСО-d6), δ, м.д. (J, Гц): 172.4, 165.3, 162.4, 161.4, 152.5, 150.2, 128.7, 127.0, 114.6, 114.0, 112.7, 111.3, 110.0, 94.3, 54.2. Масс-спектр, m/z (Iотн, %): 308 [M-NH2]+ (0.2), 95 (100). Найдено, %: С 55.63; Н 2.34; N 17.39. C15H8N4O5. Вычислено, %: С 55.56; Н 2.49; N 17.28.
Пример 2. Способ получения метил 4-циано-5-(дицианометилен)-2-гидрокси-3-(тиофен-2-карбонил)-2,5-дигидро-1H-пиррол-2-карбоксилата (А2). Получали аналогично описанному способу с использованием метил 2,4-диоксо-4-(тиофен-2-ил)бутаноата (1b). Выход 981 мг (96%). Светло-коричневые кристаллы, т. пл. 107°С. ИК спектр, ν, см-1: 3443 (О-Н), 3259 (N-H), 2223 (C≡N), 1731, 1673 (С=O), 1616, 1549 (С=С). Спектр ЯМР 1Н (400.13 МГц, ДМСО-d6), δ, м.д. (J, Гц): 11.27 (1Н, с, NH), 7.62-7.60 (1Н, д, J=3.8,), 7.51-7.49 (1Н, д, J=3.3, C4H3S), 7.07-7.05 (1Н, м, C4H3S), 3.80 (3Н, с, ОСН3). Спектр ЯМР 13С (100.67 МГц, ДМСО-d6), δ, м.д. (J, Гц): 179.8, 174.5, 168.4, 158.1, 140.4, 139.0, 128.4, 127.9, 114.9, 114.3, 113.9, 113.6, 94.6, 53.2. Масс-спектр, m/z (Iотн, %): 341 [М+Н]+ (0.4), 61 (100). Найдено, %: С 52.97; Н 2.32; N 16.51. C15H8N4O4S. Вычислено, %: С 52.94; Н 2.37; N 16.46.
Пример 3. Способ получения метил 4-циано-5-(дицианометилен)-3-(3,4-диметоксибензоил)-гидрокси-2,5-дигидро-1H-пиррол-2-карбоксилата (A3). Получали аналогично описанному способу с использованием метил 4-(3,4-диметоксифенил)-2,4-диоксобутаноата (3с). Выход 920 мг (78%). Оранжевые кристаллы, т. пл. 186°С. ИК спектр, ν, см-1: 3441 (О-Н), 3264 (N-H), 2220 (C≡N), 1745, 1647 (С=O), 1619, 1586 (С=С). Спектр ЯМР 1Н (400.13 МГц, ДМСО-d6), δ, м.д. (J, Гц): 11.44 (1H, с, NH), 7.72 (1Н, д.д. 3J/HH=8.64, 4JHH=1.96, 6-Ph), 7.46 (1Н, д, 4JHH=1.96, 2-Ph), 7.19 (1H, д, 3JHH=8.64, 5-Ph), 3.93 (3Н, с, ОСН3), 3.86 (3Н, с, ОСН3), 3.74 (3Н, с, ОСН3). Спектр ЯМР 13С (100.67 МГц, ДМСО-d6), δ, м.д. (J, Гц): 185.1, 165.5, 164.6, 161.7, 156.2, 149.8, 127.6, 127.4, 114.3, 114.2, 110.6, 110.2, 110.1, 100.0, 94.6, 56.7, 56.3, 54.2, 50.5. Масс-спектр, m/z (Iотн, %): 394 [М]+ (3.5), 395 [М+Н]+ (1.3), 165 (100). Найдено, %: С 57.95; Н 3.42; N 14.32. C19H14N4O6. Вычислено, %: С 57.87; Н 3.58; N 14.21.
Пример 4. Способ получения метил 4-циано-5(дицианометилен)-2-гидрокси-3-(3-нитробензоил)-2,5-дигидро-1H-пиррол-2-карбоксилата (А4). Получали аналогично описанному способу с использованием метил 4-(3-нитрофенил)-2,4-диоксобутаноата (1d). Выход 1108 мг (90%), светло-коричневые кристаллы, т. пл. 98°С. ИК спектр, ν, см-1: 3445(O-Н), 3258 (N-H), 2227 (C≡N), 1740, 1671 (С=O), 1616, 1557 (С=С). Спектр ЯМР 1Н (400.13 МГц, ДМСО-d6), δ, м.д. (J, Гц): 9.61 (1Н, с, NH), 8.86-8.85 (1Н, м, C6H4), 8.65-8.49 (2Н, м, C6H4), 8.60 (1Н, с, ОН), 7.89-7.82 (1H, м, C6H4), 3.48 (3Н, с, ОСН3). Спектр ЯМР 13С (100.67 МГц, ДМСО-d6), δ, м.д. (J, Гц): 188.7, 159.8, 159.2, 148.9, 143.9, 137.6, 135.5, 131.0, 129.2, 125.8, 123.2, 123.0, 116.5, 113.0, 108.3, 53.7, 48.9. Масс-спектр, m/z (Iотн, %): 379 [М]+ (1.1), 150 (100). Найдено, %: С 53.96; Н 2.27; N 18.61. C17H9N5O6. Вычислено, %: С 53.83; Н 2.39; N 18.46.
Пример 5. Способ получения метил 3-(4-бромбензоил)-4-циано-5-(дицианометилен)-2-гидрокси-2,5-дигидро-1H-пиррол-2-карбоксилата (А5). Получали аналогично описанному способу с использованием метил 4-(4-бромфенил)-2,4-диоксобутаноата (1е). Выход 1170 мг (95%). Коричневые кристаллы, т. пл. 117°С. ИК спектр, ν, см-1: 3442 (О-Н), 3267 (N-H), 2222 (C≡N), 1742, 1659 (С=O), 1618, 1586 (С=С). Спектр ЯМР 1Н (400.13 МГц, ДМСО-d6), δ, м.д. (J, Гц): 11.07 (1Н, с, NH), 7.54-7.52 (2, д, J=8.4, C6H4), 7.31-7.29 (2Н, д, J=8.4, C6H4), 3.53 (3Н, с, ОСН3). Спектр ЯМР 13С (100.67 МГц, ДМСО-d6), δ, м.д. (J, Гц): 175.1, 168.4, 160.6, 136.4, 132.3, 131.1, 129.0, 128.8, 122.2, 115.0, 113.6, 111.0, 107.9, 95.4, 92.1, 53.2, 47.7. Масс-спектр, m/z (Iотн, %): 396 [М-ОН]+ (1.0), 413 [М]+ (0.1), 414 [М+Н]+ (0.5), 183 (100). Найдено, %: С 49.55; Н 2.11; N 13.63. C17H9BrN4O4. Вычислено, %: С 49.42; Н 2.20; N 13.56.
Пример 6. Способ получения метил 3-циннамоил-4-циано-5-(дицианометилен)-2-гидрокси-2,5-дигидро-1H-пиррол-2-карбоксилата (А6). Получали аналогично описанному способу с использованием метил 2,4-диоксо-4-стирилбутаноата (1f). Выход 915 мг (85%). Коричневые кристаллы, т. пл. 136°С. ИК спектр, ν, см-1: 3443 (О-Н), 3260 (N-H), 2221 (C≡N), 1727, 1647 (С=O), 1615, 1578 (С=С Спектр ЯМР 1Н (400.13 МГц, ДМСО-d6), δ, м.д. (J, Гц): 9.78 (1H, с, NH), 9.13 (1Н, с, ОН), 7.76-7.74 (2Н, д, J=4.8, 2,6-С6Н5), 7.70-7.66 (1H, д, J=16.0, СН), 7.52-7.44 (3Н, м, 3,4,5-С6Н5), 7.12-7.08 (1Н, д, J=16.0, СН), 3.67 (3Н, с, ОСН3). Спектр ЯМР 13С (100.67 МГц, ДМСО-d6), δ, м.д. (J, Гц): 186.7, 168.6, 166.9, 162.8, 154.1, 147.6, 134.2, 133.0, 132.1, 129.7, 129.4, 128. 8, 124.9, 114.7, 113.2, 113.1, 86.3, 53.4, 51.5. Масс-спектр, m/z (Iотн, %): 360 [М]+ (0.5), 131 (100). Найдено, %: С 63.54; Н 3.18; N 15.69. C19H12N4O4. Вычислено, %: С 63.33; Н 3.36; N 15.55.
Таким образом, как уже указывалось выше, заявляемый способ позволяет получить растворимые в воде и в полярных органических растворителях метил 3-ацил-4-циано-5-(дицианометилен)-2-гидрокси-2,5-дигидро-1H-пиррол-2-карбоксилаты общей формулы (А) без использования катализаторов. При этом продукты реакции выделяются без использования дополнительных операций (экстрагирование, разбавление, высаживание) и нет необходимости в очистке продуктов хроматографированием и (или) перекристаллизацией. Получаемые соединения могут быть использованы в качестве биологически активных соединений, оптических материалов и в качестве реагентов для органического синтеза.
Изобретение относится к способу получения метил 3-ацил-4-циано-5-(дицианометилен)-2-гидрокси-2,5-дигидро-1H-пиррол-2-карбоксилатов общей формулы (А)

где R=2-фурил (А1), 2-тиофенил (А2), 3,4-(МеО)2-С6Н3 (A3), 3-NO2-C6H4 (А4), 4-Br-С6Н4 (А5), стирил (А6). Способ включает добавление к суспензии тетрацианоэтилена в смеси бензол - диэтиловый эфир (4:1) метил 2,4-диоксо-4-R-бутаноата, перемешивание при комнатной температуре до полного растворения, выдерживание при температуре 0-5°С 30-40 ч, отфильтровывание осадка и промывание его охлажденным диэтиловым эфиром. Изобретение позволяет упростить способ получения соединений общей формулы (А). 6 пр.
Способ получения метил 3-ацил-4-циано-5-(дицианометилен)-2-гидрокси-2,5-дигидро-1H-пиррол-2-карбоксилатов общей формулы (А)
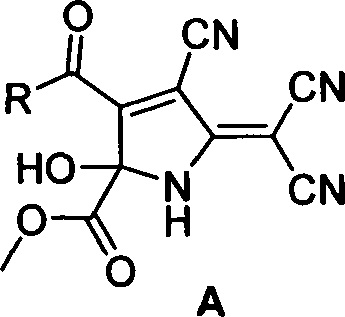
где R=2-фурил (А1), 2-тиофенил (А2), 3,4-(МеО)2-С6Н3 (A3), 3-NO2-C6H4 (А4), 4-Br-С6Н4 (А5), стирил (А6), включающий добавление к суспензии тетрацианоэтилена в смеси бензол - диэтиловый эфир (4:1) метил 2,4-диоксо-4-R-бутаноата, перемешивание при комнатной температуре до полного растворения, выдерживание при температуре 0-5°С 30-40 ч, отфильтровывание осадка и промывание его охлажденным диэтиловым эфиром.
Авторы
Даты
2019-09-24—Публикация
2018-03-07—Подача