Изобретение относится к области медицины и касается композиций, которые могут быть выполнены в том числе в виде биологически активных добавок, обладающих свойствами антиоксидантов и стимуляторов восстановления антиоксидантных систем различных клеток организма человека, в том числе клеток жировой ткани и предназначены для коррекции дисфункции жировой ткани и др. органов при различных типах окислительного стресса, включая ожирение и диабет 2 типа (далее - Д2Т).
Изобретение заключается в том, что для профилактики и коррекции окислительного стресса и дисфункции клеток жировой ткани предлагается комплексный состав, компоненты которого обладают синергичным действием на различные метаболические и сигнальные системы, включая активацию генома и активацию антиоксидантных систем или подавление прооксидантных систем и коррекцию дисрегуляции систем реакций липидного обмена адипоцитов белой жировой ткани, а также клеток других тканей и органов.
Состав для профилактики и лечения окислительного стресса различных тканей и для лечения дисфункции жировой ткани содержит: коэнзим Q10, дигидрокверцитин и альфа-липоевую кислоту, а также может содержать никотинамид.
Композиция антиоксидантного состава, направленного на подавление окислительного стресса при диабете 2 типа, содержащая в расчете на 1 дозу:
коэнзим Q10 - 50-120 мг; дигидрокверцитин - 30-160 мг; А-липоевую кислоту 30-60 мг. А также композиция антиоксидантного состава, направленного на подавление окислительного стресса при Д2Т, содержащая в расчете на 1 дозу:
коэнзим Q10 - 50-100 мг; дигидрокверцитин - 50-100 мг; А-липоевую кислоту - 30-60 мг;
никотинамид - 50-100 мг.
Изобретение обеспечивает расширение арсенала средств с антиоксидантной активностью, а также средств, препятствующих развитию дисфункции жировой ткани.
Д2Т считается пандемией 21 века [1]. По данным ВОЗ число пациентов с избыточным весом ожирением метаболическим синдромом (MS) и Д2Т в развитых странах превышает 50%. Эта цифра удвоилась за последние 20 лет. Среди подростков и детей число пациентов с MS и Д2Т превышает 18%, а среди взрослого населения 24-26% [1-3]. Число пациентов с Д2Т в России превышает 15 млн человек, в т.ч. более 4 млн пациентов в подростковом и детском возрасте.
Д2Т является хроническим метаболическим нарушением обменных процессов в организме, вызываемым главным образом избыточным потреблением высококалорийной пищи в сочетании с малоподвижным образом жизни. Д2Т характеризуется вначале избыточностью и на поздних стадиях недостаточностью секреторной функции поджелудочной железы и (или) неэффективным действием инсулина (Ins), как активатора и основного регулятора потребления глюкозы инсулин-зависимыми тканями и органами. Такое состояние называется инсулиновой резистентностью. Д2Т характеризуется хронической гипергликемией, дислепидэмией и нарушениями в обмене углеводов, липидов и белков в различных тканях [2-4]. Ключевым токсином при Д2Т считаются длинноцепочечные жирные кислоты (LCFA), поступающие с высококалорийной пищей или вновь образующиеся при избытке углеводов.
Многие исследователи полагают [4-8], что в патогенезе этого многофакторного заболевания центральную роль играет окислительный стресс, вызванный избытком циркулирующих в крови токсинов - LCFA и глюкозы.
Считается, что окислительный стресс приводит к дисфункции различных органов и тканей. Последовательное развитие ожирения в MS и далее может приводить к возникновению:
- сердечно-сосудистых заболеваний и дисфункции эндотелия - 20-30%;
- опухолевых заболеваний - 10%;
- дисфункции печени (неалкогольный стеатогепатит) или поджелудочной железы (стеатоз и острый панкреатит) и развитию Д2Т с последующим развитием цирроза печени и (или) хронического панкреатита - 60-70%.
Срок жизни пациентов не превышает 20-25 лет с момента возникновения MS [2,4].
В последнее время, наряду с дисфункцией сосудистой системы, печени и поджелудочной железы рассматривают также дисфункцию жировой ткани. Вводится термин «больной жир», поскольку дисфункция жировой ткани несет в себе большой патогенный потенциал [2]. Только в последние годы стало ясно, что белая жировая ткань является важнейшим эндокринным и иммунным органом в организме, продуцирующим десятки полезных адипокинов. В условиях ожирения, MS и последующего развития Д2Т, - образование и гибель гипертрофированных адипоцитов приводят к активации макрофагов и трансформации WAT из полезного органа в орган, продуцирующий провоспалительные цитокины, такие как: фактор некроза опухолей (TNFa), интерлейкины 1,6 и др. В таких условиях из активного буферного органа, способного запасать токсичные LCFA в виде нейтральных триглицеридов (в сытом состоянии) и выделять LCFA в кровь в условиях голода и органа продуцента полезных адипокинов WAT превращается в орган, неспособный эффективно запасать и окислять LCFA, продуцирующий провоспалительные цитокины.
Масса жировой ткани у здорового человека может составить 15-18 кг, а у больных с ожирением, MS и Д2Т до 30-50 кг и более, что в условиях дисфункции WAT и гибели гипертрофированных клеток представляет серьезную опасность для всего организма [2].
Развитие окислительного стресса и стресса эндоплазматического ретикулума в WAT, печени, поджелудочной железе характеризуется подавлением активности антиоксидантных систем: метаболических путей синтеза NADPH и восстановленного глутатиона(GSH), а также реакций нейтрализации активных форм кислорода (АФК), H2O2 и др., включая супероксиддисмутазу (SOD), каталазу (CAT), глутатионпероксидазу (GSHPx) и др. и увеличением активностей прооксидантных систем с участием NADPH оксидазы (NOX) и реакций обмена арахидоновой кислоты, включая цитоплазматическую фосфолипазу (PLA2), липоксигеназы (LO 5,12) и др. [7,9-11].
В значительной степени такие метаболические перестройки могут быть связаны с активацией ядерных Ca-зависимых факторов (включая NFAT и NFkb), имеющих место в присутствии повышенного уровня Ca++ в цитоплазме разных клеток у больных с MS и Д2Т [12].
В настоящее время неизвестно, что может быть первичным фактором в цепочке событий - ожирение → MS → Д2Т: дисфункция печени (неалкогольный стеатогепатит), дисфункция и жировое перерождение поджелудочной железы (острый стеатопанкреатит) или гипертрофия и дисфункция WAT.
По нашему мнению в большинстве случаев первичной причиной развития MS и Д2Т является дисфункция WAT, приводящая к неспособности WAT эффективно убирать токсичные LCFA и глюкозу и к ее трансформации в орган, продуцирующий провоспалительные цитокины, вызывающие, при совместном действии с LCFA, неспецифический окислительный стресс в организме.
Антиоксиданты широко используются как возможные средства коррекции MS и Д2Т.
Антиоксиданты - молекулы или вещества, способные замедлить или предотвратить окисление других молекул. В свою очередь, окисление представляет собой перенос электронов от окисленного вещества к окислителю, в реакциях сопряженных с продукцией свободных радикалов, активных форм кислорода (АФК), перекисей (H2O2) и др., которые в свою очередь включают цепочки реакций, приводящих к повреждениям различных систем клеток.
Развивающийся неспецифический окислительный стресс является побочным продуктом ряда естественных физических и физиологических процессов, таких как интенсивные физические упражнения, физический и эмоциональный стресс, химиотерапия, лекарственное отравление, действие загрязняющих и токсичных веществ, радиация и др. Окислительный стресс также рассматривается, как один из факторов старения, при котором также имеет место выраженное угасание аэробного (митохондриального) энергетического обмена клеток различных типов.
Развивающийся неспецифический окислительный стресс контролируется с участием антиоксидантных систем (перечисленных выше) и дисфункция этой защиты или истощение антиоксидантных систем приводит к повреждениям ДНК и РНК, к нежелательным окислениям аминокислотных остатков белков и липидов и последующему апоптозу клеток.
Большинство хорошо известных и распространенных заболеваний, включая опухолевые заболевания, печеночные энцефалопатии, нейродегенеративные заболевания и др. наряду с MS и Д2Т также характеризуются наличием окислительного стресса, сопряженного с активацией известного набора прооксидантных маркеров, перечисленных выше [13, 14].
При MS и Д2Т окислительный стресс, связанный с токсическим действием LCFA и провоспалительных цитокинов (TNFa, IL1,6 и др.) носит глобальный характер и затрагивает практически все эндокринные органы (печень, поджелудочную железу, WAT) и эндотелиальные клетки сосудов [3, 14]. Имеет место процесс, сопряженный также со стрессом эндоплазматического ретикулума и возможным нитрозативным стрессом.
Развитие нитрозативного стресса в свою очередь связано с активацией индуцибельной NO синтезы (iNOS) провоспалительными цитокинами и с подавлением активности цепочки NO → cGMP → PKG, активность которой по нашему мнению играет важную роль, как в поддержании Ca2+ гомеостаза клеток, так и индукции антиоксидантных систем.
Недооценивается также роль Са2+в развитии окислительного стресса и в развитии дисфункции WAT и других органов при Д2Т, хотя хорошо известны запатентованные методы коррекции дислепидэмии и инсулиновой резистентности с использованием последовательного применения гипер и гипо кальциевых диет [15, 16].
Попытки использования антиоксидантов в лечении Д2Т предпринимаются в течение многих лет и включают применение: витаминов C и E, коэнзима Q10, А-липоевой кислоты, рибокситаурина, дигидрокверцитина, ω3-полиненасыщенных жирных кислот, а также вытяжек из натуральных продуктов, содержащих антиоксиданты, включая: бананы, горькую тыкву, черный чеснок, и комбинаций различных трав [17-24].
Мета-анализ клинического применения различных антиоксидантов при лечении Д2Т, проведенный в последнее время, показал, что нет выраженного преимущества применения антиоксидантов в сравнении с известными фармакологическими препаратами [25].
В то же время ряд веществ, перечисленных выше, не является антиоксидантами прямого действия, и их действие может быть опосредовано индукцией синтеза ферментов различных метаболических и сигнальных систем. Это в первую очередь относится: к коэнзиму Q10 [20] - одному из ключевых элементов дыхательной цепи митохондрий и индуктору митохондриогенеза; к А-липоевой кислоте - одному из ключевых кофакторов, участвующих в переносе ацильных групп митохондриальными NADH зависимыми дигидрогеназами. Более того, в последнее время стало ясно, что А-липоевая кислота не только является индуктором митохондриогенеза, но оказывает активирующее действие на активацию синтеза de novo киназы G (PKG) [26, 27].
В свою очередь PKG и сигнальный путь NO - cGMP - PKG играют важное значение в регуляции Ca2+ гомеостаза клеток разных типов и липогенеза жировой ткани. В последнее время также стало ясно, что активация PKG через атрионатрийуретический пептид предсердия (ANP) также играет важную роль в регуляции липолиза WAT. В ряде научных исследований активация этого пути рассматривается, как один из возможных вариантов коррекции Д2Т.
Ранее было показано, что LCFA и их активированные производные (AcylCoA), активируя Ca2+ каналы эндоплазматического ретикулума (IP3 и рианодинзависимые депо), приводят к росту Ca2+ в цитоплазме с возникновением неспецифической Na+ проводимости плазмалеммы и гибели клеток, не по типу апоптоза а по типу некроза [28].
Как показали наши исследования этот же механизм активации ретикулярных депо в хроническом варианте приводит к: гипертрофии адипоцитов (за счет активации Ca2+ зависимых ядерных факторов NFAT и NFkb); активации каскада фосфолипаз; развития окислительного стресса и гибели адипоцитов. Активация макрофагов, элиминирующих гибнущие адипоциты, в свою очередь приводит к продукции провоспалительных цитокинов WAT (TNFa, IL1,6 и ангиотензина II (ANGII)), к дальнейшему развитию окислительного стресса, вследствие активации каскадов реакций с участием фосфолипаз (в первую очередь PLA2). Наряду с цитокинами, продуцируемыми адипоцитами в этих условиях, ANGII, обеспечивает вход Ca2+ в клетки, что ведет к еще большей активации каскадов реакций с участием фосфолипаз и как следствие приводит к дисрегуляции ключевого сигнального пути: eNOS - NO - sGC - cGMP - PKG - CD38 - RyR - Ca2+ играющего важную роль в поддержании Ca2+ гомеостаза клеток.
Таким образом, при ожирении, MS и Д2Т избыток LCFA, обеспечивая рост Cai в цитоплазме клеток, приводит к образованию порочного круга активации Ca++ зависимых процессов (в первую очередь с участием фосфолипаз PLC, PLD и KPLA2), вызывающих через включение ряда каскадных реакций (активация NADHоксидазы и лироксигеназ LO5,12)развитие окислительного стресса [3, 14, 28, 29].
В отличие от предполагавшихся ранее различными авторами схем применения антиоксидантов нами предложено комбинированное использование коэнзима Q10, А-липоевой кислоты, дигидрокверцитина и никотинамида (витамина PP). Такое сочетание как, оказалось, обладает синергичным действием, направленным на индукцию митохондриогенеза, на коррекцию дисфункции Ca-сигнального пути с участием PKG и RyR, на снижение активностей пероксидазных систем, на активацию липолиза и устранение дисфункции WAT.
Представленные ниже примеры иллюстрируют эти положения.
Пример 1
В таблице 1 представлены данные о генерации активных форм кислорода (АФК) культурами адипоцитов WAT мышей 9 DIV, выделенных из преадипоцитов эпидидимальных депо здоровых животных (4-6 недель). Представлены данные о приросте АФК за 30 минут при росте клеток на глюкозе (10 мМ), на глюкозе и пальмитоилкарнитине (PC 3 мкМ), а также при наличии в среде культивирования клеток протектора S1, содержащего А-липоевую кислоту (100 мкМ), а также Q10 (200 мкМ) и дигидрокверцитина (100 мкМ), растворенные в DMSO.
Видно, что рост клеток в присутствии активированных производных LCFA (3 мкМ PC) приводит к увеличению накопления АФК. При введении в среду инкубации клеток 30 мМ PC имеет место практически двукратное увеличение прироста АФК, как клетками, растущими на глюкозе, так и клетками, растущими в присутствии 3 мкМ PC. В этом случае имеют место выраженное различие в продукции АФК, между клетками, растущими в отсутствии и при наличии антиоксидантной композиции S1, что свидетельствует о протекторных свойствах заявленной композиции.
Этот вывод подтверждают данные об антиокдантной активности состава S1 в экспериментах, выполненных на культурах адипоцитов, выращенных из преадипоцитов полученных из животных с Д2Т (таблица 2). Из этой таблицы видно, что при всех условиях прирост АФК в этих культурах выше, чем в предыдущем случае. Однако, культивирование клеток с S1 также приводит к почти двукратному снижению прироста АФК в присутствии 15 мкМ PC.
Использование больших концентраций PC 30 мМ как в среде с культурами адипоцитов, выделенных из клеток здоровых животных, приводит к быстрой гибели клеток по типу некроза, описанному выше. В экспериментах использовались животные (мыши), у которых Д2Т вызывался введением в рацион питания свиного хребтового жира (с известным составом LCFA) из расчета 300-500 мг /30-50 г массы животного в течение 8-12 месяцев В экспериментах использовались клетки WAT эпидидимальных депо из животных с показателями глюкозы 10-13 мМ и Ins 2-4 мг/л после 12 часов голодания.
Пример 2
В этом эксперименте животным вводили состав S2, содержащий: коэнзим Q10, А-липоевую кислоту, дигидрокверцитин и никотинамид, растворенные в дегидрогенизированном соевом масле из расчета 20 мг/кг, 10 мг/кг, 15 мг/кг и 15 мг/кг соответственно. Состав вводили pper os пипеткой в течение четырех недель. В таблице 3 приведены сравнительные данные о приросте АФК, продуцируемых суспензиями зрелых адипоцитов, выделенных из здоровых животных и животных с Д2Т в отсутствие и при наличии 15 мкМ PC в среде инкубации клеток. В этом случае также видно выраженное антиоксидантное действие состава S2, приводящее к подавлению продукции АФК с 20,3±3,1 до 13,2±2,4 условных единиц (таблица 2).
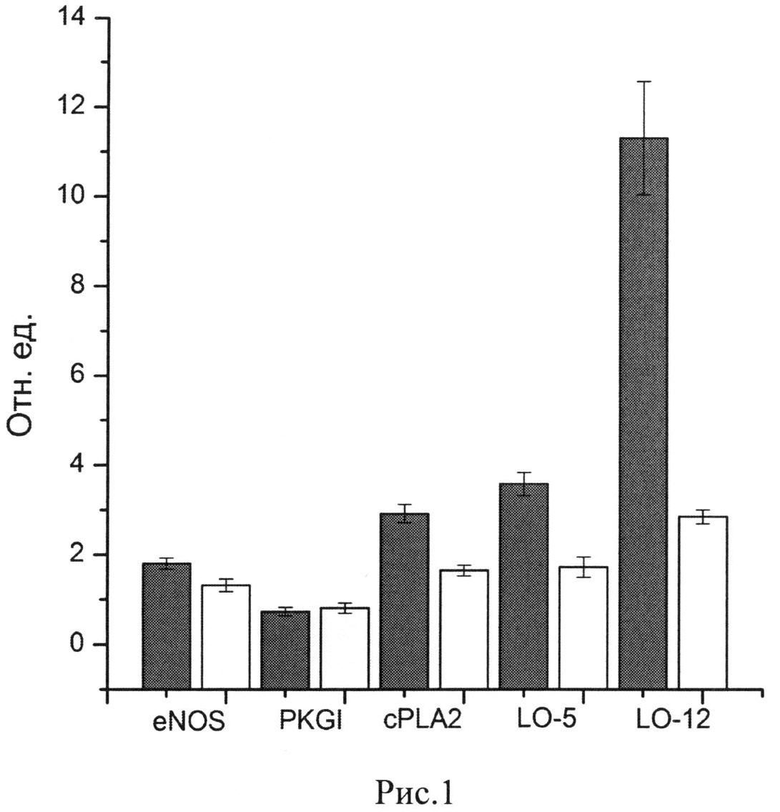
На рис. 1 представлены данные иммуноблотинга об экспрессии ключевых белков (ферментов) - маркеров различных метаболических и сигнальных путей адипоцитов (eNOS, PKGI, cPLA2 и LO-5,12) которые позволяют судить об активностях этих сигнальных путей у здоровых животных и у животных с Д2Т, получавших или не получавших протектор S2. Видно, что животные с Д2Т характеризуются увеличенным содержанием (экспрессией) eNOS, cPLA2 и LO-5 и уменьшением экспрессии (активности) PKG, что может свидетельствовать о дисфункции сигнального пути eNOS-NO-cGMP-PKG и об активации прооксидантных путей с участием фосфолипаз (cPLA2) и образования лейкотриенов (LO-5,12) ведущих к истощению NADPH и GSH. Из этих данных видно, что скармливание животным протекторного состава S2 приводит к снижению экспрессии eNOS, увеличению количества PKG и к снижению экспрессии белков прооксидантных систем с PLA2 и LO-5,12.
Высокое содержание eNOS у мышей с Д2Т не отражает высокую активность этого фермента, а, по-видимому, является компенсаторной реакцией на снижение концентрации NADPH (субстрата eNOS) у животных с Д2Т, в условиях развития окислительного стресса.
Таким образом, данные, представленные в таблице 2 и на рис. 1, свидетельствуют о том, что антиоксидантный состав S2, так же как состав S1, подавляет продукцию АФК, обеспечивает подавление индукции прооксидантных путей и обеспечивает устранение дисрегуляции сигнального пути с участием PKG.
Рис.1. Сравнительные данные о ферментах-маркерах сигнальных путей здоровых мышей и мышей с Д2Т, получавших (белые столбики) и не получавших (черные столбики) антиоксидантный состав S2. Данные для здоровых животных взяты за 1. Приведены данные экспрессии белков (иммуноблотинг) eNOS, PKGI,.cPLA2 и LO-5,12 в относительных единицах
Сущность изобретения.
Объектом изобретения являются комплексные составы, обладающие как прямым антиоксидантным действием, так и синергичным действием на различные анти- и прооксидантные системы адипоцитов и клеток других тканей и органов и способные:
- обеспечить подавление активированных при Д2Т прооксидантных систем окисления арахидоновой кислоты и реакций продукции АФК митохондриями;
- увеличить активность сигнальных путей с участием PKG.
Прирост АФК за 30 минут. Регистрация прироста АФК () по флуоресценции Mito Sox Red. Относительные единицы. Средние данные по 30 клеткам в 5 экспериментах.
Животным вводили протектор S2 per os в течение 1 месяца. Прирост АФК за 30 минут в относительных единицах.
Литература
1. Zimmet P, Alberti KG, Shaw J., Global and societal implications of the diabetes epidemic. Nature. 2001 Dec 13; 414(6865):782-7.
2. Harold E Bays, J Michael González-Campoy, George A Bray, Abbas E Kitabchi, Donald A Bergman, Alan Bruce Schorr, Helena W Rodbard, Robert R Henry. Pathogenic potential of adipose tissue and metabolic consequences of adipocyte hypertrophy and increased visceral adiposity. Expert Review of Cardiovascular Therapy, March 2008, Vol.6, No.3, Pages 343-368.
3. American diabetes association. Diabetes information. All about diabetes. http://www.diabetes.org/about-diabetes.jsp [November 2012].
4. Bays HE. Adiposopathy, diabetes mellitus, and primary prevention of atherosclerotic coronary artery disease: treating "sick fat" through improving fat function with antidiabetes therapies. Am J Cardiol. 2012 Nov 6; 110 (9 Suppl):4B-12B. dot: 10.1016/j.amjcard.2012.08.029.
5. Cole BK, Lieb DC, Dobrian AD, Nadler JL. 12- and 15-lipoxygenases in adipose tissue inflammation. Prostaglandins Other Lipid Mediat. 2012 Aug 20.
6. Petersen KF, Dufour S, Befroy D, Lehrke M, Hendler RE, Shulman GI. Reversal of nonalcoholic hepatic steatosis, hepatic insulin resistance, and hyperglycemia by moderate weight reduction in patients with type 2 diabetes. Diabetes. 2005 Mar; 54(3):603-8.
7. Blüher M. Adipose tissue dysfunction in obesity. Exp Clin Endocrinol Diabetes. 2009 Jun; 117(6):241-50. doi: 10.1055/S-0029-1192044.
8. Capurso С, Capurso A. From excess adiposity to insulin resistance: the role of free fatty acids. Vascul Pharmacol. 2012 Sep-Oct; 57(2-4):91-7. doi: 10.1016/j.vph.2012.05.003.
9. Souhad El Akoum, Vikie Lamontagne, Isabelle Cloutier, Jean-Francois Tanguay. Nature of fatty acids in high fat diets differentially delineates obesity-linked metabolic syndrome components in male and female C57BL/6J mice. Diabetol Metab Syndr. 2011; 3: 34. Published online 2011 December 14. doi: 10.1186/1758-5996-3-34
10. Strissel KJ, Stancheva Z, Miyoshi H, Perfield JW 2nd, DeFuria J, Jick Z, Greenberg AS, Obin MS. Adipocyte death, adipose tissue remodeling, and obesity complications. Diabetes. 2007 Dec; 56(12):2910-8. Epub 2007 Sep 11.
11. Gregor MF, Hotamisligil GS. Thematic review series: Adipocyte Biology. Adipocyte stress: the endoplasmic reticulum and metabolic disease. J Lipid Res. 2007 Sep; 48(9):1905-14. Epub 2007 May 9. Review.
12. Aggarwal BB, Prasad S, Reuter S, Kannappan R, Yadev VR, Park B, Kim JH, Gupta SC, Phromnoi K, Sundaram C, Prasad S, Chaturvedi MM, Sung B. Identification of Novel Anti-inflammatory Agents from Ayurvedic Medicine for Prevention of Chronic Diseases: "Reverse Pharmacology" and "Bedside to Bench" Approach. Curr Drug Targets 12(11):1595-653, 10/2011. e-Pub 5/2011. PMCID: PMC3170500.
13. Sun GY, Horrocks LA, Farooqui AA. The roles of NADPH oxidase and phospholipases A2 in oxidative and inflammatory responses in neurodegenerative diseases. J Neurochem. 2007 Oct; 103(1): 1-16. Epub 2007 Jun 11.
14. Cole BK, Lieb DC, Dobrian AD, Nadler JL. 12- and 15-lipoxygenases in adipose tissue inflammation. Prostaglandins Other Lipid Mediat. 2012 Aug 20.
15. Xue В, Greenberg AG, Kraemer FB, Zemel MB. Mechanism of intracellular calcium ([Ca2+]i) inhibition of lipolysis in human adipocytes. FASEB J. 2001 Nov; 15(13):2527-9. Epub 2001 Sep 17.
16. Zemel MB, Sun X. Dietary calcium and dairy products modulate oxidative and inflammatory stress in mice and humans. J Nutr. 2008 Jun; 138(6): 1047-52.
17. Montonen J, Knekt P, Jarvinen R, Reunanen A. Dietary antioxidant intake and risk of type 2 diabetes. Diabetes Care. 2004 Feb; 27(2):362-6.
18. Rainsford KD. Anti-inflammatory drugs in the 21st century. Subcell Biochem. 2007; 42:3-27.
19. Shen W, Liu K, Tian C, Yang L, Li X, Ren J, Packer L, Cotman CW, Liu J. R-alpha-lipoic acid and acetyl-L-carnitine complementarily promote mitochondrial biogenesis in murine 3T3-L1 adipocytes. Diabetologia. 2008 Jan; 51(1): 165-74. Epub 2007 Nov 17.
20. Golbidi S, Badran M, Laher I. Diabetes and alpha lipoic Acid. Front Pharmacol. 2011; 2:69. doi: 10.3389/fphar.2011.00069.
21. Dewanjee S, Maiti A, Sahu R, Dua TK, Mandal V. Effective Control of Type 2 Diabetes through Antioxidant Defense by Edible Fruits of Diospyros peregrina. Evid Based Complement Altemat Med. 2011; 2011:675397. doi: 10.1093/ecam/nep080.
22. Golbidi S, Ebadi SA, Laher I. Antioxidants in the treatment of diabetes. Curr Diabetes Rev. 2011 Mar; 7(2): 106-25.
23. P.P. Singh, Farzana Mahadi, Ajanta Roy, and Praveen Sharma. Reactive oxygen species, reactive nitrogen species and antioxidants in etiopathogenesis of diabetes mellitus type-2. Indian J Clin Biochem. 2009 October; 24(4): 324-342. Published online 2009 December 30. doi: 10.1007/s12291-009-0062-6 PMCID: PMC3453064
24. Shao CH, Wehrens XH, Wyatt ТА, Parbhu S, Rozanski GJ, Patel KP, Bidasee KR. Exercise training during diabetes attenuates cardiac ryanodine receptor dysregulation. J Appl Physiol. 2009 Apr; 106(4): 1280-92. doi: 10.1152/japplphysiol.91280.2008.
25. Thompson D, Karpe F, Lafontan M, Frayn K. Physical activity and exercise in the regulation of human adipose tissue physiology. Physiol Rev. 2012 Jan; 92(1):157-91. doi: 10.1152/physrev.00012.2011.
26. Kawanishi N, Yano H, Yokogawa Y, Suzuki K. Exercise training inhibits inflammation in adipose tissue via both suppression of macrophage infiltration and acceleration of phenotypic switching from M1 to M2 macrophages in high-fat-diet-induced obese mice. Exerc Immunol Rev. 2010; 16:105-18.
27. Bird SR, Hawley JA. Exercise and type 2 diabetes: new prescription for an old problem. Maturitas. 2012 Aug; 72(4):311-6. doi: 10.1016/j.maturitas.2012.05.015.
28. A.V. Berezhnov, E.I. Fedotova, M.N. Nenov, V.P. Zinchenko, V.V. Dynnik Role of phospholipases in cytosolic calcium overload and cardiomyocytes death in the presence of activated fatty acid derivatives. Biochemistry (Moscow) Supplemental Series A: Membrane and Cell Biology, 2010; 4(1): 56-63.
29. Туровский Е.А., Туровская М.В, Толмачева А.В., Долгачева Л.П., Зинченко В.П., Дынник В.В. β-адренорецепторы как регуляторы внутриклеточного кальция в адипоцитах белого жира. Журн. «Фундаментальные исследования». 2012 (12), 74-87.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ ПРОТЕКТОРОВ ОСТРЫХ И ХРОНИЧЕСКИХ ПЕЧЕНОЧНЫХ ЭНЦЕЛОПАТИЙ И СПОСОБ ЛЕЧЕНИЯ ОСТРЫХ И ХРОНИЧЕСКИХ ПЕЧЕНОЧНЫХ ЭНЦЕЛОПАТИЙ | 2011 |
|
RU2491062C2 |
| ПРИМЕНЕНИЕ НАТРИЕВОЙ СОЛИ ДИЭТИЛОВОГО ЭФИРА 4-ОКСО-1,4-ДИГИДРОПИРАЗОЛО[5,1-С]-1,2,4-ТРИАЗИН-3,8-ДИКАРБОНОВОЙ КИСЛОТЫ, МОНОГИДРАТА В КАЧЕСТВЕ СРЕДСТВА ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ПОЗДНИХ ОСЛОЖНЕНИЙ САХАРНОГО ДИАБЕТА | 2019 |
|
RU2765117C2 |
| Применение клеток штамма Lactobacillus fermentum U-21 для предотвращения патологических изменений в тканях, вызванных оксидативным стрессом | 2019 |
|
RU2757118C2 |
| Штамм Lactobacillus fermentum U-21, продуцирующий комплекс биологически активных веществ, осуществляющих нейтрализацию супероксид-аниона, индуцируемого химическими агентами | 2018 |
|
RU2705250C2 |
| СПОСОБ КОРМЛЕНИЯ МОЛОДНЯКА СВИНЕЙ В ПЕРИОД ОТКОРМА | 2022 |
|
RU2804619C1 |
| СПОСОБ ДИАГНОСТИКИ И КОРРЕКЦИИ ЭНДОТЕЛИАЛЬНОЙ ДИСФУНКЦИИ ПРИ СОСУДИСТЫХ ОСЛОЖНЕНИЯХ АЛЛОКСАНОВОГО ДИАБЕТА В ЭКСПЕРИМЕНТЕ | 2010 |
|
RU2455702C1 |
| Способ прогнозирования задержки роста плода у пациенток с гестационным сахарным диабетом, не требующим инсулинотерапии | 2024 |
|
RU2831900C1 |
| Способ профилактики задержки внутриутробного развития (ЗВУР) и резорбции эмбрионов у лабораторных мышей | 2024 |
|
RU2833145C1 |
| Способ коррекции остеопороза и остеопоротических переломов 2-этил-6-метил-3-гидроксипиридинийгидроксибутандиоатом в эксперименте | 2021 |
|
RU2775439C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЛИТИЕВОЙ СОЛИ КОМЕНОВОЙ КИСЛОТЫ И ПРИМЕНЕНИЕ ЕЕ КАК АНТИОКСИДАНТНОГО СТРЕСС- И НЕЙРОПРОТЕКТОРНОГО СРЕДСТВА | 2011 |
|
RU2477722C1 |
Изобретение относятся к композициям антиоксидантного состава, направленного на подавление окислительного стресса при диабете 2 типа. Указанные композиции содержат в расчете на 1 дозу: 50-120 мг коэнзима Q10, 30-160 мг дигидрокверцетина и 30-60 мг А-липоевой кислоты или 50-100 мг коэнзима Q10, 50-100 мг дигидрокверцетина, 30-60 мг А-липоевой кислоты и 50-100 мг никотинамида. Заявленные композиции обладают антиоксидантной активностью и препятствуют развитию дисфункции жировой ткани. 2 н.п. ф-лы, 1 ил., 2 табл., 2 пр.
1. Композиция антиоксидантного состава, направленного на подавление окислительного стресса при диабете 2 типа, содержащая в расчете на 1 дозу: коэнзим Q10 - 50-120 мг, дигидрокверцитин - 30-160 мг, А-липоевую кислоту 30-60 мг.
2. Композиция антиоксидантного состава, направленного на подавление окислительного стресса при диабете 2 типа, содержащая в расчете на 1 дозу: коэнзим Q10 - 50-100 мг, дигидрокверцитин - 50-100 мг, А-липоевую кислоту - 30-60 мг, никотинамид - 50-100 мг.
| ФИТОКОНЦЕНТРАТ ЛЕЧЕБНО-ПРОФИЛАКТИЧЕСКОГО ДЕЙСТВИЯ ДЛЯ ЛИЦ С ЗАБОЛЕВАНИЕМ САХАРНЫМ ДИАБЕТОМ | 1997 |
|
RU2123350C1 |
| WO 2000007575 A2 17.02.2000 | |||
| US 6277842 B1 21.08.2001 | |||
| CN 101982115 A 02.03.2011 | |||
| SAEID GOLBIDI “Antioxidants in the treatment of diabetes”, Curr Diabetes Rev., 2011, 7(2), pp.106-125 | |||
Авторы
Даты
2014-12-10—Публикация
2012-12-21—Подача