Изобретение относится к фармацевтической промышленности, а именно к созданию лекарственных средств природного происхождения, обладающих гастропротекторной активностью.
Гастропротекторные препараты используются в медицине для защиты слизистой оболочки желудка и 12-перстной кишки от повреждающего действия химических и физических факторов. Применяются в основном в комплексной терапии язвенной болезни, в том числе осложненной инфицированием Helicobacter pillory. Особая востребованность этих средств связана с их защитным эффектом на фоне лечения гормональными препаратами и нестероидными противовоспалительными средствами (НПВС), на долю которых приходится до 25% всех выявленных язв желудка, а среди язв, осложненных кровотечением, - до 60% [Л. Фридман, У. Питерсон. Язвенная болезнь, гастрит и другие заболевания желудка. - Из «Внутренние болезни по Тинсли Р. Харрисону». М.: «Практика», 2005. С. 1925 - 1949; Клиническая фармакология по Гудману и Гилману - М.: «Практика», 2006. С.785].
Современные гастропротекторные средства представлены двумя основными группами: синтетическими аналогами простагландинов, повышающими секрецию слизи в желудке, и препаратами, образующими защитную пленку на поверхности слизистой оболочки. Вторая группа гастропротекторов, создающих механическую защиту слизистой оболочки, состоит из препаратов на основе солей алюминия, магния и висмута. Эти неорганические вещества, нерастворимые в воде, образуют в кислой среде невсасывающиеся комплексы с белками язвенных дефектов, что затрудняет доступ к последним хлористоводородной кислоты и ускоряет заживление язв. Среди гастропротекторов этого типа наиболее эффективны препараты солей алюминия (Сукралфат, Фосфалюгель) и висмута (Де-нол, Пилорид, Алцид).
Сукралфат (алюминиевая соль октасульфата сахарозы) - аморфный порошок, в кислой среде полимеризуется, образуя вязкий липкий гель. Фосфалюгель (фосфат алюминия с пектином и агар-агаром) применяется в виде коллоидной суспензии, которая быстро распределяется по поверхности слизистой оболочки, образуя гелеобразную пленку. Фосфалюгель не вызывает характерного для Сукралфата дефицита фосфатов в желудочно-кишечном тракте. Де-нол (висмута субцитрат) также применяется в виде суспензии, образующей в кислой среде полимерный комплекс с гликопротеинами слизистой оболочки. Особенностью препаратов висмута является их антибактериальное действие, направленное на Helicobacter pillory [Д.А. Харкевич «Фармакология». - М.: «Гэотар-Медиа», 2010. С.379-371]. Недостатком гастропротекторов на основе неорганических веществ является их побочное действие в виде запора, тошноты, рвоты, а при длительном применении они способствуют развитию остеопороза. При заболеваниях почек их токсичность возрастает за счет усиления всасывания ионов алюминия и висмута. Кроме того, на их фоне снижается всасывание и биодоступность других препаратов [Клиническая фармакология по Гудману и Гилману. - М.: «Практика», 2006. С.782].
Среди природных гастропротекторов, применяемых в терапии язвенной болезни, известен растительный препарат глицирризиновой кислоты - Карбеноксолон, получаемый из экстракта солодкового корня. Эффект препарата связан со стимуляцией секреции и усилением вязкости слизи за счет повышения в ней сиаловых кислот, а также с понижением активности пепсина [Д.А. Харкевич «Фармакология». - М.: «Гэотар-Медиа», 2010. С.381]. Однако побочные эффекты Карбеноксолона, связанные с его минералокортикоидной активностью (отеки, задержка ионов натрия, гипертензия), ограничивают его применение.
В качестве противоязвенных средств с гастрозащитной активностью описаны водорастворимые экстракты корневища аира, коры крушины, корня солодки, листьев березы [RU 2264822 C1, 27.11.2005], коры и побегов облепихи крушиновидной, корней и травы шлемника, сухого экстракта коры осины и др. растений [Крылова С.Г. Растения Сибири и Дальнего Востока в терапии язвенной болезни желудка и двенадцатиперстной кишки: экспериментальное исследование. Дисс. Докт. Биол. Наук. Томск, 2005].
Действие растительных экстрактов в целом направлено на снижение протеолитической активности и кислотности желудочного сока, стимуляцию секреции слизи и процессов, способствующих регенерации язвенного дефекта, однако эффективность их действия невысока. Поэтому задача изыскания новых природных материалов, в том числе биогенных соединений, с высокой гастропротекторной активностью, остается актуальной.
В последние годы для получения различных композиционных материалов используются полиионные полисахариды морского происхождения. Один из них - хитозан - катиоонный (1-4)-2-амино-2-деокси-β-d-глюкан, получают из панциря ракообразных [Скрябин К.Г., Вихорева Г.А., Варламов В.П. Хитин и хитозан. Получение, свойства и применение //М.: Наука. - 2002. - С.217-246]. Хитозан и его производные, проявляющие широкий спектр биологической активности, в том числе иммуностимулирующие и антибактериальными свойства, может применяться в качестве ранозаживляющих пленок [RU 2460532 C1, 10.09.2012; RU 2254145 C1, 20.06.2005], носителя для лекарственных средств [RU 2482133 C2, 20.05.2013], матрикса для размножения клеток [Them-Ham W.W., Kitiyanant Y. //J. Biomed. Mater. Res. 2007. Vol.80. №1. P. 92-101] и вектора для доставки генетического материала в клетку [Краюхина М.А. и др. //Успехи химии, 2008. Т. 77, №9. С.854-869].
На моделях язвы желудка, индуцированной этанолом, уксусной кислотой или индометацином показано, что хитозан с низкой молекулярной массой (25-50 кДа) проявляет небольшую гастропротекторную активность, которая носит дозозависимый характер (250 - 1000 мг/кг) [Ito M., Ban A., Ishihara M. Anti-ulcer effects of chitin and chitosan, healthy foods, in rats //The Japanese journal of pharmacology. - 2000. - Т. 82. - №. 3. - С.218-225; Ahmed J.H., Jala'a A., Al-Masoodi E.A. Evaluation of the gastroprotective effect of misoprostol, chitosan and their combination on indomethacin induced gastric ulcer in rats, MJBU, Vol 29, No. 1&2, 2011].
Другими перспективными компонентами гидробиоты могут считаться каррагинаны - сульфатированные полисахариды красных водорослей [M. Yermak, Yu.S. Khotimchenko, in: Recent Advances in Marine Biotechnology M Fingerman, R. Nagabhushanam (Eds.), Sci. Publ. Inc. USA-UK. 2003, P.207-255]. В зависимости от структурного типа каррагинаны проявляют ярко выраженную антивирусную, антимикробиальную, иммуномодулирующую или антикоагулирующую активность [RU 2012118600 A, 20.11.2013; Yermak I. M., Khotimchenko Yu. S. //In Recent Advances in Marine Biotechnology /Ed. by Fingerman M, Nagabhushanam R. Sci. Publ. Inc., USA-UK. 2003. Vol.3. P. 207-255; Yermak I.M., Barabanova A.O., Aminin D.L.,.Davydova B.N., Sokolova E.V., Yong Hwan Kim, Kwang Soon Shin, Solov'eva T.F. //Carbohydr. Polym. 2012. Vol.87. P. 713-720].
Показано, что каррагинан является эффективным комплексообразователем для некоторых транквилизаторов и антибиотиков [A.G. Schmidt, S. Wartewig, K.M. Picker, Eur. J. Pharm. Biopharm., 2003, 56, P. 101-110]. Полиэлектролитные комплексы (ПЭК) на основе каррагинана используются для создания систем с контролируемым высвобождением активных веществ [F.van de Velde, N.D.Lourenco, H.M. Pinheiro, M.Bakken. Adv.Synth.Catal.,2002, 334., №8, P. 815-835].
В литературе описаны ПЭК каррагинан:хитозан, полученные в виде пленок [X. L. Yan, E. Khor, L. Y. Lim. J. Biomed. Mater. Res. Part B Appl. Biomater., 58, №4, 358-365 (2001)], микрокапсул [N. Devi, T. K. Maji. J. Macromol. Sci. Part A,. 46, №11, 1114-1121 (2009)] и гелей [DE 102005050895 A1, 26.04.2007], которые в основном рассматриваются в качестве векторов доставки различных биологически активных субстанций и компонентов для пролонгированного высвобождения медицинских препаратов.
Заявителями были получены растворимые ПЭК каррагинан:хитозан путем смешивания полисахаридов при разных соотношениях исходных компонентов и показано, что растворимый комплекс каррагинан:хитозан обладает антивирусной активностью на модели вируса табачной мозаики [Володько А.В., Давыдова В.Н. «Растворимые комплексы хитозан-каррагинан» XIII Всерос. молодеж. школа-конф. по актуал. проблемам химии и биологии, МЭС ТИБОХ, Владивосток, 7-14 сент. 2010 г. С.10].
Ранее заявителями было установлено, что и каррагинан и хитозан проявляют выраженный иммунопротекторный эффект против эндотоксинов грамотрицательных бактерий. [RU 2351351 C1, Yermak I., Davidova V., Gorbach V.. et al Forming and immunological properties of some lipopolysaccharide-chitosan complexes //Biochimie. - 2006. - Т. 88. - №. 1. - С.23-30].
Приведенные данные свидетельствует о высокой перспективности морских полисахаридов как комплексообразователей с высокой биологической активностью. Однако указания на то, что ПЭК каррагинан:хитозан обладает гастропротекторным действием в доступной патентной и другой научно-технической литературе не обнаружено.
Задача изобретения - расширение арсенала природных средств, обладающих гастропротекторным действием, предотвращающих ульцерогенное воздействие на слизистую оболочку желудка путем создания на ее поверхности защитного слоя.
Задача решена применением водорастворимого полиэлектролитного комплекса каппа-каррагинан:хитозан при соотношении компонентов 1:10 в/в (весовое соотношение) в качестве средства, обладающего гастропротекторной активностью. При этом ПЭК каппа-каррагинан:хитозан в качестве полианиона содержит каппа-каррагинан с молекулярной массой 311 кДа. По своим характеристикам (молекулярной массе и степени сульфатирования) каррагинан полностью соответствует требованиям международного кодекса, предъявляемым к пищевым добавкам [Codex Alimentarius Comisson (2006) Report of the thirty-eighth session of the Codex Committee on Food Additives and Contaminants (CCFAC), The Hague, The Netherlands, 24-28 April 2006].
В качестве поликатиона в комплекс входит хитозан с молекулярной массой 115 кДа и степенью N-ацетилирования 6%. Заявляемое средство не имеет аналогов по составу среди современных гастропротекторных препаратов. Оно может применяться в качестве гастропротекторного средства для профилактики и лечения ульцерогенного поражения слизистой желудка, в том числе при длительном лечении НПВС.
Водорастворимые ПЭК каппа-каррагинан:хитозан были получены при двух весовых соотношениях 1:10 в/в и 10:1 в/в, путем смешивания водных растворов полисахаридов. Для получения ПЭК-1 каппа-каррагинан:хитозан 1:10 в/в к 50 мл раствора каппа-каррагинана C=0,1 мг/мл добавляли 50 мл раствора хитозана C=1 мг/мл. Для получения ПЭК-2 каппа-каррагинан:хитозан 10:1 в/в к 50 мл раствора хитозана C=0,1 мг/мл добавляли 50 мл раствора каппа-каррагинана C=1 мг/мл.
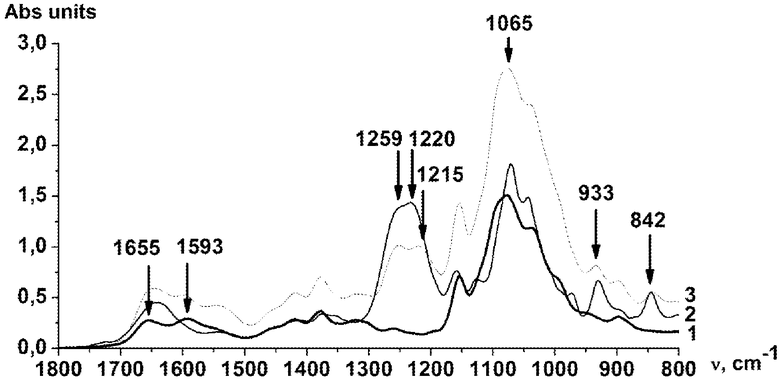
Формирование ПЭК каппа-каррагинан:хитозан регистрировали методом ИК-спектроскопии, проведя разложение спектров на индивидуальные компоненты и сравнив соотношение характерных для каррагинана полос поглощения в исходном полисахариде и его комплексе с хитозаном. Для регистрации ПЭК были использованы полосы поглощения каппа-каррагинана при 1259 см-1 (валентные колебания (SO3 -)) и при 842 см-1 (деформационные колебания (S~O~C(4)).
На фигуре представлен ИК-спектр исходных каппа-каррагинана, хитозана и их ПЭК каппа-каррагинан:хитозан.
В ИК-спектре комплекса по сравнению с ИК-спектром исходного каппа-каррагинана наблюдается уменьшение площадей интенсивности полосы поглощения сульфатных групп практически в два раза. Так в исходном каппа-каррагинане отношение площадей полос S1259 и S842 равно 4,0, а в ПЭК каппа-каррагинан:хитозан это отношение составляет 1,7, что свидетельствует о связывании сульфатных групп каппа-каррагинана с аминогруппами хитозана и образовании ими комплекса.
Технический результат, обеспечиваемый изобретением, заключается в способности водорастворимого ПЭК каппа-каррагинан:хитозан при соотношении компонентов 1:10 в/в с молекулярной массой каппа-каррагинана 311 кДа и с молекулярной массой хитозана 115 кДа и степенью N-ацетилирования 6% проявлять гастропротективное действие.
Гастропротекторные свойства растворимого ПЭК каппа-каррагинан:хитозан, ранее не описанные в литературе, были выявлены экспериментальным путем на модели язвы желудка, индуцированной индометацином. Опыты проводили в трех независимых сериях на самках крыс массой 200-220 г, в каждой группе было по 6 животных. В дополнительном эксперименте на беспородных мышах-самцах определяли способность ПЭК купировать воспалительный отек лапы, вызванный субпланарным введением гистамина. Обе модели воспроизводили в соответствии с методическими рекомендациями для проведения доклинических испытаний новых соединений [«Руководством по экспериментальному (доклиническому) изучению новых фармакологических веществ», Москва, 2005].
При оценке гастропротекторного эффекта животных на сутки лишали пищи при свободном доступе к воде. После этого всем крысам вводили в желудок субстанцию индометацина в дозе 20 мг/кг в виде взвеси в воде с твином. Через сутки после введения индометацина животных наркотизировали хлороформом, проводили вскрытие, извлекали желудки и подсчитывали под лупой количество язв и эрозий на слизистой оболочке.
Изучаемые образцы вводили внутрижелудочно в двух режимах. В первом случае каппа-каррагинан, хитозан и их комплексы вводили однократно за 1 час до введения индометацина. Во втором полисахариды вводили профилактически в течение трех дней до введения индометацина (последний раз за сутки до ульцерогенного агента). В качестве эталонного препарата использовали гастропротектор Фосфалюгель (алюминия фосфат гель, «Astellas Pharma», Нидерланды). Раствор ПЭК вводили перорально в дозе 5 мг/кг (или по 0,5 мг/мл/100 г массы тела). Растворы каррагинана и хитозана вводили в дозе 4,55 мг/кг, которая соответствует их дозе в составе ПЭК. Референсный препарат Фосфалюгель вводили в дозе 4,55 мг/кг. Контрольные животные получали воду в эквивалентном количестве.
В каждом эксперименте подсчитывали индекс Паулса (ИП) по формуле:
ИП=А·В/100, где А - среднее количество язв на одно животное; В - количество животных с язвами в группе (в %).
Противоязвенную активность (ПА) определяли как отношение ИП контрольной группы/ИП опытной группы. Считается, что исследуемый агент обладает противоязвенной активностью при ПА больше 2 ед. [Pauls F., Wick A.M., Mac Key E.M. et al., 1947].
Влияние агентов на состояние слизистой оболочки оценивали визуально в баллах, исходя из следующих критериев: выраженная гиперемия - 5 баллов; умеренная гиперемия - 4 балла; слабая гиперемия - 3 балла; отсутствие гиперемии (норма) - 2 балла; бледная слизистая - 1 балл.
Результаты обрабатывали с помощью программы STATISTICA 6. Значения признаны статистически верными при p<0.05.
Установлено, что при внутрижелудочном введении за час до ульцерогенного воздействия, ПЭК каппа-каррагинан:хитозан, в зависимости от состава, оказывает различный протекторный эффект. ПЭК-1 состава каппа-каррагинан:хитозан 1:10 в/в снижает количество язв в желудке в 3, а ПЭК-2 состава каппа-каррагинан:хитозан 10:1 в/в - в 2 раза по сравнению с контролем. Таким образом оптимальным для гастропротекторного эффекта является соотношение полисахаридных компонентов в ПЭК-1 каппа-каррагинан:хитозан 1:10 в/в.
Дальнейшее исследование гастрозащитной активности ПЭК-1 в сравнении с исходными полисахаридами и эталонным препаратом Фосфалюгель показало, что ПЭК-1 не уступает Фосфалюгелю и превосходит полисахариды каппа-каррагинан и хитозан (в 2 и 4,7 раз соответственно). Кроме того, ПЭК-1 полностью купирует гиперемию слизистой оболочки, в то время как эталонное средство и компоненты ПЭК-1 не оказывают положительного влияния на состояние ее микрососудистой гемодинамики.
Трехдневное профилактическое введение ПЭК-1, а также его полисахаридных компонентов и Фосфалюгеля, не оказывает противоязвенного действия, однако улучшает гемодинамику в стенке желудка, достоверно уменьшая гиперемию слизистой оболочки. Это указывает на разрушение гелевого слоя, образованного комплексом и референсным препаратом в желудке крыс, через 24 часа после их внутрижелудочного введения. Следует отметить, что, по данным литературы, гастрозащитный эффект Фосфалюгеля обеспечивается трехразовым приемом препарата в сутки, а стабильность пленки препарата Сукралфат (алюминиевой соли октасульфата сахарозы) поддерживается в желудке в течение 6 часов после приема [Клиническая фармакология по Гудману и Гилману.- М.: «Практика», 2006. С.782, Д.А. Харкевич «Фармакология».- М.: «Гэотар-Медиа», 2010. С. 379]. В соответствии с этими данными, можно заключить, что противоязвенный эффект ПЭК-1 обеспечивается в основном за счет обволакивающих свойств его геля. Улучшение состояние микроциркуляторного русла под влиянием профилактического введения ПЭК-1, как и его исходных полисахаридов, возможно, обеспечивается за счет уменьшения секреции гистамина, который является активным вазодилататором и паракринным стимулятором секреции хлористоводородной кислоты обкладочными клетками эпителия желудка.
Влияние ПЭК-1 на активность гистамина изучалось в модели воспалительного отека лапы мышей, индуцированного субпланарным введением 0,01% раствора последнего. Показано, что раствор ПЭК-1, введенный парентерально в дозе 10 мг/кг за час до гистамина, снижает выраженность отека на 51%. При этом эффект комплекса не значимо отличается от соответствующего эффекта препарата сравнения индометацина, введенного тем же путем в дозе 50 мг/кг.
Таким образом, комплекс ПЭК-1 состава каппа-каррагинан:хитозан при соотношении компонентов 1:10 в/в представляет собой средство с выраженной гастропротекторной активностью, не уступающей эталонному гастропротектору Фосфалюгелю. К преимуществам ПЭК-1 состава каппа-каррагинан:хитозан 1:10 в/в следует отнести:
• Природное (морское) происхождение исходных полисахаридов.
• Высокую биологическую активность каппа-каррагинана и хитозана.
• Выраженный противоязвенный эффект комплекса.
• Уменьшение гиперемии слизистой оболочки желудка.
• Уменьшение отека и воспаления, вызванного гистамином.
Изобретение иллюстрируется следующими примерами.
Пример 1. Зависимость гастропротекторной активности ПЭК каппа-каррагинан:хитозан от соотношения полисахаридных компонентов.
Для определения влияния соотношения полисахаридных компонентов в ПЭК на его гастропротекторную активность брали 2 композиции каппа-каррагинана с хитозаном с весовым отношением 1:10 (ПЭК-1) и 10:1 (ПЭК-2) в/в.
Сравнительную гастропротекторную активность комплексов определяли в эксперименте на 18-и самках крыс линии Вистар в модели индометациновой язвы желудка. Растворы ПЭК-1 и ПЭК-2 концентрацией 0,5 мг/мл готовили за сутки до введения животным путем растворения в дистиллированной воде при 37°. На ночь растворы оставляли при комнатной температуре.
За сутки до воспроизведения язвы животных лишали пищи при свободном доступе к воде. В качестве ульцерогенного агента использовали субстанцию индометацина («Fluka»), которую вводили всем животным внутрижелудочно в дозе 20 мг/кг в виде взвеси в воде с твином. За 1 час до индометацина опытным группам вводили внутрижелудочно растворы ПЭК-1 и ПЭК-2 в дозе 5 мг/кг, контрольной группе - воду. Через сутки животных наркотизировали хлороформом, проводили вскрытие, извлекали желудки и подсчитывали под лупой количество язв на слизистой оболочке.
Для оценки противоязвенного эффекта рассчитывали Индекс Паулса по формуле: ИП=А·В/100, где А - среднее количество язв на одно животное; В - количество животных с язвами в группе (в %). Противоязвенную активность определяли как отношение ИП контрольной группы к ИП опытной группы. Исследуемый агент обладает противоязвенной активностью, если индекс ПА больше 2 единиц.
Состояние слизистой оболочки оценивали визуально в баллах, исходя из следующих критериев: выраженная гиперемия - 5 баллов; умеренная гиперемия - 4 балла; слабая гиперемия - 3 балла; отсутствие гиперемии (норма) - 2 балла; бледная слизистая - 1 балл.
Статистическую обработку данных проводили с помощью программы STATISTICA 6. Результаты считали достоверными при Р<0,05.
Результаты представлены в таблице 1.
Сравнительная гастрозащитная активность ПЭК-1 и ПЭК-2 с различным соотношением полисахаридных компонентов
В результате эксперимента установлено, что обе полисахаридных композиции в условиях ульцерогенного воздействия оказывают защитное действие на слизистую желудка, которое выражается как в снижении количества язв, так и уменьшении раздражимости стенки желудка. Наиболее высокую активность проявляет ПЭК-1, который достоверно уменьшает язвообразование (в 3 раза относительно контроля) и нормализует состояние слизистой оболочки. У ПЭК-2 гастрозащитный эффект имел недостоверный характер.
Таким образом, было установлено, что оптимальным для гастропротекторного эффекта является соотношение полисахаридных компонентов в ПЭК каппа-каррагинан:хитозан 1:10 в/в.
Пример 2. Эффективность гастропротекторного действия ПЭК-1 в сравнении с его полисахаридными компонентами и эталонным средством Фосфалюгелем.
Исследование гастропротекторного действия ПЭК-1 в сравнении с каппа-каррагинаном, хитозаном и эталонным гастропротекторным средством Фосфалюгель (алюминия фосфат гель, «Astellas Pharma», Нидерланды) проводили на 30 самках крыс линии Вистар на модели индометациновой язвы желудка, описанной выше в примере 1.
Растворы ПЭК-1 и его исходных компонентов (хитозана и каппа-каррагинана) концентрацией 0,5 мг/мл готовили за сутки до введения животным путем растворения в дистиллированной воде при 37°. Приготовленные растворы ПЭК-1, хитозана и каппа-каррагинана вводили внутрижелудочно опытным животным, Фосфалюгель тем же путем референсной группе, контрольной группе - воду.
Дальнейшие манипуляции с животными, отбор материала и расчет показателей гастропротектрного действия проводили, как описано выше. Статистическую обработку данных проводили с помощью программы STATISTICA 6. Результаты считали достоверными при Р<0,05.
Результаты приведены в таблице 2.
Показатели гастрозащитного эффекта ПЭК-1 и его компонентов в сравнении с Фосфалюгелем у крыс с индуцированной индометацином язвой желудка
Данные, приведенные в таблице 2, показывают, что по эффекту снижения интенсивности язвообразования в желудке ПЭК-1 не уступает Фосфалюгелю и превосходит каппа-каррагинан и хитозан (в 2-4,7 раз соответственно). Кроме того, ПЭК-1 полностью купирует гиперемию слизистой оболочки, в то время как эталонное средство и компоненты ПЭК-1 не оказывают положительного влияния на ее состояние.
Таким образом, показано, что в результате комплексообразования морских полисахаридов каппа-каррагинана и хитозана гастропротекторная активность ПЭК-1 состава каппа-каррагинан:хитозан 1:10 в/в возрастает. Данная полисахаридная композиция не уступает по противоязвенному эффекту Фосфалюгелю и дополнительно существенно устраняет раздражающее действие НПВС на слизистую желудка.
Пример 3. Оценка гастропротекторного эффекта ПЭК каппа-каррагинан:хитозан при профилактическом введении.
С целью решения вопроса, повышает ли ПЭК-1 резистентность слизистой желудка к ульцерогенному воздействию НПВС, его вводили внутрижелудочно (как описано выше) крысам в течение трех дней до воспроизведения язвы желудка. Аналогично вводили полисахариды каппа-каррагинан и хитозан, а также референсный агент Фосфалюгель. Контрольная группа получала воду. После трехдневного введения агентов всех животных лишали пищи при свободном доступе к воде. Через сутки после отъема корма животным вводили в желудок субстанцию индометацина в дозе 20 мг/кг в виде взвеси в воде с твином. Через сутки после введения индометацина животных наркотизировали хлороформом, проводили вскрытие, извлекали желудки и подсчитывали под лупой количество язв на слизистой оболочке. Расчеты показателей гастропротекторной активности проводились, как указано выше.
Результаты приведены в таблице 3.
Показатели гастрозащитного эффекта ПЭК-1 и его компонентов при профилактическом введении в сравнении с Фосфалюгелем у крыс с индуцированной индометацином язвой желудка
Установлено, что профилактическое введение ПЭК-1 и его компонентов не оказывает противоязвенного действия, однако улучшает гемодинамику в стенке желудка, достоверно уменьшая гиперемию слизистой оболочки. Аналогичный эффект проявляет Фосфалюгель.
Таким образом, при профилактическом введении ПЭК-1 состава каппа-каррагинан:хитозан 1:10 в/в и его полисахаридных компонентов снижают раздражимость слизистой оболочки желудка и улучшают состояние микроциркуляторного русла в подслизистом слое. Однако противоязвенный эффект ПЭК-1 и Фосфалюгеля исчезает через 24 часа после внутрижелудочного введения, что, по-видимому, обусловлено разрушением образованного ими гелевого слоя.
Пример 4. Противовоспалительный эффект ПЭК каппа-каррагинан:хитозан на модели воспалительного отека лапы, индуцированного гистамином.
Противовоспалительную активность ПЭК-1 оценивали по снижению воспалительного отека лапы мышей, вызванного субпланарным введением 0,01% раствора гистамина. ПЭК-1, а также его полисахариды каппа-каррагинан и хитозан, в виде водных растворов концентрацией 0,5 мг/мл вводили внутрибрюшинно за 1 час до флогогена. Контрольным животным вводили тем же способом водно-твиновую взвесь. Референсным препаратом являлась субстанция индометацина («Fluka»), которую вводили внутрибрюшинно в эффективной дозе 50 мг/кг. Величину отека определяли через 6 часов после введения агентов по разности масс воспаленной и здоровой лап. Для каждого животного рассчитывали индекс воспаления как отношение этой разности к массе здоровой лапы. Различия считали достоверными с вероятностью Р<0,05. Для опытной и референсной группы рассчитывали величину отека относительно контроля, который принимали за 100%. За противовоспалительный эффект принимали разность относительной величины отека в контрольной группе и соответствующим значением в опытных группах.
Результаты приведены в таблице 4.
Противовоспалительный эффект комплексов и их компонентов
в модели гистаминового отека лапы
#Р<0,05, ###Р<0,001 относительно группы с введением индометацина.
Установлено, что парентеральное введение ПЭК-1 и отдельно взятых полисахаридов мышам достоверно снижает выраженность воспалительной реакции, индуцированной гистамином. При этом сам комплекс, а также хитозан не уступают по активности эталонному препарату (достоверные различия отсутствуют). У каппа-каррагинана противовоспалительная активность меньше, чем у ПЭК-1 и индометацина соответственно в 1,4 и 1,8 раз.
| название | год | авторы | номер документа |
|---|---|---|---|
| Лекарственная форма гистохрома для перорального введения и пролонгированного действия | 2017 |
|
RU2651042C1 |
| Средство, обладающее гастропротекторной активностью | 2016 |
|
RU2629090C1 |
| СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА, ОБЛАДАЮЩЕГО ПРОТИВОЯЗВЕННЫМ ДЕЙСТВИЕМ | 2013 |
|
RU2533228C2 |
| 3-[3-(МОРФОЛИН-4-ИЛ)ПРОПИЛ]-2-[(2,2,3-ТРИМЕТИЛЦИКЛОПЕНТ-3-ЕН-1-ИЛ)МЕТИЛ]-1,3-ТИАЗОЛИДИН-4-ОН, ОБЛАДАЮЩИЙ ПРОТИВОЯЗВЕННОЙ И ПРОТИВОВОСПАЛИТЕЛЬНОЙ АКТИВНОСТЬЮ | 2017 |
|
RU2643669C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОТИВОЯЗВЕННОГО ГАСТРОРЕТЕНТИВНОГО СРЕДСТВА | 2013 |
|
RU2531092C1 |
| СПОСОБ ПРОФИЛАКТИКИ ЯЗВООБРАЗОВАНИЯ НА СЛИЗИСТОЙ ОБОЛОЧКЕ ЖЕЛУДКА | 2020 |
|
RU2744455C1 |
| СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА, ОБЛАДАЮЩЕГО ПРОТИВОЯЗВЕННОЙ, АНТИСТРЕССОРНОЙ И ГЕМОСТАТИЧЕСКОЙ АКТИВНОСТЯМИ | 2012 |
|
RU2495674C1 |
| 13-Е-(2,4-ДИОКСО-1,2,3,4-ТЕТРАГИДРОПИРИМИДИН-5-ИЛ) ЭВДЕСМАНОЛИДЫ, ОБЛАДАЮЩИЕ ПРОТИВОЯЗВЕННОЙ АКТИВНОСТЬЮ | 2013 |
|
RU2536870C1 |
| АМИД β -ГЛИЦИРРИЗИНОВОЙ КИСЛОТЫ С ФЕНИЛБОРОНОВОЙ КИСЛОТОЙ, ПРОЯВЛЯЮЩИЙ ПРОТИВОВОСПАЛИТЕЛЬНУЮ И ПРОТИВОЯЗВЕННУЮ АКТИВНОСТЬ | 1991 |
|
RU2032694C1 |
| БИОЛОГИЧЕСКИ АКТИВНАЯ ДОБАВКА К ПИЩЕ "БИОСИНОЛ", ОБЛАДАЮЩАЯ ГАСТРОПРОТЕКТОРНОЙ АКТИВНОСТЬЮ | 2009 |
|
RU2397775C1 |
Изобретение относится к области фармацевтики, а именно к применению водорастворимого полиэлектролитного комплекса каппа-каррагинан:хитозан при соотношении компонентов 1:10 в/в с молекулярной массой каппа-каррагинана 311 кДа и с молекулярной массой хитозана 115 кДа и степенью N-ацетилирования 6% в качестве средства, обладающего гастропротекторной активностью. Изобретение обеспечивает расширение арсенала природных средств, обладающих гастропротекторным действием, предотвращающих ульцерогенное воздействие на слизистую оболочку желудка путем создания на ее поверхности защитного слоя, а также демонстрирует бóльшую эффективность снижения язвообразования по сравнению с каппа-каррагинаном и хитозаном, взятыми по отдельности. 1 з.п. ф-лы, 4 пр., 4 табл., 1 ил.
1. Применение водорастворимого полиэлектролитного комплекса каппа-каррагинан:хитозан при соотношении компонентов 1:10 в/в в качестве средства, обладающего гастропротекторной активностью.
2. Применение по п.1 водорастворимого полиэлектролитного комплекса каппа-каррагинан:хитозан с молекулярной массой каппа-каррагинана 311 кДа и с молекулярной массой хитозана 115 кДа и степенью N-ацетилирования 6%.
| US 5904927 A, 18.05.1999 | |||
| Топка для твердого многозольного топлива | 1924 |
|
SU1373A1 |
| Mikio Ito et al / Anti-ulcer Effects of Chitin and Chitosan, Healthy Foods, In Rats / Jpn | |||
| J | |||
| Pharmacol | |||
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
| R | |||
| Anandan et al / Anti-ulcerogenic effect of chitin and chitosan on mucosal antioxidant defence system in HCl-ethanol-induced ulcer in rats / Journal of | |||
Авторы
Даты
2014-12-20—Публикация
2014-01-28—Подача