Предлагаемое изобретение относится к области органического синтеза, в частности к способу получения алкиловых эфиров 1- и 2-нафталинкарбоновых кислот.
Нафталинкарбоновые кислоты находят широкое применение в органическом синтезе. Они используются в синтезе гербицидов, гормонов роста растений, красителей, фотоматериалов и полимеров [1. Сиккенга Д.Л., Кульманн Д.Е., Беренс П.К., Зейтлин М. А., Хувер С.В. Пат. 2128641, (1999). РФ]. Производные нафталинкарбоновых кислот применяются в медицине и косметологии [2. Одрэ Р. Пат. 2385708, (2010). РФ].
В литературе известны разнообразные методы получения нафталинкарбоновых кислот.
Так, 1-нафталинкарбоновую кислоту (1) синтезируют продолжительным нагреванием циннамилиденгиппуровой кислоты (С6Н5СНСНСНС(СООН)NHCOC6H5) с 24%-ной соляной кислотой в запаянной трубке при 120°С [3. Erlenmeyer jr. Е., Matter О. // Ann. 1904. №337. P. 271]. В работе [4. Price С.С, Chapin Е. С. // J. Am. Chem. Soc. 1941. №63. P. 1857; 5. 1942. №64. P. 2227] приведен необычный метод получения 1-нафталинкарбоновой кислоты (1), основанный на конденсации бензола с фуран-2-карбоновой кислотой в присутствии AlCl3 сначала при охлаждении, а затем при нагревании до 60°С (12-18 ч). Выход (1) составляет 10-13%.
Наиболее распространенными являются методы получения нафталинкарбоновых кислот из соответствующих галогенпроизводных нафталина.
2-Нафталинкарбоновую кислоту (2) синтезировали цианированием 2-бромнафталина (3) с помощью KCN в присутствии катализатора CuCN-Cu° в водном этиленгликоле в течение 31 ч (выход 14%) [6. Loevenich J., Loeser А. // Ber. 1927. №60. P. 320] или превращением в реактив Гриньяра и обработкой эфирного раствора последнего углекислым газом при -20°С (выход 42%) [7. Salkind J. // Ber. 1934. №67. Р. 1031].
Недавно предложен новый метод синтеза 1-й 2-нафталинкарбоновых кислот (1, 2) взаимодействием 1-иод-(4) и 2-бромнафталина (3) с малононитрилом в присутствии медьсодержащего катализатора [8. Yang D., Yang Н., Fu H. // Chem. Commun. 2011. Vol.47. №8. P. 2348-2350]. Выход 1-нафталинкарбоновой кислоты (1) по данному методу составляет -50%, 2-нафталинкарбоновой (2) - 44%.
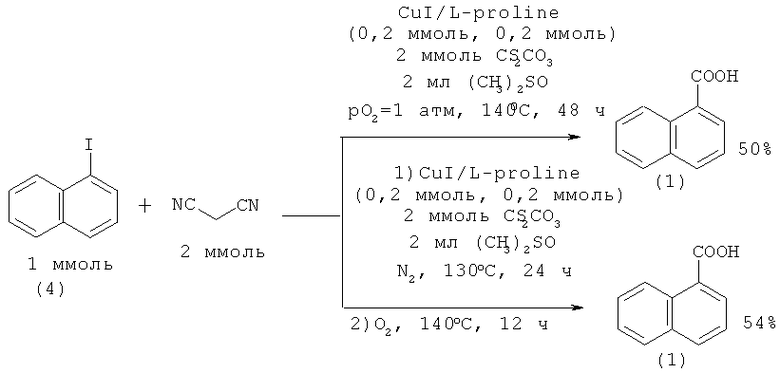
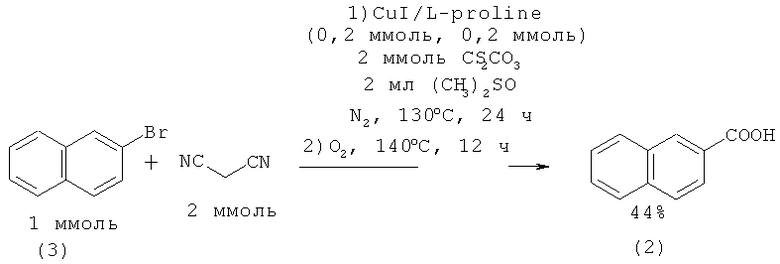
Недостатки:
1. Использование высокотоксичного малононитрила;
2. Значительная продолжительность реакции 36-48 ч;
3. Необходимость проведение работ под давлением. Карбоксилирование 1-бромнафталина (5) с помощью углекислого газа в присутствии палладиевого катализатора и диэтилцинка (С2Н5)2Zn приводит к образованию 1-нафталинкарбоновой кислоты (1) с выходом 72% [9. Romo М., Francisco R. // ЕР 2311788 (2011); 10. Correa A., Martin R. // J. Am. Chem. Soc. 2009. Vol.131. №44. P. 15974-15975].
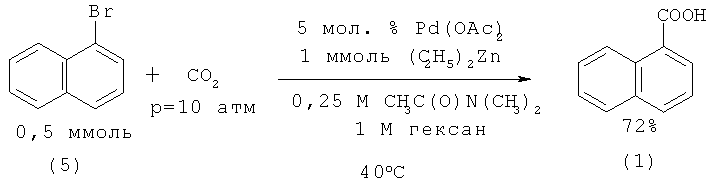
Недостатки:
1. Использование дорогостоящего палладиевого катализатора;
2. Использование аппаратуры, работающей под давлением;
3. Пожароопасность процесса из-за использования 2-кратного избытка самовоспламеняющегося на воздухе диэтилцинка.
1-Нафталинкарбоновая кислота (1) получена карбоксилированием 1-иоднафталина (4) с формиатом лития под действием палладийсодержащего катализатора в среде уксусного ангидрида. Выход 1-нафталинкарбоновой кислоты (1) при использовании гомогенного и нанесенного катализатора примерно равны и составляют 82-89% [11. Cacchi S., Cotet С.L., Fabrizi G., Forte G., Goggiamani A., Martin L., Martinez S., Molins E., Moreno-Manas M., Petrucci F., Roig A., Vallribera A. // Tetrahedron. 2007. Vol.63. №11. P. 2519-2523; 12. Cacchi S., Fabrizi G., Coggiamani A. // Org. Lett. 2003. Vol.5. №23. P. 4269-4272].
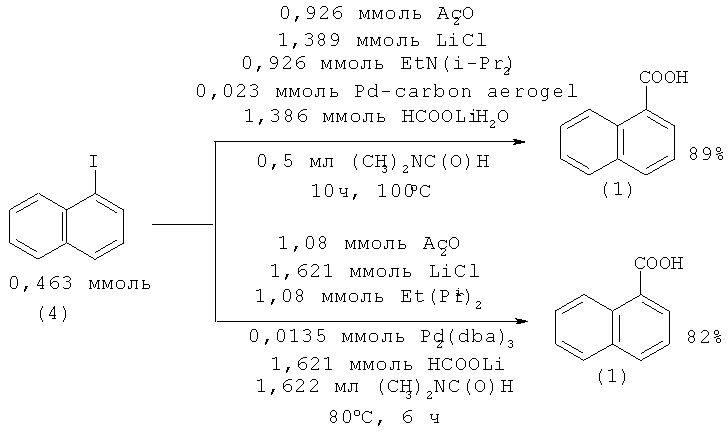
Недостатки методов:
1.Использование в качестве растворителя уксусного ангидрида, являющегося прекурсором;
2. Использование дорогостоящего палладийсодержащего катализатора;
3. Необходимость использования большого количества вспомогательных реагентов ((CH3)2NC(O)H, HCOOLi, LiCl, Et(Pri)2 и др.), не входящих в состав конечного продукта.
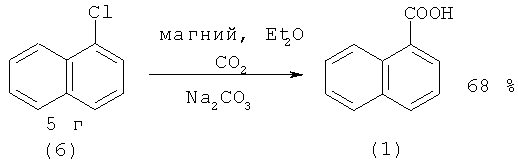
1-Нафталинкарбоновую кислоту (1) можно получить гарбонилированием 1-хлорнафталина (6) в течение 20 мин в воде под действием иодида никеля при 180°С [13. Пат. 2424(1952). Япония // С.А. 1954. Vol.48. №2105].
В литературе описан ряд каталитических методов синтеза 1-й 2-нафталинкарбоновых кислот (1,2) карбонилированием галогензамещенных гафталинов под действием комплексов Со, Rh, Pd, Mo и Ni. Так, сарбонилированием 1-хлорнафталина (6) под действием катализатора Co2(СО)8 в различных условиях была получена 1-нафталинкарбоновая сислота (1). В работе [14. Боярский В.П., Жеско Т.Е., Ланина С.А. // Журнал прикладной химии. 2005. Т. 78. Вып.11. С.1844-1848] выход кислоты (1) в присутствии эпоксида пропилена составляет 92%, а в работе [15. Francalanci F., Bencini E., Gardano A., Vincenti M., Foa M. // J. Organomet. Chem. 1986. №301. P. 27-30] при использовании диметилсульфата и Са(ОН)2 не превышает 20%. Аналогичной реакцией 1-бромнафталина (5) с СО и MeI получили 1-нафталинкарбоновую кислоту (1) с выходом 44% [16. Miura М, Akase F, Nomura М. // J.Org. Chem. 1987. №52. P. 2623-2625].
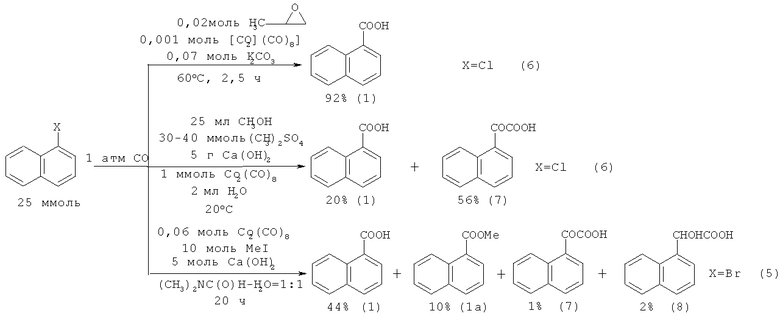
Недостатки методов:
1. Необходимость использования токсичного катализатора октакарбонила кобальта;
1. Значительная продолжительность реакции (20 ч);
3. Низкая селективность процесса;
4. В качестве окислителя используется легковоспламеняющийся эпоксид пропилена.
В работе [17. Mizuno Т., Alper Н. // J. Mol. Catal. A: Chem. 1997. Vol.123. №1. P. 21-24] для карбонилирования 1-иоднафталина (4) с получением 1-нафталинкарбоновой кислоты (1) предложено использовать комплекс родия с трифенилфосфином.

Недостатки метода:
1. Процесс проводится под давлением 41 атм;
2. Использование дорогостоящего и труднодоступного родийсодержащего катализатора;
3. Высокая температура 210°С, значительная продолжительность реакции (16 ч).
1-Нафталинкарбоновую кислоту (1) получают карбоксилированием 1-иоднафталина (4) под действием катализатора - цианида никеля за 16 ч. Выход кислоты (1) составляет 60% [18. Amer I., Alper Н. // J. Org. Chem. 1988. №. 53. P. 5147-5148].

Недостатки метода:
1. Значительная продолжительность реакции 16 ч;
2. Использование в качестве катализатора токсичного цианида никеля;
3. Необходимость применения избытка NaOH, что осложняет выделение конечного продукта.
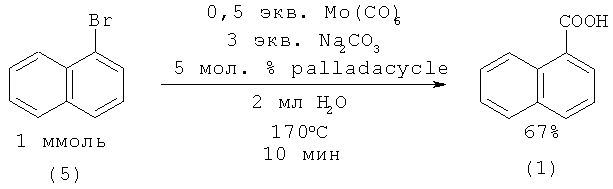
1-Нафталинкарбоновую кислоту (1) с выходом 67% можно получить из 1-бромнафталина (5) в присутствии катализаторов на основе молибдена и палладия [19. Wu X., Larhed М. // Org. Lett. 2005. Vol.7. №15. P. 3327-3329].
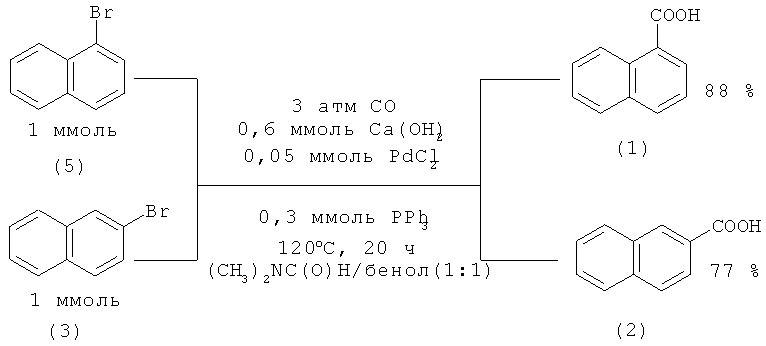
Серия работ посвящена карбонилированию галогензамещенных нафталинов с помощью монооксида углерода под действием комплексов палладия. В работе [20. Pri-Bar I., Buchman О. // J. Org. Chem. 1988. Vol.53. №3. P. 624-626] осуществлено карбонилирование 1-(5) и 2-бромнафталинов (3) с образованием 1-(1) и 2-нафталинкарбоновых кислот (2) с выходом ~80% в присутствии PdCl2-PPh3.
Реакции 1-иоднафталина (4) и 1-бромнафталина (5) с оксидом углерода в присутствии палладиевых катализаторов приводит к получению 1-нафталинкарбоновой кислоты (1) с выходом 80% [21. Grushin V. V., Alper Н. // Organometallics. 1993. Vol.12. № 10. P. 3846-3850], 35% [22. Klobayashi Т., Sakakura Т., Tanaka M. // Tetrahedron Lett. 1987. Vol.28. №24. P. 2721-2722] и 55% [23. Calo V., Giannoccaro P., Nacci A., Monopoli A. // J.Organometal.Chem. 2002. Vol.645. №1-2. P. 152-157].
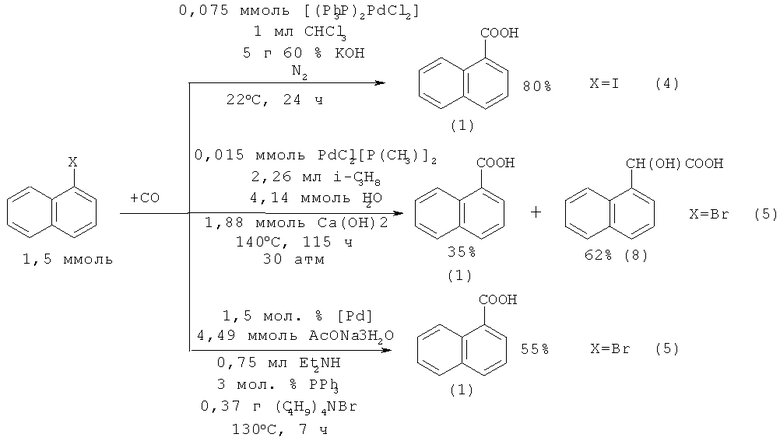
Недостатки методов:
1. Использование дорогостоящих палладийсодержащих катализаторов;
2. Необходимость работы под давлением;
3. Значительная продолжительность реакции (115 ч);
4. Исходным соединением является труднодоступный 1-иоднафталин
(4);
5. Низкая селективность процесса.
В литературе имеется серия работ по получению 1-нафталинкарбоновой кислоты (1) через реактив Гриньяра. Так, в работе [24. Fieser L.F., Holmes Н.L., Newman М.S. //J. Am. Chem. Soc. 1936. №58. P. 1055] описан синтез 1-нафталинкарбоновой кислоты (1) с выходом 90% из 1-бромнафталина (5) через реактив Гриньяра, с последующим карбоксилированием, или обработкой 1-бромнафталина (5) бутиллитием в дибутиловом эфире при комнатной температуре с последующим прибавлением твердой СО2 (выход до 91%) [25. Gilman Н., Moore F. W. //J. Am. Chem. Soc. 1940. №62. P. 1843; 26. Gilman H., Swiss J. //J. Am. Chem. Soc. 1940. №62. P. 1847].
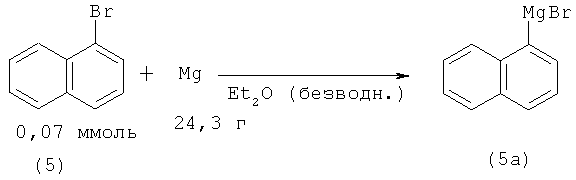
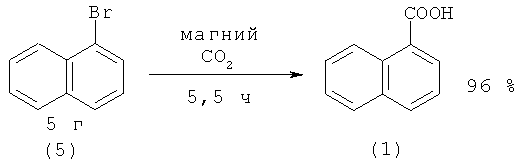
1-Нафталинкарбоновую кислоту (1) синтезируют из нафтилмагнийбромида (5а) (предварительно полученного из магния и 1-бромнафталина (5)) и карбоната бария, который генерирует CO2 в среде безводного тетрагидрофурана [27. Andres Н. // J. Label Compd. Radiopharm. 1989. Vol.27. №11. P. 1307-1315].

При получении 1-нафталинкарбоновой кислоты (1) из 1-нафтилмагниийбромида (5а) и двуокиси углерода выход (1) был выше и составил 68% [28. Gilman Н., John N.В. St., Schulse F. // Org. Syn. 1931. Vol.2. №11. P. 80; 1943. Vol.2. №2. P. 425].

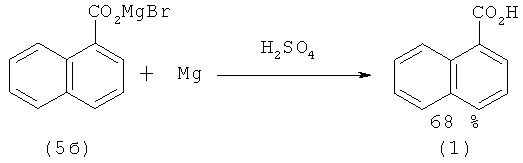
Аналогично, но с более низким выходом проходит реакция с участием 1-хлорнафталина (6) под действием магния и CO2 [29. Brown С, Sikkel В.J., Carvalho С, Sargent М.V. // J. Chem. Soc, Perkin Trans. 1982. №1. P. 3007-3010].
Недостатки методов:
1. Необходимость использования на стадии синтеза реактивов Гриньяра безводных эфирных растворителей (ТГФ, диэтиловый эфир);
2. Использование аппаратуры, работающей под давлением;
3. Многостадийность процесса;
4. Применение серной кислоты;
5. Применение токсичного карбоната бария;
6. Исходными реагентами являются 1-хлор (6) или 1-бромнафталины (5) и металлический магний;
7. Низкий выход 1-нафталинкарбоновой кислоты (34%).
В ряде работ нафталинкарбоновые кислоты получены окислением алкилнафталинов.
Так, 1-метилнафталин (9) окисляют в 1-нафталинкарбоновую кислоту (1) разбавленной азотной кислотой в течение 4-5 дней. Труднее окисляется 2-метилнафталин (10), который превращается в 2-нафталинкарбоновую кислоту (2) при кипячении с концентрированной азотной кислотой. 2-Нафталинкарбоновую кислоту (2) можно получить обработкой 2-(1-бутенил)-нафталина (11) перманганатом бария в ацетоне при комнатной температуре и последующей обработкой бихроматом натрия в кипящей уксусной кислоте [30. Химия и технология соединений нафталинового ряда / Под редакцией А.И.Королева. - М.: Химическая литература, 1963, С.478-481].
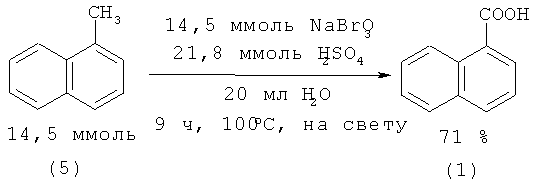
1-Нафталинкарбоновая кислота (1) с выходом 71% образуется при окислении 1-метилнафталина (9) бромидами / броматами в воде. [31. Patil R.D., Bhadra S., Adimurthy S., Ranu B.C // Synth. Commun. 2010. Vol.40. №19. P. 2922-2929.]:
Недостатки метода:
1. Образование большого количества отходов из-за использования избытка серной кислоты (1-метилнафталин (9) : H2SO4=1:1.5) и неорганических реагентов NaBr-NaBrO3.
В работе [32. Ranu В.С, Brandra S., Adak L. // Tetrahedron Lett. 2008. Vol.49. №16. P. 2588-2591] 1-нафталинкарбоновую кислоту (1) получали окислением 1-этилнафталина (10) гидропероксидом трет-бутила под действием индиевого катализатора.
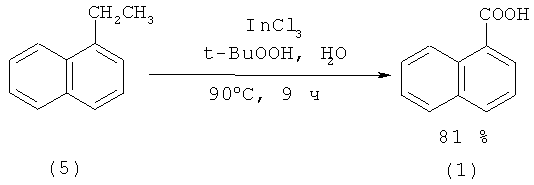
Недостатки метода:
1. Использование пожаровзрывоопасного, токсичного третбутил-гидропероксида;
2. Необходимость использования дефицитных реагентов: 1-этилнафталина (10) и хлорида индия.
При фотоокислении 1-метилнафталина (9) и 1-(11) и 2-гидроксиметилнафталинов (12) кислородом в присутствии CBr4 и PPh3 образуются 1-(1) и 2-нафталинкарбоновые кислоты (2) с выходом до 88% [33. Sugai Т., Itoh A. // Tetrahedron Lett. 2007., Vol.48. №52. P. 9096-9099].
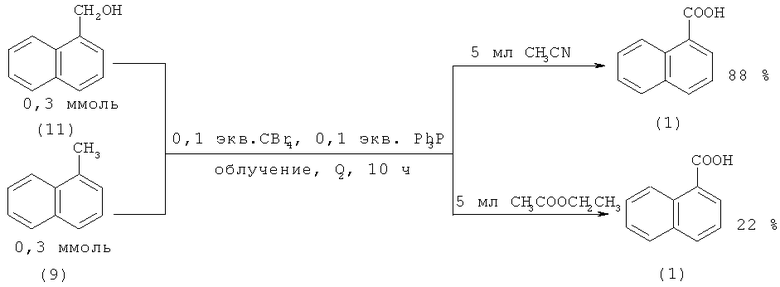
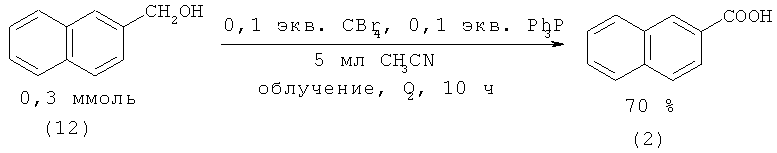
Аналогичная реакция в среде H2O-HBr и MeCN приводит к получению 1-(1) и 2-нафталинкарбоновых кислот (2) с более высокими выходами - 81 и 94% соответственно [34. Hirashima S. - i., Hashimoto S., Masaki Y., Itoh A. // Tetrahedron. 2006. Vol.62. №33. P. 7887-7891].
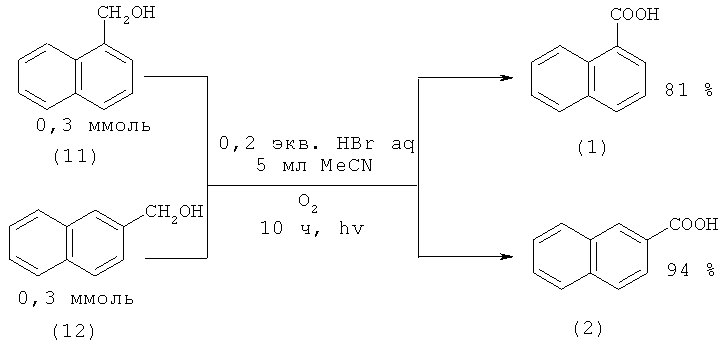
Недостатки методов:
1. Использование бромоводородной кислоты;
2. Исходные соединения являются труднодоступными и дорогостоящими реактивами.
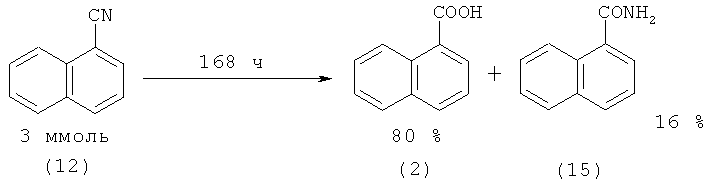
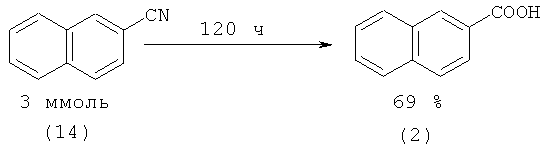
1-(1) и 2-Нафталинкарбоновые кислоты (2) могут быть получены из 1-(13) и 2-нитрилнафталинов (14) соответственно под действием штамма Rhodococcus sp AJ270. Выход 1-нафталинкарбоновой кислоты (1) составляет 80%, 2-нафталинкарбоновой (2) - 69% [35. Meth-Cohn О., Wang М. -Х. III. Chem. Soc. Perkin Trans. 1997. №l. p.1099-1104].
В работе [36. Kay F.W., Morton A. // J. Chem. Soc. 1914. №105. P. 1565; 37. Kamm O., Mc Clugage H.B. // J. Am. Chem. Soc. 1916. №38. P. 419] 1-нафталинкарбоновую кислоту (1) получают окислением 1-нафтилметилкетона (16) или омылением 1-нафтонитрила (13).
Частым литературным примером получения нафталинкарбоновых кислот является окисление соответствующих альдегидов.
Так, 1-нафтальдегид (17) окисляется до 1-нафталинкарбоновой кислоты (1) бихроматом натрия в кипящей уксусной кислоте или при выдерживании на воздухе [30. Химия и технология соединений нафталинового ряда / Под редакцией А.И.Королева. М.: Химическая литература, 1963, С.481,479].
1-(1) и 2-Нафталинкарбоновые кислоты (2) с выходами 70% получены окислением 1(17)- и 2-нафтальдегида (18) соответственно [38. Shirini F., Zolfigol М.A., Torabi S. // Synth. Commun. 2006. Vol.36. №19. P. 2833-2840].
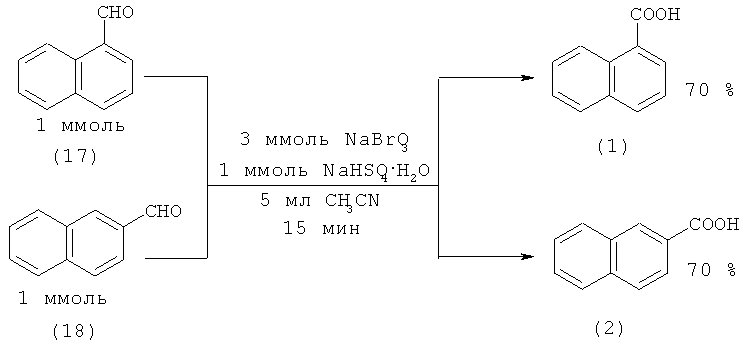
1-Нафталинкарбоновую кислоту (1) из 1-нафтальдегида (17) также можно получить по реакции Канницаро [39. Yoshizawa К., Toyota S., Toda F. // Tetrahedron Lett. 2001. Vol.42. №45. P. 7983-7985], окислением с помощью триоксодинитрата натрия (Angeli's salt) Na2N2O3 [40. Torun L., Mohammad Т., Morrison H. // Tethrahedron Lett. 1999. №40. P. 5279-5282] и окислением избытком пероксида водорода в присутствии SeO2 [41. Brzaszcz М., Kloc К., Marosah М., Mlochowski J. // Synth. Commun. 2000. Vol.30. №24. P. 4425-4434].
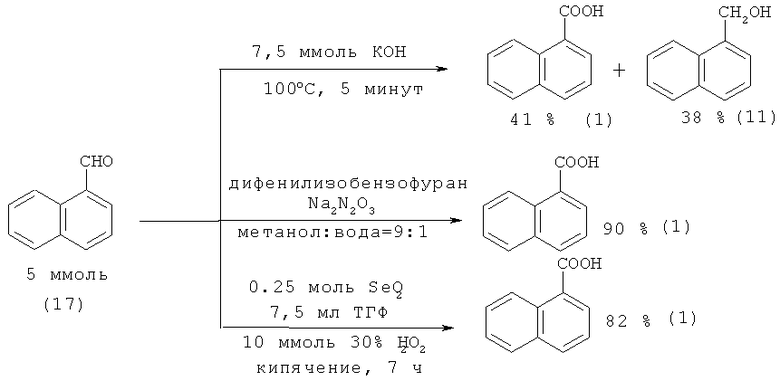
Недостатки методов:
1. Использование в качестве исходного соединения труднодоступного 1-нафталинальдегида (17);
2. Применение в качестве катализатора дорогостоящего и токсичного диоксида селена;
3. Необходимость использования окислителей (Na2N2O3, H2O2) и основания (КОН).
Особый интерес представляют синтез нафталинкарбоновых кислот непосредственно из доступного нафталина (19).
Например, нафталин (19) нагревают в течение нескольких часов с формальдегидом и раствором соляной кислоты и полученный 1-хлорметилнафталин (20) онисляют до кислоты (1) двуокисью марганца в 10%-ной H2SO4 при 90-95°С [42. Швейц. пат. 256515 (1949)].
В работе [43. Nemoto К., Yoshida Н., Egusa N., Morohashi N., Hattori T. // J. Org. Chem. 2010. Vol.47. №8. P. 7855-7862] описывается карбоксилирование нафталина (19) в присутствии системы Ph3SiCl/AlBr3 с образованием смеси 1-нафталинкарбоновой (1) и 2-нафталинкарбоновой кислот (2).
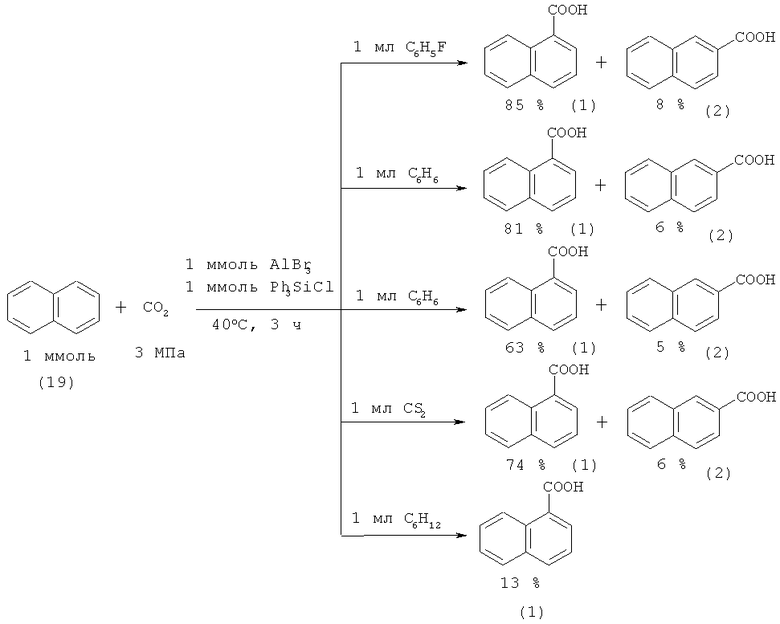 Недостатки:
Недостатки:
1. Использование реагентов и катализатора в стехиометрическом соотношении;
2. Проведение работы под высоким давлением диоксида углерода 3 МПа;
3. Использование токсичных реагентов - сероуглерода и трифенилхлорсилана.
Совместно 1- (1) и 2- (2) нафталинкарбоновые кислоты были получены карбоксилированием нафталина (19) оксидом углерода в присутствии катализатора на основе палладия в различных средах. Если средой является персульфат калия и трифторуксусная кислота, то общий выход нафталинкарбоновых кислот (1, 2) составляет 6% [44. Lu W., Yamaoka Y., Taniguchi Y., Kitamura Т., Takaki K., Fujiwara Y. // J. Organomet. Chem. 1999. Vol.580. №2. P. 290-294], в среде t-BuOH/CH3COOH/CH2CHCH2Cl выход получился меньше 1% [45. Fujiwara Y., Kawata I., Sugimoto H., Taniguchi H. // J. Organomet. Chem. 1983. Vol.256. №2. P. 35-36], а в среде уксусной кислоты общий выход кислот (1, 2) составляет 90% [46. Sakakibara Т., Odaira Y. // J. Org. Chem. 1976. Vol.41. №11. P. 2049-2052].
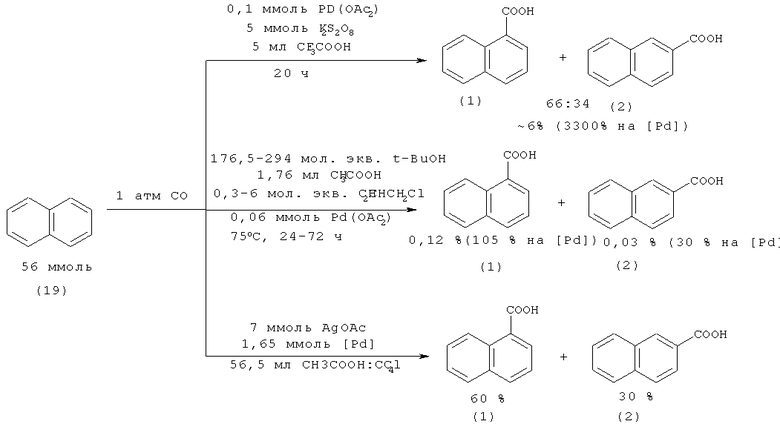
Недостатки методов:
1. Использование дорогостоящего катализатора на основе палладия и серебра;
2. Значительная продолжительность реакции до 72 ч;
3. Использование большого избытка агрессивных реагентов: уксусной кислоты, персульфата калия и трифторуксусной кислоты.
Авторами предлагается способ получения алкиловых эфиров нафталинкарбоновых кислоты, не имеющий вышеперечисленных недостатков.
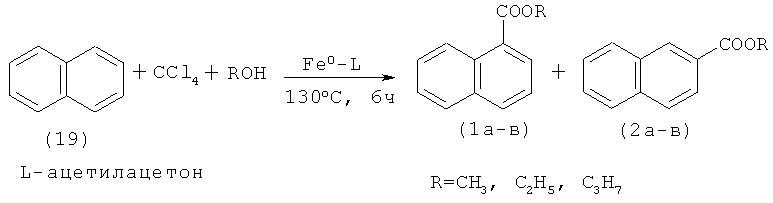
Сущность способа заключается во взаимодействии нафталина (19) с четыреххлористым углеродом и спиртами (метанол, этанол, н-пропанол) в присутствии металлического железа (активированного HCl) и ацетилацетона (лиганд), при температуре 130°С в течение 4-12 ч при мольном соотношении [Fe0]:[ацетилацетон]:[нафталин]:[CCl4]:[спирт]=5-50:5:100:100-1000:100-1000 с получением алкиловых эфиров 1- и 2-нафталинкарбоновых кислот. При температуре 130°С общий выход алкиловых эфиров 1- и 2-нафталинкарбоновых кислот достигает 75%. Следует отметить, что при увеличении соотношения катализатора к нафталину до [50]:[100] увеличивается конверсия исходного нафталина до 100%, выход эфиров 1-нафталинкарбоновых кислот до 70%, но при этом реакция проходит менее селективно за счет образования диалкиловых эфиров 1,5- и 2,6-нафталиндикарбоновых кислот (3а-в, 4а-в). Синтез проводят в атмосфере аргона.
В отсутствие катализатора, ацетилацетона, CCl4 или спирта (любого из компонентов) реакция не проходит.
Существенные отличия предлагаемого способа от прототипа.
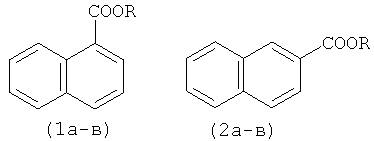
Для получения алкиловых эфиров 1-(1а-в) и 2-нафталинкарбоновых кислот (2а-в) из нафталина (19) используют систему металлическое железо-ацетилацетон-CCl4-ROH.
Преимущества предлагаемого метода
1. Использование доступных исходных реагентов: нафталина, CCl4 и алифатических спиртов;
2. Низкий расход катализатора;
3. Отсутствие агрессивных окислителей;
4. Удешевление себестоимости и упрощение технологии в целом за счет уменьшения энерго- и трудозатрат;
5. Высокий выход эфиров 1-нафталинкарбоновой кислоты до 70%.
Предлагаемый способ поясняется примерами:
ПРИМЕР 1. Получение пропиловых эфиров 1- и 2-нафталинкарбоновых кислот (1в, 2в).
Реакцию проводили в стеклянной ампуле объемом 10 мл, помещенной в микроавтоклав из нержавеющей стали объемом 17 мл, при постоянном перемешивании и регулируемом нагреве.
В ампулу в токе аргона загружали 2.2 мг (5 ммоль) Fe0(мет.) (активированный HCl), 0.004 мл (5 ммоль) ацетилацетона, 102 мг (100 ммоль) нафталина, 0.77 мл (1000 ммоль) четыреххлористого углерода и 0.6 мл (1000 ммоль) н-пропилового спирта. Запаянную ампулу помещали в автоклав, автоклав герметично закрывали и нагревали при 130°С в течение 6 ч при постоянном перемешивании. После окончания реакции автоклав охлаждали до комнатной температуры, ампулу вскрывали, реакционную массу нейтрализовали и фильтровали через бумажный фильтр. Растворитель отгоняли, остаток перегоняли под вакуумом. Конверсия исходного нафталина (19) составила 66%, выход пропилового эфира 1-нафталинкарбоновой кислоты (1в) - 41%, 2-нафталинкарбоновой (26) - 25%.
Строение полученных соединений доказано методами ЯМР, масс-спектрометрии.
Пропиловый эфир 1-нафталинкарбоновой кислоты (1в)
Спектр ЯМР 13С (δ, м.д.): 10.44 (СН3), 21.90 (СН2СН3), 66.70 (СН2С2Н5), 125.24 (С3), 126.51 (С6), 126.59 (С7), 127.19 (С8), 128.51 (С5), 130.04 (С2), 130.28(С1), 132.50 (С9), 133.19 (С4), 133.88 (С10), 168.95 (СОО). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 0.98 т (3Н, СН3 J 1.8 Гц), 1.6 м (2Н, СН2СН2СН3 J 3.7 Гц), 4.1 т (2Н, CH2CH2CH3 J 1.5 Гц), 8.6 д (1H, С2Н J 0,4 Гц), 7.6 д, д (1Н, С3Н J 7 Гц, 9 Гц), 8.2 д (1Н, С4Н J 7 Гц), 7.8 д (1H, С5Н J 8 Гц), 7.5 м (1Н, С6Н J 8 Гц), 7.5 м (1Н, С7Н J 8 Гц), 7.88 д (1Н, С9Н J 8 Гц).
Масс-спектр, m/z (Iотн (%)): 214.10 [М]+(70), 172(100), 156(21), 155(96), 128(13), 127(58), 115(4).
Пропиловый эфир 2-нафталинкарбоновой кислоты (2в)
Спектр ЯМР 13С (δ, м.д.): 10.52 (СН3), 22.17 (СН2СН3), 66.63 (СН2С2Н5), 125.24 (С6), 125.84 (С3), 127.19 (С4), 127.47 (С10), 127.74 (С7), 128.51 (С5), 129.31(С1), 131.36 (С8), 132.50 (С9), 135.47 (С2), 167.59 (СОО). Спектр ЯМР 1H (CDCl3, δ, м.д.): 1.08 т (3Н, СН3 J 3 Гц), 2,03 м (2Н, СН2СН2СН3 J 1,05 Гц), 4.3 т (2Н, СН2СН2СН3 J 2 Гц), 7.68 д (Н, С3Н J 8 Гц), 8.2 д (Н, С4Н J 7 Гц), 7.8 д (1Н, С5Н J 8 Гц), 7.5 м (1Н, С6Н J 8 Гц), 7.5 м (1H, С7Н J 8 Гц), 8.04 д (1H, С8Н J 8 Гц),8.6 с(1Н,С1Н).
Масс-спектр, m/z (Iотн (%)): 214.10 [М]+(47), 207 (29), 205 (5), 173 (15), 172(95), 163 (10), 155(100).
ПРИМЕР 2-5. Получение пропиловых эфиров 1- и 2-нафталинкарбоновых кислот (1в, 2в).
Аналогично примеру 1, за исключением количества взятого катализатора: [Fe0]:[ацетилацетон]:[нафталин]:[CCL4]:[н-пропанол]=10:5:100:1000:1000 (пример 2) - конверсия исходного нафталина (19) составила 68%, выход пропилового эфира 1-нафталинкарбоновой кислоты (1в) - 48%, 2-нафталинкарбоновой (2в) - 20%; при соотношении [Fe0]:[ацетилацетон]:[нафталин]:[CCl4]:[н-пропанол]=20:5:100:1000:1000 (пример 3) - конверсия нафталина (19) составила 93%, выход пропилового эфира 1-нафталинкарбоновой кислоты (1в) - 56%, 2-нафталинкарбоновой (2в) - 17%, выход 1,5-дипропилового эфира 1,5-нафталиндикарбоновой кислоты (3в) - 13%, 2,6-дипропилового эфира 2,6-нафталиндикарбоновой кислоты (4в) - 7%; при соотношении реагентов [Fe0]:[ацетилацетон]:[нафталин]:[CCl4]:[н-пропанол]=30: 5:100:1000:1000 (пример 4) - конверсия составила 96%, выход пропилового эфира 1-нафталинкарбоновой кислоты (1в) - 63%, 2-нафталинкарбоновой (2в) - 12%, выход 1,5-дипропилового эфира 1,5-нафталиндикарбоновой кислоты (3в) - 15%, 2,6-дипропилового эфира 2,6-нафталиндикарбоновой кислоты (4в) - 6%; при мольном соотношении реагентов [Fe0]:[ацетилацетон]:[нафталин]:[CCl4]: [спирт]=50:5:100:1000:1000 (пример 5) - конверсия исходного нафталина (19) составила 100%, выход пропилового эфира 1-нафталинкарбоновой кислоты (1в) - 70%, выход 1,5-дипропилового эфира 1,5-нафталиндикарбоновой кислоты (3в) - 22%, 2,6-дипропилового эфира 2,6-нафталиндикарбоновой кислоты (4в) - 8%.
Дипропиловый эфир 1,5-нафталиндикарбоновой кислоты (3в)
Спектр ЯМР 13С (δ, м.д.): 10.56 (СН3), 22.02 (СН2СН3), 67.11 (CH2O), 125.86 (С4), 125.86 (С8), 126.17 (С3), 126.17 (С7), 132.15(С2), 132.15(С6), 133.19 (С9), 133.19 (С10), 140.24(С1), 140.24(С5), 167.59 (СОО). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 0.98 т (3Н, СН3 J 5.8 Гц), 1.6 м (2Н, СН2СН2СН3 J 1.7 Гц), 4.1 т (2Н, СН2СН2СН3 J 4 Гц), 9.1 д (2Н, С2,6Н J 9 Гц), 7.6 д, д (1Н, С3Н J Гц, 9 Гц), 8.28 д (2Н, С4,8Н J Гц), 7.6 м (1Н, С7Н, J Гц).
Масс-спектр, m/z (Iотн (%)): 300.10 [М]+(64), 258 (28), 241 (85), 221 (18), 216 (100), 199 (61), 150 (13), 126 (19), 143 (9).
Дипропиловый эфир 2,6-нафталиндикарбоновой кислоты (4в)
Спектр ЯМР 13С (δ, м.д.): 10.67 (СН3), 22.16 (СН2СН3), 66.88 (CH2O), 127.67 (С3), 127.67 (С7), 130.47 (С4), 130.47 (С8), 131.68(С1), 131.68(С5), 134.03 (С9), 134.03 (С10), 140.24(С2), 140.24 (С6), 167.59 (СОО). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 1.08 т (3Н, СН3 J 5,2 Гц), 1,8 м (2Н, CH2CH2CH3 J 2 Гц), 4.4 т (2Н, СН2СН2СН3 J 4 Гц), 8.6 с (2Н, С1,5Н), 8.2 д (2Н, С3,7Н J 8 Гц), 8.20 д (2Н, С4,8Н J 7 Гц).
Масс-спектр, m/z (Iотн (%)): 300.10 [М]+(43), 281 (19), 258 (21), 241 (79), 216 (100), 207 (47), 199 (48), 171 (27), 126 (16), 115 (24).
ПРИМЕРЫ 6-9. Получение пропиловых эфиров 1- и 2-нафталинкарбоновых кислот (1в, 2в).
Аналогично примеру 1, за исключением продолжительности реакции: за 4 ч (пример 6) - конверсия исходного нафталина (19) составила 23%, выход пропилового эфира 1-нафталинкарбоновой кислоты (1в) - 11%, 2-нафталинкарбоновой кислоты (2в) - 12%; за 8 ч (пример 7) - конверсия (19) - 60%, выход пропилового эфира 1-нафталинкарбоновой кислоты (1в) - 35%, 2-нафталинкарбоновой кислоты (2в) - 25%; за 10 ч (пример 8) конверсия нафталина (19) составила 71%, выход пропилового эфира 1-нафталинкарбоновой кислоты (1в) - 39%, 2-нафталинкарбоновой кислоты (2в) - 32%; за 12 ч (пример 9) конверсия - 44%, выход пропилового эфира 1-нафталинкарбоновой кислоты (1в) - 23%, 2-нафталинкарбоновой кислоты (2в) - 17%.
ПРИМЕРЫ 10-14. Получение пропиловых эфиров 1- и 2-нафталинкарбоновых кислот (1в, 2в).
Аналогично примеру 1, за исключением соотношения катализатора и реагентов: [Fe0]:[ацетилацетон]:[нафталин]:[CCl4]:[н-пропанол]=5:5:100:100:100 (пример 10) - конверсия исходного нафталина (19) составила 30%, выход пропилового эфира 1-нафталинкарбоновой кислоты (1в) - 30%; при соотношении [Fe0]: [ацетилацетон]:[нафталин]:[CCl4]:[н-пропанол]=5:5:100:300:300 (пример 11) - конверсия составила 50%, выход пропилового эфира 1-нафталинкарбоновой кислоты (1в) - 35%, 2-нафталинкарбоновой кислоты (2в) - 15%; при соотношении [Fe0]: [ацетилацетон]: [нафталин]: [CCl4]:[н-пропанол]=5:5:100:1000:500 (пример 12) - конверсия нафталина (19) составила 40%, выход пропилового эфира 1-нафталинкарбоновой кислоты (1в) - 26%, 2-нафталинкарбоновой кислоты (2в) - 13%; при соотношении [Fe0]:[ацетилацетон]:[нафталин]:[CCl4]: [н-пропанол]=5:5:100:500:500 (пример 13) - конверсия нафталина (19) составила 75%, выход пропилового эфира 1-нафталинкарбоновой кислоты (1в) - 45%, 2-нафталинкарбоновой кислоты (2в) - 23%, выход 1,5-дипропилового эфира 1,5-нафталиндикарбоновой кислоты составил 7%; при соотношении [Fe0]:[ацетилацетон]:[нафталин]:[CCl4]:[н-пропанол]=5:5:100:500:1000 (пример 14) - конверсия исходного нафталина (19) составила 46%, выход пропилового эфира 1-нафталинкарбоновой кислоты (1в) - 26%, 2-нафталинкарбоновой кислоты (2в) - 15%), а выход 2,6-дипропиловый эфира 2,6-нафталиндикарбоновой кислоты составил 5%.
ПРИМЕР 15. Получение этиловых эфиров 1- и 2-нафталинкарбоновых кислот (16,26).
Реакцию проводили в стеклянной ампуле объемом 10 мл, помещенной в микроавтоклав из нержавеющей стали объемом 17 мл, при постоянном перемешивании и регулируемом нагреве.
В ампулу в токе аргона загружали 2,2 мг (5 ммоль) Fe0 (мет.) (активированный HCl), 0,004 мл (5 ммоль) ацетилацетона, 102 мг (100 ммоль) нафталина, 0,77 мл (1000 ммоль) четыреххлористого углерода и 0,47 мл (1000 ммоль) этилового спирта. Запаянную ампулу помещали в автоклав, автоклав герметично закрывали и нагревали при 130°С в течение 6 ч при постоянном перемешивании. После окончания реакции автоклав охлаждали до комнатной температуры, ампулу вскрывали, реакционную массу нейтрализовали и фильтровали через бумажный фильтр. Растворитель отгоняли, остаток перегоняли под вакуумом. Конверсия исходного нафталина (19) составила 30%, выход этилового эфира 1-нафталинкарбоновой кислоты (16) - 16%, 2-нафталинкарбоновой (26)- 14%.
Строение полученных соединений доказано методами ЯМР, масс-спектрометрии.
Этиловый эфир 1-нафталинкарбоновой кислоты (16)
Ткип 165-166°С/10 Торр (Ср. лит. [30]: Ткип 310°С. Спектр ЯМР 13С (δ, м.д.): 14.40 (СН3), 61.04 (CH2O), 125.27(С3), 126.17(С6), 126.60(С7), 127.44(С8), 128.16(С5). 129.33(С1), 130.11(С2), 131.37(С9), 133.23 (С4), 133.85(С10), 167.59 (С=O). Спектр ЯМР 1Н (CDC13, δ, м.д.): 1.40 м (3Н, СН3 J 7.6 Гц), 4.4 кв (2Н, СН2СН3 J 3.7 Гц), 8.97 д (1Н, С2Н J 9 Гц), 7.63 д, д (1Н, С3Н J 7 Гц, 9 Гц), 8.21 д (1Н, С4Н J 7 Гц), 8 д (1Н, 7.7 С5Н J 8 Гц), 7,5 м (1Н, С6Н J 8 Гц), 7.5 м (1Н, С7Н J 8 Гц), 7.87 д (1Н, С8Н J 8 Гц).
Масс-спектр, m/z (Iотн (%)): 200.10 [М]+(71), 172 (15), 156 (17), 155 (100), 127 (68), 126(13).
Этиловый эфир 2-нафталинкарбоновой кислоты (26)
Тплав 31-33°С (Ср. лит. [30]: Тплав 32°С. Спектр ЯМР 13С (δ, м.д.): 14.40 (СН3), 61.10 (СН3СН2), 124.50(С6), 125.27(С3), 126.60(С10), 127.44(С4), 127.76(С7), 128.16(С5), 128.55(С1), 130.96(С8), 131.37(С9), 133.85(С2), 167.59 (С=O). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 1.37 м (3Н, СН3 J 7.6 Гц), 4.4 кв (2Н, СН2СН3 J 3.8 Гц), 7.63 д (1Н, С3Н J 7 Гц), 8.2 д (1H, С4Н J 7 Гц), 7.8 д (1Н, С5Н J 8 Гц), 7.5 м (1Н, С6Н J 8 Гц), 7.4 м (1H, С7Н J 8 Гц), 7.8 м (1Н, С8Н J 8 Гц), 8.5 с (1Н, С1Н)
Масс-спектр, m/z (Iотн (%)): 200.10 [М]+(65), 186 (46), 156 (16), 155 (100), 126(14), 44 (24).
ПРИМЕРЫ 16-17. Получение этиловых эфиров 1- и 2-нафталинкарбоновых кислот (16,26).
Аналогично примеру 15 за исключением количества взятого катализатора: [Fe0]: [ацетилацетон]:[нафталин]:[ССl4]:[этанол]=10:5:100:1000:1000 (пример 16) - конверсия исходного нафталина (19) составила 48%, выход этилового эфира 1-нафталинкарбоновой кислоты (16) - 38%, 2-нафталинкарбоновой (26) - 10%; при соотношении [Fe0]:[ацетилацетон]:[нафталин]:[CCl4]:[этанол]=50:5:100:1000:1000 (пример 17) - конверсия составила 90%, выход этилового эфира 1-нафталинкарбоновой кислоты (16) - 65%, 2-нафталинкарбоновой (26) - 6%. Выход 1,5-диэтилового эфира 1,5-нафталиндикарбоновой кислоты (36) - 14%, 2,6-диэтилового эфира 2,6-нафталиндикарбоновой кислоты (46) - 5%. Диэтиловый эфир 1,5-нафталиндикарбоновой кислоты (36)
Спектр ЯМР 13С (δ, м.д.): 14.37 (СН3), 61.22 (CH2O), 126.17 (С4), 126.17 (С8), 126.60(С3), 126.60 (С7), 131.37(С2), 131.37 (С6), 133.23 (С9), 133.23 (С10), 133.85(С1), 133.85 (С5), 167.57 (СОО). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 1.40 м (3Н, СН3 J 15.3 Гц), 4.3 кв (2Н, СН2СН3 J 4.3 Гц), 9.1 д (2Н, С2,6Н J 9 Гц), 7.6 д, д (1Н, С3Н J 7 Гц, 9 Гц), 7,65 м (1Н, С7Н, 8 Гц), 8.28 д (2Н, С4,8Н J 7 Гц).
Диэтиловый эфир 2,6-нафталиндикарбоновой кислоты (46)
Спектр ЯМР 13С (δ, м.д.): 14.34 (СН3), 61.25 (CH2O), 130.56 (С4), 130.56 (С8), 127.66(С3), 127.66 (С7), 133.23 (С2), 133.23 (С6), 133.85 (С9), 133.85 (С10), 130.96(С1), 130.96 (С5), 167,59 (СОО). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 1.35 м (3Н, СН3 J 15.3 Гц), 4.4 кв (2Н, СН2СН3 J 7.6 Гц), 8.6 с (2Н, С1,5Н), 8.71 д (2Н, С3,7Н J 8 Гц), 7.95 д (1Н, С4Н J 8 Гц), 7.98 д (1Н, С8Н J 8 Гц).
ПРИМЕР 18. Получение метиловых эфиров 1- и 2-нафталинкарбоновых кислот (1а, 16).
В ампулу в токе аргона загружали 2,2 мг (5 ммоль) Fe0 (мет.) (активированный HCl), 0,004 мл (5 ммоль) ацетилацетона, 102 мг (100 ммоль) нафталина, 0,77 мл (1000 ммоль) четыреххлористого углерода и 0,32 мл (1000 ммоль) метилового спирта. Запаянную ампулу помещали в автоклав, автоклав герметично закрывали и нагревали при 130°С в течение 6 ч при постоянном перемешивании. После окончания реакции автоклав охлаждали до комнатной температуры, ампулу вскрывали, реакционную массу нейтрализовали и фильтровали через бумажный фильтр. Растворитель отгоняли, остаток перегоняли под вакуумом. Конверсия исходного нафталина (19) составила 34%, выход метилового эфира 1-нафталинкарбоновой кислоты (1а) - 23%, 2-нафталинкарбоновой (2а) - 10%.
Строение полученных соединений доказано методами ЯМР, масс-спектрометрии.
Метиловый эфир 1-нафталинкарбоновой кислоты (1а)
Ткип 155-157°С/10 Торр (Ср. лит. [30]: Ткип 165°С/17 Торр). Спектр ЯМР 13С (δ, м.д.): 52.19 (CH3), 126.27 (С6), 125.34 (С3), 126.39 (С7), 127.19 (С8), 128.36 (С5), 128.77(С1), 130.44 (С2), 132.59 (С9), 132.69 (С4), 133.47 (С10), 167.32(СОО). Спектр ЯМР 1Н (CDC13, δ, м.д.): 3.99 с (3Н, СН3), 8.7 д (1Н, С2Н J 9 Гц), 7.69 д, д (1Н, С3Н J 7 Гц, 9 Гц), 8.23 д (1Н, С4Н J 7 Гц), 8.00 д (1Н, C5H J 8 Гц), 7.5 м (1Н, С6Н J 7 Гц), 7.58 м (1Н, С7Н J 7 Гц), 7.9 д (1Н, С8Н J 8 Гц).
Масс-спектр, m/z (Iотн (%)): 186.17 [М]+(69), 155 (100), 127 (81), 126 (15), 77(10), 75(5).
Метиловый эфир 2-нафталинкарбоновой кислоты (16)
Тплав 76-78°С (Ср. лит. [30]: Тплав 77°С. Спектр ЯМР 13С (δ, м.д.): 52.28 (СН3), 125.34 (С6), 125.43 (С3), 126.80 (С10), 127.19 (С4), 127.88 (С7), 128.68 (С5), 129.40(С1), 131.16 (С8), 132.59 (С9), 135.57 (С2), 167.90 (СОО).
Спектр ЯМР 1Н (CDCl3, δ, м.д.): 3.93 с (3Н, СН3), 7,7 д (1Н, С3Н J 7 Гц), 8.19 д (1H, С4Н J 7 Гц), 7.83 д (1H, С5Н J 8 Гц), 7.48 м (1Н, C6H J 7 Гц), 7.4 м (1Н, C7H J 7 Гц), 7.8 д (1Н, С8Н J 8 Гц), 8.6 с (1Н, С1Н).
Масс-спектр, m/z (1отн (%)): 186.17 [М]+(69), 155 (100), 127 (80), 126 (15), 40(16).
ПРИМЕРЫ 19-21. Получение метиловых эфиров 1- и 2-нафталинкарбоновых кислот (1а, 2а).
Аналогично примеру 18 за исключением количества взятого катализатора: [Fe0]:[ацетилацетон]:[нафталин]:[CCl4]:[метанол]=10:5:100:1000:1000 (пример 19) - конверсия исходного нафталина (19) составила 36%, выход метилового эфира 1-нафталинкарбоновой кислоты (1а) - 27%, 2-нафталинкарбоновой (2а) - 11%; при соотношении [Fe0]: [ацетилацетон]:[нафталин]:[CCl4]:[метанол]=20:5:100:1000:1000 (пример 20) - конверсия составила 48%, выход метилового эфира 1-нафталинкарбоновой кислоты (1а) - 36%, 2-нафталинкарбоновой (2а) - 12%; при соотношении [Fe0]:[ацетилацетон]:[нафталин]:[CCl4]: [метанол]=50:5:100:1000:1000 (пример 21) - конверсия нафталина (19) составила 50%, выход метилового эфира 1-нафталинкарбоновой кислоты (1а) - 36%, 2-нафталинкарбоновой (2а) - 14%.
Другие примеры, подтверждающие способ приведены в таблице 1.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ЭФИРОВ ЛЕВУЛИНОВОЙ КИСЛОТЫ | 2006 |
|
RU2319690C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛКИЛОВЫХ ЭФИРОВ ГИДРОКСИБЕНЗОЙНЫХ КИСЛОТ | 2017 |
|
RU2675496C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛКИЛОВЫХ ЭФИРОВ ФЕНАНТРЕН-9-КАРБОНОВОЙ КИСЛОТЫ | 2014 |
|
RU2566086C1 |
| СПОСОБ ПОЛУЧЕНИЯ АМИДОЭФИРОВ ЩАВЕЛЕВОЙ КИСЛОТЫ | 2023 |
|
RU2813338C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2- И 2,3-ЗАМЕЩЕННЫХ ХИНОЛИНОВ | 2012 |
|
RU2504540C2 |
| СПОСОБ ПОЛУЧЕНИЯ АЛКИЛОВЫХ ЭФИРОВ МЕТОКСИБЕНЗОЙНЫХ КИСЛОТ | 2016 |
|
RU2640206C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ ХИНОЛИНОВ ИЗ АНИЛИНА, 1,2-ДИОЛОВ И ССl ПОД ДЕЙСТВИЕМ ЖЕЛЕЗОСОДЕРЖАЩИХ КАТАЛИЗАТОРОВ | 2015 |
|
RU2614251C2 |
| СПОСОБ ПОЛУЧЕНИЯ АЛКИЛОВЫХ ЭФИРОВ 4-БИФЕНИЛКАРБОНОВОЙ КИСЛОТЫ | 2016 |
|
RU2640205C1 |
| ВОДОРАСТВОРИМОЕ ПРОИЗВОДНОЕ ХЛОРОФИЛЛА α, МОДИФИЦИРОВАННОЕ ФРАГМЕНТОМ МИРИСТИНОВОЙ КИСЛОТЫ | 2017 |
|
RU2680523C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ ХИНОЛИНОВ ИЗ АНИЛИНА, 1,3-ДИОЛОВ И CCl4 ПОД ДЕЙСТВИЕМ ЖЕЛЕЗОСОДЕРЖАЩИХ КАТАЛИЗАТОРОВ | 2013 |
|
RU2561503C2 |
Изобретение относится к области органической химии, в частности к способу получения алкиловых эфиров 1- и 2-нафталинкарбоновых кислот, которые используются в синтезе гербицидов, гормонов роста растений, красителей, фотоматериалов и полимеров. Способ получения соединений формулы (1а-в) или (2а-в), в которой R=CH3, C2H5, н-C3H7, заключается в том, что нафталин подвергают взаимодействию с CCl4 и спиртом (метанол, этанол, н-пропанол) в присутствии металлического железа, активированного НСl, и ацетилацетона при мольном соотношении [Fe0(мет.)]:[ацетилацетон]:[нафталин]:[CCl4]:[спирт]=5-50:5:100:100-1000:100-1000, при температуре 130°С в течение 4-12 ч в атмосфере аргона. Общий выход алкиловых эфиров 1- и 2-нафталинкарбоновых кислот достигает 75%.
1 табл., 21 пр.
Способ получения алкиловых эфиров 1- и 2-нафталинкарбоновых кислот формулы
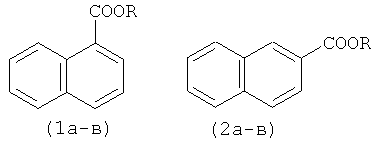
R=CH3, C2H5, н-C3H7,
отличающийся тем, что нафталин подвергают взаимодействию с CCl4 и спиртом (метанол, этанол, н-пропанол) в присутствии металлического железа, активированного НСl, и ацетилацетона при мольном соотношении [Fe0(мет.)]:[ацетилацетон]:[нафталин]:[CCl4]:[спирт]=5-50:5:100:100-1000:100-1000, при температуре 130°С в течение 4-12 ч в атмосфере аргона.
| Screttas, Constantinos G | |||
| et al | |||
| "The tert-butyl chloride-lithium naphthalene radical anion and tert-butyllithium-naphthalene systems | |||
| Mechanism of metalation" Journal of Organometallic Chemistry, 556(1-2), 243, 1998 | |||
| Morley, James A | |||
| et al | |||
| "Metal arene complexes in organic synthesis | |||
| Hydroxylation, trimethylsilylation, and carbethoxylation of |
Авторы
Даты
2014-12-27—Публикация
2012-07-31—Подача