Изобретение относится к медицине, а именно к биохимическим исследованиям биологических объектов, и может найти применение в диагностике злокачественных, вирусных и наследственных заболеваний.
В основе существующих в настоящее время коммерческих наборов для выделения ДНК из эукариотических клеток, включая человека, лежит обратимая сорбция молекул ДНК на частицах синтетического силикагеля в буферах, содержащих высокие концентрации йодистого натрия, перхлората натрия или гуанидинтиоцианата [Proc. Natl. Acad. Sci. 1979, v. 76, 615-619, 2; Nucl. Acids Res. 1990, v. 18, 1074].
Так, в качестве сорбционного буфера в наборе для выделения ДНК ″Geneclean″ компании BIO 101 используется йодистый натрий. В состав данного набора входят следующие компоненты: 6 М раствор йодистого натрия, суспензия сорбента Glassmilk и отмывочный буфер, состоящий из хлористого натрия, Трис-HCl, Трилона Б, этилового спирта и воды [The Geneclean Kit. 1989. BIO 101 Inc., Release 7]. Этот набор используется для выделения ДНК плазмид из бактерий и агарозных гелей. Качество выделяемой ДНК соответствует стандарту. Однако наличие в наборе йодистого натрия, способного необратимо связывать ДНК с сорбентом, приводит к ее потерям при выделении, а остаточная примесь йодистого натрия может ингибировать активность ферментов, используемых для последующей модификации ДНК.
Известен также набор для выделения ДНК ″Prep-A-Gene″ компании Bio-Rad, в состав которого входят следующие компоненты: 6 М раствор йодистого натрия в качестве связывающего буфера, суспензия сорбента в растворе 6 М перхлората натрия и отмывочный буфер [Prep-A-Gene DNA Purification Kit. 1990. Bio-Rad Laboratories, Bulletin 1541]. Данный набор используется для выделения плазмидной ДНК и извлечения фрагментов ДНК из агарозных гелей. Однако ценность набора снижается вследствие использования в нем йодистого натрия и перхлората натрия, остаточные примеси которых могут ингибировать активность ферментов-модификаторов ДНК.
Подавляющее большинство коммерческих наборов основано на использовании в качестве лизирующего и связывающего агента гуанидинтиоцианата [Lab. Times. 2005, 5: 51-58].
Общим недостатком наборов для выделения ДНК на основе гуанидинизотиоцианата является то, что малейшие остаточные примеси этого агента в элюируемой по протоколу ДНК ингибируют активность ферментов, используемых для последующей модификации ДНК, включая полимеразную цепную реакцию, что существенно снижает ценность данных наборов.
Для устранения этого недостатка нами ранее был разработан набор для выделения ДНК [Патент №2116795 на изобретение «Набор для выделения ДНК». Зарегистрирован 10 августа 1998 г. C07H 21/04] на основе ингредиентов, остаточные примеси которых не ингибируют активность ферментов. Этот набор взят нами в качестве прототипа.
Набор состоит из лизирующего буфера, состоящего из 3-10 М раствора мочевины, связывающего буфера, состоящего из 2,5-5 М хлористого натрия, отмывочного буфера, состоящего из 80%-ного этилового спирта, элюирующего буфера, состоящего из 10 мМ Трис-HCl, 1 мМ Трилона Б с pH 8 и сорбента, состоящего из 50%-ной водной суспензии силикагеля.
Использование в наборе мочевины и хлористого натрия, обладающих мягким денатурирующим действием и легко отмываемых от сорбента, обеспечило высокое качество получаемой ДНК и уменьшило ингибирующий эффект на ферменты модификации ДНК остаточных примесей компонентов используемых буферов. Это обусловлено тем, что мочевина и хлористый натрий, широко применяемые при выделении нативных белков, являются физиологичными и не привносят в процесс выделения ДНК иных компонентов.
Как и в подавляющем большинстве коммерческих наборов, в прототипе в качестве сорбента для ДНК использовался синтетический аморфный силикагель. Однако, в процессе длительного использования этого набора для выделения ДНК, а также других коммерческих наборов, сорбирующим компонентом которых являются частицы синтетического аморфного силикагеля, обнаружены следующие недостатки: во-первых, в зависимости от партии используемого аморфного силикагеля его сорбционные свойства различаются, что существенно сказывается на воспроизводимости результатов, особенно это касается количественной полимеразной цепной реакции; во-вторых, вариации пористости различных партий синтетического аморфного кремнезема приводят к вариациям примесей компонентов ингредиентов буферов набора в конечном препарате ДНК и, соответственно, к вариациям активности ферментов модификации ДНК; в-третьих, шарообразная поверхность синтетических частиц силикагеля обладает минимальной сорбционной способностью в отношении выделяемых молекул ДНК. Это ограничивает их применение в диагностических целях, особенно в области количественной полимеразной цепной реакции.
Технический результат настоящего изобретения состоит в повышении выхода ДНК, чистоты ДНК и более высокой молекулярной массы выделяемой ДНК.
Этот результат достигается тем, что в известном наборе выделения ДНК, состоящем из лидирующего буфера на основе 3-10 М раствора мочевины, связывающего буфера на основе 2,5-5 М хлористого натрия, промывочного - на основе 80% этанола, элюирующего - на основе 10 мМ Трис-HCl и 1 мМ Трилона Б с pH 8, согласно изобретению, в качестве сорбента используют кристаллический кварцевый песок с размером частиц 10-50 мкм.
В процессе многолетних исследований и сравнительного анализа сорбционной способности различных форм двуокиси кремния, а также соединений кремния, как синтетических, так и природного происхождения, нами было выяснено, что частицы природной кристаллической формы двуокиси кремния - кварцевого песка лишены всех вышеперечисленных недостатков, а именно: недостаточно высокой сорбционной емкости ДНК, недостаточной прочности связи ДНК с сорбентом, а также различий сорбционной емкости ДНК различных партий силикагелей. Причиной этого являются следующие свойства кристаллической формы двуокиси кремния: 1 - компактная регулярная кристаллическая решетка кварца обладает минимальным количеством микропор и, как следствие, привносит минимальные загрязнения ингредиентами набора в искомой ДНК; 2 - более высокий отрицательный заряд поверхности частиц кварца по сравнению с аморфным силикагелем приводит к более прочному связыванию молекул ДНК с частицами и, соответственно, обеспечивает меньшие потери ДНК в процессе процедур сорбции и отмывки ДНК на частицах; 3 - кристаллический кварц с частицами нерегулярной формы по сравнению с шарообразными частицами аморфного кремнезема имеет большую поверхность и, соответственно, большую емкость в отношении выделяемой ДНК. Следует отметить также, что стоимость кристаллического кварцевого песка во много раз ниже стоимости синтетического аморфного силикагеля. Все это приводит к тому, что использование набора для выделения ДНК на основе кристаллического кварцевого песка может быть более эффективным по сравнению как с прототипом, так и аналогичными коммерческими наборами.
Использование в наборе лизирующего буфера на основе мочевины позволяет исключить гуанидинтиоцианат и тем самым предотвратить ингибирование активности ферментов, используемых для последующей модификации ДНК.
Использование в качестве связывающего буфера хлористого натрия позволило исключить из набора перхлорат натрия, который, как и гуанидинтиоцианат, является ингибитором активности ферментов.
Использование кристаллического кварцевого песка (ГОСТ 22551-77, марка ООВС-010-В: «Кварцевый песок и жильный кварц, обогащенные и высшего сорта») с размером частиц 10-50 мкм в качестве сорбента обеспечивает высокую чистоту выделяемой ДНК за счет того, что кристаллический кварц обладает более высоким отрицательным зарядом поверхности по сравнению с аморфным силикагелем, что обеспечивает более высокую сорбционную емкость в отношении ДНК, а меньшая пористость кристаллов кварца по сравнению с частицами силикагеля обеспечивает более высокую эффективность удаления остаточных примесей используемых в процессе буферов, что, в конечном счете, обеспечивает более высокую чистоту искомого препарата ДНК.
Состав набора для выделения ДНК:
Набор состоит из 4-х буферов и сорбента, каждый из которых находится в отдельной пробирке и добавляется отдельно в реакционную смесь в соответствии с нижеприведенной методикой выделения ДНК, а также инструкции по выделению ДНК. Пробирки с ингредиентами набора находятся в картонной коробке с ячейками для их вертикального расположения.
Набор имеет следующий состав:
Лизирующий буфер (4 М раствор мочевины) - 1 мл;
Связывающий буфер (2.5 М раствор хлористого натрия) - 3 мл;
Отмывочный буфер (80% раствор этилового спирта) - 15 мл;
Элюирующий буфер (10 мМ Трис-HCl и 1 мМ Трилона Б с рН 8) -1,2 мл; Сорбент (50% суспензия кварцевого песка ГОСТ 22551-77, марка ООВС-01 О-В: «Кварцевый песок и жильный кварц, обогащенные и высшего сорта») с размером частиц 10-50 мкм в растворе 2.5 М хлористого натрия) - 1 мл.
Примеры использования набора.
Пример 1.
Для иллюстрации получения геномной ДНК приводим пример №1 - выделение ДНК из клеток крови человека с использованием данного набора.
Осадок белых клеток крови, полученных из 1 мл цельной крови, растворяли в 20 мкл лизисного буфера, после чего добавляли 100 мкл связывающего буфера, смесь перемешивали и добавляли 30 мкл суспензии сорбента, вновь перемешивали и оставляли на 10 мин при комнатной температуре, после чего добавляли 0,5 мл отмывочного буфера, перемешивали и центрифугировали при 5000 об/мин в течение 1 мин. Супернатант тщательно отбирали и отбрасывали, а к осадку добавляли 30 мкл элюирующего буфера, смесь пипетировали и помещали на 20 мин в водяную баню при +60°C, после чего центрифугировали при 5000 об/мин в течение 1 мин. Отбирали содержащий ДНК супернатант и измеряли концентрацию ДНК с помощью флуориметра. Выход обычно составлял 15-20 мкг ДНК из 1 мл крови, что соответствует максимальной величине. Степень очистки ДНК от примесей белков определяли спектрофотометрически по величине отношения А260/А280, которое было в пределах 1,8-2,0, что соответствует стандарту. Нативность ДНК и ее способность служить субстратом для ферментов модификации контролировали с помощью электрофореза в 0,8% агарозе, окрашивание ДНК осуществляли бромистым этидием (0,5 мкг/мл), фотографировали электрофореграммы в УФ-свете с использованием оранжевого фильтра.
Качество искомой ДНК проиллюстрировано электрофореграммами выделенной геномной ДНК и продуктов ее расщепления ферментами рестрикции, широко используемыми в молекулярной диагностике. На рис.1 приведены результаты выделения ДНК из клеток крови с использованием набора на основе аморфного кремнезема (прототип) (дорожка 1) и данного набора (дорожка 2). В качестве маркеров молекулярной массы использовали ДНК фага лямбда (дорожка М) и ДНК-лестницу из дрожжей (дорожка М′). Как видно из рис.1, выход геномной ДНК выше при использовании набора на основе кристаллического кварца (дорожка 2), чем при использовании аналогичного набора на основе аморфного кремнезема (дорожка 1), о чем свидетельствует сравнение интенсивности сигналов окрашенных бромистым этидием полосок ДНК на электрофореграмме. На рис.1 также видно, что молекулярная масса ДНК, полученной с помощью набора на основе кристаллического кварца (дорожка 2), в 2 раза больше, чем при использовании аналогичного набора на основе аморфного кремнезема (дорожка 1), о чем свидетельствует более низкая электрофоретическая подвижность искомой ДНК относительно маркеров молекулярной массы (дорожки М и М′).
Количественный анализ выхода искомой ДНК в трех независимых выделениях ДНК из образцов крови с флуоресцентным измерением количества ДНК на приборе DyNa Quant 200 (компания GE) показал, что выход ДНК с использованием набора на основе кристаллического кварца был на 30-40% выше, чем в случае использования аналогичного набора на основе аморфного кремнезема.
Ключевым физико-химическим параметром, определяющим величину и прочность связывания ДНК с сорбентом, является величина поверхностного заряда частиц. Поэтому мы сравнили величину поверхностного заряда частиц кварца и кремнезема. Величины поверхностного заряда частиц кварца, входящего в состав данного набора, и аморфного силикагеля, являющегося компонентом коммерческих наборов для выделения ДНК, определяли как величину дзетта-потенциала с помощью прибора Zetasizer Nano ZS (компания Malvern). Величина дзетта-потенциала частиц кварца составила -50,9 мВт, а для трех партий аморфного кремнезема эта величина составила -13,6, -14,8 и -16,5 мВт соответственно, то есть величина дзетта-потенциала поверхности частиц кристаллического кварца кремнезема была более чем в три раза выше, чем у аморфного кремнезема, что и определяет более высокую сорбирующую способность частиц кварца в отношении ДНК.
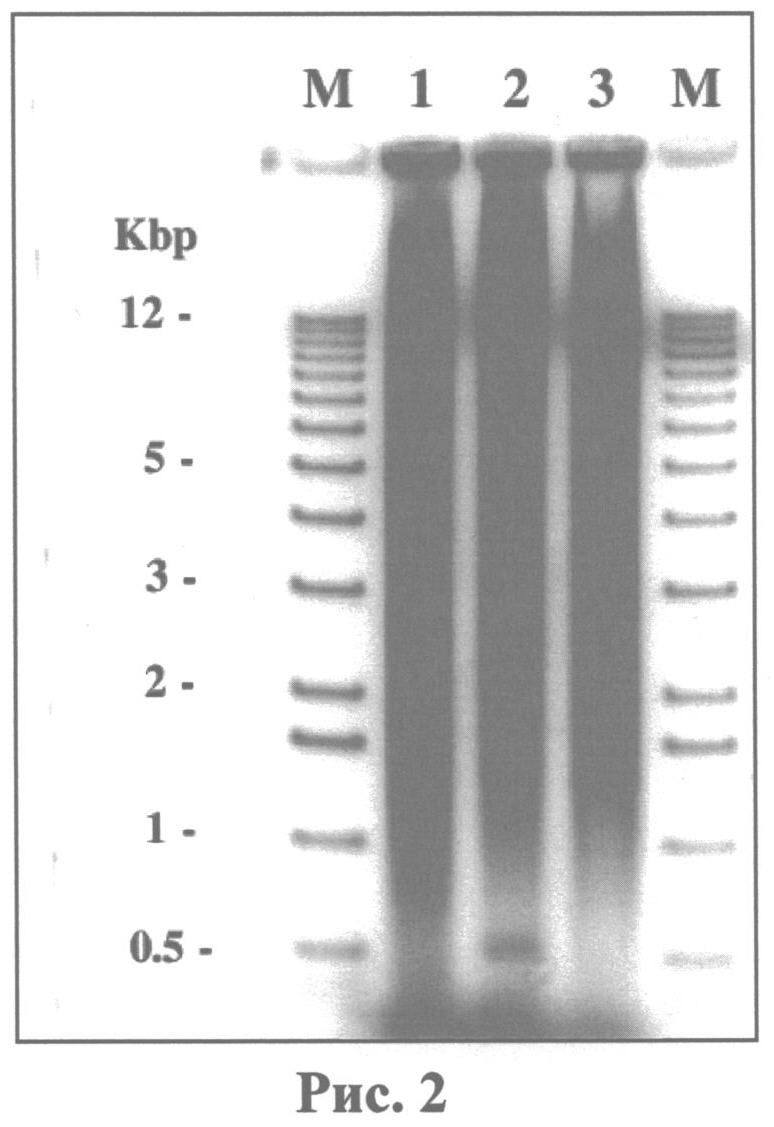
Важнейшим критерием чистоты, полученной с помощью набора ДНК, является ее способность служить субстратом для ферментов модификации ДНК, используемых в молекулярной диагностике. В качестве контроля качества искомой ДНК использовали ее ферментативный гидролиз тремя рестрикционными энданиклеазами. На рис.2 представлены результаты гидролиза ДНК следующими эндонуклеазами - EcoRI (дорожка 1), BamHI (дорожка 2) и HindIII (дорожка 3). Каждый фермент был добавлен в количестве 1 единица на 1 мкг ДНК, инкубацию проводили при +37°C в течение 12 ч, анализ гидролизатов ДНК проводили в 0,8% агарозе, окрашивание ДНК осуществляли бромистым этидием (0,5 мкг/мл), фотографировали электрофореграммы в УФ-свете с использованием оранжевого фильтра. В качестве маркера молекулярной массы использовали ДНК-лестницу с шагом 1000 пар нуклеотидов (дорожки М). Как показал ферментативный гидролиз геномной ДНК тремя рестрикционными энданиклеазами, искомая ДНК является прекрасным субстратом для эндонуклеаз.
Как видно из приведенных примеров, предлагаемый набор обеспечивает высокий выход ДНК, на 30-40% превышающий прототип и другие коммерческие наборы, а также высокую степень чистоты ДНК, что позволяет использовать ее в медицинской практике для диагностических целей.
Предлагаемый набор, по сравнению с известными, имеет ряд существенных преимуществ.
1. Использование кристаллического кварца обеспечивает получение более высокого выхода препаратов ДНК по сравнению с прототипом.
2. Использование кристаллического кварца обеспечивает получение более высококачественных препаратов ДНК с более высокой молекулярной массой по сравнению с прототипом.
3. Компоненты набора являются физиологичными, обладают мягким денатурирующим действием, легко отмываются от сорбента и тем самым обеспечивают высокое качество получаемой ДНК и отсутствие остаточных примесей используемых буферов, что не может обеспечить ни один из известных наборов.
4. Набор состоит из легко доступных, нетоксичных компонентов и является наиболее дешевым из известных наборов для этих целей.
Набор разработан автором в лаборатории генной инженерии Федерального государственного бюджетного учреждения «Российский научный центр радиологии и хирургических технологий» Министерства здравоохранения Российской Федерации, прошел лабораторные исследования в НИИ особочистых биопрепаратов (г. Санкт-Петербург), институте акушерства и гинекологии им. Отто (г. Санкт-Петербург), НИИ вирусологии им. Д.И. Иваницкого (г. Москва) и готов к внедрению в широкую медицинскую практику.
| название | год | авторы | номер документа |
|---|---|---|---|
| НАБОР ДЛЯ ВЫДЕЛЕНИЯ ДНК | 1996 |
|
RU2116795C1 |
| Набор для выделения ДНК | 2020 |
|
RU2753768C1 |
| СМЕННЫЙ МИКРОФЛЮИДНЫЙ МОДУЛЬ ДЛЯ АВТОМАТИЗИРОВАННОГО ВЫДЕЛЕНИЯ И ОЧИСТКИ НУКЛЕИНОВЫХ КИСЛОТ ИЗ БИОЛОГИЧЕСКИХ ОБРАЗЦОВ И СПОСОБ ВЫДЕЛЕНИЯ И ОЧИСТКИ НУКЛЕИНОВЫХ КИСЛОТ С ЕГО ИСПОЛЬЗОВАНИЕМ | 2008 |
|
RU2380418C1 |
| СПОСОБ АВТОМАТИЗИРОВАННОГО ВЫДЕЛЕНИЯ С ОДНОВРЕМЕННОЙ ОЧИСТКОЙ НУКЛЕИНОВЫХ КИСЛОТ ИЗ НЕСКОЛЬКИХ БИОЛОГИЧЕСКИХ ОБРАЗЦОВ | 2014 |
|
RU2595374C2 |
| Универсальный способ выделения ДНК и лизирующая смесь для его осуществления | 2022 |
|
RU2807254C1 |
| МАГНИТНЫЙ СОРБЕНТ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И СПОСОБ ВЫДЕЛЕНИЯ МОЛЕКУЛ НУКЛЕИНОВЫХ КИСЛОТ | 2017 |
|
RU2653130C1 |
| Способ выделения целевых фрагментов ДНК из многокомпонентной смеси | 2024 |
|
RU2832884C1 |
| СПОСОБЫ И НАБОРЫ РЕАГЕНТОВ ДЛЯ ГЕНАМПЛИФИКАЦИОННОЙ ДИАГНОСТИКИ МЕТОДАМИ ПЦР И РНК-ПЦР | 2000 |
|
RU2164532C1 |
| АВТОМАТИЗИРОВАННЫЙ ПРИБОР ДЛЯ ВЫДЕЛЕНИЯ, ОЧИСТКИ И АНАЛИЗА НУКЛЕИНОВЫХ КИСЛОТ МЕТОДОМ ПЦР-РВ | 2020 |
|
RU2784821C2 |
| СПОСОБ И НАБОР ДЛЯ ОБНАРУЖЕНИЯ БАКТЕРИЙ РОДА CAMPYLOBACTER У БОЛЬНЫХ С ВОСПАЛИТЕЛЬНЫМИ ЗАБОЛЕВАНИЯМИ КИШЕЧНИКА | 2019 |
|
RU2732923C1 |

Изобретение относится к медицине, а именно к биохимическим исследованиям биологических объектов. Набор состоит из лизирующего буфера на основе 3-10 М раствора мочевины, связывающего буфера на основе 2,5-5 М хлористого натрия, элюирующего буфера на основе раствора 10 мМ Трис-HCl и 1 мМ Трилона Б с pH 8 и 80% этилового спирта в качестве отмывочного буфера. При этом в качестве сорбента набор включает кварцевый песок с размером частиц 10-50 мкм. Набор позволяет выделять ДНК из биологических объектов с высоким выходом, высокой степенью чистоты и высокой молекулярной массой выделяемой ДНК. 2 ил., 1 пр.
Набор для выделения ДНК, состоящий из лизирующего буфера на основе 3-10 М раствора мочевины, связывающего буфера на основе 2,5-5 М хлористого натрия, промывочного буфера на основе 80% этанола, элюирующего буфера на основе 10 мМ Трис-HCl и 1 мМ Трилона Б с pH 8, и сорбента, отличающийся тем, что в качестве сорбента ДНК он содержит кристаллический кварцевый песок с размером частиц 10-50 мкм.
| НАБОР ДЛЯ ВЫДЕЛЕНИЯ ДНК | 1996 |
|
RU2116795C1 |
| CN 0101709298 B 27.05.2009 | |||
| Способ получения фиолетового метилового | 1929 |
|
SU26391A1 |
| Устройство для включения счетчиков в автоматических телефонных установках | 1926 |
|
SU15648A1 |
Авторы
Даты
2015-01-10—Публикация
2013-11-11—Подача