Изобретение относится к искусственным полиэпитопным конструкциям, включающим Т-клеточные эпитопы, выбранные из ряда иммунодоминантных антигенов Mycobacterium tuberculosis, и может быть использовано в молекулярной биологии, генетической инженерии и медицине, в частности в иммунологии, вакцинологии и клеточной терапии как основной компонент профилактической или терапевтической вакцины нового поколения для борьбы с таким тяжелым заболеванием человека, как туберкулез.
В настоящее время около трети всего человечества заражено туберкулезом. Ежегодно выявляется около 8-9 миллионов человек с активным туберкулезом. Каждый год от туберкулеза умирает около 1.5 миллионов человек. В 2006 году зарегистрировано 9.2 миллиона новых случаев инфекции и 1.2 миллиона человек умерли от туберкулеза (WHO Report 2008: Global Tuberculosis Control - surveillance, planning, financing), в 2007 году: 9.27 и 1.8 миллионов, соответственно (WHO Report 2009: Global Tuberculosis Control - epidemiology, strategy, financing). Кроме того, в настоящее время все большее распространение получают лекарственно-устойчивые формы туберкулеза, в том числе формы со множественной (MDR - multiple-drug-resistant) и широкой лекарственной устойчивостью (XDR - extensively drug-resistant). Доля MDR среди всех выявленных в 2008 году новых случаев туберкулеза составила около 2.9 %, т.е. она была практически в три раза выше, чем в 2004 году. В бывших советских республиках доля MDR среди новых выявленных случаев туберкулеза достигла 22 % (WHO 2008, Antituberculosis drug resistance in the world: fourth global report). На февраль 2008 года XDR туберкулез был зарегистрирован в 45 странах: доля форм с широкой лекарственной устойчивостью доходит до 10-20 % (и даже до 30 %) от всех форм со множественной лекарственной устойчивостью (Shenoi S. and Friedland G., 2008, Annu. Rev. Med., 60:307-320).
Лишь у 5-10% людей при инфекции развивается активный туберкулез. У большинства индивидуумов прогресс болезни эффективно подавляется иммунной системой (Barker L.F., 2009, Curr Opin Immunol, 21:331-338). У большинства из этих людей болезнь так и не разовьется, но примерно у 10 % из них при ослаблении организма неблагоприятными условиями жизни, другими инфекциями, развитием злокачественных новообразований или при реинфекции болезнь, не проявлявшая себя в течение многих лет, может реактивироваться. Риск развития активной формы туберкулеза очень сильно возрастает при заражении ВИЧ: у ВИЧ-инфицированных риск развития активной формы ТБ (при заражении Mycobacterium tuberculosis) составляет 5% в год (Hoft D.F. 2008, Lancet, 372:164-175; Barker L.F., 2009, Curr Opin Immunol, 21:331-338).
Для вакцинопрофилактики туберкулеза в настоящее время используется BCG - аттенуированный лабораторный штамм M. bovis. Однако эффективность данной вакцины сильно варьирует (от 40 до 80%). Заметно более эффективна вакцинация детей в раннем возрасте (до 90%). При вакцинации детей BCG они оказываются защищенными от развития милиарного туберкулеза и микобактериального менингита, но не от легочной инфекции в более позднем возрасте. Протективный иммунитет сохраняется на протяжении 12-15 лет, но ревакцинация оказывается неэффективной (Andersen P. and Doherty T.M., 2005, Nat Rev Microbiol, 3:656-662). Но вакцинация может оказаться не эффективной, если организм уже сенсибилизирован к микобактериальным антигенам, в ряде случаев при этом развивается Тх2-зависимый ответ, который не является протективным, и восприимчивость к инфекции усиливается. Кроме того, у индивидуумов с ослабленной иммунной системой BCG сама способна вызвать инфекцию.
В связи с увеличением случаев заражения лекарственно устойчивыми формами M. tuberculosis, с распространением ВИЧ все большее внимание уделяется развитию эффективных способов терапии туберкулеза, разработке профилактических и терапевтических вакцин и способов надежного диагностирования заболевания.
Многочисленные исследования показали, что важнейшую роль в развитии протективного иммунного ответа, направленного против M. tuberculosis, играют CD4+ Т-лимфоциты. У мышей, нокаутных по гену CD4, нарушено формирование гранулем, ограничивающих рост и распространение микобактерий (Ladel et al., 1995, Eur J Immunol, 25:377-384; Caruso et al., 1999, J Immunol, 162:5407-5416; Saunders et al., 2002, Cell Immunol, 216:65-72). Истощение популяции CD4+ Т-лимфоцитов перед заражением делает мышей крайне восприимчивыми к M. tuberculosis (Scanga et al., 2000, J Exp Med, 192:347-358; Cowley and Elkins, 2003, J. Immunol., 171:4689-4699). Адоптивный перенос CD4+ Т-лимфоцитов, специфичных к антигенам M. tuberculosis, защищает иммунологически наивных животных от инфекции (Feng and Britton, 2000, J Infect Dis, 181:1846-1849; Wangoo et al., 2001, J immunol, 166:3432-3439; Andersen and Smedegaard, 2000, 68:621-629). По мере развития инфекции все большую роль приобретают CD8+ Т-лимфоциты. Показано, что мыши, нокаутные по генам CD8 или MHC класса I, в высокой степени восприимчивы к инфекции M. tuberculosis (Flynn et al., 1992, PNAS, 89:12013-12017). Содержащийся в цитотоксических гранулах CD8+ Т-лимфоцитов гранулизин обладает бактерицидным действием, и поэтому CD8+ цитотоксические лимфоциты способны не только разрушать клетки, несущие микобактерии, но и убивать самих инфекционных агентов, в том числе и экстраклеточные бактерии (Stenger et al., 1998, Science, 282:121-125). На мышиной модели туберкулеза показано, что CD8+ цитотоксические лимфоциты играют существенную роль в предотвращении реактивации латентной инфекции (van Pinxteren et al., 2000, Eur J Immunol, 30:3689-3698).
Кроме того, важную роль в контроле за развитием инфекции играют Т-лимфоциты, рестриктированные CD1, и γ/δ-Т-клетки, распознающие небелковые антигены и липопротеины (Hoft D.F. 2008, Lancet, 372:164-175). В последнее время значительное внимание уделяется CD4+ Т-лимфоцитам, продуцирующим ИЛ-17, - так называемым, Тх17, роль которых в противостоянии организма M. tuberculosis представляется крайне важной (Cooper, 2009, Annu Rev Immunol, 27:393-422). Так, показано, что отсутствие Тх17 препятствует развитию вторичного иммунного ответа и приводит к большей восприимчивости организма к инфекции (Cooper, 2009, Annu Rev Immunol, 27:393-422; Khader and Cooper, 2008, Cytokine, 41:79-83).
Долгое время считалось, что гуморальный ответ не является протективным при туберкулезе из-за внутриклеточной локализации патогена. Однако показано, что введение микобактерий при экспериментальном туберкулезе одновременно с введением моноклональных антител к ManLAM или поверхностным белкам микобактерий вызывает усиленный фагоцитоз микобактериальных клеток, опсонизированных антителами через взаимодействие с Fc-рецепторами, что приводит к сильной активации макрофагов и быстрому уничтожению захваченных бактерий. Иммунизация животных ManLAM либо его конъюгатами с белковыми микобактериальными антигенами индуцировала протективный иммунный ответ (Maglione and Chan, 2009, Eur J Immunol, 39:676-686). Кроме того, существуют данные, указывающие на чрезвычайно важную роль B-лимфоцитов в регуляции активности эффекторных и регуляторных Т-лимфоцитов и в регуляции защитных и иммунопатологических реакций при туберкулезе (Maglione and Chan, 2009, Eur J Immunol, 39:676-686).
Известна конструкция рекомбинантной химерной ДНК, используемой для создания вакцины против туберкулеза, стимулирующей иммунный ответ у теплокровных животных (международная заявка WO, 2010010577, МПК А61К39/04, C12N15/30, опубл. 28.01.2010 г.).
Наиболее близким аналогом (прототипом) является полинуклеотид, индуцирующий при введении в ткань позвоночного один или более антимикобактериальных иммунных ответов, выбранных из ответов, опосредованных антителами, цитотоксическими Т-лимфоцитами, хелперными Т-лимфоцитами, и защитных иммунных ответов, содержащий промотор транскрипции, такой как промотор CMV, связанный с первым цистроном, таким как ген, кодирующий микобактериальный белок, выбранный из группы, содержащей 85А, В и С, связанным с подходящей контрольной последовательностью, включающей сигнал терминации транскрипции, такой как терминатор транскрипции BGH или IRES, при необходимости связанной со вторым цистроном, таким как ген, кодирующий GM-CSF, IL-12, интерферон или член семейства В7 Т-клеточных костимулирующих белков, при необходимости связанным с сигналом терминации транскрипции, таким как терминатор транскрипции BGH, связанным с геном устойчивости к антибиотику, таким как ген устойчивости к ампициллину или канамицину, связанным с участком, включающим точку начала репликации (патент РФ №2186109, МПК А61К 39/04, опубл. 27.06.1999 г.).
Однако вышеприведенные аналоги и прототип не обеспечивают достаточно надежного протективного иммунного ответа.
Техническим результатом является создание такой вакцинной конструкции, которая обеспечивала бы формирование эффективного протективного и терапевтического Т-клеточного иммунного ответа не только антигенспецифических цитотоксических CD8+ Т-лимфоцитов, но и интенсивный ответ CD4+ Т-лимфоцитов.
Указанный технический результат достигается получением следующих девяти вариантов профилактической и терапевтической полиэпитопной противотуберкулезной вакцинной конструкции.
1. pTBUi, обеспечивающая индукцию ответа CD8+ Т-лимфоцитов, представляющая собой универсальный полиэпитопный иммуноген, содержащий ЦТЛ-эпитопы, выбранные из иммунодоминантных антигенов M. tuberculosis, слитый с N-конца с убиквитином, с аминокислотной последовательностью, приведенной на фиг. 1 (SEQ ID NO 1).
2. pTBUi_a0201, обеспечивающая индукцию ответа CD8+ Т-лимфоцитов, представляющая собой специфичный для аллеля HLA-A*0201 полиэпитопный иммуноген, содержащий ЦТЛ-эпитопы, выбранные из иммунодоминантных антигенов M. tuberculosis, слитый с N-конца с убиквитином, с аминокислотной последовательностью, приведенной на фиг. 2 (SEQ ID NO 2).
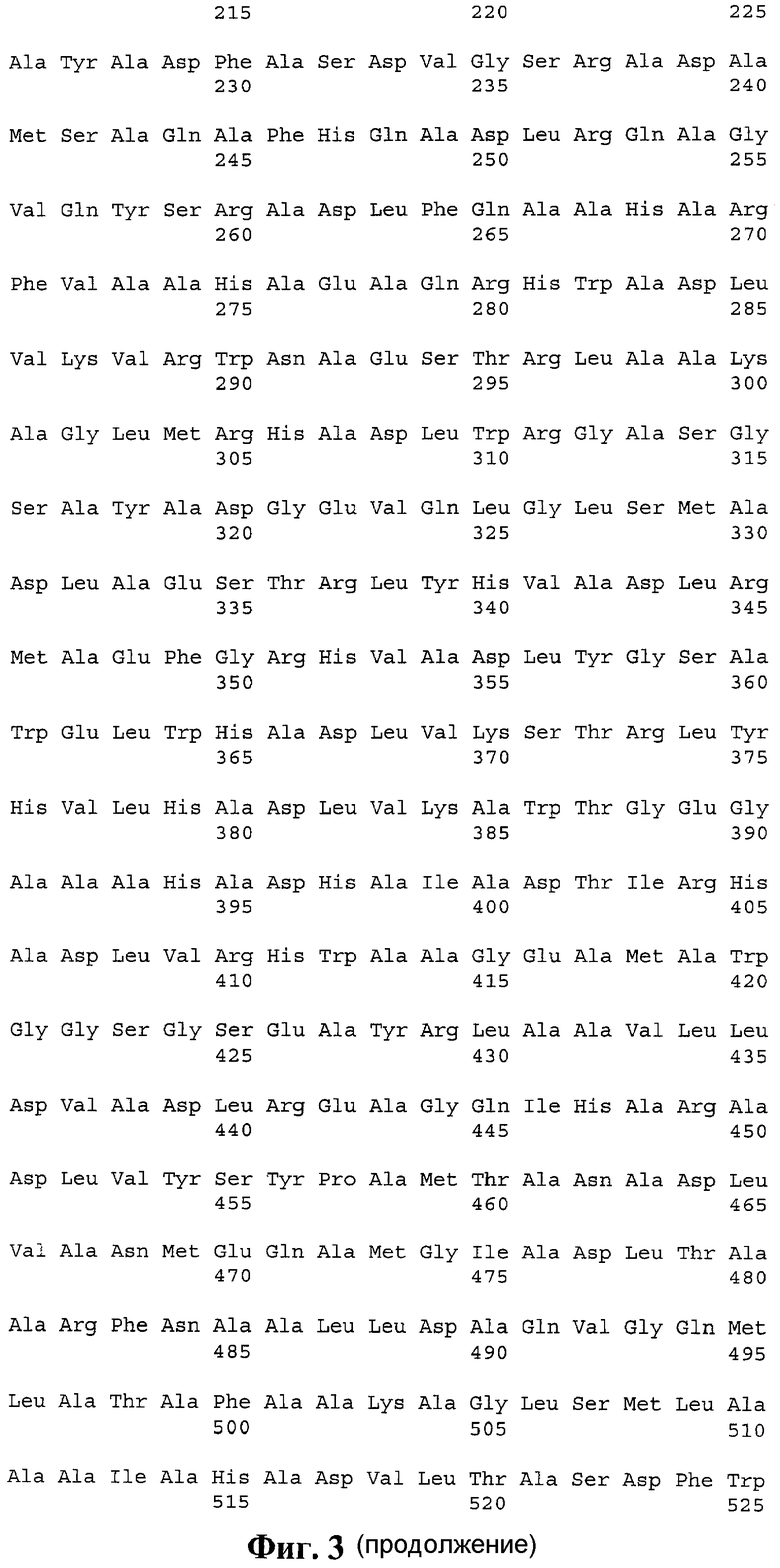
3. pTBUe, обеспечивающая индукцию ответа CD8+ Т-лимфоцитов, представляющая собой универсальный полиэпитопный иммуноген, содержащий ЦТЛ-эпитопы, выбранные из ESAT-подобных антигенов M. tuberculosis, слитый с N-конца с убиквитином, с аминокислотной последовательностью, приведенной на фиг. 3 (SEQ ID NO 3).
4. pTBUe_a0201, обеспечивающая индукцию ответа CD8+ Т-лимфоцитов, представляющая собой специфичный для аллеля HLA-A*0201 полиэпитопный иммуноген, содержащий ЦТЛ-эпитопы, выбранные из ESAT-подобных антигенов M. tuberculosis, слитый с N-конца с убиквитином, с аминокислотной последовательностью, приведенной на фиг. 4 (SEQ ID NO 4).
5. pTBUd, обеспечивающая индукцию ответа CD8+ Т-лимфоцитов, представляющая собой универсальный полиэпитопный иммуноген, содержащий ЦТЛ-эпитопы, выбранные из DosR антигенов M. tuberculosis, слитый с N-конца с убиквитином, с аминокислотной последовательностью, приведенной на фиг. 5 (SEQ ID NO 5).
6. pTBUd_a0201, обеспечивающая индукцию ответа CD8+ Т-лимфоцитов, представляющая собой специфичный для аллеля HLA-A*0201 полиэпитопный иммуноген, содержащий ЦТЛ-эпитопы, выбранные из DosR антигенов M. tuberculosis, слитый с N-конца с убиквитином, с аминокислотной последовательностью, приведенной на фиг. 6 (SEQ ID NO 6).
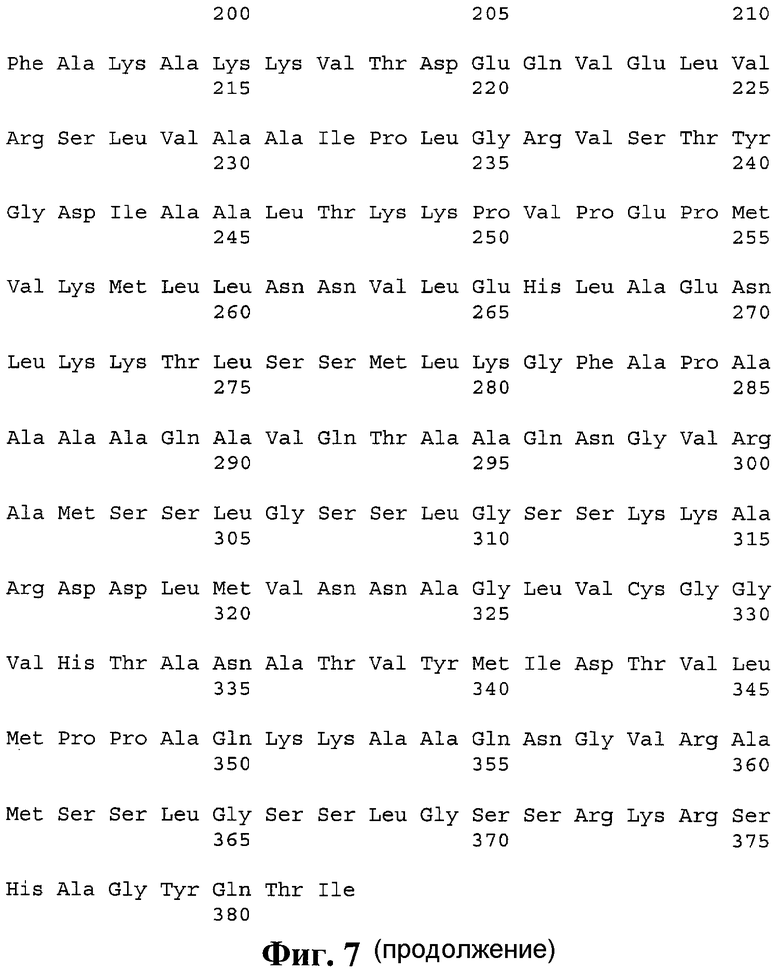
7. pTBih, обеспечивающая индукцию ответа CD4+ Т-хелперных лимфоцитов, представляющая собой полиэпитопный иммуноген, содержащий Т-хелперные эпитопы, выбранные из иммунодоминантных антигенов M. tuberculosis, слитый с N-конца с сигнальным пептидом, а с C-конца - с C-концевым фрагментом белка LAMP-1 человека, с аминокислотной последовательностью, приведенной на фиг. 7 (SEQ ID NO 7).
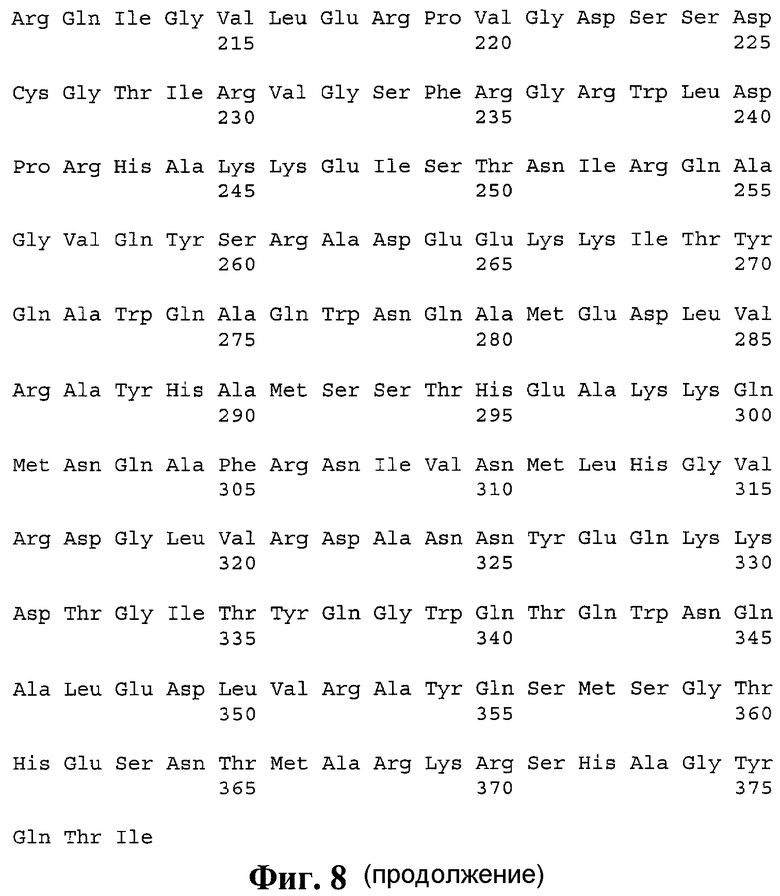
8. pTBeh, обеспечивающая индукцию ответа CD4+ Т-хелперных лимфоцитов, представляющая собой полиэпитопный иммуноген, содержащий Т-хелперные эпитопы, выбранные из ESAT-подобных антигенов M. tuberculosis, слитый с N-конца с сигнальным пептидом, а с C-конца - с C-концевым фрагментом белка LAMP-1 человека, с аминокислотной последовательностью, приведенной на фиг. 8 (SEQ ID NO 8).
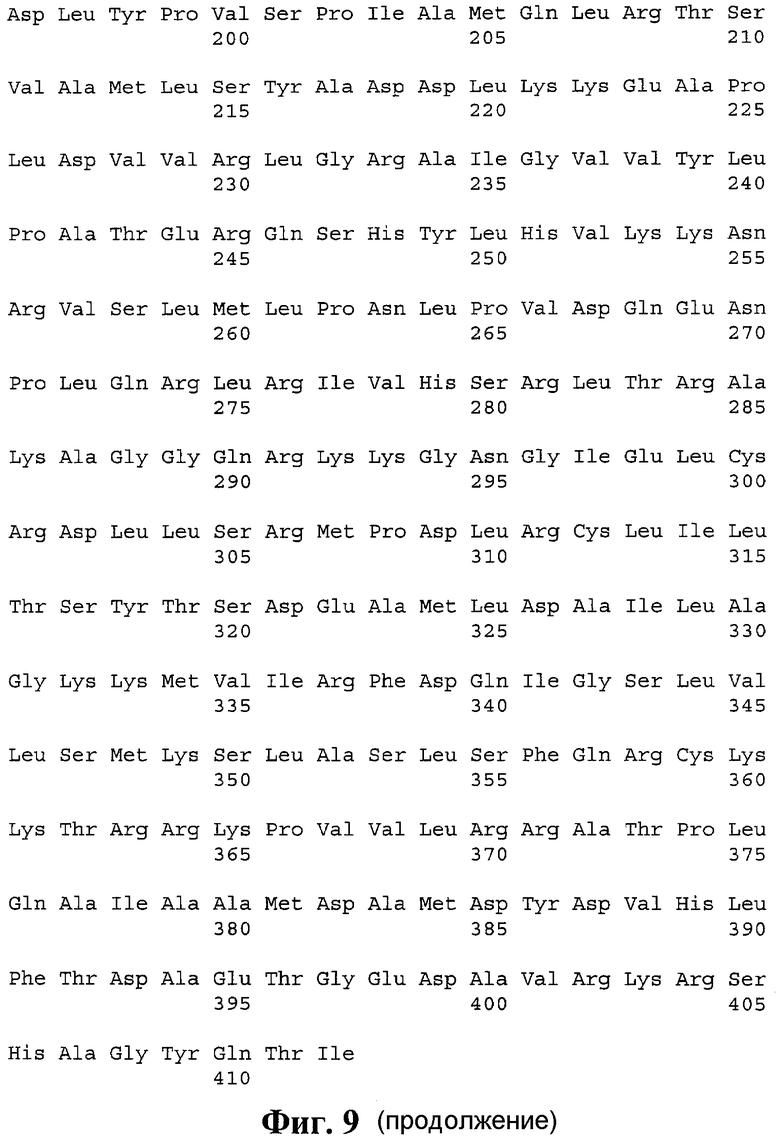
9. pTBdh, обеспечивающая индукцию ответа CD4+ Т-хелперных лимфоцитов, представляющая собой полиэпитопный иммуноген, содержащий Т-хелперные эпитопы, выбранные из DosR антигенов M. tuberculosis, слитый с N-конца с сигнальным пептидом, а с C-конца - с C-концевым фрагментом белка LAMP-1 человека, с аминокислотной последовательностью, приведенной на фиг. 9 (SEQ ID NO 9).
Данные соответствия заявленного технического решения критериям изобретения, основанные на новой стратегии вакцинации
Исходя из изложенного выше, можно придти к выводу, что важнейшей задачей для формирования протективного ответа является наработка мощного Т-клеточного ответа. Важно получить не только антигенспецифические цитотоксические CD8+ Т-лимфоциты, но и интенсивный ответ CD4+ Т-лимфоцитов, поскольку именно они вовлекаются в формирование гранулемы на более ранних стадиях. От того, насколько интенсивным будет Т-клеточный ответ, будет зависеть эффективность контроля за развитием инфекции. Из-за особенностей патогена невозможно избежать болезни с помощью профилактической вакцины, но можно эффективно блокировать развитие патологического процесса, значительно снизить степень поражения тканей и избежать генерализации инфекции. Кроме того, вероятно, что использование Т-клеточных иммуногенов необходимо сочетать с индукцией мукозального гуморального ответа на ряд микобактериальных антигенов, в том числе и на антигены небелковой природы.
Как было сказано выше, в настоящее время для вакцинопрофилактики туберкулеза у людей используется только BCG, живая вакцина, лабораторный аттенуированный штамм M. bovis. Несмотря на высокую эффективность вакцинации в раннем возрасте (новорожденные), при вакцинации в более позднем возрасте эффективность снижается. При ревакцинации может наблюдаться сенсибилизация. Кроме того, иммунологическая память сохраняется в течение примерно 15 лет и последующая ревакцинация неэффективна. BCG слабо эффективна в развивающихся странах. BCG также оказывается бессильной при заражении M. tuberculosis группы W-Beijing. В настоящее время ведутся работы по созданию новых вакцинных штаммов BCG или ауксотрофных и/или нокаутных по ключевым факторам вирулентности штаммов M. tuberculosis. Большое количество работ по разработке новых туберкулезных вакцин посвящено созданию субъединичных белковых вакцин в сочетании с адъювантами, эффективно стимулирующими развитие Тх1-зависимого иммунного ответа, ДНК-вакцин, кодирующих различные иммунодоминантные микобактериальные антигены, либо вирусных векторов, несущих гены, кодирующие микобактерианльные антигены. Разрабатываются новые протоколы иммунизации (Barker et al., 2009, Curr Opin Immunol, 21:331-338).
Предлагаемая нами в данной работе стратегия является уникальной, в настоящее время неизвестно ни одной кандидатной туберкулезной вакцинной конструкции, созданной на основе полиэпитопных конструкций. В результате использования искусственного полиэпитопного иммуногена можно добиться высокого уровня ответа не только на доминантные, но и на субдоминантные эпитопы. При этом мы предполагаем, что расширение спектра специфичности Т-лимфоцитов, стимулируемых при вакцинации, позволит покрыть большую часть антигенных детерминант и позволит создать пул антигенспецифичных клеток с широким спектром распознаваемых эпитопов. Наряду с использованием микобактериальных цитотоксических эпитопов необходимо использование специфических для M. tuberculosis Тх-эпитопов, поскольку CD4+ лимфоциты важны для формирования гранулем, для активации макрофагов для эффективного контроля за развитием инфекции. Важным условием для создания успешной полиэпитопной антигенной конструкции является необходимость учитывать чрезвычайно высокий полиморфизм генов HLA (лейкоцитарный человеческий антиген, human leukocyte antigen) или MHC (главный комплекс тканевой совместимости, major histocompatibility complex) человека. Эта задача может быть решена:
- за счет использования в полиэпитопной конструкции Т-клеточных эпитопов, способных связываться с приемлемым уровнем аффинности с широким спектром аллельных вариантов молекул MHC и в первую очередь с наиболее распространенными в мировой популяции аллельными вариантами молекул HLA, или
- путем создания «аллелеспецифических» антигенных конструкций, в состав которых включены эпитопы, взаимодействующие с определенными алломорфами HLA.
Предложенные полиэпитопные конструкции могут использоваться в качестве ДНК-вакцин; в качестве рекомбинантных встроек в геном векторного микроорганизма (например, вируса или бактерии) для получения кандидатного вакцинного штамма; для получения антиген-презентирующих клеток (АПК), экспрессирующих целевые полиэпитопные иммуногены и способных индуцировать формирование адекватного Т-клеточного иммунного ответа, с целью использования таких АПК в виде клеточной вакцины (или для клеточной терапии) либо для индукции эффекторных антигенспецифических Т-лимфоцитов in vitro с целью использования полученных иммунокомпетентных Т-лимфоцитов в качестве вакцины либо для терапевтических целей. Предложенные вакцинные конструкции могут использоваться в качестве терапевтических вакцин, в том числе для дополнения лечения туберкулеза фармакологическими препаратами.
По сравнению с живыми, инактивированными и субъединичными вакцинами полиэпитопные антигены обладают следующими преимуществами: они более безопасны, поскольку не содержат живых микроорганизмов и полноразмерных белков, которые могут обладать иммуносупрессирующим действием или другой нежелательной биологической активностью; в состав таких конструкций могут входить эпитопы из различных белковых антигенов; полиэпитопные антигены могут содержать эпитопы, покрывающие заданное разнообразие аллельных вариантов молекул MHC; для увеличения иммуногенности и для оптимизации MHC I- или MHC II-зависимой презентации эпитопов в состав полиэпитопных конструкций могут быть включены сигнальные последовательности: лидерный пептид, направляющий синтезируемый белок в ЭР; С-концевой фрагмент LAMP-1, обеспечивающий перенаправление полипептида из секреторного пути на лизосомную деградацию; N-концевой убиквитин, направляющий синтезированный полипептид на протеасомную деградацию, и т.д.
Изобретение иллюстрируется следующими графическими материалами. На фиг. 1 приведена аминокислотная последовательность универсального полиэпитопного иммуногена pTBUi, содержащего ЦТЛ-эпитопы, выбранные из иммунодоминантных антигенов M. tuberculosis, слитого с N-конца с убиквитином. На фиг. 2 приведена аминокислотная последовательность специфичного для аллеля HLA-A*0201 полиэпитопного иммуногена pTBUi_a0201, содержащего ЦТЛ-эпитопы, выбранные из иммунодоминантных антигенов M. tuberculosis, слитого с N-конца с убиквитином. На фиг. 3 приведена аминокислотная последовательность универсального полиэпитопного иммуногена pTBUe, содержащего ЦТЛ-эпитопы, выбранные из ESAT-подобных антигенов M. tuberculosis, слитого с N-конца с убиквитином. На фиг. 4 приведена аминокислотная последовательность специфичного для аллеля HLA-A*0201 полиэпитопного иммуногена pTBUe_a0201, содержащего ЦТЛ-эпитопы, выбранные из ESAT-подобных антигенов M. tuberculosis, слитого с N-конца с убиквитином. На фиг. 5 приведена аминокислотная последовательность универсального полиэпитопного иммуногена pTBUd, содержащего ЦТЛ-эпитопы, выбранные из DosR антигенов M. tuberculosis, слитого с N-конца с убиквитином. На фиг. 6 приведена аминокислотная последовательность специфичного для аллеля HLA-A*0201 полиэпитопного иммуногена pTBUd_a0201, содержащего ЦТЛ-эпитопы, выбранные из DosR антигенов M. tuberculosis, слитого с N-конца с убиквитином. На фиг. 7 приведена аминокислотная последовательность полиэпитопного иммуногена pTBih, содержащего Т-хелперные эпитопы, выбранные из иммунодоминантных антигенов M. tuberculosis, слитого с N-конца с сигнальным пептидом, а с C-конца - с C-концевым фрагментом белка LAMP-1 человека. На фиг. 8 приведена аминокислотная последовательность полиэпитопного иммуногена pTBeh, содержащего Т-хелперные эпитопы, выбранные из ESAT-подобных антигенов M. tuberculosis, слитого с N-конца с сигнальным пептидом, а с C-конца - с C-концевым фрагментом белка LAMP-1 человека. На фиг. 9 приведена аминокислотная последовательность полиэпитопного иммуногена pTBdh, содержащего Т-хелперные эпитопы, выбранные из DosR антигенов M. tuberculosis, слитого с N-конца с сигнальным пептидом, а с C-конца - с C-концевым фрагментом белка LAMP-1 человека. На фиг. 10 представлены данные по оценке продукции γIFN для изучения Т-клеточного ответа (в качестве клеток-мишеней для каждого случая были использованы аутологичные ДК, инфицированные M. tuberculosis H37Rv). На фиг. 11 представлены данные по изучение цитотоксического ответа в результате лизиса клеток-мишеней (аутологичных макрофагов, инфицированных M. tuberculosis H37Rv).
Примеры получения заявляемых вакцинных конструкций
Поли-ЦТЛ конструкции на основе иммунодоминантных антигенов M. tuberculosis
Для выбранных антигенов с помощью TEpredict было проведено предсказание ЦТЛ-эпитопов, рестриктированных 35 различными аллельными вариантами молекул HLA-A и HLA-B. При этом проводилось предсказание протеасомного и иммунопротеасомного процессинга антигенов, а также эффективности связывания потенциально антигенных пептидов с TAP. Затем для составления «универсальной» полиэпитопной конструкции был произведен выбор минимального количества потенциальных Т-клеточных эпитопов из иммунодоминантных антигенов M. tuberculosis, покрывающих выбранное разнообразие алломорф HLA класса I с пятикратной избыточностью. Выбраны фланкирующие аминокислотные последовательности, оптимизирующие взаимодействие выбранных пептидов с TAP человека.
Проведен дизайн «универсальной» поли-ЦТЛ-эпитопной конструкции на основе иммунодоминантных антигенов M. tuberculosis (SEQ ID NO 1). Были подобраны спейсерные аминокислотные последовательности, оптимизирующие как протеасомное, так и иммунопротеасомное высвобождение эпитопов, включенных в состав полиэпитопа. Итоговая аминокислотная последовательность приведена на фигуре 1.
Из выбранных иммунодоминантных антигенов M. tuberculosis аналогичным образом была создана аллелеспецифичная поли-ЦТЛ конструкция для наиболее распространенного в человеческой популяции аллеля HLA-A*0201 (SEQ ID NO 2). Итоговая аминокислотная последовательность приведена на фигуре 2.
Поли-ЦТЛ конструкции на основе ESAT-подобных антигенов M. tuberculosis
Для выбранных ESAT-подобных антигенов с помощью TEpredict было проведено предсказание ЦТЛ-эпитопов, рестриктированных 35 различными аллельными вариантами молекул HLA-A и HLA-B. Также проводилось предсказание протеасомного и иммунопротеасомного процессинга антигенов, а также эффективности связывания потенциально антигенных пептидов с TAP. Затем для составления «универсальной» полиэпитопной конструкции был произведен выбор минимального количества потенциальных Т-клеточных эпитопов из ESAT-подобных антигенов M. tuberculosis, покрывающих выбранное разнообразие алломорф HLA класса I с пятикратной избыточностью. Выбраны фланкирующие аминокислотные последовательности, оптимизирующие взаимодействие выбранных пептидов с TAP человека.
Проведен дизайн «универсальной» поли-ЦТЛ-эпитопной конструкции на основе ESAT-подобных антигенов M. tuberculosis (SEQ ID NO 3). Были подобраны спейсерные аминокислотные последовательности, оптимизирующие как протеасомное, так и иммунопротеасомное высвобождение эпитопов, включенных в состав полиэпитопа. Итоговая аминокислотная последовательность приведена на фигуре 3.
Из выбранных ESAT-подобных антигенов M. tuberculosis аналогичным образом была создана аллелеспецифичная поли-ЦТЛ-эпитопная конструкция для наиболее распространенного в человеческой популяции аллеля HLA-A*0201 (SEQ ID NO 4). Итоговая аминокислотная последовательность приведена на фигуре 4.
Поли-ЦТЛ-эпитопные конструкции на основе DosR антигенов M. tuberculosis
Для выбранных DosR антигенов M. tuberculosis с помощью TEpredict было проведено предсказание ЦТЛ-эпитопов, рестриктированных 35 различными аллельными вариантами молекул HLA-A и HLA-B. Также проводилось предсказание протеасомного и иммунопротеасомного процессинга антигенов, а также эффективности связывания потенциально антигенных пептидов с TAP. Затем для составления «универсальной» полиэпитопной конструкции был произведен выбор минимального количества потенциальных Т-клеточных эпитопов из DosR антигенов M. tuberculosis, покрывающих выбранное разнообразие алломорф HLA класса I с пятикратной избыточностью. Выбраны фланкирующие аминокислотные последовательности, оптимизирующие взаимодействие выбранных пептидов с TAP человека.
Проведен дизайн «универсальной» поли-ЦТЛ-эпитопной конструкции на основе DosR антигенов M. tuberculosis (SEQ ID NO 5). Были подобраны спейсерные аминокислотные последовательности, оптимизирующие как протеасомное, так и иммунопротеасомное высвобождение эпитопов, включенных в состав полиэпитопа. Итоговая аминокислотная последовательность приведена на фигуре 5.
Из выбранных DosR антигенов M. tuberculosis аналогичным образом была создана аллелеспецифичная поли-ЦТЛ-эпитопная конструкция для наиболее распространенного в человеческой популяции аллеля HLA-A*0201 (SEQ ID NO 6). Итоговая аминокислотная последовательность приведена на фигуре 6.
Поли-Т-хелперные конструкции на основе антигенов M. tuberculosis
Для выбранных антигенов с помощью TEpredict было проведено предсказание Т-хелперных эпитопов. При этом проводился выбор фрагментов, содержащих большое количество потенциальных эпитопов, взаимодействующих с наибольшим количеством алломорф молекул HLA класса II (HLA-DR). Из каждого антигена (из каждого набора) выбиралось по три наиболее перспективных антигенных фрагмента и затем из всего набора выбранных фрагментов отбиралось по 10 наиболее перспективных.
В соответствии с описанным выше алгоритмом был проведен дизайн поли-Т-хелперных конструкций на основе следующих наборов антигенов M. tuberculosis: из иммунодоминантных антигенов (SEQ ID NO 7), из ESAT-подобных антигенов (SEQ ID NO 8) и из антигенов DosR-регулона (SEQ ID NO 9). Итоговая аминокислотная последовательность поли-Т-хелперной конструкции на основе иммунодоминантных антигенов M. tuberculosis приведена на фигуре 7. Итоговая аминокислотная последовательность поли-Т-хелперной конструкции на основе ESAT-подобных антигенов M. tuberculosis приведена на фигуре 8. Итоговая аминокислотная последовательность поли-Т-хелперной конструкции на основе DosR антигенов M. tuberculosis приведена на фигуре 9.
Результаты проведенных исследований
Для разработанных полиэпитопных конструкций (SEQ ID NO 1, SEQ ID NO 2, SEQ ID NO 3, SEQ ID NO 4, SEQ ID NO 5, SEQ ID NO 6, SEQ ID NO 7, SEQ ID NO 8 и SEQ ID NO 9) были сконструированы кодирующие их искусственные гены. Последовательности генов были оптимизированы для экспрессии в клетках человека, для чего из них были исключены редко используемые кодоны. Дизайн генов проводился с таким расчетом, чтобы минимизировать сложность вторичной структуры матричной РНК.
Для создания ДНК-вакцинных конструкций с использованием полученных искусственных генов была выбрана плазмида pDNAVACC-Ultra (pDNAVACC5, NBC, USA, http://www.natx.com/). В качестве отрицательного контроля также использовалась плазмида pDNAVACC5.
Было создано девять конструкций:
1) pTBUi - плазмида pDNAVACC со встроенной последовательностью, кодирующей универсальный полиэпитопный иммуноген, содержащий ЦТЛ-эпитопы, выбранные из иммунодоминантных антигенов M. tuberculosis, слитый с N-конца с убиквитином (SEQ ID NO 1);
2) pTBUi_a0201 - плазмида pDNAVACC со встроенной последовательностью, кодирующей специфичный для аллеля HLA-A*0201 полиэпитопный иммуноген, содержащий ЦТЛ-эпитопы, выбранные из иммунодоминантных антигенов M. tuberculosis, слитый с N-конца с убиквитином (SEQ ID NO 2);
3) pTBUe - плазмида pDNAVACC со встроенной последовательностью, кодирующей универсальный полиэпитопный иммуноген, содержащий ЦТЛ-эпитопы, выбранные из ESAT-подобных антигенов M. tuberculosis, слитый с N-конца с убиквитином (SEQ ID NO 3);
4) pTBUe_a0201 - плазмида pDNAVACC со встроенной последовательностью, кодирующей специфичный для аллеля HLA-A*0201 полиэпитопный иммуноген, содержащий ЦТЛ-эпитопы, выбранные из ESAT-подобных антигенов M. tuberculosis, слитый с N-конца с убиквитином (SEQ ID NO 4);
5) pTBUd - плазмида pDNAVACC со встроенной последовательностью, кодирующей универсальный полиэпитопный иммуноген, содержащий ЦТЛ-эпитопы, выбранные из DosR антигенов M. tuberculosis, слитый с N-конца с убиквитином (SEQ ID NO 5);
6) pTBUd_a0201 - плазмида pDNAVACC со встроенной последовательностью, кодирующей специфичный для аллеля HLA-A*0201 полиэпитопный иммуноген, содержащий ЦТЛ-эпитопы, выбранные из DosR антигенов M. tuberculosis, слитый с N-конца с убиквитином (SEQ ID NO 6);
7) pTBih - плазмида pDNAVACC со встроенной последовательностью, кодирующей полиэпитопный иммуноген, содержащий Т-хелперные эпитопы, выбранные из иммунодоминантных антигенов M. tuberculosis, слитый с N-конца с сигнальным пептидом, а с C-конца - с C-концевым фрагментом белка LAMP-1 человека (SEQ ID NO 7);
8) pTBeh - плазмида pDNAVACC со встроенной последовательностью, кодирующей полиэпитопный иммуноген, содержащий Т-хелперные эпитопы, выбранные из ESAT-подобных антигенов M. tuberculosis, слитый с N-конца с сигнальным пептидом, а с C-конца - с C-концевым фрагментом белка LAMP-1 человека (SEQ ID NO 8);
9) pTBdh - плазмида pDNAVACC со встроенной последовательностью, кодирующей полиэпитопный иммуноген, содержащий Т-хелперные эпитопы, выбранные из DosR антигенов M. tuberculosis, слитый с N-конца с сигнальным пептидом, а с C-конца - с C-концевым фрагментом белка LAMP-1 человека (SEQ ID NO 9).
Описание процессинга и презентации антигенов
Белковые антигены, синтезированные в цитоплазме клетки, как правило, презентируются молекулами MHC класса I. Эндогенные белковые антигены подвергаются протеолитическому разрезанию на олигопептидные фрагменты под действием протеасомы - крупного белкового комплекса, состоящего из регуляторных и протеолитических субъединиц (Rock KL and Goldberg AL, 1999, Annu. Rev. Immunol, 17:739-779; Niedermann G et al., 1999, Immunol. Rev, 172:29-48). Образованные в результате протеасомного процессинга олигопептиды с помощью гетеродимеров TAP1/TAP2 (Transporters associated with antigen processing) транспортируются в просвет эндоплазматического ретикулума (ЭР), где связываются с молекулами MHC класса I. Образовавшиеся комплексы антигенных пептидов с молекулами MHC класса I транспортируются на поверхность клетки для презентации специфическим CD8+ Т-лимфоцитам (Pamer E and Cresswell P, 1998, Ann. Rev. Immunol, 16:323-358). Процессинг антигенов в антигенпрезентирующих клетках может осуществляться иммунопротеасомой, несколько отличающейся от протеасомы по специфичности расщепления в результате включения в ее состав альтернативных протеолитических субъединиц, экспрессируемых клеткой под действием провоспалительных стимулов (Van den Eynde B. and Morel S. 2001. Curr Opin Immunol, 13:147-153; Rivett A. and Hearn A. 2004. Curr Prot Pept Sci, 5:153-161).
Молекулы MHC класса II, как правило, презентируют пептидные фрагменты белков, интернализованных клеткой в результате эндоцитоза. Это могут быть растворимые белки, белки клеточной поверхности или белки захваченных микроорганизмов (вирусов, бактерий или простейших). Образованные в ЭР комплексы молекул MHC класса II с инвариантной цепью транспортируются в комплекс Гольджи и затем направляются в мультивизикулярные компартменты эндосомной/лизосомной сети. Здесь происходит протеолитическая деградация инвариантной цепи, процессинг захваченных белковых антигенов и ассоциация антигенных пептидов с молекулами MHC класса II. Образовавшиеся комплексы антигенных пептидов с молекулами MHC класса II транспортируются на поверхность клетки для презентации специфическим CD4+ Т-лимфоцитам (Cresswell P, 1994, Ann. Rev. Immunol, 12:259-293; Watts C., 1997, Ann. Rev. Immunol, 15:821-850). Кроме того, показано, что экзогенные антигены могут презентироваться и молекулами MHC класса I в результате кросс-презентации (Guermonprez P. et al., 2002. Annu Rev Immunol, 20:621-667).
Описание алгоритма выбора ЦТЛ- и Тх-эпитопов и конструирования полиэпитопных Т-клеточных иммуногенов
Выбор антигенов. Было решено сформировать три различные выборки антигенов M. tuberculosis: 1) состоящая из иммунодоминантных антигенов (Ag85A, Ag85B, Ag85C, Hsp65, Esat-6, CFP-10 и др.), 2) состоящая из Esx-подобных антигенов (все они характеризуются небольшими размерами и являются секретируемыми белками и иммунодоминантными антигенами. Данные белки играют важную роль не только на ранних, но и на более поздних стадиях инфекции, а следовательно, должны обладать эффективностью не только при использовании в составе профилактической, но и в качестве терапевтической вакцины) и 3) объединяющая ряд белков латентной фазы и белков из DosR регулона.
Выбор Т-клеточных эпитопов. В настоящее время разработано большое количество алгоритмов для предсказания Т-клеточных эпитопов, обладающих высокой точностью. Некоторые из них уже доказали свою применимость для поиска новых эпитопов и дизайна вакцинных конструкций (Bian H et al., 2003, Methods. 29:299-309; Adotevi O et al., 2006, Clin. Cancer Res, 12:3158- 3167; Hundemer M et al., 2006, Exp. Hematol, 34:486-496; Mustafa AS and Shaban FA, 2006, Tuberculosis, 86:115-124;Sundar K et al., 2007, Virology, 360:257-263; Wen JS et al.,2008, Virus Res, 132:42-48). При разработке предложенных полиэпитопных конструкций мы использовали разработанное нами программное обеспечение TEpredict, предназначенное для предсказания Т-клеточных эпитопов и основных этапов процессинга антигенов (Антонец Д. и Максютов А. 2009. Мол Биол, 43:1-10). Дополнительно нами были использованы предсказательные модели веб-сервера NetMHC (Lundegaard C. et al. 2008. NAR, 36:W509-512).
Предсказание цитотоксических Т-клеточных эпитопов проводилось для 30 различных аллельных вариантов молекул HLA класса I (HLA-A*0101, A*0201, A*0202, A*0203, A*0206, A*0301, A*2301, A*2402, A*2403, A*2601, A*2902, A*3001, A*3002, A*3101, B*0702, B*0801, B*1501, B*1801, B*2705, B*3501, B*4001, B*4002, B*4402, B*4403, B*4501, B*5101, B*5301, B*5401, B*5701, B*5801). Пептиды, для которых предсказанное значение pIC50 (характеристика аффинности взаимодействия пептида с молекулой MHC) было больше 6.8, были отобраны для дальнейшего анализа.
Показано, что предсказание аффинности связывания пептидов с комплексом TAP (связанные с процессингом транспортные белки, transporter associated with antigen processing) перед предсказанием пептидов, способных связываться с молекулами MHC класса I, снижает количество ложноположительно предсказанных эпитопов (Peters B et al., 2003, J. Immunol, 171:1741-1749), следовательно, предсказание аффинности взаимодействия пептидов с TAP может быть использовано в качестве фильтра при выборе потенциальных Т-клеточных эпитопов или в качестве оценочной функции для ранжирования пептидов согласно эффективности их взаимодействия с TAP. Для предсказания аффинности связывания пептидов с TAP могут быть использованы алгоритмы, разработанные Петерсом и др. (Peters B et al., 2003, J. Immunol, 171:1741-1749) либо Дойчиновой и др. (Doitchinova I. et al., 2004, J. Immunol, 173:6813-6819), реализованные в программе TEpredict либо с использованием другого программного обеспечения. При дизайне полиэпитопных ЦТЛ иммуногенов мы использовали алгоритм, разработанный Петерсом и др.
C-конец большинства Т-клеточных эпитопов образуется под действием протеасомы (Craiu A et al., 1997, PNAS USA, 94:10850-10855; Stoltze L et al., 1998, Eur. J. Immunol, 28:4029-4036). Можно предположить, что предсказание протеасомного процессинга антигена также может увеличить точность предсказания Т-клеточных эпитопов, исключая из рассмотрения пептиды, не имеющие на своем С-конце сайта протеасомного расщепления. Однако было показано, что в результате специфичность предсказания эпитопов не увеличивается, а чувствительность предсказания может снижаться (Peters B et al., 2003, J. Immunol, 171:1741-1749). Тем не менее, мы предполагаем, что использование предсказания протеасомного процессинга в качестве фильтра позволит увеличить эффективность поиска эпитопов, более эффективно высвобождаемых протеасомой in vivo. Предсказание (иммуно)протеасомного процессинга проводилось с использованием моделей, разработанных Toes et al. (Toes RE et al., 2001, J. Exp. Med, 194:1-12). Определение пороговых значений для предсказания процессинга описано в работе Singh and Raghava (Singh H and Raghava GP, 2003, Bioinformatics, 19:1009-1014).
Предсказание Т-хелперных эпитопов (рестриктированных молекулами MHC класса II) проводилось с использованием программ TEpredict и NetMHC.
Далее производили выбор эпитопов для конструирования «универсальных» полиэпитопных иммуногенов: были сформированы выборки эпитопов, покрывающие разнообразие выбранных алломорф молекул MHC класса I и II с пятикратной избыточностью. Кроме того, для наиболее распространенного в человеческой популяции аллеля HLA-A*0201 были созданы выборки эпитопов для конструирования аллелеспецифичных полиэпитопных антигенов.
Конструирование полиэпитопных антигенов. Несмотря на то, что первые работы показали способность полиэпитопных конструкций, составленных в результате простого объединения эпитопов, индуцировать цитотоксический Т-клеточный ответ на все эпитопы, включенные в состав таких антигенов (Thomson et al., 1995), в дальнейшем было показано, что иммуногенность пептидов в составе полиэпитопа в значительной степени зависит от фланкирующих аминокислотных остатков, и что при конструировании полиэпитопных иммуногенов следует учитывать особенности протеасомного процессинга антигенов и взаимодействия пептидов с ТАР. Было показано, что введение в состав полиэпитопного антигена спейсерных аминокислотных последовательностей, обеспечивающих образование сайтов протеасомного расщепления между эпитопами и оптимизирующих связывание пептидных фрагментов с TAP, приводит к увеличению иммуногенности таких конструкций за счет повышения эффективности процессинга и презентации целевых эпитопов иммунной системе. В настоящее время известны аминокислотные мотивы, определяющие аффинность связывания олигопептидов с комплексом TAP (Peters B et al., 2003, J. Immunol, 171:1741-1749; Doitchinova I. et al., 2004, J. Immunol, 173:6813-6819), и вырожденные мотивы, определяющие эффективность сайтов (иммуно)протесомного расщепления (Toes et al., 2001). На основе математических моделей, предсказывающих эффективность (иммуно)протеасомного процессинга антигенов и аффинность связывания пептидов с TAP, нами был разработан алгоритм конструирования полиэпитопных ЦТЛ-иммуногенов за счет подбора оптимальных спейсерных последовательностей для каждого паросочетания эпитопов и за счет выбора наилучших паросочетий эпитопов.
Алгоритмы объединения выбранных эпитопов в
поли-ЦТЛ-эпитопную конструкцию
Учет взаимодействия пептидов с TAP. Для оптимизации взаимодействия антигенных пептидов с TAP было решено добавлять при необходимости к выбранным олигопептидным эпитопам N-концевые фланкирующие аминокислотные остатки, усиливающие связывание. Аминокислотные остатки добавлялись только к тем пептидам, для которых была предсказана низкая аффинность взаимодействия с TAP.
Алгоритм выбора фланкирующих а.к.о. основан на модели, предсказывающей аффинность связывания олигопептидов с TAP, разработанной Петерсом и др. (Peters B et al., 2003, J. Immunol, 171:1741-1749), включенной в состав программы TEpredict. Аффинность связывания рассчитывалась согласно формуле: N1+N2+N3+C, где N1 обозначает вклад первого (N-концевого) а.к.о. пептида, N2 - второго, N3 - третьего, а C обозначает вклад последнего а.к.о. (C-концевого). Поскольку C-конец пептида должен оставаться неизменным, следовательно, аминокислотные остатки могут быть добавлены только на N-конец. Согласно модели Петерса и др. оптимальным для связывания с TAP человека является N-концевой мотив ARY. Таким образом, сначала к пептиду (при необходимости) добавляется остаток Ala, если этого оказалось недостаточно, то к исходному пептиду добавляется мотив Ala-Arg, если же и этого оказалось недостатончно, то к исходному пептиду добавляется мотив Ala-Arg-Tyr. Конечно, фланкирующие а.к.о. могут выбираться и из вырожденного мотива, например, [ANRK][RQYW][YWFVI].
Учет протеасомного/иммунопротеасомного процессинга. Для оптимизации (иммуно)протеасомного процессинга антигена для эффективного высвобождения целевых эпитопов необходимо для каждой пары эпитопов подобрать оптимальные спейсерные аминокислотные последовательности. Для этого могут быть использованы два подхода.
В первом варианте алгоритма в качестве спейсерной последовательности была выбрана консенсусная последовательность из шести аминокислот: ADLVKV, являющийся оптимальным для одновременной оптимизации протеасомного и иммунопротеасомного процессинга (при дизайне фланков для оптимизации высвобождения С-конца эпитопов мы использовали матрицы из ProPred1). Для анализа сочетаний и представления данных мы использовали направленные графы: пептиды - узлы графа; ребра, соединяющие узлы А и В, обозначают сочетания, в которых на C-конце пептида А присутствует необходимый сайт расщепления.
Конечно, для данного алгоритма можно использовать и другие спейсерные последовательности. Например, ADLVAG для оптимизации протеасомного процессинга или ADLAVK для иммунопротеасомного процессинга. Эти мотивы могут быть вырожденными: любой аминокислотный остаток из спейсерного мотива может быть заменен на любой другой аминокислотный остаток из двадцати канонических а.к.о. При этом при составления спейсерной последовательности между пептидами А и В предпочтение отдается а.к.о., обеспечивающим наиболее эффективное высвобождение C-конца эпитопа А.
Этот вариант алгоритма конструирования последовательности фрагмента полиэпитопного иммуногена можно представить в виде следующей последовательности шагов.
1. Добавление спейсерных последовательностей (для оптимизации связывания пептидов с TAP) для всех выбранных пептидов (при необходимости).
2. Для всех вариантов фланкирующих последовательностей из набора [' ', 'A', 'AD', 'ADL', 'ADLV', 'ADLVK', 'ADLVKV'], пока не будет создан итоговый полиэпитопный фрагмент, содержащий все выбранные эпитопы, или пока не будут испытаны все варианты фланков.
Если не создан путь, включающий все выбранные эпитопы:
2.1. проводится построение графа;
2.2. если в графе есть смежные вершины, то выбираем из него путь с максимальной длиной;
2.3. исключение из графа вершин, соответствующих пептидам, вошедшим в выбранный путь;
2.4. добавление к выборке пептида, представляющего выбранный путь;
2.5. см. п. 2.2;
2.6. если в графе не осталось смежных вершин, то создаем новую выборку пептидов, состоящую из выбранных путей и оставшихся узлов графа; переходим к следующей итерации цикла (п. 2).
3. В итоге должна получиться последовательность искомого полиэпитопного фрагмента; если не был выбран путь, включающий все эпитопы, то нужно повторить алгоритм с п. 2, снизив строгость протеасомного/иммунопротеасомного фильтра.
Второй подход основан на использовании для оптимизации протеасомного и/или иммунопротеасомного процессинга вырожденного оптимального мотива [APRS] [DILT] [AGL] [AKV]. Из этого мотива строится набор фланкирующих последовательностей с длиной от 1 до 4 а.к.о., к которому дополнительно добавляется пустой элемент - ' ', который обозначает соединение пептидов стык-в-стык. При использовании данного мотива набор возможных фланкирующих последовательностей включает более 150 вариантов. Могут использоваться и другие мотивы, в том числе и мотивы большей длины, например:
[ARSPNK] [DLITGV] [LGAVEK] [VKAFSI] [ALKSEI] [GVKLSE] или
[AGNRKP] [DIATVG] [LGANVE] [ASNVLK] [VIKAGP] [KAGVSE]
Несмотря на то, что большинство используемых спейсерных последовательностей имеет длину в 3-4 а.к.о., они могут иметь и существенно большую длину. В указанных позициях спейсерные последовательности могут иметь аминокислотные остатки, отличные от указанных (если они не препятствуют образованию искомого сайта протеасомного/иммунопротеасомного расщепления между пептидами).
При использовании второго подхода для каждого сочетания пептидов А и В из всех возможных спейсеров отбираются те, которые обеспечивают наличие сайта протеасомного расщепления на С-конце пептида А, предсказываемого с заданным уровнем строгости протеасомного фильтра. Для всех отобранных вариантов проводится предсказание эпитопов и затем отбирается один (критерии описаны ниже) для данной пары пептидов. Затем производится конструирование последовательности полиэпитопного фрагмента, при этом первый пептид может либо задаваться в качестве аргумента для функции, либо выбираться автоматически (как лучший по выбранным критериям). В результате получается полиэпитопный фрагмент, содержащий все эпитопы. Если какой-либо из пептидов (например, пептид Х) не вошел в итоговую конструкцию, программа проводит поиск пептидов, между которыми может быть вставлен пептид Х; либо, если возможного места вставки не было найдено, пептид Х используется в качестве стартового.
В качестве критериев выбора спейсерной последовательности для пары пептидов А и В могут использоваться следующие: количество “нецелевых” эпитопов, предсказанных для стыковки с использованием данного спейсера; количество алломорф MHC, с которыми взаимодействуют эти “нецелевые” эпитопы; длина спейсерной последовательности (как правило, при прочих равных условиях, лучшим считается спейсер меньшей длины); естественно, при выборе все варианты спейсерных последовательностей для данной пары пептидов (А и В) ранжируются по предсказанной эффективности высвобождения С-конца пептида А. Эти критерии могут использоваться как фильтры, они могут применяться по отдельности или все вместе в различной последовательности. Кроме того, при этом можно варьировать строгость предсказания потенциальных Т-клеточных эпитопов и протеасомного/иммунопротеасомного процессинга пептидных фрагментов. Кроме того, с целью уменьшения количества “нецелевых” эпитопов можно использовать для составления итоговой конструкции пептидные фрагменты, составленные из пересекающихся в последовательности целевых антигенов эпитопов.
При конструировании итоговой последовательности полиэпитопного фрагмента критерии используются для выбора первой пары пептидов (если первый пептид не был задан изначально) и для выбора каждого следующего пептида.
Создание полиэпитопных конструкций для стимуляции
ответа CD4+ Т-лимфоцитов
Поскольку для формирования Т-клеточного иммунного ответа, способного эффективно противостоять M. tuberculosis, необходимо индуцировать ответ не только цитотоксических (CD8+), но и хелперных (CD4+) T-лимфоцитов, нами были созданы полиэпитопные конструкции, содержащие Т-хелперные эпитопы микобактериальных антигенов. Для конструирования таких полиэпитопных иммуногенов мы использовали описанные выше наборы эпитопов, рестриктированных различными алломорфами молекул MHC класса II, предсказанных с помощью TEpredict.
В результате анализа предсказаний (эпитопных карт микобактериальных антигенов) были выбраны фрагменты, содержавшие эпитопы, способные связываться с наибольшим количеством алломорф молекул MHC класса II человека (HLA-DR). При выборе фрагментов учитывался тот факт, что аминокислотные остатки, фланкирующие эпитоп в составе белка (целевого антигена), могут быть важны для взаимодействия с соответствующим Т-клеточным рецептором, поэтому в состав антигенного фрагмента включались 3-5 а.к.о., фланкирующих выбранный район. Пептиды объединялись с помощью спейсерных мотивов [KR][KR], являющихся сайтами расщепления для лизосомных катепсинов B и L, принимающих участие в процессинге экзогенных антигенов.
Увеличение иммуногенности полиэпитопных конструкций и направление процессинга полиэпитопных конструкций по MHC I- или по MHC II-зависимому пути. В результате многочисленных исследований было показано, что при включении в состав полиэпитопных конструкций или рекомбинантных антигенов N-концевых сигнальных пептидов и тирозинового C-концевого мотива лизосомной сортировки из белка LAMP-1 человека наблюдается очень высокий уровень Т-хелперного ответа, по сравнению с конструкциями, не имеющими указанных сигнальных последовательностей. При этом уровень ответа CD8+ Т-лимфоцитов снижается не столь сильно, а ряд исследователей, напротив, сообщает о его усилении. Суть включения этих сигналов в состав иммуногена заключается в том, что N-концевой сигнальный пептид обеспечивает поступление полипептида в ЭР и в секреторный путь, а LAMP-мотив направляет этот полипептид из секреторного пути на деградацию в лизосомы, где образующиеся пептидные фрагменты связываются с молекулами MHC класса II и затем презентируются на поверхности клеток. В качестве сигнального пептида, направляющего антигенный полипептид в ЭР, использован пептид MKLTTMIKTAVAVVAMAAIATFAAPVALA. На C-конец иммуногенов был добавлен лизосомный сортировочный сигнал - 11 C-концевых а.к.о. белка LAMP-1 человека: RKRSHAGYQTI.
Для дополнительной стимуляции цитотоксического ответа (CD8+) на N-конец всех поли-ЦТЛ-эпитопных конструкций добавлен убиквитин V76 (UbV76).
Способы доставки
Стратегия вакцинации предполагает совместное введение одной или нескольких конструкций для вызова ответа CD8+ ЦТЛ и одной или нескольких конструкций для вызова ответа CD4+ Т-хелперных лимфоцитов.
Предложенные кандидатные вакцинные конструкции могут быть использованы в виде ДНК-вакцины - плазмиды со встроенным геном, кодирующим целевую полиэпитопную конструкцию. Ген, кодирующий целевой полиэпитопный антиген, может быть встроен в геном вируса или бактерии для получения вакцинного штамма микроорганизма. Вместе с целевым полиэпитопным антигеном в состав плазмиды или в геном вакцинного штамма микроорганизма могут быть встроены гены, кодирующие дополнительные факторы, стимулирующие развитие клеточного иммунного ответа, например ИЛ-12, ИЛ-23, ГМ-КСФ и др. Кроме того, предложенные полиэпитопные антигены могут быть использованы в виде очищенных рекомбинантных белков в качестве субъединичной вакцины. Предложенные полиэпитопные антигены могут быть использованы для вакцинации в комбинации с адъювантами, в составе вирусоподобных частиц, липосом, в комбинации с катионными пептидами и других иммуностимулирующих комплексов. Предложенные полиэпитопные антигены могут быть использованы в различных комбинациях, вместе и по отдельности.
Полинуклеотидные фрагменты, кодирующие целевые полиэпитопные антигены (либо векторные микроорганизмы, несущие соответствующие гены), могут быть использованы для стабильной или транзиентной трансфекции (или инфекции) клеток, например, антигенпрезентирующих клеток (дендритных клеток, клеток Лангерганса или других АПК). Эти клетки могут быть использованы для клеточной терапии (для стимуляции иммунного ответа in situ) или для стимуляции формирования эффекторных CD8+ и/или CD4+ Т-лимфоцитов in vitro с целью использования полученных антигенспецифических эффекторных Т-лимфоцитов в качестве клеточной вакцины.
Предложенные кандидатные вакцинные конструкции, а также векторные микроорганизмы или иммуностимулирующие комплексы, содержащие гены, кодирующие данные антигены, или рекомбинантные полиэпитопные белки, а также АПК, презентирующие предложенные антигены, или антигенспецифичные эффекторные Т-лимфоциты, полученные in vitro, могут быть использованы в качестве профилактической или терапевтической туберкулезной вакцины, в том числе в качестве дополнения различных схем терапии туберкулеза. Описанные формы данных вакцинных конструкций могут вводиться подкожно, внурикожно, внутримышечно, внутривенно, орально, через респираторный тракт, в различных сочетаниях.
Далее проводилась оценка эффективности индукции Т-клеточного ответа in vitro с помощью полученных полиэпитопных конструкций.
Для этого было подобрано 10 здоровых доноров, преимущественно экспрессирующих аллельный вариант HLA-A*0201, поскольку помимо универсальной конструкции в экспериментах используется вариант полиэпитопного антигена, спроектированного именно для этого аллельного варианта молекулы MHC класса I человека, поскольку этот алломорф является одним из наиболее распространенных в мировой человеческой популяции. Генотипирование проводилось с помощью ПЦР с использованием коммерческого набора ALLSET™ GOLD HLA A LOW RES SSP (Invitrogen, USA). В итоге было отобрано 10 HLA-A*02-положительных доноров. Точного генотипирования аллельных вариантов HLA не проводилось, поскольку подавляющее число HLA-A*02-положительных индивидуумов несут аллель HLA-A*0201 (ожидаемый процент носителей данного аллельного варианта HLA-A среди HLA-A*02-положительных индивидуумов не менее 75-80%).
Из полученной периферической крови с помощью стандартной методики были выделены мононуклеарные клетки (МНК). В полученной фракции клеток проверяли уровень экспресии маркеров CD3, CD14. Из полученной фракции мононуклеарных клеток с помощью сорбции на пластике отбирали фракцию моноцитов. Проверяли уровень экспресии маркеров CD3, CD14 в полученной фракции клеток для оценки обогащения фракции моноцитами. МНК были выделены из периферической крови HLA-A2-положительных доноров с помощью центрифугирования в градиенте плотности фиколл-урографина (Sigma-Aldrich, USA; Schering, Germany). Фракцию МНК, обогащенную моноцитами, получали методом адгезии на пластике (Nunc, Denmark) в результате культивирования в течение 1 часа. Неприлипшие клетки удаляли и сохраняли для дальнейшего использования.
Для получения незрелых дендритных клеток (ДК) фракция прилипающих МНК культивировалась в среде AIM-V (Invitrogen, USA), содержащей 50 нг/мл рчGM-CSF (BioVision, USA) и 200 нг/мл рчIL-4 (BioVision, USA) (Obermaier B. et.al, Biol Proced Online, 2003, (5):197-203). После 24 часов для созревания ДК в культуру добавлялся ЛПС (E. coli 055:B5, Sigma, USA) в количестве 5 мкг/мл. Через 24 часа после добавления ЛПС клетки собирались и использовались как зрелые ДК. Фенотип полученных ДК подтверждался с помощью моноклональных антител, меченных FITC или PE, специфичных к CD3, CD11c, CD14, CD83, CD86 и HLA-DR (BD Biosciences, USA). Интенсивность флуоресценции измерялась с помощью FACSCalibur (BD Biosciences, USA). Фагоцитирующая активность ДК оценивалась с использованием декстрана, конъюгированного с FITC (Sigma, USA) (Della Bella S. et. al, J. Leukocyte Biol., 2004, 75(1):106-16; Kato M. et.al. Int. Immunol., 2000, 11:1511-1519).
Полученные зрелые ДК были трансфецированы целевыми плазмидами с помощью специальной методики магнитной трансфекции (MATra - agnet assisted transfection, Promokine, Germany) согласно протоколу производителя (http://www.promokine.info/fileadmin/PDFs/Cell_Transfection/MATra_handbook_PromoKine.pdf). Эффективность трансфекции подтверждалась с помощью ОТ-ПЦР, а также с помощью флуоресцентной микроскопии. Флуоресцентные плазмиды были созданы с помощью кита для ник-трансляции (PromoKine, Germany).
Полученные зрелые ДК подвергались совместному культивированию с неприлипающими МНК в течение 48 часов в соотношении ДК:МНК = 1:10 в присутствии 40 нг/мл рчIL-18 и 10 нг/мл рчIL-12 (BioVision, USA) для стимуляции эффекторных Т-лимфоцитов.
Макрофаги были получены в результате инкубации прилипающих МНК в среде AIM-V (Invitrogen, USA), содержащей 100 нг/мл рчМ-CSF (BioVision, USA), в течение 72 часов.
Далее проводилось получение незрелых ДК из моноцитов. Для этого фракция клеток, обогащенная моноцитами, инкубировалась с рекомбинантным человеческим GM-CSF (в концентрации 50 нг/мл) и рекомбинантным человеческим IL-4 (в концентрации 100 нг/мл). Исследовали фенотип полученных клеток: оценивали уровень экспрессии маркеров CD14, CD11c, CD83, CD86, HLA-DR и фагоцитирующую активность (по захвату Fitc-Dextran). Проводили трансфекцию незрелых ДК созданными вакцинными плазмидами с использованием набора MATra (Magnet assisted transfection, Promokine, USA) согласно протоколу, рекомендованному производителем. Оценку эффективности трансфекции проводили с помощью дот-блот анализа и проточной цитометрии с внутриклеточным окрашиванием. Полученные результаты подтверждают эффективность трансфекции и достаточно высокий уровень экспрессии целевых антигенов.
Под действием ФНО проводилось созревание трансфецированных дендритных клеток. Созревание ДК подтверждали с помощью оценки уровня экспресии маркеров CD14, CD11c, CD83, CD86, HLA-DR и снижением фагоцитирующей активности (захват Fitc-Dextran). В итоге были получены зрелые ДК с доказанной экспрессией полиэпитопных антигенов.
Полученные зрелые ДК использовали для совместного культивирования с полученными ранее аутологичными неадгезированными фракциями мононуклеарных клеток периферической крови (ПК) (в соотношении 1:10) в присутствии рекомбинантных человеческих цитокинов ИЛ-18 и ИЛ-12 для стимуляции клеточного иммунного ответа. Напомним, что стратегия вакцинации предполагает совместное введение одной или нескольких конструкций для вызова ответа CD8+ ЦТЛ и одной или нескольких конструкций для вызова ответа CD4+ Т-хелперных лимфоцитов. Было создано восемь групп (в скобках приведена смесь плазмид, которыми трансфецировались ДК):
1. ДК:(pTBUi+pTBih) + МНК ПК;
2. ДК:(pTBUi_a0201+pTBih) + МНК ПК;
3. ДК:(pTBUe+pTBih) + МНК ПК;
4. ДК:(pTBUe_a0201+pTBih) + МНК ПК;
5. ДК:(pTBUd+pTBih) + МНК ПК;
6. ДК:(pTBUd_a0201+pTBih) + МНК ПК;
7. ДК, стимулированные лизатом M. tuberculosis H37Rv, + МНК ПК;
8. Не стимулированные МНК ПК.
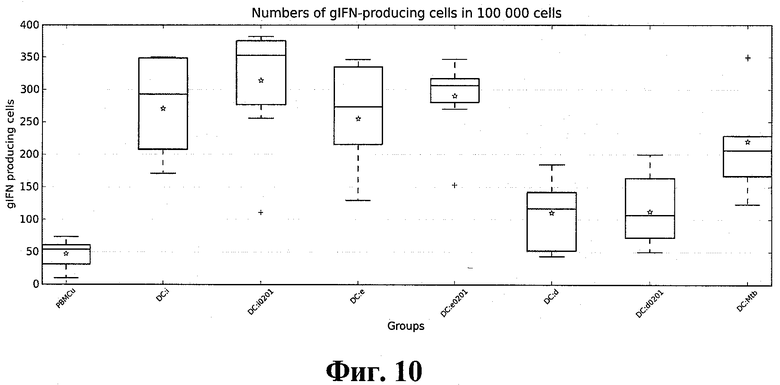
Для изучения Т-клеточного ответа в качестве клеток-мишеней для каждого случая были использованы аутологичные ДК, инфицированные M. tuberculosis H37Rv. В культурах ДК + МНК ПК проводилось изучение уровня продукции γIFN в ответ на добавление к культуре аутологичных макрофагов, инфицированных M. tuberculosis H37Rv, обработанных митомицином С для подавления пролиферации. Для предотвращения секреции цитокинов в культуру был добавлен Brefeldin A. Оценка продукции γIFN проводилась с помощью ELISpot. Результаты представлены на фиг. 10.
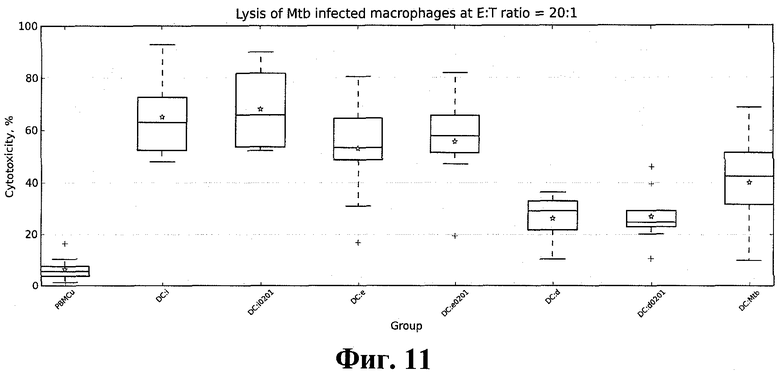
Было проведено изучение цитотоксического ответа. Для этого с помощью колориметрического метода (CytoTox 96® Non-Radioactive Cytotoxicity Assay, Promega, USA) определялся уровень активности лактат-дегидрогеназы (ЛДГ) - цитозольного фермента, высвобождаемого в результате лизиса клеток-мишеней (аутологичных макрофагов, инфицированных M. tuberculosis H37Rv) под действием полученных эффекторных Т-лимфоцитов, согласно протоколу изготовителя (http://www.promega.com/tbs/tb163/tb163.pdf). Интенсивность окраски, прямо пропорциональная количеству лизированных клеток, измерялась с помощью мультимодального ридера LB 941 TriStar (Berthold Technologies, Germany). Результаты этих экспериментов представлены на фиг. 11.
Оценка достоверности отличий полученных результатов проводилась с помощью теста Манна-Уитни. Значения p < 0.05 считались статистически достоверными (табл. 1). Как и ожидалось, все полиэпитопные конструкции продемонстрировали более высокую эффективность индукции Т-клеточного иммунного ответа, по сравнению с отрицательной контрольной группой (p < 0.001). Во всех экспериментальных группах количество клеток, продуцирующих γIFN спонтанно, было достоверно меньше (p < 0.05) количества γIFN-продуцирующих клеток после стимуляции клетками-мишенями (данные не приведены). Отличие эффективности индукции Т-клеточного иммунного ответа универсальными конструкциями (pTBUi, pTBUe и pTBUd) от соответствующих им аллелеспецифических вариантов (pTBUi_a0201, pTBUe_a0201 и pTBUd_a0201) для наиболее распространенного в человеческой популяции аллеля HLA-A*0201 оказалось статистически недостоверным (p > 0.1).
Таблица 1. Результаты статистического анализа экспериментальных данных.
Примечание. Анализ проводили с использованием теста Манна-Уитни, статистически достоверными считались значения p < 0.05.
Обозначения.
DC:i - ДК:(pTBUi+pTBih) + МНК ПК;
DC:i0201 - ДК:(pTBUi_a0201+pTBih) + МНК ПК;
DC:e - ДК:(pTBUe+pTBih) + МНК ПК;
DC:e0201 - ДК:(pTBUe_a0201+pTBih) + МНК ПК;
DC:d - ДК:(pTBUd+pTBih) + МНК ПК;
DC:d0201 - ДК:(pTBUd_a0201+pTBih) + МНК ПК;
DC:Mtb - ДК, стимулированные лизатом M. tuberculosis H37Rv, + МНК ПК;
PBMCu - не стимулированные МНК ПК.
Согласно полученным результатам, наиболее эффективно Т-клеточный иммунный ответ стимулировался ДК, трансфецированными смесью плазмид pTBUi, кодирующей поли-ЦТЛ-эпитоп, составленный на основе эпитопов иммунодоминантных антигенов M. tuberculosis, и pTBih, кодирующей поли-Т-хелперный иммуноген, составленный на основе эпитопов иммунодоминантных антигенов M. tuberculosis. Близкую, хотя и несколько меньшую, эффективность показала плазмида pTBUe, кодирующая поли-ЦТЛ-эпитоп, составленный на основе эпитопов ESAT-подобных антигенов M. tuberculosis.
Использование плазмид, кодирующих поли-Т-хелперные иммуногены, составленные на основе эпитопов ESAT-подобных (pTBeh) и DosR (pTBdh) антигенов M. tuberculosis, в соответствующих конструкциях ДК:(pTBUe+pTBeh) + МНК ПК и ДК:(pTBUd+pTBdh) + МНК ПК не показало достоверных отличий по сравнению с использованием плазмиды pTBih, кодирующей поли-Т-хелперный иммуноген, составленный на основе эпитопов иммунодоминантных антигенов M. tuberculosis.
| название | год | авторы | номер документа |
|---|---|---|---|
| Полиэпитопная противоопухолевая вакцинная конструкция, содержащая эпитопы опухоль-ассоциированных антигенов, фармацевтическая композиция и ее применение для стимуляции специфического противоопухолевого иммунного ответа | 2016 |
|
RU2684235C2 |
| ПОЛИЭПИТОПНЫЕ ИММУНОГЕННЫЕ ПОЛИПЕПТИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2598265C2 |
| СПОСОБ СТИМУЛЯЦИИ ЦИТОТОКСИЧЕСКОГО ИММУННОГО ОТВЕТА ПРОТИВ КЛЕТОК ОПУХОЛЕВОЙ ЛИНИИ АДЕНОКАРЦИНОМЫ МОЛОЧНОЙ ЖЕЛЕЗЫ, ЭКСПРЕССИРУЮЩИХ СПЕЦИФИЧЕСКИЕ АНТИГЕНЫ, С ПОМОЩЬЮ ДЕНДРИТНЫХ КЛЕТОК, ТРАНСФЕЦИРОВАННЫХ ПОЛИЭПИТОПНОЙ ДНК-КОНСТРУКЦИЕЙ | 2012 |
|
RU2520091C2 |
| СПОСОБ ПОЛУЧЕНИЯ АНТИГЕН-СПЕЦИФИЧЕСКИХ ЦИТОТОКСИЧЕСКИХ КЛЕТОК, ОБЛАДАЮЩИХ АКТИВНОСТЬЮ ПРОТИВ КЛЕТОК РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2013 |
|
RU2596920C2 |
| Искусственный ген MEL-TCI, кодирующий полиэпитопный белок-иммуноген MEL-TCI, рекомбинантная плазмидная ДНК pMEL-TCI, обеспечивающая экспрессию искусственного гена MEL-TCI и искусственный белок-иммуноген MEL-TCI, содержащий CTL- и Th-эпитопы антигенов меланомы, рестриктированные множественными аллелями HLA I и II класса | 2017 |
|
RU2650872C1 |
| ИСКУССТВЕННЫЙ ГЕН MEL-TCI-A0201, КОДИРУЮЩИЙ ПОЛИЭПИТОПНЫЙ БЕЛОК-ИММУНОГЕН MEL-TCI-A0201, РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pMEL-TCI-A0201, ОБЕСПЕЧИВАЮЩАЯ ЭКСПРЕССИЮ ИСКУССТВЕННОГО ГЕНА MEL-TCI-A0201 И ИСКУССТВЕННЫЙ БЕЛОК-ИММУНОГЕН MEL-TCI-A0201, СОДЕРЖАЩИЙ МНОЖЕСТВЕННЫЕ CTL- И Th-ЭПИТОПЫ АНТИГЕНОВ МЕЛАНОМЫ | 2012 |
|
RU2522830C2 |
| Способ получения in vitro популяций активированных антигенспецифических противоопухолевых цитотоксических Т-лимфоцитов, специфичных к эпитопам опухоль-ассоциированного антигена | 2016 |
|
RU2619186C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pCI-UB-POLYEPI, СОДЕРЖАЩАЯ ЭПИТОПЫ ОПУХОЛЬ-АССОЦИИРОВАННЫХ АНТИГЕНОВ ДЛЯ КОЛОРЕКТАЛЬНОГО РАКА, И СПОСОБ ЕЕ ПРИМЕНЕНИЯ ДЛЯ СТИМУЛЯЦИИ СПЕЦИФИЧЕСКОГО ПРОТИВООПУХОЛЕВОГО ИММУННОГО ОТВЕТА ПРОТИВ КЛЕТОК КОЛОРЕКТАЛЬНОГО РАКА | 2012 |
|
RU2507265C2 |
| Искусственный ген, кодирующий белок-иммуноген BSI-COV, рекомбинантная плазмидная ДНК pBSI-COV, обеспечивающая экспрессию целевого гена, и искусственный полиэпитопный белок-иммуноген BSI-COV, содержащий эпитопы антигенов вируса SARS-CoV-2 и индуцирующий SARS-CoV-2-специфический T-клеточный иммунитет | 2023 |
|
RU2806556C1 |
| Искусственный ген, кодирующий белок-иммуноген BSI-COV-Ub, рекомбинантная плазмидная ДНК pBSI-COV-Ub, обеспечивающая экспрессию целевого гена, и искусственный полиэпитопный белок-иммуноген BSI-COV-Ub, содержащий убиквитин и эпитопы антигенов вируса SARS-CoV-2 и индуцирующий SARS-CoV-2-специфический Т-клеточный иммунитет | 2023 |
|
RU2806590C1 |



















Изобретение относится к области генетической инженерии, молекулярной биологии и вакцинологии. Предложена полиэпитопная противотуберкулезная вакцинная конструкция для формирования иммунного ответа, обеспечивающая индукцию иммунного ответа CD8+ Т-лимфоцитов, состоящая из универсального полиэпитопного иммуногена, содержащего ЦТЛ-эпитопы, выбранные из иммунодоминантных антигенов М. tuberculosis, слитого с N-конца с убиквитином, и имеющая аминокислотную последовательность SEQ ID NO: 1. Вакцинная конструкция обеспечивает достижение эффективного терапевтического Т-клеточного иммунного ответа не только за счет антигенспецифических цитотоксических СD8+ Т-лимфоцитов, но и интенсивный ответ CD4+ Т-лимфоцитов. 1 табл., 11 ил.
Полиэпитопная противотуберкулезная вакцинная конструкция для формирования иммунного ответа, обеспечивающая индукцию иммунного ответа CD8+ Т-лимфоцитов, состоящая из универсального полиэпитопного иммуногена, содержащего ЦТЛ-эпитопы, выбранные из иммунодоминантных антигенов М. tuberculosis, слитого с N-конца с убиквитином, и имеющая аминокислотную последовательность SEQ ID NO: 1.
| ПОЛИНУКЛЕОТИДНАЯ ПРОТИВОТУБЕРКУЛЕЗНАЯ ВАКЦИНА | 1995 |
|
RU2186109C2 |
| WO 2010010577 A1, 28.01.2010 | |||
| US 20050058626 A1, 17.03.2005 | |||
Авторы
Даты
2015-01-10—Публикация
2011-01-13—Подача