Предпосылки создания изобретения
Основным препятствием при разработке вакцин против вирусов и бактерий, особенно против вирусов и бактерий со многими серотипами или высокой скоростью мутации, против которых требуется выявление нейтрализующих антител и/или защитные клеточно-опосредованные иммунные ответы, является многообразие наружных белков среди изолятов или штаммов. Так как цитотоксические Т-лимфоциты (ЦТЛ) как у мышей, так и у людей способны распознавать эпитопы, образованные из консервативных внутренних вирусных белков [J.W. Yewdell et al., Proc. Natl. Acad. Sci. (USA) 82, 1785 (1985); A.R.M. Townsend, et al., Cell 44, 959 (1986); A.J. McMichael., et al., J. Gen. Virol. 67, 719 (1986); J. Bastin et al. , J. Exp. Med. 165, 1508 (1987); A.R.M. Townsend and H. Bodmer, Annu. Rev. Immunol. 7, 601 (1989)] и, как полагают, важны при иммунной реакции против вирусов [Y. -L. Lin and В.А. Askonas, J. Exp. Med. 154, 225 (1981); I. Gardner et al., Eur. J. Immunol. 4, 68 (1974); K.L. Yap and G.L. Ada, Nature 273, 238 (1978); A.J. McMichael et al., New Engl. J. Med. 309, 13 (1983); P. M. Taylor and B.A. Askonas, Immunol. 58, 417 (1986)]; усилия направлялись на разработку ЦТЛ-вакцин, способных обеспечить гетерологичную защищу против различных вирусных штаммов.
Известно, что ЦТЛ убивают клетки, инфицированные вирусом или бактериями, когда их Т-клеточные рецепторы распознают чужеродные пептиды, связанные с молекулами ГКГС класса I и/или класса II. Эти пептиды могут образоваться из эндогенно синтезированных чужеродных пептидов, независимо от расположения или функции белка в пределах патогена. Посредством распознавания эпитопов из консервативных белков ЦТЛ могут обеспечить гетерологичную защиту. В случае внутриклеточных бактерий белки, секретированные бактериями или выделенные из бактерий, процессируются и представляются молекулами ГКГС класса I и класса II, причем посредством этого генерируются Т-клеточные реакции, которые могут играть роль в ослаблении или уничтожении инфекции.
В большинстве работ по генерации ЦТЛ-реакций использовались либо векторы репликации для получения белкового антигена в клетке [J.R. Bennink et al., там же, 311, 578 (1990); J.R. Bennink and J.W. Yewdell, Curr. Top. Microblol. Immunol. 163, 153 (1990); С.К. Stover et al./ Nature 351, 456 (1991); A. Aldovini and R.A. Young, Nature 351, 479 (1991); R. Schafer et al., J. Immunol. 149, 53 (1992); C.S. Hahn et al., Proc. Natl. Acad. Sci. (USA) 89, 2679 (1992)], либо они фокусировались на введении пептидов в цитозоль [F.R. Carbone and M.J. Bevan, J. Exp. Med. 169, 603 (1989); К. Deres et al., Nature 342, 561 (1989); H. Takahashi et al., там же, 344, 873 (1990); D.S. Collins et al., J. Immunol. 148, 3336 (1992); M.J. Newman et al., там же, 148, 2357 (1992)] . Оба эти подхода имеют ограничения, которые могут снизить их полезность для вакцин. Ретровирусные векторы имеют ограничения по размеру и структуре полипептидов, которые могут экспрессироваться как слитые белки при сохранении способности рекомбинантного вируса к репликации [A.D. Miller, Curr. Top. Microbiol. Immunol. 158, 1 (1992)], и эффективность таких векторов как вакциния для последующих иммунизации может быть поставлена под угрозу иммунными реакциями против вакцинии [E.L. Cooney et al., Lancet 337, 567 (1991)] . Вирусные векторы и модифицированные патогены также небезопасны по природе, что может ограничить их применение для людей [R.R. Redfield et al., New Engl. J. Med. 316, 673 (1987); L. Mascola et al., Arch. Intern. Med. 149, 1569 (1989)]. Кроме того, селекция пептидных эпитопов, которые представлены, зависит от строения антигенов ГКГС индивидуума, и, следовательно, пептидные вакцины могут иметь ограниченную эффективность из-за многообразия гаплотипов ГКГС в аутбредных популяциях.
Benvenisty, N., и Rescef, L. [PNAS 83, 9551-9555, (1986)] показали, что можно экспрессировать осаждаемую СаСl2 ДНК, введенную мышам интраперитонеально (и. п. ), внутривенно (в.в.) или внутримышечно (в.м.). Показано, что внутримышечная (в.м.) инъекция ДНК-экспрессионных векторов мышам приводит, в результате, к поглощению ДНК мышечными клетками и экспрессии белка, кодированного данной ДНК [J.A. Wolff et al., Science 247, 1465 (1990); G. Ascadi et al. , Nature 352, 815 (1991)]. Показано, что плазмиды сохраняются эписомально и не реплицируются. Впоследствии наблюдали устойчивую экспрессию после в.м. инъекции в скелетные мышцы крыс, рыб и приматов, и в сердечную мышцу крыс [Н. Lin et al., Circulation 82, 2217 (1990); R.N. Kitsis et al., Proc. Natl. Acad. Sci. (USA) 88, 4138 (1991); E. Hansen et al., FEBS Lett. 290, 73 (1991); S. Jiao et al., Hum. Gene Therapy 3, 21 (1992); J.A. Wolff et al., Human Mol. Genet. 1, 363 (1992)]. О методах с использованием нуклеиновых кислот в качестве терапевтических агентов сообщается в WO90/11092 (4 октября 1990), где простые полинуклеотиды используются для вакцинации позвоночных.
Недавно рассматривались координированные роли В7 и представления главного комплекса гистосовместимости (ГКГС) эпитопов на поверхности антигенпредставляющих клеток при активации ЦТЛ для удаления опухолей [Edgington, Biotechnology 11, 1117-1119, 1993]. Когда молекула ГКГС на поверхности антигенпредставляющей клетки (АПК) представляет эпитоп к Т-клеточному рецептору (ТКР), В7, экспрессированный на поверхности той же АПК, действует как второй сигнал, связываясь с ЦТЛА-4 или с CD28. Результатом является быстрое деление CD4+ хелперных Т-клеток, которые дают сигнал CD8+ Т-клеткам пролиферировать и убивать АПК.
Для успеха метод иммунизации не обязательно является внутримышечным. Так, Tang с сотр. [Nature, 356, 152-154 (1992)] сообщают, что введение золотых микропулек (microprojectile), покрытых ДНК, кодирующей бычий гормон роста (BGH), в кожу мыши приводит к продуцированию у мыши антител против BGH. Furth с сотр. [Analitical Biochemistry, 205, 365-368 (1992)] показали, что для трансфекции кожной, мышечной, жировой ткани и ткани молочных желез живых животных можно использовать безыгольный инъектор. В последнее время сообщается о различных способах введения нуклеиновых кислот [Friedman, Т., Science, 244, 1275-1281 (1989)]. См. также Robinson et al. [Abstracts of Papers Presented at the 1992 meeting on Modern Approaches to New Vaccines, Including Prevention of AIDS, Cold Spring Harbor, p.92; Vaccine 11, 957 (1993)], где сообщается, что в.м., и.п. и в.в. введение цыплятам ДНК птичьего гриппа обеспечило защиту от смертельного контрольного заражения. Zhu с сотр. [Science 261, 209-211(9 July 1993); см. также WO93/24640/ 9 декабря 1993] сообщают, что внутривенная инъекция мышам комплекса ДНК с катионогенными липосомами приводит к системной экспрессии клонированного трансгена. Недавно Ulmer с сотр. [Science 259, 1745-1749 (1993)] сообщили о гетерологичной защите против заражения вирусом гриппа путем инъекции ДНК, кодирующей белки вируса гриппа.
Wang с сотр. [P.N.A.S. USA 90, 4156-4160 (May, 1993)] сообщают, что иммунных реакций у мышей против ВИЧ удалось добиться путем внутримышечной инокуляции клонированным геномным (без сплайсинга) геном ВИЧ. Однако достигнутый уровень иммунных ответов был очень низким, и система использовала части промотора длинного концевого повтора (LTR) вируса опухоли молочной железы мыши (MMTV) и части промотора вируса обезьян 40 (SV40) и терминатор. Известно, что SV40 трансформирует клетки, вероятно, через объединение с клеточной ДНК хозяина. Таким образом, система, описанная Wang с сотр., совершенно не подходит для введения людям, а такое введение является одной из целей настоящего изобретения.
В WO93/17706 описывается способ вакцинации животных против вируса, при котором на частицы носителя наносят покрытие из генной конструкции, и покрытые частицы ускоренно развиваются в клетках животного.
Исследования Wolff с сотр. (см. выше) впервые показали, что внутримышечная инъекция плазмидной ДНК, кодирующей репортерный ген, приводит к экспрессии такого гена в миоцитах в и вблизи места инъекции. Недавние сообщения описывают успешную иммунизацию мышей против гриппа посредством инъекции плазмид, кодирующих гемагглютинин гриппа A (Montgomery, D.L. et al., 1993, Cell Blol., 12, pp. 777-783), или нуклеопротеин (Montgomery, D.L. et al. , см. выше; Ulmer, J.B. et al., 1993, Science, 259, pp. 1745-1749). Сообщается о первом применении ДНК-иммунизации против вируса герпеса (Сох et al. , 1993, J. Virol. , 67, pp. 5664-5667). Инъекция плазмиды, кодирующей гликопротеин g IV бычьего герпесвируса 1 (BHV-1), вызывает появление антител против g IV у мышей и телят. После интраназального контрольного заражения BHV-1 у иммунизированных телят симптомы ослабевают, и выделение вируса в среду значительно меньшее, чем у контрольных животных.
Туберкулез (ТБ) является хроническим инфекционным заболеванием легких, вызванным патогенным микроорганизмом Mycobacterium tuberculosis. ТБ является одним из наиболее клинически существенных инфекционных заболеваний, широко распространенным во всем мире, с частотой смертельных случаев 3 миллиона в год и 10 миллионами новых случаев заболевания каждый год. Подсчитано, что приблизительно треть мирового населения может быть инфицирована, и сообщается о 55 миллионах случаев активного ТБ в развивающихся странах. До начала нынешнего века ТБ был основной причиной смерти в Соединенных Штатах. Но с улучшением санитарных условий и появлением противомикробных лекарственных средств смертность постепенно снизилась до уровня, исходя из которого предсказывали, что заболевание будет искоренено к 2000 году. Однако в большинстве развитых стран число случаев активного ТБ растет с середины 80-х годов с каждым годом. Частично это возрождение связано с иммиграцией и возрастающим числом людей с ослабленным иммунитетом и ВИЧ-инфицированных. Если ситуация не изменится, предсказано, что ТБ унесет более 30 миллионов человеческих жизней в следующем десятилетии. Даже большее беспокойство, чем эта тревожная картина, вызывает появление штаммов М.tuberculosis со множественной лекарственной устойчивостью (МЛУ, MDR). Такие МЛУ-штаммы не поддаются лечению обычными лекарственными средствами и ответственны за несколько последних вспышек ТБ, в частности, в городских районах. Поэтому одним из ключевых моментов в устранении ТБ на продолжительное время станет эффективная вакцина [для общего представления см. Bloom and Murray, 1993, Science 257, 1055].
M. tuberculosis является внутриклеточным патогеном, который инфицирует макрофаги и способен выживать в суровой окружающей среде фаголизосомы в клетке этого типа. Большинство попавших с дыханием бацилл разрушается активированными альвеолярными макрофагами. Однако выживающие бациллы могут размножаться в макрофагах и выделяться после гибели клетки, которая подает сигналы инфильтрации лимфоцитов, моноцитов и макрофагов к этому месту. Лизис нагруженных бациллами макрофагов опосредуется гиперчувствительностью замедленного типа (DTH) и приводит к развитию твердого казеозного туберкулезного бугорка, окружающего пространство инфицированных клеток. Продолжительная DTH заставляет туберкулезный бугорок разжижаться, причем при этом выселяются захваченные бациллы. Большая доза внеклеточных бацилл инициирует дальнейшую DTH, вызывая поражение бронхов и распространение инфекции лимфатическими, кроветворными и бронхиальными путями, и давая возможность, в конце концов, инфекционным бациллам распространяться при дыхании.
Иммунитет к ТБ включает несколько типов эффекторных клеток. Активация макрофагов цитокинами, такими как γ-интерферон, является эффективным способом снижения до минимума внутриклеточного микобактериального размножения. Однако полное искоренение бацилл таким способом часто не достигается. Приобретение защиты против ТБ требует Т-лимфоцитов. Из их числа оказываются важными как CD8+ так и CD4+ Т-клетки [Orme et al, 1993, J. Infect. Dis. 167, 1481]. Эти типы клеток секретируют γ-интерферон в ответ на микобактерии, что является признаком Thl-иммунной реакции, и обладают цитотоксической активностью в отношении отмеченных микобактериями клеток-мишеней. В недавних исследованиях с использованием мышей с дефицитом β-2-микроглобулина и CD8 показано, что ЦТЛ-реакции критичны при обеспечении защиты против М.tuberculosis [Flynn et al., 1992, Proc. Natl. Acad. Sci. USA 89, 12013; Flynn et al., 1993, J. Exp. Med. 178, 2249; Cooper et al., J. Exp. Med. 178, 2243]. В противоположность этому оказалось, что В-лимфоциты не включаются, и пассивный перенос антител против микобактерий не обеспечивает защиты. Следовательно, эффективные вакцины против ТБ должны генерировать клеточно-опосредованные иммунные реакции.
Антигенная стимуляция Т-клеток требует представления молекулами ГКГС. Чтобы микобактериальным антигенам приобрести доступ к антигенпредставленному пути, они должны выделиться из бактерий. В инфицированных макрофагах это может осуществиться путем секреции или бактериального лизиса. Микобактерии обладают многими потенциальными антигенами к Т-клеткам, и некоторые из них в настоящее время идентифицированы [Andersen 1994, Dan. Med. Bull. 41, 205].
Некоторые из этих антигенов секретированы бактериями. Вообще, считается, что иммунитет против ТБ опосредуется Т-клетками CD8+ и CD4+, направленными к этим секретированным антигенам. На мышиных моделях ТБ и моделях ТБ с морскими свинками защита от контрольного бактериального заражения, при измерении по уменьшению потери в весе, достигнута с использованием смеси секретированных микобактериальных антигенов [Pal and Horowitz, 1992, Infect. Immunity 60, 4781; Andersen 1994, Infect. Immunity 62, 2536; Collins, 1994, Veterin. Microbiol. 40, 95].
Несколько возможных Т-клеточных антигенов идентифицировано в М.tuberculosis, и некоторые из них иследовались в качестве мишеней для вакцин. В недавно опубликованной работе указано, что доминирующие Т-клеточные антигены представляют собой белки, которые секретированы микобактериями во время их нахождения в макрофагах, а именно, I) антигенный 85 комплекс белков (85А, 85В, 85С) [Wiker and Harboe, 1992, Microbiol. Rev. 56, 648], II) белок в 6 кДа, названный ESAT-6 [Andersen 1994, Infect. Immunity 62, 2536], III) липопротеин в 38 кДа с гомологией к PhoS [Young and Garbe, 1991, Res. Microbiol. 142, 55; Andersen, 1992, J. Infect. DIs. 166, 874], IV) хитшоковый белок GroEL в 65 кДа [Siva and Lowrie, 1994, Immunol. 82, 244], V) белок в 55 кДа, обогащенный пролином и треонином [Remain et al., 1993, Proc. Natl. Acad. Scl. USA 90, 5322], и VI) липопротеин в 19 кДа [Faith et al., 1991, Immunol. 74, 1].
Гены для каждого из трех антигенных 85 белков (А, В и С) клонированы и секвенированы [Borremans et al., 1989, Infect. Immunity 57, 3123; Content et al. , Infect. Immunity 59, 3205; DeWit et al., 1994, DNA Seq. 4, 267]. Кроме того, эти структурно родственные белки являются мишенями для сильных Т-клеточных реакций как после заражения, так и после вакцинации [Huygen et al., 1988, Scand. J. Immunol. 27, 187; Launois et al., 1991, Clin. Exp. Immunol. 86, 286; Huygen et al., 1992, Infect. Immunity 60, 2880; Munk et al., 1994, Infect. Immunity 62, 726; Launois et al., 1994, Infect. Immunity 62, 3679]. Поэтому считается, что 85 антигенные белки являются хорошими вакцинными мишенями.
Краткое изложение сущности изобретения
Чтобы проверить эффективность ДНК-иммунизации при предупреждении заболевания М.tb, ДНК-последовательности, кодирующие М.tb, клонируют в эукариотных экспрессионных векторах. Эти ДНК-конструкции при инъекции животным выявляют иммунную реакцию. Иммунизированных животных заражают микобактериями, чтобы оценить, может или нет прямая ДНК-иммунизация геном (или другими генами М.tb) защитить животных от заболевания. Также описываются нуклеиновые кислоты, включая ДНК-конструкции и РНК-транскрипты, способные индуцировать in vivo экспрессию белков М. tb после прямого введения в ткани животного посредством инъекции или иным путем. Инъекция таких нуклеиновых кислот может выявить иммунные реакции, которые приводят к продуцированию цитотоксичных Т-лимфоцитов (ЦТЛ), специфических для антигенов M.tb, так же, как и к генерации М.tb-специфических хелперных Т-лимфоцитных реакций, которые являются защитными при последующем контрольном заражении. Эти нуклеиновые кислоты полезны в качестве вакцин для индуцирования иммунитета к М.tb, который может предотвратить инфекцию и/или уменьшить интенсивность заболевания, вызванного М. tb.
Краткое описание чертежей
На фиг. 1 показаны общие принципы клонирования генов M.tb в экспрессионных векторах.
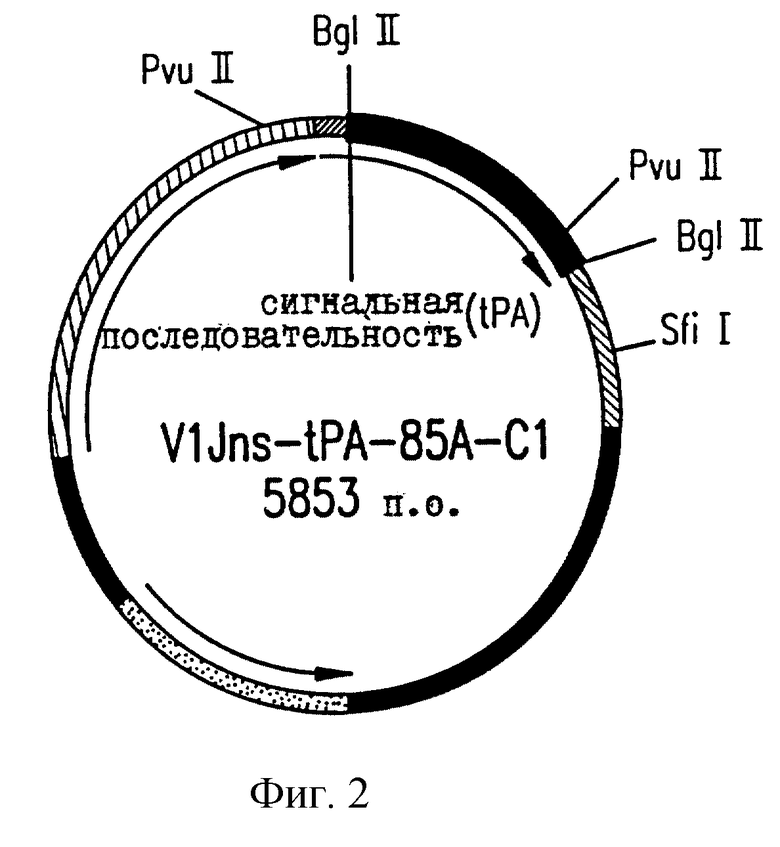
На фиг.2 приводится векторная карта V1Jns.tPA85A.Cl.
На фиг.3 приводится векторная карта V1Jns.85A.C2.
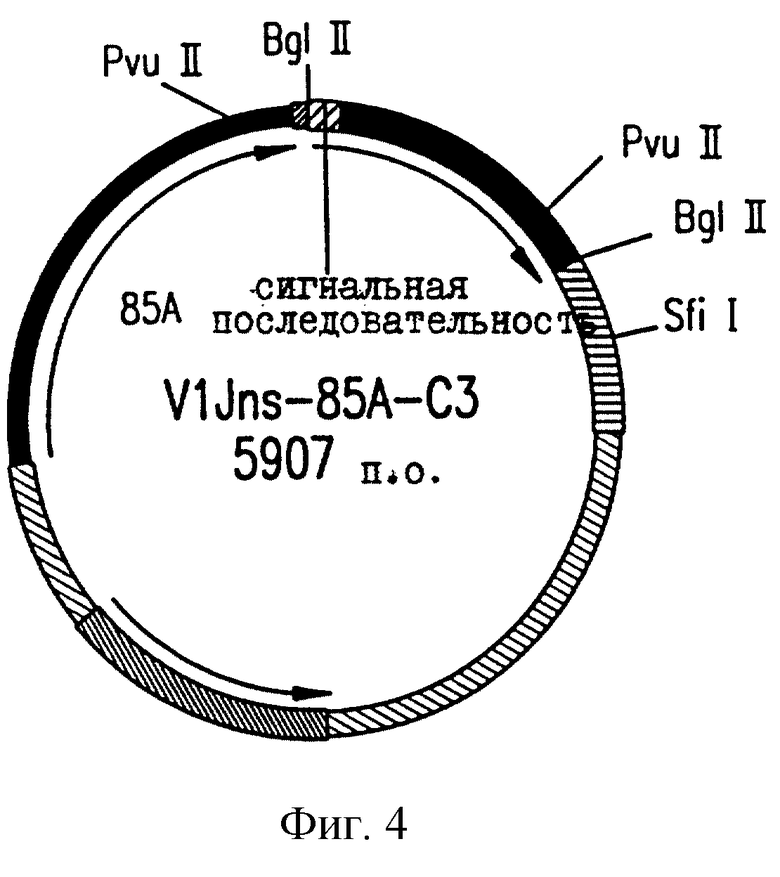
На фиг.4 приводится векторная карта V1Jns.85A.C3.
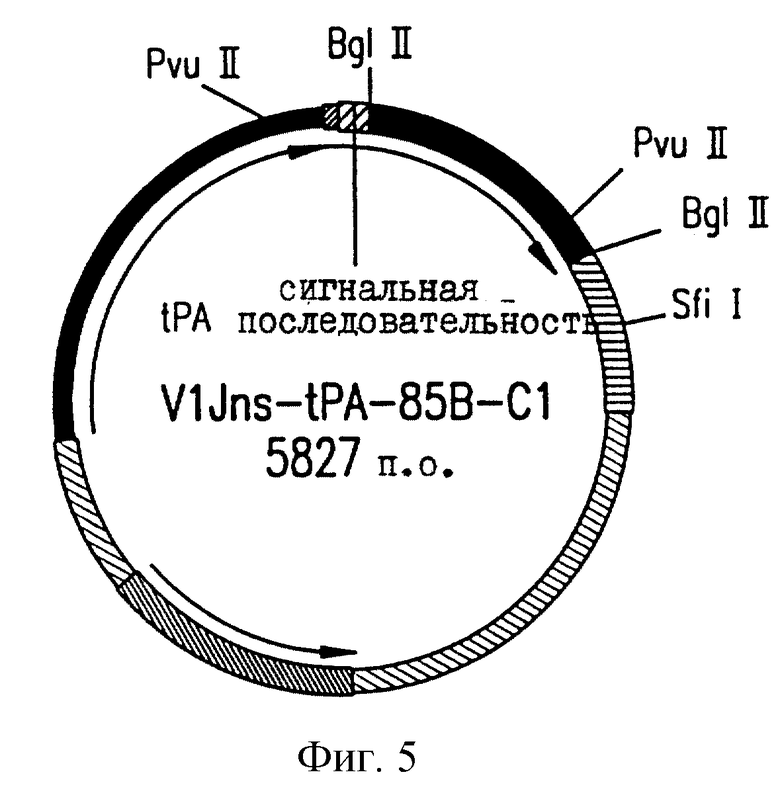
На фиг.5 приводится векторная карта VlJns.tPA 85В.С1.
На фиг.6 приводится векторная карта V1Jns. tPA85C.Cl.
На фиг.7 показано подтверждение N-концевых последовательностей конструкций.
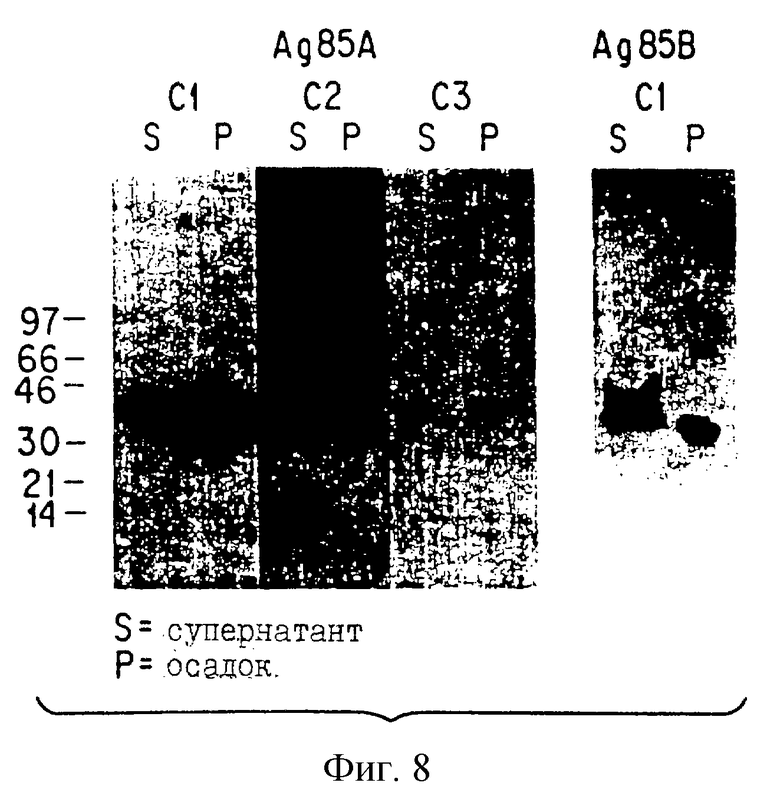
На фиг.8 показана экспрессия белков M.tb в тканевой культуре.
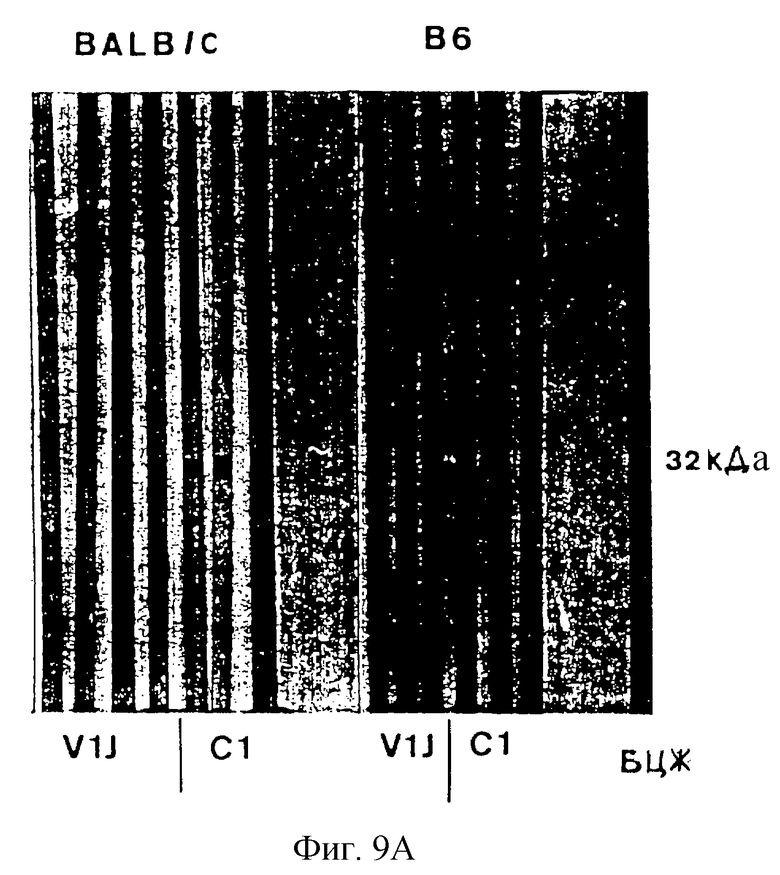
На фиг. 9. показано продуцирование антиген-85А-специфических антител у мышей, вакцинированных ДНК.
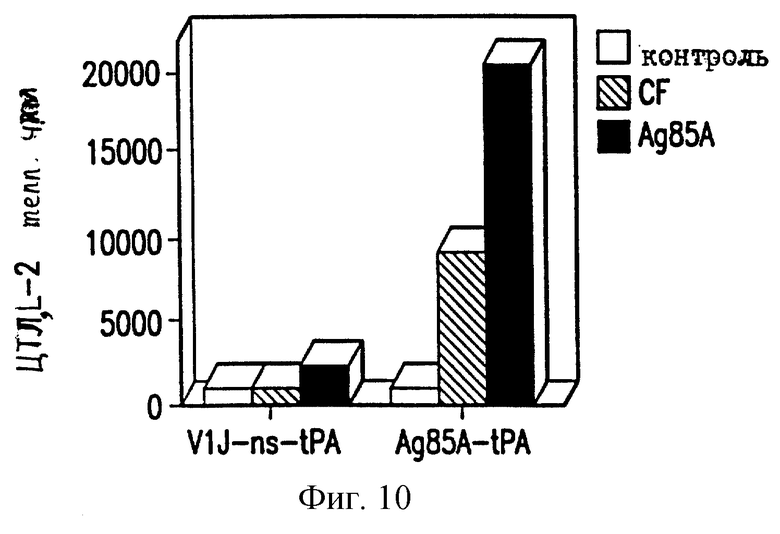
На фиг. 10 показано продуцирование ИЛ-2 у мышей BALB/c ДНК-вакциной против ТБ.
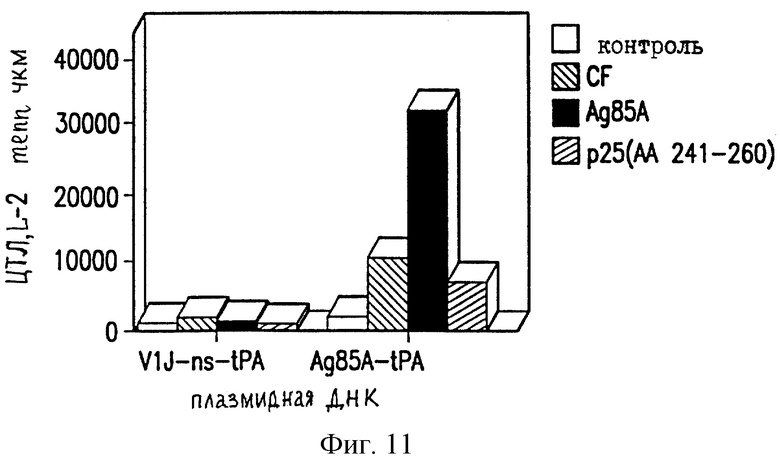
На фиг. 11 показано продуцирование ИЛ-2 у мышей C57BL/6 ДНК-вакциной против ТБ.
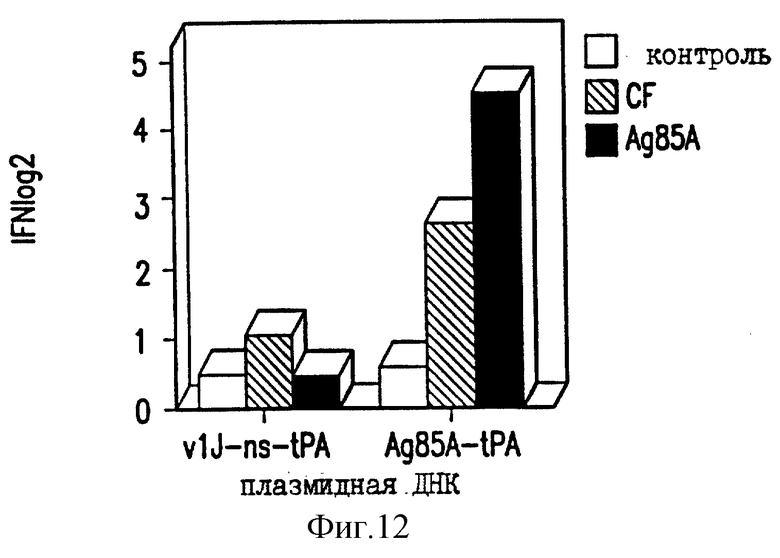
На фиг.12 показано продуцирование γ-интерферона у мышей BALB/c ДНК-вакциной против ТБ.
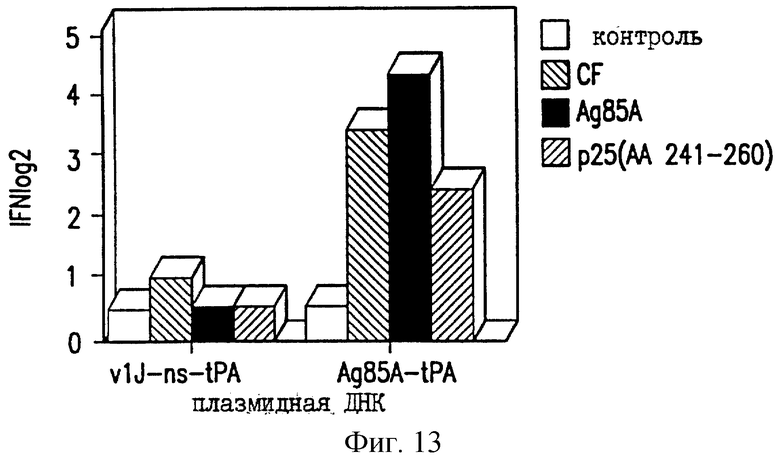
На фиг.13 показано продуцирование γ-интерферона у мышей C57BL/6 ДНК-вакциной против ТБ.
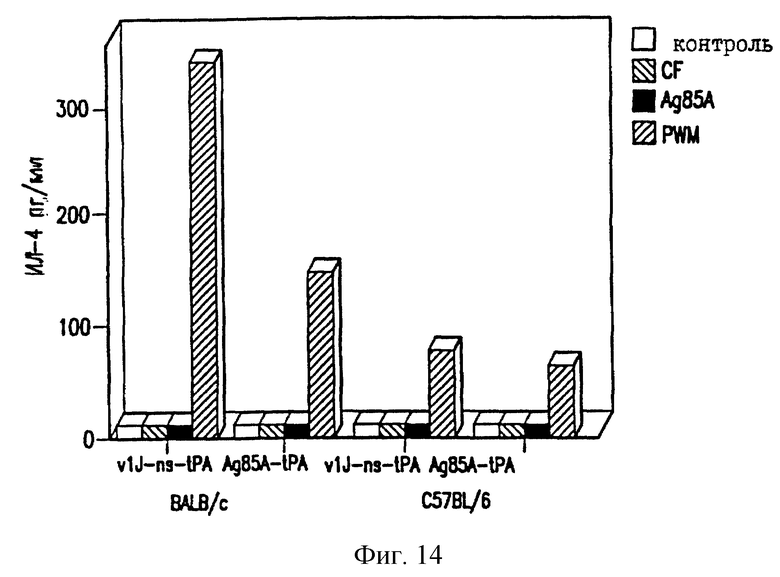
На фиг. 14 показано отсутствие продуцирования ИЛ-4 у мышей BALB/c ДНК-вакциной против ТБ.
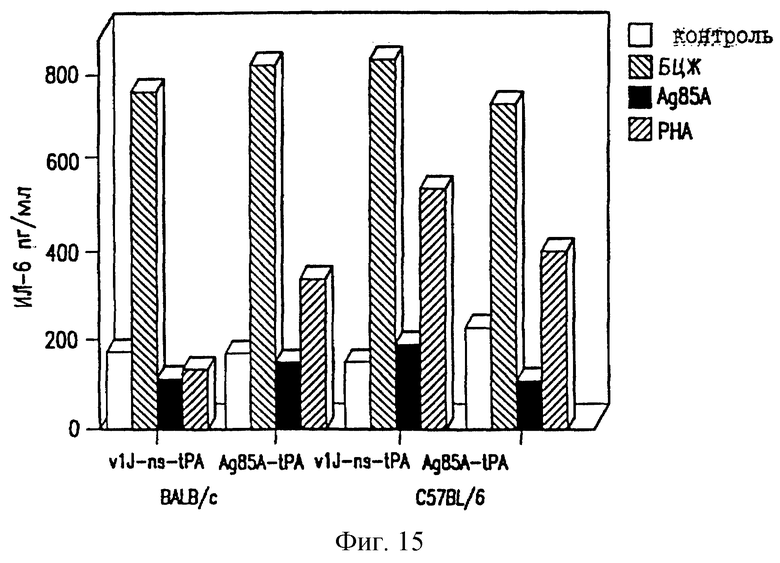
На фиг. 15 показано отсутствие продуцирования ИЛ-6 у мышей ДНК-вакциной против ТБ.
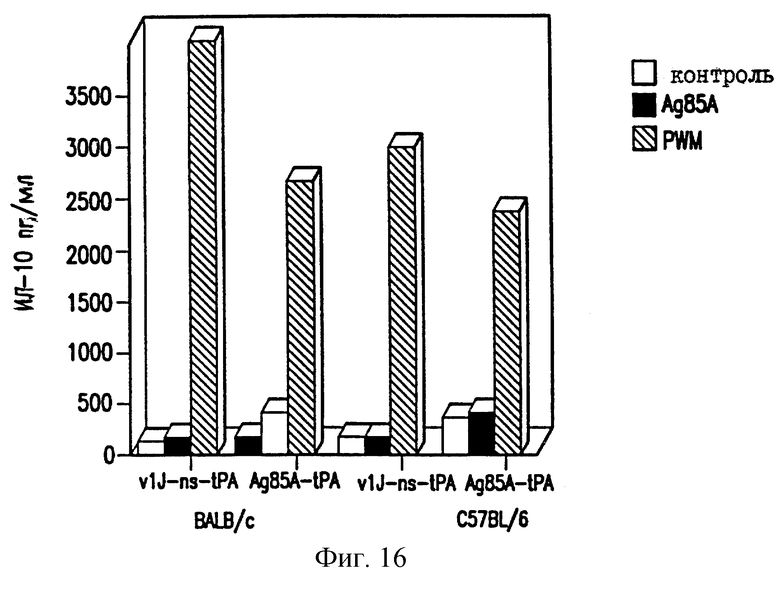
На фиг.16 показано отсутствие продуцирования ИЛ-10 у мышей ДНК-вакциной против ТБ.
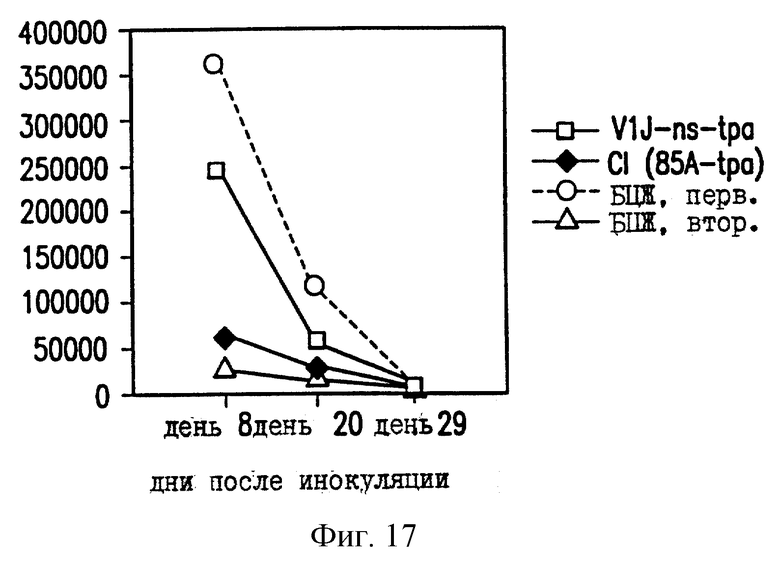
На фиг. 17 показано уменьшение размножения ВЦЖ в легких мышей C57BL/6, вакцинированных ДНК-вакциной против ТБ.
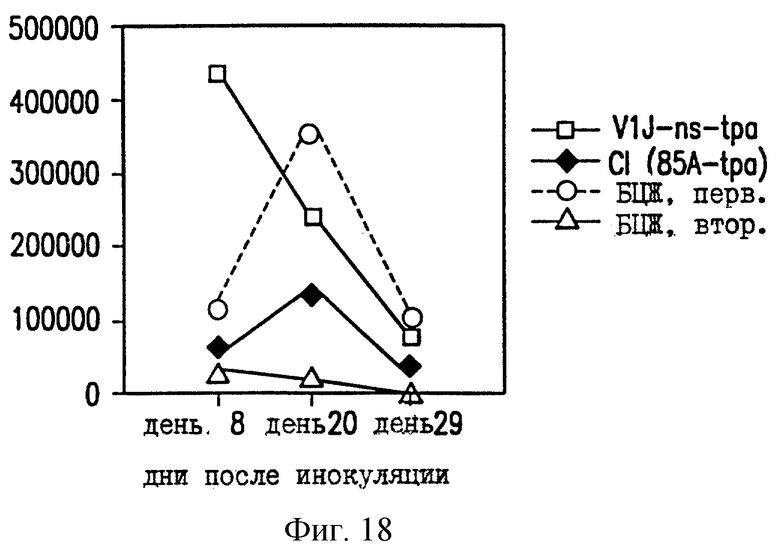
На фиг. 18 показано уменьшение размножения ВЦЖ в легких мышей BALB/c, вакцинированных ДНК-вакциной против ТБ.
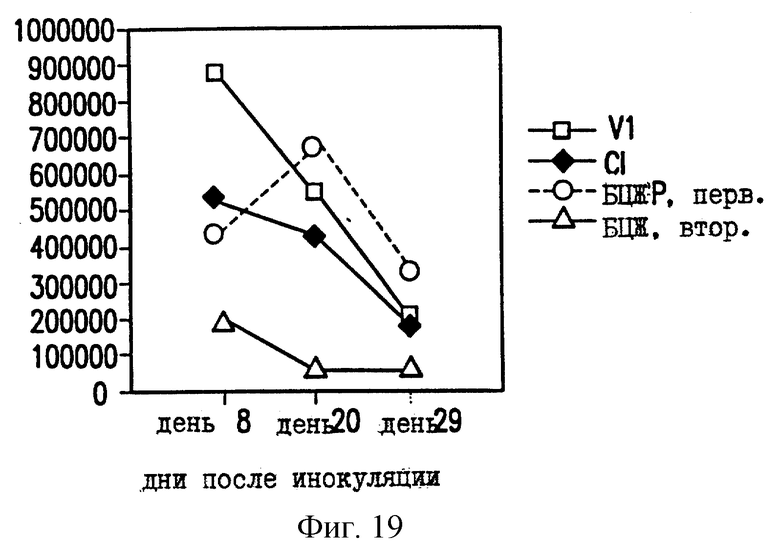
На фиг.19 показано уменьшение размножения ВЦЖ в селезенке мышей BALB/c, вакцинированных ДНК-вакциной против ТБ.
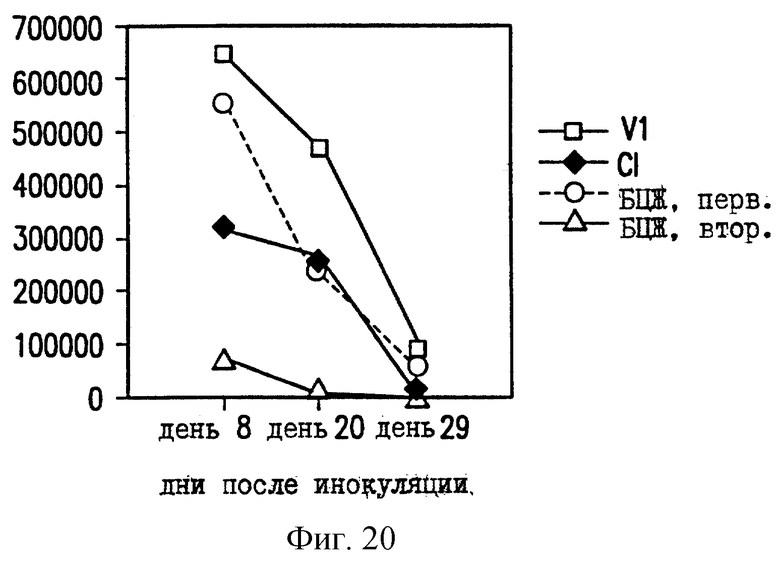
На фиг.20 показано уменьшение размножения ВЦЖ в селезенке мышей C57BL/6, вакцинированных ДНК-вакциной против ТБ.
Подробное описание изобретения
Настоящее изобретение относится к полинуклеотидам, которые при непосредственном введении in vivo позвоночному, включая млекопитающих, например людей, индуцируют экспрессию кодированных белков в организме животного. Используемый здесь термин "полинуклеотид" означает нуклеиновую кислоту, которая содержит основные регуляторные элементы, такие как после введения в клетку живого позвоночного, и способна управлять клеточным комплексом, который продуцирует продукты трансляции, кодированные генами, содержащими полинуклеотид. В одном из вариантов осуществления изобретения полинуклеотид представляет собой полидезоксирибонуклеиновую кислоту, содержащую гены Micobacterium tuberculosis (M. tb), оперативно связанные с промотором транскрипции. В другом варианте осуществления изобретения полинуклеотидная вакцина содержит полирибонуклеиновую кислоту, кодирующую гены М. tb, которые поддаются трансляции эукариотным клеточным комплексом (рибосомы, тРНК и другие факторы трансляции). Когда белок, кодированный полинуклеотидом, представляет собой белок, который обычно не встречается у животного, за исключением патологических состояний (т.е. гетерологичный белок), как, например, белки, ассоциированные с М. tb, иммунная система животного активируется, чтобы запустить защитную иммунную реакцию. Так как эти экзогенные белки продуцированы собственными тканями животного, экспрессированные белки процессируются главным комплексом гистосовместимости (ГКГС) аналогично случаю, когда имеет место фактическое заражение M. tb. Результатом, как описано здесь, является индукция иммунных реакций против М. tb. Полинуклеотиды для цели генерации иммунных реакций к кодированному белку названы здесь полинуклеотидными вакцинами или ПНВ (PNV).
Существует много вариантов осуществления настоящего изобретения, которые специалисты в данной области техники могут представить на основании описания. Так, могут успешно использоваться различные промоторы транскрипции, терминаторы, векторы-носители или специфические генные последовательности.
Настоящее изобретение относится к способу применения полинуклеотида, который после введения в ткань млекопитающего индуцирует экспрессию in vivo полинуклеотида, продуцируя посредством этого кодированный белок. Для специалистов в этой области техники совершенно очевидно, что можно получить вариации или производные нуклеотидной последовательности, кодирующей белок, которые изменяют аминокислотную последовательность кодированного белка. Измененный экспрессированный белок может иметь измененную аминокислотную последовательность, но еще выявляет иммунные ответы для реакции с микобактериальным белком и считается функциональным эквивалентом. Кроме того, можно также создать фрагменты непроцессированных генов, которые кодируют части непроцессированного белка. Эти фрагменты могут кодировать белок или пептид, которые выявляют антитела, которые реагируют с микобактериальным белком, и считаются функциональными эквивалентами.
В одном из вариантов осуществления настоящего изобретения ген, кодирующий генный продукт М.tb, включается в экспрессионный вектор. Вектор содержит промотор транскрипции, распознаваемый эукариотной РНК-полимеразой, и терминатор транскрипции на конце последовательности, кодирующей ген М.tb. В предпочтительном варианте осуществления изобретения промотор представляет собой цитомегаловирусный промотор с последовательностью интрона-А (CMV-intA), хотя специалистам в этой области техники известно, что можно использовать любой промотор из числа других известных промоторов, например сильнодействующий иммуноглобулин, или другие эукариотные генные промоторы. Предпочтительным терминатором транскрипции является терминатор бычьего гормона роста. Предпочтительно сочетание CMVintA с терминатором BGH. Кроме того, для содействия в получении полинуклеотидов в прокариотных клетках также, необязательно, включают маркер устойчивости к антибиотикам в экспрессионный вектор под транскрипционным контролем подходящего прокариотного промотора. Могут быть использованы гены устойчивости к ампициллину, гены устойчивости к неомицину или любой другой подходящий маркер устойчивости к антибиотику. В предпочтительном варианте осуществления настоящего изобретения ген устойчивости к антибиотику кодирует генный продукт для устойчивости к неомицину/ канамицину. Кроме того, чтобы содействовать высокому уровню продуцирования полинуклеотида путем роста в прокариотных организмах, выгодно, чтобы вектор содержал прокариотный ориджин репликации и состоял из большого числа копий. Любой вектор из числа коммерчески доступных прокариотных клонирующих векторов обеспечивает эти элементы. В предпочтительном варианте осуществления настоящего изобретения эти функции обеспечиваются коммерчески доступными векторами, известными как серия pUC. Однако может быть желательно удалить несущественные ДНК-последовательности. Так, могут быть удалены lacZ- и -lacI-кодирующие последовательности pUC. Также желательно, чтобы векторы были неспособны к репликации в эукариотных клетках. Это сводит к минимуму опасность слияния последовательностей полинуклеотидной вакцины с геномом реципиента.
В другом варианте осуществления изобретения используют экспрессионный вектор pnRSV, при этом длинный концевой повтор (LTR) вируса саркомы Рауса (RSV) используют в качестве промотора. В еще одном варианте осуществления изобретения используют Vl-мутированный вектор pBR322, в котором клонированы CMV-промотор и терминатор транскрипции BGH. В предпочтительном варианте осуществления настоящего изобретения для получения экспрессионного вектора, названного V1J, объединены элементы V1 и pUC19.
В V1J, VlJtPA или другом нужном экспрессионном векторе клонируют ген М. tb, например один из генов антигенного комплекса 85 или любой другой ген М. tb, который может индуцировать иммунные реакции против М.tb (ЦТЛ, хелперные Т-лимфоциты и антитела). В другом варианте осуществления изобретения из V1J удаляют ген устойчивости к ампициллину и заменяют геном устойчивости к неомицину, чтобы генерировать V1J-neo, в котором можно клонировать любой ген из числа различных генов М.tb для применения по настоящему изобретению. Еще в одном варианте осуществления изобретения вектором является V1Jns, который такой же, как вектор Vl-neo, за исключением того, что уникальный сайт рестрикции Sfil создан в одном сайте Kpnl в положении 2114 V1J-neo. Частота появления сайта Sfil в человеческой геномной ДНК очень низкая (приблизительно 1 сайт на 100000 оснований). Таким образом, этот вектор дает возможность тщательного контроля за слиянием экспрессионного вектора с ДНК хозяина просто путем переваривания Sfil экстрагированной геномной ДНК. В другом варианте осуществления изобретения вектором является V1R. В этом векторе "убрано" столько несущественных ДНК, сколько возможно, чтобы получить высококомпактный вектор. Этот вектор дает возможность использования большего числа вставок с меньшим беспокойством по поводу кодирования нежелательных последовательностей и оптимизирует поглощение клетками, когда конструкция, кодирующая специфические вирусные гены, вводится в близлежащую ткань. Способы, применяемые при продуцировании вышеупомянутых векторных модификаций, и процедуры их развития могут осуществляться в соответствии с методами, известными специалистам в этой области техники.
Из настоящей работы специалисты в данной области техники узнают, что полезность настоящего изобретения состоит в предоставлении системы тестирования и анализа как in vivo, так и in vitro, так что можно осуществить корреляцию между многообразием последовательностей М. tb и пролиферативными реакциями ЦТЛ и Т-клеток, как и другими параметрами. Выделение и клонирование этих различных генов можно осуществить в соответствии с методами, известными специалистам в этой области техники. Настоящее изобретение также относится к способу систематичной идентификации штаммов М. tb и последовательностей для получения вакцин. Включение генов из первичных изолятов штаммов М. tb дает иммуноген, который индуцирует иммунные реакции против клинических изолятов организма, и, таким образом, удовлетворяет потребность, которая пока в этой области не удовлетворена. Кроме того, если вирулентные изоляты изменяются, можно модифицировать иммуноген, чтобы отразить необходимые последовательности.
В одном из вариантов осуществления настоящего изобретения ген, кодирующий белок М.tb, непосредственно связан с промотором транскрипции. Применение тканеспецифических промоторов или энхансеров, например энхансерного элемента мышечной креатинкиназы (МСК), может быть желательным для ограничения экспрессии полинуклеотида к ткани определенного типа. Например, миоциты являются окончательно дифференцированными клетками, которые не делятся. Слияние чужеродной ДНК с хромосомами появляется как требование как деления клеток, так и синтеза белка. Таким образом, может быть предпочтительным ограничение экспрессии белка до неделящихся клеток. Однако использование CMV-промотора является адекватным для достижения экспрессии во многих тканях, в которые вводят ПНВ.
М. tb и другие гены лигируют предпочтительно с экспрессионным вектором, который специфически оптимизирован для полинуклеотидных вакцинаций. Элементы включают промотор транскрипции, иммуногенные эпитопы и дополнительные цистроны, кодирующие гены иммуноусиления или иммуномодуляторные гены, с их собственными промоторами, терминатор транскрипции, бактериальный ориджин репликации и ген устойчивости к антибиотику, как описано здесь. Вектор может содержать, необязательно, аминоацильные сайты внутренних рибосом (IRES) для экспрессии полицистронной мРНК. Специалисты в этой области техники поймут, что РНК, которая транскрибирована in vitro для продуцирования многоцистронных мРНК, кодированных эквивалентами ДНК, входит в объем настоящего изобретения. Для этой цели желательно использовать в качестве промотора транскрипции такие сильные РНК-полимеразные промоторы, как промоторы Т7 или SP6, и осуществлять in vitro продолжение транскрипции с линеаризованной ДНК-матрицей. Эти способы хорошо известны в технике.
Защитная эффективность полинуклеотидных иммуногенов М. tb против последующего контрольного заражения демонстрируется с помощью иммунизации ДНК настоящего изобретения. Это выгодно, так как не включается никакой инфекционный фактор, не требуется сборки/ репликации бактерий, и разрешена селекция антигенных детерминант. Кроме того, так как последовательность микобактериальных генных продуктов может быть сохранена среди различных штаммов М. tb, получают защиту против последующего контрольного заражения другим штаммом.
Инъекция ДНК-экспрессионного вектора, кодирующего антиген 85А, В или С, может привести к образованию существенного защитного иммунитета против последующего контрольного заражения. В частности, могут быть получены специфические реакции ЦТЛ и хелперных Т-лимфоцитов.
Так как каждый из генных продуктов М. tb обнаруживает высокую степень сохранности в различных штаммах М. tb, и так как иммунные реакции могут генерироваться в ответ на интрацеллюлярную экспрессию и процессинг ГКГС, ожидается, что многие различные конструкции ПНВ против М.tb могут дать начало кросс-реактивным иммунным ответам.
Настоящее изобретение относится к способу индуцирования гетерологичного защитного иммунитета, не требующему самореплицирующихся факторов или адъювантов. Генерация антител с высоким титром против экспрессированных белков после инъекции вирусного белка и ДНК человеческого гормона роста [Tang et al., Nature 356, 152, 1992] указывает, что такая инъекция является простым и высокоэффективным способом получения вакцин на основе антител, либо одних, либо в сочетании с цитотоксическими Т-лимфоцитными и хелперными Т-лимфоцитными вакцинами, нацеленными на консервативные антигены.
Легкость продуцирования и очистки ДНК-конструкций выигрывает при сравнении с традиционной очисткой белка, облегчая образование комбинированных вакцин. Таким образом, могут быть получены, смешаны и введены совместно множественные конструкции, например кодирующие гены антигенного комплекса 85 и любой другой ген M.tb, также включающий не М.tb гены. Кроме того, после инъекции ДНК сохраняется экспрессия белка [Н. Lin et al., Circulation 82, 2217 (1990); R. N. Kitsis et al., Proc. Natl. Acad. Sci. (USA) 88, 4138 (1991); E. Hansen et al., FEBS Lett. 290, 73 (1991); S. Jiao et al., Hum. Gene Therapy 3, 21 (1992); J.A. Wolff et al., Human Mol. Genet. 1, 363. (1992)] , может быть усилена устойчивость В- и Т-клеточной памяти [D. Gray and P. Matzinger, J. Exp. Med. 174, 969 (1991); S. Oehen et al., там же, 176, 273 (1992)], причем посредством этого создают длительный гуморальный и клеточно-опосредованный иммунитет.
Количество экспрессируемой ДНК или транскрибированной РНК, которое вводят реципиенту вакцины, будет иметь очень широкий интервал дозирования и может зависеть от силы используемых промоторов транскрипции и трансляции. Кроме того, интенсивность иммунной реакции может зависеть от уровня экспрессии белка и от иммуногенности экспрессированного генного продукта. Как правило, эффективные дозы от 1 нг до 5 мг, от 100 нг до 2,5 мг, от 1 мкг до 750 мкг и предпочтительно от 10 мкг до 300 мкг ДНК вводят непосредственно в мышечную ткань. Также подходящими являются подкожная инъекция, интрадермальное введение, вдавливание через кожу и другие способы введения, такие как интраперитонеальная, внутривенная доставка или доставка путем ингаляции. Также ожидается, что можно осуществлять активную вакцинацию. После вакцинации полинуклеотидным иммуногеном М.tb предполагается также ревакцинация иммуногенами белков М.tb, например генными продуктами антигенного комлекса 85. Может быть выгодным парентеральное введение, например внутривенное, внутримышечное подкожное, или другими способами введения, белка интерлейкина 12 (или другого цитокина, например, ГМ-КСФ), одновременное или следующее за парентеральным введением ПНВ настоящего изобретения.
Полинуклеотид может быть простым, т.е. неассоциированным с какими-либо белками, адъювантами или другими факторами, которые действуют на иммунную систему реципиента. В этом случае желательно, чтобы полинуклеотид находился в физиологически приемлемом растворе, например в стерильном физиологическом растворе или в стерильном забуференном физиологическом растворе, но возможно использование и других растворов. С другой стороны, ДНК может быть соединена с липосомами, например, с лецитиновыми липосомами, или с другими липосомами, известными в технике, в виде ДНК-липосомной смеси, или ДНК может быть соединена с адъювантом, известным в технике для усиления иммунных реакций, таким как белок, или с другим носителем. Также могут использоваться средства, которые содействуют клеточному поглощению ДНК, например ионы кальция, или другие агенты. Вообще, эти агенты упоминаются здесь как реагенты, облегчающие трансфекцию, и фармацевтически приемлемые носители. Методы нанесения полинуклеотида на микрочастицы известны в технике и также применяются в связи с настоящим изобретением. Может быть полезным, чтобы конечный продукт ДНК, предназначенной для использования людьми, находился в фармацевтически приемлемом носителе или буферном растворе. Фармацевтически приемлемые носители или буферные растворы известны в технике и включают вещества, описанные в различных работах, например в Remington's Pharmaceutical Sciences.
В еще одном варианте осуществления изобретения присутствует полинуклеотид, который содержит соседние нуклеотидные последовательности, способные, будучи экс-прессированными, продуцировать генный продукт после введения упомянутого полинуклеотида в эукариотные ткани in vivo. Кодированный генный продукт действует предпочтительно или как иммуностимулятор, или как антиген, способный генерировать иммунную реакцию. Так, в этом варианте осуществления изобретения нуклеотидные последовательности кодируют иммуногенный эпитоп M. tb и, необязательно, цитокин или Т-клеточный костимулирующий элемент, например, из семейства белков В7.
Существуют некоторые преимущества иммунизации геном, а не его генным продуктом. Первое преимущество заключается в относительной простоте, с которой нативный или почти нативный антиген может быть представлен иммунной системе. Белки млекопитающего, экспрессированные рекомбинантно в бактериях, дрожжах или даже в клетках млекопитающего, часто требуют для обеспечения соответствующей антигенности длительной обработки. Вторым преимуществом ДНК-иммунизации является возможность для иммуногена принимать участие в каскаде реакций ГКГС класса I и вызывать цитотоксичные Т-клеточные реакции. Иммунизация мышей ДНК, кодирующей нуклеопротеин (NP) гриппа А, облегчает реакцию CD8+ на NP, которая защищает мышей от контрольного заражения гетерологичными штаммами гриппа (Montgomery, D.L., et al., см. выше; Ulmer J., et al., см. выше).
Совершенно очевидно, что клеточно-опосредованный иммунитет важен для борьбы с инфекцией М. tb [Orme et al., 1993, J. Infect. Dis. 167, 1481; Cooper et al., 1993, J. Exp. Med. 178, 2243; Flynn et al., 1993, J. Exp. Med. 178, 2249; Orme et al. , 1993, J. Immunol. 151, 518]. Так как иммунизация ДНК может вызвать как гуморальный, так и клеточно-опосредованный иммунитет, большим преимуществом может быть то, что она дает относительно простой способ исследования большого числа генов M.tb на их вакцинный потенциал.
Иммунизация посредством инъекции ДНК также дает возможность, как описано выше, легкой сборки многокомпонентных субъединичных вакцин. Недавно опубликовано сообщение об одновременной иммунизации множественными генами гриппа (Donnelly, J., et al., 1994, Vaccines, pp. 55-59). Включение в вакцину против M.tb генов, продукты которых активируют различные ветви иммунной системы, также может предоставить защиту от последующего контрольного заражения.
Вакцины настоящего изобретения пригодны для введения домашним или сельскохозяйственным животным, а также людям. Вакцины настоящего изобретения могут использоваться для предотвращения и/или борьбы с инфекцией любых сельскохозяйственных животных, включая, но не ограничиваясь им, молочный скот, который восприимчив к микобактериальной инфекции. Методы введения этих вакцин животным и людям известны специалистам в области ветеринарии и здравоохранения соответственно.
Приведенные ниже примеры приводятся для иллюстрации настоящего изобретения, которое, однако, ими не ограничивается.
Пример 1
Векторы для получения вакцины
А) Экспрессионный вектор VI
Экспрессионный вектор VI создают из pCMVIE-AKI-DHFR [Y. Whang et al., J. Virol. 61, 1796 (1987)]. Гены AKI и DHFR удаляют путем вырезания вектора с EcoR I и рециркуляризации. Этот вектор не содержит интрона А в CMV-промоторе, так как он добавляется как фрагмент ПЦР, у которого удален внутренний сайт Sac I [в 1855 по нумерации B.S. Chapman et al., Nuc. Acids Res. 19, 3979 (1991)] . Матрица, применяемая для ПЦР-реакций, представляет собой pCMVintA-Lux, полученную лигированием Hind III и фрагмента Nhe из pCMV6al20 [см. B. S. Chapman et al. , там же], который включает энхансер/промотор hCMV-IEl и интрон А, с сайгами Hind III и Xba I pBL3, для образования pCMVIntBL. Фрагмент гена люциферазы в 1881 пару оснований (Hind III-Sma I, вставлен в фрагмент Кленова) из RSV-Lux [J.R. de Wet et al., Mol. Cell Blol. 7, 725, 1987] клонируют в сайте Sal I pCMVIntBL, который вставлен в фрагмент Кленова и обработан фосфатом.
Затравки, которые охватывают интрон А, представляют собой
5'- затравку, послед. 1:
5'-CTATATAAGCAGAG CTCGTTTAG-3'; 3'- затравку, послед. 2:
5'-GTAGCAAAGATCTAAGGACGGTGA CTGCAG-3'.
Затравки, использованные для удаления сайта Sac I, представляют собой
смысловую затравку, послед. 3: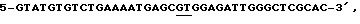
и антисмысловую затравку, послед. 4: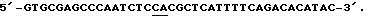
Фрагмент ПЦР вырезают Sac I и Вgl II и вставляют в вектор, который вырезан теми же ферментами.
Б) Экспрессионный вектор V1J
Цель создания V1J состоит в удалении промотора и элементов терминации транскрипции из вектора V1, чтобы поместить их в более определенные условия, создать более компактный вектор и улучшить выход при очистке плазмиды.
V1J образуется из векторов V1 и pUC18 - коммерчески доступной плазмиды. V1 переваривают с ферментами рестрикции SspI и EcoRI, получая два фрагмента ДНК. Меньший из этих фрагментов, содержащий промотор CMVintA и элементы терминации транскрипции бычьего гормона роста (BGH), которые контролируют экспрессию гетерологичных генов, очищают электрофорезом на агарозном геле. Концы этого фрагмента ДНК затем "затупляют" с использованием фермента ДНК-полимеразы Т4, чтобы облегчить его лигирование с другим ДНК-фрагментом с "затупленными концами".
pUC18 выбирают для обеспечения "каркаса" экспрессионного вектора. Известно, что для получения высокого выхода плазмиды она тщательно характеризуется последовательностью и функцией и имеет небольшой размер. Из этого вектора частичным перевариванием с ферментом рестрикции HaeII удаляют полный lac-оперон. Оставшуюся плазмиду очищают электрофорезом на агарозном геле, затупляют концы ДНК-полимеразой Т4, обработанной телячьей кишечной щелочной фосфатазой, и лигируют с описанным выше элементом CMVintA/BGH. Получают плазмиды, обнаруживающие любую из двух возможных ориентации промоторных элементов в каркасе pUC. Одна из этих плазмид дает более высокий выход ДНК в E. coli и обозначается VIJ. Такое строение вектора подтверждают анализом последовательностей областей соединений, и впоследствие, сравнивая с V1, демонстрируют сравнимую или, более высокую экспрессию гетерологичных генов.
В) Экспрессионныи вектор V1Jneo
Необходимо удалить ген аmpr, используемый для отбора по антибиотику бактерий, укрывающих V1J, поскольку в больших ферментерах ампициллин может быть нежелательным. Ген аmрr из каркаса pUC V1J удаляют путем переваривания с ферментами рестрикции SspI и Eam1105I. Остающуюся плазмиду очищают электрофорезом на агарозном геле, затупляют концы ДНК-полимеразой Т4 и затем обрабатывают телячьей кишечной щелочной фосфатазой. Коммерчески доступный ген kanr, образованный из транспозона 903 и находящийся в плазмиде pUC4K, исключают с использованием фермента рестрикции PstI, очищают электрофорезом на агарозном геле и затупляют концы ДНК-полимеразой Т4. Этот фрагмент лигируют с каркасом V1J и получают плазмиды с геном kanr в той или иной ориентации, которые обозначают VlJneo # # 1 и 3. Осуществляют рестрикционный анализ и секвенирование ДНК областей соединения каждой из этих плазмид, и показывают продуцирование такого же количества плазмид, как V1J. Экспрессия гетерологичных генных продуктов для этих векторов VlJneo, также сравнима с V1J. Отбирают VlJneo #3, называемый далее VlJneo, который содержит ген kanr в той же ориентации, что и ген ampr в V1J как экспрессионной конструкции.
Г) Экспрессионный вектор V1Jns
К VlJneo добавляют сайт Sfi I, чтобы облегчить исследования слияния. Коммерчески доступный линкер Sfi I в 13 пар оснований (New England BioLabs) добавляют в сайт Крn I в пределах последовательности BGH вектора. V1Jneo линеаризуют с Крn I, очищают на геле, затупляют концы ДНК-полимеразой Т4 и лигируют с затупленным линкером Sfi I. Клональные изоляты выбирают путем рестрикционного картирования и контролируют секвенированием до линкера. Новый вектор называют VlJns. Экспрессия гетерологичных генов в VlJns (с Sfi I) сравнима с экспрессией тех же генов в V1Jneo (с Крn I).
Д) V1Jns-tPA
Чтобы обеспечить гетерологичную лидерную пептидную последовательность для секретированных и/или мембранных белков, VlJns модифицируют, включая последовательность человеческого тканеспецифического активатора плазминогена (tPA). Отжигают два синтетических комплементарных олигомера и затем лигируют с V1Jn, который переварен BglII. Смысловым и антисмысловым олигомерами являются 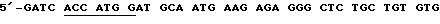 CTG CTG CTG TGT GGA GCA GTC TTC GTT TCG CCC AGC GA-3', послед. 5, и 5'-GAT CTC GCT GGG CGA AAC GAA GAC TGC TCC АСА CAG CAG CAG CAC АСА GCA GAG CCC TCT CTTCAT TGCATC CAT GGT-3', послед. 6. В смысловом олигомере подчеркнута последовательность Козака. Эти олигомеры имеют выступающие основания, совместимые с лигированием к расщепленным BglII последовательностям. После лигирования разрушается сайт BglII в обратном направлении, в то время как BglII в прямом направлении сохраняется для последующего лигирования. Оба участка соединений, как и полную лидерную последовательность tPA контролируют секвенированием ДНК. Кроме того, для соответствия консенсусному оптимизированному вектору VlJns (= V1Jneo с сайтом Sfi I), сайт рестрикции Sfi I помещают в сайт KpnI в терминаторной области VlJn-tPA, затупляя концы сайта KpnI ДНК-полимеразой Т4 с последующим лигированием с линкером Sfi I ( по каталогу 1138, New England Biolabs). Эту модификацию контролируют путем рестрикционного переваривания и электрофореза на агарозном геле.
CTG CTG CTG TGT GGA GCA GTC TTC GTT TCG CCC AGC GA-3', послед. 5, и 5'-GAT CTC GCT GGG CGA AAC GAA GAC TGC TCC АСА CAG CAG CAG CAC АСА GCA GAG CCC TCT CTTCAT TGCATC CAT GGT-3', послед. 6. В смысловом олигомере подчеркнута последовательность Козака. Эти олигомеры имеют выступающие основания, совместимые с лигированием к расщепленным BglII последовательностям. После лигирования разрушается сайт BglII в обратном направлении, в то время как BglII в прямом направлении сохраняется для последующего лигирования. Оба участка соединений, как и полную лидерную последовательность tPA контролируют секвенированием ДНК. Кроме того, для соответствия консенсусному оптимизированному вектору VlJns (= V1Jneo с сайтом Sfi I), сайт рестрикции Sfi I помещают в сайт KpnI в терминаторной области VlJn-tPA, затупляя концы сайта KpnI ДНК-полимеразой Т4 с последующим лигированием с линкером Sfi I ( по каталогу 1138, New England Biolabs). Эту модификацию контролируют путем рестрикционного переваривания и электрофореза на агарозном геле.
Е) pGEM-3-Х-IRES-В7
(где Х=любому антигенному гену)
В качестве примера дицистронной вакцинной конструкции, которая обеспечивает координированную экспрессию гена, кодирующего иммуноген, и гена, кодирующего иммуностимуляторный белок, муриновый ген В7 амплифицируют ПЦР из клеточной линии В-лимфомы СН1 (полученной от АТСС). В7 является членом семейства белков, которые обеспечивают существенную Т-клеточную активацию костимуляции антигеном в контексте главных комплексов гистосовместимости I и II. Клетки СН1 обеспечивают хороший источник мРНК В7, поскольку они имеют фенотип, будучи конструктивно активированными, и В7 экспрессируется, главным образом, активированными антигенпредставляющими клетками, такими как В-клетки и макрофаги. Эти клетки также стимулируются in vitro с использованием цАМФ или ИЛ-4, и мРНК получают с использованием стандартных методов с тиоцианатом гуанидиния. Синтез кДНК осуществляют с использованием этой мРНК, используя набор для ПЦР GeneAmp РНК (Perkin-Elmer Cetus) и инициирующий олигомер (5'-GTA CCT CAT GAG CCA CAT ААТ АСС ATG-3', послед. 7), специфический для В7, расположенного в прямом направлении трансляционной открытой рамки считывания В7. В7 амплифицируют ПЦР с использованием следующих смыслового и антисмыслового ПЦР-олигомеров: 5'-GGT АСА AGA ТСТ АСС ATG GCT TGC ААТ TGT CAG TTG ATG С-3', послед. 8; и 5'-ССА CAT AGA ТСТ CCA TGG GAA СТА AAG GAA GAC GGT CTG ТТС-3', послед. 9, соответственно. Эти олигомеры дают сайты фермента рестрикции BglII на концах вставки, так же, как последовательность инициации трансляции Козака, содержащая сайт рестрикции NcoI и дополнительный сайт NcoI, расположенный непосредственно перед 3'-концевым сайтом BglII. Переваривание NcoI дает фрагмент, подходящий для клонирования в pGEM-3-IRES, который переварен с NcoI. Получающийся в результате вектор pGEM-3-IRES-B7 содержит кластер IRES-B7, который может быть легко перенесен в V1Jns-X, где Х представляет антиген-кодирующий ген.
Ж) pGEM-3-X-IRES-GM-CSF
(где Х=любой антигенный ген)
Этот вектор содержит кластер, аналогичный кластеру, описанному выше в разделе В, за исключением того, что используют ген для иммуностимуляторного цитокина GM-CSF, а не В7. GM-CSF является цитокином макрофаговой дифференциации и стимуляции, который, как было показано, выявляет сильную противоопухолевую Т-клеточную активность in vivo [G. Dranoff et al., Proc. Natl. Acad. Sci. USA, 90, 3539 (1993)].
З) pGEM-3-X-IRES-IL-12
(где Х=любой антигенный ген)
Этот вектор содержит кластер, аналогичный кластеру, описанному выше в разделе В, за исключением того, что используют ген для иммуностимуляторного цитокина IL-12 (ИЛ-12), а не В7. Показано, что IL-12 оказывает влияние на сдвиг иммунных реакций в сторону клеточного, с преобладанием Т-клеток, пути, в противоположность гуморальным реакциям [L. Alfonso et al., Science, 263, 235, 1994].
Пример 2
Получение вектора V1R
В продолжение усилий по оптимизации основного вектора вакцинации получают производное VlJns, названное V1R. Целью создания этого вектора является получение вакцинного вектора минимального размера без ненужных ДНК-последовательностей, который еще сохраняет все характеристики экспрессии оптимизированного гетерологичного гена, и высокий плазмидный выход, которые дают VIJ и VlJns. На основании литературных, а также экспериментальных данных установлено, что (1) участки в каркасе pUC, содержащие точку начала репликации E. coli, можно удалить, не затрагивая выход плазмиды из бактерии; (2) 3'-область гена kanr после открытой рамки считывания канамицина можно удалить, если на ее место вставляется бактериальный терминатор; и (3) ~3 00 п.о., из 3'-половины терминатора BGH можно удалить, не затрагивая его регуляторной функции (после исходного сайта фермента рестрикции КpnI в элементе, BGH).
V1R создают путем применения ПЦР для синтеза трех сегментов ДНК из VlJns, представляющих промотор CMVintA/терминатор BGH, точку начала репликации и элементы устойчивости к канамицину, соответственно. Ферменты рестрикции, особые для каждого сегмента, добавляют к каждому концу сегмента с использованием ПЦР-олигомеров SspI и Xhol для CMVintA/BGH; EcoRV и BamHI для гена kanr и BclI и SalI для оrir. Выбирают эти ферментные сайты, так они дают возможность направленного лигирования каждого из полученных ПЦР сегментов ДНК с последующей потерей каждого сайта: EcoRV и SspI покидают ДНК с затупленными концами, которые совместимы для лигирования, в то время как BamHI и BclI покидают комплементарные выступы, как SalI и XhoI. После получения ПЦР этих сегментов каждый сегмент переваривают соответствующими ферментами рестрикции, указанными выше, и затем лигируют вместе в единой реакционной смеси, содержащей все три сегмента ДНК. Переваривают 5'-конец orir, чтобы включить независимую терминаторную последовательность Т2 rho, которая обычно обнаруживается в этой области, так что она может дать информацию о терминации для гена устойчивости к канамицину. Лигированный продукт проверяют перевариванием ферментами рестрикции (>8 ферментов), а также ДНК-секвенированием участков лигирования. Выход ДНК-плазмиды и гетерологичная экспрессия с использованием вирусных генов в V1R подобны V1Jns. Конечное уменьшение размера вектора достигает 1346 п.о. (V1Jns=4,86 кб; V1R=3,52 кб).
ПЦР-олигомерные последовательности, используемые для синтеза V1R (сайты ферментов рестрикции подчеркнуты и указаны в квадратных скобках приведенных ниже последовательностей):
(1) 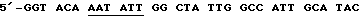 G-37 [SspI], послед. 10,
G-37 [SspI], послед. 10,
(2) 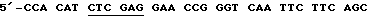 ACC-3' [XhoI], послед. 11,
ACC-3' [XhoI], послед. 11,
(для сегмента CMVintF/BGH);
(3) 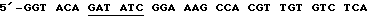 AAA TC-3' [EcoRV], послед. 12,
AAA TC-3' [EcoRV], послед. 12,
(4) 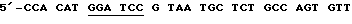 АСА АСС-3' [BamHI], послед. 13,
АСА АСС-3' [BamHI], послед. 13,
(для сегмента гена устойчивости к канамицину);
(5) 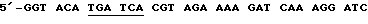 TTC TTG-3' [BelI], послед. 14,
TTC TTG-3' [BelI], послед. 14,
(6) 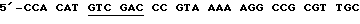 TGG-3' [SalI], послед. 15,
TGG-3' [SalI], послед. 15,
(для точки начала репликации Е.coli).
Пример 3
Клеточная культура и трансфекция
Для получения устойчиво трансфицированных клеточных линий, экспрессирующих антигены М. tb, клетки RD (рабдомиосаркомы человека, АТСС CCL 136) выращивают при 37oС, с 5% СО2, в модифицированной по способу Дульбекко среде Игла (DMEM) с добавлением 10% инактивированной теплом сыворотки плода коровы, 20 мМ HEPES, 4 мМ L-глутамина и по 100 мкг/мл пенициллина и стрептомицина. Клетки высевают в планшеты по 1,5х106 клеток на 100 мм2 и выращивают в течение 18 часов. Клетки трансфектируют 10 мкг/планшет ТБ-конструкцией и 10 мкг котрансфектированной Cat-конструкцией с использованием набора CellPhect (Pharmacia), и через 5 часов после добавления к клеткам ДНК встряхивают с глицерином (glycerol shocked) (15% глицерина в ЗФР, рН 7,2, в течение 2,5 мин). Культуры собирают через 72 часа после трансфекции, промывая планшеты 2х10 мл холодного ЗФР, рН 7,2, добавляя 5 мл холодного ТЭН-буфера (40 мМ трис-Cl, рН 7,5, 1 мМ ЭДТК, 150 мМ NaCl) и соскабливая. Для анализа экспрессии белка клеточные осадки лизируют в 50 мкл однодетергентного лизирующего буфера (50 мМ трис-Cl, рН 8,0, 150 мМ NaCl, 0,02% NaN3, 1% нонидета Р-40, 100 мМ ФМСФ, 2 мкг/мл апротинина, 2 мкг/мл лейпептина и 1 мкг/мл пепсатина А) и разрушают ультразвуком при охлаждении на льду (время разрушения 2-15 секунд). Лизаты центрифугируют при 13000хg, 4oС, в течение 10 минут. Концентрацию белка определяют методом Брэдфорда (Bradford) и наносят 20 мкг белка клеточного экстракта на дорожку на полиакриламидный гель с 10% трис-глицина (Novex), и затем переносят на мембрану из иммобилона Р (Millipore). Иммуноблоты вводят в реакцию в течение ночи с разведенным 1:20 мышиным моноклональным антителом TD 17-4 [Huygen et al./ 1994, Infect. Immunity 62, 363] , с последующей реакцией с пероксидазой Fc козьего, антимышиного иммуноглобулина G (IgGFc), разведение 1:1000, в течение 1,5 часов. Блоты проявляют с использованием набора ECL (Amersham).
Пример 4
Клонирование и получение ДНК
1. Конструкцию VlJns-tPA-85A (содержит зрелый Аg85А [антиген 85А] с сигнальной последовательностью tPA) получают с использованием следующих затравок:
смысловая затравка 85А.С1 [послед. 16]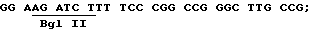
антисмысловая затравка 85А [послед. 17]
GGAAGATCTTGTCTGTTCGGAGCTAGGC.
Аg85А из М. tuberculosis амплифицируют из плазмиды p85A.tub, которую получают путем лигирования фрагмента HindIII в 800 п.о. с фрагментом HindIII-SphI в 1600 п.о., см. фиг. 2 в работе Borremans et al., 1989 [Infect. Immunity 57, 3123] . Получающуюся в результате вставку в 2400 п.о. субклонируют в сайтах HindIII и SphI BlueSchribe M13+. Полную кодирующую последовательность и фланкирующие области в BlueScribe M13+ (VCS/Stratagene) амплифицируют ПЦР с указанными затравками в следующих условиях. Каждые 100 мкл реакционной смеси содержат 2,5 единицы ДНК-полимеразы клонированных БОЕ (Stratagene), 200 мМ dNTP (дезоксинуклеозид-5'-трифосфат), по 0,5 мкг каждой затравки и 250 нг матричной ДНК в реакционном буфере с добавлением фермента (Stratagene). Термореактор Hybaid программируют следующим образом: денатурация в течение 5 минут при 94oС с последующими 25 циклами (1 минута при 94oС, 2 минуты при 55oС и 3 минуты при 72oС), заканчивая продолжением процесса в течение 10 минут при 72oС.
Амплифицированную ДНК переваривают с 50 мкг/мл протеиназы К (Boehring Mannheim) в течение 30 минут при 37oС, нагревают в течение 10 минут при 95oС с последующими 2 фенольными (хлороформ-изоамиловый спирт) экстракциями и осаждают 1 объемом изопропанола, дважды промывают 70% этанолом, сушат и растворяют в 20 мкл Н2О. Переваривают 3 мкг амплифицированной ДНК с 40 единицами Bgl II (Boehring Mannheim), и выделяют фрагмент в 907 п.о. (в случае 85А-С1) на 1% агарозном геле, и экстрагируют на "Prep a gene", следуя указаниям изготовителя.
Этот фрагмент (50 нг) лигируют с 20 нг Bgl II, переваривают и дефосфорилируют вектор VlJns.tPA в 10 мкл реакционной смеси, содержащей 2,5 единицы ДНК-лигазы Т4 (Amersham) в лигирующем буфере в течение 16 часов при 14oС, переносят в компетентную E. coli DH5 (BRL) и высевают на канамицин (50 мкг/мл), содержащий LB-агаризованную твердую питательную среду. Трансформанты выбирают и их плазмидные ДНК рестриктируют с Bgl II (чтобы подтвердить присутствие вставки), и с Pvu II, чтобы определить их ориентацию.
2. Конструкцию VlJns-85A [C2] (содержит зрелый Аg85А без сигнальной последовательности) получают с использованием следующих затравок:
смысловая 85А C2 [послед. 18]
GGAAGATCTACC ATG GGC TTT TCC CGG CCG GGC TTG С;
антисмысловая 85А [послед. 17].
GGAAGATCTTGCTGTTCGGAGCTAGGC.
Следуют той же процедуре, какая описана выше в разделе 1, за исключением того, что клонирование происходит в V1Jns.
3. Конструкцию VlJns-85A [С3] (содержит зрелый Аg85А с его собственной сигнальной последовательностью) получают с использованием следующих затравок:
смысловая 85А С3 [послед. 19]
GGAAGATCTACC ATG GCA CAG CTT GTT GAC AGG GTT;
антисмысловая 85А [послед. 17]
GGAAGATCTTGCTGTTCGGAGCTAGGC.
Следуют той же процедуре, какая описана выше в разделе 1, за исключением того, что клонирование происходит в V1Jns.
4. Конструкцию V1Jns-tPA-85B [Cl] (содержит Аg85В с сигнальной последовательностью tPA) получают с использованием следующих затравок:
смысловая 85В [С1] [послед. 20]
GGAAG ATC ТСС ТТС TCCCGG CCG GGG CTG CCG GTC GAG;
антисмысловая 85В [послед. 21]
GGAAGATCTAACCTTCGGTTGATCCCGTCAGCC.
Следуют той же процедуре, какая описана выше в разделе 1, за исключением того, что матрицей для ПЦР является p85B.tub.
5. Конструкцию V1Jns-tPA-85C [Cl] (содержит Аg85С с сигнальной последовательностью tPA) получают с использованием следующих затравок:
смысловая 85С [Cl] [послед. 22]
GGAAG ATC ТСС ТТС ТСТ AGG CCC GGT СТТ ССА;
антисмысловая 85С [послед. 23]
GGAAGATCTTGCCGATGCTGGCTTGCTGGCTCAGGC.
Следуют той же процедуре, какая описана выше в разделе 1, за исключением того, что матрицей для ПЦР является p85C.tub.
6. Конструкцию V1Jns-85B, [C2] (содержит Аg85В без сигнальной последовательности) получают с использованием следующих затравок:
смысловая 85В [C2] [послед. 24]
GGA AGA ТСТ АСС ATG GGC ТТС ТСС CGG CCG GGG CTG С;
антисмысловая 85В [послед. 21]
GGAAGATCTAACCTCGGTTGATCCCGTCAGCC.
Следуют той же процедуре, какая описана выше в разделе 1, за исключением того, что матрицей для ПЦР является p85B.tub, и что клонирование происходит в VlJns.
7. Конструкцию V1Jns-85C [C2] (содержит Аg85С без сигнальной последовательности) получают с использованием следующих затравок:
смысловая 85С [C2] [послед. 25]
GGA AGA TCT ACC ATG GGC TTC TCT AGG CCC GGT СТТ С;
антисмысловая 85С [послед. 23]
GGAAGATCTTGCCGATGCTGGCTTGCTGGCTCAGGC.
Следуют той же процедуре, какая описана выше в разделе 1, за исключением того, что матрицей для ПЦР является p85C.tub, и что клонирование происходит в VlJns.
После рестрикционного анализа все конструкции частично секвенируют через векторные соединения. Получение ДНК в крупном масштабе, по существу, таково, как описано в Montgomery, D.L., et al., см. выше).
Плазмидные конструкции характеризуются с помощью рестрикционного картирования и анализа последовательностей соединений векторов со вставками (см. фиг. 1-6). Результаты соответствуют опубликованным сведениям о последовательностях М. tb и показывают, что инициирующий кодон является неповрежденным для каждой конструкции (фиг. 7). Также показаны различные дополнительные аминокислотные остатки, не родственные Аg85 М.tb, которые вставляются в результате клонирования.
Пример 5
Экспрессия белков М. tb из плазмид VlJns tPA
Клетки рабдомиосаркомы (АТСС CCL 136) высевают на планшеты за день до использования с плотностью 1,2х106 клеток на лунку в 9,5 см2 в шестилуночных планшетах для культивирования клеток тканей в обогащенной глюкозой DMEM с добавлением 10% инактивированной теплом фетальной телячьей сыворотки, 2 мМ L-глутамина, 25 мМ HEPES, 50 Е/мл пенициллина и 50 мкг/мл стрептомицина (все реагенты от BRL-Gibco). Экстрагированную фенолом с хлороформом и очищенную с хлоридом цезия плазмидную ДНК осаждают фосфатом кальция с использованием реагентов CellPhect, Pharmacia, в соответствии с инструкциями к набору, за исключением того, что для каждой лунки в 9,5 см используют 5-15 мкг клеток RD. Культуры встряхивают с глицерином через 6 часов после добавления кальцийфосфатного ДНК-преципитата; после "подпитки" культуры инкубируют в течение двух суток перед сбором.
Лизаты трансфектированных культур получают в IX RIPA (0,5% ДСН, 1,0% тритона Х-100, 1% дезоксихолата натрия, 1 мМ ЭДТК, 150 мМ NaCl, 25 мМ трис-HCl, рН 7,4) с добавлением 1 мкМ лейпептина, 1 мкМ пепстатина, 300 нМ апротинина и 10 мкМ ТЛХК, и кратковременно воздействуют ультразвуком для уменьшения вязкости. Лизаты разделяют электрофорезом на 10% трициновых (Tricine) гелях (Novex) и затем переносят на нитроцеллюлозные мембраны. Иммуноблоты процессируют моноклональными антителами к M. tb 17/4 и 32/15 [Huygen et al. , 1994, Infect. Immunity 62, 363] и проявляют набором для детекции ECL (Amersham).
Экспрессию генов антигенного комплекса 85 М.tb демонстрируют с помощью неустойчивой трансфекции клеток RD. Лизаты трансфектированных или псевдотрансфектированных клеток фракционируют электрофорезом на полиакриламидном геле в присутствии ДСН (SDS-PAGE) и анализируют иммуноблоттингом. На фиг. 8 показано, что V1Jns. tPA-85A(C2), VlJns.tPA-85A(C2), V1Jns.tPA-85A(C3) и V1Jns. tPA-85B(Cl), трансфектированные клетками RD, экспрессируют иммунореактивный белок со средней молекулярной массой приблизительно 30-32 кДа.
Пример 6
Иммунизация ПНВ и экспрессия белков антигенов 85 in vivo
Самкам мышей BALB/c и C57BL/6 в возрасте 5-6 недель дают наркоз путем интраперитонеальной (и.п.) инъекции смеси 5 мг гидрохлорида кетамина (Aveco, Fort Dodge, Айова) и 0,5 мг ксилазина (Моbley Corp., Shawnee, KS.) в физиологическом растворе. Задние лапы обрабатывают 70% этанолом. Животных инъецируют три раза 100 мкл ДНК (2 мг/мл), суспендированной в физиологическом растворе: по 50 мкл в каждую лапу. На 17-18 день после иммунизации отбирают образцы сыворотки и анализируют на присутствие антител против Аg85. На фиг. 9 показана специфическая иммуноблотреактивность сывороток мышей, инъецированных ДНК Аg85 (С1), но не мышей, которые получали контрольную ДНК, не содержащую генную вставку (V1J). Реактивность определяют при разведении сыворотки по меньшей мере 1:160 против 300 нг очищенного антигена 85А (фиг. 9Б). Это показывает, что инъекция ДНК Аg 85 приводит к экспрессии Аg 85 in vivo, так что он доступен для образования антител как у мышей BALB/c, так и у мышей C57BL/6 (В6).
Пример 7
Антиген-85-специфические Т-клеточные реакции
Селезеночные клетки вакцинированных мышей проверяют на секрецию цитокина в ответ на специфическую антигенную рестимуляцию, как описано в работе Huygen et al., 1992 [Infect. Immunity 60, 2880]. Конкретно, селезеночные клетки инкубируют с белками культурального фильтрата (CF) из очищенного антигена 85А БЦЖ M.bovis или 20-мерного (20-mer) пептида, соответствующего известному Т-клеточному эпитопу для мышей C57BL/6 (аминокислоты 241-260). Мышей иммунизируют VlJns. tPA85A (С1) (100 мкг) три раза с трехнедельными интервалами и проводят анализ через 17 дней после последней иммунизации. Цитокины проверяют с использованием биоанализов на ИЛ-2, γ-интерферон (IFN-γ) и ИЛ-6, и ELISA на ИЛ-4 и ИЛ-10. Наблюдают значительное продуцирование ИЛ-2 и IFN-γ как у мышей BALB/c, так и у мышей C57BL/6, вакцинированных VlJns.tPA85A (С1) (фиг. 10-13). Кроме того, мыши C57BL/6 также реагируют на Н-2b-рестриктированный Т-клеточный эпитоп (фиг. 13). Уровни ИЛ-4, ИЛ-6 и ИЛ-10 не возрастают у мышей, вакцинированных VlJns. tPA85A (фиг. 14-16). Эти результаты показывают, что реакция хелперных Т-клеток Thi типа генерируется ДНК-вакциной.
Пример 8
Защита от контрольного микобактериального заражения
Чтобы проверить эффективность ДНК-вакцины против М.tb, мышей заражают путем внутривенной инъекции живых БЦЖ M.bovis (0,5 мг) и анализируют размножение БЦЖ в селезенке и легких. В качестве контроля определяют размножение БЦЖ у зараженных невакцинированных мышей (первичная инфекция) и у зараженных мышей, которые вакцинированы БЦЖ на момент инъекции ДНК (вторичная инфекция). Число колониеобразующих единиц (КОЕ) в легких мышей, вакцинированных VlJns.tPA85A (Cl), существенно снижено по сравнению с мышами с первичной инфекцией или мышами, вакцинированными контрольной ДНК VIJ. У мышей C57BL/6 КОЕ уменьшается на 83% на 8 день после контрольного заражения (фиг. 17), а у мышей BALB/c КОЕ снижается на 65% на 20 день (фиг. 18). В селезенке КОЕ снижается приблизительно на 40% на 20 день после контрольного заражения у мышей BALB/c (фиг. 19) и на 8 день у мышей C57BL/6 (фиг. 20). Следовательно, иммунные реакции, наблюдаемые после инъекции ДНК-вакцины против М.tb, обеспечивают защиту на модели с контрольным заражением живыми M.bovis.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОНСТРУКЦИЯ ДНК (ВАРИАНТЫ), ДНК-ВЕКТОР, ИММУНОГЕННАЯ КОМПОЗИЦИЯ ПРОТИВ ВИРУСА ГРИППА, СПОСОБ ИНДУКЦИИ ИММУННОГО ОТВЕТА, ВАКЦИНА И СПОСОБ ВАКЦИНАЦИИ | 1994 |
|
RU2193065C2 |
| ПОЛИНУКЛЕОТИДНАЯ ВАКЦИНА ДЛЯ ВИРУСА ПАПИЛЛОМЫ | 1995 |
|
RU2173170C2 |
| ЭКСПРЕССИРУЮЩИЙ ВЕКТОР (ВАРИАНТЫ) | 1995 |
|
RU2177999C2 |
| МОЛЕКУЛА НУКЛЕИНОВОЙ КИСЛОТЫ, КОДИРУЮЩАЯ HPV31 L1, ЭКСПРЕССИРУЮЩИЙ ВЕКТОР, КЛЕТКА-ХОЗЯИН, ВИРУСОПОДОБНАЯ ЧАСТИЦА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ, ВАКЦИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБЫ С ИХ ИСПОЛЬЗОВАНИЕМ | 2004 |
|
RU2356943C2 |
| ОПТИМИЗИРОВАННАЯ ЭКСПРЕССИЯ HPV 58 L1 В ДРОЖЖАХ | 2004 |
|
RU2370538C2 |
| ОПТИМИЗИРОВАННАЯ ЭКСПРЕССИЯ HPV 52 L1 В ДРОЖЖАХ | 2005 |
|
RU2373219C2 |
| ОЧИЩЕННЫЕ БЕЛКИ ВИРУСА ПАПИЛЛОМЫ | 1995 |
|
RU2161651C2 |
| СИНТЕТИЧЕСКАЯ МОЛЕКУЛА НУКЛЕИНОВОЙ КИСЛОТЫ (ВАРИАНТЫ), ЭКСПРЕССИОННЫЙ ВЕКТОР ДЛЯ КЛЕТОК МЛЕКОПИТАЮЩЕГО, КЛЕТКА МЛЕКОПИТАЮЩЕГО ХОЗЯИНА И СПОСОБ ЭКСПРЕССИИ ЧЕЛОВЕЧЕСКОГО БЕЛКА АНТИГЕНА ЭПИДЕРМАЛЬНОГО ФАКТОРА РОСТА-2 (HER2/neu) ИЛИ ЕГО УКОРОЧЕННОЙ ФОРМЫ | 2004 |
|
RU2397249C2 |
| ПАПИЛЛОМАВИРУСНЫЕ ВАКЦИНЫ | 1995 |
|
RU2206608C2 |
| ОПТИМИЗИРОВАННАЯ ЭКСПРЕССИЯ L1 HPV45 В ДРОЖЖАХ | 2004 |
|
RU2360001C2 |








Полипептид содержит промотор транскрипции СМV, связанный с первым цистроном. Первый цистрон содержит транскрипции CMV и представляет собой ген, кодирующий микобактериальный белок 85А, или В, или С. Указанный ген связан контрольной последовательностью. Последняя включает терминатор и промотор транскрипции BGH или JRES. Контрольная последовательность может быть связана со вторым цистроном - геном, кодирующим GM-CSF, IL-12, интерферон или член семейства В7 Т-клеточных костимулирующих белков. Указанный ген может быть связан с терминатором транскрипции BGH, геном устойчивости к ампициллину или канамицину, связанным с участком, включающим точку начала репликации. Способ индукции антимикобактериальных иммунных ответов, а также иммунных ответов против эпитопа микобактериального белка 85А заключается во введении позвоночному указанного выше полинуклеотида. Вакцина содержит эффективное количество указанного выше полинуклеотида и фармацевтически приемлемый носитель и обеспечивает индукцию иммунного ответа у позвоночного против микобактериального белка 85А. Изобретение позволяет получать иммунные сыворотки против антигенов Mycobacterium tuberculosis. 5 с.п. ф-лы, 20 ил.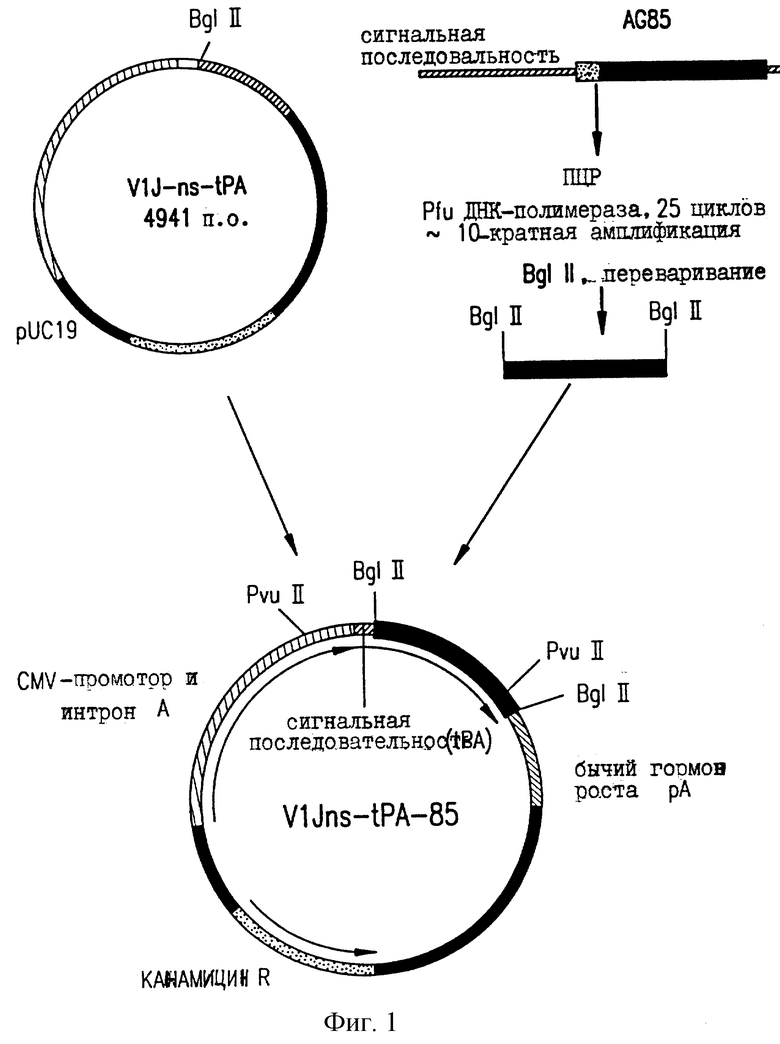
| JEAN CONTENT and an | |||
| Устройство для выпрямления опрокинувшихся на бок и затонувших у берега судов | 1922 |
|
SU85A1 |
| "Infection and Immunity", v.59, N 9, sept.1991, р.3205-3212 | |||
| LUK DE WIT and an | |||
| Способ образования коричневых окрасок на волокне из кашу кубической и подобных производных кашевого ряда | 1922 |
|
SU32A1 |
| "Nucleic Acids Research", v.18, N 13, 30.05.1990, р.3995 | |||
| MARTINE BORRMANS and an | |||
| Cloning, Sequence Determination, and Expression of a 32 kDa- protein Gene of Mycobacterium tuberculosis | |||
| "Infection and Immunity", v.57, N 10, Okt.1989, р.3123-3130 | |||
| WO 9010701 А, 20.09.1990 | |||
| WO 9015873 А, 27.12.1990 | |||
| Способ определения микобактерий туберкулеза в диагностической пробе | 1989 |
|
SU1684616A1 |
Авторы
Даты
2002-07-27—Публикация
1995-11-13—Подача