Предлагаемое изобретение относится к органической химии и медицине, а именно к новому соединению - 6-метил-5-морфолинометил-1-(тиетан-3-ил)пиримидин-2,4(1H,3H)-диону, обладающему антиоксидантной активностью.
Известны комплексные соединения 6-метилурацила с янтарной кислотой [патент RU 2259357, 2003 г.], 1,3-бис(2-гидроксиэтил)-5-гидрокси-6-метилурацила с фумаровой кислотой [патент RU 2330025, 2006 г.], обладающие антигипоксической активностью.
Известны основания Манниха в ряду урацила (пиримидин-2,4(1H,3H)-диона): 6-метил-5-морфолинометилурацил и 6-метил-5-пиперидинометилурацил, обладающие антиокислительной активностью [Чернышенко Ю.Н., Мустафин А.Г., Гимадиева А.Р., Абдрахманов И.Б., Герчиков А.Я., Сафарова И.В. // Синтез и антиокислительная активность оснований Манниха 6-метилурацила. Хим.-фарм. журнал, 2010. - Т.44, №3, - с.14-16]; 6-метил-5-морфолинометилурацил принят в качестве наиболее близкого аналога изобретения.
Задачей изобретения является расширение арсенала биологически активных веществ, в том числе обладающих антиоксидантной активностью.
Технический результат - получение биологически активного вещества, обладающего антиоксидантной активностью.
Сущность изобретения: 6-метил-5-морфолинометил-1-(тиетан-3-ил)пиримидин-2,4(1H,3H)-дион формулы (I):
 ,
,
обладающий антиоксидантной активностью.
Указанное соединение и его свойства в литературе не описаны.
Заявляемое соединение синтезируют аминометилированием 6-метил-1-(тиетан-3-ил)пиримидин-2,4(1H,3H)-диона по реакции Манниха с применением формальдегида и вторичного циклического амина - морфолина. 6-Метил-1-(тиетан-3-ил)пиримидин-2,4(1H,3H)-дион получен по методике, описанной в работах [Катаев В.А., Мещерякова С.А., Лазарев В.В., Кузнецов В.В. // Синтез тиетанилзамещенных пиримидин-2,4(1H,3H)-дионов. - ЖОрХ. - 2013. - Т.49. Вып.5. - с.760-762; патент RU 2485118, 2013 г.]
Пример 1. Синтез заявляемого соединения.
К раствору 1,58 г (8 ммоль) 6-метил-1-(тиетан-3-ил)пиримидин-2,4(1H,3H)-диона в 50 мл этанола при перемешивании добавляют 0,8 мл 33,7%-ного (8,8 ммоль) раствора формальдегида, 0,76 г (8,8 ммоль) морфолина и 0,88 мл 1М раствора хлористоводородной кислоты. Реакционную смесь кипятят 5 часов, охлаждают, выпавший осадок отфильтровывают, промывают этанолом, сушат. Выход 1,54 г (65%). Очищают кристаллизацией из этанола. Т.пл.=188-190°C.
Пример 2. Синтез заявляемого соединения.
К суспензии 1,8 г (9 ммоль) 6-метил-1-(тиетан-3-ил)пиримидин-2,4(1H,3H)-диона в 60 мл ацетона добавляют 8,1 мл 33,7%-ного (90 ммоль) раствора формальдегида, 2,35 г (27 ммоль) морфолина. Реакционную смесь кипятят 3 ч, охлаждают, выпавший осадок отфильтровывают, промывают водой, сушат. Выход 1,95 г (73%). Очищают кристаллизацией из этанола. Т.пл.=188-190°C.
ИК-спектр, ν, см-1: 3097 (N-H), 1717 (C2=O), 1646 (C4=O, C=C), 1423 (CH2-C5=C6).
Спектр ЯМР 1H (500 МГц, CDCl3) δ, м.д.: 2.32 с (3H, 6-CH3), 2.46 т [4H, N(CH2)2, J 4.1 Гц], 3.18-3.22 м [2H, S(CH)2], 3.31 с (2H, 5-CH2), 3.68 т [4H, O(CH2)2, J 4.5 Гц], 4.33-4.37 м [2H, S(CH)2], 6.23-6.30 м (1H, NCH), 10.37 уш. с (1H, N3H).
Спектр ЯМР 13C (500 МГц, CDCl3) δ, м.д.: 17.04 (6-CH3), 32.03 [S(CH2)2тиет.], 47.58 (NCHтиет.), 52.39 (5-CH2), 53.51 

Элементный анализ.
Найдено, %: C 52.63; H 6.21; N 14.29 - C13H19N3O3S.
Вычислено, %: C 52.51; H 6.44; N 14.13.
Заявляемое соединение представляет собой белый кристаллический порошок, нерастворимый в воде, этаноле, растворимый в хлороформе, диметилформамиде, диметилсульфоксиде.
Пример 3. Влияние заявляемого соединения на поведенческие реакции экспериментальных животных.
В качестве препарата сравнения взят эталонный антиоксидант оксиметилурацил (иммурег), применяемый в медицинской практике [Государственный реестр лекарственных средств. // М., 2004 - т.II, с.417], антиоксидантная активность которого описана в работах [Мышкин В.А., Бакиров А.Б. // Оксиметилурацил. Очерки экспериментальной фармакологии, Уфа, 2001. с.136-137; Лазарева Д.Н., Алехин Е.К., Плечев В.В. // Иммурег (Immureg). БГМУ, НПО «Башбиомед», 2004].
Эксперименты выполнены на 40 белых неинбредных крысах массой 200-220 г. Животным в течение 21 дня вводили препараты внутрижелудочно в дозе 50 мг/кг в виде суспензии на 2% крахмальной слизи. Первая группа - контроль (интактная), вторая группа ежедневно получала препарат сравнения - оксиметилурацил и третья группа - заявляемое соединение I (6-метил-5-морфолинометил-1-(тиетан-3-ил)пиримидин-2,4(1H,3H)-дион).
На фоне введения препаратов животным давали физическую нагрузку (ФН) в виде плавательного теста, по методике, предложенной Рыловой М.Л. и Burgin R. [Рылова М.Л. // Методы исследования хронического действия вредных факторов среды в эксперименте. - М.: Медицина, 1964. - 230 с.; R. Burgin, R. Weizman, М. Gavish // Repeated swim stress and peripheral; benzodiazepines receptors. - Neuropsychobiology. - 1996. - Vol.33 - p.28-31], трижды - в начале эксперимента, середине и по его завершении. Плавание как насильственная для крыс процедура вызывает неспецифическую реакцию организма на данную ФН и служит для создания у животных в эксперименте состояния напряжения и оксидативного стресса. В качестве бассейна использовалась емкость 1,7 м в диаметре, высота краев - 50 см, которая наполнялась водой на 30 см. Температура воды поддерживалась на уровне 25±1°C. В бассейн крысы помещались одновременно по 3 особи на 25 минут.
Изучение поведенческих (ориентировочных) реакций проводилось с помощью метода «Открытое поле» [Подшивалов В.П. // Экспериментальная психофармакология агрессивного поведения. - Л., 1986. - 174 с.]. Для этого использовалась круглая камера (100 см в диаметре) с металлическими стенками высотой 40 см, окрашенная в белый цвет. Белый пол камеры расчерчен черной краской на 16 квадратов, в центре камеры высверлены норки, отверстия диаметром 3 см. Камера освещалась лампой накаливания мощностью 60 Вт, расположенной на высоте 100 см над центром поля. Крыса помещалась у стенки поля, после чего в течение 4 минут (отдельно для каждого животного) фиксировались параметры свободного поведения.
Интегральные критерии рассчитывались по следующим формулам:
 ОИА=Σ(О+П+Н) ЭТ=Σ(ДнМ+Су+Вс)
ОИА=Σ(О+П+Н) ЭТ=Σ(ДнМ+Су+Вс)
где Kп - коэффициент подвижности;
ОИА - ориентировочно-исследовательская активность (сек);
ЭТ - эмоциональная тревожность (сек);
П - паттерн «поступательное перемещение»;
С - паттерн «сидит»;
Ф - паттерн «фризинг» (неподвижность);
Н - паттерн «заглядывание в норку»;
О - паттерн «обнюхивание»;
ДнМ - паттерн «движение на месте»;
Су - паттерн «вертикальная стойка на задних лапах с упором передними в стенку камеры»;
Вс - паттерн «вертикальная стойка на задних лапах».
Результаты исследования поведения животных в тесте приведены в таблицах 1-2.
Под воздействием ФН у экспериментальных животных первой группы понижался «норковый» рефлекс и уменьшались горизонтальный и вертикальный компоненты спонтанно-двигательной активности. Нарушалась ориентировочно-исследовательская активность. У животных второй и третьей групп, получающих препараты, поведенческие реакции изменялись с течением времени. При длительном применении препарата ориентировочно-исследовательская деятельность у крыс как до, так и после дачи физической нагрузки возросла (по сравнению с аналогичными показателями в начале эксперимента). Животные активно перемещались по горизонтальной плоскости поля. Увеличились количество заглядываний в норки. В некоторой степени снизилась эмоциональная тревожность.
Таким образом, исследуемые препараты: оксиметилурацил и заявляемое соединение I предохраняют животных от торможения поведенческих реакций, вызванных однократной физической нагрузкой. Наилучшие результаты выявлены в группе животных, получавших заявляемое соединение I.
Пример 4. Влияние заявляемого соединения на процессы свободнорадикального окисления (СРО) в мозге и печени экспериментальных животных in vivo.
Процессы СРО в гомогенатах мозга и печени исследовались методом регистрации железо-индуцированной хемилюминесценции (ХЛ) [Фархутдинов P.P., Лиховских В.А. // Хемилюминисцентные методы исследования свободнорадикального окисления в биологии и медицине. - Уфа, 1995. - 92 с.].
Приготовление гомогенатов органов экспериментальных животных после ФН: навеску ткани отмывали охлажденным фосфатным буфером, измельчали и заливали фосфатным буфером в соотношении 1:5 (вес : объем), гомогенизировали в механическом гомогенизаторе 5 мин при температуре +4°С. Полученный гомогенат фильтровали через капроновый фильтр, определяли содержание белка по Лоури и доводили до 20 мг/мл. Для изучения ХЛ отбирали 1 мл пробы, разводили в 20 мл фосфатного буфера. ХЛ инициировали добавлением 1 мл раствора FeSO4·7H2O - 50 мМ. Регистрацию свечения проводили на приборе «ХЛМ-003» (Россия).
В таблице 3 приведены средние значения светосуммы и максимальной интенсивности свечения в гомогенатах печени и мозга контрольных животных и животных, получавших препараты: светосумма свечения (S) характеризует способность липидов к окислению, максимальная интенсивность свечения (I max) зависит от интенсивности накопления гидроперекисей липидов. Как видно из таблицы, введение заявляемого соединения I приводило к снижению светосуммы и максимальной светимости ХЛ, что свидетельствует о том, что соединение I обладает протективной способностью нейтрализовать перекисные липидные радикалы в ткани мозга.
Пример 5. Влияние заявляемого соединения на генерацию активных форм кислорода (АФК) в крови экспериментальных животных.
Генерацию АФК в крови оценивали по изменению спонтанной и индуцированной люминолозависимой ХЛ (ЛЗХЛ) [Фархутдинов P.P., Лиховских В.А. // Хемилюминисцентные методы исследования свободнорадикального окисления в биологии и медицине. - Уфа, 1995. - 92 с.]. Для оценки спонтанной и индуцированной ЛЗХЛ крови использовали цельную гепаринизированную кровь экспериментальных животных после ФН (0,1 мл крови разводили в 2 мл физиологического раствора pH 7,2 с добавлением 0,1 мл 10-5 М раствора люминола). Для стимуляции «кислородного взрыва» в фагоцитах 0,1 мл крови экспериментальных животных инкубировали в течение 10 минут при 37°C с 0,01 мл 1% взвеси зимозана (зимозан - биополимер, выделенный из оболочки дрожжевой клетки и состоящий в основном из глюкана, в виде суспензии на изотоническом растворе натрия хлорида).
Результаты средних значений светосуммы и максимальной интенсивности свечения приведены в таблице 4. Из таблицы видно, что под действием оксиметилурацила и соединения I увеличились значения интегральных параметров ЛЗХЛ крови: спонтанной - в 1,8 раза, индуцированной - в 1,2-1,5 раза, что свидетельствует о подавлении генерации АФК.
Пример 6. Влияние заявляемого соединения на содержание ТБК-активных продуктов в гомогенатах мозга, печени и плазме крови экспериментальных животных.
Результаты исследования СРО в гомогенатах мозга и печени, полученные методом регистрации ХЛ, подтвердились при оценке содержания ТБК-активных продуктов, характеризующих состояние процессов перекисного окисления липидов (ПОЛ). Содержание ТБК-активных продуктов оценивали по цветной реакции с 2-тиобарбитуровой кислотой в присутствии ТХУ. Максимум поглощения окрашенного комплекса приходится на 532 нм, молярный коэффициент поглощения составляет 1,56·105 см-1 [Фархутдинов P.P., Тевдорадзе С.И. // Методики исследования жемилюминесценции биологического материала на хемилюминометре ХЛ-003. - Методы оценки антиоксидантной активности биологически активных веществ лечебного и профилактического назначения: сб. докл. науч.-практич. семинара. - М., 2005. - С.147-154].
В таблице 5 приведены средние значения концентрации ТБК-активных продуктов в мозге, печени и плазме крови экспериментальных животных. Уровень содержания малонового диальдегида в тканях мозга и печени у животных, которым вводили оксиметилурацил и соединение I, был несколько ниже контрольных значений, что свидетельствует об ингибировании ПОЛ.
Пример 7. Влияние заявляемого соединения на состояние общего антиоксидантного статуса в гомогенатах мозга, печени и плазме крови экспериментальных животных.
Состояние общего антиоксидантного статуса исследовали независимым спектрофотометрическим методом (TAS) в мозге, печени и плазме крови экспериментальных животных после ФН. В основе метода: присутствие антиоксидантов в образцах ингибирует сине-зеленый цвет радикала катиона ABTS при детекции в 600 нм, а степень ингибиции цвета пропорциональна концентрации антиоксиданта в исследуемом веществе.
Результаты исследования состояния общего антиоксидантного статуса независимым спектрофотометрическим методом (TAS) в мозге, печени и плазме крови экспериментальных животных в норме и на фоне введения препаратов подтвердили незначительные изменения CPO в организме подопытных животных: присутствие искомых антиоксидантов в образцах слабо ингибировало сине-зеленый цвет радикала катиона ABTS при детекции в 600 нм.
В таблице 6 приведены средние значения концентрации антиокислителя в мозге, печени и плазме крови экспериментальных животных. Можно отметить, что в образцах печени и мозга, полученных от группы животных, принимавших заявляемое соединение I, выявилось наибольшее увеличение концентрации антиокислителя. В плазме крови обнаружена другая тенденция - наибольшая концентрация антиокислителя выявлена в группе животных, принимавших препарат сравнения - оксиметилурацил.
Представленное химическое соединение при изучении его влияния на физиологические и метаболические процессы в организме экспериментальных животных на фоне ФН, сопровождающегося оксидативным стрессом, обладает антиоксидантной активностью, по некоторым показателям превосходя препарат сравнения - оксиметилурацил, и предохраняет экспериментальных животных от торможения поведенческих реакций, вызванных ФН. Также выявлено наибольшее увеличение концентрации заявляемого соединения I в печени (в 1,5 раза) и мозге (в 1,35 раза) экспериментальных животных по сравнению с оксиметилурацилом.
| название | год | авторы | номер документа |
|---|---|---|---|
| (5-БРОМ-2-ГИДРОКСИФЕНИЛ)МЕТИЛИДЕНГИДРАЗИД 2-[6-МЕТИЛ-4-(ТИЕТАН-3-ИЛОКСИ)ПИРИМИДИН-2-ИЛТИО]УКСУСНОЙ КИСЛОТЫ, ПРОЯВЛЯЮЩИЙ АНТИОКСИДАНТНУЮ АКТИВНОСТЬ | 2016 |
|
RU2626651C1 |
| СРЕДСТВО, ПРЕДСТАВЛЯЮЩЕЕ СОБОЙ 5-АМИНО-6-МЕТИЛУРАЦИЛ, ПРОЯВЛЯЮЩЕЕ АНТИОКСИДАНТНУЮ АКТИВНОСТЬ, И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2008 |
|
RU2398767C2 |
| 5-ГИДРОКСИ-6-МЕТИЛ-1-(ТИЕТАНИЛ-3)ПИРИМИДИН-2,4(1Н,3Н)-ДИОН, ПОДАВЛЯЮЩИЙ ГЕНЕРАЦИЮ АКТИВНЫХ ФОРМ КИСЛОРОДА | 2012 |
|
RU2487129C1 |
| ПРИМЕНЕНИЕ N′-{ 1-[6-МЕТИЛ-3-(ТИЕТАН-3-ИЛ)-2,4-ДИОКСО-3,4-ДИГИДРОПИРИМИДИН-1(2Н)-ИЛ]ПРОПАН-2-ИЛИДЕН} ИЗОНИКОТИНОГИДРАЗИДА В КАЧЕСТВЕ СРЕДСТВА, СТИМУЛИРУЮЩЕГО РЕГЕНЕРАЦИЮ ТКАНЕЙ | 2023 |
|
RU2813148C1 |
| СРЕДСТВО, ПРОЯВЛЯЮЩЕЕ АНТИТРОМБОТИЧЕСКИЙ ЭФФЕКТ ПОСРЕДСТВОМ БЛОКИРОВАНИЯ РЕЦЕПТОРОВ ТРОМБОЦИТОВ ГП IIb-IIIa (ВАРИАНТЫ) | 2016 |
|
RU2643336C1 |
| НОВЫЕ БИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ПИРРОЛИДИНОВ, ОБЛАДАЮЩИЕ АНТИОКСИДАНТНОЙ АКТИВНОСТЬЮ, И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2011 |
|
RU2472794C1 |
| (4-БРОМФЕНИЛ)ЭТИЛИДЕНГИДРАЗИД 2-[6-МЕТИЛ-1-(ТИЕТАН-3-ИЛ)УРАЦИЛ-3-ИЛ]УКСУСНОЙ КИСЛОТЫ, ПРОЯВЛЯЮЩИЙ ГИПОТЕНЗИВНУЮ АКТИВНОСТЬ | 2013 |
|
RU2539301C1 |
| БИЦИКЛИЧЕСКИЕ ПИРИМИДИНЫ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ-АКТИВАТОРЫ АНТИОКСИДАНТНОЙ ПРОГРАММЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЦИТОПРОТЕКТОРОВ | 2014 |
|
RU2545758C1 |
| N-БУТИЛ-2-[6-МЕТИЛ-4-(ТИЕТАН-3-ИЛОКСИ)ПИРИМИДИН-2-ИЛТИО]АЦЕТАМИД, ПРОЯВЛЯЮЩИЙ АНТИОКСИДАНТНУЮ АКТИВНОСТЬ | 2024 |
|
RU2824634C1 |
| Антиагрегационное и антиоксидантное средство | 2023 |
|
RU2808474C1 |
Изобретение относится к органической химии, а именно к гетероциклическому соединению - 6-метил-5-морфолинометил-1-(тиетан-3-ил)пиримидин-2,4(1H,3H)-дион формулы 6-метил-5-морфолинометил-1-(тиетан-3-ил)пиримидин-2,4(1H,3H)-дион формулы: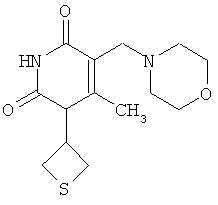 .
.
Технический результат: получено новое соединение, обладающее антиоксидантной активностью. 1 з.п. ф-лы, 6 табл., 7 пр.
1. 6-Метил-5-морфолинометил-1-(тиетан-3-ил)пиримидин-2,4(1H,3H)-дион формулы:

2. Соединение по п.1, обладающее антиоксидантной активностью.
| 6-МЕТИЛ-1-(ТИЕТАНИЛ-3)УРАЦИЛ, СТИМУЛИРУЮЩИЙ ЗАЩИТНУЮ АКТИВНОСТЬ ФАГОЦИТОВ | 2012 |
|
RU2485118C1 |
| Jeffery B | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| A novel transformation", J | |||
| Org | |||
| Chem., 1992, 57 (23), pp.6335–6339 | |||
Авторы
Даты
2015-01-20—Публикация
2013-11-18—Подача