Предлагаемое изобретение относится к органической химии и медицине, а именно к новому соединению - (5-бром-2-гидроксифенил)метилиденгидразиду 2-[6-метил-4-(тиетан-3-илокси)пиримидин-2-илтио]уксусной кислоты, обладающему антиоксидантной активностью.
Близкими структурными аналогами изобретения являются 6-метил-1-(тиетанил-3)урацил, стимулирующий защитную активность фагоцитов [Патент RU 2485118, 2013 г.], а также 6-метил-5-морфолинометил-1-(тиетан-3-ил)пиримидин-2,4(1H,3H)-дион, проявляющий антиоксидантную активность [Патент RU 2539302, 2015 г.].
В качестве прототипа и препарата сравнения взят эталонный антиоксидант оксиметилурацил (иммурег), применяемый в медицинской практике [Государственный реестр лекарственных средств. // М., 2004 - т. II, с. 417], антиоксидантная активность которого описана в работах [Мышкин В.А., Бакиров А.Б. // Оксиметилурацил. Очерки экспериментальной фармакологии, Уфа, 2001. с. 136-137; Лазарева Д.Н., Алехин Е.К., Плечев В.В. // Иммурег (Immureg). БГМУ, НПО «Башбиомед», 2004].
Задачей изобретения является расширение арсенала биологически активных веществ, в том числе обладающих антиоксидантной активностью.
Технический результат - получение биологически активного вещества, обладающего антиоксидантной активностью.
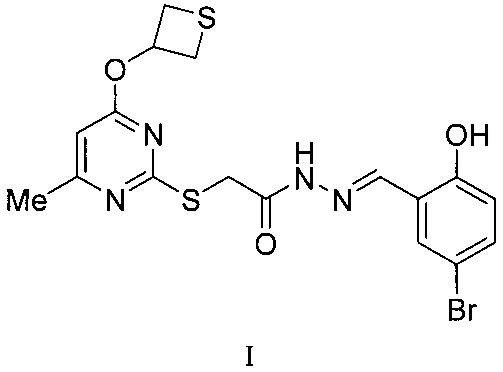
Сущность изобретения: (5-бром-2-гидроксифенил)метилиденгидразид 2-[6-метил-4-(тиетан-3-илокси)пиримидин-2-илтио]уксусной кислоты формулы (I):
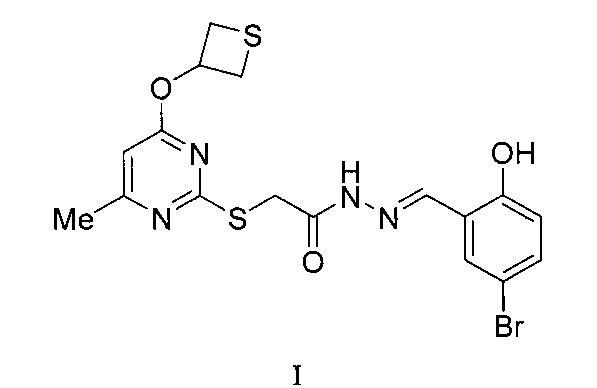 ,
,
обладающий антиоксидантной активностью.
Указанное соединение и его свойства в литературе не описаны.
Заявляемое соединение синтезируют следующим образом.
Взаимодействием калиевой соли 6-метил-2-тиоурацила с этил-2-хлорацетатом получают этиловый эфир 2-[6-метил-4-оксо-3,4-дигидропиримидин-2-илтио]уксусной кислоты, тиетанилирование которого 2-хлорметилтиираном в присутствии гидроксида калия в воде с последующим гидразинолизом приводит к образованию гидразида 2-[6-метил-4-(тиетан-3-илокси)пиримидин-2-илтио]уксусной кислоты. Полученный гидразид 2-[6-метил-4-(тиетан-3-илокси)пиримидин-2-илтио]уксусной кислоты конденсируют с 5-бром-2-гидроксибензальдегидом и получают (5-бром-2-гидроксифенил)метилиденгидразид 2-[6-метил-4-(тиетан-3-илокси)пиримидин-2-илтио]уксусной кислоты.
Пример 1
Синтез заявляемого соединения. 1,65 г (9,17 ммоль) калиевой соли 6-метил-2-тиоурацила растворяют в 12 мл этанола, затем при перемешивании добавляют 1,35 г (10,99 ммоль) этил-2-хлорацетата в 2 мл этанола. Нагревают на водяной бане при перемешивании. Образовавшийся порошок отфильтровывают, фильтрат охлаждают. Выпавший осадок этилового эфира 2-[6-метил-4-оксо-3,4-дигидропиримидин-2-илтио]уксусной кислоты отфильтровывают. Выход 1,69 г (81%). Очищают кристаллизацией из этилацетата. Т.пл.=144°С.
Спектр ЯМР 1Н (300 МГц, DMSO-d6), δ, м.д.: 1,11 (т, 3Н, СН3, Et, J 7,0); 2,12 (с, 3H, 6-СН3); 3,96 (с, 2Н, SCH2); 4,11 (к, 2Н, ОСН2, Et, J 7,0); 6,01 (с, 1Н, 5-Н); 12,26 (уш. с, 1Н, NH).
Элементный анализ:
Найдено, %: С 47,38; Н 5,32; N 12,27; О 21,03; S 14,05 - C9H12N2O3S.
Вычислено, %: С 47,36; Н 5,30; N 12,27; О 21,03; S 14,05.
1,5 г (6,58 ммоль) этилового эфира 2-[6-метил-4-оксо-3,4-дигидропиримидин-2-илтио]уксусной кислоты растворяют при интенсивном перемешивании в 10,25 мл 4%-ного раствора гидроксида калия. Раствор нагревают до 40-60°С и добавляют в один прием 0,79 г (7,2 ммоль) 2-хлорметилтиирана. Реакционную смесь перемешивают в течение 1 ч до рН≤8. Образовавшуюся смолообразную массу обрабатывают этилацетатом. Осадок отфильтровывают, органический слой промывают последовательно 5%-ным раствором гидроксида натрия и водой до нейтральной реакции. Затем растворитель отгоняют. Выход 0,83 г (42%). Очищают кристаллизацией из водного этанола (этанол-вода, 3:1). Т.пл=61°С.
Спектр ЯМР 1Н (300 МГц, CDCl3), δ, м.д.: 1,31 (т, 3H, СН3, Et, J 7,1); 2,34 (с, 3H, 6-СН3); 3,38-3,48 [м, 2Н, S(CH)2]; 3,48-3,58 [м, 2Н, S(CH)2]; 3,82 (с, 2Н, SCH2); 4,22 (к, 2Н, ОСН2, Et, J 4,1); 5,55-5,57 (м, Н, ОСНтиетан); 6,21 (с, 1Н,5-Н).
Элементный анализ:
Найдено, %: С 47,96; Н 5,39; N 9,43; О 15,88; S 21,35 - C12H16N2O3S2.
Вычислено, %: С 47,98; Н 5,37; N 9,33; О 15,98; S 21,35.
0,5 г (1,67 ммоль) этилового эфира 2-[6-метил-4-(тиетан-3-илокси)пиримидин-2-илтио]уксусной кислоты растворяют в 3 мл этанола, к раствору добавляют 0,34 г (5,01 ммоль) гидразина. Реакционную смесь перемешивают в течение 4 ч при комнатной температуре. Выпавший осадок отфильтровывают. Выход 0,32 г (67%). Очищают кристаллизацией из изопропанола. Т.пл.=119°С.
ИК спектр, ν, см-1: 3280 см-1 (N-H), 2960 см-1 (С-Н), 1630 см-1 (С=O), 1572-1591 см-1 (С=С, C=N), 1167 см-1, 1050 см-1 (С-О-С), 723 см-1, 710 см-1 (C-S).
Спектр ЯМР 1Н (500 МГц, DMSO-d6), δ, м.д.: 2,30 с (3H, 6-СН3); 3,42-3,49 [м 2Н, S(CH)2]; 3,78 (с 2Н, SCH2CO, Z); 4,18 (с 2Н, SCH2CO, E); 4,30 (уш. с, 2Н, NH2, Z); 4,54 (уш. с, 2Н, NH2, E); 5,76-5,82 (м 1Н, ОСНтиет); 6,50 (с 1Н, 5-Н, Z); 6,48 (с 1Н, 5-Н, E); 9,31 (уш. с 1Н, NH, Z); 8,61 (уш. с 1Н, NH, Е).
Спектр ЯМР 13С (500 МГц, ДМСО-d6), δ, м.д.: 23,11 (6-СН3); 32,51 (2-SCH2CO); 34,50 (С2', С4'тиетан); 69,63 (O-С3'тиетан); 101,91 (С5); 166,79 (2-SCH2CO); 166,95 (С4); 168,52 (С6); 169,17 (С2).
Элементный анализ:
Найдено, %: С 41,97; Н 4,93; N 19,57; О 11,17; S 22,39 - C10H14N4O2S2.
Вычислено, %: С 41,94; Н 4,93; N 19,57; О 11,17; S 22,39.
0,2 г (0,7 ммоль) гидразида 2-[6-метил-4-(тиетан-3-илокси)пиримидин-2-илтио]уксуснои кислоты растворяют в 4 мл этанола, добавляют 0,17 г (0,8 ммоль) 5-бром-2-гидроксибензальдегида, кипятят 0,5 ч. Охлаждают, осадок отфильтровывают, промывают этанолом, сушат. Получают 0,27 г (69%) (5-бром-2-гидроксифенил)метилиденгидразида 2-[6-метил-4-(тиетан-3-илокси)пиримидин-2-илтио]уксусной кислоты, очищают кристаллизацией из изобутанола. Тпл.=183-185°С.
Спектр ЯМР 13С (500 МГц, CDCl3), δ, м.д.: 23,84 (6-СН3); 32,93 (2-SCH2CO); 33,64 (С2', С4'тиетан); 69,52 (O-С3'тиетан); 103,59 (С5); 110,95 (С5аром); 149,30 (N=CH); 119,21 (С3аром); 132,78 (С6аром); 134,47 (С4аром); 157,70 (С2аром); 165,41 (2-SCH2CO); 167,80 (С4); 167,92 (С6); 169,80 (С2).
Элементный анализ:
Найдено, %: С 43,50; Н 3,60; Br 17,02; N 11,99; О 10,23; S 13,66 - C17H17BrN4O3S2.
Вычислено, %: С 43,50; Н 3,65; Br 17,02; N 11,94; О 10,23; S 13,66.
Заявляемое соединение представляет собой светло-желтый кристаллический порошок, нерастворимый в воде, этаноле, н-пропаноле, растворимый в диметилформамиде, диметилсульфоксиде.
Пример 2
Оценка влияния заявляемого соединения на генерацию активных форм кислорода (АФК)
Влияние заявляемого соединения и препарата сравнения на процессы свободнорадикального окисления (СРО) в трех модельных системах in vitro изучали с использованием экспресс-метода определения антиоксидантной активности, основанного на регистрации хемилюминесценции (ХЛ) - свечения, возникающего при взаимодействии свободных радикалов [Байматов В.Н., Фархутдинов P.P., Багаутдинов A.M. // Хемилюминесцентные методы исследования свободнорадикального окисления в сельском хозяйстве, ветеринарной медицине и животноводстве. - Уфа, Изд-во «Здравоохранение Башкортостана», 2009. - 104 с.].
Хемилюминесценцию регистрировали на установке ХЛМ-003 (Россия). Основными наиболее информативными характеристиками ХЛ служили интенсивность максимальной вспышки (Imax, у.е.) и светосумма свечения (S, у.е.), которую измеряли в течение 5 мин.
Заявляемое соединение добавляли в модельные системы в концентрациях, не превышающих терапевтическую дозу препарата сравнения оксиметилурацила, применяемого в медицинской практике. Изучаемое соединение растворяли в ДМСО (50 мг в 2 мл ДМСО) и добавляли в тест-системы в объеме 0,1 и 0,01 мл приготовленного раствора. В качестве контроля использовали модельные системы, в которых вместо исследуемых препаратов добавляли 0,9% физиологический раствор в том же объеме.
Для оценки влияния на процессы СРО in vitro исследования проводили на модельных системах, генерирующих АФК.
В качестве модельной системы, где генерировались АФК, использовали 10 мл фосфатного буфера (20 мМ КН2РО4, 105 мМ KCl) с добавлением раствора люминола (10-5 М) и цитрата натрия (50 мМ). Величину рН полученного раствора доводили до 7,45 ед. титрованием насыщенным раствором гидроксида калия. Для инициирования реакций, сопровождающихся образованием АФК, вводили 1 мл 50 мМ раствора солей Fe2+. Регистрация свечения продолжалась в течение 5 мин при постоянном перемешивании.
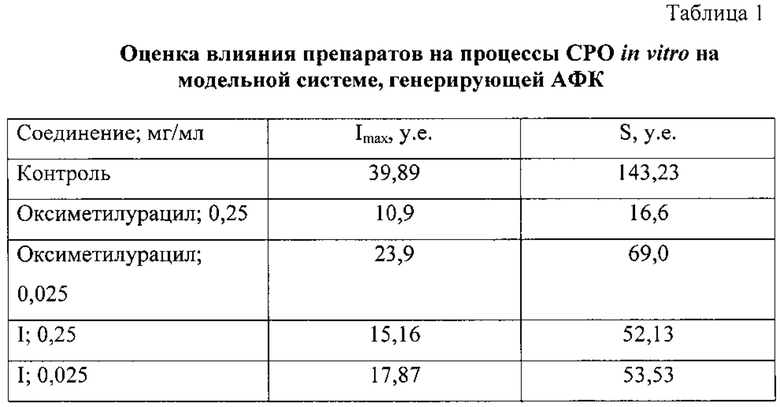
Результаты средних значений светосуммы и максимальной интенсивности свечения приведены в таблице 1.
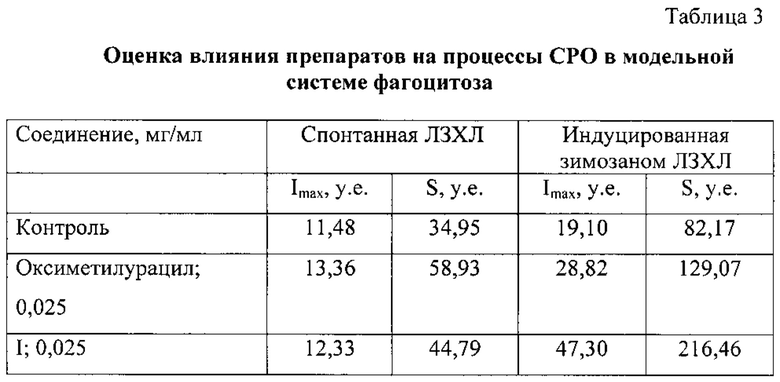
Угнетение ХЛ зависело от концентрации препарата (0,25 мг/мл; 0,025 мг/мл) (таблица 1). Чем она была выше, тем сильнее подавлялось свечение, это свидетельствовало о связи ХЛ со свободнорадикальным окислением.
Представленное химическое соединение подавляет генерацию активных форм кислорода, в концентрации 0,025 мг/мл, превосходя оксиметилурацил в 1,3 раза, что свидетельствует о наличии антиоксидантных свойств у заявляемого соединения.
Пример 3
Оценка влияния заявляемого соединения на процессы перекисного окисления липидов (ПОЛ)
Для оценки влияния на процессы СРО in vitro исследования были проведены на модельной системе, в которой протекают реакции ПОЛ.
Влияние исследуемых соединений на ПОЛ изучали в липидах куриного желтка, сходных по составу с липидами крови. Липиды получали путем гомогенизирования куриного желтка в фосфатном буфере в соотношении 1:5 и последующим разбавлением в 20 раз, отбирали 10 мл. Добавление в систему 1 мл 50 мМ раствора Fe2+ вело к инициированию окисления ненасыщенных жирных кислот, что сопровождалось ХЛ. По интенсивности свечения судили о процессах ПОЛ.
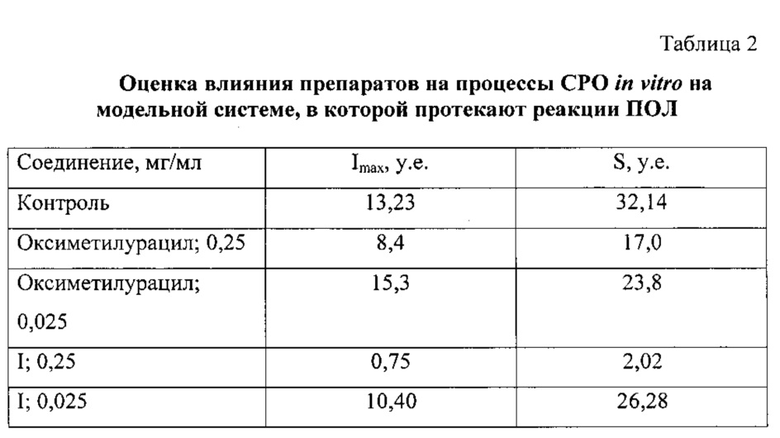
В таблице 2 приведены средние значения светосуммы и максимальной интенсивности свечения: светосумма свечения (S) характеризует способность липидов к окислению, максимальная интенсивность свечения (Imax) зависит от интенсивности накопления гидроперекисей липидов. Как видно из таблицы 2, введение заявляемого соединения I в дозе 0,25 мг/мл приводило к снижению светосуммы и максимальной светимости ХЛ, что свидетельствует о том, что соединение I обладает способностью нейтрализовать перекисные липидные радикалы.
Пример 4
Фагоцитарная активность заявляемого соединения
Для оценки влияния исследуемых соединений на процессы СРО in vitro исследования были проведены на модельной системе, генерирующей АФК в клетках крови (модель фагоцитоза).
Характер влияния на процессы генерации свободных радикалов фагоцитами изучали по схеме: кровь из локтевой вены здорового донора забирали утром натощак в количестве 2 мл и помещали в пластиковую пробирку с гепарином из расчета 50 ед. на 1 мл. Вначале регистрировали спонтанную люминолзависимую хемилюминесценцию цельной крови. Для этого к 2 мл физиологического раствора с растворенным в нем 10-5 М люминолом добавляли 0,1 мл крови и помещали в термостатируемую камеру прибора, где поддерживалась постоянная температура 37°С. Запись свечения проводилась в течение 5 минут.
Дополнительно для стимуляции фагоцитоза, для изучения индуцированной люминолзависимой хемилюминесценции кровь (0,1 мл) инкубировали со стимулятором (0,01 мл зимозана) в течение 5 минут на планшетке для иммунологических исследований в термостате при 37°С. После этого содержимое планшеты вносили в 2 мл физиологического раствора с люминолом, аналогично помещали в прибор и записывали свечение в течение 5 минут.
Влияние заявляемого соединения на процессы СРО в модельной системе фагоцитоза представлено в таблице 3.
Заявляемое химическое соединение стимулирует фагоцитарную активность клеток крови, превосходя оксиметилурацил в 2 раза.
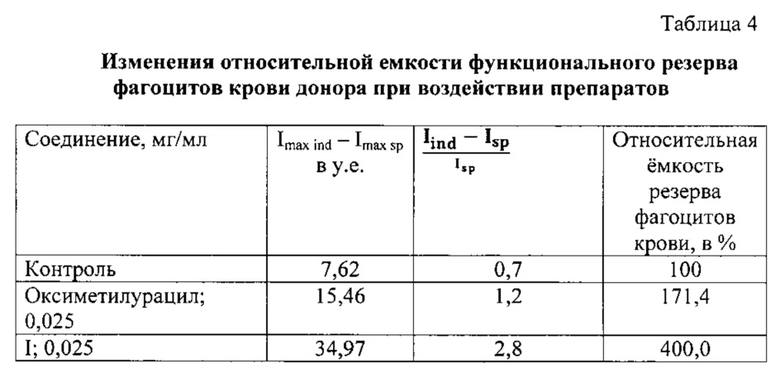
Для исследования резервных возможностей фагоцитирующих клеток крови определяли абсолютную величину резервных возможностей фагоцитов (разница между максимальной интенсивностью индуцированного свечения крови и максимальной интенсивностью спонтанного свечения крови).
Для полной характеристики резервных возможностей фагоцитов рассчитывали емкость этого резерва. Для этого применялась формула, показывающая кратность отношения резерва к спонтанному свечению:
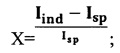
где X - соотношение резерва функциональной активности к спонтанному свечению фагоцитов крови;
Iind - максимальная интенсивность свечения индуцированной крови;
Isp - максимальная интенсивность свечения спонтанной крови.
Относительная емкость резерва функциональной активности фагоцитов крови при добавлении исследуемого соединения I увеличивается в большей степени по отношению к оксиметилурацилу (таблица 4).
| название | год | авторы | номер документа |
|---|---|---|---|
| N-БУТИЛ-2-[6-МЕТИЛ-4-(ТИЕТАН-3-ИЛОКСИ)ПИРИМИДИН-2-ИЛТИО]АЦЕТАМИД, ПРОЯВЛЯЮЩИЙ АНТИОКСИДАНТНУЮ АКТИВНОСТЬ | 2024 |
|
RU2824634C1 |
| 2-[6-МЕТИЛ-4-(ТИЕТАН-3-ИЛОКСИ)ПИРИМИДИН-2-ИЛТИО]АЦЕТОГИДРАЗИД МАЛЕИНОВОЙ КИСЛОТЫ, ПРОЯВЛЯЮЩИЙ ПРОТИВОМИКРОБНУЮ АКТИВНОСТЬ | 2018 |
|
RU2671573C1 |
| ПРОИЗВОДНЫЕ ТИЕТАНСОДЕРЖАЩИХ 1-БУТИЛ-3-МЕТИЛКСАНТИНОВ, ПРОЯВЛЯЮЩИЕ АНТИОКСИДАНТНУЮ АКТИВНОСТЬ | 2020 |
|
RU2740926C1 |
| 2-БРОМО-1-(4-БРОМОФЕНИЛ)ЭТИЛИДЕН-2-[6-МЕТИЛ-4-(ТИЕТАН-3-ИЛОКСИ)ПИРИМИДИН-2-ИЛТИО]АЦЕТОГИДРАЗИД, ОБЛАДАЮЩИЙ АНТИКОАГУЛЯЦИОННОЙ И АНТИАГРЕГАЦИОННОЙ АКТИВНОСТЬЮ | 2024 |
|
RU2824993C1 |
| N'-ПИРИДИН-4-ИЛМЕТИЛЕН-2-[6-МЕТИЛ-4-(ТИЕТАН-3-ИЛОКСИ)ПИРИМИДИН-2-ИЛТИО]АЦЕТОГИДРАЗИД, ОБЛАДАЮЩИЙ АНТИАГРЕГАЦИОННОЙ И АНТИКОАГУЛЯЦИОННОЙ АКТИВНОСТЬЮ | 2024 |
|
RU2825129C1 |
| 6-МЕТИЛ-5-МОРФОЛИНОМЕТИЛ-1-(ТИЕТАН-3-ИЛ)ПИРИМИДИН-2,4(1Н,3Н)-ДИОН, ПРОЯВЛЯЮЩИЙ АНТИОКСИДАНТНУЮ АКТИВНОСТЬ | 2013 |
|
RU2539302C1 |
| 6-МЕТИЛ-1-(ТИЕТАНИЛ-3)УРАЦИЛ, СТИМУЛИРУЮЩИЙ ЗАЩИТНУЮ АКТИВНОСТЬ ФАГОЦИТОВ | 2012 |
|
RU2485118C1 |
| 5-ГИДРОКСИ-6-МЕТИЛ-1-(ТИЕТАНИЛ-3)ПИРИМИДИН-2,4(1Н,3Н)-ДИОН, ПОДАВЛЯЮЩИЙ ГЕНЕРАЦИЮ АКТИВНЫХ ФОРМ КИСЛОРОДА | 2012 |
|
RU2487129C1 |
| 5(6)-НИТРО-1-(ТИЕТАНИЛ-3)-2-ЭТОКСИБЕНЗИМИДАЗОЛ, ИНГИБИРУЮЩИЙ ПЕРЕКИСНОЕ ОКИСЛЕНИЕ ЛИПИДОВ | 2014 |
|
RU2555832C1 |
| СРЕДСТВО, ИНГИБИРУЮЩЕЕ ПЕРЕКИСНОЕ ОКИСЛЕНИЕ ЛИПИДОВ | 2014 |
|
RU2545808C1 |
Изобретение относится к новому соединению - (5-бром-2-гидроксифенил)метилиденгидразиду 2-[6-метил-4-(тиетан-3-илокси)пиримидин-2-илтио]уксусной кислоты формулы I. Соединение обладает антиоксидантной активностью и обладает стимулирующей защитной активностью фагоцитов. 2 з.п. ф-лы, 4 табл., 4 пр.
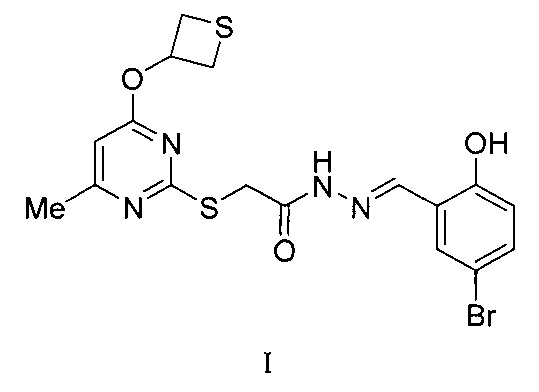
1. (5-Бром-2-гидроксифенил)метилиденгидразид 2-[6-метил-4-(тиетан-3-илокси)пиримидин-2-илтио]уксусной кислоты формулы:
2. Вещество по п. 1, проявляющее антиоксидантную активность.
3. Вещество по п. 1, стимулирующее защитную активность фагоцитов.
| 6-МЕТИЛ-5-МОРФОЛИНОМЕТИЛ-1-(ТИЕТАН-3-ИЛ)ПИРИМИДИН-2,4(1Н,3Н)-ДИОН, ПРОЯВЛЯЮЩИЙ АНТИОКСИДАНТНУЮ АКТИВНОСТЬ | 2013 |
|
RU2539302C1 |
| 6-МЕТИЛ-1-(ТИЕТАНИЛ-3)УРАЦИЛ, СТИМУЛИРУЮЩИЙ ЗАЩИТНУЮ АКТИВНОСТЬ ФАГОЦИТОВ | 2012 |
|
RU2485118C1 |
| (4-БРОМФЕНИЛ)ЭТИЛИДЕНГИДРАЗИД 2-[6-МЕТИЛ-1-(ТИЕТАН-3-ИЛ)УРАЦИЛ-3-ИЛ]УКСУСНОЙ КИСЛОТЫ, ПРОЯВЛЯЮЩИЙ ГИПОТЕНЗИВНУЮ АКТИВНОСТЬ | 2013 |
|
RU2539301C1 |
| СРЕДСТВО, ПРЕДСТАВЛЯЮЩЕЕ СОБОЙ 5-АМИНО-6-МЕТИЛУРАЦИЛ, ПРОЯВЛЯЮЩЕЕ АНТИОКСИДАНТНУЮ АКТИВНОСТЬ, И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2008 |
|
RU2398767C2 |
Авторы
Даты
2017-07-31—Публикация
2016-10-31—Подача