Изобретение относится к медицине, а точнее к средствам для магнитно-резонансной контрастной диагностики и бинарной лучевой терапии злокачественных опухолей (нейтрон-захватная и фотон-захватная терапия). Изобретение может быть использовано как в экспериментальных, так и в клинических исследованиях.
Магнитно-резонансные контрастные средства широко используются в клинической практике для диагностики различных патологических состояний. Магнитно-резонансное контрастное средство увеличивает чувствительность, специфичность и диагностическую надежность магнитно-резонансной томографии, способствует не только выявлению патологического очага, но и более точному определению степени его распространенности, постановке дифференциального диагноза, сокращает, в конечном итоге, время исследования и, следовательно, делает последнее более экономичным.
В нейтрон-захватной и фотон-захватной лучевой терапии лекарственные средства, содержащие гадолиний, применяются для формирования дополнительной энергии в облучаемой мишени, которая образуется в результате ядерно-физических взаимодействий гадолиния с тепловыми нейтронами или фотонами;
n+157Gd → 158Gd → фотоны (7,88 мэВ) + электроны конверсии (45-66 кэВ) + электроны Оже и Кестер-Кронига (5-9 кэВ);
γ(~60 кэВ) + Gd, Bi ~ рентгеновское излучение (-30 кэВ) + электроны (~30 кэВ)
В настоящее время известен ряд коммерческих магнитно-резонансных контрастных средств, нашедших применение в клинической практике в качестве диагностических препаратов. Все они представляют собой водные растворы комплексных соединений гадолиния с органическими лигандами. Это препараты Магневист и Гадовист германской фирмы Bayer AG, Омнискан американской фирмы GE Healthcare, Дотарем французской фирмы Laboratore Gubert. ПроХанс и МультиХанс итальянской фирмы Bracco.
Наиболее широко используются препараты на основе диэтилентриаминопентауксусной кислоты и, в частности, препарат Магневист, который был избран в качестве аналога [DE №3129906, A61, опубл. 1981].
Препарат Магневист представляет собой 0,5 М водный раствор димеглюминовой соли гадопентетата с pH ~7, вязкостью 4,9 cP при 20°C и плотностью не более 1,2 г/см3 при 20°C.
Применение Магневиста и других магнитно-резонансных контрастных средств для формирования дополнительного энерговыделения в бинарных лучевых технологиях ограничено высокой скоростью элиминации из места их внутритканевого введения. Системные пути введения этих препаратов не эффективны для этой цели, поскольку все они являются внеклеточными веществами и не способны накапливаться внутри нормальных и опухолевых клеток. Кроме того, препарат Магневист не безопасен для медицинского применения, так как сложен для контроля его качества.
Известна лекарственная форма гадопентетата, представляющая собой 0,5 М раствор динатриевой соли комплекса гадолиния с диэтилентриаминопентауксусной кислотой с pH 5,0-85, содержащий до 5% поливинилпирролидона с молекулярной массой 12000±1500 дальтон. Данная лекарственная форма взята нами в качестве прототипа [RU №2150961, A61K 49/00, опубл. 20.06.2000]. Наличие в лекарственной форме поливинилпирролидона с молекулярной массой 12000±1500 дальтон обеспечивает замедленную элиминацию основной субстанции гадопентетата при интратуморальном пути его введения. Недостатком лекарственной формы - прототипа является наличие в них поливинилпирролидона с молекулярной массой 12000±1500 дальтон, запрещенного для использования в медицинских целях (Циркуляр Федеральной службы по надзору в сфере здравоохранения и социального развития (№1100-Пр/05 от 24.05.2005). Скорость элиминации гадопентетата при интратуморальном введении лекарственной формы в технологиях нейтрон-захватной и фотон-захватной лучевой терапии характеризуется периодом полуэлиминации, Т1/2Э, равным 50±5 мин, что не является оптимальной величиной для реализации бинарных лучевых технолотий.
Известна контрастная композиция для магнитно-резонансной томографии и рентгеновских исследований на основе комплекса гадолиния, согласно изобретению, содержащая от 0.1 до 1.5 моль/л комплекса гадолиния (Gd3+) с динатриевой солью диэтилентриаминопентауксусной кислоты (ДТПА) или диметиламиддиэтилентриаминопентауксусной кислоты (ДМАДТПА) с pH 6-8 и дополнительно содержащая от 0.0001 до 0.5% металлохромного индикатора от массы гадолиния. В качестве металлохромного индикатора используют хромазурол S или хромоксан чисто-голубой БЛД, растворы которых устойчивы в течение длительного времени. Хромазурол S и хромоксан чисто-голубой БЛД имеют контрастный переход (желтый - фиолетовый) в рабочем диапазоне pH от 6 до 8 единиц. Константа комплексообразования этих индикаторов составляет 12 до 16 единиц. Изменение цвета раствора композиции обусловлено образованием комплекса гадолиний-индикатор при распаде комплекса гадолиний-ДТПА или гадолиний-ДМАДТПА (RU 2308290, A61K 49/06, A61K 49/04, опубл. 20.10.2007). Этот источник принят в качестве прототипа.
Положительный результат, получаемый при реализации предложенной композиции, заключается в высокой безопасности препарата в качестве магнитно-резонансной и рентгеновской контрастной композиции. Но при наличии таких положительных качеств данное контрастное средство имеет недостаток, заключающийся в недостаточной визуализации специфической ферментативной активности и активации факторов транскрипции в живых системах.
Настоящее изобретение направлено на достижение технического результата, заключающегося в повышении эффективности применения в нейтрон-захватной и фотон-захватной терапии за счет усиления визуализации специфической ферментативной активности и активации факторов транскрипции в живых системах.
Указанный технический результат достигается тем, что в качестве контрастного средства используют модифицированные гадопентетатом производные бета-циклодекстрина, в частности бета-циклодекстрин, содержащий один, два, три остатка гадопентетата или их смесь с общей формулой
(C42H70-nO35)(C14H21N3O8)nGdn, где n=1-7.
Указанный технический результат так же достигается тем, что в качестве контрастного средства используют модифицированные гадопентетатом производные бета-циклодекстрина, в частности бета-циклодекстрин, содержащий один, два, три остатка гадопентетата или их смесь с общей формулой
(C42H70-nO35)(C14H21N3O8)nGdn, где n=1-7, при этом смесь состоит из 70-80% монопроизводного бета-циклодекстрина, 10-20%, ди-производного бета-циклодекстрина и 5-10% три-производного бета-циклодекстрина.
Указанные признаки являются существенными и взаимосвязаны с образованием устойчивой совокупности существенных признаков, достаточной для получения требуемого технического результата.
Настоящее изобретение поясняется иллюстративным материалом, где:
фиг.1 - фронтальная MP томограмма мыши с перевивной опухолью меланомы B16, T2 - взвешенное изображение,
фиг.2 - фронтальная MP томограмма мыши с перевивной опухолью меланомы B16, T1 взвешенное изображение до введения образца;
фиг.3 - фронтальная MP томограмма мыши с перевивной опухолью меланомы B16, T1 взвешенное изображение после введения образца, область роста опухоли выделена;
фиг.4 - фронтальная MP томограмма тазовой области мыши с перевивной эпидермоидной карциномой легкого Льюиса LLC1, T2 - взвешенное изображение;
фиг.5 - фронтальная MP томограмма тазовой области мыши с перевивной эпидермоидной карциномой легкого Льюиса LLC1, T1 взвешенное изображение до введения образца;
фиг.6 - фронтальная MP томограмма тазовой области мыши с перевивной эпидермоидной карциномой легкого Льюиса LLC1, T1 взвешенное изображение после введения образца, область роста опухоли выделена.
фиг.7 - фронтальная MP томограмма тазовой области мыши с перевивной аденокарциномой молочной железы Ca755, T2 - взвешенное изображение;
фиг.8 - фронтальная MP томограмма тазовой области мыши с перевивной аденокарциномой молочной железы Ca755, T1 взвешенное изображение до введения образца;
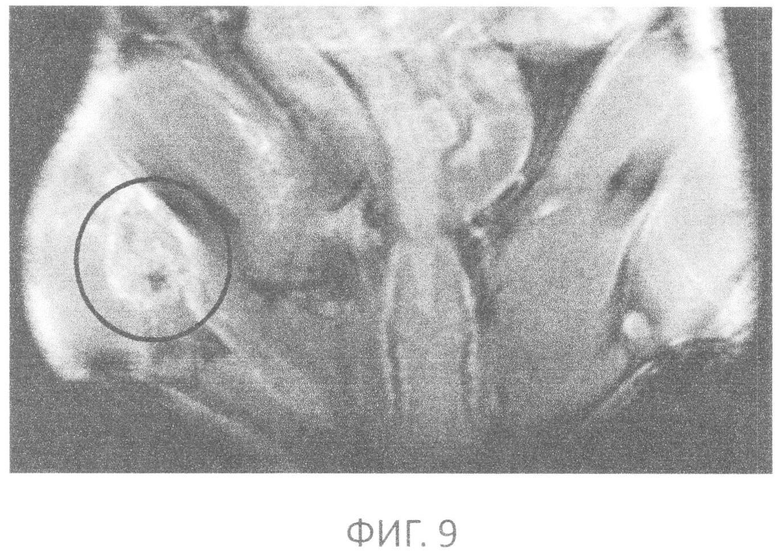
фиг.9 - фронтальная MP томограмма тазовой области мыши с перевивной аденокарциномой молочной железы Ca755, T1 взвешенное изображение после введения образца, область роста опухоли выделена.
Применение контрастных препаратов с парамагнитными свойствами представляет собой одно из наиболее перспективных направлений улучшения диагностических возможностей магнитно-резонансной томографии (МРТ). До сих пор контрастные препараты создаются на основе комплексов с Gd+3. Парамагнитные релаксационные свойства Gd+3 выгодно показывают возможность создания парамагнитных контрастных препаратов с релаксивностью. Контрастное вещество (KB) используется при МРТ в тех случаях, если необходимо выявить опухоль, ее размеры, состав клеток и границы. Контраст позволяет более детально изучить структуру тканей. Компоненты на основе гадолиния не токсичны и хорошо растворяются в воде. Для того чтобы гадолиний перестал быть токсичным, создают специальные хелатные комплексы (композиции, субстанции), так как простые его соли ядовиты. Применение контраста увеличивает отдачу сигнала от интересующей области тела. Скорость действия контраста зависит в первую очередь от того, как густо покрыта область кровеносными сосудами.
Главной целью использования KB в МРТ является ускорение процессов релаксации спинов протонов воды в окружающей ткани, т.е. укорачивание спин-решеточного T1 и спин-спинового Т2 времен релаксации, путем применения соли гадолиния Gd (III), так как катион Gd (III) имеет 7 неспаренных f-электронов, и симметричное S-состояние, что определяет, с одной стороны, большой магнитный момент, а с другой - медленную релаксацию электронов, что необходимо с точки зрения эффективности парамагнитного КВ. Общая теория релаксации в разбавленных растворах парамагнитных веществ была разработана Блюмбергеном, Соломоном и Морганом в 1950-х годах. Согласно этой теории, частота релаксации (релаксивность R(1,2)=1/T(1,2), т.е. величина обратная времени релаксации) в присутствии катиона Gd(III)1/Т(1,2)=1/Td(1,2)+1/Tp(1,2)=1/Td(1,2)+r(1,2)[Gd], где 1/Td(1,2) - диамагнитный терм, описывающий релаксацию в отсутствие KB; а r - т.н. молярная релаксивность, являющаяся коэффициентом пропорциональности между релаксивностью и [Gd]-концентрацией парамагнитного катиона. Обычно под релаксивностью понимают протонную релаксивность. Парамагнитная релаксация протонов воды происходит из-за диполь-дипольных взаимодействий между ядерными спинами и флуктуирующим локальным магнитным полем KB, которое создается благодаря наличию спина у неспаренных электронов. Для того, чтобы парамагнитный эффект релаксации влиял на большое число протонов молекул, они должны находиться в непосредственной сфере воздействия поля KB, так как это поле быстро уменьшается при удалении от парамагнитного атома. Для комплексов парамагнитных металлов подобным специфическим взаимодействием является координационное связывание молекул воды с КВ, т.е. взаимодействие во внутренней координационной оболочке. Кроме внутреннеоболочечного эффекта существует также внешнеоболочечный, который зависит от стохастической поступательной диффузии протонов вблизи КВ. Кроме того, молекулы воды образуют водородные связи с хелатирующим веществом. Эти молекулы воды во вторичной координационной оболочке вносят вклад во внешнеоболочечный эффект. Таким образом, суммарная релаксивность протонов воды в упрощенном виде равна сумме релаксивностей, где R=RIS+ROS, IS - внутренняя оболочка, a OS - внешняя оболочка. Величина обратная времени спин-решеточной релаксации во внутренней координационной оболочке (т.е. релаксивность) записывается в виде: 1/T1=(([Gd]·q/55.5)(T1m=τm)-1, где q - число молекул воды, связанных с Gd (число гидратации), T1m - время релаксации связанной воды и τm - время жизни молекулы воды во внутренней координационной оболочке.
Релаксация протонов в присутствии хелатированных парамагнитных катионов подвержена воздействию целого комплекса факторов. Если хелатирующее вещество препятствует образованию координационных связей между водой и катионом во внутренней оболочке, число гидратации катиона q<1, а релаксивность хелатированного катиона значительно меньше, чем релаксивность гидратированного катиона. Наиболее часто используемые на практике хелаты Gd (III) допускают образование координационной связи с q=1. Если выполняется соотношение T1m<<τm, то скорость обмена координированных с KB молекул воды является единственным определяющим фактором релаксивности.
Данные особенности позволили экспериментально создать новое КВ. Суть изобретения заключается в том, что для выделения области поражения при МРТ в качестве контрастного средства используется новая композиция (субстанция), которая представляет собой модифицированные гадопентетатом производные бета-циклодекстрина, в частности бета-циклодекстрин, содержащий один, два, три остатка гадопентетата или их смесь.
Общая формула субстанции: (C42H70-nO35)(C14H21N3O8)nGdn где n=1-7.
В частности, как вариант, рассматривается модифицированные гадопентетатом производные бета-циклодекстрина, а именно бета-циклодекстрин, содержащий один, два, три остатка гадопентетата или их смесь, состоящую из 70-80% монопроизводного бета-циклодекстрина, 10-20% ди-производного бета-циклодекстрина и 5-10% три-производного бета-циклодекстрина.
Циклогадопентетат (ЦГП) получают в две стадии. Степень модификации определяется соотношением компонентов - циклодекстрина и ДАДТПА.
На первой стадии модифицируют циклодекстрин диангидридом диэтилентриаминопентауксусной кислоты (ДАДТПА). К раствору 30 г (0,0264 М) бета-циклодекстрина в диметилсульфоксиде прибавляют 23,6 г диангидрида диэтилентриаминопентауксусной кислоты и продолжают перемешивать при 60°C двадцать часов. Раствор охлаждают до комнатной температуры, выливают в стакан вместимостью 2 л, содержащий 600 мл ацетона. Выпадает белый осадок. Смесь тщательно перемешивают и выдерживают 30 мин для завершения формирования осадка. Реакционную смесь фильтруют в вакууме водоструйного насоса на воронке с пористым дном и обрабатывают ацетоном пятью порциями по 300 мл и сушат в вакууме (15 мм) при слабом нагревании (500°C) до постоянного веса. Выход циклопентетата (ЦП) (97%).
На второй стадии получают ЦГП путем взаимодействия ЦП с нитратом гадолиния. В плоскодонную термостойкую колбу емкостью 750 мл, снабженную обратным шариковым холодильником и якорем для магнитной мешалки, помещают 45 г циклопентетата, наливают 450 мл воды дистиллированной и перемешивают в течение 15 мин. К раствору циклопентетата в воде дистиллированной прибавляют 22 г гадолиния азотнокислого шестиводного и перемешивают при комнатной температуре один час. Полученный раствор выливают в стакан вместимостью 2 л, содержащий 1000 мл ацетона. Выпадает белый осадок. Смесь тщательно перемешивают и выдерживают 30 мин для формирования осадка. Осадок фильтруют и высушивают. Выход ЦГП 98%.
Для очистки ЦГП его переосаждают из водного раствора. Для этого подсушенный полупродукт переносят в стакан вместимостью 1 л и растворяют в 400 мл воды дистиллированной. Раствор выливают в стакан вместимостью 2 л, содержащий 1000 мл ацетона. Выпавший осадок отфильтровывают и сушат.
Содержание компонентов с различной степенью модификации в полученном продукте определяют методом высокоэффективной хроматографии. Характеристика полученных смесей представлена в таблице 1.
Релаксивность определяли на MP-томографе ClinScan фирмы BrukerBioSpinc (магнитная индукция 7 Тл, резонансная частота 300 МГц для 1H).
МРТ-исследования с использованием полученных смесей проводили на МР-томографе ClinScan фирмы Bruker BioSpin с напряженностью поля 7Т (300 МГц для 1H) с использованием двухсегментной поверхностной принимающей катушки. После получения быстрых ортогональных Т1 взвешенных изображений (ВИ) получали Т2 взвешенные изображения (ВИ) с частотным подавлением сигнала жира во фронтальной плоскости с помощью импульсной последовательности Turbo Spin Echo с параметрами: TR=2220 ms, ТЕ=49 ms, толщина среза 1 мм, 16 срезов, матрица 320×320, FOV read=50 мм, траектория заполнения К-пространства - BLADE, BLADE coverage 100%. Так же получали Т2-ВИ с частотным подавлением сигнала жира в аксиальной проекции: Turbo Spin Echo, TR=3310 ms, TE=51 ms, толщина среза 1 мм, 26 срезов, матрица 256×256, FOV read=40 мм. Т2 ВИ были использованы для верификации наличия опухолевого процесса, а также более точного позиционирования последующих срезов. Затем с аналогичной геометрией получали двухмерные градиентные Т1-ВИ с частотным подавлением жира, в аксиальной: TR=529 ms, ТЕ=4.3 ms, угол=70 градусов, толщина среза 1 мм, 26 срезов, матрица 259×384 и FOV read=50 мм; и фронтальной плоскостях: TR=419 ms, ТЕ=4.03 ms, угол=70 градусов, толщина среза 1 мм, 18 срезов, матрица 259×384, FOV read=50 мм, время сбора данных - 2:16 мин. После введения животным изучаемого компонента за динамикой его распределения и выведения следили с помощью фронтальных Т1-ВИ изображений с двухминутным шагом (время сбора данных 2:16).
Пример 1.
Суспензию клеток мышиной меланомы В-16 (Банк опухолевых штаммов ФГБУ РОНЦ им. Н.Н. Блохина РАМН) трансплантируют под кожу и внутрь мышцы правого заднего бедра мышам лини BDF1 с массой тела 19-22 грамма (2-3-го месяцев жизни) в 0,3 мл полного раствора Хенкса с красителем. При инъекции животным вводят 3,5-4,0 млн опухолевых клеток. Развитие опухоли контролируется путем измерения размеров опухоли. Животные отбираются к дальнейшим исследованиям по достижении размеров опухоли около 1 см3.
Мышам линии BDF1 с перевивной меланомой В16 на 8 сутки после перевивки внутривенно вводится 0,04 мл водного ЦГП с pH=7 с содержанием гадолиния 0,4 мг. На МРТ томограммах отчетливо видно накопление препарата в опухоли. На фиг.1-3 представлены фронтальные MP томограммы мыши с перевивной опухолью меланомы В16: Т2 - взвешенное изображение, Т1 - взвешенное изображение до введения образца и Т1 - взвешенное изображение после введения образца. Область роста опухоли четко выделена.
Пример 2.
Суспензию клеток эпидермоидной карцином легкого LLC1 (Банк опухолевых штаммов ФГБУ РОНЦ им.Н.Н. Блохина РАМН) трансплантировали под кожу и внутрь мышцы правого заднего бедра мышам линии BDF1 с массой тела 19-22 грамма (2-3-го месяцев жизни) в 0,3 мл полного раствора Хенкса с красителем. При инъекции животным вводят 3,5-4,0 млн опухолевых клеток. Развитие опухоли контролируется путем измерения размеров опухоли. Животные отбираются к дальнейшим исследованиям по достижении размеров опухоли около 1 см3.
Мышам линии BDF1 с перевивной карциномой легкого Льюиса LLC на 8 сутки после перевивки внутривенно вводится 0,04 мл водного ЦГП с pH=7 с содержанием гадолиния 0,4 мг. На МРТ томограммах отчетливо видно контрастирование опухоли. На фиг.4-6 показаны фронтальные MP томограммы тазовой области мыши с перевивной эпидермоидной карциномой легкого Льюиса LLC1: Т2 - взвешенное изображение, Т1 - взвешенное изображение до введения образца и Т1 - взвешенное изображение после введения образца. Область роста опухоли четко выделена.
Пример 3.
Суспензию клеток аденокарциномы молочной железы Ca755 (Банк опухолевых штаммов ФГБУ РОНЦ им. Н.Н. Блохина РАМН) трансплантировали под кожу и внутрь мышцы правого заднего бедра мышам линии BDF1 с массой тела 19-22 грамма (2-3-го месяцев жизни) в 0,3 мл полного раствора Хенкса с красителем. При инъекции животным вводят 3,5-4,0 млн опухолевых клеток. Развитие опухоли контролируется путем измерения размеров опухоли. Животные отбираются к дальнейшим исследованиям по достижении размеров опухоли около 1 см3.
Мышам линии BDF1 с перевивной аденокарциномой Ca755 на 8 сутки после перевивки внутривенно вводится 0,04 мл водного ЦГП с pH=7 с содержанием гадолиния 0,4 мг. На МРТ томограммах отчетливо видно накопление препарата. На фиг.7-9 показаны фронтальные MP томограммы тазовой области мыши с перевивной аденокарциномой молочной железы Ca755: Т2 - взвешенное изображение, Т1 - взвешенное изображение до введения образца и Т1 - взвешенное изображение после введения образца. Область роста опухоли четко выделена.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛЕКАРСТВЕННАЯ КОНТРАСТНАЯ КОМПОЗИЦИЯ | 2016 |
|
RU2639390C2 |
| Метод функциональной магнитно-резонансной томографии для определения перфузионного кровотока при врожденных аномалиях матки с использованием парамагнитного контрастного агента | 2015 |
|
RU2611762C1 |
| СПОСОБ ВИЗУАЛИЗАЦИИ БИОЛОГИЧЕСКИХ ТКАНЕЙ И/ИЛИ ОРГАНОВ | 2019 |
|
RU2735463C1 |
| СРЕДСТВО И СПОСОБ КОМБИНИРОВАННОЙ КОНТРАСТНОЙ МАГНИТНО-РЕЗОНАНСНОЙ ТОМОГРАФИЧЕСКОЙ ВИЗУАЛИЗАЦИИ ИЗОБРАЖЕНИЙ БИОМЕХАНИКИ ПРОЦЕССОВ ИНФИЛЬТРАЦИИ, ИНВАЗИИ И МЕТАСТАЗИРОВАНИЯ ЗЛОКАЧЕСТВЕННЫХ КЛЕТОК | 2020 |
|
RU2761827C1 |
| СПОСОБ МАГНИТНО-РЕЗОНАНСНОЙ ТОМОГРАФИЧЕСКОЙ ДИАГНОСТИКИ ИШЕМИЧЕСКИХ НАРУШЕНИЙ КОРОНАРНОГО КРОВООБРАЩЕНИЯ | 2006 |
|
RU2330609C1 |
| СПОСОБ ДИАГНОСТИКИ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ В ЭКСПЕРИМЕНТЕ | 2007 |
|
RU2343828C2 |
| СРЕДСТВО ДЛЯ РАННЕГО КОНТРАСТНОГО МРТ ВЫЯВЛЕНИЯ ЦЕНТРОВ ЗЛОКАЧЕСТВЕННОЙ ПРОЛИФЕРАЦИИ С ПИТАЮЩИМИ СОСУДАМИ, ГРАНИЦАМИ ДИФФУЗНОЙ ИНФИЛЬТРАЦИИ И ОПРЕДЕЛЕНИЕ СТАДИЙ ИХ РАЗВИТИЯ В ДИНАМИКЕ | 2017 |
|
RU2692579C2 |
| КОНТРАСТИРУЮЩИЙ АГЕНТ ДЛЯ МАГНИТНО-РЕЗОНАНСНОЙ ДИАГНОСТИКИ ОПУХОЛЕЙ | 2008 |
|
RU2385152C1 |
| Способ оценки количественного накопления парамагнитного контрастного препарата GDOF-Mn-DTPA для магнитно-резонансной томографии печени экспериментальных животных | 2018 |
|
RU2699334C1 |
| СПОСОБ ДИАГНОСТИКИ МУЛЬТИФОРМНОЙ ГЛИОБЛАСТОМЫ С ПОМОЩЬЮ МРТ | 2012 |
|
RU2530762C2 |








Изобретение относится к медицине. Модифицированные гадопентетатом производные бета-циклодекстрина, отличающиеся тем, что в качестве контрастного средства используют бета-циклодекстрин, содержащий один, два, три остатка гадопентетата или их смесь с общей формулой (C42H70-nO35)(C14H21N3O8)nGdn, где n=1-3. 2 н.п. ф-лы, 1 табл., 3 пр., 9 ил.
1. Средство для магнитно-резонансной диагностики, представляющее собой модифицированные гадопентетатом производные бета-циклодекстрина, где бета-циклодекстрин содержит один, два, три остатка гадопептетата или их смесь с общей формулой (C42H70-nO35)(C14H21N3O8)nGdn, где n=1-3.
2. Средство для магнитно-резонансной диагностики, представляющее собой модифицированные гадопентетатом производные бета-циклодекстрина, где бета-циклодекстрин, который содержит один, два, три остатка гадопентетата или их смесь, состоящую из 70-80% монопроизводного бета-циклодекстрина, 10-20% ди-производного бета-циклодекстрина и 5-10% три-производного бета-циклодекстрина с общей формулой (C42H70-nO35)(C14H21N3O8)nGdn, где n=1-3.
| МАГНИТНО-РЕЗОНАНСНАЯ И РЕНТГЕНОВСКАЯ КОНТРАСТНАЯ КОМПОЗИЦИЯ | 2006 |
|
RU2308290C1 |
| КОНТРАСТНАЯ КОМПОЗИЦИЯ ДЛЯ МЕДИЦИНСКОЙ ДИАГНОСТИКИ НА ОСНОВЕ КОМПЛЕКСОВ ГАДОЛИНИЯ | 2009 |
|
RU2396983C1 |
| МАГНИТНО-РЕЗОНАНСНАЯ КОНТРАСТНАЯ КОМПОЗИЦИЯ | 1998 |
|
RU2150961C1 |
| Наполов В.К | |||
| и др | |||
| "Эффективность применения препаратов гадолиния в рентгенодиагностике", Изд | |||
| Медицинская Визуализация, 2005.-N 3.-С | |||
| Прибор для определения всасывающей силы почвы | 1921 |
|
SU138A1 |
| Наполов В.К | |||
| и др | |||
| "Эффективность применения препаратов гадолиния в качестве рентгеноконтрастных средств", Изд | |||
| "Вестник рентгенологии и радиологии", 2004.-N 6.-С.58-64 | |||
Авторы
Даты
2015-02-10—Публикация
2013-11-28—Подача